Contenido
Molibdeno es un oligoelemento esencial para casi todas las formas de vida. Funciona como un cofactor para una seria de enzimas que catalizan importantes transformaciones químicas en el carbono global, nitrógeno, azufre y los ciclos de azufre (1). Por lo tanto, enzimas molibdeno dependiente no son necesarias para la salud humana, sino para la salud de nuestro ecosistema.
La forma biológica del átomo de molibdeno es una molécula orgánica conocida como el cofactor molibdeno (Moco) presente en el sitio activo de las enzimas que contienen Moco (enzima molibdeno) (2). En seres humanos, molibdeno es conocido por funcionar como un factor de cuatro enzimas:
De estas enzimas, sulfito oxidasa se conoce ser crucial para la salud de los seres humanos. Xantinuria hereditario, caracterizado por la deficiencia en xantina oxidase (Tipo 1) o por la deficiencia tanto en la xantina oxidasa y aldehído oxidasa (Tipo 2), puede se asintomática (6). Sin embargo, en menos de la mitad de los casos, los individuos afectados presentan una serie de problemas de salud de severa variable (7, 8).
Un estudio anterior reporto que la ingesta de molibdeno de 500 μg/día y 1,500 μg/día de sorgo aumenta la excreción urinaria de cobre (2). Sin embargo, los resultados más recientes, de un estudio mejor controlado indicaron que una ingesta dietética alta de molibdeno (hasta 1,500 μg/día) no afectó adversamente el estado nutricional en ocho hombres jóvenes sanos (9).
El exceso de molibdeno en la dieta se ha encontrado ser el resultado en la deficiencia de cobre en los animales de pastoreo (rumiantes). En el tracto digestivo de los rumiantes, la formación de compuestos que contienen azufre y molibdeno, conocido como timolibdatos, previene la absorción de cobre y puede causar desordenes fatales de dependencia de cobre (10). Tetratiomolibdato (TM) es una molécula que puede formar complejos de alta afinidad con cobre, controlando cobre libre (cobre que no está unido a la ceruloplasmina) e inhibición de chaperones de cobre y enzimas que contienen cobre (11, 12). La habilidad de TM para reducir los niveles de cobre libre es explotara en el tratamiento de la enfermedad de Wilson, un desorden genético caracterizado por acumulación de cobre en los tejidos responsables por la hepatitis y desórdenes neurológicos. Empeoramiento neurológico se ha relacionado a niveles tóxicos de cobre libre en el suero de pacientes neurológicamente presentes. La terapia TM parecer ser capaz de estabilizar el estado neurológico y prevenir el deterioro neurológico en estos pacientes, en comparación a con la opción de tratamiento inicial estándar (13).
Cobre también es requerido como cofactor de enzimas envueltas en la inflamación y angiogénesis, conocidos para acelerar la progresión y metástasis de cáncer. Estudios de depleción de cobre que emplean TM se han iniciado en pacientes con neoplasias avanzadas con el fin de prevenir la progresión de la enfermedad o recaída. Estos ensayos pilotos mostraron un resultado prometedor en personas con cáncer de riñón metastásico (14), cancer colorrectal metastásico (15), y cáncer de mama con alto riesgo de recaída (16). TM fue relativamente bien tolerado y estabilizo la enfermedad o previno la recaída en correlación con el agotamiento de cobre. La eficaz de TM es también investigado en modelos de animales con enfermedades inflamatorias y relacionado a lo inmune (17, 18), y, en este momento, se necesitan estudios clínicos para evaluar si la depleción de cobre puede estabilizar la enfermedad y mejorar la supervivencia en los seres humanos, tal como lo sugiera un estudio de terapia TM con los pacientes con cirrosis biliar (19).
La deficiencia dietética de molibdeno nunca se ha observada en personas saludables (2).
El único casa documentado de deficiencia de molibdeno adquirida ocurrió en pacientes con la enfermedad de Crohn en la nutrición parenteral total a largo plazo (NPT) sin molibdeno añadido a la NPT solución (20). El paciente desarrollo un ritmo cardiaco y respiratorio rápido, dolores de cabeza, y ceguera nocturna, y en la última instancia se convirtió en estado de coma. El paciente fue diagnosticado con defectos en la producción de ácido úrico y metabolismo de aminoácidos de azufre. La condición clínica de pacientes mejoro y la intolerancia de aminoácidos desapareció cuando se suspendió la solución de NPT fue descontinuada y en su lugar fue suplementada con molibdeno en la forma de molibdato de amonio (160 μg/día) (20).
Dado a las funciones de molibdeno solo en la forma de Moco en los seres humanos, cualquier perturbación del metabolismo de Moco puede perturbar la función de todas las enzimas molibdeno. La comprensión actual de la esencialidad de molibdeno en humanos se basa principalmente en los estudios de individuos con trastornos metabólicos congénitos muy raros causados por la deficiencia en Moco. Moco se sintetiza de novo por una vía metabólica de etapas múltiples que implican cuatro genes: MOCS1, MOCS2, MOCS3, and GPHN (Figura 1). Hasta la fecha, más de 60 mutaciones afectan la mayoría de MOCS1 y MOCS2 se han identificado (21).

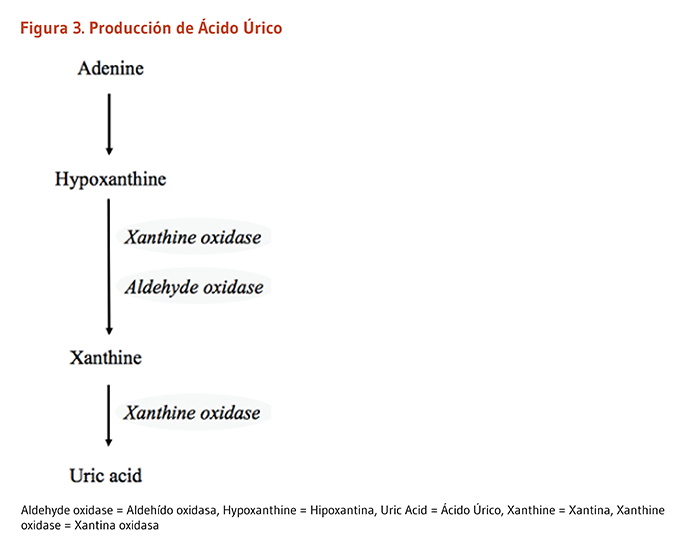
La ausencia de un Moco funcional tiene un impacto directo sobre la actividad de las enzimas de molibdeno. Desordenes metabólicos especialmente asociados con la deficiencia de actividad de sulfito oxidasa incluye una acumulación de sulfito, taurina, S-sulfocisteina y tiosulfato (Figura 2). Este perfil metabólico es idéntico a la observada en la deficiencia aislada de sulfito oxidase (ISOD) una condición hereditaria causada por mutaciones en el gene SUOX que codifica para sulfito oxidasa (22). En comparación con ISOD, la deficiencia de moco (MocoD) también afecta la vía de xantina y conduce a la acumulación de hipoxantina y xantina, y baja el ácido úrico en la sangre a niveles indetectables (Figura 3). MocoD y ISOD se han diagnosticado en más de 100 individuos en todo el mundo. Sin embargo la incidencia global de MocoD es probable que sea subestimada como resultado de una falta de diagnósticos o reportes (21, 23, 24). Ambos desordenes derivan de rasgos recesivos, lo que significa que solo las personas que heredan dos copias de genes anormales (uno de cada padre) desarrollan la enfermedad. Los individuos que heredan solo una copia del gen anormal son conocidos como portadores de los rasgos pero no presentan ningún síntoma. ISOD y MocoD pueden diagnosticarse relativamente temprano en el embarazo (10-14 semanas de gestación) mediante ensayos de actividad enzimática utilizando células amnióticas y muestras de vellosidades coriónicas y mediante pruebas genéticas (23, 25).
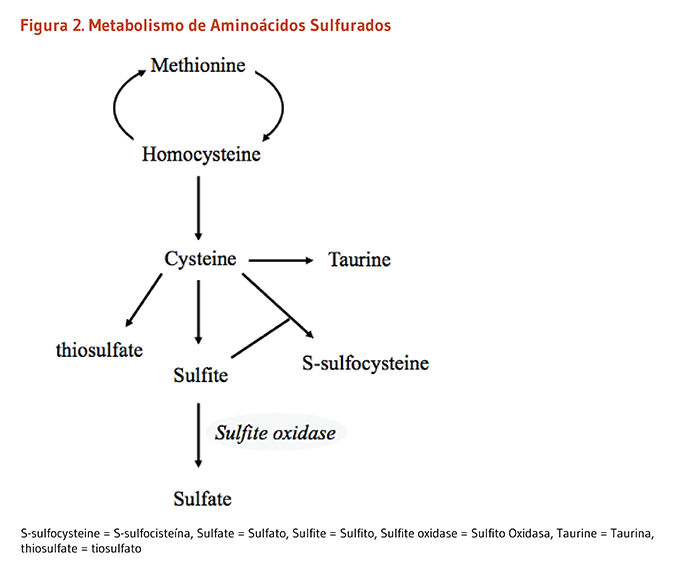
MocoD e ISOD normalmente ocurren en los primeros días de vida, aunque algunos casos de MocoD con presentaciones tardías se han descrito (26-28). La pérdida de actividad de sulfito oxidasa en ISOD y MocoD conduce a severa disfunción neurológica caracterizada por el atrofio cerebral, retraso mental, convulsiones intratables, y la dislocación de los lentes oculares. En la actualidad, no esta claro si los efectos neurológicos son el resultado de la acumulación de metabolito toxico, como el sulfito, o inadecuada producción de sulfate. Pacientes con ISOD y MocoD también se encontraron con elevada excreción de semialdehido adipico a-amino (a-AASA) (29). Acumulación de a-AASA es la firma metabólica de la deficiencia en a-AASA deshidrogenada observada en pacientes con epilepsia dependiente piridoxida. La deficiencia enzimática en estos individuos provoca aumento en a-AASA y en su forma cíclica piperideina 6 carboxilato (P6C). P6C puede atrapar piridoxal 5 fosfatos (PLP), la forma activa de vitamina B6 (piridoxina), lo que lleva a una deficiencia en PLP, lo cual se corregí con suplemento de piridoxina. Una disminución en PLP también se ha observado en el líquido cefalorraquideo de pacientes ISOD y MocoD (30). No es claro si sulfito es responsable por la acumulación de a-AASA y la deficiencia en PLP en pacientes ISOD y MocoD. Sin embargo la suplementación de piridoxina y ácido fólico en pacientes con MocoD normalizaron con éxito el nivel PLP y abolieron las convulsiones en dos pacientes con mutaciones en MOCS2 (MocoD Tipo B) (31). Aunque los medicamentos anticonvulsivo y las restricciones dietéticas de aminoácidos que contienes sulfuro pueden ser beneficiosos en algunos casos (32), no hay tratamientos opciones para pacientes con mutaciones en MOCS2, GPHN (MocoD Tipo C), o genes SUOX. Suplementos de piridoxina es una nueva opción de ser considerado para aliviar características clínicas especificas en pacientes.
Un tratamiento exitoso usa monofosfato ciclico pyranopterin (CPMP) ha sido descrito para los pacientes con mutaciones en los genes MOCS1, y un ensayo clínico con enfoque retrospectivo esta en marcha para avaluar su seguridad. El gene MOCS1 controla el paso inicial en la ruta biocinética de Moco, catalizando la conversión de trifosfato de guanosina en cPMP. Por lo tanto, los pacientes con mutaciones en los genes MOCS1 carecen cPMP. La administración diaria de cPMP a pacientes resuelve todas las anormalidades metabólicas asociadas con la defectuosidad de sulfito oxidasa y vías xantinas y previene nuevos signos de deterioro neurológico (33, 34). Un diagnostico temprano y la iniciación de tratamiento son esenciales para asegurar el éxito (34). Dado que la terapia de remplazo cPMP solo puede beneficiar MocoD Tipo A, se requiere métodos de tratamientos adicionales.
La IDR para molibdeno fue revisado recientemente en enero, 2001 (2). Se basa en los resultados de los estudios de balance nutricional en ocho hombres saludables bajo condiciones de laboratorio controlado (35, 36). Los valores de IDR para molibdeno están enlistados en la tabla siguiente en microgramos (μg)/día por año y genero. Se establecieron los niveles de ingesta adecuada (IA) para los infantes basado en el promedio de ingesta molibdeno de la leche humana, exclusiva.
| Etapa de la Vida | Edad | Machos (μg/día) | Hembras (μg/día) |
|---|---|---|---|
| Infantes | 0-6 meses | 2 (IA) | 2 (IA) |
| Infantes | 7-12 meses | 3 (IA) | 3 (IA) |
| Niños | 1-3 años | 17 | 17 |
| Niños | 4-8 años | 22 | 22 |
| Niños | 9-13 años | 34 | 34 |
| Adolescentes | 14-18 años | 43 | 43 |
| Adultos | 19 años o más | 45 | 45 |
| Embarazo | Todas las edades | - | 50 |
| Período de lactancia | Todas las edades | - | 50 |
Linxian es una pequeña región en el norte de China donde el incidente de cáncer del esófago y estomago es muy alta (10 veces mas que el promedio en China y 100 veces mas que el promedio en los U.S.). La tierra en esta región es baja en molibdeno y otros elementos minerales: por lo tanto, ingesta dietética de molibdeno es también bajo. Estudios conducidos en otras áreas de baja y alta incidencia de cáncer de esófago mostraron que el contenido de molibdeno y zinc en el cabello y uñas es significativamente menor en habitantes de las regiones de alto riesgo en comparación con los puntos fríos. Por otra parte, los pacientes con cáncer de esófago muestra un contenido reducido de los elementos traza en comparación con los parientes sanos (37, 38).
El aumento de nitrosaminas, los cuales son conocidos como carcinógenos, puede ser uno de una serie de factores dietéticos y ambientales que contribuye al desarrollo de cáncer de esófago en residentes de las regiones con alto riesgo. Adición de molibdato de amonio al suelo puede disminuir el riesgo de cáncer de esófago, limitando la exposición de nitrosamina. No esta claro si la suplementación dietética de molibdeno suplementario es beneficial en la disminución del riesgo de cáncer de esófago. Los ensayos de intervención conducidos en áreas de Linxian con suplementación de minerales y vitaminas, incluyendo molibdeno (30 μg/día), no lograron disminuir las tasas de mortalidad de cáncer de esófago u otros tipos de cáncer y la incidencia en un periodo de cinco años (revisado en 39).
Rugao es un condado en la providencia de Jiangsu (China), famoso por la longevidad de sus habitantes. La longevidad extendida difícilmente puede atribuirse a diferencia significativas en las tradiciones, estilos de vida, o hábitos de alimentación entre los residentes, y las personas mas longevas no están relacionados entre sin, limitando la posibilidad de influenza genética. Sin embargo, el condado tiene un gran numero de suelos cuyas composiciones podrían afectar la traza de distribución de oligoelementos en el agua y cultivos y podrían ser vinculado con la salud humana y longevidad.
Se encontraron correlaciones significativamente entre la proporción de personas mayores de 90 años de edad por cada 100,000 habitantes y oligoelementos, incluyendo molibdeno, en suelos, agua potable, y arroz, lo cual constituye elementos fundamentales de su medio natural (40). El porcentaje de personas de larga vida (>80 años) en Zhongxiang (provincia de Hubei) también positivamente vinculado con el contenido de molibdeno en sus alimentos básicos, arroz (41). En estas regiones, es probable que las combinaciones de oligoelementos contribuyan a la salud optima y longevidad en comparación con el único efecto de molibdeno.
El Estudio de la Dieta Total, una encuesta anual de contenido de minerales en una dieta típica estadounidense, indica que la ingesta dietética de los promedios de molibdeno es 76 μg/día para mujeres y 109 μg/día para hombres. Por lo tanto, la ingestas usual de molibdeno son superiores a las dosis diarias recomendadas por la IDR para el molibdeno. Las legumbres, tales como los frijoles, lentejas, y chicharos, son las fuentes mas ricas en molibdeno. Los productos de granos y nueces están considerados como buenas fuentes, mientras que los productos de animales, frutas y muchas verduras son generalmente bajos en molibdeno (2). Debido al contenido de molibdeno de plantas depende del contenido de molibdeno de los suelos y otras condiciones ambientales, el contenido de molibdeno de los alimentos puede variar considerablemente (38, 42).
Molibdeno en suplementos nutricionales es generalmente en la forma de molibdato de sodio o molibdato de amonio (43).
La toxicidad de compuestos de molibdeno parecer ser relativamente baja en humanos. El aumento de los niveles séricos de ácido úricos y ceruloplasmina (una enzima de oxidante de hierro) se ha reportado en trabajadores expuestos en una planta de tostación de molibdeno (44). Los síntomas de seudogotosa se ha reportado en la población Armenia que consume 10 a 15 miligramos (mg) de molibdeno diaria (45). En otros estudios, la sangre y los niveles de acido úrico no se elevaron por la ingesta de molibdeno hasta 1.5 mg/día (2). Solo ha reportado un caso de toxicidad aguda relacionada a molibdeno de un suplemento dietético: un varón adulto reporto consumir un total de 13.5 mg de molibdeno durante un periodo de 18 días (300-800 μg/día) y desarrollo psicosis aguda con alucinaciones, convulsiones, y otros síntomas neurológicos (46). Sin embargo, un estudio controlado en cuatro, hombres jóvenes saludables encontraron que la ingesta de molibdeno, que va dese 22 μg/día a 1,490 μg/día (casi 1.5mg/día) no provoco efectos adversos graves cuando molibdeno fue dada durante 24 días (35).
La Junta de Alimentos y Nutricionales (JAN/FNB) del Instituto de Medicina encontró poca evidencia que el exceso de molibdeno se asocia con resultados adversos para la salud de las personas generalmente sanas. Para determinar la tolerancia del nivel máximo de ingesta tolerable (NM), la JAN/FNB selecciono efectos adversos sobre la reproducción en ratas como el índice más sensible de toxicidad y aplico un factor de incertidumbre grande por que los datos de animales fueron usados (2). La NM de molibdeno esta enlistada por edad y en la siguiente tabla.
| Grupo Etario | NM (μg/día) |
|---|---|
| Infantes 0-12 meses | No es posible establizar* |
| Niños 1-3 años | 300 |
| Niños 4-8 años | 600 |
| Niños 9-13 años | 1,100 (1.1 mg/día) |
| Adolescentes 14-18 años | 1,700 (1.7 mg/día) |
| Adultos 19 años y más | 2,000 (2.0 mg/día) |
| *La fuente de ingesta debería ser solo de alimentos y formula. | |
Se ha encontrado que dosis altas de molibdeno inhiben el metabolismo de paracetamol en ratas (47); sin embargo, no fue encontrado si esto ocurre a dosis clínicamente relevantes en humanos.
La IDR para molibdeno (45 μg/día para adultos) es suficiente para prevenir la deficiencia. Aunque la ingesta de molibdeno para la salud optima se desconoce, actualmente no hay evidencia de que una ingesta mayor que la IDR sea beneficioso. La mayoría de las personas en los EE.UU. consumen mas molibdeno de los suficiente en sus dietas, lo que hace la suplementación innecesaria. Siguiendo las recomendaciones generales del Instituto de Linus Pauling de tomar un suplemento multivitamínico/mineral que contenga 100% de los valores diarios (VD) para la mayoría de los nutrientes es probable que proporcione 75 μg/día de molibdeno porque la VD para molibdeno no ha sido revisada para reflejar la IDR reciente. Aunque la cantidad de molibdeno encontrada reciente en la mayoría de los suplementos multivitamínicos/minerales es superior a la dosis de IDR, es muy por debajo de las niveles máximos de ingesta tolerable (NM) de 2,000 μg/día y debería ser seguro para los adultos.
Debido a que el envejecimiento no se ha asociado con cambios significativos en el requisito de molibdeno (2), nuestras recomendaciones para adultos mayores es la misma que para los adultos de 50 años o menores.
Escrito en 2001 por:
Jane Higdon, Ph.D.
Instituto Linus Pauling
Universidad Estatal de Oregon
Actualizado en Abril de 2007 por:
Victoria J. Drake, Ph.D.
Instituto Linus Pauling
Universidad Estatal de Oregon
Actualizado en Junio de 2013 por:
Barbara Delage, Ph.D.
Instituto Linus Pauling
Universidad Estatal de Oregon
Revisado en Julio de 2013 por:
Ralf R. Mendel, Ph.D.
Profesor de Biologia Vegetal y Director
Departamento Biologia Vegetal
Universidad de Braunschweig de Tecnologia
Braunschweig, Alemania
Traducido al Español en 2012 por:
Guillermo Sandoval, Facultad de Odontologia, Universidad de Chile;
Revisado y editado en Diciembre 2012 por:
Andrew F.G. Quest, Ph.D. y Lisette Leyton, Ph.D.,
Profesores Titulares del Instituto de Ciencias Biomédicas,
Facultad de Medicina, Universidad de Chile,
en el marco del proyecto Anillo #ACT1111, grupo NEMESIS.
La traducción de el MIC del Inglés al Español fue asegurado, en parte, por una subvención de Bayer Consumer Care AG, Basel, Switzerland.
Derechos de autoría 2001-2024 Instituto Linus Pauling
1. Wuebbens MM, Liu MT, Rajagopalan K, Schindelin H. Insights into molybdenum cofactor deficiency provided by the crystal structure of the molybdenum cofactor biosynthesis protein MoaC. Structure Fold Des. 2000;8(7):709-718. (PubMed)
2. Food and Nutrition Board, Institute of Medicine. Molybdenum. In: Dietary reference intakes for vitamin A, vitamin K, boron, chromium, copper, iodine, iron, manganese, molybdenum, nickel, silicon, vanadium, and zinc. Washington, D.C.: National Academy Press; 2001:420-441. (National Academy Press)
3. Eckhert C. Other trace elements In: Shils ME, Shike M, Ross AC, Caballero B, Cousins RJ, eds. Modern Nutrition in Health and Disease. 10th ed. Philadelphia: Lippincott, Williams & Wilkins; 2006:338-350.
4. Wahl B, Reichmann D, Niks D, et al. Biochemical and spectroscopic characterization of the human mitochondrial amidoxime reducing components hmARC-1 and hmARC-2 suggests the existence of a new molybdenum enzyme family in eukaryotes. J Biol Chem. 2010;285(48):37847-37859. (PubMed)
5. Plitzko B, Ott G, Reichmann D, et al. The Involvement of Mitochondrial Amidoxime Reducing Components 1 and 2 and Mitochondrial Cytochrome b5 in N-reductive Metabolism in Human Cells. J Biol Chem. 2013;288(28):20228-20237. (PubMed)
6. Beedham C. Molybdenum hydroxylases as drug-metabolizing enzymes. Drug Metab Rev. 1985;16(1-2):119-156. (PubMed)
7. Zannolli R, Micheli V, Mazzei MA, et al. Hereditary xanthinuria type II associated with mental delay, autism, cortical renal cysts, nephrocalcinosis, osteopenia, and hair and teeth defects. J Med Genet. 2003;40(11):e121. (PubMed)
8. Fujiwara Y, Kawakami Y, Shinohara Y, Ichida K. A case of hereditary xanthinuria type 1 accompanied by bilateral renal calculi. Intern Med. 2012;51(14):1879-1884. (PubMed)
9. Turnlund JR, Keyes WR. Dietary molybdenum: Effect on copper absorption, excretion, and status in young men. In: Roussel AM, ed. Trace Elements in Man and Animals. Vol 10. New York: Kluwer Academic Press.; 2000:951-953.
10. Suttle NF. Copper imbalances in ruminants and humans: unexpected common ground. Adv Nutr. 2012;3(5):666-674. (PubMed)
11. Helz GR, Erickson BE. Extraordinary stability of copper(I)-tetrathiomolybdate complexes: possible implications for aquatic ecosystems. Environ Toxicol Chem. 2011;30(1):97-102. (PubMed)
12. Alvarez HM, Xue Y, Robinson CD, et al. Tetrathiomolybdate inhibits copper trafficking proteins through metal cluster formation. Science. 2010;327(5963):331-334. (PubMed)
13. Brewer GJ, Askari F, Dick RB, et al. Treatment of Wilson's disease with tetrathiomolybdate: V. Control of free copper by tetrathiomolybdate and a comparison with trientine. Transl Res. 2009;154(2):70-77. (PubMed)
14. Redman BG, Esper P, Pan Q, et al. Phase II trial of tetrathiomolybdate in patients with advanced kidney cancer. Clin Cancer Res. 2003;9(5):1666-1672. (PubMed)
15. Gartner EM, Griffith KA, Pan Q, et al. A pilot trial of the anti-angiogenic copper lowering agent tetrathiomolybdate in combination with irinotecan, 5-flurouracil, and leucovorin for metastatic colorectal cancer. Invest New Drugs. 2009;27(2):159-165. (PubMed)
16. Jain S, Cohen J, Ward MM, et al. Tetrathiomolybdate-associated copper depletion decreases circulating endothelial progenitor cells in women with breast cancer at high risk of relapse. Ann Oncol. 2013;24(6):1491-1498. (PubMed)
17. Hou G, Abrams GD, Dick R, Brewer GJ. Efficacy of tetrathiomolybdate in a mouse model of multiple sclerosis. Transl Res. 2008;152(5):239-244. (PubMed)
18. Wei H, Zhang WJ, McMillen TS, Leboeuf RC, Frei B. Copper chelation by tetrathiomolybdate inhibits vascular inflammation and atherosclerotic lesion development in apolipoprotein E-deficient mice. Atherosclerosis. 2012;223(2):306-313. (PubMed)
19. Askari F, Innis D, Dick RB, et al. Treatment of primary biliary cirrhosis with tetrathiomolybdate: results of a double-blind trial. Transl Res. 2010;155(3):123-130. (PubMed)
20. Abumrad NN, Schneider AJ, Steel D, Rogers LS. Amino acid intolerance during prolonged total parenteral nutrition reversed by molybdate therapy. Am J Clin Nutr. 1981;34(11):2551-2559. (PubMed)
21. Reiss J, Hahnewald R. Molybdenum cofactor deficiency: Mutations in GPHN, MOCS1, and MOCS2. Hum Mutat. 2011;32(1):10-18. (PubMed)
22. Tan WH, Eichler FS, Hoda S, et al. Isolated sulfite oxidase deficiency: a case report with a novel mutation and review of the literature. Pediatrics. 2005;116(3):757-766. (PubMed)
23. Shalata A, Mandel H, Dorche C, et al. Prenatal diagnosis and carrier detection for molybdenum cofactor deficiency type A in northern Israel using polymorphic DNA markers. Prenat Diagn. 2000;20(1):7-11. (PubMed)
24. Kikuchi K, Hamano S, Mochizuki H, Ichida K, Ida H. Molybdenum cofactor deficiency mimics cerebral palsy: differentiating factors for diagnosis. Pediatr Neurol. 2012;47(2):147-149. (PubMed)
25. Johnson JL. Prenatal diagnosis of molybdenum cofactor deficiency and isolated sulfite oxidase deficiency. Prenat Diagn. 2003;23(1):6-8. (PubMed)
26. Hughes EF, Fairbanks L, Simmonds HA, Robinson RO. Molybdenum cofactor deficiency-phenotypic variability in a family with a late-onset variant. Dev Med Child Neurol. 1998;40(1):57-61. (PubMed)
27. Vijayakumar K, Gunny R, Grunewald S, et al. Clinical neuroimaging features and outcome in molybdenum cofactor deficiency. Pediatr Neurol. 2011;45(4):246-252. (PubMed)
28. Alkufri F, Harrower T, Rahman Y, et al. Molybdenum cofactor deficiency presenting with a parkinsonism-dystonia syndrome. Mov Disord. 2013;28(3):399-401. (PubMed)
29. Mills PB, Footitt EJ, Ceyhan S, et al. Urinary AASA excretion is elevated in patients with molybdenum cofactor deficiency and isolated sulphite oxidase deficiency. J Inherit Metab Dis. 2012;35(6):1031-1036. (PubMed)
30. Footitt EJ, Heales SJ, Mills PB, Allen GF, Oppenheim M, Clayton PT. Pyridoxal 5'-phosphate in cerebrospinal fluid; factors affecting concentration. J Inherit Metab Dis. 2011;34(2):529-538. (PubMed)
31. Struys EA, Nota B, Bakkali A, Al Shahwan S, Salomons GS, Tabarki B. Pyridoxine-dependent epilepsy with elevated urinary alpha-amino adipic semialdehyde in molybdenum cofactor deficiency. Pediatrics. 2012;130(6):e1716-1719. (PubMed)
32. Johnson JL, Duran M. Molybdenum cofactor deficiency and isolated sulfite deficiency. In: Scriver RC, ed. Metabolic and molecular bases of inherited disease. New York: μgraw-Hill; 2001:3163-3177.
33. Veldman A, Santamaria-Araujo JA, Sollazzo S, et al. Successful treatment of molybdenum cofactor deficiency type A with cPMP. Pediatrics. 2010;125(5):e1249-1254. (PubMed)
34. Hitzert MM, Bos AF, Bergman KA, et al. Favorable outcome in a newborn with molybdenum cofactor type A deficiency treated with cPMP. Pediatrics. 2012;130(4):e1005-1010. (PubMed)
35. Turnlund JR, Keyes WR, Peiffer GL. Molybdenum absorption, excretion, and retention studied with stable isotopes in young men at five intakes of dietary molybdenum. Am J Clin Nutr. 1995;62(4):790-796. (PubMed)
36. Turnlund JR, Keyes WR, Peiffer GL, Chiang G. Molybdenum absorption, excretion, and retention studied with stable isotopes in young men during depletion and repletion. Am J Clin Nutr. 1995;61(5):1102-1109. (PubMed)
37. Nouri M, Chalian H, Bahman A, et al. Nail molybdenum and zinc contents in populations with low and moderate incidence of esophageal cancer. Arch Iran Med. 2008;11(4):392-396. (PubMed)
38. Ray SS, Das D, Ghosh T, Ghosh AK. The levels of zinc and molybdenum in hair and food grain in areas of high and low incidence of esophageal cancer: a comparative study. Glob J Health Sci. 2012;4(4):168-175. (PubMed)
39. Goodman M, Bostick RM, Kucuk O, Jones DP. Clinical trials of antioxidants as cancer prevention agents: past, present, and future. Free Radic Biol Med. 2011;51(5):1068-1084. (PubMed)
40. Huang B, Zhao Y, Sun W, et al. Relationships between distributions of longevous population and trace elements in the agricultural ecosystem of Rugao County, Jiangsu, China. Environ Geochem Health. 2009;31(3):379-390. (PubMed)
41. Lv J, Wang W, Krafft T, Li Y, Zhang F, Yuan F. Effects of several environmental factors on longevity and health of the human population of Zhongxiang, Hubei, China. Biol Trace Elem Res. 2011;143(2):702-716. (PubMed)
42. Mills CF, Davis GK. Molybdenum. In: Mertz W, ed. Trace elements in human and animal nutrition. 5th ed. San Diego: Academic Press; 1987:429-463.
43. Molybdenum. In: Hendler S, Rorvik D, eds. PDR for Nutritional Supplements. 2nd ed. Montvale: Physicians' Desk Reference Inc.; 2008:425-429.
44. Walravens PA, Moure-Eraso R, Solomons, CC, Chapell, R, Bentley G. Biochemical abnormalities in workers exposed to molybdenum dust. Arch Environ Health. 1979;34(5):302-308. (PubMed)
45. Vyskocil A, Viau C. Assessment of molybdenum toxicity in humans. J Appl Toxicol. 1999;19(3):185-192. (PubMed)
46. Momcilovic B. A case report of acute human molybdenum toxicity from a dietary molybdenum supplement--a new member of the "Lucor metallicum" family. Arh Hig Rada Toksikol. 1999;50(3):289-297. (PubMed)
47. Boles JW, Klaassen CD. Effects of molybdate and pentachlorophenol on the sulfation of acetaminophen. Toxicology. 2000;146(1):23-35. (PubMed)