項目
ビタミン
ビオチン
目次
要約
ビオチンはビタミンB複合体(ビタミンB群)に属する水溶性ビタミンの1種である。ビオチンがビタミンとして立証されるまでにはその発見以後40年近くを要した(1)。ビオチンは全ての生物に必要であるが、生合成できる生物種はバクテリアや酵母、カビ、藻類やいくつかの植物に限られている(2)。
機能
ビオチンは哺乳動物の5種類のカルボキシラーゼ(enzyme)の活性部位に結合する(3)。ビオチンがタンパク質など別の分子へ結合することを“ビオチニル化”という。ホロカルボキシラーゼ合成酵素(HCS)はアポカルボキシラーゼ(不活性型)のビオチニル化やヒストンのビオチニル化を触媒する(ヒストンのビオチニル化の項目を参照)。ビオチニダーゼはヒストンやカルボキシラーゼの分解産物(peptide)からビオチンを遊離する。
補酵素
各々のカルボキシラーゼは生命維持に必須の代謝反応を触媒する。
- アセチルCoAカルボキシラーゼⅠ及びⅡはアセチルCoAに重炭酸イオン(HCO3-)を結合させマロニルCoAを合成する反応を触媒する。マロニルCoAは脂肪酸合成に必須である。アセチルCoAカルボキシラーゼⅠは細胞質での脂肪酸の合成に極めて重要であり、アセチルCoAカルボキシラーゼⅡはミトコンドリアでの脂肪酸の酸化(β酸化)を調節する。
- ピルビン酸カルボキシラーゼは糖新生-糖質以外の物質(例えばアミノ酸)からグルコースを生成すること-において極めて重要な酵素である。
- メチルクロトニルCoAカルボキシラーゼは必須アミノ酸であるロイシンの異化で、不可欠なステップを触媒する。
- プロピオニルCoAカルボキシラーゼは特定のアミノ酸やコレステロール、奇数鎖脂肪酸(炭素数が奇数個の脂肪酸)の代謝で必須段階を触媒する(4)。
ヒストンのビオチニル化
ヒストンはDNAと結合しコンパクトな構造にパッケージングすることでヌクレオソーム(クロモソームに不可欠な構造的構成要素)を形成するタンパク質である。コンパクトにパッケージングされたDNAは、DNAの複製や転写の際に弛まなければならない。アセチル基やメチル基の結合によるヒストン修飾(アセチル化もしくはメチル化)はヒストン構造を変化させ、DNAの複製や転写に影響を与える。数多くの証拠から、ヒストンのビオチニル化は細胞増殖や他の細胞応答と同様にDNAの複製や転写を調節する役割を持つことが示されている(5-7)。
ビオチン欠乏症
明白なビオチン欠乏症は非常に稀であるが、ヒトにおける食事性ビオチンの必要量は異なる2つの状況での調査から明示されている。すなわち、ビオチン補給なしでの長期的経静脈栄養(非経口栄養)と長期間(数週間~数年間)にわたる生卵白の摂取である。アビジンは卵白中に存在する抗微生物タンパク質で、ビオチンと強固に結合し腸管からの吸収を阻害する。アビジンは加熱調理によって消化を受けやすくなる。その結果、アビジンは食事性ビオチンの吸収を阻害することができなくなる(8)。
以下の3つは、ビオチン栄養状態の指標としてその有効性が実証されている評価基準である:(1)ビオチン酵素であるメチルクロトニルCoAカルボキシラーゼ活性の低下を反映する有機酸(3-ヒドロキシイソ吉草酸)排泄の増加(2)尿中ビオチン排泄の減少(3)末梢血リンパ球のプロピオニルCoAカルボキシラーゼ活性の低下(4, 9-11)
兆候と症状
明白なビオチン欠乏症の兆候として、脱毛や眼、口、鼻、生殖器周辺での鱗屑性皮疹が挙げられる。成人での神経症状としては、精神抑うつ、無気力、幻覚、四肢のしびれや刺痛がある。ある研究者は異常な脂肪分布を伴う特徴的な顔面皮疹を「ビオチン欠乏顔貌」と称している(8)。ビオチン代謝に遺伝性疾患のあるヒトは機能的な面でビオチン欠乏症となる。そのため、しばしば免疫機能異常や細菌等への感染症の増加、ビオチン欠乏症に似た身体所見が認められる(12)。
素因的(欠乏しやすくなる)状態
ビオチン欠乏症はビオチニダーゼ欠損症など幾つかの遺伝性疾患で発症する。ビオチニダーゼは食事から摂取した結合型ビオチン(タンパク質に共有結合しているビオチン)を遊離する作用がある。そのため、ビオチニダーゼが欠損するとビオチンの腸管からの吸収は減少する。また、ビオチンはタンパク質へ結合することで再利用されるが、ビオチニダーゼに結合していないビオチンは腎臓で急速に排泄されるため、ビオチンの再利用は悪化し、尿中へのビオチン排泄が増加する(5,8)。ビオチニダーゼ欠損症は適度なビオチン補給で回復する。経口補給では5-10mg/dayのビオチンが必要となるケースもある。しかし、多くの場合はもっと少量のビオチンで十分である。ある種のホロカルボキシラーゼ合成酵素(HCS)欠損症の場合では、多量のビオチンが必要となる。HCSはビオチン酵素である4種のカルボキシラーゼとビオチンの結合を触媒する(機能の項目を参照)。HCS欠損症では、血中ビオチン濃度が正常範囲であってもホロ酵素化が低下する。そのため、多量(40-100mg/day)のビオチン補給が必要となる。先天異常であるビオチン輸送担体欠損症においても多量のビオチン補給が必要となる(13)。これら3つの疾患の予後診断は、ビオチン治療が早期(幼年期や幼児期)に開始され生涯継続された場合、概ね良好である(12)。
長期間の生卵白摂取やビオチン不含の経静脈栄養だけでなく、その他の状況においてもビオチン欠乏症の危険性は増加する。発育中の胎児では細胞は急速に分裂するが、これらの細胞ではヒストンのビオチニル化と必須カルボキシラーゼの合成にビオチンを必要とする。そのため、妊娠中にもビオチン必要量は増加する。研究者は、相当な数の女性が正常な妊娠にもかかわらずその期間に軽度もしくは潜在性のビオチン欠乏症を発症すると示唆する(6,14)。しかしながら、妊娠期におけるビオチンの推奨目安量は設定されていない(目安量の項目を参照)。加えて、ある種の肝臓病ではビオチニダーゼ活性は低下し、理論上ビオチン要求量の増加が推察される。62名の慢性肝臓病の小児と27名の健常児の研究では、肝硬変を原因とする重篤な肝機能障害のある患児において血清ビオチニダーゼ活性の著しい低下が示されている(15)。しかし、この研究ではビオチン欠乏症については全く触れていない。さらに、てんかん患児の発作予防に使用される抗痙攣剤による治療はビオチン欠乏症の危険性を増大させる(16,17)。ビオチンと抗痙攣剤に関する情報については「安全性の項目」を参照されたし。
目安量(AI: Adequate Intake)
1988年、米国医学研究所食品栄養委員会(Food and Nutrition Board of Institute of Medicine)は、ビオチンの推奨量(RDA)を算出するには科学的根拠が不足しているとの判断から、推奨量ではなく目安量(AI)を策定した。ビオチンの目安量は、栄養要求量に見合ったビオチンの平均摂取量(35-60µg/day)で設定されている(1)。
| ライフステージ | 年齢 (月齢) | 男性 (µg/day) | 女性 (µg/day) |
|---|---|---|---|
| 乳児期 | 0-6ヶ月 | 5 | 5 |
| 乳児期 | 7-12ヶ月 | 6 | 6 |
| 幼児期 | 1-3歳 | 8 | 8 |
| 幼児期・小児期 | 4-8歳 | 12 | 12 |
| 小児期 | 9-13歳 | 20 | 20 |
| 青年期 | 14-18歳 | 25 | 25 |
| 成人期 | 19歳以上 | 30 | 30 |
| 妊娠期 | 全年齢 | - | 30 |
| 授乳期 | 全年齢 | - | 35 |
疾病予防
先天性異常
ビオチンの分解速度は妊娠中に速まる。そのため、ビオチン栄養状態は妊娠経過中に低下することが指摘されている(6)。ある研究では、13名のうち6名の妊娠女性で妊娠後期におけるビオチン排泄量が正常範囲を下回っており、ビオチン栄養状態の異常な低下が示唆されている。妊娠女性の半数以上では、ビオチン酵素の活性低下を反映する代謝産物(3-ヒドロキシイソ吉草酸)の排泄量が著しく増加する。26名の妊娠女性の研究では、ビオチン補給よるこの代謝産物の排泄量の減少が示されており、軽度のビオチン欠乏症が妊娠女性において比較的共通の症状であることが示唆されている(14)。ある研究では、75%以上の妊娠女性でリンパ球のプロピオニルCoAカルボキシラーゼ活性(ビオチン欠乏症の指標)が低下した(18)。ビオチン欠乏の程度が診断兆候や症状を発症させるに至らないレベルであっても、潜在性ビオチン欠乏症が複数の動物種では先天性異常を誘発するといった報告もあるので、そのような所見には留意すべきである(16)。現在、少なくとも三分の一の女性は妊娠中に潜在性ビオチン欠乏症を発症すると推定されている(8)。確固たる証拠はないが、ヒトにおいても潜在性ビオチン欠乏症による先天性異常が示唆されている。結局のところ、ビオチン欠乏症を原因とした催奇形性(胚もしくは胎児の異常発達)の潜在的リスクが存在するのであれば、そうしたリスクを回避するためにも全ての妊娠期間で適切なビオチン摂取量を確保することが賢明である。妊娠女性は神経管欠損症の予防のために妊娠前と妊娠中にサプリメントで葉酸を摂取するようアドバイスされる(葉酸の項目を参照)。葉酸をマルチビタミン剤(葉酸を400μg以上含む)で摂取すれば、少なくとも30µg/dayのビオチンを容易に補給することができる。このレベルでのビオチンによる毒性は報告されていない(安全性の項目を参照)。
疾病治療
糖尿病
顕在的なビオチン欠乏ラットにおけるグルコース利用能の悪化は古くから知られている(19)。ヒトを対象とした研究では、43名の2型糖尿病患者の血中ビオチン濃度は健常者よりも有意に低下し、空腹時血糖値と血中ビオチン濃度の間に逆相関の関係が認められた。1ヶ月間のビオチン補給(9000µg/day)によって空腹時血糖値は平均45%減少した(20)。一方、10名の2型糖尿病患者と7名の健常者の研究では、28日間ビオチンを補給(15,000µg/day)しても空腹時血糖値には何ら変化が認められなかった(21)。最近発表された同一研究グループによる二重盲検 プラセボ比較試験では、同様のビオチン療法プロトコールで、糖尿病の有無にかかわらず高トリグリセリド血症患者の血漿中性脂肪レベルが低下した(22)。この研究では、ビオチンは糖尿病、非糖尿病患者の血糖値に何ら影響を与えなかった。さらに、二三の研究では、ビオチンとクロミウム・ピコリネートの併用補給が2型糖尿病の補助療法として有効であることが示された(23-26)。しかし、いつくかの研究では、クロミウム・ピコリネートは単独投与でも糖尿病患者の血糖コントロールを改善することが示されている(27)。クロミウムの項目を参照されたし。
1週間のビオチン内服(16,000µg/day)によって7名の1型糖尿病患者の血糖値が減少することが報告されている(28)。ビオチンによる血糖降下作用はいつくかの作用機序で説明することができる。ビオチンは、脂肪酸合成に必須の酵素(アセチルCoAカルボキシラーゼ)の補酵素として作用するため、脂肪酸合成でグルコースの利用を増加することが推察される。ビオチンは、肝臓においてグルコースの貯蔵型であるグリコーゲンの合成を亢進するグルコキナーゼを活性化する。また、ビオチンはラットのインスリン(血糖降下ホルモン)分泌を刺激することが確認されている(29)。グルコーストランスポーターに対するビオチンの効果については今も検討中である。現在までに、ヒトを対象とした血糖値に対するビオチンの効果に関する研究は数少ないため、更なる研究が必要である。
もろい爪
ビオチン補給は馬や豚の蹄の治療に効果がある。こうした事実から、ビオチン補給はヒトのもろい爪の強化にも有効と推測される。3つの非対照試験において、もろい爪の女性患者に対するビオチン補給(6か月間まで2.5mg/day)の効果が検討されている(29-31)。2つの試験では、治療期間の最後までフォローアップが可能であった参加者のうち69-91%で自覚的な臨床症状の改善が報告されている(29,30)。もうひとつの試験では、電子顕微鏡によるスキャンニングによって爪の厚みと縦裂を評価しており、ビオチン補給によって爪の厚みが25%増加し、縦裂が減少することを報告している(31)。これら3つ非対照試験では、ビオチン補給がもろい爪の補強に有用であることを示唆している。しかし、もろい爪の治療に対する高濃度のビオチン補給の有効性を評価するためには大規模なプラセボ対照試験が必要である。
脱毛
脱毛は重度なビオチン欠乏症の兆候(欠乏の項目を参照)であるが、ヒトの脱毛予防・治療に対する高濃度のビオチン補給の有効性について科学的に検証した研究報告はない。
供給源
食物供給源
ビオチンは多くの食品に含まれているが、他の水溶性ビタミンと比較するとその含量は概して少ない。卵黄、レバー、酵母はビオチンを豊富に含んだ優良供給源である。米国における大規模国民栄養調査では、食品中ビオチン含量のデータ不足からビオチンの摂取量を見積もることができなかった。極僅かな研究ではあるが、成人における平均ビオチン摂取量は40-60μg/dayと算出されている(1)。以下の表にビオチンの優良供給源とその含量を示す(32)。しかし、食品中のビオチン含量を化学的定量法で測定した近年の研究では、いくつかの同一食品においてその含量が全く異なることが報告されている(33)。(一般的にビオチンは微生物定量法で測定される〔訳者注〕)
| 食品 | 一回当たりの摂取目安量 | ビオチン量(µg) |
|---|---|---|
| 酵母 | 1袋(7g) | 1.4-14 |
| パン(全粒小麦) | 1枚 | 0.02-6 |
| 鶏卵(加熱調理) | 大1個 | 13-25 |
| チーズ(チェダー) | 1オンス | 0.4-2 |
| レバー(加熱調理) | 3オンス* | 27-35 |
| 豚肉(加熱調理) | 3オンス* | 2-4 |
| サケ(加熱調理) | 3オンス* | 4-5 |
| アボカド | 1個 | 2-6 |
| ラズベリー | 1カップ | 0.2-2 |
| カリフラワー(生) | 1カップ | 0.2-4 |
*3オンスの食肉の大きさは1組のトランプとほぼ同サイズである。
細菌による合成
小腸及び大腸に常在する細菌の多くはビオチンを合成する。ヒトにおけるビオチンの出納についてはよくわかっていない。しかし、ビオチン吸収のための特別なプロセスについては小腸及び大腸由来の培養細胞で確認されている(34)。これらは豚で実証された現象ではあるが、ヒトにおいても腸内細菌由来のビオチンを吸収することが可能であることを示唆している。
安全性
毒性
ビオチンの毒性は今のところ報告されていない。先天的ビオチン代謝疾患の患者では、経口ビオチン補給は200,000µg/dayまで良好な耐容性を示した(毒性を示さなかった)(1)。ビオチン代謝疾患のないヒトにおいても、2年間にわたり5,000µg/dayまでのビオチンを服用しても何ら副作用は認められなかった(35)。しかし、高齢女性が2ヶ月間10,000µg/dayのビオチンと300mg/dayのパントテン酸を併用摂取したところ、致命的な好酸球性胸膜心膜漏出が認められたとの報告が1件ある(36)。米国医学研究所は、1988年にビオチンの食事摂取基準が策定された際、ビオチンの副作用の報告がなかったことからビオチンの耐容上限量(UL)を設定しなかった(1)。Note: 1mg = 1,000µg
栄養素相互作用
パントテン酸(ビタミンB5)はビオチンと類似した構造のため、多量に摂取すると腸管からの吸収や細胞への取り込みでビオチンと競合する可能性がある(37)。さらに、ラットでは過剰量(薬理量)のリポ酸がビオチン依存性カルボキシラーゼの活性を低下させることが報告されている。しかし、ヒトではこれらの影響について確認されていない(4,38)。
薬物間相互作用
長期間にわたり抗痙攣薬(抗発作薬)の治療を受けた患者では、ビオチンの血中濃度の低下と有機酸の尿中排泄の増加(ビオチン酵素であるカルボキシラーゼの活性低下の指標)が報告されている(39)。抗痙攣薬であるプリミドンとカルバマゼピンは小腸でのビオチンの吸収を阻害する。フェノバルビタールやフェニトイン、カルバマゼピンによる長期治療では、3-ヒドロキシイソ吉草酸の尿中排泄が増加するようである。小児では、抗痙攣薬であるバルプロ酸の服用がビオチニダーゼ活性の低下と関連している(17)。サルファ剤や抗生物質による長期治療では、腸内細菌によるビオチン合成の低下が推察される。そのため、理論上、食事性ビオチンの必要量が増加することになる。
ライナス・ポーリング研究所の推奨量
ビオチンに関しては、最適な健康状態の維持・増進や慢性疾患の予防に必要とされる食事性ビオチン量の情報は全く報告されていない。ライナス・ポーリング研究所では、米国医学研究所食品栄養委員会が推奨するビオチンの目安量(成人30µg/day)を勧める。多様な食生活によって多くの人が十分量のビオチンを摂取できるものと考えられる。しかし、マルチビタミン・ミネラルのサプリメントを毎日摂取するというライナス・ポーリング研究所の推奨に従えば、少なくとも一日当たり30µgのビオチンを摂取することができる。
高齢者(50歳以上)
現在、高齢者においてビオチン必要量が増加するとの指摘はない。食事から摂取するビオチンだけでは不十分であれば、マルチビタミン-ミネラルサプリメントを毎日摂取することによって、少なくとも一日当たり30µg/dayのビオチンが摂取可能となる。
Authors and Reviewers
Originally written by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in June 2004 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in August 2008 by:
Victoria J. Drake, Ph.D.
Linus Pauling Institute
Oregon State University
Reviewed in August 2008 by:
Donald Mock, M.D., Ph.D.
Professor
Departments of Biochemistry and Molecular Biology and Pediatrics
University of Arkansas for Medical Sciences
Copyright 2000-2024 Linus Pauling Institute
References
1. Food and Nutrition Board, Institute of Medicine. Biotin. Dietary Reference Intakes: Thiamin, Riboflavin, Niacin, Vitamin B6, Vitamin B12, Pantothenic Acid, Biotin, and Choline. Washington, D.C.: National Academy Press; 1998:374-389. (National Academy Press)
2. Mock DM. Biotin. In: Shils ME, Olson JA, Shike M, Ross AC, eds. Modern Nutrition in Health and Disease. 9th ed. Baltimore: Lippincott Williams & Wilkins; 1999:459-466.
3. Chapman-Smith A, Cronan JE, Jr. Molecular biology of biotin attachment to proteins. J Nutr. 1999;129(2S Suppl):477S-484S. (PubMed)
4. Zempleni J, Mock DM. Biotin biochemistry and human requirements. 1999; volume 10: pages 128-138. J Nutr. Biochem. 1999;10:128-138. (PubMed)
5. Hymes J, Wolf B. Human biotinidase isn't just for recycling biotin. J Nutr. 1999;129(2S Suppl):485S-489S. (PubMed)
6. Zempleni J, Mock DM. Marginal biotin deficiency is teratogenic. Proc Soc Exp Biol Med. 2000;223(1):14-21. (PubMed)
7. Kothapalli N, Camporeale G, Kueh A, et al. Biological functions of biotinylated histones. J Nutr Biochem. 2005;16(7):446-448. (PubMed)
8. Mock DM. Biotin. In: Shils ME, Shike M, Ross AC, Caballero B, Cousins RJ, eds. Modern Nutrition in Health and Disease. 10th ed. Baltimore: Lippincott Williams & Wilkins; 2006:498-506.
9. Mock DM. Marginal biotin deficiency is teratogenic in mice and perhaps humans: a review of biotin deficiency during human pregnancy and effects of biotin deficiency on gene expression and enzyme activities in mouse dam and fetus. J Nutr Biochem. 2005;16(7):435-437. (PubMed)
10. Stratton SL, Bogusiewicz A, Mock MM, Mock NI, Wells AM, Mock DM. Lymphocyte propionyl-CoA carboxylase and its activation by biotin are sensitive indicators of marginal biotin deficiency in humans. Am J Clin Nutr. 2006;84(2):384-388. (PubMed)
11. Mock D, Henrich C, Carnell N, Mock N, Swift L. Lymphocyte propionyl-CoA carboxylase and accumulation of odd-chain fatty acid in plasma and erythrocytes are useful indicators of marginal biotin deficiency small star, filled. J Nutr Biochem. 2002;13(8):462. (PubMed)
12. Baumgartner ER, Suormala T. Inherited defects of biotin metabolism. Biofactors. 1999;10(2-3):287-290.
13. Mardach R, Zempleni J, Wolf B, et al. Biotin dependency due to a defect in biotin transport. J Clin Invest. 2002;109(12):1617-1623. (PubMed)
14. Mock DM, Quirk JG, Mock NI. Marginal biotin deficiency during normal pregnancy. Am J Clin Nutr. 2002;75(2):295-299. (PubMed)
15. Pabuccuoglu A, Aydogdu S, Bas M. Serum biotinidase activity in children with chronic liver disease and its clinical significance. J Pediatr Gastroenterol Nutr. 2002;34(1):59-62. (PubMed)
16. Mock DM. Biotin status: which are valid indicators and how do we know? J Nutr. 1999;129(2S Suppl):498S-503S. (PubMed)
17. Schulpis KH, Karikas GA, Tjamouranis J, Regoutas S, Tsakiris S. Low serum biotinidase activity in children with valproic acid monotherapy. Epilepsia. 2001;42(10):1359-1362. (PubMed)
18. Mock DM. Marginal biotin deficiency is common in normal human pregnancy and is highly teratogenic in mice. J Nutr. 2009; 139(1):154-157. (PubMed)
19. Zhang H, Osada K, Sone H, Furukawa Y. Biotin administration improves the impaired glucose tolerance of streptozotocin-induced diabetic Wistar rats. J Nutr Sci Vitaminol (Tokyo). 1997;43(3):271-280. (PubMed)
20. Maebashi M, Makino Y, Furukawa Y, Ohinata K, Kimura S, Sato T. Therapeutic evaluation of the effect of biotin on hyperglycemia in patients with non-insulin dependent diabetes mellitus. J Clin Biochem Nutr. 1993;14:211-218.
21. Baez-Saldana A, Zendejas-Ruiz I, Revilla-Monsalve C, et al. Effects of biotin on pyruvate carboxylase, acetyl-CoA carboxylase, propionyl-CoA carboxylase, and markers for glucose and lipid homeostasis in type 2 diabetic patients and nondiabetic subjects. Am J Clin Nutr. 2004;79(2):238-243. (PubMed)
22. Revilla-Monsalve C, Zendejas-Ruiz I, Islas-Andrade S, et al. Biotin supplementation reduces plasma triacylglycerol and VLDL in type 2 diabetic patients and in nondiabetic subjects with hypertriglyceridemia. Biomed Pharmacother. 2006;60(4):182-185. (PubMed)
23. Geohas J, Daly A, Juturu V, Finch M, Komorowski JR. Chromium picolinate and biotin combination reduces atherogenic index of plasma in patients with type 2 diabetes mellitus: a placebo-controlled, double-blinded, randomized clinical trial. Am J Med Sci. 2007;333(3):145-153. (PubMed)
24. Albarracin C, Fuqua B, Geohas J, Juturu V, Finch MR, Komorowski JR. Combination of chromium and biotin improves coronary risk factors in hypercholesterolemic type 2 diabetes mellitus: a placebo-controlled, double-blind randomized clinical trial. J Cardiometab Syndr. 2007;2(2):91-97. (PubMed)
25. Singer GM, Geohas J. The effect of chromium picolinate and biotin supplementation on glycemic control in poorly controlled patients with type 2 diabetes mellitus: a placebo-controlled, double-blinded, randomized trial. Diabetes Technol Ther. 2006;8(6):636-643. (PubMed)
26. Albarracin CA, Fuqua BC, Evans JL, Goldfine ID. Chromium picolinate and biotin combination improves glucose metabolism in treated, uncontrolled overweight to obese patients with type 2 diabetes. Diabetes Metab Res Rev. 2008;24(1):41-51. (PubMed)
27. Broadhurst CL, Domenico P. Clinical studies on chromium picolinate supplementation in diabetes mellitus--a review. Diabetes Technol Ther. 2006;8(6):677-687. (PubMed)
28. Coggeshall JC, Heggers JP, Robson MC, Baker H. Biotin status and plasma glucose levels in diabetics. Ann NY Acad Sci. 1985;447:389-392.
29. Romero-Navarro G, Cabrera-Valladares G, German MS, et al. Biotin regulation of pancreatic glucokinase and insulin in primary cultured rat islets and in biotin-deficient rats. Endocrinology. 1999;140(10):4595-4600. (PubMed)
30. Floersheim GL. [Treatment of brittle fingernails with biotin]. Z Hautkr. 1989;64(1):41-48. (PubMed)
31. Hochman LG, Scher RK, Meyerson MS. Brittle nails: response to daily biotin supplementation. Cutis. 1993;51(4):303-305. (PubMed)
32. Briggs DR, Wahlqvist ML. Food facts: the complete no-fads-plain-facts guide to healthy eating. Victoria, Australia: Penguin Books; 1988.
33. Staggs CG, Sealey WM, McCabe BJ, Teague AM, Mock DM. Determination of the biotin content of select foods using accurate and sensitive HPLC/avidin binding. J Food Compost Anal. 2004;17(6):767-776. (PubMed)
34. Said HM, Ortiz A, McCloud E, Dyer D, Moyer MP, Rubin S. Biotin uptake by human colonic epithelial NCM460 cells: a carrier-mediated process shared with pantothenic acid. Am J Physiol. 1998;275(5 Pt 1):C1365-1371. (PubMed)
35. Koutsikos D, Agroyannis B, Tzanatos-Exarchou H. Biotin for diabetic peripheral neuropathy. Biomed Pharmacother. 1990;44(10):511-514. (PubMed)
36. Debourdeau PM, Djezzar S, Estival JL, Zammit CM, Richard RC, Castot AC. Life-threatening eosinophilic pleuropericardial effusion related to vitamins B5 and H. Ann Pharmacother. 2001;35(4):424-426. (PubMed)
37. Zempleni J, Mock DM. Human peripheral blood mononuclear cells: ; Inhibition of biotin transport by reversible competition with pantothenic acid is quantitatively minor. J Nutr Biochem. 1999;10(7):427-432. (PubMed)
38. Flodin N. Pharmacology of micronutrients. New York: Alan R. Liss, Inc.; 1988.
39. Camporeale G, Zempleni J. Biotin. In: Bowman BA, Russell RM, eds. Present Knowledge in Nutrition. 9th ed. Volume 1. Washington, D.C.: ILSI Press; 2006:314-326.
葉酸塩
目次
要約
- 葉酸塩は、食品に含まれる天然の葉酸塩や、サプリメントや強化食品に使用される合成された葉酸の総称である。葉酸塩は核酸前駆物質やいくつかのアミノ酸の代謝およびメチル化反応に重要である。(詳細はこちら)
- 葉酸塩またはビタミンB12の重度の不足は巨赤芽球性貧血に至る可能性があり、疲労、虚弱、および息切れなどを起こす。ビタミンB12依存性巨赤芽球性貧血を不適切に高用量葉酸の補給で治療すると、ビタミンB12欠乏の診断の遅れを招く可能性があり、それによって不可逆性の脳損傷になるリスクに個人をさらすことになる。(詳細はこちら)
- 葉酸塩の状態は葉酸塩代謝の遺伝的変異の存在によって影響を受け、特に5,10メチレンテトラヒドロ葉酸塩還元酵素(MTHFR)遺伝子の遺伝的変異に影響される。(詳細はこちら)
- 妊娠初期の葉酸塩の状態が不適切であると、先天性異常のリスクが高くなる。米国で1998年に導入された精製した穀物の製品への強制的な葉酸の強化は、新生児の神経管欠損(NTD)の罹患率を減らした。それでも世界中で妊娠可能年齢の女性の大部分で葉酸塩の状態が不適切であると考えられている。しかも、妊娠中に葉酸塩欠乏症になりやすくなることで、遺伝的要因がNTDのリスクを変えるかもしれない。NTD以外の先天性異常の予防に葉酸の補給が果たす役割を調査するいくつかの研究が現在行われている。(詳細はこちら)
- 血液中で葉酸塩が欠乏したりホモシステインの濃度が高いと、心(臓)血管疾患(CVD)のリスク上昇と関連する。血液循環中のホモシステイン濃度を制御するのに葉酸補給が有効であるとわかっているが、CVDの発症におけるホモシステイン濃度低下の効果については未だに論争がある。(詳細はこちら)
- 葉酸塩が低い状態だと、がんのリスク上昇と結びつく。しかし高用量の葉酸の介入試験では、一般的にがんの発症に関して何の有益性もなかった。(詳細はこちら)
- 前向きコホート研究で、特に男性の葉酸塩の状態と結直腸がん(CRC)のリスクに逆相関が報告された。しかしながら、葉酸塩の状態とがんリスクの関係は複雑で、さらなる研究が必要である。(詳細はこちら)
- 葉酸塩は脳の発達と機能に不可欠である。葉酸塩が低い状態であること、および/またはホモシステイン濃度が高いことは、加齢による認知機能障害(軽度の障害から認知症まで)と関連する。葉酸を含むビタミンB群の補給が認知機能を良好に保つのに長期的な有益性があるのかどうかは不明である。(詳細はこちら)
- 葉塩酸の輸送と代謝に影響する常染色体劣性遺伝疾患のいくつかは、葉酸誘導体であるフォリン酸の高用量補給で治療可能である。(詳細はこちら)
葉酸塩は水溶性のビタミンB群の一つで、葉酸塩(folate)と葉酸(folic acid)という用語が、この水溶性のビタミンに対してしばしば互換性を持って使用され、また、ビタミンB9またはホラシンとしても知られている。天然起源の葉酸塩は多くの化学的形態で存在しており、食品に含まれるだけでなく、ヒトの体内で代謝的に活発な形態でも存在する。葉酸は、強化食品やビタミンサプリメントに含まれる主要な合成形態である。その他の合成形態には、フォリン酸(図1参照)やレボメフォリック酸がある。葉酸は葉酸塩に変換されないと、何ら生物学的活性を持たない(1)。以下の議論では、食品や体内に存在する形態を「葉酸塩」と呼び、サプリメントや強化食品に含まれる形態を「葉酸」と呼ぶ。
機能
一炭素代謝
体内での葉酸塩補酵素(folate coenzyme)の唯一の機能は、一炭素単位の輸送を仲介することのようである(2)。葉酸塩補酵素は、核酸およびアミノ酸の代謝に重要な種々の反応における一炭素単位の受容体および供与体として働く(図2参照)(3)。
核酸の代謝
葉酸塩補酵素は、2つの異なる経路でのDNA代謝に極めて重要な役割を果たす。(1)核酸の前駆物質(チミジンおよびプリン)からの核酸の合成は、葉酸塩補酵素に依存する。(2)葉酸塩補酵素はホモシステインからメチオニンを合成するのに必要であり、メチオニンはSアデノシルメチオニン(SAM)の合成に必要である。SAMは、DNA、RNA、タンパク質、およびリン脂質の多数の部位におけるメチル化を含むほとんどの生物学的メチル化反応に使用されるメチル基(一炭素単位)の供与体である。DNAのメチル化は遺伝子発現の制御に関与しており、細胞の分化に重要である。DNAメチル化の異常は、がんの発症と結びついている(「がん」の項参照)。
アミノ酸代謝
葉酸塩補酵素は、メチオニン、システイン、セリン、グリシン、およびヒスチジンといったいくつかの重要なアミノ酸の代謝に必要である。ホモシステインからのメチオニンの合成は、葉酸塩(5メチルテトラヒドロ葉酸塩のような)だけでなくビタミンB12を使う酵素であるメチオニンシンターゼ(合成酵素)が触媒作用をする。したがって、葉酸塩(および/またはビタミンB12)の欠乏はメチオニンの合成を減らし、ホモシステインの蓄積に至る可能性がある。ホモシステインの血中濃度が高くなると、心血管疾患および認知症を含むいくつかの慢性疾患のリスク要因になると長年考えられてきた(「疾病予防」の項参照)。
他の栄養素との相互作用
ビタミンB12とビタミンB6
含硫アミノ酸代謝の中間体であるホモシステインの代謝は、最適な生理機能および健康に必要な栄養素の間の相互関係の例である。健康な個人は、ホモシステインを代謝するのに2つの異なる経路を用いる(図3)。一つの経路(メチオニン合成)はホモシステインからメチオニンを合成し、補助因子としての葉酸塩やビタミンB12に依存する。もう一つの経路はホモシステインを別のアミノ酸であるシステインに変えるもので、2つのビタミンB6依存性酵素を必要とする。したがって血液中のホモシステイン濃度は、葉酸塩、ビタミンB12、ビタミンB6という3つのビタミンBによって調整されている(4)。人によっては、リボフラビン(ビタミンB2)もホモシステイン濃度の調整に関わっている。
リボフラビン
あまりよく知られていないが、葉酸塩はリボフラビンと重要な代謝相互作用をする。リボフラビンは葉酸塩の代謝酵素である5,10-メチレンテトラヒドロ葉酸塩還元酵素(MTHFR)の活性に必要な補酵素であるフラビンアデニンジヌクレオチド(FAD)の前駆体である。FAD依存性MTHFRは、5メチルテトラヒドロ葉酸塩を生成する反応の触媒作用を次々と行う(上の図2参照)。この葉酸塩の活性型は、ホモシステインからメチオニンを作るのに必要である。その他のビタミンBに加えて、リボフラビンの高摂取は血漿中のホモシステイン濃度の低下と関連する(5)。葉酸塩の代謝におけるリビフラビンの効果は、MTHFR遺伝子の一般的なc.677C>T多型を持つホモ接合(TT型)の人達で最も大きいようである(「葉酸塩必要量における遺伝的差異」の項参照)(6)。これらの人達(世界中の成人の約10%)は、葉酸塩が低い状態であり、ホモシステイン濃度が高いことが典型的で、特に葉酸塩および/またはリボフラビンの摂取が最適以下である場合にそうである。これらの人々における高いホモシステイン濃度はリボフラビン補給によって低下しやすく、リボフラビンとMTHFRの相互作用の重要性を裏付けている(7)。
ビタミンC
ビタミンCは天然の葉酸塩補酵素および補給された葉酸の胃内での分解を低減して、葉酸塩の生物学的利用性を向上させている可能性がある。健康な9人の男性による交差試験で、5メチルテトラヒドロ葉酸塩(343μg)およびビタミンC(289mgまたは974mg)を同時に経口投与したところ、血清葉酸塩濃度が 5メチルテトラヒドロ葉酸塩のみの場合に比べて高かったという関連があった(8)。さらに、葉酸塩の代謝に関するいくつかの遺伝的変異が葉酸塩の代謝に関するビタミンCの効果に影響している可能性が、最近の研究で示唆された(9)。
生物学的利用性
食事性の葉酸塩は主に(いくつかのグルタミン酸残基を含む)ポリグルタミル形で存在するのに対し、合成ビタミンの形態である葉酸は一つのグルタミン酸しか含まないモノグルタミン酸である。加えて、天然の葉酸塩は還元された分子であるのに対し、葉酸は完全に酸化されている。これらの化学的差異がビタミンの生物学的利用性に大きな関連があり、たとえば同等の摂取濃度でも葉酸は天然起源の食品の葉酸塩よりも生物学的利用性があると考えられている。
食事由来の葉酸塩の小腸での吸収は、葉酸塩ポリグルタミン酸がそれに対応するモノグルタミン酸誘導体に加水分解され、その後に腸の細胞内に輸送されるという2段階のプロセスになっている。小腸細胞内では葉酸は天然起源の葉酸塩、つまり5-メチルテトラヒドロ葉酸塩に変換され、これがヒトの体内で循環する葉酸塩の主要形態である(上の図1参照)。
天然起源の葉酸塩の生物学的利用性は遺伝的に限定され、かつ変動する。異なる食品基質からの葉酸塩の放出され易さには大きな変動が伴われ、そして小腸細胞により取り込まれる前にポリグルタミルの「尾部」が除去(脱抱合)される。その他の食事成分も、変わり易い葉酸塩の不安定さに消化の過程で影響する。その結果、天然起源の葉酸塩は、葉酸に比べて不十分な生物学的利用性を示す。対照的に、サプリメントとして消化されれば葉酸の生物学的利用性は100%と考えられ、強化食品の葉酸は、サプリメントの葉酸の約85%の生物学的利用性であると推定される。
留意したいのは、米国およびその他の特定の国での葉酸塩の推奨量は、現在では「食事性葉酸塩等量(DFE)」として表記されている点である。これは葉酸が天然起源の葉酸塩に比べて生物学的利用性がずっと高いことを考慮して工夫された計算となっている(「推奨量」の項参照)。
輸送
葉酸塩とその補酵素は、細胞膜を通過するのに輸送体が必要である。葉酸塩の輸送体には、還元型葉酸塩キャリアー(RFC)、プロトン共役葉酸トランスポーター(PCFT)、および葉酸塩受容体タンパク質であるFRαとFRβがある。葉酸塩の恒常性は葉酸塩の輸送体があらゆる所に分布していることに支えられているが、その存在量や重要性は組織によって異なる(10)。PCFTをコード化する遺伝子に影響する突然変異が遺伝性葉酸吸収不全を引き起こすことから、PCFTは腸での葉酸塩の輸送に主要な役割を担っていることがわかる。PCFTに欠陥があると、脳への葉酸塩輸送障害にもなる(「疾病治療」の項参照)。FRαとRFCも、それぞれ細胞外の葉酸塩濃度が低いまたは高い時に、血液脳関門を超えた葉酸塩の輸送に重要となる。葉酸塩は胚および胎児の正しい発育に不可欠である。胎盤は葉酸塩を胎児の体内の循環に集中させることが知られており、妊娠中の女性そのものに比べて胎児での葉酸塩濃度が高くなる。妊娠中には、胎盤を通しての葉酸塩の輸送に3種の受容体のすべてが関わる(11)。
欠乏症
原因
葉酸塩欠乏症(folate deficiency)は食事不足によって起きることが最も多いが、その他の多くの状況でも起こる。たとえば、(食事からの摂取が少ないことに加えて)慢性的または多量のアルコール摂取は葉酸塩の吸収減と関連していて、葉酸塩欠乏症になる可能性がある(12)。喫煙も、葉酸塩が低い状態であることと関連する。ある研究では、血液中の葉酸塩濃度は、喫煙者では非喫煙者に比べて約15%低かった(13)。加えて、妊娠中に喫煙するかアルコールを乱用した妊婦は、胎児への葉酸塩の輸送に障害があると報告されている(14, 15)。
胎児、胎盤、および母体の組織の急速な細胞複製および成長による要求を満たすために、妊娠中は葉酸塩の需要が大幅に増加する時である。がんや炎症といった症状も細胞分裂および代謝の速度を上げることになり、体の葉酸塩に対する需要を増やす(16)。さらに、葉酸塩欠乏症は炎症性腸疾患(クローン病や潰瘍性大腸炎)や小児脂肪便症(セリアック病)を含む吸収不全状態から起こることもある(17)。葉酸塩欠乏症にはいくつかの薬物が関係している可能性もある(「薬物相互作用」の項参照)。加えて、葉酸塩の吸収、輸送、または代謝に影響する多くの遺伝性疾患が葉酸塩欠乏症やその代謝機能の阻害を起こすことがある(「疾病治療」の項参照)。
症状
臨床的な葉酸塩欠乏症は巨赤芽球性貧血になるが、これは葉酸による治療で回復できる。DNAの合成や細胞分裂は葉酸塩補酵素に依存するため、骨髄由来の細胞のように急速に分裂する細胞は葉酸塩欠乏症の影響を最も受けやすい。急速に分裂している骨髄の細胞への葉酸塩の供給が不適切だと血液細胞の分裂が減り、大きいが数が少ない赤血球になってしまう。このタイプの貧血を巨赤芽球性貧血または大球性貧血と呼び、大きく未成熟な赤血球を意味する。好中球という白血球が過分葉していて、血液サンプルを顕微鏡で調べることで発見可能である。正常な赤血球は血液循環において約4ヶ月の寿命であるので、葉酸塩欠乏症の人達が特徴的な巨赤芽球性貧血を発症するには数ヶ月かかることもある。そのような貧血の進行は血液の酸素運搬能力が減って、ついには疲労、虚弱、および息切れといった症状になる(1)。葉酸塩欠乏症による巨赤芽球性貧血はビタミンB12欠乏による巨赤芽球性貧血と同じなので、巨赤芽球性貧血の真の原因を診断するにはさらなる臨床検査が必要であるということを指摘しておくことが大切である(「毒性」の項参照)。
葉酸塩欠乏症の初期段階にある人達は明確な症状を呈することがないかもしれないが、血液中のホモシステイン濃度は上昇している可能性がある(「疾病予防」の項参照)。しかし血液循環中のホモシステイン濃度は葉酸塩の状態を示す特別な指標ではなく、ホモシステインの濃度上昇は、ビタミンB12やその他のビタミンB欠乏、ライフスタイル要因、および腎不全の結果であることもある。無症状の欠乏状態は、概して血清/血漿中または赤血球中の葉酸塩濃度の測定で検出される。
推奨量(RDA)
RDAの決定
食事性の葉酸塩の必要量は、貧血のような症状を起こすくらい重い欠乏を防ぐのに必要な量としてかつては定義されていた。最も新しいRDA(1998年;表1)は、異なる葉酸塩摂取量における赤血球葉酸塩濃度の妥当性に主に基いており、その妥当性は異常な血液学的指標がないことで判断される。赤血球中の葉酸塩は肝臓での葉酸塩の貯蔵と相関があることが示されており、長期的な葉酸塩の状態を示す指標として使用される。血漿の葉酸塩濃度は最近の葉酸塩の摂取を反映しており、葉酸塩の状態を示す信頼性のあるバイオマーカーではない。一炭素代謝の指標である血中ホモシステイン濃度を正常に維持することは、適切な葉酸塩摂取の補助的な指標であると考えられてきた。
妊娠は葉酸塩補酵素を必要とする細胞分裂やその他の代謝プロセスの大幅な増進と関連しているため、妊娠中の女性のRDAは妊娠していない女性のそれよりもかなり高い(3)。しかしながら、妊娠中の女性に対するRDAを設定する際に、神経管欠損(NTD)の予防は考慮されなかった。むしろNTDのリスク減少は、妊娠可能な女性向けの別な推奨の中で考慮された(「疾病予防」の項参照)。なぜならば、神経管の発達における重要な事象は、多くの女性が妊娠に気づく前に起こるからである(18)。
食事性葉酸塩当量(DFE)
米国医学研究所の食品栄養委員会が葉酸塩に対する新しい食事性推奨量を設定する際に、食事性葉酸塩当量(DFE)という新しい単位を導入した(1)。DFEの使用は、サプリメントや強化食品に含まれる合成された葉酸の生物学的利用性が天然起源の食品からの葉酸塩よりも高いことを反映している(18)。
- 1マイクログラム(μg)の食品性葉酸塩は、1μgのDFEにあたる
- 食事と一緒に摂取された葉酸または強化食品として摂取された1μgの葉酸は、1.7μgのDFEにあたる
- 空腹時に(サプリメントから)摂取された1μgの葉酸は、2μgのDFEにあたる
たとえば、60μgの葉酸塩を含む食品1サービング(分)は、60μgのDFEを供給する。一方で、60μgの葉酸を強化したパスタ1サービングは、葉酸の生物学的利用性が高いことから、1.7×60=102μgのDFEを供給する。空腹時に摂取された400μgの葉酸サプリメントは、800μgのDFEを供給する。DFEは成人による研究で決定されており、乳児用調製粉乳における葉酸が母乳に含まれる葉酸塩よりも生物学的利用性が高いかどうかは研究されていないことに留意すべきである。乳幼児に対する葉酸塩の必要量を決定するのにDFEを使用することは望ましくない。
葉酸塩の必要量における遺伝的差異
5,10メチレンテトラヒドロ葉酸塩還元酵素(MTHFR)に対する遺伝子配列における一般的な多型または変異はMTHFR c.677C>Tとして知られ、熱不安定性酵素となって現れる(19)。MTHFR遺伝子のエクソン4においてヌクレオチド677がシトシン(C)からチミン(T)に置き換わると、酵素の触媒ドメイン(触媒領域)におけるアラニンからバリンへの転移が起こる。集団によるが、MTHFR遺伝子に関して、20~53%の人達がTの遺伝子を1つ(677C/T型)受け継ぎ、3~32%の人達が2つ(677T/T型)受け継いでいる可能性がある(20)。MTHFRは、5,10メチレンテトラヒドロ葉酸塩(5,10メチレンTHF)の5メチルテトラヒドロ葉酸塩(5MeTHF)への還元を触媒する。後者はホモシステインからメチオニンを作るのに必要な葉酸塩補酵素である(上記の図2参照)。677C/C遺伝子型の人達に比べて、ヘテロ接合体677C/Tおよびホモ接合体677T/Tの人達では、MTHFRの活性が大きく弱まる(それぞれ30%と65%減少)(21)。ホモ接合体の突然変異(677T/T)は、赤血球での葉酸塩濃度がより低く、ホモシステインの血中濃度がより高いことに関連する(22,23)。Tの対立遺伝子を持つ年配の女性の葉酸塩の栄養状態が改善したら、血漿ホモシステイン濃度が減少した(24)。葉酸塩に関してまだわかっていない重要な問題は、少なくとも一つのT対立遺伝子を持つ人達におけるMHTFR酵素の活性の低さを補償するのに現在のRDAが十分であるのか、それともそれらの人達はRDAよりも葉酸塩の必要量が高いのかということである(25)。
疾病予防
妊娠結果への悪影響
神経管欠損
胎児の成長や発達は、広範な細胞分裂が特徴である。適切な量の葉酸塩がDNAやRNAの合成に重要である。神経管欠損(NTD)は受胎後21~27日後の胎児の神経管閉鎖の障害に由来し、この時は多くの女性は妊娠に気づかないことすらあるかもしれない(26)。NTDは脳の病変(たとえば無脳症や脳瘤)または脊椎の障害(脊椎破裂)などの様々な奇形を含み、それらは破滅的で生死に関わる(27)。食品に葉酸を強化する前の米国におけるNTDの罹患率は、1,000人に1人であったと推定される(1)。無作為化試験の結果、女性が受胎前後(受胎の約1ヶ月前から少なくとも1ヶ月後まで)に様々な食事に加えて葉酸のサプリメントを摂取したら、NTDの症例が60~100%減ったことが論証された(28, 29).。これらおよびその他の研究結果から、NTDを防ぐために妊娠可能な女性はすべて400μgの葉酸を毎日摂取するように、米国公衆衛生局は推奨した。以前にNTDの影響があった妊娠を経験した女性も、NTDの再発を防ぐために4,000mgの葉酸を毎日摂るように勧められた(30)。これらの推奨は、妊娠可能な年齢のすべての女性に対して行われた。なぜならば適切な量の葉酸塩が妊娠のごく初期に利用可能になっていなければならないからであり、また米国での妊娠の多くが計画されたものではないからである(31)。
葉酸塩の状態を改善する上での葉酸サプリメントの有効性にもかかわらず、世界的には、たったの30%の妊娠可能な女性しか正しく推奨に従っていないようであり、少数民族出身や社会経済学的に低階層の若い女性は最も推奨に従い難いであろうとの心配がある(32-34)。NTDの発生を減らすため、米国食品医薬品局(USFDA)は1998年にすべての強化穀物製品に対して穀物1kgあたり1.4mgの葉酸を強化するように要求する法令を実施した(「摂取源」の項参照)。米国における葉酸強化に要求されている濃度は、当初は平均的な個人の食事に100μgの葉酸を追加的に供給すると推定されていたが、食品メーカーによる葉酸の過剰使用により、実際にはより以上の葉酸を供給しているであろう(25, 35)。全米出生時異常予防ネットワークは、葉酸の強化以前に比べて米国ではNTDの罹患率が約30%減少し、強化後のNTD罹患率は出産および死産1,000人に対して0.69人であると報告している(36)。
また、NTDの病因学において遺伝的要因があることは、NTDの家族歴の女性はリスクが高いことや、民族によってもリスクが異なることが証左となっている(37)。加えて、NTDの発生は特定の葉酸・遺伝子の相互作用によるものでありうる。MTHFR c.677C>T多型やその他の遺伝的変異が、葉酸塩の必要量を増やし、NTDを患う妊娠へのなりやすさを高めている可能性がある。強化が始まる前、ある症例対象研究で、野生型のC/C遺伝子型に比べてT/TやC/Tの変異のある妊婦は、赤血球および血清葉酸塩濃度が有意に低いことが示された(22)。このことは、母体が特定の遺伝子型の場合、葉酸塩代謝が不十分であることを示唆している。2,429人の症例群の母親と3,570人の対照群の母親を含む25の症例対照研究のメタ解析で、母体のMTHFR c.677C>T多型とNTDとの正の相関が示された(38)。別のMTHFR変異である塩基番号1298におけるAからCへの変化も、MTHFRの活性を低下させNTDリスクが高くなるという相関があった(39)。両方のMTHFR変異(677C/Tと1298A/Cの組み合わせ)のあるヘテロ接合の人達は、677C/Tと1298A/Aという組み合わせの遺伝子型の人達よりも、血漿葉酸塩濃度が低くホモシステイン濃度が高かった(40)。G/Gのホモ接合である遺伝子型に還元型葉酸塩キャリアー(RFC-1)という輸送体の多型(c.80A>G)が組み合わさると、NTDの発生にさらに寄与することになるかもしれない(41)。NTDのリスクの程度は、MTHFRのその他の多型(c.116C>T, c.1793G>A)(42)や、メチオニンシンターゼ(MTR c.2756A>G)(43)、メチオニンシンターゼ還元酵素(MTRR c.66A>G)(44)、およびメチレンテトラヒドロ葉酸脱水素酵素(MTHFD1 c.1958G>A)(45)を含む一炭素代謝のその他の酵素に影響する突然変異に関連していた。母体の遺伝子型が妊娠の結果に影響することはあるが、母体と胎児との間の遺伝子の相互作用がもっと影響するようである。NTDのリスクは、母体のMTHFR c.677C>Tと胎児のMTHFR c.677C>T、および母体のMTRR c.66A>Gと胎児のMTHFR c.677C>Tの相互作用を含む特定の遺伝子の組み合わせによって増加する(43, 44, 46)。さらに、一炭素代謝における特定の多型がある場合に、ビタミンB12の状態がNTDリスクの変化と関連する(47)。
心(臓)血管の奇形
心臓の先天的異常は乳児の死亡の主な原因であるが、成人してからも死をもたらす(48)。欧州先天異常監視機構(EUROCAT)のデータベースからのデータを用いた596の症例と2,359の対照群による症例対照研究で、妊娠前後期(受胎1ヶ月前から胎児の心臓の発達の時期にあたる 受胎後8週間まで)に少なくとも400μg/日の葉酸を摂取すると、先天性心臓欠陥リスクが18%減少するという関連があった(49)。20~25の症例対照研究および家族に基づく研究の最近のメタ解析で、母方、胎児、または父方のMTHFR c.677C>T変異と先天性心臓欠陥の発生との間の正の相関がわかった(50, 51)。先天性心臓欠陥のリスクにおける遺伝子と栄養素の相互作用の影響を明らかにするにはさらなる研究が必要であるが、現在までにわかっている研究は適切な葉酸塩摂取が重要な役割を果たしているであろうことを示している。
口唇口蓋裂 (口腔顔面裂)
妊娠時の母体の葉酸塩の状態は、口蓋裂を伴うまたは伴わない口唇裂(CL/P)である口唇口蓋裂と呼ばれる先天性異常のリスクに影響する可能性がある(52)。ノルウェーでの集団に基づく症例対照研究で、CL/Pのある377人の新生児、196人の口蓋裂(CPO)のみの新生児、および763人の対照群それぞれの母親への葉酸補給の影響が調べられた(52)。母親自らによる(妊娠初期の3ヶ月間の)食事からまたはサプリメントからの摂取がCL/Pのリスクを大きく変えることはなかったが、食事からの葉酸塩の他にマルチビタミンや葉酸(日に400μg以上)のサプリメントを摂取した女性はリスクが64%低かったと報告された。同じ集団で、シスタチオニンβシンターゼ(CBS)遺伝子の多型(c.699C>T)またはMTHFR遺伝子(葉酸塩の摂取が400μg/日よりも少ない場合のc677C>T)の多型が異常の予防に役立つようであり、葉酸塩/一炭素代謝におけるその他の遺伝子変異はCL/Pと関係がないのかもしれない(54, 55)。しかしながら、18の研究の最近のメタ解析で、母体が677T/Tホモ接合であるとCL/Pリスクが上昇することが示された(56)。遺伝的多型と葉酸塩摂取パラメータの両方を統合してCL/Pのリスクを評価する追加的研究が必要である。CPOリスクにおける葉酸塩の役割を支持する疫学的エビデンスは不足している。
その他の妊娠結果への悪影響
低体重出生は生後1年間の死亡率が高くなるリスクと関連があり、成人してからの健康にも影響するかもしれない(57)。8つの無作為化対照試験の最近の系統的レビューおよびメタ解析で、葉酸の補給と出生時体重との正の相関がわかったが、妊娠期間と体重との関連は見られなかった(58)。さらに、306人の少女の妊婦の前向きコホート研究で、妊娠後期の低葉酸塩摂取と母体の葉酸塩の状態が、胎内発育遅延での出生(出生時体重が10パーセンタイルより少ないもの)と関連していた(59)。しかも、母体のMTHFR c677C>T遺伝子型と機能的な葉酸塩欠乏症の指標であると考えられるホモシステイン濃度の上昇が、出生時の低体重と関連していた(60)。
血中ホモシステイン濃度の上昇は、流産および子癇前症や胎盤早期剥離を含むその他の妊娠合併症の発生の増加と関連している(61)。大規模な後ろ向き研究で、ノルウェー人女性の血漿ホモシステイン濃度が、過去の妊娠における子癇前症、早産、および極低出生体重児を含む妊娠結果や合併症への悪影響と強く関係していたことが示された(62)。51の前向きコホート研究の最近のメタ解析では、MTHFR c677C>T変異が白人および東アジアの人々の子癇前症リスク上昇と関連づけられ、葉酸塩代謝がその症状に関わっているのではないかという考えが強化された(63)。妊娠中ずっと5.1mgまでの葉酸を毎日補給することが、リスクの高い女性の子癇前症やその他の有害事象(母体の死、胎盤剥離、早期分娩など)を予防するかどうかを評価するために、葉酸臨床試験(FACT)という大規模な多機関による無作為化対照試験が始まった(64)。妊娠中の適切な葉酸塩の摂取は、巨赤芽球性貧血から体を護る(65)。最近の症例対照研究で、母親と子供がMTHFR c677C>T遺伝子型である時に、毎日600μg以上の葉酸を妊娠前と妊娠中に摂取すると、自閉症スペクトラム障害のリスクが減ることがわかった(66)。
したがって、神経管閉鎖の後も妊娠中ずっと葉酸補給をすることは、妊娠中のその他の問題のリスクを減らすために理にかなっている。さらに、観察研究の最近の系統的レビューでは、妊娠中に葉酸を摂ることと、出生児の健康への悪影響、特に小児喘息やアレルギーなどとの関連のエビデンスはなかった(67, 68)。
心(臓)血管疾患
モシステインと心(臓)血管疾患
80超の研究の結果、血液中のホモシステイン濃度の少しの上昇でも心(臓)血管疾患(CVD)のリスクが高まることが示された(4)。血管障害になりやすい体質は、ある集団ではホモシステイン代謝における遺伝子欠損とも関連付けられてきた(69)。ホモシステインが血管疾患のリスクを高めるかもしれないメカニズムは幾多の研究の主題となってきたが、それにはホモシステインが血液凝固、血管拡張、および動脈壁の肥厚に及ぼす悪影響が関連しているのかもしれない(70)。血液中のホモシステイン濃度の上昇は一貫してCVDリスクの上昇と関連してきたが、循環血液中のホモシステイン濃度を下げることがCVDリスクを下げることになるのか不明である(「葉酸塩とホモシステイン」の項参照)。研究では、3マイクロモル/リットルという血清ホモシステイン濃度の長期の減少がCVDリスクを最大25%減らし、リスクの高い個人の合理的な治療目標であると、はじめは予想されていた(71,72)。しかし、最近のビタミンB補給の臨床試験の解析で、ホモシステイン濃度を下げても、すでにCVDを患っている患者の第二の心血管障害の予防には、ならなかったことが示された(73,74)。その結果、たとえば個人的または家族歴に早発性の心血管疾患がある者、栄養不良または吸収不良症候群の者、甲状腺機能低下症の者、腎不全の者、狼瘡のある者、または特定の薬剤(ニコチン酸、テオフィリン、胆汁酸-結合樹脂(胆汁酸吸着レジン)、メトトレキサート、およびL-ドーパ)を飲んでいる者などのハイリスクな個人のみが、総ホモシステイン濃度が高くないか検診することを米国心臓協会は推奨している。
葉酸塩とホモシステイン
葉酸塩の豊富な食事は、冠状動脈疾患、心筋梗塞(心臓発作)、および脳卒中を含むCVDリスクの減少と関連がある。1,980人のフィンランド人男性を10年間追跡した研究で、食事からの葉酸塩の摂取が最も多い場合は、最も少ない場合に比べて急性の冠動脈性事故のリスクが55%低いことがわかった(75)。ホモシステイン濃度を調整している3種のビタミンBのうち、ビタミンB12やB6が同時に欠乏していない場合には、葉酸は血液中のホモシステインの基礎濃度を下げるのに最大の効果があることが示されている(「栄養素の相互作用」の項参照)(76)。葉酸塩の豊富な食事やサプリメントで葉酸塩の摂取を増やすことは、ホモシステイン濃度を下げることがわかっている(77)。加えて、米国でFDAが穀物に葉酸を強化するよう命じてから、血中ホモシステイン濃度は減少した(25)。ほぼ3,000人の被験者を含む25の無作為化対照試験のメタ解析で、800μg/日以上の葉酸補給によって血漿ホモシステイン濃度が最大25%下がることがわかった。このメタ解析では、毎日200μgおよび400μgの用量の葉酸が、それぞれ13%と20%の血漿ホモシステイン濃度の減少と関連があった(78)。もしも、はじめに試した葉酸塩の豊富な食事(「摂取源」の項参照)が、ホモシステイン濃度を適度に下げるのにうまくいかなかった場合、400μgの葉酸、2mgのビタミンB6、および6μgのビタミンB12による補給養生法を米国心臓協会が提唱している(79)。
葉酸塩/一炭素代謝におけるいくつかの多型が血中ホモシステイン濃度を変える(80)。特に、MTHFR c.677C>T変異の効果は、世界中で葉酸強化政策との関係で調べられてきた。CVDの病歴のない59,995人の被験者を含む無作為化試験の分析で、T/TおよびC/C遺伝子型でのホモシステイン濃度の差は、強化食品政策を取っている地域に比べて葉酸塩の摂取の少ない地域(3.12マイクロモル/リットル対0.13マイクロモル/リットル)で大きかったことがわかった (81)。葉酸の補給は効果的にホモシステイン濃度を下げているが、それがCVDのリスクも下げているかどうかは不明である。心血管または腎臓の持病のある47,921人の被験者を対象にした19の無作為化臨床試験の最近のメタ解析で、葉酸やその他のビタミンB補給によるホモシステイン濃度の低下は、血漿ホモシステイン濃度が大幅に下がってもCVDの発生を減らすことにはならなかったことがわかった(74)。その他のメタ解析では、脳卒中リスク(83,84)を含むCVDリスク(80-82)とホモシステイン濃度の低下に因果関係がないことが確認された。したがって、全米心臓協会はハイリスクの女性に対して心血管疾患予防での葉酸の使用を推奨することを取り下げた(85)。今日までの予防試験の大多数は、進行したCVDの患者に対して行われてきたことには留意すべきである。葉酸塩とそれに関連するビタミンB類の有益さを支持するエビデンスは、脳卒中の一次的予防に関して最も強いようである(86)。強制的な葉酸強化の導入は北米で脳卒中に絡んだ死亡の減少と関連があり、脳卒中の予防に葉酸塩の状態を強化すること、および/またはホモシステイン濃度を下げることの潜在的有益性をさらに支持するものである(87)。
CVD予防におけるホモシステイン濃度の低下の役割に関する論争にかかわらず、血管障害のリスク要因として知られるアテローム性動脈硬化症の発症に対する葉酸補給の効果を調べたいくつかの研究がある。頸動脈内膜中膜複合体厚(CIMT)の測定値は、初期のアテローム性動脈硬化症の代替エンドポイントであり、心血管イベント(心血管事象)の予測因子である(88)。葉酸補給の効果をテストした10の無作為化試験のメタ解析で、慢性的腎疾患やCVDのリスクのある被験者のCIMTが大きく減ったが、健康な参加者ではそうではなかった(89)。内皮機能障害は、アテローム性動脈硬化症や血管疾患に共通の特徴である。高用量(400~10,000μg/日)の葉酸は、健康な被験者でもCVDの被験者でも血管の健康の改善に関わっていた(90)。最近の研究では葉酸補給による心血管保護の論証はできなかったが、葉酸塩の低摂取は血管疾患のリスク要因として知られており、血管の健康を維持するための葉酸塩の役割を調べるさらなる研究が必要である(91)。
がん
がんは、進行中のDNAの修復過剰および/または重要な遺伝子の不適切な発現によるDNA損傷から起こると考えられている。DNAおよびRNAの合成やメチル化に葉酸塩が重要な役割を果たしていることから、不十分な葉酸塩の摂取が、がんの発症をしばしば特徴づけるゲノムの不安定さや染色体切断に寄与している可能性がある。特に、DNAの複製と修復はゲノムの維持に重要であり、葉酸塩欠乏によるヌクレオチド不足が、ゲノムの不安定さやDNAの突然変異に至るのかもしれない。5,10-メチレンTHFの減少は、チミジル酸合成酵素(TS)によるデオキシウリジン一リン酸(dUMP)のデオキシチミジン一リン酸(dTMP)への変換を損なう可能性があり、ウラシルの蓄積とチミンの枯渇を引き起こす。するとこれがDNAの複製や修復の際にウラシルをDNAに誤って取り込み、点突然変異や鎖切断を含むDNA損傷を起こすことになりかねない(92)。5,10-メチレンTHFはMTHFR酵素の基質でもあるので、c.677C>T多型に伴うMTHFR活性の減少がチミジル酸合成のための5,10-メチレンTHFの使用増加をおこし、DNA損傷を防いでいることは妥当であろう。しかしながら、この仮説は葉酸塩欠乏症の状態でのみ正しいかもしれない(93)。逆に、葉酸補給がDNA合成を促進し腫瘍の成長を促すのではないかという議論もあった。これは、TSが腫瘍促進物質(発がん遺伝子)のように機能することができて、一方ではTS活性の減少ががんリスクの低下と関連しているという観察によって裏付けられる(94,95)。さらに、チミジル酸合成経路を阻害する葉酸(代謝)拮抗薬分子は、がんの治療にうまく使用されている(96)。葉酸塩は、ホモシステイン/メチオニン代謝サイクルと、メチル化反応のメチル供与体であるS-アデノシルメチオニン(SAM)の貯蔵も制御している。したがって、葉酸塩欠乏症はDNAとタンパク質のメチル化を損い、DNA修復、増殖、および細胞死に関係する遺伝子の発現を変える可能性がある。がんの典型的な特徴である全体的な低メチル化は、ゲノムの不安定さや染色体切断を引き起こす((97)の文献で総括)。
毎日少なくとも5サービング分の果物や野菜を摂取することは、がんの発症が減ることと常に関連してきた(98)。果物や野菜は葉酸塩の優れた摂取源で、抗発がん性効果に役立っているのかもしれない。観察研究では、葉酸塩の減少した状態が、部位特異的ながんに関連があるとわかっている。米国では食品への強化は義務である(1998年以降。「摂取源」の項参照)が、葉酸の高摂取がもたらす健康への影響の懸念がその他のいくつかの国での実施を遅らせている(99)。しかしながら、最も新しい葉酸介入試験(サプリメントの用量が500~5,000μg/日で少なくとも1年間)のメタ解析では、がん全体の発症および部位特異的ながんの発症でも、何ら特別な有益さも害も示されなかった(100,101)。
結直腸がん
全部で725,134人を7~20年間追跡した13の前向きコホート研究の統合解析で、食事からの葉酸塩および葉酸塩全体(食品やサプリメントからのもの)の摂取量と結腸がんリスクとの控えめな逆相関がわかった。特に、総葉酸塩摂取が100μg/日増えるごとに、結腸がんリスクが2%減少すると推定された(102)。1995~2006年に50~71歳の525,488人の被験者を追跡した米国の大規模前向き研究では、食事からの葉酸塩、サプリメントの葉酸、および総葉酸塩の摂取が結直腸がん(CRC)リスクの減少と関連があった(103)。しかしながら、性によって分けると、女性には食事からの葉酸塩の摂取とCRCリスクとの関連はなかった(103,104)。CRCリスクと食事からの葉酸塩摂取、サプリメントの葉酸摂取、および総葉酸塩摂取との関連がないことは、米国で葉酸強化が始まる前後の11年間にわたり、90,000人の閉経後の女性を追跡した別の前向き研究でも報告された(105)。これらのデータは、葉酸塩によるCRCリスクの違いに性別が影響している可能性を示唆する。後者の研究では、葉酸強化の義務化後に一時的ではあるが、かなりのリスク上昇も観察された。しかしながら、これが葉酸の強化義務による葉酸塩摂取増加によって引き起こされたものではないだろうという主張もある(106)。また、18の症例対照研究のメタ解析で、食品からの葉酸塩でCRCリスクがわずかに減少することがわかった(107)。しかし、その症例対照研究はとても不均質で、食物繊維、ビタミン、およびアルコール摂取が研究結果を混同させていると著者らが述べていることに留意することが大切である。しかも、葉酸塩摂取の最高分位の下限は270~1,367μg/日とかなりの幅があった(107)。
たいていの疫学的研究が結直腸がん発症に対する葉酸塩による防護効果を示している一方で、高用量の葉酸サプリメントが実際にはがん患者の腫瘍の成長を加速しているかもしれないという示唆もある(108)。正常な食事の範囲で葉酸塩が高めの状態なことはがんに対して防護的であると広く考えられているが、過剰な葉酸の高摂取によって既存の新生物(腫瘍)の成長が助長されるのではないかと懸念している研究者もいる(108)。結直腸腺腫の病歴のある患者への葉酸補給の効果を扱ったいくつかの臨床試験があり、葉酸補給によるリスク低下があったものもあれば、まったく効果がなかったものもあった(109-112)。リスクの高い被験者による3つの大規模無作為化対照試験の最近のメタ解析では、葉酸を24~42ヶ月の間500または1,000μg/日の用量で補給した被験者の結直腸腺腫の再発は、プラセボに比べて何も増加しなかった(113)。
前に示唆したように、葉酸塩が少ない状態ではMTHFR 677T/T遺伝子型がウラシルの誤取込を防ぎ、DNAの統合性と安定性を護るのかもしれない。62の症例対照研究と2つのコホート研究のメタ解析で、C/TおよびC/C遺伝子型に比べてT/T変異がCRCリスクを12%下げる一方で、遺伝子型にかかわらず全葉酸塩摂取量が高い(348~1,583μg/日)と、低い(264~450μg/日)場合に比べてリスクが30%減ったことがわかった(114)。メチオニンシンターゼをコード化するMTR遺伝子の一般的多型(c.2756A>G)でも、結直腸の腺腫やがんのリスクとの関係が調べられた。メチオニンシンターゼは、ホモシステインと5メチレンTHFをそれぞれ同時にメチオニンとTHFに変換する反応の触媒作用をする。27の症例対照研究の最近のメタ解析では、MTRの変異とがんリスクとの関連は示されなかった(115)。
アルコール摂取は葉酸塩の吸収と代謝を妨げる(16)が、1つの症例対照研究と5つの前向きコホート研究で、アルコールを飲まない者は飲む者に比べてCRCリスクが低下するか無関連であることが報告された(107)。しかしながら、28,000人以上の男性医療従事者を22年間追跡した大規模前向き研究では、毎日2杯より多いアルコール飲料(30グラム超のアルコール)の摂取で、葉酸強化前の期間ではCRCリスクが42%増えた。CRCリスクは強化後の期間には増大しなかったので、高アルコール摂取と低葉酸塩摂取の組み合わせがCRCリスクを増加させるのではないかと示唆している。69,000人の女性看護師を28年間追跡した別の前向き研究では、葉酸の強化が義務化される以前でも以後でも、アルコール摂取とCRCリスクの上昇との関係は報告されなかった(116)。いくつかの研究では、MTHFR c.677C>T多型がホモ接合(T/T)の人達は、葉酸塩の摂取が適切である場合には結腸がんリスクが減ることがわかった。しかしながら、葉酸塩の摂取が少なく(および/または)アルコール摂取が高いと、T/T遺伝子型の人達は結直腸がんのリスクが上昇していた(117,118)。
乳がん
葉酸塩の摂取が乳がんリスクに影響するかを調べたいくつかの前向きコホート研究および症例対照研究は、結果がまちまちである(119)。15の前向き研究および1つのコホート内症例対照研究では、食事からの葉酸塩の摂取とは無関係であった(120)。女性は適度のアルコール摂取でも、乳がんリスク上昇と関連する(121)。3つの前向き研究の結果から、葉酸塩の摂取を増やすと、アルコールを定期的に摂取している女性の乳がんリスクが減る可能性があることが示唆された(122-124)。したがって、葉酸塩の高摂取は、アルコール摂取によって乳がんリスクが高くなっている女性にのみリスク低下と関連しているのかもしれない。88,000人超の看護師を対象にした大規模前向き研究で、1日に1杯未満のアルコール飲料しか摂取しない女性の乳がんと葉酸の摂取は関連がなかったと報告された。しかしながら、1日に少なくとも1杯のアルコール飲料を摂取する女性では、毎日少なくとも600μgの葉酸摂取で、毎日300μg未満の葉酸しか摂取しない女性に比べて乳がんリスクが約半分になった(124)。それでも、アルコール摂取が乳がんリスクを上げているのかどうかや、どのように上げているのかは未だに議論のあるところである(125,126)。また、がんリスクに対する一炭素代謝における多型の影響を評価する最近のメタ解析で、チミジル酸合成酵素をコード化する遺伝子の特定の変異が、特定の民族集団の乳がんリスクを上げることがわかった(127,128)。
小児がん
子供におけるウィルムス腫瘍(腎臓がん)と特定の悪性脳腫瘍(神経芽細胞腫、神経節芽細胞腫、および上衣腫)の発症は、米国での1998年の穀物製品への葉酸強化の義務化以来少なくなっている(129)。しかしながら、小児の主な悪性腫瘍である白血病に関しては、強化の前後で発症率に変化がなかった。妊娠中の母体への葉酸補給と小児白血病のリスク減少を関連付けた初期の研究にもかかわらず、最近の研究では葉酸の予防効果を支持するエビデンスはほとんどない(130)。いくつかのメタ解析でも、MTHFR多型の防護効果はほとんど、または、全くないことがわかっている。しかしながら、22の症例対照研究の最も新しいメタ解析で、c.677C>T変異のある白人やアジア人の急性リンパ芽球性白血病(ALL)のリスク低下がわかった(131)。
アルツハイマー病および認知障害
アルツハイマー病(AD)は米国で最も一般的な認知症の形態で、65歳以上の500万人以上がこの病にかかっている(132)。AD患者の脳でのβ-アミロイド斑の沈着、タウタンパク質形成のもつれ、および細胞死の増加が、認知機能低下や記憶の喪失と関連している。ある研究では、葉酸塩の豊富な食品源である果物や野菜の摂取増加と、女性の認知症やADの発症リスクの低下には関連があった(133)。核酸の合成およびメチル化の際のメチル供与体という役割から、妊娠中および出生後だけでなくその後の人生においても、葉酸塩は正常な脳の発達と機能に重要である(134)。年配女性の1つの横断研究では、AD患者は健康な者に比べてホモシステイン濃度が有意に高く、赤血球の葉酸塩濃度が低かった。しかしながら、血清葉酸塩濃度には両群間で違いはなかった。このことから、最近の葉酸塩摂取ではなく長期的な葉酸塩の状態がADリスクと関連しているかもしれないということがわかる(135)。
数人の研究者が、年配者ではホモシステイン濃度が高いことと認知障害との関連があると記載している(136)。しかし前向きコホート研究では、葉酸塩の高摂取と認知機能の向上との関連があるとはわかっていない(137,138)。高めのホモシステイン濃度は、健康な被験者に比べてADや血管性認知症を含む認知症の人達に見うけられる(139,140)。葉酸塩、ビタミンB12、およびビタミンB6の欠乏がホモシステイン濃度を上昇させる可能性はあるが、AD患者の血清ビタミン濃度が健康な個人に比べて低いことは、ビタミン摂取の減少によるものでないかもしれない(141)。現在では、血清のホモシステインが認知症発症のリスク要因であるのか、それとも単に認知機能の低下に関連するのかはっきりしない。ここ10年間で、ホモシステイン濃度を低下させ認知機能低下を予防あるいは遅延するために、いくつかの臨床試験でビタミンB群がテストされた。45歳以上の健康な人達を対象に葉酸〔0.2~15mg/日を約6ヶ月間(中央値)にわたって〕補給した9例の無作為化プラセボ対照試験のメタ解析で、記憶、速度、言語、および実行機能を含む認知機能への短期的効果はなかったことがわかった(142)。より最近では、ビタミンB補給の無作為化プラセボ対照試験19例のメタ解析で、補給によってホモシステイン濃度は効果的に下がったものの、補給した群とプラセボ群との間に認知機能パラメーターの差がなかった(143)。試験ごとに一貫しない結果になったのは、試験の計画や方法の差によるものであるかもしれない((144)の文献で概説)。
それでもなお、軽い認知障害のある168人の年配の被験者による2年間の無作為化プラセボ対照試験で、800μgの葉酸、500μgのビタミンB12,および20mgのビタミンB6の組み合わせを毎日摂取することの有益性が最近報告された(145,146)。ADによる影響を受けた脳の特定領域の萎縮は両群で見られ、この萎縮は認知機能の低下と関連していた。しかしながら、ビタミンBで治療した群はプラセボ群に比べて、灰白質の損失が小さかった(0.5%対3.7%)。試験開始時にホモシステイン濃度が高かった被験者で、より有効であったことから、認知機能低下や認知症の予防に血液中のホモシステイン濃度を下げることが重要であることを示唆している。有望ではあるが、ビタミンB補給の効果については、ADの発症のような長期的結果を評価できる、より大規模な試験でさらに研究される必要がある。
疾病治療
代謝性疾患
テトラヒドロ葉酸誘導体であるフォリン酸(上記の図1参照)は、葉酸塩の輸送または代謝に影響するまれな先天性異常の臨床管理に使用されている((147)の文献で概説)。そのような容態は常染色体劣性遺伝であり、突然変異した遺伝子を2つ(両方の親から1つずつ)受け継いだ人達のみがその病気を発症することになる。
遺伝性葉酸吸収不全症
遺伝性葉酸吸収不全症は、葉酸塩輸送体であるPCFTをコード化するSLC46A1遺伝子の突然変異によって引き起こされ、概して胃腸での葉酸塩の吸収と脳への葉酸塩の輸送に影響する(148)。患者は血清および脳脊髄液の葉酸塩濃度が低いか、または検出不能な濃度であったり、汎血球減少(全血球の数が少ないこと)になったり、感染にかかりやすくなる免疫応答障害が出たりして、一般的に丈夫でない(149)。てんかん発作を含む神経症状も見られる(150)。非経口的フォリン酸の補給による臨床的な改善が報告されている(151)。
脳性葉酸(塩)欠乏(CFD)症候群
CFDは、血液中の葉酸塩濃度が正常であるにもかかわらず脳脊髄液中の葉酸塩補酵素濃度が低いことが特徴である。血液脳関門を通過する葉酸塩の輸送がCFDの患者では損なわれており、これは葉酸塩受容体のFRαを阻害する抗体があることや、FRαをコード化するFOLR1遺伝子の突然変異と関連がある(152,153)。視覚聴覚障害を伴う神経学的異常がCFDの子供に報告されている。自閉症スペクトラム障害(ASD)があるケースもある。フォリン酸(ロイコボリンとも言う)は脳に入り込んで葉酸塩補酵素の濃度を正常にし、葉酸塩濃度を正常にして、ASDの子供の気分、行動、および言葉でのコミュニケーションを含むCFDの様々な社会的相互作用を向上させることが示されている(152,154,155)。
ジヒドロ葉酸還元酵素(DHFR)欠乏症
DHFRはNADPH依存性酵素で、ジヒドロ葉酸(DHF)をテトラヒドロ葉酸(THF)に還元する反応の触媒作用をする。DHFRは葉酸をDHFに変換するのにも必要である。DHFR欠乏症は巨赤芽球性貧血や脳性葉酸(塩)欠乏症が特徴で、難治性の発作や精神的な欠陥を起こす。フォリン酸による治療がDHFR欠乏症の症状を軽減するとはいえ、不可逆的な脳損傷を予防し治療結果を向上させるのに初期段階での診断が欠かせない(156,157)。
摂取源
食品源
緑色の葉物野菜(葉)は葉酸塩の豊富な食品源で、その名前の由来となっている。柑橘のジュース、豆類、および強化食品も優れた葉酸塩摂取源である(1)。強化されたシリアルの葉酸塩含有量は大きく幅がある。いくつかの葉酸塩が豊富な食品を、マイクログラム(μg)表記の葉酸塩含有量とともに表2に示す。特定の食品の栄養素含有量の詳細は、米国農務省(USDA)の 食品成分データベースを検索のこと。
| 食品 | サービング数(分量) | 葉酸塩 (μg DFEs) |
|---|---|---|
| レンズ豆(成熟したものを加熱調理) | ½カップ | 179 |
| ひよこ豆(加熱調理) | ½カップ | 141 |
| アスパラガス(加熱調理) | ½カップ(約6本) | 134 |
| ホウレンソウ(加熱調理) | ½カップ | 131 |
| アオイマメ(大きな成熟したものを加熱調理) | ½カップ | 78 |
| オレンジジュース(生) | 約180ml | 56 |
| スパゲッティ(強化食品を加熱) | 1カップ | 167* |
| 白米(強化食品を加熱) | 1カップ | 153* |
| パン(強化したもの) | 1切れ | 84* |
| *神経管欠損の予防に役立てるため、すでにナイアシン、チアミン、リボフラビン、および鉄を強化した精白した穀物の製品に穀物1kgあたり1.4mgの葉酸を強化するよう、米国のFDAは1998年1月1日以降要求している。栄養素の欠乏予防や処理過程で失われる栄養素を戻すために食品に栄養素を加えることを強化という。FDAはもともと、このレベルの強化で1日あたり平均100μgの摂取増加になるであろうと推定していた(26)。しかし、観察研究に基づく、さらなる評価で、摂取量はFDAの予想した量の2倍に増加していることが示唆されている(35)。血清および赤血球中の低葉酸塩濃度の人達の米国総人口に対する割合は、葉酸強化以前にはそれぞれ24%と3.5%であったが、現在では1%以下である (158)。 | ||
サプリメント
サプリメントの葉酸塩の主要形態は葉酸である。単一成分としても、ビタミンB複合体サプリメントやマルチビタミンのような他の成分との組み合わせとしても入手可能である。1mg以上の用量は処方箋が必要である(159)。さらに、テトラヒドロ葉酸誘導体であるフォリン酸は特定の代謝性疾患の治療に使用される(「疾病治療」の項参照)。また、米国FDAは経口避妊薬に葉酸塩を入れることを承認している。レボメフォラート・カルシウム(levomefolate calciumはMeTHFのカルシウム塩。451μg/錠)を経口避妊薬に添加するのは、妊娠可能年齢の女性の葉酸塩の状態を向上させる意図がある(160)。全米調査によると、15~44歳の妊娠していない女性の24%しか400μg/日という現在の葉酸推奨量を満たしていない(161)。
安全性
毒性
食品から葉酸塩を過剰摂取しても、関連する悪影響はない。安全性に関する懸念は、合成された葉酸の摂取についてのみである。しばしば診断されないこともあるが、ビタミンB12の欠乏はかなり多くの人、特に年配の成人(「ビタミンB12」の項の記事参照)に影響しているのかもしれない。ビタミンB12欠乏症の一つの症状は巨赤芽球性貧血で、葉酸塩欠乏症によるものと区別がつかない(「欠乏症」の項参照)。ビタミンB12欠乏と診断されていない人が高用量の葉酸を使用すると、隠れているビタミンB12欠乏を治すことなく巨赤芽球性貧血を治すことになり、不可逆的な神経性損傷を起こしてしまうリスクにさらされることになる。ビタミンB12欠乏症における神経性疾患の進行のそのようなケースは、大部分が5,000μg(5mg)以上の用量の葉酸で見られる。ビタミンB12欠乏症の人達の不可逆的神経性損傷を確実に予防するため、米国医学研究所の食品栄養委員会は、すべての成人は(サプリメントおよび強化食品からの)葉酸摂取を毎日1,000μg(1mg)に限るようにアドバイスしている(表3)。委員会はまた、ビタミンB12欠乏症は妊娠可能年齢の女性には非常にまれであるので、1,000μg/日以上の葉酸を摂取しても問題はないであろうとしている(1)。しかしながら、大量投与の効果に関するデータは限られている。
| 年齢層 | UL (μg/日) |
|---|---|
| 乳児 0~12ヶ月 | 確定不能* |
| 幼児 1~3歳 | 300 |
| 子供 4~8歳 | 400 |
| 子供 9~13歳 | 600 |
| 青少年 14~18歳 | 800 |
| 成人 19歳以上 | 1,000 |
| *摂取は食品および調整粉乳からのみ | |
葉酸の経口補給によるDHFR代謝能力の飽和は、血中における未代謝葉酸の出現と関連があるとされている(162)。血液学的な異常や認知機能が低下することは、年配(60歳以上)のビタミンB12欠乏症の成人における未代謝葉酸の存在と関連がある(163,164)。閉経後の女性による小規模な研究で、未代謝の葉酸が免疫機能におよぼす影響について懸念が提示されている(165)。マルチビタミンのサプリメントを30週間毎日摂取した生殖可能年齢の38人の女性による小規模な無作為化オープンラベル試験(無作為化非盲検試験)では、1日に1.1mgまたは5mgの葉酸補給によって、最初の12週間に血中に未代謝の葉酸が過渡的に現れた(166)。しかし、研究の終了時には未代謝の葉酸塩濃度は研究開始時の濃度にまで戻ったため、適応機構によって最終的には葉酸が葉酸塩の還元された形態に変換されたことを示唆している。それにもかかわらず、レボメフォラート(5MeTHF)をサプリメントとして使用することは、年配の成人において未変換の葉酸のネガティブな作用の可能性を予防する選択肢となるかもしれない。
薬物相互作用
アスピリンまたはイブプロフェンのような非ステロイド系抗炎症剤(NSAID)を非常に高い治療薬量(すなわち重篤な関節炎治療用)で服用した場合、それが葉酸塩の代謝を阻害する可能性がある。対照的に、NSAIDの日常的な使用が葉酸塩の状態に悪影響を及ぼすということはわかっていない。抗けいれん薬のフェニトインは葉酸塩の腸での吸収を抑制することが示されており、フェニトイン、フェノバルビタール、およびプリミドンといった抗けいれん薬の長期使用が葉酸塩の状態を低下させると関連づけた研究もいくつかある(167)。しかしながら、抗けいれん薬の使用者と非使用者との間で、食事性葉酸塩摂取の差を考慮した研究はほとんどない。また、コレスチラミンやコレスチポールというコレステロール低下薬といっしょに葉酸を摂取すると、葉酸塩の吸収を減らす可能性がある(159)。メトトレキサートは、がん、リューマチ性関節炎、および乾癬を含む多くの疾患の治療に使われる葉酸拮抗薬である。メトトレキサートの副作用は重篤な葉酸塩欠乏症の副作用と似ており、葉酸またはフォリン酸といっしょに服用して葉酸拮抗薬の毒性を減らすのに使用される。がんの治療に現在使われるその他の葉酸拮抗薬(の分子)は、アミノプテリン、ペメトレキセド、プララトレキサート、およびラルチトレキセドを含む(96)。さらに、多くの他の薬物が葉酸拮抗薬活性を持つことが示されており、トリメトプリム(抗生物質)、ピリメタミン(抗マラリア薬)、トリアムテレン(血圧の薬)、およびスルファサラジン(潰瘍性大腸炎の治療薬)などが挙げられる。高用量のエストロゲンを含む初期の経口避妊薬の研究で、葉酸塩の状態への悪影響が示されたが、この発見は低容量経口避妊薬を使用し、かつ食事からの葉酸塩を管理した最近の研究では支持されていない(168)。
ライナス・ポーリング研究所の推奨
利用可能な科学的エビデンスは、適切な葉酸塩摂取が神経管欠損やその他の不具合な妊娠結果を予防し、ある種のがん、特に遺伝的にそれにかかりやすい人達のがんのリスク低減に役立ち、そして、心血管疾患のリスクまで下げる可能性があることを示している。ライナス・ポーリング研究所は、一日摂取量(Daily Value=DV)である400μgの葉酸を含むマルチビタミン/マルチミネラルサプリメントを成人が毎日摂取することを推奨する。強化食品から平均より多い葉酸を摂取したとしても、各個人の毎日の葉酸摂取が米国医学研究所によって設定された許容上限摂取量である1,000μg/日をいつも超えるということはないであろう(「安全性」の項参照)。
年配の成人(51歳以上)
葉酸塩の豊富な食事に加えて、マルチビタミン/マルチミネラルサプリメントの成分として400μg/日の葉酸を毎日摂取することを推奨することは、血中ホモシステイン濃度が年齢とともに増加しやすい年配の成人には特に重要である(「疾病予防」の項参照)。
Authors and Reviewers
Originally written in 2000 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in April 2002 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in September 2007 by:
Victoria J. Drake, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in June 2014 by:
Barbara Delage, Ph.D.
Linus Pauling Institute
Oregon State University
Reviewed in December 2014 by:
Helene McNulty, Ph.D., R.D.
Professor of Human Nutrition and Dietetics
Northern Ireland Centre for Food and Health (NICHE)
University of Ulster
Coleraine, United Kingdom
The 2014 update of this article was underwritten, in part, by a grant from Bayer Consumer Care AG, Basel, Switzerland.
Copyright 2000-2024 Linus Pauling Institute
References
1. Food and Nutrition Board, Institute of Medicine. Folate. Dietary Reference Intakes: Thiamin, Riboflavin, Niacin, Vitamin B6, Folate, Vitamin B12, Pantothenic Acid, Biotin, and Choline. Washington, D.C.: National Academy Press; 1998:196-305. (National Academy Press)
2. Choi SW, Mason JB. Folate and carcinogenesis: an integrated scheme. J Nutr. 2000;130(2):129-132. (PubMed)
3. Bailey LB, Gregory JF, 3rd. Folate metabolism and requirements. J Nutr. 1999;129(4):779-782. (PubMed)
4. Gerhard GT, Duell PB. Homocysteine and atherosclerosis. Curr Opin Lipidol. 1999;10(5):417-428. (PubMed)
5. Jacques PF, Bostom AG, Wilson PW, Rich S, Rosenberg IH, Selhub J. Determinants of plasma total homocysteine concentration in the Framingham Offspring cohort. Am J Clin Nutr. 2001;73(3):613-621. (PubMed)
6. Jacques PF, Kalmbach R, Bagley PJ, et al. The relationship between riboflavin and plasma total homocysteine in the Framingham Offspring cohort is influenced by folate status and the C677T transition in the methylenetetrahydrofolate reductase gene. J Nutr. 2002;132(2):283-288. (PubMed)
7. McNulty H, Dowey le RC, Strain JJ, et al. Riboflavin lowers homocysteine in individuals homozygous for the MTHFR 677C->T polymorphism. Circulation. 2006;113(1):74-80. (PubMed)
8. Verlinde PH, Oey I, Hendrickx ME, Van Loey AM, Temme EH. L-ascorbic acid improves the serum folate response to an oral dose of [6S]-5-methyltetrahydrofolic acid in healthy men. Eur J Clin Nutr. 2008;62(10):1224-1230. (PubMed)
9. Lucock M, Yates Z, Boyd L, et al. Vitamin C-related nutrient-nutrient and nutrient-gene interactions that modify folate status. Eur J Nutr. 2013;52(2):569-582. (PubMed)
10. Desmoulin SK, Hou Z, Gangjee A, Matherly LH. The human proton-coupled folate transporter: Biology and therapeutic applications to cancer. Cancer Biol Ther. 2012;13(14):1355-1373. (PubMed)
11. Solanky N, Requena Jimenez A, D'Souza SW, Sibley CP, Glazier JD. Expression of folate transporters in human placenta and implications for homocysteine metabolism. Placenta. 2010;31(2):134-143. (PubMed)
12. Halsted CH, Villanueva JA, Devlin AM, Chandler CJ. Metabolic interactions of alcohol and folate. J Nutr. 2002;132(8 Suppl):2367S-2372S. (PubMed)
13. Pfeiffer CM, Sternberg MR, Schleicher RL, Rybak ME. Dietary supplement use and smoking are important correlates of biomarkers of water-soluble vitamin status after adjusting for sociodemographic and lifestyle variables in a representative sample of US adults. J Nutr. 2013;143(6):957S-965S. (PubMed)
14. Stark KD, Pawlosky RJ, Sokol RJ, Hannigan JH, Salem N, Jr. Maternal smoking is associated with decreased 5-methyltetrahydrofolate in cord plasma. Am J Clin Nutr. 2007;85(3):796-802. (PubMed)
15. Hutson JR, Stade B, Lehotay DC, Collier CP, Kapur BM. Folic acid transport to the human fetus is decreased in pregnancies with chronic alcohol exposure. PLoS One. 2012;7(5):e38057. (PubMed)
16. Herbert V. Folic acid. In: Shils M, Olson JA, Shike M, Ross AC, eds. Modern Nutrition in Health and Disease. 9th ed. Baltimore: Lippincott Williams & Wilkins; 1999:433-446.
17. Stabler SP. Clinical folate deficiency. In: Bailey LB, ed. Folate in Health and Disease. 2nd edition ed. Boca Raton, FL: CRC press, Taylor & Francis Group; 2010:409-428.
18. Bailey LB. Dietary reference intakes for folate: the debut of dietary folate equivalents. Nutr Rev. 1998;56(10):294-299. (PubMed)
19. Bailey LB, Gregory JF, 3rd. Polymorphisms of methylenetetrahydrofolate reductase and other enzymes: metabolic significance, risks and impact on folate requirement. J Nutr. 1999;129(5):919-922. (PubMed)
20. Wilcken B, Bamforth F, Li Z, et al. Geographical and ethnic variation of the 677C>T allele of 5,10 methylenetetrahydrofolate reductase (MTHFR): findings from over 7000 newborns from 16 areas world wide. J Med Genet. 2003;40(8):619-625. (PubMed)
21. Guenther BD, Sheppard CA, Tran P, Rozen R, Matthews RG, Ludwig ML. The structure and properties of methylenetetrahydrofolate reductase from Escherichia coli suggest how folate ameliorates human hyperhomocysteinemia. Nat Struct Biol. 1999;6(4):359-365. (PubMed)
22. Molloy AM, Daly S, Mills JL, et al. Thermolabile variant of 5,10-methylenetetrahydrofolate reductase associated with low red-cell folates: implications for folate intake recommendations. Lancet. 1997;349(9065):1591-1593. (PubMed)
23. Rozen R. Genetic predisposition to hyperhomocysteinemia: deficiency of methylenetetrahydrofolate reductase (MTHFR). Thromb Haemost. 1997;78(1):523-526. (PubMed)
24. Kauwell GP, Wilsky CE, Cerda JJ, et al. Methylenetetrahydrofolate reductase mutation (677C-->T) negatively influences plasma homocysteine response to marginal folate intake in elderly women. Metabolism. 2000;49(11):1440-1443. (PubMed)
25. Shane B. Folic acid, vitamin B-12, and vitamin B-6. In: Stipanuk M, ed. Biochemical and Physiological Aspects of Human Nutrition. Philadelphia: W.B. Saunders Co.; 2000:483-518.
26. Eskes TK. Open or closed? A world of difference: a history of homocysteine research. Nutr Rev. 1998;56(8):236-244. (PubMed)
27. Czeizel AE, Dudas I, Vereczkey A, Banhidy F. Folate deficiency and folic acid supplementation: the prevention of neural-tube defects and congenital heart defects. Nutrients. 2013;5(11):4760-4775. (PubMed)
28. MRC Vitamin Study Research Group. Prevention of neural tube defects: results of the Medical Research Council Vitamin Study. Lancet. 1991;338(8760):131-137. (PubMed)
29. Czeizel AE, Dudas I. Prevention of the first occurrence of neural-tube defects by periconceptional vitamin supplementation. N Engl J Med. 1992;327(26):1832-1835. (PubMed)
30. Talaulikar VS, Arulkumaran S. Folic acid in obstetric practice: a review. Obstet Gynecol Surv. 2011;66(4):240-247. (PubMed)
31. American College of Obstetricians and Gynecologists (ACOG). Neural tube defects. Washington, DC. 2003. Available at: http://www.guideline.gov/content.aspx?id=3994. Accessed 12/19/14.
32. McNulty B, Pentieva K, Marshall B, et al. Women's compliance with current folic acid recommendations and achievement of optimal vitamin status for preventing neural tube defects. Hum Reprod. 2011;26(6):1530-1536. (PubMed)
33. Nilsen RM, Vollset SE, Gjessing HK, et al. Patterns and predictors of folic acid supplement use among pregnant women: the Norwegian Mother and Child Cohort Study. Am J Clin Nutr. 2006;84(5):1134-1141. (PubMed)
34. Ray JG, Singh G, Burrows RF. Evidence for suboptimal use of periconceptional folic acid supplements globally. BJOG. 2004;111(5):399-408. (PubMed)
35. Quinlivan EP, Gregory JF, 3rd. Effect of food fortification on folic acid intake in the United States. Am J Clin Nutr. 2003;77(1):221-225. (PubMed)
36. National Birth Defects Prevention Network. Neural Tube Defect Ascertainment Project. Available at: http://www.nbdpn.org/ntd_folic_acid_information.php. Accessed 12/16/14.
37. Copp AJ, Stanier P, Greene ND. Neural tube defects: recent advances, unsolved questions, and controversies. Lancet Neurol. 2013;12(8):799-810. (PubMed)
38. Yan L, Zhao L, Long Y, et al. Association of the maternal MTHFR C677T polymorphism with susceptibility to neural tube defects in offsprings: evidence from 25 case-control studies. PLoS One. 2012;7(10):e41689. (PubMed)
39. De Marco P, Calevo MG, Moroni A, et al. Study of MTHFR and MS polymorphisms as risk factors for NTD in the Italian population. J Hum Genet. 2002;47(6):319-324. (PubMed)
40. van der Put NM, Gabreels F, Stevens EM, et al. A second common mutation in the methylenetetrahydrofolate reductase gene: an additional risk factor for neural-tube defects? Am J Hum Genet. 1998;62(5):1044-1051. (PubMed)
41. De Marco P, Calevo MG, Moroni A, et al. Reduced folate carrier polymorphism (80A-->G) and neural tube defects. Eur J Hum Genet. 2003;11(3):245-252. (PubMed)
42. O'Leary VB, Mills JL, Parle-McDermott A, et al. Screening for new MTHFR polymorphisms and NTD risk. Am J Med Genet A. 2005;138A(2):99-106. (PubMed)
43. Christensen B, Arbour L, Tran P, et al. Genetic polymorphisms in methylenetetrahydrofolate reductase and methionine synthase, folate levels in red blood cells, and risk of neural tube defects. Am J Med Genet. 1999;84(2):151-157. (PubMed)
44. Relton CL, Wilding CS, Pearce MS, et al. Gene-gene interaction in folate-related genes and risk of neural tube defects in a UK population. J Med Genet. 2004;41(4):256-260. (PubMed)
45. Brody LC, Conley M, Cox C, et al. A polymorphism, R653Q, in the trifunctional enzyme methylenetetrahydrofolate dehydrogenase/methenyltetrahydrofolate cyclohydrolase/formyltetrahydrofolate synthetase is a maternal genetic risk factor for neural tube defects: report of the Birth Defects Research Group. Am J Hum Genet. 2002;71(5):1207-1215. (PubMed)
46. van der Put NM, van den Heuvel LP, Steegers-Theunissen RP, et al. Decreased methylene tetrahydrofolate reductase activity due to the 677C-->T mutation in families with spina bifida offspring. J Mol Med (Berl). 1996;74(11):691-694. (PubMed)
47. Wilson A, Platt R, Wu Q, et al. A common variant in methionine synthase reductase combined with low cobalamin (vitamin B12) increases risk for spina bifida. Mol Genet Metab. 1999;67(4):317-323. (PubMed)
48. Gilboa SM, Salemi JL, Nembhard WN, Fixler DE, Correa A. Mortality resulting from congenital heart disease among children and adults in the United States, 1999 to 2006. Circulation. 2010;122(22):2254-2263. (PubMed)
49. van Beynum IM, Kapusta L, Bakker MK, den Heijer M, Blom HJ, de Walle HE. Protective effect of periconceptional folic acid supplements on the risk of congenital heart defects: a registry-based case-control study in the northern Netherlands. Eur Heart J. 2010;31(4):464-471. (PubMed)
50. Yin M, Dong L, Zheng J, Zhang H, Liu J, Xu Z. Meta analysis of the association between MTHFR C677T polymorphism and the risk of congenital heart defects. Ann Hum Genet. 2012;76(1):9-16. (PubMed)
51. Wang W, Wang Y, Gong F, Zhu W, Fu S. MTHFR C677T polymorphism and risk of congenital heart defects: evidence from 29 case-control and TDT studies. PLoS One. 2013;8(3):e58041. (PubMed)
52. Badovinac RL, Werler MM, Williams PL, Kelsey KT, Hayes C. Folic acid-containing supplement consumption during pregnancy and risk for oral clefts: a meta-analysis. Birth Defects Res A Clin Mol Teratol. 2007;79(1):8-15. (PubMed)
53. Wilcox AJ, Lie RT, Solvoll K, et al. Folic acid supplements and risk of facial clefts: national population based case-control study. BMJ. 2007;334(7591):464. (PubMed)
54. Boyles AL, Wilcox AJ, Taylor JA, et al. Folate and one-carbon metabolism gene polymorphisms and their associations with oral facial clefts. Am J Med Genet A. 2008;146A(4):440-449. (PubMed)
55. Boyles AL, Wilcox AJ, Taylor JA, et al. Oral facial clefts and gene polymorphisms in metabolism of folate/one-carbon and vitamin A: a pathway-wide association study. Genet Epidemiol. 2009;33(3):247-255. (PubMed)
56. Luo YL, Cheng YL, Ye P, Wang W, Gao XH, Chen Q. Association between MTHFR polymorphisms and orofacial clefts risk: a meta-analysis. Birth Defects Res A Clin Mol Teratol. 2012;94(4):237-244. (PubMed)
57. Wilcox AJ. On the importance--and the unimportance--of birthweight. Int J Epidemiol. 2001;30(6):1233-1241. (PubMed)
58. Fekete K, Berti C, Trovato M, et al. Effect of folate intake on health outcomes in pregnancy: a systematic review and meta-analysis on birth weight, placental weight and length of gestation. Nutr J. 2012;11:75. (PubMed)
59. Baker PN, Wheeler SJ, Sanders TA, et al. A prospective study of micronutrient status in adolescent pregnancy. Am J Clin Nutr. 2009;89(4):1114-1124. (PubMed)
60. Lee HA, Park EA, Cho SJ, et al. Mendelian randomization analysis of the effect of maternal homocysteine during pregnancy, as represented by maternal MTHFR C677T genotype, on birth weight. J Epidemiol. 2013;23(5):371-375. (PubMed)
61. Scholl TO, Johnson WG. Folic acid: influence on the outcome of pregnancy. Am J Clin Nutr. 2000;71(5 Suppl):1295S-1303S. (PubMed)
62. Vollset SE, Refsum H, Irgens LM, et al. Plasma total homocysteine, pregnancy complications, and adverse pregnancy outcomes: the Hordaland Homocysteine study. Am J Clin Nutr. 2000;71(4):962-968. (PubMed)
63. Wang XM, Wu HY, Qiu XJ. Methylenetetrahydrofolate reductase (MTHFR) gene C677T polymorphism and risk of preeclampsia: an updated meta-analysis based on 51 studies. Arch Med Res. 2013;44(3):159-168. (PubMed)
64. Wen SW, Champagne J, Rennicks White R, et al. Effect of folic acid supplementation in pregnancy on preeclampsia: the folic acid clinical trial study. J Pregnancy. 2013;2013:294312. (PubMed)
65. Lassi ZS, Salam RA, Haider BA, Bhutta ZA. Folic acid supplementation during pregnancy for maternal health and pregnancy outcomes. Cochrane Database Syst Rev. 2013;3:CD006896. (PubMed)
66. Schmidt RJ, Tancredi DJ, Ozonoff S, et al. Maternal periconceptional folic acid intake and risk of autism spectrum disorders and developmental delay in the CHARGE (CHildhood Autism Risks from Genetics and Environment) case-control study. Am J Clin Nutr. 2012;96(1):80-89. (PubMed)
67. Crider KS, Cordero AM, Qi YP, Mulinare J, Dowling NF, Berry RJ. Prenatal folic acid and risk of asthma in children: a systematic review and meta-analysis. Am J Clin Nutr. 2013;98(5):1272-1281. (PubMed)
68. Brown SB, Reeves KW, Bertone-Johnson ER. Maternal folate exposure in pregnancy and childhood asthma and allergy: a systematic review. Nutr Rev. 2014;72(1):55-64. (PubMed)
69. Ding R, Lin S, Chen D. The association of cystathionine β synthase (CBS) T833C polymorphism and the risk of stroke: a meta-analysis. J Neurol Sci. 2012;312(1-2):26-30. (PubMed)
70. Seshadri N, Robinson K. Homocysteine, B vitamins, and coronary artery disease. Med Clin North Am. 2000;84(1):215-237. (PubMed)
71. Wald DS, Law M, Morris JK. Homocysteine and cardiovascular disease: evidence on causality from a meta-analysis. BMJ. 2002;325(7374):1202. (PubMed)
72. Homocysteine Studies Collaboration. Homocysteine and risk of ischemic heart disease and stroke: a meta-analysis. JAMA. 2002;288(16):2015-2022. (PubMed)
73. Clarke R, Halsey J, Bennett D, Lewington S. Homocysteine and vascular disease: review of published results of the homocysteine-lowering trials. J Inherit Metab Dis. 2011;34(1):83-91. (PubMed)
74. Huang T, Chen Y, Yang B, Yang J, Wahlqvist ML, Li D. Meta-analysis of B vitamin supplementation on plasma homocysteine, cardiovascular and all-cause mortality. Clin Nutr. 2012;31(4):448-454. (PubMed)
75. Voutilainen S, Rissanen TH, Virtanen J, Lakka TA, Salonen JT. Low dietary folate intake is associated with an excess incidence of acute coronary events: The Kuopio Ischemic Heart Disease Risk Factor Study. Circulation. 2001;103(22):2674-2680. (PubMed)
76. Brattstrom L. Vitamins as homocysteine-lowering agents. J Nutr. 1996;126(4 Suppl):1276S-1280S. (PubMed)
77. Rader JI. Folic acid fortification, folate status and plasma homocysteine. J Nutr. 2002;132(8 Suppl):2466S-2470S. (PubMed)
78. Homocysteine Lowering Trialists' Collaboration. Dose-dependent effects of folic acid on blood concentrations of homocysteine: a meta-analysis of the randomized trials. Am J Clin Nutr. 2005;82(4):806-812. (PubMed)
79. Malinow MR, Bostom AG, Krauss RM. Homocyst(e)ine, diet, and cardiovascular diseases: a statement for healthcare professionals from the Nutrition Committee, American Heart Association. Circulation. 1999;99(1):178-182. (PubMed)
80. van Meurs JB, Pare G, Schwartz SM, et al. Common genetic loci influencing plasma homocysteine concentrations and their effect on risk of coronary artery disease. Am J Clin Nutr. 2013;98(3):668-676. (PubMed)
81. Holmes MV, Newcombe P, Hubacek JA, et al. Effect modification by population dietary folate on the association between MTHFR genotype, homocysteine, and stroke risk: a meta-analysis of genetic studies and randomised trials. Lancet. 2011;378(9791):584-594. (PubMed)
82. Clarke R, Bennett DA, Parish S, et al. Homocysteine and coronary heart disease: meta-analysis of MTHFR case-control studies, avoiding publication bias. PLoS Med. 2012;9(2):e1001177. (PubMed)
83. Ji Y, Tan S, Xu Y, et al. Vitamin B supplementation, homocysteine levels, and the risk of cerebrovascular disease: A meta-analysis. Neurology. 2013;81(15):1298-1307. (PubMed)
84. Zhang C, Chi FL, Xie TH, Zhou YH. Effect of B-vitamin supplementation on stroke: a meta-analysis of randomized controlled trials. PLoS One. 2013;8(11):e81577. (PubMed)
85. Mosca L, Benjamin EJ, Berra K, et al. Effectiveness-based guidelines for the prevention of cardiovascular disease in women--2011 update: a guideline from the American Heart Association. J Am Coll Cardiol. 2011;57(12):1404-1423. (PubMed)
86. Wang X, Qin X, Demirtas H, et al. Efficacy of folic acid supplementation in stroke prevention: a meta-analysis. Lancet. 2007;369(9576):1876-1882. (PubMed)
87. Yang Q, Botto LD, Erickson JD, et al. Improvement in stroke mortality in Canada and the United States, 1990 to 2002. Circulation. 2006;113(10):1335-1343. (PubMed)
88. Lorenz MW, Markus HS, Bots ML, Rosvall M, Sitzer M. Prediction of clinical cardiovascular events with carotid intima-media thickness: a systematic review and meta-analysis. Circulation. 2007;115(4):459-467. (PubMed)
89. Qin X, Xu M, Zhang Y, et al. Effect of folic acid supplementation on the progression of carotid intima-media thickness: a meta-analysis of randomized controlled trials. Atherosclerosis. 2012;222(2):307-313. (PubMed)
90. de Bree A, van Mierlo LA, Draijer R. Folic acid improves vascular reactivity in humans: a meta-analysis of randomized controlled trials. Am J Clin Nutr. 2007;86(3):610-617. (PubMed)
91. McNeil CJ, Beattie JH, Gordon MJ, Pirie LP, Duthie SJ. Nutritional B vitamin deficiency disrupts lipid metabolism causing accumulation of proatherogenic lipoproteins in the aorta adventitia of ApoE null mice. Mol Nutr Food Res. 2012;56(7):1122-1130. (PubMed)
92. Blount BC, Mack MM, Wehr CM, et al. Folate deficiency causes uracil misincorporation into human DNA and chromosome breakage: implications for cancer and neuronal damage. Proc Natl Acad Sci U S A. 1997;94(7):3290-3295. (PubMed)
93. Narayanan S, McConnell J, Little J, et al. Associations between two common variants C677T and A1298C in the methylenetetrahydrofolate reductase gene and measures of folate metabolism and DNA stability (strand breaks, misincorporated uracil, and DNA methylation status) in human lymphocytes in vivo. Cancer Epidemiol Biomarkers Prev. 2004;13(9):1436-1443. (PubMed)
94. Rahman L, Voeller D, Rahman M, et al. Thymidylate synthase as an oncogene: a novel role for an essential DNA synthesis enzyme. Cancer Cell. 2004;5(4):341-351. (PubMed)
95. Hubner RA, Liu JF, Sellick GS, Logan RF, Houlston RS, Muir KR. Thymidylate synthase polymorphisms, folate and B-vitamin intake, and risk of colorectal adenoma. Br J Cancer. 2007;97(10):1449-1456. (PubMed)
96. Desmoulin SK, Wang L, Polin L, et al. Functional loss of the reduced folate carrier enhances the antitumor activities of novel antifolates with selective uptake by the proton-coupled folate transporter. Mol Pharmacol. 2012;82(4):591-600. (PubMed)
97. Crider KS, Yang TP, Berry RJ, Bailey LB. Folate and DNA methylation: a review of molecular mechanisms and the evidence for folate's role. Adv Nutr. 2012;3(1):21-38. (PubMed)
98. Butrum RR, Clifford CK, Lanza E. NCI dietary guidelines: rationale. Am J Clin Nutr. 1988;48(3 Suppl):888-895. (PubMed)
99. Crider KS, Bailey LB, Berry RJ. Folic acid food fortification-its history, effect, concerns, and future directions. Nutrients. 2011;3(3):370-384. (PubMed)
100. Qin X, Cui Y, Shen L, et al. Folic acid supplementation and cancer risk: A meta-analysis of randomized controlled trials. Int J Cancer. 2013;133(5):1033-1041. (PubMed)
101. Vollset SE, Clarke R, Lewington S, et al. Effects of folic acid supplementation on overall and site-specific cancer incidence during the randomised trials: meta-analyses of data on 50,000 individuals. Lancet. 2013;381(9871):1029-1036. (PubMed)
102. Kim DH, Smith-Warner SA, Spiegelman D, et al. Pooled analyses of 13 prospective cohort studies on folate intake and colon cancer. Cancer Causes Control. 2010;21(11):1919-1930. (PubMed)
103. Gibson TM, Weinstein SJ, Pfeiffer RM, et al. Pre- and postfortification intake of folate and risk of colorectal cancer in a large prospective cohort study in the United States. Am J Clin Nutr. 2011;94(4):1053-1062. (PubMed)
104. Stevens VL, McCullough ML, Sun J, Jacobs EJ, Campbell PT, Gapstur SM. High levels of folate from supplements and fortification are not associated with increased risk of colorectal cancer. Gastroenterology. 2011;141(1):98-105, 105 e101. (PubMed)
105. Zschabitz S, Cheng TY, Neuhouser ML, et al. B vitamin intakes and incidence of colorectal cancer: results from the Women's Health Initiative Observational Study cohort. Am J Clin Nutr. 2013;97(2):332-343. (PubMed)
106. Keum N, Giovannucci EL. Folic acid fortification and colorectal cancer risk. Am J Prev Med. 2014;46(3 Suppl 1):S65-72. (PubMed)
107. Kennedy DA, Stern SJ, Moretti M, et al. Folate intake and the risk of colorectal cancer: a systematic review and meta-analysis. Cancer Epidemiol. 2011;35(1):2-10. (PubMed)
108. Kim YI. Folate: a magic bullet or a double edged sword for colorectal cancer prevention? Gut. 2006;55(10):1387-1389. (PubMed)
109. Paspatis GA, Kalafatis E, Oros L, Xourgias V, Koutsioumpa P, Karamanolis DG. Folate status and adenomatous colonic polyps. A colonoscopically controlled study. Dis Colon Rectum. 1995;38(1):64-67; discussion 67-68. (PubMed)
110. Jaszewski R, Misra S, Tobi M, et al. Folic acid supplementation inhibits recurrence of colorectal adenomas: a randomized chemoprevention trial. World J Gastroenterol. 2008;14(28):4492-4498. (PubMed)
111. Wu K, Platz EA, Willett WC, et al. A randomized trial on folic acid supplementation and risk of recurrent colorectal adenoma. Am J Clin Nutr. 2009;90(6):1623-1631. (PubMed)
112. Logan RF, Grainge MJ, Shepherd VC, Armitage NC, Muir KR. Aspirin and folic acid for the prevention of recurrent colorectal adenomas. Gastroenterology. 2008;134(1):29-38. (PubMed)
113. Figueiredo JC, Mott LA, Giovannucci E, et al. Folic acid and prevention of colorectal adenomas: a combined analysis of randomized clinical trials. Int J Cancer. 2011;129(1):192-203. (PubMed)
114. Kennedy DA, Stern SJ, Matok I, et al. Folate intake, MTHFR polymorphisms, and the risk of colorectal cancer: a systematic review and meta-analysis. J Cancer Epidemiol. 2012;2012:952508. (PubMed)
115. Ding W, Zhou DL, Jiang X, Lu LS. Methionine synthase A2756G polymorphism and risk of colorectal adenoma and cancer: evidence based on 27 studies. PLoS One. 2013;8(4):e60508. (PubMed)
116. Nan H, Lee JE, Rimm EB, Fuchs CS, Giovannucci EL, Cho E. Prospective study of alcohol consumption and the risk of colorectal cancer before and after folic acid fortification in the United States. Ann Epidemiol. 2013;23(9):558-563. (PubMed)
117. Slattery ML, Potter JD, Samowitz W, Schaffer D, Leppert M. Methylenetetrahydrofolate reductase, diet, and risk of colon cancer. Cancer Epidemiol Biomarkers Prev. 1999;8(6):513-518. (PubMed)
118. Ma J, Stampfer MJ, Giovannucci E, et al. Methylenetetrahydrofolate reductase polymorphism, dietary interactions, and risk of colorectal cancer. Cancer Res. 1997;57(6):1098-1102. (PubMed)
119. Larsson SC, Giovannucci E, Wolk A. Folate and risk of breast cancer: a meta-analysis. J Natl Cancer Inst. 2007;99(1):64-76. (PubMed)
120. Liu M, Cui LH, Ma AG, Li N, Piao JM. Lack of effects of dietary folate intake on risk of breast cancer: an updated meta-analysis of prospective studies. Asian Pac J Cancer Prev. 2014;15(5):2323-2328. (PubMed)
121. Brooks PJ, Zakhari S. Moderate alcohol consumption and breast cancer in women: from epidemiology to mechanisms and interventions. Alcohol Clin Exp Res. 2013;37(1):23-30. (PubMed)
122. Rohan TE, Jain MG, Howe GR, Miller AB. Dietary folate consumption and breast cancer risk. J Natl Cancer Inst. 2000;92(3):266-269. (PubMed)
123. Sellers TA, Kushi LH, Cerhan JR, et al. Dietary folate intake, alcohol, and risk of breast cancer in a prospective study of postmenopausal women. Epidemiology. 2001;12(4):420-428. (PubMed)
124. Zhang S, Hunter DJ, Hankinson SE, et al. A prospective study of folate intake and the risk of breast cancer. JAMA. 1999;281(17):1632-1637. (PubMed)
125. Tjonneland A, Christensen J, Olsen A, et al. Alcohol intake and breast cancer risk: the European Prospective Investigation into Cancer and Nutrition (EPIC). Cancer Causes Control. 2007;18(4):361-373. (PubMed)
126. Bassett JK, Baglietto L, Hodge AM, et al. Dietary intake of B vitamins and methionine and breast cancer risk. Cancer Causes Control. 2013;24(8):1555-1563. (PubMed)
127. Wang J, Wang B, Bi J, Di J. The association between two polymorphisms in the TYMS gene and breast cancer risk: a meta-analysis. Breast Cancer Res Treat. 2011;128(1):203-209. (PubMed)
128. Weiner AS, Boyarskikh UA, Voronina EN, et al. Polymorphisms in the folate-metabolizing genes MTR, MTRR, and CBS and breast cancer risk. Cancer Epidemiol. 2012;36(2):e95-e100. (PubMed)
129. Linabery AM, Johnson KJ, Ross JA. Childhood cancer incidence trends in association with US folic acid fortification (1986-2008). Pediatrics. 2012;129(6):1125-1133. (PubMed)
130. Milne E, Royle JA, Miller M, et al. Maternal folate and other vitamin supplementation during pregnancy and risk of acute lymphoblastic leukemia in the offspring. Int J Cancer. 2010;126(11):2690-2699. (PubMed)
131. Yan J, Yin M, Dreyer ZE, et al. A meta-analysis of MTHFR C677T and A1298C polymorphisms and risk of acute lymphoblastic leukemia in children. Pediatr Blood Cancer. 2012;58(4):513-518. (PubMed)
132. Alzheimer's Association. 2013 Alzheimer's Disease Fact and Figures. Alzheimer's & Dementia. 9(2). http://www.alz.org/downloads/facts_figures_2013.pdf. Accessed 9/9/13.
133. Hughes TF, Andel R, Small BJ, et al. Midlife fruit and vegetable consumption and risk of dementia in later life in Swedish twins. Am J Geriatr Psychiatry. 2010;18(5):413-420. (PubMed)
134. Weir DG, Scott JM. Brain function in the elderly: role of vitamin B12 and folate. Br Med Bull. 1999;55(3):669-682. (PubMed)
135. Faux NG, Ellis KA, Porter L, et al. Homocysteine, vitamin B12, and folic acid levels in Alzheimer's disease, mild cognitive impairment, and healthy elderly: baseline characteristics in subjects of the Australian Imaging Biomarker Lifestyle study. J Alzheimers Dis. 2011;27(4):909-922. (PubMed)
136. Van Dam F, Van Gool WA. Hyperhomocysteinemia and Alzheimer's disease: A systematic review. Arch Gerontol Geriatr. 2009;48(3):425-430. (PubMed)
137. Morris MC, Evans DA, Bienias JL, et al. Dietary folate and vitamin B12 intake and cognitive decline among community-dwelling older persons. Arch Neurol. 2005;62(4):641-645. (PubMed)
138. Morris MC, Evans DA, Schneider JA, Tangney CC, Bienias JL, Aggarwal NT. Dietary folate and vitamins B-12 and B-6 not associated with incident Alzheimer's disease. J Alzheimers Dis. 2006;9(4):435-443. (PubMed)
139. Wald DS, Kasturiratne A, Simmonds M. Serum homocysteine and dementia: meta-analysis of eight cohort studies including 8669 participants. Alzheimers Dement. 2011;7(4):412-417. (PubMed)
140. Ho RC, Cheung MW, Fu E, et al. Is high homocysteine level a risk factor for cognitive decline in elderly? A systematic review, meta-analysis, and meta-regression. Am J Geriatr Psychiatry. 2011;19(7):607-617. (PubMed)
141. Nilforooshan R, Broadbent D, Weaving G, et al. Homocysteine in Alzheimer's disease: role of dietary folate, vitamin B6 and B12. Int J Geriatr Psychiatry. 2011;26(8):876-877. (PubMed)
142. Wald DS, Kasturiratne A, Simmonds M. Effect of folic acid, with or without other B vitamins, on cognitive decline: meta-analysis of randomized trials. Am J Med. 2010;123(6):522-527 e522. (PubMed)
143. Ford AH, Almeida OP. Effect of homocysteine lowering treatment on cognitive function: a systematic review and meta-analysis of randomized controlled trials. J Alzheimers Dis. 2012;29(1):133-149. (PubMed)
144. Nachum-Biala Y, Troen AM. B-vitamins for neuroprotection: narrowing the evidence gap. Biofactors. 2012;38(2):145-150. (PubMed)
145. Smith AD, Smith SM, de Jager CA, et al. Homocysteine-lowering by B vitamins slows the rate of accelerated brain atrophy in mild cognitive impairment: a randomized controlled trial. PLoS One. 2010;5(9):e12244. (PubMed)
146. Douaud G, Refsum H, de Jager CA, et al. Preventing Alzheimer's disease-related gray matter atrophy by B-vitamin treatment. Proc Natl Acad Sci U S A. 2013;110(23):9523-9528. (PubMed)
147. Watkins D, Rosenblatt DS. Update and new concepts in vitamin responsive disorders of folate transport and metabolism. J Inherit Metab Dis. 2012;35(4):665-670. (PubMed)
148. Zhao R, Min SH, Qiu A, et al. The spectrum of mutations in the PCFT gene, coding for an intestinal folate transporter, that are the basis for hereditary folate malabsorption. Blood. 2007;110(4):1147-1152. (PubMed)
149. Borzutzky A, Crompton B, Bergmann AK, et al. Reversible severe combined immunodeficiency phenotype secondary to a mutation of the proton-coupled folate transporter. Clin Immunol. 2009;133(3):287-294. (PubMed)
150. Sofer Y, Harel L, Sharkia M, Amir J, Schoenfeld T, Straussberg R. Neurological manifestations of folate transport defect: case report and review of the literature. J Child Neurol. 2007;22(6):783-786. (PubMed)
151. Diop-Bove N, Kronn D, Goldman ID. Hereditary folate malabsorption. In: Pagon RA, Adam MP, Bird TD, Dolan CR, Fong CT, Stephens K, eds. GeneReviews™ [Internet]. Seattle, WA: University of Washington, Seattle; 2008. (PubMed)
152. Frye RE, Sequeira JM, Quadros EV, James SJ, Rossignol DA. Cerebral folate receptor autoantibodies in autism spectrum disorder. Mol Psychiatry. 2013;18(3):369-381. (PubMed)
153. Grapp M, Just IA, Linnankivi T, et al. Molecular characterization of folate receptor 1 mutations delineates cerebral folate transport deficiency. Brain. 2012;135(Pt 7):2022-2031. (PubMed)
154. Ramaekers VT, Blau N, Sequeira JM, Nassogne MC, Quadros EV. Folate receptor autoimmunity and cerebral folate deficiency in low-functioning autism with neurological deficits. Neuropediatrics. 2007;38(6):276-281. (PubMed)
155. Ramaekers VT, Hausler M, Opladen T, Heimann G, Blau N. Psychomotor retardation, spastic paraplegia, cerebellar ataxia and dyskinesia associated with low 5-methyltetrahydrofolate in cerebrospinal fluid: a novel neurometabolic condition responding to folinic acid substitution. Neuropediatrics. 2002;33(6):301-308. (PubMed)
156. Banka S, Blom HJ, Walter J, et al. Identification and characterization of an inborn error of metabolism caused by dihydrofolate reductase deficiency. Am J Hum Genet. 2011;88(2):216-225. (PubMed)
157. Cario H, Smith DE, Blom H, et al. Dihydrofolate reductase deficiency due to a homozygous DHFR mutation causes megaloblastic anemia and cerebral folate deficiency leading to severe neurologic disease. Am J Hum Genet. 2011;88(2):226-231. (PubMed)
158. Pfeiffer CM, Hughes JP, Lacher DA, et al. Estimation of trends in serum and RBC folate in the US population from pre- to postfortification using assay-adjusted data from the NHANES 1988-2010. J Nutr. 2012;142(5):886-893. (PubMed)
159. Folate. In: Hendler SS, Rorvik, D.R., ed. PDR for Nutritional Supplements. 2nd ed. Montvale: Physicians' Desk Reference Inc.; 2008.
160. Wiesinger H, Eydeler U, Richard F, et al. Bioequivalence evaluation of a folate-supplemented oral contraceptive containing ethinylestradiol/drospirenone/levomefolate calcium versus ethinylestradiol/drospirenone and levomefolate calcium alone. Clin Drug Investig. 2012;32(10):673-684. (PubMed)
161. Tinker SC, Cogswell ME, Devine O, Berry RJ. Folic acid intake among US women aged 15-44 years, National Health and Nutrition Examination Survey, 2003-2006. Am J Prev Med. 2010;38(5):534-542. (PubMed)
162. Kelly P, McPartlin J, Goggins M, Weir DG, Scott JM. Unmetabolized folic acid in serum: acute studies in subjects consuming fortified food and supplements. Am J Clin Nutr. 1997;65(6):1790-1795. (PubMed)
163. Morris MS, Jacques PF, Rosenberg IH, Selhub J. Folate and vitamin B-12 status in relation to anemia, macrocytosis, and cognitive impairment in older Americans in the age of folic acid fortification. Am J Clin Nutr. 2007;85(1):193-200. (PubMed)
164. Morris MS, Jacques PF, Rosenberg IH, Selhub J. Circulating unmetabolized folic acid and 5-methyltetrahydrofolate in relation to anemia, macrocytosis, and cognitive test performance in American seniors. Am J Clin Nutr. 2010;91(6):1733-1744. (PubMed)
165. Troen AM, Mitchell B, Sorensen B, et al. Unmetabolized folic acid in plasma is associated with reduced natural killer cell cytotoxicity among postmenopausal women. J Nutr. 2006;136(1):189-194. (PubMed)
166. Tam C, O'Connor D, Koren G. Circulating unmetabolized folic acid: relationship to folate status and effect of supplementation. Obstet Gynecol Int. 2012;2012:485179. (PubMed)
167. Apeland T, Mansoor MA, Strandjord RE. Antiepileptic drugs as independent predictors of plasma total homocysteine levels. Epilepsy Res. 2001;47(1-2):27-35. (PubMed)
168. Wilson SM, Bivins BN, Russell KA, Bailey LB. Oral contraceptive use: impact on folate, vitamin B(6), and vitamin B(1)(2) status. Nutr Rev. 2011;69(10):572-583. (PubMed)
ビタミンD
目次
要約
-
ビタミンDは日光を浴びることによって皮膚で合成可能で、肝臓と腎臓で代謝されて1α,25-ジヒドロキシビタミンDと呼ばれる代謝的に活性のある形態になる。ビタミンD受容体(VDR)と結合することで、1α,25-ジヒドロキシビタミンDは骨格やその他の生体機能に関わる数百の遺伝子の発現を調整することができる。(詳細はこちら)
-
カルシウムとリンの恒常性の調整による骨の石灰化の維持にビタミンDは不可欠である。ビタミンDは、骨格以外にも特に免疫、内分泌、および心血管系に対して多くの効果を発揮する。(詳細はこちら)
-
ビタミンDは、正常な骨の発達と維持に重要である。重篤なビタミンD欠乏症は、子供のくる病や成人の骨軟化症を引き起こす。(詳細はこちら)
-
ビタミンDの不足による二次性副甲状腺機能亢進症は、骨の分解を進めて骨粗しょう症を促進する可能性がある。無作為化臨床試験では、ビタミンDを少なくとも800 IU/日補給することによって、年配者の転倒や骨折リスクを減らせるかもしれないことが示されている。(詳細はこちら)
-
大部分の体細胞にあるビタミンD受容体と結合することによって、ビタミンDは細胞の分化と成長を調整することができる。日光にあたることが少ないことやビタミンDの栄養状態が良くないことと、結腸直腸がんや乳がんの発症リスクの上昇との間に関連があることが観察研究で報告されている。がん予防にビタミンD補給が有益であるかを評価する無作為化対照試験が必要である。(詳細はこちら)
-
様々な観察研究で、1型糖尿病、多発性硬化症、関節リウマチ、および全身性エリテマトーデスなどの自己免疫疾患のなりやすさや重篤度とビタミンDの状態との逆相関が報告されている。(詳細はこちら)
-
観察研究による現在のエビデンス(=科学的根拠)で、血液中のビタミンD濃度と2型糖尿病リスクとの逆相関が示唆されている。耐糖能障害の者のビタミンD欠乏症を治すことで2型糖尿病への進行リスクを減らすことができるかどうかはまだわかっていない。(詳細はこちら)
-
神経変性疾患を持つ被験者の認知機能低下や疾患の進行をビタミンD補給によって制限できるかどうかについて、無作為化臨床試験で現在調査中である。(詳細はこちら)
-
妊婦のビタミンD不足は、母親と新生児へのいくつかの悪影響と関連している可能性がある。妊娠中のビタミンD補給の安全性と有益性は、臨床試験で評価されねばならない。(詳細はこちら)
-
新型コロナウィルス感染症であるCOVID-19の発症率や重症度の上昇はビタミンD欠乏症と相関があることが、観察研究で報告されている。(詳細はこちら)
-
ビタミンD補給でアトピー性皮膚炎(湿疹)やクローン病の治療に改善の見込みがあるかもしれないことが、予備調査で示されている。(詳細はこちら)
ビタミンDはカルシウムの恒常性を調整し、骨の健康に不可欠な脂溶性ビタミンである(1)。食事やサプリメントでも摂取できるが、日光の紫外線B波(UVB)にさらされると、7-デヒドロコレステロールからビタミンD3(コレカルシフェロール)が皮膚内で合成される。ビタミンD2(エルゴカルシフェロール)は、植物、キノコ類、および酵母によって光合成されるビタミンDの類似体である。ビタミンD2はしばしば、食品のビタミンD強化にも使用される(2)。UVBにあたることが不十分で皮膚のビタミンD3が不適切な状態だと、ビタミンD需要を満たすためにビタミンDの経口摂取が必要である。
機能
ビタミンDの代謝
コレカルシフェロールとエルゴカルシフェロールは生物学的に不活性なビタミンD前駆体で、肝臓や腎臓で生物活性のある形態に変換されねばならない(図1)。実際、食事から摂取したりUVBにあたって表皮で合成されたりした後では、どちらの形態のビタミンDも血液中に入ってビタミンD結合タンパク質によって(および程度は低いがアルブミンによっても)肝臓まで輸送される。肝実質細胞(肝細胞)では、ビタミンDは25-ヒドロキシビタミンD(カルシジオール;カルシフェジオール)にヒドロキシル化(=水酸化)される。日光を浴びることや食事からビタミンDを摂取することで、25-ヒドロキシビタミンDの血清濃度が上がる。25-ヒドロキシビタミンDは血液中のビタミンDの主要な形態であり、25-ヒドロキシビタミンD2と25-ヒドロキシビタミンD3の血清濃度の合計は、ビタミンDの栄養状態の指標として使用される(3)。腎臓の25-ヒドロキシビタミンD-1α-ヒドロキシラーゼ酵素(CYP27B1としても知られる)は最終的に、25-ヒドロキシビタミンDを1α,25-ジヒドロキシビタミンD(カルシトリオール)に変換する第二のヒドロキシル化の触媒作用をする。腎臓での1α,25-ジヒドロキシビタミンDの生成は、血清中のリン、カルシウム、副甲状腺ホルモン(PTH)、線維芽細胞増殖因子-23(FGF-23)、および1α,25-ジヒドロキシビタミンDそのものなどのいくつかの要因によって調整されている。腎臓は1α-ヒドロキシラーゼ(=水酸化酵素)が活動する主要な部位であるが、皮膚、副甲状腺、乳房、結腸、前立腺、および免疫細胞や骨細胞などの様々な組織でも1α,25-ジヒドロキシビタミンDの腎臓外での生成が行われる(2)。体内でのビタミンDのほとんどの生理的効果は、1α,25-ジヒドロキシビタミンDの活性に関連している(4)。ビタミンDの様々な形態を図1に示す。
作用メカニズム
すべてではないがほとんどのビタミンDの作用は、ビタミンD受容体(VDR)として知られる核転写因子によって媒介される(図2)(5)。細胞の核に入ると、1α,25-ジヒドロキシビタミンDはVDRと結合し、レチノイドX受容体(RXR)という別の核受容体を動員する。1α,25-ジヒドロキシビタミンDがあると、VDR/RXR複合体はビタミンD応答配列(VDRE)というDNAの小配列と結合し、特定の遺伝子の転写を調整する一連の分子相互作用を開始させる。数千のVDREがゲノム中で識別されており、1α,25-ジヒドロキシビタミンDによるVDRの活性化は、直接および/または間接的に100~1,250の遺伝子を調整すると考えられている(6)。
カルシウムのバランス
血清カルシウム濃度を狭い範囲に維持することは、神経系の正常な機能や骨の成長および骨密度の維持に極めて重要である。体がカルシウムを効率的に利用するために、ビタミンDは不可欠である(1)。副甲状腺が血清カルシウム濃度を感知し、それが正常値より少ないと副甲状腺ホルモン(PTH)を分泌する(図3参照)。PTHの上昇が腎臓での25-ヒドロキシビタミンD3-1α-ヒドロキシラーゼ酵素の活性を刺激し、その結果1α,25-ジヒドロキシビタミンDの生成が増える。ビタミンDの活性型である1α,25-ジヒドロキシビタミンDは血液中に放出され、標的組織に運ばれる。標的細胞の中で1α,25-ジヒドロキシビタミンDはVDRと結合してそれを活性化し、血清カルシウム濃度を正常化する遺伝子の発現を変化させる。この遺伝子は(1)食事性カルシウムの腸における吸収を増やし、(2)腎臓でろ過されたカルシウムの再吸収を増やし、(3)正常な血清カルシウム濃度を維持するのに必要な食事性のカルシウムが不足している場合には骨からカルシウムを移動させる(7)。
リンのバランス
カルシウムとリンの恒常性の調整は密接に関連しており、カルシウム調整ホルモンであるPTHと1α,25-ジヒドロキシビタミンDは、血清リン濃度も調整可能である。特に、1α,25-ジヒドロキシビタミンDは小腸でのナトリウム・リン酸共輸送体の発現を刺激することで、腸でのリンの吸収を増やす。PTHは腎臓でのリンの再吸収を減らして尿へのリンの排出を増やすが、1α,25-ジヒドロキシビタミンDが直接的に腎臓でのリンの輸送を調整することができるのかどうかは不明である。リン利尿ホルモンであり、骨芽細胞(骨を造る細胞)で分泌される線維芽細胞増殖因子-23(FGF-23)は、25-ヒドロキシビタミンD-1α-ヒドロキシラーゼ酵素を抑制することで、1α,25-ジヒドロキシビタミンDの生成を制限する(図3)((8)の文献でレビュー)。
細胞分化
急速に分裂している細胞は増殖していると言う。分化の結果、細胞が特定の機能に特化する。一般的に、細胞分化は増殖の低下につながる。細胞増殖は成長や傷の治癒には不可欠であるが、特定の突然変異を持つ細胞の制御不能な増殖は、がんになる可能性がある。活性のあるビタミンD形態である1α,25-ジヒドロキシビタミンDは増殖を抑制し、VDRと結合することで細胞分化を刺激する(1)。
免疫
VDRを介して作用する1α,25-ジヒドロキシビタミンDは、免疫系の強力な調整役である。VDRは、樹状細胞やマクロファージといった制御性T細胞や抗原提示細胞などの免疫系のほとんどの細胞で発現する(9)。特定の状況では、単球、マクロファージ、およびT細胞は25-ヒドロキシビタミンD3-1α-ヒドロキシラーゼ酵素を発現させて1α,25-ジヒドロキシビタミンDを生成し、局所的に免疫反応の調整作用をする(10,11)。1α,25-ジヒドロキシビタミンDが免疫系の機能に様々な効果をもたらし、これが生来の免疫を強化したり自己免疫の発生を抑制しているのかもしれないという少なからぬ科学的エビデンスがある(12)。逆に、ビタミンDの欠乏は免疫系の整合性を損なって、不適切な免疫反応を起こすことになるのかもしれない(「自己免疫疾患」の項参照)。
インスリンの分泌
VDRは膵臓のインスリン分泌細胞によって発現し、動物研究の結果では、1α,25-ジヒドロキシビタミンDはインスリン需要が増えた状況でのインスリンの分泌に関与することが示唆されている(13,14)。横断研究および前向き研究で、ビタミンDの栄養状態が不充分だと、インスリンの分泌および2型糖尿病(非インスリン依存性糖尿病)の耐糖能に悪影響を及ぼすかもしれないことが示唆されている((15)の文献でレビュー)。
血圧の調整
レニン・アンジオテンシン系は、血圧の調整に重要な役割を果たす(16)。レニンは肝臓で造られる大きいタンパク質(アンジオテンシノーゲン)から小さいペプチド(アンジオテンシンI)が開裂(分割)される際の触媒作用をする酵素である。アンジオテンシン変換酵素(ACE)は、アンジオテンシンIが開裂してアンジオテンシンIIを生成する際の触媒作用をし、アンジオテンシンIIは小動脈の圧縮を促しナトリウムと水分をより多く保持することで血圧を上昇させることができるペプチドである。アンジオテンシンIIの合成率は、レニンに依存する(17)。VDRをコード化する遺伝子がないマウスの研究では、1α,25-ジヒドロキシビタミンDはレニンをコード化する遺伝子の発現をVDRとの相互作用で減らすことが示されている(18)。レニン・アンジオテンシン系の不適切な活性化は高血圧に寄与する可能性があるので、適切なビタミンDの栄養状態になることが高血圧のリスク低下に重要であるかもしれない(「高血圧」の項参照)。
欠乏症
ビタミンD欠乏症では、体のカルシウム需要を満たすのに十分なまでにカルシウムの吸収を増やすことができない(4)。したがって、副甲状腺によるPTHの生成が増えて、正常な血清カルシウム濃度を維持するために骨格からカルシウムが移動する。これは二次性副甲状腺機能亢進症として知られている。重篤なビタミンD欠乏症が骨の健康に深刻な結果を引き起こすことは長らく知られているが、それほど明白でないビタミンD欠乏症状態が一般的で、骨粗しょう症やその他の様々な健康上の問題のリスクを上昇させることが研究から示唆される(「疾病予防」の項参照)。
重篤なビタミンD欠乏症
くる病
幼児や子供では、重篤なビタミンD欠乏症は骨の石灰化不全を起こす。骨芽細胞によるリン酸カルシウム結晶の生成を起こす石灰化のプロセスは、骨の硬さや強さを決定する。ビタミンD欠乏症は、急速に成長する骨に深刻に影響する。骨の成長板は大きくなり続けるが、適切な石灰化ができないと、体重を支える四肢(腕と脚)が曲がる。幼児では、頭蓋骨の泉門(柔らかい部分)の閉鎖が遅れることになるかもしれず、また横隔膜に引っ張られて胸郭が変形する可能性がある。重篤なケースでは、血清カルシウム濃度が低い(低カルシウム血症)ことで痙攣が起きる可能性がある。ビタミンD欠乏症に関しては食品の強化で満足のいく結果になっているが、世界中では栄養不足のくる病はいまだに報告されている(19,20)。
骨軟化症
成人の骨はもはや成長はしないが、常に代謝回転、つまり「再形成」の状態にある。重篤なビタミンD欠乏症の成人では、コラーゲン性骨基質は保持されているものの骨塩の喪失が進行して骨が柔らかくなったり(骨軟化症)、骨の痛みがあったり、骨粗しょう症のリスクが上がったりする(21)。
筋力低下と筋肉痛
ビタミンD欠乏症は、子供や成人に筋力低下や筋肉痛を引き起こす。デンマークに住むアラブ人およびデンマーク人のイスラム教徒女性の研究で、筋肉痛や筋力低下はビタミンD欠乏症の顕著な症状であった(22)。持続する非特異性の筋骨格痛を診てもらうためににミネソタ州の診療所を訪れた150人の連続症例の横断研究では、93%が血清中の25-ヒドロキシビタミンD濃度が20ng/mL以下で平均で12.1ng/mLであり、これはビタミンD不足を呈している(23)。筋力がなくなると転倒や骨折のリスクが大幅に高くなり、年配者では特にそうである(24)。加えて、長期にわたるビタミンDの不足は年配者の骨粗しょう症の要因であるかもしれない(「骨粗しょう症」の項参照)。
ビタミンD欠乏症のリスク要因
環境要因および文化的慣習が、ビタミンDの状態の差異となって現れる。
●環境的条件:緯度や高度などの地理的位置や大気の状態(大気汚染や雲の有無など)は、地面に到達するUVBの強度に大きく影響する。季節的な変化もUVBの質や量に影響し、それによる皮膚でのビタミンD生成にも影響する(25~27)。
●肌を隠す服装:宗教的または文化的理由で頭にスカーフをしたり肌を全部隠す中東の女性2,032人の研究で、96%が血清中の25-ヒドロキシビタミンD濃度が20ng/mL未満で、60%がビタミンD濃度が12ng/mLより低かった(28)。子供や女性が屋外ではいつでも肌の大部分または全部を覆う中東や北アフリカでは、くる病や骨軟化症は珍しいことではない(29)。
●日光への安全策:日光に当たることを制限する、保護的な服や帽子を身に付ける、および日焼け止めを塗るなどの日光への防護対策は日光が肌に当たることを邪魔するので、適切な経口摂取がないとビタミンD3生成が減ったり、血液中のビタミンD代謝物が減ったりすることになる。留意したいのは、日焼け防止指数(SPF)が10の日焼け止め(2mg/cm2)を塗ると、UVBが90%減ることである(30)。
●母乳のみで育つ乳児:母乳のみで育ってビタミンDの補給を受けない乳児はビタミンD欠乏症のリスクが高く、肌の色が濃いおよび/または日光にほとんど当たらない場合は特にそうである(19)。母乳は一般に1リットル(L)に10~80 IUのビタミンDを含むが、これは一日の平均母乳摂取を0.75リットルとすると、0.2~1.5g/日(8~60 IU/日)に相当する(31)。米国小児科学会は、母乳のみおよび一部母乳で育つ乳児は400 IU/日の経口ビタミンD補給を受けるべきであると推奨している(19)。授乳期間中の母親のビタミンD補給も母乳で育つ乳児のビタミンDの状態を改善するのに役立つ可能性があり、ビタミンD欠乏症の有病率が高い集団では特にそうである(32)。ビタミンDを強化していない代用乳(大豆でできた人工乳など)や離乳食のみで育てられて成長した乳児や幼児は、ビタミンD欠乏症のリスクにさらされている(33)。
ビタミンDの合成、吸収、および代謝の効率も様々な生物学的要因に依存する。
●肌の色:肌の色が暗い人々は、日光に当たってもビタミンDの合成が肌の色が明るい人々よりも少ない(34)。米国の国家的な調査では、血清中の25-ヒドロキシビタミンD濃度の平均は、20歳以上の白人、メキシコ系アメリカ人、およびアフリカ系アメリカ人でそれぞれ28.1ng/mL、21.6ng/mL、16.9ng/mLであったと報告されている(25)。
●遺伝的変異:SUNLIGHTコンソーシアム([Study of Underlying Genetic Determinants of Vitamin D and Highly Related Traits]=根底にあるビタミンDの遺伝的決定因子および関連性の高い体質の研究)として知られる30,000人のヨーロッパ系参加者による15のコホート(=同齢などの共通因子を持つ集団)の国際的多機関ゲノム全体関連研究(GWAS)で、ビタミンDの栄養状態に影響するコレステロール合成、ヒドロキシル化、およびビタミンD輸送に関わる遺伝子における共通の変異(遺伝子多型)がわかった(35)。ヨーロッパ系(36,37)やアジア系(38,39)の集団での低ビタミンD状態の遺伝的決定因子はわかりつつあるが、アフリカ系の集団でのゲノム全体の関連研究が必要である。
●高齢:年配者はUVBに当っても皮膚でビタミンDを合成する能力が低下しているうえに、屋内にいたり日焼け止めを使ったりしやすく、これはビタミンD合成を妨げる。カナダ、米国、およびヨーロッパでは、ビタミンD欠乏症の罹患率は自活をしている年配者で10~20%である(40)。さらに、施設に入っていてビタミンD補給をされていない成人は、ビタミンD欠乏症のリスクが極端に高い(41,42)。
●慢性腎臓疾患(CKD):腎臓の機能が損なわれた患者のビタミンD欠乏症は、1α,25-ジヒドロキシビタミンDの合成が減り尿中へ25-ヒドロキシビタミンDの排出が増えることによるものである(43)。
●脂肪吸収不全症:ビタミンD欠乏症は、嚢胞性線維症や、胆汁うっ滞性および非胆汁うっ滞性の肝臓疾患の患者によく見られる。これは、食事からのビタミンDの吸収が減ったり、ビタミンDから25-ヒドロキシビタミンDへの変換が損なわれたりすることによるものである((44)の文献でレビュー)。
●炎症性腸疾患:クローン病のような炎症性腸疾患のある者はビタミンD欠乏症のリスクが高くなるようであり、小腸を切除した者は特にそうである(45)。
●肥満:肥満(肥満度指数BMIが30kg/m2以上)はビタミンD欠乏症のリスクを高くする(46)。ビタミンDが摂取されたり皮膚で合成されたりすると体脂肪の中に蓄えられ、体脂肪量の多い者には生物学的に利用しにくくなってしまう。さらに、正常体重(BMIが25kg/m2未満)の参加者と同量の経口用量を服用しても、肥満の者は血清の25-ヒドロキシビタミンD濃度がずっと低くなることがビタミンD補給試験で示された(47)。
●マグネシウム欠乏症:最近の発見で、マグネシウムの摂取が多いとビタミンD不足のリスクを減らせるかもしれないことが示唆されている。マグネシウムはビタミンDの代謝に重要な酵素の活性を調整するので、それによってマグネシウム欠乏症がどのようにビタミンDの状態にネガティブに影響するのかを説明できるであろう(48)。
ビタミンDの栄養状態の評価
ビタミンDの不足がくる病や骨軟化症以上の重篤な健康問題を起こすことを広く知らしめるため、ビタミンDの栄養状態を正確に評価する必要性が強調される。現在では、血清25-ヒドロキシビタミンDの全体濃度(1ng/mLが2.5nmol/Lに相当)の測定が、ビタミンDの状態を示す最善の指標であると合意されている。しかしながら、現在のカットオフ値(=しきい値)がビタミンD不足や欠乏症の状態を定義するのに最適であることを確実にする質の高いエビデンスがいまだに必要である(40)。さらに、大部分が標準化されていない研究データを用いての指針が開発できるように、商業的および研究室で開発される25-ヒドロキシビタミンDアッセイ(=測定法)の標準化への努力がやっと最近になってなされている(49)。ビタミンDの充足濃度を示す試験室での基準値はもともと、健康な者のコホートにおける血清中の25-ヒドロキシビタミンD濃度に基づいている。しかし、二次性副甲状腺機能亢進症や骨量減少を防ぐための健康に基づくカットオフ値は、それよりかなり高くなくてはいけないことが追加的な研究で示唆されている。実際、血清の25-ヒドロキシビタミンD濃度が8~10ng/mL(20~25-nmol/L)未満だと、くる病や骨軟化症を伴う重篤な欠乏症を示すと考えられているが、いくつかの研究でPTH濃度(50,51)やカルシウム吸収(52)は、血清の25-ヒドロキシビタミンD濃度が32ng/mL(80nmol/L)未満では最適化されなかったことが観察された。
今のところ、より最近の研究でもPTHの抑制と最適なカルシウム吸収に関する血清の25-ヒドロキシビタミンD濃度のしきい値を見つけることはできなかった。一方で312,962の臨床試料の横断的分析では、血清中のPTHおよび25-ヒドロキシビタミンD濃度の測定値のペアが逆相関を示すよく理論に合うグラフにおいて、25-ヒドロキシビタミンD濃度が70ng/mL(175nmol/L)超でもPTH抑制のしきい値のエビデンスはわからなかった(53)。これは、40ng/mL(100nmol/L)以上の25-ヒドロキシビタミンD濃度に対するPTHの最大抑制値を推測した米国全国健康栄養調査(NHANES2003-2006)の解析と矛盾する(54)。さらに、どちらの研究も血清25-ヒドロキシビタミンD濃度が優に20ng/mL(50nmol/L)を超える者に軽度の副甲状腺機能亢進症(血清PTHが65pg/mL超)のエビデンスを見つけており、血清PTHをビタミンD欠乏症の感度の良い指標として使用することに疑問を呈している(53,54)。一方で、ビタミンD不足(血清中の25-ヒドロキシビタミンD濃度が20ng/mL未満)の閉経後の女性に400~4,800 IUのビタミンD3を毎日補給した無作為化プラセボ対照試験では、20~66ng/mLという正常な25-ヒドロキシビタミンD濃度の範囲にわたって、カルシウムの吸収にわずかな変化(6%)しか見られなかった(55)。
米国医学研究所(IOM)によって提唱されている現在のカットオフ値は以下のようである:血清25-ヒドロキシビタミンD濃度が12ng/mL(30nmol/L)未満で欠乏症、12~19ng/mL(30~49nmol/L)で不足、20~50ng/mL(50~125nmol/L)で充足である(56)。米国医学研究所で設定した食事摂取基準(EAR, RDA)は、骨の健康と最適なカルシウム吸収を維持するのに適切である血液中の25-ヒドロキシビタミンD濃度を達成することを意図している(57)。
しかし、多くの慢性疾患による負荷がかかる状態での30ng/mL未満の血中濃度がもたらす潜在的役割を考慮(6)して、米国内分泌学会はカットオフ値を以下のように定義することを提案している:血清25-ヒドロキシビタミンD濃度が20ng/mL(50nmol/L)以下で欠乏症、21~29ng/mL(51~74nmol/L)で不足、30~100ng/mL(75~250nmol/L)で充足である(40)。この代替範囲はいくつかの観察研究で支持されているが、無作為化対照試験によるデータに基づくものではない(47)(「疾病予防」の項参照)。これらの後者のカットオフ値を使用すると、低ビタミンD症が広く蔓延していて、子供もどの年齢の大人も等しく不足症や欠乏症のリスクがあることが世界中の研究から推定される(58)。補給による研究のデータで、温帯にあたる緯度に住む成人が少なくとも30ng/mL(75nmol/L)の血清25-ヒドロキシビタミンD濃度を達成するには、少なくとも800~1,000 IU/日のビタミンD摂取が必要であることが示された(40)。
なお、血清25-ヒドロキシビタミンDの全体濃度が必ずしもビタミンDの生物学的利用能を適切に反映するものではなく(35)、異なる民族の集団におけるビタミンDの状態をよりよく決定するためにさらなるエビデンスが必要である。
推奨量 (RDA)
米国医学研究所の食品栄養委員会(FNB)は、骨の健康に必要なビタミンDの量に基づく推奨量(RDA)を2010年に設定した。RDAは1997年に設定された目安量(AI)よりも増やされたが、一般の人々の副甲状腺機能亢進症を最小限にして骨の健康を最善にする最適な推奨摂取量や血清25-ヒドロキシビタミンD濃度についてはいまだに議論のあるところである(40)。年齢層別および性別ごとのビタミンDのRDAを表1に示す。
疾病予防
死亡率
15,099人(うち77%が白人)が参加した第三回米国全国健康栄養調査(NHANES III)の9年間に及ぶ追跡分析で、ビタミンD標準化プログラム(VDSP)によって開発された方法論により標準化された血清25-ヒドロキシビタミンD濃度と死亡率との関係が調べられた。その分析からは、血清25-ヒドロキシビタミンD濃度が16ng/mL未満に減少すると総死亡率が上昇することが示唆された(60)。対照的に、ベースライン(=調査開始時)血清25-ヒドロキシビタミンD濃度が16~40ng/mLの範囲だと、総死亡率リスクにはほとんど変化がなかった(60)。標準化された25-ヒドロキシビタミンD濃度と死亡率の関係を考慮した平均で10.5年間の8つの前向きコホート研究のメタ解析でも、似たような結果が得られた。25-ヒドロキシビタミンD濃度が30~39.99ng/mLの場合の死亡リスクに比べて、濃度が12~15.99ng/mLだと死亡リスクが19%高く、12ng/mL未満だと56%高かったことがわかった(61)。800,000人超が参加した73の前向きコホート研究のメタ解析で、血清25-ヒドロキシビタミンD濃度が最低位の三分位群は最高位の三分位群に比べて、総死亡率(+35%)、心血管疾患による死亡率(+35%)、およびがんによる死亡率(+14%)のすべてでリスクが高いことがわかった(62)。しかしデンマークの95,766人の成人による3つの大規模コホートのデータを、交絡因子因果および逆因果によるバイアスを限定するメンデルランダム化解析(63)で分析すると、遺伝的な血漿25-ヒドロキシビタミンD低濃度は総死亡率とがん関連の死亡率には有意な相関があったが、心血管疾患関連の死亡率とは相関がないことがわかった(64)。なお、無作為化対照試験の2つのメタ解析で、ビタミンDとカルシウムを補給した年配者の総死亡率がやや低下したものの、ビタミンD単独ではそうではなかったことが示唆された(62,65)。ビタミンD単独またはカルシウムとの組み合わせでの補給が食事が充分に足りている者の早期死亡を防ぐことに役立つのかどうかを、さらなるプラセボ対照試験で調べる必要がある。
骨粗しょう症
ビタミンDの栄養状態、骨粗鬆症、および骨折リスク
骨粗しょう症の原因には多くの因子があるが、年配の成人にはビタミンDの不足が重要な病因学的要素となりうる。骨粗しょう症は、60~70歳の女性の3分の1に、80歳以上の女性の3分の2に影響している(66)。骨粗しょう症を患う2,600人超の閉経後の女性による多国間(北緯64度から南緯38度までの18ヶ国)調査で、31%の被験者の25-ヒドロキシビタミンD濃度が20ng/mL(50nmol/L)よりも低かったことが明らかになった(67)。さらに、111人の大腿骨頚部骨折患者と73人の対照群(中央値が83歳)を含む症例対照研究で、患者の血清中の25-ヒドロキシビタミンD濃度およびビタミンK1濃度がともに低いと、大腿骨頚部骨折のリスクが対照群よりも高まるという関連があることがわかった(68)。日光にあたったり食事から摂取したりしてビタミンDを充分にしておかないと、腸でのカルシウムの吸収が大きく減りうる。これが副甲状腺によるPTH分泌を増やし、PTHが高いままだと骨からのカルシウムの再吸収を増やすことになり、結果的に骨粗しょう症による骨折のリスクを上昇させることになるかもしれない(69)。
ビタミンD補給と骨密度
骨密度(BMD)が進行的に減って骨減少症(骨粗しょう症の前兆)や骨粗しょう症になるのは、年配者、特に老齢者によく見られる。4,000人超(平均年齢59歳)が参加した23の無作為化対照試験をメタ解析した結果、腰椎、大腿骨頚部、転子、前腕、および全身といった調査対象の5箇所の骨格部位のどこにおいても、ビタミンDの補給がBMDに及ぼす効果のエビデンスはほとんど見られなかった。BMDのかなりの上昇が報告されたのは、大腿骨頚部のみであった(70)。しかしながら、それはこの年齢層の者のカルシウム摂取が適切で、それによって正常な骨の新陳代謝が行われているため、骨量の増加にビタミンD補給の効果がないことを示唆しているのかもしれない(71)。逆に年配の個人では、ビタミンD補給は適切な血清25-ヒドロキシビタミンD濃度を達成したり維持したりして、二次的な副甲状腺機能亢進症や骨密度減少を防ぐのに不可欠である(72)。
ビタミンD補給と骨折リスク
米国で18年にわたって72,000人超の閉経後の女性を追跡した前向きコホート研究で、少なくとも600 IU/日のビタミンDを食事やサプリメントから摂取していた者は、140 IU/日未満のビタミンDしか摂取しなかった女性よりも、骨粗しょう症での大腿骨頚部骨折リスクが37%低かったことがわかった(73)。しかしながら、36,282人の閉経後の女性によるWomen's Health Initiative trial(=女性の健康イニシアティブ研究)では、1,000mgのカルシウムとともに400 IUのビタミンD3を毎日補給しても、大腿骨頚部骨折リスクはプラセボに比べて大きく減ることがなく(74)、骨折リスクの減少が見られるのに必要なビタミンD摂取のしきい値があるかもしれないことが示唆される。この試験データの遺伝子解析結果では、骨折リスクに対するビタミンDとカルシウム補給の有益な効果は、低骨密度になる遺伝子リスクが最も少ない女性に限られているかもしれないことが示唆された(75)。それでも、アドヒアランス(=服薬遵守)が悪いことや結果を交絡させかねない追加のビタミンDやカルシウムのサプリメント摂取が認められていたことなどから、この研究には疑問が呈されてきた。さらに、閉経後の女性の集団における主要な交絡要因であるにもかかわらず、この集団の骨格の健康状態に対するビタミンDやカルシウムの効果の研究において、ホルモン補充療法の適用が考慮されていなかった(57,76)。
カルシウムまたはビタミンDの無作為化評価研究(RECORD)という別の研究では、ビタミンD3単独(800 IU/日)またはカルシウム(1,000mg/日)との組み合わせでの経口補給は、軽度の骨粗しょう症性骨折の外傷をすでにしたことのある年配の成人の骨粗しょう症性骨折の発生を予防することはできなかったことが報告された(77)。後者の研究でも、アドヒアランスが悪いことおよび/またはビタミンD補給によって血清25-ヒドロキシビタミンD濃度が骨折を防ぐであろうほどには上昇しなかったことなどを含むいくつかの制限が、効果がなかったことの原因であるかもしれない(78)。治療へのアドヒアランスが高かったにも関わらず、3年間のビタミンD評価試験(ViDA)では、ビタミンD3補給(初期に200,000 IU/月で、その後100,000 IU/月)をしてもプラセボ補給をしても、閉経後の女性の非椎体骨折の発生率は同じようなものだった(79)。
それでも、米国予防医学専門委員会が52,915人の年配者(そのうち69%は閉経後の女性)を含む11の無作為化プラセボ対照試験をメタ解析し、最大7年間ビタミンD(300~1,000 IU/日)およびカルシウム(500~1,200mg/日)を補給したら、新しく骨折するリスクが12%減ったことを発見した(80)。65歳以上の31,022人(91%が女性)に対するビタミンD補給の効果に関する11の無作為化二重盲検プラセボ対照試験の別のメタ解析では、ビタミンD摂取が最大(792~2,000 IU/日)の者は大腿骨頚部骨折のリスクが30%、その他の脊髄以外の骨折のリスクが14%低かったことが示された(81)。なお、ビタミンDとカルシウムの組み合わせが年配の男性や閉経後の女性の骨折を予防する効果を調べた試験の第三のメタ解析でも、大腿骨頚部骨折を含む新たな骨折のリスクは、補給した者のほうが対照群に比べてかなり下がったとの結論になった(82)。興味深いことにこれらの3つのメタ解析では、ビタミンDとカルシウムの補給によって骨折が予防されるのは、施設に入っている年配者に限られた。実際、地域社会で生活をしている年配者の骨折リスクは大きく下がることはなかった(80~82)。
ビタミンD補給と姿勢バランス、筋力、および転倒リスク
840人の転倒経験者と1,330人の非転倒経験者を調べた7つの観察研究のメタ解析で、転倒経験者は非経験者に比べて血清25-ヒドロキシビタミンD濃度がかなり低いことがわかった(83)。さらに、3つの観察研究からの4つのコホートのメタ解析で、ビタミンDの栄養状態と転倒リスクの間に控えめながらも有意な逆相関があることが報告された(83)。いくつかの無作為化対照試験で年配の被験者の筋力、姿勢バランス、または転倒リスクに対するビタミンD補給の影響が調べられた。これらの試験のメタ解析で、筋力および運動性についてそれぞれ1種類の検査を基にしたビタミンD補給効果の限定的なエビデンスが見られた。しかしながら、ビタミンDの栄養状態が最適ではない(平均血清25-ヒドロキシビタミンD濃度が20ng/mL未満)160人の閉経後の女性(50~65歳)による最近の無作為化二重盲検プラセボ対照試験で、1,000 IU/日のビタミンD3補給により、ビタミンDの栄養状態だけでなく上肢および下肢の筋力および姿勢バランスのパラメータが大きく改善した(84,85)。転倒および転倒の繰り返しのリスクは、ビタミンD3補給をした群よりも対照群の方が2~3倍高いことがわかった(85)。対照的に、200人の年配者(そのうち58%はベースライン血清25-ヒドロキシビタミンD濃度が20ng/mL未満)による12ヶ月の別の無作為化対照研究では、2,000 IU/日(10μgのカルシジオール補給も有りもしくは無し)の補給をした者には、800 IU/日の補給をした者と比べて下肢の機能または転倒の可能性に関して何の利点も示されなかった(86)。最近発表されたViDA試験の事後解析で、平均で3.4年間ビタミンD補給(100,000 IU/月、すなわち約3,350 IU/日)またはプラセボを摂取するように無作為化されても、5,108人の地域在住参加者(50~84歳)の転倒の可能性や報告数に何の違いもなかったことがわかった(79)。ViDAの参加者のほとんどは血清25-ヒドロキシビタミンD濃度が20ng/mL以上で、少なくともこれがビタミンDが転倒におよぼす影響がなかったことの説明になっているかもしれない(87)。
全体的に、800~1,000 IU/日のビタミンD3補給が年配者の転倒や骨折率を減らすのに役立つのではないかということが、現在のエビデンスから示唆される。ビタミンD補給が骨の健康を維持するのに有効であるためには、食事からの適切なカルシウム摂取(1,000~1,200mg/日)をすべきである(「カルシウム」の項目の別記事を参照)(88)。
がん
生態学的研究で、北緯とビタミンD欠乏症とがんの発生率との関連が最初に示唆された(89)。1980年代からのいくつかの前向きコホート研究で、ビタミンD摂取またはビタミンDの栄養状態と様々な種類のがんとの関連が調べられてきた。137,567人を対象とした16の前向き研究の2013年のシステマティックレビュー(=系統的総括)とメタ解析で、血液中の25-ヒドロキシビタミンD濃度が20ng/mL(50nmol/L)増加するごとにがん全体の発生率が11%減少し、がんの死亡率も17%低下することが報告された。しかし、8つの研究の性別によるサブグループ(=下位群)の解析で、女性では血液中のビタミンD濃度とがんの死亡率には逆相関があったものの、男性ではそれがなかった(90)。さらに、ビタミンD受容体(VDR)をコード化する遺伝子のいくつかの変異が個人のビタミンDの状態に影響し、それによって部位ごとのがんのなりやすさに変化があったり(91)、がんからの回復に影響したりしている(92)かもしれないことが、増大するエビデンスによって示唆されている。なお、乳がん、肺がん、皮膚がん(メラノーマ)、結腸がん、および骨がんを含む多くの悪性腫瘍がVDRを発現させることがわかっており(93)、これらがビタミンDの作用によって影響されやすいかもしれないことが示唆される。多数の実験的研究で、1α,25-ジヒドロキシビタミンDやその類似体などの生物学的に活性のある形態のビタミンDは、多種のがん状態の細胞の分裂抑制および/または細胞分化や細胞死(アポトーシス)の誘発によって、VDRと結合する際に細胞の運命を制御しうることが実証された(94)。
結腸直腸がん
結腸がんの死亡率の地理的分布は、かつてのくる病の地理的分布と似ている(95)。このことは、日光にあたることが減りビタミンDの栄養状態が悪化することが結腸がんのリスク上昇に関係するのではないかという状況的な証拠を提示している。観察研究からのエビデンスは概ねこの仮設を支持している。4つの前向きコホート研究、4つの横断研究、および7つの症例対照研究の最近のメタ解析で、血液中のビタミンD濃度と悪性に変わる可能性のある良性腫瘍である結腸直腸腺腫の発生率に逆相関があることがわかった(96)。この解析で、血清25-ヒドロキシビタミンD濃度が最高位の四分位群は最低位の四分位群に比べて32%のリスク減少があることがわかった(96)。さらに、ビタミンD摂取が多いことと血清中の25-ヒドロキシビタミンD濃度が高いことが結腸直腸がんのリスク減少に関連があることを示唆する前向きコホート研究のメタ解析からの強力なエビデンスがある(97~99)。4つの前向きコホート研究、17のコホート内症例対照研究、および3つの症例対照研究の最新のメタ解析で、血清25-ヒドロキシビタミンD濃度が最高位の四分位群は、最低位の四分位群に比べて結腸直腸がんのリスクが38%低いことがわかった(100)。 5つのコホート内症例内対照研究に基づく初期の用量反応解析では、33ng/mL以上の血清25-ヒドロキシビタミンD濃度だと、(12ng/mL以下と比較して)結腸直腸がんリスクが50%低下するという関連があると推測された(101)。
しかしながら、女性の健康イニシアティブ研究に参加した36,282人の閉経後の女性による7年間の無作為化二重盲検プラセボ対照試験では、ビタミンD3(400 IU/日)にカルシウム(1,000mg/日)を組み合わせて補給しても、結腸直腸がんの発生率は低下しなかった(102)。カルシウム補給(1,200mg/日)が有りまたは無しでビタミンD3補給(1,000 IU/日)をした別の無作為化対照試験では、参加者の結腸直腸腺腫をまず除去した後の3~5年間に腺腫が再発するリスクに、プラセボと比べて何の低下も見られなかった(103)。これらのビタミンDの一日用量では、がんの発生に対する効果を検出するには低すぎるのかどうかはよくわかっていない(101,104)。結腸直腸がんの予防にビタミンD補給が役立つのかどうかを評価するさらなる無作為化臨床試験が必要である。また、ビタミンDの代謝や機能に関わる遺伝子配列の遺伝的変異(多型)が、ビタミンDの状態と結腸直腸腺腫またはがんのリスクの関係に影響する可能性があるのかはっきりしな(105~107)。
積み上がっていくエビデンスからは、適切なビタミンDの状態が結腸直腸がんの患者の生存によいという関連があるのではないかと示唆される。5つの前向き研究のメタ解析で、血清25-ヒドロキシビタミンD濃度が高いがん患者の結腸直腸部位のがん死亡リスクが35%低いことがわかった。用量反応解析では、25-ヒドロキシビタミンD濃度が8ng/mL増えるごとに、結腸直腸がんの死亡率が10%下がるという関連が推定された(108)。
乳がん
緯度が高くなって日光にあたることが減ると乳がんの死亡率が増えることが生態学的エビデンスから示唆されるが、ビタミンDの栄養状態と乳がんリスクの関連を裏付ける最新の観察研究データはほとんどない(86)。第一回米国国民健康栄養調査(NHANES I)に参加した女性による初期の前向き研究では、適切な日光浴と食事からのビタミンD摂取をした白人女性は、20年後に乳がんのリスクがかなり減ったことがわかった(110)。しかしながら、この研究と9つのより直近の前向き研究をともにメタ解析したところ、ビタミンD摂取の程度の高低による乳がんの発生リスクには何の有意な違いもなかった(111)。さらに、血液中のビタミンD濃度と乳がんリスクの間に関連があるのかもはっきりしない。14の観察研究(9,110人の症例群と16,244人の対照群)のメタ解析で、血清25-ヒドロキシビタミンD濃度が最高位の四分位群を最低位の四分位群と比べると、全体で16%のリスク低下があったと報告された。この逆相関は閉経後の女性で統計的に有意であったが、閉経前の女性ではそうではなかった(112)。しかし、同じような群を含む14の前向き研究(そのうち2つの研究では異なる)の別のメタ解析では、全体的に何の関連も見られなかった(111)。初期の乳がん患者に対する研究の1つのメタ解析では、ビタミンDの状態が不適切であることと、再発および死亡のリスク上昇に関連があることがわかった(113)。無作為化対照試験からのエビデンスは現在、ビタミンD補給が乳がん発生を減らす可能性について結論付けるにはあまりに限定的すぎる((114)の文献でレビュー)。
しかしながら、3つのメタ解析で血液中のビタミンD濃度と乳がん関連死の間の逆相関がわかった(111,115,116)。1つの後ろ向きコホート研究と5つの前向きコホート研究のメタ解析で、血清ビタミンD濃度が高い者は低い者よりも死亡率が33%低いという関連があり、用量反応解析では血清ビタミンD濃度が8ng/mL上昇するごとに12%低下していたことがわかった(115)。
なお、現在のエビデンスではVDRのコード化における特定の遺伝子変異が乳がんリスクに影響しているかもしれないとは示されていない(117,118)。
その他のがん
ビタミンDの状態とその他のがんとを関連づけるエビデンスは、現在のところ限られている。前立腺がんの発生が日照と逆相関があるように思われるが、前向きコホート研究では血清25-ヒドロキシビタミンD濃度とそれによる前立腺がんの発症リスクとの有意な関係は一般的に示されていない(119,120)。実際、血液中のビタミンD濃度が高いと前立腺がんのリスクが高いと示唆する研究もある。たとえばスカンジナビアの男性(622人の症例と1,451人の対照群)によるコホート内症例対照研究では、血清25-ヒドロキシビタミンD濃度と前立腺がんリスクとの間にU字形の関係があったことがわかった。その研究では、血清25-ヒドロキシビタミンD濃度が7.6ng/mL以下か32ng/mL以上だと、前立腺がんリスクが高いという関連があった(121)。17のコホート内症例対照研究、3つの前向きコホート研究、および1つの後ろ向きコホート研究のメタ解析では、血液中の25-ヒドロキシビタミンD濃度が高い者は、低い者に比べて前立腺がんのリスクが17%高かったことがわかった(122)。血中ビタミンD濃度が高い男性の前立腺がんの症例が少し多く発見されることは、交絡因子の可能性によって説明できるかもしれないことが、最近の発表で強調されている(123)。
なお、観察研究の最近のメタ解析で、ビタミンDの状態と肺がんリスク(124,125)および膀胱がんリスク(126,127)の逆相関がわかった。しかし、現在までに発表されたしばしば異種な内容の研究では、血清25-ヒドロキシビタミンD濃度は、非ホジキンリンパ腫(128)、卵巣がん(129)、胃がん(130)、または皮膚がん(131)などの他のがんと関連づけられなかった。
自己免疫疾患
インスリン依存性糖尿病(1型糖尿病)、多発性硬化症(MS)、関節リウマチ(RA)、および全身性エリテマトーデス(SLE)は自己免疫疾患の例である。自己免疫疾患は、体が外来の病原体ではなく自分自身の組織に対して免疫反応を起こして発生する。1型糖尿病では、インスリン産生をする膵臓のβ細胞が不適切な免疫反応の標的になる。MSでは、中枢神経系のミエリン産生細胞が標的であり、RAでは関節のコラーゲン産生細胞が標的である(132)。SLEは複数の組織を損傷する可能性のある広範な自己抗体があることが特徴である(133)。自己免疫反応は、T細胞と呼ばれる免疫細胞によって媒介されている。生物学的に活性のあるビタミンDの形態である1α,25-ジヒドロキシビタミンDは、自己免疫反応が消えるようにT細胞の反応を調整することがわかっている。自己免疫疾患(特にMS(134))の罹患率は緯度が高くなるに連れて増えることが生態学的研究からわかっており、UVBに当たらないで皮膚でのビタミンD合成が減ると、これらの疾病の病理に影響があるかもしれないことを示唆している。いくつかの前向きコホート研究の結果も、異なる年齢層(胎児、幼児、および青少年期を含む)における適切なビタミンDの状態が、自己免疫疾患リスクを減少させるかもしれないことを示唆している。
1型糖尿病
新たに1型糖尿病と診断される患者は、同じ年齢層や性別の糖尿病でない被験者に比べて、血液中のビタミンD濃度が低いことが報告されている(135,136)。複数の膵島関連自己抗体(インスリンを分泌する膵臓の細胞に対する抗体)を持つ前糖尿病性の子供は、自己抗体を持たない子供に比べてビタミンDの不足や欠乏症が蔓延していることも観察されている。しかし前糖尿病性の子供のコホートを追跡した前向き研究では、不足、欠乏、または充足で定義されるビタミンDの状態は、5または10年間の追跡後に1型糖尿病に進行する率とは関連がなかったことがわかった(137)。1966年にフィンランドに生まれた子供を30年間追跡した初期の前向きコホート研究では、生後1年間ビタミンD補給をされた子供は、補給を受けなかった子供に比べて1型糖尿病を発症するリスクが88%低かったことがわかった。しかも、生後1年間にくる病(重篤なビタミンD欠乏症)の疑いのあった子供は、1型糖尿病の発症率が有意に高かった(138)。したがって、ビタミンD補給は1型糖尿病の発症から体を保護するようであり、乳幼児期に最適以下のビタミンDの状態だと、その後の人生で免疫反応に長期的影響があるかもしれない。
妊娠中の母親のビタミンD不足が子供の1型糖尿病リスクに影響するかもしれないと示唆する限定的なデータもある。最近の症例対照研究で、母親の妊娠後期での血清25-ヒドロキシビタミンD濃度が21.6ng/mL(54nmol/L)未満だと、濃度が35.6ng/mL(89nmol/L)超の母親から生まれた子供に比べて、子供の1型糖尿病の発症リスクが2倍よりも高かった(139)。その他の症例対照研究でも、妊娠中のビタミンD補給で子供の糖尿病関連の自己抗体の発生リスクが低いという関連がわかった(140,141)。しかしながら、糖尿病のリスクが遺伝的に高い子供の母親に対する大規模な研究では、子供の生後1年間の膵島関連自己抗体および/または糖尿病の発生と母親の妊娠中のビタミンD摂取との間に関連はなかったと報告された(142)。別の症例対照研究では、妊娠初期の血清25-ヒドロキシビタミンDと子供の1型糖尿病の発症との間に関係が見られなかった(143)。妊娠中の母親のビタミンDの状態が子供の1型糖尿病リスクに影響するのかどうかを確定する大規模前向き研究が必要である。
また、ビタミンD代謝に関係する遺伝子の多型と1型糖尿病との関係が現在研究されている。たとえば、CYP27B1(25-ヒドロキシビタミンD3-1α-ヒドロキシラーゼをコード化する)やVDRの遺伝子における特定の多型がビタミンDの作用に機能的に関係があり、それにより1型糖尿病のなりやすさに影響しているのかもしれないということが提唱されている。1型糖尿病の8,517人の子供および青少年と7,320人の対照群に対する研究では、コレステロールの合成とビタミンDのヒドロキシル化に関わる遺伝子の多型が、血液中のビタミンD濃度と糖尿病の状態に関連していた(26)。
多発性硬化症
日光にあたることが少ないことやビタミンDの欠乏症は、多発性硬化症(MS)の発症に関連しているようである。ビタミンDの状態が悪いと、様々な免疫反応の調整に重要な特定の免疫細胞の働きを損ない、MSの自己免疫を引き起こすことに寄与してしまうかもしれない(144)。Multiple Sclerosis Genetics Consortium(=多発性硬化症遺伝学コンソーシアム)のデータのメンデルランダム化解析において、ビタミンDの低栄養状態の遺伝的決定因子は最近、成人発症性のMSになりやすくなることと関連付けられた(145)。これはビタミンDが充分であることがMSのリスク低下に関連していることを示唆しているいくつかの観察研究の結果と呼応していた。オーストラリアで行われた紫外線の量とMSの症例の後ろ向き研究で、子供のMSの発生は、妊娠初期の母親が紫外線に当たることと逆相関があったことがわかった(146)。1,660人のMS患者と3,050人の対照群を含む最近の症例対照研究でも、日光にあたることはビタミンD摂取の代替マーカーとして使用された。屋外での活動がたまにしかなく幼児期や青少年期に日焼け止めを使用していると、後にMSを発症するリスクが高くなるという関連があることを著者らは発見した(147)。横断研究では、子供の時に日光に当たってタラの肝油(ビタミンDが豊富)を摂取することが、再発性MSを患う退役軍人の後の症状の発現に関連していた(148)。さらに、MSと診断された257人の症例を含む米国軍人の症例対照研究では、血清25-ヒドロキシビタミンD濃度が最高五分位(39.6ng/mL超)の白人被験者は、最低五分位(25.3ng/mL未満)の者に比べてMSの発症リスクが62%低かったことがわかった(149)。また、187,000人超の米国人女性の2つの大規模コホートを少なくとも10年間追跡したところ、ビタミンDのサプリメント(400 IU/日以上)を使用していると、MSの発症リスクが41%低いという関連があった(150)。別の前向き非対照研究では、156人の再発寛解型MS患者に第一線の免疫調節療法に加えてビタミンD補給(100,000 IU/月を6~42ヶ月、平均で31ヶ月)をする前と後で、症状の再発生をビタミンDの状態との関係でモニターしたら(151)、血清25-ヒドロキシビタミンD濃度が4ng/mL上がるごとに再発生が14.9%減るという関連があった(151)。新たに臨床分離症候群(CIS)と診断されインターフェロン(IFN)-βで治療を受けている患者に対して行われた多機関の研究で、ビタミンDの状態がMSの活動性や進行の予兆となっていた。CISの診断から最初の1年間の血清25-ヒドロキシビタミンD濃度が高い(20ng/mLすなわち50nmol/L以上)と、その後4年間の追跡でMSと診断されるまでの時間が長くなり、新規の病変の数が減り、病変の変化も脳の体積の変化も少ないことが予見された(152)。しかしながらある後ろ向き研究では、再発寛解型MS患者のビタミンDの状態は、身体障害の悪化が特徴的である二次性進行型MSへの転換までの時間に関しての予測値にはならないと示唆された(153)。
MS患者の再発率や身体障害に関連した症状について、単独またはIFN-βによる治療と組み合わせてビタミンD補給をしても、臨床試験では何の利点も実証されなかった(154,155)。別の臨床試験でも、ビタミンD3補給は免疫調節作用を示さなかった(156~159)。53人のIFN-β治療を受けている再発寛解型MS患者に対する最近の無作為化プラセボ対照試験で、ビタミンD3補給(7,000 IU/日を4週間、その後14,000 IU/日を第48週まで)は48週間の研究期間にわたって、ある種の制御性T細胞とB細胞の比率にほとんど影響しなかった。ビタミンD3は抗炎症のCD4+T細胞の割合の維持にのみ役立つようであったが、これはプラセボを与えられた患者では減少していたものの、ガラス容器内で1,25-ジヒドロキシビタミンDで刺激してもこの細胞の反応性が良くなることはなかった(157)。別の試験では、再発寛解型MS患者にビタミンD3(10,400 IU/日を3ヶ月間)補給をすると、炎症促進性のIL-17産生CD4+T細胞の割合が減ったことがわかり、これはMSの発症に中心的な役割を果たしていると考えられている(160)。
関節リウマチ
エビデンスが主に動物研究によるものであるとはいえ、ビタミンDの欠乏は関節リウマチ(RA)の病因および/または進行にも関係があるかもしれない。ビタミンD受容体(VDR)がない遺伝子組み換えのマウスは、炎症の程度がひどく自己免疫になりやすくなるという関連がある(161)。自然に炎症性の関節炎を起こす遺伝子導入マウスにVDRが欠乏していると、より侵襲性の慢性関節炎を起こす(162)。また、VDR遺伝子が特定の多型だと、ある集団でRAになりやくなるという関連があるが、これらの遺伝子的変異がどのようにビタミンDの機能に作用するのかは充分にわかっていない(163~165)。しかしながら、RAを含む多くの慢性疾患の根本的な炎症プロセスの調整におけるビタミンDの役割が、現在のデータで示されている。中度から重度の炎症のある個人を対象にしたいくつかの横断研究では、血液中の25-ヒドロキシビタミンD濃度と炎症マーカーとの間には、何の関係もないか逆相関があることが報告された。それでもなお、重度炎症のある被験者の炎症を制限し疾病(RAを含む)のリスクを減らすことがビタミンD補給によってできるかどうかを示す介入試験が不足してい(166)。
今のところ、RAの発症にビタミンD欠乏症の有病率が関連しているかどうかは不明のままである。30,000人近い米国の閉経後の女性を対象にした大規模コホート研究では、ビタミンD摂取が最多レベル(467.7 IU/日以上)の被験者は最少レベル(221.4 IU/日未満)の者に比べて、11年間の追跡調査後にRAの発症リスクが33%低かった(167)。しかし、200,000人近くの米国人女性の2つの大規模コホートを数十年間にわたって追跡したより最近の解析では、青少年期や成人期におけるビタミンDの食事からの摂取の報告(食品摂取頻度調査票を使用した)とその後のRAの発症との関連は見られなかった(168,169)。さらに、RA患者の血液中のビタミンDと疾患活動性との関係を探ったいくつかの研究で、関連の有無どちらの結果も報告されている((170)の文献でレビュー)。しかし、観察研究の最近の2つのメタ解析で、疾患活動性指標28(DAS28)を使用して評価されたRA患者の疾患活動性とビタミンDの栄養状態の間に逆相関があることがわかった(171,172)。なお、関節炎の患者の疾患活動性に対するビタミンD補給の効果を探る研究は不足している。22人のRA患者による小規模な無作為化二重盲検プラセボ対照試験では、カルシウム(1,500mg/日)と高用量ビタミンD2(エルゴカルシフェロール;平均4,500 IU/日超)を1年間補給された被験者は、プラセボと比べても疾患活動性や炎症の程度に改善が見られなかった(173)。初期のRAである41人の女性を対象にした3ヶ月間の別の無作為化対照試験では、T-ヘルパーリンパ球の数え上げ、サイトカイン産生、または疾患活動性を含む臨床的パラメータに関して、ビタミンD3補給(300,000 IUの急速投与を1回)は標準的療法(メソトレキサートおよびグルココルチコイド)に対して何の追加的利点もなかったことがわかった(174)。また、ビタミンD補給は2つの小規模な無作為化対照試験に登録したRA患者の再発率を減らすことができなかった(175,176)。サンプル数が少ないことも含めてこれらの研究にはいくつかの限界があり、追加的な研究がなされるべきである。
全身性エリテマトーデス
非白人(ヒスパニック、アフリカ系、およびアジア系)により多く見られより重症である(177)全身性エリテマトーデス(SLE)は、臨床的に様々な症状を示す自己免疫疾患である。この病気は、皮膚(皮膚発疹や光過敏性)、腎臓(腎炎)および関節(関節炎)を含むたいていの組織や臓器に影響する可能性がある。動物モデルでは、SLEの予防にビタミンDが役立つというエビデンスがある(178)。興味深いことに、11の症例対照研究の最近のメタ解析で、特定のVDRの多型がアジア人のSLEに特に関連しているとわかった(179)。しかし、そのような遺伝子変異の機能的関連性はわかっていない(180)。200,000人近い米国人女性に対する2つの大規模前向きコホート研究の解析では、青少年期や成人期におけるビタミンDの食事からの摂取(食品摂取頻度調査票を使用した)と、その後のSLEの発症との関連は見られなかった(168,169)。
今のところ、ビタミンDの状態がSLEの被験者では最適以下なことが一般的で、これは日光に当たることが少ないことによって一部説明可能で、それが疾病の症状を悪化させる傾向がある(181,182)。血清中の25-ヒドロキシビタミンD濃度は、378人のSLE患者のコホートで疾患活動性の測定値と逆相関があった(183)。20人のSLEの被験者に高用量ビタミンD3補給(100,000 IU/週を1ヶ月間、その後100,000 IU/月を6ヶ月間)でビタミンD不足を治してもらったら、免疫の不均衡の徴候やSLEで典型的に検出される自己抗体の濃度が下がったという関連があり、これは疾病の治療におけるビタミンDの効果を示唆している(184)。皮膚エリテマトーデス(皮膚病だけのループス(=狼瘡)の一種)でビタミンD欠乏症でもある52人の患者に対する別の前向き研究で、ビタミンD3(初めは1,400 IU/日で、後に800 IU/日)とカルシウムを1年間補給した群は、何もしなかった群に比べて疾病の重症度が下がったことが報告された(185)。267人のSLE患者に対する無作為化プラセボ対照試験でも、ビタミンD3補給(200 IU/日を1年間)をしたら、炎症サイトカインの濃度を下げることができた(186)。別の無作為化プラセボ対照試験では、ビタミンD3補給(50,000 IU/週を6ヶ月間)によってSLE疾患活動性指標(SLEDAI)、欧州コンセンサスループス活動性測定(ECLAM)のスコア、および若年発症型SLEの若者のいくつかの疲労測定値が改善した(187)。しかしながら最近の2つの別な研究では、ビタミンD3補給(約800~7,000 IU/日に相当する1週または1月あたりの急速投与量で6~24ヶ月補給)でSLE患者のビタミンDの状態が改善したものの、疾患活動性に関して何の利点も示されなかった(188,189)。SLE患者へのビタミンDの経口投与は耐容性がよいものの、その効能には疑問が残るままであり、さらなる臨床試験での調査がなされるべきである。
要旨
したがって、自己免疫疾患の予防や治療にビタミンD補給が有効であると結論づけられないものの、ビタミンD不足を解消し充分な濃度を維持することが疾患のリスクを下げることに役立つ可能性があることを、ヒトでの疫学的研究のエビデンスは示している(190)。
心血管疾患
高血圧
高血圧は心血管疾患(CVD)のリスク要因としてよく知られている(191)。観察研究および臨床研究の結果は、血圧を下げるのにビタミンDが役立つことを示唆しており、これは一部には1α,25-ジヒドロキシビタミンDがレニンの合成を抑制するということで説明できるかもしれない(「機能」の項参照)。したがって、ビタミンD欠乏症とそれによるレニン・アンジオテンシン系の上方制御が高血圧やCVDリスクに寄与するのかもしれない。PTH濃度が高いと、高血圧やCVDのリスクを高めるのではないかとも示唆されてきた(6)。3,002人(ベースライン時に平均59歳)に対する最近の前向きコホート研究で、9年間の追跡期間に41%の参加者が高血圧を患ったが、この発症は血清25-ヒドロキシビタミンD濃度が20ng/mL未満の者には多くなく、PTH濃度が高いことにわずかに関連があった(192)。それにもかかわらず、全部で48,633人が参加し5,000人近くが高血圧を発症した7つの前向き研究のメタ解析で、血清25-ヒドロキシビタミンD濃度が上部三分位の者は、下部三分位の者より30%高血圧リスクが低かったことがわかった。用量反応解析では、血清25-ヒドロキシビタミンD濃度が10ng/mL上がるごとに、高血圧リスクが12%下がるという関連が推定された(193)。4つの前向き研究と14の横断研究のメタ解析でも、血液中の25-ヒドロキシビタミンD濃度と高血圧の逆相関が報告された(194)。
血管内皮障害
血管内皮障害は心血管疾患(CDV)のリスク上昇に寄与し、慢性腎疾患(CKD)の患者に一般的に見られる(195)。CKDの患者では、上腕動脈の血流依存性血管拡張反応(FMD)という血管の健康状態を示す代理マーカーの値が低いことが、異常な血管内皮機能と関連している。軽度から中度のCKDの被験者に対する最近の研究で、血清25-ヒドロキシビタミンD濃度はFMDの値と正の相関があり、これはビタミンDの状態が最適より悪いことが血管内皮障害と関連があることを示唆している(196)。ある予備的な介入研究では、ビタミンDが不足(平均で17.2ng/mL)している26人の中度のCKD患者に300,000 IUのビタミンD3を2回補給(1週目と8週目)し、全体で16週間追跡した。ビタミンD補給によって血清25-ヒドロキシビタミンD濃度がほぼ倍になり、PTH濃度は68.5%減った。ビタミンDの状態の改善は、FMDの数値の上昇と血管内皮障害のマーカーの低下とともに起こった(197)。CVDリスクが高い患者に対する12の小規模無作為化対照試験の最近のメタ解析で、ビタミンD補給(1日用量で2,500~5,000 IU、1週用量で50,000 IU、1月用量で60,000 IU、1回の急速投与量で100,000~200,000 IU)を8週間から6ヶ月したところ、FMDが有意に上昇したことがわかった(198)。
観察研究と臨床試験での心血管イベント(=事象)
今日までビタミンDとCVDの転帰(=結果)との関係を調べた多くの疫学的研究は、まちまちの結果を生んできた((199)の文献でレビュー)。最近のメンデルランダム化研究では、冠動脈性心疾患、虚血性心疾患、または心筋梗塞のリスクと遺伝的低血清25-ヒドロキシビタミンD濃度との間には何の関連も見られなかった(200,201)。このことは、観察研究で報告された関連が交絡因子や因果関係の逆転によるものである可能性を示唆している。5,292人の年配者によるRECORD試験(「骨粗しょう症」の項参照)では、800 IU/日のビタミンD3補給(カルシウム有りまたは無し)によって、カルシウム単独またはプラセボを摂取した場合に比べて最初の心不全リスクが減ったものの、心筋梗塞および脳卒中のリスクには何の効果もなかった(202)。心血管イベントに対するビタミンD補給の効果に関するデータは、13,033人の参加者(60歳以上)による21の無作為化対照研究(RECORD試験も含む)から集められ、メタ解析に組み込まれた(202)。1~6.2年間の追跡期間にわたって、心不全、心筋梗塞、および脳卒中といった主要な心血管イベントに関してビタミンD補給(ビタミンD類似体を含む)の効果は見られなかった(202)。しかしながら、これらの結果を解釈する際には注意をした方がよい。それというのもこれらの試験はもともと骨の健康に対するビタミンDの効果を評価するように考えられたものであって、心血管に関する結果は主要エンドポイント(=評価項目)ではないからである。CVDリスクに対するビタミンD補給の効果を探るいくつかの無作為化対照試験が現在進行中であり(203)、それらには米国のビタミンDとオメガ3試験(VITAL)(204)やオーストラリアのD健康試験(D-Health trial)(205)という2つの大規模試験も含まれる。ニュージーランドの無作為化対照試験であるビタミンD評価試験(ViDA)の結果が最近発表された。追跡期間中の全CVDイベント数や最初のCVDイベントまでの時間は、中央値で3.3年にわたってビタミンD3補給(最初の月の用量が200,000 IUでその後100,000 IUの1月用量)をした者とプラセボを摂取した者とでは違いはなかった(206)。
2型糖尿病
メタボリック症候群の人々は、2型糖尿病(非インスリン依存性糖尿病)や心血管疾患(CVD)のリスクが高い。メタボリック症候群とは、脂質異常症、高血圧、インスリン抵抗性、および肥満を含むいくつかの代謝障害をいう。最近の研究で、1,801人のメタボリック症候群の患者における2型糖尿病の罹患率は、血清25-ヒドロキシビタミンD濃度が低い(30ng/mL未満)ことと関連していることがわかった。8年間の追跡期間で、血清25-ヒドロキシビタミンD濃度が30ng/mL(75nmol/L)超の者は、10ng/mL(25nmol/L)未満の者に比べて全死因による死亡リスクが72%低く、CVDによる死亡のリスクも64%低いことが報告された(207)。
健康な者には、ビタミンDが充分であることはインスリン感受性や膵臓β細胞の適切な機能と正の相関がある。逆に、ビタミンD欠乏症はグルコース恒常性に影響し、耐糖能異常やインスリン抵抗性を引き起こすかもしれない(208)。前糖尿病状態(2型糖尿病の発症リスクが高い状態)にある4,057人を含む12,719人の成人に対する横断研究で、前糖尿病の罹患率は血清25-ヒドロキシビタミンD濃度が低いこと(32.4ng/mL以下)と関連があった。血清25-ヒドロキシビタミンD濃度が最低レベル(17.7ng/mL以下)の被験者は、現在喫煙中で肥満で高血圧であることが多かった(209)。リスクの高い個人のビタミンD不足は、はっきりとした糖尿病への進行を加速させるかもしれない。2,378人の中年男性および女性を8~10年間追跡した前向き研究で、前糖尿病から2型糖尿病への進行リスクは、血液中のビタミンD濃度が最も高い(28.4ng/mL超)四分位群では、最も低い(18.5ng/mL未満)四分位群より女性で62%、男性で60%低かった。用量反応解析では、2型糖尿病への進行リスクは、血清25-ヒドロキシビタミンD濃度が4ng/mL(10nmol/L)上がるごとに、平均で23%低くなった(210)。210,000人超の参加者を中央値で10年間追跡した18の前向きコホート研究の最近のレビューとメタ解析で、ビタミンD濃度(血液中の濃度または食事からの摂取による)が上位3分の1の者は、2型糖尿病リスクやメタボリック症候群リスクが下位の3分の1に比べてそれぞれ19%と14%低かった(211)。28,258人の年配者(平均年齢67.7歳)に対する9つの前向き研究の別のメタ解析で、中央値で7.3年間の追跡期間にわたって、ベースライン血中ビタミンD濃度が低い者は高い者より2型糖尿病になるリスクが17%高いという関連があったことがわかった(212)。現在、ビタミンD補給は耐糖能障害や顕性2型糖尿病の者のインスリン感受性を向上させるかもしれないということが、限定的なエビデンスで示唆されている(213~216)。適切なビタミンD濃度を維持することが健康またはリスクの高い個人の代謝に関する結果の悪化を防ぐのかどうかを調べるように良く計画された臨床試験が必要である。
神経変性疾患
認知障害およびアルツハイマー病
アルツハイマー病(AD)は最も一般的な認知症の形態で、脳内に神経外のβアミロイド斑や神経内のTタンパク質凝集物(神経原線維変化として知られる)が存在することが特徴である。動物研究で現在調べられているメカニズムのモデルは、大脳皮質や海馬の領域でのビタミンD欠乏またはビタミンD代謝の異常および/またはビタミンDとVDRの経路の分断が、神経細胞の変性や認知機能の喪失に関わっているかもしれないことを示唆している(217)。中枢神経系のカルシウムチャネルの調整、神経細胞保護、および免疫調整におけるビタミンDの役割を裏付ける実験的エビデンスでも、低ビタミンD状態が加齢に伴う認知機能障害の前兆となったり寄与をしたりすることが暗示されている(218)。
食事性のビタミンD摂取と血清25-ヒドロキシビタミンD濃度との関連で、年配者の認知機能低下と脳の変性疾患が多くの観察研究で調べられてきた。閉経後の女性の骨粗しょう症と大腿骨頚部骨折に関するフランスでの大規模コホート研究では、ファイファーの簡易携帯型知的状態質問票(SPMSQ)というテストで評価された全体的な認知能力の損傷は、5,596人の年配の女性(平均年齢80.5歳)で食事からのビタミンD摂取が少ない(1,400 IU/週未満)ことと関連があった(219)。498人のサブグループの女性を7年間追跡した研究では、ベースライン時に食事性ビタミンD摂取が最高五分位の者は、最低五分位の者に比べて(その他の認知症ではなく)アルツハイマー病のリスクが77%低かったことが示された(220)。全部ではないがいくつかの観察研究で、血清25-ヒドロキシビタミンD濃度が低いことと年配者の軽度認知障害に関連があることがわかった(219,221,222)。65歳以上の1,604人の男性(223)と6,257人の女性(224)に対する2つの前向き研究の横断的および縦断的解析で、女性はビタミンD欠乏症(血液中の25-ヒドロキシビタミンD濃度が10ng/mL未満)だと30ng/mL以上の場合よりもベースライン時で認知障害の可能性が60%高く、4年間の追跡期間の間では認知障害のリスクが58%上昇したが、男性ではそうではなかったことが報告された。2,273人(平均年齢70.4歳)を対象とした多民族のコホート内症例対照研究であるSingapore Kidney Eye Study(=シンガポール腎臓眼研究)では、簡略型認知機能テスト(AMT)で評価された逆行性エピソード記憶、意味記憶、および時間の見当識に影響する認知障害と、血清25-ヒドロキシビタミンD濃度が逆相関していた(225)。
しかし観察研究の系統的総括やメタ解析は、認知能力やADとビタミンDの状態との関連についてまちまちな結果となっている(226-230)。さらに、1,182人の男性を18年間追跡した成人男性ウプサラ縦断研究(ULSAM)の最近のデータ解析では、ビタミンD合成の遺伝的決定因子、ビタミンD摂取、および血漿25-ヒドロキシビタミンD濃度と、認知機能障害、AD,血管性認知症、または全原因による認知症のリスクとの間の相関は見られなかった(231)。対照的に別のメンデルランダム化研究では、国際アルツハイマー病ゲノムプロジェクト(International Genomics of Alzheimer's Project)のデータ(17,008人のAD患者と37,154人の健常者)で、ビタミンDの状態が悪いことの遺伝的決定因子とADリスクの上昇が関連付けられた(232)。
そうは言っても、年配の成人の70~90%にビタミンDの不足/欠乏が蔓延しており、血清25-ヒドロキシビタミンD濃度が低い状態を治すことが、認知プロセス、特に実行機能の向上に役立つかもしれない(233)。外来診療所での小規模非無作為化対照研究において、800 IU/日(または100,000 IU/月)のビタミンD補給をした20人の患者と24人の対照群被験者で、ベースライン時と16ヶ月後に認知機能全体の評価が行われた。補給されなかった群に比べて、外来患者へのビタミンD補給によってビタミンD濃度が低い状態は改善され(血清25-ヒドロキシビタミンD濃度の平均はベースライン時で16.8ng/mL、16ヶ月後では30ng/mL)、認知テストの成績が大きく改善するという関連があった(234)。鼻からのインスリン投与を受けている32人の軽度から中度のAD患者による小規模無作為化プラセボ対照臨床試験では、高用量(最大で36,000 IU/日)のビタミンD2を8週間補給しても、低用量(1,000 IU/日)の場合に比べて大きく認知能力が改善することはなかった(235)。年配者におけるビタミンDの再充足と認知能力への長期的な有益性の因果関係を調べるさらなる試験が必要である。また、認知障害の被験者のビタミンD欠乏を治すことが抗認知症治療の影響を強めることができるかどうかを評価することは非常に重要である(236)。
パーキンソン病
パーキンソン病(PD)は、患者の間でビタミンD不足が広く見られるという関連があり、体を動かすことに問題がある者については特にそうである(237)。平均年齢65歳の296人の外来患者による症例対照研究では、血清25-ヒドロキシビタミンD濃度が20ng/mL以下の者はPD被験者の23%にあたり、AD患者や健康な者ではそれぞれ16%と10%だった(238)。ベースライン時にPDでなかった50~79歳の男女3,173人による前向きコホート研究では、血清25-ヒドロキシビタミンD濃度が最高四分位(女性では20ng/mL以上、男性では22.8ng/mL以上)にある者は、最低四分位(女性で10ng/mL以下、男性で11.2ng/mL以下)にある者に比べてPDのリスクが67%低かった(239)。観察研究からメタ解析用にプールされたデータはすべて、健康な対照群にくらべてPD患者にはビタミンDの状態の不適切さが報告されやすいことを示していた(240~242)。
ある無作為化二重盲検プラセボ対照試験では、標準的なPD治療を受けている112人のPD患者(平均年齢72歳)が1,200 IU/日のビタミンDまたはプラセボ補給を12ヶ月受けた。ビタミンD補給によって、補給を受けた被験者の血清25-ヒドロキシビタミンD濃度が倍近くになった(平均22.5ng/mLから41.7ng/mLへ)だけでなく、PDの進行も限定的になった。これは、補給を受けた群の大部分の患者で、症状の悪化(ホーン・ヤールの重症度分類[Hoehn and Yahr stage]やパーキンソン病統一スケールのパートII[United Parkinson Disease Rating Scale part II]で評価)がプラセボ群に比べてまったくなかったことによって示されている(243)。この疾患の病因にビタミンD不足が関わっているかは不明だが、ビタミンDを充足させてやることで、PDの予防および/または治療以上の健康への利点があるかもしれない。たとえば、ビタミンD欠乏はPDや多発性硬化症を含む神経障害のある者の骨粗しょう症や骨折のリスクを悪化させるかもしれない(244~246)。興味深いことに、324人のPDの年配者に対する前向き研究で、日光に当たることはビタミンDの状態の改善、第二中手骨の骨密度の増加、および大腿骨頚部骨折の発生率の低下と関連があることがわかった(247)。
妊娠への悪影響
母親のビタミンDの状態と妊娠の転帰に関する31の観察研究の系統的総括とメタ解析で、ビタミンD不足は妊娠中の女性の妊娠糖尿病、妊娠高血圧腎症 、および細菌性膣炎と関連しているかもしれないことが示された。妊娠中に母親の血清ビタミンD濃度が低いと不当軽量児や低出生体重児のリスクが上昇することとも関連しているが、帝王切開とは関連がない(248)。しかし、妊娠中にビタミンD補給をすることが上記のような妊娠への悪影響の発生を減らす可能性があるのかについて結論を出すには、介入試験の数が現在ではあまりにも限られすぎている(249)。
妊娠糖尿病
膵臓のβ細胞機能障害による異常な高血糖症は、2型糖尿病でない妊婦における妊娠糖尿病(GDM)の徴候の特徴である。この症状は、妊娠高血圧腎症、帝王切開分娩のリスク上昇、およびメタボリック症候群や2型糖尿病の生涯を通じてのリスク上昇を含む深刻な母体への悪影響と関連している。GDMは、生まれた子供の胎児性巨大児(過剰出生体重)、新生児低血糖症、新生児呼吸窮迫症候群、および生涯を通じての肥満、耐糖能異常、2型糖尿病、および心血管疾患のリスク上昇を含むリスクの上昇に寄与しているかもしれない((250)の文献でレビュー)。
655人の妊婦に対する最近の前向き研究で、GDMを発症した54人の女性はそれ以外の者に比べて、妊娠第一期に平均血清25-ヒドロキシビタミンD濃度がかなり低かった(23ng/mL対25.4ng/mL)ことがわかった。ビタミンDの状態とGDMのリスク(体重過多/肥満および2型糖尿病やGDMの前病歴を含む)の交絡因子に対する複数の補正を行った後、妊娠初期に血清25-ヒドロキシビタミンD濃度が7.5ng/mL減少するごとに、GDM発症リスクが48%高くなるという関連があることがこの研究でわかった(251)。118人のGDMの妊婦と219人の同等な対照群の被験者によるコホート内症例対照研究で、妊娠第二期に血清25-ヒドロキシビタミンD濃度が低い(29.4ng/mL未満)ことはGDMの発症と関連があった(252)。中等~上質の観察研究を含む5つのメタ解析(248, 253~256)でも、異なる血清25-ヒドロキシビタミンD濃度測定方法が使用されていたり、異なる妊娠期に濃度測定されていたり、GDMの評価の基準が異なるなどの研究の偏りのエビデンスはあったものの、妊娠中の母体の血清ビタミンD濃度はGDMの発症リスクと逆相関していたと報告された((257)の文献でレビュー)。
さらに、妊娠中のグルコース(=ブドウ糖)調整におけるビタミンDの役割のエビデンスが、GDMと診断された54人の妊婦に対する小規模無作為化二重盲検プラセボ対照試験で報告された。6週間に2回(第1日目と第21日目)50,000 IUのビタミンD3を補給したら、プラセボに比べて空腹時血糖値および血清インスリン濃度が有意に低くなり、インスリン抵抗性が減り、インスリン感受性が改善した(258)。これは、ビタミンD欠乏が妊娠中の耐糖能に悪影響を及ぼし、GMDの発症に寄与するかもしれないことを示唆している。今のところ、耐糖能異常やGDMの予防におけるビタミンD補給の潜在的有益性は評価されていない。GDMのリスクのある妊婦(妊娠前BMIが29kg/m2以上)の代謝の状態に対して、ビタミンD補給とライフスタイルのへ介入(健康な食事や運動)の効果を評価する多機関の無作為化対照試験(DALI)がヨーロッパで進行中である(259)。健康な食事と運動が標準治療に比べて妊娠性の体重増加を抑えるのに役立つことが予備的な結果では示唆されているが、これらの生活様式変化は肥満の妊婦のGDMリスクを低くすることはなさそうである(260)。DALI研究でのビタミンD補給の効果に関する結果はまだ発表されていない。
生まれた子供の健康
妊娠中に腸でのカルシウム吸収や骨格からのカルシウム代謝が増えることによって、胎児の骨格へのカルシウムの付加が可能になる。しかし、母親のビタミンDの状態と胎児の骨成長の測定値の関係を調べた観察研究は、一貫した結果になっていない(261,262)。さらに、母親のビタミンD骨粗しょう症研究(MAVIDOS)からの最近のデータでは、妊娠17週未満から出産までの間毎日ビタミンD3(1,000 IU)またはプラセボを無作為化されて補給した母親から生まれた新生児の全身の骨塩量(BMC)には、差がなかったことが示唆された(263)。また、母親が妊娠中にビタミンD強化によって余分にビタミンDを摂取していてもいなくても、10~18歳のデンマークの子供の骨折リスクは同じようなものであった(264)。妊娠中のビタミンD補給は、出産時に新生児のビタミンD欠乏症リスクを効果的に防ぐ(265)ものの、新生児のビタミンD状態がその後の幼児期に骨折リスクに影響するというエビデンスはほとんどない(266)。
いくつかの観察研究で、妊娠中の母親のビタミンDが充分であることと子供の呼吸器症状やアレルギーの発生との関係を支持するやや弱いエビデンスが示された(267)。無作為化対照試験では、妊娠第三期(妊娠第27週から出産まで)の108人の妊婦にビタミンD3を800 IU/日または200,000 IUの急速投与で補給しても、3歳時点でその子供の喘鳴、アレルギー性鼻炎、食物アレルギーの診断、下気道感染症、または湿疹のリスクはプラセボ(N=50)に比べて減らなかったことがわかった(268)。より最近の二重盲検無作為化対照試験で、295人のデンマーク人妊婦に妊娠第22~26週から出産まで2,800 IU/日(70μg/日)のビタミンD3補給をしたら、400 IU/日(10μg/日)のビタミンD3補給(これはデンマークの現在の推奨量である)をした場合(N=286)に比べて、子供が3歳になるまでの間に肺の症状で問題になるエピソードのリスクが17%減ったことがわかった(269)。しかしながら持続性喘鳴、喘息、アレルギーの感作、気道感染症、または湿疹のリスクに関して、治療群と対照群とでは何の差も報告されなかった(269)。喘息、アレルギー性鼻炎、または湿疹の病歴(または配偶者にその病歴)のある777人の米国人妊婦に対するビタミンD出生前喘息低減試験(Vitamin D Antenatal Asthma Reduction Trial)という同様の無作為化二重盲検対照試験で、2,400 IU/日(60μg/日)または400 IU/日(10μg/日)の補給をしても、その子供が3歳時点で喘息や再発性喘鳴を発症するリスクには何の差もなかった(270)。個々の研究で有意性がなかったにも関わらず、これら3つの研究の統合解析では、妊娠中に高用量のビタミンD補給をした母親の子供は低用量の補給をした母親の子供よりも、再発性喘鳴のリスクが19%低いことがわかった(271)。378の母子ペアのコホートでは、妊娠第34週で測定された血清25-ヒドロキシビタミンD濃度が高いと、子供が2歳までに食物アレルギーになるリスクが上昇するという関連があり、妊娠中のビタミンD補給の安全性に関して注意深い評価が必要となっている(272)。
ビタミンDが不十分なことが自己免疫に関連する(「自己免疫疾患」の項参照)ため、妊娠中に母親のビタミンDの状態が良くないことがその子供の自己免疫性糖尿病(インスリン依存性1型糖尿病)のリスク上昇に寄与しているかもしれない。しかし1型糖尿病リスクが遺伝的に高い3,723人の子供を平均で4.3年間追跡した研究の結果、妊娠第三期の母親のビタミンD摂取(食物および/または補給による摂取を食品摂取頻度質問票で評価)は、進行したβ細胞自己免疫や臨床的糖尿病とは関連がなかった(142)。あるコホート内症例対照研究では、1型糖尿病の子供の母親343人と対照群の母親343人の妊娠第三期における血清25-ヒドロキシビタミンDの平均濃度には何の差もなかった(143)。追跡研究では、母親のビタミンDの状態よりもむしろ特定のVDR多型が、子供が1型糖尿病を発症しやすくなることに関連しているかもしれないことが示唆された(273)。別のコホート内症例対照研究(1型糖尿病の子供の母親119人と129人の対照群の母親)では、25-ヒドロキシビタミンD濃度ではなく妊娠第三期のビタミンD結合タンパク質濃度と子供の1型糖尿病リスクとの間に逆相関があることがわかった(274)。現在のところ、妊娠中の母親のビタミンDの状態と子供の自己免疫疾患との間の因果関係は確定していない。
急性呼吸器感染症
200超のウィルスが上気道(URT)によくある感染、つまり風邪を引き起こし、鼻づまりや鼻水、咳、喉の痛み、およびくしゃみといった症状が現れる(275)。第三回米国国民健康栄養調査(NHANES III)への18,883人の参加者(12歳以上)による横断的データの解析で、血清25-ヒドロキシビタミンD濃度と最近の(自己申告による)URT感染(URTI)との間に逆相関が報告された。血液中のビタミンD濃度が30ng/mL以上の場合に比べて、10~29ng/mLの者では24%、10ng/mL未満の者だと36%URTIのリスクが高かった(276)。サブグループの解析で、喘息や慢性閉塞性肺疾患(COPD)の被験者が低い血清25-ヒドロキシビタミンD濃度だと、肺疾患のない者に比べてずっとURTIにかかりやすいと関連付けられた。
322人の健康な成人(18歳以上)に対して行われた無作為化二重盲検プラセボ対照試験では、月々のビタミンD3の服用(初めの2ヶ月は200,000 IUで、その後16ヶ月は100,000 IU)によって、プラセボに比べて介入群では平均の血清25-ヒドロキシビタミンD濃度が大きく上昇(29ng/mLから48ng/mLに変化)したが、URTIの発生が減ることはなかった(277)。また、結腸直腸腺腫の病歴のある2,259人の被験者(45~75歳)によるより大規模な多機関4群臨床試験では、ベースライン時に血清25-ヒドロキシビタミンD濃度が最低レベルの参加者でも、毎日1,000 IUのビタミンD3補給をしても冬またはその他の季節のURTIの症例の数や期間が減ることはなかった(278)。さらに、644人(60~84歳)による無作為化プラセボ対照試験の事後解析では、最長1年間1ヶ月に30,000または60,000 IUのビタミンD3を補給しても、細菌性気道感染に対する抗生物質の処方の割合は大きくは減らなかった。しかし月に60,000 IUの用量では、70歳以上の参加者への抗生物質使用のリスクが47%減ったことが層別解析でわかった(279)。また、妊婦にビタミンD3補給(2,000 IU/日)を出産までの3ヶ月とその後に子供への補給(800 IU/日)を生後6ヶ月まで行ったところ、介入期間後に6~18ヶ月齢の子供の急性呼吸器感染症の数がプラセボに比べて大幅に減った(280)。興味深いことにこれらのデータと追加的な21の試験のデータの統合解析では、試験の不均一性が大きいにもかかわらず、急速投与(毎週、毎月、または3ヶ月ごと)、毎日投与、または急速投与と毎日投与の組み合わせでビタミンD3を摂取すると、URTIの発症が全体で12%減少したことが示唆された(281)。サブグループの解析では、ベースライン血清25-ヒドロキシビタミンD濃度が10ng/mL未満の被験者ではビタミンD3補給によってURTIリスクが42%減ったが、濃度が10ng/mL以上の者には何の予防効果もなかったことがわかった。また急速投与を除いたサブグループの解析で、ベースラインのビタミンDの状態に関わらず毎日および毎週のビタミンD3投与計画がURTIに対して予防的であるようで、急速大量投与(30,000 IU以上)は毎日または毎週の投与に比べて効果がないことがわかった。またURTIに対するビタミンD3補給の効果は、年齢、BMI、喘息やCOPDの持病があること、およびインフルエンザワクチンの状態によっては変化しないようであった(281)。
ニュージーランドでの大規模臨床試験であるビタミンD状態評価研究(ViDA)の結果で、急性呼吸器感染症リスクの低下にビタミンDの急速大量投与は無効であることが確認された(282)。5,110人の年配者(ベースライン時で50~84歳)を対象としたこの二重盲検プラセボ対照試験で、中間値で3.3年間ビタミンD3を初めに200,000 IU/月、その後100,000 IU/月補給しても、急性呼吸器感染症の発症(自己申告による)に関して何の効果(HR, 1.01; 95% CI, 0.94-1.07)もなかった。ビタミンDの状態によるデータの層別化でも、血中ビタミンD濃度が20ng/mL(50nmol/L)以下の参加者には効果無し(HR, 1.08; 95% CI, 0.95-1.23)という同様の結果が見られた(282)。
最近終了したビタミンDとオメガ-3試験(VITAL試験)で、感染症の予防は試験の二次的な結果であるものの、年配者の気道感染症リスクに関する毎日のビタミンD服用(2,000 IU/日)効果に対する追加的なエビデンスが提供されるかもしれない(204,283,284)。
就学前の子供による試験では、2,000 IU/日のビタミンDを少なくとも4ヶ月間補給しても、400 IU/日を少なくとも4ヶ月間補給した場合と比べて、冬季間のURTIの発生率(285)または重症度(286)は低下しなかった。2,000 IU/日の補給で400 IU/日の場合より血清25-ヒドロキシビタミンDの平均濃度は有意に上昇した(48.7ng/mLに対して36.8ng/mL)が、これらの幼児のURTI予防には400 IUの用量で充分であったかもしれない(285)。ベトナムの農村における1,300人の健康な子供と青少年(対照群も介入群もベースライン25-ヒドロキシビタミンD濃度は26ng/mL)を対象にしたプラセボ対照試験で、8ヶ月間ビタミンDを14,000 IU/週補給したところ、インフルエンザでないウィルス性の呼吸器感染症が24%という有意な減少を示したが、インフルエンザAまたはBの発症は減少しなかった(287)。
新型コロナウィルス感染症、COVID-19
新型コロナウィルス感染症のCOVID-19は、重症急性呼吸器症候群コロナウィルス-2(SARS-CoV-2)に感染することによって引き起こされる。このウィルスは2019年後半に中国の武漢において発生し、急速に世界中に広まって全世界的なパンデミックを引き起こしている。咳、発熱、倦怠感、および呼吸困難といったインフルエンザに似た症状だけでなく、その他の多様な症状がCOVID-19の特徴である(CDCやWHOのウェブサイトを参照のこと)。この疾患の影響は広範囲に及び、最も重篤な場合には肺炎や呼吸困難、および死亡といった結果になる。しかしSARS-CoV-2に感染しても無症状のままで、他者をウィルス感染させてしまう可能性のある者もいる(288)。さらに、SARS-CoV-2に感染した者は症状が現れる前にこの疾病を拡散してしまう(発症前感染)可能性があり(289)、手洗い、マスク着用、ソーシャルディスタンスの確保、および検査や接触者追跡といった公衆衛生対策がこのパンデミックを抑えていくために重要である。
いくつかの観察研究でビタミンDの栄養状態とCOVID-19発生との相関が調べられ、全部(290-292)ではないがその大部分で、ビタミンDの欠乏または不足がSARS-CoV-2の感染リスク上昇と関連しているとわかった。2020年春の3ヶ月間にSARS-CoV-2検査を受けた191,000人超の米国在住者を調べた後ろ向きコホート研究で、ウィルス検査以前の12ヶ月以内のある一時点で測定された血清25-ヒドロキシビタミンD濃度が低めであることが、SARS-CoV-2検査での陽性結果と強く相関していた(293)。この研究では、血清25-ヒドロキシビタミンD濃度が1ng/mL上がるごとにSARS-CoV-2の陽性リスクが1.6%下がるという関連があり、血清濃度が55ng/mL以上でリスクが最も低くなっていた(293)。イスラエルにおける782人のSARS-CoV-2陽性者を含む7,807人の集団ベース後ろ向き研究で、血漿25-ヒドロキシビタミンD濃度が30ng/mL未満だと、それ以上のビタミンD濃度の場合に比べてSARS-CoV-2感染のリスクが50%高いという関連があった(294)。この研究ではビタミンDの状態評価がウィルス検査の前に行われたが、その時間枠に関する詳細情報は不足している。ビタミンDの栄養状態測定値とCOVID診断検査の時間的な関係は英国バイオバンク(UK Biobank)の大規模データ分析でも懸念であり、この分析ではSARS-CoV-2感染とビタミンDの状態には関連がないとなっている。この研究においては、COVID-19診断検査の10~14年前に行われたビタミンDの状態評価が使用された(291)。小規模後ろ向きコホート研究(295)と5つの症例対照研究(296-300)では、ビタミンDの状態とSARS-CoV-2感染との逆相関が報告されており、これは現在までのほとんどの研究結果と一致している。361,934人が参加した10の観察研究の2021年のメタ解析では、ビタミンD不足または欠乏とCOVID-19リスクの上昇との関連(OR, 1.43; 95% CI: 1.00-2.05)が報告されたが、それぞれの研究ごとの異種性が高い(301)。また英国バイオバンクのデータの解析では、ビタミンDのサプリメントを定期的に服用していると、服用していない者に比べてSARS-CoV-2感染リスクが34%低いという関連が見られた(292)。
さらに、入院の必要性や集中治療室への入室(302)」、肺炎のステージ(男性のみで女性はない;(303))、非侵襲的換気の必要性(304)、侵襲的機械的換気の必要性(305)、またはこれらやその他の指標の組み合わせ(297)によって測定されたCOVID-19の重篤リスクの上昇とビタミンD欠乏症との関連がわかり、ビタミンDの栄養状態が悪いこととCOVID-19の重篤度の関連が観察研究の大部分で示唆された。別の研究では、血漿25-ヒドロキシビタミンD濃度が30ng/mL未満と定義されるビタミンD不足とCOVID関連の入院可能性の上昇との相関がわかったが、50歳超の者のサブ解析(OR, 2.71; 95% CI 1.55-4.78; p<0.001)以外ではこの相関は統計的に有意になっていない(p=0.061)(294)。今日までの大部分のエビデンスと対照的に、ある症例対照研究ではビタミンD欠乏症はCOVID-19の重篤度と関連がないとわかった(298)。また、いくつかの研究でビタミンDの状態とCOVID-19の死亡率の関係が調べられ、そのうちの3つでビタミンD欠乏症が死亡リスクの上昇と関連しているとわかった(303, 305, 306)。残りの2つでは何の関連も見つからなかった(304, 307)が、そのうちの1つはCOVID-19診断検査の10年以上も前のビタミンDの測定値を使用していた(307)。
高齢、肥満、および2型糖尿病や心血管疾患の持病など、COVID-19重篤化リスク要因はいくつか知られている(308)ため、観察研究では潜在的交絡因子をコントロールすることが重要である。2つの準実験的研究では、SARS-CoV-2感染の前または間にビタミンD3を大量補給(50,000 IU/月、または80,000~100,000 IUを2~3ヶ月ごと)することによって、脆弱な年配のCOVID-19患者の重症度低下や生存率向上に関連があったと報告されている(309, 310)。COVID-19予防や治療にビタミンD補給をする無作為化対照試験がいくつか進行中であり、これらの結果でこの関連の因果関係に関する情報が得られるであろう。とはいえ現在のデータは、ビタミンDの状態を補給で改善することによってCOVID-19リスク要因を変えられることを示している。
疾病治療
アトピー性皮膚炎
アトピー性皮膚炎やアトピー性湿疹は先進国で特に広がっており、10~20%の子供および1~3%の成人が罹っている。アトピー性皮膚炎は、罹患すると皮膚が乾いて痒みのあることが特徴的な慢性炎症性皮膚疾患である。局所的な皮膚の炎症や免疫機能不全は、罹患者の表皮バリアを損なって皮膚感染やアトピー性反応を起こしやすくする可能性がある。この疾患はしばしば、食物アレルギー、喘息、およびアレルギー性鼻炎などのその他のアトピー性疾患を伴う(311)。
この疾病の病因は充分によくわかっていないが、ビタミンD欠乏がこの疾病の発症および/または重篤度に寄与しているかもしれないことが示唆されている(312)。英国バイオバンクの資料、(313)、SUNLIGHTコンソーシアム(35)、GABRIEL asthmaコンソーシアム(314)、EAGLE eczemaコンソーシアム(315)などのヨーロッパ系白人の大規模データを用いて、遺伝的に血清25-ヒドロキシビタミンD濃度が低いこととアトピー性皮膚炎、喘息、または血清イムノグロブリン(Ig)-E濃度が高いこととの間に何の関連もないことが最近のメンデルランダム化研究でわかった(316)。
もしかしたら局所的な炎症反応を調整し皮膚の抗菌作用を刺激することで、ビタミンDはこの疾病の治療に有効な付加的手段になるかもしれないのではないかと、いくつかの無作為化対照研究で調べられた。さらに、アトピー性皮膚炎の特定のケースに見られる光療法の有効性にも、ビタミンDの作用が部分的に介在しているかもしれない(311)。アトピー性皮膚炎でビタミンD濃度が低い45人の患者(被験者の70%が血清25-ヒドロキシビタミンD濃度が20ng/mL未満)による小規模無作為化二重盲検プラセボ対照試験で、600 IUのビタミンEと一緒もしくは単体で1,600 IUのビタミンD3を60日間毎日経口投与したら、SCORAD(SCORing Atopic Dermatitis=アトピー性皮膚炎のスコア)によって評価された湿疹の広がりやひどさが有意に低減した(317)。別の小規模無作為化試験でも、ビタミンD3(1,600 IU/日を60日間)はアトピー性皮膚炎の53人の患者のビタミンDの栄養状態を改善し、疾病の重篤度を下げた(318)。より最近では、湿疹面積と重症度指数(EASI)および包括的重症度評価(IGA)のスコア変化で示されたモンゴル人の子供の冬季性アトピー性皮膚炎の重症度が、ビタミンD3(1,000 IU/日を1ヶ月)によって改善した(319)。4つの小規模試験(上記のものを含む)のメタ解析で、ビタミンD補給は罹患者の測定可能な臨床的改善につながる可能性があると結論づけられた(320)。これらの予備的結果を支持し最も適切で効果的な補給計画を決定するための大規模試験が必要である。注記したいのは、ビタミンD類似体による乾癬の局所的治療が米国食品医薬品局(FDA)によって承認され、これはその他の皮膚病の治療でも有効であるかもしれないことだ(321)。
炎症性腸疾患
いくつかの原因不明の環境および遺伝的要因は、潰瘍性大腸炎(UC)およびクローン病(CD)を引き起こす腸内細菌叢に対する不適切な免疫反応が起こることに寄与すると考えられている。特定のVDR多型が、UCやCDを発症しやすくなることに関連しているかもしれない(322)。一方で、72,719人の女性の大規模コホートでは、ビタミンD摂取が多く血液中の濃度が高いと考えられると、UCやCDの発生が減るという関連がわかった(323)。6つの観察研究のメタ解析で、ビタミンDの状態とCDの重症度の逆相関がわかった(324)。3つの研究で、おそらく腸の炎症を抑えることでビタミンD3がCDの患者に有益となるかどうかを調べた。多機関による1つの二重盲検プラセボ対照研究で、1年間の治療後に寛解状態にあるCD患者の再発率は、毎日1,200 IUのビタミンD3と1,200mgのカルシウムを補給した者の方が、カルシウムのみを補給した者に比べて有意に低かった(13%対29%)(325)。もう一つの予備的研究では、18人のCD患者に1,000から5,000 IUまで用量を増やしながら24週間毎日ビタミンD3を投与して、血液中の25-ヒドロキシビタミンD濃度が40ng/mL超になるようにした。患者の半分は40ng/mLには至らなかったが、平均25-ヒドロキシビタミンD濃度は(ベースラインの平均16ng/mLから)45ng/mLまで上がり、ビタミンDの状態が全体的に改善したことで、クローン病活動指数(CDAI)のスコアで評価されるこの疾病の重篤度が有意に下がるという関連があった(326)。寛解中の27人の患者に対する3ヶ月の無作為化二重盲検プラセボ対照試験で、ビタミンD3を毎日補給(2,000 IU)したらビタミンDの状態はよくなったが、腸管透過性(腸管壁浸漏)または炎症や疾患活動度の測定値には何の有意な効果もなかった(327)。それでもその研究で、血清25-ヒドロキシビタミンD濃度が30 ng/mL以上になることが腸の炎症を減らして患者の生活の質を上げることに役立つかもしれないことが示唆された。炎症性腸疾患におけるビタミンDの治療的有効性を確定するさらなる研究が必要である。
心血管疾患
Intermountain Heart Collaborative study(=インターマウンテン心臓共同研究)における41,504の電子医療記録の前向き解析で、患者の3分の1しか適切な血清25-ヒドロキシビタミンD濃度(30ng/mL超)になっていなかったことがわかった。ビタミンD不足(血清25-ヒドロキシビタミンD濃度が30ng/mL以下)は、高血圧、冠動脈疾患、心不全、および脳卒中などの多くの心血管的病状の発生や蔓延に関連していた(328)。最適以下のビタミンD状態は、高血圧の発生や心血管的な有害事象の強力な決定因子である動脈壁硬化や血管内皮障害に関連付けられてきた(329)。
高血圧
いくつかの介入試験で、血圧に対するビタミンD補給の効果が評価されてきた。オランダに住み軽度の高血圧だが治療を受けていない18名の男女による初期の対照臨床試験で、冬に6週間毎週3回紫外線B波に当たると、血清25-ヒドロキシビタミンD濃度が162%上昇し、PTH濃度が15%下がり、24時間自由行動下の収縮期(=最高)および拡張期(=最低)血圧値が平均で6mmHg下がったことがわかった(330)。健康または心臓代謝の既存症状(高血圧を含む)のある1,879人の参加者による16の無作為化対照試験の最近のメタ解析で、ビタミンD補給(800~8,571 IU/日を5週間から1年間)をしても最高および最低血圧値が大きく下がることはなかった。しかし、6つの試験のサブグループ解析で、既存症状のある者の最低血圧値が有意に1.31mmHg下がったことがわかった。ビタミンD不足/欠乏の場合には血圧の改善が期待できても、参加者の最適以下のビタミンD濃度は心臓代謝の症状のある者にのみ観察されるのではないことに、著者らは留意している(331)。対照的に、Styrian vitamin D hypertension trial(=スティリアのビタミンD高血圧試験)(332)およびDAYLIGHT(=高血圧リスクの高い者へのビタミンD療法試験)(333)という最近の2つの介入試験で、(前)高血圧症の被験者にビタミンD3補給(400~4,000 IU/日を2~6ヶ月)しても、ベースラインのビタミンDの状態(IOMの現在のカットオフ値で不足または適切)に関わらず血圧低下のエビデンスは示されなかった。
皮膚の色が濃い、温帯気候の緯度に住んでいる、および加齢などの皮膚でのビタミンD合成を減らす条件は高血圧の罹患率の上昇と関連があり(334)、このことはビタミンDが特定の集団の血圧を下げるかもしれないことを示唆している。上記のメタ解析で、ある4群二重盲検プラセボ対照試験が283人のアフリカ系アメリカ人に対して行われ、彼らは無作為に分けられて日に1,000 IU、2,000 IU、または4,000 IUのビタミンD3補給を3ヶ月間受けた。ベースライン値に比べて最高血圧は1,000 IU/日、2,000 IU/日、および4,000 IU/日の群でそれぞれ0.66mmHg、3.4mmHg、および4mmHg下がったのに対して、プラセボ群では1.7mmHg上がった。25-ヒドロキシビタミンD濃度が1ng/mL上がるごとに、最高血圧値が有意に0.2mmHg下がることが発見された。しかし、ビタミンD3とプラセボとでは3ヶ月の血圧変化に何の統計的な差もなかった(335)。150人の年配者(平均年齢77歳)を対象にした別の無作為化プラセボ対照試験では、3ヶ月ごとに100,000 IUのビタミンD3補給を1年間しても、プラセボに比べて血圧は大きく下がらなかった(336)。
ビタミンD補給が高血圧の予防や管理に役立つのかどうかを決定するさらなる研究が必要である。
うっ血性心不全
うっ血性心不全(心機能不全)は、脈拍が上がりその後に左心室肥大になることが特徴である。心不全は、心エコー検査(=心臓超音波検査)で評価される左室駆出率(LVEF)の減少を伴う。心不全の患者には現在、アンジオテンシン変換酵素(ACE)阻害薬(「血圧調整」の項参照)が第一選択治療薬として使用される。冠動脈造影を受けた健康な患者に対する横断研究で、血清25-ヒドロキシビタミンD濃度が30ng/mL未満だと、冠血流量率が悪いという関連があった(337)。ビタミンD濃度が最適以下だと、心不全の患者の予後がよくないこととも関連があった(338)。過去数年間のいくつかの介入研究で、心不全の者へのビタミンD補給の効果が調べられた。12週間の無作為化二重盲検プラセボ対照研究では、慢性うっ血性心不全の子供に毎日1,200 IUのビタミンD3を補給したら、ビタミンDの状態が大幅に良くなり、心筋の働きも改善(LVEFが高くなる)し、PTHや炎症性サイトカインの濃度も低くなった(339)。心不全を患う64人の年配の患者による別の無作為化二重盲検プラセボ対照試験では、800mg/日のカルシウムと50,000 IU/週のビタミンD3を摂取した参加者は、カルシウムだけ補給した者と比べても、体力成績(有酸素能力や骨格筋強度の評価の代替指標として使用される)が大幅に良いということはなかった(340)。心不全の573人の被験者に対する7つの小規模無作為化プラセボ対照試験の最近のメタ解析で、ビタミンD補給(1,000 IU/日~50,000 IU/週)を6週間~9ヶ月したら血清中のPTH、腫瘍壊死因子-α(TNF-α)、およびC-反応性タンパク質(CRP)の濃度が下がった。しかしビタミンDで治療をした患者とプラセボを摂取した患者とでは、LVEF、血中インターロイキン-10(IL-10)濃度およびレニン濃度に有意な差はなかった(341)。また、末期心不全でビタミンD濃度が不適切(ベースライン血清25-ヒドロキシビタミンD濃度が8.6~19.7ng/mL)な患者に対するEVITA(=総死亡率に対するビタミンDの効果)試験で、4,000 IU/日のビタミンD補給を3年間しても、プラセボに比べて死亡リスクは下がらなかった(342)。
摂取源
日光
日光に含まれる紫外線B波(UVB;波長290~315ナノメートル)は、皮膚の表皮でのビタミンD3の生成を刺激する(343)。日光にあたることで、大部分の人のビタミンD必要量全部がまかなえる。屋外で週に2~3回短時間すごす子供や若い成人は一般的に、ビタミンD欠乏症を防ぐのに必要なすべてのビタミンDを合成することになる。ある研究で、模擬太陽光に最小紅斑量(肌が若干赤くなるのに必要な量)だけ全身を当てた後の血清ビタミンD濃度は、ビタミンDを約10,000~25,000 IU摂取した時と同じであった(344)。肌の色が濃い者は肌の色が明るい者に比べて、日光に当たってもビタミンD合成が顕著に少ない(34)。さらに、年配者は日光に当ってもビタミンDを合成する能力が下がっている上に、皮膚がんや肌の損傷を防ぐために頻繁に日焼け止めを使ったり肌を覆ったりする。SPF値が10の日焼け止めを塗ると、ビタミンD合成が90%も減る(30)。北緯および南緯40度くらい(マサチューセッツ州ボストンは北緯42度)では、11月から3月初旬までビタミンD合成に必要なUVB量が不十分である。さらに10度北または南(たとえばカナダのエドモントン)では、「ビタミンD不足の冬」は10月中旬から3月中旬まで延びる。緯度が25度(フロリダ州マイアミ)では年間を通して、緯度42度(ボストン)では春、夏、および秋に、12時ころに手、腕、および顔に日光を毎日15分まで浴びると、肌の色が明るい者はビタミンDが1,000 IU生成されるかもしれない(345)。
食品の摂取源
ビタミンDは天然にはいくつかの食品にしか入っておらず、それには油ののった魚(サバ、サケ、イワシ)、肝油、およびビタミンDを餌に混ぜて育てられた鶏の卵、および日光または紫外線にさらされたきのこなどがある。米国では牛乳と粉ミルクがビタミンD強化されており、1リットル弱に400 IU(10μg)入っている。しかし、チーズやヨーグルトなどのその他の乳製品は、常にビタミンD強化されているとは限らない。シリアル、パン、およびフルーツジュースもビタミンD強化されている可能性がある。強化食品のビタミンD含有量の変異が大きいので、ビタミンDの食事からの平均摂取量を正確に推定するのは難しい(346)。下の表2にビタミンDが豊富ないくつかの食品のビタミンD含有量(ビタミンD2とビタミンD3の合計)を国際単位(IU)とマイクログラム(μg)で示す。特定の食品の栄養素含有量についての詳細は、USDA(=米国農務省)のFoodData Centralを検索のこと。25-ヒドロキシビタミンD代謝物も低濃度で特定の食物に含まれ、それらには肉、乳製品、および卵などがある(347,348)。
| 食品 | 分量 | ビタミンD(IU) | ビタミンD(μg) |
|---|---|---|---|
| 缶詰のカラフトマス(ピンクサーモン) | 85g | 465 | 11.6 |
| 詰のサバ(骨なし) | 85g | 248 | 6.2 |
| 缶詰のイワシ | 85g | 164 | 4.1 |
| 低脂肪(1%)ビタミンD強化牛乳 | 1カップ強 | 108 | 2.7 |
| ビタミンD強化オレンジジュース | 1カップ強 | 100 | 2.5 |
| 強化シリアル |
1食分(通常1カップ強) |
40~50 | 1.0~1.3 |
| 卵黄 | 大1 | 37 | 0.9 |
サプリメント
処方箋なしで入手可能な大部分のビタミンDサプリメントは、コレカルシフェロール(ビタミンD3)を含んでいる。マルチビタミンのサプリメントは一般的に、400 IU~1,000 IU(10μg~25μg)のビタミンD2またはD3を含む。ビタミンD単一成分サプリメントは400~50,000 IUのビタミンD3を含むかもしれないが、400 IUが最も一般的な用量である(66)。多くのカルシウムサプリメントもビタミンDを含んでいることがある。ビタミンD2(エルゴカルシフェロール)の急速投与量では血清25-ヒドロキシビタミンD濃度を上げるのにビタミンD3ほど常に有効ではないかもしれないことが無作為化対照試験のメタ解析で示唆されたが、毎日補給の効能にはビタミンD2とビタミンD3の差は見られなかった(349)。ただしある25週間の無作為化二重盲検プラセボ対照試験では、夏の終わりに毎日1,000 IUのビタミンD3補給を開始すると、夏の時点の25-ヒドロキシビタミンD濃度を秋や冬も維持する効能がビタミンD2よりも高かったことがわかった(350)。
コレカルシフェロールのヒドロキシ化された形態である25-ヒドロキシビタミンD3(カルシジオール;カルシフェジオール)をサプリメントとして使用することに関心が高まっている。このビタミンD代謝物は皮膚で生成されたり食事で摂取されたりしたコレカルシフェロールからヒトや動物の肝臓で合成され、いくつかの食物(肉、牛乳、卵など)にも低濃度で含まれている(347,348)。一般的にカルシフェジオールの方が、同量のコレカルシフェロールを補給するよりも血中25-ヒドロキシビタミンD濃度の上昇に2~5倍効能があることが、臨床研究でわかっている(351~359)。したがってカルシフェジオール補給はコレカルシフェロールよりも低用量でビタミンDの状態を急速かつ一貫して改善するための手段である可能性があり、コレカルシフェロールの腸での吸収が減るような症状の者には有益であるかもしれない(359)。しかしながら25-ヒドロキシビタミンD3の形態は、現在米国では店頭で購入可能なサプリメントではない。
安全性
毒性
ビタミンDの毒性(ビタミンD過剰症)で、日光にあたることによって発生したものは観察されていない。これは、過剰な日光浴が7-デヒドロコレステロールやコレカルシフェロールから生物学的に不活性ないくつかの光反応生成物を発生させるからである(3)。ビタミンDの毒性で異常に高い血清カルシウム濃度(高カルシウム血症)になることがあり、これは長期間治療しないでいると骨量減少、腎臓結石、および心臓や腎臓といった臓器の石灰化に至る可能性がある。高カルシウム血症は、日に50,000 IU超のビタミンDを摂取した後に見られる(360)。全体的に、10,000 IU/日未満の摂取量なら、ビタミンDによる毒性は健康な者ではとても少ないことが研究で示唆されている(361~363)。しかし、米国医学研究所の食品栄養委員会は許容上限摂取量(UL)をすべての成人に対して4,000 IU/日(100μg/日)に設定した(表3参照)。原発性副甲状腺機能亢進症、サルコイドーシス、結核、およびリンパ腫などの特定の病状は、ビタミンDに反応して高カルシウム血症のリスクを高めることがある(361)。これらの病状の者はビタミンDのいかなる増加にも反応して高カルシウム血症になるかもしれず、ビタミンD摂取の増加に関して有識の医療従事者に相談すべきである。
| 年齢 | μg/日 | IU/日 |
|---|---|---|
| 乳児 0-6ヶ月 | 25 | 1,000 |
| 乳児 6-12ヶ月 | 37.5 | 1,500 |
| 幼児 1-3歳 | 62.5 | 2,500 |
| 子供 4-8歳 | 75 | 3,000 |
| 子供 9-13歳 | 100 | 4,000 |
| 青少年 14-18歳 | 100 | 4,000 |
| 成人 19歳以上 | 100 | 4,000 |
薬物相互作用
以下の薬物は腸でのビタミンDの吸収を減らす可能性があるので、ビタミンDと同時に摂取すべきでない:コレスチラミン(クエストラン)、コレスチポール(コレスチッド)、オルリスタット(ゼニカル)、および鉱物油(364,365)。以下の薬物はビタミンDの代謝を上げて血清25-ヒドロキシビタミンD濃度を減らすかもしれない:フェニトイン(ジランチン)、フォスフェニトイン(セレビクス)、フェノバルビタール(ルミナール)、カルバマゼピン(テグレトール)、およびリファンピン(リマクタン)(6)。胃酸の分泌を抑えるH2ブロッカーであるシメチジンは、肝臓でのビタミンDのヒドロキシル化を阻害する(366)。呑酸、胃食道逆流疾患(GERD)、または胃潰瘍をプロトンポンプ阻害薬(オメプラゾール、ランソプラゾール)で治療することは、カルシウムの吸収に支障をきたして骨折リスクを高めるかもしれないので、患者にはカルシウムとビタミンDのサプリメントの摂取が勧められる(367)。経口抗真菌薬のケトコナゾールは25-ヒドロキシビタミンD3-1α-ヒドロキシラーゼ酵素を抑制し、健康な男性の血清1α,25-ジヒドロキシビタミンD濃度を減らすことがわかっている(368)。米国内分泌学会は、糖質コルチコイドやHIVの治療薬を服用している患者のビタミンD状態を監視することも勧めている。これらの薬物は25-ヒドロキシビタミンDの異化を増進させるからである(40)。細胞増殖抑制剤の中には、化学療法中のがん患者の25-ヒドロキシビタミンDおよび1α,25-ジヒドロキシビタミンDの分解を増進するものがある(6)。ビタミンDを有害なレベルまで服用して高カルシウム血症になると、ジゴキシン(ラノキシン)を服用している患者の不整脈を促進するかもしれない(366)。高カルシウム血症はまた、心房細動におけるベラパミル(カラン)およびジルチアゼム(カルディゼム)の効果を低減させる可能性がある(366)。
ライナス・ポーリング研究所の推奨
ライナス・ポーリング研究所は、概して健康な成人が毎日2,000 IU(50μg)のビタミンD補給をすることを推奨する。大部分のマルチビタミン剤は400 IU(10μg)のビタミンDを含んでおり、ビタミンD単一成分のサプリメントも追加的に利用できる。日光浴、食事、肌の色、および肥満度指数(BMI)が、体のビタミンD濃度に変動的かつ実質的に影響する。個人差を調整し適切なビタミンDの状態を確保するために、ライナス・ポーリング研究所は血清25-ヒドロキシビタミンD濃度として少なくとも30ng/mL(75nmol/L)を目標にすることを推奨する。血清25-ヒドロキシビタミンビタミンD濃度が30ng/mL~60ng/mLだと、がんや自己免疫疾患などの健康への悪影響のリスクが低いという関連が観察研究で示唆されている。
米国小児科学会は現在、すべての幼児、子供、および青少年が毎日400 IUのビタミンD補給を受けることを提唱している(19)。米国内分泌学会の推奨(40)と同様に、乳児は400~1,000 IU(10~25μg)のビタミンDを、子どもや青少年では600~1,000 IU(15~25μg)のビタミンDを毎日摂取することをライナス・ポーリング研究所は推奨する。母乳、粉ミルク、および子供や青少年の食事の平均的ビタミンD含有量であれば、これらの推奨値を達成するのにビタミンD補給が必要かもしれない。
年配者(50歳超)
年配者には毎日2,000 IU(50μg)のビタミンD補給が特に重要で、これは加齢によって日光に当たっても皮膚でビタミンDを合成する能力が下がるという関連があるからである。
Authors and Reviewers
Originally written in 2000 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in March 2003 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in March 2004 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in January 2008 by:
Victoria J. Drake, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in July 2014 by:
Barbara Delage, Ph.D.
Linus Pauling Institute
Oregon State University
The 2014 update of this article was supported by a grant from Bayer Consumer Care AG, Basel, Switzerland.
Updated in July 2017 by:
Barbara Delage, Ph.D.
Linus Pauling Institute
Oregon State University
Reviewed in October 2017 by:
Adrian F. Gombart, Ph.D.
Principal Investigator, Linus Pauling Institute
Associate Professor, Department of Biochemistry and Biophysics
Oregon State University
The 2017 update of this article was supported by a grant from Pfizer Inc.
Last updated 2/11/21 Copyright 2000-2024 Linus Pauling Institute
References
1. Holick MF. Vitamin D: importance in the prevention of cancers, type 1 diabetes, heart disease, and osteoporosis. Am J Clin Nutr. 2004;79(3):362-371. (PubMed)
2. Bikle DD. Vitamin D metabolism, mechanism of action, and clinical applications. Chem Biol. 2014;21(3):319-329. (PubMed)
3. Volmer DA, Mendes LR, Stokes CS. Analysis of vitamin D metabolic markers by mass spectrometry: Current techniques, limitations of the "gold standard" method, and anticipated future directions. Mass Spectrom Rev. 2015;34(1):2-23. (PubMed)
4. Holick MF. Vitamin D: A millenium perspective. J Cell Biochem. 2003;88(2):296-307. (PubMed)
5. Sutton AL, MacDonald PN. Vitamin D: more than a "bone-a-fide" hormone. Mol Endocrinol. 2003;17(5):777-791. (PubMed)
6. Grober U, Spitz J, Reichrath J, Kisters K, Holick MF. Vitamin D: Update 2013: From rickets prophylaxis to general preventive healthcare. Dermatoendocrinol. 2013;5(3):331-347. (PubMed)
7. Lieben L, Carmeliet G. The delicate balance between vitamin D, calcium and bone homeostasis: lessons learned from intestinal- and osteocyte-specific VDR null mice. J Steroid Biochem Mol Biol. 2013;136:102-106. (PubMed)
8. Fukumoto S. Phosphate metabolism and vitamin D. Bonekey Rep. 2014;3:497. (PubMed)
9. Lin R, White JH. The pleiotropic actions of vitamin D. Bioessays. 2004;26(1):21-28. (PubMed)
10. Edfeldt K, Liu PT, Chun R, et al. T-cell cytokines differentially control human monocyte antimicrobial responses by regulating vitamin D metabolism. Proc Natl Acad Sci U S A. 2010;107(52):22593-22598. (PubMed)
11. Smolders J, Thewissen M, Damoiseaux J. Control of T cell activation by vitamin D. Nat Immunol. 2011;12(1):3; author reply 3-4. (PubMed)
12. Aranow C. Vitamin D and the immune system. J Investig Med. 2011;59(6):881-886. (PubMed)
13. Zeitz U, Weber K, Soegiarto DW, Wolf E, Balling R, Erben RG. Impaired insulin secretory capacity in mice lacking a functional vitamin D receptor. Faseb J. 2003;17(3):509-511. (PubMed)
14. Bourlon PM, Billaudel B, Faure-Dussert A. Influence of vitamin D3 deficiency and 1,25 dihydroxyvitamin D3 on de novo insulin biosynthesis in the islets of the rat endocrine pancreas. J Endocrinol. 1999;160(1):87-95. (PubMed)
15. Heer M, Egert S. Nutrients other than carbohydrates: their effects on glucose homeostasis in humans. Diabetes Metab Res Rev. 2015;31(1):14-35. (PubMed)
16. Sheng H-W. Sodium, chloride, and potassium. In: Stipanuk M, ed. Biochemical and Physiological Aspects of Human Nutrition. Philadelphia: W.B. Saunders Company; 2000:686-710.
17. Sigmund CD. Regulation of renin expression and blood pressure by vitamin D(3). J Clin Invest. 2002;110(2):155-156. (PubMed)
18. Li YC, Kong J, Wei M, Chen ZF, Liu SQ, Cao LP. 1,25-Dihydroxyvitamin D(3) is a negative endocrine regulator of the renin-angiotensin system. J Clin Invest. 2002;110(2):229-238. (PubMed)
19. Wagner CL, Greer FR, American Academy of Pediatrics Section on B, American Academy of Pediatrics Committee on N. Prevention of rickets and vitamin D deficiency in infants, children, and adolescents. Pediatrics. 2008;122(5):1142-1152. (PubMed)
20. Goldacre M, Hall N, Yeates DG. Hospitalisation for children with rickets in England: a historical perspective. Lancet. 2014;383(9917):597-598. (PubMed)
21. Jones AN, Hansen KE. Recognizing the musculoskeletal manifestations of vitamin D deficiency. J Musculoskelet Med. 2009;26(10):389-396. (PubMed)
22. Bringhurst FR, Demay MB, Kronenberg HM. Mineral Metabolism. In: Larson PR, Kronenberg HM, Melmed S, Polonsky KS, eds. Williams Textbook of Endocrinology. 10th ed. Philadelphia: Saunders Book Company; 2003:1317-1320.
23. Plotnikoff GA, Quigley JM. Prevalence of severe hypovitaminosis D in patients with persistent, nonspecific musculoskeletal pain. Mayo Clin Proc. 2003;78(12):1463-1470. (PubMed)
24. Deandrea S, Lucenteforte E, Bravi F, Foschi R, La Vecchia C, Negri E. Risk factors for falls in community-dwelling older people: a systematic review and meta-analysis. Epidemiology. 2010;21(5):658-668. (PubMed)
25. Al-Khalidi B, Kimball SM, Rotondi MA, Ardern CI. Standardized serum 25-hydroxyvitamin D concentrations are inversely associated with cardiometabolic disease in US adults: a cross-sectional analysis of NHANES, 2001-2010. Nutr J. 2017;16(1):16. (PubMed)
26. Cooper JD, Smyth DJ, Walker NM, et al. Inherited variation in vitamin D genes is associated with predisposition to autoimmune disease type 1 diabetes. Diabetes. 2011;60(5):1624-1631. (PubMed)
27. Webb AR, Kline L, Holick MF. Influence of season and latitude on the cutaneous synthesis of vitamin D3: exposure to winter sunlight in Boston and Edmonton will not promote vitamin D3 synthesis in human skin. J Clin Endocrinol Metab. 1988;67(2):373-378. (PubMed)
28. Nichols EK, Khatib IM, Aburto NJ, et al. Vitamin D status and determinants of deficiency among non-pregnant Jordanian women of reproductive age. Eur J Clin Nutr. 2012;66(6):751-756. (PubMed)
29. Bassil D, Rahme M, Hoteit M, Fuleihan Gel H. Hypovitaminosis D in the Middle East and North Africa: prevalence, risk factors and impact on outcomes. Dermatoendocrinol. 2013;5(2):274-298. (PubMed)
30. Balk SJ, Council on Environmental H, Section on D. Ultraviolet radiation: a hazard to children and adolescents. Pediatrics. 2011;127(3):e791-817. (PubMed)
31. Dawodu A, Tsang RC. Maternal vitamin D status: effect on milk vitamin D content and vitamin D status of breastfeeding infants. Adv Nutr. 2012;3(3):353-361. (PubMed)
32. Thiele DK, Senti JL, Anderson CM. Maternal vitamin D supplementation to meet the needs of the breastfed infant: a systematic review. J Hum Lact. 2013;29(2):163-170. (PubMed)
33. Wharton B, Bishop N. Rickets. Lancet. 2003;362(9393):1389-1400. (PubMed)
34. Chen TC, Chimeh F, Lu Z, et al. Factors that influence the cutaneous synthesis and dietary sources of vitamin D. Arch Biochem Biophys. 2007;460(2):213-217. (PubMed)
35. Wang TJ, Zhang F, Richards JB, et al. Common genetic determinants of vitamin D insufficiency: a genome-wide association study. Lancet. 2010;376(9736):180-188. (PubMed)
36. Ahn J, Yu K, Stolzenberg-Solomon R, et al. Genome-wide association study of circulating vitamin D levels. Hum Mol Genet. 2010;19(13):2739-2745. (PubMed)
37. Wang W, Ingles SA, Torres-Mejia G, et al. Genetic variants and non-genetic factors predict circulating vitamin D levels in Hispanic and non-Hispanic White women: the Breast Cancer Health Disparities Study. Int J Mol Epidemiol Genet. 2014;5(1):31-46. (PubMed)
38. Elkum N, Alkayal F, Noronha F, et al. Vitamin D insufficiency in Arabs and South Asians positively associates with polymorphisms in GC and CYP2R1 genes. PLoS One. 2014;9(11):e113102. (PubMed)
39. Zhang Y, Yang S, Liu Y, Ren L. Relationship between polymorphisms in vitamin D metabolism-related genes and the risk of rickets in Han Chinese children. BMC Med Genet. 2013;14:101. (PubMed)
40. Holick MF, Binkley NC, Bischoff-Ferrari HA, et al. Evaluation, treatment, and prevention of vitamin D deficiency: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab. 2011;96(7):1911-1930. (PubMed)
41. Harris SS, Soteriades E, Coolidge JA, Mudgal S, Dawson-Hughes B. Vitamin D insufficiency and hyperparathyroidism in a low income, multiracial, elderly population. J Clin Endocrinol Metab. 2000;85(11):4125-4130. (PubMed)
42. Allain TJ, Dhesi J. Hypovitaminosis D in older adults. Gerontology. 2003;49(5):273-278. (PubMed)
43. Doorenbos CR, van den Born J, Navis G, de Borst MH. Possible renoprotection by vitamin D in chronic renal disease: beyond mineral metabolism. Nat Rev Nephrol. 2009;5(12):691-700. (PubMed)
44. Pappa HM, Bern E, Kamin D, Grand RJ. Vitamin D status in gastrointestinal and liver disease. Curr Opin Gastroenterol. 2008;24(2):176-183. (PubMed)
45. Jahnsen J, Falch JA, Mowinckel P, Aadland E. Vitamin D status, parathyroid hormone and bone mineral density in patients with inflammatory bowel disease. Scand J Gastroenterol. 2002;37(2):192-199. (PubMed)
46. Arunabh S, Pollack S, Yeh J, Aloia JF. Body fat content and 25-hydroxyvitamin D levels in healthy women. J Clin Endocrinol Metab. 2003;88(1):157-161. (PubMed)
47. Gallagher JC, Yalamanchili V, Smith LM. The effect of vitamin D supplementation on serum 25(OH)D in thin and obese women. J Steroid Biochem Mol Biol. 2013;136:195-200. (PubMed)
48. Deng X, Song Y, Manson JE, et al. Magnesium, vitamin D status and mortality: results from US National Health and Nutrition Examination Survey (NHANES) 2001 to 2006 and NHANES III. BMC Med. 2013;11:187. (PubMed)
49. Sempos CT, Durazo-Arvizu RA, Binkley N, Jones J, Merkel JM, Carter GD. Developing vitamin D dietary guidelines and the lack of 25-hydroxyvitamin D assay standardization: The ever-present past. J Steroid Biochem Mol Biol. 2016;164:115-119. (PubMed)
50. Chapuy MC, Preziosi P, Maamer M, et al. Prevalence of vitamin D insufficiency in an adult normal population. Osteoporos Int. 1997;7(5):439-443. (PubMed)
51. Thomas MK, Lloyd-Jones DM, Thadhani RI, et al. Hypovitaminosis D in medical inpatients. N Engl J Med. 1998;338(12):777-783. (PubMed)
52. Heaney RP, Dowell MS, Hale CA, Bendich A. Calcium absorption varies within the reference range for serum 25-hydroxyvitamin D. J Am Coll Nutr. 2003;22(2):142-146. (PubMed)
53. Valcour A, Blocki F, Hawkins DM, Rao SD. Effects of age and serum 25-OH-vitamin D on serum parathyroid hormone levels. J Clin Endocrinol Metab. 2012;97(11):3989-3995. (PubMed)
54. Ginde AA, Wolfe P, Camargo CA, Jr., Schwartz RS. Defining vitamin D status by secondary hyperparathyroidism in the US population. J Endocrinol Invest. 2012;35(1):42-48. (PubMed)
55. Gallagher JC, Yalamanchili V, Smith LM. The effect of vitamin D on calcium absorption in older women. J Clin Endocrinol Metab. 2012;97(10):3550-3556. (PubMed)
56. Looker AC, Johnson CL, Lacher DA, Pfeiffer CM, Schleicher RL, Sempos CT. Vitamin D status: United States, 2001-2006. NCHS Data Brief. 2011(59):1-8. (PubMed)
57. Food and Nutrition Board, Institute of Medicine. Dietary Reference Intakes for Calcium and Vitamin D. Washington, D.C.: The National Academies Press; 2011. (The National Academies Press)
58. Mithal A, Wahl DA, Bonjour JP, et al. Global vitamin D status and determinants of hypovitaminosis D. Osteoporos Int. 2009;20(11):1807-1820. (PubMed)
59. Powe CE, Evans MK, Wenger J, et al. Vitamin D-binding protein and vitamin D status of black Americans and white Americans. N Engl J Med. 2013;369(21):1991-2000. (PubMed)
60. Durazo-Arvizu RA, Dawson-Hughes B, Kramer H, et al. The reverse J-shaped association between serum total 25-hydroxyvitamin D concentration and all-cause mortality: the impact of assay standardization. Am J Epidemiol. 2017;185(8):720-726. (PubMed)
61. Gaksch M, Jorde R, Grimnes G, et al. Vitamin D and mortality: Individual participant data meta-analysis of standardized 25-hydroxyvitamin D in 26916 individuals from a European consortium. PLoS One. 2017;12(2):e0170791. (PubMed)
62. Chowdhury R, Kunutsor S, Vitezova A, et al. Vitamin D and risk of cause specific death: systematic review and meta-analysis of observational cohort and randomised intervention studies. BMJ. 2014;348:g1903. (PubMed)
63. Gupta V, Walia GK, Sachdeva MP. 'Mendelian randomization': an approach for exploring causal relations in epidemiology. Public Health. 2017;145:113-119. (PubMed)
64. Afzal S, Brondum-Jacobsen P, Bojesen SE, Nordestgaard BG. Genetically low vitamin D concentrations and increased mortality: Mendelian randomisation analysis in three large cohorts. BMJ. 2014;349:g6330. (PubMed)
65. Bjelakovic G, Gluud LL, Nikolova D, et al. Vitamin D supplementation for prevention of mortality in adults. Cochrane Database Syst Rev. 2014(1):Cd007470. (PubMed)
66. Wacker M, Holick MF. Vitamin D - effects on skeletal and extraskeletal health and the need for supplementation. Nutrients. 2013;5(1):111-148. (PubMed)
67. Lips P, Hosking D, Lippuner K, et al. The prevalence of vitamin D inadequacy amongst women with osteoporosis: an international epidemiological investigation. J Intern Med. 2006;260(3):245-254. (PubMed)
68. Torbergsen AC, Watne LO, Wyller TB, et al. Vitamin K1 and 25(OH)D are independently and synergistically associated with a risk for hip fracture in an elderly population: A case control study. Clin Nutr. 2015;34(1):101-106. (PubMed)
69. Lips P, van Schoor NM. The effect of vitamin D on bone and osteoporosis. Best Pract Res Clin Endocrinol Metab. 2011;25(4):585-591. (PubMed)
70. Reid IR, Bolland MJ, Grey A. Effects of vitamin D supplements on bone mineral density: a systematic review and meta-analysis. Lancet. 2014;383(9912):146-155. (PubMed)
71. Rosen CJ. Vitamin D supplementation: bones of contention. Lancet. 2014;383(9912):108-110. (PubMed)
72. Mocanu V, Vieth R. Three-year follow-up of serum 25-hydroxyvitamin D, parathyroid hormone, and bone mineral density in nursing home residents who had received 12 months of daily bread fortification with 125 mug of vitamin D3. Nutr J. 2013;12:137. (PubMed)
73. Feskanich D, Willett WC, Colditz GA. Calcium, vitamin D, milk consumption, and hip fractures: a prospective study among postmenopausal women. Am J Clin Nutr. 2003;77(2):504-511. (PubMed)
74. Jackson RD, LaCroix AZ, Gass M, et al. Calcium plus vitamin D supplementation and the risk of fractures. N Engl J Med. 2006;354(7):669-683. (PubMed)
75. Wang Y, Wactawski-Wende J, Sucheston-Campbell LE, et al. The influence of genetic susceptibility and calcium plus vitamin D supplementation on fracture risk. Am J Clin Nutr. 2017;105(4):970-979. (PubMed)
76. Gurney EP, Nachtigall MJ, Nachtigall LE, Naftolin F. The Women's Health Initiative trial and related studies: 10 years later: a clinician's view. J Steroid Biochem Mol Biol. 2014;142:4-11. (PubMed)
77. Grant AM, Avenell A, Campbell MK, et al. Oral vitamin D3 and calcium for secondary prevention of low-trauma fractures in elderly people (Randomised Evaluation of Calcium Or vitamin D, RECORD): a randomised placebo-controlled trial. Lancet. 2005;365(9471):1621-1628. (PubMed)
78. Bischoff-Ferrari HA, Giovannucci E, Willett WC, Dietrich T, Dawson-Hughes B. Estimation of optimal serum concentrations of 25-hydroxyvitamin D for multiple health outcomes. Am J Clin Nutr. 2006;84(1):18-28. (PubMed)
79. Khaw KT, Stewart AW, Waayer D, et al. Effect of monthly high-dose vitamin D supplementation on falls and non-vertebral fractures: secondary and post-hoc outcomes from the randomised, double-blind, placebo-controlled ViDA trial. Lancet Diabetes Endocrinol. 2017;5(6):438-447. (PubMed)
80. Chung M, Lee J, Terasawa T, Lau J, Trikalinos TA. Vitamin D with or without calcium supplementation for prevention of cancer and fractures: an updated meta-analysis for the US Preventive Services Task Force. Ann Intern Med. 2011;155(12):827-838. (PubMed)
81. Bischoff-Ferrari HA, Willett WC, Orav EJ, et al. A pooled analysis of vitamin D dose requirements for fracture prevention. N Engl J Med. 2012;367(1):40-49. (PubMed)
82. Avenell A, Mak JC, O'Connell D. Vitamin D and vitamin D analogues for preventing fractures in post-menopausal women and older men. Cochrane Database Syst Rev. 2014;4:CD000227. (PubMed)
83. Annweiler C, Beauchet O. Questioning vitamin D status of elderly fallers and nonfallers: a meta-analysis to address a 'forgotten step'. J Intern Med. 2015;277(1):16-44. (PubMed)
84. Cangussu LM, Nahas-Neto J, Orsatti CL, Bueloni-Dias FN, Nahas EA. Effect of vitamin D supplementation alone on muscle function in postmenopausal women: a randomized, double-blind, placebo-controlled clinical trial. Osteoporos Int. 2015;26(10):2413-2421. (PubMed)
85. Cangussu LM, Nahas-Neto J, Orsatti CL, et al. Effect of isolated vitamin D supplementation on the rate of falls and postural balance in postmenopausal women fallers: a randomized, double-blind, placebo-controlled trial. Menopause. 2016;23(3):267-274. (PubMed)
86. Bischoff-Ferrari HA, Dawson-Hughes B, Orav EJ, et al. Monthly high-dose vitamin D treatment for the prevention of functional decline: a randomized clinical trial. JAMA Intern Med. 2016;176(2):175-183. (PubMed)
87. Murad MH, Elamin KB, Abu Elnour NO, et al. Clinical review: The effect of vitamin D on falls: a systematic review and meta-analysis. J Clin Endocrinol Metab. 2011;96(10):2997-3006. (PubMed)
88. Boonen S, Lips P, Bouillon R, Bischoff-Ferrari HA, Vanderschueren D, Haentjens P. Need for additional calcium to reduce the risk of hip fracture with vitamin d supplementation: evidence from a comparative metaanalysis of randomized controlled trials. J Clin Endocrinol Metab. 2007;92(4):1415-1423. (PubMed)
89. Grant WB. Update on evidence that support a role of solar ultraviolet-B irradiance in reducing cancer risk. Anticancer Agents Med Chem. 2013;13(1):140-146. (PubMed)
90. Yin L, Ordonez-Mena JM, Chen T, Schottker B, Arndt V, Brenner H. Circulating 25-hydroxyvitamin D serum concentration and total cancer incidence and mortality: a systematic review and meta-analysis. Prev Med. 2013;57(6):753-764. (PubMed)
91. Gandini S, Gnagnarella P, Serrano D, Pasquali E, Raimondi S. Vitamin D receptor polymorphisms and cancer. Adv Exp Med Biol. 2014;810:69-105. (PubMed)
92. Vaughan-Shaw PG, O'Sullivan F, Farrington SM, et al. The impact of vitamin D pathway genetic variation and circulating 25-hydroxyvitamin D on cancer outcome: systematic review and meta-analysis. Br J Cancer. 2017;116(8):1092-1110. (PubMed)
93. Gombart AF, Luong QT, Koeffler HP. Vitamin D compounds: activity against microbes and cancer. Anticancer Res. 2006;26(4A):2531-2542. (PubMed)
94. Thorne J, Campbell MJ. The vitamin D receptor in cancer. Proc Nutr Soc. 2008;67(2):115-127. (PubMed)
95. Garland CF, Garland FC, Gorham ED. Calcium and vitamin D. Their potential roles in colon and breast cancer prevention. Ann N Y Acad Sci. 1999;889:107-119. (PubMed)
96. Choi YJ, Kim YH, Cho CH, Kim SH, Lee JE. Circulating levels of vitamin D and colorectal adenoma: A case-control study and a meta-analysis. World J Gastroenterol. 2015;21(29):8868-8877. (PubMed)
97. Gandini S, Boniol M, Haukka J, et al. Meta-analysis of observational studies of serum 25-hydroxyvitamin D levels and colorectal, breast and prostate cancer and colorectal adenoma. Int J Cancer. 2011;128(6):1414-1424. (PubMed)
98. Ma Y, Zhang P, Wang F, Yang J, Liu Z, Qin H. Association between vitamin D and risk of colorectal cancer: a systematic review of prospective studies. J Clin Oncol. 2011;29(28):3775-3782. (PubMed)
99. Touvier M, Chan DS, Lau R, et al. Meta-analyses of vitamin D intake, 25-hydroxyvitamin D status, vitamin D receptor polymorphisms, and colorectal cancer risk. Cancer Epidemiol Biomarkers Prev. 2011;20(5):1003-1016. (PubMed)
100. Ekmekcioglu C, Haluza D, Kundi M. 25-Hydroxyvitamin D status and risk for colorectal cancer and type 2 diabetes mellitus: a systematic review and meta-analysis of epidemiological studies. Int J Environ Res Public Health. 2017;14(2). (PubMed)
101. Gorham ED, Garland CF, Garland FC, et al. Optimal vitamin D status for colorectal cancer prevention: a quantitative meta analysis. Am J Prev Med. 2007;32(3):210-216. (PubMed)
102. Cauley JA, Chlebowski RT, Wactawski-Wende J, et al. Calcium plus vitamin D supplementation and health outcomes five years after active intervention ended: the Women's Health Initiative. J Womens Health (Larchmt). 2013;22(11):915-929. (PubMed)
103. Baron JA, Barry EL, Mott LA, et al. A trial of calcium and vitamin D for the prevention of colorectal adenomas. N Engl J Med. 2015;373(16):1519-1530. (PubMed)
104. Holick MF. Calcium plus vitamin D and the risk of colorectal cancer. N Engl J Med. 2006;354(21):2287-2288; author reply 2287-2288. (PubMed)
105. Barry EL, Peacock JL, Rees JR, et al. Vitamin D receptor genotype, vitamin D3 supplementation, and risk of colorectal adenomas: a randomized clinical trial. JAMA Oncol. 2017;3(5):628-635. (PubMed)
106. Hiraki LT, Joshi AD, Ng K, et al. Joint effects of colorectal cancer susceptibility loci, circulating 25-hydroxyvitamin D and risk of colorectal cancer. PLoS One. 2014;9(3):e92212. (PubMed)
107. Vidigal VM, Silva TD, de Oliveira J, Pimenta CAM, Felipe AV, Forones NM. Genetic polymorphisms of vitamin D receptor (VDR), CYP27B1 and CYP24A1 genes and the risk of colorectal cancer. Int J Biol Markers. 2017;32(2):e224-e230. (PubMed)
108. Maalmi H, Ordonez-Mena JM, Schottker B, Brenner H. Serum 25-hydroxyvitamin D levels and survival in colorectal and breast cancer patients: Systematic review and meta-analysis of prospective cohort studies. 2014;50(8):1510-1521. (PubMed)
109. Mohr SB, Garland CF, Gorham ED, Grant WB, Garland FC. Relationship between low ultraviolet B irradiance and higher breast cancer risk in 107 countries. Breast J. 2008;14(3):255-260. (PubMed)
110. John EM, Schwartz GG, Dreon DM, Koo J. Vitamin D and breast cancer risk: the NHANES I Epidemiologic follow-up study, 1971-1975 to 1992. National Health and Nutrition Examination Survey. Cancer Epidemiol Biomarkers Prev. 1999;8(5):399-406. (PubMed)
111. Kim Y, Je Y. Vitamin D intake, blood 25(OH)D levels, and breast cancer risk or mortality: a meta-analysis. Br J Cancer. 2014;110(11):2772-2784. (PubMed)
112. Wang D, Velez de-la-Paz OI, Zhai JX, Liu DW. Serum 25-hydroxyvitamin D and breast cancer risk: a meta-analysis of prospective studies. Tumour Biol. 2013;34(6):3509-3517. (PubMed)
113. Rose AA, Elser C, Ennis M, Goodwin PJ. Blood levels of vitamin D and early stage breast cancer prognosis: a systematic review and meta-analysis. Breast Cancer Res Treat. 2013;141(3):331-339. (PubMed)
114. Sperati F, Vici P, Maugeri-Sacca M, et al. Vitamin D supplementation and breast cancer prevention: a systematic review and meta-analysis of randomized clinical trials. PLoS One. 2013;8(7):e69269. (PubMed)
115. Hu K, Callen DF, Li J, Zheng H. Circulating vitamin D and overall survival in breast cancer patients: a dose-response meta-analysis of cohort studies. Integr Cancer Ther. 2017:1534735417712007. (PubMed)
116. Mohr SB, Gorham ED, Kim J, Hofflich H, Garland CF. Meta-analysis of vitamin D sufficiency for improving survival of patients with breast cancer. Anticancer Res. 2014;34(3):1163-1166. (PubMed)
117. Lu D, Jing L, Zhang S. Vitamin D receptor polymorphism and breast cancer risk: a meta-analysis. Medicine (Baltimore). 2016;95(18):e3535. (PubMed)
118. Mun MJ, Kim TH, Hwang JY, Jang WC. Vitamin D receptor gene polymorphisms and the risk for female reproductive cancers: A meta-analysis. Maturitas. 2015;81(2):256-265. (PubMed)
119. Gilbert R, Martin RM, Beynon R, et al. Associations of circulating and dietary vitamin D with prostate cancer risk: a systematic review and dose-response meta-analysis. Cancer Causes Control. 2011;22(3):319-340. (PubMed)
120. van der Rhee H, Coebergh JW, de Vries E. Is prevention of cancer by sun exposure more than just the effect of vitamin D? A systematic review of epidemiological studies. Eur J Cancer. 2013;49(6):1422-1436. (PubMed)
121. Tuohimaa P, Tenkanen L, Ahonen M, et al. Both high and low levels of blood vitamin D are associated with a higher prostate cancer risk: a longitudinal, nested case-control study in the Nordic countries. Int J Cancer. 2004;108(1):104-108. (PubMed)
122. Xu Y, Shao X, Yao Y, et al. Positive association between circulating 25-hydroxyvitamin D levels and prostate cancer risk: new findings from an updated meta-analysis. J Cancer Res Clin Oncol. 2014;140(9):1465-1477. (PubMed)
123. Grant WB, Karras SN, Bischoff-Ferrari HA, et al. Do studies reporting 'U'-shaped serum 25-hydroxyvitamin D-health outcome relationships reflect adverse effects? Dermatoendocrinol. 2016;8(1):e1187349. (PubMed)
124. Wu X, Cheng J, Yang K. Vitamin D-related gene polymorphisms, plasma 25-hydroxy-vitamin D, cigarette smoke and non-small cell lung cancer (NSCLC) Risk. Int J Mol Sci. 2016;17(10). (PubMed)
125. Zhang L, Wang S, Che X, Li X. Vitamin D and lung cancer risk: a comprehensive review and meta-analysis. Cell Physiol Biochem. 2015;36(1):299-305. (PubMed)
126. Liao Y, Huang JL, Qiu MX, Ma ZW. Impact of serum vitamin D level on risk of bladder cancer: a systemic review and meta-analysis. Tumour Biol. 2015;36(3):1567-1572. (PubMed)
127. Zhang H, Zhang H, Wen X, Zhang Y, Wei X, Liu T. Vitamin D deficiency and increased risk of bladder carcinoma: a meta-analysis. Cell Physiol Biochem. 2015;37(5):1686-1692. (PubMed)
128. Lu D, Chen J, Jin J. Vitamin D status and risk of non-Hodgkin lymphoma: a meta-analysis. Cancer Causes Control. 2014;25(11):1553-1563. (PubMed)
129. Prescott J, Bertrand KA, Poole EM, Rosner BA, Tworoger SS. Surrogates of long-term vitamin d exposure and ovarian cancer risk in two prospective cohort studies. Cancers (Basel). 2013;5(4):1577-1600. (PubMed)
130. Khayatzadeh S, Feizi A, Saneei P, Esmaillzadeh A. Vitamin D intake, serum Vitamin D levels, and risk of gastric cancer: A systematic review and meta-analysis. J Res Med Sci. 2015;20(8):790-796. (PubMed)
131. Gandini S, Raimondi S, Gnagnarella P, Dore JF, Maisonneuve P, Testori A. Vitamin D and skin cancer: a meta-analysis. Eur J Cancer. 2009;45(4):634-641. (PubMed)
132. Deluca HF, Cantorna MT. Vitamin D: its role and uses in immunology. Faseb J. 2001;15(14):2579-2585. (PubMed)
133. Agmon-Levin N, Mosca M, Petri M, Shoenfeld Y. Systemic lupus erythematosus one disease or many? Autoimmun Rev. 2012;11(8):593-595. (PubMed)
134. Goodin DS. The epidemiology of multiple sclerosis: insights to disease pathogenesis. Handb Clin Neurol. 2014;122:231-266. (PubMed)
135. Littorin B, Blom P, Scholin A, et al. Lower levels of plasma 25-hydroxyvitamin D among young adults at diagnosis of autoimmune type 1 diabetes compared with control subjects: results from the nationwide Diabetes Incidence Study in Sweden (DISS). Diabetologia. 2006;49(12):2847-2852. (PubMed)
136. Pozzilli P, Manfrini S, Crino A, et al. Low levels of 25-hydroxyvitamin D3 and 1,25-dihydroxyvitamin D3 in patients with newly diagnosed type 1 diabetes. Horm Metab Res. 2005;37(11):680-683. (PubMed)
137. Raab J, Giannopoulou EZ, Schneider S, et al. Prevalence of vitamin D deficiency in pre-type 1 diabetes and its association with disease progression. Diabetologia. 2014;57(5):902-908. (PubMed)
138. Hypponen E, Laara E, Reunanen A, Jarvelin MR, Virtanen SM. Intake of vitamin D and risk of type 1 diabetes: a birth-cohort study. Lancet. 2001;358(9292):1500-1503. (PubMed)
139. Sorensen IM, Joner G, Jenum PA, Eskild A, Torjesen PA, Stene LC. Maternal serum levels of 25-hydroxy-vitamin D during pregnancy and risk of type 1 diabetes in the offspring. Diabetes. 2012;61(1):175-178. (PubMed)
140. Brekke HK, Ludvigsson J. Vitamin D supplementation and diabetes-related autoimmunity in the ABIS study. Pediatr Diabetes. 2007;8(1):11-14. (PubMed)
141. Fronczak CM, Baron AE, Chase HP, et al. In utero dietary exposures and risk of islet autoimmunity in children. Diabetes Care. 2003;26(12):3237-3242. (PubMed)
142. Marjamaki L, Niinisto S, Kenward MG, et al. Maternal intake of vitamin D during pregnancy and risk of advanced beta cell autoimmunity and type 1 diabetes in offspring. Diabetologia. 2010;53(8):1599-1607. (PubMed)
143. Miettinen ME, Reinert L, Kinnunen L, et al. Serum 25-hydroxyvitamin D level during early pregnancy and type 1 diabetes risk in the offspring. Diabetologia. 2012;55(5):1291-1294. (PubMed)
144. Smolders J, Thewissen M, Peelen E, et al. Vitamin D status is positively correlated with regulatory T cell function in patients with multiple sclerosis. PLoS One. 2009;4(8):e6635. (PubMed)
145. Mokry LE, Ross S, Ahmad OS, et al. Vitamin D and risk of multiple sclerosis: a Mendelian randomization study. PLoS Med. 2015;12(8):e1001866. (PubMed)
146. Staples J, Ponsonby AL, Lim L. Low maternal exposure to ultraviolet radiation in pregnancy, month of birth, and risk of multiple sclerosis in offspring: longitudinal analysis. BMJ. 2010;340:c1640. (PubMed)
147. Bjornevik K, Riise T, Casetta I, et al. Sun exposure and multiple sclerosis risk in Norway and Italy: The EnvIMS study. Mult Scler. 2014; 20(8):1042-1049. (PubMed)
148. McDowell TY, Amr S, Culpepper WJ, et al. Sun exposure, vitamin D and age at disease onset in relapsing multiple sclerosis. Neuroepidemiology. 2011;36(1):39-45. (PubMed)
149. Munger KL, Levin LI, Hollis BW, Howard NS, Ascherio A. Serum 25-hydroxyvitamin D levels and risk of multiple sclerosis. JAMA. 2006;296(23):2832-2838. (PubMed)
150. Munger KL, Zhang SM, O'Reilly E, et al. Vitamin D intake and incidence of multiple sclerosis. Neurology. 2004;62(1):60-65. (PubMed)
151. Pierrot-Deseilligny C, Rivaud-Pechoux S, Clerson P, de Paz R, Souberbielle JC. Relationship between 25-OH-D serum level and relapse rate in multiple sclerosis patients before and after vitamin D supplementation. Ther Adv Neurol Disord. 2012;5(4):187-198. (PubMed)
152. Ascherio A, Munger KL, White R, et al. Vitamin d as an early predictor of multiple sclerosis activity and progression. JAMA Neurol. 2014;71(3):306-314. (PubMed)
153. Muris AH, Smolders J, Rolf L, et al. Vitamin D status does not affect disability progression of patients with multiple sclerosis over three year follow-up. PLoS One. 2016;11(6):e0156122. (PubMed)
154. Kampman MT, Steffensen LH, Mellgren SI, Jorgensen L. Effect of vitamin D3 supplementation on relapses, disease progression, and measures of function in persons with multiple sclerosis: exploratory outcomes from a double-blind randomised controlled trial. Mult Scler. 2012;18(8):1144-1151. (PubMed)
155. Soilu-Hanninen M, Aivo J, Lindstrom BM, et al. A randomised, double blind, placebo controlled trial with vitamin D3 as an add on treatment to interferon beta-1b in patients with multiple sclerosis. J Neurol Neurosurg Psychiatry. 2012;83(5):565-571. (PubMed)
156. Mrad MF, El Ayoubi NK, Esmerian MO, Kazan JM, Khoury SJ. Effect of vitamin D replacement on immunological biomarkers in patients with multiple sclerosis. Clin Immunol. 2017;181:9-15. (PubMed)
157. Muris AH, Smolders J, Rolf L, Thewissen M, Hupperts R, Damoiseaux J. Immune regulatory effects of high dose vitamin D3 supplementation in a randomized controlled trial in relapsing remitting multiple sclerosis patients receiving IFNbeta; the SOLARIUM study. J Neuroimmunol. 2016;300:47-56. (PubMed)
158. O'Connell K, Sulaimani J, Basdeo SA, et al. Effects of vitamin D3 in clinically isolated syndrome and healthy control participants: A double-blind randomised controlled trial. Mult Scler J Exp Transl Clin. 2017;3(3):2055217317727296. (PubMed)
159. Rosjo E, Steffensen LH, Jorgensen L, et al. Vitamin D supplementation and systemic inflammation in relapsing-remitting multiple sclerosis. J Neurol. 2015;262(12):2713-2721. (PubMed)
160. Sotirchos ES, Bhargava P, Eckstein C, et al. Safety and immunologic effects of high- vs low-dose cholecalciferol in multiple sclerosis. Neurology. 2016;86(4):382-390. (PubMed)
161. Bruce D, Whitcomb JP, August A, McDowell MA, Cantorna MT. Elevated non-specific immunity and normal Listeria clearance in young and old vitamin D receptor knockout mice. Int Immunol. 2009;21(2):113-122. (PubMed)
162. Zwerina K, Baum W, Axmann R, et al. Vitamin D receptor regulates TNF-mediated arthritis. Ann Rheum Dis. 2011;70(6):1122-1129. (PubMed)
163. Hitchon CA, Sun Y, Robinson DB, et al. Vitamin D receptor polymorphism rs2228570 (Fok1) is associated with rheumatoid arthritis in North American natives. J Rheumatol. 2012;39(9):1792-1797. (PubMed)
164. Lee YH, Bae SC, Choi SJ, Ji JD, Song GG. Associations between vitamin D receptor polymorphisms and susceptibility to rheumatoid arthritis and systemic lupus erythematosus: a meta-analysis. Mol Biol Rep. 2011;38(6):3643-3651. (PubMed)
165. Mosaad YM, Hammad EM, Fawzy Z, et al. Vitamin D receptor gene polymorphism as possible risk factor in rheumatoid arthritis and rheumatoid related osteoporosis. Hum Immunol. 2014;75(5):452-461. (PubMed)
166. Zanetti M, Harris SS, Dawson-Hughes B. Ability of vitamin D to reduce inflammation in adults without acute illness. Nutr Rev. 2014;72(2):95-98. (PubMed)
167. Merlino LA, Curtis J, Mikuls TR, Cerhan JR, Criswell LA, Saag KG. Vitamin D intake is inversely associated with rheumatoid arthritis: results from the Iowa Women's Health Study. Arthritis Rheum. 2004;50(1):72-77. (PubMed)
168. Costenbader KH, Feskanich D, Holmes M, Karlson EW, Benito-Garcia E. Vitamin D intake and risks of systemic lupus erythematosus and rheumatoid arthritis in women. Ann Rheum Dis. 2008;67(4):530-535. (PubMed)
169. Hiraki LT, Munger KL, Costenbader KH, Karlson EW. Dietary intake of vitamin D during adolescence and risk of adult-onset systemic lupus erythematosus and rheumatoid arthritis. Arthritis Care Res (Hoboken). 2012;64(12):1829-1836. (PubMed)
170. Sen D, Ranganathan P. Vitamin D in rheumatoid arthritis: panacea or placebo? Discov Med. 2012;14(78):311-319. (PubMed)
171. Lee YH, Bae SC. Vitamin D level in rheumatoid arthritis and its correlation with the disease activity: a meta-analysis. Clin Exp Rheumatol. 2016;34(5):827-833. (PubMed)
172. Lin J, Liu J, Davies ML, Chen W. Serum vitamin D level and rheumatoid arthritis disease activity: review and meta-analysis. PLoS One. 2016;11(1):e0146351. (PubMed)
173. Hansen KE, Bartels CM, Gangnon RE, Jones AN, Gogineni J. An evaluation of high-dose vitamin D for rheumatoid arthritis. J Clin Rheumatol. 2014;20(2):112-114. (PubMed)
174. Buondonno I, Rovera G, Sassi F, et al. Vitamin D and immunomodulation in early rheumatoid arthritis: A randomized double-blind placebo-controlled study. PLoS One. 2017;12(6):e0178463. (PubMed)
175. Dehghan A, Rahimpour S, Soleymani-Salehabadi H, Owlia MB. Role of vitamin D in flare ups of rheumatoid arthritis. Z Rheumatol. 2014;73(5):461-464. (PubMed)
176. Yang J, Liu L, Zhang Q, Li M, Wang J. Effect of vitamin D on the recurrence rate of rheumatoid arthritis. Exp Ther Med. 2015;10(5):1812-1816. (PubMed)
177. Gonzalez LA, Toloza SM, McGwin G, Jr., Alarcon GS. Ethnicity in systemic lupus erythematosus (SLE): its influence on susceptibility and outcomes. Lupus. 2013;22(12):1214-1224. (PubMed)
178. Hsieh CC, Lin BF. Dietary factors regulate cytokines in murine models of systemic lupus erythematosus. Autoimmun Rev. 2011;11(1):22-27. (PubMed)
179. Mao S, Huang S. Association between vitamin D receptor gene BsmI, FokI, ApaI and TaqI polymorphisms and the risk of systemic lupus erythematosus: a meta-analysis. Rheumatol Int. 2014;34(3):381-388. (PubMed)
180. Monticielo OA, Teixeira Tde M, Chies JA, Brenol JC, Xavier RM. Vitamin D and polymorphisms of VDR gene in patients with systemic lupus erythematosus. Clin Rheumatol. 2012;31(10):1411-1421. (PubMed)
181. Ruiz-Irastorza G, Egurbide MV, Olivares N, Martinez-Berriotxoa A, Aguirre C. Vitamin D deficiency in systemic lupus erythematosus: prevalence, predictors and clinical consequences. Rheumatology (Oxford). 2008;47(6):920-923. (PubMed)
182. Toloza SM, Cole DE, Gladman DD, Ibanez D, Urowitz MB. Vitamin D insufficiency in a large female SLE cohort. Lupus. 2010;19(1):13-19. (PubMed)
183. Amital H, Szekanecz Z, Szucs G, et al. Serum concentrations of 25-OH vitamin D in patients with systemic lupus erythematosus (SLE) are inversely related to disease activity: is it time to routinely supplement patients with SLE with vitamin D? Ann Rheum Dis. 2010;69(6):1155-1157. (PubMed)
184. Terrier B, Derian N, Schoindre Y, et al. Restoration of regulatory and effector T cell balance and B cell homeostasis in systemic lupus erythematosus patients through vitamin D supplementation. Arthritis Res Ther. 2012;14(5):R221. (PubMed)
185. Cutillas-Marco E, Marquina-Vila A, Grant W, Vilata-Corell J, Morales-Suarez-Varela M. Vitamin D and cutaneous lupus erythematosus: effect of vitamin D replacement on disease severity. Lupus. 2014;23(7):615-623. (PubMed)
186. Abou-Raya A, Abou-Raya S, Helmii M. The effect of vitamin D supplementation on inflammatory and hemostatic markers and disease activity in patients with systemic lupus erythematosus: a randomized placebo-controlled trial. J Rheumatol. 2013;40(3):265-272. (PubMed)
187. Lima GL, Paupitz J, Aikawa NE, Takayama L, Bonfa E, Pereira RM. Vitamin D supplementation in adolescents and young adults With juvenile systemic lupus erythematosus for improvement in disease activity and fatigue scores: a randomized, double-blind, placebo-controlled trial. Arthritis Care Res (Hoboken). 2016;68(1):91-98. (PubMed)
188. Andreoli L, Dall'Ara F, Piantoni S, et al. A 24-month prospective study on the efficacy and safety of two different monthly regimens of vitamin D supplementation in pre-menopausal women with systemic lupus erythematosus. Lupus. 2015;24(4-5):499-506. (PubMed)
189. Karimzadeh H, Shirzadi M, Karimifar M. The effect of Vitamin D supplementation in disease activity of systemic lupus erythematosus patients with Vitamin D deficiency: A randomized clinical trial. J Res Med Sci. 2017;22:4. (PubMed)
190. Antico A, Tampoia M, Tozzoli R, Bizzaro N. Can supplementation with vitamin D reduce the risk or modify the course of autoimmune diseases? A systematic review of the literature. Autoimmun Rev. 2012;12(2):127-136. (PubMed)
191. Wang TJ, Pencina MJ, Booth SL, et al. Vitamin D deficiency and risk of cardiovascular disease. Circulation. 2008;117(4):503-511. (PubMed)
192. van Ballegooijen AJ, Kestenbaum B, Sachs MC, et al. Association of 25-Hydroxyvitamin D and parathyroid hormone with incident hypertension: MESA (Multi-Ethnic Study of Atherosclerosis). J Am Coll Cardiol. 2014;63(12):1214-1222. (PubMed)
193. Kunutsor SK, Apekey TA, Steur M. Vitamin D and risk of future hypertension: meta-analysis of 283,537 participants. Eur J Epidemiol. 2013;28(3):205-221. (PubMed)
194. Burgaz A, Orsini N, Larsson SC, Wolk A. Blood 25-hydroxyvitamin D concentration and hypertension: a meta-analysis. J Hypertens. 2011;29(4):636-645. (PubMed)
195. Moody WE, Edwards NC, Madhani M, et al. Endothelial dysfunction and cardiovascular disease in early-stage chronic kidney disease: cause or association? Atherosclerosis. 2012;223(1):86-94. (PubMed)
196. Chitalia N, Recio-Mayoral A, Kaski JC, Banerjee D. Vitamin D deficiency and endothelial dysfunction in non-dialysis chronic kidney disease patients. Atherosclerosis. 2012;220(1):265-268. (PubMed)
197. Chitalia N, Ismail T, Tooth L, et al. Impact of vitamin d supplementation on arterial vasomotion, stiffness and endothelial biomarkers in chronic kidney disease patients. PLoS One. 2014;9(3):e91363. (PubMed)
198. Mazidi M, Karimi E, Rezaie P, Vatanparast H. The impact of vitamin D supplement intake on vascular endothelial function; a systematic review and meta-analysis of randomized controlled trials. Food Nutr Res. 2017;61(1):1273574. (PubMed)
199. Messa P, Curreri M, Regalia A, Alfieri CM. Vitamin D and the cardiovascular system: an overview of the recent literature. Am J Cardiovasc Drugs. 2014;14(1):1-14. (PubMed)
200. Brondum-Jacobsen P, Benn M, Afzal S, Nordestgaard BG. No evidence that genetically reduced 25-hydroxyvitamin D is associated with increased risk of ischaemic heart disease or myocardial infarction: a Mendelian randomization study. Int J Epidemiol. 2015;44(2):651-661. (PubMed)
201. Manousaki D, Mokry LE, Ross S, Goltzman D, Richards JB. Mendelian randomization studies do not support a role for vitamin D in coronary artery disease. Circ Cardiovasc Genet. 2016;9(4):349-356. (PubMed)
202. Ford JA, MacLennan GS, Avenell A, Bolland M, Grey A, Witham M. Cardiovascular disease and vitamin D supplementation: trial analysis, systematic review, and meta-analysis. Am J Clin Nutr. 2014;100(3):746-755. (PubMed)
203. Chin K, Appel LJ, Michos ED. Vitamin D, calcium, and cardiovascular disease: a"D"vantageous or "D"etrimental? An era of uncertainty. Curr Atheroscler Rep. 2017;19(1):5. (PubMed)
204. Pradhan AD, Manson JE. Update on the Vitamin D and OmegA-3 trial (VITAL). J Steroid Biochem Mol Biol. 2016;155(Pt B):252-256. (PubMed)
205. Neale RE, Armstrong BK, Baxter C, et al. The D-Health Trial: A randomized trial of vitamin D for prevention of mortality and cancer. Contemp Clin Trials. 2016;48:83-90. (PubMed)
206. Scragg R, Stewart AW, Waayer D, et al. Effect of monthly high-dose vitamin D supplementation on cardiovascular disease in the vitamin D assessment study: a randomized clinical trial. JAMA Cardiol. 2017;2(6):608-616. (PubMed)
207. Thomas GN, o Hartaigh B, Bosch JA, et al. Vitamin D levels predict all-cause and cardiovascular disease mortality in subjects with the metabolic syndrome: the Ludwigshafen Risk and Cardiovascular Health (LURIC) Study. Diabetes Care. 2012;35(5):1158-1164. (PubMed)
208. Chiu KC, Chu A, Go VL, Saad MF. Hypovitaminosis D is associated with insulin resistance and beta cell dysfunction. Am J Clin Nutr. 2004;79(5):820-825. (PubMed)
209. Shankar A, Sabanayagam C, Kalidindi S. Serum 25-hydroxyvitamin D levels and prediabetes among subjects free of diabetes. Diabetes Care. 2011;34(5):1114-1119. (PubMed)
210. Deleskog A, Hilding A, Brismar K, Hamsten A, Efendic S, Ostenson CG. Low serum 25-hydroxyvitamin D level predicts progression to type 2 diabetes in individuals with prediabetes but not with normal glucose tolerance. Diabetologia. 2012;55(6):1668-1678. (PubMed)
211. Khan H, Kunutsor S, Franco OH, Chowdhury R. Vitamin D, type 2 diabetes and other metabolic outcomes: a systematic review and meta-analysis of prospective studies. Proc Nutr Soc. 2013;72(1):89-97. (PubMed)
212. Lucato P, Solmi M, Maggi S, et al. Low vitamin D levels increase the risk of type 2 diabetes in older adults: A systematic review and meta-analysis. Maturitas. 2017;100:8-15. (PubMed)
213. George PS, Pearson ER, Witham MD. Effect of vitamin D supplementation on glycaemic control and insulin resistance: a systematic review and meta-analysis. Diabet Med. 2012;29(8):e142-150. (PubMed)
214. Gulseth HL, Wium C, Angel K, Eriksen EF, Birkeland KI. Effects of vitamin D supplementation on insulin sensitivity and insulin secretion in subjects with type 2 diabetes and vitamin D deficiency: a randomized controlled trial. Diabetes Care. 2017;40(7):872-878. (PubMed)
215. Lee CJ, Iyer G, Liu Y, et al. The effect of vitamin D supplementation on glucose metabolism in type 2 diabetes mellitus: A systematic review and meta-analysis of intervention studies. J Diabetes Complications. 2017;31(7):1115-1126. (PubMed)
216. Talaei A, Mohamadi M, Adgi Z. The effect of vitamin D on insulin resistance in patients with type 2 diabetes. Diabetol Metab Syndr. 2013;5(1):8. (PubMed)
217. Gezen-Ak D, Yilmazer S, Dursun E. Why vitamin d in Alzheimer's disease? The hypothesis. J Alzheimers Dis. 2014;40(2):257-269. (PubMed)
218. Landel V, Annweiler C, Millet P, Morello M, Feron F. Vitamin D, cognition and Alzheimer's disease: the therapeutic benefit is in the D-tails. J Alzheimers Dis. 2016;53(2):419-444. (PubMed)
219. Annweiler C, Schott AM, Rolland Y, Blain H, Herrmann FR, Beauchet O. Dietary intake of vitamin D and cognition in older women: a large population-based study. Neurology. 2010;75(20):1810-1816. (PubMed)
220. Annweiler C, Rolland Y, Schott AM, et al. Higher vitamin D dietary intake is associated with lower risk of Alzheimer's disease: a 7-year follow-up. J Gerontol A Biol Sci Med Sci. 2012;67(11):1205-1211. (PubMed)
221. Annweiler C, Fantino B, Schott AM, Krolak-Salmon P, Allali G, Beauchet O. Vitamin D insufficiency and mild cognitive impairment: cross-sectional association. Eur J Neurol. 2012;19(7):1023-1029. (PubMed)
222. Hooshmand B, Lokk J, Solomon A, et al. Vitamin D in relation to cognitive impairment, cerebrospinal fluid biomarkers, and brain volumes. J Gerontol A Biol Sci Med Sci. 2014;69(9):1132-1138. (PubMed)
223. Slinin Y, Paudel ML, Taylor BC, et al. 25-Hydroxyvitamin D levels and cognitive performance and decline in elderly men. Neurology. 2010;74(1):33-41. (PubMed)
224. Slinin Y, Paudel M, Taylor BC, et al. Association between serum 25(OH) vitamin D and the risk of cognitive decline in older women. J Gerontol A Biol Sci Med Sci. 2012;67(10):1092-1098. (PubMed)
225. Annweiler C, Milea D, Whitson HE, et al. Vitamin D insufficiency and cognitive impairment in Asians: a multi-ethnic population-based study and meta-analysis. J Intern Med. 2016;280(3):300-311. (PubMed)
226. Annweiler C, Llewellyn DJ, Beauchet O. Low serum vitamin D concentrations in Alzheimer's disease: a systematic review and meta-analysis. J Alzheimers Dis. 2013;33(3):659-674. (PubMed)
227. Balion C, Griffith LE, Strifler L, et al. Vitamin D, cognition, and dementia: a systematic review and meta-analysis. Neurology. 2012;79(13):1397-1405. (PubMed)
228. Lopes da Silva S, Vellas B, Elemans S, et al. Plasma nutrient status of patients with Alzheimer's disease: Systematic review and meta-analysis. Alzheimers Dement. 2014;10(4):485-502. (PubMed)
229. Shen L, Ji HF. Vitamin D deficiency is associated with increased risk of Alzheimer's disease and dementia: evidence from meta-analysis. Nutr J. 2015;14:76. (PubMed)
230. Sommer I, Griebler U, Kien C, et al. Vitamin D deficiency as a risk factor for dementia: a systematic review and meta-analysis. BMC Geriatr. 2017;17(1):16. (PubMed)
231. Olsson E, Byberg L, Karlstrom B, et al. Vitamin D is not associated with incident dementia or cognitive impairment: an 18-y follow-up study in community-living old men. Am J Clin Nutr. 2017;105(4):936-943. (PubMed)
232. Mokry LE, Ross S, Morris JA, Manousaki D, Forgetta V, Richards JB. Genetically decreased vitamin D and risk of Alzheimer disease. Neurology. 2016;87(24):2567-2574. (PubMed)
233. Annweiler C, Montero-Odasso M, Llewellyn DJ, Richard-Devantoy S, Duque G, Beauchet O. Meta-analysis of memory and executive dysfunctions in relation to vitamin D. J Alzheimers Dis. 2013;37(1):147-171. (PubMed)
234. Annweiler C, Fantino B, Gautier J, Beaudenon M, Thiery S, Beauchet O. Cognitive effects of vitamin D supplementation in older outpatients visiting a memory clinic: a pre-post study. J Am Geriatr Soc. 2012;60(4):793-795. (PubMed)
235. Stein MS, Scherer SC, Ladd KS, Harrison LC. A randomized controlled trial of high-dose vitamin D2 followed by intranasal insulin in Alzheimer's disease. J Alzheimers Dis. 2011;26(3):477-484. (PubMed)
236. Annweiler C, Karras SN, Anagnostis P, Beauchet O. Vitamin D supplements: a novel therapeutic approach for Alzheimer patients. Front Pharmacol. 2014;5:6. (PubMed)
237. Sato Y, Kikuyama M, Oizumi K. High prevalence of vitamin D deficiency and reduced bone mass in Parkinson's disease. Neurology. 1997;49(5):1273-1278. (PubMed)
238. Evatt ML, Delong MR, Khazai N, Rosen A, Triche S, Tangpricha V. Prevalence of vitamin D insufficiency in patients with Parkinson disease and Alzheimer disease. Arch Neurol. 2008;65(10):1348-1352. (PubMed)
239. Knekt P, Kilkkinen A, Rissanen H, Marniemi J, Saaksjarvi K, Heliovaara M. Serum vitamin D and the risk of Parkinson disease. Arch Neurol. 2010;67(7):808-811. (PubMed)
240. Lv Z, Qi H, Wang L, et al. Vitamin D status and Parkinson's disease: a systematic review and meta-analysis. Neurol Sci. 2014;35(11):1723-1730. (PubMed)
241. Shen L, Ji HF. Associations between vitamin D status, supplementation, outdoor work and risk of Parkinson's disease: a meta-analysis assessment. Nutrients. 2015;7(6):4817-4827. (PubMed)
242. Zhao Y, Sun Y, Ji HF, Shen L. Vitamin D levels in Alzheimer's and Parkinson's diseases: a meta-analysis. Nutrition. 2013;29(6):828-832. (PubMed)
243. Suzuki M, Yoshioka M, Hashimoto M, et al. Randomized, double-blind, placebo-controlled trial of vitamin D supplementation in Parkinson disease. Am J Clin Nutr. 2013;97(5):1004-1013. (PubMed)
244. Dobson R, Yarnall A, Noyce AJ, Giovannoni G. Bone health in chronic neurological diseases: a focus on multiple sclerosis and parkinsonian syndromes. Pract Neurol. 2013;13(2):70-79. (PubMed)
245. Torsney KM, Noyce AJ, Doherty KM, Bestwick JP, Dobson R, Lees AJ. Bone health in Parkinson's disease: a systematic review and meta-analysis. J Neurol Neurosurg Psychiatry. 2014;85(10):1159-66. (PubMed)
246. van den Bos F, Speelman AD, Samson M, Munneke M, Bloem BR, Verhaar HJ. Parkinson's disease and osteoporosis. Age Ageing. 2013;42(2):156-162. (PubMed)
247. Sato Y, Iwamoto J, Honda Y. Amelioration of osteoporosis and hypovitaminosis D by sunlight exposure in Parkinson's disease. Parkinsonism Relat Disord. 2011;17(1):22-26. (PubMed)
248. Aghajafari F, Nagulesapillai T, Ronksley PE, Tough SC, O'Beirne M, Rabi DM. Association between maternal serum 25-hydroxyvitamin D level and pregnancy and neonatal outcomes: systematic review and meta-analysis of observational studies. BMJ. 2013;346:f1169. (PubMed)
249. Perez-Lopez FR, Pasupuleti V, Mezones-Holguin E, et al. Effect of vitamin D supplementation during pregnancy on maternal and neonatal outcomes: a systematic review and meta-analysis of randomized controlled trials. Fertil Steril. 2015;103(5):1278-1288.e1274. (PubMed)
250. Alzaim M, Wood RJ. Vitamin D and gestational diabetes mellitus. Nutr Rev. 2013;71(3):158-167. (PubMed)
251. Lacroix M, Battista MC, Doyon M, et al. Lower vitamin D levels at first trimester are associated with higher risk of developing gestational diabetes mellitus. Acta Diabetol. 2014;51(4):609-616. (PubMed)
252. Parlea L, Bromberg IL, Feig DS, Vieth R, Merman E, Lipscombe LL. Association between serum 25-hydroxyvitamin D in early pregnancy and risk of gestational diabetes mellitus. Diabet Med. 2012;29(7):e25-32. (PubMed)
253. Lu M, Xu Y, Lv L, Zhang M. Association between vitamin D status and the risk of gestational diabetes mellitus: a meta-analysis. Arch Gynecol Obstet. 2016;293(5):959-966. (PubMed)
254. Poel YH, Hummel P, Lips P, Stam F, van der Ploeg T, Simsek S. Vitamin D and gestational diabetes: a systematic review and meta-analysis. Eur J Intern Med. 2012;23(5):465-469. (PubMed)
255. Wei SQ, Qi HP, Luo ZC, Fraser WD. Maternal vitamin D status and adverse pregnancy outcomes: a systematic review and meta-analysis. J Matern Fetal Neonatal Med. 2013;26(9):889-899. (PubMed)
256. Zhang MX, Pan GT, Guo JF, Li BY, Qin LQ, Zhang ZL. Vitamin D deficiency increases the risk of gestational diabetes mellitus: a meta-analysis of observational studies. Nutrients. 2015;7(10):8366-8375. (PubMed)
257. Triunfo S, Lanzone A, Lindqvist PG. Low maternal circulating levels of vitamin D as potential determinant in the development of gestational diabetes mellitus. J Endocrinol Invest. 2017;40(10):1049-1059. (PubMed)
258. Asemi Z, Hashemi T, Karamali M, Samimi M, Esmaillzadeh A. Effects of vitamin D supplementation on glucose metabolism, lipid concentrations, inflammation, and oxidative stress in gestational diabetes: a double-blind randomized controlled clinical trial. Am J Clin Nutr. 2013;98(6):1425-1432. (PubMed)
259. Jelsma JG, van Poppel MN, Galjaard S, et al. DALI: Vitamin D and lifestyle intervention for gestational diabetes mellitus (GDM) prevention: an European multicentre, randomised trial - study protocol. BMC Pregnancy Childbirth. 2013;13:142. (PubMed)
260. Simmons D, Devlieger R, van Assche A, et al. Effect of Physical Activity and/or Healthy Eating on GDM Risk: The DALI Lifestyle Study. J Clin Endocrinol Metab. 2017;102(3):903-913. (PubMed)
261. Galthen-Sorensen M, Andersen LB, Sperling L, Christesen HT. Maternal 25-hydroxyvitamin D level and fetal bone growth assessed by ultrasound: a systematic review. Ultrasound Obstet Gynecol. 2014;44(6):633-640. (PubMed)
262. Shor DB, Barzel J, Tauber E, Amital H. The effects of maternal vitamin D on neonatal growth parameters. Eur J Pediatr. 2015;174(9):1169-1174. (PubMed)
263. Cooper C, Harvey NC, Bishop NJ, et al. Maternal gestational vitamin D supplementation and offspring bone health (MAVIDOS): a multicentre, double-blind, randomised placebo-controlled trial. Lancet Diabetes Endocrinol. 2016;4(5):393-402. (PubMed)
264. Handel MN, Frederiksen P, Osmond C, Cooper C, Abrahamsen B, Heitmann BL. Prenatal exposure to vitamin D from fortified margarine and risk of fractures in late childhood: period and cohort results from 222 000 subjects in the D-tect observational study. Br J Nutr. 2017;117(6):872-881. (PubMed)
265. Rodda CP, Benson JE, Vincent AJ, Whitehead CL, Polykov A, Vollenhoven B. Maternal vitamin D supplementation during pregnancy prevents vitamin D deficiency in the newborn: an open-label randomized controlled trial. Clin Endocrinol (Oxf). 2015;83(3):363-368. (PubMed)
266. Handel MN, Frederiksen P, Cohen A, Cooper C, Heitmann BL, Abrahamsen B. Neonatal vitamin D status from archived dried blood spots and future risk of fractures in childhood: results from the D-tect study, a population-based case-cohort study. Am J Clin Nutr. 2017;106(1):155-161. (PubMed)
267. Bountouvi E, Douros K, Papadopoulou A. Can getting enough vitamin D during pregnancy reduce the risk of getting asthma in childhood? Front Pediatr. 2017;5:87. (PubMed)
268. Goldring ST, Griffiths CJ, Martineau AR, et al. Prenatal vitamin D supplementation and child respiratory health: a randomised controlled trial. PLoS One. 2013;8(6):e66627. (PubMed)
269. Chawes BL, Bonnelykke K, Stokholm J, et al. Effect of vitamin D3 supplementation during pregnancy on rsk of persistent wheeze in the offspring: a randomized clinical trial. JAMA. 2016;315(4):353-361. (PubMed)
270. Litonjua AA, Carey VJ, Laranjo N, et al. Effect of prenatal supplementation with vitamin D on asthma or eecurrent wheezing in offspring by age 3 years: the VDAART randomized clinical trial. JAMA. 2016;315(4):362-370. (PubMed)
271. Vahdaninia M, Mackenzie H, Helps S, Dean T. Prenatal intake of vitamins and allergic outcomes in the offspring: a systematic review and meta-analysis. J Allergy Clin Immunol Pract. 2017;5(3):771-778.e775. (PubMed)
272. Weisse K, Winkler S, Hirche F, et al. Maternal and newborn vitamin D status and its impact on food allergy development in the German LINA cohort study. Allergy. 2013;68(2):220-228. (PubMed)
273. Miettinen ME, Smart MC, Kinnunen L, et al. Maternal VDR variants rather than 25-hydroxyvitamin D concentration during early pregnancy are associated with type 1 diabetes in the offspring. Diabetologia. 2015;58(10):2278-2283. (PubMed)
274. Sorensen IM, Joner G, Jenum PA, et al. Vitamin D-binding protein and 25-hydroxyvitamin D during pregnancy in mothers whose children later developed type 1 diabetes. Diabetes Metab Res Rev. 2016;32(8):883-890. (PubMed)
275. Makela MJ, Puhakka T, Ruuskanen O, et al. Viruses and bacteria in the etiology of the common cold. J Clin Microbiol. 1998;36(2):539-542. (PubMed)
276. Ginde AA, Mansbach JM, Camargo CA, Jr. Association between serum 25-hydroxyvitamin D level and upper respiratory tract infection in the Third National Health and Nutrition Examination Survey. Arch Intern Med. 2009;169(4):384-390. (PubMed)
277. Murdoch DR, Slow S, Chambers ST, et al. Effect of vitamin D3 supplementation on upper respiratory tract infections in healthy adults: the VIDARIS randomized controlled trial. JAMA. 2012;308(13):1333-1339. (PubMed)
278. Rees JR, Hendricks K, Barry EL, et al. Vitamin D3 supplementation and upper respiratory tract infections in a randomized, controlled trial. Clin Infect Dis. 2013;57(10):1384-1392. (PubMed)
279. Tran B, Armstrong BK, Ebeling PR, et al. Effect of vitamin D supplementation on antibiotic use: a randomized controlled trial. Am J Clin Nutr. 2014;99(1):156-161. (PubMed)
280. Grant CC, Kaur S, Waymouth E, et al. Reduced primary care respiratory infection visits following pregnancy and infancy vitamin D supplementation: a randomised controlled trial. Acta Paediatr. 2015;104(4):396-404. (PubMed)
281. Martineau AR, Jolliffe DA, Hooper RL, et al. Vitamin D supplementation to prevent acute respiratory tract infections: systematic review and meta-analysis of individual participant data. BMJ. 2017;356:i6583. (PubMed)
282. Scragg R, Waayer D, Stewart AW, et al. The Vitamin D Assessment (ViDA) study: design of a randomized controlled trial of vitamin D supplementation for the prevention of cardiovascular disease, acute respiratory infection, falls and non-vertebral fractures. J Steroid Biochem Mol Biol. 2016;164:318-325. (PubMed)
283. Manson JE, Bassuk SS, Buring JE, Group VR. Principal results of the VITamin D and OmegA-3 TriaL (VITAL) and updated meta-analyses of relevant vitamin D trials. J Steroid Biochem Mol Biol. 2020;198:105522. (PubMed)
284. Gold DR, Litonjua AA, Carey VJ, et al. Lung VITAL: Rationale, design, and baseline characteristics of an ancillary study evaluating the effects of vitamin D and/or marine omega-3 fatty acid supplements on acute exacerbations of chronic respiratory disease, asthma control, pneumonia and lung function in adults. Contemp Clin Trials. 2016;47:185-195. (PubMed)
285. Aglipay M, Birken CS, Parkin PC, et al. Effect of high-dose vs standard-dose wintertime vitamin D supplementation on viral upper respiratory tract infections in young healthy children. JAMA. 2017;318(3):245-254. (PubMed)
286. Hueniken K, Aglipay M, Birken CS, et al. Effect of high-dose vitamin D supplementation on upper respiratory tract infection symptom severity in healthy children. Pediatr Infect Dis J. 2019;38(6):564-568. (PubMed)
287. Loeb M, Dang AD, Thiem VD, et al. Effect of Vitamin D supplementation to reduce respiratory infections in children and adolescents in Vietnam: A randomized controlled trial. Influenza Other Respir Viruses. 2019;13(2):176-183. (PubMed)
288. Kronbichler A, Kresse D, Yoon S, Lee KH, Effenberger M, Shin JI. Asymptomatic patients as a source of COVID-19 infections: A systematic review and meta-analysis. Int J Infect Dis. 2020;98:180-186. (PubMed)
289. Wiersinga WJ, Rhodes A, Cheng AC, Peacock SJ, Prescott HC. Pathophysiology, transmission, diagnosis, and treatment of coronavirus disease 2019 (COVID-19): a review. JAMA. 2020;324(8):782-793. (PubMed)
290. Ferrari D, Locatelli M. No significant association between vitamin D and COVID-19. A retrospective study from a northern Italian hospital. Int J Vitam Nutr Res. 2020:1-4. (PubMed)
291. Hastie CE, Mackay DF, Ho F, et al. Vitamin D concentrations and COVID-19 infection in UK Biobank. Diabetes Metab Syndr. 2020;14(4):561-565. (PubMed)
292. Ma H, Zhou T, Heianza Y, Qi L. Habitual use of vitamin D supplements and risk of coronavirus disease 2019 (COVID-19) infection: a prospective study in UK Biobank. Am J Clin Nutr. 2021;113(5):1275-1281. (PubMed)
293. Kaufman HW, Niles JK, Kroll MH, Bi C, Holick MF. SARS-CoV-2 positivity rates associated with circulating 25-hydroxyvitamin D levels. PLoS One. 2020;15(9):e0239252. (PubMed)
294. Merzon E, Tworowski D, Gorohovski A, et al. Low plasma 25(OH) vitamin D level is associated with increased risk of COVID-19 infection: an Israeli population-based study. FEBS J. 2020;287(17):3693-3702. (PubMed)
295. Meltzer DO, Best TJ, Zhang H, Vokes T, Arora V, Solway J. Association of vitamin D status and other clinical characteristics with COVID-19 test results. JAMA Netw Open. 2020;3(9):e2019722. (PubMed)
296. D'Avolio A, Avataneo V, Manca A, et al. 25-Hydroxyvitamin D concentrations are lower in patients with positive PCR for SARS-CoV-2. Nutrients. 2020;12(5):1359. (PubMed)
297. Ye K, Tang F, Liao X, et al. Does serum vitamin D level affect COVID-19 infection and its severity?-a case-control study. J Am Coll Nutr. 2020:1-8. (PubMed)
298. Hernandez JL, Nan D, Fernandez-Ayala M, et al. Vitamin D status in hospitalized patients with SARS-CoV-2 infection. J Clin Endocrinol Metab. 2020;106(3):e1343-e1353. (PubMed)
299. Im JH, Je YS, Baek J, Chung MH, Kwon HY, Lee JS. Nutritional status of patients with COVID-19. Int J Infect Dis. 2020;100:390-393. (PubMed)
300. Abdollahi A, Kamali Sarvestani H, Rafat Z, et al. The association between the level of serum 25(OH) vitamin D, obesity, and underlying diseases with the risk of developing COVID-19 infection: A case-control study of hospitalized patients in Tehran, Iran. J Med Virol. 2020;93(4):2359-2364. (PubMed)
301. Liu N, Sun J, Wang X, Zhang T, Zhao M, Li H. Low vitamin D status is associated with coronavirus disease 2019 outcomes: a systematic review and meta-analysis. Int J Infect Dis. 2021;104:58-64. (PubMed)
302. Panagiotou G, Tee SA, Ihsan Y, et al. Low serum 25-hydroxyvitamin D (25[OH]D) levels in patients hospitalized with COVID-19 are associated with greater disease severity. Clin Endocrinol (Oxf). 2020;93(4):508-511. (PubMed)
303. De Smet D, De Smet K, Herroelen P, Gryspeerdt S, Martens GA. Serum 25(OH)D level on hospital admission associated with COVID-19 stage and mortality. Am J Clin Pathol. 2020;155(3):381-388. (PubMed)
304. Baktash V, Hosack T, Patel N, et al. Vitamin D status and outcomes for hospitalised older patients with COVID-19. Postgrad Med J. 2020. [Epub ahead of print] (PubMed)
305. Radujkovic A, Hippchen T, Tiwari-Heckler S, Dreher S, Boxberger M, Merle U. Vitamin D deficiency and outcome of COVID-19 patients. Nutrients. 2020;12(9): 2757. (PubMed)
306. Carpagnano GE, Di Lecce V, Quaranta VN, et al. Vitamin D deficiency as a predictor of poor prognosis in patients with acute respiratory failure due to COVID-19. J Endocrinol Invest. 2020;(4):765-771. (PubMed)
307. Hastie CE, Pell JP, Sattar N. Vitamin D and COVID-19 infection and mortality in UK Biobank. Eur J Nutr. 2020;60(1):545-548. (PubMed)
308. Centers for Disease Control and Prevention. Assessing Risk Factors for Severe COVID-19 Illness. Available at: https://www.cdc.gov/coronavirus/2019-ncov/covid-data/investigations-discovery/assessing-risk-factors.html. Accessed 1/22/21.
309. Annweiler G, Corvaisier M, Gautier J, et al. Vitamin D supplementation associated to better survival in hospitalized frail elderly COVID-19 patients: the GERIA-COVID quasi-experimental study. Nutrients. 2020;12(11):3377. (PubMed)
310. Annweiler C, Hanotte B, Grandin de l'Eprevier C, Sabatier JM, Lafaie L, Celarier T. Vitamin D and survival in COVID-19 patients: A quasi-experimental study. J Steroid Biochem Mol Biol. 2020;204:105771. (PubMed)
311. Mesquita Kde C, Igreja AC, Costa IM. Atopic dermatitis and vitamin D: facts and controversies. An Bras Dermatol. 2013;88(6):945-953. (PubMed)
312. Lee SA, Hong S, Kim HJ, Lee SH, Yum HY. Correlation between serum vitamin D level and the severity of atopic dermatitis associated with food sensitization. Allergy Asthma Immunol Res. 2013;5(4):207-210. (PubMed)
313. Sudlow C, Gallacher J, Allen N, et al. UK biobank: an open access resource for identifying the causes of a wide range of complex diseases of middle and old age. PLoS Med. 2015;12(3):e1001779. (PubMed)
314. Moffatt MF, Gut IG, Demenais F, et al. A large-scale, consortium-based genomewide association study of asthma. N Engl J Med. 2010;363(13):1211-1221. (PubMed)
315. Paternoster L, Zhurov AI, Toma AM, et al. Genome-wide association study of three-dimensional facial morphology identifies a variant in PAX3 associated with nasion position. Am J Hum Genet. 2012;90(3):478-485. (PubMed)
316. Manousaki D, Paternoster L, Standl M, et al. Vitamin D levels and susceptibility to asthma, elevated immunoglobulin E levels, and atopic dermatitis: A Mendelian randomization study. PLoS Med. 2017;14(5):e1002294. (PubMed)
317. Javanbakht MH, Keshavarz SA, Djalali M, et al. Randomized controlled trial using vitamins E and D supplementation in atopic dermatitis. J Dermatolog Treat. 2011;22(3):144-150. (PubMed)
318. Amestejani M, Salehi BS, Vasigh M, et al. Vitamin D supplementation in the treatment of atopic dermatitis: a clinical trial study. J Drugs Dermatol. 2012;11(3):327-330. (PubMed)
319. Camargo CA, Jr., Ganmaa D, Sidbury R, Erdenedelger K, Radnaakhand N, Khandsuren B. Randomized trial of vitamin D supplementation for winter-related atopic dermatitis in children. J Allergy Clin Immunol. 2014;134(4):831-835.e831. (PubMed)
320. Kim G, Bae JH. Vitamin D and atopic dermatitis: A systematic review and meta-analysis. Nutrition. 2016;32(9):913-920. (PubMed)
321. Wat H, Dytoc M. Off-label uses of topical vitamin d in dermatology: a systematic review. J Cutan Med Surg. 2014;18(2):91-108. (PubMed)
322. Xue LN, Xu KQ, Zhang W, Wang Q, Wu J, Wang XY. Associations between vitamin D receptor polymorphisms and susceptibility to ulcerative colitis and Crohn's disease: a meta-analysis. Inflamm Bowel Dis. 2013;19(1):54-60. (PubMed)
323. Ananthakrishnan AN, Khalili H, Higuchi LM, et al. Higher predicted vitamin D status is associated with reduced risk of Crohn's disease. Gastroenterology. 2012;142(3):482-489. (PubMed)
324. Sadeghian M, Saneei P, Siassi F, Esmaillzadeh A. Vitamin D status in relation to Crohn's disease: meta-analysis of observational studies. Nutrition. 2016;32(5):505-514. (PubMed)
325. Jorgensen SP, Agnholt J, Glerup H, et al. Clinical trial: vitamin D3 treatment in Crohn's disease - a randomized double-blind placebo-controlled study. Aliment Pharmacol Ther. 2010;32(3):377-383. (PubMed)
326. Yang L, Weaver V, Smith JP, Bingaman S, Hartman TJ, Cantorna MT. Therapeutic effect of vitamin d supplementation in a pilot study of Crohn's patients. Clin Transl Gastroenterol. 2013;4:e33. (PubMed)
327. Raftery T, Martineau AR, Greiller CL, et al. Effects of vitamin D supplementation on intestinal permeability, cathelicidin and disease markers in Crohn's disease: Results from a randomised double-blind placebo-controlled study. United European Gastroenterol J. 2015;3(3):294-302. (PubMed)
328. Anderson JL, May HT, Horne BD, et al. Relation of vitamin D deficiency to cardiovascular risk factors, disease status, and incident events in a general healthcare population. Am J Cardiol. 2010;106(7):963-968. (PubMed)
329. Al Mheid I, Patel R, Murrow J, et al. Vitamin D status is associated with arterial stiffness and vascular dysfunction in healthy humans. J Am Coll Cardiol. 2011;58(2):186-192. (PubMed)
330. Krause R, Buhring M, Hopfenmuller W, Holick MF, Sharma AM. Ultraviolet B and blood pressure. Lancet. 1998;352(9129):709-710. (PubMed)
331. Kunutsor SK, Burgess S, Munroe PB, Khan H. Vitamin D and high blood pressure: causal association or epiphenomenon? Eur J Epidemiol. 2014;29(1):1-14. (PubMed)
332. Pilz S, Gaksch M, Kienreich K, et al. Effects of vitamin D on blood pressure and cardiovascular risk factors: a randomized controlled trial. Hypertension. 2015;65(6):1195-1201. (PubMed)
333. Arora P, Song Y, Dusek J, et al. Vitamin D therapy in individuals with prehypertension or hypertension: the DAYLIGHT trial. Circulation. 2015;131(3):254-262. (PubMed)
334. Rostand SG. Ultraviolet light may contribute to geographic and racial blood pressure differences. Hypertension. 1997;30(2 Pt 1):150-156. (PubMed)
335. Forman JP, Scott JB, Ng K, et al. Effect of vitamin D supplementation on blood pressure in blacks. Hypertension. 2013;61(4):779-785. (PubMed)
336. Witham MD, Price RJ, Struthers AD, et al. Cholecalciferol treatment to reduce blood pressure in older patients with isolated systolic hypertension: the VitDISH randomized controlled trial. JAMA Intern Med. 2013;173(18):1672-1679. (PubMed)
337. Oz F, Cizgici AY, Oflaz H, et al. Impact of vitamin D insufficiency on the epicardial coronary flow velocity and endothelial function. Coron Artery Dis. 2013;24(5):392-397. (PubMed)
338. Liu LC, Voors AA, van Veldhuisen DJ, et al. Vitamin D status and outcomes in heart failure patients. Eur J Heart Fail. 2011;13(6):619-625. (PubMed)
339. Shedeed SA. Vitamin D supplementation in infants with chronic congestive heart failure. Pediatr Cardiol. 2012;33(5):713-719. (PubMed)
340. Boxer RS, Kenny AM, Schmotzer BJ, Vest M, Fiutem JJ, Pina IL. A randomized controlled trial of high dose vitamin D3 in patients with heart failure. JACC Heart Fail. 2013;1(1):84-90. (PubMed)
341. Jiang WL, Gu HB, Zhang YF, Xia QQ, Qi J, Chen JC. Vitamin D supplementation in the treatment of chronic heart failure: a meta-analysis of randomized controlled trials. Clin Cardiol. 2016;39(1):56-61. (PubMed)
342. Zittermann A, Ernst JB, Prokop S, et al. Effect of vitamin D on all-cause mortality in heart failure (EVITA): a 3-year randomized clinical trial with 4000 IU vitamin D daily. Eur Heart J. 2017;38(29):2279-2286. (PubMed)
343. Norman AW, Henry HH. Vitamin D. In: Bowman BA, Russell RM, eds. Present Knowledge in Nutrition. 9th ed. Washington, D.C.: ILSI Press; 2006:198-210.
344. Holick MF. Vitamin D: the underappreciated D-lightful hormone that is important for skeletal and cellular health. Curr Opin Endocrinol Diabetes. 2002;9:87-98.
345. Terushkin V, Bender A, Psaty EL, Engelsen O, Wang SQ, Halpern AC. Estimated equivalency of vitamin D production from natural sun exposure versus oral vitamin D supplementation across seasons at two US latitudes. J Am Acad Dermatol. 2010;62(6):929 e921-929. (PubMed)
346. Food and Nutrition Board, Institute of Medicine. Vitamin D. Dietary Reference Intakes for Calcium, Phosphorus, Magnesium, Vitamin D, and Fluoride. Washington, D.C.: National Academies Press; 1999:250-287. (National Academy Press)
347. Ovesen L, Brot C, Jakobsen J. Food contents and biological activity of 25-hydroxyvitamin D: a vitamin D metabolite to be reckoned with? Ann Nutr Metab. 2003;47(3-4):107-113. (PubMed)
348. Jakobsen J, Christensen T. Natural vitamin D in food: to what degree does 25-hydroxyvitaminn D contribute to the vitamin D activity in food? JMBR Plus. 2020: doi: 10.1002/jbm1004.10453.
349. Tripkovic L, Lambert H, Hart K, et al. Comparison of vitamin D2 and vitamin D3 supplementation in raising serum 25-hydroxyvitamin D status: a systematic review and meta-analysis. Am J Clin Nutr. 2012;95(6):1357-1364. (PubMed)
350. Logan VF, Gray AR, Peddie MC, Harper MJ, Houghton LA. Long-term vitamin D3 supplementation is more effective than vitamin D2 in maintaining serum 25-hydroxyvitamin D status over the winter months. Br J Nutr. 2013;109(6):1082-1088. (PubMed)
351. Barger-Lux MJ, Heaney RP, Dowell S, Chen TC, Holick MF. Vitamin D and its major metabolites: serum levels after graded oral dosing in healthy men. Osteoporos Int. 1998;8(3):222-230. (PubMed)
352. Cashman KD, Seamans KM, Lucey AJ, et al. Relative effectiveness of oral 25-hydroxyvitamin D3 and vitamin D3 in raising wintertime serum 25-hydroxyvitamin D in older adults. Am J Clin Nutr. 2012;95(6):1350-1356. (PubMed)
353. Bischoff-Ferrari HA, Dawson-Hughes B, Stocklin E, et al. Oral supplementation with 25(OH)D3 versus vitamin D3: effects on 25(OH)D levels, lower extremity function, blood pressure, and markers of innate immunity. J Bone Miner Res. 2012;27(1):160-169. (PubMed)
354. Jetter A, Egli A, Dawson-Hughes B, et al. Pharmacokinetics of oral vitamin D(3) and calcifediol. Bone. 2014;59:14-19. (PubMed)
355. Navarro-Valverde C, Sosa-Henriquez M, Alhambra-Exposito MR, Quesada-Gomez JM. Vitamin D3 and calcidiol are not equipotent. J Steroid Biochem Mol Biol. 2016;164:205-208. (PubMed)
356. Shieh A, Ma C, Chun RF, et al. Effects of cholecalciferol vs calcifediol on total and free 25-hydroxyvitamin D and parathyroid hormone. J Clin Endocrinol Metab. 2017;102(4):1133-1140. (PubMed)
357. Vaes AMM, Tieland M, de Regt MF, Wittwer J, van Loon LJC, de Groot L. Dose-response effects of supplementation with calcifediol on serum 25-hydroxyvitamin D status and its metabolites: A randomized controlled trial in older adults. Clin Nutr. 2018;37(3):808-814. (PubMed)
358. Graeff-Armas LA, Bendik I, Kunz I, Schoop R, Hull S, Beck M. Supplemental 25-hydroxycholecalciferol is more effective than cholecalciferol in raising serum 25-hydroxyvitamin D concentrations in older adults. J Nutr. 2020;150(1):73-81. (PubMed)
359. Quesada-Gomez JM, Bouillon R. Is calcifediol better than cholecalciferol for vitamin D supplementation? Osteoporos Int. 2018;29(8):1697-1711. (PubMed)
360. Holick MF. Vitamin D deficiency. N Engl J Med. 2007;357(3):266-281. (PubMed)
361. Vieth R. Vitamin D supplementation, 25-hydroxyvitamin D concentrations, and safety. Am J Clin Nutr. 1999;69(5):842-856. (PubMed)
362. Heaney RP, Davies KM, Chen TC, Holick MF, Barger-Lux MJ. Human serum 25-hydroxycholecalciferol response to extended oral dosing with cholecalciferol. Am J Clin Nutr. 2003;77(1):204-210. (PubMed)
363. Vieth R, Chan PC, MacFarlane GD. Efficacy and safety of vitamin D3 intake exceeding the lowest observed adverse effect level. Am J Clin Nutr. 2001;73(2):288-294. (PubMed)
364. Knodel LC, Talbert RL. Adverse effects of hypolipidaemic drugs. Med Toxicol. 1987;2(1):10-32. (PubMed)
365. McDuffie JR, Calis KA, Booth SL, Uwaifo GI, Yanovski JA. Effects of orlistat on fat-soluble vitamins in obese adolescents. Pharmacotherapy. 2002;22(7):814-822. (PubMed)
366. Natural Medicines. Vitamin D. Professional handout/Drug interactions. Available at: https://naturalmedicines.therapeuticresearch.com. Accessed 6/11/17.
367. Panday K, Gona A, Humphrey MB. Medication-induced osteoporosis: screening and treatment strategies. Ther Adv Musculoskelet Dis. 2014;6(5):185-202. (PubMed)
368. Glass AR, Eil C. Ketoconazole-induced reduction in serum 1,25-dihydroxyvitamin D. J Clin Endocrinol Metab. 1986;63(3):766-769. (PubMed)
ビタミンE
目次
ビタミンEは4種(α、β、γ、δ)のトコフェロールと4種のトコトリエノールの合計8種の抗酸化物質で構成されている。人体において積極的に保持されるのはビタミンEの中でもα-トコフェロールのみであるため、血液や組織に最も多く存在するビタミンEはα-トコフェロールである(1)。ビタミンEの中で栄養学的に最も重要な同族体はα-トコフェロールであることから、以下の解説ではα-トコフェロールが話題の中心となる。最新の摂取推奨量(栄養所要量)においても、ビタミンEの1日当たりの推奨摂取量(RDA)はα-トコフェロールの量で表される。
機能
α-トコフェロール
α-トコフェロールはヒトにおいて抗酸化物質として主に機能する。フリーラジカルは正常な代謝の過程で、さらには喫煙や汚染物質のような環境因子にさらされる過程で主に生成する。細胞膜を構成する脂質はフリーラジカルによって酸化されやすい。脂溶性ビタミンであるα-トコフェロールはフリーラジカルの捕捉に適しており、脂質過酸化の連鎖反応を阻止する。生体における細胞膜の機能維持に加えて、α-トコフェロールは低密度リポタンパク質(LDL)中の脂質を酸化から保護する。リポタンパク質は脂質とタンパク質から構成される粒子で、血流を介して脂質を輸送する。LDLは肝臓から体の各組織へコレステロールを特異的に輸送する。酸化LDLは心疾患の進行に関与することがわかっている(疾病予防を参照)。α-トコフェロールがフリーラジカルを中和するとその抗酸化能が失われるが、ビタミンCのような抗酸化物質はα-トコフェロールの抗酸化活性を再生することができる(2, 3)。
α-トコフェロールのその他の機能としては、抗酸化以外の働きがあることが示されている。例えば、α-トコフェロールは重要な細胞情報伝達分子であるプロテインキナーゼCの活性を阻害することが知られている。α-トコフェロールは免疫細胞や炎症細胞において分子や酵素の発現・活性にも影響を与えているようである。さらに、α-トコフェロールは血小板凝集を阻害し血管拡張を促進することも示されている(4,5)。
食品に含まれるα-トコフェロールの異性体はRRR-α-トコフェロール(天然型またはd-α-トコフェロールとも言われる)である。合成したα-トコフェロールはall-rac-α-トコフェロールまたはdl-α-トコフェロールと表記され、生理活性の強さはRRR-α-トコフェロールの半分しかない(サプリメントを参照)。多くの場合、ビタミンE強化食品には合成したα-トコフェロールが含まれており、その量は一日の摂取量である30 IUの百分率で示される。本文では、α-トコフェロールの量を国際単位(IU)とmgで表記する。
γ-トコフェロール
γ-トコフェロールのヒトでの機能は現在不明である。アメリカ人の食事にはビタミンE異性体の中でγ-トコフェロールが最も多く含まれているが(食料源を参照)、一般的にγ-トコフェロールの血中濃度はα-トコフェロールの10分の1である。この現象には2つの機構が関与すると考えられている。1) α-トコフェロールは肝臓のα-トコフェロール輸送タンパク質(α-TTP)によって生体内に保持される。α-TTPは血中のリポタンパク質にα-トコフェロールを選択的に取り込んで(1)、最終的に各組織へα-トコフェロールを運搬する(6)。α-TTPとビタミンEの充足性についての情報がさらに必要な場合はライナスポーリング研究所のニュースレターを参照すること。2) α-トコフェロール以外のビタミンE同族体は速やかに代謝される(6)。γ-トコフェロールはα-トコフェロールと同様の機構で吸収されるため、微量のγ-トコフェロールが血中や組織から検出される。トコフェロール類の代謝物は尿から検出できる。α-トコフェロールよりもγ-トコフェロールの代謝物が尿に多く排出されることから、生体における必要量はγ-トコフェロールの方が少ないと示唆される(7)。γ-トコフェロールとその代謝物にはフリーラジカルの消去能があると試験管内での実験や動物試験で示されているが(8,9)、ヒトにおける有効性はまだ証明されていない。前向き研究では、血漿のγ-トコフェロール濃度の増加に伴った有意な前立腺癌のリスク低下が認められた。この研究では、血漿α-トコフェロール濃度と足の爪に蓄積したセレニウム濃度が高く、且つγ-トコフェロール濃度が高い場合には前立腺癌の予防につながることが明らかになった(10)。α-トコフェロールの摂取が血中γ-トコフェロール濃度を低下させるという事実に加えて、上記の知見はγ-トコフェロールの健康に対する効果に更なる研究が必要であることを示している(11)。血漿γ-トコフェロール濃度が比較的高いと、野菜や植物油の摂取が多いことを示している可能性があることも重要である。
欠乏症
ビタミンE欠乏は重篤な低栄養状態、α-トコフェロール輸送タンパク質の遺伝子異常、脂肪吸収不全症の患者に認められている。例えば、嚢胞性線維症や胆汁鬱滞性肝疾患の子供(食事由来の脂質の吸収不良のため脂溶性ビタミンの吸収も阻害される)は、ビタミンE欠乏の症状を示すだろう。深刻なビタミンE欠乏は平衡感覚や協調運動の障害(運動失調)、感覚神経の損傷(末梢神経障害)、筋力低下(筋疾患)、網膜の損傷(網膜色素変性)などの神経症状を呈する。このため、末梢神経障害、運動失調、網膜色素変性の患者にはビタミンE欠乏の検査をすべきである(2)。発達中の神経系はビタミンE欠乏により特に影響を受けやすい。例えば、生まれつき重篤なビタミンE欠乏症の子供はビタミンE投与が行われていない場合には神経症状が急速に進行する。一方、成人期にビタミンEの吸収不全に罹った患者は、10~20年間は神経症状を示さないだろう。ビタミンEの摂取量が少ない健常人がビタミンE欠乏症を呈するという症例は過去に無いことを強調しておく(2,12)。
ビタミンE欠乏症は実際には稀であるが、アメリカではビタミンE摂取がほとんど無い状態が日常的に生じている。1988~1994年の国民健康栄養調査III(NHANES III)で、18歳以上の16,295人の成人におけるα-トコフェロールの一日の摂取量と血中濃度を調査した。白人の27%、アフリカ系アメリカ人の41%、メキシコ系アメリカ人の28%、その他の人種の32%が20μM以下の血中α-トコフェロール濃度であることがわかった。心疾患のリスクが20μMの濃度以下の場合に上昇するという報告を基に、この濃度をカットオフ値として選んでいる(13)。より最近の2003~2006年のNHANESのデータによると、2歳以上のアメリカ人における食品(強化食品も含む)から摂取するα-トコフェロールの平均値は一日6.9 mgである(14)。この摂取量は一日の推奨量である15 mgをはるかに下回っている(RDAを参照)。実際にこの摂取量であれば、90%以上のアメリカ人が一日のビタミンE推奨量を満たしていないことになる(14)。
推奨摂取量(RDA)
以前、ビタミンEの推奨摂取量(RDA)は女性で一日8 mg、男性で10 mgであった。医学研究所の食品栄養委員会によって2000年に推奨摂取量が改定された(4)。この推奨量は、1950年代に行われたビタミンE欠乏食を摂取した男性の研究成果を基にしている。血液を試験管に取り、過酸化水素を加え、赤血球の崩壊(溶血反応)をビタミンE欠乏の指標とした。重篤なビタミンE欠乏の子供に溶血反応が認められているため、この分析はビタミンEの状態に関する臨床的に意義のある試験と考えられてきている。このことは、最新のビタミンE推奨摂取量においても、これまで通り、欠乏症の発症予防に基づいており、健康の増進や慢性疾患の予防ではないことを強調しておきたい。
疾病予防
心疾患
少なくとも5つの大規模観察研究の成果によって、ビタミンE摂取の増加に伴って心筋梗塞(心臓発作)や心臓病による死亡のリスクが男女ともに低下することが示されている。これらの試験は、健常者のビタミンE摂取量を調べ、心臓病と診断された人数もしくはそれが原因で死亡した人数を長年にわたって追跡調査した前向き研究である。それらのうちの2つの研究で、一日3~5 mg以下のα-トコフェロールを摂取していたヒトと比べて一日7 mg以上のα-トコフェロールを食事から摂取したヒトが心臓病で死亡する率はその35%であることがわかった(15,16)。その他の2つの研究で、毎日100 IU以上のRRR-α-トコフェロール(67 mgに相当)を摂取している男女は心臓病のリスクが有意に低減することが報告された(17,18)。近年、アテローム性頸動脈硬化症とその重症度(超音波検査による検出)が血漿や赤血球のα-トコフェロール濃度と逆相関することが見出されている(19-22)。Women’s Health Studyに参加した女性39,876名の無作為化プラセボ対照介入試験では、10年間にわたって一日おきに600 IUのRRR-α-トコフェロール(400 mgに相当)を摂取しても心疾患(心筋梗塞と脳卒中)の発症率に影響しないが、ビタミンEは心疾患による死亡率を24%低減することがわかった(23)。本研究はビタミンEが静脈血栓塞栓症のリスクを21%低下させることも示している(24)。しかし、健康な中年男性に実施した大規模無作為化臨床試験(試験名称:PHS II)では8年間一日おきに400 IUの合成α-トコフェロールを摂取しても心疾患のリスクに影響ないことがわかった(25)。心疾患の予防に関するビタミンE摂取の有益性については近年の総説で議論されている(26)。心臓病や腎臓病患者の介入試験では、ビタミンE摂取が心臓発作や死亡の予防に効果がないことを示している(疾病の治療を参照)。
白内障
白内障は眼球の水晶体でタンパク質が酸化されることで生じ、その酸化はα-トコフェロールのような抗酸化物質によって抑制される可能性がある。ビタミンE摂取量と白内障の発症率・重症度との関連性を検証した観察研究が行われている。研究成果は相反しており、ビタミンE摂取が白内障の進行を防ぐという報告もあれば、関連性がないという報告もある(27)。500 mgのビタミンC、400 IUの合成ビタミンE(dl-α-トコフェロール酢酸エステル:180 mgのRRR-α-トコフェロールに相当)15 mgのβ-カロテンを含む抗酸化物質を7年にわたって毎日サプリメントとして摂取しても加齢に伴う白内障の進行に効果がないことが4,629人の男女に対するプラセボ対照介入試験で明らかになった(28)。5年間の介入試験でも同様に、抗酸化物質の摂取(500 mgのビタミンC、400IU [268 mg]のRRR-α-トコフェロール、15 mgのβ-カロテン)は白内障の進行に影響しなかった(29)。4年間の無作為化プラセボ対照試験では、一日あたり500 IUの天然型のビタミンE(335 mgのRRR-α-トコフェロール)を摂取しても高齢者の白内障の発症や進行を低減化しないことが報告された(30)。50 mgの合成α-トコフェロール(25 mgのRRR-α-トコフェロールに相当)サプリメントを毎日摂っても男性喫煙者の白内障手術の実施率に影響しないことが介入試験により見出された(31)。いくつかの観察研究ではビタミンEによる白内障の進行抑制効果を示唆する結果が得られているものの、臨床試験の結果からは予防効果が認められていない。
免疫機能
α-トコフェロールが加齢に伴って衰える特定の免疫応答を高めることが知られている。例えば、一日200 mgの合成α-トコフェロール(100 mgのRRR-α-トコフェロールまたは150 IUのRRR-α-トコフェロールに相当)を数か月間摂取した高齢者は、B型肝炎{がた かんえん}ワクチンと破傷風ワクチンに応答して抗体産生が増大することがわかった(32)。しかし、α-トコフェロールによる高齢者の免疫機能の賦活はインフルエンザ(インフルエンザウィルス)のような感染症にも抵抗性を示すかどうかはわからない(33)。老人ホームに入居している高齢者に対する無作為化プラセボ対照試験で、200 IUの合成α-トコフェロール(90mgのRRR-α-トコフェロールに相当)を一年にわたって毎日摂取すると風邪のような上気道感染症の罹患率が有意に低下するが、下気道(肺)の感染症には効果がないと報告された(34)。ビタミンE摂取が高齢者において風邪などの感染症の予防につながるかについてはさらなる研究が必要である。
癌
多くの癌はフリーラジカルによるDNAの酸化損傷に起因すると考えられている。癌予防の研究の多くはα-トコフェロールによるフリーラジカルの消去能に焦点を当てている。しかし、α-トコフェロール摂取と肺癌・乳癌の発症率に有意な相関が認められないことがいくつかの大規模前向き研究で明らかになった(4)。77,126人の男女を対象としたコホート研究で、10年間にわたるビタミンEサプリメントの使用は常習喫煙者の肺癌リスクを増大させることが示された(35)。これまでに、ビタミンE摂取が癌のリスクに影響しないことがほとんどの臨床試験で明らかになっている。Women’s Health Studyに参加した女性39,876名の無作為化プラセボ対照試験(RCT)によって、10年間にわたって一日おきに600 IUのRRR-α-トコフェロール(400 mgに相当)を摂取しても癌の発症率と癌による死亡率に影響しないことがわかった(23)。ビタミンE摂取は乳癌、肺癌、大腸癌のような特定組織における癌の発症率にも効果がなかった。さらに、最近の12のRCTをまとめたメタ分析でもビタミンE摂取は癌の発症率、癌による死亡率、総死亡率に影響がないと結論されたことが近年報告された(36)。
RCTにおけるα-トコフェロールの前立腺癌に対する効果が注目を集めている。α-トコフェロールの肺癌に与える影響を調べたプラセボ対照介入試験(試験名称:ATBC)で、毎日50 mgの合成α-トコフェロール(25 mgのRRR-α-トコフェロールに相当)を喫煙者が摂取すると前立腺癌の発症率が34%低下することがわかった(37)。この試験と他の3つのRCTを統合したメタ分析によって、ビタミンEサプリメントが前立腺癌のリスクを15%低減させるという結果が得られた(35)。しかし、その後に行われた2つの大規模無作為化プラセボ対照介入試験では、ビタミンEを摂取している健康な男性において前立腺癌に対する有益性も有害性もないことがわかった。Physicians’ Healthy Study II(PHS II)では、8年間一日おきに400 IUの合成ビタミンE(180 mgのRRR-α-トコフェロールに相当)を摂取した50歳以上の14,641人の健康な男性に対して追跡調査をした(38)。これらの男性においてビタミンE摂取は前立腺癌と全ての部位の癌に対して効果がなかった。50歳以上の35,533人の健康な男性に対して前立腺癌の予防効果がないことが実証されたため、α-トコフェロールとセレニウムの同時摂取とそれぞれの単独摂取による大規模無作為化プラセボ対照介入試験(試験名称:SELECT)は近年中止となった(39,40)。この試験の5.5年後の追跡調査では、ビタミンE(一日400 IUのall-rac-α-トコフェロール)を単独摂取した被験者は統計学的に有意ではないが前立腺癌のリスクが上昇した(41)。試験中止後の解析(7年の追跡調査の中央値)によって、ビタミンE摂取群はプラセボ群と比較して前立腺癌のリスクが17%高いことが示された(42)。
病気の治療法
心疾患
観察研究によって、α-トコフェロール摂取は心疾患の治療に対して有益であることが示唆されている。例えば、冠動脈バイパス手術を受けた前歴のある男性を対象とした小規模観察研究で、一日100 IU(67 mgに相当)以下のα-トコフェロール摂取群に比べて、それ以上のα-トコフェロールを摂取した群では冠動脈アテローム性動脈硬化の進行が抑えられることが血管造影法でによる判定で判明した(43)。イギリスの無作為化プラセボ対照介入試験(CHAOS試験)では、平均18か月間400 IUまたは800 IUの合成α-トコフェロール(それぞれ180 mgと360 mgのRRR-α-トコフェロールに相当)を摂取した心臓病患者において致命的ではない心臓発作の発生が77%に低減した。しかし、α-トコフェロール摂取による心臓病の死亡率の有意な低下は認められなかった(44)。慢性腎臓透析(人工透析)患者は健常者よりも心臓病で死亡するリスクが極めて高く、酸化ストレスに曝されていることも実証されている。平均1.4年間800 IUの天然型α-トコフェロール(536 mgのRRR-α-トコフェロールに相当)を摂取した人工透析患者はプラセボ群と比較して有意に心臓病のリスクが低下した(45)。一方、その他の3つの介入試験ではα-トコフェロールによるリスク低下は認められなかった。主として癌の予防効果を調べるために実施されたATBC試験では、毎日50 mgの合成α-トコフェロール(25 mgのRRR-α-トコフェロールに相当)の摂取は過去に心臓発作を経験した患者において致命的でない心臓発作を11%低下させたが、この低下に統計的有意差はなかった(46)。同様に、心臓病患者(過去に心臓発作、脳卒中、血管障害を経験)を対象としたその他の2つの大規模試験では、400 IUの天然型α-トコフェロール(268 mgの RRR-α-トコフェロールに相当)を毎日摂取した場合(試験名称:HOPE)または300 mgの合成α-トコフェロール(150 mgのRRR-α-トコフェロールに相当)を毎日摂取した場合(試験名称:GISSI)のいずれも心臓発作や脳卒中のリスクに有意差はなかった(47,48)。血管障害または糖尿病患者による試験では、平均7年間毎日400 IUの天然型α-トコフェロールを摂取しても心血管系疾患(心筋梗塞や脳卒中)と死亡率に影響がないことが示された。注目すべきは、この試験はビタミンEを摂取する被験者において心不全のリスクをわずかに上昇させることである(49)。したがって、心臓病の治療のためにビタミンEを用いた臨床試験の大部分は有益な効果が得られていない。
臨床試験の計画を特徴づける目的で、心血管系疾患に対して高いリスクを有する患者を対象としてα-トコフェロールの用量反応試験を行った(50)。高コレステロール血症と血漿F2-イソプラスタン濃度が高値(酸化ストレスが誘導されていることを示す)の35人の男女(平均42歳)に、プラセボもしくは100、200、400、800、1,600、3,200 IUの天然型α-トコフェロール(RRR-α-トコフェロール)を16週間毎日投与した。1,600 IU以上の摂取によって有意に血漿F2-イソプラスタン濃度が低減した。被験者の酸化ストレスを軽減した一日1,600 IUの摂取はビタミンEの許容上限量(一日1,500 IU)を上回っていることに注意しなければならない(安全性を参照)。
糖尿病
糖尿病では酸化ストレスが増加しており、心血管系の合併症(心臓発作と脳卒中)が糖尿病の主な死因であるため、糖尿病患者のα‐トコフェロール摂取が提案されている。酸化ストレスのバイオマーカー(F2-イソプロスタンの尿中排泄量)が上昇している糖尿病患者に600 mgの合成α-トコフェロール(300mgのRRR-α-トコフェロールに相当)を14日間投与すると、そのバイオマーカーレベルが減少することが報告された(50)。α-トコフェロールの血中グルコース制御に及ぼす影響の研究結果は相反している。ある研究では、ビタミンEを補給すると2型糖尿病(51)と非糖尿病(52,53)患者においてインスリンの働きと糖代謝を改善することを示しているが、他の研究では2型糖尿病の糖代謝において軽度の改善または全く改善を示さないことが報告されている(54,55)。1型糖尿病(インスリン依存性)で酸化ストレスの増加も報告されている(51)。1型糖尿病患者が一日100 IUの合成型α-トコフェロール(45 mgのRRR-α-トコフェロールに相当)を一ヶ月補給することで糖化ヘモグロビンとトリグリセリドの値が大幅に改善したことが報告されている(56)。また、この研究ではα-トコフェロール摂取によって血糖値の有意な改善は認められなかったとも述べられている(57)。α-トコフェロール摂取は1型糖尿病と2型糖尿病の治療に役立つかもしれないが、十分に管理された臨床試験による証拠が不足しているのが現状である。
認知症(認知機能の障害)
脳は、アルツハイマー病のような神経変性疾患の病態に影響を与える酸化ストレスに特に脆弱である(56)。アルツハイマー患者の脳脊髄液のビタミンEレベルは低いという研究報告がある(58)。大規模プラセボ対照介入試験で、2年間毎日2,000 IUの合成α-トコフェロール(900 mg/日のRRR-α-トコフェロールに相当)を中程度の神経障害患者に投与することでアルツハイマー病による認知症の進行が有意に遅れることを発見した(59)。一方で、軽度認知症患者における3年間のプラセボ対照試験では、同様のビタミンEの投与量ではアルツハイマー病の進行に影響ないことが報告されている(60)。アルツハイマー病後の血管性認知症(脳卒中の結果として生じる認知症)はアメリカにおいて、最も一般的な認知症のタイプである。ある症例対照研究では血管性認知症の危害因子を調査し、日系アメリカ人の高齢者男性において、ビタミンEとビタミンCの摂取は血管性認知症とその他の認知症のリスクを有意に減少させたが、アルツハイマー病とは関連がないことを発見した(61)。認知症でない高齢者男性では、ビタミンEの摂取が認識力テストの高スコアと相関が認められた。これらの知見は有望ではあるが、アルツハイマー病とその他の認知症に対するα-トコフェロール補給の役割を特定するために、さらなる研究が必要である。
癌
癌細胞は急速に増殖し、アポトーシス(プログラムされた細胞死)に耐性を示す。培養細胞を用いた研究で、エステル型のビタミンEであるα-トコフェロールコハク酸エステルは様々な癌細胞に対して増殖阻害とアポトーシス誘導を示す(62,63)α-トコフェロールではなく、エステル型のα-トコフェロールコハク酸エステルが、効率的なガン細胞の増殖阻害と細胞死の誘導に必要とされる(64)。α-トコフェロールコハク酸エステルのガン細胞に及ぼす影響のメカニズムはまだ明らかでないが、エステル型は抗酸化活性を持たないという事実は抗酸化とは異なるメカニズムが寄与していることを示唆している(65)。癌の動物モデルに限ったデータで、α-トコフェロールコハク酸エステルの注射による投与で腫瘍の成長を阻害できることが示されている(66-69)が、α-トコフェロールコハク酸エステルがヒトの癌治療の有用な補助となるかどうかを決めるためには、さらに多くの研究が必要だろう。経口摂取したα-トコフェロールコハク酸エステルは腸管内でα-トコフェロールへと変換されるため、注射による投与が確実に手助けとなるだろう(70)。今のところ、ヒトにおいて経口摂取したα-トコフェロールコハク酸エステルが組織へ運ばれている証拠はない。
供給源
食料源
アメリカの食事では植物油(オリーブ油、ひまわり油、紅花油)、ナッツ類、全粒粉及び緑葉野菜に含まれているα-トコフェロールが主な供給源である。全部で8種類のビタミンE(α、β、γ、δ-トコフェロール及びトコトリエノール)は食品中で天然に存在するが、含量は異なる。食品の栄養分含量の詳細情報は、USDA食品データベースを検索すること。
サプリメント
α-トコフェロール
アメリカでは、2歳以上の人で食品(濃縮や栄養強化したものを含む)からのα-トコフェロールの平均摂取量は一日6.9 mgである(14)。これはRRR-α-トコフェロールの推奨摂取量である15 mg/日を遥かに下回っている(4)。
多くの科学者は、脂肪摂取を増やさずに、食品のみから一日に15 mg以上のα-トコフェロールを推奨量以上摂取するのは難しいと考えている。食品に含まれるすべてのα-トコフェロールはRRR-α-トコフェロール異性体の構造をとっている。ただ、サプリメントが全てそうとは限らない。ビタミンEのサプリメントは一般的に100 IUから1000 IUのα-トコフェロールを含んでいる。天然物から作られるサプリメントはRRR-α-トコフェロール(d-α-トコフェロールとも表記される)のみを含んでいる。RRR-α-トコフェロールは生体内で好んで利用される異性体であり、α-トコフェロールの中で最も生物が利用しやすい構造である。栄養強化食品と栄養補助食品でよく見られる合成α-トコフェロールは、大抵all-rac-α-トコフェロールまたはdl-α-トコフェロールと表記され、それはα-トコフェロールの異性体、全8種の混合物であることを意味している。all-rac-α-トコフェロールに存在するα-トコフェロールの異性体の半分は体では利用できないため、合成型α-トコフェロールは生物学的利用が劣っており、半分の効力しかない。サプリメント中に存在する生物学的に利用可能なα-トコフェロールのmg数を算出するには、次式を使用する。
-
RRR-α-トコフェロール(天然型またはd-α-トコフェロール):
IU × 0.67 = mg RRR-α-トコフェロール
例 100 IU = 67mg
(天然型ビタミンE 100 IUからRRR-α-トコフェロール67 mgが摂れる) -
all-rac-α-トコフェロール(合成型またはdl-α-トコフェロール):
IU × 0.45 = mg RRR-α-トコフェロール
例 100 IU = 45mg
(合成ビタミンE 100 IUからRRR-α-トコフェロール45 mgが摂れる)
α-トコフェロールコハク酸エステルとα-トコフェロール酢酸エステル(エステル型α-トコフェロール)
α-トコフェロールのサプリメントで利用可能なエステル型はα-トコフェロールコハク酸エステルとα-トコフェロール酢酸エステルである。トコフェロールエステルは保管している間、非エステル型トコフェロールよりも酸化抵抗性がある。経口摂取した時、腸内ではコハク酸または酢酸部分がトコフェロールから外れる。α-トコフェロールコハク酸エステルとα-トコフェロール酢酸エステルから生じるα-トコフェロールの生物学的利用率は遊離型のα-トコフェロールと同等である。エステル型のα-トコフェロールの国際単位(IU)は分子量から算出されるため、α-トコフェロールコハク酸エステルとα-トコフェロール酢酸エステルから生じて、体内に吸収利用されるα-トコフェロール量を換算するための係数はα-トコフェロールの係数と同じである(式を参照)(4)。α-トコフェロールではなく、エステル型のα-トコフェロールコハク酸が培養癌細胞を増殖阻害と細胞死へ効果的に誘導するのに必要とされる(病気の治療:癌を参照)。しかし、現在、ヒトが経口摂取したα-トコフェロールコハク酸エステルがα-トコフェロールコハク酸エステルとして組織に運ばれる証拠はない。
α-トコフェロールリン酸(Ester-E)
α-トコフェロールを含むサプリメントよりも、α-トコフェロールリン酸を含んでいるサプリメントの方がよりヒトにおいて効率よく吸収され、生物学的利用率が優れているという証拠はまだ発表されてない。
γ-トコフェロール
γ-トコフェロールのサプリメントやトコフェロール異性体を混合したサプリメントが市販されている(71)。トコフェロール異性体を混合したサプリメントにおけるα-トコフェロールとγ-トコフェロールの含量はそれぞれ異なるため、サプリメントのラベルを読み、トコフェロールの個々の含量を判断することが大切である。
安全性
毒性
一日2000 mg以下のα-トコフェロール(RRR-またはall-rac-α-トコフェロール)サプリメントを摂っている成人について、ごく僅かな副作用が知られている。しかし、α-トコフェロール摂取による毒性や副作用の研究のほとんどはほんの数週から数ヶ月間にわたるもので、長期的なα-トコフェロール摂取の結果として生じる副作用は十分に研究されていない。最も気になる可能性は血液凝固能の低下で、それにより人によっては出血の可能性が増加する。医学研究所の食品栄養委員会は出血の予防を根拠に、α-トコフェロールサプリメントの許容上限量(UL)を設定した(下記の表を参照)。委員会は、一日1000 mgのα-トコフェロール(1500 IU/日のRRR-α-トコフェロールまたは1100 IU/日のall-rac-α-トコフェロールに相当)は、ほぼすべての成人で出血が起こらない上限量だと考えた(4)。α-トコフェロールのある種の異性体のみが血中を循環するが、全ての異性体は吸収され、肝臓で代謝される。そのため、どのような型のα-トコフェロール(天然型でも合成品)でも吸収され、潜在的に有毒になり得る可能性があるという理論的解釈が、全てのα-トコフェロール異性体に関する許容上限摂取量(UL)策定の根拠になっている。
一部の内科医は出血のリスクを低下させるために待機手術の1ヶ月前に、高用量のビタミンE摂取の中止を勧めている。未熟児はα-トコフェロールの副作用に対して特に弱いと考えられるので、小児科医の管理の下で使用すべきである(71)。一日400 IUのビタミンE補給によって、ビタミンE欠乏症と関わりのない網膜色素変性症が進行することがわかっている(72)。
| 年齢層 | mg/日 | IU/日 d-α-トコフェロール |
|---|---|---|
| 幼児 0~12ヶ月 | 確立されていない✽ | |
| 小児 1~3歳 | 200 | 300 |
| 小児 4~8歳 | 300 | 450 |
| 小児 9~13歳 | 600 | 900 |
| 青年 14~18歳 | 800 | 1,200 |
| 成人 19歳以上 | 1,000 | 1,500 |
| ✽摂取源は食品または粉ミルクだけ | ||
ビタミンE摂取と死亡率
心臓病、末期腎不全、アルツハイマーを含む様々な病気とビタミンE摂取に関する19の臨床試験の結果をまとめたメタ解析では、成人で一日400 IU又はそれ以上のビタミンEサプリメントを摂取した人はサプリメントを摂らなかった人に比べ、死亡する可能性が6%高いことが報告されている(73)。しかしながら、ビタミンE摂取と他のビタミン・ミネラル摂取の組み合わせによって、更にリスクを分析した結果、統計学的に有意に死のリスクが増加したのは成人のULよりも高い一日2000 IUを摂取した時だけであることが分かった。その上、心血管疾患の予防や治療に対するビタミンE補給の有効性を評価するための無作為化比較試験の結果を統合した他の3例のメタ分析では、一日800 IU以下のビタミンE補給によって心血管疾患の死亡率または全死亡率が有意に増加または減少した証拠は見つかってない(74-76)。その上、最近の57の無作為化比較試験によってビタミンEの摂取量が5500 IU/日以下であれば、総死亡率に影響がないことがわかった(77)。さらに、68の無作為試験のメタ解析で、ビタミンEを単独、または他の抗酸化サプリメントと併用しても死亡のリスクに有意な変化がないことが明らかになった(78)。現時点では一日800 IU以下のビタミンE摂取であれば、心血管疾患などによって死亡する危険性が増加するという確かな証拠はない。
薬物との相互作用
抗凝血剤であるワーファリン(クマジン)、抗血小板薬であるクロピドグレル(プラビックス)やジピリダモール(ペルサチン)、非ステロイド性抗炎症薬(NSAIDs)であるアスピリンやイブロフェンなどを摂取している人は、ビタミンEサプリメントを使用すると出血のリスクが増加する可能性がある。また、抗凝血療法(抗凝血剤)を受けている人またはビタミンK欠乏の人は出血のリスクが増加するため、医師の指導なしにはα-トコフェロールサプリメントを摂取してはいけない(4)。コレスチラミン、コレスチポール、イソニアジド、ミネラルオイル、オルリスタット、スクラルファートや合成脂肪であるオレストラなどの薬物はビタミンEの吸収を低下させる可能性がある。フェノバビタール、フェニトイン、またはカルバマゼピンのような抗痙攣薬もビタミンEの血漿濃度を減少させる(4,71)。
抗酸化物質とHMG-CoAレダクターゼ阻害(スタチン)
160名の冠動脈心疾患(CHD)と低HDL値患者による3年間の無作為化比較試験によって、シンバスタチン(ゾコール)とナイアシンの組み合わせでHDL2が増加し、冠動脈狭搾症(狭小化)の進行を抑制し、心筋梗塞や脳卒中のような心血管系疾患の頻度が減少することが分かった(79)。驚いたことに、抗酸化物質(毎日1000 mgのビタミンC、800 IUのα-トコフェロール、100 mgのセレンと25 mgのβ-カロテンを摂取)と、シンバスチン-ナイアシンの組み合わせを服用した際に予防効果が減少した。しかし、20,000人以上の冠動脈狭窄症または糖尿病の男女において、シンバスチンと抗酸化物質(毎日600 mgのビタミンE、250 mgのビタミンCと20 mgのβ-カロテンを摂取)を組み合わせた大規模無作為化比較試験において、抗酸化物質の組み合わせはシンバスタチン治療の心臓保護作用に対して5年間悪影響を及ぼすことはなかった(80)。これらの相反する知見は、抗酸化物質とHMG-CoAレダクターゼ阻害剤(スタチン)のようなコレステロール降下薬間の相互作用の可能性についてさらなる研究が必要であることを示す。
ライナスポーリング研究所の推奨
成人男女におけるビタミンEの推奨摂取量(RDA)は1日15 mg(22.5 IU)である。特に、アメリカにおいて年齢2歳以上の人の90%以上が、食事だけでは一日の必要量のビタミンEを満たしていないが、高用量のビタミンE摂取が慢性疾患のリスクを減少させる決定的な証拠はない。したがって、LPIは一般的に健康な成人(19歳以上)にはマルチビタミン/ミネラルのサプリメント(30 IUの合成型ビタミンEもしくはRDAの90%のビタミンEを含む)を推奨する。 高用量のビタミンE摂取が慢性疾患のリスクを低下させるという確かな証拠はなく、また、一部の人達にはむしろ悪影響を与えるという研究報告も存在している。
高齢者(50歳以上)
ライナスポーリング研究所では、ビタミンEを含むマルチビタミン/ミネラル(MVM)サプリメントを毎日摂取することを高齢者にも推奨する。MVMは30 IUの合成型ビタミンEまたはRDAの90%を含む典型的なものとする。
Authors and Reviewers
Originally written in 2000 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in November 2004 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in June 2008 by:
Victoria J. Drake, Ph.D.
Linus Pauling Institute
Oregon State University
Reviewed in June 2008 by:
Maret G. Traber, Ph.D.
Professor of Nutrition and Exercise Sciences
Principal Investigator, Linus Pauling Institute
Oregon State University
Last updated 11/17/11 Copyright 2000-2024 Linus Pauling Institute
References
1. Traber MG. Utilization of vitamin E. Biofactors. 1999;10(2-3):115-120. (PubMed)
2. Traber MG. Vitamin E. In: Shils ME, Shike M, Ross AC, Caballero B, Cousins RJ, eds. Modern Nutrition in Health and Disease. Philadelphia: Lippincott Williams & Wilkiins; 2006:396-411.
3. Bruno RS, Leonard SW, Atkinson J, et al. Faster plasma vitamin E disappearance in smokers is normalized by vitamin C supplementation. Free Radic Biol Med. 2006;40(4):689-697. (PubMed)
4. Food and Nutrition Board, Institute of Medicine. Vitamin E. Dietary reference intakes for vitamin C, vitamin E, selenium, and carotenoids. Washington D.C.: National Academy Press; 2000:186-283. (National Academy Press)
5. Traber MG. Does vitamin E decrease heart attack risk? summary and implications with respect to dietary recommendations. J Nutr. 2001;131(2):395S-397S. (PubMed)
6. Traber MG. Vitamin E regulatory mechanisms. Annu Rev Nutr. 2007;27:347-362. (PubMed)
7. Traber MG, Elsner A, Brigelius-Flohe R. Synthetic as compared with natural vitamin E is preferentially excreted as α-CEHC in human urine: studies using deuterated α-tocopheryl acetates. FEBS Lett. 1998;437(1-2):145-148. (PubMed)
8. Christen S, Woodall AA, Shigenaga MK, Southwell-Keely PT, Duncan MW, Ames BN. γ-Tocopherol traps mutagenic electrophiles such as NO(X) and complements α-tocopherol: physiological implications. Proc Natl Acad Sci U S A. 1997;94(7):3217-3222. (PubMed)
9. Li D, Saldeen T, Mehta JL. γ-Tocopherol decreases ox-LDL-mediated activation of nuclear factor-kappaB and apoptosis in human coronary artery endothelial cells. Biochem Biophys Res Commun. 1999;259(1):157-161. (PubMed)
10. Helzlsouer KJ, Huang HY, Alberg AJ, et al. Association between alpha-tocopherol, gamma-tocopherol, selenium, and subsequent prostate cancer. J Natl Cancer Inst. 2000;92(24):2018-2023. (PubMed)
11. Jiang Q, Christen S, Shigenaga MK, Ames BN. Gamma-tocopherol, the major form of vitamin E in the US diet, deserves more attention. Am J Clin Nutr. 2001;74(6):714-722. (PubMed)
12. Traber MG. Vitamin E. In: Bowman BA, Russell RM, eds. Present Knowledge in Nutrition. 9th ed. Volume 1. Washington, D.C.: ILSI Press; 2006:211-219.
13. Ford ES, Sowell A. Serum α-tocopherol status in the United States population: findings from the Third National Health and Nutrition Examination Survey. Am J Epidemiol. 1999;150(3):290-300. (PubMed)
14. Fulgoni VL 3rd, Keast DR, Bailey, Dwyer J. Foods, fortificants, and supplements: where do Americans get their nutrients? J Nutr. 2011;141(10):18-47-1854. (PubMed)
15. Knekt P, Reunanen A, Jarvinen R, Seppanen R, Heliovaara M, Aromaa A. Antioxidant vitamin intake and coronary mortality in a longitudinal population study. Am J Epidemiol. 1994;139(12):1180-1189. (PubMed)
16. Kushi LH, Folsom AR, Prineas RJ, Mink PJ, Wu Y, Bostick RM. Dietary antioxidant vitamins and death from coronary heart disease in postmenopausal women. N Engl J Med. 1996;334(18):1156-1162. (PubMed)
17. Rimm EB, Stampfer MJ, Ascherio A, Giovannucci E, Colditz GA, Willett WC. Vitamin E consumption and the risk of coronary heart disease in men. N Engl J Med. 1993;328(20):1450-1456. (PubMed)
18. Stampfer MJ, Hennekens CH, Manson JE, Colditz GA, Rosner B, Willett WC. Vitamin E consumption and the risk of coronary disease in women. N Engl J Med. 1993;328(20):1444-1449. (PubMed)
19. Cherubini A, Zuliani G, Costantini F, et al. High vitamin E plasma levels and low low-density lipoprotein oxidation are associated with the absence of atherosclerosis in octogenarians. J Am Geriatr Soc. 2001;49(5):651-654. (PubMed)
20. Gale CR, Ashurst HE, Powers HJ, Martyn CN. Antioxidant vitamin status and carotid atherosclerosis in the elderly. Am J Clin Nutr. 2001;74(3):402-408. (PubMed)
21. McQuillan BM, Hung J, Beilby JP, Nidorf M, Thompson PL. Antioxidant vitamins and the risk of carotid atherosclerosis. The Perth Carotid Ultrasound Disease Assessment study (CUDAS). J Am Coll Cardiol. 2001;38(7):1788-1794. (PubMed)
22. Simon E, Gariepy J, Cogny A, Moatti N, Simon A, Paul JL. Erythrocyte, but not plasma, vitamin E concentration is associated with carotid intima-media thickening in asymptomatic men at risk for cardiovascular disease. Atherosclerosis. 2001;159(1):193-200. (PubMed)
23. Lee IM, Cook NR, Gaziano JM, et al. Vitamin E in the primary prevention of cardiovascular disease and cancer: the Women's Health Study: a randomized controlled trial. JAMA. 2005;294(1):56-65. (PubMed)
24. Glynn RJ, Ridker PM, Goldhaber SZ, Zee RY, Buring JE. Effects of random allocation to vitamin E supplementation on the occurrence of venous thromboembolism: report from the Women's Health Study. Circulation. 2007;116(13):1497-1503. (PubMed)
25. Sesso HD, Buring JE, Christen WG, et al. Vitamins E and C in the prevention of cardiovascular disease in men: the Physicians' Health Study II randomized controlled trial. JAMA. 2008;300(18):2123-2133. (PubMed)
26. Traber MG, Frei B, Beckman JS. Vitamin E revisited: do new data validate benefits for chronic disease prevention? Curr Opin Lipidol. 2008;19(1):30-38. (PubMed)
27. West AL, Oren GA, Moroi SE. Evidence for the use of nutritional supplements and herbal medicines in common eye diseases. Am J Ophthalmol. 2006;141(1):157-166. (PubMed)
28. A randomized, placebo-controlled, clinical trial of high-dose supplementation with vitamins C and E and β carotene for age-related cataract and vision loss: AREDS report no. 9. Arch Ophthalmol. 2001;119(10):1439-1452. (PubMed)
29. Gritz DC, Srinivasan M, Smith SD, et al. The Antioxidants in Prevention of Cataracts Study: effects of antioxidant supplements on cataract progression in South India. Br J Ophthalmol. 2006;90(7):847-851. (PubMed)
30. McNeil JJ, Robman L, Tikellis G, Sinclair MI, McCarty CA, Taylor HR. Vitamin E supplementation and cataract: randomized controlled trial. Ophthalmology. 2004;111(1):75-84. (PubMed)
31. Teikari JM, Rautalahti M, Haukka J, et al. Incidence of cataract operations in Finnish male smokers unaffected by α tocopherol or β carotene supplements. J Epidemiol Community Health. 1998;52(7):468-472. (PubMed)
32. Meydani SN, Meydani M, Blumberg JB, et al. Vitamin E supplementation and in vivo immune response in healthy elderly subjects. A randomized controlled trial. JAMA. 1997;277(17):1380-1386. (PubMed)
33. Han SN, Meydani SN. Vitamin E and infectious diseases in the aged. Proc Nutr Soc. 1999;58(3):697-705. (PubMed)
34. Meydani SN, Leka LS, Fine BC, et al. Vitamin E and respiratory tract infections in elderly nursing home residents: a randomized controlled trial. JAMA. 2004;292(7):828-836. (PubMed)
35. Slatore CG, Littman AJ, Au DH, Satia JA, White E. Long-term use of supplemental multivitamins, vitamin C, vitamin E, and folate does not reduce the risk of lung cancer. Am J Respir Crit Care Med. 2008;177(5):524-530. (PubMed)
36. Alkhenizan A, Hafez K. The role of vitamin E in the prevention of cancer: a meta-analysis of randomized controlled trials. Ann Saudi Med. 2007;27(6):409-414. (PubMed)
37. Heinonen OP, Albanes D, Virtamo J, et al. Prostate cancer and supplementation with α-tocopherol and β-carotene: incidence and mortality in a controlled trial. J Natl Cancer Inst. 1998;90(6):440-446. (PubMed)
38. Gaziano JM, Glynn RJ, Christen WG, et al. Vitamins E and C in the prevention of prostate and total cancer in men: the Physicians' Health Study II randomized controlled trial. JAMA. 2009;301(1):52-62. (PubMed)
39. Klein EA, Thompson IM, Lippman SM, et al. SELECT: the next prostate cancer prevention trial. Selenum and Vitamin E Cancer Prevention Trial. J Urol. 2001;166(4):1311-1315. (PubMed)
40. National Cancer Institute. Review of Prostate Cancer Prevention Study Shows No Benefit for Use of Selenium and Vitamin E Supplements. [Web page]. http://www.cancer.gov/newscenter/pressreleases/SELECTresults2008. Accessed 10/28/08.
41. Lippman SM, Klein EA, Goodman PJ, et al. Effect of selenium and vitamin E on risk of prostate cancer and other cancers: the Selenium and Vitamin E Cancer Prevention Trial (SELECT). JAMA. 2009;301(1):39-51. (PubMed)
42. Klein EA, Thompson IM, Jr., Tangen CM, et al. Vitamin E and the risk of prostate cancer: the Selenium and Vitamin E Cancer Prevention Trial (SELECT). JAMA. 306(14):1549-1556. (PubMed)
43. Azen SP, Qian D, Mack WJ, et al. Effect of supplementary antioxidant vitamin intake on carotid arterial wall intima-media thickness in a controlled clinical trial of cholesterol lowering. Circulation. 1996;94(10):2369-2372. (PubMed)
44. Stephens NG, Parsons A, Schofield PM, Kelly F, Cheeseman K, Mitchinson MJ. Randomised controlled trial of vitamin E in patients with coronary disease: Cambridge Heart Antioxidant Study (CHAOS). Lancet. 1996;347(9004):781-786. (PubMed)
45. Boaz M, Smetana S, Weinstein T, et al. Secondary prevention with antioxidants of cardiovascular disease in endstage renal disease (SPACE): randomised placebo-controlled trial. Lancet. 2000;356(9237):1213-1218. (PubMed)
46. Rapola JM, Virtamo J, Ripatti S, et al. Randomised trial of α-tocopherol and β-carotene supplements on incidence of major coronary events in men with previous myocardial infarction. Lancet. 1997;349(9067):1715-1720. (PubMed)
47. Yusuf S, Dagenais G, Pogue J, Bosch J, Sleight P. Vitamin E supplementation and cardiovascular events in high-risk patients. The Heart Outcomes Prevention Evaluation Study Investigators. N Engl J Med. 2000;342(3):154-160. (PubMed)
48. Gruppo Italiano per lo Studio della Sopravvivenza nell'Infarto miocardico. Dietary supplementation with n-3 polyunsaturated fatty acids and vitamin E after myocardial infarction: results of the GISSI-Prevenzione trial. Gruppo Italiano per lo Studio della Sopravvivenza nell'Infarto miocardico. Lancet. 1999;354(9177):447-455. (PubMed)
49. Lonn E, Bosch J, Yusuf S, et al. Effects of long-term vitamin E supplementation on cardiovascular events and cancer: a randomized controlled trial. JAMA. 2005;293(11):1338-1347. (PubMed)
50. Roberts LJ 2nd, Oats JA, Linton MF, et al. The relationship between dose of vitamin E and suppression of oxidative stress in humans. Free Radic Biol Med. 2007;43(10):1388-1393. (PubMed)
51. Davi G, Ciabattoni G, Consoli A, et al. In vivo formation of 8-iso-prostaglandin f2α and platelet activation in diabetes mellitus: effects of improved metabolic control and vitamin E supplementation. Circulation. 1999;99(2):224-229. (PubMed)
52. Paolisso G, D'Amore A, Giugliano D, Ceriello A, Varricchio M, D'Onofrio F. Pharmacologic doses of vitamin E improve insulin action in healthy subjects and non-insulin-dependent diabetic patients. Am J Clin Nutr. 1993;57(5):650-656. (PubMed)
53. Paolisso G, Di Maro G, Galzerano D, et al. Pharmacological doses of vitamin E and insulin action in elderly subjects. Am J Clin Nutr. 1994;59(6):1291-1296. (PubMed)
54. Paolisso G, D'Amore A, Galzerano D, et al. Daily vitamin E supplements improve metabolic control but not insulin secretion in elderly type II diabetic patients. Diabetes Care. 1993;16(11):1433-1437. (PubMed)
55. Reaven PD, Herold DA, Barnett J, Edelman S. Effects of Vitamin E on susceptibility of low-density lipoprotein and low-density lipoprotein subfractions to oxidation and on protein glycation in NIDDM. Diabetes Care. 1995;18(6):807-816. (PubMed)
56. Jain SK, McVie R, Jaramillo JJ, Palmer M, Smith T. Effect of modest vitamin E supplementation on blood glycated hemoglobin and triglyceride levels and red cell indices in type I diabetic patients. J Am Coll Nutr. 1996;15(5):458-461. (PubMed)
57. Meydani M. Antioxidants and cognitive function. Nutr Rev. 2001;59(8 Pt 2):S75-80; discussion S80-72.
58. Kontush K, Schekatolina S. Vitamin E in neurodegenerative disorders: Alzheimer's disease. Ann N Y Acad Sci. 2004;1031:249-262. (PubMed)
59. Sano M, Ernesto C, Thomas RG, et al. A controlled trial of selegiline, α-tocopherol, or both as treatment for Alzheimer's disease. The Alzheimer's Disease Cooperative Study. N Engl J Med. 1997;336(17):1216-1222. (PubMed)
60. Petersen RC, Thomas RG, Grundman M, et al. Vitamin E and donepezil for the treatment of mild cognitive impairment. N Engl J Med. 2005;352(23):2379-2388. (PubMed)
61. Masaki KH, Losonczy KG, Izmirlian G, et al. Association of vitamin E and C supplement use with cognitive function and dementia in elderly men. Neurology. 2000;54(6):1265-1272. (PubMed)
62. Yu W, Sanders BG, Kline K. RRR-α-tocopheryl succinate-induced apoptosis of human breast cancer cells involves Bax translocation to mitochondria. Cancer Res. 2003;63(10):2483-2491. (PubMed)
63. You H, Yu W, Munoz-Medellin D, Brown PH, Sanders BG, Kline K. Role of extracellular signal-regulated kinase pathway in RRR-α-tocopheryl succinate-induced differentiation of human MDA-MB-435 breast cancer cells. Mol Carcinog. 2002;33(4):228-236. (PubMed)
64. Neuzil J, Weber T, Schroder A, et al. Induction of cancer cell apoptosis by α-tocopheryl succinate: molecular pathways and structural requirements. FASEB J. 2001;15(2):403-415. (PubMed)
65. Brigelius-Flohe R, Kelly FJ, Salonen JT, Neuzil J, Zingg JM, Azzi A. The European perspective on vitamin E: current knowledge and future research. Am J Clin Nutr. 2002;76(4):703-716. (PubMed)
66. Weber T, Lu M, Andera L, et al. Vitamin E succinate is a potent novel antineoplastic agent with high selectivity and cooperativity with tumor necrosis factor-related apoptosis-inducing ligand (Apo2 ligand) in vivo. Clin Cancer Res. 2002;8(3):863-869. (PubMed)
67. Malafa MP, Fokum FD, Mowlavi A, Abusief M, King M. Vitamin E inhibits melanoma growth in mice. Surgery. 2002;131(1):85-91. (PubMed)
68. Malafa MP, Neitzel LT. Vitamin E succinate promotes breast cancer tumor dormancy. J Surg Res. 2000;93(1):163-170. (PubMed)
69. Quin J, Engle D, Litwiller A, et al. Vitamin E succinate decreases lung cancer tumor growth in mice. J Surg Res. 2005;127(2):139-143. (PubMed)
70. Cheeseman KH, Holley AE, Kelly FJ, Wasil M, Hughes L, Burton G. Biokinetics in humans of RRR-α-tocopherol: the free phenol, acetate ester, and succinate ester forms of vitamin E. Free Radic Biol Med. 1995;19(5):591-598. (PubMed)
71. Hendler SS, Rorvik DR, eds. PDR for Nutritional Supplements. Montvale: Medical Economics Company, Inc; 2001.
72. Berson EL, Rosner B, Sandberg MA, et al. A randomized trial of vitamin A and vitamin E supplementation for retinitis pigmentosa. Arch Ophthalmol. 1993;111(6):761-772. (PubMed)
73. Miller ER, Pastor-Barriuso R, Dalal D, Riemersma RA, Appel LJ, Guallar E. Meta-analysis: high-dosage vitamin E supplementation may increase all-cause mortality. Ann Intern Med. 2005;142(1):37-46. (PubMed)
74. Shekelle PG, Morton SC, Jungvig LK, et al. Effect of supplemental vitamin E for the prevention and treatment of cardiovascular disease. J Gen Intern Med. 2004;19(4):380-389. (PubMed)
75. Eidelman RS, Hollar D, Hebert PR, Lamas GA, Hennekens CH. Randomized trials of vitamin E in the treatment and prevention of cardiovascular disease. Arch Intern Med. 2004;164(14):1552-1556. (PubMed)
76. Abner EL, Schmitt FA, Mendiondo MS, Marcum JL, Kryscio RJ. Vitamin E and all-cause mortality: a meta-analysis. Curr Aging Sci. 2011; 4(2):158-170 (PubMed)
77. Vivekananthan DP, Penn MS, Sapp SK, Hsu A, Topol EJ. Use of antioxidant vitamins for the prevention of cardiovascular disease: meta-analysis of randomised trials. Lancet. 2003;361(9374):2017-2023. (PubMed)
78. Bjelakovic G, Nikolova D, Gluud LL, Simonetti RG, Gluud C. Mortality in randomized trials of antioxidant supplements for primary and secondary prevention: systematic review and meta-analysis. JAMA. 2007;297(8):842-857. (PubMed)
79. Brown BG, Zhao XQ, Chait A, et al. Simvastatin and niacin, antioxidant vitamins, or the combination for the prevention of coronary disease. N Engl J Med. 2001;345(22):1583-1592. (PubMed)
80. Collins R, Peto R, Armitage J. The MRC/BHF Heart Protection Study: preliminary results. Int J Clin Pract. 2002;56(1):53-56. (PubMed)
チアミン
目次
要約
-
チアミンの活性化形態であるチアミンピロリン酸(TPP)は、炭水化物、分岐鎖アミノ酸、および脂肪酸の代謝に関連するいくつかの酵素機能に関わっている。(詳細はこちら)
-
重篤なチアミン欠乏症は、中枢および末梢神経系を含む多数の器官系に影響する疾患である脚気を起こす。(詳細はこちら)
-
ウェルニッケ脳症は、チアミン欠乏症に次いで起こる急性神経障害である。ウェルニッケ・コルサコフ症候群は脳症に関連した症状とともに、記憶の形成が永続的に変質してしまう。(詳細はこちら)
-
チアミン欠乏症は貧弱な食事性摂取、不適切な非経口栄養の提供、胃腸での吸収低下、代謝需要の増加、またはチアミンの喪失過剰によって起こることがある。先進国では、慢性的アルコール摂取がチアミン欠乏症の第一の原因である。(詳細はこちら)
-
糖尿病患者ではブドウ糖代謝の変化が血漿チアミン濃度の低下と関連付けられてきた。チアミン欠乏症を治すことは、糖尿病患者の血管合併症リスクを下げるかもしれない。(詳細はこちら)
-
チアミン欠乏症とチアミン依存性酵素の活性低下は、アルツハイマー病と関連がある。チアミン欠乏症の動物モデルはチアミン補給によって顕著に認知障害が回復したが、アルツハイマー病患者へのチアミン補給の効果は未だにわかっていない。(詳細はこちら)
-
利尿剤に誘発されたチアミンの排泄は、うっ血性心不全患者のチアミン欠乏症リスクや疾患の重篤度を上げるかもしれない。この疾患の管理にチアミン補給を取り入れる評価をするさらなる研究が必要である。(詳細はこちら)
チアミンは別名がビタミンB1またはアノイリンという水溶性ビタミンBである(1)。1930年代に単離され特性が明らかにされたチアミンは、ビタミンとして認知された初期の有機化合物の一つである(2)。人体ではチアミンは遊離チアミンとして、また様々なリン酸化された形態で存在する。それらはチアミン一リン酸(TMP)、チアミン三リン酸(TTP)、およびチアミンピロリン酸(TPP)、別名チアミン二リン酸である。
機能
補酵素機能
遊離チアミンからTPPを合成するには、マグネシウム、アデノシン三リン酸(ATP)、およびチアミンピロホスホキナーゼという酵素が必要である。TPPは、炭水化物や分岐鎖アミノ酸の代謝に関連する4つの多成分酵素複合体の補酵素として必要である。
ピルビン酸脱水素酵素、αケトグルタル酸脱水素酵素、および分岐鎖αケト酸脱水素酵素(BCKDH)は、ミトコンドリアと呼ばれる細胞小器官内に見られるそれぞれ異なる酵素複合体を構成する。それらはピルビン酸、αケトグルタル酸、および分岐鎖アミノ酸の脱炭酸反応を触媒し、それぞれアセチル補酵素A(アセチルCoA)、スクシニルCoA、および分岐鎖アミノ酸誘導体を生成する。これらのすべては、クエン酸回路(クレブス回路)への関わりで食物からエネルギーを生成することに決定的な役割をしている(2)。ロイシン、イソロイシン、およびバリンを含む分岐鎖アミノ酸(BCAA)は最終的にアセチルCoAとスクシニルCoAに分解され、クエン酸回路を促進する。これら3つのBCAAの異化作用はコレステロールの生成にも関わり、神経伝達物質であるグルタミン酸とガンマアミノ酪酸(GABA)の合成のための窒素を提供する(3)。各々の脱水素酵素複合体はチアミン補酵素(TPP)に加えて、ナイアシン含有補酵素(NAD)、リボフラビン含有補酵素(FAD)、およびリポ酸を必要とする。
トランスケトラーゼは、サイトゾル(細胞基質)で起こるペントースリン酸経路(五炭糖リン酸回路)として知られる別の代謝回路の重要な反応を触媒する。この経路における最も重要な中間体の一つは、ATPやグアノシン三リン酸(GTP)などの高エネルギーリボヌクレオチドの合成に必要な五炭糖リン酸であるリボース-5-リン酸である。ヌクレオチドは、核酸、DNA、およびRNAの構成要素である。ペントースリン酸経路はまた、脂肪酸合成を含む様々な同化経路にナイアシン含有補酵素のNADPHを供給し、これは多くの生合成反応に必須である(1, 4)。トランスケトラーゼはチアミン欠乏症の初期に減少し、ほとんどのチアミン依存性酵素と違って赤血球に存在するので、赤血球におけるその活性の測定がチアミンの栄養状態の評価に使用されている(2)。
欠乏症
重篤なチアミン欠乏症から起こる脚気は、紀元前2600年もの早期に中国の文献に記載された。チアミン欠乏症は、心血管系、神経系、筋肉系、消化器系、および中枢抹消神経系に影響する(2)。重篤なチアミン欠乏症で影響を受ける系によって、脚気は乾性脚気、湿性脚気、脳性脚気、または胃腸の脚気にさらに分けられる(1, 5)。
乾性脚気
乾性脚気(麻痺性または神経性脚気)の主な特徴は、神経障害である。神経障害の初期には、「灼熱足症候群」が起こるかもしれない。その他の症状には、異常な(不自然な)反射や感覚の衰え、および足や腕の脱力感などがある。筋肉痛や圧痛、およびしゃがんだ体勢からの起立困難も観察されている(6)。
湿性脚気
神経性の症状に加えて、湿性脚気(心臓性の脚気)はチアミン欠乏症の心血管性兆候が特徴的であり、これには頻脈、心臓肥大、ひどい腫れ(浮腫)、呼吸困難、および究極的にはうっ血性心不全などを含む。日本の文献では、急性の劇症性湿性脚気を「衝心」と記載している(7)。
脳性脚気
脳性脚気はウェルニッケ脳症やコルサコフ精神病に至るかもしれず、アルコールを乱用する者は特にそうである。ウェルニッケ脳症の診断は「三徴候」に基づき、これは異常な眼球運動、姿勢や歩行の運動失調、および認知障害を含む。未治療のままだと、不可逆性の神経性ダメージがコルサコフ精神病として知られるさらなる臨床的兆候を引き起こすことがある。この症候群はコルサコフ認知症、コルサコフ記憶喪失、または健忘作話症候群とも呼ばれるが、混乱したり無関心な状態や、重篤な記憶喪失や最近の記憶および作業記憶の喪失を伴う深刻な記憶障害を含む。
中枢神経系に影響するチアミン欠乏症は、記憶喪失状態がない場合はウェルニッケ病と、記憶喪失症状があり眼球運動や歩行障害がある場合はウェルニッケ・コルサコフ症候群(WKS)と呼ばれる。より稀な神経性兆候には、痙攣発作も含まれることがある(8)。WKS患者のほとんどはアルコール中毒者であるが、胃がんやAIDSを含むその他の全体的栄養失調障害でも観察されている。WKS患者にチアミンの静脈投与をすると一般的に眼球の症状が迅速に改善するが、症状がどれほど長く続いたかによって、運動協調や記憶の面での改善はそれより軽いかもしれない。脳内で選択的に損傷を受けた領域での免疫細胞の活性が高まりフリーラジカルの生成が増えるというエビデンス(科学的根拠)から、チアミン欠乏症の神経性病理には酸化ストレスが重要な役割を果たしていることが示唆される(9)。
胃腸の脚気
TPPは解糖系およびクエン酸回路でブドウ糖を利用する代謝反応に決定的に重要である(図1参照)。チアミン依存性酵素の活性低下はピルビン酸からアセチルCoAへの変換とクエン酸回路の利用を制限し、ピルビン酸と乳酸の蓄積につながる。乳酸の蓄積から起こる乳酸アシドーシスはしばしば、胃腸の脚気として記載される症候群の吐き気、嘔吐、および重い腹痛に関連している(5)。
チアミン欠乏症の原因
チアミン欠乏症は、不適切なチアミン摂取、チアミン必要量の増加、体からのチアミンの喪失過剰、食物中の抗チアミン因子の摂取、またはこれらの要因の組み合わせで起こるかもしれない。
不適切な摂取
発展途上国では、不適切なチアミン摂取がチアミン欠乏症の主要な原因である(2)。チアミン欠乏症は、食事に炭水化物が多くチアミンが少ない(たとえば精米や白米など)低収入の集団で一般的である。チアミン欠乏症の母に母乳で育てられた乳児は、乳児脚気を発症しやすい。先進国では、その他の栄養素とともにチアミンの低摂取に関連するアルコール中毒が、チアミン欠乏症の第一の原因である。WKSに伴う非アルコール性症状には、食欲不振、肥満外科手術(減量手術)、胃腸の悪性腫瘍、および吸収不全症候群などがある(10~13)。ウェルニッケ脳症の症例は、ビタミン補給を欠いた非経口栄養法とも関連付けられてきた(14, 15)。
必要量の増加
チアミンの必要量増加を起こす状態には、激しい身体運動、発熱、妊娠、授乳、および思春期の成長などがある。そのような状態は、チアミン摂取がぎりぎりの者をチアミン欠乏症の症状発症のリスクにさらす。東南アジアのマラリア患者は、感染していない者に比べてチアミン欠乏症である頻度が高いことがわかっている(16, 17)。マラリア感染は、ブドウ糖の代謝的必要量を大きく増加させる。チアミンはブドウ糖代謝に関わる酵素に必要であるので、すでになりやすくなっている者のチアミン欠乏症が、マラリア感染で起こるストレスによって悪化するかもしれない。AIDSを発症してもしていなくても、HIV感染者はチアミン欠乏症リスクが高いことがわかっている(18)。さらに、慢性的アルコール乱用はチアミンの腸での吸収と利用を損なう(1)。したがって、アルコール中毒者はチアミン必要量が高くなる。チアミン欠乏症は、再栄養症候群の合併症としても見られる。すなわち、重症な飢餓の者に炭水化物を与えると、解糖系においておよびチアミン欠乏症を促進するクエン酸回路において、チアミンの必要量が増えることになる(19)。
喪失過剰
チアミンの喪失過剰は、チアミン欠乏症を促進するかもしれない。尿流を増やすことで、利尿剤は腎臓でのチアミン再吸収を妨げて尿中への排泄を増やすかもしれない(20, 21)。チアミン摂取がぎりぎりの状態で利尿剤治療を受けている患者(22)と、長期間の利尿治療を受けている者(23)のチアミン欠乏症リスクは上昇する。血液透析を必要とする腎不全の者はチアミンを高い割合で喪失し、チアミン欠乏症リスクがある(24)。液体の高摂取と高尿流率を維持しているアルコール中毒者も、チアミン喪失が増えて低チアミン摂取による作用を悪化させるかもしれない(25)。
抗チアミン因子(ATF)
食物中の抗チアミン因子(ATF)の存在も、チアミン欠乏症リスクに寄与する。ある種の植物はATFを含むが、これはチアミンと反応し、酸化された不活性の生成物を作る。紅茶やコーヒー(カフェイン抜きも含む)の大量摂取、および茶葉やビンロウジュを噛んだりすることは、それに含まれるATFが原因でヒトのチアミン枯渇と関連づけられてきた(26, 27)。ATFにはマイコトキシン(カビ毒)や、食物のチアミンを分解するチアミナーゼも含まれる。習慣的に特定の生の淡水魚、生の貝や甲殻類、およびシダを摂取する者は、チアミン欠乏症リスクが高い。なぜならこれらの食物は、通常は調理の熱で不活性化されるチアミナーゼを含むからである(1)。ナイジェリアでは、一部のナイジェリア人にとって伝統的高タンパク質食物であるアフリカカイコに含まれるチアミナーゼで促進された急性の神経性症候群(季節性運動失調)が、チアミン欠乏症と関連付けられてきた(28)。
推奨量 (RDA)
1998年に米国医学研究所の食品栄養委員会によって改訂されたチアミンのRDAは、全般的に健康な者の欠乏症を予防することに基づいている(表1)(29)。
疾病予防
白内障
49歳以上のオーストラリア人男女2,900人による横断研究で、チアミン摂取が最も多い五分位の者は最も少ない五分位の者に比べて、核性白内障に40%なりにくいことがわかった(30)。また408人の米国人女性による最近の研究で、チアミンの食事性摂取がより多いことは水晶体の混濁形成における5年間の変化と逆相関があったことがわかった(31)。しかしこれらの横断的関連は、因果関係の研究でまだ明らかになっていない。
糖尿病と血管合併症
健康な者にくらべてチアミンの血漿濃度が低く腎クリアランスが高いことが、糖尿病患者において観察される(32)。このことから1型または2型の糖尿病の者は、チアミン欠乏症リスクが高いことが示唆される。2つのチアミン輸送体であるチアミン輸送体-1(THTR-1)とチアミン輸送体-2(THTR-2)は、小腸の腸細胞によるチアミンの取り込みと腎臓の近位尿細管における再取り込みに関わっている。糖尿病患者の高血糖状態は、腎臓でのチアミン輸送体の発現を減らすことでチアミンの再取り込みに影響するのではないかと、最近の研究で示唆された(33)。逆にチアミン欠乏症は膵臓の正常な内分泌機能を損ない、高血糖を悪化させるようである。初期の研究では、チアミン欠乏症ラットの膵臓内分泌細胞におけるインスリン合成や分泌が変化していることが示された(34, 35)。ヒトでは、THTR-1を符号化する遺伝子の劣性突然変異によるチアミン欠乏症によって、チアミン反応性巨赤芽球性貧血症候群における糖尿病に至る(「代謝疾患」の項参照)。
無作為化二重盲検予備研究で、高用量チアミンのサプリメント(300 mg/日)が高血糖の者(耐糖能障害または新規に2型糖尿病と診断された者)に6週間与えられた。チアミン補給はプラセボ治療に比べて空腹時血糖やインスリン濃度がさらに上がることを防いだが、高血糖を減らせなかった(36)。しかしある研究では、チアミン補給が2型糖尿病の初期段階(すなわち糖尿病前症または初期糖尿病)における空腹時血糖濃度を改善させるかもしれないことが示された(37)。
糖尿病の者の慢性的高血糖は、微小血管疾患の病因となる。糖尿病に関係した血管損傷は、心臓(心筋症)、腎臓(腎症)、網膜(網膜症)、および末梢神経系(神経症)に影響を与えうる。糖尿病患者では、血管の成長に非常に重要な骨髄由来の内皮前駆細胞(EPC)の機能を高血糖が変えてしまう(38)。興味深いことに2型糖尿病の88人の者において、食事からの毎日のチアミン摂取が多いと体内循環のEPCが多くなり、血管内皮の健康状態が良いという相関があった(39)。糖尿病患者の血漿チアミン濃度と、血管の機能障害のマーカーである可溶性血管細胞接着分子-1(sVCAM-1)の存在の逆相関も見つかっている(32, 40)。糖尿病性腎症の初期のマーカーは尿中の血清アルブミンの存在で、微量アルブミン尿症として知られている。チアミンまたはベンフォチアミン(チアミンの誘導体)の投与によって、化学的誘発性糖尿病のラットが腎臓の合併症を発症することが防がれた(41)。微量アルブミン尿症のある40人の2型糖尿病患者による無作為化二重盲検研究で、高用量のチアミン補給(300 mg/日)によって、3ヶ月間に渡って尿中へのアルブミン排泄がプラセボに比べて減ったことがわかった(40)。培養細胞や動物モデルではチアミンによる治療が有望な結果を示している(42~44)ため、血管性の合併症に対するチアミンとその誘導体の効果が糖尿病患者で調べられるべきである。
疾病治療
アルツハイマー病
年配者の中には不適切な食事性摂取、胃腸での吸収の減少、および様々な医学的症状によって、無症状性のチアミン欠乏症を発症するリスクが高い者もいる(45, 46)。チアミン欠乏症は認知症(ウェルニッケ・コルサコフ症候群)という形態に至ることもあるので、アルツハイマー病(AD)やその他の形態の認知症との関係が調べられてきた。ADは年配者の認知機能低下が特徴的で、βアミロイド斑の沈着やリン酸化されたタウタンパク質で形成された線維のもつれ(神経原線維変化)を含む病理学的特徴を伴う(47)。陽電子放射断層撮影法(PET)によるスキャンの使用で、AD患者の脳内でブドウ糖代謝が低下していることが観察された(48)。放射標識されたブドウ糖の類似体であるフッ素18-フルオロデオキシグルコース(FDG)を使用した大規模多機関PET研究で、AD患者のFDG取り込み(ブドウ糖代謝の代替マーカー)の減少と認知障害の程度とが相関付けられた。認知的に正常な者(229人)、軽度認知障害のある者(405人)、または軽度のAD(188人)である55歳超の822人の被験者を含むこの研究で、軽度認知障害からADへの進行を脳のブドウ糖利用から予想できるのではないかということが示された(49)。興味深いことに、年配者(55歳超)における糖尿病とAD発症リスクの上昇が、9年間の縦断的研究で関連付けられた(50)。
脳内でのチアミン依存性プロセスの低下が、AD患者のブドウ糖代謝の変化と関係があるかもしれない(51)。38人の年配女性の症例対照研究で、血中チアミン、TPP、およびTMP濃度が、アルツハイマー型認知症(DAT)の者は対照群の者に比べて低かったことがわかった(52)。さらに、ADで亡くなった患者の脳内でTPP依存性酵素であるαケトグルタル酸脱水素酵素とトランスケトラーゼの活性が低下していたというエビデンスを、数人の研究者が発見した(53)。遊離チアミンとTMP濃度が正常であるのに脳内のTPP濃度が低いという発見は、チアミンの生物学的利用性が悪いというよりもTPP合成に変化があることを示唆していた。しかし、AD患者はTPP代謝酵素(チアミンピロホスホキナーゼを含む)の活性が変化しているのかどうかは明らかでない(54, 55)。ADのマウスモデルでは、チアミン誘導体であるベンフォチアミンの慢性的投与によって、脳内のTMPやTPP濃度を上げることなく認知的変化が和らいでβアミロイド斑の数が減った。このことは、脳でのベンフォチアミンの有益な効果はTPPに依存しない経路の刺激によって仲介されているであろうことを示唆していた(56)。
チアミン欠乏症は、培養神経細胞内のβアミロイド生産の増加と、動物モデルでのプラーク形成に関連付けられてきた(57, 58)。これらのADの病理学的特徴はチアミン補給で元に戻せる可能性があり、このことはチアミンがADを防ぐ可能性を示唆している。さらに、ミトコンドリアの機能障害や慢性的酸化ストレスを含むその他の障害は、チアミン欠乏症とADの病因および進行に関連付けられてきた(9, 59)。現在のところチアミン補給がADに有益であるというエビデンスはわずかで、一貫性がない。15人の患者(10人が研究を最後まで受けた)による二重盲検プラセボ対照研究で、12ヶ月にわたって3グラム/日のチアミン補給をしても、認知機能低下に何の有益な効果もなかったと報告された(60)。別の研究の予備報告でDATに対する3~8グラム/日のチアミン補給の緩やかな効果が主張されたが、この研究からの追加的データは利用可能となっていない(61)。AD患者に対する緩やかに有益な効果が、100 mg/日のチアミン誘導体(チアミンテトラヒドロフルフリルジスルフィド)による12週間の治療後に報告されたが、この研究はプラセボ対照研究ではなかった(62)。DAT患者へのチアミン使用による無作為化二重盲検プラセボ対照試験のシステマティックレビュー(総括)で、アルツハイマー病の症状に対してチアミンが有益な治療法であるとするエビデンスは見つからなかった(63)。
うっ血性心不全 (CHF)
重篤なチアミン欠乏症(湿性脚気)は心臓機能障害に至り、究極的にはうっ血性心不全(CHF)になる。先進国では脚気の症状が心臓に現れることは稀であるが、その他の原因によるCHFは一般的であり、特に年配者においてそうである。CHF治療に使用される利尿剤、とりわけフロセミドはチアミン排泄を増やすことがわかっており、チアミン欠乏症ぎりぎりになる可能性がある(64)。多くの研究でCHF患者のチアミンの栄養状態が調べられ、トランスケトラーゼ活性アッセイ(測定法)で測定された結果から、そのほとんどでチアミン欠乏症の発生率がかなり高いとわかった。一般的な集団と同様に、年配のCHF患者は若い者よりチアミン欠乏症リスクが高い(65)。CHFにおける心臓機能の重要な測定は左室駆出率(LVEF)で、これは心臓超音波検査(心エコー)で評価できる。25人の患者によるある研究で、フロセミドを80 mg/日以上の用量で使用することと98%というチアミン欠乏症罹患率との関連があったことがわかった(23)。フロセミド(80 mg/日)を少なくとも3ヶ月間服用した30人のCHF患者による無作為化二重盲検研究で、静脈投与によるチアミン治療(200 mg/日)を7日間行ったところ、静脈へのプラセボ投与に比べてLVEFが改善した(66)。その研究の30人のCHF患者全員が続けて経口チアミン治療(200 mg/日)を6週間受けたところ、平均LVEFが22%改善した。LVEFの改善はCHF患者の生存率上昇と関連があることから、この発見は関連しているかもしれない(67)。しかし、研究のサンプル数の少なさ、いくつかの研究における無作為性の欠如、およびチアミンの栄養状態のより精密な測定の必要性から、今日までに出版された研究の結論は限定的である。目下のところ、CHF患者の心臓機能の維持におけるチアミン補給の必要性は、今だに議論のあるところである。
がん
急速に成長する腫瘍のあるがん患者の中には、チアミン欠乏症が見られることがある。培養細胞や動物モデルによる研究では、急速に分裂しているがん細胞はチアミンの必要量が多いことが示されている(68)。急速に分裂するすべての細胞は高率で核酸を必要とし、がん細胞の中には核酸合成に必要なリボース-5-リン酸を提供するTPP依存性酵素のトランスケトラーゼに大きく依存しているように見えるものもある。最近の研究でTHTR-1、トランスケトラーゼ、およびミトコンドリアのTPP輸送体の濃度がヒトの乳がん組織標本で正常な組織に比べて高いことがわかり、これはがんの代謝を支えるチアミンの恒常性における適応を示唆している(69)。がん患者のチアミン補給はチアミン欠乏症を防ぐために一般的であるが、ボロスらは過剰なチアミンは実際のところいくつかの悪性腫瘍の成長を促すかもしれないと注意している(70)。このことは、実際にチアミン欠乏症のがん患者へのチアミン補給は控えめであるべきだと示唆している。現在はこの理論を裏付けたり論駁したりするヒトでの研究からのエビデンスはない。しかし、チアミン補給を考えているがん患者は、彼らのがん治療を管理する医師と話し合うことが賢明であろう。
代謝疾患
チアミン補給は、炭水化物や分岐鎖アミノ酸(BCAA)の代謝に影響する遺伝子疾患の臨床管理に含められている。
チアミン反応性ピルビン酸脱水素酵素複合体(PDHC)欠損症
PDHCにおける突然変異は、それを患う者の効率的な炭水化物酸化を妨げる。PDHC欠損症は、乳酸アシドーシス、神経変性および神経筋変性、および幼児期の死亡が一般的な特徴である。チアミン治療(数mg/日から1,000 mg/日の用量まで)に反応する患者は、PDHCのTPPに対する親和性が低下していることからPDHC欠損症を呈する(71, 72)。ビタミン補給で乳酸の蓄積を減らしてチアミン反応性患者の臨床的症状を改善できるが、それは治癒ではない(73)。
メープルシロップ尿症
BCAA代謝の先天異常は、チアミン反応性分岐鎖ケト酸尿症、別名メープルシロップ尿症を起こす。BCAAの異化経路の変化は、BCAAとその誘導体である分岐鎖ケト酸(BCKA)の蓄積によって起こる神経機能障害に至る。治療方法にはBCAA含有量を減らした合成食があり、BCKDH複合体のE2サブユニットに突然変異がある患者にはチアミン(10~1,000 mg/日)が補給される(74)。チアミン反応性の者には、BCAA制限食に頼らずともその表現型を治すためにチアミン補給が有効であることが証明されている。
チアミン反応性巨赤芽球性貧血
腸でのチアミンの取り込みを損ないチアミン欠乏症を起こすTHTR-1の変異が、チアミン反応性巨赤芽球性貧血の患者で見つかっている。この症候群は巨赤芽球性貧血、糖尿病、および聴覚喪失が特徴的である。30の症例のレビューで、追加的な神経性、視覚性、および心臓性の障害が報告された(75)。経口用量のチアミン(最大300 mg/日)で、思春期前の子供の健康を維持し高血糖を治せる。しかし思春期後では膵臓機能の低下によって、高血糖を制御するためにインスリンとともにチアミンも必要となる。ある研究では、生後4ヶ月の女児を100 mg/日のチアミンで治療しても、生後20ヶ月の段階で聴覚喪失を防げなかったことも報告された(76)。
ビオチン反応性大脳基底核疾患
ビオチン反応性大脳基底核疾患、別名チアミン代謝機能不全症候群2は、THTR-2を符号化する遺伝子の突然変異によって起こる。臨床的兆候は3~4歳ごろから現れ、亜急性脳症(混乱、眠気、意識レベルの変化)、運動失調、および痙攣発作を含む。サウジアラビアの同じ家族または部族出身の18人の患者による後ろ向き研究が、最近行われた。そのデータから、ビオチン単独療法(5~10 mg/kg/日)でその疾患の臨床的兆候が効率的に消失したが、3分の1の患者が急性発作の再発を患った。結果がうまくいかないこともしばしばであるが、チアミン補給では開始時(300~400 mg/日)も5年間の追跡期間後も、急性発作は見られなかった。早期の診断とビオチンおよびチアミンでの早急な治療が良い結果を生む(77)。
摂取源
ヒトは食事性の摂取源から、および結腸の正常な細菌叢からチアミンを得ているが、体のチアミン必要量に対する後者の寄与はよくわからない(78)。
食物の摂取源
様々な食事によって、ほとんどの者は欠乏症を予防できるだけの適切なチアミンを得られる。米国では若い成人男性の平均食事性チアミン摂取量は約2 mg/日で、若い成人女性では1.2 mg/日であった。60歳超の者の調査では、平均食事性チアミン摂取量は男性で1.4 mg/日、女性で1.1 mg/日であることがわかった(29)。しかし施設に入所することや貧困で、年配者のチアミン摂取が不適切になりやすい(79)。全粒穀物、豆類(インゲン豆やレンズ豆など)、ナッツ、赤身の豚肉、およびイーストはチアミンの豊富な摂取源である(1)。チアミンのほとんどは精白小麦粉や精白米の精製で失われてしまうので、多くの西洋諸国では小麦粉から作られた食品(パンやパスタなど)や白米はチアミンが強化されている。チアミンの豊富な食物を、ミリグラム(mg)で表記したチアミン含有量とともに表2に示す。食物の栄養素含有量についての詳細は、USDA(米国農務省)の食品成分データベースを検索のこと(80)。
サプリメント
チアミンは栄養サプリメントに含まれており、また塩酸チアミンや硝酸チアミンとして強化に利用される(81)。
安全性
毒性
食品栄養委員会はチアミンの許容上限摂取量(UL)を設定しなかった。これは、食物に含まれるチアミンまたは長期の経口補給(最大で200 mg/日)のチアミンの過剰摂取によるよく知られた中毒作用がないからである。チアミンの大用量静脈投与で、命に関わるアナフィラキシー反応が少数見られた(29)。
薬物相互作用
血中チアミン濃度が下がることが、発作性疾患(てんかん)で長期間抗けいれん薬であるフェニトインを摂取した者について報告された(82)。がんの治療で使用される薬物である5-フルオロウラシルは、チアミンからTPPへのリン酸化を阻害する(83)。利尿剤、特にフロセミドは、チアミン摂取がぎりぎりである者がチアミン欠乏症になるリスクを、チアミンの尿中排泄が増えることによって上げるかもしれない(21)。また慢性的なアルコール乱用は、食事性摂取が少ないことや、吸収や利用が損なわれることや、ビタミンの排泄が増えることによって、チアミン欠乏症と関連がある(1)。ラットに慢性的にアルコールを与えると、腸管上皮におけるチアミンの膜輸送体THTR-1の阻害に関連するチアミンの積極的吸収が減ることが示された(84)。ラットのアルコール摂取は腎臓上皮細胞におけるTHTR-1とTHTR-2の濃度を減らし、それによって腎臓のチアミン再取り込みが制限されてしまう(85)。
ライナス・ポーリング研究所の推奨
ライナス・ポーリング研究所は、男性で1,2 mg/日、女性で1.1 mg/日という食品栄養委員会の推奨を支持する。ほとんどの者に十分なチアミンが、様々な食事によって得られるはずである。一日所要量(DV)の100%を含むマルチビタミン/ミネラルのサプリメントを毎日摂取するというライナス・ポーリング研究所の推奨に従えば、少なくとも1.5 mg/日のチアミンが確実に摂取できるであろう。
年配者(50歳超)
現在、年配者のチアミン必要量が増えるというエビデンスはないが、不適切な食事性摂取やチアミンの不足が年配者の集団でより一般的であることがいくつかの研究でわかっている(79)。したがって、年配者はマルチビタミン/ミネラルのサプリメントを摂取することが賢明であり、それによって一般的に少なくとも1.5 mg/日のチアミンが得られる。
Authors and Reviewers
Originally written in 2000 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in September 2002 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in June 2007 by:
Victoria J. Drake, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in June 2013 by:
Barbara Delage, Ph.D.
Linus Pauling Institute
Oregon State University
Reviewed in July 2013 by:
Christopher Bates, D.Phil.
Honorary Senior Scientist
Formerly Head of Micronutrient Status Research
MRC Human Nutrition Research
Elsie Widdowson Laboratory
Cambridge, UK
Copyright 2000-2024 Linus Pauling Institute
References
1. Tanphaichitr V. Thiamin. In: Shils M, Olson JA, Shike M, Ross AC, eds. Modern Nutrition in Health and Disease. 9th ed. Baltimore: Williams & Wilkins; 1999:381-389.
2. Rindi G. Thiamin. In: Ziegler EE, Filer LJ, eds. Present Knowledge in Nutrition. 7th ed. Washington D.C.: ILSI Press; 1996:160-166.
3. Hutson SM, Sweatt AJ, Lanoue KF. Branched-chain [corrected] amino acid metabolism: implications for establishing safe intakes. J Nutr. 2005;135(6 Suppl):1557S-1564S. (PubMed)
4. Brody T. Nutritional Biochemistry. 2nd ed. San Diego: Academic Press; 1999.
5. Donnino M. Gastrointestinal beriberi: a previously unrecognized syndrome. Ann Intern Med. 2004;141(11):898-899. (PubMed)
6. McDowell L. Thiamin. In: Vitamins in Animal and Human Nutrition. 2nd ed. Ames: Iowa State University Press; 2000:265-310. Available at: http://www.ucv.ve/fileadmin/user_upload/facultad_agronomia/Producion_Animal/Vitamins_in_Animal_and_Human_Nutrition.pdf
7. Yamasaki H, Tada H, Kawano S, Aonuma K. Reversible pulmonary hypertension, lactic acidosis, and rapidly evolving multiple organ failure as manifestations of shoshin beriberi. Circ J. 2010;74(9):1983-1985. (PubMed)
8. Doss A, Mahad D, Romanowski CA. Wernicke encephalopathy: unusual findings in nonalcoholic patients. J Comput Assist Tomogr. 2003;27(2):235-240. (PubMed)
9. Hazell AS, Faim S, Wertheimer G, Silva VR, Marques CS. The impact of oxidative stress in thiamine deficiency: a multifactorial targeting issue. Neurochem Int. 2013;62(5):796-802. (PubMed)
10. Saad L, Silva LF, Banzato CE, Dantas CR, Garcia C, Jr. Anorexia nervosa and Wernicke-Korsakoff syndrome: a case report. J Med Case Rep. 2010;4:217. (PubMed)
11. Becker DA, Balcer LJ, Galetta SL. The Neurological Complications of Nutritional Deficiency following Bariatric Surgery. J Obes. 2012;2012:608534. (PubMed)
12. Jung ES, Kwon O, Lee SH, et al. Wernicke's encephalopathy in advanced gastric cancer. Cancer Res Treat. 2010;42(2):77-81. (PubMed)
13. Greenspon J, Perrone EE, Alaish SM. Shoshin beriberi mimicking central line sepsis in a child with short bowel syndrome. World journal of pediatrics : World J Pediatr. 2010;6(4):366-368. (PubMed)
14. Sequeira Lopes da Silva JT, Almaraz Velarde R, Olgado Ferrero F, et al. Wernicke's encephalopathy induced by total parental nutrition. Nutr Hosp. 2010;25(6):1034-1036. (PubMed)
15. Francini-Pesenti F, Brocadello F, Manara R, Santelli L, Laroni A, Caregaro L. Wernicke's syndrome during parenteral feeding: not an unusual complication. Nutrition. 2009;25(2):142-146. (PubMed)
16. Krishna S, Taylor AM, Supanaranond W, et al. Thiamine deficiency and malaria in adults from southeast Asia. Lancet. 1999;353(9152):546-549. (PubMed)
17. Mayxay M, Taylor AM, Khanthavong M, et al. Thiamin deficiency and uncomplicated falciparum malaria in Laos. Trop Med Int Health. 2007;12(3):363-369. (PubMed)
18. Muri RM, Von Overbeck J, Furrer J, Ballmer PE. Thiamin deficiency in HIV-positive patients: evaluation by erythrocyte transketolase activity and thiamin pyrophosphate effect. Clin Nutr. 1999;18(6):375-378. (PubMed)
19. Stanga Z, Brunner A, Leuenberger M, et al. Nutrition in clinical practice-the refeeding syndrome: illustrative cases and guidelines for prevention and treatment. Eur J Clin Nutr. 2008;62(6):687-694. (PubMed)
20. Suter PM, Haller J, Hany A, Vetter W. Diuretic use: a risk for subclinical thiamine deficiency in elderly patients. J Nutr Health Aging. 2000;4(2):69-71. (PubMed)
21. Rieck J, Halkin H, Almog S, et al. Urinary loss of thiamine is increased by low doses of furosemide in healthy volunteers. J Lab Clin Med. 1999;134(3):238-243. (PubMed)
22. Sica DA. Loop diuretic therapy, thiamine balance, and heart failure. Congestive heart failure 2007;13(4):244-247. (PubMed)
23. Zenuk C, Healey J, Donnelly J, Vaillancourt R, Almalki Y, Smith S. Thiamine deficiency in congestive heart failure patients receiving long term furosemide therapy. Can J Clin Pharmacol. 2003;10(4):184-8. (PubMed)
24. Hung SC, Hung SH, Tarng DC, Yang WC, Chen TW, Huang TP. Thiamine deficiency and unexplained encephalopathy in hemodialysis and peritoneal dialysis patients. Am J Kidney Dis. 2001;38(5):941-947. (PubMed)
25. Wilcox CS. Do diuretics cause thiamine deficiency? J Lab Clin Med. 1999;134(3):192-193.
26. Vimokesant SL, Hilker DM, Nakornchai S, Rungruangsak K, Dhanamitta S. Effects of betel nut and fermented fish on the thiamin status of northeastern Thais. Am J Clin Nutr. 1975;28(12):1458-1463. (PubMed)
27. Ventura A, Mafe MC, Bourguet M, Tornero C. Wernicke's encephalopathy secondary to hyperthyroidism and ingestion of thiaminase-rich products. Neurologia. 2013;28(4):257-259. (PubMed)
28. Nishimune T, Watanabe Y, Okazaki H, Akai H. Thiamin is decomposed due to Anaphe spp. entomophagy in seasonal ataxia patients in Nigeria. J Nutr. 2000;130(6):1625-1628. (PubMed)
29. Food and Nutrition Board, Institute of Medicine. Thiamin. Dietary Reference Intakes: Thiamin, Riboflavin, Niacin, Vitamin B6, Vitamin B12, Pantothenic Acid, Biotin, and Choline. Washington D.C.: National Academy Press; 1998:58-86. (National Academy Press)
30. Cumming RG, Mitchell P, Smith W. Diet and cataract: the Blue Mountains Eye Study. Ophthalmology. 2000;107(3):450-456. (PubMed)
31. Jacques PF, Taylor A, Moeller S, et al. Long-term nutrient intake and 5-year change in nuclear lens opacities. Arch Ophthalmol. 2005;123(4):517-526. (PubMed)
32. Thornalley PJ, Babaei-Jadidi R, Al Ali H, et al. High prevalence of low plasma thiamine concentration in diabetes linked to a marker of vascular disease. Diabetologia. 2007;50(10):2164-2170. (PubMed)
33. Larkin JR, Zhang F, Godfrey L, et al. Glucose-induced down regulation of thiamine transporters in the kidney proximal tubular epithelium produces thiamine insufficiency in diabetes. PLoS One. 2012;7:e53175. (PubMed)
34. Rathanaswami P, Sundaresan R. Effects of thiamine deficiency on the biosynthesis of insulin in rats. Biochem Int. 1991;24(6):1057-1062. (PubMed)
35. Rathanaswami P, Pourany A, Sundaresan R. Effects of thiamine deficiency on the secretion of insulin and the metabolism of glucose in isolated rat pancreatic islets. Biochem Int. 1991;25(3):577-583. (PubMed)
36. Alaei Shahmiri F, Soares MJ, Zhao Y, Sherriff J. High-dose thiamine supplementation improves glucose tolerance in hyperglycemic individuals: a randomized, double-blind cross-over trial. Eur J Clin Nutr. 2013. May 29 [Epub ahead of print] (PubMed)
37. Gonzalez-Ortiz M, Martinez-Abundis E, Robles-Cervantes JA, Ramirez-Ramirez V, Ramos-Zavala MG. Effect of thiamine administration on metabolic profile, cytokines and inflammatory markers in drug-naive patients with type 2 diabetes. Eur J Clin Nutr. 2011;50(2):145-149. (PubMed)
38. Tepper OM, Galiano RD, Capla JM, et al. Human endothelial progenitor cells from type II diabetics exhibit impaired proliferation, adhesion, and incorporation into vascular structures. Circulation. 2002;106(22):2781-2786. (PubMed)
39. Wong CY, Qiuwaxi J, Chen H, et al. Daily intake of thiamine correlates with the circulating level of endothelial progenitor cells and the endothelial function in patients with type II diabetes. Mol Nutr Food Res. 2008;52(12):1421-1427. (PubMed)
40. Rabbani N, Alam SS, Riaz S, et al. High-dose thiamine therapy for patients with type 2 diabetes and microalbuminuria: a randomised, double-blind placebo-controlled pilot study. Diabetologia. 2009;52(2):208-212. (PubMed)
41. Babaei-Jadidi R, Karachalias N, Ahmed N, Battah S, Thornalley PJ. Prevention of incipient diabetic nephropathy by high-dose thiamine and benfotiamine. Diabetes. 2003;52(8):2110-2120. (PubMed)
42. Hammes HP, Du X, Edelstein D, et al. Benfotiamine blocks three major pathways of hyperglycemic damage and prevents experimental diabetic retinopathy. Nature Med. 2003;9(3):294-299. (PubMed)
43. Varkonyi T, Kempler P. Diabetic neuropathy: new strategies for treatment. Diabetes Obes Metab. 2008;10(2):99-108. (PubMed)
44. Kohda Y, Shirakawa H, Yamane K, et al. Prevention of incipient diabetic cardiomyopathy by high-dose thiamine. J Toxicol Sci. 2008;33(4):459-472. (PubMed)
45. Lee DC, Chu J, Satz W, Silbergleit R. Low plasma thiamine levels in elder patients admitted through the emergency department. Acad Emerg Med. 2000;7(10):1156-1159. (PubMed)
46. Ito Y, Yamanaka K, Susaki H, Igata A. A cross-investigation between thiamin deficiency and the physical condition of elderly people who require nursing care. J Nutr Sci Vitaminol. 2012;58(3):210-216. (PubMed)
47. Prvulovic D, Hampel H. Amyloid β (A-β) and phospho-τ (p-τ) as diagnostic biomarkers in Alzheimer's disease. Clin Chem Lab Med. 2011;49:367-374. (PubMed)
48. Kish SJ. Brain energy metabolizing enzymes in Alzheimer's disease: α-ketoglutarate dehydrogenase complex and cytochrome oxidase. Ann N Y Acad Sci. 1997;826:218-228. (PubMed)
49. Langbaum JB, Chen K, Lee W, et al. Categorical and correlational analyses of baseline fluorodeoxyglucose positron emission tomography images from the Alzheimer's Disease Neuroimaging Initiative (ADNI). NeuroImage. 2009;45(4):1107-1116. (PubMed)
50. Arvanitakis Z, Wilson RS, Bienias JL, Evans DA, Bennett DA. Diabetes mellitus and risk of Alzheimer disease and decline in cognitive function. Arch Neurol. 2004;61(5):661-666. (PubMed)
51. Gibson GE, Hirsch JA, Cirio RT, Jordan BD, Fonzetti P, Elder J. Abnormal thiamine-dependent processes in Alzheimer's Disease. Lessons from diabetes. Mol Cell Neurosci. 2013;55:17-25. (PubMed)
52. Glaso M, Nordbo G, Diep L, Bohmer T. Reduced concentrations of several vitamins in normal weight patients with late-onset dementia of the Alzheimer type without vascular disease. J Nutr Health Aging. 2004;8(5):407-413. (PubMed)
53. Bender DA. Optimum nutrition: thiamin, biotin and pantothenate. Proc Nutr Soc. 1999;58(2):427-433. (PubMed)
54. Mastrogiacoma F, Bettendorff L, Grisar T, Kish SJ. Brain thiamine, its phosphate esters, and its metabolizing enzymes in Alzheimer's disease. Ann Neurol. 1996;39(5):585-591. (PubMed)
55. Heroux M, Raghavendra Rao VL, Lavoie J, Richardson JS, Butterworth RF. Alterations of thiamine phosphorylation and of thiamine-dependent enzymes in Alzheimer's disease. Metab Brain Dis. 1996;11(1):81-88. (PubMed)
56. Pan X, Gong N, Zhao J, et al. Powerful beneficial effects of benfotiamine on cognitive impairment and beta-amyloid deposition in amyloid precursor protein/presenilin-1 transgenic mice. Brain. 2010;133(Pt 5):1342-1351. (PubMed)
57. Karuppagounder SS, Xu H, Shi Q, et al. Thiamine deficiency induces oxidative stress and exacerbates the plaque pathology in Alzheimer's mouse model. Neurobiol Aging. 2009;30(10):1587-1600. (PubMed)
58. Zhang Q, Yang G, Li W, et al. Thiamine deficiency increases beta-secretase activity and accumulation of beta-amyloid peptides. Neurobiol Aging. 2011;32(1):42-53. (PubMed)
59. Dumont M, Beal MF. Neuroprotective strategies involving ROS in Alzheimer disease. Free Rad Res Med. 2011;51(5):1014-1026. (PubMed)
60. Nolan KA, Black RS, Sheu KF, Langberg J, Blass JP. A trial of thiamine in Alzheimer's disease. Arch Neurology. 1991;48(1):81-83. (PubMed)
61. Meador K, Loring D, Nichols M, et al. Preliminary findings of high-dose thiamine in dementia of Alzheimer's type. J Geriatr Psychiatry Neurol. 1993;6(4):222-229. (PubMed)
62. Mimori Y, Katsuoka H, Nakamura S. Thiamine therapy in Alzheimer's disease. Metab Brain Dis. 1996;11(1):89-94. (PubMed)
63. Rodriguez-Martin JL, Qizilbash N, Lopez-Arrieta JM. Thiamine for Alzheimer's disease (Cochrane Review). Cochrane Database Syst Rev. 2001;2:CD001498. (PubMed)
64. Hanninen SA, Darling PB, Sole MJ, Barr A, Keith ME. The prevalence of thiamin deficiency in hospitalized patients with congestive heart failure. J Am Coll Cardiol. 2006;47(2):354-361. (PubMed)
65. Wilkinson TJ, Hanger HC, George PM, Sainsbury R. Is thiamine deficiency in elderly people related to age or co-morbidity? Age Ageing. 2000;29(2):111-116. (PubMed)
66. Shimon I, Almog S, Vered Z, et al. Improved left ventricular function after thiamine supplementation in patients with congestive heart failure receiving long-term furosemide therapy. Am J Med. 1995;98(5):485-490. (PubMed)
67. Leslie D, Gheorghiade M. Is there a role for thiamine supplementation in the management of heart failure? Am Heart J. 1996;131(6):1248-1250.
68. Comin-Anduix B, Boren J, Martinez S, et al. The effect of thiamine supplementation on tumour proliferation. A metabolic control analysis study. Eur J Biochem. 2001;268(15):4177-4182. (PubMed)
69. Zastre JA, Hanberry BS, Sweet RL, et al. Up-regulation of vitamin B1 homeostasis genes in breast cancer. J Nutr Biochem. 2013. May 1 [Epub ahead of print] (PubMed)
70. Boros LG, Brandes JL, Lee WN, et al. Thiamine supplementation to cancer patients: a double edged sword. Anticancer Res. 1998;18(1B):595-602. (PubMed)
71. Naito E, Ito M, Yokota I, Saijo T, Ogawa Y, Kuroda Y. Diagnosis and molecular analysis of three male patients with thiamine-responsive pyruvate dehydrogenase complex deficiency. J Neurological Sci. 2002;201(1-2):33-37. (PubMed)
72. Patel KP, O'Brien TW, Subramony SH, Shuster J, Stacpoole PW. The spectrum of pyruvate dehydrogenase complex deficiency: clinical, biochemical and genetic features in 371 patients. Mol Genet Metab. 2012;106(3):385-394. (PubMed)
73. Lee EH, Ahn MS, Hwang JS, Ryu KH, Kim SJ, Kim SH. A Korean female patient with thiamine-responsive pyruvate dehydrogenase complex deficiency due to a novel point mutation (Y161C)in the PDHA1 gene. J Korean Med Sci. 2006;21(5):800-804. (PubMed)
74. Chuang DT, Chuang JL, Wynn RM. Lessons from genetic disorders of branched-chain amino acid metabolism. J Nutr. 2006;136(1 Suppl):243S-249S. (PubMed)
75. Shaw-Smith C, Flanagan SE, Patch AM, et al. Recessive SLC19A2 mutations are a cause of neonatal diabetes mellitus in thiamine-responsive megaloblastic anaemia. Pediatr Diabetes. 2012;13(4):314-321. (PubMed)
76. Akin L, Kurtoglu S, Kendirci M, Akin MA, Karakukcu M. Does early treatment prevent deafness in thiamine-responsive megaloblastic anaemia syndrome? J Clin Res Pediatr Endocrinol. 2011;3(1):36-39. (PubMed)
77. Alfadhel M, Almuntashri M, Jadah RH, et al. Biotin-responsive basal ganglia disease should be renamed biotin-thiamine-responsive basal ganglia disease: a retrospective review of the clinical, radiological and molecular findings of 18 new cases. Orphanet J Rare Dis. 2013;8:83. (PubMed)
78. LeBlanc JG, Milani C, de Giori GS, Sesma F, van Sinderen D, Ventura M. Bacteria as vitamin suppliers to their host: a gut microbiota perspective. Curr Opin Biotechnol. 2013;24(2):160-168. (PubMed)
79. Russell RM, Suter PM. Vitamin requirements of elderly people: an update. Am J Clin Nutr. 1993;58(1):4-14. (PubMed)
80. US Department of Agriculture, Agricultural Research Service. USDA National Nutrient Database for Standard Reference, Release 25. 2012. Available at: http://ndb.nal.usda.gov. Accessed 6/21/13.
81. Thiamin (vitamin B1). In: Hendler S, Rorvik D, eds. PDR for Nutritional Supplements. 2nd ed. Montvale: Physicians' Desk Reference Inc.; 2008:609-615.
82. Flodin N. Pharmacology of micronutrients. New York: Alan R. Liss, Inc.; 1988.
83. Schumann K. Interactions between drugs and vitamins at advanced age. Int J Vitam Nutr Res. 1999;69(3):173-178. (PubMed)
84. Subramanya SB, Subramanian VS, Said HM. Chronic alcohol consumption and intestinal thiamin absorption: effects on physiological and molecular parameters of the uptake process. Am J Physiol Gastrointest Liver Physiol. 2010;299(1):G23-G31. (PubMed)
85. Subramanian VS, Subramanya SB, Tsukamoto H, Said HM. Effect of chronic alcohol feeding on physiological and molecular parameters of renal thiamin transport. Am J Physiol Renal Physiol. 2010;299(1):F28-F34. (PubMed)
パントテン酸
目次
要約
-
ビタミンB5としても知られるパントテン酸は水溶性ビタミンで、補酵素Aの合成における前駆体である。補酵素Aは、生命を支える多くの生化学的反応に必須である。また、補酵素Aのホスホパンテテイニル基部分は、脂肪酸の合成に関わるアシルキャリアタンパク質を含むいくつかのタンパク質の生物学的活性に必要である。 (詳細はこちら)
-
パントテン酸は、すべての形態の生物に必須である。それは植物および動物由来の食物にあまねく含まれ、食事による欠乏症は非常に稀である。 (詳細はこちら)
-
米国医学研究所の食品栄養委員会は、パントテン酸の推定1日平均摂取量に基づいて、5mg/日という成人の目安量(AI)を設定した。 (詳細はこちら)
-
限定的な介入研究によるエビデンスから、パントテン酸および/またはパントテノール(アルコール類似体)が皮膚の創傷治癒過程を改善させるかもしれないことが示唆される。今なお追加的なより大規模の研究が認められている。 (詳細はこちら)
-
パントテン酸の誘導体であるパンテチンによる高用量の治療で、血清コレステロールや脂質濃度が下がることが示されてきた。パンテチンによる治療は耐用性が高いようであるが、医学的監督が欠かせない。 (詳細はこちら)
-
パントテン酸の豊富な食品は、動物の臓器(肝臓や腎臓)、魚、貝、牛乳製品、卵、アボカド、豆類、マッシュルーム、およびサツマイモなどである。 (詳細はこちら)
-
食事性およびサプリメントからのパントテン酸は毒性とほとんど何の関連もないので、許容上限摂取量(UL)が設定されていないほどである。 (詳細はこちら)
ビタミンB5としても知られるパントテン酸は、すべての形態の生命に必須である(1)。パントテン酸は、多数の化学反応に非常に重要な補酵素である補酵素Aの形態で生物の全部門に見られる(2)。
機能
パントテン酸補助因子の合成
補酵素A
パントテン酸は、生命を支える多様な生化学反応に必須の補酵素である補酵素A(CoA、図1参照)の生合成における前駆体である(下記参照)。パントテン酸キナーゼII(PanK2)は、パントテン酸から4'-ホスホパントテン酸へのリン酸化の初期段階を触媒作用する。補酵素Aとその誘導体は4'-ホスホパントテン酸の合成を阻害するが、脂肪酸のミトコンドリアへの輸送に必要なカルニチンによってこの阻害は保留可能である(3)。この生合成経路におけるその後の反応には、中間体である4'-ホスホパンテテインの合成や、補酵素Aから4'-ホスホパンテテインへの再利用などがある(図1参照)。
4'-ホスホパンテテイン
補酵素Aの4'-ホスホパンテテイニル基部分は、生物学的活性のために4'-ホスホパンテテインが必須の補助因子である酵素類へと移送可能である(4'-ホスホパンテテイニル化の項参照)。
補助因子および補助基質機能
補酵素A
補酵素Aはアシル基と反応し、アセチルCoA、スクシニルCoA、マロニルCoA、および3-ヒドロキシ-3-メチルグルタリル(HMG)-CoAなどのチオエステル誘導体を生じる。補酵素Aとそのアシル誘導体は、食事性の脂肪、炭水化物、およびタンパク質の分解によってエネルギーを作り出す反応に必要である。また、アセチルCoAとスクシニルCoAの形態の補酵素Aはクエン酸回路や、必須脂肪、コレステロール、ステロイドホルモン、ビタミンAとD、および神経伝達物質のアセチルコリンの合成、さらに脂肪酸β酸化経路に関わっている。補酵素Aの誘導体はまた、メラトニンというホルモンの合成、およびヘムと呼ばれるヘモグロビン成分に必要である。加えて、肝臓での多数の薬剤や毒素の代謝に補酵素Aが必要である(4)。
補酵素Aは、そのアセチル化反応における役割から命名された。体内のアセチル化されたタンパク質の大部分は、補酵素Aのチオエステル誘導体であるアセチルCoAによって提供されたアセテート基を加えることによって修飾される。タンパク質のアセチル化はタンパク質の全体的な電荷を変化させ、その三次元的構造を変え、その機能まで変える可能性がある。たとえば、アセチル化は脳下垂体が生成するものも含めたペプチドホルモンの活性を調整するメカニズムである(5)。またタンパク質のアセチル化は、その他の翻訳後修飾と同様に、多くのシグナル(信号)分子、転写因子、および酵素の細胞内局在化、機能、半減期を調整することが示されている。特にヒストンのアセチル化は転写(すなわちmRNAの合成)を促進することで遺伝子発現の調整に役割を果たすが、脱アセチル化されたヒストンは通常、クロマチン凝縮や遺伝子発現抑制に関連がある。ヒストンのアセチル化はクロマチンの構造変化につながることがわかっており、これはDNAとタンパク質、およびタンパク質とタンパク質同士の相互作用に影響する。ヒストンのアセチル化標識とその他の転写後修飾のクロストーク(相互干渉)はまた、その後転写される遺伝子のプロモーターへの転写調整因子の補充も促す((6)の文献でレビュー)。
最後に、多くのシグナル分子は補酵素Aによって提供された長鎖脂肪酸の付加によって修飾される。これらの修飾はタンパク質のアシル化として知られ、細胞シグナル伝達経路に中心的役割を果たす(4)。
4'-ホスホパンテテイニル化
特定の多酵素複合体は、秩序だったやり方でいくつかの反応を実施する必要があるが、4'-ホスホパンテテインアームの「キャリア」領域(またはタンパク質)への共有結合を必要とするかもしれない。このキャリア領域は、様々な酵素反応の進行中に基質または反応中間体を保持する。哺乳類では、補酵素Aから特定のキャリア領域の保存セリン残基への4'-ホスホパンテテイニル基部分の輸送は、唯一ホスホパンテテイニル転移酵素によって触媒作用がなされる(7)。4'-ホスホパンテテイニル化は、アポ酵素を十分に活性のあるホロ酵素に変換するために必要である(下記参照)。
アシルキャリアタンパク質
脂質は正常な生理学的機能に必須の脂肪分子で、あまたある中にスフィンゴ脂質(神経伝達を強化するミエリン鞘の必須成分)、リン脂質(細胞膜の重要な構造成分)、および脂肪酸を含む。脂肪酸合成酵素(FAS)は、脂肪酸の合成を触媒する多酵素複合体である。FAS複合体の中でも、アシルキャリアタンパク質(ACP)はキャリアタンパク質としての活性のために4'-ホスホパンテテインの形態でパントテン酸を必要とする(3)。ACPにとっての4'-ホスホパンテテイニル基部分のような基は、補欠分子族と呼ばれる。補欠分子族はアミノ酸を含まず、いくつかのタンパク質の生物学的活性に必要な強固に結合した補助因子である(図2参照)。アセチルCoA、マロニルCoA、およびACPはどれも、サイトゾルにおける脂肪酸の合成に必要である。脂肪酸の合成中に、アセチルCoAとマロニルCoAのアシル基は、ACPの4'-ホスホパンテテイニル基部分のスルフヒドリル基(-SH)に輸送される。補欠分子族は、増殖中の脂肪酸鎖をI型FAS複合体の酵素的中心部のそれぞれに輸送するためのフレキシブル(可撓性)アームとして使用される。ミトコンドリアでは、4'-ホスホパンテテインはミトコンドリアのII型FAS複合体にあるACP相同体に対する補欠分子族としても作用する(8)。
10-ホルミルテトラヒドロ葉酸脱水素酵素
10-ホルミルテトラヒドロ葉酸脱水素酵素(FDH)は、10-ホルミルテトラヒドロ葉酸が核酸およびアミノ酸の代謝に不可欠の補助因子であるテトラヒドロ葉酸へと変換する際に触媒作用をする(図3参照)。ACPと同様に、FDHは自身の生物学的活性のために4'-ホスホパンテテイン補欠分子族を必要とする。補欠分子族は、FDHの2つの触媒領域の活性を結びつけるスイング(揺動)アームとして働く(9,10)。ミトコンドリアのFDHの相同体も、生物学的に活性を持つために4'-ホスホパンテテイニル化を必要とする(11)。
アミノアジピン酸セミアルデヒド合成酵素
4'-ホスホパンテテイニル化は、アポ酵素であるα-アミノアジピン酸セミアルデヒド合成酵素(AASS)の生物学的活性に必要である。AASSは、ヒトにとっての必須アミノ酸であるリジンをミトコンドリアで分解する経路における初期反応を触媒する。AASSは2つの触媒領域でできている。リジンケトグルタル酸還元酵素領域がまずリジンからサッカロピンへの変換を触媒する。サッカロピンはさらに、サッカロピン脱水素酵素領域によって触媒される反応においてα-アミノアジピン酸セミアルデヒドに変換される(図4参照)。
欠乏症
ヒトでの自然発生的なパントテン酸欠乏症は非常に稀で、重篤な栄養不良の場合にのみ観察されてきた。フィリピン、ミャンマー、および日本での第二次世界大戦捕虜は、足のしびれや苦痛を伴った灼熱感や刺痛を経験した。これらの症状は、特にパントテン酸補給で緩和された(4)。ヒトのパントテン酸欠乏症は、実験的にパントテン酸キナーゼ阻害薬(オメガ>メチルパントテン酸、上記の図1参照)とパントテン酸欠乏の食事を同時投与することで誘発されてきた。この実験の参加者は、頭痛、疲労、不眠、腸の不調、および手足のしびれやひりひり感を訴えた(12)。別の研究では、パントテン酸を含まない食事のみを与えられた参加者は欠乏症の臨床的兆候を示さなかったが、何人かはだるそうで疲労を訴えた(13)。
ホモパントテン酸カルシウム(ホパンテン酸カルシウム)は、コリン作動性効果(神経伝達物質のアセチルコリンの効果に似たもの)があるパントテン酸拮抗薬である。この化合物は日本で、特にアルツハイマー病の精神機能の強化に使用されている。これの稀な副作用は、肝臓が毒素を除去することができずに起こる異常な脳機能状態である肝性脳症の発症であった。肝性脳症はパントテン酸補給によって回復し、このことから肝性脳症はホモパントテン酸で誘発されたパントテン酸欠乏症であったことが示唆される(14)。留意したいのは、パントテン酸キナーゼII(上記の図1参照)を符号化するヒトの遺伝子であるPanK2の突然変異は、4'-ホスホパンテテインおよび補酵素Aの合成障害を起こすということである(「機能」の項参照)。パントテン酸キナーゼ関連神経変性症と呼ばれるこの障害は、視覚および知的障害、ジストニア(筋緊張異常)、言語異常、行動困難、および人格障害によって特徴付けられる(15)。
しかし、パントテン酸は自然に広く分布しておりヒトでの欠乏症は非常に稀であることから、欠乏症の結果に関するほとんどの情報は動物での実験研究から集められてきた((3)の文献でレビュー)。パントテン酸欠乏症のラットは副腎に損傷が起こり、サルはヘモグロビンの成分であるヘムの合成不足から貧血になった。パントテン酸欠乏症のイヌは低血糖、呼吸促迫や頻脈、および痙攣を起こした。ニワトリは皮膚刺激、羽毛の異常、およびミエリン鞘の変性に関連した脊髄神経損傷を発症した。パントテン酸が欠乏したマウスは運動耐性が下がり、筋肉や肝臓でのブドウ糖貯蔵(グリコーゲンの形態)が減るという症状を示した。マウスはまた、皮膚刺激や毛の白髪化も起こり、これはパントテン酸の投与で元に戻った。
症状が多様なことは、パントテン酸には補酵素の形態で多数の機能があることを強く示すものである。
目安量(AI)
ヒトでのパントテン酸の必要量に関する情報がほとんどないため、米国医学研究所の食品栄養委員会は健康な集団で観察された食事性摂取量に基づいて目安量(AI)を設定した(表1)(16)。
| 年齢層 | 年齢 | 男性(mg/日) | 女性(mg/日) |
|---|---|---|---|
| 乳児 | 0~6ヶ月 | 1.7 | 1.7 |
| 乳児 | 7~12ヶ月 | 1.8 | 1.8 |
| 子供 | 1~3歳 | 2 | 2 |
| 子供 | 4~8歳 | 3 | 3 |
| 子供 | 9~13歳 | 4 | 4 |
| 青少年 | 14~18歳 | 5 | 5 |
| 成人 | 19歳以上 | 5 | 5 |
| 妊娠期 | 全年齢 | - | 6 |
| 授乳期 | 全年齢 | - | 7 |
疾病治療
創傷治癒
D-パントテン酸カルシウムおよび/またはパントテノール(図5参照)を人工的に傷つけた皮膚線維芽細胞培養物の培地に添加すると細胞増殖や細胞移動が高まり、そのためin vitro(ガラス容器内)での創傷治癒が早くなることがわかった(17,18)。同様に、ガラス容器内でパントテン酸欠乏症状態を作ると、細胞増殖中の皮膚線維芽細胞の分化マーカーの発現を誘発し、ヒトのケラチノサイト(角化細胞)の増殖を阻害した(19)。D-パンテノールまたはデクスパンテノールとしても知られるD-パントテン酸カルシウムまたはパントテノールのどちらかを含む軟膏を皮膚に塗ると、動物の皮膚の創傷閉鎖を早め、瘢痕組織の強度が増すことが示されている(3)。
創傷治癒におけるデクスパンテノールの効果はよくわかっていない。12人の健康なボランティアを含むプラセボ対照研究で、デクスパンテノールを含む軟膏を皮膚の創傷治癒モデルに塗った(12時間ごとに1~6日間)ら、細胞増殖、炎症、および組織修復のマーカーの発現が強化されるという関連があった(20)。しかしこの研究では、デクスパンテノールの局所適用に反応したこれらの変化がプラセボに比べて傷の修復プロセスを向上させたのかどうかを報告していない(20)。何の効果も示されなかった研究もある。タトゥー消去の手術を受けた患者による初期の無作為化対照試験で、1または3グラムのビタミンCと200mgまたは900mgのパントテン酸を21日間毎日併用補給しても、創傷治癒プロセスはあまり向上しなかったことがわかった(21,22)。しかし最近の無作為化二重盲検プラセボ対照研究で、デクスパンテノールのトローチ(300mg/日を最長で術後14日間)の使用によって、扁桃摘出術を受けた子供の粘膜治癒が早くなったことがわかった(23)。
高コレステロール
初期の研究で、パンテノン酸の誘導体であるパンテチンを薬理学的用量で使用すると、コレステロール低減効果があるかもしれないことが示唆された(24,25)。パンテチンは2つのパンテチン分子がジスルフィド結合(2つの硫黄分子間の化学結合)によって結合してできている(図5参照)。パンテチンは補酵素Aに構造的に関連があり、アシルキャリアタンパク質であるホルミルテトラヒドロ葉酸脱水素酵素の生物学的機能に必要な補欠分子族と、α-アミノアジピン酸セミアルデヒド合成酵素に見られる(「機能」の項参照)。16週間の無作為化二重盲検プラセボ対照研究で、毎日のパンテチン補給(600mg/日を8週間、その後900mg/日を8週間)によって、心血管疾患(CVD)リスクが低~中の120人の脂質パラメータプロフィールが大きく向上した。ベースライン(試験開始時)への調整の後で、低密度リポタンパク質コレステロール(LDL-C)およびアポリポタンパク質B(apoB)濃度を低下させること、およびトリグリセリド(中性脂肪)と高密度リポタンパク質コレステロールの比率(TG:HDL-C)を下げることにおいて、パンテチンはプラセボよりもかなり効果的であったことがわかった(26)。パンテチンは耐容性がよくコレステロール代謝を向上させるのにも有益な可能性があるようだが、パンテチンはビタミンではない。薬理学的用量のパンテチンを高い血中コレステロールやトリグリセリドの治療に使用するという決定は、適切な追跡をすることができる有資格医療提供者が合意した場合のみなされねばならない。
白髪化
パントテン酸欠乏のマウスは皮膚刺激や毛が白くなる症状を起こしたが、これはパントテン酸の投与で元に戻った。ヒトでは、パントテン酸をサプリメントとして摂取したりパントテン酸入りのシャンプーを使用したりすることが髪の色を保ったり復元したりすることができるというエビデンスはない。
摂取源
食品の摂取源
パントテン酸は、通常は補酵素A(CoA)や4'-ホスホパンテテインの成分として様々な食物に含まれる(上記の図1参照)。消化の際には、食事性の補酵素Aとホスホパンテテインは腸での吸収の前にパントテン酸に加水分解される(3)。動物の肝臓や腎臓、魚、貝、豚肉、鶏肉、卵黄、牛乳、ヨーグルト、豆類、マッシュルーム、アボカド、ブロッコリー、およびサツマイモは、パントテン酸の良好な摂取源である。穀物もパントテン酸の良好な摂取源であるが、加工や精製することで35~70%が喪失しかねない。冷凍や缶詰も同様の喪失が起こる(16)。大規模な国家的栄養調査では、パントテン酸摂取量の推定ができなかった。これは主に食物のパントテン酸含有量データが不足していたからである(16)。小規模研究では、パントテン酸の毎日の平均摂取量は成人で4~7mgと推定された。表2はパントテン酸の豊富な食物とその含有量をミリグラムで表示したものである。食物の栄養素含有量の詳細情報は、USDAの食品成分データベースを検索のこと。
腸内細菌
結腸(大腸)に通常棲み着いている細菌は、パントテン酸を合成可能である。ビオチンとパントテン酸の摂取のための特別な輸送体が結腸内壁の培養細胞において同定されたことから、ヒトは腸内細菌によって生成されたパントテン酸とビオチンを吸収できるのではないかと示唆された(27)。しかし、細菌による合成がヒトのパントテン酸摂取にどの程度貢献しているかは不明である(28)。
サプリメント
パントテノールおよびパントテン酸塩
サプリメントは一般的にパントテン酸の安定したアルコール類似体であるパントテノール(パンテノール)を含み、これはヒトでは急速にパントテン酸に変換される。パントテン酸のカルシウムおよびナトリウム塩であるD-パントテン酸カルシウムおよびナトリウムも、サプリメントとして市販されている。
パンテチン
パンテチンは日本でコレステロール低減薬として使用されており、米国では栄養補助食品として市販されている(29)。
安全性
毒性
パントテン酸はヒトに有毒であるとはされていない。注目された唯一の有害作用は、D-パントテン酸カルシウムを10~20g/日という非常に高用量で摂取した結果としての下痢である(30)。しかし、10mg/日のビオチンと300mg/日のパントテン酸を2ヶ月間併用した年配女性が、命に関わる好酸球性胸膜心膜滲出(好酸球性胸水)を起こした報告が1つある(31)。パントテン酸の食事摂取基準量(DRI)が1998年に確定された際には有害作用の報告がなかったため、米国医学研究所の食品栄養委員会はパントテン酸の許容上限摂取量(UL)を設定しなかった(16)。パンテチンは最大1,200mg/日まで一般的によく耐用性がある。しかし、吐き気や胸焼けなどの胃腸系の副作用が報告されている(29)。また、デクスパンテノール(D-パンテノール)を最大5%まで含む局所製剤は、最長1ヶ月まで安全に使用されてきた。それでもデクスパンテノール含有の軟膏の使用による皮膚刺激、接触性皮膚炎、および湿疹の報告がいくつかある(32,33)。
栄養素相互作用
大用量のパントテン酸は、ヒトのナトリウム依存性マルチビタミン輸送体(hSMVT)による腸および細胞での取り込みにおいて、ビオチンと競合する可能性がある(27,34)。
薬物相互作用
エストロゲンやプロゲスチンを含む経口避妊薬は、パントテン酸の需要を増やすかもしれない(30)。スタチン(HMG-CoA還元酵素阻害薬)と呼ばれるコレステロール低減薬またはニコチン酸 とパンテチンを併用すると、血中脂質に相加効果をもたらすかもしれない(29)。
ライナス・ポーリング研究所の推奨
健康を最大限促進し慢性疾患を防ぐために必要な食事性パントテン酸の量を決めるためのさらなるデータが必要である。ライナス・ポーリング研究所は、食品栄養委員会が設定した成人に対する5mg/日というパントテン酸の推奨量を支持する。様々な食事によって、十分なパントテン酸がほとんどの人には提供されているはずである。パントテン酸の一日摂取量(DV)を100%含むマルチビタミン/ミネラルのサプリメントを毎日摂取するというライナス・ポーリング研究所の推奨に従えば、少なくとも5mg/日の摂取が確実であろう。
年配者(50歳超)
パントテン酸の摂取または必要量が年配者では異なるというエビデンスは、現在ほとんどない。たいていのマルチビタミン/ミネラルのサプリメントで、少なくとも5mg/日のパントテン酸が摂れる。
Authors and Reviewers
Written in May 2004 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in April 2008 by:
Victoria J. Drake, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in April 2015 by:
Barbara Delage, Ph.D.
Linus Pauling Institute
Oregon State University
Reviewed in July 2015 by:
Robert B. Rucker, Ph.D.
Distinguished Professor Emeritus
Department of Nutrition and School of Medicine
University of California, Davis
Copyright 2000-2023 Linus Pauling Institute
References
1. Trumbo PR. Pantothenic acid. In: Ross AC, Caballero B, Cousins RJ, Tucker KL, Ziegler TR, eds. Modern Nutrition in Health and Disease. 11th ed. Baltimore: Lippincott Williams & Wilkins; 2014:351-357.
2. Martinez DL, Tsuchiya Y, Gout I. Coenzyme A biosynthetic machinery in mammalian cells. Biochem Soc Trans. 2014;42(4):1112-1117. (PubMed)
3. Miller JW, Rucker RB. Pantothenic acid. In: Erdman JWJ, Macdonald IA, Zeisel SH, eds. Present Knowledge in Nutrition. 10th ed. Ames: Wiley-Blackwell; 2012:375-390.
4. Bauerly K, Rucker RB. Pantothenic acid. In: Zempleni J, Rucker RB, McCormick DB, Suttie JW, eds. Handbook of vitamins. 4th ed. Boca Raton: CRC Press; 2007:289-314.
5. Takahashi A, Mizusawa K. Posttranslational modifications of proopiomelanocortin in vertebrates and their biological significance. Front Endocrinol (Lausanne). 2013;4:143. (PubMed)
6. Choudhary C, Weinert BT, Nishida Y, Verdin E, Mann M. The growing landscape of lysine acetylation links metabolism and cell signalling. Nat Rev Mol Cell Biol. 2014;15(8):536-550. (PubMed)
7. Beld J, Sonnenschein EC, Vickery CR, Noel JP, Burkart MD. The phosphopantetheinyl transferases: catalysis of a post-translational modification crucial for life. Nat Prod Rep. 2014;31(1):61-108. (PubMed)
8. Bunkoczi G, Pasta S, Joshi A, et al. Mechanism and substrate recognition of human holo ACP synthase. Chem Biol. 2007;14(11):1243-1253. (PubMed)
9. Donato H, Krupenko NI, Tsybovsky Y, Krupenko SA. 10-formyltetrahydrofolate dehydrogenase requires a 4'-phosphopantetheine prosthetic group for catalysis. J Biol Chem. 2007;282(47):34159-34166. (PubMed)
10. Strickland KC, Hoeferlin LA, Oleinik NV, Krupenko NI, Krupenko SA. Acyl carrier protein-specific 4'-phosphopantetheinyl transferase activates 10-formyltetrahydrofolate dehydrogenase. J Biol Chem. 2010;285(3):1627-1633. (PubMed)
11. Strickland KC, Krupenko NI, Dubard ME, Hu CJ, Tsybovsky Y, Krupenko SA. Enzymatic properties of ALDH1L2, a mitochondrial 10-formyltetrahydrofolate dehydrogenase. Chem Biol Interact. 2011;191(1-3):129-136. (PubMed)
12. Hodges RE, Ohlson MA, Bean WB. Pantothenic acid deficiency in man. J Clin Invest. 1958;37(11):1642-1657. (PubMed)
13. Fry PC, Fox HM, Tao HG. Metabolic response to a pantothenic acid deficient diet in humans. J Nutr Sci Vitaminol (Tokyo). 1976;22(4):339-346. (PubMed)
14. Bender DA. Optimum nutrition: thiamin, biotin and pantothenate. Proc Nutr Soc. 1999;58(2):427-433. (PubMed)
15. Kurian MA, Hayflick SJ. Pantothenate kinase-associated neurodegeneration (PKAN) and PLA2G6-associated neurodegeneration (PLAN): review of two major neurodegeneration with brain iron accumulation (NBIA) phenotypes. Int Rev Neurobiol. 2013;110:49-71. (PubMed)
16. Food and Nutrition Board, Institute of Medicine. Pantothenic acid. Dietary Reference Intakes: Thiamin, Riboflavin, Niacin, Vitamin B6, Vitamin B12, Pantothenic Acid, Biotin, and Choline. Washington, D.C.: National Academy Press; 1998:357-373. (National Academy Press)
17. Weimann BI, Hermann D. Studies on wound healing: effects of calcium D-pantothenate on the migration, proliferation and protein synthesis of human dermal fibroblasts in culture. Int J Vitam Nutr Res. 1999;69(2):113-119. (PubMed)
18. Wiederholt T, Heise R, Skazik C, et al. Calcium pantothenate modulates gene expression in proliferating human dermal fibroblasts. Exp Dermatol. 2009;18(11):969-978. (PubMed)
19. Kobayashi D, Kusama M, Onda M, Nakahata N. The effect of pantothenic acid deficiency on keratinocyte proliferation and the synthesis of keratinocyte growth factor and collagen in fibroblasts. J Pharmacol Sci. 2011;115(2):230-234. (PubMed)
20. Heise R, Skazik C, Marquardt Y, et al. Dexpanthenol modulates gene expression in skin wound healing in vivo. Skin Pharmacol Physiol. 2012;25(5):241-248. (PubMed)
21. Vaxman F, Olender S, Lambert A, et al. Effect of pantothenic acid and ascorbic acid supplementation on human skin wound healing process. A double-blind, prospective and randomized trial. Eur Surg Res. 1995;27(3):158-166. (PubMed)
22. Vaxman F, Olender S, Lambert A, Nisand G, Grenier JF. Can the wound healing process be improved by vitamin supplementation? Experimental study on humans. Eur Surg Res. 1996;28(4):306-314. (PubMed)
23. Celebi S, Tepe C, Yelken K, Celik O. Efficacy of dexpanthenol for pediatric post-tonsillectomy pain and wound healing. Ann Otol Rhinol Laryngol. 2013;122(7):464-467. (PubMed)
24. Coronel F, Tornero F, Torrente J, et al. Treatment of hyperlipemia in diabetic patients on dialysis with a physiological substance. Am J Nephrol. 1991;11(1):32-36. (PubMed)
25. Gaddi A, Descovich GC, Noseda G, et al. Controlled evaluation of pantethine, a natural hypolipidemic compound, in patients with different forms of hyperlipoproteinemia. Atherosclerosis. 1984;50(1):73-83. (PubMed)
26. Rumberger JA, Napolitano J, Azumano I, Kamiya T, Evans M. Pantethine, a derivative of vitamin B(5) used as a nutritional supplement, favorably alters low-density lipoprotein cholesterol metabolism in low- to moderate-cardiovascular risk North American subjects: a triple-blinded placebo and diet-controlled investigation. Nutr Res. 2011;31(8):608-615. (PubMed)
27. Said HM, Ortiz A, McCloud E, Dyer D, Moyer MP, Rubin S. Biotin uptake by human colonic epithelial NCM460 cells: a carrier-mediated process shared with pantothenic acid. Am J Physiol. 1998;275(5 Pt 1):C1365-1371. (PubMed)
28. Said HM. Intestinal absorption of water-soluble vitamins in health and disease. Biochem J. 2011;437(3):357-372. (PubMed)
29. Hendler SS, Rorvik DR, eds. PDR for Nutritional Supplements. 2nd ed. Montvale: Thomson Reuters; 2008.
30. Flodin N. Pharmacology of micronutrients. New York: Alan R. Liss, Inc.; 1988.
31. Debourdeau PM, Djezzar S, Estival JL, Zammit CM, Richard RC, Castot AC. Life-threatening eosinophilic pleuropericardial effusion related to vitamins B5 and H. Ann Pharmacother. 2001;35(4):424-426. (PubMed)
32. Herbst RA, Uter W, Pirker C, Geier J, Frosch PJ. Allergic and non-allergic periorbital dermatitis: patch test results of the Information Network of the Departments of Dermatology during a 5-year period. Contact Dermatitis. 2004;51(1):13-19. (PubMed)
33. Schmuth M, Wimmer MA, Hofer S, et al. Topical corticosteroid therapy for acute radiation dermatitis: a prospective, randomized, double-blind study. Br J Dermatol. 2002;146(6):983-991. (PubMed)
34. Chirapu SR, Rotter CJ, Miller EL, Varma MV, Dow RL, Finn MG. High specificity in response of the sodium-dependent multivitamin transporter to derivatives of pantothenic acid. Curr Top Med Chem. 2013;13(7):837-842. (PubMed)
ビタミンA
要約
- ビタミンAは、多数の関連する化合物群の一般名称であり、果物や植物においてプロビタミンAあるいは既成ビタミンA(レチノール)として含まれる脂溶性化合物である。(詳細はこちら)
- ビタミンAは、人体内の実質的にすべての細胞の成長と特殊化(分化)を制御することに関与している。ビタミンAは、胚発生、胎児発育中の臓器形成、正常な免疫機能、および眼の発達および視覚において重要な役割を果たしている。(詳細はこちら)
- 世界中の予防可能な失明において、ビタミンA欠乏症はその主要因とされている。子供や妊娠中の女性においてしばしば認められる。ビタミンA欠乏症は、甲状腺および皮膚疾患だけでなく感染症に対する感受性の増加と関連している。(詳細はこちら)
- 推奨されている摂取量(RDA)は、レチノール活性当量(RAE)で1日当たり700μg/日、男性については900μgRAE/日である。(詳細はこちら)
- レチノイン酸および類縁体は、急性前骨髄球性白血病および種々の皮膚疾患において、薬理学的用量で治療に用いられている。(詳細はこちら)
- 既成ビタミンAが豊富な動物性食品には、乳製品、強化シリアル、肝臓、および魚油がある。プロビタミンAカロテノイドは、サツマイモやほうれん草などのオレンジとグリーンの野菜に豊富に含まれている。(詳細はこちら)
- 既成ビタミンAの過剰摂取においては強い毒性が認められ、妊娠前および妊娠中は特に禁忌とされている。これは、重度の先天性欠損をもたらす可能性があるためである。成人のビタミンAの許容上限摂取量(UL)は、1日当たり3000μgRAEに設定されている。 ULは、カロチノイド由来のビタミンAには適用されない。(詳細はこちら)
ビタミンAは、多くの関連化合物を包含する総称である(Figure 1)。レチノール(アルコール)及びレチナール(アルデヒド)が、しばしば既成ビタミンA(preformed Vitamin A)のことをさしている。レチナールは、体内で遺伝子転写に影響するといわれるビタミンAの形態であるレチノイン酸(レチノール酸)へ変換される。レチノール、レチナール、レチノイン酸及び類縁化合物は、レチノイドといわれる。生体内でレチノールに変換されるβ-カロテンなどのカロテノイド類は、プロビタミンAカロテノイドと呼ばれる。数100種類のカロテノイド類が植物によって合成されるが、そのうちの約10%だけがプロビタミンAカロテノイドである (1)。以下の記述は、主に既成ビタミンA及びレチノイン酸に焦点をあてた内容である。
機能
ビタミンA化合物は、レチニルエステル(例えばレチニルパルミテート)の形で主に肝臓に貯蔵される必須の脂溶性分子である。通常は、レチニルエステルは加水分解されて全トランス - レチノールを生成し、これは血流中に放出する前にレチノール結合タンパク質(RBP)に結合する。全トランス-レチノール/ RBP複合体は、全トランス-レチノールを末梢組織へ送るタンパク質であるトランスサイレチンに結合して循環する (2)。カイロミクロン中のレチニルエステルとしてのビタミンAは、特に早期にビタミンAを肝外組織に送る際に重要な役割を果たすことも知られている (3,4) 。
視覚
網膜(retina)は、目の裏側に位置している。光が水晶体を通過すると、網膜によって感知され、脳が認識するための神経インパルスへ変換される。レチノールは、循環系から網膜へ輸送され、網膜色素上皮細胞に蓄積する。ここで、レチノールがエステル化されレチノールエステルが生成され、貯蔵される。必要時に、レチノールエステルが分解(加水分解)し異性化され、11-cis-レチノールを生成し、それがさらに酸化され、11-cis-レチナールを生成する。11-cis-レチナールが、光受容体間マトリックスを通過し桿状体細胞へ到達し、その細胞内でオプシンと呼ばれるタンパク質と結合し視覚色素のロドプシン(視紅とも呼ばれる)を生成する。ロドプシンを伴った桿状体細胞は、極めて微量の光を検知でき、暗視能力にとって重要なものとなる。光の光子吸収が、11-cis-レチナールをall-trans-レチナールへの異性化を触媒し、結果としてそれらを放出する。この異性化が一連のイベントの引き金となり、視神経への電気信号を発生する。視神経により放出される神経インパルスが、脳へ伝達され視覚として認識される。all-trans-レチナールは放出されるとすぐにtrans-レチノールへ変換され、光受容体間マトリックスを通り網膜上皮細胞へ運ばれ、その結果視覚サイクルが完結する (2)。網膜で利用できるレチノールが不足すると、暗順応障害を起こし、いわゆる「夜盲症」になる。
遺伝子発現の制御
レチノイン酸(RA)異性体は、遺伝子発現に影響するホルモンとして働き、多くの生理プロセスに影響を及ぼす。all-trans-RA及び9-cis-RAは、細胞質内のレチノイン酸結合タンパク質(CRABP)のある細胞核へ輸送される。細胞核内で、RAはレチノイン酸受容体タンパク質と結合する。特異的に、all-trans-RAはレチノイン酸受容体(RAR)と結合し、9-cis-RAはレチノイドX受容体(RXR)と結合する。RARとRXRはRAR/RXRヘテロ二量体を形成する。これらへテロ二量体が、レチノイン酸応答エレメント(RARE)と呼ばれる染色体の制御領域と結合する。二量体は2つのタンパク分子の複合体である。ヘテロ二量体は2つの異なるタンパクの複合体で、ホモ二量体は同じタンパクの複合体である。all-trans-RA及び9-cis-RAとRAR及びRXRとの結合は、それぞれ複合体の遺伝子転写を可能とするため、特定タンパク質の合成に影響を及ぼす。RXRは、甲状腺ホルモン受容体(THR)やビタミンD受容体(VDR)ともヘテロ二量体を形成する。このように、ビタミンA、 甲状腺ホルモン及びビタミンDは、相互作用し遺伝子転写に影響する (3)。特定遺伝子の転写に対する促進と抑制によって、レチノイン酸は、高度に特殊な生理的役割である細胞の特殊化、すなわち細胞分化に大きな役割を持つ。ビタミンAに関係する多くの生理作用は、細胞分化における役割から起こると考えられる。
免疫
ビタミンAは、免疫系の正常な機能に必要なため、一般に抗感染性ビタミンといわれる (4)。皮膚と粘膜細胞(気道、消化器官及び尿路を覆う細胞)は、バリアーとして働き、感染に対する生体内の最初の防御ラインを形成する。レチノールとその代謝物は、これらの細胞の完全性と機能性の維持に必要である (5)。ビタミンA及びレチノイン酸(RA)は、免疫反応に重要な役割を持つリンパ球などの白血球細胞の発生や分化に中心的役割を果たす。免疫系の主な制御細胞であるT-リンパ球の活性化が、RARのall-trans-RA結合に必要と考えられる (3)。
成長と発達
ビタミンAの過剰と欠乏は、両方とも先天性異常を起こすことが知られている。レチノール及びレチノイン酸(RA)は、胎児の発育に必須である (4)。胎児の発育中に、RAは、手足の発達及び心臓、眼及び耳の形成に機能を果たす (6)。さらに、RAは、成長ホルモンに対する遺伝子発現を制御することが認められている。
赤血球の産生
全ての血液細胞と同様、赤血球細胞は、幹細胞と呼ばれる前駆細胞から生成する。幹細胞は、正常な赤血球細胞への分化に関して、レチノイドに左右される。さらに、ビタミンAは、赤血球細胞中の酸素運搬体であるヘモグロビンへ導入するために、鉄を貯蔵部位から発達中の赤血球へ移動させることを助長する (2,7)。
栄養成分との相互作用
亜鉛
亜鉛欠乏は、いくつかの点でビタミンA代謝を阻害すると考えられる。(1) 亜鉛欠乏は、循環により組織(網膜など)へレチノールを輸送し、またレチノールの潜在毒性から器官を保護する、レチノール結合タンパク質(RBP)の合成を低下させる。(2) 亜鉛欠乏は、肝臓における貯蔵型であるパルミチン酸レチニルからレチノールを遊離する酵素の活性を低下させる。(3) 亜鉛は、レチノールをレチナールに変換する酵素に必要である (8,9)。現在のところ、人におけるビタミンA栄養状態に及ぼす亜鉛欠乏の健康影響は不明である (10)。
鉄
ビタミンA欠乏は、鉄欠乏性貧血を悪化させる可能性がある。ビタミンA補給は、鉄欠乏性貧血に有効であり、子供や妊婦における鉄の栄養状態を改善する。ビタミンAと鉄の補給の組み合わせは、それぞれの単独補給より、貧血抑制に有効と思われる (11)。さらに、ラットの実験から、鉄欠乏がビタミンAの血漿中レベルと肝臓中レベルを変化させることが報告されている (12,13)。
欠乏症
ビタミンA欠乏と視力
開発途上国の子供の間でのビタミンA欠乏は、主要な予防可能である視力喪失の原因である (14)。ビタミンA欠乏の初期の形跡は、暗所順応障害や夜盲症である。軽度のビタミンA欠乏は、「ビトー斑点」と呼ばれる結膜(眼の隅)中の変化を引き起こす。重度または継続的なビタミンA欠乏は、眼球乾燥症(ドライアイ)と呼ばれる症状を起こし、それは角膜(眼の透明膜)細胞の変化で特徴付けられ、最終的に角膜潰瘍、角膜瘢痕及び失明を起こす (4,9)。
ビタミンA欠乏と感染症
ビタミンA欠乏は、栄養的な後天性免疫不全疾患とみなすことができる (15)。ごく軽度のビタミンA不足の子供でさえ、ビタミンA供給が十分な子供と比較して、感染症による高い死亡率のみならず、呼吸器疾患や下痢などの高い罹患率を示す (16)。ビタミンA補給は、ビタミンA欠乏が日常的な途上国における下痢やはしかに関連する重症度や死亡率を減少させることが認められている (17)。感染が発症すると極めて速やかに血中のレチノール濃度が低下する。この現象は、一般に、肝臓によるレチノール結合タンパク質(RBP)の合成低下に関係するといわれている。このように、ビタミンAの不十分な栄養状態が、感染症からの重症度や死亡確率を高めることと関係するため、感染が悪循環を亢進する。一方で、最近の4つの研究レビューから、ビタミンA補給は、母親から子へのHIV伝染の抑制には効果がないと結論付けられた (19)。ある研究では、ビタミンAが欠乏しているHIV感染女性が、乳児へ3~4倍HIVを伝染させやすいことが認められた (20)。
推奨栄養所要量(RDA)
ビタミンAに対するRDAは、2001年に、米国医学研究所の食品栄養委員会(FNB)により改訂された。最新のRDAは、正常な生殖機能、免疫機能、遺伝子発現及び視力を維持するために、体内中で適切なビタミンA蓄積に必要な量(4ヵ月)に基づいている (21)。下の表に、レチノール当量(RAE)(μg)及び国際単位(IU)の両方のRDA値を示した。これらの単位の詳細情報はRAE章を参照。
疾病予防
がん
培養細胞や実験動物における研究から、天然及び合成のレチノイドが、皮膚、乳、肝臓、結腸、前立腺その他の部位において、有意に発がんを抑制する能力があると報告されている (2)。しかしながら、既成ビタミンAの摂取とがんとの因果関係を試験したヒトの研究結果は、あまり明確ではない。
肺がん
少なくとも10の前向き研究により、後に肺がんを発症した人と発症しなかった人の間で、血中レチノールレベルが比較された。それらの中で、一つの研究だけから、血清中レチノールと肺がんリスクとの間に統計的有意な逆相関が認められた (22)。β-カロテン・レチノール有効性試験(CARET)の結果から、高用量のビタミンAとβ-カロテンが、肺がんの高リスク者では避けるべきであることが示唆された (23)。約9、000人(喫煙者とアスベスト曝露者)が、レチノール25、000 IUとβ-カロテン30 mgを1日当たりの処方量として投与され、一方で同数の人にプラセボが投与された。追跡4年後、肺がんの発症率は、対照群と比較し、補給群で28%高くなった。このような結果について考えられる説明は、タバコやアスベスト曝露により生成された肺の酸化的環境が、発がんに関与する異常な量のカロテノイド分解産物を生成させるのではないかということである。現在のところ、レチノールの効果は、喫煙者と非喫煙者で異なっているのかもしれないが、レチノール摂取の増量が、肺がんリスクを減少させることはなさそうである (22)。
乳がん
レチノール及びその代謝物は、in vitroで乳がん細胞の生育を抑制することが認められているが、ヒトにおける食事からのレチノール摂取量の観察研究では、in vivoでこのことは確認されていない (24)。大部分の疫学研究からは、女性におけるレチノール摂取量と乳がんリスクとの間に有意な相関は認められていない (25-28) が、一つの大規模な前向き研究から、総ビタミンA摂取量が、乳がんの家族歴をもつ閉経前女性における乳がんリスクと逆相関が認められた (29)。レチノールの血中レベルは、既成ビタミンAとβ-カロテンのようなプロビタミンAカロテノイドの両方の摂取量を反映している。症例-対照研究からは、血清中レチノールレベルと血清中抗酸化物質レベルが、乳がんリスクと逆相関することが認められ (30)、2つの前向き研究からは、血中レチノール濃度と進行性乳がんのその後のリスクとの間に有意な相関は認められなかった (31,32)。現在のところ、既成ビタミンAまたはレチノールの摂取量増加が、人において乳がんリスクを減少させるという証拠はほとんどない。
疾病治療
レチノイドの薬理学的用量(上限レベルも参照)
レチノイドは、網膜色素変性、急性前骨髄球性白血病及び様々な皮膚疾患などのいくつかの症状を治療するために薬理学的用量で使用される。天然または合成のレチノイドの高用量処置が、体自体の制御メカニズムを無効としないように注意することが重要である。従って、レチノイド治療は、潜在的な副作用と毒性を伴う。さらに、全てのレチノイド化合物は、先天性異常を起こすことが認められている。そこで、妊娠する可能性のある女性は、これらの薬物治療を避けるべきである。レチノイドは、作用期間が長い傾向にある。副作用や先天性異常は、レチノイド治療を止めた数ヵ月後に起こることが報告されている (2)。以下に議論するレチノイドは処方薬のことであり、医師の管理下で用いるべきである。
網膜色素変性(Retinitis pigmentosa)
網膜色素変性とは、目網膜中の光受容体細胞(桿状体と錘状体)に進行性の消失を起こす広い範囲での遺伝性障害のことをいう (33)。網膜色素変性の初期症状は、暗所順応の損傷と夜盲症であり、その後時間の経過とともに周辺視覚と中心視覚が徐々に低下していく。一般的な網膜色素変性の症状を持つ600人以上被験者による無作為化比較対照試験(randomized controlled trial)の結果から、既成ビタミンA(レチノール)を4、500 μg(15、000 IU)/日で補給することにより、4~6年の期間で有意に網膜機能の低下を遅らせることが示唆された (34)。対照的に、ビタミンEの400 IU/日補給は、程度は低いが有意に網膜機能の低下を強め、一般的な網膜色素変性患者の治療に、長期間のビタミンA補給は有効であるが、代表的なマルチビタミンにみられるような高いレベルでのビタミンE補給は避けるべきであることを示唆していた。これらの患者の12年までの追跡調査からは、過剰なビタミンA摂取から起こる肝毒性のいかなる徴候も認められなかった (35)。網膜色素変性の過程を遅らせるための高用量ビタミンA補給は、医師の指示を必要とし、妊娠の可能性がある場合は服用を中止しなければならない(「安全性」参照)。
急性前骨髄球性白血病(Acute promyelocytic leukemia)
骨髄における正常な骨髄幹細胞の分化は、血小板、赤血球細胞及び免疫反応に重要な白血球細胞を誘導する。それらの幹細胞の分化異常は、未成熟の白血病細胞の増殖をもたらし、白血病を引き起こす。レチノイン酸受容体(RAR)の突然変異が、急性前骨髄球性白血病(APL)と呼ばれる特異的な白血病患者で発見された。all-trans-レチノイン酸またはall-trans-パルミチン酸レチニルにより処置で、正常な分化状態を回復し、数名のAPL患者における症状改善になる (2,18)。
皮膚の疾患
天然と合成のレチノイドは、両方とも皮膚障害治療の医薬品として使用されている。エトレチネートとアシトレチンは、乾癬(白い鱗屑に覆われた赤い班を特徴とする慢性皮膚疾患)の治療に有効なレチノイドであり、トレチノイン(レチン-A)とイソトレチノイン(アキュテイン)は、重度のニキビ(痤瘡)治療に有効である。レチノイドは、皮膚の成長因子やそれらの受容体の転写にほとんど影響を及ぼさないとされる (2)。妊娠女性によるレチノイドの薬物服用は、先天性異常を起こす(「妊娠中の安全性」参照)。
摂取源
レチノール活性当量(RAE)
各種の食事からのビタミンA摂取源は異なる利用能を持つ。例えば、β-カロテンは、レチノールよりは吸収が容易ではなく、体内でレチナールやレチノールに変換される必要がある。最も新しいビタミンA単位に対する国際基準はレチノール活性当量(RAE)で、ビタミンA活性をレチノールとして表現する。サプリメントとして供給される油脂中のβ-カロテンの2 μgは、体内でレチノール1 μgに変換され、RAE比は2:1になる。一方、体内でレチノール1 μgを供給するために、食品からのβ-カロテン12 μgが必要で、食事からのβ-カロテンのRAEは12:1である。他の食品中のプロビタミンAカロテノイドは、β-カロテンほど容易に吸収されないため、RAE比は24:1になる。β-カロテンと他のプロビタミンAカロテノイドのRAE比を下表に示す (21)。今なお一般的に使用される古い国際標準は、国際単位(IU)である。1 IUはレチノール0.3 μgに相当する。
食事摂取源
遊離のレチノールは食品中には一般には存在しない。レチノールの前駆体及び貯蔵形態であるパルミチン酸レチニルが、動物由来食品に認められる。植物は、ビタミンA前駆体であるいくつかのカロテノイドを含む(α-カロテン、β-カロテン及びβ-クリプトキサンチン等)。黄色や橙色の野菜は有意な量のカロテノイド類を含有する。緑色野菜もカロテノイドを含むが、色素がクロロフィルの緑色に隠されている (1)。多くの良質なビタミンAの食品源を、レチノール当量(μg RAE)としてのビタミンA含量とともに下表に示した。レチノール活性が、主としてプロビタミンAカロテノイドに由来する食品について、カロテノイド含量とレチノール活性当量を示した。リコペン、ルテイン及びゼアキサンチンなど数種異なるカロテノイド含量を確認するために、USDA食品成分データベースを用いることが可能である。しかしながら、USDAデータベース中のビタミンA のIUは、様々なカロテノイドの生物学的利用能を考慮していない。カロテノイドを含む食品中のビタミンAについてのより正確なIU値を得るためには、RAEに3.33を乗ずる。
サプリメント
サプリメント中の既成ビタミンA(レチノール)の基本的な形態は、パルミチン酸レチニルと酢酸レチニルである。β-カロテンもサプリメント中の一般的なビタミンA供給源で、多くのサプリメントはレチノールとβ-カロテンを組み合わせて供給される (36)。サプリメント中の総ビタミンA含量の割合がβ-カロテンに由来する場合、この情報がビタミンAのサプリメント表示ラベルに加えられる(「サプリメント表示ラベル」参照:注)別文書)。米国で入手できるほとんどのマルチビタミン補助食品は、ビタミンAを1、500 μg(5、000 IU)供給しているため、ビタミンAに対する現在のRDAより多くなる。このことは、サプリメント表示についてFDAが用いる一日摂取量(DV)が、最新のRDAよりもむしろ1968年に設定されたRDAに基づいているためで、マルチビタミンサプリメントは、一般的にほとんどの栄養成分ついてのDVの100%を供給している。レチノールの5、000 IU/日摂取量は、高齢者における骨粗鬆症のリスク増加と関係しているため(「安全性」参照)、会社によっては、マルチビタミンサプリメント中のレチノール含量を750 μg(2、500 IU)まで下げているところもある。
安全性
毒性
ビタミンA毒性により起こる症状は、「ビタミンA過剰症」と呼ばれる。これは、カロテノイドではなく既成ビタミンAの過剰摂取により起こされる。既成ビタミンAは速やかに吸収され、体内からの排泄は遅い。したがって、既成ビタミンAによる毒性は、実際には、短期間の高用量曝露またはかなり低い摂取量による慢性曝露から起こる (2)。急性のビタミンA毒性は比較的まれで、症状には、吐き気、頭痛、倦怠感、食欲不振、めまい、皮膚乾燥(乾燥肌)、落屑(外側皮膚の喪失)及び脳水腫などである。慢性毒性の徴候は、かゆみを伴う皮膚乾燥、落屑、食欲不振、頭痛、脳水腫及び骨・間接の痛みなどである。また、乳児におけるビタミンAの毒性症状は、泉門(胎児・乳児の頭蓋骨にある膜でおおわれた間隙)の隆起である。ビタミンA過剰症が重度の場合、肝障害、出血及び昏睡を起こす可能性がある。概して、毒性の徴候は、RDAの10倍(8、000~10、000 μg/日、または25、000~33、000 IU)以上のビタミンAの長期摂取に関係している。しかしながら、潜在性(無症状性)のビタミンA毒性が特定集団に懸念があるかどうか判断するためには、さらに研究が必要である (37)。高齢者、慢性アルコール摂取者及び高コレステロールに対する遺伝的素因をもつ人々など、いくつかの集団が、比較的低用量で毒性を受けやすい可能性があるとの証拠がある (8)。2001年1月に、米国医学研究所の食品・栄養委員会(FNB)は、成人に対するビタミンAの耐容上限摂取量(UL)を、既成ビタミンAとして3、000 μg(10、000 IU)/日に設定した (21)。
妊娠中の安全性
正常な胎児発育には十分なビタミンA摂取量が必要であるが、妊娠中の過剰な既成ビタミンA(レチノール)摂取は、先天性異常を誘発するといわれている。3、000 μg/日(10、000 IU/日)未満の用量でのサプリメントからの既成ビタミンAでは、ビタミンAに関係する先天性異常のリスク増加は認められていない (21)。米国における多数の商品に既成ビタミンAが添加されているため、妊娠女性は、1、500 μg(5、000 IU)以上のビタミンAを含むマルチビタミンまたは出産前サプリメントを避けるべきである。β-カロテン由来のビタミンAが、先天性異常のリスクを高めることは知られていない。レチノールの合成誘導体であるエトレチネートやイソトレチノイン(アキュテイン)は、重い先天異常を誘発することが知られ、妊娠時または妊娠する可能性がある場合、摂取してはいけない (38)。もう一つのレチノール誘導体のトレチノイン(レチン-A)は、皮膚に塗布する局所剤として処方されている。局所からのトレチノインが全身吸収される可能性があるため、妊娠中での使用は推奨されない。
ビタミンAの高摂取は骨粗鬆症リスクを高めるか?
いくつかの研究結果から、ビタミンA摂取量が、骨ミネラル密度(BMD)や骨折リスクの及ぼす有害影響と関係しないことが示されている (39-41)。しかしながら、いくつかの前向き研究の結果からは、1、500 μg/日(5、000 IU/日)を超える既成ビタミンAの長期間摂取が、高齢の男女において、骨粗鬆症性骨折及びBMD低下のリスク増加と関係することが示唆されている (42-44)。この摂取レベルはRDAの700~900 μg/日(2、300~3、000 IU/日)より高いが、実質的にはULの3、000 μg/日(10、000 IU/日)よりは低い。β-カロテンではなく既成ビタミンA(レチノール)の過剰摂取だけが、骨の健康への悪性影響と関係があった。これらの観察研究からは、過剰のレチノール摂取と骨粗鬆症との間の関係に関する根拠を得ることはできないが、限られた実験データでは、過剰のレチノールが、骨吸収を亢進する可能性 (45)、あるいはカルシウムバランスを維持するビタミンDの作用を阻害する可能性 (46) が示唆されている。米国において、5、000 IU/日を超えるレチノール摂取量は、定期的にマルチビタミンサプリメントやいくつかの朝食シリアルなどの強化食品を摂取する人々では容易に到達することができる。影響範囲のもう一方では、有意な数の年配者はビタミンA摂取量が不足しており、それもまたBMD低下と関係がある。ある高齢男女の研究では、BMDが、RDAに近いビタミンA摂取量が最適であることが認められた (43)。サプリメントや強化食品が現在のビタミンAに対するRDAを反映するように改良されるまで、ビタミンAを2、500 IU含むマルチビタミンサプリメント、または最低50%がβ-カロテンに由来するビタミンAを5、000 IU含むマルチビタミンサプリメントを求めることは有意義ではある。
薬物との相互作用
慢性のアルコール摂取は、ビタミンAの肝臓蓄積を枯渇させ、アルコール誘発性の肝障害の原因になる (47)。一方で、既成ビタミン(レチノール)の肝毒性は、慢性アルコール摂取により亢進されるため、アルコール依存症におけるビタミンA補給のための治療幅を狭めることになる (48)。エストロゲンやプロゲスチンを含む経口避妊薬は、肝臓によるレチノール結合タンパク質(RBP)合成を増進させ、血中におけるRBP-レチノール複合体の排出を増加させる。これがビタミンAの食事からの必要量を増加させるかどうか不明であるが、レチノイドやアシトレチン、all-trans-レチノイン酸、ベキサロテン、エトレチネート及びイソトレチノイン(アキュテイン)などのレチノイド同族体は、ビタミンA毒性のリスクを高めるため、ビタミンAサプリメントといっしょに使うべきではない (36)。
ライナス・ポーリング研究所の推奨
ビタミンAに対するRDA (女性2、300 IU/日、男性3、000 IU/日)は、正常な遺伝子発現、免疫機能及び視覚を維持するために十分な量である。しかしながら、ライナスポーリング研究所の推奨に従って毎日マルチビタミン/ミネラルのサプリメントを摂取することは、高齢者における骨の健康に及ぼす悪性影響と関係する量である、レチノールとして5、000 IU/日のビタミンAを供給することになる。このため、我々は、2、500 IU(750 μg)くらいの既成ビタミン(通常、ビタミンA酢酸塩またはビタミンAパルミチン酸塩と表示される)、及びβ-カロテンとして2、500 IU程度の追加のビタミンAを供給するマルチビタミン/マルチミネラルのサプリメントをとることを推奨した。作用の強いビタミンAサプリメントは、毒性リスクがあるため、医師の指導なく使用すべきではない。
高齢者(65歳以上)
現在、高齢者におけるビタミンA必要量が、若い成人の必要量と異なるという証拠はほとんどない。さらに、ビタミンAの毒性は、高齢者では、若い成人より低い用量で発生する可能性がある。ライナスポーリング研究所の推奨に従って毎日マルチビタミン/ミネラルのサプリメントを摂取することは、高齢者における骨の健康の悪影響と関係する量である、レチノールとして5、000 IU/日供給することになる。このため、我々は、2、500 IU(750 μg)くらいの既成ビタミンA(通常、ビタミンA酢酸塩またはビタミンAパルミチン酸塩と表示される)、及びβ-カロテンとして2、500 IU程度の追加のビタミンAを供給するマルチビタミン/マルチミネラルのサプリメントをとることを推奨した。作用の強いビタミンAサプリメントは、毒性リスクがあるため、医師の指導なく使用すべきではない。
Authors and Reviewers
Originally written in 2000 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in December 2003 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in November 2007 by:
Victoria J. Drake, Ph.D.
Linus Pauling Institute
Oregon State University
Copyright 2000-2024 Linus Pauling Institute
References
1. Groff JL. Advanced Nutrition and Human Metabolism. 2nd ed. St Paul: West Publishing; 1995.
2. Ross AC. Vitamin A and retinoids. In: Shils M、 Olson JA、 Shike M、 Ross AC. ed. Modern Nutrition in Health and Disease. 9th ed. Baltimore: Lippincott Williams & Wilkins; 1999:305-327.
3. Semba RD. The role of vitamin A and related retinoids in immune function. Nutr Rev. 1998;56(1 Pt 2):S38-48.
4. Semba RD. Impact of vitamin A on immunity and infection in developing countries. In: Bendich A、 Decklebaum RJ、 eds. Preventive Nutrition: The Comprehensive Guide for Health Professionals. 2nd ed. Totowa: Humana Press Inc; 2001:329-346.
5. McCullough、 F. et al. The effect of vitamin A on epithelial integrity. Nutr Soc. 1999; volume 58: pages 289-293. (PubMed)
6. Solomons NW. Vitamin A and carotenoids. In: Bowman BA、 Russell RM、 eds. Present Knowledge in Nutrition. 8th ed. Washington、 D.C.: ILSI Press; 2001:127-145.
7. Lynch SR. Interaction of iron with other nutrients. Nutr Rev. 1997;55(4):102-110. (PubMed)
8. Russell RM. The vitamin A spectrum: from deficiency to toxicity. Am J Clin Nutr. 2000;71(4):878-884. (PubMed)
9. Brody T. Nutritional Biochemistry. 2nd ed. San Diego: Academic Press; 1999.
10. Christian P、 West KP、 Jr. Interactions between zinc and vitamin A: an update. Am J Clin Nutr. 1998;68(2 Suppl):435S-441S. (PubMed)
11. Suharno D、 West CE、 Muhilal、 Karyadi D、 Hautvast JG. Supplementation with vitamin A and iron for nutritional anaemia in pregnant women in West Java、 Indonesia. Lancet. 1993;342(8883):1325-1328. (PubMed)
12. Jang JT、 Green JB、 Beard JL、 Green MH. Kinetic analysis shows that iron deficiency decreases liver vitamin A mobilization in rats. J Nutr. 2000;130(5):1291-1296. (PubMed)
13. Rosales FJ、 Jang JT、 Pinero DJ、 Erikson KM、 Beard JL、 Ross AC. Iron deficiency in young rats alters the distribution of vitamin A between plasma and liver and between hepatic retinol and retinyl esters. J Nutr. 1999;129(6):1223-1228. (PubMed)
14. Underwood BA、 Arthur P. The contribution of vitamin A to public health. FASEB J. 1996;10(9):1040-1048. (PubMed)
15. Semba RD. Vitamin A and human immunodeficiency virus infection. Nutr Soc. 1997;56(1B):459-469.
16. Field CJ、 Johnson IR、 Schley PD. Nutrients and their role in host resistance to infection. J Leukoc Biol. 2002;71(1):16-32. (PubMed)
17. West CE. Vitamin A and measles. Nutr Rev. 2000;58(2 Pt 2):S46-54.
18. Thurnham DI、 Northrop-Clewes CA. Optimal nutrition: vitamin A and the carotenoids. Nutr Soc. 1999;58(2):449-457. (PubMed)
19. Wiysonge CS、 Shey MS、 Sterne JA、 Brocklehurst P. Vitamin A supplementation for reducing the risk of mother-to-child transmission of HIV infection. Cochrane Database Syst Rev. 2005;(4):CD003648. (PubMed)
20. Ramasethu J. Semba RD、 et al.、 Maternal vitamin A deficiency and mother-to-child transmission of HIV-1. Lancet 1994;343:1593-7. Pediatr AIDS HIV Infect. 1995;6(5):303-304.
21. Food and Nutrition Board、 Institute of Medicine. Vitamin A. Dietary Reference Intakes for Vitamin A、 Vitamin K、 Arsenic、 Boron、 Chromium、 Copper、 Iodine、 Iron、 Manganese、 Molybdenum、 Nickel、 Silicon、 Vanadium、 and Zinc. Washington、 D.C.: National Academy Press; 2001:82-161. (National Academy Press)
22. Comstock GW、 Helzlsouer KJ. Preventive nutrition and lung cancer. In: Bendich A、 Decklebaum RJ、 eds. Preventive Nutrition: The Comprehensive Guide for Health Professionals. 2nd ed. Totowa: Humana Press Inc; 2001:97-129.
23. Omenn GS、 Goodman GE、 Thornquist MD、 et al. Effects of a combination of beta carotene and vitamin A on lung cancer and cardiovascular disease. N Engl J Med. 1996;334(18):1150-1155. (PubMed)
24. Prakash P、 Krinsky NI、 Russell RM. Retinoids、 carotenoids、 and human breast cancer cell cultures: a review of differential effects. Nutr Rev. 2000;58(6):170-176. (PubMed)
25. Bohlke K、 Spiegelman D、 Trichopoulou A、 Katsouyanni K、 Trichopoulos D. Vitamins A、 C and E and the risk of breast cancer: results from a case-control study in Greece. Br J Cancer. 1999;79(1):23-29. (PubMed)
26. Franceschi S. Micronutrients and breast cancer. Eur J Cancer Prev. 1997;6(6):535-539. (PubMed)
27. Longnecker MP、 Newcomb PA、 Mittendorf R、 Greenberg ER、 Willett WC. Intake of carrots、 spinach、 and supplements containing vitamin A in relation to risk of breast cancer. Cancer Epidemiol Biomarkers Prev. 1997;6(11):887-892. (PubMed)
28. Michels KB、 Holmberg L、 Bergkvist L、 Ljung H、 Bruce A、 Wolk A. Dietary antioxidant vitamins、 retinol、 and breast cancer incidence in a cohort of Swedish women. Int J Cancer. 2001;91(4):563-567. (PubMed)
29. Zhang S、 Hunter DJ、 Forman MR、 et al. Dietary carotenoids and vitamins A、 C、 and E and risk of breast cancer. J Natl Cancer Inst. 1999;91(6):547-556. (PubMed)
30. Ching S、 Ingram D、 Hahnel R、 Beilby J、 Rossi E. Serum levels of micronutrients、 antioxidants and total antioxidant status predict risk of breast cancer in a case control study. J Nutr. 2002;132(2):303-306. (PubMed)
31. Hulten K、 Van Kappel AL、 Winkvist A、 et al. Carotenoids、 alpha-tocopherols、 and retinol in plasma and breast cancer risk in northern Sweden. Cancer Causes Control. 2001;12(6):529-537. (PubMed)
32. Dorgan JF、 Sowell A、 Swanson CA、 et al. Relationships of serum carotenoids、 retinol、 alpha-tocopherol、 and selenium with breast cancer risk: results from a prospective study in Columbia、 Missouri (United States). Cancer Causes Control. 1998;9(1):89-97. (PubMed)
33. van Soest S、 Westerveld A、 de Jong PT、 Bleeker-Wagemakers EM、 Bergen AA. Retinitis pigmentosa: defined from a molecular point of view. Surv Ophthalmol. 1999;43(4):321-334. (PubMed)
34. Berson EL、 Rosner B、 Sandberg MA、 et al. A randomized trial of vitamin A and vitamin E supplementation for retinitis pigmentosa. Arch Ophthalmol. 1993;111(6):761-772. (PubMed)
35. Sibulesky L、 Hayes KC、 Pronczuk A、 Weigel-DiFranco C、 Rosner B、 Berson EL. Safety of <7500 RE (<25000 IU) vitamin A daily in adults with retinitis pigmentosa. Am J Clin Nutr. 1999;69(4):656-663. (PubMed)
36. Hendler SS、 Rorvik DR、 eds. PDR for Nutritional Supplements. Montvale: Medical Economics Company、 Inc; 2001.
37. Penniston KL、 Tanumihardjo SA. The acute and chronic toxic effects of vitamin A. Am J Clin Nutr. 2006;83(2):191-201. (PubMed)
38. Chan A、 Hanna M、 Abbott M、 Keane RJ. Oral retinoids and pregnancy. Med J Aust. 1996;165(3):164-167. (PubMed)
39. Rejnmark L、 Vestergaard P、 Charles P、 et al. No effect of vitamin A intake on bone mineral density and fracture risk in perimenopausal women. Osteoporos Int. 2004;15(11):872-880. (PubMed)
40. Sowers MF、 Wallace RB. Retinol、 supplemental vitamin A and bone status. J Clin Epidemiol. 1990;43(7):693-699. (PubMed)
41. Ballew C、 Galuska D、 Gillespie C. High serum retinyl esters are not associated with reduced bone mineral density in the Third National Health And Nutrition Examination Survey、 1988-1994. J Bone Miner Res. 2001;16(12):2306-2312. (PubMed)
42. Michaelsson K、 Lithell H、 Vessby B、 Melhus H. Serum retinol levels and the risk of fracture. N Engl J Med. 2003;348(4):287-294. (PubMed)
43. Promislow JH、 Goodman-Gruen D、 Slymen DJ、 Barrett-Connor E. Retinol intake and bone mineral density in the elderly: the Rancho Bernardo Study. J Bone Miner Res. 2002;17(8):1349-1358. (PubMed)
44. Feskanich D、 Singh V、 Willett WC、 Colditz GA. Vitamin A intake and hip fractures among postmenopausal women. JAMA. 2002;287(1):47-54. (PubMed)
45. Rohde CM、 DeLuca H. Bone resorption activity of all-trans retinoic acid is independent of vitamin D in rats. J Nutr. 2003;133(3):777-783. (PubMed)
46. Johansson S、 Melhus H. Vitamin A antagonizes calcium response to vitamin D in man. J Bone Miner Res. 2001;16(10):1899-1905. (PubMed)
47. Wang XD. Chronic alcohol intake interferes with retinoid metabolism and signaling. Nutr Rev. 1999;57(2):51-59. (PubMed)
48. Leo MA、 Lieber CS. Alcohol、 vitamin A、 and beta-carotene: adverse interactions、 including hepatotoxicity and carcinogenicity. Am J Clin Nutr. 1999;69(6):1071-1085. (PubMed)
ビタミンB12
目次
要旨
- ビタミンB12、別名コバラミンは葉酸塩の代謝、およびクエン酸回路の中間体であるスクシニルCoAの合成に必須の役割を果たす。(詳細はこちら)
- ビタミンB12欠乏症は慢性的な胃の炎症と一般的に関連があり、これは悪性貧血と呼ばれる自己免疫性のビタミンB12吸収不全症および食品タンパク質結合ビタミンB12吸収不全症に寄与しているかもしれない。ビタミンB12の吸収が損なわれると、欠乏症の者に巨赤芽球性貧血や神経性の障害を起こすことがある。(詳細はこちら)
- 60歳超の個人では、食品に結合したビタミンB12の吸収に必要な消化器系の正常な機能が一般的に損なわれており、それがビタミンB12欠乏症のリスクをもたらす。(詳細はこちら)
- ビタミンB12と葉酸塩はホモシステイン代謝に重要である。血中ホモシステイン濃度が高いことは、心血管疾患(CVD)のリスク要因である。ビタミンB補給がホモシステイン濃度の制御に有効であることは証明されているが、介入試験による現在のデータでは、ホモシステイン濃度を下げることがCVDリスクを減少させるとは示されていない。(詳細はこちら)
- DNAの完全性は、葉酸塩とビタミンB12の利用性によって保持される。ビタミンB12の栄養状態が悪いことは、いくつかの観察研究で乳がんリスクの上昇と関連があったが、すべての研究でそうだったわけではない。葉酸とともにビタミンB12補給をすることで乳がんの発症が減るのかどうかを評価する必要がある。(詳細はこちら)
- 母体のビタミンB12の状態が悪いことは、神経管欠損(NTD)のリスク上昇と関連があるが、ビタミンB12補給がNTDリスクの減少に役立つのかどうかは不明である。(詳細はこちら)
- ビタミンB12は、神経細胞の周りのミエリン鞘の保持と神経伝達物質の合成に不可欠である。高ホモシステイン血症は認知機能の損傷リスクを高めるかもしれないが、ビタミンB12欠乏症が年配者の認知症リスクに寄与するのかどうかは不明である。ビタミンB補給は年配の被験者のホモシステイン濃度を下げるが、長期間の有益性についてはわからない。(詳細はこちら)
- うつ病と骨粗鬆症のどちらも、ビタミンB12の栄養状態が悪くなることや高ホモシステイン濃度と関連がある。(詳細はこちら)
- 動物性食品はビタミンB12の主要な摂取源となっている。ビタミンB12の必要量を満たすために、年配者と完全菜食主義者(ヴィーガン)にはビタミンB12が強化された食品やサプリメントの使用が推奨される。(詳細はこちら)
- 胃酸分泌阻害薬のような特定の薬剤の長期使用は、ビタミンB12の吸収に悪影響を与えることがある。(詳細はこちら)
ビタミンB12は全てのビタミンの中で最大で最も複雑な化学構造をしている。金属イオンであるコバルトを含むということで、ビタミンの中でビタミンB12は独特である。そのため、コバラミンという用語がビタミンB12の活動をする化合物を指し示すのに使用される。メチルコバラミンおよび5-デオキシアデノシルコバラミンは、ヒトの体内で使用されるビタミンB12の形態である(1)。ほとんどの栄養補助食品や栄養強化食品で使用されるコバラミンの形態であるシアノコバラミンは、体内ですぐに5-デオキシアデノシルコバラミンやメチルコバラミンに変換される。哺乳類では、コバラミンはメチオニン合成酵素およびLメチルマロニルCoAムターゼという2つの酵素のみの補助因子である(2)。
機能
メチオニン合成酵素の補助因子
メチルコバラミンは、葉酸依存性酵素であるメチオニン合成酵素の機能に必要である。この酵素は、ホモシステインからアミノ酸であるメチオニンを合成するために必要である。次にメチオニンはSアデノシルメチオニンの合成に必要であり、これはDNA、RNA、およびタンパク質内での多部位のメチル化を含むたくさんの生物学的メチル化反応で使用されるメチル基供与体である(3)。DNAやタンパク質のメチル化異常はクロマチン構造や遺伝子発現の変化を引き起こすが、これはがん細胞に一般的な特徴である。メチオニン合成酵素の機能が不適切だとホモシステインの蓄積につながることがあり、これは心血管疾患のリスク上昇と関連がある(図1参照)。
L-メチルマロニルCoA ムターゼの補助因子
5-デオキシアデノシルコバラミンは、L-メチルマロニルCoAからスクシニル補酵素A(スクシニルCoA)への変換の触媒作用をする酵素に必要であり、この物質はその後クエン酸回路に入る(図2参照)。スクシニルCoAは脂質やタンパク質からのエネルギー生成に重要な働きをしており、赤血球の酸素運搬色素であるヘモグロビンの合成にも必要である(3)。
欠乏症
健康な個人では、ビタミンB12欠乏症は稀である。これは主に、体全体の貯蔵が2,500μgを超えること、日々の代謝回転がゆっくりなこと、および適切なビタミンB12の状態を維持するのにわずか2.4μg/日の食事からの摂取で十分なこと(「RDA」の項参照)などが理由である(4)。年配者ではビタミンB12欠乏症はより一般的で、これは腸管吸収が損なわれることが原因であり、この集団のビタミンB12欠乏症ぎみひいては重篤な欠乏症に至ることがある。
ビタミンB12欠乏症の原因
ビタミンB12欠乏症のほとんどの症例は、食事からの不適切な摂取ではなく腸での吸収不全で説明できる(5)。食物からビタミンB12を吸収するには、胃、膵臓、および小腸の機能が正常でなければならない。胃酸と酵素が食物からビタミンB12を遊離し、唾液や胃液にあるRタンパク質(トランスコバラミン-1またはハプトコリンともいう)と結合できるようにする。小腸のアルカリ性環境中で、Rタンパク質は膵酵素によって分解され、これによりビタミンB12が胃の特殊な細胞から分泌されるタンパク質である内因子(IF)と結合できるように遊離される。回腸(小腸の最終部)の表面にある受容体が、膵臓によって供給されるカルシウムがある場合にのみIF-B12複合体を吸収する(5)。ビタミンB12は受動拡散によっても吸収されうるが、このプロセスは非常に非効率的である。ビタミンB12の用量のうち、わずか約1%だけが受動的に吸収される(2)。ビタミンB12欠乏症の一般的な原因は(1)悪性貧血として知られる自己免疫性の容態、および(2)食品タンパク質結合ビタミンB12吸収不全である。どちらも萎縮性胃炎という胃の慢性炎症性疾患に関連する。
萎縮性胃炎
60歳を超えた者の10~30%が萎縮性胃炎を発症していると考えられている(6)。この症状は、胃の細胞に直接作用する自己抗体があること(「悪性貧血」の項参照)、および/またはヘリコバクター・ピロリ菌(H.ピロリ菌)による感染としばしば関連している(7)。H.ピロリ菌感染は胃の慢性炎症を引き起こし、これが消化性潰瘍、萎縮性胃炎、および/または胃がんへと進行する者もいる。萎縮性胃炎にかかった個人の胃機能の衰退によって小腸での細菌の異常増殖へと至り、食品タンパク質結合ビタミンB12吸収不全を起こすことがある。H.ピロリ菌に感染した個人は、血清、血漿、および胃液中のビタミンB12濃度がかなり低くなり、除菌によって血清ビタミンB12濃度が大きく向上することが示されている(8)。
悪性貧血
悪性貧血は60歳を超えた者の約2%に見られると推定されている(9)。貧血はしばしばその症状となるが、この症状は実は自己免疫性萎縮性胃炎として知られる胃の自己免疫性炎症の末期症状であり、自分自身の抗体(自己抗体)によって胃の細胞が破壊されることになる。胃の内側を覆う細胞の進行的な破壊によって、食物に結合したビタミンB12の遊離に必要な酸や酵素の分泌が減ってしまう。内因子(IF)の抗体はIFと結合しIF-B12複合体の生成を妨げ、さらにビタミンB12の吸収を阻害する。悪性貧血患者の親戚の約20%も同じ症状があり、遺伝的素因が示唆される。ある集団では、H.ピロリ菌感染が自己免疫反応を引き起こすことに関わっているとも思われる(10)。また、自己免疫性萎縮性胃炎とその他の自己免疫症状、特に自己免疫性甲状腺炎や1型糖尿病の同時発生も報告されている(11, 12)。
悪性貧血の治療には、腸での吸収をバイパスするためにビタミンB12の注射が一般的に必要である。高用量経口補給も別の治療選択肢である。なぜなら1,000μg(1mg)/日のビタミンB12を経口摂取することは、受動拡散によって約10μg/日(用量の1%)を吸収することになるからである。実際、高用量経口治療は筋肉内注射と同様に有効であると考えられている(4)。
食品タンパク質結合ビタミンB12吸収不全
食品タンパク質結合ビタミンB12吸収不全は、食物つまりタンパク質に結合したビタミンB12を吸収する能力が損なわれることと定義される。この疾患の個人は、遊離型を全部吸収することができる(13)。この疾患は年配者の集団におけるビタミンB12の栄養不良の主な原因であるが、それは萎縮性胃炎と通常関連している。萎縮性胃炎は胃の内膜の慢性的炎症で、究極的には胃腺を消失(萎縮)し胃酸の分泌を減少させることになる(「萎縮性胃炎」の項参照)。胃酸は食物に含まれるタンパク質からビタミンB12を遊離するのに必要であるので、ビタミンB12の吸収が減ってしまう。胃酸生成が減ると、胃の中で嫌気性細菌の異常増殖につながる環境も作り出されてしまい、ビタミンB12吸収にさらに支障をきたす(3)。サプリメントのビタミンB12はタンパク質と結合しておらず、内因子(IF)は今だに利用可能であることから、サプリメントのビタミンB12の吸収は悪性貧血の場合ほど減らない。したがって食品タンパク質結合ビタミンB12吸収不全の個人は、ビタミンB12の要求量が増えない。ただ単に強化食品や栄養補助サプリメントに含まれる結晶型の形態のビタミンB12を必要とする。
ビタミンB12欠乏症のその他の原因
ビタミンB12欠乏症のその他の原因には、IF-B12複合体の受容体がある胃や小腸の一部を外科的に切除することが含まれる。吸収不全症候群(セリアック病や熱帯性スプルー)などの小腸に影響する疾患でも、ビタミンB12欠乏症になるかもしれない。膵臓は重要な酵素とビタミンB12の吸収に必要なカルシウムとを提供するので、膵機能不全もビタミンB12欠乏症に寄与する可能性がある。ビタミンB12は動物性の食物にしか含まれないので、厳密な菜食主義者(ヴィーガン)の食事はビタミンB12欠乏症を起こしてきた。またアルコール依存症の者は、腸でのビタミンB12の吸収が減ることがあるかもしれない(2)。さらに、後天性免疫不全症候群(AIDS)の個人は、おそらくIF-B12複合体を受けるIF-B12受容体の不全症に関係して欠乏症のリスクが高いようである(3)。そのほか、胃酸抑制剤の長期使用もビタミンB12欠乏症に関わっている(「薬物相互作用」の項参照)。
ビタミンB12吸収の遺伝性疾患
ビタミンB12代謝の先天性異常の稀な症例が文献で報告されている((5)でレビュー)。イメルスルンド-グレスベック症候群は遺伝性のビタミンB12吸収不全症候群で、これを患う個人に巨赤芽球性貧血や様々な重篤度の神経障害を引き起こす。遺伝性のIF欠乏症(先天性悪性貧血とも呼ばれる)の個人にも同様の臨床症状が見られ、この個人ではIFの欠如がビタミンB12吸収の欠陥となってしまう。さらに、体内でのビタミンB12輸送に影響する突然変異も確認されている(14)。
ビタミンB12欠乏症の症状
ビタミンB12欠乏症は、ビタミンB12を必要とする酵素の活動の障害となる。メチオニン合成酵素の活動に障害があるとホモシステインの濃度上昇が起こり、L-メチルマロニルCoAムターゼの活動に障害があれば、メチルマロニル酸(MMA)というメチルマロニルCoAの代謝物の濃度上昇に至る。軽度のビタミンB12欠乏症の個人は症状を感じないかもしれないが、血中のホモシステインおよび/またはMMA濃度は上昇しているかもしれない(15)。
巨赤芽球性貧血
ビタミンB12欠乏症でメチオニン合成酵素の活動が減ると、テトラヒドロ葉酸(THF)の再生が阻害され、体内で使用できない形態に葉酸を閉じ込めてしまい(図3参照)、葉酸塩濃度が適切でも葉酸欠乏症の症状になってしまう。したがって、葉酸欠乏症でもビタミンB12欠乏症でも、葉酸塩がDNA合成の際に利用できない。このDNA合成障害は、急速に細胞分裂する骨髄の細胞にその他の細胞より先に影響し、大きく未熟でヘモグロビンの少ない赤血球ができてしまう。その結果としての貧血は巨赤芽球性貧血として知られ、これはそのために悪性貧血と命名された疾患の症状である(3)。葉酸を補給すれば、正常な赤血球の生成を回復するのに十分な葉酸塩が提供される。しかし、もしビタミンB12欠乏症がその原因であれば、貧血が治ってもその症状が長引く。そのため、巨赤芽球性貧血はその原因がわかるまで葉酸での治療をすべきではない(16)。
神経性の症状
ビタミンB12欠乏症の神経性症状には、手およびそれより一般的な足の痺れや刺痛、歩行困難、記憶喪失、見当識障害、および気分変動を伴うまたは伴わない認知症などがある。神経学的合併症の進行は一般的にゆっくりであるものの、そのような症状はビタミンB12欠乏症の治療でも治らないかもしれず、長期にわたる場合は特にそうである。神経学的合併症は常に巨赤芽球性貧血に関連するとは限らず、約25%の症例ではビタミンB12欠乏症の唯一の臨床的症状である(17)。ビタミンB12欠乏症は脳神経、脊髄神経、および末梢神経を覆うミエリン鞘を損傷することが知られているが、ビタミンB12欠乏症における神経的損傷が起こる生化学的プロセスは今だに十分に理解されていない(18)。
胃腸症状
舌の痛み、食欲喪失、および便秘も、ビタミンB12欠乏症と関連がある。これらの症状の起源は不明であるが、ビタミンB12欠乏症のいくつかの症例の根底にある胃の炎症や胃の内膜の進行的破壊に関係しているのかもしれない(17)。
推奨量(RDA)
ビタミンB12の推奨量は、米国医学研究所の食品栄養委員会(FNB)によって1998年に改訂された(表1)。年配者の食品タンパク質結合ビタミンB12吸収不全症のリスクが高くなることから、FNBは50歳を超える成人はRDAの大部分を強化食品やビタミンB12含有サプリメントから摂取することを推奨した(17)。
疾病予防
心血管疾患
上記のように、慢性萎縮性胃炎やH.ピロリ菌感染は吸収不全によってビタミンB12欠乏症を引き起こすことがある(「ビタミンB12欠乏症の原因」の項参照)。けれどもH.ピロリ菌感染や慢性萎縮性胃炎が発生しても、50歳超の10,000人近い男女による大規模コホート研究における心血管性の発作(脳卒中や心臓発作)の5年発症率や死亡率に変わりはなかった(19)。しかし年配者のビタミンB12欠乏症の有病率が高いにもかかわらず、ビタミンB12の栄養状態はこの研究で評価がなされなかった。
ホモシステインと心血管疾患
血中ホモシステイン濃度が軽く高いくらいでも心血管疾患(CVD)リスクが高くなることを疫学的研究は示している(20)が、ホモシステインがCVDリスクを上昇させるかもしれないメカニズムは多くの研究の主題のままである(21)。血中のホモシステイン量は少なくとも3つのビタミンで調整されている。それらは葉酸塩、ビタミンB6、およびビタミンB12である(上記の図1参照)。12の無作為化対照試験結果の初期の解析で、葉酸補給(0.5~5mg/日)が血中ホモシステイン濃度低下に最も効果的(25%の減少)であり、葉酸とともにビタミンB12(500μg/日)を補給することで、血中ホモシステイン濃度がさらに7%減少(32%低下)したことが示された(22)。53人の男女による順次補給試験の結果、葉酸補給の後ではビタミンB12が血漿ホモシステイン濃度の主要な決定因子になることが示された(23)。ホモシステイン濃度の上昇は、60歳超の個人におけるビタミンB12欠乏症が一因なのではないかと考えられる。2つの研究で、ホモシステイン濃度が高い年配者の60%超では、血中メチルマロニル酸(MMA)濃度が高いことがわかった。腎臓機能が損なわれていない場合、高MMA濃度でもあり高ホモシステイン濃度でもあることは、ビタミンB12の欠乏症またはビタミンB12と葉酸塩の両方の欠乏症のどちらかが示唆される(24)。したがって、ホモシステイン濃度低下療法を開始する前に、高ホモシステイン濃度の年配者はビタミンB12の栄養状態と腎臓機能の評価をされることが重要なようである。ホモシステインとCVDの関係のさらなる情報については、「葉酸塩」のタイトルの記事を参照のこと。
介入研究
葉酸およびビタミンB12摂取を増やすことはホモシステイン濃度を下げるのに有効であるが、これらのビタミンBを併用した介入ではCVDリスクが下がらなかった。実際、葉酸、ビタミンB12、およびビタミンB6補給によるホモシステイン濃度低下がCVDの発症を減らすのかどうかを決めるいくつかの無作為化プラセボ対照試験が行われた。CVDリスクのある45,000人近い参加者を含む11の試験データに対する最近のメタ解析で、心筋梗塞(心臓発作)または脳卒中リスクにビタミンB補給はさっぱり効果がなく、全死因のリスクにも変化がなかった(25)。慢性的な腎臓病患者を含むその他のメタ解析でも、心筋梗塞や死亡のリスクに対するホモシステイン濃度低下の効果はないことが確認された。しかし、脳卒中リスクはビタミンB補給によって7~12%とかなり低下した(26, 27)。ホモシステイン濃度低下による血流依存性血管拡張反応(FMD;血管の健康状態の代替マーカー)を測定した12の臨床試験の別なメタ解析で、ビタミンB補給によって短期間(8週間未満)ではFMDの向上が見られるが、既存の血管疾患のある被験者による長期間の研究ではそうではなかった(28)。しかし、これらのメタ解析に含まれた研究のいくつかではビタミンB12が使用されておらず、血管機能や脳卒中リスクに対する葉酸塩投与単独での保護的な役割はすでに示されている(29)。さらに、年配者では吸収不全障害やビタミンB12欠乏症の罹患率が高いことから、これらの試験で使用された用量よりも高い用量のビタミンB12の使用が是認されるかもしれない(30)。吸収不全の症例では、高用量の経口治療や筋肉内注射のみでビタミンB12欠乏症が克服できる(4)。
がん
葉酸塩はDNA合成に必要であり、葉酸塩の利用性が低下すると、より影響を受けやすいDNA鎖が損傷を受けるというエビデンス(科学的根拠)がある。ビタミンB12欠乏症は、葉酸塩を体がDNA合成に利用できない形態に閉じ込めてしまう。ビタミンB12欠乏症でも葉酸欠乏症でも、メチル化反応(上記の図3参照)の能力低下に至る。したがって、ビタミンB12欠乏症だとDNA損傷の割合が高くなったり、DNAのメチル化に変化が起きたりするが、そのどちらもががんの重要なリスク要因である。若い成人と年配の男性による一連の研究で、血中のホモシステイン濃度が高いこととビタミンB12濃度が低いことは、白血球における染色体切断のバイオマーカーと関連があった((31)の文献でレビュー)。ある二重盲検プラセボ対照試験では、2ヶ月間毎日シリアルで700μgの葉酸と7μgのビタミンB12を補給した若い成人は、同じ染色体切断マーカーが最小限になった(32)。
乳がん
ある症例対照研究で、後に乳がんと診断された195人の女性とそれに同齢のがんでない195人の女性で、診断前の血清葉酸塩、ビタミンB6、およびビタミンB12の濃度が比べられた。閉経後の女性では、血中ビタミンB12濃度と乳がんの関連はしきい値効果を示唆していた。血清ビタミンB12濃度が最も低い五分位の女性はそれより高い五分位の女性に比べて、乳がんリスクが2倍以上であった(33)。しかし、この研究に3つの症例対照研究を加えたメタ解析では、血清ビタミンB12濃度が高いことが低いことに比べて保護効果があるという関連が見つからなかった(34)。メキシコ人女性(475の症例群と1,391の対照群)による症例対照研究では、ビタミンB12摂取が最も高い(7.3~7.7μg/日)四分位の女性は、最も低い四分位(2.6μg/日)の女性に比べて乳がんリスクが68%低かったことが報告された。そのデータの層別化で、食事性ビタミンB12摂取と乳がんリスクの逆相関は、閉経後の女性の方が閉経前の女性に比べて強かったことがわかり、どちらの関連も統計学的に有意義であった。また閉経後の女性では、葉酸塩による明らかな保護効果はビタミンB12摂取が最も高い四分位の女性のみで見られた(35)。しかし、より最近の症例対照研究や前向きコホート研究では、ヒスパニック、アフリカ系アメリカ人、およびヨーロッパ系アメリカ人の女性といった異なる集団において、ビタミンB12摂取に関連するリスク低下は弱いかまったくなかったと報告された(36, 37)。7つの症例対照研究および7つの前向きコホート研究のメタ解析で、ビタミンB12摂取の高低によって乳がんリスクが変わることはないと結論づけられた(34)。葉酸塩およびビタミンB12両方の摂取と乳がんリスクとの関連もない。目下、ビタミンB12の栄養状態と乳がんとの関係を示唆するエビデンスもほとんどない。さらに観察研究の結果では、食事性葉酸塩摂取が高いことと乳がんリスク低下との関連は一貫した支持がなされていない(「葉酸塩」のタイトルの記事参照)。閉経期の状態、民族性、およびアルコール摂取などの乳がんリスクを変える様々な要因を考慮して、よく対照された無作為化臨床試験で葉酸塩とビタミンB12補給の効果を評価する必要がある。
神経管欠損
神経管欠損(NTD)は無脳症または脊髄披裂にいたる可能性があり、それらはほとんど致命的な中枢神経系の先天性奇形である。この欠陥は胎児の神経管が閉じないことによって起こり、多くの女性が妊娠に気づかない時期である受胎後21~28日の間に起こる(38)。無作為化対照試験では、女性が受胎の前後1ヶ月ずつの間に様々な食事に加えて葉酸のサプリメントを摂取すると、NTDの症例が60~100%減ることが明示された。増大するエビデンスによれば、葉酸のホモシステイン濃度低下効果がNTDリスクの減少に重大な役割を果たしていることが示されている(39)。メチオニン合成酵素が有効的に機能するための葉酸および/またはビタミンB12が不十分だと、血液中にホモシステインが溜まるかもしれない。NTDのリスクが高い妊婦の血中および羊水では、ビタミンB12濃度の低下とホモシステイン濃度の上昇が見られる(40)。現在または過去にNTDの影響を受けた567人の母親と影響がなかった1,566人の母親を含む12の症例対照研究に対する最近のメタ解析で、母体のビタミンB12の栄養状態が悪いこととNTDリスクが高いことに関連があったことが示された(41)。しかし、ビタミンB12補給がNTD予防に有益かどうかは、今まで評価されていない(42)。
認知機能低下、認知症、およびアルツハイマー病
ビタミンB12欠乏症の発症は年配者の集団によくあり、しばしばアルツハイマー病と関連付けられてきた((43)の文献でレビュー)。アルツハイマー病患者の脳脊髄液におけるビタミンB12濃度は、その他のタイプの認知症の患者よりも低いことが研究でわかったが、血中ビタミンB12濃度には差がなかった(44)。ビタミンB12の栄養状態が悪いこととアルツハイマー病との関連の原因ははっきりしない。葉酸塩の欠乏症と同様に、ビタミンB12欠乏症もメチオニンおよびS-アデノシルメチオニン(SAM)の合成が減ることになり、それによってメチル化反応に悪い影響があるのかもしれない。メチル化反応は、神経細胞におけるミエリン鞘の成分の代謝と神経伝達物質の合成に不可欠である(18)。ビタミンB12欠乏症のその他の代謝上の関わりにはホモシステインとメチルマロニル酸の蓄積があり、それは認知症の神経病理学的特徴に寄与しているかもしれない(43)。
観察研究
横断的研究および前向きコホート研究の大部分では、ホモシステイン濃度が高いことが、認知機能測定値のスコアが悪いことやアルツハイマー病を含む認知症のリスクが高いことと関連づけられてきた((45)の文献でレビュー)。アルツハイマー型の認知症患者164人によるある症例対照研究には、死後に脳細胞の検査でアルツハイマー病の診断が確定した76人の症例が含まれていた。認知症のエビデンスのない108人の対照群の被験者に比べて、アルツハイマー型の認知症である被験者およびアルツハイマー病と確定された被験者は血中ホモシステイン濃度が高く、葉酸塩とビタミンB12の血中濃度が低かった。全般的な栄養状態の測定値からは、ホモシステイン濃度が高いことやビタミンB12の栄養状態が低いこととアルツハイマー病との関連は、認知症に関係する栄養不良によるものではないことが示された(46)。認知症のない1,092人の男女のサンプル集団を平均で10年間追跡したら、ベースライン時(開始時)の血漿ホモシステイン濃度が高い者はアルツハイマー病およびその他の認知症の発症リスクが相当に高かった。具体的には、血漿ホモシステイン濃度が14μmol/Lより高い者は、アルツハイマー病発症リスクが2倍近かった(47)。650人の年配の男女によるある研究で、血漿ホモシステイン濃度が高くなるリスクは、認知機能スコアが低い者のほうが有意義に高かったことが報告された(48)。816人の年配の男女によるある前向き研究では、高ホモシステイン血症(ホモシステイン濃度が15μmol/L超)の者はアルツハイマー病または認知症の発症リスクがかなり高かったことが報告されている。ホモシステイン濃度が高いことは、ビタミンB12の栄養状態が悪いことが一因であるかもしれないが、この研究では後者はアルツハイマー病または認知症のリスクと関係がなかった(49)。
ベースライン時に認知症があるまたはない年配者のビタミンB12の状態と認知機能低下の関連を評価する35の前向きコホート研究に対する最近のシステマティックレビューで、血清ビタミンB12濃度と認知機能低下、認知症、またはアルツハイマー病との関係は支持されなかった(50)。それにもかかわらず、ホロトランスコバラミン(holo-TC、ビタミンB12担体)およびメチルマロニル酸の測定値を含むビタミンB12のより鋭敏なバイオマーカーを利用した研究では、ビタミンB12の栄養状態が悪いことと認知機能悪化が速いこと、およびアルツハイマー病リスクとの関連に対するより一貫した結果と傾向が示された(51~55)。さらに、ホモシステイン濃度が高いことや葉酸塩の栄養状態が悪いことなどの潜在的交絡因子が同時にあることが、ビタミンB12の栄養状態が認知機能に果たす真の寄与を軽くしているかもしれないことを却下するわけにはいかない(45)。
介入研究
認知機能の障害のあるまたはない年配者の高ホモシステイン血症の治療に、高用量ビタミンB補給は有効であることが証明されてきた。しかしこうした集団の認知機能悪化予防に関して、ホモシステイン低減試験は相反する結果を生み出してきた。ビタミンB補給の効果を調べる18の無作為化プラセボ対照試験のシステマティックレビューおよびメタ解析では、ホモシステイン濃度の低下が年配の被験者の認知機能低下を予防または遅延させるということにはならなかった(56)。認知機能障害のリスクの高い900人の年配者によるより最近の無作為化二重盲検プラセボ対照臨床試験で、毎日400μgの葉酸と100μgのビタミンB12を2年間補給したら、即時記憶や遅延記憶の測定値が有意義に向上したり、血漿ホモシステイン濃度上昇が遅くなったことがわかった(57)。しかし、補給を受けた被験者はベースライン時に比べてホモシステイン濃度の低下がなく、プラセボに比べて処理速度テストで成績がよいこともなかった。年配の成人による別の2年間の無作為化プラセボ対照研究では、毎日800μgの葉酸、500μgのビタミンB12、および20mgのビタミンB6摂取というレジメン(治療計画)で、プラセボ治療に比べて脳萎縮の速度がかなり遅くなったことが報告された(0.5%対3.7%)。興味深いことに、ベースライン時のホモシステイン濃度が高い者の方が低い者よりも大きな効果が見られ、脳萎縮および認知機能低下の予防にホモシステイン濃度低下が重要であることを示唆している(58, 59)。著者らはホモシステイン濃度の変化を主にビタミンB12によるものだとしている(59)。最後に、脳卒中を患った2,500人超の者による最新の無作為化二重盲検プラセボ対照試験で、ビタミンB補給(2mgの葉酸、500μgのビタミンB12、および25mgのビタミンB6)によってホモシステイン濃度が正常化しても、プラセボに比べて認知行動能力は向上せず、認知機能低下の発生も減ることがなかったことが示された(60)。目下のところ、アルツハイマー病の発症のような長期的結果に関するビタミンB補給の効果を評価するより大規模な試験が必要である。
うつ病
うつ病で入院した患者の30%もがビタミンB12欠乏症であるということが、観察研究でわかった(61)。65歳超の700人の地域生活を送る身体障害者女性による横断研究で、ビタミンB12欠乏症の女性はそうでない女性に比べて重いうつ病に2倍もなりやすいことがわかった(62)。うつ病的障害のある3,884人の年配の男女による集団ベースの研究で、ビタミンB12欠乏症の者はビタミンB12の状態が正常な者に比べてほぼ70%もうつ病になりやすいことがわかった(63)。ビタミンB12欠乏症とうつ病の関係の原因ははっきりしないが、S-アデノシルメチオニン(SAM)の不足が関わっているかもしれない。SAMは脳内での多くのメチル化反応におけるメチル基供与体で、不足することがうつ病に関わる神経伝達物質の代謝もこの反応に含まれる(64)。マウスモデルでの重篤なビタミンB12欠乏症では、脳内でのDNAメチル化の程度に劇的な変化が示され、これが神経学的障害へとつながっているのかもしれない(65)。この仮説は、SAMの補給でうつ病的症状が改善することを示すいくつかの研究によって裏付けされている(66~69)。
ホモシステイン濃度が高いことは、年配者におけるうつ病的症状に関連するビタミンB12欠乏症のもう一つの非特異性バイオマーカーである(70)。しかし、1,677人の年配者に対して行われた最近の横断的研究で、血漿ビタミンB12濃度が高いことはうつ病的症状の出現が少ないことと相関があったが、ホモシステイン濃度の変化はそれとの相関がなかった(71)。ビタミンB12の状態とホモシステイン濃度、および経年的なうつ病の発症との関係を調べた研究はとても少ない。心理的苦痛がある900人超の年配の参加者による無作為化プラセボ対照介入研究で、2年間毎日葉酸(400μg)とビタミンB12(100μg)を補給しても、プラセボに比べて血中の葉酸塩、ビタミンB12、およびホモシステインの濃度がかなりよくなったにもかかわらず、うつ病症状の発生が減ることはなかった(72)。しかし、うつ病リスクの高い脳血管性発作に苦しむ者による長期の無作為化二重盲検プラセボ対照研究で、毎日の2mgの葉酸、25mgのビタミンB6、および500μgのビタミンB12補給で、7年間の追跡期間における主要なうつ病的エピソードのリスクがプラセボに比べて大きく下がった(73)。うつ病にビタミンB12欠乏症が原因的な役割を果たしているかどうかはまだわからないが、うつ病の医学的評価の一部として年配者のビタミンB12欠乏症を検査することは有益であるかもしれない。
骨粗鬆症
ホモシステイン濃度が高いと骨吸収(破壊)を増やし、骨形成を減らし、骨の血流を減らして骨リモデリング(再形成)に影響するかもしれない。提唱されている別のメカニズムでは、骨のコラーゲンマトリックスへのホモシステインの結合が関わっており、これがコラーゲンの特性を変えて骨の強度を下げるのかもしれない((74)の文献でレビュー)。骨の生化学的特性の変化は、骨粗鬆症に寄与して年配者の骨折リスクを上げることがある。ビタミンB12はホモシステイン代謝の決定因子であるので、年配の被験者の骨粗鬆症的骨折リスクがビタミンB12欠乏症によって高くなるのではないかと示唆された。全部で7,475人の年配者を3~16年追跡した4つの観察研究のメタ解析で、血中ビタミンB12濃度が50pmol/L上がると骨折リスクが減るという弱い関連が見つかった(75)。血清葉酸塩およびビタミンB12濃度が低く骨折リスクの高い559人の年配者による無作為化プラセボ対照試験で、非常に高用量の葉酸(5mg/日)およびビタミンB12(1.5mg/日)の併用補給が評価された。2年間の研究で、プラセボに比べて補給によりビタミンBの栄養状態が良くなって、ホモシステイン濃度が減少し、全体の骨折リスクが下がったことがわかった(76)。しかし、心血管疾患または糖尿病のある5,485人の被験者による多機関の研究では、毎日葉酸(2.5mg)、ビタミンB12(1mg)、およびビタミンB6(50mg)を補給することでホモシステイン濃度は下がったが、プラセボに比べて骨折リスクへの効果は何もなかったことが示された(77)。ビタミンDの栄養状態が悪い93人による別の小規模無作為化二重盲検試験では、ビタミンB補給(50mg/日のビタミンB6、0.5mg/日の葉酸、および0.5mg/日のビタミンB12)をしても、ビタミンDとカルシウム補給に関連する以上の骨の健康マーカーへの追加的な効果は1年間に見られなかった。それでもこの研究が短期間であるので、ビタミンB補給によってホモシステイン濃度を下げることが骨強度や骨折リスクに長期的な有益性をもたらすかどうかを結論付けることはできなかった(78)。既存の症状のない年配者に対して、骨の健康マーカーや骨折の発生に対するビタミンB補給の効果を評価する大規模介入研究が現在進行中である。年配者の集団における骨の健康に対してビタミンBに保護的効果があるのかどうかが、この試験で明らかになるかもしれない(79)。
摂取源
食物の摂取源
細菌だけがビタミンB12を合成できる(80)。ビタミンB12は、肉、家禽類の肉、魚(貝や甲殻類を含む)などの動物性食品に含まれ、それよりは少ないが乳製品や卵にも含まれる(1)。新鮮な殺菌された牛乳は1カップ(約240ml)あたり0.9μgを含み、一部の菜食主義者にとって重要なビタミンB12摂取源になっている(17)。動物性食品をいっさい食べない厳密な菜食主義者(ヴィーガン)は、その必要量を満たすためにビタミンB12補給をしなければならない。最近の解析で、ある種の植物起源の食物、たとえば特定の発酵豆類や発酵野菜、および食用藻類やキノコなどは、生理活性のあるビタミンB12を相当量含んでいることがわかった(81)。ビタミンB強化食品やサプリメントと一緒に摂取することで、これらの食物が菜食主義の食事をする者のビタミンB12欠乏症予防に控えめではあるが貢献するかもしれない。また、50歳超の個人はビタミンB12をサプリメントや強化食品(強化シリアルなど)で摂取すべきである。なぜなら加齢によって食品タンパク質結合ビタミンB12吸収不全になりやすくなるからである。
たいていの人々は、食物に含まれるビタミンB12を2.4μg/日というRDAどおりに摂取することに何の問題もない。米国での全国的調査によると、食事性の平均ビタミンB12摂取は成人男性で5.4μg/日、女性で3.4μg/日である。60歳を超えた成人は、平均で4.8μg/日を食事で摂取している(42)。しかし、どのようなタイプであっても菜食主義の食事をすると、全ての年齢層の者におけるビタミンB12欠乏症の罹患率が上がる(82)。ビタミンB12の量が多いいくつかの食物を、その含有量をマイクログラム(μg)で表したものとともに表2に記載する。特定の食物の栄養素含有量についてのさらなる情報は、USDAの食品成分データベースを検索のこと。
サプリメント
シアノコバラミンは経口サプリメントに使用されるビタミンB12の主要形態であるが、メチルコバラミンもサプリメントとして入手可能である。シアノコバラミンは、悪性貧血の治療用に注射剤および点鼻用ゲルとして処方箋で入手できる。シアノコバラミンを含む店頭用製剤には、マルチビタミン、ビタミンB複合体サプリメント、およびビタミンB12単一成分サプリメントがある(83)。
安全性
毒性
健康な個人では、食物またはサプリメントからのビタミンB12の多量摂取に関連する毒性や有害作用はない。経口で毎日2mg(2,000μg)または筋肉内注射(IM)で1mgを毎月といった高用量でも、目立った副作用もなく悪性貧血の治療に使用されている(84)。高用量のビタミンB12を経口で投与されてもわずかな割合しか吸収されず、それが毒性の低さの所以かもしれない(4)。ビタミンB12が低毒性なので、米国の食品栄養委員会は許容上限摂取量(UL)を設定していない(17)。
薬物相互作用
いくつかの薬剤はビタミンB12の吸収を低くする。ゾリンジャー・エリソン症候群や胃食道逆流疾患(GERD)の治療に使用されるプロトンポンプ阻害薬(オメプラゾールやランソプラゾールなど)は、サプリメントではなく食物からビタミンB12を遊離するのに必要な胃酸の分泌を顕著に減らす。プロトンポンプ阻害薬の長期使用は、血中ビタミンB12濃度を下げることがわかっている。しかし、ビタミンB12欠乏症は少なくとも3年間の継続治療の後までは一般的に発症しない(85, 86)。ヒスタミン2(H2)受容体拮抗薬(シメチジン、ファモチジン、およびラニチジンなど)として知られる胃酸分泌抑制剤の別種は消化性潰瘍疾患の治療によく使用されるが、これも食物からのビタミンB12吸収を減らすことがわかっている。H2受容体拮抗薬の長期使用が明白なビタミンB12欠乏症を引き起こすのかどうかは明らかでない(87, 88)。胃酸分泌を抑制する薬剤を使用している個人は、吸収に胃酸を必要としないサプリメントの形態でビタミンB12を摂取することを考慮すべきである。食物からのビタミンB12吸収を阻害することがわかっているその他の薬剤には、コレスチラミン(高コレステロール治療に使われる胆汁酸結合レジン)、クロラムフェニコールとネオマイシン(抗生物質)、およびコルヒチン(痛風の治療薬)がある。2型糖尿病の者への治療薬であるメトホルミンは、IF-B12複合体の吸収に必要な遊離カルシウムと結合することで、ビタミンB12の吸収を減らすことがわかっている(89)。しかし、このことの臨床的意味はわかっていない(90)。カルシウム補給でビタミンB12吸収不全を治せるのかどうかはわからない。したがって現在では、メトホルミン誘発性のビタミンB12欠乏症の予防や治療にカルシウム補給は処方されていない(91)。大容量のビタミンCはビタミンB12を壊すという以前の報告は裏付けられなかった(92)。これはビタミンB12濃度測定に使用されるアッセイ(試験)のアーティファクト(人為的結果)であるかもしれない(17)。
よく使用される麻酔薬である亜酸化窒素は、ビタミンB12を酸化し不活性化する。したがってビタミンB12依存性酵素を2つとも阻害して、巨赤芽球性貧血やまたは神経障害などのビタミンB12欠乏症の臨床的症状を多く発生させる可能性がある。亜酸化窒素は年配者の手術で一般的に使用されるので、その使用の前にビタミンB12欠乏症を除外しておくべきだと感じる専門家もいる(6, 15)。
診断されていないビタミンB12欠乏症の個人に大容量の葉酸を与えると、根底にあるビタミンB12欠乏症が治らないまま巨赤芽球性貧血が治るものの、不可逆性の神経学的障害を発症するリスクを残したままになるかもしれない(17)。そのため米国医学研究所の食品栄養委員会は、全ての成人の(サプリメントや強化食品由来の)葉酸摂取は一日に1,000μg(1mg)を限度とするように勧めている。
ライナス・ポーリング研究所の推奨
様々な食事によって、50歳以下のほとんどの者の欠乏症を予防するのに十分なビタミンB12が得られる。厳密な菜食主義者や妊娠を計画中の女性は、毎日マルチビタミンサプリメントを摂取したり強化シリアルを食べたりするべきで、それによって吸収しやすい形態のビタミンB12を毎日6~30μg摂取することが確実であろう。より高用量のビタミンB12サプリメントは、ビタミンB12の吸収を妨げる薬剤を使用している患者に推奨される(「薬物相互作用」の項参照)。
年配者(50歳超)
年配者ではビタミンB12吸収不全や欠乏症がより一般的であるので、ライナス・ポーリング研究所は50歳超の成人が100~400μg/日のビタミンB12補給をすることを推奨する。
Authors and Reviewers
Originally written in 2000 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in March 2003 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in August 2007 by:
Victoria J. Drake, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in January 2014 by:
Barbara Delage, Ph.D.
Linus Pauling Institute
Oregon State University
Reviewed in April 2014 by:
Joshua W. Miller, Ph.D.
Professor and Chair, Department of Nutritional Sciences
Rutgers, The State University of New Jersey
Last updated 6/4/15 Copyright 2000-2023 Linus Pauling Institute
References
1. Brody T. Nutritional Biochemistry. 2nd ed. San Diego: Academic Press; 1999.
2. Carmel R. Cobalamin (Vitamin B-12). In: Shils ME, Shike M, Ross AC, Caballero B, Cousins RJ, eds. Modern Nutrition in Health and Disease. Philadelphia: Lippincott Williams & Wilkins; 2006:482-497.
3. Shane B. Folic acid, vitamin B-12, and vitamin B-6. In: Stipanuk M, ed. Biochemical and Physiological Aspects of Human Nutrition. Philadelphia: W.B. Saunders Co.; 2000:483-518.
4. Carmel R. How I treat cobalamin (vitamin B12) deficiency. Blood. 2008;112(6):2214-2221. (PubMed)
5. Kozyraki R, Cases O. Vitamin B12 absorption: mammalian physiology and acquired and inherited disorders. Biochimie. 2013;95(5):1002-1007. (PubMed)
6. Baik HW, Russell RM. Vitamin B12 deficiency in the elderly. Annu Rev Nutr. 1999;19:357-377. (PubMed)
7. Neumann WL, Coss E, Rugge M, Genta RM. Autoimmune atrophic gastritis--pathogenesis, pathology and management. Nat Rev Gastroenterol Hepatol. 2013;10(9):529-541. (PubMed)
8. Lahner E, Persechino S, Annibale B. Micronutrients (Other than iron) and Helicobacter pylori infection: a systematic review. Helicobacter. 2012;17(1):1-15. (PubMed)
9. Carmel R. Megaloblastic anemias. Curr Opin Hematol. 1994;1(2):107-112. (PubMed)
10. Banka S, Ryan K, Thomson W, Newman WG. Pernicious anemia - genetic insights. Autoimmun Rev. 2011;10(8):455-459. (PubMed)
11. Lam-Tse WK, Batstra MR, Koeleman BP, et al. The association between autoimmune thyroiditis, autoimmune gastritis and type 1 diabetes. Pediatr Endocrinol Rev. 2003;1(1):22-37. (PubMed)
12. Checchi S, Montanaro A, Ciuoli C, et al. Prevalence of parietal cell antibodies in a large cohort of patients with autoimmune thyroiditis. Thyroid. 2010;20(12):1385-1389. (PubMed)
13. Ho C, Kauwell GP, Bailey LB. Practitioners' guide to meeting the vitamin B-12 recommended dietary allowance for people aged 51 years and older. J Am Diet Assoc. 1999;99(6):725-727. (PubMed)
14. Watkins D, Rosenblatt DS. Lessons in biology from patients with inborn errors of vitamin B12 metabolism. Biochimie. 2013;95(5):1019-1022. (PubMed)
15. Weir DG, Scott JM. Vitamin B12 "Cobalamin." In: Shils M, ed. Nutrition in Health and Disease. 9th ed. Baltimore: Williams & Wilkins; 1999:447-458.
16. Herbert V. Vitamin B-12. In: Ziegler EE, Filer LJ, eds. Present Knowledge in Nutrition. 7th ed. Washington D.C.: ILSI Press; 1996:191-205.
17. Food and Nutrition Board, Institute of Medicine. Vitamin B12. Dietary Reference Intakes for Thiamin, Riboflavin, Niacin, Vitamin B6, Vitamin B12, Pantothenic Acid, Biotin, and Choline. Washington, D.C.: National Academy Press; 1998:306-356. (National Academy Press)
18. Scalabrino G. The multi-faceted basis of vitamin B12 (cobalamin) neurotrophism in adult central nervous system: Lessons learned from its deficiency. Prog Neurobiol. 2009;88(3):203-220. (PubMed)
19. Schottker B, Adamu MA, Weck MN, Muller H, Brenner H. Helicobacter pylori infection, chronic atrophic gastritis and major cardiovascular events: a population-based cohort study. Atherosclerosis. 2012;220(2):569-574. (PubMed)
20. Gerhard GT, Duell PB. Homocysteine and atherosclerosis. Curr Opin Lipidol. 1999;10(5):417-428. (PubMed)
21. Homocysteine Lowering Trialists' Collaboration. Lowering blood homocysteine with folic acid based supplements: meta-analysis of randomised trials. Homocysteine Lowering Trialists' Collaboration. BMJ. 1998;316(7135):894-898. (PubMed)
22. Lowering blood homocysteine with folic acid based supplements: meta-analysis of randomised trials. Homocysteine Lowering Trialists' Collaboration. Bmj. 1998;316(7135):894-898. (PubMed)
23. Quinlivan EP, McPartlin J, McNulty H, et al. Importance of both folic acid and vitamin B12 in reduction of risk of vascular disease. Lancet. 2002;359(9302):227-228. (PubMed)
24. Stabler SP, Lindenbaum J, Allen RH. Vitamin B-12 deficiency in the elderly: current dilemmas. Am J Clin Nutr. 1997;66(4):741-749. (PubMed)
25. Marti-Carvajal AJ, Sola I, Lathyris D, Karakitsiou DE, Simancas-Racines D. Homocysteine-lowering interventions for preventing cardiovascular events. Cochrane Database Syst Rev. 2013;1:CD006612. (PubMed)
26. Huang T, Chen Y, Yang B, Yang J, Wahlqvist ML, Li D. Meta-analysis of B vitamin supplementation on plasma homocysteine, cardiovascular and all-cause mortality. Clin Nutr. 2012;31(4):448-454. (PubMed)
27. Ji Y, Tan S, Xu Y, et al. Vitamin B supplementation, homocysteine levels, and the risk of cerebrovascular disease: A meta-analysis. Neurology. 2013;81(15):1298-1307. (PubMed)
28. Potter K, Hankey GJ, Green DJ, Eikelboom J, Jamrozik K, Arnolda LF. The effect of long-term homocysteine-lowering on carotid intima-media thickness and flow-mediated vasodilation in stroke patients: a randomized controlled trial and meta-analysis. BMC Cardiovasc Disord. 2008;8:24. (PubMed)
29. Qin X, Xu M, Zhang Y, et al. Effect of folic acid supplementation on the progression of carotid intima-media thickness: a meta-analysis of randomized controlled trials. Atherosclerosis. 2012;222(2):307-313. (PubMed)
30. Spence JD. B vitamin therapy for homocysteine: renal function and vitamin B12 determine cardiovascular outcomes. Clin Chem Lab Med. 2013;51(3):633-637. (PubMed)
31. Fenech M. Folate (vitamin B9) and vitamin B12 and their function in the maintenance of nuclear and mitochondrial genome integrity. Mutat Res. 2012;733(1-2):21-33. (PubMed)
32. Fenech M. Micronucleus frequency in human lymphocytes is related to plasma vitamin B12 and homocysteine. Mutat Res. 1999;428(1-2):299-304. (PubMed)
33. Wu K, Helzlsouer KJ, Comstock GW, Hoffman SC, Nadeau MR, Selhub J. A prospective study on folate, B12, and pyridoxal 5'-phosphate (B6) and breast cancer. Cancer Epidemiol Biomarkers Prev. 1999;8(3):209-217. (PubMed)
34. Wu W, Kang S, Zhang D. Association of vitamin B6, vitamin B12 and methionine with risk of breast cancer: a dose-response meta-analysis. Br J Cancer. 2013;109(7):1926-1944. (PubMed)
35. Lajous M, Lazcano-Ponce E, Hernandez-Avila M, Willett W, Romieu I. Folate, vitamin B(6), and vitamin B(12) intake and the risk of breast cancer among Mexican women. Cancer Epidemiol Biomarkers Prev. 2006;15(3):443-448. (PubMed)
36. Yang D, Baumgartner RN, Slattery ML, et al. Dietary intake of folate, B-vitamins and methionine and breast cancer risk among Hispanic and non-Hispanic white women. PLoS One. 2013;8(2):e54495. (PubMed)
37. Bassett JK, Baglietto L, Hodge AM, et al. Dietary intake of B vitamins and methionine and breast cancer risk. Cancer Causes Control. 2013;24(8):1555-1563. (PubMed)
38. Eskes TK. Open or closed? A world of difference: a history of homocysteine research. Nutr Rev. 1998;56(8):236-244. (PubMed)
39. Mills JL, Scott JM, Kirke PN, et al. Homocysteine and neural tube defects. J Nutr. 1996;126(3):756S-760S. (PubMed)
40. Imbard A, Benoist JF, Blom HJ. Neural tube defects, folic acid and methylation. Int J Environ Res Public Health. 2013;10(9):4352-4389. (PubMed)
41. Wang ZP, Shang XX, Zhao ZT. Low maternal vitamin B(12) is a risk factor for neural tube defects: a meta-analysis. J Matern Fetal Neonatal Med. 2012;25(4):389-394. (PubMed)
42. Dror DK, Allen LH. Interventions with vitamins B6, B12 and C in pregnancy. Paediatr Perinat Epidemiol. 2012;26 Suppl 1:55-74. (PubMed)
43. McCaddon A. Vitamin B12 in neurology and ageing; clinical and genetic aspects. Biochimie. 2013;95(5):1066-1076. (PubMed)
44. Nourhashemi F, Gillette-Guyonnet S, Andrieu S, et al. Alzheimer disease: protective factors. Am J Clin Nutr. 2000;71(2):643S-649S. (PubMed)
45. Smith AD. The worldwide challenge of the dementias: a role for B vitamins and homocysteine? Food Nutr Bull. 2008;29(2 Suppl):S143-172. (PubMed)
46. Clarke R, Smith AD, Jobst KA, Refsum H, Sutton L, Ueland PM. Folate, vitamin B12, and serum total homocysteine levels in confirmed Alzheimer disease. Arch Neurol. 1998;55(11):1449-1455. (PubMed)
47. Seshadri S, Beiser A, Selhub J, et al. Plasma homocysteine as a risk factor for dementia and Alzheimer's disease. N Engl J Med. 2002;346(7):476-483. (PubMed)
48. Ravaglia G, Forti P, Maioli F, et al. Homocysteine and cognitive function in healthy elderly community dwellers in Italy. Am J Clin Nutr. 2003;77(3):668-673. (PubMed)
49. Ravaglia G, Forti P, Maioli F, et al. Homocysteine and folate as risk factors for dementia and Alzheimer disease. Am J Clin Nutr. 2005;82(3):636-643. (PubMed)
50. O'Leary F, Allman-Farinelli M, Samman S. Vitamin B(1)(2) status, cognitive decline and dementia: a systematic review of prospective cohort studies. Br J Nutr. 2012;108(11):1948-1961. (PubMed)
51. Clarke R, Birks J, Nexo E, et al. Low vitamin B-12 status and risk of cognitive decline in older adults. Am J Clin Nutr. 2007;86(5):1384-1391. (PubMed)
52. Tangney CC, Tang Y, Evans DA, Morris MC. Biochemical indicators of vitamin B12 and folate insufficiency and cognitive decline. Neurology. 2009;72(4):361-367. (PubMed)
53. Kivipelto M, Annerbo S, Hultdin J, et al. Homocysteine and holo-transcobalamin and the risk of dementia and Alzheimers disease: a prospective study. Eur J Neurol. 2009;16(7):808-813. (PubMed)
54. Hooshmand B, Solomon A, Kareholt I, et al. Homocysteine and holotranscobalamin and the risk of Alzheimer disease: a longitudinal study. Neurology. 2010;75(16):1408-1414. (PubMed)
55. Hooshmand B, Solomon A, Kareholt I, et al. Associations between serum homocysteine, holotranscobalamin, folate and cognition in the elderly: a longitudinal study. J Intern Med. 2012;271(2):204-212. (PubMed)
56. Ford AH, Almeida OP. Effect of homocysteine lowering treatment on cognitive function: a systematic review and meta-analysis of randomized controlled trials. J Alzheimers Dis. 2012;29(1):133-149. (PubMed)
57. Walker JG, Batterham PJ, Mackinnon AJ, et al. Oral folic acid and vitamin B-12 supplementation to prevent cognitive decline in community-dwelling older adults with depressive symptoms--the Beyond Ageing Project: a randomized controlled trial. Am J Clin Nutr. 2012;95(1):194-203. (PubMed)
58. Smith AD, Smith SM, de Jager CA, et al. Homocysteine-lowering by B vitamins slows the rate of accelerated brain atrophy in mild cognitive impairment: a randomized controlled trial. PLoS One. 2010;5(9):e12244. (PubMed)
59. Douaud G, Refsum H, de Jager CA, et al. Preventing Alzheimer's disease-related gray matter atrophy by B-vitamin treatment. Proc Natl Acad Sci U S A. 2013;110(23):9523-9528. (PubMed)
60. Hankey GJ, Ford AH, Yi Q, et al. Effect of B vitamins and lowering homocysteine on cognitive impairment in patients with previous stroke or transient ischemic attack: a prespecified secondary analysis of a randomized, placebo-controlled trial and meta-analysis. Stroke. 2013;44(8):2232-2239. (PubMed)
61. Hutto BR. Folate and cobalamin in psychiatric illness. Compr Psychiatry. 1997;38(6):305-314. (PubMed)
62. Penninx BW, Guralnik JM, Ferrucci L, Fried LP, Allen RH, Stabler SP. Vitamin B(12) deficiency and depression in physically disabled older women: epidemiologic evidence from the Women's Health and Aging Study. Am J Psychiatry. 2000;157(5):715-721. (PubMed)
63. Tiemeier H, van Tuijl HR, Hofman A, Meijer J, Kiliaan AJ, Breteler MM. Vitamin B12, folate, and homocysteine in depression: the Rotterdam Study. Am J Psychiatry. 2002;159(12):2099-2101. (PubMed)
64. Mischoulon D, Fava M. Role of S-adenosyl-L-methionine in the treatment of depression: a review of the evidence. Am J Clin Nutr. 2002;76(5):1158S-1161S. (PubMed)
65. Fernandez-Roig S, Lai SC, Murphy MM, Fernandez-Ballart J, Quadros EV. Vitamin B12 deficiency in the brain leads to DNA hypomethylation in the TCblR/CD320 knockout mouse. Nutr Metab (Lond). 2012;9:41. (PubMed)
66. Bressa GM. S-adenosyl-l-methionine (SAMe) as antidepressant: meta-analysis of clinical studies. Acta Neurol Scand Suppl. 1994;154:7-14. (PubMed)
67. Bell KM, Plon L, Bunney WE, Jr., Potkin SG. S-adenosylmethionine treatment of depression: a controlled clinical trial. Am J Psychiatry. 1988;145(9):1110-1114. (PubMed)
68. Delle Chiaie R, Pancheri P, Scapicchio P. Efficacy and tolerability of oral and intramuscular S-adenosyl-L-methionine 1,4-butanedisulfonate (SAMe) in the treatment of major depression: comparison with imipramine in 2 multicenter studies. Am J Clin Nutr. 2002;76(5):1172S-1176S. (PubMed)
69. Williams AL, Girard C, Jui D, Sabina A, Katz DL. S-adenosylmethionine (SAMe) as treatment for depression: a systematic review. Clin Invest Med. 2005;28(3):132-139. (PubMed)
70. Almeida OP, McCaul K, Hankey GJ, Norman P, Jamrozik K, Flicker L. Homocysteine and depression in later life. Arch Gen Psychiatry. 2008;65(11):1286-1294. (PubMed)
71. Moorthy D, Peter I, Scott TM, et al. Status of vitamins B-12 and B-6 but not of folate, homocysteine, and the methylenetetrahydrofolate reductase C677T polymorphism are associated with impaired cognition and depression in adults. J Nutr. 2012;142(8):1554-1560. (PubMed)
72. Walker JG, Mackinnon AJ, Batterham P, et al. Mental health literacy, folic acid and vitamin B12, and physical activity for the prevention of depression in older adults: randomised controlled trial. Br J Psychiatry. 2010;197(1):45-54. (PubMed)
73. Almeida OP, Marsh K, Alfonso H, Flicker L, Davis TM, Hankey GJ. B-vitamins reduce the long-term risk of depression after stroke: The VITATOPS-DEP trial. Ann Neurol. 2010;68(4):503-510. (PubMed)
74. Vacek TP, Kalani A, Voor MJ, Tyagi SC, Tyagi N. The role of homocysteine in bone remodeling. Clin Chem Lab Med. 2013;51(3):579-590. (PubMed)
75. van Wijngaarden JP, Doets EL, Szczecinska A, et al. Vitamin B12, folate, homocysteine, and bone health in adults and elderly people: a systematic review with meta-analyses. J Nutr Metab. 2013;2013:486186. (PubMed)
76. Sato Y, Honda Y, Iwamoto J, Kanoko T, Satoh K. Effect of folate and mecobalamin on hip fractures in patients with stroke: a randomized controlled trial. JAMA. 2005;293(9):1082-1088. (PubMed)
77. Sawka AM, Ray JG, Yi Q, Josse RG, Lonn E. Randomized clinical trial of homocysteine level lowering therapy and fractures. Arch Intern Med. 2007;167(19):2136-2139. (PubMed)
78. Herrmann W, Kirsch SH, Kruse V, et al. One year B and D vitamins supplementation improves metabolic bone markers. Clin Chem Lab Med. 2013;51(3):639-647. (PubMed)
79. van Wijngaarden JP, Dhonukshe-Rutten RA, van Schoor NM, et al. Rationale and design of the B-PROOF study, a randomized controlled trial on the effect of supplemental intake of vitamin B12 and folic acid on fracture incidence. BMC Geriatr. 2011;11:80. (PubMed)
80. LeBlanc JG, Milani C, de Giori GS, Sesma F, van Sinderen D, Ventura M. Bacteria as vitamin suppliers to their host: a gut microbiota perspective. Curr Opin Biotechnol. 2013;24(2):160-168. (PubMed)
81. Watanabe F, Yabuta Y, Tanioka Y, Bito T. Biologically active vitamin B12 compounds in foods for preventing deficiency among vegetarians and elderly subjects. J Agric Food Chem. 2013;61(28):6769-6775. (PubMed)
82. Pawlak R, Parrott SJ, Raj S, Cullum-Dugan D, Lucus D. How prevalent is vitamin B(12) deficiency among vegetarians? Nutr Rev. 2013;71(2):110-117. (PubMed)
83. Hendler SS, Rorvik DR, eds. PDR for Nutritional Supplements. Montvale: Medical Economics Company, Inc; 2001.
84. Kuzminski AM, Del Giacco EJ, Allen RH, Stabler SP, Lindenbaum J. Effective treatment of cobalamin deficiency with oral cobalamin. Blood. 1998;92(4):1191-1198. (PubMed)
85. Dharmarajan TS, Kanagala MR, Murakonda P, Lebelt AS, Norkus EP. Do acid-lowering agents affect vitamin B12 status in older adults? J Am Med Dir Assoc. 2008;9(3):162-167. (PubMed)
86. Wilhelm SM, Rjater RG, Kale-Pradhan PB. Perils and pitfalls of long-term effects of proton pump inhibitors. Expert Rev Clin Pharmacol. 2013;6(4):443-451. (PubMed)
87. Valuck RJ, Ruscin JM. A case-control study on adverse effects: H2 blocker or proton pump inhibitor use and risk of vitamin B12 deficiency in older adults. J Clin Epidemiol. 2004;57(4):422-428. (PubMed)
88. Termanini B, Gibril F, Sutliff VE, Yu F, Venzon DJ, Jensen RT. Effect of long-term gastric acid suppressive therapy on serum vitamin B12 levels in patients with Zollinger-Ellison syndrome. Am J Med. 1998;104(5):422-430. (PubMed)
89. Bauman WA, Shaw S, Jayatilleke E, Spungen AM, Herbert V. Increased intake of calcium reverses vitamin B12 malabsorption induced by metformin. Diabetes Care. 2000;23(9):1227-1231. (PubMed)
90. Obeid R. Metformin causing vitamin B12 deficiency: a guilty verdict without sufficient evidence. Diabetes Care. 2014;37(2):e22-23. (PubMed)
91. Mazokopakis EE, Starakis IK. Recommendations for diagnosis and management of metformin-induced vitamin B12 (Cbl) deficiency. Diabetes Res Clin Pract. 2012;97(3):359-367. (PubMed)
92. Simon JA, Hudes ES. Relation of serum ascorbic acid to serum vitamin B12, serum ferritin, and kidney stones in US adults. Arch Intern Med. 1999;159(6):619-624. (PubMed)
ビタミンB6
目次
要旨
-
ビタミンB6とその誘導体であるピリドキサール5'-リン酸(PLP)は、主にタンパク質の代謝に関わる100超の酵素にとって不可欠である。(詳細はこちら)
-
体内循環しているホモシステインの濃度が高いと、心血管疾患のリスクが上がるという関連がある。無作為化対照試験では、ビタミンB6を含むビタミンBの補給がホモシステイン濃度を効果的に下げる可能性があることが明示された。しかしながら、ビタミンBによるホモシステイン濃度の低下は、高リスクの個人における心血管的な有害事象のリスクを減らすことができなかった。(詳細はこちら)
-
実験的および臨床的研究に基づき増大するエビデンスは、ほとんどの慢性病に潜む全身性炎症がビタミンB6の代謝を損なうかもしれないことを示している。(詳細はこちら)
-
ビタミンB6およびその他のビタミンBの補給は年配者の認知行動能力の向上または認知低下の遅延に関連がないものの、最近の研究ではビタミンB6が晩年のうつ病のリスクを下げるのに役立つかもしれないことが示唆されている。(詳細はこちら)
-
薬理学的用量のビタミンB6は、まれな先天性ビタミンB6代謝異常でおこるてんかん発作の治療で使われる。また、無作為化対照試験の結果は妊婦のつわりの治療におけるビタミンB6の使用を支持しており、月経前症候群や手根管症候群の管理に有益である可能性を暗示している。(詳細はこちら)
-
ビタミンB6は、魚、家禽類、ナッツ、豆類、ジャガイモ、およびバナナなど様々な食品に含まれる。(詳細はこちら)
-
抗結核薬、抗パーキンソン病薬、非ステロイド性抗炎症薬、および経口避妊薬を含むいくつかの薬剤は、ビタミンB6の代謝に支障をきたす可能性がある。(詳細はこちら)
ビタミンB6は1930年代に初めて単離された水溶性ビタミンである。ビタミンB6という用語は6つの一般的形態を指し、それらはピリドキサール、ピリドキシン(ピリドキソール)、ピリドキサミン、およびそれらのリン酸化された形態を意味する。リン酸エステルの形態の誘導体であるピリドキサール5'-リン酸(PLP)は、全酵素反応の4%超に関わる生理活性補酵素の形態である(図1)(1~3)。

機能
ヒトの体内で合成できないので、ビタミンB6は食事から摂取されねばならない。PLPは、ヒトの体内で不可欠な化学反応の触媒作用をする100超の酵素の機能に決定的な役割を果たす(4)。PLP依存性酵素は、Fold Type I~Vという5つの構造グループに分けられる(5)。
- Fold Type I アスパラギン酸アミノ基転移酵素ファミリー
(アスパラギン酸アミノトランスフェラーゼファミリー)
- Fold Type II トリプトファン合成酵素ファミリー
(トリプトファンシンターゼファミリー)
- Fold Type III アラニンラセマーゼファミリー
- Fold Type IV D-アミノ酸アミノ基転移酵素ファミリー
(D-アミノ酸アミノトランスフェラーゼファミリー)
- Fold Type V グリコーゲンホスホリラーゼファミリー
PLP依存性酵素が触媒作用をする多くの生化学的反応は、ヘモグロビンやアミノ酸の生合成や脂肪酸代謝などの生物学的に必須のプロセスに関わる。PLPは、貯蔵されたグリコーゲンからブドウ糖を遊離する反応の触媒作用をする酵素であるグリコーゲンホスホリラーゼの補酵素としても働く。ヒトの体内でのPLPの多くは、グリコーゲンホスホリラーゼに結合した筋肉に見られる。PLPはまた、アミノ酸からブドウ糖を生成する反応の補酵素でもあり、このプロセスは糖新生として知られる(6)。
神経系の機能
脳内では、PLP依存性酵素である芳香族L-アミノ酸脱炭酸酵素(芳香族L-アミノ酸デカルボキシラーゼ)が2つの主要な神経伝達物質の合成の触媒作用をする。それらはアミノ酸であるトリプトファンからのセロトニンの合成と、L-3,4-ジヒドロキシフェニルアラニン(L-Dopa)からのドーパミンの合成である。グリシン、D-セリン、グルタミン酸、ヒスタミン、およびγアミノ酪酸(GABA)などのその他の神経伝達物質も、PLP依存性酵素が触媒作用をする反応において合成される(7)。
ヘモグロビンの合成と機能
PLPは5-アミノレブリン酸合成酵素(5-アミノレブリン酸シンターゼ)の補酵素として働き、これはヘモグロビンの鉄含有成分であるヘムの合成に関わる。ヘモグロビンは赤血球で見られ、体内にあまねく酸素を運ぶ赤血球の能力に不可欠である。ピリドキサールとPLPはともにヘモグロビンの分子に結合可能で、ヘモグロビンが酸素を授受する能力に影響を与える。しかし、このことが組織への正常な酸素運搬に与える影響については不明である(6,8)。ビタミンB6欠乏症はヘモグロビン合成を損ない、小球性貧血に至るのかもしれない(3)。
トリプトファンの代謝
別のビタミンBであるナイアシンの欠乏症は、適切な食事摂取によって簡単に予防できる。ナイアシンとその補酵素であるニコチンアミドアデニンジヌクレオチド(NAD)の食事からの必要量も、かなり限らられた程度までではあるもののトリプトファン代謝のキヌレニン経路における必須アミノ酸であるトリプトファンの異化作用によって摂取可能である(図2)。この経路の重要な反応はPLPに依存する。特にPLPはキヌレニナーゼ酵素の補助因子であり、キヌレニナーゼは3-ヒドロキシキヌレニンから3-ヒドロキシアントラニル酸への変換の触媒作用をする。PLPの利用性が減ると主にキヌレニナーゼの活動に影響し、NADの生成を制限し、血中および尿中でのキヌレニン、3-ヒドロキシキヌレニン、およびキサンツレン酸の濃度が高くなることにつながるようである(図2)(9)。したがって、食事性のビタミンB6を制限するとトリプトファンからのNADの合成が損なわれる一方で、適切なPLP濃度はトリプトファンからのNADの生成を維持するのに役立つ(10)。免疫の活性化と炎症に関してビタミンB6の量が不適切であることの影響は、トリプトファン代謝のキヌレニン経路におけるPLPの役割に一部関係しているのかもしれない(「疾病予防」の項参照)。
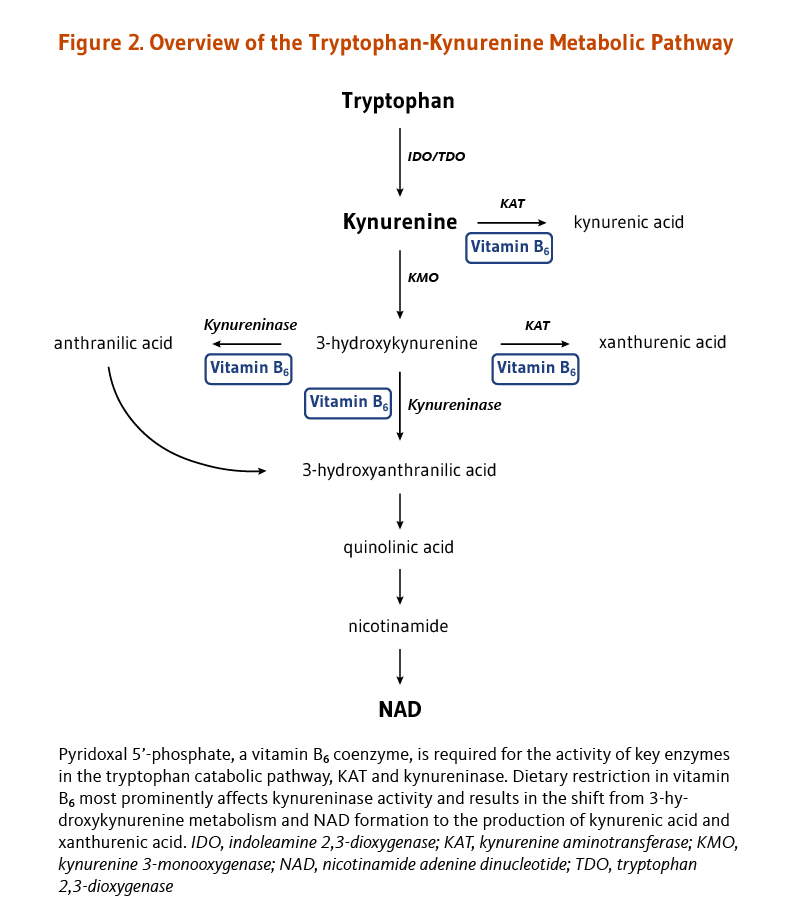
ホルモンの機能
エストロゲンやテストステロンなどのステロイドホルモンは、体内で標的細胞の核にあるステロイドホルモン受容体と結合することでその効果を表す。核の受容体そのものはDNAの特定の制御配列と結合し、標的遺伝子の転写を変える。PLPがステロイド受容体の活動に影響し、遺伝子発現へのそれらの効果を減少させるかもしれないメカニズムが、実験的な研究で明らかになった。生殖生物学における役割が知られている核内受容体の抑制因子であるRIP140/NRIP1とPLPが相互作用するのではないかということがわかった(11)。しかし、この相互作用がステロイド受容体介在性の遺伝子発現におけるRIP140/NRIP1の抑制活動を強めることを確認するさらなる研究が必要である。エストロゲン、プロゲステロン、テストステロン、またはその他のステロイドホルモンの受容体の活動がPLPによって阻害されるのであれば、乳がんや前立腺がんのようにステロイドホルモンによって促される疾病の発症リスクにビタミンB6の栄養状態が影響を与えることが可能かもしれない(6)。
核酸の合成
前駆体であるチミジンおよびプリン体からの核酸の合成は、葉酸補酵素に依存する。de novoチミジル酸(dTMP)生合成経路には、3つの酵素が関わる。それらはジヒドロ葉酸還元酵素(DHFR)、セリンヒドロキシメチルトランスフェラーゼ(SHMT)、およびチミジル酸合成酵素(TYMS)である(図3)。PLPはSHMTの補酵素として働き、これはセリンからグリシンへの変換とテトラヒドロ葉酸(THF)から5,10-メチレンTHFへの同時変換の触媒作用をする。後者の分子は、TYMSによるデオキシウリジン一リン酸(dUMP)からのdTMPの生成における一炭素供与体である。
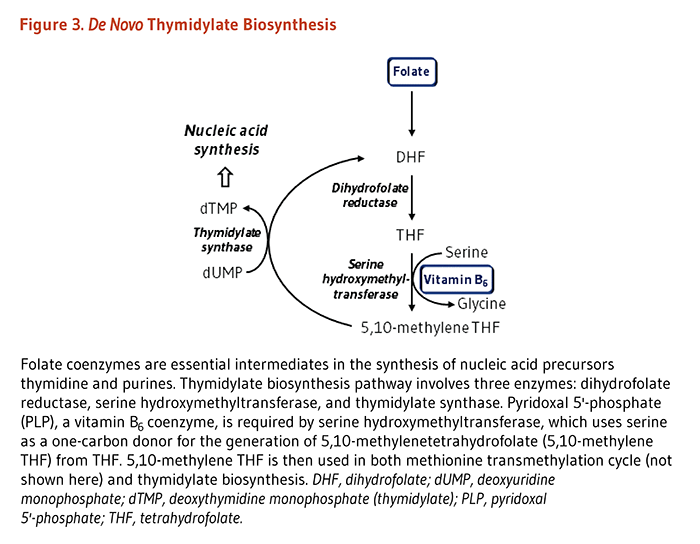
欠乏症
ビタミンB6の重篤な欠乏症は一般的でない。アルコール依存症患者は、食事性のビタミン摂取が少なくビタミン代謝も損なわれているので、ビタミンB6欠乏症のリスクが最も高いと考えられている。1950年代初期には、粉ミルク製造上の過失による重篤なビタミンB6欠乏症の結果として、乳児に発作が起きた(7)。ビタミンB6欠乏症の成人でも異常な脳波(EEG)パターンが報告されている。重篤なビタミンB6欠乏症で見られるその他の神経性症状には、易怒性、うつ、および錯乱があり、その他の症状には舌の炎症、口内炎や口内痛、および口角の皮膚の潰瘍などがある(12)。
推奨量(RDA)
ビタミンB6は代謝の多くの態様、特にアミノ酸の代謝経路に関わっているので、個人のタンパク質摂取量がビタミンB6の必要量に影響しているであろう(13)。米国医学研究所の食品栄養委員会(FNB)が発した以前の推奨量と違って、これらの関係はRDAを設定するのに考慮されてはいるものの、最新のビタミンB6のRDAはタンパク質摂取の見地からは表されてれていない(14)。現在のRDAは1998年にFNBによって改訂されており、表1にそれを示す。
疾病予防
免疫機能不全
トリプトファン代謝のキヌレニン経路のいくつかの酵素反応は、ビタミンB6補酵素であるピリドキサール5'-リン酸(PLP、上記の図2参照)に依存する(「トリプトファン代謝」の項参照)。この経路は炎症促進性の免疫反応において活性化され、妊娠期間中の胎児の免疫寛容に重要な役割を果たすことが知られている(15)。トリプトファン代謝のキヌレニン経路の重要な中間体が、免疫反応の調整に関わっている。トリプトファン誘導体のいくつかは、リンパ球(特に1型ヘルパーT細胞)のようなある種の免疫細胞の細胞死(アポトーシス)または細胞分裂阻止を引き起こすことがわかっている。それらはまた、炎症促進性サイトカインの生成を阻害することがある((15)の文献でレビュー)。最適な免疫機能、特に年配者のそれでは、ビタミンB6の適切な摂取が重要であることを示唆するエビデンス(根拠)がある(16,17)。しかし、トリプトファン分解の誘因となり多くの疾病(心血管疾患やがんなど)の根底にある慢性的炎症は、PLPの喪失を早めてビタミンB6の必要量を増やすかもしれない。現在のRDAより多いビタミンB6摂取が免疫系の障害を予防および/または反転できるのかを評価するさらなる研究が必要である(「ビタミンB6と炎症」の項参照)。
心血管疾患
米国看護師健康調査に参加した80,082人の女性集団による大規模前向き研究で、マルチビタミン(ビタミンB6を含む)サプリメントの使用は、偶発的な冠動脈疾患(CAD)リスクの24%の低下と関連があった(18)。食物摂取頻度調査票を使って、著者らは食物およびサプリメントからのビタミンB6摂取が最も高い五分位(中央値で4.6mg/日)の女性は、最も低い五分位(中央値で1.1mg/日)の女性に比べて、CADのリスクが34%低いことを見つけた。CADは冠状動脈の異常な狭窄(狭くなること)が特徴(一般的にはアテローム性動脈硬化症が原因)で、致命的な心筋梗塞(心臓発作)に至ることもある。最近では40,000人超の中年の日本人集団を11年半追跡した前向き研究で、サプリメントを使用しない者の中でビタミンB6摂取が最も高い五分位(平均で1.6mg/日)は、最も低い五分位(平均で1.3mg/日)に比べて心筋梗塞のリスクが48%低かったことが報告された(19)。
初期の観察研究でも、最適に満たない血漿ピリドキサール5'-リン酸(PLP)濃度、高い血中ホモシステイン濃度、および心血管疾患のリスク上昇には関連があることが示された(20~22)。より最近の研究で、血漿PLPが低い状態はCADのリスク要因であることが確定された。CADの184人の参加者と516人の健康な対照群によるある症例対照研究で、血漿PLP濃度が低いこと(30ナノモル/リットル未満)は、高いこと(30ナノモル/リットル以上)に比べてCADのリスクが倍近くになるという関連があった(23)。144の心筋梗塞症例(うち21人は死亡)を含む看護師健康調査の集団に基づくコホート内症例対照研究では、血中PLP濃度が最も高い四分位(70ナノモル/リットル以上)の女性は最も低い四分位(27.9ナノモル/リットル未満)の者に比べて心筋梗塞のリスクが79%低かった(24)。
ビタミンB6とホモシステイン
血中のホモシステイン濃度が少し高いだけでも、心不全、CAD、心筋梗塞、および脳血管性の発作(脳卒中)を含む心血管疾患(CVD)のリスク上昇と関連がある(25)。タンパク質の消化の際に、メチオニンを含むアミノ酸が放出される。メチオニンは必須アミノ酸であり、DNA、RNA、タンパク質、およびリン脂質のメチル化を含むほとんどのメチル化反応における普遍的なメチル基供与体であるSアデノシルメチオニン(SAM)の前駆体である(図4)。ホモシステインは、メチオニンの代謝における中間体である。健康な個人は、メチオニンの再メチル化サイクルにおいてホモシステインからメチオニンを再生するために2つの異なる経路を使用する(図5)。ホモシステインをメチオニンへと変換して戻すために、一方の経路はビタミンB12依存性メチオニン合成酵素とメチル基供与体である5-メチルテトラヒドロ葉酸(葉酸塩の誘導体)に依存する。他方の反応はベタイン-ホモシステインメチル基転移酵素によって触媒作用され、これはホモシステインからメチオニンを生成するのにベタインをメチル基の供給源として使用する。さらに、ホモシステイントランススルフレーション経路においてホモシステインをアミノ酸に変換するには、シスタチオニンβ合成酵素とシスタチオニンγリアーゼという2つのPLP依存性酵素が必要である(図5参照)。したがって血中のホモシステイン量は、葉酸塩、ビタミンB12、およびビタミンB6という少なくとも3つのビタミンBの栄養状態によって影響されるかもしれない。
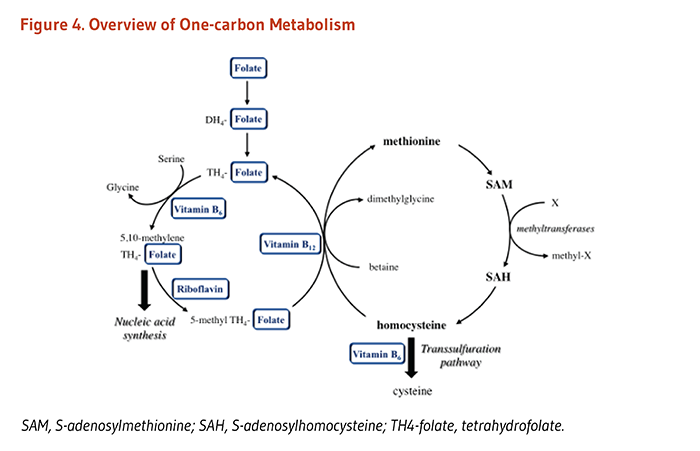
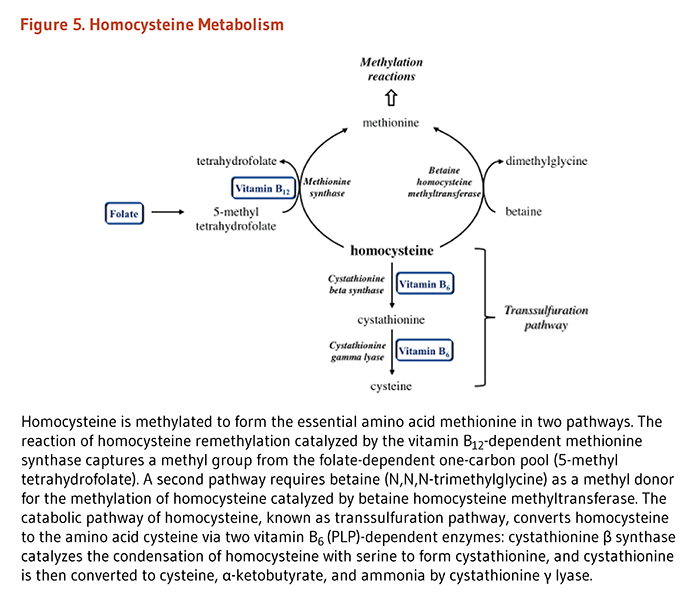
これらのビタミンBの1つもしくは全ての欠乏症は、再メチル化およびトランススルフレーションプロセスの両方に影響して異常なホモシステイン高濃度に至る可能性がある。初期の研究で、経口用量のメチオニンを与えた(メチオニン負荷試験)後でのビタミンB6の補給は血中ホモシステイン濃度を下げるかもしれないということがわかったが(26)、空腹時ホモシステイン濃度を下げることにおいてはビタミンB6補給は有効ではないかもしれない。9人の若い健康なボランティアによる最近の研究で、食後のホモシステイン濃度上昇は、ビタミンB6欠乏症ぎりぎり(平均血漿PLP濃度が19ナノモル/リットル)だとビタミンB6が十分(平均PLP濃度が49ナノモル/リットル)な場合に比べて大きいことがわかった(27)。著者らはビタミンB6制限に伴うシスタチオニン合成の速度上昇を報告し、このことはPLPの利用性がわずかに減少することに反応してトランススルフレーションにおけるホモシステインの異化作用が維持または強化されるのかもしれないことを示している。しかし、9人の参加者のうち6人において、メチオニンサイクルとトランススルフレーション経路の流出比は、トランススルフレーションよりも再メチル化によるホモシステインのクリアランス(排除)を支持しているようであった(27)。
高ホモシステイン血症や血管性障害のある被験者による多くの無作為化対照試験は、葉酸を単体もしくはビタミンB6やビタミンB12と一緒に補給すると、空腹時血漿ホモシステイン濃度を効果的に下げることができるかもしれないことを明示した。あるメタ解析に最近含まれた19の介入研究では、ビタミンB補給の後の血中ホモシステイン濃度は、ベースライン濃度(治験前の濃度)に比べて7.6%~51.7%の範囲で低下した(28)。対照的に、個人にビタミンB6のみを補給した研究では、通常は空腹時ホモシステイン濃度に効果を示さなかった(29,30)。補給された3種類のビタミンBのうち、ビタミンB12またはビタミンB6の欠乏症がない場合は、葉酸が空腹時ホモシステイン濃度の調整の主要な決定因子であるようだ(31)。しかし、CVDリスク低下におけるホモシステイン濃度低下の効果には議論の余地がある。9つの無作為化対照試験の最近のメタ解析では、ビタミンB補給で脳卒中の事象が10%減ったと報告され、これは高リスクの被験者(たとえば腎臓疾患の者など)にとってより有益であった(32)。それでも、今日までのビタミンB介入研究のシステマティックレビュー(概説)やメタ解析の大部分で、空腹時ホモシステイン濃度の低下と心血管事象の予防との間に因果関係が見られないことが示されている(28,33~35)。さらに、高リスク被験者へのビタミンB補給試験では、アテローム性動脈硬化症の進行を評価するのに使用される2つの血管健康状態マーカーである頸動脈内膜中膜肥厚(CIMT)や上腕動脈の血流依存性血管拡張反応(FMD)に大きな変化は見られなかった(36)。最後に、CADの疑いのある87人の被験者による無作為化二重盲検プラセボ対照試験である西ノルウェービタミンB介入試験(WENBIT)では、中央値で10ヶ月間ビタミンB6補給(40mg/日のピリドキシン)をしても、定量的血管造影検査によって評価された冠状動脈狭窄の進行には何の効果もなかった(37)。
CVDの一次予防で使用される抗血小板療法が、CVDリスクに関してビタミンBでホモシステイン濃度を低下させる効果に支障をきたしてしているかもしれないと示唆されてきた(38)。この点に関して、多機関共同無作為化二重盲検プラセボ対照試験であるVITATOPS(39)の部分集団事後解析で、抗血小板薬で治療を受けている患者はビタミンBによるホモシステイン濃度低下のささやかな有効性が帳消しにされているのかもしれないと提唱された(40)。しかし、一次予防(つまり、抗血小板薬の非使用者)におけるビタミンB補給の有益性は、未だに確立されていない。
ビタミンB6と炎症
ビタミンB6の栄養状態が悪いと、ホモシステイン濃度低下とは関係ないメカニズムによって心血管疾患のリスクが高くなるかもしれないことが、増大中のエビデンスで目下のところ示唆されている(41~43)。冠動脈疾患(CAD)の個人では、免疫活性と炎症のマーカーが高ホモシステイン血症(15マイクロモル/リットル超のホモシステイン濃度)と関連があった(44)。実際、動脈壁内のプラーク(アテロームとして知られる)に脂質が蓄積するアテローム性動脈硬化症の初期の段階には炎症が関わっており、CADリスクを上昇させる(45)。267人のCAD患者と475人の健康な対照群を含むある症例対照研究で、血漿PLP濃度は全身の炎症を示す2つのマーカーであるC反応性タンパク質(CRP)とフィブリノゲンの濃度と逆相関をしていた(46)。しかしその研究では、炎症マーカーへの補正をしてもCADリスクが変わらなかった(補正なしのオッズ比(OR)が1.71で、多変量補正後のORが1.73)ことから、最適未満のPLP濃度(36.3ナノモル/リットル未満)は炎症とは無関係にCADリスク増大に寄与するかもしれないことが示唆された。さらに、米国における2003~2004年全国健康栄養調査(NHANES)への参加者2,686人に対する炎症マーカーの解析で、血清CRP濃度がビタミンB6の全摂取量(食品およびサプリメントから)に逆相関することが示された。特に、血清CRP濃度が10mg/L超(高炎症活性に相当)になるリスクは、ビタミンB6摂取が2mg/日に満たない個人では摂取が5mg/日以上の者に比べて57%高かった(41)。さらに、ビタミンB6摂取が5mg/日に満たないでビタミンB6の栄養状態が不適切(血漿PLP濃度が20ナノモル/リットル未満)な者の割合は、血清CRP濃度が高い(10mg/L超)者の方が低い(3mg/L以下)者に対して体系的に高く、このことは炎症がビタミンB6の代謝を損なう可能性があることを示唆している。これらの観察はその他の同齢集団(フラミンガム次世代研究)の研究でも確認されており、この中ではビタミンB6の状態が13の炎症マーカー(CRP、フィブリノゲン、腫瘍壊死因子-α、およびインターロイキン-6を含む)の濃度に基づく全体的な炎症スコアと関連していた(42)。特に、炎症スコアが最も高い三分位の者は、最も低い三分位の者に比べて血漿PLP濃度が24%低かった。また、PLP濃度と炎症スコアとの逆相関はビタミンB6摂取の量にかかわらず大きいままだったことから、この関係性の本質がまたしても疑問視される。興味深いことに、WENBIT研究で集められたデータの最近の解析で、全身性の炎症がピリドキサール(PL)から4-ピリドキシン酸(PA)への分解が増えることと関連があることが明示され、これはビタミンB6の状態および全身性炎症という双方のマーカーとしてPAとPL+PLPとの比率を使用することを支持している(47)。最後に、炎症はビタミンB6の状態が悪いことに寄与するかもしれないが、現在のエビデンスは、心血管疾患の患者の炎症の制御におけるビタミンB6の役割を支持するものではない(48,49)。
認知機能低下とアルツハイマー病
いくつかの観察研究では、年配者の認知機能低下やアルツハイマー病(AD)と、葉酸塩、ビタミンB12、およびビタミンB6の栄養状態が不適切なこととを関連付けてきた(50)。しかし、年配者の間で高ホモシステイン血症の有病率が高いことや全身性炎症の徴候があることの両方のために、ビタミンBと加齢における認知機能の健全性との関係は複雑である(51)。一方では炎症がビタミンB6代謝を損なうかもしれないことから、血清PLP濃度が低いことは栄養不良というよりは加齢に関わる過程によって引き起こされているのかもしれない。他方では、まだ議論中ではあるものの、血清ホモシステイン濃度が高いことが年配者の認知機能低下リスク要因である可能性がある。特に、ビタミンB補給に関する19の無作為化プラセボ対照試験のメタ解析で、治療によってホモシステイン濃度が効果的に下がったにもかかわらず、治療を受けた群とプラセボを投与された群でのいくつかの認知機能測定値に差が報告されなかった(52)。認知障害のあるまたはない2,695人の脳卒中経験者による最近の無作為化二重盲検プラセボ対照研究で、2mgの葉酸、0.5mgのビタミンB12、および25mgのビタミンB6を毎日3.4年間補給したら、プラセボに比べて平均ホモシステイン濃度が大きく下がった(認知障害のない患者で28%、認知障害のある患者で43%)。しかしビタミンBによる介入は、新規に認知障害と診断される症例の発生率や認知行動能力の測定値に関して、プラセボに比べて何の効果もなかった(53)。対照的に最近の別のプラセボ対照試験で、高リスクの年配者のホモシステイン濃度を大きく低下させた毎日のビタミンBレジメン(治療計画)は、ADの過程に関連する脳の灰白質での進行性萎縮を制限するかもしれないことがわかった(54)。しかし、著者らはホモシステイン濃度の変化は主にビタミンB12によるものであるとしている。結果が混在しているので、ビタミンB補給が年配者の認知機能低下を鈍らせるかどうかは今のところ明らかでない。年配者には比較的一般的である若干のビタミンB欠乏が加齢に関連した認知機能の低下に寄与するのか、それとも両方とも加齢および/または疾患に関連するプロセスの結果なのかどうかを決定するエビデンスが必要である。
うつ病
晩年のうつ病は、股関節骨折や脳卒中などの急性の病気の後で時々起こる一般的な疾患である(55,56)。うつ病の症状とビタミンB6の低栄養状態(血漿PLP濃度が20ナノモル/リットル以下)の共存が、いくつかの横断的研究で報告されている(57,58)。シカゴ健康加齢プロジェクトに参加した自由生活を送る3,503人の65歳以上の人々の前向き研究で、ビタミンB6の全摂取量(食事性の摂取だけではない)は、平均7.2年の追跡期間のうつ病的症状の発生と逆相関があった(59)。最近脳卒中を経験した563人による無作為化二重盲検プラセボ対照試験で、毎日2mgの葉酸、0.5mgのビタミンB12、および25mgのビタミンB6を補給すると、平均7.1年間の追跡期間中に主なうつ病エピソードの発症リスクが半分になった(60)。このリスク低下は、対照群に比べて補給群の患者の血漿ホモシステイン濃度が25%低いことと関連していた。うつ病リスクが高い年配者の日常的な管理にビタミンBも含めるかどうかを評価するさらなるエビデンスが必要である。
がん
ほとんどのがんの根底にある慢性的炎症は、ビタミンB6の分解を促進するかもしれない(「ビタミンB6と炎症」の項参照)。さらに、メチオニンサイクル、ホモシステイン異化作用、およびチミジル酸合成におけるPLPの必要性から、ビタミンB6の低栄養状態は腫瘍の発生および/または進行に寄与するかもしれない。9つの前向き研究のシステマティックレビューで、ビタミンB6摂取と直腸結腸がん(CRC)リスクとの間の負または正のどちらの相関も見つかった(61)。ビタミンB6摂取と乳がんの関連における一貫しないエビデンスも、あるメタ解析で最近報告された(62)。しかし、500,000人近い年配の成人を9年間追跡した前向き研究で、ビタミンB6の全摂取量が最も高い五分位の参加者(中央値で2.7mg/日)は、最も低い参加者(中央値で1.4mg/日)に比べて食道がんおよび胃がんのリスクが低いことが観察された(63)。さらに、4つのコホート内症例対照研究のメタ解析で、血中PLP濃度が最も高い四分位の者は最も低い者に比べてCRCリスクが48%低いことが報告された(61)。5つのコホート内症例対照研究の別のメタ解析で、血清PLP濃度が高いと濃度が低い場合より閉経後の女性の乳がんリスクが29%低いという関連がわかったが、閉経前の女性ではそうではなかった(62)。
ビタミンBとがんリスクの関連の本質を調べる無作為化プラセボ対照試験でビタミンB6に焦点を当てたものは非常に少ない。冠動脈疾患の被験者で行われた初期の2つの研究では、ビタミンB6補給(40mg/日)をしてもCRCリスクや死亡率に何の有益性も見られなかった((64)の文献でレビュー)。心血管リスクの高い1,470人の女性に行われた最近の無作為化二重盲検プラセボ対照研究で、毎日2.5mgの葉酸、1mgのビタミンB12、および50mgのビタミンB6を平均して7.3年間補給しても、プラセボに比べて直腸結腸腺腫の発症リスクに何の効果もなかったことが示された(65)。
腎結石
ある大規模前向き研究で、女性のビタミンB6摂取と症候性腎結石の発生の関係が調べられた。腎結石の病歴のない85,000人超の女性群が14年超にわたって追跡され、毎日40mg以上のビタミンB6を摂取した者は、3mg以下しか摂取しなかった者に比べて腎結石を発症するリスクが3分の2しかなかった(66)。しかしながら、45.000人超の男性群を14年間追跡したら、ビタミンB6摂取と腎結石の発症には何の関連も見つからなかった(67)。高用量のピリドキサミン補給は、シュウ酸カルシウムの腎結石の生成を減らし、シュウ酸カルシウムの腎結石生成の重要な決定因子である尿中シュウ酸塩濃度を下げるのに役立つかもしれないことが、限定的な実験データから示唆される(68,69)。現在のところ、ビタミンB6摂取と腎結石発症リスクの関係については、何らかの推奨がなされる前にさらなる研究が必要である。
疾病治療
薬理学的用量(欠乏症を予防するのに必要な量よりずっと高用量)のビタミンB6サプリメントは、広範な症状の治療の試みで使用されてきており、以下でそのいくつかについて検討する。
代謝疾患
ピリドキシン依存性てんかん(PDE)やピリドキシン/ピリドキサミン5'-リン酸オキシダーゼ(PNPO)欠乏症などの稀な先天性代謝障害のいくつかは、薬理学的用量のビタミンB6によく反応することがわかっている早発性てんかん性脳症の原因である。PDEやPNPO欠乏症の個人では、PLPの生物学的利用性が限定されており、ピリドキシンおよび/またはPLPでの治療がこれらの病状の特徴であるてんかん発作を軽減または消失させるために使用されてきた(70,71)。食事性のタンパク質制限とともにピリドキシンで治療することも、PLP依存性酵素であるシスタチオニンβ合成酵素の欠乏でおこりビタミンB6によく反応するホモシスチン尿症の管理に使用される(72)。
つわり
つわりとよく言われる妊娠中の吐き気と嘔吐(NVP)は、妊娠初期の85%の女性に影響し、通常は12~16週間続く(73)。妊娠中の吐き気治療にビタミンB6が1940年代から使用されてきた。ビタミンB6はもともとベンデクチンという薬剤に含まれ、これはNVP治療に処方され、後に先天性欠損のリスクが高くなるのではないかという未証明の懸念によって市場から回収された。ビタミンB6自体は妊娠中でも安全であると考えられており、致命的な害のエビデンスも無く妊婦に使用されている(74)。25mgのピリドキシンを8時間ごとに3日間使った妊婦(75)や10mgのピリドキシンを8時間ごとに5日間使った妊婦(76)を含む401人の妊婦による2つの二重盲検プラセボ対照試験の結果では、ビタミンB6は吐き気を抑えるのに有益であるかもしれないということが示唆された。妊娠初期のNVP症状に関する無作為化対照試験の最近のシステマティックレビューで、ビタミンB6補給は多少の効果があるとわかった(77)。NVPは通常は何の治療もしないで解決するので、よく対照された試験を行うことが難しいことに留意すべきである。より最近では、NVPに悩まされる256人の妊婦(妊娠7~14週)に対して行われた無作為化二重盲検プラセボ対照研究において、妊娠特有嘔吐定量化(PUQE)スコアを用いてNVPの症状が評価された(78)。プラセボに比べてPUQEスコアが低かったため、ピリドキシンおよびドキシラミンという薬剤の補給は、NVPの症状を大きく改善したと評価された。また、ピリドキシンとドキシラミンを補給した女性は、プラセボで処置された女性よりも15日間の試験の終わりにその治療を継続したいと希望した者が多かった(48.9%対32.8%)。アメリカおよびカナダの産婦人科学会は、NVPの第一選択療法としてビタミンB6(塩酸ピリドキシン10mg)とコハク酸ドキシラミン(10mg)の使用を勧めている(73)。
月経前症候群
月経前症候群(PMS)とは、疲労、易怒性、むら気/うつ、体液貯留、および乳房圧痛などを含む症状群を言うが、これだけには限定されず、排卵(中間期)後の頃に始まり月経(生理)の始まりとともに和らぐ。9つの無作為化プラセボ対照試験のシステマティックレビューおよびメタ解析で、最大100mg/日までのビタミンB6補給が気分的な症状を含むPMSの治療に有益かもしれないと示唆された。しかし、ほとんどの研究の品質がよくないため、限定的な結論しか出せないかもしれない(79)。13の無作為化対照試験の最近の別のレビューでも、推奨を出せるくらいの決定的なエビデンスの必要性が強調された(80)。
うつ
いくつかの神経伝達物質(「神経系の機能」の項参照)の合成におけるPLP依存性酵素の重要性から、研究者はビタミンB6欠乏症がうつ病症状の発症に寄与しているのではないかと考えるようになった(「疾病予防」の項参照)。ビタミンB6補給がうつ病の管理に治療的効能があるかもしれないと示唆するエビデンスは限定的である。急性の疾病で入院した225人の年配の患者に対して行われたある無作為化プラセボ対照試験では、毎日6ヶ月間マルチビタミン/ミネラル補給をする介入でビタミンBの栄養状態が改善し、プラセボに比べてうつ症状の回数や重篤度が低下した(81)。さらに、サプリメントの摂取によってプラセボに比べて効果的に血漿ホモシステイン濃度が減り、ホモシステイン濃度が最も低い四分位の被験者(10マイクロモル/リットル以下)は最も高い四分位(16.1マイクロモル/リットル以上)に比べて試験終了時のうつ病的症状に対する補給の効果が大きかった(82)。しかし、晩期発症型うつ病の病因はよくわからず、ビタミンB(ビタミンB6を含む)補給がうつ病的症状を和らげるのかどうかということを示唆するエビデンスが現在不足している。
手根管症候群
手根管症候群(CTS)は、手首の正中神経の圧迫により手や指に痺れ、痛み、および脱力感を引き起こす。それは手首に繰り返し与えられた圧力損傷や軟組織の腫脹によるものであるかもしれず、時として妊娠や甲状腺機能低下症とともに起こる。同じ研究者による初期の研究で100~200mg/日のビタミンB6を数ヶ月補給すると、ビタミンB6の栄養状態が悪い個人のCTSの症状を改善するかもしれないことが示唆された(83,84)。さらに、ビタミンのサプリメントを摂取していない137人の男性による横断的研究で、低い血中PLP濃度がCTSの症状である痛み、うずき、および中途覚醒の増加と関連していることがわかった(85)。しかし、正中神経の伝導の電気生理学的測定を使用した大部分の研究では、ビタミンB6欠乏症とCTSの関連は見つけられなかった(86)。ビタミンB6補給によるいくらかの症状の軽減に言及した研究もあったが、二重盲検プラセボ対照試験は一般的にビタミンB6がCTS治療に効果的だとはしていない(86)。しかし、有効性に関する賛否両論があるにもかかわらず、手の手術を避けるための試みとしての補完療法にビタミンB6補給が時々使用される。高用量のビタミンB6を摂取している患者は、医師に助言を受けビタミンB6関連の毒性の症状に関してチェックされねばならない(「毒性」の項参照)(87)。
摂取源
食品の摂取源
2003~2004年に行われた米国のNHANESで集められたデータの解析で、ビタミンB6の食品のみからの摂取は平均で1.9mg/日であったことが示された(88)。現在のRDAを大きく上回る数字であるにもかかわらず、2mg/日未満というビタミンB6の全摂取量(食品およびサプリメントを合わせたもの)は、全年齢層でビタミンB6の栄養状態が低い人の割合が比較的高いことと関連しているように見える(「サプリメント」の項参照)。多くの植物性食品はピリドキシングルコシドという独特な形態のビタミンB6を含有しており、この形態のビタミンB6はその他の食品源やサプリメント由来のビタミンB6に比べて約半分の生物学的利用性しかないようである(7)。混合食に含まれるビタミンB6は約75%の生物学的利用性があることがわかっている(14)。たいていの場合ビタミンB6の豊富な食品を食事に含めることで、現在のRDAを満たすのに十分なビタミンB6が供給されるはずである。しかし、非常に制限された菜食主義の食事を守る者は、ビタミンB6が強化された食品を食べたりサプリメントを摂ったりして、ビタミンB6摂取を増やす必要があるかもしれない。ビタミンB6が比較的豊富な食品とその含有量をミリグラム(mg)で示したものを、表2に記載する。特定の食品の栄養素含有量についてのさらなる情報は、USDAの食品成分データベースを検索のこと。
サプリメント
ビタミンB6はマルチビタミン、ビタミンB複合体、およびビタミンB6のサプリメント中の塩酸ピリドキシンとして入手可能である(89)。2003~2004年のNHANESでは、ビタミンB6の栄養状態が悪い(血漿PLP濃度が20ナノモル/リットル未満)ケースがサプリメントの不使用者で24%、サプリメント使用者で11%報告された。さらに、2mg/日より少ないビタミンB6全摂取量(食品およびサプリメント由来)が、血漿PLP濃度の低い者の割合が高いことと関連があった。これは13~54歳の男性の16%、月経のある女性の24%、および65歳以上の者の26%にあたる。最後に、ビタミンB6摂取が2mg/日未満の者の方がそれより摂取が多い者に比べて低PLP濃度の割合が高かった。たとえば、65歳以上の男女ではビタミンB6の全摂取量が2~2.9mg/日の者はその14%が低PLP濃度だったのに対し、2mg/日未満の者では26%が低PLP濃度であった(88)。
安全性
毒性
有害作用はビタミンB6サプリメントに関しての記録しかなく、食品源からの記録がないため、ビタミンB6(ピリドキシン)のサプリメントのみに関しての安全性を議論する。ビタミンB6は水溶性ビタミンで尿中に排泄されるものの、非常に高用量のピリドキシンの長期補給は感覚性ニューロパチーとして知られる痛みを伴う神経症状に至る可能性がある。症状には四肢の痛みや痺れなどがあるが、重篤な場合は歩行困難になる。感覚性ニューロパチーは、1日に1,000mgを超える用量のピリドキシンで一般的に発症する。しかし、数ヶ月間の毎日500mg未満の用量でも感覚性ニューロパチーを発症した個人のいくつかの症例報告がある。客観的な神経学的検査が行われた研究で、毎日200mg未満のピリドキシン摂取で感覚神経損傷のエビデンスが報告されたものはない(90)。実質的にすべての者の感覚性ニューロパチーを防ぐために、米国医学研究所の食品栄養委員会は成人に対するピリドキシンの許容上限摂取量(UL)を100mg/日と設定した(表3)(14)。プラセボ対照研究で高用量ピリドキシンの治療効果が一般的に示されなかったため、100mg/日というULを超えることにはほとんど意味がない。
| 年齢層 | UL(mg/日) |
|---|---|
| 乳児 0~12ヶ月 | 設定不可能* |
| 幼児 1~3歳 | 30 |
| 子供4~8歳 | 40 |
| 子供9~13歳 | 60 |
| 青少年 14~18歳 | 80 |
| 成人 19歳以上 | 100 |
| *摂取源は食品および粉ミルクのみ。 | |
薬物相互作用
特定の薬物はビタミンB6代謝に支障をきたす。したがってビタミンB6補給をしないとビタミンB6欠乏症になりやすいかもしれない個人もいる。2003~2004年のNHANESの解析で、月経期の女性で現在および過去に経口避妊薬(OC)を使用したことのある者は、使用したことのない女性に比べて血漿PLP濃度が低い者がかなり多かった。このことはOCに含まれるエストロゲンがビタミンB6代謝に支障をきたす可能性を示唆する(「経口避妊薬の副作用」の項参照)(88)。抗結核薬(たとえばイソニアジドやシクロセリンなど)、金属キレートペニシラミン、およびLドーパのような抗パーキンソン病薬はすべてビタミンB6と複合体を形成することが可能で、ビタミンB6の生物学的利用性を限定してしまい、機能性欠乏症を引きおこしてしまう。PLPの生物学的利用性も、特定の呼吸状態の治療に使用されるテオフィリンなどのメチルキサンチンによって低下する可能性がある(7)。長期間の非ステロイド性抗炎症薬(NSAID、たとえばセレコキシブやナプロキセン)の使用も、ビタミンB6代謝を損なう可能性がある(91)。逆に、高用量のビタミンB6はフェノバルビタールとフェニトインという2つの抗痙攣薬、およびLドーパの効能を下げることがわかっている(6,90)。
経口避妊薬の副作用
ビタミンB6はアミノ酸であるトリプトファンの代謝に必要であるので、トリプトファン負荷試験(トリプトファンの経口投与後のトリプトファン代謝物の測定)がビタミンB6の状態の機能評価として使用されてきた。1960~1970年代に高用量の経口避妊薬(OC)を摂取した女性の異常なトリプトファン負荷試験の結果はこれらの女性がビタミンB6欠乏であると示唆し、OCを摂取する女性への高用量ビタミンB6(100~150mg/日)処方につながった。しかし、高用量OCを摂取した女性のビタミンB6状態に関するその他のほとんどの指標は正常であり、OCに含まれるエストロゲンの方がトリプトファン代謝の異常の原因であるようだった(88)。しかしながら、最近になってより低用量の製剤の使用も、ビタミンB6の不適切さと関連していた(88,92)。OCが実際にビタミンB6代謝を損なうのかPLPの組織分布に影響しているだけなのか不明であるが、OCの使用は女性がOCを止めて妊娠した際にビタミンB6欠乏症になるリスクを高くするのかもしれない(93)。ホモシステイン濃度が正常でもOCの使用者は心血管疾患のリスクが高いのかどうかも確定されねばならない。最後に、高用量ビタミンB6(ピリドキシン)はOCの副作用リスクの予防に何の効果もないと実証されてきた(94)が、現在および過去のOC使用者にはビタミンB6サプリメントの使用が是認されてもよいかもしれない。
ライナス・ポーリング研究所の推奨
ライナス・ポーリング研究所はビタミンB6のRDAを支持する。LPIはすべての成人が毎日マルチビタミン/ミネラルのサプリメントを摂取することを推奨し、これには通常少なくとも2mgのビタミンB6が含まれる。この量はRDAより若干多いが、食品栄養委員会によって設定された許容上限摂取量(UL)よりも50倍も低い(「安全性」の項参照)。
年配の成人(50歳超)
初期の代謝研究は、年配者のビタミンB6必要量は毎日約2mgであると示してきた(95)。しかし、2003~2004年の米国の集団調査(NHANES)の分析で、65歳以上の人々における適切なビタミンB6の状態と低ホモシステイン濃度は3mg/日以上のビタミンB6全摂取量と関連があることが示された(88)。ライナス・ポーリング研究所は、年配者が少なくとも2.0mgのビタミンB6を毎日摂れるマルチビタミン/ミネラルサプリメントを摂取することを推奨する。
Authors and Reviewers
Originally written in 2000 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in February 2002 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in November 2007 by:
Victoria J. Drake, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in May 2014 by:
Barbara Delage, Ph.D.
Linus Pauling Institute
Oregon State University
Reviewed in June 2014 by:
Jesse F. Gregory, Ph.D.
Professor, Food Science and Human Nutrition
University of Florida
The 2014 update of this article was underwritten, in part, by a grant from Bayer Consumer Care AG, Basel, Switzerland.
Copyright 2000-2024 Linus Pauling Institute
References
1. Dakshinamurti S, Dakshinamurti K. Vitamin B6. In: Zempleni J, Rucker RB, McCormick DB, Suttie JW, eds. Handbook of Vitamins. 4th ed. New York: CRC Press (Taylor & Fracis Group); 2007:315-359.
2. Galluzzi L, Vacchelli E, Michels J, et al. Effects of vitamin B6 metabolism on oncogenesis, tumor progression and therapeutic responses. Oncogene. 2013;32(42):4995-5004. (PubMed)
3. McCormick DB. Vitamin B6. In: Bowman BA, Russell RM, eds. Present Knowledge in Nutrition. Vol. I. Washington, D.C.: International Life Sciences Institute; 2006:269-277.
4. Da Silva VR, Russell KA, Gregory JF 3rd. Vitamin B6. In: Erdman JW Jr., Macdonald IA, Zeisel SH. Present Knowldege in Nutrition. 10th ed: Wiley-Blackwell; 2012:307-320.
5. Eliot AC, Kirsch JF. Pyridoxal phosphate enzymes: mechanistic, structural, and evolutionary considerations. Annu Rev Biochem. 2004;73:383-415. (PubMed)
6. Leklem JE. Vitamin B-6. In: Shils M, Olson JA, Shike M, Ross AC, eds. Modern Nutrition in Health and Disease. 9th ed. Baltimore: Williams & Wilkins; 1999:413-422.
7. Clayton PT. B6-responsive disorders: a model of vitamin dependency. J Inherit Metab Dis. 2006;29(2-3):317-326. (PubMed)
8. Schnackerz KD, Benesch RE, Kwong S, Benesch R, Helmreich EJ. Specific receptor sites for pyridoxal 5'-phosphate and pyridoxal 5'-deoxymethylenephosphonate at the α and β NH2-terminal regions of hemoglobin. J Biol Chem. 1983;258(2):872-875. (PubMed)
9. Rios-Avila L, Nijhout HF, Reed MC, Sitren HS, Gregory JF, 3rd. A mathematical model of tryptophan metabolism via the kynurenine pathway provides insights into the effects of vitamin B-6 deficiency, tryptophan loading, and induction of tryptophan 2,3-dioxygenase on tryptophan metabolites. J Nutr. 2013;143(9):1509-1519. (PubMed)
10. Oxenkrug G. Insulin resistance and dysregulation of tryptophan-kynurenine and kynurenine-nicotinamide adenine dinucleotide metabolic pathways. Mol Neurobiol. 2013;48(2):294-301. (PubMed)
11. Huq MD, Tsai NP, Lin YP, Higgins L, Wei LN. Vitamin B6 conjugation to nuclear corepressor RIP140 and its role in gene regulation. Nat Chem Biol. 2007;3(3):161-165. (PubMed)
12. Leklem JE. Vitamin B6. In: Machlin L, ed. Handbook of Vitamins. New York: Marcel Decker Inc; 1991:341-378.
13. Hansen CM, Shultz TD, Kwak HK, Memon HS, Leklem JE. Assessment of vitamin B-6 status in young women consuming a controlled diet containing four levels of vitamin B-6 provides an estimated average requirement and recommended dietary allowance. J Nutr. 2001;131(6):1777-1786. (PubMed)
14. Food and Nutrition Board, Institute of Medicine. Vitamin B6. Dietary Reference Intakes: Thiamin, Riboflavin, Niacin, Vitamin B6, Vitamin B12, Pantothenic Acid, Biotin, and Choline. Washington D.C.: National Academies Press; 1998:150-195. (National Academies Press)
15. Paul L, Ueland PM, Selhub J. Mechanistic perspective on the relationship between pyridoxal 5'-phosphate and inflammation. Nutr Rev. 2013;71(4):239-244. (PubMed)
16. Meydani SN, Ribaya-Mercado JD, Russell RM, Sahyoun N, Morrow FD, Gershoff SN. Vitamin B-6 deficiency impairs interleukin 2 production and lymphocyte proliferation in elderly adults. Am J Clin Nutr. 1991;53(5):1275-1280. (PubMed)
17. Talbott MC, Miller LT, Kerkvliet NI. Pyridoxine supplementation: effect on lymphocyte responses in elderly persons. Am J Clin Nutr. 1987;46(4):659-664. (PubMed)
18. Rimm EB, Willett WC, Hu FB, et al. Folate and vitamin B6 from diet and supplements in relation to risk of coronary heart disease among women. JAMA. 1998;279(5):359-364. (PubMed)
19. Ishihara J, Iso H, Inoue M, et al. Intake of folate, vitamin B6 and vitamin B12 and the risk of CHD: the Japan Public Health Center-Based Prospective Study Cohort I. J Am Coll Nutr. 2008;27(1):127-136. (PubMed)
20. Folsom AR, Nieto FJ, McGovern PG, et al. Prospective study of coronary heart disease incidence in relation to fasting total homocysteine, related genetic polymorphisms, and B vitamins: the Atherosclerosis Risk in Communities (ARIC) study. Circulation. 1998;98(3):204-210. (PubMed)
21. Robinson K, Arheart K, Refsum H, et al. Low circulating folate and vitamin B6 concentrations: risk factors for stroke, peripheral vascular disease, and coronary artery disease. European COMAC Group.Circulation. 1998;97(5):437-443. (PubMed)
22. Robinson K, Mayer EL, Miller DP, et al. Hyperhomocysteinemia and low pyridoxal phosphate. Common and independent reversible risk factors for coronary artery disease. Circulation. 1995;92(10):2825-2830. (PubMed)
23. Lin PT, Cheng CH, Liaw YP, Lee BJ, Lee TW, Huang YC. Low pyridoxal 5'-phosphate is associated with increased risk of coronary artery disease. Nutrition. 2006;22(11-12):1146-1151. (PubMed)
24. Page JH, Ma J, Chiuve SE, et al. Plasma vitamin B(6) and risk of myocardial infarction in women. Circulation. 2009;120(8):649-655. (PubMed)
25. Gerhard GT, Duell PB. Homocysteine and atherosclerosis. Curr Opin Lipidol. 1999;10(5):417-428. (PubMed)
26. Ubbink JB, Vermaak WJ, van der Merwe A, Becker PJ, Delport R, Potgieter HC. Vitamin requirements for the treatment of hyperhomocysteinemia in humans. J Nutr. 1994;124(10):1927-1933. (PubMed)
27. Lamers Y, Coats B, Ralat M, Quinlivan EP, Stacpoole PW, Gregory JF, 3rd. Moderate vitamin B-6 restriction does not alter postprandial methionine cycle rates of remethylation, transmethylation, and total transsulfuration but increases the fractional synthesis rate of cystathionine in healthy young men and women. J Nutr. 2011;141(5):835-842. (PubMed)
28. Huang T, Chen Y, Yang B, Yang J, Wahlqvist ML, Li D. Meta-analysis of B vitamin supplementation on plasma homocysteine, cardiovascular and all-cause mortality. Clin Nutr. 2012;31(4):448-454. (PubMed)
29. Bosy-Westphal A, Holzapfel A, Czech N, Muller MJ. Plasma folate but not vitamin B(12) or homocysteine concentrations are reduced after short-term vitamin B(6) supplementation. Ann Nutr Metab. 2001;45(6):255-258. (PubMed)
30. Lee BJ, Huang MC, Chung LJ, et al. Folic acid and vitamin B12 are more effective than vitamin B6 in lowering fasting plasma homocysteine concentration in patients with coronary artery disease. Eur J Clin Nutr. 2004;58(3):481-487. (PubMed)
31. Bostom AG, Carpenter MA, Kusek JW, et al. Homocysteine-lowering and cardiovascular disease outcomes in kidney transplant recipients: primary results from the Folic Acid for Vascular Outcome Reduction in Transplantation trial. Circulation. 2011;123(16):1763-1770. (PubMed)
32. Qin X, Huo Y, Xie D, Hou F, Xu X, Wang X. Homocysteine-lowering therapy with folic acid is effective in cardiovascular disease prevention in patients with kidney disease: a meta-analysis of randomized controlled trials. Clin Nutr. 2013;32(5):722-727. (PubMed)
33. Clarke R, Halsey J, Bennett D, Lewington S. Homocysteine and vascular disease: review of published results of the homocysteine-lowering trials. J Inherit Metab Dis. 2011;34(1):83-91. (PubMed)
34. Marti-Carvajal AJ, Sola I, Lathyris D, Karakitsiou DE, Simancas-Racines D. Homocysteine-lowering interventions for preventing cardiovascular events. Cochrane Database Syst Rev. 2013;1:CD006612. (PubMed)
35. Zhang C, Chi FL, Xie TH, Zhou YH. Effect of B-vitamin supplementation on stroke: a meta-analysis of randomized controlled trials. PLoS One. 2013;8(11):e81577. (PubMed)
36. Potter K, Hankey GJ, Green DJ, Eikelboom J, Jamrozik K, Arnolda LF. The effect of long-term homocysteine-lowering on carotid intima-media thickness and flow-mediated vasodilation in stroke patients: a randomized controlled trial and meta-analysis. BMC Cardiovasc Disord. 2008;8:24. (PubMed)
37. Loland KH, Bleie O, Blix AJ, et al. Effect of homocysteine-lowering B vitamin treatment on angiographic progression of coronary artery disease: a Western Norway B Vitamin Intervention Trial (WENBIT) substudy. Am J Cardiol. 2010;105(11):1577-1584. (PubMed)
38. Wang X, Qin X, Demirtas H, et al. Efficacy of folic acid supplementation in stroke prevention: a meta-analysis. Lancet. 2007;369(9576):1876-1882. (PubMed)
39. Vitatops Trial Study Group. B vitamins in patients with recent transient ischaemic attack or stroke in the VITAmins TO Prevent Stroke (VITATOPS) trial: a randomised, double-blind, parallel, placebo-controlled trial. Lancet Neurol. 2010;9(9):855-865. (PubMed)
40. Hankey GJ, Eikelboom JW, Yi Q, et al. Antiplatelet therapy and the effects of B vitamins in patients with previous stroke or transient ischaemic attack: a post-hoc subanalysis of VITATOPS, a randomised, placebo-controlled trial. Lancet Neurol. 2012;11(6):512-520. (PubMed)
41. Morris MS, Sakakeeny L, Jacques PF, Picciano MF, Selhub J. Vitamin B-6 intake is inversely related to, and the requirement is affected by, inflammation status. J Nutr. 2010;140(1):103-110. (PubMed)
42. Sakakeeny L, Roubenoff R, Obin M, et al. Plasma pyridoxal-5-phosphate is inversely associated with systemic markers of inflammation in a population of US adults. J Nutr. 2012;142(7):1280-1285. (PubMed)
43. Shen J, Lai CQ, Mattei J, Ordovas JM, Tucker KL. Association of vitamin B-6 status with inflammation, oxidative stress, and chronic inflammatory conditions: the Boston Puerto Rican Health Study. Am J Clin Nutr. 2010;91(2):337-342. (PubMed)
44. Schroecksnadel K, Grammer TB, Boehm BO, Marz W, Fuchs D. Total homocysteine in patients with angiographic coronary artery disease correlates with inflammation markers. Thromb Haemost. 2010;103(5):926-935. (PubMed)
45. Hartman J, Frishman WH. Inflammation and atherosclerosis: a review of the role of interleukin-6 in the development of atherosclerosis and the potential for targeted drug therapy. Cardiol Rev. 2014;22(3):147-151. (PubMed)
46. Friso S, Girelli D, Martinelli N, et al. Low plasma vitamin B-6 concentrations and modulation of coronary artery disease risk. Am J Clin Nutr. 2004;79(6):992-998. (PubMed)
47. Ulvik A, Midttun O, Pedersen ER, Eussen SJ, Nygard O, Ueland PM. Evidence for increased catabolism of vitamin B-6 during systemic inflammation. Am J Clin Nutr. 2014;100(1):250-255. (Epub ahead of print) (PubMed)
48. Bleie O, Semb AG, Grundt H, et al. Homocysteine-lowering therapy does not affect inflammatory markers of atherosclerosis in patients with stable coronary artery disease. J Intern Med. 2007;262(2):244-253. (PubMed)
49. Potter K, Lenzo N, Eikelboom JW, Arnolda LF, Beer C, Hankey GJ. Effect of long-term homocysteine reduction with B vitamins on arterial wall inflammation assessed by fluorodeoxyglucose positron emission tomography: a randomised double-blind, placebo-controlled trial. Cerebrovasc Dis. 2009;27(3):259-265. (PubMed)
50. Selhub J, Bagley LC, Miller J, Rosenberg IH. B vitamins, homocysteine, and neurocognitive function in the elderly. Am J Clin Nutr. 2000;71(2):614S-620S. (PubMed)
51. Pawelec G, Goldeck D, Derhovanessian E. Inflammation, ageing and chronic disease. Curr Opin Immunol. 2014;29C:23-28. (PubMed)
52. Ford AH, Almeida OP. Effect of homocysteine lowering treatment on cognitive function: a systematic review and meta-analysis of randomized controlled trials. J Alzheimers Dis. 2012;29(1):133-149. (PubMed)
53. Hankey GJ, Ford AH, Yi Q, et al. Effect of B vitamins and lowering homocysteine on cognitive impairment in patients with previous stroke or transient ischemic attack: a prespecified secondary analysis of a randomized, placebo-controlled trial and meta-analysis. Stroke. 2013;44(8):2232-2239. (PubMed)
54. Douaud G, Refsum H, de Jager CA, et al. Preventing Alzheimer's disease-related gray matter atrophy by B-vitamin treatment. Proc Natl Acad Sci U S A. 2013;110(23):9523-9528. (PubMed)
55. Hackett ML, Yapa C, Parag V, Anderson CS. Frequency of depression after stroke: a systematic review of observational studies. Stroke. 2005;36(6):1330-1340. (PubMed)
56. Lenze EJ, Munin MC, Skidmore ER, et al. Onset of depression in elderly persons after hip fracture: implications for prevention and early intervention of late-life depression. J Am Geriatr Soc. 2007;55(1):81-86. (PubMed)
57. Merete C, Falcon LM, Tucker KL. Vitamin B6 is associated with depressive symptomatology in Massachusetts elders. J Am Coll Nutr. 2008;27(3):421-427. (PubMed)
58. Pan WH, Chang YP, Yeh WT, et al. Co-occurrence of anemia, marginal vitamin B6, and folate status and depressive symptoms in older adults. J Geriatr Psychiatry Neurol. 2012;25(3):170-178. (PubMed)
59. Skarupski KA, Tangney C, Li H, Ouyang B, Evans DA, Morris MC. Longitudinal association of vitamin B-6, folate, and vitamin B-12 with depressive symptoms among older adults over time. Am J Clin Nutr. 2010;92(2):330-335. (PubMed)
60. Almeida OP, Marsh K, Alfonso H, Flicker L, Davis TM, Hankey GJ. B-vitamins reduce the long-term risk of depression after stroke: The VITATOPS-DEP trial. Ann Neurol. 2010;68(4):503-510. (PubMed)
61. Larsson SC, Orsini N, Wolk A. Vitamin B6 and risk of colorectal cancer: a meta-analysis of prospective studies. JAMA. 2010;303(11):1077-1083. (PubMed)
62. Wu W, Kang S, Zhang D. Association of vitamin B6, vitamin B12 and methionine with risk of breast cancer: a dose-response meta-analysis. Br J Cancer. 2013;109(7):1926-1944. (PubMed)
63. Xiao Q, Freedman ND, Ren J, Hollenbeck AR, Abnet CC, Park Y. Intakes of folate, methionine, vitamin B6, and vitamin B12 with risk of esophageal and gastric cancer in a large cohort study. Br J Cancer. 2014;110(5):1328-1333. (PubMed)
64. Zhang XH, Ma J, Smith-Warner SA, Lee JE, Giovannucci E. Vitamin B6 and colorectal cancer: current evidence and future directions. World J Gastroenterol. 2013;19(7):1005-1010. (PubMed)
65. Song Y, Manson JE, Lee IM, et al. Effect of combined folic acid, vitamin B(6), and vitamin B(12) on colorectal adenoma. J Natl Cancer Inst. 2012;104(20):1562-1575. (PubMed)
66. Curhan GC, Willett WC, Speizer FE, Stampfer MJ. Intake of vitamins B6 and C and the risk of kidney stones in women. J Am Soc Nephrol. 1999;10(4):840-845. (PubMed)
67. Taylor EN, Stampfer MJ, Curhan GC. Dietary factors and the risk of incident kidney stones in men: new insights after 14 years of follow-up. J Am Soc Nephrol. 2004;15(12):3225-3232. (PubMed)
68. Chetyrkin SV, Kim D, Belmont JM, Scheinman JI, Hudson BG, Voziyan PA. Pyridoxamine lowers kidney crystals in experimental hyperoxaluria: a potential therapy for primary hyperoxaluria. Kidney Int. 2005;67(1):53-60. (PubMed)
69. Scheinman JI, Voziyan PA, Belmont JM, Chetyrkin SV, Kim D, Hudson BG. Pyridoxamine lowers oxalate excretion and kidney crystals in experimental hyperoxaluria: a potential therapy for primary hyperoxaluria. Urol Res. 2005;33(5):368-371. (PubMed)
70. Pearl PL, Gospe SM, Jr. Pyridoxine or pyridoxal-5'-phosphate for neonatal epilepsy: The distinction just got murkier. Neurology. 2014;82(16):1392-1394. (PubMed)
71. Stockler S, Plecko B, Gospe SM, Jr., et al. Pyridoxine dependent epilepsy and antiquitin deficiency: clinical and molecular characteristics and recommendations for diagnosis, treatment and follow-up. Mol Genet Metab. 2011;104(1-2):48-60. (PubMed)
72. Picker JD, Levy HL. Homocystinuria caused by cystathionine β-synthase deficiency. In: Pagon RA, Adam MP, Ardinger HH, et al., eds. GeneReviews®. Seattle, Washington: University of Washington, Seattle 1993-2014. (PubMed)
73. Maltepe C, Koren G. The management of nausea and vomiting of pregnancy and hyperemesis gravidarum--a 2013 update. J Popul Ther Clin Pharmacol. 2013;20(2):e184-192. (PubMed)
74. Magee LA, Mazzotta P, Koren G. Evidence-based view of safety and effectiveness of pharmacologic therapy for nausea and vomiting of pregnancy (NVP). Am J Obstet Gynecol. 2002;186(5 Suppl Understanding):S256-261. (PubMed)
75. Sahakian V, Rouse D, Sipes S, Rose N, Niebyl J. Vitamin B6 is effective therapy for nausea and vomiting of pregnancy: a randomized, double-blind placebo-controlled study. Obstet Gynecol. 1991;78(1):33-36. (PubMed)
76. Vutyavanich T, Wongtra-ngan S, Ruangsri R. Pyridoxine for nausea and vomiting of pregnancy: a randomized, double-blind, placebo-controlled trial. Am J Obstet Gynecol. 1995;173(3 Pt 1):881-884. (PubMed)
77. Matthews A, Haas DM, O'Mathuna DP, Dowswell T, Doyle M. Interventions for nausea and vomiting in early pregnancy. Cochrane Database Syst Rev. 2014;3:CD007575. (PubMed)
78. Koren G, Clark S, Hankins GD, et al. Effectiveness of delayed-release doxylamine and pyridoxine for nausea and vomiting of pregnancy: a randomized placebo controlled trial. Am J Obstet Gynecol. 2010;203(6):571 e571-577. (PubMed)
79. Wyatt KM, Dimmock PW, Jones PW, Shaughn O'Brien PM. Efficacy of vitamin B-6 in the treatment of premenstrual syndrome: systematic review. BMJ. 1999;318(7195):1375-1381. (PubMed)
80. Whelan AM, Jurgens TM, Naylor H. Herbs, vitamins and minerals in the treatment of premenstrual syndrome: a systematic review. Can J Clin Pharmacol. 2009;16(3):e407-429. (PubMed)
81. Gariballa S, Forster S. Effects of dietary supplements on depressive symptoms in older patients: a randomised double-blind placebo-controlled trial. Clin Nutr. 2007;26(5):545-551. (PubMed)
82. Gariballa S. Testing homocysteine-induced neurotransmitter deficiency, and depression of mood hypothesis in clinical practice. Age Ageing. 2011;40(6):702-705. (PubMed)
83. Ellis J, Folkers K, Watanabe T, et al. Clinical results of a cross-over treatment with pyridoxine and placebo of the carpal tunnel syndrome. Am J Clin Nutr. 1979;32(10):2040-2046. (PubMed)
84. Ellis JM, Kishi T, Azuma J, Folkers K. Vitamin B6 deficiency in patients with a clinical syndrome including the carpal tunnel defect. Biochemical and clinical response to therapy with pyridoxine. Res Commun Chem Pathol Pharmacol. 1976;13(4):743-757. (PubMed)
85. Keniston RC, Nathan PA, Leklem JE, Lockwood RS. Vitamin B6, vitamin C, and carpal tunnel syndrome. A cross-sectional study of 441 adults. J Occup Environ Med. 1997;39(10):949-959. (PubMed)
86. Aufiero E, Stitik TP, Foye PM, Chen B. Pyridoxine hydrochloride treatment of carpal tunnel syndrome: a review. Nutr Rev. 2004;62(3):96-104. (PubMed)
87. Ryan-Harshman M, Aldoori W. Carpal tunnel syndrome and vitamin B6. Can Fam Physician. 2007;53(7):1161-1162. (PubMed)
88. Morris MS, Picciano MF, Jacques PF, Selhub J. Plasma pyridoxal 5'-phosphate in the US population: the National Health and Nutrition Examination Survey, 2003-2004. Am J Clin Nutr. 2008;87(5):1446-1454. (PubMed)
89. Hendler SS, Rorvik DR, eds. PDR for Nutritional Supplements. Montvale: Medical Economics Company, Inc; 2001.
90. Bender DA. Non-nutritional uses of vitamin B6. Br J Nutr. 1999;81(1):7-20 (PubMed)
91. Chang HY, Tang FY, Chen DY, et al. Clinical use of cyclooxygenase inhibitors impairs vitamin B-6 metabolism. Am J Clin Nutr. 2013;98(6):1440-1449. (PubMed)
92. Lussana F, Zighetti ML, Bucciarelli P, Cugno M, Cattaneo M. Blood levels of homocysteine, folate, vitamin B6 and B12 in women using oral contraceptives compared to non-users. Thromb Res. 2003;112(1-2):37-41. (PubMed)
93. Wilson SM, Bivins BN, Russell KA, Bailey LB. Oral contraceptive use: impact on folate, vitamin B(6), and vitamin B(1)(2) status. Nutr Rev. 2011;69(10):572-583. (PubMed)
94. Villegas-Salas E, Ponce de Leon R, Juarez-Perez MA, Grubb GS. Effect of vitamin B6 on the side effects of a low-dose combined oral contraceptive. Contraception. 1997;55(4):245-248. (PubMed)
95. Ribaya-Mercado JD, Russell RM, Sahyoun N, Morrow FD, Gershoff SN. Vitamin B-6 requirements of elderly men and women. J Nutr. 1991;121(7):1062-1074. (PubMed)
ビタミンK
目次
要旨
- 天然起源形態のビタミンKは、フィロキノン(ビタミンK1)およびメナキノン(MKまたはビタミンK2)と呼ばれる分子ファミリーを含む。(詳細はこちら)
- ビタミンKの貯蔵能力が限られているので、ビタミンKを何回も再使用できるように体はビタミンK酸化還元サイクルでビタミンKを再利用する。 (詳細はこちら)
- ビタミンKは、多くのビタミンK依存性タンパク質(VKDP)のグルタミン酸残基のカルボキシル化に必須の補助因子であり、VKDPは血液凝固、骨代謝、血管の石灰化予防、および様々な細胞機能の調整に関わる。(詳細はこちら)
- ビタミンK欠乏症だと、出血過多(大量出血)のリスクが上がる。命に関わる頭蓋骨内の出血から全ての新生児を守るため、ビタミンK注射が推奨される。(詳細はこちら)
- ビタミンKの目安量(AI)は、女性で90μg/日、男性で120μg/日に設定されている。(詳細はこちら)
- ビタミンK欠乏症は、VKDPの活動を損なって骨粗鬆症や骨折のリスクを増大させるかもしれない。しかし、観察研究ではビタミンK摂取を全般的な健康食から切り出すことができなかった。したがってビタミンK摂取と骨の健康マーカーとの正の相関の解釈には注意が必要である。全体として、カルシウムやビタミンDが足りている成人のさらなる骨量減少の縮小に対するビタミンK補給の役割に関して、介入試験では結論が出ていない。(詳細はこちら)
- 血管の異常な石灰化は加齢とともに増え、心血管疾患の主要なリスク要因である。ビタミンKの量が不適切だと、血管内でカルシウム沈殿物の生成を抑制するいくつかのVKDPを不活性化してしまうかもしれない。血管の石灰化および心血管イベントの予防におけるビタミンK補給の効果については、無作為化対照試験で尚も評価する必要がある。(詳細はこちら)
- フィロキノンは緑色葉物野菜や特定の植物油に高濃度で存在するが、ほとんどのメナキノンはたいてい動物の肝臓や発酵食品に見られる。(詳細はこちら)
- ビタミンK拮抗薬(ワルファリンなど)を含むいくつかの薬剤は、ビタミンKの吸収と代謝に支障をきたすことが知られている。(詳細はこちら)
ビタミンKは脂溶性ビタミンである。血餅の生成過程における役割からもともと同定されたように(「K」はドイツ語で凝固を意味する「koagulation」に由来する)、ビタミンKは血液凝固(凝血)の調整などをする生理学的プロセスに関わるいくつかのタンパク質の機能に不可欠である(1)。天然起源のビタミンKには、ビタミンK1およびビタミンK2として知られるいくつかのビタマー(ビタミン誘導体)がある(図1参照)。ビタミンK1別名フィロキノンは植物によって合成され、食事に含まれるものの主な形態である。ビタミンK2はメナキノンと総称される範疇のビタミンKの形態を含む。ほとんどのメナキノンはヒトの腸内細菌叢で合成され、発酵食品や動物性食品に見られる。メナキノンは、分子の側鎖における5炭素単位の繰り返しの長さが1~14まで異なる。これらの形態のビタミンKは、メナキノン-n(MK-n)と示され、nは5炭素単位の数を表す(MK-2からMK-14まで)(2, 3)。畜産で広く使用されメナジオン(ビタミンK3)として知られる合成化合物はビタミン前駆体で、活性を持つためにはメナキノン-4(MK-4)に変換されねばならない(4)。
機能
ビタミンKはγ-グルタミルカルボキシラーゼ(GGCX)という酵素の補助因子として機能し、この酵素はアミノ酸であるグルタミン酸(Glu)をγ-カルボキシグルタミン酸(Gla)にカルボキシル化する反応の触媒作用をする。同定されたビタミンK依存性タンパク質(VKDP)中の特定のグルタミン酸残基においてのみ発生するビタミンK依存性γカルボキシル化によって、残基がカルシウムと結合する能力が決定的になる(5)。
ビタミンK酸化還元サイクル
ビタミンKは脂溶性ビタミンであるが、体には非常に少量しか貯蔵されておらず、定期的な食事からの摂取がないと急速に枯渇してしまう。おそらくビタミンKを蓄える能力がこのように限られていることから、体はビタミンKエポキシドサイクルと呼ばれるプロセスによってビタミンKを再利用している(図2参照)。ビタミンKサイクルによって、少量のビタミンKがタンパク質のカルボキシル化に何回も再利用できることになり、それによって食事からの必要量が減る。手短に言えば、ビタミンKヒドロキノン(還元された形態)がビタミンKエポキシド(酸化された形態)に酸化される。この反応で、γグルタミルカルボキシラーゼはビタミンK依存性タンパク質における選択的なグルタミン酸残基をカルボキシル化することができる。ビタミンKエポキシド(酸化型)からヒドロキノン(還元型)への再利用は、ビタミンKエポキシド(KO)をビタミンKキノンに還元し、その後ビタミンKヒドロキノン(KH2:図2参照)に還元するという2つの反応で行われる。また、ビタミンKオキシドレダクターゼ(VKOR)という酵素は、KOからビタミンKキノンへの還元を触媒する。VKORは、未だに定義されていない別の還元酵素とともに、ビタミンKキノンからKH2を生成することにも関わっているかもしれない(6, 7)。抗凝固薬のワルファリンはVKORの活動を阻害することでビタミンK拮抗薬として作用し、ビタミンKの再利用を妨げる(「血液凝固」の項参照)。
血液凝固 (凝血)
凝固カスケードにおけるいくつかのビタミンK依存性凝固因子、つまりタンパク質の活性化には、カルシウムイオン(Ca2+)と結合する能力が必要である。凝固カスケードという用語は、血餅を生成することで出血を止める一連の事象のことであり、各事象はたがいに依存しあっている。それらのタンパク質中の特定のグルタミン酸残基のビタミンK依存性γカルボキシル化によって、それらはカルシウムと結合可能になる。第II因子(プロトロンビン)、第VII因子、第IX因子、および第X因子が凝固カスケードの中心となる。プロテインZは、細胞膜のリン脂質との会合を促進することでトロンビン(プロトロンビンの活性化された形態)の作用を強化するようである。プロテインCとプロテインSは抗凝固タンパク質で、凝固カスケードを制御均衡する。プロテインZも抗凝固機能を持つ。無制御な凝血は無制御な出血と同様に命に関わるかもしれないので、凝固カスケードの制御メカニズムが存在する。ビタミンK依存性凝固因子は肝臓で合成される。したがって、重篤な肝臓疾患だとビタミンK依存性凝固因子の血中濃度が低くなり、無制御な出血のリスク上昇に至る(8)。
ビタミンK拮抗薬による経口抗凝固治療
血餅生成のリスクが高い者もおり、これは心臓、脳、または肺の動脈の血流をブロックし、それぞれ心筋梗塞(心臓発作)、脳卒中、または肺塞栓症に至ることがある。異常な血液凝固は過剰なビタミンK摂取と関係がなく、ビタミンK1またはK2に関連する毒性も知られていない(「毒性」の項参照)。ワルファリン(クマジン、Jantoven)などの経口抗凝固薬は、ビタミンKの作用に拮抗することで凝血を阻害する。ワルファリンはVKORの活動を阻止することでビタミンKの再利用を妨げるので、その結果として機能性ビタミンK欠乏症を起こす(上記の図2参照)。ビタミンK依存性凝固タンパク質の不適切なγカルボキシル化は凝固カスケードに支障をきたし、これが血餅の生成を妨げる。大量の食事性または補給用のビタミンK摂取でビタミンK拮抗薬の抗凝固効果を弱らせるので、これらの薬剤を服用している患者は非常に大量または変量のビタミンK摂取に対して注意をすべきである(「薬物相互作用」の項参照)。ワルファリンのようなビタミンK拮抗薬を服用している患者に対して、今や専門家は現在の食事からの推奨量(90~120μg/日)を満たす適度な一定の食事性ビタミンK摂取を勧めている(9)。最後に、患者によってビタミンK拮抗薬への反応が大きく変化するので、毎日低用量フィロキノンを補給することで抗凝固治療が安定するかもしれないと提唱されている。しかしいくつかのメタ解析で、ワルファリンを服用している者に対するこの選択を支持する十分なエビデンスがないことが最近強調された(10~12)。
骨格形成と軟組織の石灰化予防
ビタミンK依存性γカルボキシル化は、オステオカルシン(OC)、抗凝固因子プロテインS、マトリックスγ-カルボキシグルタミン酸(Gla)タンパク質(MGP:マトリックスGlaタンパク質)、Glaリッチタンパク質(GRP)、およびペリオスチン(元々はosteoblast-specific factor-2:骨芽細胞特異因子2と呼ばれた)などのいくつかの骨に関係するタンパク質に必須である。オステオカルシン(bone Gla protein:骨Glaタンパク質としても知られる)は骨芽細胞(骨を造る細胞)によって合成され、オステオカルシンの合成はビタミンDの活性化形態である1,25-ジヒドロキシビタミンD(カルシトリオール)によって調整されている。オステオカルシンがカルシウムと結合するためには、3つのグルタミン酸残基のビタミンK依存性γカルボキシル化反応が必要である。骨石灰化における機能は十分にわかっていないが、オステオカルシンはカルシウムヒドロキシアパタイト結晶の成長と成熟に必要である(「骨粗鬆症」の項参照)(13)。
プロテインSは、破骨細胞が介する骨の分解に関わっているようである。遺伝性のプロテインS欠乏症の者は、血液凝固が高じることに関連する合併症と、骨壊死を患う(14, 15)。プロテインSは、食作用に関わるTAMファミリーの受容体と結合し活性化させることができる。TAM受容体の突然変異は、視力障害、精子形成の欠陥、自己免疫異常、および血小板異常を起こすことがある(16)。
MGPは軟骨、骨、および血管壁を含む軟組織に見られ、血管壁では血管平滑筋細胞によってMGPが合成され分泌される。MGPは軟骨、血管壁、皮膚の弾性繊維、またはヒトの目の線維柱帯網などの様々な部位の石灰化予防に関わっている(「血管石灰化」の項参照)(17)。さらに、MGPを含むいくつかのVKDPは、弾性線維性仮性黄色腫およびβサラセミアなどの特定の遺伝性疾患における動脈、皮膚、腎臓、および目の石灰化に関連がある(18, 19)。
ビタミンK依存性タンパク質であるGRPとペリオスチンも骨の組織で合成されるが、骨の代謝におけるそれらの役割は未だにはっきりしない(20, 21)。GRPは正常なヒトの皮膚や血管組織で発現し、石灰化した動脈や石灰化した皮膚の病巣における細胞外基質の異常なミネラル沈着物と共存している(22)。
ペリオスチンは皮膚や骨を含むほとんどの結合組織で発現し、初めは細胞接着や細胞移動と関連付けられた。このVKDPも、心臓弁の変質や腫瘍成長の際の血管新生(新しい血管の生成)を促進するようである(23, 24)。
GGCXの活性低下および/またはビタミンKの生物学的利用能の低下がVKDPの活動を損ない、骨石灰化の欠陥や異常な軟組織の石灰化に寄与するかもしれないことが、現在の研究から示唆される(「疾病予防」の項参照)(25)。
細胞機能の調整
Gas6(growth arrest-specific gene 6 protein:増殖停止特異的タンパク質6)は1993年に同定されたビタミンK依存性タンパク質である。これは神経系にくまなく見られ、心臓、肺、胃、腎臓、および軟骨にも見られる。膜貫通型チロシンキナーゼ受容体のTAMファミリーのリガンドとして同定されたGas6は、細胞シグナル伝達活動をする細胞増殖調整因子のようである。Gas6は多様な細胞機能に関わっており、それらには食作用、細胞接着、細胞増殖、および細胞死予防などがある(5)。それは発育中および老化中の神経系でも重要な役割を果たしているかもしれない((26)の文献でレビュー)。さらに、Gas6は血小板のシグナル伝達と血管の恒常性も調整しているようである(27)。ほとんどの組織で発現し多くの細胞機能に関わっているGas6は、血餅形成(血栓形成)、アテローム性動脈硬化、慢性炎症、およびがんの増殖を含むいくつかの病態と関連がある(28~30)。
欠乏症
明白なビタミンK欠乏症は血液凝固が損なわれることになり、たいていは凝固時間を測る臨床検査で実証される。症状としては簡単に青あざや出血が起こりやすくなり、これは鼻血、歯茎の出血、血尿、血便、タール便、または極端にひどい月経として現れるかもしれない。乳児では、ビタミンK欠乏症は命に関わる頭蓋骨内部の出血(頭蓋内出血)を起こすかもしれない(8)。
成人
ビタミンK欠乏症は、健康な成人ではいくつかの理由によって珍しい。それらは(1)ビタミンKは食物に広く含まれている(「食物の摂取源」の項参照);(2)ビタミンKサイクルによってビタミンKが保たれる(「ビタミンK酸化還元サイクル」の項参照);および(3)相当な量が吸収されたり利用されたりするのかは不明であるが、通常は大腸に存在する細菌がメナキノン(ビタミンK2)を合成する(「食物の摂取源」の項参照)からである。ビタミンK欠乏症のリスクのある成人は、ビタミンK拮抗薬を服用している者や、相当な肝臓障害や疾患のある者である(8)。さらに、炎症性腸疾患や嚢胞性繊維症などを含む脂肪吸収不全障害のある個人は、ビタミンK欠乏症のリスクが高いかもしれない(31~33)。
乳児
母乳のみで育つ新生児は、ビタミンK欠乏症リスクが高い。なぜなら母乳は粉ミルクに比べて比較的ビタミンKが少ないからである。一般的に新生児は次のような理由でビタミンKの栄養状態が悪い。それらは(1)胎盤関門を通るビタミンKの輸送が限られている;(2)肝臓のビタミンK貯蔵がとても少ない;(3)新生児、特に未熟児ではビタミンKサイクルが十分に機能していないかもしれない;および(4)母乳のビタミンK含有量が少ない(5)ということである。母親がてんかん発作予防に抗けいれん薬を服用している乳幼児も、ビタミンK欠乏症リスクがある。新生児のビタミンK欠乏症は、新生児乳児のビタミンK欠乏性出血症(VKDB)とよばれる出血障害に至ることがある((34)の文献でレビュー)。VKDBは命に関わるが簡単に予防できるため、米国小児科学会や多くの同様の国際機関は、全ての新生児に筋肉内注射用量のフィロキノン(ビタミンK1)を投与することを勧めている(35)。
新生児へのビタミンK投与をめぐる論争
ビタミンKと小児白血病:1990年代初期に2つの後ろ向き研究で、新生児へのフィロキノン注射と小児白血病およびその他の小児がんの発症に関連があるのではないかという提唱が発表された。しかし米国およびスウェーデンでの2つの大規模後ろ向き研究で、それぞれ54,000人および130万人の子供の医療記録を調べ直したところ、小児がんと誕生時のフィロキノン注射との関係を示すエビデンスは何もなかったと判明した(36, 37)。さらに、小児がんと診断された2,431人の子供と6,338人のがんでない子供を含む6つの症例対照研究の統合解析で、新生児へのフィロキノン注射が小児白血病のリスクを上げるというエビデンスは見つからなかった(38)。米国小児学会はその方針声明で、ビタミンKによる新生児への通例的な予防を続けるように推奨した。VKDBは命にかかわり、がんのリスクが証明されていないうえにおそらくないからである(35)。親側による新生児へのビタミンK予防の省略や拒否が増加傾向にあることから、過去数年において医師は遅発性のVKDB症例の増加を報告している(39)。
未熟児への低用量ビタミンK1:未熟児のビタミンK濃度に関する2つの研究結果から、正期産児への標準的フィロキノン(ビタミンK1)初回量(1.0mg)は、未熟児には高すぎるかもしれないことが示唆された(40, 41)。これらの発見から、1,000g未満の出生体重の乳児にはフィロキノン初回量を0.3mg/kgにし、0.5mgというフィロキノン初回量が新生児の出血性疾患を予防するであろうと提唱する専門家もいる(40)。
目安量 (AI)
2001年1月に米国医学研究所の食品栄養委員会(FNB)は、健康な個人の摂取レベルに基づくビタミンKの目安量レベルを設定した(表1)。乳児のAIは、母乳からのビタミンK摂取の推定に基づいていた(42)。
疾病予防
骨粗鬆症
骨にあるビタミンK依存性タンパク質の発見が、骨の健康を維持する際のビタミンKの役割に関する研究につながった。
ビタミンKと骨の健康:観察研究
ビタミンK1:フィロキノン(ビタミンK1)と加齢による骨量減少(骨粗鬆症)との関係が、観察研究でわかった。看護師健康研究では、72,000人超の女性を10年間追跡した。このコホート(集団)の解析で、フィロキノンの摂取が109μg/日より少ない女性は、それ以上の摂取の女性に比べて30%も股関節骨折のリスクが高かった(43)。7年間800人超の年配の男女を追跡したフラミンガム心臓研究という別の前向き研究で、食事性ビタミンK 摂取が最も高い四分位(中央値で254μg/日)の参加者は、摂取が最も低い(中央値で56μg/日)者より股関節骨折リスクが65%低かった(44)。骨粗鬆症的な骨折はしばしば骨石灰化の減退と関連している。しかし研究者たちは、フラミンガム研究の被験者における食事性フィロキノン摂取と骨密度(BMD)との間に何の関連も見出さなかった(44)。他の研究で食事性フィロキノン摂取と骨強度、BMD、または骨折の発生との関連を観察できないでいた(45, 46)が、3,199人の中年女性コホートのクロスオーバー研究(横断研究:交差研究)で、食事性フィロキノン摂取が最も高い四分位の被験者(162μg/日)は、最も低い四分位の者(59μg/日)よりも股関節部および腰椎部のBMDがかなり高いことがわかった(47)。さらに、最近のクロスオーバー研究や症例対照研究で、フィロキノン摂取が多い方が股関節骨折の発生が少ないという関連が報告された(48, 49)。
しかしながら、緑色葉物野菜がフィロキノンの主要な食事性摂取源であり、それらは通常バランスのとれた食事の一部であることから、フィロキノンの高摂取は単に健康な食習慣の現れであり、フィロキノン自体ではなくこのことが観察研究で報告された関連の全部または一部を説明しているのかもしれない(50)。血漿フィロキノン濃度を測定した数少ない研究では、一般的に循環濃度がより高いと骨折リスクがより低いという関連が見られた(17, 51)。たとえば、30~88歳の379人の日本人女性による4年間の前向き研究で、椎体骨折の発生は腰部BMDや血漿フィロキノン濃度と逆相関があった(51)。しかし観察研究は因果関係の推論をするように考えられておらず、無作為化対照試験でのみフィロキノンが骨の健康に有益なのかどうかを評価することができる(「ビタミンK補給研究と骨粗鬆症」の項参照)。
ビタミンK2:メナキノン(ビタミンK2)と骨の健康との関連についての研究はほとんどない。それはおそらく西洋式の食事に含まれるビタミンK2の主な形態であるメナキノン-4(MK-4)の食事性摂取源が限られているからである。加熱した大豆を納豆菌で発酵させた日本の食品である納豆は、MK-7が豊富である。944人の日本人女性(20~79歳)を追跡した前向き研究で、ベースライン時(開始時)の全体的な股関節BMDは、閉経後の女性で納豆の摂取量と正の相関があった(52)。納豆を食べる女性(200μg/日超のMK-7)は食べない女性に比べて、大腿骨頚部のBMD減少率が3年間の追跡期間でかなり低かった。閉経前の女性では、納豆摂取量とBMDの関連は見られなかった(52)。
全体的な股関節および大腿骨頚部のBMDも、2,000人近い65歳以上の日本人男性のうち、定期的に1日に少なくとも1パックの納豆(350μg/日以上のMK-7)を食べる者の方が、週に1パック未満(50μg/日未満のMK-7)しか食べない者に比べて高かったと報告された(53)。しかし納豆の消費を増やすと、骨格の健康に潜在的有益性のあるその他の食事性化合物(大豆イソフラボンなど)の摂取も最大化される。したがって、ビタミンKの栄養状態の信頼できる測定値が必要である。今の所、観察研究は循環メナキノン(MK-7およびMK-4)濃度と骨折リスクとの関連を明確に裏付けていない(17, 54)。
ビタミンKの栄養状態のバイオマーカーと骨の健康
骨のタンパク質であるオステオカルシンの総循環濃度は、骨生成の鋭敏なマーカーであることが示されてきた。ビタミンKではなくビタミンDなどのいくつかのホルモンや成長因子が、骨芽細胞によるオステオカルシンの合成を調整する。しかしビタミンKは、オステオカルシンに含まれる3つのグルタミン酸残基のγ-カルボキシル化に不可欠な補助因子である。ヒトの骨や血清でのオステオカルシンの低カルボキシル化は、ビタミンKの栄養状態が悪いことと関連づけられてきた。オステオカルシンのγ-カルボキシル化の程度はビタミンKの栄養介入療法に反応するので、ビタミンKの栄養状態の相対的指標として使用される(13)。
低カルボキシル化オステオカルシン(ucOC)の循環濃度は閉経後の女性の方が閉経前の女性より高く、70歳超の女性では顕著に高いことがわかった。また、総OC濃度に対するucOCの割合(ucOC/OC)が高いことは、年配の女性の股関節骨折リスクの予測となるようである(55, 56)。ビタミンK欠乏症が血中ucOC/OC比率が高いことの一番の原因であるようだが、ビタミンDの栄養状態の生化学的測定値とucOC濃度の間の逆相関と、ビタミンD補給によるucOC/OC比率の相当な低下を述べている研究者もいる(57)。循環ucOC/OC比率の上昇は、ビタミンDの不足を含む全体的な栄養状態の悪さを反映していると提唱されており、これが上記の観察を説明するのかもしれない(58)。しかし若い女性(58, 59)や閉経後の女性(60)に対するいくつかの無作為化プラセボ対照介入研究で、ビタミンD補給がucOC/OC比率を低下させたり、ビタミンK補給によるucOC/OC比率の低下に追加的な効果を示したりすることはなかった。
ビタミンK補給研究と骨粗鬆症
ビタミンK1補給:12~36ヶ月にわたる200~5,000μg/日の用量でのフィロキノン(ビタミンK1)補給が股関節部のBMDに与える効果を評価する5つの無作為化臨床試験のシステマティックレビュー(総括)で、骨の健康に対する有望な利点はほとんど見られなかった(17)。5つの研究すべてでフィロキノン補給によってucOC濃度は低下したが、1つの研究でのみBMDに対するフィロキノン補給の効果が報告されただけだった(61)。この研究では、150人の閉経後の女性にプラセボか、ミネラル(500mg/日のカルシウム、130mg/日のマグネシウム、および10mg/日の亜鉛)にビタミンD(320 IU/日)か、またはミネラル、ビタミンD、およびフィロキノン(1,000mg/日)かを無作為に与えた。腰椎ではなく大腿骨頚部におけるBMD減少の割合が、フィロキノン補給をした被験者では他の2群に比べてかなり低かった。したがって、年配の成人の骨の健康に対するフィロキノンの推定的な効果のエビデンスは弱いと考えられる。これらの研究は、骨粗鬆症に関連する骨折に対するフィロキノンの効果を評価するように考えられていなかった。フィロキノン補給がビタミンKが不足してリスクが高い被験者(吸収不全症候群や嚢胞性線維症の者など)の骨格の健康を向上させるのかどうかを、さらなる研究によって評価するようになるかもしれない。
ビタミンK2補給:薬理学的用量のメナキノン-4(MK-4、商標名はメナテトレノン)は、現在日本で骨粗鬆症の治療に使用されている。したがって、骨量減少に対する高用量MK-4の効果を調べるほとんどの介入試験が、日本の閉経後の女性に対して行われている。7つの無作為化対照試験の2006年のメタ解析で、MK-4補給はBMD増加や骨折発生の減少と相関付けられた(62)。7つの研究のうち1つ以外のすべてで、毎日45mgのMK-4が使用され、残りの1つでは15mg/日であった(62)。このメタ解析で、6ヶ月超のMK-4補給によって椎体骨折で60%、股関節骨折で77%、非椎体骨折で81%の大幅なリスク低下が報告された。しかし、含まれる研究の規模が小さいことと、その中のいくつかがプラセボ対照ではなく併用または非盲検療法(カルシウムとビタミンDなど)であったという事実から、このメタ解析結果は後に控えめに扱われた。さらにこの解析は、骨折リスクに対するMK-4の効果がないと報告していたことからこのメタ解析の結果を変えたであろうサンプル数のより多い未発表のデータを含んでいなかった(63)。
より最近の非プラセボ対照研究で、4,000人超の閉経後の日本人女性が3年間カルシウムを単独でまたはMK-4(45mg/日)と併用して無作為化されて摂取した。追加的なもう1年間の追跡期間(全体で4年間)の終わりには、椎体骨折の発生に関してグループごとの差はなく、カルシウム単独治療に比べて併用治療を受けた者に新規の臨床的な骨折の発生がわずかに減った(4.4%対3.4%)が、これも骨折リスクが高い女性のみにおいてであった(64)。欧州および米国で行われた追加的試験では、曖昧な結果が報告されている。325人の健康な閉経後の女性による3年間のプラセボ対照介入試験では、3年間のMK-4補給(45mg/日)によってプラセボに比べて骨強度の測定値が向上した(65)。留意したいのは、引用された研究のほとんどで使用されたこのMK-4用量は、ビタミンKの目安量の約500倍であるということだ。365人の健康だがビタミンKの状態が不適切な(低カルボキシル化オステオカルシンが4%以上)閉経後のアメリカ人女性による別の1年間の無作為化二重盲検プラセボ対照試験では、高用量のフィロキノン(1,000μg/日)補給もMK-4(45mg/日)補給も、プラセボに比べて骨代謝回転またはBMD(腰椎および股関節)の血清マーカーに対する効果はなかった(65)。この研究では、すべての被験者は毎日非盲検でカルシウム(630mg)とビタミンD3(400 IU)も摂取した。
いくつかの観察研究で納豆(MK-7が豊富)の摂取と骨の健康との関連が示唆されている。しかし334人の健康な閉経後の女性(閉経後1~5年)による最近の無作為化二重盲検プラセボ対照研究では、360μg/日のMK-7(納豆カプセルの形態)はベースライン時に比べて1年後の様々な部位におけるBMDに何の効果も見られなかった(67)。244人の閉経期の女性による別の比較可能なプラセボ対照試験では、180μg/日のMK-7を3年間補給したら、大腿骨頚部における骨量減少がかなり少なくなったが、その他の部位ではそうではなかった(68)。現在のところ、骨の健康に対するメナキノン補給の潜在的役割は、大規模無作為化のよく対照された試験で確立される必要がある。
ビタミンK拮抗薬と骨の健康
ワルファリンなどの特定の経口抗凝固薬は、ビタミンK拮抗薬であることが知られている(「血液凝固」の項参照)。年配の女性の慢性的ワルファリン使用と骨折リスクとの関連を調べた研究はほとんどない。ある研究では長期間のワルファリンによる治療と骨折リスクの関連は何もないと報告された(69)が、別の研究ではワルファリン使用者は非使用者に比べて肋骨および椎体骨折のリスクがかなり高いことがわかった(70)。さらに、心房細動のある年配の患者によるある研究では、長期間のワルファリンによる治療は男性の骨粗鬆症的骨折リスクがかなり高くなることと関連があったが、女性ではそうではなかったと報告された(71)。11の発表済み研究結果をメタ解析したところ、経口抗凝固治療は手首のBMDのささやかな低下と関連があったが、股関節や脊椎のBMDは変化しなかったことがわかった(72)。ビタミンKの再利用を阻止しない新しい抗凝固薬の開発によって、ビタミンK拮抗薬の使用に替わる安心な代替物が提供されるかもしれない(73)。
心血管疾患
ビタミンK摂取と死亡率との逆相関は、3,401人が参加した米国の全国的調査(NHANES III)で報告された(74)。ビタミンK摂取が適切な者は不適切な者(性別ごとのAIに基づく:女性で90μg/日、男性で120μg/日)よりも、心血管疾患関連の死亡リスクが22%、全死因による死亡リスクが15%低いという関連があった。報告ではまた、慢性腎臓疾患の者の3分の2超はAIよりもビタミンK摂取が少ないのだが、適切な摂取の者はそれ以下の者に比べてCVDによる死亡率が41%低かったことが示された(74)。しかし、CVD発症リスクのある7,216人の年配の成人を追跡した前向き研究で、ビタミンK摂取が多い方がCVDによる死亡率が低いという関連はなかった(75)。この研究では、メナキノンではなくフィロキノンの摂取が多い方が、全死因による死亡率が低いという関連があった。
35,476人の健康なオランダ人男女を平均で12.1年間追跡した最近の別の前向き研究で、脳卒中発症のリスクはフィロキノンやメナキノン摂取とさして関連がなかった(76)。初期の観察研究はフィロキノン摂取とCVDリスクとの逆相関を限定的に裏付けていたが、高摂取は低い心血管リスクに関連する健康な食事習慣の指標と時には見なされていた((77)の文献でレビュー)。16,057人のオランダ人女性(49~70歳)を平均8.1年間追跡した前向きコホート研究で、メナキノン摂取が10μg/日増えるごとに冠動脈心疾患(CHD)リスクが9%減ることがわかった(78)。55歳以上の健康な4,807人の男女を調べたオランダでの初期の別の研究で、メナキノン摂取が最も高い三分位(32.7μg超/日)の参加者は、最も低い三分位(21.6μg未満/日)の者よりもCHD発症リスクが41%、全死因による死亡リスクが26%低かった(79)。さらに、メナキノン摂取はCVDの主要なリスク要因である大動脈石灰化と逆相関があることがわかった(79)。
血管石灰化
心血管疾患の顕著な特徴の一つは、動脈壁の動脈硬化巣の存在である。血餅の生成(血栓形成)を起こすプラーク破裂は、心筋梗塞(心臓発作)または脳卒中の通常の原因である。プラークの石灰化はアテローム性動脈硬化症の進行で起こるが、石灰化がプラークの不安定性さを高めて破裂や血栓形成になるリスクを予測するのかどうかは不明である(80)。しかし、石灰化は将来の心血管疾患性イベントの予測的なものであるかもしれない。全部で218,080人の参加者による30の前向きコホート研究のメタ解析で、血管石灰化が見られると、全体的に3~4倍の心血管イベントや死亡率の上昇リスクがあることがわかった(81)。閉経後の女性(60~79歳)による初期の集団ベースの研究で、大動脈石灰化のある年齢が低い方の女性(60~69歳)は石灰化がない女性に比べてビタミンK摂取が少なかったが、年齢が高いほうの女性(70~79歳)ではそうではなかったことが観察された(82)。39~45歳の男女807人による前向きコホート研究で、食事からのフィロキノン摂取とコンピュータ断層撮影(CT)によって非侵襲的に測定された冠状動脈の石灰化との間には、何の相関もないことがわかった(83)。さらに、49~70歳の1,689人の女性のクロスオーバー研究で、フィロキノンまたはメナキノン摂取は胸部の動脈の石灰化と関連がなかった(84)。しかし別のクロスオーバー研究で、メナキノン(MK-4~MK-10)の摂取が最高の四分位(摂取の中央値が48.5μg/日)と最低の四分位(18μg/日)では、564人の閉経後の女性の冠状動脈石灰化罹患率が20%低いという関連が見つかった(85)。
最近の研究で、ビタミンKが骨の石灰化を促進する一方で血管の石灰化を妨げるかもしれないメカニズムの可能性が明らかになった。その可能性のあるメカニズムはまだ十分に理解されていないが、マトリックスGlaタンパク質(MGP)と新規に記述されたGlaリッチタンパク質(GRP)とを含むビタミンK依存性タンパク質に関係している。動脈血管壁にある血管平滑筋細胞(VSMC)などの様々なタイプの細胞から分泌されるMGPは、軟骨、脈管、皮膚、および目の線維柱帯網細胞などの軟組織の石灰化予防に重要なようである(17, 86)。MGPノックアウトマウスでは、VSMCから骨状の細胞への転換や過剰な血管の石灰化によって、大血管破裂や早期死亡へと至った。ヒトのMGP遺伝子の欠陥は、異常な軟骨の石灰化や肺動脈の狭窄がとりわけ特徴的な稀な遺伝性病態であるコイテル症候群と関連付けられてきた。MGPによる石灰化予防には、カルシウム結晶との結合や異所性化骨の生成を促進することが知られているタンパク質(骨形成タンパク質、BMP)の阻害などのいくつかのメカニズムが関わっていた((87)の文献でレビュー)。
MGPのカルシウムとの結合活性は、2種類の修飾(タンパク質合成の後に起こるので翻訳後修飾として知られる)によって調整されている。それらは最大5つのGlu残基のビタミンK依存性カルボキシル化と、セリン残基のリン酸化である。タンパク質の5つのGlaドメインの1つにおけるトレオニンからアラニンへの変移を起こすMGPの遺伝子配列の変異(多型)は、カルボキシル化を妨げてMGPがカルシウムと結合する能力に変化を引き起こすのかもしれない。MGPThr83Alaとして知られるこの多型は、605人の中年男女を追跡した地域ベースの前向き研究において、平均で10.6年にわたる冠状動脈の石灰化の進行に関連があった(88)。この関連はベースライン時に検出可能な石灰化が見られなかった参加者にのみ見られ、ベースライン時に石灰化していた者では見られなかった(88)。興味深いことに、MGPThr83Alaはその遺伝子型保因者の心筋梗塞および大腿動脈石灰化のリスクが高いことと関連していた(89)。
さらに、低カルボキシル化のMGP(ucMGP)は健康な被験者の頸動脈の最も内側を構成する膜にはないが、アテローム性動脈硬化症患者の頸動脈の内膜におけるほとんどのMGPは低カルボキシル化のものだったことが、ある小規模な研究で最初にわかった(90)。577人の年配の男女を平均で5.6年間追跡した別の研究で循環MGPと心血管性イベントの発症の関連を調べたら、脱リン酸化-低カルボキシル化MGP(dp-ucMGP)の血漿濃度が最高の三分位は最低の三分位に比べて、心血管疾患(すなわち冠状動脈疾患、末梢動脈疾患、および脳血管疾患)のリスクが3~4倍も大きかった(91)。別の前向き研究の結果では、循環dp-ucMGP濃度は明白な血管疾患の被験者における死亡リスクの予測となるかもしれないことが示唆された(92)。実際、冠状動脈疾患または脳卒中の被験者でdp-ucMGP濃度が最大の四分位の者は、最低の四分位の者に比べて心血管関連および全死因の死亡リスクが2倍近いことがわかった(92)。
ビタミンKの栄養状態が最適以下だとカルボキシル化が制限され、その結果生物学的に不活性のucMGPになってしまうかもしれないため、ビタミンK補給が血管の石灰化を防ぐかもしれないと推測されてきた。3年間の二重盲検対照試験で、ベースライン時にCVDがない401人の地域社会生活を送る年配者(60~80歳)の冠状動脈石灰化の進行に対するビタミンKの潜在的効果が調べられた(93)。参加者は毎日マルチビタミンに加えてカルシウムとビタミンDを500mgのフィロキノン有りまたは無しで摂取するように無作為に分けられた。ベースライン時および追跡時の冠状動脈石灰化の測定値を使用して、フィロキノン補給は対照群に比べて血管石灰化の進行を限定し、血漿dp-ucMGPを減らすことができたとわかった(93, 94)。循環dp-ucMGPはビタミンKの栄養状態の様々なマーカーと相関があったが、冠状動脈石灰化の測定値との関連は見つからなかった(94)。
ヒトの動脈硬化巣の石灰化におけるその他のビタミンK依存性タンパク質(GRP、ペリオスチン、Gas6など)の役割を調べ、血管石灰化の進行とCVDリスクに対するビタミンK補給の効果を評価するさらなる研究が必要である。
ビタミンK拮抗薬と血管石灰化
いくつかのクロスオーバー研究で、ビタミンK拮抗薬の慢性的使用者は非使用者に比べて血管の石灰化スコア(血管石灰化を定量化する手段)が上がることが報告された((95)の文献でレビュー)。CVDの被験者で血管石灰化を調べた最近の前向き研究においても、ワルファリン療法は循環dp-ucMGP濃度がより高いことと関連づけられた(92)。VKDPの活動に支障をきたさないで凝固因子を直接阻害する新規開発薬剤は、特に血管石灰化に関してビタミンK拮抗薬よりも適切かもしれない(95)。
摂取源
食物の摂取源
欧州および米国での栄養調査で、食事性ビタミンK(全形態)の平均摂取量は、60~200μg/日と個人や集団で大きく異なることが示された(96)。
ビタミンK1
フィロキノン(ビタミンK1)は、ほとんどの食事におけるビタミンKの主要形態である。緑色葉物野菜やいくつかの植物油(大豆油、キャノーラ油、オリーブ油、および綿実油)は、食事性ビタミンKの主な摂取源である。しかし緑色野菜由来のフィロキノンの生物学的利用性は、油やサプリメントのものの利用性より低い。また、緑色野菜のフィロキノン含有量は葉緑素(緑色の色素)の含有量に依存するので、外側の葉の方が内側の葉よりもフィロキノンが多い。フィロキノンの腸での吸収効率は摂取源の植物によって異なり、食事に脂肪源を加えると増加する。最後に、植物油の水素添加は食事性フィロキノンの吸収や生物学的効果を低下させるかもしれない((2, 9)の文献でレビュー)。食品中のフィロキノンを含む栄養素含有量を調べたいならば、USDAの食品成分データベースを検索のこと。フィロキノンが豊富な食品のいくつかを、そのフィロキノン含有量をマイクログラム(μg)で示して表2に記載する。
ビタミンK2
メナキノン(ビタミンK2)は主として微生物起源であるので、チーズ、凝乳、および納豆(発酵させた大豆)などの発酵性食品に一般的に見られる。長鎖のメナキノン(MK-7~MK-13)のその他の摂取源は、動物の肝臓である(9)。メナキノンの食品成分表が入手しにくいので、ビタミンK摂取全体におけるその割合は推定しづらく、異なる食物摂取習慣の集団ごとに違っているであろう(2)。大腸(結腸)に通常住み着いている細菌は、メナキノンを合成できる。ヒトのビタミンK必要量の最大50%は、細菌による合成で賄われるのではないかと初めは考えられていた。しかしすべての形態のビタミンKが胆汁酸塩を必要とするメカニズムを介して小腸で吸収される一方で、大部分のメナキノン生成は胆汁酸塩がない結腸で行われている。現在の研究では、正確な割合は不明なままであるものの、細菌による合成の割合は以前考えられていたよりもずっと少ないことが示唆される(97)。メナキノンの中で、MK-4は動物用飼料に含まれるメナジオン(合成ビタミンKの形態)から作られるか、食事性フィロキノンから組織特異的な方法で変換される。したがって、それは細菌によって製造されない唯一のメナキノンである(4)。長鎖のメナキノンは、限られた発酵食品に含まれる。大豆を素にした日本の発酵食品である納豆はMK-7が豊富(998μg/100g)で、MK-8(84μg/100g)も含む。いくつかの種類のチーズには、MK-8およびMK-9が含まれる(2)。
サプリメント
米国では、一般的に一錠に25~100μgの用量のマルチビタミンおよびその他の栄養補助食品として、フィロキノンもメナキノンも処方箋無しで入手可能である(98)。メナキノン-4(MK-4)は日本では骨粗鬆症治療用に市販されているが、米国食品医薬品局(FDA)は現在、いかなる形態のビタミンKも骨粗鬆症予防または治療への使用を許可していない。
安全性
毒性
アレルギー反応の可能性はあるものの、ビタミンKのフィロキノン(ビタミンK1)またはメナキノン(ビタミンK2)形態での高用量(食事性または補給用)摂取に関連する毒性は知られていない(42)。合成メナジオン(ビタミンK3)とその誘導体はそうではない。メナジオンは体が持つ天然抗酸化剤の一つであるグルタチオンの機能を妨げる可能性があり、結果として細胞膜の酸化ダメージを起こす。注射によるメナジオンは、乳児に肝毒性、黄疸、および溶血性貧血(赤血球の破裂による)を誘発してきた。したがって、メナジオンはビタミンK欠乏症の治療にはもはや用いられていない(5)。ビタミンKの許容上限摂取量(UL)は設定されていない(42)。
栄養素相互作用
大容量のビタミンAとEは、ビタミンKと拮抗することがわかっている(8)。過剰なビタミンAはビタミンKの吸収に支障をきたすようであり、ビタミンEはビタミンK依存性カルボキシラーゼの活動を抑制し、凝固カスケードに支障をきたすのかもしれない(99)。正常な凝血状態の成人によるある研究で、1,000 IU/日のビタミンEを12週間補給したら、ビタミンK依存性タンパク質であるプロトロンビンのγカルボキシル化が低減したことがわかった(100)。ワルファリンのような抗凝固薬を服用している個人やビタミンK欠乏症の者は、大量出血(過剰な出血)のリスクが増大するので、厳しい医学的管理無しにビタミンEサプリメントを摂取すべきでない(101)。
薬物相互作用
ビタミンK拮抗薬(ワルファリンなど)の抗凝固効果は、非常に高用量の食事性または補給用のビタミンK摂取によって損なわれるかもしれない。さらに、毎日最大100μgのフィロキノンサプリメントはワルファリン服用患者にとって安全であると考えられているが、治療上の抗凝固薬の安定性は毎日10~20μgといった低用量のMK-7によって弱まるかもしれない(102)。一般的に、ワルファリン服用者はビタミンKの目安量(90~120μg/日)を摂取するようにして、抗凝固薬の用量調整に支障をきたすかもしれないようなビタミンK摂取量の大きな変動を避けることが推奨される(9)。妊婦や授乳婦への抗ビタミンK性の抗凝固薬、抗けいれん薬(フェニトインなど)、および抗結核薬(リファンピンやイソニアジドなど)の処方は、新生児にビタミンK欠乏症のリスク上昇をもたらすかもしれない(103)。
セファロスポリンやサリチル酸塩などの薬効範囲の広い抗生物質の長期使用は、腸内細菌によるビタミンK合成に支障をきたしビタミンK吸収を減らす可能性がある。心房細動を含む特定の不整脈(不規則な脈)の管理に使用されるアミオダロンという薬剤は、ワルファリンの抗凝固効果を強めて出血リスクを上昇させるかもしれない(104, 105)。さらに、コレステロール低下薬(コレスチラミンやコレスチポールなど)の使用は、オルリスタット、鉱物油、および脂肪吸収を妨げる脂肪代替物のオレストラの使用とともに、ビタミンKを含む脂溶性ビタミンの吸収に影響するかもしれない(106)。
ライナス・ポーリング研究所の推奨
骨でのビタミンK依存性タンパク質(「骨粗鬆症」の項参照)のγカルボキシル化を最適化するのに、ビタミンKの目安量で十分であるかどうかは不明である。フラミンガム心臓研究における股関節骨折リスクの低下に関連した量のビタミンK(約250μg/日)を摂取するには、刻んだブロッコリーを120mlより少し多いくらいか、大量のミックス緑色野菜サラダを毎日食べる必要がある。すべてのビタミンK依存性タンパク質の最適な機能に必要な食事性ビタミンKの摂取量はわからないが、ライナス・ポーリング研究所はマルチビタミン/ミネラルのサプリメントを服用し、毎日少なくとも240mlの濃い緑色の葉物野菜を食べることを推奨する。バターやチーズのような食事性の飽和脂肪をオリーブ油やキャノーラ油に含まれる一不飽和脂肪に替えると、食事性ビタミンK摂取を増やし、心血管疾患リスクを減少させるかもしれない。
年配の成人 (50歳超)
年配者は骨粗鬆症や股関節骨折のリスクが高いため、マルチビタミン/ミネラルのサプリメントおよび毎日少なくとも240mlの濃い緑色葉物野菜を摂るという上記の推奨は、特に年配者に関連があるものである。
Authors and Reviewers
Originally written in 2000 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in May 2004 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in May 2008 by:
Victoria J. Drake, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in July 2014 by:
Barbara Delage, Ph.D.
Linus Pauling Institute
Oregon State University
Reviewed in August 2014 by:
Sarah L. Booth, Ph.D.
Director, Vitamin K Research Program
Jean Mayer USDA Human Nutrition Research Center on Aging
Tufts University
Copyright 2000-2024 Linus Pauling Institute
References
1. Brody T. Nutritional Biochemistry. 2nd ed. San Diego: Academic Press; 1999.
2. Booth SL. Vitamin K: food composition and dietary intakes. Food Nutr Res. 2012;56. (PubMed)
3. Kidd PM. Vitamins D and K as pleiotropic nutrients: clinical importance to the skeletal and cardiovascular systems and preliminary evidence for synergy. Altern Med Rev. 2010;15(3):199-222. (PubMed)
4. Nakagawa K, Hirota Y, Sawada N, et al. Identification of UBIAD1 as a novel human menaquinone-4 biosynthetic enzyme. Nature. 2010;468(7320):117-121. (PubMed)
5. Ferland G. Vitamin K. In: Erdman Jr. JW, Macdonald IA, Zeisel SH, eds. Present Knowledge in Nutrition. 10th ed. Ames: Wiley-Blackwell; 2012:230-247.
6. Rishavy MA, Hallgren KW, Wilson LA, Usubalieva A, Runge KW, Berkner KL. The vitamin K oxidoreductase is a multimer that efficiently reduces vitamin K epoxide to hydroquinone to allow vitamin K-dependent protein carboxylation. J Biol Chem. 2013;288(44):31556-31566. (PubMed)
7. Tie JK, Jin DY, Straight DL, Stafford DW. Functional study of the vitamin K cycle in mammalian cells. Blood. 2011;117(10):2967-2974. (PubMed)
8. Olson RE. Vitamin K. In: Shils M, Olson JA, Shike M, Ross AC, eds. Modern Nutrition in Health and Disease. 9th ed. Baltimore: Lippincott Williams & Wilkins; 1999:363-380.
9. Holmes MV, Hunt BJ, Shearer MJ. The role of dietary vitamin K in the management of oral vitamin K antagonists. Blood Rev. 2012;26(1):1-14. (PubMed)
10. Kramps M, Flanagan A, Smaldone A. The use of vitamin K supplementation to achieve INR stability: a systematic review and meta-analysis. J Am Assoc Nurse Pract. 2013;25(10):535-544. (PubMed)
11. Lam J, Schulman S, Witt DM, Vandvik PO, Qayyum F, Holbrook AM. Anticoagulation control with daily low-dose vitamin k to reduce clinically adverse outcomes and international normalized ratio variability: a systematic review and meta-analysis. Pharmacotherapy. 2013;33(11):1184-1190. (PubMed)
12. Mahtani KR, Heneghan CJ, Nunan D, Roberts NW. Vitamin K for improved anticoagulation control in patients receiving warfarin. Cochrane Database Syst Rev. 2014;5:CD009917. (PubMed)
13. Gundberg CM, Lian JB, Booth SL. Vitamin K-dependent carboxylation of osteocalcin: friend or foe? Adv Nutr. 2012;3(2):149-157. (PubMed)
14. Pierre-Jacques H, Glueck CJ, Mont MA, Hungerford DS. Familial heterozygous protein-S deficiency in a patient who had multifocal osteonecrosis. A case report. J Bone Joint Surg Am. 1997;79(7):1079-1084. (PubMed)
15. Rawat RS, Mehta Y, Arora D, Trehan N. Asymptomatic type B right atrial thrombus in a case with protein S deficiency. Ann Card Anaesth. 2014;17(3):237-239. (PubMed)
16. van der Meer JH, van der Poll T, van 't Veer C. TAM receptors, Gas6, and protein S: roles in inflammation and hemostasis. Blood. 2014;123(16):2460-2469. (PubMed)
17. Booth SL. Roles for vitamin K beyond coagulation. Annu Rev Nutr. 2009;29:89-110. (PubMed)
18. Boraldi F, Annovi G, Guerra D, et al. Fibroblast protein profile analysis highlights the role of oxidative stress and vitamin K recycling in the pathogenesis of pseudoxanthoma elasticum. Proteomics Clin Appl. 2009;3(9):1084-1098. (PubMed)
19. Boraldi F, Garcia-Fernandez M, Paolinelli-Devincenzi C, et al. Ectopic calcification in β-thalassemia patients is associated with increased oxidative stress and lower MGP carboxylation. Biochim Biophys Acta. 2013;1832(12):2077-2084. (PubMed)
20. Coutu DL, Wu JH, Monette A, Rivard GE, Blostein MD, Galipeau J. Periostin, a member of a novel family of vitamin K-dependent proteins, is expressed by mesenchymal stromal cells. J Biol Chem. 2008;283(26):17991-18001. (PubMed)
21. Viegas CS, Simes DC, Laize V, Williamson MK, Price PA, Cancela ML. Gla-rich protein (GRP), a new vitamin K-dependent protein identified from sturgeon cartilage and highly conserved in vertebrates. J Biol Chem. 2008;283(52):36655-36664. (PubMed)
22. Viegas CS, Cavaco S, Neves PL, et al. Gla-rich protein is a novel vitamin K-dependent protein present in serum that accumulates at sites of pathological calcifications. Am J Pathol. 2009;175(6):2288-2298. (PubMed)
23. Hakuno D, Kimura N, Yoshioka M, et al. Periostin advances atherosclerotic and rheumatic cardiac valve degeneration by inducing angiogenesis and MMP production in humans and rodents. J Clin Invest. 2010;120(7):2292-2306. (PubMed)
24. Kudo Y, Siriwardena BS, Hatano H, Ogawa I, Takata T. Periostin: novel diagnostic and therapeutic target for cancer. Histol Histopathol. 2007;22(10):1167-1174. (PubMed)
25. Vanakker OM, Martin L, Schurgers LJ, et al. Low serum vitamin K in PXE results in defective carboxylation of mineralization inhibitors similar to the GGCX mutations in the PXE-like syndrome. Lab Invest. 2010;90(6):895-905. (PubMed)
26. Ferland G. Vitamin K and the nervous system: an overview of its actions. Adv Nutr. 2012;3(2):204-212. (PubMed)
27. Laurance S, Lemarie CA, Blostein MD. Growth arrest-specific gene 6 (gas6) and vascular hemostasis. Adv Nutr. 2012;3(2):196-203. (PubMed)
28. Robins RS, Lemarie CA, Laurance S, Aghourian MN, Wu J, Blostein MD. Vascular Gas6 contributes to thrombogenesis and promotes tissue factor up-regulation after vessel injury in mice. Blood. 2013;121(4):692-699. (PubMed)
29. Rothlin CV, Leighton JA, Ghosh S. Tyro3, Axl, and Mertk Receptor Signaling in Inflammatory Bowel Disease and Colitis-associated Cancer. Inflamm Bowel Dis. 2014;20(8):1472-1480. (PubMed)
30. Tjwa M, Moons L, Lutgens E. Pleiotropic role of growth arrest-specific gene 6 in atherosclerosis. Curr Opin Lipidol. 2009;20(5):386-392. (PubMed)
31. Jagannath VA, Fedorowicz Z, Thaker V, Chang AB. Vitamin K supplementation for cystic fibrosis. Cochrane Database Syst Rev. 2013;4:CD008482. (PubMed)
32. Nakajima S, Iijima H, Egawa S, et al. Association of vitamin K deficiency with bone metabolism and clinical disease activity in inflammatory bowel disease. Nutrition. 2011;27(10):1023-1028. (PubMed)
33. Nowak JK, Grzybowska-Chlebowczyk U, Landowski P, et al. Prevalence and correlates of vitamin K deficiency in children with inflammatory bowel disease. Sci Rep. 2014;4:4768. (PubMed)
34. Shearer MJ. Vitamin K deficiency bleeding (VKDB) in early infancy. Blood Rev. 2009;23(2):49-59. (PubMed)
35. American Academy of Pediatrics Committee on Fetus and Newborn. Controversies concerning vitamin K and the newborn. Pediatrics. 2003;112(1 Pt 1):191-192. (PubMed)
36. Klebanoff MA, Read JS, Mills JL, Shiono PH. The risk of childhood cancer after neonatal exposure to vitamin K. N Engl J Med. 1993;329(13):905-908. (PubMed)
37. Ekelund H, Finnstrom O, Gunnarskog J, Kallen B, Larsson Y. Administration of vitamin K to newborn infants and childhood cancer. BMJ. 1993;307(6896):89-91. (PubMed)
38. Roman E, Fear NT, Ansell P, et al. Vitamin K and childhood cancer: analysis of individual patient data from six case-control studies. Br J Cancer. 2002;86(1):63-69. (PubMed)
39. Schulte R, Jordan LC, Morad A, Naftel RP, Wellons JC, 3rd, Sidonio R. Rise in late onset vitamin K deficiency bleeding in young infants because of omission or refusal of prophylaxis at birth. Pediatr Neurol. 2014;50(6):564-568. (PubMed)
40. Costakos DT, Greer FR, Love LA, Dahlen LR, Suttie JW. Vitamin K prophylaxis for premature infants: 1 mg versus 0.5 mg. Am J Perinatol. 2003;20(8):485-490. (PubMed)
41. Kumar D, Greer FR, Super DM, Suttie JW, Moore JJ. Vitamin K status of premature infants: implications for current recommendations. Pediatrics. 2001;108(5):1117-1122. (PubMed)
42. Food and Nutrition Board, Institute of Medicine. Vitamin K. Dietary Reference Intakes for Vitamin A, Vitamin K, Arsenic, Boron, Chromium, Copper, Iodine, Iron, Manganese, Molybdenum, Nickel, Silicon, Vanadium, and Zinc. Washington, D.C.: National Academy Press; 2001:162-196. (National Academy Press)
43. Feskanich D, Weber P, Willett WC, Rockett H, Booth SL, Colditz GA. Vitamin K intake and hip fractures in women: a prospective study. Am J Clin Nutr. 1999;69(1):74-79. (PubMed)
44. Booth SL, Tucker KL, Chen H, et al. Dietary vitamin K intakes are associated with hip fracture but not with bone mineral density in elderly men and women. Am J Clin Nutr. 2000;71(5):1201-1208. (PubMed)
45. Rejnmark L, Vestergaard P, Charles P, et al. No effect of vitamin K1 intake on bone mineral density and fracture risk in perimenopausal women. Osteoporos Int. 2006;17(8):1122-1132. (PubMed)
46. McLean RR, Booth SL, Kiel DP, et al. Association of dietary and biochemical measures of vitamin K with quantitative ultrasound of the heel in men and women. Osteoporos Int. 2006;17(4):600-607. (PubMed)
47. Macdonald HM, μguigan FE, Lanham-New SA, Fraser WD, Ralston SH, Reid DM. Vitamin K1 intake is associated with higher bone mineral density and reduced bone resorption in early postmenopausal Scottish women: no evidence of gene-nutrient interaction with apolipoprotein E polymorphisms. Am J Clin Nutr. 2008;87(5):1513-1520. (PubMed)
48. Apalset EM, Gjesdal CG, Eide GE, Tell GS. Intake of vitamin K1 and K2 and risk of hip fractures: The Hordaland Health Study. Bone. 2011;49(5):990-995. (PubMed)
49. Torbergsen AC, Watne LO, Wyller TB, et al. Vitamin K1 and 25(OH)D are independently and synergistically associated with a risk for hip fracture in an elderly population: A case control study. Clin Nutr. 2015;34(1):101-106. (PubMed)
50. Booth SL, Mayer J. Warfarin use and fracture risk. Nutr Rev. 2000;58(1):20-22. (PubMed)
51. Tsugawa N, Shiraki M, Suhara Y, et al. Low plasma phylloquinone concentration is associated with high incidence of vertebral fracture in Japanese women. J Bone Miner Metab. 2008;26(1):79-85. (PubMed)
52. Ikeda Y, Iki M, Morita A, et al. Intake of fermented soybeans, natto, is associated with reduced bone loss in postmenopausal women: Japanese Population-Based Osteoporosis (JPOS) Study. J Nutr. 2006;136(5):1323-1328. (PubMed)
53. Fujita Y, Iki M, Tamaki J, et al. Association between vitamin K intake from fermented soybeans, natto, and bone mineral density in elderly Japanese men: the Fujiwara-kyo Osteoporosis Risk in Men (FORMEN) study. Osteoporos Int. 2012;23(2):705-714. (PubMed)
54. Kaneki M, Hodges SJ, Hosoi T, et al. Japanese fermented soybean food as the major determinant of the large geographic difference in circulating levels of vitamin K2: possible implications for hip-fracture risk. Nutrition. 2001;17(4):315-321. (PubMed)
55. Szulc P, Chapuy MC, Meunier PJ, Delmas PD. Serum undercarboxylated osteocalcin is a marker of the risk of hip fracture in elderly women. J Clin Invest. 1993;91(4):1769-1774. (PubMed)
56. Vergnaud P, Garnero P, Meunier PJ, Breart G, Kamihagi K, Delmas PD. Undercarboxylated osteocalcin measured with a specific immunoassay predicts hip fracture in elderly women: the EPIDOS Study. J Clin Endocrinol Metab. 1997;82(3):719-724. (PubMed)
57. Shearer MJ. The roles of vitamins D and K in bone health and osteoporosis prevention. Proc Nutr Soc. 1997;56(3):915-937. (PubMed)
58. O'Connor E, Molgaard C, Michaelsen KF, Jakobsen J, Cashman KD. Vitamin D-vitamin K interaction: effect of vitamin D supplementation on serum percentage undercarboxylated osteocalcin, a sensitive measure of vitamin K status, in Danish girls. Br J Nutr. 2010;104(8):1091-1095. (PubMed)
59. Kanellakis S, Moschonis G, Tenta R, et al. Changes in parameters of bone metabolism in postmenopausal women following a 12-month intervention period using dairy products enriched with calcium, vitamin D, and phylloquinone (vitamin K(1)) or menaquinone-7 (vitamin K (2)): the Postmenopausal Health Study II. Calcif Tissue Int. 2012;90(4):251-262. (PubMed)
60. Bolton-Smith C, McMurdo ME, Paterson CR, et al. Two-year randomized controlled trial of vitamin K1 (phylloquinone) and vitamin D3 plus calcium on the bone health of older women. J Bone Miner Res. 2007;22(4):509-519. (PubMed)
61. Braam LA, Knapen MH, Geusens P, et al. Vitamin K1 supplementation retards bone loss in postmenopausal women between 50 and 60 years of age. Calcif Tissue Int. 2003;73(1):21-26. (PubMed)
62. Cockayne S, Adamson J, Lanham-New S, Shearer MJ, Gilbody S, Torgerson DJ. Vitamin K and the prevention of fractures: systematic review and meta-analysis of randomized controlled trials. Arch Intern Med. 2006;166(12):1256-1261. (PubMed)
63. Tamura T, Morgan SL, Takimoto H. Vitamin K and the prevention of fractures. Arch Intern Med. 2007;167(1):94; author reply 94-95. (PubMed)
64. Inoue T, Fujita T, Kishimoto H, et al. Randomized controlled study on the prevention of osteoporotic fractures (OF study): a phase IV clinical study of 15-mg menatetrenone capsules. J Bone Miner Metab. 2009;27(1):66-75. (PubMed)
65. Knapen MH, Schurgers LJ, Vermeer C. Vitamin K2 supplementation improves hip bone geometry and bone strength indices in postmenopausal women. Osteoporos Int. 2007;18(7):963-972. (PubMed)
66. Binkley N, Harke J, Krueger D, et al. Vitamin K treatment reduces undercarboxylated osteocalcin but does not alter bone turnover, density, or geometry in healthy postmenopausal North American women. J Bone Miner Res. 2009;24(6):983-991. (PubMed)
67. Emaus N, Gjesdal CG, Almas B, et al. Vitamin K2 supplementation does not influence bone loss in early menopausal women: a randomised double-blind placebo-controlled trial. Osteoporos Int. 2010;21(10):1731-1740. (PubMed)
68. Knapen MH, Drummen NE, Smit E, Vermeer C, Theuwissen E. Three-year low-dose menaquinone-7 supplementation helps decrease bone loss in healthy postmenopausal women. Osteoporos Int. 2013;24(9):2499-2507. (PubMed)
69. Jamal SA, Browner WS, Bauer DC, Cummings SR. Warfarin use and risk for osteoporosis in elderly women. Study of Osteoporotic Fractures Research Group. Ann Intern Med. 1998;128(10):829-832. (PubMed)
70. Caraballo PJ, Heit JA, Atkinson EJ, et al. Long-term use of oral anticoagulants and the risk of fracture. Arch Intern Med. 1999;159(15):1750-1756. (PubMed)
71. Gage BF, Birman-Deych E, Radford MJ, Nilasena DS, Binder EF. Risk of osteoporotic fracture in elderly patients taking warfarin: results from the National Registry of Atrial Fibrillation 2. Arch Intern Med. 2006;166(2):241-246. (PubMed)
72. Caraballo PJ, Gabriel SE, Castro MR, Atkinson EJ, Melton LJ, 3rd. Changes in bone density after exposure to oral anticoagulants: a meta-analysis. Osteoporos Int. 1999;9(5):441-448. (PubMed)
73. Fusaro M, Crepaldi G, Maggi S, et al. Bleeding, vertebral fractures and vascular calcifications in patients treated with warfarin: hope for lower risks with alternative therapies. Curr Vasc Pharmacol. 2011;9(6):763-769. (PubMed)
74. Cheung CL, Sahni S, Cheung BM, Sing CW, Wong IC. Vitamin K intake and mortality in people with chronic kidney disease from NHANES III. Clin Nutr. 2014; pii: S0261-5614(14)00086-7. doi: 10.1016/j.clnu.2014.03.011. (Epub ahead of print) (PubMed)
75. Juanola-Falgarona M, Salas-Salvado J, Martinez-Gonzalez MA, et al. Dietary intake of vitamin K is inversely associated with mortality risk. J Nutr. 2014;144(5):743-750. (PubMed)
76. Vissers LE, Dalmeijer GW, Boer JM, Monique Verschuren WM, van der Schouw YT, Beulens JW. Intake of dietary phylloquinone and menaquinones and risk of stroke. J Am Heart Assoc. 2013;2(6):e000455. (PubMed)
77. Rees K, Guraewal S, Wong YL, et al. Is vitamin K consumption associated with cardio-metabolic disorders? A systematic review. Maturitas. 2010;67(2):121-128. (PubMed)
78. Gast GC, de Roos NM, Sluijs I, et al. A high menaquinone intake reduces the incidence of coronary heart disease. Nutr Metab Cardiovasc Dis. 2009;19(7):504-510. (PubMed)
79. Geleijnse JM, Vermeer C, Grobbee DE, et al. Dietary intake of menaquinone is associated with a reduced risk of coronary heart disease: the Rotterdam Study. J Nutr. 2004;134(11):3100-3105. (PubMed)
80. Otsuka F, Sakakura K, Yahagi K, Joner M, Virmani R. Has our understanding of calcification in human coronary atherosclerosis progressed? Arterioscler Thromb Vasc Biol. 2014;34(4):724-736. (PubMed)
81. Rennenberg RJ, Kessels AG, Schurgers LJ, van Engelshoven JM, de Leeuw PW, Kroon AA. Vascular calcifications as a marker of increased cardiovascular risk: a meta-analysis. Vasc Health Risk Manag. 2009;5(1):185-197. (PubMed)
82. Jie KS, Bots ML, Vermeer C, Witteman JC, Grobbee DE. Vitamin K intake and osteocalcin levels in women with and without aortic atherosclerosis: a population-based study. Atherosclerosis. 1995;116(1):117-123. (PubMed)
83. Villines TC, Hatzigeorgiou C, Feuerstein IM, O'Malley PG, Taylor AJ. Vitamin K1 intake and coronary calcification. Coron Artery Dis. 2005;16(3):199-203. (PubMed)
84. Maas AH, van der Schouw YT, Beijerinck D, et al. Vitamin K intake and calcifications in breast arteries. Maturitas. 2007;56(3):273-279. (PubMed)
85. Beulens JW, Bots ML, Atsma F, et al. High dietary menaquinone intake is associated with reduced coronary calcification. Atherosclerosis. 2009;203(2):489-493. (PubMed)
86. Borras T, Comes N. Evidence for a calcification process in the trabecular meshwork. Exp Eye Res. 2009;88(4):738-746. (PubMed)
87. Schurgers LJ, Uitto J, Reutelingsperger CP. Vitamin K-dependent carboxylation of matrix Gla-protein: a crucial switch to control ectopic mineralization. Trends Mol Med. 2013;19(4):217-226. (PubMed)
88. Cassidy-Bushrow AE, Bielak LF, Levin AM, et al. Matrix gla protein gene polymorphism is associated with increased coronary artery calcification progression. Arterioscler Thromb Vasc Biol. 2013;33(3):645-651. (PubMed)
89. Herrmann SM, Whatling C, Brand E, et al. Polymorphisms of the human matrix gla protein (MGP) gene, vascular calcification, and myocardial infarction. Arterioscler Thromb Vasc Biol. 2000;20(11):2386-2393. (PubMed)
90. Schurgers LJ, Teunissen KJ, Knapen MH, et al. Novel conformation-specific antibodies against matrix γ-carboxyglutamic acid (Gla) protein: undercarboxylated matrix Gla protein as marker for vascular calcification. Arterioscler Thromb Vasc Biol. 2005;25(8):1629-1633. (PubMed)
91. van den Heuvel EG, van Schoor NM, Lips P, et al. Circulating uncarboxylated matrix Gla protein, a marker of vitamin K status, as a risk factor of cardiovascular disease. Maturitas. 2014;77(2):137-141. (PubMed)
92. Mayer O, Jr., Seidlerova J, Bruthans J, et al. Desphospho-uncarboxylated matrix Gla-protein is associated with mortality risk in patients with chronic stable vascular disease. Atherosclerosis. 2014;235(1):162-168. (PubMed)
93. Shea MK, O'Donnell CJ, Hoffmann U, et al. Vitamin K supplementation and progression of coronary artery calcium in older men and women. Am J Clin Nutr. 2009;89(6):1799-1807. (PubMed)
94. Shea MK, O'Donnell CJ, Vermeer C, et al. Circulating uncarboxylated matrix gla protein is associated with vitamin K nutritional status, but not coronary artery calcium, in older adults. J Nutr. 2011;141(8):1529-1534. (PubMed)
95. Chatrou ML, Winckers K, Hackeng TM, Reutelingsperger CP, Schurgers LJ. Vascular calcification: the price to pay for anticoagulation therapy with vitamin K-antagonists. Blood Rev. 2012;26(4):155-166. (PubMed)
96. Booth SL, Suttie JW. Dietary intake and adequacy of vitamin K. J Nutr. 1998;128(5):785-788. (PubMed)
97. Beulens JW, Booth SL, van den Heuvel EG, Stoecklin E, Baka A, Vermeer C. The role of menaquinones (vitamin K(2)) in human health. Br J Nutr. 2013;110(8):1357-1368. (PubMed)
98. Hendler SS, Rorvik DR. Vitamin K. PDR for Nutritional Supplements. 2nd ed. Montvale: Physicians' Desk Reference Inc.; 2008:708-7123.
99. Traber MG. Vitamin E and K interactions--a 50-year-old problem. Nutr Rev. 2008;66(11):624-629. (PubMed)
100. Booth SL, Golly I, Sacheck JM, et al. Effect of vitamin E supplementation on vitamin K status in adults with normal coagulation status. Am J Clin Nutr. 2004;80(1):143-148. (PubMed)
101. Pastori D, Carnevale R, Cangemi R, et al. Vitamin E serum levels and bleeding risk in patients receiving oral anticoagulant therapy: a retrospective cohort study. J Am Heart Assoc. 2013;2(6):e000364. (PubMed)
102. Shearer MJ, Newman P. Recent trends in the metabolism and cell biology of vitamin K with special reference to vitamin K cycling and MK-4 biosynthesis. J Lipid Res. 2014;55(3):345-362. (PubMed)
103. Thorp JA, Gaston L, Caspers DR, Pal ML. Current concepts and controversies in the use of vitamin K. Drugs. 1995;49(3):376-387. (PubMed)
104. Reiffel JA. An important indirect drug interaction between dronedarone and warfarin that may be extrapolated to other drugs that can alter gastrointestinal function. Am Heart J. 2011;161(2):e5; author reply e7. (PubMed)
105. Shirolkar SC, Fiuzat M, Becker RC. Dronedarone and vitamin K antagonists: a review of drug-drug interactions. Am Heart J. 2010;160(4):577-582. (PubMed)
106. Hendler SS, Rorvik DR, eds. PDR for Nutritional Supplements. Montvale: Medical Economics Company, Inc.; 2001.
リボフラビン
目次
要約
-
リボフラビンはフラビンアデニンジヌクレオチド(FAD)とフラビンモノヌクレオチド(FMN)という補酵素の前駆体である。それらはエネルギー生産や多数の代謝経路に関わるたくさんの酸化還元反応における電子伝達体として働く。(詳細はこちら)
-
リボフラビン欠乏症は、ビタミンB6、葉酸塩、ナイアシン、および鉄の代謝における複数の経路に影響することがある。(詳細はこちら)
-
リボフラビン欠乏症は、妊婦の子癇前症と関連づけられてきた。この症状は子癇へと進行し、重度の出血や死を引き起こすかもしれない。子癇前症のリスクは最近、メチレンテトラヒドロ葉酸還元酵素(MTHFR)遺伝子における遺伝子変異(C677T)の存在との関わりがわかった。この遺伝子はMTHFR酵素を符号化し、これはFAD依存性である。(詳細はこちら)
-
酸化ストレスは眼の水晶体を混濁化させ、年配者の白内障へと至らせることがある。いくつかの観察研究の結果は有望であるものの、白内障の予防におけるリボフラビンの利点の可能性を評価する介入研究が必要である。(詳細はこちら)
-
リボフラビン(FADの形態)は、葉酸塩を代謝する主要な酵素であるMTHFRの補助因子として必要である。リボフラビンの状態が悪いと葉酸塩の代謝に支障をきたす可能性があり、MTHFRC677T遺伝子変異がホモ接合である者は特にそうである。これらの者は心血管疾患(CVD)のリスクがより高い。介入試験から導かれるエビデンスでは、MTHFRC677TT遺伝子型の者の高血圧に対するリボフラビンの予防的役割が裏付けられている。(詳細はこちら)
-
リボフラビンは偏頭痛に悩む子供や成人による研究で予防薬として評価されてきた。リボフラビン補給は成人の頭痛発作の頻度や重篤度を下げることが示されたが、子供ではそうではなかった。(詳細はこちら)
-
リボフラビン代謝の常染色体劣性遺伝疾患のある患者にはリボフラビン補給が有益であるかもしれないことが症例報告で示されている。(詳細はこちら)
-
リボフラビンはがんおよびある種の眼科疾患の補助療法としての可能性が評価されてきた。(詳細はこちら)
リボフラビンはビタミンB2としても知られる水溶性ビタミンBである。リボフラビンは体内において、補酵素であるフラビンアデニンジヌクレオチド(FAD)およびフラビンモノヌクレオチド(FMN)に不可欠な成分として主に存在する(1)。リボフラビン由来の補酵素はフラビン補酵素と命名され、フラビン補酵素を使用する酵素はフラビンタンパク質と呼ばれる(2)。
機能
酸化還元反応
生物はそのエネルギーのほとんどを酸化還元反応から得ており、これは電子の移送を伴うプロセスである。フラビン補酵素は、多数の代謝経路において酸化還元反応に関わっている(3)。それらは炭水化物、脂質、およびタンパク質の代謝に非常に重要である。FADは電子伝達(呼吸)鎖の一部であり、これはエネルギー生産の中心である。シトクロムP-450とともに、フラビン補酵素は薬剤や毒素の代謝にも関わる(4)。
抗酸化機能
グルタチオン還元酵素は、グルタチオンの酸化還元サイクルに関わるFAD依存性酵素である。グルタチオン酸化還元サイクルは、ヒドロペルオキシドのような活性酸素種から生物を守ることに主要な役割を果たす。グルタチオン還元酵素(GR)は、酸化されたグルタチオンから還元されたグルタチオン2分子を再生するためにFADを必要とする。リボフラビン欠乏症は、酸化ストレス上昇と関連付けられてきた(4)。リボフラビンの栄養状態を評価するために、赤血球のGR活性測定値が一般的に使用される(5)。赤血球グルタチオン還元酵素の活性係数(EGRac)アッセイ(試験法)は、in vitro(ガラス容器内)での補欠分子族FADによる再活性化の前後でGRの活性を測定することで、リボフラビンの状態を評価する。EGRacはFADに刺激された酵素活性と刺激されなかったものの比率として計算され、組織がリボフラビンで飽和された程度を示すものである。EGRacはしたがってリボフラビンの状態の機能性測定値であり、重篤な欠乏症から正常な状態までのバイオマーカーの状態を反映する有効性が示されている(6)。
セレン含有酵素であるグルタチオンペルオキシダーゼ(GPx)は、還元されたグルタチオン2分子をヒドロペルオキシドの分解に必要とする。GPxはグルタチオン酸化還元サイクルに関わっている(図1参照)。
別のFAD依存性酵素であるキサンチン酸化酵素は、ヒポキサンチンやキサンチンを尿酸へと酸化する反応を触媒する。尿酸は、血液中で最も効果的な水溶性抗酸化物質の一つである。リボフラビン欠乏症はキサンチン酸化酵素の活性を下げ、血中尿酸濃度を低下させることになるかもしれない(7)。
栄養素相互作用
ビタミンB群
フラビンタンパク質は、その他のいくつかのビタミン(すなわちビタミンB6、ナイアシン、および葉酸塩)の代謝に関わっている。したがって、重篤なリボフラビン欠乏症は多くの酵素系に影響する可能性がある。ほとんどの天然由来のビタミンB6をその補酵素形態であるピリドキサール5'-リン酸(PLP)に変換するには、FMN依存性酵素であるピリドキシン5'-リン酸酸化酵素(PPO)が必要である(8)。年配者対象の少なくとも2つの研究で、ビタミンB6の指標とリボフラビンの栄養状態との間に有意な相互作用があることが記載された(9,10)。アミノ酸のトリプトファンからナイアシン含有補酵素のNADとNADPを合成するには、FAD依存性酵素のキヌレニン(3-)モノオキシゲナーゼを必要とする。重篤なリボフラビン欠乏症はトリプトファンからのNADやNADPの合成を減らし、ナイアシン欠乏症のリスクを上げる可能性がある(3)。5,10-メチレンテトラヒドロ葉酸還元酵素(MTHFR)は、ホモシステインからメチオニンを作るために必要な特定の葉酸酵素を維持することに重要な役割を果たすFAD依存性酵素である(図2参照)。その他のビタミンB群と同様に、リボフラビンの高摂取は血漿ホモシステイン濃度の低下と関連付けられてきた(11)。主にMTHFR遺伝子のC677T多型がホモ接合である者や葉酸塩の摂取が少ない者では、血漿リボフラビン濃度の上昇が血漿ホモシステイン濃度の減少とも関連付けられる(12)。そのような結果は、遺伝性および食事性の要因の複雑な相互作用によって慢性疾患リスクが影響を受けることを示している(「心血管疾患」および「がん」の項参照)。
鉄
リボフラビン欠乏症は鉄の代謝を変える。そのメカニズムはよくわかっていないが、動物による研究ではリボフラビン欠乏症が鉄の吸収を損ない、腸での鉄の損失を増やし、および/またはヘモグロビン(Hb)合成のための鉄の利用を損なうかもしれないことが示されている(13)。ヒトでは、リボフラビンの栄養状態を向上させることが体内循環のHb濃度を上げることがわかっている(14)。リボフラビンも鉄も欠乏症の者のリボフラビン欠乏症を治すと、鉄欠乏性貧血の鉄による治療への反応が改善する(15)。全世界的な公衆衛生問題である妊娠中の貧血は、かなりの出生時罹患や死亡の原因である(16,17)。母親の貧血の管理には単独または葉酸と併用での鉄補給があり(18)、リボフラビン補給が鉄葉酸補給を強化するのではないかと考えられてきた。東南アジアの貧血の妊婦に対する無作為化二重盲検介入試験で、葉酸、鉄、ビタミンA、およびリボフラビンの組み合わせは鉄と葉酸だけの補給に比べてHb濃度を好転させ、貧血の罹患率を低減させたことが示された(19,20)。
欠乏症
ビタミンB2欠乏症は、臨床的リボフラビン欠乏症の医学用語である。リボフラビン欠乏症は、単独で見つかることは稀である。それはしばしばその他の水溶性ビタミン欠乏症とともに起こる。リボフラビン欠乏症の症状は、咽頭痛、口内や喉の赤み(発赤)や腫れ(腫脹)、唇表面のひび割れや痛み(口唇症)、および口の端の割れ目や痛み(口角炎)、舌の炎症や発赤(赤色舌炎)、およびじくじくして剥がれ落ちる皮膚の炎症(脂漏性皮膚炎)などがある。その他の症状では、眼の透明膜における血管の生成(角膜の血管新生)や、現存の赤血球は正常なヘモグロビン濃度と大きさであるのに赤血球数が減ること(正色素性正球性貧血)もあるかもしれない(1,3)。重篤なリボフラビン欠乏症は、ビタミンB6からその補酵素の形態(PLP)への変換の低減や、トリプトファンからナイアシンへの変換の減少に至るかもしれない(「栄養素相互作用」の項参照)。
子癇前症は、妊娠中の血圧上昇、尿中タンパク質、および浮腫(ひどい腫れ)が起こることと定義される。子癇前症の妊婦の約5%が、母体および胎児の死亡の重大原因である子癇へと進行する。子癇は痙攣が特徴で、高血圧や出血(大量出血)リスクの上昇も伴う(21)。子癇前症のリスクが高い154人の妊婦による研究で、リボフラビン欠乏症の者はリボフラビンの栄養状態が適切である者に比べて子癇前症に4.7倍なりやすかったことがわかった(22)。子癇前症と子癇の原因はわかっていない。フラビン補酵素の細胞内濃度の低下がミトコンドリアの機能不全を起こして酸化ストレスを増大させ、一酸化窒素の放出に支障をきたして、そのために血管拡張が妨げられる。これらすべての変化が子癇前症と関連がある(22)。
51の研究の最近のメタ解析で、メチレンテトラヒドロ葉酸還元酵素(MTHFR)遺伝子のC677T多型が白人および東アジアの集団における子癇前症と関連があることがわかった(23)。しかし初期のメタ解析では、MTHFR677TTの遺伝子型はアジア人女性のみにおいて子癇前症のリスクがかなり高い一方で、白人女性ではリスク上昇はそれほどでもなかったことが報告された(24)。研究ごとのそのような違いは、MTHFR677TT遺伝子型の効果が、集団ごとにかなり異なるかもしれないリボフラビンやその他の関連する食事要因によって調整されているのかもしれないことを示唆している。C677T遺伝子変異体を持つ被験者に見られるフラビンタンパク質のMTHFR活性の低下は、血漿ホモシステイン濃度がやや上昇することになり、ホモシステイン濃度の上昇は子癇前症と関連付けられてきた(25)。子癇前症のリスクの高い450人の妊婦による1つの小規模無作為化プラセボ対照二重盲検試験で、毎日15 mgのリボフラビン補給では症状を予防できなかったことがわかった(26)。しかし、周産期の合併症、特にC677T遺伝子型の女性の子癇前症を減らすためのリボフラビン補給の潜在的有益性を評価する研究が必要である。
リボフラビン欠乏症のリスク要因
アルコール中毒者は、リボフラビンの摂取が不足したり、吸収が悪かったり、利用が損なわれたりしてリボフラビン欠乏症リスクが高い。興味深いことに、リボフラビン欠乏に伴うホモシステイン濃度上昇は、アルコールを控える間は急速に下がる(27)。また、拒食症の者が適切にリボフラビンを摂取することは稀であり、ラクトース不耐性の者は、リボフラビンの良好な摂取源である牛乳やその他の乳製品を摂取しないかもしれない。リボフラビンからFADやFMNへの変換は、甲状腺機能低下症や副腎機能不全によって損なわれる(3,4)。さらに、身体的に非常に活動的な者(アスリートや肉体労働者)はリボフラビン必要量が少し高いかもしれない。しかし一般的には、リボフラビン補給で運動耐性または運動能力が上がるとはされていない(28)。
臨床的リボフラビン欠乏症(すなわち口角炎、口唇症、および舌炎などの兆候を含む)は先進国では稀であるが、リボフラビンの状態(機能的バイオマーカーのEGRacで決定されるもの)が適切でないことは、それ以外は健康な先進国の多くの集団に影響する広汎な問題であるかもしれないと示唆するエビデンス(科学的根拠)がある。たとえば英国成人のかなりの割合は、EGRacを使用した国家的調査データから決定されたように、リボフラビンの状態が良くないと報告された(29)。しかし摂取が少ない若い女性を除けば、食事性摂取量は一般的に推奨量に程よく匹敵することがわかった。食事性摂取量が適切であるように見えるのにEGRacの数値が異常な英国人の割合が高いことは、さらなる調査が必要である。
推奨量(RDA)
1998年に改定されたリボフラビンのRDAは、欠乏症予防に基づいている(表1)。ヒトの欠乏症の臨床的兆候は0.5~0.6ミリグラム(mg)/日よりも少ない摂取量で現れ、約1 mg/日の摂取量でリボフラビンの尿中への排泄が見られる(1)。
疾病予防
白内障
加齢性白内障は、米国およびその他の先進国における視覚障害の主因である。研究では、栄養学的な抗酸化物質に焦点が当てられてきたが、これは水晶体のタンパク質の光誘発性酸化ダメージから加齢性白内障の発症に至るのではないかとするエビデンスに拠るものである。症例対照研究で、食事性リボフラビン摂取が最も高い五分位(中央値で1.6~2.2 mg/日)の男女は、最も低い五分位(男女とも中央値で0.08 mg/日)の者に比べて加齢性白内障リスクがかなり低い(33%対55%)ことがわかった(30)。別の症例対照研究では、赤血球グルタチオン還元酵素活性で測定されたリボフラビンの栄養状態が最も高い五分位の者は、最も低い五分位の者に比べて加齢性白内障の発生が約半分であったことが報告されたが、その結果は統計学的にそれほど有意義ではなかった(31)。49歳以上のオーストラリアの男女2,900人による横断研究で、リボフラビン摂取が最多の五分位の者は、最少の者に比べて白内障に50%なりにくいことがわかった(32)。50,000人超の女性による前向き研究においては、リボフラビン摂取が最も多い五分位(中央値で1.5 mg/日)の女性と最も少ない五分位(中央値で1.2 mg/日)の女性の間で、白内障摘出手術の割合に差は見られなかった(33)。しかし最多と最少の範囲が小さく、どちらの五分位も摂取の中央値が現在のリボフラビンのRDAより上であった。408人の女性による研究では、リボフラビン摂取が多いと5年間の水晶体混濁形成の変化と逆相関があることがわかった(34)。これらの観察は白内障予防におけるリボフラビンの役割をいくらか裏付けるものであるが、この関係を確認するために反応のバイオマーカー(EGRacなど)を含む無作為化プラセボ対照介入試験が必要である。
心血管疾患
何年も血漿ホモシステイン濃度が高いことは心血管疾患(CVD)のリスク要因であると考えられてきたが、最近これにはいささか議論がある(35)。血漿ホモシステインは葉酸塩や、リボフラビンを含む代謝的に関連のあるビタミンB群での介入による低減効果に反応する。リボフラビンはMTHFRの補助因子として働くので、ホモシステインからメチオニンへの再メチル化に必要な5-メチルテトラヒドロ葉酸を生成するために必要である(上記の図2参照)。これらのビタミンB群はしかしながら、ホモシステインに対するそれらの効果とは別にCVD予防における役割があるかもしれない。
遺伝学的研究で、ビタミンBの栄養状態が不適切なこととCVDリスクに関連があることを裏付ける確信的なエビデンスが提供されている。そのような研究のメタ解析で、MTHFRC677T遺伝子変異がホモ接合の者は、この多型を持っていない者に比べてCVDリスクがかなり高い(14~21%)ことが示された。しかしCVDリスクの増加には大きな地理的差異があり(36)、食事性の要因でこの遺伝子要因に関連した疾病リスクを調整できるのではないかということが強く示唆される。
蓄積されたエビデンスから、この一般的な葉酸代謝遺伝子多型とCVD、特に脳卒中の主要なリスク要因である高血圧(血圧が140/90 mmHg以上と定義)とが関連付けられている。この多型がホモ接合の患者の血圧が低用量のリボフラビンにとてもよく反応する(「疾病治療」の項参照)という最近のエビデンスから、リボフラビンの状態を改善することが高血圧予防に重要な役割を持つであろう可能性が出てくる。これは、関連する遺伝子型の者にとって特に脳卒中リスクを低減できるかもしれないことになる。注目すべきことに、報告されているMTHFR677TT遺伝子型の出現頻度は全世界では10%だが、ヨーロッパで4~26%、中国北部で20%、そしてメキシコでは32%にもなる(37)。
がん
フラビンタンパク質であるメチレンテトラヒドロ葉酸還元酵素(MTHFR)は、葉酸介在のホモシステイン代謝に中心的な役割をする。MTHFRは5,10-メチレンテトラヒドロ葉酸を5-メチルテトラヒドロ葉酸に変換し、これはホモシステインからメチオニンへの再メチル化に必要である(上記の図2参照)。ホモシステインからメチオニンへの変換はホモシステインの解毒と、DNAおよびヒストンのメチル化の際のメチル基供与体であるS-アデノシルメチオニン(SAM)の生成に重要である。葉酸塩欠乏症とホモシステイン濃度上昇は、がんリスクを上昇させるかもしれない(「葉酸塩」のタイトルの記事参照)。異常なメチル化の変化は、がんの進行中にDNAとヒストンの構造や機能を変化させることが知られている(38)。MTHFRはホモシステインの解毒とSAM合成のためのメチル基供給を制御しているため、その活性の低下はホモシステイン代謝に影響して細胞でのメチル化プロセスを乱す可能性がある。MTHFR遺伝子の位置677におけるシトシンからチミンへの置換(c.677C>T)はFADの結合に影響する多型であり、MTHFRがフラビン補酵素を喪失する傾向を強めることになる(39)。この変異がホモ接合の者(すなわちMTHFR677TT遺伝子型)はMTHFR活性の低下を示し、そうした者は様々な部位でのがんリスクが高くなるというエビデンスがある(40~42)。しかし、この一般的な多型とがんリスクの関連の本質は今もはっきりしていない。
上記のように(「ビタミンB群」の項参照)、リボフラビン摂取はホモシステイン濃度の決定要因である。このことはリボフラビンの状態がMTHFR活性と葉酸代謝に影響し、それによってがんリスクに影響する可能性があることを示唆している(42)。ある無作為化二重盲検プラセボ対照研究で、大腸ポリープのある93人の被験者と86人の健康な被験者に45日間にわたってプラセボか、葉酸(400または1,200 mcg/日)か、葉酸(400 mcg/日)とリボフラビン(5 mg/日)を与えた。これらの介入によって、ビタミン補給された者の葉酸塩とリボフラビンの状態はプラセボを摂取した者よりかなり改善した。興味深いことに、特にC677T遺伝子変異のあるポリープ患者では、体内循環の5-メチルテトラヒドロ葉酸(5-MeTh4)に対する400 mcgの葉酸の効果をリボフラビンが強化していた(43)。このことは、MTHFR活性が下がっている者への葉酸補給に対する反応を、リボフラビンが向上させるかもしれないことを示唆している。また、閉経後の88,045人の女性による前向きコホート研究で、リボフラビンの全摂取量(食事性およびサプリメント性)について毎日の摂取量が最多の四分位(3.97 mg超)の者と最少の四分位(1.80 mg未満)の者とで比べた場合に、全摂取量は結腸直腸がん(大腸がん)リスクと逆相関があることがわかった(44)。参照群における摂取量はRDAを大きく上回る1.1 mg/日であった。この研究の被験者はC677T遺伝子型を持つ者を事前に選別しておらず、C677T多型と大腸がんの関連ははっきりしないが、T対立遺伝子があるとリスクが低下することを示唆する報告がある(45)。
リボフラビン摂取とがんリスクの関連は、その他のタイプのがんでも評価されている。ある7年間の介入研究は、中国で食道がんのリスクが高い22,093人の者へのリボフラビン強化塩の使用について評価した。対照群に比べて、介入群ではリボフラビンの状態と食道に関する病理学的数値(正常、形成異常、およびがん組織のパーセント)が向上したが、介入群における食道がんの発生率が低いことは、統計学的に有意義ではなかった(46)。さらに、41,514人の男女を15年間追跡したメルボルン共同コホート研究では、リボフラビン摂取と肺がん(47)および乳がん(48)に弱い逆相関が見られたが、前立腺がんでは何の相関もなかった(49)。胃がんリスクが高い患者の介入試験の10年にわたる追跡では、リボフラビン(3.2 mg/日)とナイアシン(40 mg/日)を含むミネラルとビタミンの食事性補給を5年間しても、胃がんの発生率や死亡率を下げることはできなかったことがわかった(50)。
疾病治療
偏頭痛
脳内でのミトコンドリアの酸素代謝が損なわれることが偏頭痛の病理に関わっているのではないかと示すエビデンスがある。リボフラビンは、ミトコンドリアの電子伝達系のフラビンタンパク質が必要とする2つのフラビン補酵素(FADおよびFMN)の前駆体であるので、リボフラビン補給は偏頭痛の治療法として調べられてきた。ある無作為化プラセボ対照試験で、偏頭痛の再発の履歴がある54人の男女における片頭痛予防に関して、3ヶ月間400 mg/日のリボフラビンを摂取する効果が調べられた(51)。リボフラビンはプラセボに比べて発作頻度と頭痛のある日を減らすことにおいてかなり良好であったが、有益な効果は治療の3ヶ月目に最も顕著であった。同じ研究者による別の研究で、βブロッカー(遮断薬)と呼ばれる薬物または高用量リボフラビン(400 mg/日)で4ヶ月間治療したところ臨床的に改善があったが、どちらの治療法も別個の病理学的メカニズムに作用するようだとわかった。すなわちβブロッカーは皮質の異常な情報処理に、リボフラビンは脳のミトコンドリアのエネルギー産生低下に働くようであった(52)。23人の患者による小規模研究で、毎日400 mgのリボフラビンを3ヶ月間補給したら偏頭痛発作頻度の中央値が下がったと報告された(53)。しかし、偏頭痛に悩む者にリボフラビン(400 mg/日)、マグネシウム、およびナツシロギクを併用投与した3ヶ月間の無作為化二重盲検プラセボ対照研究では、25 mg/日のリボフラビンを含むプラセボを摂取した場合以上の治療効果は何もなかったと報告された(54)。この試験でのベースライン時(治療開始時)の測定に比べて、プラセボ群も治療群も偏頭痛の平均回数、日数、または指標に関していくらかの有益性があった(54)。これらの発見はまだ先行的なものであるが、今日までのほとんどの研究からのデータは、成人へのリボフラビン補給が片頭痛予防の薬理学的治療法に対する有益な補助療法であるかもしれないことを示唆している。
2つの無作為化二重盲検プラセボ対照試験で、偏頭痛のある子供の発作の頻度や重篤度に関してリボフラビン補給の効果が調べられた。第一の研究では、5~15歳の48人の子供に200 mg/日のリボフラビンを12週間与えた効果を評価した(55)。第二の研究は、6~13歳の42人の子供による横断研究であった。そのうち半分は50 mg/日のリボフラビンを16週間摂取してから4週間の休薬期間を経てプラセボ(100 mg/日のカロテン)を16週間摂取し、残りの半分はまずプラセボを摂取してからリボフラビンを摂取した(56)。どちらの研究でも治療による偏頭痛の頻度、持続時間、または強さに何の差も示されなかった。偏頭痛の子供へのリボフラビン補給の有効性はまだ確率されておらず、将来の研究ではこの集団に対する最適な用量をまず決定すべきである。
代謝障害
FAD依存性酵素の欠陥による常染色体劣性遺伝疾患の患者はリボフラビン補給で恩恵を受けるかもしれないことが、増大するエビデンスで示唆されている。
多種アシルCoA脱水素酵素欠損症(MADD)
II型グルタル酸尿症(または血症)としても知られるMADDは、様々な組織における短鎖、中鎖、および長鎖のアシルカルニチンの蓄積が特徴的な脂肪酸代謝異常症である。MADDの新生児期および遅発性の発症形態は、突発性の脳症、周期性嘔吐、肝障害、および横紋筋融解症を含む様々な症状を広範な臨床的重篤度で呈する(57)。MADDは、ミトコンドリア内でアシル補酵素A(アシルCoA)からコエンザイムQ10/ユビキノンへの電子輸送に関わる酵素の活性を損なう遺伝子の突然変異によって起こる(図3参照)。ETFA、ETFB、およびETFDHはそれぞれ、電子伝達系フラビンタンパク質(ETF-AおよびETF-B)の2つのサブユニットおよびETF脱水素酵素/ユビキノン酸化還元酵素(ETFDH/ETFQO)を符号化する。
これらの酵素(ETFまたはETFDH)の欠損は酸化されたFADの減少につながり、ミトコンドリア内で起こる主要な脂肪酸異化作用であるβ酸化の第一段階を含むFAD依存性脱水素反応において、酸化されたFADが利用不能になってしまう。脂肪酸β酸化の欠陥は骨格筋での脂質蓄積を引き起こし、筋肉痛や筋力低下、および運動不耐性が特徴的な脂質蓄積性ミオパシーにつながる。低脂肪で炭水化物が多い食事と一緒にリボフラビン補給をすると、ETFDH突然変異を持つ患者にかなりの臨床的改善が起こる。FTE/ETFDHにおける特定のタイプの突然変異は、発症年齢、重篤度、およびリボフラビンによる治療への反応性に関わる(58)。さらに、リボフラビン反応性MADDの20歳の男性に関する最近の報告ではETFやETFDH遺伝子に突然変異が見つからなかったことから、その他の部位の突然変異も排除すべきではないことが示唆された(57)。最後に、呼吸鎖での二次性欠損がMADDで観察され、これはリボフラビン治療にうまく反応するようである(58,59)。
アシルCoA脱水素酵素9欠損症(ACAD9)
FAD依存性のアシルCoA脱水素酵素を符号化するACAD9遺伝子の劣性突然変異が、呼吸鎖疾患であるミトコンドリア複合体I欠損症患者で見つかった(60)。ACAD9欠損は脂肪酸のβ酸化の欠陥とは関連がないため、複合体I構造におけるACAD9の役割が示唆される(61)。複合体Iは電子伝達系でNADHからコエンザイムQ10へ電子を運ぶ。複合体I欠損による酸化的リン酸化(呼吸鎖によるATP合成)の欠陥は、新生児死亡から遅発性神経変性疾患まで広範な臨床症状と関連付けられてきた。ACAD9の突然変異による複合体I欠損の症状には、筋力低下、運動不耐性、乳酸アシドーシス、脳症、および心筋症などがある。リボフラビン補給(100~300 mg/日)によって、幼少期発症性臨床形態のACAD9欠損を持つ患者の複合体I活性が高まった。筋力や運動耐性の向上も、リボフラビン補給と関連があった(62~64)。
リボフラビン輸送の欠陥に関連する疾患
SLC52A1、SLC52A3、およびSLC52A2遺伝子はそれぞれヒトのリボフラビン輸送体であるhRTF1、hRTF2、およびhRTF3を符号化する。これらの遺伝子の突然変異は、様々な発症年齢が特徴的である稀な神経変性疾患のブラウン-ビアレット-ヴァン・ラール(BVVL)症候群と関連付けられてきた。その症状には、筋緊張低下や顔面脱力を伴う球麻痺、感音性難聴、および呼吸不全などがある。BVVL症候群の臨床的記載で聴覚喪失がないものは、ファチオ・ロンド(FL)症候群として知られている。MADDの一過性の臨床的および生化学的特徴が、リボフラビン欠乏症の母親から生まれた新生児に関して記述された。hRTF1遺伝子の突然変異によって起こるこの軽症の欠乏症は、リボフラビン補給によって迅速に治療された(65,66)。BVVL/FL症候群に罹った74人の患者の報告を分析した文献の最近のレビューで、リボフラビン補給(平均用量で10 mg/kg/日)を受けた13人のうち8人が臨床的な改善を示し、治療を受けた者は生存率が100%だったことがわかった(67)。異常なプロフィールを示す患者でも、リボフラビンはフラビンとアシルカルニチン濃度を正常に回復させた。
リボフラビン反応性トリメチルアミン尿症
原発性トリメチルアミン尿症は、フラビン含有モノオキシゲナーゼ3(FMO3)と呼ばれる肝臓のフラビンタンパク質によるトリメチルアミン酸化の欠陥で起こる。FMO3欠損の者は、尿、汗、および息のトリメチルアミン濃度が高い(68)。この社会的に苦悩を与える症状は魚臭症候群として知られ、これはトリメチルアミンの持つ魚のような匂いと揮発性によるものである。FMO3遺伝子の突然変異は通常、軽度または間欠性トリメチルアミン尿症と関連がある。症状は時として、女性の月経周期の頃またはトリメチルアミンが豊富な食品の摂取の際に限られる。この症状の臨床的管理としてトリメチルアミンとその前駆体の食事制限があり、コリンの豊富な食物や海産物、およびトリメチルアミン前駆体とFMO3拮抗物質の両方を含むアブラナ科の野菜などを制限する(69)。ピリドキシン非反応性ホモシスチン尿症を患う17歳の女性患者へのリボフラビンサプリメントの使用が最近報告された(70)。この疾患は最初はベタイン(コリン誘導体)で治療されていたが、FMO3欠損症に次ぐ体臭が発生した。リボフラビン補給(200 mg/日)は、トリメチルアミンの排出とベタイン治療関連の体臭を減らした。このデータから、リボフラビンは原発性トリメチルアミン尿症患者のFMO3酵素の残存活性を最大化することに役立つかもしれないことが示唆される。
高血圧
高血圧の病因ははっきりしないが、メチレンテトラヒドロ葉酸還元酵素(MTHFR)遺伝子のC677T多型はホモシステイン濃度の主要な決定因子であり、血圧が高くなること(高血圧のマーカー)(71)や、冠動脈心疾患および血管性発作のリスク上昇(72~74)と関連付けられてきた。この遺伝子変異はMTHFRの活性低下に至るため、677TT遺伝子型の者はリボフラビン補給で恩恵を受けるかもしれない。MTHFR遺伝子型で事前選別された77人の健康な被験者による初期の無作為化二重盲検プラセボ対照試験で、リボフラビン補給(1.6 mg/日を12週間)によってMTHFR677TT遺伝子型の群ではホモシステイン濃度が下がったが、ベースライン時に正常な血漿ホモシステイン濃度だった同齢の677CCおよび677CT群はそうならなかった(75)。早発性心血管疾患(CVD)患者(事前にMTHFR677C→T多型について選別)によるその後の2つの無作為化二重盲検プラセボ対照試験で、リボフラビンで高血圧を調節する可能性が調べられた(76,77)。その結果、リボフラビン補給(1.6 mg/日を16週間)をした677TT遺伝子型の患者においてのみプラセボに比べてかなりの血圧低下が示され、これは元の試験(69)でも、同じ高リスクCVD患者のコホート(集団)を元の試験から4年後に再調査した際でもそうであった(70)。別の研究で、MTHFR677TT遺伝子型の88人の高血圧患者(ただし、明白なCVD症状はない)に対するリボフラビンの効果が調べられ、そのうちの大半は降圧療法で治療中であった。ベースライン時には、3~4種類の降圧薬を使用中でも参加者の60%は目標の血圧レベル(140/90 mm Hg以下)に到達していなかった。これらの患者へのリボフラビン補給(1.6 mg/日を16週間)に伴う血圧降下は、この遺伝子変異に関連した高血圧リスク過多がリボフラビンの状態を最適化することで克服できるかもしれないことを示した(78)。
がん
抗がん剤はしばしば、患者に用量を制限したり治療をやめさせたりするように強いるかもしれない様々な副作用を呈する。タモキシフェンで90日間治療を受けた78人の閉経後の乳がん患者にリボフラビン(10 mg/日)、ナイアシン(50 mg/日)、およびコエンザイムQ10(100 mg/日)を同時投与しての抗酸化効果が評価された。この補給によって、タモキシフェン治療に伴う酸化ストレスが効果的に防がれた(79)。リボフラビンは光増感剤としても作用することができ、この特性ががんの光線力学的療法には価値のあることかもしれない。最も効果的な抗がん剤であるシスプラチンとリボフラビンを併用する効果を評価するために、マウスのモデルが使用された。光に当てると、肝臓や腎臓でシスプラチンに誘発されたDNA損傷がリボフラビン投与によって減った(80)。これらの結果は有望であるが、リボフラビンが化学療法に対する有効的な補助療法であるのかを調べるヒトでの研究が必要である。
角膜の障害
角膜拡張は、視覚に影響する角膜の形状の歪みが特徴的な目の症状である。角膜の損傷が進行するのを制限するために専門家によって行われる新しい方法である角膜の架橋結合は、紫外線照射とともにリボフラビンの使用を伴う。架橋結合は角膜の特性を変更し、その構造を強化する(81)。
摂取源
食物の摂取源
たいていの植物性および動物性食物は、少なくとも少量のリボフラビンを含む。米国では、1943年から小麦粉とパンにリボフラビン(およびチアミン、ナイアシン、鉄)が強化されてきた。大規模な食事調査からのデータでは、平均的リボフラビン摂取量は男性で約2 mg/日、女性で約1.5 mg/日であることが示され、どちらもRDAを優に上回っている。摂取量は年配の男女の集団でも同様であった(1)。リボフラビンは光に当たると簡単に破壊される。たとえば、透明なガラス瓶の牛乳に含まれるリボフラビンの最大50%は、眩しい日光に2時間当たると破壊されることがある(7)。リボフラビン含有量が多い食物とその含有量をミリグラム(mg)で表2に示す。食物の栄養素含有量についてのより詳細な情報は、USDAの食品成分データベースを検索のこと。
サプリメント
サプリメントとして入手可能な最も一般的な形態のリボフラビンは、リボフラビンおよび5'-一リン酸リボフラビンである。リボフラビンは、マルチビタミンおよびビタミンB複合体製剤に最も一般的に見られる(82)。
安全性
毒性
ヒトでのリボフラビン高摂取による毒性または有害作用は知られていない。培養細胞による研究で、発がん物質として知られているクロム(六価)があるとDNA鎖切断のリスクがリボフラビンの過剰によって高まるかもしれないことが示されている(83)。これはクロムにさらされる労働者には懸念であるかもしれないが、ヒトでのデータはない。高用量のリボフラビン療法は尿の色を明るい黄色に強める(フラビニュリア)ことがわかっているが、これは無害の副作用である。食品栄養委員会は1998年にRDAが改定された際に、許容上限摂取量(UL)を設定しなかった(1)。
薬物相互作用
高用量の経口避妊薬(OC)を摂取している女性はリボフラビンの栄養状態が低下していると初期のいくつかの報告があった。しかし研究者が食事性リボフラビン摂取に関して調整をした際には、OC使用者と非使用者に何の差も見つからなかった(1)。向精神薬のクロルプロマジンや三環系抗うつ薬のようなフェノチアジン誘導体は、抗マラリア薬のキナクリンやがんの化学療法薬であるアドリアマイシンと同様に、FADやFMNへのリボフラビンの取り込みを阻害する(4)。抗けいれん薬のフェノバルビタールの長期使用は、肝臓の酵素によるリボフラビンの破壊を増加して欠乏症リスクを上昇させるかもしれない(3)。また、慢性的アルコール摂取はリボフラビン欠乏症と関連付けられてきた。慢性的にアルコールを与えられたラットでは、リボフラビン輸送体の阻害によってビタミンの腸での吸収と腎臓での再吸収が損なわれた(84)。
ライナス・ポーリング研究所の推奨
ほとんどの者の欠乏症を予防するはずであるリボフラビンのRDA(男性で1.3 mg/日、女性で1.1 mg/日)は、様々な食事をすることで簡単に達成できる。様々な食事をすることで、一日に1.5 mgから2 mgのリボフラビンが摂取できる。一日摂取量(DV)を100%含むマルチビタミン/ミネラルのサプリメントを摂取するというライナス・ポーリング研究所の推奨に従えば、少なくとも1.7 mg/日のリボフラビン摂取が確実になる。
年配者(50歳超)
栄養と加齢の専門家の中には、RDA(男性で1.3 mg/日、女性で1.1 mg/日)は50歳超の者にとって余裕がほとんどないと感じる者もいる(85,86)。65~90歳で独立して生活する者の研究で、ほぼ25%の者がリボフラビンの推奨摂取量未満しか摂取せず、10%は欠乏症の生化学的証拠を示していたことがわかった(87)。白内障有病率の疫学的研究で、1.6~2.2 mg/日のリボフラビン摂取で加齢による白内障の発症リスクが下がるかもしれないことが示された。また、急性虚血性脳卒中を患う年配者はリボフラビンが不足していることがわかり(88)、リボフラビン欠乏症はMTHFR677T変異を持つ閉経後の女性の骨折リスクが高いことと関連付けられている(89)。食事に適切なリボフラビンが含まれていない者、特に50歳超の者は、マルチビタミン/ミネラルのサプリメント摂取を考慮すべきで、これによって少なくとも1.7 mg /日のリボフラビンが一般的に摂れる。
Authors and Reviewers
Originally written in 2000 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in September 2002 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in June 2007 by:
Victoria J. Drake, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in July 2013 by:
Barbara Delage, Ph.D.
Linus Pauling Institute
Oregon State University
Reviewed in December 2013 by:
Helene McNulty, Ph.D., R.D.
Professor of Human Nutrition and Dietetics
Northern Ireland Centre for Food and Health (NICHE)
University of Ulster
Coleraine, United Kingdom
Reviewed in December 2013 by:
Adrian McCann, Ph.D.
Research Associate
Northern Ireland Centre for Food and Health (NICHE)
University of Ulster
Coleraine, United Kingdom
Copyright 2000-2023 Linus Pauling Institute
References
1. Food and Nutrition Board, Institute of Medicine. Riboflavin. Dietary Reference Intakes: Thiamin, Riboflavin, Niacin, Vitamin B6, Vitamin B12, Pantothenic Acid, Biotin, and Choline. Washington D.C.: National Academy Press; 1998:87-122. (National Academy Press)
2. Brody T. Nutritional Biochemistry. 2nd ed. San Diego: Academic Press; 1999.
3. McCormick DB. Riboflavin. In: Shils M, Olson JA, Shike M, Ross AC, eds. Modern Nutrition in Health and Disease. 9th ed. Baltimore: Williams & Wilkins; 1999:391-399.
4. Powers HJ. Current knowledge concerning optimum nutritional status of riboflavin, niacin and pyridoxine. Proc Nutr Soc. 1999;58(2):435-440. (PubMed)
5. Rivlin RS. Riboflavin. In: Ziegler EE, Filer LJ, eds. Present Knowledge in Nutrition. 7th ed. Washington D.C.: ILSI Press; 1996:167-173.
6. Hoey L, McNulty H, Strain JJ. Studies of biomarker responses to intervention with riboflavin: a systematic review. Am J Clin Nutr. 2009;89(6):1960S-1980S. (PubMed)
7. Bohles H. Antioxidative vitamins in prematurely and maturely born infants. Int J Vitam Nutr Res. 1997;67(5):321-328. (PubMed)
8. McCormick DB. Two interconnected B vitamins: riboflavin and pyridoxine. Physiol Rev. 1989;69(4):1170-1198. (PubMed)
9. Madigan SM, Tracey F, McNulty H, et al. Riboflavin and vitamin B-6 intakes and status and biochemical response to riboflavin supplementation in free-living elderly people. Am J Clin Nutr. 1998;68(2):389-395. (PubMed)
10. Lowik MR, van den Berg H, Kistemaker C, Brants HA, Brussaard JH. Interrelationships between riboflavin and vitamin B6 among elderly people (Dutch Nutrition Surveillance System). Int J Vitam Nutr Res. 1994;64(3):198-203. (PubMed)
11. Jacques PF, Bostom AG, Wilson PW, Rich S, Rosenberg IH, Selhub J. Determinants of plasma total homocysteine concentration in the Framingham Offspring cohort. Am J Clin Nutr. 2001;73(3):613-621. (PubMed)
12. Jacques PF, Kalmbach R, Bagley PJ, et al. The relationship between riboflavin and plasma total homocysteine in the Framingham Offspring cohort is influenced by folate status and the C677T transition in the methylenetetrahydrofolate reductase gene. J Nutr. 2002;132(2):283-288. (PubMed)
13. Powers HJ, Weaver LT, Austin S, Beresford JK. A proposed intestinal mechanism for the effect of riboflavin deficiency on iron loss in the rat. Br J Nutr. 1993;69(2):553-561. (PubMed)
14. Powers HJ, Hill MH, Mushtaq S, Dainty JR, Majsak-Newman G, Williams EA. Correcting a marginal riboflavin deficiency improves hematologic status in young women in the United Kingdom (RIBOFEM). Am J Clin Nutr. 2011;93(6):1274-1284. (PubMed)
15. Powers HJ. Riboflavin-iron interactions with particular emphasis on the gastrointestinal tract. Proc Nutr Soc. 1995;54(2):509-517. (PubMed)
16. Kalaivani K. Prevalence & consequences of anaemia in pregnancy. Indian J Med Res. 2009;130(5):627-633. (PubMed)
17. Worldwide prevalence of anaemia 1993-2005: WHO global database on anaemia. de Benoist B, McLean E, Egli I, Cogswell M, eds. 2008; World Health Organization Press. Available at: http://www.who.int/nutrition/publications/
micronutrients/anaemia_iron_deficiency/9789241596657/en/. Accessed 7/22/13.
18. Pena-Rosas JP, Viteri FE. Effects of routine oral iron supplementation with or without folic acid for women during pregnancy. Cochrane Database Syst Rev. 2006(3):CD004736. (PubMed)
19. Suprapto B, Widardo, Suhanantyo. Effect of low-dosage vitamin A and riboflavin on iron-folate supplementation in anaemic pregnant women. Asia Pac J Clin Nutr. 2002;11(4):263-267. (PubMed)
20. Ma AG, Schouten EG, Zhang FZ, et al. Retinol and riboflavin supplementation decreases the prevalence of anemia in Chinese pregnant women taking iron and folic Acid supplements. J Nutr. 2008;138(10):1946-1950. (PubMed)
21. Crombleholme WR. Obstetrics. In: Tierney LM, McPhee SJ, Papadakis MA, eds. Current Medical Treatment and Diagnosis. 37th ed. Stamford: Appleton and Lange; 1998:731-734.
22. Wacker J, Fruhauf J, Schulz M, Chiwora FM, Volz J, Becker K. Riboflavin deficiency and preeclampsia. Obstet Gynecol. 2000;96(1):38-44. (PubMed)
23. Wang XM, Wu HY, Qiu XJ. Methylenetetrahydrofolate reductase (MTHFR) gene C677T polymorphism and risk of preeclampsia: an updated meta-analysis based on 51 studies. Arch Med Res. 2013;44(3):159-168. (PubMed)
24. Xia XP, Chang WW, Cao YX. Meta-analysis of the methylenetetrahydrofolate reductase C677T polymorphism and susceptibility to pre-eclampsia. Hypertens Res. 2012;35(12):1129-1134. (PubMed)
25. Braekke K, Ueland PM, Harsem NK, Karlsen A, Blomhoff R, Staff AC. Homocysteine, cysteine, and related metabolites in maternal and fetal plasma in preeclampsia. Pediatr Res. 2007;62(3):319-324. (PubMed)
26. Neugebauer J, Zanre Y, Wacker J. Riboflavin supplementation and preeclampsia. Int J Gynaecol Obstet. 2006;93(2):136-137. (PubMed)
27. Heese P, Linnebank M, Semmler A, et al. Alterations of homocysteine serum levels during alcohol withdrawal are influenced by folate and riboflavin: results from the German Investigation on Neurobiology in Alcoholism (GINA). Alcohol Alcohol. 2012;47(5):497-500. (PubMed)
28. Soares MJ, Satyanarayana K, Bamji MS, Jacob CM, Ramana YV, Rao SS. The effect of exercise on the riboflavin status of adult men. Br J Nutr. 1993;69(2):541-551. (PubMed)
29. Ruston D, Hoare J, Henderson L, et al. The National Diet & Nutrition Survey: adults aged 19 to 64 years: Nutritional status (anthropometry and blood analytes), blood pressure and physical activity. Volume 4. London: The Stationary Office; 2004.
30. Mares-Perlman JA, Brady WE, Klein BE, et al. Diet and nuclear lens opacities. Am J Epidemiol. 1995;141(4):322-334. (PubMed)
31. Leske MC, Wu SY, Hyman L, et al. Biochemical factors in the lens opacities. Case-control study. The Lens Opacities Case-Control Study Group. Arch Ophthalmol. 1995;113(9):1113-1119. (PubMed)
32. Cumming RG, Mitchell P, Smith W. Diet and cataract: the Blue Mountains Eye Study. Ophthalmology. 2000;107(3):450-456. (PubMed)
33. Hankinson SE, Stampfer MJ, Seddon JM, et al. Nutrient intake and cataract extraction in women: a prospective study. BMJ. 1992;305(6849):335-339. (PubMed)
34. Jacques PF, Taylor A, Moeller S, et al. Long-term nutrient intake and 5-year change in nuclear lens opacities. Arch Ophthalmol. 2005;123(4):517-526. (PubMed)
35. McNulty H, Strain JJ, Pentieva K, Ward M. C(1) metabolism and CVD outcomes in older adults. Proc Nutr Soc. 2012;71(2):213-221. (PubMed)
36. Holmes MV, Newcombe P, Hubacek JA, et al. Effect modification by population dietary folate on the association between MTHFR genotype, homocysteine, and stroke risk: a meta-analysis of genetic studies and randomised trials. Lancet. 2011;378(9791):584-594. (PubMed)
37. Wilcken B, Bamforth F, Li Z, et al. Geographical and ethnic variation of the 677C>T allele of 5,10 methylenetetrahydrofolate reductase (MTHFR): findings from over 7000 newborns from 16 areas world wide. J Med Genet. 2003;40(8):619-625. (PubMed)
38. McGlynn AP, Wasson GR, O'Reilly SL, et al. Low colonocyte folate is associated with uracil misincorporation and global DNA hypomethylation in human colorectum. J Nutr. 2013;143(1):27-33. (PubMed)
39. Guenther BD, Sheppard CA, Tran P, Rozen R, Matthews RG, Ludwig ML. The structure and properties of methylenetetrahydrofolate reductase from Escherichia coli suggest how folate ameliorates human hyperhomocysteinemia. Nat Struct Biol. 1999;6(4):359-365. (PubMed)
40. Yin G, Ming H, Zheng X, Xuan Y, Liang J, Jin X. Methylenetetrahydrofolate reductase C677T gene polymorphism and colorectal cancer risk: A case-control study. Oncol Lett. 2012;4(2):365-369. (PubMed)
41. Gao S, Ding LH, Wang JW, Li CB, Wang ZY. Diet folate, DNA methylation and polymorphisms in methylenetetrahydrofolate reductase in association with the susceptibility to gastric cancer. Asian Pac J Cancer Prev. 2013;14(1):299-302. (PubMed)
42. Wen YY, Yang SJ, Zhang JX, Chen XY. Methylenetetrahydrofolate reductase genetic polymorphisms and esophageal squamous cell carcinoma susceptibility: a meta-analysis of case-control studies. Asian Pac J Cancer Prev. 2013;14(1):21-25. (PubMed)
43. Powers HJ, Hill MH, Welfare M, et al. Responses of biomarkers of folate and riboflavin status to folate and riboflavin supplementation in healthy and colorectal polyp patients (the FAB2 Study). Cancer Epidemiol Biomarkers Prev. 2007;16(10):2128-2135. (PubMed)
44. Zschabitz S, Cheng TY, Neuhouser ML, et al. B vitamin intakes and incidence of colorectal cancer: results from the Women's Health Initiative Observational Study cohort. Am J Clin Nutr. 2013;97(2):332-343. (PubMed)
45. Kennedy DA, Stern SJ, Matok I, et al. Folate Intake, MTHFR Polymorphisms, and the Risk of Colorectal Cancer: A Systematic Review and Meta-Analysis. J Cancer Epidemiol. 2012:952508. doi: 10.1155/2012/952508. (PubMed)
46. He Y, Ye L, Shan B, Song G, Meng F, Wang S. Effect of riboflavin-fortified salt nutrition intervention on esophageal squamous cell carcinoma in a high incidence area, China. Asian Pac J Cancer Prev. 2009;10(4):619-622. (PubMed)
47. Bassett JK, Hodge AM, English DR, et al. Dietary intake of B vitamins and methionine and risk of lung cancer. Eur J Clin Nutr. 2012;66(2):182-187. (PubMed)
48. Bassett JK, Baglietto L, Hodge AM, et al. Dietary intake of B vitamins and methionine and breast cancer risk. Cancer Causes Control. 2013;24(8):1555-1563. (PubMed)
49. Bassett JK, Severi G, Hodge AM, et al. Dietary intake of B vitamins and methionine and prostate cancer incidence and mortality. Cancer Causes Control. 2012;23(6):855-863. (PubMed)
50. Qiao YL, Dawsey SM, Kamangar F, et al. Total and cancer mortality after supplementation with vitamins and minerals: follow-up of the Linxian General Population Nutrition Intervention Trial. J Natl Cancer Inst. 2009;101(7):507-518. (PubMed)
51. Schoenen J, Jacquy J, Lenaerts M. Effectiveness of high-dose riboflavin in migraine prophylaxis. A randomized controlled trial. Neurology. 1998;50(2):466-470. (PubMed)
52. Sandor PS, Afra J, Ambrosini A, Schoenen J. Prophylactic treatment of migraine with β-blockers and riboflavin: differential effects on the intensity dependence of auditory evoked cortical potentials. Headache. 2000;40(1):30-35. (PubMed)
53. Boehnke C, Reuter U, Flach U, Schuh-Hofer S, Einhaupl KM, Arnold G. High-dose riboflavin treatment is efficacious in migraine prophylaxis: an open study in a tertiary care centre. Eur J Neurol. 2004;11(7):475-477. (PubMed)
54. Maizels M, Blumenfeld A, Burchette R. A combination of riboflavin, magnesium, and feverfew for migraine prophylaxis: a randomized trial. Headache. 2004;44(9):885-890. (PubMed)
55. MacLennan SC, Wade FM, Forrest KM, Ratanayake PD, Fagan E, Antony J. High-dose riboflavin for migraine prophylaxis in children: a double-blind, randomized, placebo-controlled trial. J Child Neurol. 2008;23(11):1300-1304. (PubMed)
56. Bruijn J, Duivenvoorden H, Passchier J, Locher H, Dijkstra N, Arts WF. Medium-dose riboflavin as a prophylactic agent in children with migraine: a preliminary placebo-controlled, randomised, double-blind, cross-over trial. Cephalalgia. 2010;30(12):1426-1434. (PubMed)
57. Cotelli MS, Vielmi V, Rimoldi M, et al. Riboflavin-responsive multiple acyl-CoA dehydrogenase deficiency with unknown genetic defect. Neurol Sci. 2012;33(6):1383-1387. (PubMed)
58. Olsen RK, Olpin SE, Andresen BS, et al. ETFDH mutations as a major cause of riboflavin-responsive multiple acyl-CoA dehydrogenation deficiency. Brain. 2007;130(Pt 8):2045-2054. (PubMed)
59. Liang WC, Ohkuma A, Hayashi YK, et al. ETFDH mutations, CoQ10 levels, and respiratory chain activities in patients with riboflavin-responsive multiple acyl-CoA dehydrogenase deficiency. Neuromuscul Disord. 2009;19(3):212-216. (PubMed)
60. Haack TB, Danhauser K, Haberberger B, et al. Exome sequencing identifies ACAD9 mutations as a cause of complex I deficiency. Nat Genet. 2010;42(12):1131-1134. (PubMed)
61. Nouws J, Nijtmans L, Houten SM, et al. Acyl-CoA dehydrogenase 9 is required for the biogenesis of oxidative phosphorylation complex I. Cell Metab. 2010;12(3):283-294. (PubMed)
62. Scholte HR, Busch HF, Bakker HD, Bogaard JM, Luyt-Houwen IE, Kuyt LP. Riboflavin-responsive complex I deficiency. Biochim Biophys Acta. 1995;1271(1):75-83. (PubMed)
63. Gerards M, van den Bosch BJ, Danhauser K, et al. Riboflavin-responsive oxidative phosphorylation complex I deficiency caused by defective ACAD9: new function for an old gene. Brain. 2011;134(Pt 1):210-219. (PubMed)
64. Garone C, Donati MA, Sacchini M, et al. Mitochondrial Encephalomyopathy Due to a Novel Mutation in ACAD9. JAMA Neurol. 2013:1-3. (PubMed)
65. Chiong MA, Sim KG, Carpenter K, et al. Transient multiple acyl-CoA dehydrogenation deficiency in a newborn female caused by maternal riboflavin deficiency. Mol Genet Metab. 2007;92(1-2):109-114. (PubMed)
66. Ho G, Yonezawa A, Masuda S, et al. Maternal riboflavin deficiency, resulting in transient neonatal-onset glutaric aciduria Type 2, is caused by a microdeletion in the riboflavin transporter gene GPR172B. Hum Mutat. 2011;32(1):E1976-1984. (PubMed)
67. Bosch AM, Stroek K, Abeling NG, Waterham HR, Ijlst L, Wanders RJ. The Brown-Vialetto-Van Laere and Fazio Londe syndrome revisited: natural history, genetics, treatment and future perspectives. Orphanet J Rare Dis. 2012;7:83. doi: 10.1186/1750-1172-7-83. (PubMed)
68. Mackay RJ, McEntyre CJ, Henderson C, Lever M, George PM. Trimethylaminuria: causes and diagnosis of a socially distressing condition. Clin Biochem Rev. 2011;32(1):33-43. (PubMed)
69. Phillips IR, Shephard EA. Trimethylaminuria. 2007 Oct 8 (Updated 2011 Apr 19). In: Pagon RA, Adam MP, Bird TD, et al., editors. GeneReviews™ (Internet). Seattle: University of Washington, Seattle; 1993-2013. Available at: http://www.ncbi.nlm.nih.gov/books/NBK1103/.
70. Manning NJ, Allen EK, Kirk RJ, Sharrard MJ, Smith EJ. Riboflavin-responsive trimethylaminuria in a patient with homocystinuria on betaine therapy. JIMD Rep. 2012;5:71-75. (PubMed)
71. Niu WQ, You YG, Qi Y. Strong association of methylenetetrahydrofolate reductase gene C677T polymorphism with hypertension and hypertension-in-pregnancy in Chinese: a meta-analysis. J Hum Hypertens. 2012;26(4):259-267. (PubMed)
72. Almawi WY, Khan A, Al-Othman SS, Bakhiet M. Case-control Study of methylenetetrahydrofolate reductase mutations and hyperhomocysteinemia and risk of stroke. J Stroke Cerebrovasc Dis. 2009;18(5):407-408. (PubMed)
73. Heux S, Morin F, Lea RA, Ovcaric M, Tajouri L, Griffiths LR. The methylentetrahydrofolate reductase gene variant (C677T) as a risk factor for essential hypertension in Caucasians. Hypertens Res. 2004;27(9):663-667. (PubMed)
74. Klerk M, Verhoef P, Clarke R, et al. MTHFR 677C→T polymorphism and risk of coronary heart disease: a meta-analysis. JAMA. 2002;288(16):2023-2031. (PubMed)
75. McNulty H, Dowey le RC, Strain JJ, et al. Riboflavin lowers homocysteine in individuals homozygous for the MTHFR 677C→T polymorphism. Circulation. 2006;113(1):74-80. (PubMed)
76. Horigan G, McNulty H, Ward M, Strain JJ, Purvis J, Scott JM. Riboflavin lowers blood pressure in cardiovascular disease patients homozygous for the 677C→T polymorphism in MTHFR. J Hypertens. 2010;28(3):478-486. (PubMed)
77. Wilson CP, Ward M, McNulty H, et al. Riboflavin offers a targeted strategy for managing hypertension in patients with the MTHFR 677TT genotype: a 4-y follow-up. Am J Clin Nutr. 2012;95(3):766-772. (PubMed)
78. Wilson CP, McNulty H, Ward M, et al. Blood pressure in treated hypertensive individuals with the MTHFR 677TT genotype is responsive to intervention with riboflavin: findings of a targeted randomized trial. Hypertension. 2013;61(6):1302-1308. (PubMed)
79. Yuvaraj S, Premkumar VG, Vijayasarathy K, Gangadaran SG, Sachdanandam P. Augmented antioxidant status in Tamoxifen treated postmenopausal women with breast cancer on co-administration with Coenzyme Q10, Niacin and Riboflavin. Cancer Chemother Pharmacol. 2008;61(6):933-941. (PubMed)
80. Hassan I, Chibber S, Khan AA, Naseem I. Riboflavin ameliorates cisplatin induced toxicities under photoillumination. PLoS One. 2012;7(5):e36273. (PubMed)
81. Raiskup F, Spoerl E. Corneal crosslinking with riboflavin and ultraviolet A. I. Principles. Ocul Surf. 2013;11(2):65-74. (PubMed)
82. Hendler SS, Rorvik DR, eds. PDR for Nutritional Supplements. Montvale: Medical Economics Company, Inc; 2001.
83. Sugiyama M. Role of physiological antioxidants in chromium(VI)-induced cellular injury. Free Radic Biol Med. 1992;12(5):397-407. (PubMed)
84. Subramanian VS, Subramanya SB, Ghosal A, Said HM. Chronic alcohol feeding inhibits physiological and molecular parameters of intestinal and renal riboflavin transport. Am J Physiol Cell Physiol. 2013; 305(5):C539-C546. (PubMed)
85. Russell RM, Suter PM. Vitamin requirements of elderly people: an update. Am J Clin Nutr. 1993;58(1):4-14. (PubMed)
86. Blumberg J. Nutritional needs of seniors. J Am Coll Nutr. 1997;16(6):517-523. (PubMed)
87. Lopez-Sobaler AM, Ortega RM, Quintas ME, et al. The influence of vitamin B2 intake on the activation coefficient of erythrocyte glutation reductase in the elderly. J Nutr Health Aging. 2002;6(1):60-62. (PubMed)
88. Gariballa S, Ullegaddi R. Riboflavin status in acute ischaemic stroke. Eur J Clin Nutr. 2007;61(10):1237-1240. (PubMed)
89. Yazdanpanah N, Uitterlinden AG, Zillikens MC, et al. Low dietary riboflavin but not folate predicts increased fracture risk in postmenopausal women homozygous for the MTHFR 677 T allele. J Bone Miner Res. 2008;23(1):86-94. (PubMed)
ミネラル
カルシウム
目次
カルシウムは,人体内で最も一般的なミネラルである。体内のカルシウムの約99%が骨と歯に存在し,残りの1%が血液と軟質組織に認められる。血液中及び細胞周辺の体液(細胞外液)中のカルシウムは,正常な生理機能のために極めて狭い範囲内に維持されなければならない。カルシウムの生理学的機能は,生命維持に極めて重要であるため,カルシウム摂取量が不足すると,生体は,正常な血液中のカルシウムレベルを維持するために骨の脱ミネラル化を行う。そのため,適正な食事からのカルシウムが,健康な骨組織を維持するにあたって極めて重要な要素である (1)。
機能
構造
カルシウムは,骨と歯において主要な構成元素である。骨のミネラル成分は,主としてカルシウムとリンを大量に含むヒドロキシアパタイト [Ca10(PO4)6(OH)2]結晶で構成される (2)。骨は,生涯を通して再構築される動的な組織である。破骨細胞と呼ばれる骨細胞が,骨を溶解または再吸収することによって,再構築プロセスを開始する。それから骨芽細胞(造骨細胞)と呼ばれる骨形成細胞が,新たな骨を合成し再吸収された骨と置き換わる。正常な成長では,骨形成が骨吸収を凌駕する。骨粗鬆症は,骨吸収が慢性的に骨形成を上回るときに起こる (1)。
細胞のシグナル伝達
カルシウムは,血管の収縮と弛緩(血管収縮と血管拡張),神経インパルス伝達,筋肉収縮,及びインスリンなどのホルモン分泌を媒介する役割を持つ (3)。骨格筋や神経細胞のような興奮性細胞は,細胞膜中にカルシウム濃度を速やかに変化させる電位依存性のカルシウムチャンネルを持っている。例えば,筋繊維が収縮するよう刺激する神経インパルスを受けると,細胞膜内のカルシウムチャンネルが開口し,少量のカルシウムイオンを筋肉細胞へ送る。これらのカルシウムイオンは細胞内の活性タンパク質と結合し,細胞内部の貯蔵小胞からカルシウムイオン流を放出する。カルシウムとタンパク質,トロポニン-C,との結合が,筋肉を収縮させる一連のステップを開始する。カルシウムとタンパク質,カルモジュリン,との結合が,筋肉収縮のエネルギーを供給するために筋肉グリコーゲンを分解する酵素を活性化する (1)。
酵素及びタンパク質の補酵素
カルシウムは,多くのタンパク質と酵素を安定化させ,それらの活性を最適化するのに必要である。血液凝固カスケードにおける7つの「ビタミンK依存性」凝固因子を活性化するために,カルシウムイオンとの結合が必要とされる(「ビタミンK」参照)。「血液凝固カスケード」という用語は,一連のイベントをさし,それぞれが,凝血形成により出血を止める他の反応に依存する (4)。
カルシウムレベルの調整
細胞を取り巻く血液や体液中のカルシウム濃度は,正常な生理機能を維持するために堅固に制御されている(図)。血液中のカルシウムが減少すると(すなわちカルシウム摂取量が不足した場合),副甲状腺(上皮小体)内のカルシウム感知タンパク質がシグナルを送り,副甲状腺ホルモン(PTH)を分泌させる (5)。PTHは,腎臓中でビタミンDを活性型のカルシトリオールへ変換する。カルシトリオールは,小腸からのカルシウム吸収を増加させる。PTHとともに,カルシトリオールは,破骨細胞(骨を再吸収する細胞)を活性化させ骨からのカルシウム放出を刺激し,腎臓における再吸収を増加させることにより,カルシウムの尿からの排泄を減少させる。血液中のカルシウムが正常レベルに上昇したとき,副甲状腺がPTH分泌を中止し,腎臓は過剰のカルシウムを尿中へ排泄し始める。この複雑なシステムは血中カルシウムの速やかで堅固な調節を可能とするが,骨格の消費でもある (1)。
欠乏症
血中カルシウムが低い状態は,副甲状腺機能の異常を意味し,骨格が正常な血中レベルを維持するためにカルシウムを多量に供給するため,食事からのカルシウム摂取量が低いときまれに起こる。異常に血中カルシウムが低い状態の他の原因は,慢性の腎臓疾患,ビタミンD欠乏及び主として重度のアルコール中毒症の場合に起こる血中マグネシウムの欠乏である。マグネシウム欠乏は,破骨細胞のPTHに対する応答性の低下を起こす。成長期の人の慢性的なカルシウム摂取不足は,最適なピーク骨量の達成を妨害する可能性がある。一度ピーク骨量が達成されると,カルシウム摂取量不足は,骨量減少を加速し,最終的に骨粗鬆症の発症に関係してくる可能性がある(「疾病予防」参照)(1)。
栄養成分との相互作用
ビタミンD
ビタミンDは最適なカルシウム吸収に必要である(「機能」または「ビタミンD」参照)。いくつかの他の栄養成分(及び非栄養成分)は,体内のカルシウム保持に影響を及ぼしカルシウムの栄養状態に影響する可能性がある。
ナトリウム
高いナトリウム摂取量は,おそらく腎臓での再吸収の際のナトリウムとカルシウムの拮抗によるか,あるいは副甲状腺ホルモン(PTH)分泌に及ぼすナトリウムの影響によって,尿からのカルシウム消失を増加させる。腎臓により排泄される2.3 gのナトリウムの増加(NaClとして6 g)が,カルシウムの約24~40 mgを尿へ導くことが認められている。尿からの消失が個人間のカルシウム保持の約半分の差に相当するため,食事からのナトリウム摂取は,骨量減少に大きく影響する可能性がある。成人女性において,一日の消費されるナトリウムの余剰のグラム当たり,カルシウム消失が全て骨から由来すると仮定して,1年で1%の骨の消失率に追加されると考えられている。動物実験では,骨量減少が,食塩摂取量が高くなるにつれ大きくなることが示されているが,人における食塩摂取量と骨の消失との間の相関を確認するための管理された臨床試験は実施されたことがない (1,6)。しかしながら,閉経後女性による2年間の研究において,尿中ナトリウムの排泄量の増加が(ナトリウム摂取量増加の指標),腰部の骨ミネラル密度(BMD)の減少と相関することが認められている (7)。さらに,40人の閉経後女性についての縦断研究(経年的研究)から,6ヵ月間の低ナトリウムの食事(2 g/日)を堅持することが,ナトリウム排泄,カルシウム排泄及び骨吸収のバイオマーカーであるI型コラーゲンのアミノ末端プロペプチドを有意に低減させることと相関がみられた。しかしながら,これらの相関は,試験開始時の尿中ナトリウム排泄量が,3.4 g/日以上(すなわち米国成人の平均ナトリウム摂取量)である女性にだけ認められた (8)。尿中のナトリウムとカルシウムの排泄と保持についての食事からのナトリウムの影響における人種間の差が,思春期の女子で報告されている。白人の女子は高い食塩食事で余分なナトリウムを排泄するが,黒人の女子はプラスのナトリウムバランスへ向かっており,それは白人の女子と比較して尿中のカルシウム消失が低い結果によるものであった (9)。
タンパク質
食事からのタンパク質摂取量が増えると,カルシウムの尿中排泄量も増加する。米国人の推奨カルシウム摂取量は,米国人のタンパク摂取量が概して高いため,比較的工業化されていない国々の人より高くなる。タンパク質のRDA(推奨栄養所要量)は,成人女性で46 g/日,成人男性56 g/日であるが,米国におけるタンパク質の平均摂取量は高い傾向にある(成人女性65~70 g/日,成人男性90~110 g/日)(3)。最近,全体のカルシウム収支は,カルシウム吸収の変化を相殺することにより,食事からのタンパク質により影響を受けることが確認されなかった (10)。タンパク質の摂取不足は,骨粗鬆症関連骨折からの回復の遅さと相関が認められ,血清中アルブミンの値(タンパク質栄養状態の指標)が,股関節骨折リスクと逆相関することが認められた (3)。
リン
タンパク質が多い食品には一般的に認められるリンは,尿中のカルシウム排泄を減少させる傾向がある。しかしながら,リンの多い食品は,消化排泄されるカルシウム含量を増加させ,便中のカルシウム消失を増加させる傾向にもある。従って,リンは,タンパク質摂取増加に関連するカルシウム消失の全量を相殺しない (1)。ソフトドリンクと食品添加物からのリン酸塩摂取量の増加は,骨の健康についての意義に関して,いくつかの研究者から懸念を生じさせている。リンが多くカルシウムが少ない食事は,カルシウムが低くなるにつれ,副甲状腺ホルモン(PTH)分泌を増加させることが認められた (3,6)。カルシウムバランスと骨の健康に及ぼすリンの高摂取の影響は,現在のところ不明ではあるが,牛乳や他の食事からのカルシウム供給源を多量のソフトドリンクへ変えることは,青少年や成人における骨の健康に関する懸念を起こす。
カフェイン
多量のカフェインは,短時間で尿中カルシウム含量を増加させる。一方,400 mg/日のカフェイン摂取量は,閉経後女性において24時間内の尿中カルシウム排泄を,対照群と比較し有意に変化させなかった (11)。一つの観察研究から,カルシウムを744 mg/日以下摂取する閉経後女性において,骨量減少の加速が認められ,彼女らはコーヒーを2~3杯/日飲むと報告されたが (12),カフェイン摂取量を測定したその後の研究では,閉経後女性において,カフェイン摂取量と骨量減少との間に何の相関も認められなかった (13)。平均して,8オンスカップ1杯のコーヒーは,わずか2~3 mgのカルシウム保持を減少させるだけである (1)。
推奨栄養所要量(RDA)
骨の健康の最適性に基づく最新の推奨カルシウム摂取量が,2010年に米国医薬品協会の食品栄養委員会(FNB)から発表された。カルシウムの推奨栄養所要量(RDA)を,ライフステージと性別により下表に示した。
疾病の予防
大腸癌
大腸癌は,最も一般的な胃腸器官のがんで,米国における第二位のがんによる死因である。大腸癌は,遺伝的要因と環境要因が組み合わさって起こり,これら2つの要因が人の結腸癌リスクに影響を及ぼす程度は大きく異なる。家族性大腸腺腫症を持つ人々において,結腸癌の原因は,ほぼ完全に遺伝性と考えられているが,食事要因も他の種類の結腸癌リスクに影響すると考えられる。動物実験からは,腸癌を予防するのにカルシウムが保護的な役割をすることが強く裏づけされている (14)。人における管理された臨床試験で,直腸結腸腺癌(前がん性ポリープ)の穏やかな減少が,カルシウムの1,200~2,000 mg/日補給によって確認され (15,16),その後の研究から,介入終了後5年間まで予防効果が続くことが認められた (17)。564,536人の男女が関与した10例の前向きコホート研究のメタアナリシスで,カルシウム摂取量(食品からの)の最大5分位の人が,最小5分位の人より大腸癌リスクが14%低いことが認められた。食事からのカルシウム摂取量は10例のコホートで674~1,051 mg/日の範囲であった (18)。このメタアナリシスにおいて,総カルシウム摂取量(食品とサプリメントから)が最大5分位の被験者は,大腸癌リスクが22%低かった。調査された研究の一日総カルシウム摂取量は732~1,087 mgであった。一方,大部分の前向き研究は,個々には,カルシウム摂取量増加が,大腸癌リスク減少にわずかに弱い相関があると報告されている。これらの弱い相関は,カルシウムに対する応答が異なる群が集団内に存在することにより説明できるかもしれない。例えば,インスリン様成長因子-1(IGF-1)の循環レベルが高い人は,大腸癌リスクが高く,カルシウム摂取量増加が,この亜群では他の群以上に効果があるという証拠がいくつかある。511人の男性による症例-対照研究では,カルシウム摂取量の増加が,IGF-1の循環レベルの高い人で大腸癌リスク減少とより強く相関が認められた (19)。結論を導く前に,大規模集団内の特定亜集団が,大腸癌リスク低下に関して,異なるカルシウム必要量を有するかどうか解明するために,さらに多くの研究が必要である。
骨粗鬆症
骨粗鬆症は,骨の強度が損なわれる骨格障害で,骨折のリスクを高めることになる。股関節骨折を招くことが,骨粗鬆症の最も深刻な結果である。骨粗鬆性の股関節骨折を招く人のほぼ1/3は,骨折後,年内に老人ホームに入居し,1年以内に骨粗鬆性股関節骨折を経験した人の5人に1人が死亡する。骨粗鬆症は,白人の閉経後女性で最も多く診断されるが,他の人種や年齢群の女性,男性及び子供も骨粗鬆症を発症する可能性はある (20)。
骨粗鬆症は多因子性の障害であり,栄養が,その発症と進行に関係する唯一の因子である(2)。骨粗鬆症を発症するリスクを高くする他の因子は,これだけとは限らないが,加齢,女性,エストロゲン欠乏,喫煙,代謝疾患(甲状腺機能亢進症など)及び特定治療薬(コルチコステロイド,抗痙攣薬など)の使用である。骨粗鬆症関連骨折の素因は,その人のピーク骨量とピーク骨量に到達した後の骨量減少率と関連している。成人の身長に達した後,骨格は,人生の30年まで骨の蓄積を続ける。ピーク骨量に遺伝的要因が強く影響するが,生活習慣の要素も有意な役割を果たす可能性がある。骨粗鬆症性の骨折リスクを低減する方法には,最大のピーク骨量の達成と人生後期での骨量減少を少なくすることである。カルシウムは,ピーク骨量を達成し骨粗鬆症を予防するために最も重要な栄養成分であることは一致して確認されているが,適正なビタミンD摂取量も,最適なカルシウム吸収に必要である (20)。
運動が,骨粗鬆症と骨粗鬆症性骨折を予防するために有効なもう一つの生活習慣要素である。人生初期の運動が,より高いピーク骨量の達成に寄与することを示唆するエビデンスがある。適正なカルシウムとビタミンDの摂取量の下での運動は,おそらく人生後期の骨量減少率を遅くするのに適度な効果がある。公表されたカルシウムの試験の1つの編集物では,運動増加による骨格への有用な効果が,1,000 mg/日以上のカルシウム摂取量においてのみ達成可能であることが示唆された (21)。骨量減少を予防するため,高衝撃性の運動や抵抗運動(ウェイト)が,最も有効と考えられる。歩行,水泳及びサイクリングのような比較的低衝撃性の運動は,健康や機能の他の面で有効であるが,骨量減少についての効果は少ない。しかしながら,人生後期の運動は,90歳を超えても,なお骨の強度を高め,別の股関節骨折の重要なリスク因子である転倒の可能性を低下させる (20)。カルシウムサプリメントだけでは,骨粗鬆症の人では,減少骨量の回復は通常できない。しかしながら,いかなる薬物治療を用いた骨粗鬆症の最適な治療でも,カルシウム(1,200 mg/日)とビタミンD(600 IU/日)の適正な摂取量を必要とする (2,20)。骨粗鬆症についての追加情報は,国立骨粗鬆症基金のウェブサイト参照。
腎臓結石
米国人の約12%が,何らかのときに腎臓結石になる。ほとんどの腎臓結石は,シュウ酸カルシウムかリン酸カルシウムからなる。その原因は通常不明であるが,異常に高い尿中カルシウム(高カルシウム尿症)が,カルシウム結石の発症リスクを増加させる。食事からのカルシウム増加は尿中カルシウムを少し増加させ,この上昇は高カルシウム尿症患者でより顕著である。しかしながら,ナトリウムやタンパク質のような他の食事要因も,尿中カルシウムを増加させることが知られている (22,23)。12年間男性を追跡した大規模な前向き研究から,症状のある腎臓結石の発症率が,カルシウム摂取量が平均1,326 mg/日である最大5分位(1/5)の男性で,平均516 mg/日である最小5分位の男性と比較して44%低かった (24)。女性を12年間追跡した大規模な前向き研究でも同様の結果が得られた (25)。14年間男性を追跡した研究から,カルシウム摂取量が,60歳以下の人で腎臓結石リスク低下と相関し,60歳以上の男性では相関がないと報告された (26)。さらに,96,245人の27~44歳の比較的若い女性コホートにおける前向き研究において,高いカルシウム摂取量は腎臓結石のリスク低下と相関が認められた (27)。これら2つの試験の著者らは,食事からのカルシウム増加が,シュウ酸カルシウム結石のリスク因子である食事からのシュウ酸の吸収を阻害し,尿中シュウ酸塩を低減させる可能性があると示唆した。この概念の裏づけは,カルシウム補給の有る無しによるシュウ酸塩吸収を調査した試験に由来する (28)。カルシウム元素相当200 mgをシュウ酸塩とともに供給すると,シュウ酸塩の吸収と排泄の両方が有意に低減された。
カルシウム結石の形成者は,これまではカルシウム摂取量を制限するよう助言されていたが,シュウ酸カルシウム結石患者282人による症例-対照研究からは,尿中ナトリウム排泄量を測定したときに,食事からの食塩が尿中カルシウム排泄と最も強く相関する食事要因であることが認められた (29)。カルシウム結石を生成している患者85人の研究において,骨ミネラル密度の低い人が,高い食塩摂取量と高い尿中ナトリウム排泄量であることが認められ,このことから,著者らは,食塩摂取量を減らすことを,カルシウム結石生成患者に推奨すべきであると提案した (30)。カルシウム摂取量が低いカルシウム結石形成患者の骨ミネラル密度が低くなる可能性を示すという結果は,食事からのカルシウムを制限する治療法にも疑問を投げかけている。現在,腎臓結石の再発を減らすのに効果的と証明されている唯一の食事内容の変更は水分摂取量を増やすことである。しかしながら,36,282人の閉経後女性による最近の無作為二重盲検プラセボ対照試験からは,サプリメントからのカルシウム(1,000 mg/日)とビタミンD(400 IU/日)の組合せ使用が,腎臓結石リスクを有意の増加させることと相関すると報告されている。サプリメントからのカルシウムが腎臓結石の発生に影響があるかどうかを決定するため,さらに多くの管理された試験が必要である (31)。
妊娠誘発性の高血圧(子癇前症,妊娠高血圧腎症)
妊娠が誘発する高血圧(PIH)は妊娠の10%で発生し,妊婦とその産子における大きな健康リスクである。PIHは,妊娠高血圧,子癇前症及び子癇発作を包含する用語である。妊娠高血圧症は,通常妊娠の20週目以降に発症する異常に高い血圧として定義される。妊娠高血圧症の他に,子癇前症には,浮腫(重度の腫れ)やタンパク尿症(尿中タンパク質)がある。子癇前症は子癇発作(妊娠中毒症とも呼ばれる)へと進行し,生命を危うくする痙攣や昏睡を起こす可能性がある (32)。PIHの原因は完全に解明されているわけではないが,カルシウム代謝が作用していると考えられている。PIHのリスク因子は,初めての妊娠,多胎妊娠(双子や三つ子),慢性の高血圧,糖尿病及びある種の自己免疫疾患である。疫学研究の結果では,カルシウム摂取量とPIH発症率との間に逆相関が示唆されているが,カルシウム補給とPIHに関する実験結果はあまりクリアではない。無作為対照研究の系統的レビューからは,PIH高リスクの妊娠女性だけでなくカルシウム摂取量の低い妊娠女性において,カルシウム補給が高血圧の発生率を低減させることが認められた。しかしながら,PIHのリスクが低くカルシウム摂取量が適正な女性において,カルシウム補給の恩恵が小さく臨床的に有意とは考えられないと判定された (33)。4,500人以上の妊娠女性による「子癇前症予防に関するカルシウム」についての大規模多機関臨床試験において,PIHにおけるカルシウムの2,000 mg補給の効果は認められなかった。しかしながら、補給群の女性が平均2,300 mg/日の摂取量であったのに対して、対照群の女性は960 mg/日の平均摂取量であった, (34)。一般集団については,妊娠時に現在の推奨カルシウム摂取量に適合することがPIH予防につながるかもしれない。PIHに対し高リスクの女性が現在の推奨以上にカルシウムを補給することで効果があるかどうか判断するために,追加研究が必要である。
鉛中毒症
たとえ少量でも慢性的に鉛に曝露されている子供は,学習障害,行動の問題及びIQ値の低下を起こす可能性が高い。発育異常と神経系発達異常は,妊娠期に鉛に曝露された女性の乳児で起こりやすい。成人において,鉛中毒は腎臓障害や高血圧症を起こす可能性がある。鉛塗料や加鉛ガソリンの使用は米国では中止されているが,鉛中毒は,特に都会に住む子供で重要な健康問題として継続している。都市近郊の300人以上の子供における調査では,1~8歳の子供の49%は血液中の鉛レベルの現行ガイドラインを超えており,過剰の鉛曝露が示唆された。この調査において,1~3歳児の59%と4~8歳の子供の41%だけが,カルシウムの推奨摂取量を満たしていた (35)。適正なカルシウム摂取量は,少なくとも2つの方法で鉛の毒性に対する予防を可能とする。食事からのカルシウム摂取量増加は,胃腸器官からの鉛の吸収を減らすことが知られている。鉛が体内に入ると,骨格に蓄積されやすく20年以上残るといわれている。適正なカルシウム摂取は,骨の脱ミネラル化の間に骨格から移動する鉛による曝露も防止する。最近の妊娠中の血液中鉛レベルの研究では,妊娠の第二半期における不十分なカルシウム摂取量が,おそらく蓄積された鉛の血液中への放出によると考えられる骨の脱ミネラル化を増進させることに関連して,血液中の鉛レベルを上昇させる可能性が高まることが報告された (36)。妊娠女性における血中鉛は,胎盤を速やかに通過し,神経系の発達に極めて影響しやすい時期に胎児の鉛曝露を起こす。さらに,閉経後女性において,カルシウム摂取量の増加が血液中の鉛レベル低下と相関が認められた。エストロゲン代替療法や運動などの骨の脱ミネラル化防止として知られる他の要因も,血液中の鉛レベルと逆相関がみられる (37)。
疾病の治療
高血圧(高血圧症)
カルシウム摂取量と高血圧との間の相関関係は,最近20年間で広範囲に調査されている。23例の大規模な観察研究の解析から,カルシウムの1日あたり100 mg摂取が収縮期血圧を0.34 mmHg下げ,拡張期血圧をカルシウム100 mgあたり0.15 mmHg下げることが認められた (38)。カルシウムの血圧に及ぼす効果をプラセボ群と比較した42例の無作為対照研究の大規模な系統的レビューから,全体として,収縮期血圧を1.44 mmHg低下させ,拡張期血圧を0.84 mmHg低下させることが認められた (39)。これらの無作為対照試験におけるカルシウム補給は,500~2,000 mg/日の範囲で,1,000~1,500 mg/日が最も多い用量であった。DASH(Dietary Approaches to Stop Hypertension)研究において,549人の人が,8週間,無作為に次の3つの食事を割り当てられた。1) 果実・野菜及び乳製品の少ない対照食事,2) 果実(5食/日)と野菜(3食/日)の多い食事,3) 果実・野菜の多い食事と低脂肪乳製品を組み合わせた食事(3食/日)(40)。この組合せ食事は,対照群より約800 mg/日カルシウムが多く,総量で約1,200 mg/日カルシウムが果実・野菜の多い食事には相当していた。組合せ食事は,対照群より,収縮期血圧を5.5 mmHg下げ,拡張期血圧を3.0 mmHg低下させた。一方,果実・野菜食事は,対照群より,収縮期血圧を2.8 mmHg下げ,拡張期血圧を1.1 mmHg低下させた。高血圧と診断された人の中で,対照群と比較し,組合せ食事が収縮期血圧を11.4 mmHgまで,拡張期血圧を5.5 mmHgまで低下させ,一方,果実・野菜食事は,対照食事と比較し収縮期で7.2 mmHg,拡張期で2.8 mmHg低下させた (41)。この研究から,推奨レベル(1,000~1,200 mg/日)でのカルシウム摂取量が,軽度の高血圧の予防及び治療に有用である可能性が示唆された (42)。DASH食事試験についてのさらに多くの情報はNational Institutes of Health(NIH)から入手できる。
月経前症侯群(PMS)
PMSは,疲労とは少し異なり,イライラ,不機嫌/うつ状態,体液貯留及び乳房圧痛を含む,排卵(中間期)にしばしば始まり,月経開始(月一回)でおさまる症状群のことをさす (43)。食事からのカルシウム不足がいくつかの試験でPMSと関連付けられ,カルシウム補給が症状をやわらげることが認められている (44)。466人女性による無作為二重盲検プラセボ対照において,3つの月経周期におけるカルシウム補給(1,200 mg/日)が,プラセボ群の30%低減と比較し,総合的な症状スコアを48%低減させることと相関がみられた (45)。カルシウムを1,000 mg/日投与された2つの二重盲検プラセボ対照試験クロスオーバー試験においても,同様の効果が報告された (46,47)。Nurses' Health Study IIに参加した女性における症例-対照研究では,食品から最大のカルシウム(中央値1,283 mg/日)を摂取していた人が,最小カルシウム摂取量(中央値529 mg/日)の人と比較し,PMS発症のリスクが30%低いことが認められた (48)。しかしながら,サプリメントからのカルシウム摂取はこの研究ではPMSに効果がなかった。食事からのカルシウム摂取量の増加やカルシウムサプリメントの摂取が,PMSの治療や予防に治療効果があるかどうか判断するために,大規模な臨床試験が必要である。
食品からの摂取源
米国におけるカルシウムの平均食事摂取量は,全ての年齢群と性別,特に女性でRDA(推奨栄養所要量)をかなり下回っている。9~17歳の男子約25%と女子の10%だけしか,推奨量を満たさないと推定される。乳製品は,アメリカ人食事においてカルシウムの75%を供給する。しかしながら,青少年 が牛乳の代わりに清涼飲料を摂取する傾向があるのは,一般的に,骨量発達に最も重要な期間である (1, 3)。乳製品はカルシウムが豊富で吸収容易な摂取源であるが,特定の野菜や穀類もカルシウム供給源である。一方,カルシウムの生体利用能は考慮されなければならない。カルシウムの多いケール属植物(ブロッコリー,チンゲン菜,キャベツ,マスタード及びカブの葉)は,牛乳と同等の生体利用能を持つカルシウムを含有するが,ある種の食品成分がカルシウムの吸収を阻害することが認められている。シュウ酸塩ともいわれるシュウ酸は,最も作用の強いカルシウムの吸収阻害剤であり,ホウレンソウやルバーブ中に高濃度認められ,スウィートポテトや乾燥豆類にやや低濃度存在している。フィチン酸はシュウ酸塩よりも弱いカルシウム阻害剤である。酵母は,発酵中に穀類のフィチン酸を分解する酵素(フィターゼ)を持ち,パンなどの発酵食品ではフィチン酸含量が低下する。小麦のぬかや乾燥ビーンズなどは,フィチン酸の濃縮要因で本質的にカルシウム吸収を弱める (1)。カルシウムが多く含まれる食品を,カルシウム含量と牛乳1杯から吸収できるカルシウム相当量に必要な食品の一食数とともに下表に示した (49)。食品中の栄養成分含有量についての追加情報は,USDAの食品成分データベース(USDA food composition database)で検索できる。
サプリメント
食品中のカルシウムは,体内がカルシウム利用するのを補助する他の重要な栄養成分を伴うため,多くの専門家は,食品から可能な限り多くのカルシウムを摂るように推奨する。一方で,食品から十分なカルシウムを摂取することが困難な人には,カルシウムサプリメントが必要かもしれない。サプリメントはバルク製品(かさが大きい)で,錠剤の場合飲み込むには大きすぎるため,カルシウムの推奨一日摂取量(DV)を100%含有するマルチビタミン/マルチミネラル・サプリメントはない。現在米国市場で全てのサプリメントに要求されている「サプリメントファクト」ラベルには,元素カルシウムとしてサプリメント中のカルシウム含量が表示されている。サプリメントに使用されるカルシウム製剤は,炭酸カルシウム,乳酸カルシウム,グルコン酸カルシウム,クエン酸カルシウム及びクエン酸リンゴ酸カルシウムである。サプリメント中のカルシウム製剤がどれであるか判断するために,有効成分表示を見なければならない。炭酸カルシウムが一般に,最も安価なカルシウムサプリメントである。吸収を最大化するためには,一回でカルシウム元素を少なくとも500 mgは摂る必要がある。大部分のカルシウムサプリメントは,食事といっしょに摂る必要があるが,クエン酸カルシウムやクエン酸リンゴ酸カルシウムは,いつ摂ってもよい (50)。
カルシウムサプリメント中の鉛
数年前に,天然由来(カキ貝殻,骨粉,ドロマイト)のカルシウムサプリメント中の鉛に関する懸念が提起された。1993年に,研究者が,試験した70種製剤のほとんどから鉛を定量下限以上検出した (51)。それ以来,製造者は,カルシウム元素1,000 mg中で0.5 g以下まで,カルシウムサプリメント中の鉛含量を下げるよう尽力している。連邦基準値は,7.5 g/1,000 mgカルシウム元素である。鉛は広く存在し長く残留するため,完全に鉛が含まれない食品やサプリメントを誰も保証できない。最近の研究では,21のサプリメント製品中の8製品から鉛が検出され,その量はカルシウム元素1,000 mg中で平均1~2 gであった (52)。カルシウムは鉛の腸からの吸収を阻害し,適正なカルシウム摂取量は鉛の毒性に対し予防効果があるため,カルシウムサプリメント中に存在する微量の鉛は,不十分なカルシウム摂取ほどには,過剰の鉛曝露のリスクが少ない。現在の大部分のカルシウム摂取源は比較的安全であるが,ラベルに「鉛フリー」の表示があるサプリメントを捜し,多量(1,500mg/日以上)のサプリメント服用は避ける必要がある。
安全性
毒性
カルシウムの過剰摂取により起こる血液中カルシウムの異常な上昇(高カルシウム血症)は,食品から起こった報告はこれまでなく,カルシウムサプリメントからだけである。軽度の高カルシウム血症は症状がないか,あるいは,食欲減退,吐き気,嘔吐,便秘,腹痛,口内乾燥,口の渇き感,及び頻尿を起こす。さらに重度の高カルシウム血症は,錯乱,精神錯乱,昏睡及び処置しなければ,死に至る。高カルシウム血症は,制酸薬とともに多量のカルシウムサプリメントを摂取した場合,特に消化性潰瘍が多量の牛乳,炭酸カルシウム(制酸薬)及び炭酸水素ナトリウム(吸収可能アルカリ)により処置されたとき,のみ報告されている (1)。この症状は乳アルカリ症候群と呼ばれ,カルシウムサプリメントを1.5~16.5 g/日を2日間から30年間まで摂取した場合に報告されている。消化性潰瘍の治療が変えられたため,この症状の発生率はかなり減少している (3)。
腎臓結石を起こすリスクは,尿中カルシウムが異常に上昇した人(高カルシウム血症)で高くなるが,この症状は常にカルシウム摂取量と相関しているわけではなく,むしろ腎臓によるカルシウム排泄の増加と関係している。全体として,食事からのカルシウム増加は腎臓結石のリスク低下と相関している。一方,大規模前向き研究において,カルシウムサプリメントを摂っている女性における腎臓結石の発症リスクは,サプリメントを摂らない人より20%高かった (25)。この作用は,カルシウムサプリメントを食品なしで摂取し,腸のシュウ酸吸収を軽減する有益作用を消失させるということと関係するのかもしれない。
2010年に,米国医薬品協会の食品栄養委員会は,カルシウムの耐容上限摂取量(UL)を改訂した。年齢群ごとのULを下表に示した。
| 年齢群 | UL (mg/day) |
|---|---|
| 乳児;0~6ヵ月 | 1,000 |
| 乳児;6~12ヵ月 | 1,500 |
| 子供;1~8歳 | 2,500 |
| 子供;9~13歳 | 3,000 |
| 青少年;14~18歳 | 3,000 |
| 成人;19~50歳 | 2,500 |
| 成人;51歳以上 | 2,000 |
高いカルシウム摂取量が前立腺癌リスクを増加させるか
最近の疫学研究からは,高いカルシウム摂取量が前立腺癌のリスク増加と相関するとの懸念が提起されている。米国における大規模前向きコホート研究で,8年間50,000人以上の健康従事者男性が追跡され,カルシウム摂取量が2,000 mg/日以上であった男性が,500 mg/日以下のカルシウム摂取量の人より進行性の前立腺癌発症リスクが3倍高く,転移性前立腺癌の発症リスクが4倍高かった (53)。スウェーデンの症例-対照研究でも同様の結果が認められ,前立腺癌と診断された526人男性のカルシウム摂取量は対照群の536人との比較であった (54)。どちらの研究でも,カルシウム摂取量は,総前立腺癌リスクや非進行性前立腺癌リスクの増加と相関は認められなかった。その後,米国医学者の別の前向き研究で,乳製品からのカルシウム摂取量増加が,前立腺癌リスクの増加と相関があることが認められた (55)。この研究はサプリメント使用を試験したものではなかったが,乳製品からのそれぞれ500 mg/日のカルシウム摂取量増加が,前立腺癌(進行性と非進行性を結合)のリスクの16%増加と相関がみられた。さらにその後,29,133人の男性喫煙者を17年間追跡した前向きコホート研究において,高いカルシウム摂取(>1,000 mg/日)が,前立腺癌のリスク増加と相関が認められた (56)。カルシウム摂取量と前立腺癌との間の相関関係の背景にある生理メカニズムはまだ不明である。食事で摂取した高レベルのカルシウムが,活性型ビタミンDのカルシトリオールの循環レベルを低下させるのかもしれない。前立腺癌の細胞系及び実験動物で実施された実験において,カルシトリオールは予防作用があることが認められた。しかしながら,人において,血清中カルシトリオールレベルと前立腺癌リスクに関して実施された研究において,あまり関連性はみられていない。
全ての疫学研究が,カルシウム摂取量と前立腺癌との間の相関を証明しているわけではない。レビューの一つでは,14の症例-対照研究の中の7つ,及び9つの前向きコホート研究中の5つが,前立腺癌と乳製品摂取の数種の尺度との間に統計的に有意な相関関係を確立していると報告されている。カルシウムの摂取量を試験したそれらの研究の中で,6つの症例-対照研究のうち3つと4つのコホート研究中2つが,前立腺癌とカルシウム摂取量との間に統計的に有意な相関関係を報告している (57)。一方,セルビアの症例-対照研究からは,カルシウム摂取量の増加が前立腺癌リスク低減と相関することが認められた (58)。6例の前向き研究のメタアナリシスにおいて,Gaoらは,1日のカルシウム摂取量が高い男性が,摂取量の低い人と比較し,前立腺癌の発症リスクが39%増加することを報告した。乳製品の摂取量が高い男性は,乳製品の摂取量が低い人より前立腺癌リスクが11%高かった (59)。しかしながら,このメタアナリシスに含まれる各種研究の半分だけが,高いカルシウム摂取量と前立腺癌との間の相関を報告していた。その後のメルボルンでの14,642人男性が参加した共同コホート研究において,カルシウム摂取量は前立腺癌リスクとは相関がみられなかった (60)。Gaoらは,この報告を加えて再度メタアナリシスを行った (59)。彼らは,カルシウム摂取量が高い人が,前立腺癌リスクも32%高かったことを確認したが,7つ全てのメタアナリシスでは,乳製品の摂取量が前立腺癌リスクの増加と何ら関係しないことが示された (60)。研究の間に一致性がないことは,前立腺癌のリスク因子間の複雑な相互作用があることを示唆しており,自由生活型(食道楽)の人におけるカルシウム摂取量を評価する困難さをも反映している。カルシウムと前立腺癌の間の相関関係が明らかににされるまで,男性は,医薬品協会の食品栄養委員会が推奨するカルシウムの総量1,000~1,200 mg/日(食事とサプリメントの両方から)を摂取することが妥当である(RDA参照)。
薬物との相互作用
チアジド系利尿剤(ハイドロクロロチアジドなど)との組合せでカルシウムサプリメントを服用すると,腎臓におけるカルシウムの再吸収が増大し,高カルシウム血症の発症リスクが高くなる。高用量のカルシウムサプリメントは,心臓死予防にジギタリス(ジゴキシン)を服用している人において,不整脈の可能性を高める (61)。カルシウムは,静脈から供給した場合,カルシウムチャンネル遮蔽剤の効果を弱める可能性がある (62)。しかしながら,食事や経口からのカルシウム補給は,カルシウムチャンネル遮蔽薬の作用には影響しないと思われる (63)。カルシウムは,テトラサイクリン系とキノロン系抗生物質,ビスホスフォネート類及びレボチロキシン系薬物の吸収を低下させるため,これらの医薬品とカルシウムが多い食品やサプリメントは2時間空けて服用することが推奨される。H2遮蔽薬(シメチジンなど)やプロトンポンプ阻害薬(オメプラゾ-ルなど)の使用は,炭酸カルシウムやリン酸カルシウムの吸収を減少させる可能性がある (50, 64)。
カルシウムと栄養成分との相互作用
カルシウムの存在は,非ヘム由来の鉄(すなわち,大部分のサプリメントと肉以外の食品)の吸収を阻害する。しかしながら,最大12週間までのカルシウム補給は,鉄の栄養状態を変化させないことが確認され,それはおそらく鉄吸収における補完的な増加と考えられる。鉄サプリメントを摂取する人は,鉄の吸収を最適化するために,カルシウムの多い食品またはサプリメントを,2時間は間を空けて摂取するべきである。ラットにおいて,高いカルシウム摂取量は相対的なマグネシウム欠乏を起こすが,カルシウム摂取量は人におけるマグネシウム維持に影響は認められなかった (1)。多くの研究により,高いカルシウム摂取量が,亜鉛吸収や亜鉛の栄養状態に影響することは認められていないが,10人の男女のよる研究から,食事とともにカルシウムを600 mg摂取すると,その食事からの亜鉛吸収を50%まで減少させることが示唆された (65)。
最近の研究
カルシウムと体重減少
カルシウム密度の高い食事(総カロリーあたりのカルシウム)は,いくつかの研究において,過体重や肥満の発生率を低減させることと相関がみられた。これらの研究は,肥満や体脂肪に及ぼすカルシウムの効果を調べるために設計されたものではなく,その意義は,その後の培養細胞と動物実験から,カルシウム不足が,脂肪細胞が脂肪を蓄積する傾向を高めるホルモン変化と代謝変化を起こすことが示唆されるまでよくわからなかった (66)。2年間の運動試験において,食事から多くカルシウムを摂取することが,参加者が運動グループまたは対照グループの中にいたかどうかにかかわらず,体重減少と相関が認められた (67)。カルシウム補給のプラセボ対照試験では,高齢女性にカルシウムを1,200 mg/日補給したとき,対照群と比較し有意に高い体重減少が認められた (68)。その後,健常女性での1年間の乳製品介入試験(カルシウム1,000~1,400 mg/日)において,対照群(カルシウム <800 mg/日)と比較し,体重や脂肪量に変化がみられなかった (69)が, 6ヵ月追跡時に高用量群(1,300~1,400 mg/日のカルシウム)で,体脂肪の量のわずかな減少が認められた (70)。体脂肪や体重に及ぼすカルシウムの影響が少しでもあるのであれば,カロリーを固定した管理された介入試験が必要である。そのような試験が現在行われている。
ライナスポーリング研究所の推奨
Linus Pauling Instituteは,米国医薬品協会の食品栄養委員会によって設定された推奨食事摂取量(RDA)レベルを支持する。これらの推奨に従うと,適正なカルシウムが供給され骨格の健康が増進され,さらにいくつかの慢性疾患リスクの低減にもなる。
子供と青少年(9~18歳)
最大のピーク骨量の達成を促進するため,子供や青少年は,カルシウム総量(食事とサプリメントから)を1,300 mg/日摂取する必要がある。
成人(19~50歳の女性,19~70歳の男性)
成人の身長に到達した後,ピーク骨量に達する人生の30年まで,骨格は骨を蓄積し続ける。最大のピーク骨量の達成を増進し,人生後期の骨量減少を低減するために,成人女性(50歳以下)及び成人男性(70歳以下)は,カルシウムを総量(食事とサプリメント)1,000 mg/日摂取すべきである。
高齢女性(51歳以上)
骨量減少を最小化するために,閉経後女性は,カルシウムを総量(食事とサプリメント)で1,200 mg/日摂取すべきである。最低10 g(400 IU)/日のビタミンDを含有するマルチビタミン/マルチミネラル・サプリメントを摂取することが,適正なカルシウムの吸収を確実にするために有用である(ビタミンD参照)。
高齢男性(71歳以上)
骨量減少を最小化するために,高齢男性は,カルシウムを総量(食事とサプリメント)で1,200 mg/日摂取すべきである。最低10 g(400 IU)/日のビタミンDを含有するマルチビタミン/マルチミネラル・サプリメントを摂取することが,適正なカルシウムの吸収を確実にするために有用である(ビタミンD参照)。
妊婦及び母乳授乳女性
妊婦及び母乳授乳の女性(19歳未満)は,カルシウムを総量で1,300 mg/日摂取すべきで,妊婦及び母乳授乳の成人女性(19歳以上)は,カルシウムを総量で1,000 mg/日摂取すべきである。
Authors and Reviewers
Written in April 2003 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in October 2007 by:
Victoria J. Drake, Ph.D.
Linus Pauling Institute
Oregon State University
Reviewed in October 2007 by:
Connie M. Weaver, Ph.D.
Distinguished Professor and Head of Foods and Nutrition
Purdue University
Does a high calcium intake increase the risk of prostate cancer?
Reviewed in June 2007 by: June Chan, Sc.D.
Associate Professor,Departments of Epidemiology & Biostatistics and Urology
University of California, San Francisco
Last updated 11/30/10 Copyright 2001-2023 Linus Pauling Institute
References
1. Weaver C, Heaney R. Calcium. In: Shils M, Olson J, Shike M, Ross A,eds. Modern Nutrition in Health and Disease. 9th ed. Baltimore: Williams & Wilkins; 1999:141-155.
2. Heaney RP. Calcium, dairy products and osteoporosis. J Am Coll Nutr. 2000;19(2 Suppl):83S-99S. (PubMed)
3. Food and Nutrition Board, Institute of Medicine. Calcium. Dietary Reference Intakes: Calcium, Phosphorus, Magnesium, Vitamin D, and Fluoride. Washington D.C.: National Academy Press; 1997:71-145.
4. Brody T. Nutritional Biochemistry. 2nd ed. San Diego: Academic Press; 1999.
5. Pearce SH, Thakker RV. The calcium-sensing receptor: insights into extracellular calcium homeostasis in health and disease. J Endocrinol. 1997;154(3):371-378. (PubMed)
6. Calvo MS. Dietary considerations to prevent loss of bone and renal function. Nutrition. 2000;16(7-8):564-566. (PubMed)
7. Devine A, Criddle RA, Dick IM, Kerr DA, Prince RL. A longitudinal study of the effect of sodium and calcium intakes on regional bone density in postmenopausal women. Am J Clin Nutr. 1995;62(4):740-745. (PubMed)
8. Carbone LD, Barrow KD, Bush AJ, et al. Effects of a low sodium diet on bone metabolism. J Bone Miner Metab. 2005;23(6):506-513. (PubMed)
9. Wigertz K, Palacios C, Jackman LA, et al. Racial differences in calcium retention in response to dietary salt in adolescent girls. Am J Clin Nutr. 2005;81(4):845-850. (PubMed)
10. Bonjour JP. Dietary protein: an essential nutrient for bone health. J Am Coll Nutr. 2005;24(6 Suppl):526S-536S. (PubMed)
11. Barger-Lux MJ, Heaney RP, Stegman MR. Effects of moderate caffeine intake on the calcium economy of premenopausal women. Am J Clin Nutr. 1990;52(4):722-725. (PubMed)
12. Harris SS, Dawson-Hughes B. Caffeine and bone loss in healthy postmenopausal women. Am J Clin Nutr. 1994;60(4):573-578. (PubMed)
13. Lloyd T, Johnson-Rollings N, Eggli DF, Kieselhorst K, Mauger EA, Cusatis DC. Bone status among postmenopausal women with different habitual caffeine intakes: a longitudinal investigation. J Am Coll Nutr. 2000;19(2):256-261. (PubMed)
14. Bostick R. Diet and nutrition in the prevention of colon cancer. In: Bendich A, Deckelbaum R,eds. Preventive Nutrition: The Comprehensive Guide for Health Professionals. Totowa: Humana Press, Inc.; 2001:57-95.
15. Bonithon-Kopp C, Kronborg O, Giacosa A, Rath U, Faivre J. Calcium and fibre supplementation in prevention of colorectal adenoma recurrence: a randomised intervention trial. European Cancer Prevention Organisation Study Group. Lancet. 2000;356(9238):1300-1306. (PubMed)
16. Baron JA, Beach M, Mandel JS, et al. Calcium supplements and colorectal adenomas. Polyp Prevention Study Group. Ann N Y Acad Sci. 1999;889:138-145. (PubMed)
17. Grau MV, Baron JA, Sandler RS, et al. Prolonged effect of calcium supplementation on risk of colorectal adenomas in a randomized trial. J Natl Cancer Inst. 2007;99(2):129-136. (PubMed)
18. Cho E, Smith-Warner SA, Spiegelman D, et al. Dairy foods, calcium, and colorectal cancer: a pooled analysis of 10 cohort studies. J Natl Cancer Inst. 2004;96(13):1015-1022. (PubMed)
19. Ma J, Giovannucci E, Pollak M, et al. Milk intake, circulating levels of insulin-like growth factor-I, and risk of colorectal cancer in men. J Natl Cancer Inst. 2001;93(17):1330-1336. (PubMed)
20. National Insitutes of Health. Osteoporosis Prevention, Diagnosis, and Therapy. NIH Consensus Statement. 2000;17(1):1-36.
21. Specker BL. Evidence for an interaction between calcium intake and physical activity on changes in bone mineral density. J Bone Miner Res. 1996;11(10):1539-1544. (PubMed)
22. Heller HJ. The role of calcium in the prevention of kidney stones. J Am Coll Nutr. 1999;18(5 Suppl):373S-378S. (PubMed)
23. Martini LA, Wood RJ. Should dietary calcium and protein be restricted in patients with nephrolithiasis? Nutr Rev. 2000;58(4):111-117. (PubMed)
24. Curhan GC, Willett WC, Rimm EB, Stampfer MJ. A prospective study of dietary calcium and other nutrients and the risk of symptomatic kidney stones. N Engl J Med. 1993;328(12):833-838. (PubMed)
25. Curhan GC, Willett WC, Speizer FE, Spiegelman D, Stampfer MJ. Comparison of dietary calcium with supplemental calcium and other nutrients as factors affecting the risk for kidney stones in women. Ann Intern Med. 1997;126(7):497-504. (PubMed)
26. Taylor EN, Stampfer MJ, Curhan GC. Dietary factors and the risk of incident kidney stones in men: new insights after 14 years of follow-up. J Am Soc Nephrol. 2004;15(12):3225-3232. (PubMed)
27. Curhan GC, Willett WC, Knight EL, Stampfer MJ. Dietary factors and the risk of incident kidney stones in younger women: Nurses' Health Study II. Arch Intern Med. 2004;164(8):885-891. (PubMed)
28. Liebman M, Chai W. Effect of dietary calcium on urinary oxalate excretion after oxalate loads. Am J Clin Nutr. 1997;65(5):1453-1459. (PubMed)
29. Burtis WJ, Gay L, Insogna KL, Ellison A, Broadus AE. Dietary hypercalciuria in patients with calcium oxalate kidney stones. Am J Clin Nutr. 1994;60(3):424-429. (PubMed)
30. Martini LA, Cuppari L, Colugnati FA, et al. High sodium chloride intake is associated with low bone density in calcium stone-forming patients. Clin Nephrol. 2000;54(2):85-93. (PubMed)
31. Jackson RD, LaCroix AZ, Gass M, et al. Calcium plus vitamin D supplementation and the risk of fractures. N Engl J Med. 2006;354(7):669-683. (PubMed)
32. Ritchie LD, King JC. Dietary calcium and pregnancy-induced hypertension: is there a relation? Am J Clin Nutr. 2000;71(5 Suppl):1371S-1374S. (PubMed)
33. Kulier R, de Onis M, Gulmezoglu AM, Villar J. Nutritional interventions for the prevention of maternal morbidity. Int J Gynaecol Obstet. 1998;63(3):231-246. (PubMed)
34. Levine RJ, Hauth JC, Curet LB, et al. Trial of calcium to prevent preeclampsia. N Engl J Med. 1997;337(2):69-76. (PubMed)
35. Bruening K, Kemp FW, Simone N, Holding Y, Louria DB, Bogden JD. Dietary calcium intakes of urban children at risk of lead poisoning. Environ Health Perspect. 1999;107(6):431-435. (PubMed)
36. Hertz-Picciotto I, Schramm M, Watt-Morse M, Chantala K, Anderson J, Osterloh J. Patterns and determinants of blood lead during pregnancy. Am J Epidemiol. 2000;152(9):829-837. (PubMed)
37. Muldoon SB, Cauley JA, Kuller LH, Scott J, Rohay J. Lifestyle and sociodemographic factors as determinants of blood lead levels in elderly women. Am J Epidemiol. 1994;139(6):599-608. (PubMed)
38. Birkett NJ. Comments on a meta-analysis of the relation between dietary calcium intake and blood pressure. Am J Epidemiol. 1998;148(3):223-228; discussion 232-223. (PubMed)
39. Griffith LE, Guyatt GH, Cook RJ, Bucher HC, Cook DJ. The influence of dietary and nondietary calcium supplementation on blood pressure: an updated metaanalysis of randomized controlled trials. Am J Hypertens. 1999;12(1 Pt 1):84-92. (PubMed)
40. Appel LJ, Moore TJ, Obarzanek E, et al. A clinical trial of the effects of dietary patterns on blood pressure. DASH Collaborative Research Group. N Engl J Med. 1997;336(16):1117-1124. (PubMed)
41. Conlin PR, Chow D, Miller ER, 3rd, et al. The effect of dietary patterns on blood pressure control in hypertensive patients: results from the Dietary Approaches to Stop Hypertension (DASH) trial. Am J Hypertens. 2000;13(9):949-955. (PubMed)
42. Miller GD, DiRienzo DD, Reusser ME, McCarron DA. Benefits of dairy product consumption on blood pressure in humans: a summary of the biomedical literature. J Am Coll Nutr. 2000;19(2 Suppl):147S-164S. (PubMed)
43. Brown JE. Preconception Nutrition: Conditions and Interventions. In: Brown JE (ed). Nutrition through the Life Cycle. Belmont: Wadsworth/Thomson Learning; 2002:53-60.
44. Bendich A. The potential for dietary supplements to reduce premenstrual syndrome (PMS) symptoms. J Am Coll Nutr. 2000;19(1):3-12. (PubMed)
45. Thys-Jacobs S, Starkey P, Bernstein D, Tian J. Calcium carbonate and the premenstrual syndrome: effects on premenstrual and menstrual symptoms. Premenstrual Syndrome Study Group. Am J Obstet Gynecol. 1998;179(2):444-452. (PubMed)
46. Thys-Jacobs S, Ceccarelli S, Bierman A, Weisman H, Cohen MA, Alvir J. Calcium supplementation in premenstrual syndrome: a randomized crossover trial. J Gen Intern Med. 1989;4(3):183-189. (PubMed)
47. Alvir JM, Thys-Jacobs S. Premenstrual and menstrual symptom clusters and response to calcium treatment. Psychopharmacol Bull. 1991;27(2):145-148. (PubMed)
48. Bertone-Johnson ER, Hankinson SE, Bendich A, Johnson SR, Willett WC, Manson JE. Calcium and vitamin D intake and risk of incident premenstrual syndrome. Arch Intern Med. 2005;165(11):1246-1252. (PubMed)
49. Weaver CM, Proulx WR, Heaney R. Choices for achieving adequate dietary calcium with a vegetarian diet. Am J Clin Nutr. 1999;70(3 Suppl):543S-548S. (PubMed)
50. Hendler S, Rorvik D, eds. PDR for Nutritional Supplements. Montvale: Medical Economics Company, Inc.; 2001.
51. Bourgoin BP, Evans DR, Cornett JR, Lingard SM, Quattrone AJ. Lead content in 70 brands of dietary calcium supplements. Am J Public Health. 1993;83(8):1155-1160. (PubMed)
52. Ross EA, Szabo NJ, Tebbett IR. Lead content of calcium supplements. JAMA. 2000;284(11):1425-1429. (PubMed)
53. Giovannucci E, Rimm EB, Wolk A, et al. Calcium and fructose intake in relation to risk of prostate cancer. Cancer Res. 1998;58(3):442-447. (PubMed)
54. Chan JM, Giovannucci E, Andersson SO, Yuen J, Adami HO, Wolk A. Dairy products, calcium, phosphorous, vitamin D, and risk of prostate cancer (Sweden). Cancer Causes Control. 1998;9(6):559-566. (PubMed)
55. Chan JM, Stampfer MJ, Ma J, Gann PH, Gaziano JM, Giovannucci EL. Dairy products, calcium, and prostate cancer risk in the Physicians' Health Study. Am J Clin Nutr. 2001;74(4):549-554. (PubMed)
56. Mitrou PN, Albanes D, Weinstein SJ, et al. A prospective study of dietary calcium, dairy products and prostate cancer risk (Finland). Int J Cancer. 2007;120(11):2466-2473. (PubMed)
57. Chan JM, Giovannucci EL. Dairy products, calcium, and vitamin D and risk of prostate cancer. Epidemiol Rev. 2001;23(1):87-92. (PubMed)
58. Vlajinac HD, Marinkovic JM, Ilic MD, Kocev NI. Diet and prostate cancer: a case-control study. Eur J Cancer. 1997;33(1):101-107. (PubMed)
59. Gao X, LaValley MP, Tucker KL. Prospective studies of dairy product and calcium intakes and prostate cancer risk: a meta-analysis. J Natl Cancer Inst. 2005;97(23):1768-1777. (PubMed)
60. Severi G, English DR, Hopper JL, Giles GG. Re: Prospective studies of dairy product and calcium intakes and prostate cancer risk: a meta-analysis. J Natl Cancer Inst. 2006;98(11):794-795; author reply 795. (PubMed)
61. Vella A, Gerber TC, Hayes DL, Reeder GS. Digoxin, hypercalcaemia, and cardiac conduction. Postgrad Med J. 1999;75(887):554-556. (PubMed)
62. Moser LR, Smythe MA, Tisdale JE. The use of calcium salts in the prevention and management of verapamil-induced hypotension. Ann Pharmacother. 2000;34(5):622-629. (PubMed)
63. Bania TC, Blaufeux B, Hughes S, Almond GL, Homel P. Calcium and digoxin vs. calcium alone for severe verapamil toxicity. Acad Emerg Med. 2000;7(10):1089-1096. (PubMed)
64. Minerals. In: Drug Facts and Comparisons. St. Louis: Facts and Comparisons; 2000:27-51.
65. Wood RJ, Zheng JJ. High dietary calcium intakes reduce zinc absorption and balance in humans. Am J Clin Nutr. 1997;65(6):1803-1809. (PubMed)
66. Zemel MB, Shi H, Greer B, Dirienzo D, Zemel PC. Regulation of adiposity by dietary calcium. Faseb J. 2000;14(9):1132-1138. (PubMed)
67. Lin YC, Lyle RM, McCabe LD, McCabe GP, Weaver CM, Teegarden D. Dairy calcium is related to changes in body composition during a two-year exercise intervention in young women. J Am Coll Nutr. 2000;19(6):754-760. (PubMed)
68. Davies KM, Heaney RP, Recker RR, et al. Calcium intake and body weight. J Clin Endocrinol Metab. 2000;85(12):4635-4638. (PubMed)
69. Gunther CW, Legowski PA, Lyle RM, et al. Dairy products do not lead to alterations in body weight or fat mass in young women in a 1-y intervention. Am J Clin Nutr. 2005;81(4):751-756. (PubMed)
70. Eagan MS, Lyle RM, Gunther CW, Peacock M, Teegarden D. Effect of 1-year dairy product intervention on fat mass in young women: 6-month follow-up. Obesity (Silver Spring). 2006;14(12):2242-2248. (PubMed)
クロム
目次
三価のクロムは栄養的に不可欠なミネラルとして認識されているが、それが体内でどのように機能するのかについては未だに正確にわかっていない。クロムのもっとも一般的な形態は三価クロムと六価クロムである。三価クロムは食品中での主な形態であり、人体で利用される形態でもある。六価クロムは三価クロムをアルカリ性のpHにおいて加熱することによって得られ、工業用クロムの原料として使用される。強い刺激性があり、吸入すると発がん性を示すことがわかっている。低濃度では、食品中や胃の酸性環境における物質を還元することで六価クロムは三価クロムにたやすく還元され、それによって六価クロムの摂取が防がれている(1-3)。
機能
生物学的活性型の形態のクロムは、インスリンの効果を増進してブドウ糖の代謝に関わる。インスリンは、食後等の血糖値の上昇によって膵臓の特殊な細胞から分泌される。インスリンは細胞表面のインスリン受容体と結合し、それによって受容体を活性化させ、細胞によるブドウ糖の取り込みを促す。インスリン受容体との相互作用を通して、インスリンは細胞にエネルギーとしてブドウ糖を供給し、血糖値の上昇を防ぐ。炭水化物(ブドウ糖)の代謝への効果に加えて、インスリンは脂肪やタンパク質の代謝にも影響する。インスリンへの反応が低下したり、インスリン感受性が低下したりすると、インスリン非依存型糖尿病(NIDDM)としても知られる耐糖能異常(境界型糖尿病)や、2型糖尿病になる可能性がある。2型糖尿病は、血糖値の上昇とインスリン耐性が特徴である(1)。
生物学的活性型クロムの正確な構造は不明である。最近の研究では、低分子量クロム結合物質(LMWCr)がインスリン受容体のインスリンに対する反応を促進している可能性が示されている。以下はインスリンの作用に対するクロムの効果として提案されたモデルである(下図)。まず、不活性型インスリン受容体がインスリンと結合することで活性型に変わる。インスリン受容体とインスリンの結合は、細胞へのクロムの移動を刺激し、クロムのないLMWCrであるapoLMWCrがクロムと結合することになる。いったんクロムと結合すると、LMWCrはインスリン受容体と結合し、そのチロシンキナーゼ活性を増進する。LMWCrがインスリン受容体を活性化させる能力は、そのクロム含有量に依存する。血糖値の正常化によってインスリン濃度が減少すると、LMWCrはその効果を終了させるために細胞から放出されるのかもしれない(4)。その後の研究では、インスリンによって刺激されるブドウ糖輸送体の細胞膜への移動を促進することで、クロムがインスリンの作用を強めていることが示された(5)。インスリンの作用におけるクロムの効果のメカニズムは、現在研究中である(5-7)。
栄養成分との相互作用
鉄
クロムは鉄の輸送タンパク質であるトランスフェリンの結合部位の1つで鉄と競合する。しかしながら、年配(中高年)の男性に925μg/日のクロムを12週間にわたって服用してもらった結果では、鉄の栄養状態を示す値に重大な影響はなかった(8)。より若い男性の研究では、200μg/日のクロムを8週間にわたって服用した後に、鉄と飽和しているトランスフェリンがわずかに減ったとの結果になったが、この問題を長期間調べた研究はない(9)。遺伝性ヘモクロマトーシスにおける鉄の過負荷は、トランスフェリンとの結合をめぐってクロムと競合することで、クロム輸送を妨げている可能性がある。このことから、クロム輸送の減少が遺伝性ヘモクロマトーシスに伴う糖尿病に関わっているのではないかという仮説が導かれた(1)。
ビタミンC
ビタミンCと同時摂取すると、動物でのクロムの摂取が強化される(3)。3人の女性の研究では、100mgのビタミンCを1mgのクロムとともに摂取すると、ビタミンCを同時に摂らない場合に比べて血漿中のクロム濃度が高くなった(1)。
炭水化物
複合糖質(未精白穀物など)に富む食事に比べて、単糖(ショ糖など)を多く含む食事は成人の尿へのクロムの排出を増加させることになる。これは、複合糖質より単糖の消費にインスリン分泌が増加することと関係している可能性がある(1)。
欠乏症
クロムの欠乏症は、点滴液にクロムが補われていない静脈栄養補給を長期間受けた3人の患者で報告されている。これらの患者は異常なブドウ糖消費を示し、クロムの補給に反応してインスリンの所要量が増えた。加えて、栄養失調の幼児における耐糖能異常は、塩化クロムの経口投与に反応を示す。クロムがインスリンの作用を強化するようであること、およびクロム欠乏症が耐糖能異常になることから、クロムの不足は2型糖尿病の進行に寄与する要素であると仮定されてきた(1,10)。
男性ランナーを調べたいくつかの研究では、尿中へのクロムの排出は持久運動によって増え、定期的に運動をする個人にはクロムがより必要である可能性を示唆している(11)。より最新の研究では、抵抗運動(ウェイトリフティング)が中高年男性で尿中へのクロムの排出を増やすことがわかっている。しかしながら、クロムの吸収もまた増加し、抵抗運動の結果としてのクロムの損失はほとんどなかった(12)。
現在では、クロムの栄養状態を決定する感度のよい正確な試験が不足していることから、クロムの不適切な摂取の効果とクロム欠乏症のリスク要因に関する研究は限られている(1,3)。
目安量(AI)
クロムの必要性に関して推奨量(RDA)を設定するための情報の不足により、米国食品栄養委員会は目安量(AI)を通常の食事におけるクロムの含有量に基づいて設定している(1)。
疾病の予防
耐糖能異常と2型糖尿病
耐糖能異常を持つ患者を対象とした15の対照試験のうち12の試験で、クロムの補給がブドウ糖消費の値を向上させたり、血中脂質プロフィールに有益な効果があることがわかった(13)。耐糖能異常とは、正常なブドウ糖調節と明白な糖尿病との間のメタボリックな状態をいう。一般に、血糖値が正常より高いが、糖尿病と診断されるには低い状態である。耐糖能異常は心血管疾患のリスク上昇を伴うが、糖尿病のその他の典型的合併症は伴わない。耐糖能異常を持つ個人の約25%から30%が、最終的には2型糖尿病を発症する(14)。一般的に、多様な形でのクロムの補給を約200μg/日の用量で2~3ヶ月行うと、有効であることがわかっている。いくつかの研究における効果のバラ付きや効果がなかった理由ははっきりしないが、クロムの欠乏のみが耐糖能異常の原因として知られているわけではない。加えて、クロムの栄養状態の正確な測定がないことが、クロムの補給によって最も恩恵を受けるであろう患者の識別の妨げになっている(3,15)。最近の15のランダム化臨床試験をメタ分析した結果では、糖尿病でない個人にはブドウ糖やインスリンの濃度にクロムが何の影響もおよぼさないことが報告されている(16)。
心血管疾患
耐糖能異常と2型糖尿病は、脂質プロフィールの悪化や心血管疾患のリスクの増大と関連する。クロムの補給が脂質プロフィールに及ぼす影響を調べた研究は、結果の不整合が著しい。ある研究では血清総コレステロール量、LDLコレステロール量、および中性脂肪量の減少またはHDLコレステロール量の増加を示すが、他の研究では何の効果も見られない。クロムの補給に対するそのような脂質およびリポタンパク質濃度の不整合な反応は、クロムの栄養状態の違いを反映している可能性がある。食事からのクロムの摂取が不十分な個人のみが、クロムの補給によって脂質プロフィールに有効な結果を得るということが考えられる。
健康上の訴求点
筋肉量の増加
クロムの補給が除脂肪体重を増加させ体脂肪を減少させるという主張は、クロムとインスリンの作用との関係に基づく(「機能」の項参照)。ブドウ糖の代謝に影響をおよぼすだけでなく、インスリンは脂肪やタンパク質の代謝にも影響することが知られている。少なくとも12のプラセボ対照試験では、運動有りまたは無しでクロムの補給(ピコリン酸クロム200-1,000μg/日)を行って除脂肪体重および体脂肪の値への効果を比べた。一般に、体脂肪と除脂肪体重を最も感度良く正確に測定する方法(二重エネルギーX線吸収測定法(DEXA)やハイドロデンシトメトリー(水中体重秤量法)を用いた研究では、クロムの補給が体組成に与える有益な効果は示されていない(2,17)。
体重減少の促進
クロム補給の対照試験(ピコリン酸クロム200-400μg/日)では、体重や体脂肪の減少に有益な効果はほとんど示されていないし(18)、ヒトの体重が減少したという主張は誇張されているようである。1997年には、ピコリン酸クロムがヒトの体重および脂肪の減少を促進するという主張には裏付けがないと米国連邦取引委員会(FTC)が断定した(2,15,17)。その後、ピコリン酸クロム補給に関する10のランダム化二重盲検プラセボ対照試験のメタ分析で、ピコリン酸クロムによって1.1kgの体重減少がみられたことが判明した。しかしながら、そのようなわずかな変化は臨床的に関連があるとはいえない可能性がある(19)。そして最近の研究では、ピコリン酸クロムの補給がスルホニル尿素剤を服用している2型糖尿病患者の体重増加を緩和すると報告されている(20)。
疾病の治療
2型糖尿病
2型糖尿病は高い血糖値とインスリン抵抗性が特徴である。2型糖尿病患者のインスリン濃度は健康な個人より高いかもしれないが、インスリンの生理学的効果は低下している。クロムはインスリンの作用を強めることが知られているので、クロムの栄養状態と2型糖尿病の関係は科学的に考慮すべき対象となっていた。2型糖尿病患者は健康な個人よりもクロムの尿中への排出率が高いことがわかっており、2年以上にわたって患っている場合は特にそうである(21)。1997年以前は、よく計画された2型糖尿病患者へのクロム補給に関する研究で血糖値調整に何の向上も見られなかったが、インスリン濃度の減少と血液脂質プロフィールの向上にいくつかのエビデンス(根拠)が示された(22)。1997年に中国で行われたプラセボ対照試験の結果、2型糖尿病の治療にクロム補給が有益である可能性が示された(23)。180人の試験参加者が、プラセボまたは200μg/日および1,000μg/日のピコリン酸クロムを服用した。4ヶ月後、プラセボ(偽薬)を服用した人よりも1,000μg/日の補給をした人の方が血糖値が15~19%低下した。200μg/日の服用をした人はプラセボを服用した人と比べて血糖値に大きな差がなかった。ピコリン酸クロムを200μg/日または1,000μg/日服用した人のインスリン濃度は低かった。長期間の血糖調整を測定するグリコヘモグロビン濃度もクロム補給をしたグループの方が低く、1,000μg/日の服用をしたグループでは特にそうであった。中国人試験対象者のクロムの栄養状態が評価されていない上、肥満の割合が米国における2型糖尿病患者に典型的に見られるよりもずっと低いため、これらの結果を米国に当てはめることは困難である。2型糖尿病の治療におけるピコリン酸クロムの効用を調べたその後の研究がある。15の臨床研究のうち、中国での研究を含む13の研究でピコリン酸クロムが糖尿病患者の血糖調整の少なくとも1つの測定値を向上させることが最近のレビューで報告された(24)。ピコリン酸クロムはその他のクロムサプリメントよりも生物学的に利用可能で、したがってより有効である可能性がある。しかしながら、2型糖尿治療病にクロムが有効かを決定するための2型糖尿病に対するクロム補給の大規模なランダム化対照試験が必要である。
妊娠糖尿病
妊娠糖尿病へのクロム補給の効果を調べた研究はほとんどない。妊娠糖尿病は約2%の妊婦に発生し、通常は妊娠期間の第二もしくは第三の三半期にみられる。発達中の胎児への悪影響を防ぐために、血糖値は厳しく調整されなければならない。出産後、耐糖性は一般的に正常に戻る。しかし、妊娠糖尿病を経験した妊婦のうち30~40%が、5~10年以内に2型糖尿病を発症する。妊婦の観察研究では、妊娠後期における耐糖能測定値またはインスリン測定値と血清クロム濃度が関連しているという結果はみられなかったが、血清クロム濃度は組織中のクロム濃度を反映していない可能性がある(25)。8週間にわたって毎日体重1kgあたり4μgのピコリン酸クロムを補給した妊娠糖尿病の妊婦は、空腹時血糖値およびインスリン濃度がプラセボを服用した妊婦よりも低かった。しかしながら、重大な高血糖を正常化するには、ピコリン酸クロムよりもインスリン療法の方が必要である(2,26)。
摂取源
食品の摂取源
食品中のクロムの量は変動が大きく、比較的少数の食品でのみ正確に測定されている。現在では、食品中のクロム含有量の大規模なデータベースはない。加工肉、未精白穀物製品、すぐに食べられるふすま入りシリアル、サヤインゲン、ブロッコリ、およびスパイスがクロムを比較的豊富に含む。ショ糖や果糖といった単糖を多く含む食品はクロムが少ないだけでなく、クロムの損失を促進することすらわかってきた(2)。米国でのクロムの推定平均摂取量は、成人女性で23~29μg/日、成人男性で39~54μg/日である(1)。下にいくつかの食品のクロム含有量をマイクログラム(μg)で示す(27)。同じ食品でもサンプル群ごとにクロム含有量が大きく異ることがわかっているため、下表の数字は食品のクロム含有量の目安として捉えなければならない。
サプリメント
三価クロムは、塩化クロム、ニコチン酸クロム、ピコリン酸クロム、および高クロム酵母などの形態で、サプリメントとして入手可能である。これらは、単体のサプリメントまたは他の成分との組み合わせのサプリメントとして販売されている。服用量は通常、クロム元素の量として50~200μg/日である(28)。ニコチン酸クロムとピコリン酸クロムは、塩化クロムよりも生物学的に利用しやすい可能性がある(17)。耐糖能異常や2型糖尿病の研究の多くでは、ピコリン酸クロムがクロム源として使用された。しかし、ピコリン酸クロムのサプリメントの長期間使用に関する安全性について、懸念が示されている(「安全性」の項参照)。
安全性
毒性
六価クロムは発がん性物質であると認識されている。塵に含まれる六価クロムにさらされると、肺がんの発生が増え、皮膚の炎症(皮膚炎)を引き起こすことが知られている。対照的に、三価クロムは人体に有害であるというエビデンスはほとんどない。食品やサプリメントからの三価クロムの過剰摂取で副作用があったという説得力のある報告がないので、米国医学研究所の食品栄養委員会(FNB)はクロムの許容上限摂取量(UL)を設定していない。情報が限られているので、FNBは三価クロムのサプリメントの大量摂取によって副作用がおこる可能性も認識し、注意を促している(1)。
長期の三価クロム補給による安全性への懸念の大部分は、いくつかの細胞培養研究から出たものであり、三価クロム、特にピコリン酸クロムがDNAの損傷を増大させる可能性を示唆している(29-31)。現在、三価クロムが生体組織のDNA損傷を増やすというエビデンスはない(1)。ピコリン酸クロムを400μg/日摂取した10人の女性の研究では、酸化されたDNAの塩基に対する抗体として測定されるDNAの酸化損傷が増えたというエビデンスはなかった(32)。
いくつかの研究では、毎日最大1,000μgのクロムを数ヶ月服用しても安全であったことが示されている(23,33)。しかし、ピコリン酸クロムへの重大な薬害反応の単独報告もいくつかある。ピコリン酸クロムとしてクロムを6週間にわたって600μg/日摂取した5ヶ月後に、腎不全が報告された(34)。また、ピコリン酸クロムとしてクロムを4~5ヶ月間1,200μg~2,400μg/日使用した後に、腎不全と肝機能障害が報告された(35)。さらに、24才の健康な成人男性がピコリン酸クロムを含むサプリメントを2週間摂取したところ、可逆性の急性腎不全を発症したと報告された(36)。腎臓や肝臓に既存の疾患がある個人は副作用のリスクが高まるかもしれないので、サプリメントでのクロムの摂取を限定すべきである(1)。
薬物相互作用
ヒトでのクロムに関する薬物相互作用については殆ど知られていない。炭酸カルシウムや、制酸薬を含む水酸化マグネシウムの大量摂取は、ラットではクロムの吸収を減少させる。対照的に、アスピリンおよびインドメタシン(非ステロイドの抗炎症薬)はともにラットでのクロムの吸収を増大させる(3)。
ライナス・ポーリング研究所の推奨
ヒトにおけるクロムの栄養状態を感度良く示す指標がないことから、健康を最大に増進するであろうクロムの摂取量を決定することは困難である。大部分の栄養素の一日摂取量(DV)を100%含むマルチビタミンやマルチミネラルのサプリメントを摂取するというLPIの推奨に従えば、60-120μg/日のクロムが一般的に摂取できる。これは成人女性で20-25μg、成人男性で30-35μg/日という目安量を大きく上回る。
中高年(50歳より上)
年齢が高くなるとクロムの需要も増えるのかどうかは知られていないが、髪、汗、および尿のクロム濃度は年齢とともに減少するという研究がある(37)。大部分の栄養素の一日摂取量(DV)を100%含むマルチビタミンやマルチミネラルのサプリメントを摂取するというLPIの推奨に従えば、大部分の中高年に十分な量のクロムが摂れる。
耐糖能異常や2型糖尿病は潜在的に重大な健康上の問題を伴うので、これらの症状を治療するために高用量のクロムサプリメントの摂取を検討している個人は、有資格のヘルスケア提供者と連携して摂取すべきである。
Authors and Reviewers
Written in April 2003 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in September 2007 by:
Victoria J. Drake, Ph.D.
Linus Pauling Institute
Oregon State University
Reviewed in September 2007 by:
Richard A. Anderson, Ph.D.
Lead Scientist
Beltsville Human Nutrition Research Center
Beltsville, Maryland
Copyright 2001-2023 Linus Pauling Institute
References
1. Food and Nutrition Board, Institute of Medicine. Chromium. Dietary reference intakes for vitamin A, vitamin K, boron, chromium, copper, iodine, iron, manganese, molybdenum, nickel, silicon, vanadium, and zinc. Washington, D.C.: National Academy Press; 2001:197-223. (National Academy Press)
2. Lukaski HC. Chromium as a supplement. Annu Rev Nutr. 1999;19:279-302. (PubMed)
3. Stoecker BJ. Chromium. In: Shils M, Olson JA, Shike M, Ross AC, eds. Nutrition in Health and Disease. 9th ed. Baltimore: Williams & Wilkins; 1999:277-282.
4. Vincent JB. Elucidating a biological role for chromium at a molecular level. Acc Chem Res. 2000;33(7):503-510. (PubMed)
5. Chen G, Liu P, Pattar GR, et al. Chromium activates glucose transporter 4 trafficking and enhances insulin-stimulated glucose transport in 3T3-L1 adipocytes via a cholesterol-dependent mechanism. Mol Endocrinol. 2006;20(4):857-870. (PubMed)
6. Pattar GR, Tackett L, Liu P, Elmendorf JS. Chromium picolinate positively influences the glucose transporter system via affecting cholesterol homeostasis in adipocytes cultured under hyperglycemic diabetic conditions. Mutat Res. 2006;610(1-2):93-100. (PubMed)
7. Wang H, Kruszewski A, Brautigan DL. Cellular chromium enhances activation of insulin receptor kinase. Biochemistry. 2005;44(22):8167-8175. (PubMed)
8. Campbell WW, Beard JL, Joseph LJ, Davey SL, Evans WJ. Chromium picolinate supplementation and resistive training by older men: effects on iron-status and hematologic indexes. Am J Clin Nutr. 1997;66(4):944-949. (PubMed)
9. Lukaski HC, Bolonchuk WW, Siders WA, Milne DB. Chromium supplementation and resistance training: effects on body composition, strength, and trace element status of men. Am J Clin Nutr. 1996;63(6):954-965. (PubMed)
10. Jeejeebhoy KN. The role of chromium in nutrition and therapeutics and as a potential toxin. Nutr Rev. 1999;57(11):329-335. (PubMed)
11. Lukaski HC. Magnesium, zinc, and chromium nutriture and physical activity. Am J Clin Nutr. 2000;72(2 Suppl):585S-593S. (PubMed)
12. Rubin MA, Miller JP, Ryan AS, et al. Acute and chronic resistive exercise increase urinary chromium excretion in men as measured with an enriched chromium stable isotope. J Nutr. 1998;128(1):73-78. (PubMed)
13. Mertz W. Chromium in human nutrition: a review. J Nutr. 1993;123(4):626-633. (PubMed)
14. Goldman L, Bennett JC. Cecil Textbook of Medicine. 21st ed. Philadelphia: W.B. Saunders Co.; 2000.
15. Anderson RA. Effects of chromium on body composition and weight loss. Nutr Rev. 1998;56(9):266-270. (PubMed)
16. Althuis MD, Jordan NE, Ludington EA, Wittes JT. Glucose and insulin responses to dietary chromium supplements: a meta-analysis. Am J Clin Nutr. 2002;76(1):148-155. (PubMed)
17. Kobla HV, Volpe SL. Chromium, exercise, and body composition. Crit Rev Food Sci Nutr. 2000;40(4):291-308. (PubMed)
18. Volpe SL, Huang HW, Larpadisorn K, Lesser II. Effect of chromium supplementation and exercise on body composition, resting metabolic rate and selected biochemical parameters in moderately obese women following an exercise program. J Am Coll Nutr. 2001;20(4):293-306. (PubMed)
19. Pittler MH, Stevinson C, Ernst E. Chromium picolinate for reducing body weight: meta-analysis of randomized trials. Int J Obes Relat Metab Disord. 2003;27(4):522-529. (PubMed)
20. Martin J, Wang ZQ, Zhang XH, et al. Chromium picolinate supplementation attenuates body weight gain and increases insulin sensitivity in subjects with type 2 diabetes. Diabetes Care. 2006;29(8):1826-1832. (PubMed)
21. Morris BW, MacNeil S, Hardisty CA, Heller S, Burgin C, Gray TA. Chromium homeostasis in patients with type II (NIDDM) diabetes. J Trace Elem Med Biol. 1999;13(1-2):57-61. (PubMed)
22. Hellerstein MK. Is chromium supplementation effective in managing type II diabetes? Nutr Rev. 1998;56(10):302-306. (PubMed)
23. Anderson RA, Cheng N, Bryden NA, Polansky MM, Chi J, Feng J. Elevated intakes of supplemental chromium improve glucose and insulin variables in individuals with type 2 diabetes. Diabetes. 1997;46(11):1786-1791. (PubMed)
24. Broadhurst CL, Domenico P. Clinical studies on chromium picolinate supplementation in diabetes mellitus--a review. Diabetes Technol Ther. 2006;8(6):677-687. (PubMed)
25. Gunton JE, Hams G, Hitchman R, McElduff A. Serum chromium does not predict glucose tolerance in late pregnancy. Am J Clin Nutr. 2001;73(1):99-104. (PubMed)
26. Jovanovic-Peterson L, Peterson CM. Vitamin and mineral deficiencies which may predispose to glucose intolerance of pregnancy. J Am Coll Nutr. 1996;15(1):14-20. (PubMed)
27. Anderson RA, Bryden NA, Polansky MM. Dietary chromium intake. Freely chosen diets, institutional diet, and individual foods. Biol Trace Elem Res. 1992;32:117-121. (PubMed)
28. Hendler SS, Rorvik DR, eds. PDR for Nutritional Supplements. Montvale: Medical Economics Company, Inc; 2001.
29. Blasiak J, Kowalik J. A comparison of the in vitro genotoxicity of tri- and hexavalent chromium. Mutat Res. 2000;469(1):135-145. (PubMed)
30. Speetjens JK, Collins RA, Vincent JB, Woski SA. The nutritional supplement chromium(III) tris(picolinate) cleaves DNA. Chem Res Toxicol. 1999;12(6):483-487. (PubMed)
31. Stearns DM, Wise JP, Sr., Patierno SR, Wetterhahn KE. Chromium(III) picolinate produces chromosome damage in Chinese hamster ovary cells. Faseb J. 1995;9(15):1643-1648. (PubMed)
32. Kato I, Vogelman JH, Dilman V, et al. Effect of supplementation with chromium picolinate on antibody titers to 5-hydroxymethyl uracil. Eur J Epidemiol. 1998;14(6):621-626. (PubMed)
33. Hathcock JN. Vitamins and minerals: efficacy and safety. Am J Clin Nutr. 1997;66(2):427-437. (PubMed)
34. Wasser WG, Feldman NS, D'Agati VD. Chronic renal failure after ingestion of over-the-counter chromium picolinate. Ann Intern Med. 1997;126(5):410.
35. Cerulli J, Grabe DW, Gauthier I, Malone M, McGoldrick MD. Chromium picolinate toxicity. Ann Pharmacother. 1998;32(4):428-431. (PubMed)
36. Wani S, Weskamp C, Marple J, Spry L. Acute tubular necrosis associated with chromium picolinate-containing dietary supplement. Ann Pharmacother. 2006;40(3):563-566. (PubMed)
37. Davies S, McLaren Howard J, Hunnisett A, Howard M. Age-related decreases in chromium levels in 51,665 hair, sweat, and serum samples from 40,872 patients--implications for the prevention of cardiovascular disease and type II diabetes mellitus. Metabolism. 1997;46(5):469-473. (PubMed)
ヨウ素
目次
非金属微量元素であるヨウ素は、ヒトの甲状腺ホルモンの合成に必要である。ヨウ素の欠乏は世界の多くの地域における重要な健康問題である。地球上のヨウ素の大部分は海に存在し、土壌のヨウ素の含有量は地域によって異なる。むき出しになった土壌表面が古いほど、ヨウ素は侵食によって浸み出してしまっている可能性が高い。ヒマラヤ、アンデス、アルプスといった山岳地帯や、ガンジス川のような洪水のあった川の流域は、世界でも最もひどくヨウ素が欠乏している地域に挙げられる(1)。
機能
ヨウ素は甲状腺ホルモンであるトリヨードチロニン(T3)とチロキシン(T4)の必須成分で、したがって甲状腺が正常に機能するために不可欠である。人体の甲状腺ホルモンの需要に答えるために、甲状腺は血液からヨウ素を捕捉し、甲状腺ホルモンにそれを取り込む。その甲状腺ホルモンは貯蔵され、必要に応じて血液に放出されて循環する。肝臓や脳といった標的組織では、生理学的活性を持つT3が細胞核の甲状腺ホルモン受容体と結合し、遺伝子発現を制御する。標的組織では、脱ヨード酵素として知られるセレン含有酵素によって、最も多く循環している甲状腺ホルモンであるT4がT3に変換される。このようにして甲状腺ホルモンは、成長、発達、代謝、生殖機能を含む多数の生理学的プロセスを制御している。(1,2)。
甲状腺機能の制御は、脳(視床下部)や脳下垂体も関係する複雑なプロセスである。視床下部からの甲状腺刺激ホルモン放出ホルモン(TRH)の分泌により、脳下垂体が甲状腺刺激ホルモン(TSH)を分泌する。これが甲状腺によるヨウ素の捕捉、甲状腺ホルモンの合成、およびT3やT4の放出を促進する。T4やT3が適切に循環して視床下部や脳下垂体のホルモン濃度にフィードバックされ、TRHやTSHの生成を減少させる(下図)。循環しているT4の濃度が減少した際には、脳下垂体がTSHの分泌を増やす。それによりヨウ素の捕捉が増え、T3およびT4の生成と放出も増える。ヨウ素が欠乏すると、T4の生成が不十分になる。血液中のT4の濃度が下がると、脳下垂体はTSHの排出量を増やす。TSH濃度が常に高いと、甲状腺腫としても知られる甲状腺肥大を引き起こす可能性がある(「欠乏症」の項参照)(3)。
視床下部からの甲状腺刺激ホルモン放出ホルモン(TRH)の分泌により、脳下垂体が甲状腺刺激ホルモン(TSH)を分泌する。これが甲状腺によるヨウ素の捕捉、甲状腺ホルモンの合成、およびT3(トリヨードチロニン)やT4(チロキシン)の放出を促進する。食物からのヨウ素の摂取が十分であると、T4やT3が適切に循環して視床下部や脳下垂体のホルモン濃度にフィードバックされ、TRHやTSHの生成を減少させる。循環しているT4の濃度が減少した際には、脳下垂体がTSHの分泌を増やす。それによりヨウ素の捕捉が増え、T3およびT4の生成と放出も増える。食事から摂取するヨウ素が欠乏すると、T4の生成が不十分になる。血液中のT4の濃度が下がると、脳下垂体はTSHの排出量を増やす。TSH濃度が常に高いと、甲状腺腫としても知られる甲状腺肥大を引き起こす可能性がある。
欠乏症
ヨウ素の欠乏は、予防可能な脳損傷の最も一般的な原因として世界中で認められている。ヨード欠乏症(IDD)の症状は、精神遅滞、甲状腺機能低下症、甲状腺腫、および様々な程度のその他の成長上や発達上の異常などを含む(1,4)。WHOは世界人口の30%以上(20億人)が、ヨウ素の栄養状態を示す尿中への排出ヨウ素濃度が100マイクログラム(μg)/リットル未満で、ヨウ素の摂取が不十分であると推定している。さらに、世界中の学童期(6~12歳)の子供のうち推定31.5%(2億6,600万人)は、ヨウ素の摂取が不足している(5)。大規模な国際的取り組みの結果、ヨウ素不足の国でのヨウ素添加塩の使用などにより、1990年代にヨウ素の欠乏は劇的に是正された(6)。今日では、世界の70%の世帯がヨウ素添加塩を使用している(7)。ヨード欠乏症を根絶するための国際的取り組みについては、ヨード欠乏症国際対策機構(ICCIDD)やWHOのウェブサイトを参照されたい。
甲状腺腫である甲状腺肥大は、ヨード欠乏症の最初の最も明白な兆候の一つである。甲状腺は、持続的なTSHの刺激によって肥大する(「機能」の項参照)。軽度のヨード欠乏症では、十分な甲状腺ホルモンがこれによる反応だけで人体に供給される可能性がある。しかし、もっと重度のケースのヨード欠乏症では、甲状腺機能低下症に陥る。適切にヨウ素を摂取することで甲状腺腫の大きさは一般的に小さくなるが、甲状腺機能低下症の可逆性は個人の発育段階によって異なる。ヨード欠乏症は発育のすべての段階において悪影響を及ぼすが、発達途上の脳に最も損害を与える。成長や発達の様々な側面の制御だけでなく、出生前および産後すぐに最も活発となる中枢神経系の髄鞘形成に、甲状腺ホルモンは重要である(2,6)。
発育段階ごとのヨード欠乏症の影響
出生前の発育
胎児のヨウ素欠乏は、母体のヨウ素欠乏に起因する。母親のヨウ素欠乏による最も深刻な影響の一つが、先天性甲状腺機能低下症である。重度の先天性甲状腺機能低下症は時にクレチン病と称される症状になり、不可逆性の精神遅滞に至る可能性がある。クレチン病は2つの形態で起こるが、それらにはかなりの症状の重複が見られる。神経性の症状では、精神や身体発育の遅滞および聴覚消失が特徴で、胎児の甲状腺が機能する前に胎児に影響する母体のヨウ素欠乏の結果である。粘液水腫性または甲状腺機能低下性の症状は、低身長および精神遅滞が特徴である。甲状腺機能低下性の症状は、ヨウ素欠乏に加えてセレン欠乏を伴い(「栄養素の相互作用」の項参照)、甲状腺ホルモン生産を阻害する食事中の甲状腺腫誘発物質と関係する(「甲状腺腫誘発物質」の項参照)(8)。
新生児および乳児
ヨウ素欠乏地域では乳児の死亡が増え、ヨード欠乏症を治すことで子供の生存率が上がることがいくつかの研究で示されている(9)。乳児期は急速な脳の成長および発達の時期である。適切なヨウ素の摂取による十分な甲状腺ホルモンが正常な脳の発達に欠かせない。先天性甲状腺機能低下症がなくても、乳児期のヨード欠乏は、異常な脳の発達やその結果としての知的障害に至る可能性がある(10)。
子供および青少年
子供や青少年のヨウ素欠乏は、しばしば甲状腺腫を伴う。甲状腺腫の発生は青少年期にピークとなり、女子に多い。ヨウ素欠乏地域の学童は、ヨウ素が十分な地域の学童に比べて学業成績が不振で、IQが低く、学習障害の発生率が高い。18の研究のメタ分析により、ヨード欠乏症だけで子供の平均IQが13.5%低下したと結論づけられた(11,12)。
成人
成人では、不適切なヨウ素の摂取によって、甲状腺腫や甲状腺機能低下症になる可能性がある。甲状腺機能低下症の影響は、成人の脳では子供よりも軽微であるが、甲状腺機能低下症によって応答時間が鈍化したり、精神機能が損なわれたりする(1)。甲状腺機能低下症のその他の症状としては、疲労、体重増加、寒冷不耐性、および便秘などがある。
妊娠および授乳
妊娠中および授乳中の女性は、ヨウ素の需要が増える(「RDA」の項参照)(6)。妊娠中のヨード欠乏症は、流産、死産、および先天性異常の発生と関係がある。しかも、妊娠中の深刻なヨード欠乏症は、出生児の先天性甲状腺機能低下症や神経認知欠損になる可能性がある(「出生前の発育」の項参照)(6,8)。ヨード欠乏症の授乳中の女性は、ヨード欠乏症の影響を特に受けやすいその子供たちに十分なヨウ素を供給できない可能性がある(「新生児および乳児」の項参照)(1)。米国甲状腺学会が推奨するように(13)、出生前に毎日150μgのヨウ素サプリメントを服用することは、米国の妊娠中および授乳中の女性がこれらの危険期に十分なヨウ素を確実に摂取することに役立つであろう。
ヨウ素の欠乏が甲状腺による血液中のヨウ素の捕捉を増加させるので、ヨード欠乏症の個人はすべての年齢で、放射線誘発性甲状腺がん(「疾病の予防」の項参照)やヨウ素に起因する甲状腺機能亢進症(「安全性」の項参照)になりやすい(1)。
栄養素の相互作用
セレンの欠乏がヨード欠乏症を悪化させることがある。ヨウ素は甲状腺ホルモンの合成に欠かせないが、セレンに依存する酵素(ヨードチロニンデヨージナゼ)も、チロキシン(T4)が生物学的活性を持つ甲状腺ホルモンであるトリヨードチロニン(T3)に変換されるのに必要である(6,8)。加えて、ビタミンAまたは鉄の欠乏が、ヨード欠乏症を悪化させる可能性がある(6,14)。
甲状腺腫誘発物質
食物の中にはヨウ素の利用や甲状腺ホルモンの生産を妨げる物質を含むものがあり、これらの物質は甲状腺腫誘発物質と呼ばれる。コンゴ民主共和国における甲状腺腫の発生は、キャッサバを食したことと関係する。これはチオシアン酸塩に代謝される化合物を含み、甲状腺によるヨウ素の摂取を阻害する。ある種のキビおよびアブラナ科の野菜(キャベツ、ブロッコリ、カリフラワー、および芽キャベツなど)も甲状腺腫誘発物質を含む。さらに、大豆イソフラボン、ゲニステイン、およびダイゼインが甲状腺ホルモンの合成を阻害することがわかっている(15)。これらの甲状腺腫誘発物質の大部分は、大量に摂取したりヨード欠乏症時に摂取したりしない限り、臨床的に問題ではない。最近では、喫煙がヨウ素欠乏地域における甲状腺腫のリスクの増大に関連している可能性があることが示された(16)。
ヨード欠乏症のリスクがある個人
適切なヨウ素強化プログラムなしでヨウ素欠乏地域に住む人々のヨード欠乏症のリスクはよく認識されているが、ヨウ素が十分だと思われている国でも、ある集団はヨウ素を適切に摂取していないのではないかという懸念が持ち上がっている。ヨウ素添加塩、魚、および海藻を摂らない菜食主義および非菜食主義の食事は、ヨウ素がほとんど含まれていないことが判明している(1,6,17,18)。尿中へのヨウ素の排出の研究によれば、ヨウ素の摂取はスイス(19)、ニュージーランド(20)、および米国(21)で減っていることが示唆されている。これはおそらく塩分摂取を減らす食事の推奨に固執する人が増えたからであろう。しかし、米国での2003~2004年の全国健康栄養調査のデータでは、ヨウ素の摂取は安定し(22)、米国は現在ヨウ素が足りていると考えられている。また、スイスにおける子供や妊婦のヨウ素の栄養状態が、1998年にヨウ素添加塩のヨウ素濃度の増加が義務付けられた後で改善したことが最近の研究でわかった(19)。スイスも現在ではヨウ素が足りていると考えられている(23)。
推奨量(RDA)
ヨウ素のRDAは、2001年に米国医学研究所の食品栄養委員会(FNB)によって再評価された。推奨量は、正常な甲状腺機能を持つ個人の甲状腺へのヨウ素蓄積量を測定する方法を含むいくつかの方法を用いて計算された(6)。これらの推奨量は、ヨード欠乏症国際対策機構、世界保健機構、およびユニセフの推奨量と一致している(2)。
疾病の予防
放射線誘発性甲状腺がん
放射性ヨウ素、特にヨウ素131Iは、原子炉事故の結果として環境中に放出されることがある。放射性ヨウ素の甲状腺への蓄積は、特に子供で甲状腺がんのリスクを高める。ヨウ素欠乏状態で甲状腺のヨウ素捕捉活動が高まると、放射性ヨウ素(131I)の甲状腺への蓄積が増えることになる。したがって、ヨード欠乏症の個人は放射線誘発性甲状腺がんの発症の危険性が高まる。なぜならそうした個人は放射性ヨウ素をより多く蓄積することになるからだ。原子炉事故による放射線被曝の48時間前または8時間後以内に薬理学的服用量のヨウ化カリウム(成人に50~100mg)を投与すると、甲状腺のヨウ素131Iの摂取を著しく減らすことができ、放射線誘発性甲状腺がんのリスクを減らすことができる(24)。1986年のチェルノブイリ原子炉事故後に、ポーランドで予防としてヨウ化カリウムを迅速に広範囲で使用したことが、ヨウ化カリウムによる予防が広く行われなかった放射性物質の降下地域に比べてポーランドでの子供の甲状腺がんの発生に著しい増加が見られなかったことを説明している可能性がある(25)。米国では、原子力発電所からの重大な放射性物質放出の事態における一般大衆の防護措置として、ヨウ化カリウムの使用を考慮することを原子力規制委員会(NRC)が要求している(26)。
疾病の治療
繊維嚢胞性乳腺症
繊維嚢胞性乳腺症とは、良性の(がんでない)乳房の状態で、片方または両方の乳房にしこりや不快感があるのが特徴である。エストロゲンで治療したラットでは、ヨード欠乏症によって繊維嚢胞性乳腺症に見られるものと似た変化が現れたが、ヨウ素を再補充してやるとこれらの変化が元に戻った(27)。繊維嚢胞性乳腺症の233人の女性を対象とした非対照研究(比較群を設定しない研究)では、ヨウ素分子(I2)の水溶液を毎日体重1kgあたり0.08mgの分量で6~18ヶ月間服用することで、70%以上が痛みやその他の症状がよくなった(28)。約10%の試験参加者が副作用を報告したが、それは研究者が軽微とみなすものだった。繊維嚢胞性乳腺症を持つ56人の女性によるヨウ素分子水溶液の二重盲検プラセボ対照試験(体重1kgあたり0.07~0.09mgのI2を毎日6ヶ月間)では、ヨウ素分子水溶液を服用した女性の65%が症状の改善を報告したのに対して、プラセボを服用した女性では33%であった(28)。近年行われた胸の痛みの記録がある111人の女性の二重盲検プラセボ対照臨床試験では、ヨウ素分子(3mg/日または6mg/日)を5ヶ月間服用することで全体的に痛みが軽減した(29)。この研究では、ヨウ素分子の服用量が最も高かった女性の半数以上が胸の痛みが50%以上軽減したと自己評価したのに対して、プラセボを服用した女性では8.3%だった。繊維嚢胞性乳腺症に対するヨウ素分子の治療効果を決定するには、大規模な対照臨床試験が必要である。これらの研究で使用されたヨウ素の服用量(体重60kgで3~7mg/日)は、米国医学研究所の食品栄養委員会(FNB)が推奨する許容上限摂取量(UL)よりも数倍高く、医師の管理下でのみ使用されるべきである(「安全性」の項参照)。
摂取源
食品の摂取源
大部分の食品のヨウ素含有量は、土壌のヨウ素含有量に依存する。海洋動物は海水からヨウ素を濃縮できるので、シーフードはヨウ素が豊富である。ある種の海藻(わかめなど)も、ヨウ素を非常に多く含む。加工食品は、ヨウ素酸カルシウムやヨウ素酸カリウムといった食品添加物またはヨウ素添加塩を加えてあるため、ヨウ素濃度が若干高い可能性がある。米国では動物の餌にヨウ素が一般に添加されているため、乳製品は比較的良好なヨウ素の摂取源である。英国および北欧では、ヨウ素含有量の低い牧草地で牛が草をはむ夏に、乳製品のヨウ素濃度が低下する傾向がある(6)。下表はヨウ素を豊富に含む食品のヨウ素含有量をマイクログラム(μg)で示したものである。ヨウ素の含有量は食品によって大きく変化するので、これらの数値は近似値とみなされるべきである(30)。
サプリメント
ヨウ化カリウムは、典型的にはマルチビタミンやマルチミネラルのサプリメントのような、他の成分との組み合わせの栄養補助食品として入手可能である。ヨウ化カリウムの全重量の約77%がヨウ素である(15)。ヨウ素の一日摂取量(DV)を100%含むマルチビタミンやマルチミネラルのサプリメントで、150μgのヨウ素が摂取できる。米国民の大部分はヨウ素添加塩や食品添加物によって十分なヨウ素を食事から摂取しているが、150μg/日のヨウ素を追加して摂取してもヨウ素摂取過多にはなりにくいであろう。(「安全性」の項参照)。
ヨウ化カリウムおよびヨウ素酸カリウムがヨウ素添加塩に使用されていることがある。米国およびカナダでは、ヨウ素添加塩1gあたり77μgのヨウ素を含む。その他の国では、塩1gあたり通常20~40μgのヨウ素を含む。ヨウ素の添加濃度は、その他の摂取源からのヨウ素の摂取量や毎日の塩の消費量などの変数で変わってくる。ヨウ素添加植物油の年間摂取量も、ヨウ素の摂取源として変数に使用する国もある(2,15)。
安全性
急性毒性
急性のヨウ素中毒はまれで、普通は何グラムも服用した場合にのみ起こる。急性ヨウ素中毒の症状は、口、喉、および胃の灼熱感、発熱、吐き気、嘔吐、下痢、弱脈、および昏睡である(6)。
ヨウ素の過剰摂取
自然食品の食事で2,000μg/日より多いヨウ素を摂取することはまれであり、大部分の食事では1,000μg/日未満である。食事に多量の海藻を含む北日本の海岸地域に住む人々は、50,000~80,000μg/日(50~80mg/日)のヨウ素を摂取していることがわかっている(1)。
ヨウ素欠乏状態では:ヨウ素不足の人々へのヨウ素補給プログラムで、主に年配者や多結節性甲状腺腫を持つ人々にヨウ素誘発性の甲状腺機能亢進症(IHH)の発生が増えた。ヨウ素欠乏状態の人々では、150~200μg/日のヨウ素摂取でIHHの発生が増えることがわかっている。ヨウ素の欠乏によって、正常な甲状腺の調節システム(「機能」の項参照)に反応しない自発的な甲状腺結節になるリスクが高まり、ヨウ素補給の後で甲状腺機能亢進症になる。IHHはヨード欠乏症であると考える専門家もいる。一般に、ヨウ素不足の人々への小さなリスクよりも、ヨウ素供給プログラムによる大きな利益の方が勝っている(1,31)。
ヨウ素充足状態では:ヨウ素が足りている人々(米国民など)では、過剰なヨウ素摂取が甲状腺刺激ホルモン(TSH)の血中濃度の上昇、甲状腺機能低下症、および甲状腺腫に関連することが最も一般的である。TSH濃度のわずかな上昇が甲状腺ホルモンが不適切に生成されていることを示すとは必ずしも限らないが、それはヨウ素摂取が過剰な場合の甲状腺機能の異常を示す最初の兆候である。ヨウ素が十分な成人では、1,700~1,800μg/日のヨウ素摂取でTSH濃度が上昇することがわかっている。甲状腺機能低下症を発症するリスクを最小限にするため、米国医学研究所の食品栄養委員会(FNB)は、ヨウ素の許容上限摂取量(UL)を成人で1,100μg/日に設定している。非常に高用量の(薬理学的服用量の)ヨウ素は、TSHによる甲状腺の刺激が高まることで甲状腺肥大(甲状腺腫)を引き起こす可能性がある。18,000μg/日(18mg/日)を超す量を長期間摂取することで、甲状腺腫の発生が増えることがわかっている。ヨウ素のULを年齢層ごとに下表に示す。ULは、医師による管理下でヨウ素による治療を受けている個人に適用されるものではない(6)。
| 年齢層 | UL(μg/日) |
|---|---|
| 乳児(0-12ヶ月) | 設定不能* |
| 幼児(1~3歳) | 200 μg/日 |
| 子供(4-8歳) | 300 μg/日 |
| 子供(9-13歳) | 600 μg/日 |
| 青少年(14-18歳) | 900 μg/日 |
| 成人(19歳以上) | 1,100 μg/日(1.1 mg/日) |
| *摂取源は食物および人工乳のみであるべきである。 | |
ヨウ素過剰摂取に感受性が高い個人
ヨード欠乏症、結節性の甲状腺腫、または自己免疫性甲状腺疾患を持つ個人は、一般の人々には安全であると考えられている摂取量でも敏感であり、ヨウ素摂取のULでは安全でない可能性がある(6)。嚢胞性線維症を持つ子供も、ヨウ素の過剰摂取による有害作用に対してより敏感である可能性がある(32)。
ヨウ素の過剰摂取と甲状腺がん
観察研究によって、ヨウ素の摂取増加が甲状腺乳頭がんの発生増加と関連することがわかった。この理由ははっきりしない。以前にヨウ素不足だった人々では、塩へのヨウ素添加計画で相対的に甲状腺乳頭がんの増加が増え、甲状腺濾胞がんが減った。一般に、甲状腺乳頭がんは甲状腺濾胞がんよりも侵攻性が弱く、予後も良い(33)。
薬物との相互作用
異常な心臓鼓動の予防に使用される薬のアミオダロンはヨウ素の含有量が高く、甲状腺の機能に影響する可能性がある。プロピオチオウラシル(PTU)やメチマゾールといった甲状腺機能亢進症の治療薬は、甲状腺機能低下症のリスクを増やす可能性がある。さらに、薬理学的服用量のヨウ化カリウムと一緒にリチウムを使用すると、甲状腺機能低下症になる可能性がある。また、薬理学的服用量のヨウ化カリウムは、ワルファリンの抗凝固効果を下げる可能性がある(6,32)。
ライナス・ポーリング研究所の推奨
ヨウ素のRDAは、甲状腺の正常な機能を十分に保証する。今日では、RDAより多くヨウ素を摂取しても利益があるというエビデンス(根拠)はない。米国の大部分の人々は食事で十分なヨウ素を摂取しており、補給は不要である。胎児の発育期と乳児期に十分なヨウ素を摂ることが重要であるので、妊婦および授乳中の女性は150μg/日のヨウ素を補給するサプリメントの服用を考慮すべきである(「欠乏症」の項参照)。
中高年(50歳より上)
加齢によってヨウ素の需要が著しく変化するということはないので、中高年にもヨウ素の摂取に関する推奨に変化はない。
Authors and Reviewers
Written in April 2003 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in March 2010 by:Victoria J. Drake, Ph.D.
Linus Pauling Institute
Oregon State University
Reviewed in March 2010 by:
Elizabeth N. Pearce, MD, MSc.
Associate Professor of Medicine
Section of Endocrinology, Diabetes, and Nutrition
Boston University School of Medicine
Copyright 2001-2024 Linus Pauling Institute
References
1. Hetzel BS, Clugston GA. Iodine. In: Shils M, Olson JA, Shike M, Ross AC, eds. Modern Nutrition in Health and Disease. 9th ed. Baltimore: Williams & Wilkins; 1999:253-264.
2. Dunn JT. What's happening to our iodine? J Clin Endocrinol Metab. 1998;83(10):3398-3400. (PubMed)
3. Larsen PR, Davies TF, Hay ID. The thyroid gland. In: Wilson JD, Foster DW, Kronenberg HM, Larsen PR, eds. Williams Textbook of Endocrinology. 9th ed. Philadelphia: W.B. Saunders Company; 1998:389-515.
4. World Health Organization. Eliminating Iodine Deficiency disorders. World Health Organization, [Web page]. 04/09/2003. http://www.who.int/nut/idd.htm. Accessed 04/11/2003.
5. de Benoist B, McLean E, Andersson M, Rogers L. Iodine deficiency in 2007: global progress since 2003. Food Nutr Bull. 2008;29(3):195-202. (PubMed)
6. Food and Nutrition Board, Institute of Medicine. Iodine. Dietary reference intakes for vitamin A, vitamin K, boron, chromium, copper, iodine, iron, manganese, molybdenum, nickel, silicon, vanadium, and zinc. Washington, D.C.: National Academy Press; 2001:258-289. (National Academy Press)
7. United Nations Children's Fund. The State of the World's Children 2007, UNICEF. New York; 2006. p. 109.
8. Levander OA, Whanger PD. Deliberations and evaluations of the approaches, endpoints and paradigms for selenium and iodine dietary recommendations. J Nutr. 1996;126(9 Suppl):2427S-2434S. (PubMed)
9. DeLong GR, Leslie PW, Wang SH, et al. Effect on infant mortality of iodination of irrigation water in a severely iodine-deficient area of China. Lancet. 1997;350(9080):771-773. (PubMed)
10. Hetzel BS. Iodine and neuropsychological development. J Nutr. 2000;130(2S Suppl):493S-495S. (PubMed)
11. Tiwari BD, Godbole MM, Chattopadhyay N, Mandal A, Mithal A. Learning disabilities and poor motivation to achieve due to prolonged iodine deficiency. Am J Clin Nutr. 1996;63(5):782-786. (PubMed)
12. Bleichrodt N, Shrestha RM, West CE, Hautvast JG, van de Vijver FJ, Born MP. The benefits of adequate iodine intake. Nutr Rev. 1996;54(4 Pt 2):S72-78.
13. Becker DV, Braverman LE, Delange F, et al. Iodine supplementation for pregnancy and lactation-United States and Canada: recommendations of the American Thyroid Association. Thyroid. 2006;16(10):949-951. (PubMed)
14. Zimmermann MB, Jooste PL, Pandav CS. Iodine-deficiency disorders. Lancet. 2008;372(9645):1251-1262. (PubMed)
15. Hendler SS, Rorvik DM, eds. PDR for Nutritional Supplements. 2nd ed. Montvale: Thomson Reuters; 2008.
16. Knudsen N, Bulow I, Laurberg P, Ovesen L, Perrild H, Jorgensen T. Association of tobacco smoking with goiter in a low-iodine-intake area. Arch Intern Med. 2002;162(4):439-443. (PubMed)
17. Remer T, Neubert A, Manz F. Increased risk of iodine deficiency with vegetarian nutrition. Br J Nutr. 1999;81(1):45-49. (PubMed)
18. Davidsson L. Are vegetarians an 'at risk group' for iodine deficiency? Br J Nutr. 1999;81(1):3-4.
19. Zimmermann MB, Aeberli I, Torresani T, Burgi H. Increasing the iodine concentration in the Swiss iodized salt program markedly improved iodine status in pregnant women and children: a 5-y prospective national study. Am J Clin Nutr. 2005;82(2):388-392. (PubMed)
20. Thomson CD, Woodruffe S, Colls A, Doyle TD. Urinary iodine and thyroid status of New Zealand residents. In: Roussel AM, Anderson RA, Favier A, eds. Trace Elements in Man and Animals. Vol 10. New York: Kluwer Academic Press; 2000:343-344.
21. Hollowell JG, Staehling NW, Hannon WH, et al. Iodine nutrition in the United States. Trends and public health implications: iodine excretion data from National Health and Nutrition Examination Surveys I and III (1971-1974 and 1988-1994). J Clin Endocrinol Metab. 1998;83(10):3401-3408. (PubMed)
22. Caldwell KL, Miller GA, Wang RY, Jain RB, Jones RL. Iodine status of the US population, National Health and Nutrition Examination Survey 2003-2004. Thyroid. 2008;18(11):1207-1214. (PubMed)
23. Iodine Level, United States, 2000. [Web page]. January, 2007. National Center for Health Statistics. Available at: http://www.cdc.gov/nchs/data/hestat/iodine.htm. Accessed 7/11/2007.
24. Zanzonico PB, Becker DV. Effects of time of administration and dietary iodine levels on potassium iodide (KI) blockade of thyroid irradiation by 131I from radioactive fallout. Health Phys. 2000;78(6):660-667. (PubMed)
25. Nauman J, Wolff J. Iodide prophylaxis in Poland after the Chernobyl reactor accident: benefits and risks. Am J Med. 1993;94(5):524-532.
26. Nuclear Regulatory Commission. Consideration of potassium iodide in emergency plans. Nuclear Regulatory Commission. Final rule. Fed Regist. 2001;66(13):5427-5440. (PubMed)
27. Eskin BA, Grotkowski CE, Connolly CP, Ghent WR. Different tissue responses for iodine and iodide in rat thyroid and mammary glands. Biol Trace Elem Res. 1995;49(1):9-19. (PubMed)
28. Ghent WR, Eskin BA, Low DA, Hill LP. Iodine replacement in fibrocystic disease of the breast. Can J Surg. 1993;36(5):453-460. (PubMed)
29. Kessler JH. The effect of supraphysiologic levels of iodine on patients with cyclic mastalgia. Breast J. 2004;10(4):328-336. (PubMed)
30. Pennington JAT, Schoen SA, Salmon GD, Young B, Johnson RD, Marts RW. Composition of core foods of the US food supply, 1982-1991. III. Copper, manganese, selenium, iodine. J Food Comp Anal. 1995;8:171-217.
31. Delange F. Risks and benefits of iodine supplementation. Lancet. 1998;351(9107):923-924.
32. Hendler SS, Rorvik DR, eds. PDR for Nutritional Supplements. Montvale: Medical Economics Company, Inc; 2001.
33. Feldt-Rasmussen U. Iodine and cancer. Thyroid. 2001;11(5):483-486. (PubMed)
セレン
目次
セレンは少量で必須の微量元素であるが,全ての必須元素と同様に,高レベルでは毒性を示す。人や動物は,セレノタンパク質とも呼ばれる多数のセレン依存性酵素の機能のためにセレンを必要とする。セレンタンパク質合成時に,セレノシステインは,機能性タンパク質を生成するために,アミノ酸配列中の極めて特異的な位置に導入される。動物と異なり,植物は生存にセレンを必要としないと考えられる。しかしながら,セレンが土壌中に存在すると,植物はセレンを非特異的にイオウ含有化合物へ取り込む (1)。
機能
セレノタンパク質
少なくとも25種のセレノタンパク質が同定されているが,代謝機能が確認されているのは,それらの半分程度である (2)。
以下のセレノタンパク質について,機能が確認されている。
グルタチオンペルオキシダーゼ
5種のセレン含有グルタチオンペルオキシダーゼ(GPx)が確認されている。細胞質型または古典型GPx,血漿型または細胞外型GPx,リン脂質ヒドロペルオキシド型GPx,消化器型GPx,嗅覚器型GPxの5種である (2)。各々のGPxは異なるセレノタンパク質であるが,それらは全て,グルタチオンの酸化と自身の還元と連動して,過酸化水素や脂質過酸化物のような活性酸素種(ROS)を分解し,水やアルコールに無害化し減少させる能力がある抗酸化酵素である(図参照)。酸化的損傷から発育精子を保護し,後に成熟精子に必要な構造タンパク質を形成する抗酸化酵素である精子ミトコンドリア鞘中のセレノタンパク質は,かつては別のセレノタンパク質と考えられていたが,現在ではリン脂質ヒドロペルオキシド型GPxと考えられている (3)。
過酸化水素1分子が2分子の水へ還元され,グルタチオン(GSH)2分子が,セレノ酵素であるグルタチオンペルオキシダーゼによる触媒反応で酸化される。酸化型グルタチオンは,フラビンアデニンジヌクレオチド(FAD)依存性酵素のグルタチオン還元酵素により還元される。
チオレドキシン還元酵素
化合物チオレドキシンと協同し,チオレドキシン還元酵素は,おそらくビタミンCを含む数種の抗酸化物質の再生に関与する。チオレドキシン還元酵素により還元型チオレドキシンを維持することが,細胞の生育と生存力の制御に重要である (2,4)。
ヨードチロニン脱ヨウ素酵素(甲状腺ホルモン脱ヨウ素酵素)
甲状腺は,極少量の生物学的に活性のある甲状腺ホルモン(トリヨードチロニンまたはT3),及び多量の不活性型甲状腺ホルモン(チロキシンまたはT4)を循環器系に放出する。循環器系及び細胞内に存在する生理活性型のT3の大部分は,セレン依存性のヨードチロニン脱ヨウ素酵素による触媒反応でT4からヨウ素1原子を除去することによって生成する。3種のセレン依存性ヨードチロニン脱ヨウ素酵素(タイプI,II及びIII)は,T3,T4または他の甲状腺ホルモン代謝物に作用し,甲状腺ホルモンを活性型と不活性型の両方にすることができる。従って,セレンは,甲状腺ホルモン制御の役割があるため,正常な発生,発育及び代謝に必須の元素である (2,5)。
セレノタンパクP
セレノタンパクPは血漿中に存在し,血管内皮細胞(血管内壁に位置する細胞)とも関係している。セレノタンパク質Pの主要な機能は,セレンを輸送することと考えられる (6)。このタンパクは,活性窒素種(RNS)である過酸化亜硝酸のような化合物による損傷から内皮細胞を保護する抗酸化剤としても働く (7)。
セレノタンパクW
セレノタンパクWは筋肉中に存在する。その機能は今のところ不明であるが,筋肉の代謝に役割を持つと考えられている (8)。6種の異なる動物由来のセレノタンパクWは約80%の相同性がある (9)。セレノタンパクWの追加情報は,
セレノリン酸合成酵素
セレノシステインのセレノタンパクへの組み込みは,遺伝子コードにより指示され,セレノリン酸合成酵素を必要とする。セレノタンパク自体もセレノリン酸合成酵素で,セレノタンパク合成に必要なセレノシステイン前駆体であるリン酸一セリンの合成を触媒する (2)。
メチオニン-R-スルホキシド還元酵素
メチオニン-R-スルホキシド還元酵素は,2つの別々の試験室によってセレノタンパクR及びセレノタンパクXとして最初に同定された。しかしながら,その後の研究で,このタンパク質が,還元剤としてチオレドキシンを利用する反応において,酸化型のメチオニン残基の立体特異的な還元反応を触媒することが明らかにされた。この特異的なセレノタンパクには2つの型が存在する (2)。
15κDAセレノタンパク(Sep 15)
Sep 15は,細胞の小胞体に位置する哺乳類のタンパク質である。ここで,Sep 15は,タンパク質の折畳みを感知する酵素であるUGGT(UDP-グルコース:糖タンパク質/グルコシルトランスフェラーゼ)と結合する。Sep 15は酸化還元機能を持ち,がん予防とも関連している (2)。
セレノタンパクV
セレノタンパクVは精巣だけに発現し,精子形成に働くと考えられている (2)。
セレノタンパクS
セレノタンパクSは,小胞体から細胞基質(サイトゾル)へのタンパク質の誤った折畳みを復帰転写することに関与している。このタンパク質は,炎症反応や免疫応答にも関与している (2)。
栄養成分との相互作用
抗酸化性の栄養成分
グルタチオンペルオキシダーゼとチオレドキシン還元酵素の必須部分として,セレンは細胞の酸化還元状態に関係する栄養成分と相互作用する(すなわち,酸化促進剤/抗酸化剤バランス)。抗酸化性酵素の重要成分である他のミネラル類は,銅(スーパーオキシド・ジスムターゼとして),亜鉛(スーパーオキシド・ジスムターゼとして)及び鉄(カタラーゼとして)である。グルタチオンペルオキシダーゼとしてのセレンは,脂質酸化を抑制するビタミンE(α-トコフェロール)の活性も助けると思われる。動物実験から,セレンとビタミンEが互いを補い,セレンが酸化ストレスにおいてビタミンE欠乏から起こる障害をいくつか抑制すること示唆されている (10)。さらに,チオレドキシン還元酵素は,酸化型ビタミンCのデヒドロアスコルビン酸からのビタミンC再生を触媒し,ビタミンCの抗酸化作用を維持する (6)。
ヨウ素
セレン欠乏は,ヨウ素欠乏の影響を悪化させる。ヨウ素は甲状腺ホルモンの合成に必須であるが,ヨードチロニン脱ヨウ素酵素と呼ばれるセレノ酵素も,チロキシン(T4)から生理活性のある甲状腺ホルモンのトリヨードチロシン(T3)への変換に必要とされる。少数の高齢者におけるセレン補給が血液中のT4を減少させ,脱ヨウ素活性が高くなってT4からT3への変換率が高くなることが示唆された (1)。
欠乏症
セレンの摂取不足は,数種のチオレドキシン還元酵素や甲状腺脱ヨウ素酵素だけでなく,グルタチオンペルオキシダーゼの活性低下を引き起こす。重度の場合でも,セレン欠乏だけでは,通常は明らかな臨床症状は起こさない。しかしながら,セレン欠乏者は,さらに生理的ストレスに対する感受性が増すと考えられる (11)。
セレン欠乏症のリスクが高い人
臨床的なセレン欠乏症は,継続的にセレン添加のない完全非経口栄養(TPN)を受けている慢性疾病患者に認められている。これらの患者において,筋力低下,筋消耗,心筋症(心筋の炎症と損傷)が観察されている。TPN液は,現在そのような問題を防止するためセレンが添加されている。小腸の大部分を外科除去された人やクローン病のような重度の胃腸障害の人もまた,吸収障害によるセレン欠乏リスクがある。フェニルケトン尿症(PKU)のような代謝障害の治療に用いられる特別な医療食は,しばしばセレン含量が低い。長期間にわたりそればかりが使用される特定用途食は,セレン補給が必要かどうか判断するためにセレン含量を調査すべきである (11)。
克山病(ケシャン病,セレン欠乏による心筋症)
ケシャン病は,中国のセレン欠乏地域の若い女性と子供がかかる心筋症である。この疾病の急性症状は,心不全の突然の発症により特徴付けられ,慢性型は,中度~重度の心臓肥大を引き起こし,心不全の程度によってその症状が異なる。ケシャン病の発生率は,食事からのセレン摂取量が極めて低いことと乏しいセレンの栄養状態と密接に相関している。セレンの補給はケシャン病を発症している人の予防になるが,一度発症した心筋損傷を元に戻すことはできない (11,12)。セレン欠乏がケシャン病の病因の中の基本的因子であるとの強い証拠はあるが,その発生の季節変動や年度変動から,セレン欠乏に加えて感染病原体が関与していることが示唆される。コクサッキーウィルスは,ケシャン病患者から単離されたウィルスの一種で,セレン欠乏マウスにおける研究において,このウィルスが,心筋炎と呼ばれる心臓の炎症を起こすことが認められている。マウスの研究においても,セレン欠乏により誘発される酸化ストレスが,ウィルスゲノムの変化を起こす。そのようなゲノム変化が,比較的毒性の低いウィルス株を心筋炎誘発性の株へ変換する (13,14)。ケシャン病と診断されなくても,セレン欠乏症は,心筋に侵入し障害を起こす作用を持つさらに毒性の強いウィルス株を発生させる可能性がある。セレンとウィルス感染に関する追加情報は「疾病の予防」参照。
カシンベック病
カシンベック病は,関節間の軟骨の退化により特徴づけられ(骨関節炎),中国北部,北朝鮮及びシベリア東部の各地域における乏しいセレン状態と関係している。この疾病は,5~13歳の子供がかかる。重度の疾病症状は,関節の奇形と矮小化を起こす。ケシャン病と異なり,セレンの栄養状態を改善することがカシンベック病の予防になるとの証拠はほとんどない。そのため,カシンベック病の病因におけるセレン欠乏の役割はあまり確実ではない。穀類中のカビ毒,ヨウ素欠乏及び汚染した飲料水など,多くの他の要因がカシンベック病について提案されている (11,12)。
推奨栄養所要量(RDA)
RDAは,医薬品協会の食品栄養委員会(FNB)により2000年に改訂された。最新のRDAは,血漿中の抗酸化酵素グルタチオンペルオキシダーゼの活性を最大化するために必要な食事からのセレン量に基づいている (15)。
疾病の予防
免疫機能
セレンの欠乏は,免疫系の機能損傷と関係している (16)。さらに,明らかにセレンが欠乏していない人でのセレン補給は,免疫反応を刺激すると考えられる。2つの小規模研究において,セレンを亜セレン酸ナトリウムとして200 μg/日を8週間補給された健常者 (17,18) と免疫抑制のある人 (19) が,対照群と比較し,生体外抗原に対する免疫細胞の応答を増感することが認められた。かなり多くの基礎研究から,セレンが,免疫反応を組織化するサイトカインと呼ばれる細胞のシグナル伝達物質の発現を制御する役割を担うことが示されている (20)。
ウィルス感染
セレン欠乏は,ある種のウィルス感染症の毒性や進行を増強すると考えられる。セレン欠乏に起因する酸化ストレスの増加は,いくつかのウィルス遺伝子の突然変異や発現の変化を誘発する可能性がある。セレン欠乏マウスに,比較的無害なコクサッキーウィルス株を接種したとき,ウィルスをさらに有害化させるウィルスゲノムの突然変異を発生させ,心筋炎といわれる心筋の炎症を誘発した。一度変異すると,このウィルスは,毒性の増強が,宿主の免疫系に及ぼすセレン欠乏の効果というよりも,むしろウィルスの変化によることが確認されたことから,セレン欠乏でないマウスにも心筋炎を誘発する。細胞質型(古典型)グルタチオンペルオキシダーゼ酵素を欠損したマウス(GPx-1ノックアウトマウス)の研究から,細胞質型グルタチオンペルオキシダーゼが,以前は良性であったウィルスのゲノムにおける突然変異に起因する心筋炎に対して,保護作用を持つことが確認された。セレン欠乏症は,グルタチオンペルオキシダーゼ活性を低下させ,ウィルスゲノムの酸化的損傷と突然変異率を増加させる。数名のケシャン病患者の血液から単離されたコクサッキーウィルスは,人におけるセレン欠乏に関係する心筋症発症の補助因子であることが示唆されている (21)。
がん
動物実験
高レベルでのセレン補給が,実験動物でがん発生頻度を低減することを示す多数の証拠がある。20種の動物モデルにおける自然発生,ウィルス性及び化学物質が誘発するがんについて報告された100以上の研究のうちの2/3以上から,セレン補給が腫瘍の発生頻度を有意に低減することが認められている (22)。セレンのメチル化体が,腫瘍に対する活性化学種で,メチル化セレン化合物が,過剰のセレン摂取で多量に産生することが示されている (23)。セレン摂取量と人におけるがんとの関係,及びセレン状態と動物における腫瘍発生頻度との関係が,要約されている (24)。
疫学研究
地域的な研究では,一貫して土壌中のセレン濃度が低く,食事からのセレン摂取量が比較的低い集団において,がんによる死亡率が高いことが認められている。セレン摂取量の変動が少ない集団におけるがん発生率についての疫学研究結果はあまり一致性がないが,そのような研究からも,セレンレベル(血液及び爪)の低い人が数種のがんの発生率も高い傾向が認められている。一方,この傾向は女性ではさほど顕著ではない。例えば,米国における60,000人以上の看護婦による前向き研究で,足指爪のセレン含量と全体のがんリスクとの間に相関が認められなかった (25)。
ウィルス性肝炎と喫煙は,様々ながんリスクを増加させることが知られており,低い食事からのセレン摂取がさらにがんリスクを高めるかもしれない。ウィルス性のB型肝炎やC型肝炎の慢性的感染は,有意に肝臓癌リスクを高くする。慢性のウィルス性B型またはC型肝炎である台湾男性の研究において,低い血漿中のセレン濃度が,肝臓癌のさらに高いリスクと相関がみられ,喫煙者と血漿中のビタミンAや他のカロテノイドレベルが低い人において,セレンレベルと肝臓癌との間の逆相関が強くなった (26)。9,000人以上のフィンランド男女における前向き研究内の症例-対照研究において,後に肺癌と診断された95人の血清中セレンレベルが,対照群190人と比較された (27)。低い血清中セレンレベルは,肺癌のリスク増加と相関が認められ,その相関関係は喫煙者でより顕著であった。このフィンランド人の集団において,セレンレベルは,他の西洋諸国で通常みられるレベルのわずか約60%であった。最近の16例の研究についてのメタアナリシスから,セレンが肺癌に対する保護作用を持つことが示唆されている。この解析において,足指爪のセレン含量によってセレン曝露を評価した研究を結合させた場合,肺癌の有意なリスク減少(54%減少率)が,セレン状態と相関していた。血清中のセレンレベルによりセレン状態を評価した研究を選択的に解析したところ,有意性はないながらも肺癌リスクの低下(20%減少率)が認められた (28)。
低い食事からのセレン摂取が,前立腺癌のリスク増加と相関を示すことを報告した研究もいくつかある。米国における50,000人以上の男性医療従事者による前向き研究内の症例-対照研究において,足指爪のセレン含量と前立腺癌リスクとの間に有意な逆相関が認められた。この研究では,進行性前立腺癌と診断された181人男性と181人の対照が参加していた (29)。この研究において,足指爪のセレン含量が平均の食事セレン摂取量159 μg/日に相当する人は,足指爪のセレン含量が平均摂取量86 μg/日に相当する人と比較して,進行性の前立腺癌リスクが65%低かった。9,000人以上の日系アメリカ人男性の前向き研究の範囲内で,249人の前立腺癌症例と249人対照を試験した症例-対照研究から,血清中セレンレベル最大四分位の男性が,最小四分位の人と比べ前立腺癌発症リスクが50%低いことが認められた (30)。ある症例-対照研究では,診断前血漿中セレンレベルの最小四分位の男性が,最大四分位の男性より,前立腺癌を4~5倍高い確率で発症することが認められた (31)。724人の前立腺癌症例と対照879人を比較した症例-対照研究において,血清中のセレンレベルは前立腺癌と相関が認められなかった (32)。対照的に,現在まで最も大規模な症例-対照研究の一つから,足指爪のセレンと結腸癌リスクとの間に有意な逆相関が認められたが,足指爪のセレンと乳癌や前立腺癌のリスクの間には,相関関係が認められなかった (33)。20例の疫学研究(主に症例-対照研究)のメタアナリシスでは,血清中や足指爪中のセレン濃度が,前立腺癌の人では有意に低かった (34)。一方で,295,000人男性コホートにおける最近の前向き研究で,高頻度のマルチビタミン使用(>週7回)とセレンサプリメント使用が,ともに進行性及び致死的な前立腺癌の有意な増加と相関がみられた (35)。セレン状態が前立腺癌と関係するかどうか解明するために,明らかに,さらに多くの前向き研究と臨床試験が必要である。
人における介入試験
栄養不良の集団:セレン補給による介入試験が,ウィルス性B型肝炎と肝臓癌の高リスク地域である 中国の啓東市の5地域に住む130,471人の一般集団で実施された。この試験では,1地区の集団(20,847人)に亜セレン酸ナトリウムを添加した食卓塩を供給し,4地区の人を対照とした。8年の追跡期間中に,肝臓癌の平均発症率がセレン強化群で35%まで低下し,対照群では減少が認められなかった。同じ地域での臨床試験において,慢性のB型肝炎感染者226人に,セレン強化酵母錠剤としてセレン200 μgまたはプラセボ酵母錠剤のいずれかを毎日供給された。4年間の追跡で,対照群113人中の7人が原発性の肝臓癌を発症し,セレンを補給された113被験者の誰も肝臓癌の発症がなかった (36)。
栄養が満たされた集団:米国において,非黒色腫性(非メラノーマ性)皮膚癌病歴のある1,300人以上の高齢者による二重盲検プラセボ対照試験で,平均7.4年間セレン強化酵母を200μg/日補給したとき,男性における前立腺癌発生率の49%の減少と相関がみられた (37)。セレン補給による予防効果は,初発時の血漿中セレンと前立腺特異性抗原(PSA)のレベルが低い男性で最も高かった。驚いたことに,この研究の最新結果では,セレン補給が皮膚癌の一種(扁平上皮がん)のリスクを25%まで増加させ (38),肺癌リスクを有意に低下させない (39) ことが示唆されている。セレンの補給は前立腺癌予防に有望であることは認められているが,他のタイプのがんリスクについての効果は不明である。これらの知見を確認する必要性に対応して,セレンの前立腺癌予防における役割をさらに調査することを意図した大規模なプラセボ対照研究がいくつか,現在行われている (24,40,41)。しかしながら,前立腺癌予防における効果証拠がないことから,セレンとビタミンEの補給による大規模な無作為プラセボ対照介入研究(すなわちSELECT研究)は,現在停止している (42)。SELECT研究で5.5年追跡された後,セレン補給(200 μg/日)だけ,またはビタミンEとの共補給は,前立腺癌,肺癌または大腸癌のリスクに影響がなかった (67)。
予想されるメカニズム
セレンのがん予防作用について,数種のメカニズムが提案されている。1) 抗酸化性セレノ酵素の活性を亢進させ抗酸化状態を改善する,2) 免疫系機能を改善する,3) 発がん物質の代謝に影響を与える,4) 腫瘍細胞の生育を阻害するセレン代謝物の濃度を高める,5) アポトーシスにおけるセレン影響,6) DNA修復におけるセレンの影響,及び7) 血管新生抑制剤としてのセレン。セレンの異なる用量で異なる抗がん作用を明らかにするための2段階モデルが提案されている。栄養的または生理学的用量(成人において40~100 μg/日)において,セレンは,抗酸化性セレノ酵素の活性を最大化し,おそらくは免疫系機能を亢進し,発がん物質の代謝に影響を与える可能性がある。栄養的に過多状態または薬理的レベル(成人で200~300 μg/日)において,セレン代謝物,特にセレンメチル化物の生成も,抗発がん作用を示すかもしれない (22,23)。
心血管系疾患
理論的には,セレン酵素の活性を最適化することは,脂質過酸化を抑制しプロスタグランジンのような細胞シグナル伝達物質の代謝に影響を及ぼすことによって,心血管系疾患リスクを低下できる。しかしながら,人における前向き研究では,セレンの心血管保護作用を強く支持するものは確認されていない。ある研究で,血清中のセレンレベル45 μg/L未満の人が45 μg/L以上の人と比較して心血管系疾患による病気や死亡が有意に増加することが認められているが,同じ血清中セレンのカットオフ値を用いた別の研究では,脳卒中による死亡だけに有意差が認められた (44)。中高齢のデンマーク人男性における研究で,血清中のセレンレベル79 μg/L未満の男性で心血管系疾患リスクの増加が認められたが (45),いくつかの研究から,セレンの栄養状態と心血管系疾患リスクとの間に,明確な逆相関は認められていない (46)。ヨーロッパにおける多機関研究において,足指の爪中セレンレベルと心筋梗塞(心臓マヒ)が,セレンのレベルが最小の機関だけ相関が認められた (47)。疫学研究の中には,低レベルのセレン(米国の一般人以下)が心血管系疾患リスクを高めることを示唆するものもあるが,心血管系疾患予防におけるセレンの役割に関する決定的証拠を得るためには,管理された臨床試験が必要である。
2型糖尿病
セレン状態が2型糖尿病のリスクに影響を及ぼすかどうかを調査した研究は少ししかないが,結果は様々である。ある研究では,2型糖尿病の男性の足指の爪中セレンレベルが,糖尿病でない男性より低いことが認められた (48)。対照的に別の研究では,2型糖尿病患者における高い血清中セレンレベルが報告された (49)。栄養によるがん予防研究(Nutritional Prevention of Cancer)の試験において1,202人男女が参加した最近の無作為二重盲検プラセボ対照試験では,セレン補給(200 μg/日;平均7.7年の追跡)が,2型糖尿病の罹患率の増加と関連することが認められた (50)。セレンとビタミンEによるがん予防研究(SELECT)において,セレン補給(200 μg/日;5.5年追跡)は,2型糖尿病のリスク増加と統計的に有意ではないが相関を示した (67)。
疾病の治療
HIV/AIDS
セレンと後天性免疫不全症候群(AIDS)を起こす人の免疫不全ウィルス(HIV)との間に,特異的な相互作用があると考えられている。HIV感染者のセレンレベル低下は,栄養不良が一つの要因になるとしても,疾病の進行と重度についての感度の良いマーカーである。低レベルの血漿中セレンも,HIVによる死亡リスクの有意な増加と相関がみられている。適切なセレンの栄養状態は,T細胞と呼ばれる重要な免疫系細胞の機能亢進とサイトカインと呼ばれる細胞内メッセンジャーの産生を変化させることによって,HIV感染への抵抗性を高めるかもしれない (20,51)。HIV感染において,酸化ストレスの増加は,おそらく特異的な転写経路を活性化することによって,ウィルスの複製をしやすくすると思われる。グルタチオンペルオキシダーゼとチオレドキシン還元酵素の必須成分として,セレンは,HIV感染細胞における酸化ストレス低下に重要な役割を持ち,おそらくHIVの複製率を抑制するものと考えられる (51)。最近の研究からは,HIVが,宿主のセレンをグルタチオンペルオキシダーゼ活性のあるウィルスのセレノタンパク質へ取り込むことができることが示唆されている。これらの知見の有意性はさらに解明する必要があるが,人の免疫系とウィルスの活性が,セレンの栄養状態に影響されることを示唆している (51-53)。
HIV感染者におけるセレン補給試験は数件だけ報告がある。2つの管理されていないセレンの補給試験(一つは,セレン強化酵母400 μg/日,もう一つは亜セレン酸ナトリウム80 μg/日+ビタミンC 25 mg/日を用いている)において,自覚的な改善は報告されたが,AIDS進行に関連する生物学的パラメータにはいかなる改善も認められなかった (54)。亜セレン酸ナトリウム100 μg/日を投与された15人のHIV感染患者と無投与群22人を1年間追跡した別の試験において,酸化ストレス抑制及び免疫活性化とAIDS進行の生物学的マーカーの有意な減少に関するエビデンスが得られた。しかしながら,補給群と無補給群の患者間で,CD4 T細胞数(HIV感染進行の重要な生物学的マーカー)や死亡率に有意差はみられなかった (55,56)。186人のHIV陽性男女における無作為対照試験から,セレンを200 μg/日で2年間補給したとき,入院率が有意に減少した (57)。最近の174人のHIV-1-陽性者における無作為二重盲検プラセボ対照試験で,9ヵ月間のセレン補給(セレン強化酵母200 μg/日)が,血清中のセレン濃度増加,CD4 T細胞数の増加及びHIV-1ウィルス量の進行停止と相関が認められた (58)。
摂取源
食品からの摂取源
セレンの最も豊富な食品摂取源は肉臓と水産食品であり,ついで肉類である。一般に,植物はセレンを必要としないと考えられているため,植物や穀類のセレン含量は広く変動している。従って,セレンの植物タンパク質への取り込みは,土壌からのセレン含量だけに依存する。ブラジルのセレンが多い土壌で生育したブラジルナッツは,ナッツ一粒で100 μg以上のセレンを供給し,セレンが少ない土壌で生育したナッツ類はセレンが10倍少ない (59)。米国において,穀類は良質のセレン摂取源であるが,果実や野菜は,セレン摂取源としては相対的によくない。概して,北米では飲料水は重要なセレン摂取源ではない。米国成人における平均の食事摂取量は,約80~110 μg/日の範囲である。米国における食品流通の傾向から,土壌中のセレンが低い地域に居住する米国人は,土壌中のセレンが比較的多い地域で生産される食品を食べているため,欠乏症を免れている (11,15)。数種のセレン摂取源となる食品とそのセレン含有量(μg)を下表に示した。特定食品についての追加の栄養成分情報は,USDA food composition databaseで検索できる。
サプリメント
セレンのサプリメントは数種の形態で市販されている。亜セレン酸ナトリウムとセレン酸ナトリウムは無機態のセレンである。セレン酸塩はほぼ完全に吸収されるが,タンパク質へ取り込まれる前にかなりの量が尿中に排泄される。亜セレン酸塩は,約50%しか吸収されないが,いったん吸収されるとセレン酸塩より保持されやすい。天然に食品中に存在する有機態セレンであるセレノメチオニンは,約90%吸収される (15)。セレノメチオニンと主としてセレノメチオニンを供給するためのセレン強化酵母も,サプリメントとして市販されている。消費者は,市場に出ているセレン酵母の形態が,酵母に主に無機態セレンをプラスしているものが含まれていることを知っておく必要がある。無機態と有機態の両方のセレンが,体内でセレノシステインへ代謝されセレノ酵素に取り込まれる (60)。
セレンを強化された野菜
セレンを強化されたニンニク,ブロッコリー,タマネギ及びランプ(細長い球根と白っぽい花を持つ北米の多年生植物)は,ラットにおいて化学物質が誘発する腫瘍を抑制することが認められている (24,61,62)。セレン強化野菜は,それらが産生するある種のセレン形態(メチル化セレンなど)が,既存のサプリメント形態より腫瘍生成の阻害作用が強いため,科学者の関心が寄せられている。
安全性
毒性
セレンは,他の栄養成分と同様健康に必要であるが,高用量のセレンは毒性を示す。急性及び致死性の毒性は,グラム量のセレンを偶発的または自殺のために摂取したことにより起こされている。臨床的に重要なセレン毒性は,製造上のミスによって錠剤あたり27.3 mg(27,300 μg)のセレンを含むサプリメントを摂取した13人で報告されている。慢性のセレン毒性(セレン中毒症)は,比較的少量のセレンを長期間摂取したときに起こる可能性がある。最も多く報告されているセレン中毒の症状は,髪と爪の脆弱化と消失である。その他の症状には,胃腸障害,皮膚発疹,ニンニク口臭,倦怠感,いらいら及び神経系異常がある。セレン中毒の罹患率が高い中国のある地域において,血液中のセレン濃度が摂取量850 μg/日に相当するレベルに達する頻度が高くなると毒性影響が発生していた。医薬品協会の食品栄養委員会(FNB)は,最近,髪や爪の脆弱化と消失の予防と初期の慢性的なセレン毒性に基づいて,セレンの耐容上限摂取レベル(UL)を成人で400 μg/日と設定した (15)。成人についてのUL 400 μg/日(下表参照)は,食品に由来するセレンも含まれ,食品からのセレンは,サプリメントからのセレンと合わせ,米国成人で平均約100 μg/日である。最新のRDAとULの設定に用いられたデータについての詳細情報について,
| 年齢群 | UL (μg/日) |
|---|---|
| 乳児:0~6ヵ月 | 45 |
| 乳児;6~12ヵ月 | 60 |
| 子供;1~3歳 | 90 |
| 子供;4~8歳 | 150 |
| 子供:9~13歳 | 280 |
| 青少年;14~18歳 | 400 |
| 成人;19歳以上 | 400 |
薬物との相互作用
現在,セレンと医薬品との間の相互作用はあまりわかっていない (63)。抗てんかん治療薬のバルプロ酸が,血清中のセレンレベルを減少させることが認められている。動物実験では,亜セレン酸ナトリウムの補給が,抗菌剤のニトロフラントインと除草剤パラコートの毒性を弱めることが認められている (64)。
抗酸化性サプリメントとHMG-CoA還元酵素阻害剤(スタチン系薬剤)
冠動脈心疾患(CHD)の病歴がありHDLレベルが低い160人の患者における3年間の無作為対照試験において,シンバスタチン(Zocor)とナイアシンの併用がHDL2レベルを増加させ,冠状動脈狭窄(狭小化)の進行を抑制し,心筋梗塞(心臓マヒ)や脳卒中などの心血管系症例の発生頻度を減少させることが認められた (65)。驚くべきことに,抗酸化剤混合剤(ビタミンC 1,000 mg,α-トコフェロール 800 IU,セレン100 μg及びβ-カロテン 25 mgを毎日)をシバスタチン-ナイアシン混合剤とともに服用すると,予防効果がなくなった。セレンのこの効果への個別寄与は判断できないが,これらの結果は,抗酸化サプリメントとHMG-CoA還元酵素阻害剤(スタチン類)などのコレステロール降下薬との間の潜在的な相互作用について,追加研究が必要であることを強調している。
ライナスポーリング研究所の推奨
平均的な米国人食事は,現行RDA(55 μg/日)を十分超える量である約100 μg/日のセレンを供給していると推定され,血漿中および細胞内のグルタチオンペルオキシダーゼ活性を最大化するために十分と考えられる。マルチビタミン/マルチミネラル・サプリメント中のセレン量はかなり様々であるが,まれに,一日栄養所要量(DV)の70 μg以上を供給するマルチビタミン/マルチミネラル・サプリメントもある。様々な食事を摂り,毎日マルチビタミン・サプリメントを摂取することが,米国の大部分の人々にとって十分なセレンを供給することになる。
男性
栄養状態の良好な集団におけるセレン補給ががんリスクに及ぼす効果を試験した,管理された研究から,200 μg/日のセレン補給が,男性における前立腺癌のリスクを49%まで有意に低減させることが認められている (37)。一方,皮膚癌の一種のリスクは25%まで増加した (38)。前立腺癌による死亡率は,皮膚の扁平上皮癌による死亡率よりかなり高いが,これらの知見から,セレン補給ががんリスクに及ぼす全体的な影響は,いまだセレンサプリメントの追加補給の一般的推奨を支持するには十分クリアではない。より最近の,かなり大規模な無作為プラセボ対照介入試験,SELECT研究において,200 μg/日のセレンは,前立腺癌リスクに変化を与えなかった (67)。前立腺癌リスク低減のためにセレンを補給する男性は,200 μg/日を超過しないようすべきであり,扁平上皮癌リスクを低減するために,日焼け止めや長い間の日光曝露を避けるなどの注意を払う必要がある。
女性
セレン補給が,セレン欠乏症ではない女性でのがんリスクを低減するというエビデンスはないため,女性が余分にセレンサプリメントを摂る理由はない。しかしながら,動物実験からは,乳房腫瘍がセレンによって有意に低減されることが示唆され (66),現在進行中の2つの人による試験が,女性におけるこの相関関係についてのより決定的な情報を提供するはずである (24)。
高齢者(65歳以上)
加齢はセレンの必要量における有意な変化とは相関がないため,Linus Pauling Instituteのセレンに関する推奨は,高齢の男女でも同じである。
Authors and Reviewers
Written in October 2003 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in November 2007 by:
Victoria J. Drake, Ph.D.
Linus Pauling Institute
Oregon State University
Reviewed in November 2007 by:
Philip D. Whanger, Ph.D.
Professor, Emeritus Dept. of Environmental and Molecular Toxicology
Oregon State University
Last updated 1/22/09 Copyright 2001-2024 Linus Pauling Institute
References
1. Rayman MP. The importance of selenium to human health. Lancet. 2000;356(9225):233-241. (PubMed)
2. Gladyshev VN. Selenoproteins and selenoproteomes. In: Hatfield DL, Berry MJ, Gladyshev VN, eds. Selenium: Its molecular biology and role in human health. 2nd ed. New York: Springer; 2006:99-114.
3. Ursini F, Heim S, Kiess M, et al. Dual function of the selenoprotein PHGPx during sperm maturation. Science. 1999;285(5432):1393-1396. (PubMed)
4. Mustacich D, Powis G. Thioredoxin reductase. Biochem J. 2000;346 Pt 1:1-8. (PubMed)
5. Bianco AC, Larsen PR. Selenium, deiodinases and endocrine function. In: Hatfield DL, Berry MJ, Gladyshev VN, eds. Selenium: Its Molecular Biology and Role in Human Health. 2nd ed. New York: Springer; 2006:207-219.
6. Burk RF, Olson GE, Hill KE. Deletion of selenoprotein P gene in the mouse. In: Hatfield DL, Berry MJ, Gladyshev VN, eds. Selenium: Its Molecular Biology and Role in Human Health. 2nd ed. New York: Springer; 2006:111-122.
8. Kioussi C, Whanger PD. Selenoprotein W in development and oxidative stress. In: Hatfield DL, Berry MJ, Gladyshev VN, eds. Selenium: Its Molecular Biology and Role in Human Health. 2nd ed. New York: Springer; 2006:135-140.
9. Gu QP, Beilstein MA, Vendeland SC, Lugade A, Ream W, Whanger PD. Conserved features of selenocysteine insertion sequence (SECIS) elements in selenoprotein W cDNAs from five species. Gene. 1997;193(2):187-196.
12. Foster LH, Sumar S. Selenium in health and disease: a review. Crit Rev Food Sci Nutr. 1997;37(3):211-228. (PubMed)
13. Levander OA. Coxsackievirus as a model of viral evolution driven by dietary oxidative stress. Nutr Rev. 2000;58(2 Pt 2):S17-24.
14. Beck MA, Esworthy RS, Ho YS, Chu FF. Glutathione peroxidase protects mice from viral-induced myocarditis. Faseb J. 1998;12(12):1143-1149. (PubMed)
15. Food and Nutrition Board, Institute of Medicine. Selenium. Dietary reference intakes for vitamin C, vitamin E, selenium, and carotenoids. Washington D.C.: National Academy Press; 2000:284-324. (National Academy Press)
16. McKenzie RC, Beckett GJ, Arthur JR. Effects of selenium on immunity and aging. In: Hatfield DL, Berry MJ, Gladyshev VN, eds. Selenium: Its Molecular Biology and Role in Human Health. 2nd ed. New York: Springer; 2006:311-323.
17. Roy M, Kiremidjian-Schumacher L, Wishe HI, Cohen MW, Stotzky G. Supplementation with selenium and human immune cell functions. I. Effect on lymphocyte proliferation and interleukin 2 receptor expression. Biol Trace Elem Res. 1994;41(1-2):103-114. (PubMed)
18. Kiremidjian-Schumacher L, Roy M, Wishe HI, Cohen MW, Stotzky G. Supplementation with selenium and human immune cell functions. II. Effect on cytotoxic lymphocytes and natural killer cells. Biol Trace Elem Res. 1994;41(1-2):115-127. (PubMed)
19. Kiremidjian-Schumacher L, Roy M, Glickman R, et al. Selenium and immunocompetence in patients with head and neck cancer. Biol Trace Elem Res. 2000;73(2):97-111. (PubMed)
20. Baum MK, Miguez-Burbano MJ, Campa A, Shor-Posner G. Selenium and interleukins in persons infected with human immunodeficiency virus type 1. J Infect Dis. 2000;182 Suppl 1:S69-73. (PubMed)
21. Beck MA. Selenium and viral infections. In: Hatfield DL, Berry MJ, Gladyshev VN, eds. Selenium: Its Molecular Biology and Role in Human Health. 2nd ed. New York: Springer; 2006:287-298.
22. Combs GF, Jr., Gray WP. Chemopreventive agents: selenium. Pharmacol Ther. 1998;79(3):179-192. (PubMed)
23. Ip C. Lessons from basic research in selenium and cancer prevention. J Nutr. 1998;128(11):1845-1854. (PubMed)
24. Whanger PD. Selenium and its relationship to cancer: an update. Br J Nutr. 2004;91(1):11-28. (PubMed)
26. Yu MW, Horng IS, Hsu KH, Chiang YC, Liaw YF, Chen CJ. Plasma selenium levels and risk of hepatocellular carcinoma among men with chronic hepatitis virus infection. Am J Epidemiol. 1999;150(4):367-374. (PubMed)
27. Knekt P, Marniemi J, Teppo L, Heliovaara M, Aromaa A. Is low selenium status a risk factor for lung cancer? Am J Epidemiol. 1998;148(10):975-982. (PubMed)
28. Zhuo H, Smith AH, Steinmaus C. Selenium and lung cancer: a quantitative analysis of heterogeneity in the current epidemiological literature. Cancer Epidemiol Biomarkers Prev. 2004;13(5):771-778. (PubMed)
29. Yoshizawa K, Willett WC, Morris SJ, et al. Study of prediagnostic selenium level in toenails and the risk of advanced prostate cancer. J Natl Cancer Inst. 1998;90(16):1219-1224. (PubMed)
30. Nomura AM, Lee J, Stemmermann GN, Combs GF, Jr. Serum selenium and subsequent risk of prostate cancer. Cancer Epidemiol Biomarkers Prev. 2000;9(9):883-887. (PubMed)
31. Brooks JD, Metter EJ, Chan DW, et al. Plasma selenium level before diagnosis and the risk of prostate cancer development. J Urol. 2001;166(6):2034-2038. (PubMed)
32. Peters U, Foster CB, Chatterjee N, et al. Serum selenium and risk of prostate cancer-a nested case-control study. Am J Clin Nutr. 2007;85(1):209-217. (PubMed)
33. Ghadirian P, Maisonneuve P, Perret C, et al. A case-control study of toenail selenium and cancer of the breast, colon, and prostate. Cancer Detect Prev. 2000;24(4):305-313. (PubMed)
34. Brinkman M, Reulen RC, Kellen E, Buntinx F, Zeegers MP. Are men with low selenium levels at increased risk of prostate cancer? Eur J Cancer. 2006;42(15):2463-2471. (PubMed)
35. Lawson KA, Wright ME, Subar A, et al. Multivitamin use and risk of prostate cancer in the National Institutes of Health-AARP Diet and Health Study. J Natl Cancer Inst. 2007;99(10):754-764. (PubMed)
36. Yu SY, Zhu YJ, Li WG. Protective role of selenium against hepatitis B virus and primary liver cancer in Qidong. Biol Trace Elem Res. 1997;56(1):117-124. (PubMed)
37. Duffield-Lillico AJ, Dalkin BL, Reid ME, et al. Selenium supplementation, baseline plasma selenium status and incidence of prostate cancer: an analysis of the complete treatment period of the Nutritional Prevention of Cancer Trial. BJU Int. 2003;91(7):608-612. (PubMed)
38. Duffield-Lillico AJ, Slate EH, Reid ME, et al. Selenium supplementation and secondary prevention of nonmelanoma skin cancer in a randomized trial. J Natl Cancer Inst. 2003;95(19):1477-1481. (PubMed)
39. Reid ME, Duffield-Lillico AJ, Garland L, Turnbull BW, Clark LC, Marshall JR. Selenium supplementation and lung cancer incidence: an update of the nutritional prevention of cancer trial. Cancer Epidemiol Biomarkers Prev. 2002;11(11):1285-1291. (PubMed)
40. Klein EA, Thompson IM, Lippman SM, et al. SELECT: the Selenium and Vitamin E Cancer Prevention Trial: rationale and design. Prostate Cancer Prostatic Dis. 2000;3(3):145-151. (PubMed)
41. Clark LC, Marshall JR. Randomized, controlled chemoprevention trials in populations at very high risk for prostate cancer: Elevated prostate-specific antigen and high-grade prostatic intraepithelial neoplasia. Urology. 2001;57(4 Suppl 1):185-187. (PubMed)
42. National Cancer Institute. Review of Prostate Cancer Prevention Study Shows No Benefit for Use of Selenium and Vitamin E Supplements. [Web page]. http://www.cancer.gov/newscenter/pressreleases/SELECTresults2008. Accessed 10/28/08.
43. Salonen JT, Alfthan G, Huttunen JK, Pikkarainen J, Puska P. Association between cardiovascular death and myocardial infarction and serum selenium in a matched-pair longitudinal study. Lancet. 1982;2(8291):175-179. (PubMed)
44. Virtamo J, Valkeila E, Alfthan G, Punsar S, Huttunen JK, Karvonen MJ. Serum selenium and the risk of coronary heart disease and stroke. Am J Epidemiol. 1985;122(2):276-282. (PubMed)
45. Suadicani P, Hein HO, Gyntelberg F. Serum selenium concentration and risk of ischaemic heart disease in a prospective cohort study of 3000 males. Atherosclerosis. 1992;96(1):33-42. (PubMed)
46. Salvini S, Hennekens CH, Morris JS, Willett WC, Stampfer MJ. Plasma levels of the antioxidant selenium and risk of myocardial infarction among U.S. physicians. Am J Cardiol. 1995;76(17):1218-1221. (PubMed)
47. Kardinaal AF, Kok FJ, Kohlmeier L, et al. Association between toenail selenium and risk of acute myocardial infarction in European men. The EURAMIC Study. European Antioxidant Myocardial Infarction and Breast Cancer. Am J Epidemiol. 1997;145(4):373-379. (PubMed)
48. Rajpathak S, Rimm E, Morris JS, Hu F. Toenail selenium and cardiovascular disease in men with diabetes. J Am Coll Nutr. 2005;24(4):250-256. (PubMed)
49. Bleys J, Navas-Acien A, Guallar E. Serum selenium and diabetes in U.S. adults. Diabetes Care. 2007;30(4):829-834. (PubMed)
50. Stranges S, Marshall JR, Natarajan R, et al. Effects of Long-Term Selenium Supplementation on the Incidence of Type 2 Diabetes: A Randomized Trial. Ann Intern Med. 2007;147(4):217-223. (PubMed)
51. Baum MK, Campa A. Role of selenium in HIV/AIDS. In: Hatfield DL, Berry MJ, Gladyshev VN, eds. Selenium: Its Molecular Biology and Role in Human Health. 2nd ed. New York: Springer; 2006:299-310.
52. Zhao L, Cox AG, Ruzicka JA, Bhat AA, Zhang W, Taylor EW. Molecular modeling and in vitro activity of an HIV-1-encoded glutathione peroxidase. Proc Natl Acad Sci U S A. 2000;97(12):6356-6361. (PubMed)
53. Zhang W, Ramanathan CS, Nadimpalli RG, Bhat AA, Cox AG, Taylor EW. Selenium-dependent glutathione peroxidase modules encoded by RNA viruses. Biol Trace Elem Res. 1999;70(2):97-116. (PubMed)
54. Constans J, Conri C, Sergeant C. Selenium and HIV infection. Nutrition. 1999;15(9):719-720.
55. Delmas-Beauvieux MC, Peuchant E, Couchouron A, et al. The enzymatic antioxidant system in blood and glutathione status in human immunodeficiency virus (HIV)-infected patients: effects of supplementation with selenium or beta-carotene. Am J Clin Nutr. 1996;64(1):101-107. (PubMed)
56. Constans J, Delmas-Beauvieux MC, Sergeant C, et al. One-year antioxidant supplementation with beta-carotene or selenium for patients infected with human immunodeficiency virus: a pilot study. Clin Infect Dis. 1996;23(3):654-656.
57. Burbano X, Miguez-Burbano MJ, McCollister K, et al. Impact of a selenium chemoprevention clinical trial on hospital admissions of HIV-infected participants. HIV Clin Trials. 2002;3(6):483-491. (PubMed)
58. Hurwitz BE, Klaus JR, Llabre MM, et al. Suppression of human immunodeficiency virus type 1 viral load with selenium supplementation: a randomized controlled trial. Arch Intern Med. 2007;167(2):148-154. (PubMed)
59. Chang JC. Selenium content of brazil nuts from two geographic locations in Brazil. Chemosphere. 1995;30:801-802.
60. Schrauzer GN. Selenomethionine: a review of its nutritional significance, metabolism and toxicity. J Nutr. 2000;130(7):1653-1656. (PubMed)
61. Whanger PD, Ip C, Polan CE, Uden PC, Welbaum G. Tumorigenesis, metabolism, speciation, bioavailability, and tissue deposition of selenium in selenium-enriched ramps (Allium tricoccum). J Agric Food Chem. 2000;48(11):5723-5730. (PubMed)
62. Ip C, Birringer M, Block E, et al. Chemical speciation influences comparative activity of selenium-enriched garlic and yeast in mammary cancer prevention. J Agric Food Chem. 2000;48(6):2062-2070. (PubMed)
63. Azrak RG, Cao S, Pendyala L, et al. Efficacy of increasing the therapeutic index of irinotecan, plasma and tissue selenium concentrations is methylselenocysteine dose dependent. Biochem Pharmacol. 2007;73(9):1280-1287. (PubMed)
65. Brown BG, Zhao XQ, Chait A, et al. Simvastatin and niacin, antioxidant vitamins, or the combination for the prevention of coronary disease. N Engl J Med. 2001;345(22):1583-1592. (PubMed)
66. Ip C, Ganther HE. Novel stategies in selenium cancer chemoprevention research. In: Burk RF, ed. Selenium in biology and human health. New York: Springer-Verlag; 1994:169-180.
67. Lippman SM, Klein EA, Goodman PJ, et al. Effect of selenium and vitamin E on risk of prostate cancer and other cancers: the Selenium and Vitamin E Cancer Prevention Trial (SELECT). JAMA. 2009;301(1):39-51. (PubMed)
ナトリウム(塩化物)
目次
塩(塩化ナトリウム)は生命に不可欠である。人体におけるナトリウムと塩化物の濃度を厳格に管理することは非常に重要なので、それらを制御するために複数のメカニズムが協働する。最低限の量の塩が生きるために必要であることは科学者も認めるところであるが、過剰な塩の摂取が健康に与える影響は、科学者、臨床医、および保健専門家の間で継続して研究がなされている分野である(1)。
機能
ナトリウムイオン(Na+:以下「ナトリウム」と称する)および塩化物イオン(Cl-:以下「塩化物」と称する)は、血漿を含む細胞外液の主要なイオンである。したがって、それらは多数の生命維持プロセスにおいて重要な役割を果たす(2)。
細胞膜電位の維持
ナトリウムおよび塩化物は細胞膜の内外での濃度維持や電位差に寄与する電解物である。カリウムは細胞内で正の電荷を帯びたイオン(カチオン)の主たるものであり、ナトリウムは細胞外液での主なカチオンである。カリウムの濃度は細胞内では細胞外より約30倍も高い。一方で、ナトリウムは細胞内では細胞外より10倍以上も濃度が低い。細胞膜の内外でのカリウムとナトリウムの濃度差は、細胞膜電位として知られる電気化学的勾配を作り出す。細胞膜電位は、細胞膜のイオンポンプ、特にナトリウム-カリウムポンプによって維持される。これらのポンプは、カリウムと交換にナトリウムを細胞外に汲み出すためにATP(エネルギー)を使用する(下図参照)。その活動は、典型的な成人では安静時のエネルギー消費の20~40%を占めると推定される。ナトリウム/カリウムの濃度勾配の維持に使われるエネルギーの割合が多いということは、この機能が生命維持に重要であることの証である。細胞膜電位の厳密な制御は、神経インパルスの伝達、筋肉の収縮、および心機能にとって重要である。(3,4)
細胞壁を挟んでのカリウムイオンとナトリウムイオンの濃度差が、細胞膜電位として知られる電気化学的勾配を生む。アデノシン三リン酸(ATP)が、3つのナトリウムイオンを2つのカリウムイオンと交換に細胞の外に汲み出すエネルギーを提供し、細胞膜電位を維持する。
栄養素の吸収と輸送
小腸でのナトリウムの吸収は、塩化物、アミノ酸、ブドウ糖、および水分の吸収に重要な役割を果たす。同様のメカニズムは、これらの栄養素が腎臓によって血液から濾し取られた後でのこれらの栄養素の再吸収にも係る。塩酸(HCL)の形での塩化物は胃液の重要な成分でもあり、それは多くの栄養素の消化と吸収を助ける(2,5)。
血液量および血圧の維持
ナトリウムは血液量を含む細胞外液の量を決める主要な決定要因であるので、血液量や血圧を調整する数々の生理的メカニズムは、体内のナトリウム量を調整することによって機能する。循環器系では、圧力の受容体(圧受容器)が血圧の変化を感知し、興奮性または抑制性の信号を神経系および/または内分泌腺に送って、腎臓によるナトリウムの調整に作用する。一般に、ナトリウムの保持は水分の保持となり、ナトリウムの損失は水分の損失となる(4,5)。下にナトリウムの調整を介して血液量と血圧に影響する多くの系統の中から2つを記載する。
レニン-アンジオテンシン-アルドステロン系
血液量または血圧の著しい減少(重篤な失血または脱水など)に反応して、腎臓はレニンを放出して循環させる。レニンは、肝臓で作られる大きなタンパク質(アンジオテンシノーゲン)を小さなペプチド(アンジオテンシンI)に分割する酵素である。アンジオテンシンIは、血管内面、肺、肝臓、および腎臓にあるアンジオテンシン変換酵素(ACE)によってさらに小さいペプチド(アンジオテンシンII)に分割される。アンジオテンシンIIは小動脈の収縮を促し、その結果血圧が上昇する。アンジオテンシンIIは、副腎によるアルドステロンの合成も強く促す。アルドステロンはステロイドホルモンで、腎臓に作用してナトリウムの再吸収とカリウムの排泄を増やす。腎臓がナトリウムを保持することで水分も保持され、結果として血液量や血圧も上昇する(4)。
抗利尿ホルモン(ADH)
血液量や血圧の著しい減少は、脳下垂体後葉によるADHの分泌を促す。ADHは腎臓に作用して、水分の再吸収を増やす(4)。
欠乏症
ナトリウム(および塩化物)の欠乏は、たとえ非常に低塩分の食事をしていても、食事による摂取不足から起こることは一般にはない(5)。
低ナトリウム血症
血清ナトリウム濃度が136ミリモル/リットル未満の低ナトリウム血症は、体液保持の増進(希釈性の低ナトリウム血症)またはナトリウム損失の増加で起こることがある。希釈性の低ナトリウム血症は、抗利尿ホルモン(ADH)の分泌が不適切である可能性があり、中枢神経系に影響する障害や特定の薬(「薬物との相互作用」の項参照)の使用と関連している。時として、過剰な水分摂取も希釈性低ナトリウム血症を起こす可能性がある。ナトリウムや塩化物の損失を増やす条件は、激しかったり長引いたりする嘔吐や下痢、過剰で持続する発汗、抗利尿剤の使用、およびある種の腎臓病などである。低ナトリウム血症の症状は、頭痛、吐き気、嘔吐、筋肉の痙攣、疲労、見当識障害(方向感覚の喪失)、および失神である。重篤で急に発症する低ナトリウム血症の合併症として、脳水腫(脳のはれ)、脳卒中、昏睡、および脳損傷などがある。急性または重篤な低ナトリウム血症は、迅速で適切な医療的処置がなされないと、致命的になることもある(6)。
長時間の持久運動と低ナトリウム血症
マラソン、ウルトラマラソン、鉄人トライアスロンレースなどの非常に長時間の持久競技に参加する個人にとって、低ナトリウム血症は潜在的な問題であると最近では認知されている。1997年に鉄人レースに参加した650人のうち25人(ほぼ4%)が、低ナトリウム血症で治療を受けた。鉄人レースで低ナトリウム血症を起こした参加者は、比較的控えめな水分補給にもかかわらず水分過負荷の症状を示していた。このことから水分排出が不十分だったこと、および/またはこれらの超長距離アスリートは現在推奨されているよりも水分需要が低い可能性がうかがわれる(8)。非ステロイド性抗炎症薬(NSAID)の使用が、水分の排泄を損なうことで運動関連の低ナトリウム血症のリスクを高めているのではないか(9)と疑われているが、確固たる根拠は現在のところない。
ナトリウムの目安量(AI)
2004年に米国医学研究所の食品栄養委員会は、適度に活動的な人々が汗として損失するナトリウムを補充し、その他の必須栄養素を十分に摂れる食事を実現するのに必要な量に基づいて、ナトリウム摂取の目安量(AI)を設定した(5)。この推奨量は、ほとんどの米国民が平均的食事から摂取する量をはるかに下回っている。
疾病の予防(食事に含まれるナトリウムと疾病)
胃がん
主にアジアの国々で行われた疫学調査では、塩漬け、燻製、および塩酢漬けの食品摂取が多いと、胃がんのリスクが高まることが示された(10,11)。これらの食品は塩分が高く、ニトロソアミンのような発がん性物質も含んでいる可能性がある。ニトロソアミンとがんについての詳細は、ライナス・ポーリング研究所の2000年秋/冬リサーチ・ニュースレター(Research Newsletter)の記事を参照されたい。さらに、塩漬け食品の摂取が多い集団は、胃がん予防によい果物や野菜の摂取が少ない傾向がある(12)。胃がんのリスクは、胃の慢性的な炎症やヘリコバクター・ピロリ菌の感染によって高まる。高濃度の塩分は胃の内側の細胞を傷つけ、ピロリ菌の感染やがんを促しやすい遺伝子損傷のリスクを潜在的に高める可能性がある。塩そのものが発がん性物質だという根拠はほとんどないが、特定の塩漬け食品、たとえば塩漬けの魚などをたくさん摂取することは、胃がんになりやすい個人のリスクを高めるかもしれない(11,13,14)。
骨粗しょう症
骨粗しょう症は多因子的な骨障害で、骨の強度が損なわれ、その結果骨折のリスクが高まる。栄養は、骨粗しょう症の発症と進行に関与する多数の要素の中の一つである。塩分摂取が多いと、カルシウムの尿中への排泄が増えることがわかっている。腎臓から排泄されるナトリウム2.3gごと(塩(塩化ナトリウムNaCl)では5.8gごと)に、約24~40ミリグラム(mg)のカルシウムが尿に出て行く(15)。塩分摂取が骨の再吸収の生化学的マーカーと関連しているとする研究もあるが、そうではないものもある。一般に、横断研究ではナトリウム摂取と骨密度(BMD)の関連は見つかっていない(16)。しかしながら、閉経後の女性を2年間調べた研究では、尿中ナトリウム排泄(ナトリウム摂取の指標)の増加と、腰部のBMDの減少という関連が見られた(17)。さらに最近では、40人の閉経後女性の縦断的研究で、6ヶ月間低塩分の食事(2g/日)に固執すると、ナトリウムの排泄、カルシウムの排泄、および骨の再吸収のバイオマーカーであるI型コラーゲンのアミノ末端プロペプチドに著しい減少が見られた。しかしこれらの関連は、基線尿中ナトリウム排泄が3.4g/日(米国成人の平均的ナトリウム摂取量)以上の女性にのみ見られた(18)。塩分摂取を減少させることが、骨粗しょう症のリスクのある個人のBMDや骨折リスクに臨床的に意義のある効果があるかどうかを決定する長期の前向き研究が必要である。骨粗しょう症についての詳細は、「カルシウム」の記事を参照されたい。
腎結石
腎結石の大半は、カルシウムを主要成分とする。その原因はしばしば不明であるが、尿中カルシウムが異常に高くなる(高カルシウム尿症)と、カルシウム結石発症のリスクが高まる(19)。食事からの塩分摂取が増えると、尿中へのカルシウムの排泄が増えることが知られており、カルシウムを含んだ腎結石の病歴のある患者にはこの効果がより顕著である可能性がある(20)。9万人以上の女性を12年間にわたって追跡した大規模な前向き研究では、ナトリウムの摂取が平均4.9g/日(塩では12.6g/日)の女性は、平均1.5g/日のナトリウム(塩では4.0g/日)を摂取する女性よりも、腎結石の兆候の発症リスクが30%高かった(21)。しかし、男性を対象とした同様の研究では、ナトリウムの摂取と腎結石の兆候との間に相関は見られなかった(22)。臨床的研究では、ナトリウムの摂取を制限すると、カルシウム結石のできやすい個人の尿中カルシウムの量が減った(23)。また、再発性シュウ酸カルシウム結石の男性に2種類の異なった食事を与えた5年間の無作為化試験では、塩分と動物性タンパク質を控えた食事は、低カルシウムの食事よりも結石の再発を著しく減らすことがわかった(24)。
高血圧
数十年にわたって行われた複数連の研究で、ナトリウムの摂取と血圧の因果関係が示唆されてきた。動物研究は、この関係についての生理学的情報を多く提供している。特に重要なのは、ヒトの近接種であるチンパンジーの大人26匹に行われた主要な動物実験で、ナトリウムの濃度を実験的に高くしたり低くしたりした結果、血圧が上下したことが示され、ナトリウムの摂取が多いと血圧が上がり、低いと血圧も下がることの強力な根拠となった(25)。
ヒトでは、非常に低塩分な食事の文化を持つ人々と高塩分な食事の文化を持つ人々とを比べた異文化集団間の研究や、大半が横断的研究である観察研究の結果、塩の消費の増大と血圧の上昇の関連が示唆されている。しかし、異文化間研究に使われる集団群は血圧に影響するかもしれないその他のたくさんの点で異なっている可能性があり、観察研究は紛らわしい要素をコントロールする技量がまちまちである(26)。ナトリウムと血圧に関する最も大規模で最も厳密に計画された観察研究はインターソルト(INTERSALT)であり、32カ国で1万人以上の男女を研究した。集団横断的分析および集団内分析のどちらにおいても同じ結論が支持されており、24時間の尿採取で測定されたナトリウムの摂取と血圧には相関があった(27)。より高度な統計技術を用いたその後の分析は、この相関を以前報告されていたよりもさらにもっと強くしている(28)。
血圧に対する減塩の効果についての臨床試験とメタ解析
多くの無作為化臨床試験では、高血圧および非高血圧(非高血圧の血圧は現在では前高血圧と呼ばれる血圧の範囲を含むので、非高血圧は必ずしも正常血圧ではないことに注意)の人々を対象に、食事の減塩が血圧に及ぼす効果を調べてきた。中には、多くの異なった試験で集まったデータを分析するメタ解析と呼ばれる技法を用いて、食事の減塩が血圧にもたらす効果の大きさを推定したものもある(29-34)。様々なメタ解析に含まれる試験の数やタイプは実質的に異なっているが、食事の減塩が血圧にもたらす効果の大きさの推定は、解析結果で大きな差はない。コクラン・メタ解析は高血圧の参加者による20の試験と、高血圧でない参加者の11の試験から中程度の減塩の結果を評価した。中程度の減塩(24時間尿中ナトリウム排泄に基づく1.7~1.8g/日のナトリウムの減少)によって、収縮期血圧(最高血圧)/拡張期血圧(最低血圧)が、高血圧の参加者で平均で5.1/2.7mmHg、高血圧でない参加者で平均2.0/1.0mmHg減った(34)。
特に重要なのはTONE(35)およびTOHP-Phase II(36)と呼ばれる2つの大規模長期(2年以上の期間)試験の結果で、臨床および公衆衛生活動に最も関連があるものである。TONEでは、中程度の約1.0g/日のナトリウム摂取の減少で、始めは血圧の投薬を受けていた中高年の高血圧をより良くコントロールできることが示された。TOHP -Phase II(2つの高血圧予防試験のうちの2つ目の試験)は、同じ程度のナトリウム摂取の減少で、高血圧でない肥満の参加者の最高/最低血圧が1.2/1.6mmHg減っただけでなく、4年後には高血圧の発症が14%減ったことを示した(36)。高血圧の参加者の血圧減少値がささやかであることに疑問を呈する臨床医もいるが、観察研究および無作為化試験の概要では、米国人が平均2mmHg最低血圧を下げれば高血圧の蔓延が17%抑えられ、心臓発作のリスクが5%減り、脳卒中のリスクも15%減る(37)。したがって、血圧が平均してささやかに減少しただけでも、米国人全体の公衆衛生に大きな利益となる可能性がある。
食事に含まれるナトリウムの変化に対する反応の変動:塩への感受性
ナトリウム摂取の短期的変化による血圧反応の変動に関する文献は相当量ある(38,39)。しかし、たいていはたったの1回しか行われない実験用手順に従って塩分変化に対する血圧の反応を基に個人を分類することは、非常に問題である。大部分の生理的反応と同様に、塩分摂取変化に対する血圧反応は、連続的にほぼ正規分布を示す(40)。食事に変化がなかった時でも、日々の血圧は変動する(40)。個人を塩分に敏感であるとか抵抗性があると分類するのは、今のところでは集団のサンプルに基いていないし、経時的によく再現できるとは未だに示されていない。加えて、「塩分への感受性」の研究に使われる手順のほとんどでは、数日から1週間という短期間に極端な塩分摂取の操作(ナトリウム過剰および欠乏)を行う。これらの非常に短期間の研究が、長期間にわたって徐々に穏やかに変化する塩分摂取による血圧変化に関連するという根拠はない。にもかかわらず、集団内の特定の部分集団では、ナトリウム摂取の変化に平均血圧の反応が大きい傾向がある。それらの人々はすでに高血圧であったり、より高齢であったり、アフリカ系の米国人であったりする(41)。塩分への感受性に対する遺伝的根拠の研究から、ゆくゆくは塩分への感受性に関してより良くて信頼性のある個人分類ができるようになる可能性がある。多形性として知られる特定の遺伝子の共通変異が現在調査されており、これにはレニン-アンジオテンシン-アルドステロン系(「機能」の項参照)において顕著に機能する生産物を作る遺伝子の共通変異が含まれる(42)。さらに、食事の質(たとえば下のDASH食)と体重減少も、血圧を減少させる(43-45)。したがって、遺伝的要因に加えて環境的影響が塩分への感受性に影響しているようである。
食事のパターンと血圧(DASH 試験)
DASH(高血圧防止の食事療法)試験という名称の、多機関による無作為化摂食研究は、果物、野菜、精白されていない穀物、家禽、魚、木の実、および低脂肪乳製品を多く摂る食事が、典型的な米国の食事に比べて、高血圧および非高血圧の人々の血圧を実質的に低下させた(高血圧の人の最高/最低血圧で11.4mmHg/5.5mmHg、非高血圧の人では3.5/2.1mmHg)ことを示した(46)。DASH食は、典型的な米国の食事よりもカリウムとカルシウムが顕著に多く、タンパク質はやや多めで、総脂肪、飽和脂肪、およびコレステロールが低めである。しかし、ナトリウム以外の食事成分の効果をよりよく評価するために、研究ではナトリウムの濃度は一定に保たれた。その後DASHナトリウム試験では、DASH 食と典型的な米国の食事(対照食)を、塩分摂取が低(2.9g/日)、中(米国の食事指針で上限として推奨されている5.8g/日)、高(米国で典型的摂取量である8.7g/日)という3レベルに分けて比較した(47)。DASH食は、対照食に比べてどの塩分摂取レベルでも高血圧および非高血圧の人々の最高および最低血圧を著しく低下させた。塩分摂取の減少は、最高および最低血圧をさらに下げることになったのだ。DASH食と減塩は、どちらもそれ単独で行うよりも、組み合わせるとさらに血圧を下げたということである。高塩分の対照食と比べて、低ナトリウムのDASH食を摂った人の平均血圧は8.9/4.5mmHg下がった。これは、対照食での減塩効果はDASH食よりも高く、典型的な米国の食事をしている人々には減塩がより有益である可能性を示唆している。DASH試験の結果は、健康的な食事パターンが高血圧の予防および治療に効果的な方法であるという考えを支持している(48)。さらに、88,517人の中年女性を24年間追跡した前向きコホート研究で、DASH式の食事に固執すると冠動脈性心疾患と脳卒中のリスクが著しく低下することがわかった(49)。DASH食の詳細情報は、米国国立衛生研究所(NIH)の国立心肺血液研究所(NHLBI)から入手可能である。
米国の高血圧教育プログラムおよびNIHの国立心肺血液研究所は、塩の摂取を6g/日以下にするよう勧めており(50)、米国医学研究所の食品栄養委員会は最近、成人は5.8g/日以下の塩分摂取に留めるよう勧めている(5)(「安全性」の項参照)。塩分摂取に関する米国の食事指針の詳細用に、高血圧教育プログラムの記載および国立心肺血液研究所のナトリウムと血圧に関するワークショップの所見の要約がオンラインで閲覧可能である。
標的臓器の損傷
慢性的な高血圧は、心臓、血管、および腎臓を損傷し、それによって心臓疾患や脳卒中、さらには高血圧性腎臓疾患のリスクを高める。いくつかの臨床研究では、塩分摂取は左心室肥大という異常な心筋の肥厚と著しく相関があり、これは心血管疾患による死亡率の上昇と関連がある(51)。最近の研究は、高塩分摂取が血圧への影響とは別の意味で臓器の損傷に関与しているいう可能性を示している(52-54)。たとえば、動物およびヒトでの研究で、塩分摂取の増加が血圧の変化とは無関係の太い弾性動脈の構造と機能の病理変化と関連があることがわかっている(55)。
心血管疾患(CVD)
ナトリウム摂取の減少が心血管疾患および死亡率にもたらす効果を調べた研究は少なく、まちまちの結果となっている(56-61)。一般に、それらの研究では直接の関連が示唆され、特に尿中ナトリウムをナトリウム摂取の測定法として使用した研究ではそうであった(56-58)。TONE研究ではナトリウムを減らすように割り当てられた参加者の心血管疾患の減少傾向が見られた(35)。重要なのは、以前の2つのTOHP試験でナトリウム摂取の介入試験に参加したもともと高血圧でなかった人々は、対照群と比べて10~15年後に心血管疾患の発症が25%減ったことが最近の研究でわかったことである(62)。このTOHPの追跡研究をその後分析したところ、ナトリウム-カリウムの比率が容量-反応関係における心血管疾患のリスク上昇と関係があることがわかり、ナトリウムの摂取と心血管疾患の間の有害な関連を補完する証拠となっている。
摂取源
食事に含まれるナトリウムも塩化物も、大部分は塩に由来する。米国での塩の摂取の75%は、食事時にかけたり料理の際に入れたりする塩ではなく、食品の加工や製造の過程で添加される塩に由来する。最も少ない塩分摂取に関連しているのは、加工されていない食品、特に果物、野菜、豆類などを重視する食事である。最近の調査で、米国の食事からの平均塩分摂取は、成人男性で7.8~11.8g/日で、成人女性で5.8~7.8g/日であるとわかった(5)。これらの数字は、食事時に食べ物にかける塩を含んでいないので、少なめの見積もりである可能性がある。
下の表は、塩分を多く含んでいる食品、および比較的塩分の少ない食品のナトリウム含有量(ミリグラム(mg)表示)を示す。ナトリウムと塩化物の多くが塩に由来するので、食事に含まれる塩の含有量は、ナトリウムの含有量を2.5倍することで推定できる。
例:ナトリウム2,000mg(2g)×2.5 = 塩5,000mg(5g)
食品の栄養素量についての詳細は、USDAの食品成分データベースを検索されたい。
安全性
毒性
塩化ナトリウムの過剰摂取は、正常なナトリウム濃度を維持するために水分が細胞から引き出されて、細胞外液の体積増加につながる。しかし、水分が需要どおりに摂取できる限り、正常に働いている腎臓ならば過剰なナトリウムを排泄して身体を正常な状態に戻す(50)。大量の塩の摂取は、吐き気、嘔吐、下痢、および異常な痙攣を起こす可能性がある(64)。異常に高い血漿ナトリウム濃度(高ナトリウム血症)は、一般的に過剰な水分損失から始まり、渇きのメカニズムが損なわれていたり水が摂取できなかったりする状況を伴うことがよくある。過剰な体液の損失を伴う高ナトリウム血症の症状は、めまいや失神、低血圧、および尿生産の減少などを含むことがある。深刻な高ナトリウム血症は、浮腫(腫れ上がること)、高血圧、動悸、呼吸困難、痙攣、昏睡、および死亡に至る可能性がある。高ナトリウム血症は、ナトリウムの過剰摂取(たとえば海水の多量摂取や高濃度食塩水の静脈注射など)で起きることはまれである。末期腎不全では、塩分と水分の摂取が制限されないと、尿へのナトリウム排泄が損なわれることで体液貯留となり、その結果として浮腫、高血圧、うっ血性心不全となる可能性がある(2,65)。
悪影響
2004年に、米国医学研究所の食品栄養委員会は、心血管疾患および腎臓疾患の主要なリスク要因である高ナトリウム摂取が血圧に及ぼす悪影響に基いて、ナトリウム摂取の許容上限摂取量(UL)を成人で2.3g/日(塩では5.8g/日)と設定した(5)。中高年、アフリカ系アメリカ人、および高血圧、糖尿病、または慢性腎臓病の個人を含むナトリウムの血圧への影響に最も敏感な人々には、ナトリウムの許容上限摂取量がさらに少ない可能性があることを留意すべきである。ナトリウムおよび塩の許容上限摂取量の値を年齢層ごとに下の表に示す。
| 年齢層 | ナトリウムのUL(g/日) | 塩(g/日) |
|---|---|---|
| 乳児(0-12ヶ月) | 未決定* | 未決定* |
| 幼児(1-3歳) | 1.5 | 3.8 |
| 子供(4-8歳) | 1.9 | 4.8 |
| 子供(9-13歳) | 2.2 | 5.5 |
| 青少年(14-18歳) | 2.3 | 5.8 |
| 成人(19歳以上) | 2.3 | 5.8 |
| *食品および人口乳からのみ摂取。 | ||
薬物相互作用
以下の薬物は、低ナトリウム血症(異常に低い血中ナトリウム濃度)のリスクを高める可能性がある(6)。
ライナス・ポーリング研究所の推奨
比較的低塩分(5.8g/日以下)で高カリウム(少なくとも4.7g/日)の食事が、高血圧やそれに関連する心血管疾患や腎臓病のリスク低下と相関があることを示す強力で一貫した根拠がある。加えてDASH試験では、果物、野菜、精白されていない穀物、木の実、および低脂肪乳製品を多く摂る食事が実質的に血圧を減少させることが示された。この効果は塩分摂取を5.8g/日以下にすることで強められ、3.8g/日に抑えることで最も強化される。塩分摂取を3.8g/日までに限ることを目標にすべきである。ライナス・ポーリング研究所は、果物および野菜(少なくとも5品目/日)が豊富で、塩分の多い加工食品を限定する食事を推奨する。
中高年(50歳以上)
低塩分(3.8g/日以下)で高カリウム(少なくとも4.7g/日)の食事が、高血圧およびそれに関連する心血管疾患および腎臓疾患のリスクが高い中高年にとって、特に有益であると思われる。塩が血圧を上げる効果への感受性は年とともに上昇するので、低塩分で高カリウムの食事は中高年に特に有益である可能性がある。
Authors and Reviewers
Originally written in 2001 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in February 2004 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in November 2008 by:
Victoria J. Drake, Ph.D.
Linus Pauling Institute
Oregon State University
Reviewed in November 2008 by:
Eva Obarzanek, Ph.D, M.P.H., R.D.
Research Nutritionist (Retired)
Prevention and Population Sciences Program
Division of Cardiovascular Sciences
National, Heart, Lung, and Blood Institute (NHLBI)
Copyright 2001-2024 Linus Pauling Institute
References
1. Taubes G. The (political) science of salt. Science. 1998;281(5379):898-901, 903-897. (PubMed)
2. Harper ME, Willis JS, Patrick J. Sodium and chloride in nutrition. In: O'Dell BL, Sunde RA, eds. Handbook of nutritionally essential minerals. New York: Marcel Dekker; 1997:93-116.
3. Brody T. Nutritional Biochemistry. 2nd ed. San Diego: Academic Press; 1999.
4. Sheng H-W. Sodium, chloride and potassium. In: Stipanuk M, ed. Biochemical and Physiological Aspects of Human Nutrition. Philadelphia: W.B. Saunders Company; 2000:686-710.
5. Food and Nutrition Board, Institute of Medicine. Sodium and Chloride. Dietary Reference Intakes for Water, Potassium, Sodium, Chloride, and Sulfate. Washington, D.C.: National Academies Press; 2005:269-423. (The National Academies Press)
6. Adrogue HJ, Madias NE. Hyponatremia. N Engl J Med. 2000;342(21):1581-1589.
7. Speedy DB, Rogers IR, Noakes TD, et al. Diagnosis and prevention of hyponatremia at an ultradistance triathlon. Clin J Sport Med. 2000;10(1):52-58. (PubMed)
8. Speedy DB, Noakes TD, Kimber NE, et al. Fluid balance during and after an ironman triathlon. Clin J Sport Med. 2001;11(1):44-50. (PubMed)
9. Ayus JC, Varon J, Arieff AI. Hyponatremia, cerebral edema, and noncardiogenic pulmonary edema in marathon runners. Ann Intern Med. 2000;132(9):711-714. (PubMed)
10. Palli D. Epidemiology of gastric cancer: an evaluation of available evidence. J Gastroenterol. 2000;35 Suppl 12:84-89. (PubMed)
11. Tsugane S. Salt, salted food intake, and risk of gastric cancer: epidemiologic evidence. Cancer Sci. 2005;96(1):1-6. (PubMed)
12. Liu C, Russell RM. Nutrition and gastric cancer risk: an update. Nutr Rev. 2008;66(5):237-249. (PubMed)
13. Cohen AJ, Roe FJ. Evaluation of the aetiological role of dietary salt exposure in gastric and other cancers in humans. Food Chem Toxicol. 1997;35(2):271-293. (PubMed)
14. Hirohata T, Kono S. Diet/nutrition and stomach cancer in Japan. Int J Cancer. 1997;Suppl 10:34-36. (PubMed)
15. Weaver CM, Heaney RP. Calcium. In: Shils M, Olson JA, Shike M, Ross AC, eds. Modern Nutrition in Health and Disease. 9th ed. Baltimore: Williams & Wilkins;1999:141-155.
16. Cohen AJ, Roe FJ. Review of risk factors for osteoporosis with particular reference to a possible aetiological role of dietary salt. Food Chem Toxicol. 2000;38(2-3):237-253. (PubMed)
17. Devine A, Criddle RA, Dick IM, Kerr DA, Prince RL. A longitudinal study of the effect of sodium and calcium intakes on regional bone density in postmenopausal women. Am J Clin Nutr. 1995;62(4):740-745. (PubMed)
18. Carbone LD, Barrow KD, Bush AJ, et al. Effects of a low sodium diet on bone metabolism. J Bone Miner Metab. 2005;23(6):506-513. (PubMed)
19. Heller HJ. The role of calcium in the prevention of kidney stones. J Am Coll Nutr. 1999;18(5 Suppl):373S-378S. (PubMed)
20. Audran M, Legrand E. Hypercalciuria. Joint Bone Spine. 2000;67(6):509-515. (PubMed)
21. Curhan GC, Willett WC, Speizer FE, Spiegelman D, Stampfer MJ. Comparison of dietary calcium with supplemental calcium and other nutrients as factors affecting the risk for kidney stones in women. Ann Intern Med. 1997;126(7):497-504. (PubMed)
22. Curhan GC, Willett WC, Rimm EB, Stampfer MJ. A prospective study of dietary calcium and other nutrients and the risk of symptomatic kidney stones. N Engl J Med. 1993;328(12):833-838. (PubMed)
23. Assimos DG, Holmes RP. Role of diet in the therapy of urolithiasis. Urol Clin North Am. 2000;27(2):255-268. (PubMed)
24. Borghi L, Schianchi T, Meschi T, et al. Comparison of two diets for the prevention of recurrent stones in idiopathic hypercalciuria. N Engl J Med. 2002;346(2):77-84. (PubMed)
25. Denton D, Weisinger R, Mundy NI, et al. The effect of increased salt intake on blood pressure of chimpanzees. Nat Med. 1995;1(10):1009-1016. (PubMed)
26. Elliott P. Observational studies of salt and blood pressure. Hypertension. 1991;17(1 Suppl):I3-8. (PubMed)
27. Intersalt Cooperative Research Group. Intersalt: an international study of electrolyte excretion and blood pressure. Results for 24 hour urinary sodium and potassium excretion. BMJ. 1988;297(6644):319-328. (PubMed)
28. Elliott P, Stamler J, Nichols R, et al. Intersalt revisited: further analyses of 24 hour sodium excretion and blood pressure within and across populations. Intersalt Cooperative Research Group. BMJ. 1996;312(7041):1249-1253. (PubMed)
29. He FJ, MacGregor GA. Importance of salt in determining blood pressure in children: meta-analysis of controlled trials. Hypertension. 2006;48(5):861-869. (PubMed)
30. Dickinson HO, Mason JM, Nicolson DJ, et al. Lifestyle interventions to reduce raised blood pressure: a systematic review of randomized controlled trials. J Hypertens. 2006;24(2):215-233. (PubMed)
31. Graudal NA, Galloe AM, Garred P. Effects of sodium restriction on blood pressure, renin, aldosterone, catecholamines, cholesterols, and triglyceride: a meta-analysis. JAMA. 1998;279(17):1383-1391. (PubMed)
32. Cutler JA, Follmann D, Allender PS. Randomized trials of sodium reduction: an overview. Am J Clin Nutr. 1997;65(2 Suppl):643S-651S. (PubMed)
33. Midgley JP, Matthew AG, Greenwood CM, Logan AG. Effect of reduced dietary sodium on blood pressure: a meta-analysis of randomized controlled trials. JAMA. 1996;275(20):1590-1597. (PubMed)
34. He FJ, MacGregor GA. Effect of longer-term modest salt reduction on blood pressure. Cochrane Database Syst Rev. 2004;(3):CD004937. (PubMed)
35. Whelton PK, Appel LJ, Espeland MA, et al. Sodium reduction and weight loss in the treatment of hypertension in older persons: a randomized controlled trial of nonpharmacologic interventions in the elderly (TONE). TONE Collaborative Research Group. JAMA. 1998;279(11):839-846. (PubMed)
36. The Trials of Hypertension Prevention Collaborative Research Group. Effects of weight loss and sodium reduction intervention on blood pressure and hypertension incidence in overweight people with high-normal blood pressure. The Trials of Hypertension Prevention, phase II. Arch Intern Med. 1997;157(6):657-667. (PubMed)
37. Cook NR, Cohen J, Hebert PR, Taylor JO, Hennekens CH. Implications of small reductions in diastolic blood pressure for primary prevention. Arch Intern Med. 1995;155(7):701-709. (PubMed)
38. Luft FC, Weinberger MH. Heterogeneous responses to changes in dietary salt intake: the salt-sensitivity paradigm. Am J Clin Nutr. 1997;65(2 Suppl):612S-617S. (PubMed)
39. Weinberger MH. Salt sensitivity of blood pressure in humans. Hypertension. 1996;27(3 Pt 2):481-490. (PubMed)
40. Obarzanek E, Proschan MA, Vollmer WM, et al. Individual blood pressure responses to changes in salt intake: results from the DASH-Sodium trial. Hypertension. 2003;42(4):459-467. (PubMed)
41. Vollmer WM, Sacks FM, Ard J, et al. Effects of diet and sodium intake on blood pressure: subgroup analysis of the DASH-sodium trial. Ann Intern Med. 2001;135(12):1019-1028. (PubMed)
42. Giner V, Poch E, Bragulat E, et al. Renin-angiotensin system genetic polymorphisms and salt sensitivity in essential hypertension. Hypertension. 2000;35(1 Pt 2):512-517. (PubMed)
43. Neter JE, Stam BE, Kok FJ, Grobbee DE, Geleijnse JM. Influence of weight reduction on blood pressure: a meta-analysis of randomized controlled trials. Hypertension. 2003;42(5):878-884. (PubMed)
44. Franco V, Oparil S. Salt sensitivity, a determinant of blood pressure, cardiovascular disease and survival. J Am Coll Nutr. 2006;25(3 Suppl):247S-255S. (PubMed)
45. Akita S, Sacks FM, Svetkey LP, Conlin PR, Kimura G. Effects of the Dietary Approaches to Stop Hypertension (DASH) diet on the pressure-natriuresis relationship. Hypertension. 2003;42(1):8-13. (PubMed)
46. Appel LJ, Moore TJ, Obarzanek E, et al. A clinical trial of the effects of dietary patterns on blood pressure. DASH Collaborative Research Group. N Engl J Med. 1997;336(16):1117-1124. (PubMed)
47. Sacks FM, Svetkey LP, Vollmer WM, et al. Effects on blood pressure of reduced dietary sodium and the Dietary Approaches to Stop Hypertension (DASH) diet. DASH-Sodium Collaborative Research Group. N Engl J Med. 2001;344(1):3-10. (PubMed)
48. Greenland P. Beating high blood pressure with low-sodium DASH. N Engl J Med. 2001;344(1):53-55.
49. Fung TT, Chiuve SE, McCullough ML, Rexrode KM, Logroscino G, Hu FB. Adherence to a DASH-style diet and risk of coronary heart disease and stroke in women. Arch Intern Med. 2008;168(7):713-720. (PubMed)
50. Chobanian AV, Hill M. National Heart, Lung, and Blood Institute Workshop on Sodium and Blood Pressure : a critical review of current scientific evidence. Hypertension. 2000;35(4):858-863. (PubMed)
51. Chrysant GS. High salt intake and cardiovascular disease: is there a connection? Nutrition. 2000;16(7-8):662-664.
52. du Cailar G, Ribstein J, Mimran A. Dietary sodium and target organ damage in essential hypertension. Am J Hypertens. 2002;15(3):222-229. (PubMed)
53. Perry IJ, Beevers DG. Salt intake and stroke: a possible direct effect. J Hum Hypertens. 1992;6(1):23-25. (PubMed)
54. Aviv A. Salt and hypertension: the debate that begs the bigger question. Arch Intern Med. 2001;161(4):507-510. (PubMed)
55. Safar ME, Thuilliez C, Richard V, Benetos A. Pressure-independent contribution of sodium to large artery structure and function in hypertension. Cardiovasc Res. 2000;46(2):269-276. (PubMed)
56. Nagata C, Takatsuka N, Shimizu N, Shimizu H. Sodium intake and risk of death from stroke in Japanese men and women. Stroke. 2004;35(7):1543-1547. (PubMed)
57. Tuomilehto J, Jousilahti P, Rastenyte D, et al. Urinary sodium excretion and cardiovascular mortality in Finland: a prospective study. Lancet. 2001;357(9259):848-851. (PubMed)
58. Tunstall-Pedoe H, Woodward M, Tavendale R, A'Brook R, McCluskey MK. Comparison of the prediction by 27 different factors of coronary heart disease and death in men and women of the Scottish Heart Health Study: cohort study. BMJ. 1997;315(7110):722-729. (PubMed)
59. He J, Ogden LG, Vupputuri S, Bazzano LA, Loria C, Whelton PK. Dietary sodium intake and subsequent risk of cardiovascular disease in overweight adults. JAMA. 1999;282(21):2027-2034. (PubMed)
60. Cohen HW, Hailpern SM, Fang J, Alderman MH. Sodium intake and mortality in the NHANES II follow-up study. Am J Med. 2006;119(3):275 e277-214. (PubMed)
61. Alderman MH, Cohen H, Madhavan S. Dietary sodium intake and mortality: the National Health and Nutrition Examination Survey (NHANES I). Lancet. 1998;351(9105):781-785. (PubMed)
62. Cook NR, Cutler JA, Obarzanek E, et al. Long term effects of dietary sodium reduction on cardiovascular disease outcomes: observational follow-up of the trials of hypertension prevention (TOHP). BMJ. 2007;334(7599):885. (PubMed)
63. Cook NR, Obarzanek E, Cutler JA, et al. Joint effects of sodium and potassium intake on subsequent cardiovascular disease: The Trials of Hypertension Prevention (TOHP) Follow-up Study. Arch Intern Med. 2009;169(1)32-40. (PubMed)
64. Minerals. Drug Facts and Comparisons. St. Louis: Facts and Comparisons; 2000:27-51
65. Okuda T. Fluid and electrolyte disorders. In: Tierney LM, McPhee SJ, Papadakis MA, eds. Current medical diagnosis and treatment. 37th ed. Stamford: Appleton & Lange; 1998:824-849.
亜鉛
目次
要約
- 亜鉛は体内での触媒的、構造的、および調整的機能に必要な栄養的に不可欠なミネラルである(詳細はこちら)。
- 重篤な亜鉛欠乏症は、まれな遺伝的または後天的症状である。潜在的亜鉛欠乏症と呼ばれることも多い食事性亜鉛欠乏症は、発展途上国ではとても一般的な症状で、推定20億人に影響している(詳細はこちら)。
- 成人の男女に対する亜鉛の推奨摂取量はそれぞれ11mg/日と8mg/日である(詳細はこちら)。
- 亜鉛欠乏症は、子供の発育障害および発達障害、妊娠合併症、および免疫不全や感染症になりやすいといった症状を起こす可能性がある(詳細はこちら)。
- 亜鉛補給は、一般的な風邪、加齢黄斑変性、糖尿病、およびHIV/AIDSの治療可能性があるとして研究されてきた(詳細はこちら)。
- 亜鉛の生物学的利用能は、肉、卵、およびシーフードで比較的高い。フィチン酸の持つ亜鉛吸収阻害効果のせいで、亜鉛は全粒穀物や豆類では生物学的利用能が低い(詳細はこちら)。
-
許容上限摂取量(成人では40mg/日)を超えて亜鉛を長期間摂取すると、銅欠乏症になることがある(詳細はこちら)。
亜鉛はすべての形態の生物にとって不可欠な微量元素である。ヒトの栄養と公衆の健康における亜鉛の重要性は、比較的最近になって認識された。ヒトの臨床的な亜鉛欠乏症は、1961年に最初に報告された。この時、フィチン酸を多く含む(「食品の摂取源」の項参照)ために亜鉛の生物学的利用能が低い食事を摂取することが中東での「青年期栄養性小人症」と関連づけられた(1)。それ以来、亜鉛の不足は重要な公衆の健康問題、特に発展途上国での問題として、多くの専門家によって認識されている(2)。
機能
細胞における代謝の多くの態様は、亜鉛に依存している。亜鉛は成長と発達、免疫反応、神経機能、および生殖において重要な役割を果たす。細胞レベルでは、亜鉛の機能は3つのカテゴリーに分類される:(1)触媒的機能、(2)構造的機能、および(3)調整的機能である(3)。
触媒的な役割
300超の酵素が、生命に必要な化学反応の触媒作用能力を亜鉛に依存する。亜鉛依存酵素は、すべての既知の酵素群に存在する(4)。
構造的な役割
タンパク質や細胞膜の構造において、亜鉛は重要な役割を果たす。ジンクフィンガーモチーフとして知られる指のような構造は、多くのタンパク質の構造を安定化させる。たとえば銅は、銅亜鉛スーパーオキシドディスムターゼ(CuZnSOD)という抗酸化酵素の触媒作用をし、亜鉛はこの酵素における重要な構造的役割を持つ(5,6)。細胞膜の構造や機能も、亜鉛に影響を受ける。生体膜から亜鉛が失われると膜が酸化ダメージを受けやすくなり、その機能を損傷する(7)。
調整的な役割
ジンクフィンガーのタンパク質は、転写因子(DNAと結合して特定の遺伝子の転写に影響する)として作用することで、遺伝子の発現を調整することがわかっている。亜鉛は細胞内シグナル伝達にも関わっており、ホルモンの放出や神経インパルス伝達にも影響することが知られている。成長や発達、および多くの慢性疾患に関わるアポトーシス(遺伝子によって起こされる細胞死)という重要な細胞調節プロセスでも、亜鉛が役割を果たしていることがわかっている(8)。
栄養素との相互作用
銅
大量(50mg/日以上)の亜鉛を数週間にわたって摂取すると、銅の生物学的利用能に影響する可能性がある。亜鉛を高摂取すると、銅と結合するメタロチオネインというタンパク質が腸で合成される。メタロチオネインは銅を腸の細胞内に閉じ込め、体内での吸収を妨げる。通常量の亜鉛の摂取では銅の吸収は妨げられず、銅の高摂取も亜鉛の吸収に影響しない(6)。
鉄
食事から摂取できる量でなくサプリメントで摂取する量の鉄(鉄元素として38~65mg/日)は、亜鉛の吸収を減らすかもしれない(9)。この相互作用は妊娠中および授乳中の鉄補給の管理においての懸念となっており、鉄元素として60mg/日超を摂取する妊婦や授乳婦に亜鉛の補給を勧める専門家もいる(10,11)。
カルシウム
食事からのカルシウムの高摂取は動物の亜鉛吸収を損なわせるが、これがヒトでも起こるのかどうかは不明である。ある研究では、閉経後の女性に牛乳やリン酸カルシウムという形で890mg/日だけカルシウム摂取を増やした(カルシウムの全摂取量は1,360mg/日)ら、亜鉛の吸収と亜鉛のバランスが低下した(12)。しかしながら、思春期の少女にカルシウムクエン酸リンゴ酸の形態でカルシウム摂取を1,000mg/日だけ増加させても(全カルシウム摂取量は1,667mg/日)、亜鉛の吸収やバランスに影響はなかったことが、別の研究でわかった(13)。カルシウムとフィチン酸やフィチン酸塩との組み合わせは亜鉛の吸収に影響するかもしれず、生石灰(酸化カルシウム)を使用したトルティーヤを頻繁に食べる個人には特に関係があるであろう。10人の健康な女性(21~47歳)の研究で、食事からのカルシウムの高摂取(1,800mg/日くらい)は、フィチン酸塩の多い食事に含まれる亜鉛の吸収をさらに損なわせることはなかったことがわかった(14)。フィチン酸についての詳細は、下記の「食品の摂取源」の項を参照のこと。
葉酸塩
食事からの葉酸塩の生物学的利用能は亜鉛に依存する酵素の作用によって増加し、このことは亜鉛と葉酸の相互作用の可能性を示唆する。亜鉛の摂取が少ないと葉酸塩の吸収が減るとした研究が過去にはあった。その一方で、葉酸の補給は亜鉛の栄養状態がぎりぎりの個人における亜鉛の体内利用を損なうとする研究もあった(5,6)。しかし、最近の研究で比較的高容量の葉酸(800μg/日)の補給を25日間しても、亜鉛の少ない食事(3.5mg/日)をした学生のグループにおける亜鉛の栄養状態は変わらなかった。この研究では、亜鉛の摂取量は葉酸塩の利用を損なわなかった(15)。
ビタミンA
亜鉛とビタミンAはいくつかの様式で相互作用する。亜鉛は、血液中でのビタミンA輸送に必要なタンパク質であるレチノール結合タンパクを構成する。レチノール(ビタミンA)をレチナールに変換する酵素にも、亜鉛が必要である。この後者の形態のビタミンAは、目の中で光を吸収し暗順応にかかわるタンパク質であるロドプシンの合成に必要である。亜鉛欠乏症は肝臓からのビタミンAの放出減に関連があり、これは亜鉛欠乏症とともに見られる夜盲症の症状に寄与するのかもしれない(16,17)。
欠乏症
重篤な亜鉛欠乏症
重篤な亜鉛欠乏症に関して知られていることの多くは、亜鉛の吸収や輸送の障害を起こす遺伝的疾患である腸性肢端皮膚炎を持つ個人の研究によってもたらされた。重篤な亜鉛欠乏症の症状は、成長や発達の遅延や停止、性的成熟の遅れ、特徴的な皮膚発疹、慢性的で重い下痢、免疫系の欠陥、創傷治癒の障害、食欲減衰、味覚障害、夜盲症、角膜の腫れや濁り、および行動障害などである。腸性肢端皮膚炎の原因が知られる前は、患者は幼くして死亡することが典型的であった。経口亜鉛治療によってそれらの症状は完全寛解に至ったが、この遺伝性疾患の個人は生涯その治療を続けねばならない(6,18)。遺伝的疾患のない個人に重篤な亜鉛欠乏症を起こすような食事性の亜鉛欠乏症にはなりにくいが、重いやけどや長引く下痢などの亜鉛吸収不全または亜鉛の喪失が増えるような状態は、重篤な亜鉛欠乏症に至るかもしれない。重篤な亜鉛欠乏症は、亜鉛の入っていない完全静脈栄養を受けている者、アルコール乱用者やペニシリンのような特定の薬剤を使用している者にも報告されている(下記の「薬物相互作用」の項参照)(19)。
潜在的亜鉛欠乏症
軽度の亜鉛欠乏症は多くの健康上の問題を引き起こし、特に発展途上国の子供には一般的であることが今や認知されている。世界中で推定20億の人々が、食事性の亜鉛欠乏症であるとされている(20)。潜在的亜鉛欠乏症に対する感度のよい特定の指標がないことが、それが健康に及ぼす影響の科学的研究にとって障害となっている(21)。しかし、潜在的亜鉛欠乏症が身体的および神経心理学的発達の障害や、幼児が生命にかかわる感染症にかかりやすくなることに寄与することが、中度の亜鉛補給の対照試験で明らかになった(18)。実際、亜鉛欠乏症は5歳未満の子供の年間450,000人の死亡原因であると推定され、これは全世界の子供の死亡の4.4%を占める(22)。亜鉛欠乏症と健康上の問題の関係についての詳細は、「疾病予防」の項を参照のこと。
亜鉛欠乏症のリスクのある個人(6,19,23,24)
●未熟児や低出生体重児
●亜鉛が豊富な補完食の摂取が不適切で母乳で育った乳児や幼児
●子供や青少年
●妊婦や授乳婦、特に少女期の者
●完全静脈栄養補給(点滴による栄養補給)を受けている患者
●タンパク質・エネルギー栄養失調や神経性無食欲症を含む栄養失調の個人
●重篤または持続性の下痢の者
●セリアック病や短腸症候群を含む吸収不良症候群の者
●クローン病や潰瘍性大腸炎を含む炎症性の腸疾患のある者
●アルコール依存症の者、および尿中への亜鉛の排出が多く肝臓での亜鉛の濃度が低いアルコール性肝臓疾患の者
●慢性腎疾患の者
●鎌状赤血球症の者
●腸での亜鉛の吸収を減らす薬剤、亜鉛の排出を増やす薬剤、または亜鉛の利用を損なう薬剤を使用している者(下記の「薬物相互作用」の項参照)
●年配者(65歳以上)
●厳密な菜食主義者:主食が穀類や豆類である厳密な菜食主義者の食事性亜鉛の必要量は50%も高い。なぜなら、これらの食品に含まれる高濃度のフィチン酸が、亜鉛の吸収を減らすからである(「食品の摂取源」の項参照)(5)。
亜鉛の状態のバイオマーカー
現在では、ヒトの亜鉛欠乏症を検出する感度のよい特定のバイオマーカーはない。血漿や血清での亜鉛の低濃度は、集団においておよび介入研究において、亜鉛の栄養状態を示すバイオマーカーとして典型的に使用されている。しかし血漿または亜鉛の状態を測定することにはいくつかの限界があり、潜在的亜鉛欠乏症を検出する感度がないことや、炎症によって低下することや、日周変動などがあげられる(24,25)。
推奨量(RDA)
亜鉛に対する米国での推奨量(RDA)を性別および年齢層別に表1に示す。乳幼児、子供、青少年、および妊婦や授乳婦は、亜鉛欠乏症のリスクが高い。亜鉛の栄養状態を示す感度のよい指標がまだないため、亜鉛のRDAは亜鉛の栄養状態を示すいくつかの異なる指標に基づいており、特定の年齢や性別に属するほぼすべての個人の欠乏症を防ぐであろう毎日の摂取量を表している(5)。
亜鉛欠乏症に関連する疾患や症状の予防
成長障害や発達障害
発育遅延
発育遅延または体重増加不良という直線的な成長や体重増加の大幅な遅れは、子供の軽度亜鉛欠乏症の一般的特徴である。1970年代や1980年代には、成長にかなりの遅れのある年少の子供に亜鉛補給をする数件の無作為化プラセボ対照試験がコロラド州デンバーで行われた。中度の亜鉛補給(5.7mg/日)によって、プラセボよりも成長率が高くなった(26)。最近では、発展途上国でのいくつかのより大規模な研究でも、中度の亜鉛補給によって同様の結果が見られた。亜鉛の介入試験からの成長データのメタ解析で、年少の子供の成長を制限する亜鉛欠乏症が、特に発展途上国で広く起こっていることが確認された(27~29)。亜鉛欠乏症による成長制限効果の正確なメカニズムは不明であるが、成長を調整するホルモンであるインスリン様成長因子1(IGF-1)への反応を調整する細胞シグナル伝達系に亜鉛の利用能が影響することが、研究で示されている(30)。
年少の子供の神経学的および行動学的発達の遅延
母親の亜鉛の栄養状態が悪いことが、新生児の注意力低下や生後6ヶ月での運動機能不良と関連がある。母親に亜鉛補給したら、極低出生体重児の運動機能の発達が改善し、インドの乳児や幼児がより元気に活動するようになり、グアテマラの乳児や幼児により機能的な活動が増えたという関連があった(31)。さらに、子供への亜鉛の補給で、中国人の1年生の神経心理学的機能(注意力など)がよくなったが、これは亜鉛が他の微量栄養素と一緒に供給された場合にのみ観察された(32)。別の2つの研究では、亜鉛の補給と発育遅延と診断された子供の注意力の測定結果との間に関連はなかった(33)。初期の研究の中には、亜鉛欠乏症が幼児の認知的発達を抑えるのではないかと示唆するものがあるが、乳児や幼児に対する13の亜鉛補給臨床試験に対する2012年のコクランレビュー(コクラン共同計画が作成する系統的総括)では、精神や運動機能の発達が亜鉛補給で改善するというエビデンス(科学的根拠)は見られなかった(34)。
免疫系機能の障害
適切な亜鉛摂取は免疫系の統合維持に不可欠であり(35)、自然免疫反応を媒介する細胞(好中球、マクロファージ、およびナチュラルキラー細胞)や獲得免疫反応を媒介する細胞(B細胞やT細胞)の正常な発達や機能にとって特に必須である(36,37)。さらに、亜鉛には抗酸化酵素であるCuZnSOD(上記参照)における構造的な役割がある。亜鉛欠乏症は多くの免疫機能に悪影響をもたらし、特定のサイトカインの生成減少、亜鉛依存性の酵素や転写因子の活性低下、およびT細胞の機能に重要な亜鉛依存性胸腺ホルモンであるサイムリンの活性低下に至る(38)。その結果、亜鉛欠乏症の個人は多様な病原体に感染しやすくなることが知られている(39)。
子供の感染症への罹患性上昇
下痢:下痢性の疾患は、発展途上国で年間180万人超の5歳未満の子供の死亡につながっていると推定されている(40)。免疫系の機能に対する亜鉛欠乏症の悪影響が子供を感染性の下痢にかかりやすくし、長引く下痢が亜鉛欠乏症や栄養不良に寄与する。亜鉛欠乏症は大腸菌などの下痢を引き起こす細菌によって生産される毒素の効果も高めているかもしれないことが、研究では示されている(41)。多くの無作為化対照試験では、経口補水療法と併用した亜鉛補給によって子供の急性かつ持続性の下痢の期間や重篤度が大きく低減し、生存率が上がることが示された(42,43)。無作為化対照試験の2007年のメタ解析で、亜鉛補給は5歳未満の子供の下痢発生の頻度、重篤度、および期間を低減すると結論づけられた(44)。より最近のメタ解析では、亜鉛補給の有益な効果は6ヶ月(45)または12ヶ月(28)超の子供に限られることがわかった。世界保健機構と国連児童基金は、幼児の下痢性疾患の治療の一部として亜鉛補給を推奨している(46)。
肺炎:亜鉛補給はまた、肺炎などの下気道感染症の発生を減らすかもしれない。発展途上国でのいくつかの研究の統合解析で、亜鉛を補給された子供の肺炎罹患率が大きく減ることが実証された(47)。2つのメタ解析では、亜鉛補給が5歳未満の子供の肺炎または気道疾患の発生を減らすことがわかった(44,48)。しかしながら、抗生物質療法と同時に亜鉛補給をすることが肺炎の治療に有益かどうかは不明である(49,50)。
マラリア:子供におけるマラリアの臨床的な発作が亜鉛補給で減るかもしれないことが、いくつかの研究で示されてきた(33)。パプアニューギニアの就学前の子供によるプラセボ対照試験で、熱帯熱マラリア原虫によるマラリアで保健所に行く頻度が、亜鉛補給によって38%減ったことがわかった(51)。さらに、このマラリアを起こす寄生虫が血液中に高濃度でいるようなマラリアの事例数が68%減った。このことは、より重篤なマラリアの事例を防ぐのに亜鉛補給が有益であるかもしれないことを示唆している。しかし、西アフリカの700人超の子供による6ヶ月間の試験では、亜鉛を補給した子供の熱帯熱マラリア原虫によるマラリアの事例の頻度や重篤度が、プラセボを与えられた子供と異なるという結果にはならなかった(52)。加えて、急性で合併症のない熱帯熱マラリアにかかった就学前の子供に亜鉛補給は有益ではなかったことが、無作為化対照試験で報告された(53)。さらに、1~48ヶ月齢の42,000人超の子供による無作為化対照試験で、マラリアおよびその他の感染症による死亡率は、亜鉛補給によって大きくは減少しなかったことがわかった(54)。矛盾する結果の報告があるので、亜鉛補給が子供のマラリアの予防や治療に役立つかどうかは不明である(28)。
年配者の免疫反応
加齢による免疫機能の低下は亜鉛欠乏症による低下と似ていて、高齢者は軽度の亜鉛欠乏症になりやすい(55)。しかしながら、高齢者の免疫機能に対する亜鉛補給試験の結果はまちまちである。高齢者の免疫機能のある一面は、亜鉛補給で向上することがわかっている(56)。たとえば、65歳超の男女による無作為化プラセボ対照研究で25mg/日の亜鉛補給を3ヶ月間したら、いくつかの血液循環中の免疫細胞(たとえばCD4T細胞や細胞傷害性Tリンパ球)の濃度が上がったことがわかった(57)。49人の年配者(55~87歳)による無作為化二重盲検プラセボ対照試験では、そのうち35%は亜鉛欠乏症と考えられたが、45mg/日の亜鉛補給を12ヶ月したら、感染症の発生と、炎症および酸化ストレスのex vivo(体外)でのマーカー(TNF-αおよびMDA+HAE, 8-OHdG)の値が減ったことがわかった(58)。しかしながらその他の研究では、亜鉛補給は免疫機能のパラメーターを向上させなかったと報告され(56)、亜鉛と高齢者の免疫反応に関する推奨がなされる前に、さらなる研究が必要であることを示している。
妊娠合併症
世界中の妊婦の82%が、亜鉛摂取が不適切であろうと推定されている。母親の亜鉛の栄養状態が悪いことは、低出生体重、早産、分娩合併症、および先天性異常などの多くの好ましくない妊娠結果と関連している(59)。しかし、米国および発展途上国での母親への亜鉛補給試験の結果はまちまちである(31)。ある研究では母親への亜鉛補給が出生体重を増やして早産の可能性を減らすとわかったが、ペルーとバングラデシュの女性による2つのプラセボ対照研究では、亜鉛補給は低出生体重または早産の発生に影響しなかったことがわかった(60,61)。分娩合併症に対する亜鉛補給効果を調べるように考案された補給研究もまちまちの結果を生んでいるが、亜鉛欠乏症の集団に対して行われたものはほとんどない(31)。20の無作為化対照試験の最近のシステマティックレビュー(系統的総括)で、妊娠中の亜鉛補給は早産が14%減るという関連があったことがわかったが、早産の発生の減少は主に低収入の女性に見られた(62)。しかしこの解析では、亜鉛補給が母親または乳児の健康を表すその他の指標にも有益であるという発見はなかった(62)。
疾病治療
風邪
亜鉛トローチ剤
風邪の症状が出てから24時間以内に亜鉛トローチ剤を使用し、起きている間に2~3時間ごとに症状が収まるまでそれを続けることは、風邪の罹患期間を短縮するために推奨されてきた。成人の風邪の治療のために、グルコン酸亜鉛のトローチ剤を使う少なくとも10の対照試験が公表されている。5つの研究で亜鉛トローチ剤によって風邪の罹患期間が短縮されたとする一方で、5つの研究では風邪の罹患期間や重篤度に関して亜鉛トローチ剤はプラセボのトローチ剤と何も変わらなかったとした。風邪の際のグルコン酸亜鉛トローチ剤の使用に関して公表された無作為化対照試験のメタ解析で、風邪の罹患期間を短縮するのにそれが有効であるとするエビデンスはやはり不足していた(63)。風邪の症状に対する酢酸亜鉛トローチ剤の効果が2つの臨床試験で調べられた。1つの研究では、起きている間に2~3時間ごとに酢酸亜鉛トローチ剤(トローチ1つにつき12.8mgの亜鉛)を服用すると、風邪の症状全体の継続期間がプラセボに比べて減った(8.1日から4.5日に減少)(64)とした一方で、もう一方の研究では酢酸亜鉛トローチ剤は風邪の罹患期間や重篤度を低減させるのにプラセボと何の変わりもなかったとした(65)。よく対照された多くの試験にもかかわらず、風邪の症状を治すための亜鉛トローチ剤の効能には疑問が残ったままである。13の試験の系統的総括およびメタ解析で、トローチ剤やシロップの形で亜鉛を補給すると風邪の症状の期間が短くなるが、主要評価項目に大きな異質性(対象となった研究で効果が一貫しないこと)があったと報告された(66)。さらに、風邪の期間短縮に効果があったのは75mg/日超の亜鉛を補給した試験で、それより少ない用量の試験では効果がなかったことが、別の総括からわかった(67)。高用量(75mg/日超)の酢酸亜鉛を使用した試験では、風邪の期間が42%短くなったことが観察された(67)。試験によって一貫しない結果になったのは、トローチ剤に使用される様々な形態(酢酸亜鉛やグルコン酸亜鉛など)からの亜鉛の放出量が異なっていたことが一因であるかもしれない(67,68)。
風邪の症状に対する高用量亜鉛補給の有益な効果の生理学的原理はよくわかっていない。起きている間に2~3時間おきに亜鉛トローチ剤を服用すると、40mg/日という亜鉛の許容上限摂取量(UL)をはるかに超えた日々の亜鉛摂取量になってしまう(「安全性」の項参照)。短期間の亜鉛トローチ剤の使用(たとえば5日未満)では、深刻な副作用がおきていない。治験では、味が悪いことと吐き気が、もっとも多い悪影響であった(66)。長期間(とたえば6~8週間)亜鉛トローチ剤を服用すると、銅欠乏症になるであろう。こうした理由から、亜鉛トローチ剤を3~5日間服用しても風邪の症状が明らかによくなったと言えない者は、医師に診断してもらうもらうように勧める専門家もいる(64)。
経鼻亜鉛剤(経鼻亜鉛ゲルやスプレー)
鼻の内皮(鼻腔を形成する細胞)に直接適用するように考えられた経鼻亜鉛製剤も、店頭で買える風邪薬として市販されている。2つのプラセボ対照試験で経鼻グルコン酸亜鉛によって風邪の期間が少し短くなったとされた(69,70)ものの、別の3つのプラセボ対照試験では経鼻亜鉛剤は何の効果もなかったことがわかった(71~73)。3つの試験のうち最も厳格に対照された試験では、風邪の一般的な原因であるライノウィルスを接種されたボランティアの風邪の重篤度や期間に、経鼻グルコン酸亜鉛は影響しなかった(71)。懸念されるのは、風邪の治療として経鼻亜鉛製剤を使用した後で臭覚がなくなる(無嗅覚症)になった者の症例報告がいくつかあることだ(74)。亜鉛に関連した無嗅覚症は治らないかもしれないので、経鼻亜鉛製剤は避けるべきである。
加齢黄斑変性
米国で65歳超の者の失明の一番の原因は、加齢黄斑変性(AMD)として知られる黄斑の変性疾患である。黄斑は、視覚の中央に関わる目の奥の網膜の一部である。いくつかの理由から、亜鉛はAMDの発症に関わっていると仮定されている。それらは、(1)AMDに影響を受けた網膜の部分に亜鉛が高濃度で見つかっていること、(2)加齢とともに網膜の亜鉛の含有量が減っていくと示されていること、および(3)網膜での亜鉛依存性酵素の活動は加齢とともに減っていくことが示されていることである。しかしながら、AMDの発症や進行に亜鉛の摂取が関連しているという科学的エビデンスは限られている。観察研究では、食事からの亜鉛摂取とAMDの発症との間に明確な関連があることが示されていない(75~79)。ある無作為化対照試験で、200mg/日の硫酸亜鉛(亜鉛元素としては81mg/日)を2年間摂取したら、AMD患者の視力喪失が少なくなったという結果に関心がわき起こった(80)。しかし、同じ用量や期間で行われた後の試験で、片方の目により進行した形式のAMDがある患者には、何も有益な効果がなかったとわかった(81)。抗酸化物質(500mgのビタミンC、400 IUのビタミンE、および15mgのβカロテン)と高用量亜鉛(80mgの亜鉛と2mgの銅)を毎日補給した大規模無作為化対照試験である加齢性眼疾患研究(AREDS)で、抗酸化物質と高用量亜鉛の組み合わせ、および高用量亜鉛単独のどちらでも、少なくとも片方の目に中度から重度の黄斑変性のある個人がさらに進行した黄斑変性になるリスクがプラセボに比べて大きく減ったことがわかった(82)。5年間の試験であるAREDS2では、処方の亜鉛の用量を減らす(80mgから25mgへ)と、AMDの進行に何の効果もなかったことが最近わかった(83)。より小規模な試験からのデータでは、AMDに対してビタミンやミネラルの補給は予防効果が一般的に見られない(84,85)。最近、74人のAMD患者による無作為化二重盲検プラセボ対照試験で50mg/日の亜鉛モノシステインを6ヶ月間補給したら、視力、コントラスト感度、および光回復などの黄斑機能の測定値が向上したことが報告された(86)。抗酸化物質、亜鉛、銅を含むAREDSの処方(82)は、現在ではAMD患者の治療の標準である(87)。AMDの治療における亜鉛単一補給の効果を調べるさらなる無作為化対照試験が必要である。
糖尿病
軽度の亜鉛欠乏症は、糖尿病の個人には比較的よくあることかもしれない(34)。頻尿によって亜鉛をより喪失することが、糖尿病患者の亜鉛の栄養状態がぎりぎりであることに寄与しているようである(88)。亜鉛補給が糖尿病患者の免疫機能を高めると報告されているものの、ある研究では50mg/日という亜鉛補給でインスリン依存性(1型)糖尿病患者の血糖コントロールに悪影響があった(89)。別の研究では、2型糖尿病患者に6ヶ月間30mg/日の亜鉛補給をしたら、血糖コントロールに大きく影響することなく酸化ストレスの非特異的測定値(血漿TBARS)が減った(90)。より最近では、2型糖尿病の40人の男性によるプラセボ対照試験で、高用量亜鉛補給(240mg/日)を3ヶ月間したら、酸化ストレスや血管機能の測定値はよくならなかったことがわかったが、この研究に参加した男性は正常な亜鉛濃度であった(91)。現在では、糖尿病患者に高用量亜鉛補給を勧める前に、ブドウ糖の代謝に亜鉛が及ぼす影響のさらなる研究が必要である(6)。糖尿病患者は亜鉛のRDAを守ることが賢明なようである(上記のRDAの項参照)。
HIV/AIDS
免疫機能の維持に亜鉛の充足は不可欠であり、HIV感染者は亜鉛欠乏症に特になりやすい。HIV感染者では、亜鉛の血清濃度が低いとこの疾患がより進行した状態になり、死亡率も高いという関連がある(92,93)。AIDS患者に対する亜鉛補給研究の一つで、45mg/日の亜鉛を1ヶ月補給したら、プラセボに比べて日和見感染の発生が減った(94)。血漿亜鉛濃度の低い(0.75mg/l)231人のHIV陽性の成人によるプラセボ対照試験で、亜鉛補給(男性には15mg/日、女性には12mg/日)を18ヶ月したら、免疫不全(CD4陽性リンパ球細胞の数が200/mm3未満で定義される)の発生が76%減り、下痢の割合も60%減ったことがわかった(95)。
しかしながら、HIVウィルスも亜鉛を必要とするので、亜鉛の摂取過剰はHIV感染を進行させるかもしれない。たとえば、HIV感染の男性によるある観察研究で、食事性の亜鉛摂取が増えると疾病の進行が速くなるという関連の報告があった。この観察研究の亜鉛サプリメント摂取では、どれも生存率が悪くなった(96)。1,009人の参加者による6つの無作為化対照試験の最近の系統的総括で、亜鉛補給は成人の日和見感染の減少に対して安全で有益であり、妊婦や子供への亜鉛補給の効果を評価するさらなる試験が必要であると結論づけられた(97)。
摂取源
食品の摂取源
貝や甲殻類、牛肉、およびその他の赤身の肉は、亜鉛の豊富な摂取源である。ナッツ類や豆類は、比較的良好な植物性の亜鉛摂取源である。亜鉛の生物学的利用能(体内に留まって使用される亜鉛の割合)は、亜鉛吸収を妨げる化合物が比較的少ないことや、亜鉛の吸収をよくする硫黄を含むアミノ酸(システインやメチオニン)が含まれることから、肉、卵、およびシーフードで比較的高い。全粒穀物の製品や植物性タンパク質は、亜鉛の吸収を阻害する化合物であるフィチン酸が比較的多く含まれるため、生物学的利用能が低くなる(6)。酵母の酵素作用は、食品のフィチン酸の濃度を下げる。したがって発酵させた全粒穀物パンは、発酵させていない全粒穀物パンよりも生物学的利用能が高い亜鉛を含む。米国の国民食事調査では、平均的な食事性亜鉛摂取量は成人女性で9mg/日、成人男性で13mg/日と推定されている(5)。亜鉛を比較的多く含む食品の亜鉛含有量を、ミリグラム(mg)単位で表2に示す。特定の食品の栄養素の含有量についての詳細は、USDA食品成分データベースを検索のこと(98)。
サプリメント
多くの亜鉛サプリメントが市販されており、酢酸亜鉛、グルコン酸亜鉛、ピコリン酸亜鉛、および硫酸亜鉛などが含まれる。ピコリン酸亜鉛は亜鉛がより吸収されやすい形態であると宣伝されてきたが、ヒトにおいてこの考え方を支持するデータはほとんどない。限定的な動物実験では、ピコリン酸亜鉛の腸での吸収増加が排出の増加と相殺されるかもしれないことが示唆されている(5)。
安全性
毒性
急性毒性
亜鉛の急性毒性症状の単発的発生は、亜鉛メッキ容器から放出された亜鉛によって汚染された食品や飲料の摂取によって起きてきた。亜鉛の急性毒性の徴候は、腹痛、下痢、吐き気、および嘔吐などである。一回に225~450mgの用量の亜鉛によって、通常は嘔吐を起こす。50~150mg/日の用量の亜鉛サプリメントで、軽度の胃腸障害が報告されている。酸化亜鉛蒸気の吸入後には、金属ヒューム熱の発生が報告されている。特に、酸化亜鉛吸入の8時間以内に多汗症、衰弱、および動悸などが起こり、吸入しなくなった後12~24時間持続するかもしれない(5,6)。
悪影響
長期間の亜鉛摂取過剰の主な結果は、銅欠乏症である。亜鉛摂取の総量が60mg/日(50mgをサプリメントから、10mgを食事から)になると、銅欠乏症の徴候が現れる。亜鉛を含む義歯接着剤の慢性的過剰使用(17~34mg/日の亜鉛を含む接着剤のチューブを1週間に2本超)の後でも、銅欠乏症は報告されている(99)。銅欠乏症を防ぐために、米国食品栄養委員会は成人の許容上限摂取量(UL)を食事およびサプリメントを含めて40mg/日に設定した(5)(表3)。
| 年齢層 | 許容上限摂取量(mg/日) |
|---|---|
| 乳児、0~6ヶ月 | 4 |
| 乳児、7~12ヶ月 | 5 |
| 幼児、1~3歳 | 7 |
| 子供、4~8歳 | 12 |
| 子供、9~13歳 | 23 |
| 青少年、14~18歳 | 34 |
| 成人、19歳以上 | 40 |
亜鉛の経鼻投与
亜鉛の経鼻投与は、実験動物で嗅覚消失(無嗅覚症)を起こすことが知られており(100)、グルコン酸亜鉛の経鼻薬を使用した後で無嗅覚症になった個人のいくつかの症例報告がある(75)。亜鉛に関連する無嗅覚症は不可逆性かもしれないので、亜鉛の経鼻ジェルやスプレーは避けるべきである。
薬物相互作用
テトラサイクリンやキノロン系抗生物質、およびビスホスホネートなどの特定の薬物と亜鉛のサプリメントの同時投与は、亜鉛および薬物の双方の吸収を減らして薬物の効能を低減するかもしれない(101)。亜鉛のサプリメントとこれらの抗生物質の摂取間隔を少なくとも2時間あけると、この相互作用を防ぐことができるはずである(102)。さらに、ペニシラミン(ウィルソン病の銅過剰の治療に使用される)やジエチレントリアミンペンタアセテート(DTPA。鉄過剰の治療に使用される)などの金属結合剤を治療に使用すると、深刻な亜鉛欠乏症になる。抗けいれん薬、特にバルプロ酸ナトリウムは亜鉛欠乏症を促進するかもしれない。利尿剤の長期使用は亜鉛の尿中排出を増やし、亜鉛の喪失量が増えることになるかもしれない。また、結核の治療薬であるエタンブトールは金属結合性があり、ラットでは亜鉛喪失量を増やすことが示されている(6)。
ライナス・ポーリング研究所の推奨
亜鉛の推奨量(成人女性で8mg/日、成人男性で11mg/日)は、ほとんどの個人の欠乏症を防ぐのに充分なようである。しかしヒトでの亜鉛の栄養状態を示す感度の良い指標がないため、健康を最善の状態にするであろう亜鉛摂取量を決定することが困難になっている。ほとんどの栄養素の1日の摂取量(DV)を100%含むマルチビタミン/マルチミネラルのサプリメントを摂取するというライナス・ポーリング研究所の推奨に従えば、15mg/日の亜鉛が一般的に摂取できるであろう。
年配の成人(50歳超)
年配の成人の亜鉛の必要量が高いとわかっているわけではないが、この世代の亜鉛摂取量の平均はRDAよりかなり低い傾向がある。亜鉛を吸収する能力の減少、亜鉛の利用を変える疾患になりやすくなること、および亜鉛の排出を増やす薬物の使用が増えることが、年配の成人の軽度亜鉛欠乏症のリスク上昇に寄与するかもしれない。免疫系の機能の障害などの軽度亜鉛欠乏症の結果は年配者の健康に特に関わるので、適切な亜鉛の摂取に特に注意を払わなくてはいけない。
Authors and Reviewers
Originally written in 2001 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in December 2003 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in October 2007 by:
Victoria J. Drake, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in June 2013 by:
Victoria J. Drake, Ph.D.
Linus Pauling Institute
Oregon State University
Reviewed in June 2013 by:
Emily Ho, Ph.D.
Endowed Director, Moore Family Center for Whole Grain Foods,
Nutrition and Preventive Health
Professor, School of Biological and Population Health Sciences
Principal Investigator, Linus Pauling Institute
Oregon State University
The 2013 update of this article was underwritten, in part, by a grant from Bayer Consumer Care AG, Basel, Switzerland.
Copyright 2001-2024 Linus Pauling Institute
References
1. Prasad AS, Halsted JA, Nadimi M. Syndrome of iron deficiency anemia, hepatosplenomegaly, hypogonadism, dwarfism, and geophagia. Am J Med. 1961;31:532-546.
2. Prasad AS. Zinc deficiency in humans: a neglected problem. J Am Coll Nutr. 1998;17(6):542-543.
3. Cousins RJ. Zinc. In: Bowman BA, Russell RM, eds. Present Knowledge in Nutrition. 9th ed, Vol. 1. Washington, D.C.: ILSI Press; 2006:445-457.
4. McCall KA, Huang C, Fierke CA. Function and mechanism of zinc metalloenzymes. J Nutr. 2000;130(5S Suppl):1437S-1446S. (PubMed)
5. Food and Nutrition Board, Institute of Medicine. Zinc. Dietary reference intakes for vitamin A, vitamin K, arsenic, boron, chromium, copper, iodine, iron, manganese, molybdenum, nickel, silicon, vanadium, and zinc. Washington, D.C.: National Academy Press; 2001:442-501. (National Academy Press)
6. King JC, Cousins RJ. Zinc. In: Shils ME, Shike M, Ross AC, Caballero B, Cousins RJ, eds. Modern Nutrition in Health and Disease. 10th ed. Baltimore: Lippincott Williams & Wilkins; 2006:271-285.
7. O'Dell BL. Role of zinc in plasma membrane function. J Nutr. 2000;130(5S Suppl):1432S-1436S. (PubMed)
8. Truong-Tran AQ, Ho LH, Chai F, Zalewski PD. Cellular zinc fluxes and the regulation of apoptosis/gene-directed cell death. J Nutr. 2000;130(5S Suppl):1459S-1466S. (PubMed)
9. Sandstrom B. Micronutrient interactions: effects on absorption and bioavailability. Br J Nutr. 2001;85 Suppl 2:S181-185. (PubMed)
10. O'Brien KO, Zavaleta N, Caulfield LE, Wen J, Abrams SA. Prenatal iron supplements impair zinc absorption in pregnant Peruvian women. J Nutr. 2000;130(9):2251-2255. (PubMed)
11. Fung EB, Ritchie LD, Woodhouse LR, Roehl R, King JC. Zinc absorption in women during pregnancy and lactation: a longitudinal study. Am J Clin Nutr. 1997;66(1):80-88. (PubMed)
12. Wood RJ, Zheng JJ. High dietary calcium intakes reduce zinc absorption and balance in humans. Am J Clin Nutr. 1997;65(6):1803-1809. (PubMed)
13. McKenna AA, Ilich JZ, Andon MB, Wang C, Matkovic V. Zinc balance in adolescent females consuming a low- or high-calcium diet. Am J Clin Nutr. 1997;65(5):1460-1464. (PubMed)
14. Hunt JR, Beiseigel JM. Dietary calcium does not exacerbate phytate inhibition of zinc absorption by women from conventional diets. Am J Clin Nutr. 2009;89(3):839-843. (PubMed)
15. Kauwell GP, Bailey LB, Gregory JF, 3rd, Bowling DW, Cousins RJ. Zinc status is not adversely affected by folic acid supplementation and zinc intake does not impair folate utilization in human subjects. J Nutr. 1995;125(1):66-72. (PubMed)
16. Boron B, Hupert J, Barch DH, et al. Effect of zinc deficiency on hepatic enzymes regulating vitamin A status. J Nutr. 1988;118(8):995-1001. (PubMed)
17. Christian P, West KP, Jr. Interactions between zinc and vitamin A: an update. Am J Clin Nutr. 1998;68(2 Suppl):435S-441S. (PubMed)
18. Hambidge M. Human zinc deficiency. J Nutr. 2000;130(5S Suppl):1344S-1349S. (PubMed)
19. Prasad AS. Discovery of human zinc deficiency: 50 years later. J Trace Elem Med Biol. 2012;26(2-3):66-69. (PubMed)
20. Prasad AS. Zinc deficiency. BMJ. 2003;326(7386):409-410. (PubMed)
21. King JC. Zinc: an essential but elusive nutrient. Am J Clin Nutr. 2011;94(2):679S-684S. (PubMed)
22. Fischer Walker CL, Ezzati M, Black RE. Global and regional child mortality and burden of disease attributable to zinc deficiency. Eur J Clin Nutr. 2009;63(5):591-597. (PubMed)
23. International Zinc Nutrition Consultative Group, Brown KH, Rivera JA, et al. International Zinc Nutrition Consultative Group (IZiNCG) technical document #1. Assessment of the risk of zinc deficiency in populations and options for its control. Food Nutr Bull. 2004;25(1 Suppl 2):S99-203. (PubMed)
24. Krebs NF. Update on zinc deficiency and excess in clinical pediatric practice. Ann Nutr Metabol. 2013;62 Suppl 1:19-29. (PubMed)
25. Gibson RS, Hess SY, Hotz C, Brown KH. Indicators of zinc status at the population level: a review of the evidence. Br J Nutr. 2008;99 Suppl 3:S14-23. (PubMed)
26. Walravens PA, Hambidge KM, Koepfer DM. Zinc supplementation in infants with a nutritional pattern of failure to thrive: a double-blind, controlled study. Pediatrics. 1989;83(4):532-538. (PubMed)
27. Hambidge M, Krebs N. Zinc and growth. In: Roussel AM, ed. Trace elements in man and animals 10: Proceedings of the tenth international symposium on trace elements in man and animals. New York: Plenum Press; 2000:977-980.
28. Brown KH, Peerson JM, Baker SK, Hess SY. Preventive zinc supplementation among infants, preschoolers, and older prepubertal children. Food Nutr Bull. 2009;30(1 Suppl):S12-40. (PubMed)
29. Imdad A, Bhutta ZA. Effect of preventive zinc supplementation on linear growth in children under 5 years of age in developing countries: a meta-analysis of studies for input to the lives saved tool. BMC public health. 2011;11 Suppl 3:S22. (PubMed)
30. MacDonald RS. The role of zinc in growth and cell proliferation. J Nutr. 2000;130(5S Suppl):1500S-1508S. (PubMed)
31. Caulfield LE, Zavaleta N, Shankar AH, Merialdi M. Potential contribution of maternal zinc supplementation during pregnancy to maternal and child survival. Am J Clin Nutr. 1998;68(2 Suppl):499S-508S. (PubMed)
32. Sandstead HH, Penland JG, Alcock NW, et al. Effects of repletion with zinc and other micronutrients on neuropsychologic performance and growth of Chinese children. Am J Clin Nutr. 1998;68(2 Suppl):470S-475S. (PubMed)
33. Black MM. Zinc deficiency and child development. Am J Clin Nutr. 1998;68(2 Suppl):464S-469S. (PubMed)
34. Gogia S, Sachdev HS. Zinc supplementation for mental and motor development in children. Cochrane Database Syst Rev. 2012;12:CD007991. (PubMed)
35. Baum MK, Shor-Posner G, Campa A. Zinc status in human immunodeficiency virus infection. J Nutr. 2000;130(5S Suppl):1421S-1423S. (PubMed)
36. Prasad AS. Zinc in human health: effect of zinc on immune cells. Mol Med. 2008;14(5-6):353-357. (PubMed)
37. Prasad AS. Zinc: role in immunity, oxidative stress and chronic inflammation. Curr Opin Clin Nutr Metab Care. 2009;12(6):646-652. (PubMed)
38. Prasad AS. Clinical, immunological, anti-inflammatory and antioxidant roles of zinc. Exp Gerontol. 2008;43(5):370-377. (PubMed)
39. Shankar AH, Prasad AS. Zinc and immune function: the biological basis of altered resistance to infection. Am J Clin Nutr. 1998;68(2 Suppl):447S-463S. (PubMed)
40. Boschi-Pinto C, Velebit L, Shibuya K. Estimating child mortality due to diarrhoea in developing countries. Bull World Health Organ. 2008;86(9):710-717. (PubMed)
41. Wapnir RA. Zinc deficiency, malnutrition and the gastrointestinal tract. J Nutr. 2000;130(5S Suppl):1388S-1392S. (PubMed)
42. Bhutta ZA, Bird SM, Black RE, et al. Therapeutic effects of oral zinc in acute and persistent diarrhea in children in developing countries: pooled analysis of randomized controlled trials. Am J Clin Nutr. 2000;72(6):1516-1522. (PubMed)
43. Fischer Walker CL, Black RE. Micronutrients and diarrheal disease. Clin Infect Dis. 2007;45 Suppl 1:S73-77. (PubMed)
44. Aggarwal R, Sentz J, Miller MA. Role of zinc administration in prevention of childhood diarrhea and respiratory illnesses: a meta-analysis. Pediatrics. 2007;119(6):1120-1130. (PubMed)
45. Lazzerini M, Ronfani L. Oral zinc for treating diarrhoea in children. Cochrane Database Syst Rev. 2012;6:CD005436. (PubMed)
46. The United Nations Children's Fund/World Health Organization. WHO/UNICEF Joint Statement: Clinical Management of Acute Diarrhoea. Geneva; New York; 2004:1-8. Available at: http://www.unicef.org/publications/index_21433.html
47. Bhutta ZA, Black RE, Brown KH, et al. Prevention of diarrhea and pneumonia by zinc supplementation in children in developing countries: pooled analysis of randomized controlled trials. Zinc Investigators' Collaborative Group. J Pediatr. 1999;135(6):689-697. (PubMed)
48. Lassi ZS, Haider BA, Bhutta ZA. Zinc supplementation for the prevention of pneumonia in children aged 2 months to 59 months. Cochrane Database Syst Rev. 2010;(12):CD005978. (PubMed)
49. Natchu UC, Fataki MR, Fawzi WW. Zinc as an adjunct for childhood pneumonia - interpreting early results. Nutr Rev. 2008;66(7):398-405. (PubMed)
50. Basnet S, Shrestha PS, Sharma A, et al. A randomized controlled trial of zinc as adjuvant therapy for severe pneumonia in young children. Pediatrics. 2012;129(4):701-708. (PubMed)
51. Shankar AH. Nutritional modulation of malaria morbidity and mortality. J Infect Dis. 2000;182 Suppl 1:S37-53. (PubMed)
52. Muller O, Becher H, van Zweeden AB, et al. Effect of zinc supplementation on malaria and other causes of morbidity in west African children: randomised double blind placebo controlled trial. BMJ. 2001;322(7302):1567. (PubMed)
53. Effect of zinc on the treatment of Plasmodium falciparum malaria in children: a randomized controlled trial. Am J Clin Nutr. 2002;76(4):805-812. (PubMed)
54. Sazawal S, Black RE, Ramsan M, et al. Effect of zinc supplementation on mortality in children aged 1-48 months: a community-based randomised placebo-controlled trial. Lancet. 2007;369(9565):927-934. (PubMed)
55. Wong CP, Ho E. Zinc and its role in age-related inflammation and immune dysfunction. Mol Nutr Food Res. 2012;56(1):77-87. (PubMed)
56. Salgueiro MJ, Zubillaga M, Lysionek A, et al. Zinc status and immune system relationship: a review. Biol Trace Elem Res. 2000;76(3):193-205. (PubMed)
57. Fortes C, Forastiere F, Agabiti N, et al. The effect of zinc and vitamin A supplementation on immune response in an older population. J Am Geriatr Soc. 1998;46(1):19-26. (PubMed)
58. Prasad AS, Beck FW, Bao B, et al. Zinc supplementation decreases incidence of infections in the elderly: effect of zinc on generation of cytokines and oxidative stress. Am J Clin Nutr. 2007;85(3):837-844. (PubMed)
59. Shah D, Sachdev HP. Zinc deficiency in pregnancy and fetal outcome. Nutr Rev. 2006;64(1):15-30. (PubMed)
60. Caulfield LE, Zavaleta N, Figueroa A, Leon Z. Maternal zinc supplementation does not affect size at birth or pregnancy duration in Peru. J Nutr. 1999;129(8):1563-1568. (PubMed)
61. Osendarp SJ, van Raaij JM, Arifeen SE, Wahed M, Baqui AH, Fuchs GJ. A randomized, placebo-controlled trial of the effect of zinc supplementation during pregnancy on pregnancy outcome in Bangladeshi urban poor. Am J Clin Nutr. 2000;71(1):114-119. (PubMed)
62. Mori R, Ota E, Middleton P, et al. (2012) Zinc supplementation for improving pregnancy and infant outcome. Cochrane Database Syst Rev. 2012;7:CD000230. (PubMed)
63. Jackson JL, Lesho E, Peterson C. Zinc and the common cold: a meta-analysis revisited. J Nutr. 2000;130(5S Suppl):1512S-1515S. (PubMed)
64. Prasad AS, Fitzgerald JT, Bao B, Beck FW, Chandrasekar PH. Duration of symptoms and plasma cytokine levels in patients with the common cold treated with zinc acetate. A randomized, double-blind, placebo-controlled trial. Ann Intern Med. 2000;133(4):245-252. (PubMed)
65. Turner RB, Cetnarowski WE. Effect of treatment with zinc gluconate or zinc acetate on experimental and natural colds. Clin Infect Dis. 2000;31(5):1202-1208. (PubMed)
66. Science M, Johnstone J, Roth DE, Guyatt G, Loeb M. Zinc for the treatment of the common cold: a systematic review and meta-analysis of randomized controlled trials. CMAJ. 2012;184(10):E551-561. (PubMed)
67. Hemila H. Zinc lozenges may shorten the duration of colds: a systematic review. Open Respir Med J. 2011;5:51-58. (PubMed)
68. Eby GA, 3rd. Zinc lozenges as cure for the common cold--a review and hypothesis. Med Hypotheses. 2010;74(3):482-492. (PubMed)
69. Mossad SB. Effect of zincum gluconicum nasal gel on the duration and symptom severity of the common cold in otherwise healthy adults. QJM. 2003;96(1):35-43. (PubMed)
70. Hirt M, Nobel S, Barron E. Zinc nasal gel for the treatment of common cold symptoms: a double-blind, placebo-controlled trial. Ear Nose Throat J. 2000;79(10):778-780, 782. (PubMed)
71. Turner RB. Ineffectiveness of intranasal zinc gluconate for prevention of experimental rhinovirus colds. Clin Infect Dis. 2001;33(11):1865-1870. (PubMed)
72. Belongia EA, Berg R, Liu K. A randomized trial of zinc nasal spray for the treatment of upper respiratory illness in adults. Am J Med. 2001;111(2):103-108. (PubMed)
73. Eby GA, Halcomb WW. Ineffectiveness of zinc gluconate nasal spray and zinc orotate lozenges in common-cold treatment: a double-blind, placebo-controlled clinical trial. Altern Ther Health Med. 2006;12(1):34-38. (PubMed)
74. DeCook CA, Hirsch AR. Anosmia due to inhalational zinc: a case report. Chem Senses. 2000;25(5):659.
75. VandenLangenberg GM, Mares-Perlman JA, Klein R, Klein BE, Brady WE, Palta M. Associations between antioxidant and zinc intake and the 5-year incidence of early age-related maculopathy in the Beaver Dam Eye Study. Am J Epidemiol. 1998;148(2):204-214. (PubMed)
76. Smith W, Mitchell P, Webb K, Leeder SR. Dietary antioxidants and age-related maculopathy: the Blue Mountains Eye Study. Ophthalmology. 1999;106(4):761-767. (PubMed)
77. Cho E, Stampfer MJ, Seddon JM, et al. Prospective study of zinc intake and the risk of age-related macular degeneration. Ann Epidemiol. 2001;11(5):328-336. (PubMed)
78. van Leeuwen R, Boekhoorn S, Vingerling JR, et al. Dietary intake of antioxidants and risk of age-related macular degeneration. JAMA. 2005;294(24):3101-3107. (PubMed)
79. Tan JS, Wang JJ, Flood V, et al. Dietary antioxidants and the long-term incidence of age-related macular degeneration: the Blue Mountains Eye Study. Ophthalmology. 2008;115(2):334-341. (PubMed)
80. Newsome DA, Swartz M, Leone NC, Elston RC, Miller E. Oral zinc in macular degeneration. Arch Ophthalmol. 1988;106(2):192-198. (PubMed)
81. Stur M, Tittl M, Reitner A, Meisinger V. Oral zinc and the second eye in age-related macular degeneration. Invest Ophthalmol Vis Sci. 1996;37(7):1225-1235. (PubMed)
82. A randomized, placebo-controlled, clinical trial of high-dose supplementation with vitamins C and E, beta carotene, and zinc for age-related macular degeneration and vision loss: AREDS report no. 8. Arch Ophthalmol. 2001;119(10):1417-1436. (PubMed)
83. Age-Related Eye Disease Study 2 Research Group. Lutein + zeaxanthin and omega-3 fatty acids for age-related macular degeneration: the Age-Related Eye Disease Study 2 (AREDS2) randomized clinical trial. JAMA. 2013;309(19):2005-2015. (PubMed)
84. Evans JR. Antioxidant vitamin and mineral supplements for slowing the progression of age-related macular degeneration. Cochrane Database Syst Rev. 2006;(2):CD000254. (PubMed)
85. Evans J. Antioxidant supplements to prevent or slow down the progression of AMD: a systematic review and meta-analysis. Eye. 2008;22(6):751-760. (PubMed)
86. Newsome DA. A randomized, prospective, placebo-controlled clinical trial of a novel zinc-monocysteine compound in age-related macular degeneration. Curr Eye Res. 2008;33(7):591-598. (PubMed)
87. Evans JR, Lawrenson JG. Antioxidant vitamin and mineral supplements for preventing age-related macular degeneration. Cochrane Database Syst Rev. 2012;6:CD000253. (PubMed)
88. Blostein-Fujii A, DiSilvestro RA, Frid D, Katz C, Malarkey W. Short-term zinc supplementation in women with non-insulin-dependent diabetes mellitus: effects on plasma 5'-nucleotidase activities, insulin-like growth factor I concentrations, and lipoprotein oxidation rates in vitro. Am J Clin Nutr. 1997;66(3):639-642. (PubMed)
89. Cunningham JJ, Fu A, Mearkle PL, Brown RG. Hyperzincuria in individuals with insulin-dependent diabetes mellitus: concurrent zinc status and the effect of high-dose zinc supplementation. Metabolism. 1994;43(12):1558-1562. (PubMed)
90. Anderson RA, Roussel AM, Zouari N, Mahjoub S, Matheau JM, Kerkeni A. Potential antioxidant effects of zinc and chromium supplementation in people with type 2 diabetes mellitus. J Am Coll Nutr. 2001;20(3):212-218. (PubMed)
91. Seet RC, Lee CY, Lim EC, et al. Oral zinc supplementation does not improve oxidative stress or vascular function in patients with type 2 diabetes with normal zinc levels. Atherosclerosis. 2011;219(1):231-239. (PubMed)
92. Lai H, Lai S, Shor-Posner G, Ma F, Trapido E, Baum MK. Plasma zinc, copper, copper:zinc ratio, and survival in a cohort of HIV-1-infected homosexual men. J Acquir Immune Defic Syndr. 2001;27(1):56-62. (PubMed)
93. Wellinghausen N, Kern WV, Jochle W, Kern P. Zinc serum level in human immunodeficiency virus-infected patients in relation to immunological status. Biol Trace Elem Res. 2000;73(2):139-149. (PubMed)
94. Mocchegiani E, Muzzioli M. Therapeutic application of zinc in human immunodeficiency virus against opportunistic infections. J Nutr. 2000;130(5S Suppl):1424S-1431S. (PubMed)
95. Baum MK, Lai S, Sales S, Page JB, Campa A. Randomized, controlled clinical trial of zinc supplementation to prevent immunological failure in HIV-infected adults. Clin Infect Dis. 2010;50(12):1653-1660. (PubMed)
96. Tang AM, Graham NM, Saah AJ. Effects of micronutrient intake on survival in human immunodeficiency virus type 1 infection. Am J Epidemiol. 1996;143(12):1244-1256. (PubMed)
97. Zeng L, Zhang L. Efficacy and safety of zinc supplementation for adults, children and pregnant women with HIV infection: systematic review. Trop Med Int Health. 2011;16(12):1474-1482. (PubMed)
98. US Department of Agriculture, Agricultural Research Service. USDA National Nutrient Database for Standard Reference, Release 25. 2012. Available at: http://ndb.nal.usda.gov. Accessed 2/19/13.
99. Nations SP, et al. Denture cream: an unusual source of excess zinc, leading to hypocupremia and neurologic disease. Neurology. 2008;71(9):639-643. (PubMed)
100. McBride K, Slotnick B, Margolis FL. Does intranasal application of zinc sulfate produce anosmia in the mouse? An olfactometric and anatomical study. Chem Senses. 2003;28(8):659-670. (PubMed)
101. Zinc. In: Hendler S RD, eds. PDR for Nutritional Supplements. 2nd ed. Montvale: Physicians' Desk Reference Inc.; 2008.
102. Minerals. In Drug Facts and Comparisons. St. Louis, MO: Facts and Comparisons, 2000:27-51.
鉄
目次
要旨
-
鉄は酸素輸送、エネルギー生産、およびDNA合成といった不可欠な生物学的機能を支える数百のタンパク質や酵素の必須成分である。ヘモグロビン、ミオグロビン、シトクロム、およびペルオキシダーゼは、それらの生物学的活性のために補欠分子族として鉄を含むヘムを必要とする。(詳細はこちら)
-
体はほとんど鉄を排泄しないので、鉄の代謝はきっちりと調整されている。特に、鉄の調整ホルモンであるヘプシジンは、体の鉄の貯蔵が必要量を満たすのに十分な場合に食事性の鉄の吸収を阻止し、細胞での鉄のゼクエストレーション(分離)を促進し、鉄の生物学的利用性を下げる。(詳細はこちら)
-
健康な男性と妊娠していない女性では、鉄の栄養状態は血清フェリチン(鉄貯蔵タンパク質)、血清鉄、総鉄結合能、トランスフェリン(血液中の主要な鉄輸送体)飽和度、および可溶性トランスフェリン受容体を測定する臨床検査を使用して評価できる。(詳細はこちら)
-
鉄欠乏症は、体の蓄えが枯渇した後でも細胞への鉄の供給が不適切であることから起こる。小球性低色素性貧血は、体の鉄の貯蔵が少なくヘモグロビンの合成や赤血球の生成が深刻に損なわれた場合に起こる。(詳細はこちら)
-
鉄欠乏症は世界中で最も一般的な栄養素欠乏症で、主に子供、妊娠可能年齢の女性、妊婦、頻繁な献血者、および特定の医学的症状のある者に影響する。(詳細はこちら)
-
鉄必要量のかなりの部分は、老化した赤血球から鉄を再利用することで賄われる。鉄の推奨量(RDA)は、男性および閉経後の女性で8mg/日、閉経前の女性で18mg/日、および妊婦で27mg/日である。(詳細はこちら)
-
子供の貧血を伴うまたは伴わない鉄欠乏症は、認知発達不良、学業成績不良、および異常な行動パターンと関連づけられてきた。限定的なエビデンス(科学的根拠)では、3歳より若い貧血性鉄欠乏症乳幼児の精神運動発達や認知機能に鉄の補給は何の効果もないが、それより年長の子供、青少年、および貧血および/または鉄欠乏症の女性の注意力や集中力を向上させるかもしれないことが示唆されている。(詳細はこちら)
-
ヘム鉄は動物性食品に含まれるヘモグロビンやミオグロビンに由来し、肉食者の全食事性鉄摂取量の10~15%を占める。しかし、植物性および動物性食品に見られる非ヘム鉄よりもヘム鉄はずっと吸収されやすいので、ヘム鉄は吸収された鉄全体の最大40%を占める。(詳細はこちら)
-
遺伝性ヘモクロマトーシスを患う者の重要臓器に有毒な鉄が沈着することは、肝臓がんおよび2型糖尿病を含む多くの慢性症状と関連付けられてきた。ヘム鉄摂取の増加および/または鉄の恒常性喪失も、遺伝性の障害がない個人の慢性疾患リスクを上昇させるかもしれない。(詳細はこちら)
-
鉄の補給は胃腸への刺激、吐き気、嘔吐、下痢、または便秘を起こすかもしれず、抗生物質や骨粗鬆症、甲状腺機能低下症、またはパーキンソン病の症状を治療する薬物を含む特定の薬剤の吸収や効能に支障をきたすかもしれない。(詳細はこちら)
鉄は地殻で4番目に多い元素であり、栄養科学で最もよく研究された微量栄養素の一つである(1, 2)。それはすべての生体の代謝における主要元素である。鉄は、第一鉄(Fe2+)と第二鉄(Fe3+)という生物学的に関連のある2つの酸化状態で存在する。鉄は、酸素輸送、エネルギー生産、DNA合成、および細胞の増殖と複製などの本質的な生物学的機能を支える数百のタンパク質や酵素の必須成分である。
機能
ヘムは、多くの生物学的に重要な分子に見られる鉄含有化合物である(図1)。すべてではないがいくつかの鉄依存性タンパク質は、ヘム含有タンパク質(ヘムタンパク質とも呼ばれる)である。広範囲な生物学的活動をする鉄依存性タンパク質を、以下のように分類してもよい(1, 3)。
-
グロビン-ヘム(グロビンと結合したヘム):酸素の輸送や貯蔵に関連する非酵素的タンパク質(ヘモグロビン、ミオグロビン、ニューログロビンなど)
-
電子の輸送に関連するヘム酵素(シトクロムa,b,fやシトクロムCオキシダーゼなど)および/またはオキシダーゼ活性(酸化酵素活性)を持つヘム酵素(亜硫酸オキシダーゼ、シトクロムP450オキシダーゼ、ミエロペルオキシダーゼ、ペルオキシダーゼ、カタラーゼ、内皮型一酸化窒素合成酵素、シクロオキシゲナーゼなど)
-
エネルギー生産に関わる酸化還元酵素活性を持つ鉄-硫黄(Fe-S)クラスタータンパク質(コハク酸脱水素酵素、イソクエン酸脱水素酵素、NADH脱水素酵素、アコニターゼ、キサンチン酸化酵素、フェレドキシン-1など)、またはDNAの複製や修復に関わるもの(DNAポリメラーゼ、DNAヘリカーゼ)
-
触媒的作用の補助因子として鉄を必要とする非ヘム酵素(フェニルアラニン、チロシン、トリプトファン、およびリジン水酸化酵素;低酸素誘導因子(HIF)プロリルヒドロキシラーゼとアスパラギニルヒドロキシラーゼ;リボヌクレオチド還元酵素など)
-
鉄の輸送や貯蔵を担う非ヘムタンパク質(フェリチン、トランスフェリン、ハプトグロビン、ヘモペキシン、ラクトフェリンなど)
鉄含有タンパク質は多くの機能を支えているが、そのいくつかを以下に示す。
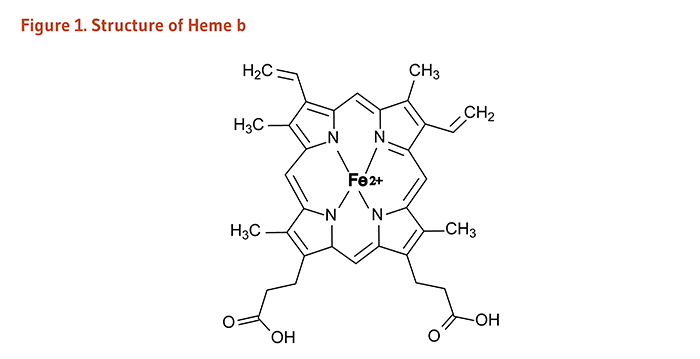
酸素の輸送と貯蔵
グロビン-ヘムは酸素の輸送や貯蔵に関わるヘム含有タンパク質であり、それよりは関与が低いがフリーラジカル(遊離基)の消去剤としても作用しているかもしれない(1)。ヘモグロビンは赤血球に見られる主要なタンパク質であり、体内の鉄の約三分の二を占める(3)。肺からそれ以外の体内へ酸素を輸送するというヘモグロビンの極めて重要な役割は、それが肺と接する短時間に急速に酸素を獲得することができる能力と、組織を巡っている間に必要に応じて酸素を放出するという能力によるものである。ミオグロビンは酸素の輸送および筋肉細胞での短時間貯蔵中に機能し、運動している筋肉からの需要と酸素の供給とが釣り合うように助ける(1)。ニューログロビンと呼ばれる第三のグロビンは中枢神経系で優先的に発現するが、その機能はよくわかっていない(4)。
電子の輸送とエネルギー代謝
シトクロムは、細胞のエネルギー生産、つまり生命に必要なミトコンドリアの電子輸送に重要な役割を持つヘム含有酵素である。特に、細胞における主要なエネルギー貯蔵化合物であるATPの合成の際に、シトクロムは電子運搬体として働く。シトクロムP450(CYP)は、多くの重要な生物学的分子(有機酸、脂肪酸、プロスタグランジン、ステロイド、ステロール、およびビタミンA、D、Kを含む)の代謝に関わる酵素ファミリーであり、解毒作用や薬物および汚染物質の代謝にも関わっている。NADH脱水素酵素、およびコハク酸脱水素酵素などのクエン酸回路における非ヘムの鉄含有酵素も、エネルギー代謝に重要である(1)。
抗酸化剤および有益な酸化促進剤の機能
カタラーゼやいくつかのペルオキシダーゼは、潜在的に有害な活性酸素種(ROS)である過酸化水素の蓄積から、過酸化水素を水と酸素に変換する反応の触媒作用をすることで細胞を護るヘム含有酵素である。免疫反応の一部として、ある種の白血球は細菌を取り込んでそれらを殺すためにROSに晒す。好中球によるそのようなROSの一つである次亜塩素酸の合成は、ヘム含有酵素であるミエロペルオキシダーゼによって触媒される(1)。
さらに甲状腺では、ヘム含有の甲状腺ペルオキシダーゼが甲状腺ホルモン生成のためのサイログロブリンのヨウ素化を触媒しており、鉄欠乏症や鉄欠乏症性貧血の際に甲状腺の代謝が損なわれる可能性がある(「栄養素相互作用」の項参照)。
酸素の感知
高地に住む者や慢性肺疾患の者が経験するような不適切な酸素濃度(低酸素症)は、赤血球の生成増加、血管成長(血管生成)増加、および嫌気性代謝で使用される酵素の生成増加を含む補償的な生理学的反応を引き起こす。低酸素症は、虚血/脳卒中や炎症性障害などの病態でも見られる。低酸素の状態では、低酸素誘導因子(HIF)として知られる転写因子が低酸素症への補償的反応に関わる様々なタンパク質を符号化する遺伝子中の応答配列と結合し、その合成を増やす。ジオキシゲナーゼファミリー(二原子酸素添加酵素ファミリー)の鉄依存性酵素であるHIFプロリルヒドロキシラーゼ(HIFプロリン水酸化酵素)とアスパラギニルヒドロキシラーゼ(HIF-1阻害因子(FIH-1))は、HIFの調整に関連している。細胞の酸素分圧が適正な時には、新規に合成されたHIF-αサブユニット(HIF-1α、HIF-2α、HIF-3α)は、急速な分解のためにHIF-αを標的にした鉄/2-オキソグルタル酸依存性のプロセスにおいてHIFプロリルヒドロキシラーゼによって修飾される。FIH-1に誘発されたHIF-αのアスパラギニルヒドロキシル化は、HIF-α転写複合体に対する活性化補助因子の補充を減らし、その結果HIF-αの転写活性を防いでしまう。細胞の酸素分圧が危機的なしきい値より低くなると、プロリルヒドロキシラーゼはもはやHIF-αを分解の標的にすることができない。するとHIF-αとHIF-βの結合を許すことになり、細胞核に入りエリスロポエチン遺伝子(EPO)のような標的遺伝子の特定の低酸素応答配列(HRE)と結合する転写複合体を生成する(5)。
DNA複製と修復
リボヌクレオチド還元酵素(RNR)は、DNA複製に必要なデオキシリボヌクレオチドの合成を触媒する鉄依存性酵素である。RNRは、DNA損傷に反応してDNA修復も促進する。DNAポリメラーゼやDNAヘリカーゼなどのDNA合成や修復に不可欠なその他の酵素は、鉄硫黄(Fe-S)クラスタータンパク質である。根本となるメカニズムは未だにはっきりしないが、細胞内の鉄の枯渇は、細胞の周期進行、成長、および分裂を阻害することがわかっている。ヘム合成の阻害も、乳がん細胞では細胞周期の停止を誘発する(6)。
鉄は、成長、生殖、治癒、および免疫機能を含むその他の多くの重要な機能に必要である。
調整
鉄の恒常性の全身的調整
鉄は不可欠な無機質であるが、細胞内の遊離した鉄は酸化ストレスや細胞損傷を引き起こすフリーラジカルの生成につながるかもしれないため、鉄は潜在的に毒性を持つ。したがって、体が全身の鉄の恒常性を調整することが重要である。体は発育中の赤血球(赤芽球)、体を循環するマクロファージ、鉄を貯蔵する肝細胞、およびその他の組織などの様々な部位への鉄の輸送を厳しく調整する(7)。細胞内の鉄の濃度は体の鉄の需要に従って調整されるが(下記参照)、細胞外のシグナルもヘプシジンの作用を通して体の鉄の恒常性を調整する。
主に肝細胞で合成されるペプチドホルモンであるヘプシジンは、全身の鉄の恒常性の主要な制御因子である。ヘプシジンは鉄排出タンパク質であるフェロポーチン-1の内部移行と分解を誘発することができる。フェロポーチン-1は腸細胞、肝細胞、および鉄を再利用するマクロファージなどの特定の細胞から血漿への鉄の放出を調整する(8)。体の鉄濃度が低かったり鉄欠乏性貧血の状態の時には、ヘプシジンの発現が最小限になり、食事からの鉄の吸収や体の貯蔵からの鉄の移動ができるようにする。対照的に、鉄の貯蔵が十分だったり鉄が過負荷になっている時には、ヘプシジンは食事性の鉄の吸収を阻害し、細胞の鉄のゼクエストレーション(分離)を促進し、鉄の生物学的利用性を下げる。ヘプシジンの発現は炎症や小胞体ストレスの状態では上方制御され、低酸素では下方制御される(9)。2B型ヘモクロマトーシス(血色素症)では、ヘプシジンの遺伝子であるHAMPの突然変異によるヘプシジン欠乏症が組織における異常な鉄の沈着を起こす(「鉄の過負荷」の項参照)。留意したいのは、体を襲う微生物の鉄の利用性を制限することで、ヘプシジンは自然免疫応答における主要な抗菌的役割をしていると考えられることである(「感染中の鉄捕獲防御」の項参照)(10)。
細胞内の鉄の調整
鉄応答エレメント(IRE)は、鉄の貯蔵、輸送、および利用の調整における重要なタンパク質を符号化するメッセンジャーRNA(mRNA)の中に見られるヌクレオチドの短配列である。鉄調整タンパク質(IRPすなわちIRP-1、IRP-2)はIREと結合可能で、mRNAの安定性と翻訳を制御し、それによってフェリチン(鉄貯蔵タンパク質)やトランスフェリン受容体-1(TfR;細胞の鉄の取り入れを制御する)などの特定のタンパク質の合成を調整する(1, 2)。
鉄の供給が少ない時は、鉄は貯蔵や血漿への放出に利用できない。IRPと結合する鉄が少なくなり、IRPはIREと結合するようになる。フェリチンとフェロポーチン-1(鉄排出タンパク質)を符号化するmRNAの5'端にあるIREとIRPが結合すると、mRNAの翻訳とタンパク質合成が阻害される。未成熟な赤血球におけるヘム合成の重要な調整酵素を符号化するmRNAの翻訳も、鉄の保持のために減る。対照的に、TfRと二価金属輸送体-1(DMT1)を符号化するmRNAの3'端にあるIREに結合するIRPは、鉄の輸送体の合成を促進し、それによって細胞への鉄の取り込みを増やす(1, 2)。
鉄の供給が多い時はより多くの鉄がIRPと結合し、それによってmRNAのIREとIRPの結合が防がれる。これによって鉄の貯蔵に関係するタンパク質(フェリチン)と排出に関連するタンパク質(フェロポーチン-1)の合成が増え、鉄の輸送体(TfRとDMT1)の合成が減って鉄の取り込みが限定されるようになる(2)。脳内でもIRPはアミロイド前駆体タンパク質(APP)mRNAの5'端との結合が妨げられ、それによってAPPの発現が可能になっている。APPはフェロポーチン-1の安定化によってニューロン(神経細胞)からの鉄の排出を促進する。パーキンソン病(PD)ではAPPの発現が不適切に抑制され、ドーパミン作動性ニューロンに鉄が蓄積することになる(11, 12)。
感染中の鉄捕獲防御
鉄はほとんどの感染病原体が成長し拡散するために必要であり、感染された宿主も効果的な免疫反応を開始するために鉄が必要である。Tリンパ球の分化と増殖、および病原体を殺すための活性酸素種(ROS)の発生にも鉄が十分にあることが重要である(13)。感染中および炎症中にはヘプシジンの合成が上方制御され、血清鉄濃度が下がり、フェリチン(鉄貯蔵タンパク質)濃度が上がる。このことは、病原体から鉄を隔離することが宿主の重要な防御メカニズムであるという考えを裏付けている(2)。
鉄の再利用
成人の体における鉄の総含有量は女性で2.3g、男性で3.8gと推定されている(2)。体は鉄をほとんど排泄しない。基礎的な喪失、月経による出血、および新しい組織の生成のための鉄の需要は、毎日少量の食事性の鉄(1~2mg/日)を吸収することで補われている。体内の鉄は主に赤血球にあり、ヘモグロビン1gあたり3.5mgが含まれている。老化した赤血球は脾臓でマクロファージに取り込まれ、約20mgの鉄がヘムの再利用によって毎日回収される。放出された鉄は脾臓のマクロファージのフェリチンに貯蔵されるか、鉄をその他の組織に運ぶトランスフェリン(血中の主要な鉄輸送体)へとフェロポーチン-1(鉄排出タンパク質)によって運ばれる。鉄の再利用は非常に効率的であり、毎日約35mgが再利用される(1)。
鉄の栄養状態の評価
鉄の貯蔵量、体内循環している鉄の量、および血液学的パラメータの測定は、炎症性障害、寄生虫感染、および肥満のない健康な人々の鉄の栄養状態の評価に使用可能である。一般的に使用される鉄の状態のバイオマーカーは、血清フェリチン(鉄貯蔵タンパク質)濃度、血清鉄濃度、総鉄結合能(TIBC)、およびトランスフェリン(血中の主要な鉄輸送体;TSAT)飽和度などがある。可溶性トランスフェリン受容体(sTfR)も、鉄の貯蔵が枯渇している際の鉄の栄養状態の指標である。鉄欠乏症および鉄欠乏性貧血の場合には、二鉄トランスフェリンと結合する細胞表面結合トランスフェリン受容体が増やされ、利用可能な鉄の取り込みを最大化する。したがって、細胞結合トランスフェリン受容体の分割によって増えたsTfRの濃度が鉄の欠乏時には上昇する。ヘモグロビン濃度、平均赤血球ヘモグロビン濃度、平均赤血球容積、および網赤血球ヘモグロビン含量を含む血液学的マーカーは、貧血がある場合の異常を検出するのに役立つ(9, 14)。
留意したいのは、血清フェリチンは炎症によって上方制御される急性相反応タンパク質であることだ。重要なことに、病原体による利用性を制限するために炎症によって血清ヘプシジン濃度も上昇する。したがって炎症の可能性を除外するために、鉄の栄養状態を評価する際には炎症マーカー(C反応性タンパク質、フィブリノゲンなど)も含めることが大切である(14)。
栄養素相互作用
ビタミンA
ビタミンA欠乏症はしばしば鉄欠乏症とともに現れ、鉄の代謝を変化させることで鉄欠乏性貧血を悪化させるかもしれない(15)。ビタミンA補給は鉄欠乏性貧血に有益であり、子供や妊婦の鉄の栄養状態を向上させることが示されてきた(15, 16)。ビタミンAと鉄の組み合わせは、鉄またはビタミンA単独での補給よりも貧血を効果的に治すようである(17)。ヘモグロビンに取り込むために、ビタミンAは貯蔵場所から発育中の赤血球への鉄の移動を促進するのかもしれない(15, 16)。さらに、ラットでの研究では鉄欠乏症が血漿および肝臓のビタミンA濃度を変えることが示されている(18, 19)。
銅
銅の栄養状態が適切であることは、正常な鉄の代謝と赤血球の生成に必要である。貧血は銅欠乏症の臨床的兆候であり、鉄は銅欠乏症の動物の肝臓に蓄積することがわかっている。このことから銅は(銅を含んだセルロプラスミンを介して)、赤血球生成のための骨髄への鉄の輸送に必要であることが示される(20)。銅の利用性と鉄の代謝との関連は、ヒトでも確立している。銅欠乏症は、二次性セルロプラスミン欠乏症や肝臓での鉄の過負荷および/または肝硬変へと至る可能性がある(21)。銅欠乏症の被験者においては、経口銅補給によって正常なセルロプラスミン濃度や血漿フェロキシダーゼ活性が回復し、鉄の代謝障害が補正された(22)。さらに、高い鉄濃度の調乳を飲んだ乳児は低い鉄濃度の調乳を飲んだ乳児よりも銅の吸収が少なかったため、鉄の高摂取が乳児の銅の吸収に支障をきたすかもしれないことが示唆される(23)。
亜鉛
亜鉛は赤血球生成を適切に維持するために必須である。鉄欠乏症と亜鉛欠乏症が同時に起こると、鉄欠乏性貧血を悪化させるかもしれない(24)。その一方、空腹で高用量の鉄サプリメントを亜鉛のサプリメントと同時に摂取すると、亜鉛の吸収が阻害されるかもしれない。食物と一緒に摂取すると、鉄のサプリメントは亜鉛の吸収を阻害しないようである。鉄強化食品が亜鉛吸収を損なうことはない(25, 26)。
カルシウム
カルシウムがあると、非ヘム鉄(肉、家禽の肉、および海産物以外の食物源およびほとんどのサプリメント由来)およびヘム鉄の摂取源からの鉄吸収が減る(27)。しかし、最長12週間までカルシウムの補給をしても、おそらくは鉄の吸収を増やして補ったため、鉄の栄養状態は変化しなかったことがわかっている(28)。鉄のサプリメントを摂取している個人は、カルシウムの豊富な食物やサプリメントの摂取から2時間空けて鉄の吸収を最大化するようにすべきである。
ヨウ素
重篤な鉄欠乏性貧血は、次のように甲状腺代謝を損なうことがある。それらは (1) 脳下垂体の甲状腺刺激ホルモン反応を変化させる; (2) 甲状腺ホルモン生成のためのサイログロブリンのヨウ素化を触媒する甲状腺ペルオキシダーゼの活性を下げる;および (3) 肝臓でT4からT3への変換を制限し、T3ターンオーバーを増やし、T3の核受容体との結合を減らすことである(29)。西アフリカおよび北アフリカでは、学童のうち最大25%が甲状腺腫と鉄欠乏性貧血を同時に発症していると推定されている(30)。甲状腺腫のある鉄欠乏症の子供による無作為化対照研究で、ヨウ素添加塩を60mg/日の鉄とともに週に4回摂取したら、プラセボに比べて甲状腺の大きさが大幅に減少したことが示された(31)。鉄欠乏性貧血を治すことによって、甲状腺障害を軽減するためのヨウ素補給の効能が向上することが、さらなる介入によって確認された((29, 30)の文献でレビュー)。
欠乏症
鉄欠乏症の程度
鉄欠乏症は米国および世界で最も一般的な栄養素欠乏症である。鉄欠乏症の程度を以下に軽度から重度の順に示す。
貯蔵された鉄の枯渇
鉄の貯蔵は枯渇するが、機能的な鉄供給は制限されていない。
初期の機能性鉄欠乏症
明らかな貧血が起こる前に、骨髄を含む組織への機能性鉄供給が赤血球生成を損なうほど不適切になる。
鉄欠乏性貧血
個人のヘモグロビン濃度が、同性同齢で同じ高度に住む健康な集団のヘモグロビン濃度分布で平均から標準偏差2よりも低くなると、貧血であると定義される(32)。2013年には、人口が50位までの国の子供および青少年の障害の最多原因が貧血であった。19歳未満の者の鉄欠乏性貧血の罹患率が最も高い国々は、アフガニスタン(41%)とイエメン(39.8%)であり、インドは貧血の症例数が最大である(1億4790万人)。米国での罹患率は19.3%と推定され、子供および青少年の鉄欠乏性貧血の症例が1600万近いとされる(33)。
鉄欠乏性貧血は、正常な赤血球生成を支えるのに不適切な量の鉄しかない時に発生する。鉄欠乏性の貧血は通常、小球性であり低色素性であることが特徴である。すなわち、赤血球が測定可能なくらい通常よりも小さく、正常な状態よりも色が薄いくらいまでそのヘモグロビン含有量が減っている。鉄欠乏症のこの段階では、症状は貧血および/または鉄依存性酵素の機能がよくないことによる不適切な酸素輸送の結果かもしれない。血液学的パラメータの変化は、鉄欠乏性貧血の臨床的診断に使用される(「鉄の栄養状態の評価」の項参照)。鉄欠乏症が貧血の唯一の原因ではなく、貧血のみを根拠とした鉄欠乏症の診断または治療は、根底にある原因の誤診や不適切な治療につながるかもしれないことを覚えておくことが重要である(34)。貧血のその他の栄養学的原因に関する情報については、「葉酸塩」および「ビタミンB12」のタイトルの記事を参照のこと。
鉄欠乏症の症状
鉄欠乏症の症状の大部分はそれに関連する貧血の結果であり、疲労、頻脈、動悸、およびあえぐような頻呼吸などを含むかもしれない。鉄欠乏症はいくつかの面で運動能力や身体的作業能力を損なう。鉄欠乏性貧血では、赤血球のヘモグロビン含有量が少ないことで活動中の組織への酸素輸送が減少してしまう。筋肉細胞でのミオグロビン濃度の減少は、酸化的代謝のためにミトコンドリアへ運搬可能な酸素の量を制限する。鉄の枯渇も、電子の輸送やATP合成に必要なシトクロムやその他の鉄依存性酵素のミトコンドリアでの含有量を減らすことによって、筋肉の酸化能を下げてしまう(「機能」の項参照)(35)。
鉄欠乏症の個人では、甲状腺の機能が悪いことと甲状腺ホルモンの合成が損なわれることで、寒さに晒された際に正常な体温を維持する能力が妨害されるであろう(「機能」の項参照)。鉄欠乏症はまた、好中球の食作用や抗菌作用、および感染に対するTリンパ球の増殖反応も損なうかもしれない(1)。重篤な鉄欠乏性貧血は、もろくてスプーン状の爪、口角の痛み、味蕾の萎縮、および舌の痛みを起こすかもしれない。稀なケースでは鉄欠乏性貧血が進行して、咽頭筋の退化により喉や食道に網状組織ができて嚥下困難になるかもしれない(36)。プランマービンソン症候群としても知られる食道の網状組織の形成は、鉄欠乏症に加えて遺伝的体質が関わっているのかもしれない。幼年期の鉄欠乏症および鉄欠乏性貧血は精神運動的な発達を損ない、短期および長期の行動的かつ認知的な変化を引き起こすことが示されている((37)の文献でレビュー)。さらに、非食物を摂取することが特徴的な行動障害である異食症は、鉄欠乏症の症状および原因であるかもしれない(38)。
鉄欠乏症のリスクのある個人
鉄の必要量が増える年齢層グループ
新生児および6ヶ月までの乳児:妊娠期に母体の鉄貯蔵が不適切だったり貧血だったりすると、妊娠期間や出生体重が減る可能性がある。すなわち、早産および/または低体重の新生児は、鉄欠乏性貧血のリスクが高い(14)。子癇前症や妊娠糖尿病を含む妊娠合併症でも、早期産児および正期産児の鉄貯蔵量が低くなるかもしれない(14)。
健康な満期産児が持つ150~250mgの鉄の大部分は妊娠第三期に蓄積されたものであり、生後4~6ヶ月の生活に十分である(34)。母乳は比較的鉄が少ない(0.2~0.4mg/L)上に、生後6ヶ月までは腸での鉄の吸収が少ないままなので、6ヶ月未満の乳児にとって鉄の貯蔵は必須である。この時期に持続する急速な成長速度での鉄の高需要は、早期産児では体の鉄不足を悪化させる可能性がある(14)。さらに、臍帯結紮が早かった(生後1分未満)乳児は、結紮が遅かった乳児に比べて生後3~6ヶ月で鉄欠乏症に少なくとも2倍なりやすいことが、無作為化対照試験のレビューで提唱された(39)。しかし健康な正期産児は、生後6ヶ月以前に外部から鉄を補給する必要がほとんどない(1)。
生後6ヶ月から3歳までの乳児および幼児:正期産児の鉄貯蔵は、通常は生後の数ヶ月間持ちこたえるのに十分であるが、6ヶ月超の乳児には鉄欠乏症のリスク上昇がある(1)。増加し続ける組織の質量、血液量、および鉄貯蔵の補填のための持続的な鉄の必要量を考えると、米国医学研究所が設定したように、生後7~12ヶ月の乳児に対する鉄の推奨量(RDA)は11mg/日である(表1参照)。
1~3歳の幼児の鉄のRDAは7mg/日である。1999~2002年の米国国民健康栄養調査(NHANES)のデータに基づくと、生後12~35ヶ月の幼児の鉄欠乏症の罹患率は6.6~15.2%、鉄欠乏性貧血の罹患率は0.9~4.4%と、民族や社会経済学的地位によって幅があった(14)。
留意したいのは、世界保健機関(WHO)および米国小児学会が1歳児全員の貧血検査を推奨していることだ。しかしながら、米国予防医学専門委員会(USPSTF)の最近の報告では、検査による利点と不利点を評価する十分なエビデンス(科学的根拠)がないと明言されている(34, 40)。
青少年:思春期の初期は急速な成長期である。思春期の少女に月経の際に起こる出血によって、青少年の鉄の必要量がさらに増える(1)。青少年期の鉄のRDAは、少年で11mg/日、少女で15mg/日である(表1参照)。
妊娠可能年齢の妊娠していない女性:2003~2006年のNHANESのデータによると、鉄の栄養状態を示す3つのマーカー(ヘモグロビン、フェリチン、トランスフェリン飽和度の百分率)のうち2つが欠乏症のカットオフ値より低い米国女性の割合は、妊娠していない女性で9.8%だった(41)。
経口避妊薬を使用すると月経の出血が減り、そのため子宮内避妊具(銅のコイル)に比べて鉄の栄養状態がよいという関連がある(1)。
授乳には食事性の鉄の需要が低いという関連があり、妊娠や出産の間に枯渇した鉄の貯蔵を補充することができる。しかし、出産数が多い女性はそのために鉄欠乏症のリスクが高く、鉄の補充が十分ではないかもしれない(41)。
妊婦:発育中の胎児や胎盤による鉄の利用の増加や母体の血液量の増加によって鉄の利用が増えるため、妊娠中は鉄の必要量が大幅に増える(42)。2005~2006年のNHANESからのデータの解析で、可溶性トランスフェリン受容体と血清フェリチンの対数比で評価したところ、18.1%の妊婦(平均年齢27.5歳)は鉄が不足していたことがわかった(43)。鉄欠乏症の罹患率は、妊娠の第1三半期に比べて第2三半期や第3三半期の方が高かった(それぞれ4.5%、20.7%、29.7%)。さらに、妊娠中の鉄欠乏症は、メキシコ系および黒人系アメリカ人の方がヒスパニックでない白人のアメリカ人よりも罹患率が高かったことがわかった(それぞれ23.6%、29.6%、13.9%)(43)。
慢性的に出血する者
慢性的出血や急性の失血で鉄欠乏症になるかもしれない。150g/Lのヘモグロビン濃度の血液1ミリリットル(mL)は鉄0.5mgを含む。したがって、わずかな血液でも慢性的に出血すれば鉄欠乏症になるかもしれない。
寄生虫感染:発展途上国での慢性的出血および鉄欠乏症の一般的な原因は、腸の寄生虫感染である(44)。
頻繁な献血:頻繁に献血をする個人、特に月経のある女性は、欠乏症予防のために鉄の摂取を増やす必要があるかもしれない。献血500mLごとに200~250mgの鉄が含まれているからである(45, 46)。
定期的な激しい運動:激しい持久力訓練をするアスリートは、毎日の鉄の喪失が大きいことがわかっている。これは、血液細胞量や筋肉量が増えることや、消化管からの微視的な出血(抗炎症薬の定期的使用を伴う)の増加、または赤血球の脆弱性や溶血現象によるものかもしれない(47)。食品栄養委員会は、定期的に激しい運動をする者は平均的な鉄の必要量が30%高いであろうと推定している(25)。
鉄の吸収が悪い者
セリアック病:セリアック病(グルテン性腸症)は、人口の1%に発生すると推定されている自己免疫疾患である。セリアック病の者がグルテンを含む食物や製品を摂取すると、免疫系の反応が腸の粘膜を損い、栄養吸収不要や鉄欠乏性貧血になるかもしれない(48)。
萎縮性胃炎:この病態は通常、胃の細胞を攻撃する抗体の存在と関連し、悪性貧血と関係があるとされてきた(「ビタミンB12」のタイトルの記事参照)。萎縮性胃炎はビタミンB12と鉄の吸収の両方を同時に損なうが、月経期の女性では体内のビタミンB12の貯蔵が枯渇する数年前に鉄欠乏症が起こるかもしれない(47)。
ヘリコバクター・ピロリ菌感染:H.ピロリ菌感染は、胃腸での出血がなかったとしても鉄欠乏性貧血と関連があり、特に子供のそれと関連がある。2000~2001年のNHANESのデータで、3歳超の者ではH.ピロリ菌感染があると、感染がない者に比べて鉄欠乏症(血清フェリチン濃度に基づく)が40%も多いことが示された(49)。胃腸の潜在出血や食事からの鉄をめぐって細菌と競合しあうことが、感染者の鉄欠乏症の原因であるかもしれない。さらにヘリコバクター・ピロリ菌感染も、萎縮性胃炎の病原としての役割があるのかもしれない(47)。
炎症性腸疾患(IBD):鉄欠乏性貧血は、IBD(潰瘍性大腸炎、クローン病)の患者の間で一般的に報告されている(50)。これはおそらく腸での鉄吸収が損なわれていることと、潰瘍化した粘膜からの出血によるものであろう。
胃バイパス手術:ある種の胃バイパス手術(肥満外科手術)は、栄養素の中でも鉄の吸収不全を起こすことにより、鉄欠乏症のリスクを高める(51)。
肥満:体重と鉄の栄養状態との間の逆相関が、子供および成人の観察研究のいくつかで報告されている(52, 53)。肥満な者のヘプシジン発現が高いことが、鉄の食事性摂取が適切でも鉄の吸収を損なうのかもしれない。肥満の者は、体重減少すれば血清ヘプシジン濃度が下がり、鉄の栄養状態が改善するかもしれない(9)。
慢性疾患性貧血:急性および慢性の炎症によって、異常に低い循環鉄濃度や貧血の発症に至るのかもしれない。このタイプの炎症性の貧血は慢性疾患性貧血(ACD)としても知られ、炎症性疾患、がん、重症疾患、外傷、慢性的感染、および寄生虫の外寄生に一般的に見られる。炎症に誘発されたヘプシジンの上方調整によって、食事性鉄の吸収や体内の鉄貯蔵部位からの鉄の移動が阻害されることで、貧血が起こると考えられている(「鉄の恒常性の全身調整」の項参照)(9)。
鉄欠乏症のその他の原因
鉄の摂取源が不適切な菜食:植物性の鉄(非ヘム鉄)は、動物性の摂取源からの鉄よりも効率的に吸収されない(「摂取源」の項参照)。そのため米国医学研究所(IOM)の食品栄養委員会(FNB)は、鉄の生物学的利用性は西洋式混合食では18%であるのに対し、菜食だと10%でしかないと推定している。したがって完全な菜食をしている者の鉄の推奨量(RDA)は、非菜食の者のRDAよりも1.8倍高いかもしれない(25)。しかし菜食でも、全粒穀物、豆類、ナッツ、種子類、ドライフルーツ、鉄強化されたシリアル、および緑色葉物野菜を含む場合は、鉄欠乏症のリスク上昇と関連しないようである(「摂取源」の項参照)(54)。
慢性腎疾患(CKD):CKD患者が鉄を喪失するのは、腎臓機能が正常な者(0.83mL/日の失血で約100mg/年に相当)に比べて、相当量を胃腸から失血(毎年1.2Lの失血で年に約400mgの鉄に相当)しているからである。血液透析を受けている患者では推定失血量がさらに多く、鉄の喪失量は年に1,000~2,000mg以上であるかもしれない。CKD患者の持続的な炎症は、体内の鉄貯蔵が適切でも赤血球生成のための鉄供給が不適切になることに寄与するかもしれない(55)。
推奨量(RDA)
鉄のRDAは2001年に改定され、鉄欠乏症予防と混合食を摂る者の鉄貯蔵を適切に維持することに基づいている(表1;(25))。
疾病予防
鉄欠乏症または鉄欠乏性貧血を予防または緩和することで、以下のような健康状態や疾患に関して鉄の不足や赤血球生成の欠陥の影響を制限することができる。
子供の精神運動的、認知的、および知的発達の損傷
鉄は中枢神経系の発達に決定的に重要であり、鉄欠乏症は出生前期間および出生後初期には特に有害であると考えられている。鉄依存性酵素は、神経の髄鞘形成、神経伝達物質合成、および神経細胞の正常なエネルギー代謝に必要である(56)。大部分の観察研究で、貧血の有無によらず子供の鉄欠乏症と、認知発達不良、学業成績不良、および異常な行動パターンとの関係がわかった((37)の文献でレビュー)。幼年期初期における精神運動的および精神的な欠陥が鉄の不足だけによるものなのか、または鉄欠乏性貧血や炎症性貧血のように鉄欠乏症と低いヘモグロビン濃度の両方の効果によるのかは不明なままである(14)。
27ヶ月より若い鉄欠乏性貧血の子供による6つの小規模プラセボ対照試験(1978~1989年に発表)の最近のシステマティックレビュー(総括)で、鉄による治療(11日未満)は治療開始から30日以内における精神運動的および精神的発達の測定値に何らかの一貫した効果があるという確信的なエビデンスは見られなかった(57)。貧血で鉄欠乏の乳児による1つの無作為化二重盲検試験だけが4ヶ月にわたる鉄による治療の影響を調べ、認知発達の指標に対する意義深い有益性が見つかったが、さらに確認する必要がある(58)。貧血でない鉄欠乏の乳児(生後0~9ヶ月)による5つの無作為化対照試験のレビューで、生後18ヶ月までの精神運動的発達(精神的発達ではない)の改善が示唆された(59)。乳児期初期(生後4~6ヶ月)の鉄補給も、プラセボに比べて9歳時の認知能力や学業に対する長期的効果は実証されなかった(60)。現在では、貧血があってもなくても、鉄欠乏症の乳児の神経発生的結果に対する鉄による治療の有益性を示すエビデンスは限定的なままである。
貧血および/または鉄欠乏症であるより年長の子供の認知的結果の向上に、鉄治療はより効果的であるかもしれない。17の無作為化対照試験のシステマティックレビューで、鉄補給は27ヶ月未満の幼児の精神発達に何の効果もなかったが、7歳超の子供の精神発達のスコアをやや向上させたことがわかった(61)。鉄欠乏症、貧血、または鉄欠乏性貧血の6歳超の子供、青少年、および女性による無作為化対照試験のより最近のメタ解析で、参加者の鉄の栄養状態とは無関係に、鉄補給が注意力や集中力を向上させるかもしれないことが示された(62)。鉄での治療によるIQ測定値の向上の可能性も、貧血の参加者の鉄の状態に関係なく報告された。記憶能力、精神運動機能、および学業の測定値に関するその他の有益性は見られなかった。
鉄欠乏症による脳機能の変化は、それが幼児期初期に起こると鉄治療に反応しにくいようである。幼い時期の鉄欠乏症の長期的結果には、社会経済学的業績の不良や、不安、うつ病、および統合失調症といった特定の精神病理リスクの上昇が含まれるかもしれない(56)。
妊娠結果への害
妊婦の重篤な貧血と、低出生体重、早期出産、および新生児や母体の死亡率などの妊娠結果への害との関連について、疫学的研究は強力なエビデンスを提供している(63)。鉄欠乏症は重篤な貧血に寄与する主要な要因であるが、鉄欠乏性貧血が妊娠結果の不良を起こすというエビデンスは未だに不足している。さらに、妊娠期の鉄補給は女性の鉄の栄養状態や血液学的パラメータを改善すると示されたが、低出生体重および/または未熟児、新生児の死亡、および先天性異常などの妊娠結果への害を大きく減らすことはできなかった(64)。また妊娠期の日常的補給は、妊娠期間の長さや新生児のアプガールスコアに何の効果もなかった(40)。それにもかかわらず、大部分の専門家は母体の貧血の管理は出生前の健康管理の重要な一部であると考えており、IOMは各妊娠三半期ごとの貧血検査を勧めている(65)。
妊娠の第2三半期および第3三半期には鉄の需要が大きく増え、妊婦へのRDAは27mg/日である(「推奨量」の項参照)(25)。米国産科婦人科学会はすべての妊婦の貧血検査を推奨し、必要ならば鉄補給を勧めている(66)。そうとはいえ、米国予防医学専門委員会(40」および米国家庭医学会(67)は、妊娠中の鉄欠乏性貧血検査や鉄補給の有益性と不利益性を評価するエビデンスが不足していると考えている。
しかしながら、マラリアが風土病の地域では、マラリアの予防および管理の手段とともに鉄補給をすることは、妊娠結果を良くするかもしれない。最近の2つの無作為化プラセボ対照試験では、鉄補給をした鉄欠乏症および鉄が十分な妊婦のマラリア感染リスクの上昇は見られず、このことはマラリアの間欠予防治療(IPT)を採用しているマラリアが風土病の国における全妊婦への鉄補給を支持している(68, 69)。
鉛の毒性
たとえ少量でも鉛に慢性的に晒された子供は、学習障害や行動的な問題を起こしやすく、IQも低くなりやすい。成長や神経学的な発達における欠陥は、妊娠中や授乳中に鉛に晒された女性の乳児に起こるかもしれない。成人では、鉛毒性によって腎臓損傷や高血圧になるかもしれない。塗料製品、ガソリン、および食品用の缶への鉛の使用は米国では停止しているが、鉛の毒性は引き続き大きな健康問題であり、都心部に住む子供では特にそうである(70)。2012年に米国疾病管理予防センターは、リスクのある子供を識別するために血中鉛濃度の基準値を1 デシリットル 当たり5マイクログラム(μg/dL)に設定した。しかしながら、これ以下なら子供が100%安全であるという血中鉛濃度は知られていない(71)。
鉄欠乏症と鉛中毒には、低い社会経済的地位、少数民族集団、および都市居住者といった多くの同じリスク要因がある。鉄欠乏症は、特にDMT1腸輸送体を介しての腸での鉛吸収を増やすことで、子供の鉛中毒リスクを上げるかもしれない(72)。しかし、真に鉄欠乏症または慢性的に鉛に晒されている鉄が十分な子供(鉛に晒された家に住むなど)に対しては、鉛中毒での鉄補給は控えるべきであるかもしれない(72)。
疾病治療
下肢静止不能症候群
下肢静止不能症候群(RLS;別名むずむず脚症候群またはウィリス・エクボム病)は、原因不明の神経学的運動障害である。RLSの者は、下肢を動かしたくなる抵抗し難い衝動や一過性の動きの中断という不快な感覚を経験する。これらの感覚は休息中により多く、しばしば睡眠の妨げとなる(73)。RLSの罹患率は女性の方が男性よりも高く、加齢とともに増える(74)。この症候群は患者の約50%に遺伝するようであり、慢性腎不全とも関係する(73)。RLSの発症には鉄欠乏症が関わっているかもしれず、神経伝達物質であるドーパミンの合成における律速鉄依存性酵素のチロシン水酸化酵素の活動に影響するのであろう(74)。RLSの管理には、鉄治療やドーパミン作動薬などの薬剤の使用が含まれる(73)。現在の臨床的エビデンスは、RLSの症状のいくつかを緩和するのに鉄治療が役立つのかどうかを評価するには不十分である(74)。しかしウィリス・エクボム病症候群財団のメディカルアドバイザリーボード(医学諮問委員会)は、すべてのRLS患者における鉄の栄養状態が評価されるべきであり、有益であるかもしれない者には鉄治療がケースバイケースで試されるべきであると提言している(73)。
摂取源
食物の摂取源
体で吸収され利用される食物やサプリメントからの鉄の量は、個人の鉄の栄養状態や鉄がヘムの形態であるかどうかによって影響される。非ヘム鉄とは異なったメカニズムで吸収されるので、ヘム鉄はすぐに吸収されやすく、またその吸収はその他の栄養素による影響を受けにくい(2)。体の鉄の状態を改善しようと、鉄が十分な者に比べて貧血や鉄欠乏の個人では鉄の吸収が強化される。
ヘム鉄
ヘム鉄は主に肉、家禽の肉、および魚のヘモグロビンやミオグロビンに由来する。ヘム鉄は食事中の鉄のわずか10~15%しか占めていないが、吸収された食事性鉄全体の最大で三分の一にもなるかもしれない(54)。ヘム鉄の吸収は、非ヘム鉄のそれよりもその他の食事性要因に影響されにくい(27)。
非ヘム鉄
植物、乳製品、肉、および食品やサプリメントに添加された鉄塩は、すべて非ヘム鉄の摂取源である。非ヘム鉄の吸収は、同じ食事に含まれるエンハンサー(促進物質)やインヒビター(阻害物質)によって強く影響を受ける(27)。
非ヘム鉄吸収のエンハンサー
- ビタミンC(アスコルビン酸):ビタミンCは、食事性の第二鉄イオン(Fe3+)を第一鉄イオン(Fe2+)に還元し吸収可能なアスコルビン酸鉄錯体を形成することで、非ヘム鉄の吸収を強力に増進する(75)。
- その他の有機酸:クエン酸、リンゴ酸、酒石酸、および乳酸は、非ヘム鉄の吸収を強化する効果がある(1)。
- 肉、家禽の肉、および魚:肉、家禽の肉、および魚は、非常に吸収のよいヘム鉄を含むだけでなく、非ヘム鉄の吸収も強化する。この非ヘム鉄吸収強化のメカニズムは、よくわからない(1, 25)。
非ヘム鉄吸収のインヒビター
- フィチン酸:豆類、全粒穀物、ナッツ、および種子類に含まれるフィチン酸は、おそらく非ヘム鉄と結合することによってその吸収を妨げる。少量(5~10mg)のフィチン酸で、非ヘム鉄の吸収を50%も減らすことができる。大豆、黒豆、レンズ豆、緑豆、および割りエンドウなどの豆類からの鉄の吸収は、わずか2%であることが示されている(25)。水に浸す、発芽させる、発酵させる、および加熱するなどの調理の準備は、フィチン酸の除去または分解に役立つ(27)。
- ポリフェノール化合物:コーヒー、紅茶、およびハーブティーに含まれるポリフェノール化合物は、非ヘム鉄の吸収を著しく阻害する(76)。この効果は、ビタミンCがあると和らぐかもしれない(22, 77)。
- 大豆タンパク質:豆腐に含まれるような大豆タンパク質は鉄吸収の抑制効果があるが、そのフィチン酸含有量と鉄吸収はわずかしか関係しない(22, 77)。
- カルシウム:カルシウムは、ヘム鉄および非ヘム鉄の両方の摂取源からの鉄吸収に影響があるようである。しかし、様々な濃度の鉄吸収エンハンサーおよびインヒビターを含む広範囲な食品を摂取すれば、その効果は限定的であるようだ(27)。
米国の全国調査で、食事性鉄の平均摂取量は男性で16~18mg/日、閉経前および閉経後の女性で12mg/日、および妊婦で15mg/日であることが示された(25)。したがって、米国の閉経前の女性および妊婦の大半はRDAよりも少ない鉄しか摂取していないが、多数の男性はRDAより多く鉄を摂取している(「推奨量」の項参照)。米国では、ほとんどの穀物製品は非ヘム鉄が強化されている。比較的鉄の豊富ないくつかの食品の鉄含有量を、表2にミリグラム(mg)で示す。特定の食品の栄養素含有量についての詳細は、米国農務省の食品成分データベースを検索のこと。
サプリメント
鉄のサプリメントは、鉄欠乏症および鉄欠乏性貧血の予防と治療用と表示されている。鉄欠乏症のリスクのない個人(成人男性や閉経後の女性など)は、適切な医学的評価無しで鉄のサプリメントを摂取すべきではない。多くの鉄サプリメントが市販されており、異なる形態で異なる元素鉄の割合で提供される。硫酸第一鉄七水和物には元素鉄が20%含まれており、硫酸第一鉄一水塩には33%含まれ、グルコン酸第一鉄では12%、フマル酸第一鉄では33%である。特別に断りがなければ、この記事での鉄とは元素鉄のことである。
鉄の過負荷
腸での鉄吸収の調節解除は、体が過剰な鉄を排泄できないので、鉄の過負荷に至るであろう(2)。しかし、長期の鉄補給による鉄の過負荷は、遺伝的体質でない健康な個人には非常に稀である。いくつかの遺伝性障害では、鉄の摂取が正常でも体に病理学的な鉄の蓄積が起こることがある。未検出なままの遺伝性疾患が多いことや、慢性的鉄過剰摂取のより微妙な効果が最近懸念されていることから、鉄欠乏症でない個人への補給は避けるべきである(「鉄過負荷に関連する疾患」の項参照)。
遺伝性鉄過負荷疾患
遺伝性ヘモクロマトーシス
遺伝性ヘモクロマトーシス(HH)とは、鉄代謝に関する遅発性常染色体劣性遺伝疾患であり、肝臓、心臓、およびその他の組織に鉄が蓄積してしまう。この疾患は、肝硬変、糖尿病、心筋症(心臓の筋肉の損傷)、性腺機能低下症、関節症(関節トラブル)、および皮膚色素沈着の増加などが起こるかもしれない((78)の文献でレビュー)。HHには4つの主要なタイプがあり、突然変異をしている特定の遺伝子によって分類されている。最も一般的なHHのタイプは1型またはHFE関連HHと呼ばれ、HFE遺伝子の突然変異に由来する(79, 80)。1型HHケースの大半は、HFE遺伝子の突然変異C282Y G>A(rs1800560)がホモ接合になる。1型HH患者の4%に見られるその他の突然変異は、HFE遺伝子のH63D C>G(rs1799945)である。HFE遺伝子によって符号化されたタンパク質は、腸での食事性鉄の吸収を調整し体の鉄貯蔵を感知する役割があると考えられている(81)。HFE遺伝子の変異は、細胞での鉄の取り込みが増加することに関連がある。30歳前に典型的に発症する若年性ヘモクロマトーシス(HH2型)は1型HHよりもずっと稀で、ヘモジュベリン(2A型)またはヘプシジン(2B型)のどちらかの機能に影響する遺伝子変異に由来する(82)。3型HHはトランスフェリン受容体2遺伝子(TFR2)の変異によるもので、4型HH(フェロポーチン病とも呼ばれる)は、細胞外に鉄を運び出すのに重要なタンパク質であるフェロポーチン-1(SLC40A1)を符号化する遺伝子の変異によるものである(「調整」の項参照)。4型HHは、1型HHに次いで2番目に多い遺伝性鉄過負荷障害である(78)。
HHの鉄過負荷は、鉄過負荷の重篤度によって決定される間隔で一回につき500mLの血液を除去する静脈切開によって治療される。キレート療法は、静脈切開治療を受けられないHH患者の鉄を取り除く別の選択肢である。HHの者は鉄サプリメントを避けるように忠告されるが、鉄の豊富な食物を避けるようにとは一般的に言われない。高用量ビタミンCレジメン(治療計画)は、HH患者の鉄過負荷を悪化させるかもしれない(75)。肝硬変のリスク上昇のため、アルコール摂取は強く禁止される(83)。遺伝子検査は血液サンプルが必要であるが、家族にヘモクロマトーシスの病歴のある者などHHのリスクがあるかもしれない者の利用が可能である。
その他の遺伝性病状
鉄過負荷になるその他の遺伝性障害には、無セルロプラスミン血症、低トランスフェリン血症、フリードライヒ運動失調症、および晩発性皮膚ポルフィリン症などがある(2)。
後天性鉄過負荷疾患
鉄過負荷は、鉄欠乏症にはよらない重篤な遺伝性貧血の者が発症するかもしれない。食事からの鉄の過剰吸収は、体が赤血球を作ろうと努力し続けている結果起こるのかもしれない。ベータサラセミア(地中海貧血症)は、βグロビン遺伝子の突然変異によるヘモグロビンA合成の欠損が特徴である。中間型サラセミア患者は、サラセミアの最も重篤な形態(重症型サラセミアと呼ばれる)の者のように輸血を必要としないが、腸からの鉄吸収が増えることで鉄の過負荷を起こす(84)。鉄の過負荷リスクのあるその他の貧血患者は、鉄芽球性貧血、溶血性貧血、ピルビン酸キナーゼ欠乏症、および重症型サラセミアなどの者であり、特にそれは彼らが何回も輸血をして治療されることによるものである。遺伝性の球状赤血球症や軽症型サラセミアの者は、鉄欠乏症と誤診され何年も大容量の鉄で治療されることがなければ、通常は鉄過負荷にはならない。鉄の過負荷は、血液透析や慢性肝疾患(代謝性、ウィルス性、およびアルコール性)とも関連付けられてきた(2)。
鉄の過負荷に関連する疾患
遺伝性ヘモクロマトーシス(HH)における重要臓器への有害な鉄沈着は、肝臓がん、2型糖尿病、および神経変性疾患と関連付けられてきた。HHでない者でも、鉄の過負荷は慢性疾患のリスクを上昇させるかもしれない。遺伝性障害のない者における組織での鉄の蓄積が、食事性鉄の高摂取によるものなのかどうかは十分にわかっていない(1)。
がん
肝臓での異常な鉄の蓄積が特徴的な遺伝性ヘモクロマトーシスは、肝臓がん(肝細胞がん(HCC))のリスク要因である。鉄の蓄積は、脂質、タンパク質、およびDNAへの損傷を起こす酸化ストレスを増やすことで、発がん性物質として機能すると考えられている。9つの観察研究のメタ解析で、健康な参加者および慢性肝疾患の患者でHFE遺伝子にC282Y変異があると、HCCのリスクが上昇することがわかった(「鉄の過負荷」の項参照)(85)。その他のメタ解析でも、HFE遺伝子のC282YおよびH63D変異と、がん全体のリスク上昇との間の関連が報告されている(86, 87)。しかしHFE遺伝子の変異と肝臓外の部位でのがんのリスクに関する報告をしている研究は少ないか、一貫していないかである。すべてではないが、いくつかの観察研究でC282Y変異と結腸直腸がん(88)、乳がん(88, 89)、および上皮性卵巣がん(90)のリスクとに大きな関連があることがわかった。HFE遺伝子のH63D変異は、白血病(91, 92)、および胃がん(93)のリスク上昇と関連があった。
食事性鉄の高摂取でヘモクロマトーシスでない者のがんリスクが上昇するのかどうかも調査されている。ヘム鉄が豊富な赤肉または加工肉(白肉ではない)の摂取は、結腸直腸がん(CRC)のリスク上昇と関連付けられてきた(94)。肉が高温で調理される際に発生する発がん性化合物(複素環式アミンと呼ばれる)や、赤肉や加工肉を食べた後で消化管で作られる発がん性Nニトロソ化合物に晒されることで、そのように関連するのかもしれない(95)。観察研究のいくつかのメタ解析でも、赤肉のヘム鉄とCRCの関連の可能性が示唆されている(96~98)。これは、損傷を起こすかもしれないNニトロソ化合物やヘム鉄が触媒する反応で派生する脂質過酸化最終産物に、結腸の細胞がより多くさらされることよるものであると説明されてきた(99)。さらに、大規模ながんと栄養に関する欧州前向き研究(EPIC)からの最近の結果で、食道腺がんのリスクが高いことと赤肉/加工肉およびヘム鉄の高摂取との関連が示唆された(100)。
心血管疾患
血管壁の損傷とアテローム性動脈硬化症の発症における鉄に誘発された酸化ストレスの役割が実験研究で示唆されたが、それはほとんどの心血管疾患の根底にある(101)。しかし、ヒトでの鉄の栄養状態と心血管疾患の疫学的研究では、矛盾する結果が生じてきた。156,427人の参加者(9,236の冠動脈性心疾患(CHD)または心筋梗塞(MI)症例)による17の前向きコホート研究の最近のシステマティックレビューおよびメタ解析では、鉄の状態に関する多くの異なる測定値とCHD/MIとの間に強い関連があることを裏付けるエビデンスを見つけることができなかった(102)。血清トランスフェリン飽和度が最も高い四分位の者は、最も低い四分位の者よりもCHD/MIの発症が18%低かっただけであった(102)。21の前向き研究の別のメタ解析では、血清トランスフェリン飽和度や血清鉄はCHDリスクと逆相関があるとわかった。しかし、ほとんどの研究で炎症による紛らわしい影響への補正をしていないことを、著者らは注記している(103)。このレビューではCHDの発症と食事性鉄の総摂取量との間の逆相関を報告しているが、食事性ヘム鉄はCHDの発症と正の相関があった(103)。鉄の貯蔵とCHD/MIの関係はさらなる解明が必要であるが、鉄欠乏症のリスクがない者(成人男性や閉経後の女性など)は過剰な鉄摂取を控えることが賢明であろう。
/2型糖尿病とメタボリック症候群
遺伝性ヘモクロマトーシス(HH)の者は、2型糖尿病の発症リスクが高いことが知られている(104)。ヘモクロマトーシスとは別に、2型糖尿病の病因における過剰な鉄の役割も増大するエビデンスから示唆されている。横断研究、症例対照研究、および前向きコホート研究は、フェリチン濃度(体の鉄貯蔵を反映する)が高いと低い場合に比べて2型糖尿病(105)やメタボリック症候群(106)のリスクが高いことを、炎症への補正の後で報告している。鉄の状態に関するその他の指標が2型糖尿病のリスクとどのように関係するのかは、現在ではよくわからない(107~110)。HH患者の鉄の過負荷で誘発される酸化ストレスは、膵臓のβ細胞を傷つけインスリン分泌を損なうと考えられている。HHでない被験者では、鉄の過剰はβ細胞の機能を損傷するのではなく肝臓を損ない、ブドウ糖代謝に支障をきたしてインスリン抵抗性を起こすのかもしれない(111, 112)。静脈切開による鉄の除去は、2型糖尿病(113)およびメタボリック症候群(114)の被験者の代謝指標を向上させることが示されている。体の鉄貯蔵を減らすことが2型糖尿病やメタボリック症候群の予防に役立つのかどうかを決定する追加的な無作為化対照試験が必要である。
神経変性疾患
鉄は細胞代謝や神経伝達物質およびミエリンの合成に関わっていることから、正常な脳や神経の機能に必要である。鉄の恒常性の調節解除は、アルツハイマー病、パーキンソン病、および筋萎縮性側索硬化症(ルー・ゲーリック病(ALS))を含む多くの神経変性疾患で観察されている(115~117)。脳での鉄の異常蓄積は食事性鉄の摂取増加によるものではなく、細胞の複雑な鉄調整プロセスが破壊されることの結果であるようだ(117)。脳での鉄の蓄積は酸化ストレスを増加させるかもしれず、脳は酸化ストレスに特に影響されやすい。神経変性疾患の患者の脳における鉄恒常性破壊のメカニズムは、活発に研究されている。たとえば、遺伝子改変マウスのモデルを使用した研究では、上流の一酸化窒素(NO)の上昇によるアミロイド前駆体タンパク質(APP)の発現(11)またはタウタンパク質の消失(12)が神経細胞の鉄排出を損わせ、パーキンソン病で影響を受ける脳の特定部位への鉄の蓄積に至るのかもしれないことが示された。初期段階のパーキンソン病患者による予備的二重盲検プラセボ対照試験では、鉄キレート剤であるデフェリプロンの12ヶ月間経口投与で、黒質と呼ばれる脳の部位での鉄沈着が減り、全身的な鉄の恒常性を損なうことなく運動能力が向上したことが実証された(118,119)。
安全性
毒性
過量服用
鉄含有製品の偶発的な過量服用は、6歳未満の子供の中毒死の単独で最大の原因である。元素鉄の経口致死量は体重1kg当たり約180~250mgであるが、これより相当少なくても致命的である。急性の毒性症状は、体重1kg当たり約20~60mgの鉄用量で起こるかもしれない。鉄の毒性の重篤度は吸収された元素鉄の量に関係するので、鉄の過量服用は非常事態である。急性の鉄中毒は4つの段階で症状を呈する。(1)摂取から1~6時間以内では、症状は吐き気、嘔吐、腹痛、タール便、無気力、弱い速脈、低血圧、発熱、呼吸困難、および昏睡を含むかもしれない。(2)すぐに致命的でないならば、約24時間症状が鎮まるかもしれない。(3)鉄の摂取後12~48時間して症状がぶり返し、心血管系、腎臓、肝臓、血液、および中枢神経系といった臓器系の深刻な不全の兆候があるかもしれない。そして(4)摂取から2~6週間後に中枢神経系、肝臓(硬変)、および胃への長期的損傷が起こるかもしれない(25, 120)。
有害作用
鉄欠乏症の治療で用いられる治療用濃度では、鉄サプリメントは胃腸への刺激、吐き気、嘔吐、下痢、または便秘を起こすかもしれない。便はしばしば色が濃く見える。鉄を含んだ液体は一時的に歯を着色することがあるが、その液体を薄めることがこの効果の予防に役立つ(120)。空腹ではなく食物と一緒に鉄サプリメントを摂取すると、胃腸の症状を緩和できるかもしれない。米国医学研究所の食品栄養委員会(FNB)は、鉄の許容上限摂取量(UL)を胃腸の苦痛を予防することに基づいて設定した(表3)。青少年(14~18歳)と、妊婦や授乳婦を含む成人のULは45mg/日である。厳密な医学的監督下で鉄による治療を受けている者に対しては、このULの適応は意図されていないことを留意すべきである。遺伝性ヘモクロマトーシスまたはその他の鉄過負荷症状のある者、およびアルコール性硬変やその他の肝臓疾患のある者は、UL未満の鉄摂取量でも有害作用があるかもしれない(25)。
薬物相互作用
制酸薬、ヒスタミン(H2)受容体拮抗薬(シメチジン、ラニチジンなど)、およびプロトンポンプ阻害薬(オメプラゾール、ランソプラゾールなど)のような胃の酸度を下げる薬剤は、鉄の吸収を損なうかもしれない。次の薬剤と同時に鉄のサプリメントを摂取すると、その薬剤の吸収や効能を下げるかもしれない。それらはカルビドパおよびラボドパ(シネメット)、レボチロキシン(シンスロイド、レボキシル)、メチルドパ(アルドメット)、ペニシラミン(カプリミン、デペン)、キノロン、テトラサイクリン、およびビスフォスフォネート(120)である。したがってこれらの薬剤は、鉄サプリメントの摂取から2時間の間隔を空けて摂取するのが最善である。コレスチラミン(クエストラン)およびコレスチポール(コレスチド)は血中コレステロール濃度を下げるのに使用されるが、鉄の吸収に支障をきたすかもしれないので、これも鉄サプリメントとは少なくとも4時間空けて摂取すべきである(121)。痛風の治療に使用される薬剤のアロプリノール(ザイロプリム)は肝臓での鉄貯蔵を増やすかもしれず、鉄サプリメントと併用すべきではない。
鉄補給はマラリア風土病地域におけるマラリアのリスクを上昇させるか?
免疫反応における鉄の重要な機能にもかかわらず、鉄の栄養状態と感染症、特にマラリアのかかりやすさとの関係の本質は論争の的であった。鉄捕獲は病原体に対する防御メカニズムとして認知されている(「感染中の鉄捕獲防御」の項参照)が、鉄補給、特にマラリア風土病地域に住む鉄が足りている子供への鉄補給の安全性に関する懸念が起きている(122)。
熱帯に住む子供への鉄補給は、臨床的なマラリアや肺炎などの他の感染症のリスク上昇と関連付けられてきた(123, 124)。東アフリカ(タンザニア)のマラリア風土病地域に住む24,076人の子供(1~35ヶ月)による無作為化対照試験で、鉄および葉酸を亜鉛有りまたは無しで補給する効果が、全死因および入院に関して亜鉛単独またはプラセボの効果と比べて調査された(125)。鉄、葉酸、および/または亜鉛の投与は重篤な有害作用、入院、および死亡のリスクを上昇させることがわかり、したがって早期に中止された。試験のさらなる解析で、鉄が足りている子供は鉄欠乏症の子供(貧血の有りまたは無し)に比べて、鉄補給の後の有害作用のリスクがあることが明らかになった(125)。日常的鉄補給のそのような有害作用の潜在的リスクは、マラリアがない環境(ネパール南部)の学齢前の子供には見られなかった(126)。
35の試験の最近のレビューで、マラリアの予防および管理ができるマラリア風土病地域に住む子供の臨床的マラリアやその他の寄生虫症、感染、および全死因のリスクは、鉄補給によって上昇しなかったことが示された(127)。さらに、3つの高品質試験の統合解析で、抗マラリア治療と併用した鉄補給は子供を臨床的マラリアから守り、血液学的パラメータを改善したことが実証された(127)。世界保健機関(WHO)は現在、マラリア風土病地域においてマラリアの予防、診断、および治療の方策とともに乳幼児や子供への鉄補給を行うことを推奨している(128)。
ライナス・ポーリング研究所の推奨
鉄のRDAに従うことで、ほとんどの者に有害作用を起こすことなく鉄欠乏症を予防するのに十分な鉄が得られるはずである。十分な鉄は様々な食事から得られるものではあるが、かなりの者が欠乏症を予防するのに適量な鉄を摂取していない。鉄の一日摂取基準量(DV)の100%を含むマルチビタミン/ミネラルのサプリメントは、18mgの元素鉄を含む。この鉄量は閉経前の女性には有益であろうが、男性および閉経後の女性にとってのRDAをずっと上回る。
成人男性および閉経後の女性
遺伝性ヘモクロマトーシスは一般的ではなく、慢性疾患リスクに関する長期的な食事性鉄の過剰摂取効果も未だにはっきりしないため、鉄欠乏症のリスクがない男性および閉経後の女性は、鉄を含まないマルチビタミン/ミネラルのサプリメントを摂取すべきである。男性または50歳超の者に特定して調整された多くのマルチビタミンは鉄を含まない。
年配の成人(50歳超)
中年および年配の者では、やや高めの鉄貯蔵が鉄欠乏症よりもずっと一般的であるかもしれない(129)。したがって鉄欠乏症と診断されない限り、年配者は一般的に鉄を含んだ栄養サプリメントを摂取すべきでない。さらに、単に鉄のサプリメントで鉄欠乏症を治療するのではなく、鉄欠乏症の根底にある原因を決定することは極めて重要である(「推奨量」の項参照)。
Authors and Reviewers
Originally written in 2001 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in March 2003 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in January 2006 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in August 2009 by:
Victoria J. Drake, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in April 2016 by:
Barbara Delage, Ph.D.
Linus Pauling Institute
Oregon State University
Reviewed in May 2016 by:
Marianne Wessling-Resnick, Ph.D.
Professor of Nutritional Biochemistry
Department of Genetics and Complex Diseases
Harvard T.H. Chan School of Public Health
The 2016 update of this article was underwritten, in part, by a grant from Bayer Consumer Care AG, Basel, Switzerland.
Copyright 2001-2024 Linus Pauling Institute
References
1. Aggett PJ. Iron. In: Erdman JWJ, Macdonald IA, Zeisel SH, eds. Present Knowledge in Nutrition. 10th ed. Ames: Wiley-Blackwell; 2012:506-520.
2. Wessling-Resnick M. Iron. In: Ross AC, Caballero B, Cousins RJ, Tucker KL, Ziegler TR, eds. Modern Nutrition in Health and Disease. 11th ed: Lippincott Williams & Wilkins; 2014:176-188.
3. Winter WE, Bazydlo LA, Harris NS. The molecular biology of human iron metabolism. Lab Med. 2014;45(2):92-102. (PubMed)
4. Burmester T, Hankeln T. What is the function of neuroglobin? J Exp Biol. 2009;212(Pt 10):1423-1428. (PubMed)
5. Salminen A, Kauppinen A, Kaarniranta K. 2-Oxoglutarate-dependent dioxygenases are sensors of energy metabolism, oxygen availability, and iron homeostasis: potential role in the regulation of aging process. Cell Mol Life Sci. 2015;72(20):3897-3914. (PubMed)
6. Zhang C. Essential functions of iron-requiring proteins in DNA replication, repair and cell cycle control. Protein Cell. 2014;5(10):750-760. (PubMed)
7. Anderson GJ, Darshan D, Wilkins SJ, Frazer DM. Regulation of systemic iron homeostasis: how the body responds to changes in iron demand. Biometals. 2007;20(3-4):665-674. (PubMed)
8. Fleming MD. The regulation of hepcidin and its effects on systemic and cellular iron metabolism. Hematology Am Soc Hematol Educ Program. 2008:151-158. (PubMed)
9. Tussing-Humphreys L, Pusatcioglu C, Nemeth E, Braunschweig C. Rethinking iron regulation and assessment in iron deficiency, anemia of chronic disease, and obesity: introducing hepcidin. J Acad Nutr Diet. 2012;112(3):391-400. (PubMed)
10. Nemeth E, Tuttle MS, Powelson J, et al. Hepcidin regulates cellular iron efflux by binding to ferroportin and inducing its internalization. Science. 2004;306(5704):2090-2093. (PubMed)
11. Ayton S, Lei P, Hare DJ, et al. Parkinson's disease iron deposition caused by nitric oxide-induced loss of beta-amyloid precursor protein. J Neurosci. 2015;35(8):3591-3597. (PubMed)
12. Lei P, Ayton S, Finkelstein DI, et al. Tau deficiency induces parkinsonism with dementia by impairing APP-mediated iron export. Nat Med. 2012;18(2):291-295. (PubMed)
13. Bhaskaram P. Immunobiology of mild micronutrient deficiencies. Br J Nutr. 2001;85 Suppl 2:S75-80. (PubMed)
14. Baker RD, Greer FR, Committee on Nutrition American Academy of Pediatrics. Diagnosis and prevention of iron deficiency and iron-deficiency anemia in infants and young children (0-3 years of age). Pediatrics. 2010;126(5):1040-1050. (PubMed)
15. Semba RD, Bloem MW. The anemia of vitamin A deficiency: epidemiology and pathogenesis. Eur J Clin Nutr. 2002;56(4):271-281. (PubMed)
16. Allen LH. Iron supplements: scientific issues concerning efficacy and implications for research and programs. J Nutr. 2002;132(4 Suppl):813S-819S. (PubMed)
17. Suharno D, West CE, Muhilal, Karyadi D, Hautvast JG. Supplementation with vitamin A and iron for nutritional anaemia in pregnant women in West Java, Indonesia. Lancet. 1993;342(8883):1325-1328. (PubMed)
18. Jang JT, Green JB, Beard JL, Green MH. Kinetic analysis shows that iron deficiency decreases liver vitamin A mobilization in rats. J Nutr. 2000;130(5):1291-1296. (PubMed)
19. Rosales FJ, Jang JT, Pinero DJ, Erikson KM, Beard JL, Ross AC. Iron deficiency in young rats alters the distribution of vitamin A between plasma and liver and between hepatic retinol and retinyl esters. J Nutr. 1999;129(6):1223-1228. (PubMed)
20. Turnlund JR. Copper. In: Shils ME, Shike M, Ross AC, Caballero B, Cousins RJ, eds. Modern Nutrition in Health and Disease. 10th ed. Philadelphia: Lippincott Williams & Wilkins; 2006:286-299.
21. Thackeray EW, Sanderson SO, Fox JC, Kumar N. Hepatic iron overload or cirrhosis may occur in acquired copper deficiency and is likely mediated by hypoceruloplasminemia. J Clin Gastroenterol. 2011;45(2):153-158. (PubMed)
22. Videt-Gibou D, Belliard S, Bardou-Jacquet E, et al. Iron excess treatable by copper supplementation in acquired aceruloplasminemia: a new form of secondary human iron overload? Blood. 2009;114(11):2360-2361. (PubMed)
23. Food and Nutrition Board, Institute of Medicine. Copper. Dietary Reference Intakes for Vitamin A, Vitamin K, Boron, Chromium, Copper, Iodine, Iron, Manganese, Molybdenum, Nickel, Silicon, Vanadium, and Zinc. Washington, D.C.: National Academy Press; 2001:224-257. (National Academy Press)
24. Kelkitli E, Ozturk N, Aslan NA, et al. Serum zinc levels in patients with iron deficiency anemia and its association with symptoms of iron deficiency anemia. Ann Hematol. 2016;95(5):751-756. (PubMed)
25. Food and Nutrition Board, Institute of Medicine. Iron. Dietary Reference Intakes for Vitamin A, Vitamin K, Boron, Chromium, Copper, Iodine, Iron, Manganese, Molybdenum, Nickel, Silicon, Vanadium, and Zinc. Washington, D.C.: National Academy Press; 2001:290-393. (National Academy Press)
26. Lynch SR. Interaction of iron with other nutrients. Nutr Rev. 1997;55(4):102-110. (PubMed)
27. Hurrell R, Egli I. Iron bioavailability and dietary reference values. Am J Clin Nutr. 2010;91(5):1461S-1467S. (PubMed)
28. Weaver CM. Calcium. In: Erdman JJ, Macdonald I, Zeisel SH, eds. Present Knowledge in Nutrition. 10th ed: John Wiley & Sons, Inc.; 2012:434-446.
29. Zimmermann MB. The influence of iron status on iodine utilization and thyroid function. Annu Rev Nutr. 2006;26:367-389. (PubMed)
30. Hess SY. The impact of common micronutrient deficiencies on iodine and thyroid metabolism: the evidence from human studies. Best Pract Res Clin Endocrinol Metab. 2010;24(1):117-132. (PubMed)
31. Hess SY, Zimmermann MB, Adou P, Torresani T, Hurrell RF. Treatment of iron deficiency in goitrous children improves the efficacy of iodized salt in Cote d'Ivoire. Am J Clin Nutr. 2002;75(4):743-748. (PubMed)
32. World Health Organization, United Nations Children's Fund, United Nations University. Iron deficiency anaemia: assessment, prevention and control - A guide for programme managers 2001.
33. Global Burden of Disease Pediatrics C, Kyu HH, Pinho C, et al. Global and National Burden of Diseases and Injuries Among Children and Adolescents Between 1990 and 2013: Findings From the Global Burden of Disease 2013 Study. JAMA Pediatr. 2016;170(3):267-287. (PubMed)
34. Wang M. Iron deficiency and other types of anemia in infants and children. Am Fam Physician. 2016;93(4):270-278. (PubMed)
35. Beard JL. Iron biology in immune function, muscle metabolism and neuronal functioning. J Nutr. 2001;131(2S-2):568S-579S; discussion 580S. (PubMed)
36. Changela K, Haeri NS, Krishnaiah M, Reddy M. Plummer-Vinson syndrome with proximal esophageal web. J Gastrointest Surg. 2015;20(5):1074-1075. (PubMed)
37. Jauregui-Lobera I. Iron deficiency and cognitive functions. Neuropsychiatr Dis Treat. 2014;10:2087-2095. (PubMed)
38. Lee GR. Disorders of iron metabolism and heme synthesis. In: Lee GR, Foerster J, Paraskevas F, Greer JP, Rogers GM, eds. Wintrobe's Clinical Hematology. Baltimore: Williams and Wilkins; 1999:979-1070.
39. McDonald SJ, Middleton P, Dowswell T, Morris PS. Effect of timing of umbilical cord clamping of term infants on maternal and neonatal outcomes. Evid Based Child Health. 2014;9(2):303-397. (PubMed)
40. Siu AL, Force USPST. Screening for iron deficiency anemia in young children: USPSTF recommendation statement. Pediatrics. 2015;136(4):746-752. (PubMed)
41. Miller EM. Iron status and reproduction in US women: National Health and Nutrition Examination Survey, 1999-2006. PLoS One. 2014;9(11):e112216. (PubMed)
42. Brody T. Nutritional Biochemistry. 2nd ed. San Diego: Academic Press; 1999.
43. Mei Z, Cogswell ME, Looker AC, et al. Assessment of iron status in US pregnant women from the National Health and Nutrition Examination Survey (NHANES), 1999-2006. Am J Clin Nutr. 2011;93(6):1312-1320. (PubMed)
44. Khuroo MS, Khuroo MS, Khuroo NS. Trichuris dysentery syndrome: a common cause of chronic iron deficiency anemia in adults in an endemic area (with videos). Gastrointest Endosc. 2010;71(1):200-204. (PubMed)
45. Brittenham GM. Iron deficiency in whole blood donors. Transfusion. 2011;51(3):458-461. (PubMed)
46. Li H, Condon F, Kessler D, et al. Evidence of relative iron deficiency in platelet- and plasma-pheresis donors correlates with donation frequency. J Clin Apher. 2016; doi: 10.1002/jca.21448. (Epub ahead of print). (PubMed)
47. Hershko C, Skikne B. Pathogenesis and management of iron deficiency anemia: emerging role of celiac disease, helicobacter pylori, and autoimmune gastritis. Semin Hematol. 2009;46(4):339-350. (PubMed)
48. Mahadov S, Green PH. Celiac disease: a challenge for all physicians. Gastroenterol Hepatol (N Y). 2011;7(8):554-556. (PubMed)
49. Cardenas VM, Mulla ZD, Ortiz M, Graham DY. Iron deficiency and Helicobacter pylori infection in the United States. Am J Epidemiol. 2006;163(2):127-134. (PubMed)
50. Dignass AU, Gasche C, Bettenworth D, et al. European consensus on the diagnosis and management of iron deficiency and anaemia in inflammatory bowel diseases. J Crohns Colitis. 2015;9(3):211-222. (PubMed)
51. Aron-Wisnewsky J, Verger EO, Bounaix C, et al. Nutritional and Protein Deficiencies in the Short Term following Both Gastric Bypass and Gastric Banding. PLoS One. 2016;11(2):e0149588. (PubMed)
52. Lecube A, Carrera A, Losada E, Hernandez C, Simo R, Mesa J. Iron deficiency in obese postmenopausal women. Obesity (Silver Spring). 2006;14(10):1724-1730. (PubMed)
53. Nead KG, Halterman JS, Kaczorowski JM, Auinger P, Weitzman M. Overweight children and adolescents: a risk group for iron deficiency. Pediatrics. 2004;114(1):104-108. (PubMed)
54. Saunders AV, Craig WJ, Baines SK, Posen JS. Iron and vegetarian diets. Med J Aust. 2013;199(4 Suppl):S11-16. (PubMed)
55. Macdougall IC, Bircher AJ, Eckardt KU, et al. Iron management in chronic kidney disease: conclusions from a "Kidney Disease: Improving Global Outcomes" (KDIGO) Controversies Conference. Kidney Int. 2016;89(1):28-39. (PubMed)
56. Doom JR, Georgieff MK. Striking while the iron is hot: Understanding the biological and neurodevelopmental effects of iron deficiency to optimize intervention in early childhood. Curr Pediatr Rep. 2014;2(4):291-298. (PubMed)
57. Wang B, Zhan S, Gong T, Lee L. Iron therapy for improving psychomotor development and cognitive function in children under the age of three with iron deficiency anaemia. Cochrane Database Syst Rev. 2013;6:CD001444. (PubMed)
58. Idjradinata P, Pollitt E. Reversal of developmental delays in iron-deficient anaemic infants treated with iron. Lancet. 1993;341(8836):1-4. (PubMed)
59. Szajewska H, Ruszczynski M, Chmielewska A. Effects of iron supplementation in nonanemic pregnant women, infants, and young children on the mental performance and psychomotor development of children: a systematic review of randomized controlled trials. Am J Clin Nutr. 2010;91(6):1684-1690. (PubMed)
60. Pongcharoen T, DiGirolamo AM, Ramakrishnan U, Winichagoon P, Flores R, Martorell R. Long-term effects of iron and zinc supplementation during infancy on cognitive function at 9 y of age in northeast Thai children: a follow-up study. Am J Clin Nutr. 2011;93(3):636-643. (PubMed)
61. Sachdev H, Gera T, Nestel P. Effect of iron supplementation on mental and motor development in children: systematic review of randomised controlled trials. Public Health Nutr. 2005;8(2):117-132. (PubMed)
62. Falkingham M, Abdelhamid A, Curtis P, Fairweather-Tait S, Dye L, Hooper L. The effects of oral iron supplementation on cognition in older children and adults: a systematic review and meta-analysis. Nutr J. 2010;9:4. (PubMed)
63. Burke RM, Leon JS, Suchdev PS. Identification, prevention and treatment of iron deficiency during the first 1000 days. Nutrients. 2014;6(10):4093-4114. (PubMed)
64. Pena-Rosas JP, De-Regil LM, Garcia-Casal MN, Dowswell T. Daily oral iron supplementation during pregnancy. Cochrane Database Syst Rev. 2015;7:CD004736. (PubMed)
65. Institute of Medicine Committee on Preventive Services for Women; Board on Population Health and Public Health Practice. Clinical prevention services for women - closing the gaps: The National Academies Press; 2011. (The National Academies Press)
66. American College of Obstetricians and Gynecologists. ACOG Practice Bulletin No. 95: anemia in pregnancy. Obstet Gynecol. 2008;112(1):201-207. (PubMed)
67. American Academy of Family Physicians. Clinical preventive service recommendation: iron deficiency anemia. Available at: http://www.aafp.org/patient-care/clinical-recommendations/all/iron-deficiency-anemia.html. Accessed 4/17/16.
68. Etheredge AJ, Premji Z, Gunaratna NS, et al. Iron supplementation in iron-replete and nonanemic pregnant women in Tanzania: a randomized clinical trial. JAMA Pediatr. 2015;169(10):947-955. (PubMed)
69. Mwangi MN, Roth JM, Smit MR, et al. Effect of daily antenatal iron supplementation on plasmodium infection in Kenyan women: a randomized clinical trial. JAMA. 2015;314(10):1009-1020. (PubMed)
70. Mielke HW, Gonzales C, Powell E, Mielke PW. Evolving from reactive to proactive medicine: community lead (Pb) and clinical disparities in pre- and post-Katrina New Orleans. Int J Environ Res Public Health. 2014;11(7):7482-7491. (PubMed)
71. Centers for Disease Control and Prevention. New blood lead level information. (Web page). Available at: http://www.cdc.gov/nceh/lead/acclpp/blood_lead_levels.htm. Accessed 6/1/16.
72. Kwong WT, Friello P, Semba RD. Interactions between iron deficiency and lead poisoning: epidemiology and pathogenesis. Sci Total Environ. 2004;330(1-3):21-37. (PubMed)
73. Silber MH, Becker PM, Earley C, Garcia-Borreguero D, Ondo WG, Medical Advisory Board of the Willis-Ekbom Disease F. Willis-Ekbom Disease Foundation revised consensus statement on the management of restless legs syndrome. Mayo Clin Proc. 2013;88(9):977-986. (PubMed)
74. Trotti LM, Bhadriraju S, Becker LA. Iron for restless legs syndrome. Cochrane Database Syst Rev. 2012;5:CD007834. (PubMed)
75. Johnston CS. Vitamin C. In: Erdman JWJ, Macdonald IA, Zeisel SH, eds. Present Knowledge in Nutrition. 10th ed. Ames: Wiley-Blackwell; 2012:248-260.
76. Morck TA, Lynch SR, Cook JD. Inhibition of food iron absorption by coffee. Am J Clin Nutr. 1983;37(3):416-420. (PubMed)
77. Natural Medicines. Iron: Interactions with Herbs & Supplements (professional monograph); 2016. Available at: https://naturalmedicines.therapeuticresearch.com/. Accessed 6/1/16.
78. Liu J, Pu C, Lang L, Qiao L, Abdullahi MA, Jiang C. Molecular pathogenesis of hereditary hemochromatosis. Histol Histopathol. 2016:11762. (Epub ahead of print). (PubMed)
79. Feder JN, Gnirke A, Thomas W, et al. A novel MHC class I-like gene is mutated in patients with hereditary haemochromatosis. Nat Genet. 1996;13(4):399-408. (PubMed)
80. Franchini M, Veneri D. Recent advances in hereditary hemochromatosis. Ann Hematol. 2005;84(6):347-352. (PubMed)
81. Ayonrinde OT, Milward EA, Chua AC, Trinder D, Olynyk JK. Clinical perspectives on hereditary hemochromatosis. Crit Rev Clin Lab Sci. 2008;45(5):451-484. (PubMed)
82. Wallace DF, Subramaniam VN. Non-HFE haemochromatosis. World J Gastroenterol. 2007;13(35):4690-4698. (PubMed)
83. Powell LW, Seckington RC, Deugnier Y. Haemochromatosis. Lancet. 2016; pii: S0140-6736(15)01315-X. doi: 10.1016/S0140-6736(15)01315-X. (Epub ahead of print). (PubMed)
84. Oikonomidou PR, Casu C, Rivella S. New strategies to target iron metabolism for the treatment of beta thalassemia. Ann N Y Acad Sci. 2016; 1368(1):162-168. (PubMed)
85. Jin F, Qu LS, Shen XZ. Association between C282Y and H63D mutations of the HFE gene with hepatocellular carcinoma in European populations: a meta-analysis. J Exp Clin Cancer Res. 2010;29:18. (PubMed)
86. Shen LL, Gu DY, Zhao TT, Tang CJ, Xu Y, Chen JF. Implicating the H63D polymorphism in the HFE gene in increased incidence of solid cancers: a meta-analysis. Genet Mol Res. 2015;14(4):13735-13745. (PubMed)
87. Zhang M, Xiong H, Fang L, et al. Meta-Analysis of the Association between H63D and C282Y Polymorphisms in HFE and Cancer Risk. Asian Pac J Cancer Prev. 2015;16(11):4633-4639. (PubMed)
88. Osborne NJ, Gurrin LC, Allen KJ, et al. HFE C282Y homozygotes are at increased risk of breast and colorectal cancer. Hepatology. 2010;51(4):1311-1318. (PubMed)
89. Liu X, Lv C, Luan X, Lv M. C282Y polymorphism in the HFE gene is associated with risk of breast cancer. Tumour Biol. 2013;34(5):2759-2764. (PubMed)
90. Gannon PO, Medelci S, Le Page C, et al. Impact of hemochromatosis gene (HFE) mutations on epithelial ovarian cancer risk and prognosis. Int J Cancer. 2011;128(10):2326-2334. (PubMed)
91. Kennedy AE, Kamdar KY, Lupo PJ, et al. Examination of HFE associations with childhood leukemia risk and extension to other iron regulatory genes. Leuk Res. 2014;38(9):1055-1060. (PubMed)
92. Viola A, Pagano L, Laudati D, et al. HFE gene mutations in patients with acute leukemia. Leuk Lymphoma. 2006;47(11):2331-2334. (PubMed)
93. Agudo A, Bonet C, Sala N, et al. Hemochromatosis (HFE) gene mutations and risk of gastric cancer in the European Prospective Investigation into Cancer and Nutrition (EPIC) study. Carcinogenesis. 2013;34(6):1244-1250. (PubMed)
94. Larsson SC, Wolk A. Meat consumption and risk of colorectal cancer: a meta-analysis of prospective studies. Int J Cancer. 2006;119(11):2657-2664. (PubMed)
95. Cross AJ, Ferrucci LM, Risch A, et al. A large prospective study of meat consumption and colorectal cancer risk: an investigation of potential mechanisms underlying this association. Cancer Res. 2010;70(6):2406-2414. (PubMed)
96. Bastide NM, Pierre FH, Corpet DE. Heme iron from meat and risk of colorectal cancer: a meta-analysis and a review of the mechanisms involved. Cancer Prev Res (Phila). 2011;4(2):177-184. (PubMed)
97. Fonseca-Nunes A, Jakszyn P, Agudo A. Iron and cancer risk--a systematic review and meta-analysis of the epidemiological evidence. Cancer Epidemiol Biomarkers Prev. 2014;23(1):12-31. (PubMed)
98. Qiao L, Feng Y. Intakes of heme iron and zinc and colorectal cancer incidence: a meta-analysis of prospective studies. Cancer Causes Control. 2013;24(6):1175-1183. (PubMed)
99. Bastide NM, Chenni F, Audebert M, et al. A central role for heme iron in colon carcinogenesis associated with red meat intake. Cancer Res. 2015;75(5):870-879. (PubMed)
100. Jakszyn P, Lujan-Barroso L, Agudo A, et al. Meat and heme iron intake and esophageal adenocarcinoma in the European Prospective Investigation into Cancer and Nutrition study. Int J Cancer. 2013;133(11):2744-2750. (PubMed)
101. de Valk B, Marx JJ. Iron, atherosclerosis, and ischemic heart disease. Arch Intern Med. 1999;159(14):1542-1548. (PubMed)
102. Das De S, Krishna S, Jethwa A. Iron status and its association with coronary heart disease: systematic review and meta-analysis of prospective studies. Atherosclerosis. 2015;238(2):296-303. (PubMed)
103. Hunnicutt J, He K, Xun P. Dietary iron intake and body iron stores are associated with risk of coronary heart disease in a meta-analysis of prospective cohort studies. J Nutr. 2014;144(3):359-366. (PubMed)
104. Swaminathan S, Fonseca VA, Alam MG, Shah SV. The role of iron in diabetes and its complications. Diabetes Care. 2007;30(7):1926-1933. (PubMed)
105. Orban E, Schwab S, Thorand B, Huth C. Association of iron indices and type 2 diabetes: a meta-analysis of observational studies. Diabetes Metab Res Rev. 2014;30(5):372-394. (PubMed)
106. Abril-Ulloa V, Flores-Mateo G, Sola-Alberich R, Manuel-y-Keenoy B, Arija V. Ferritin levels and risk of metabolic syndrome: meta-analysis of observational studies. BMC Public Health. 2014;14:483. (PubMed)
107. Huth C, Beuerle S, Zierer A, et al. Biomarkers of iron metabolism are independently associated with impaired glucose metabolism and type 2 diabetes: the KORA F4 study. Eur J Endocrinol. 2015;173(5):643-653. (PubMed)
108. Montonen J, Boeing H, Steffen A, et al. Body iron stores and risk of type 2 diabetes: results from the European Prospective Investigation into Cancer and Nutrition (EPIC)-Potsdam study. Diabetologia. 2012;55(10):2613-2621. (PubMed)
109. Podmore C, Meidtner K, Schulze MB, et al. The association of multiple biomarkers of iron metabolism and type 2 diabetes: the EPIC-InterAct study. Diabetes Care. 2016; 39(4):572-581. (PubMed)
110. Yeap BB, Divitini ML, Gunton JE, et al. Higher ferritin levels, but not serum iron or transferrin saturation, are associated with Type 2 diabetes mellitus in adult men and women free of genetic haemochromatosis. Clin Endocrinol (Oxf). 2015;82(4):525-532. (PubMed)
111. Fernandez-Real JM, McClain D, Manco M. Mechanisms linking glucose homeostasis and iron metabolism toward the onset and progression of type 2 diabetes. Diabetes Care. 2015;38(11):2169-2176. (PubMed)
112. Huang J, Karnchanasorn R, Ou HY, et al. Association of insulin resistance with serum ferritin and aminotransferases-iron hypothesis. World J Exp Med. 2015;5(4):232-243. (PubMed)
113. Fernandez-Real JM, Penarroja G, Castro A, Garcia-Bragado F, Hernandez-Aguado I, Ricart W. Blood letting in high-ferritin type 2 diabetes: effects on insulin sensitivity and β-cell function. Diabetes. 2002;51(4):1000-1004. (PubMed)
114. Houschyar KS, Ludtke R, Dobos GJ, et al. Effects of phlebotomy-induced reduction of body iron stores on metabolic syndrome: results from a randomized clinical trial. BMC Med. 2012;10:54. (PubMed)
115. Belaidi AA, Bush AI. Iron neurochemistry in Alzheimer's disease and Parkinson's disease: targets for therapeutics. J Neurochem. 2015; doi: 10.1111/jnc.13425. (Epub ahead of print). (PubMed)
116. Kwan JY, Jeong SY, Van Gelderen P, et al. Iron accumulation in deep cortical layers accounts for MRI signal abnormalities in ALS: correlating 7 tesla MRI and pathology. PLoS One. 2012;7(4):e35241. (PubMed)
117. Wong BX, Duce JA. The iron regulatory capability of the major protein participants in prevalent neurodegenerative disorders. Front Pharmacol. 2014;5:81. (PubMed)
118. Devos D, Moreau C, Devedjian JC, et al. Targeting chelatable iron as a therapeutic modality in Parkinson's disease. Antioxid Redox Signal. 2014;21(2):195-210. (PubMed)
119. Grolez G, Moreau C, Sablonniere B, et al. Ceruloplasmin activity and iron chelation treatment of patients with Parkinson's disease. BMC Neurol. 2015;15:74. (PubMed)
120. Hendler SS, Rorvik DM. PDR for Nutritional Supplements. 2nd ed. Montvale: Thomson Reuters; 2008.
121. Natural Medicines. Iron: Interactions with Drugs (professional monograph); 2016. Available at: https://naturalmedicines.therapeuticresearch.com/. Accessed 6/1/16.
122. Wander K, Shell-Duncan B, McDade TW. Evaluation of iron deficiency as a nutritional adaptation to infectious disease: an evolutionary medicine perspective. Am J Hum Biol. 2009;21(2):172-179. (PubMed)
123. Oppenheimer SJ. Iron and its relation to immunity and infectious disease. J Nutr. 2001;131(2S-2):616S-633S; discussion 633S-635S. (PubMed)
124. van den Hombergh J, Dalderop E, Smit Y. Does iron therapy benefit children with severe malaria-associated anaemia? A clinical trial with 12 weeks supplementation of oral iron in young children from the Turiani Division, Tanzania. J Trop Pediatr. 1996;42(4):220-227. (PubMed)
125. Sazawal S, Black RE, Ramsan M, et al. Effects of routine prophylactic supplementation with iron and folic acid on admission to hospital and mortality in preschool children in a high malaria transmission setting: community-based, randomised, placebo-controlled trial. Lancet. 2006;367(9505):133-143. (PubMed)
126. Tielsch JM, Khatry SK, Stoltzfus RJ, et al. Effect of routine prophylactic supplementation with iron and folic acid on preschool child mortality in southern Nepal: community-based, cluster-randomised, placebo-controlled trial. Lancet. 2006;367(9505):144-152. (PubMed)
127. Neuberger A, Okebe J, Yahav D, Paul M. Oral iron supplements for children in malaria-endemic areas. Cochrane Database Syst Rev. 2016;2:CD006589. (PubMed)
128. World Health Organization. Guideline: daily iron supplementation in infants and children. Geneva: World Health Organization; 2016.
129. Fairweather-Tait SJ, Wawer AA, Gillings R, Jennings A, Myint PK. Iron status in the elderly. Mech Ageing Dev. 2014;136-137:22-28. (PubMed)
その他の栄養素
必須脂肪酸
概要
- ω-3脂肪酸のα-リノレン酸(ALA),及びω-6脂肪酸のリノール酸(LA)は,人の体内で合成できないため,必須脂肪酸とみなされる。(詳細はこちら)
- 長鎖ω-6脂肪酸であるアラキドン酸(AA)は,LAから合成可能である。長鎖ω-3脂肪酸のエイコサペンタエン酸(EPA)とドコサヘキサエン酸(DHA)は,ALAから合成できるが,EPAとDHAの合成は,条件によっては不十分な可能性がある。(詳細はこちら)
- 典型的な洋食は,ω-3脂肪酸よりω-6脂肪酸のほうがかなり多い傾向がある。(詳細はこちら)
- DHAは視覚及び神経系の発達にとって重要と考えられるが,DHAやAAが多く含まれる乳児用調製乳の授乳が,早産児または正常産児における視力発達や神経系発達に効果があるかどうか,なお不明である。(詳細はこちら)
- 多くの科学研究からは,ω-3脂肪酸を食事から多く摂取することが,心血管系疾患リスクの低減と相関があることが示唆されている。そこで,米国心臓病協会は,全ての成人は,魚,特に油脂の多い魚を少なくとも週2回食べるよう推奨している。(詳細はこちら)
- 無作為対照試験の結果から,ω-3脂肪酸の摂取量を多くすると,心筋梗塞(心臓マヒ)や冠動脈心疾患(CHD)の人々の心臓突然死を減少させることが示唆されている。(詳細はこちら)
- DHAが低い状態は,アルツハイマー病などの認知症に対するリスク因子であるが,DHA補給がそのような認知障害の予防や治療に有用であるかどうか今のところ不明である。(詳細はこちら)
- EPAやDHAの摂取量を増やすことが,2型糖尿病,特に血清中トリグリセライドが高い人々に有効である可能性がある。(詳細はこちら)
- 無作為対照試験から,リウマチ性関節炎患者において,魚油の補給が,関節圧痛を緩和し抗炎症性薬の必要量を減少させることが認められている。(詳細はこちら)
- 限られた予備試験から,ω-3脂肪酸補給が,うつ病,双極性障害(躁鬱病)及び統合失調症(精神分裂症)の治療に有効であることが示唆されているが,治療効果確認のため,より多くの管理された臨床試験が必要とされている。(詳細はこちら)
緒言
ω-3及びω-6脂肪酸は,多価不飽和脂肪酸(PUFA)であり,cis-二重結合を2つ以上含む (1)。全てのω-3脂肪酸において,最初の二重結合は,脂肪酸のメチル基末端から数えて3番目と4番目の炭素原子の間(n-3)に位置する。同様に,全てのω-6脂肪酸における最初の二重結合は,脂肪酸のメチル基末端から6番目と7番目の炭素原子の間(n-6)に位置する。脂肪酸の科学的略号は,それらの化学構造に関しいくつかの命名法がある。α-リノレン酸(ALA)の略記の一つは,18:3n-3である。最初の部分(18:3)はALAが二重結合を3個持つ炭素数18の脂肪酸であることを意味し,二番目の部分(n-3)が最初の二重結合がn-3位に位置することを示し,これがω-3脂肪酸として定義される (Figure 1) 。
人などの哺乳動物は,炭水化物やタンパク質の炭素から飽和脂肪酸と一価不飽和脂肪酸を合成できるが,脂肪酸のn-6位やn-3位にcis-二重結合を付加するために必要な酵素を持たない (1)。そのため,ω-6脂肪酸及びω-3脂肪酸は必須栄養成分である。元となるω-6脂肪酸群はリノール酸(LA;18:2n-6)であり,ω-6脂肪酸の起源はALAである(Figure 1)。人は,ジホモ-γ-リノレン酸(DGLA;20:3n-6)やアラキドン酸(AA: 20:4n-6)などの長鎖(炭素数20以上)のω-6脂肪酸をLAから合成でき,ALAからエイコサペンタエン酸(EPA; 20:5n-3)やドコサヘキサエン酸(DHA; 22:6n-3)などの長鎖ω-3脂肪酸を合成できる(下記「代謝及び生体利用能」参照)。以前は人の食事中のω-6脂肪酸とω-3脂肪酸の比率は1:1と推定されていたが (2),現在の典型的な洋食における比率は,LAの多い植物油が増加し魚の摂取が減少しているため,ほぼ10:1である (3)。多くの科学研究からは,食事からのω-3脂肪酸の相対的比率を増加させると,多くの健康利益が得られることが示唆されている。
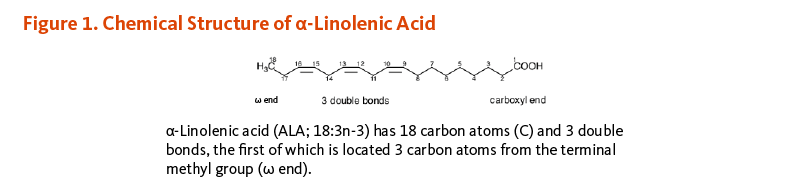
代謝及び生体利用能
小腸に吸収される前に,脂肪酸は,膵臓の酵素によって摂取した脂肪(トリグリセリド,リン脂質及びコレステロール)から加水分解される必要がある (4)。胆汁酸塩も,脂肪酸や他の脂肪消化産物を混合ミセルとするために小腸中に存在しなければならない。混合ミセルからの脂肪吸収は,小腸通過中に起こり,正常な状態で85~95%の吸収効率である。人は,一連の不飽和化反応(二重結合の付加)及び炭素鎖延長(炭素原子の付加)反応により,それぞれ必須脂肪酸のLAとALAから長鎖のω-6及びω-3脂肪酸を合成可能である(Figure 2)(5)。LA及びALAは,AAやEPAなどの長鎖多価不飽和脂肪酸の合成において,同一の延伸酵素と脱飽和酵素を競合して使用する。ALAは,δ-6 脱飽和酵素に親和性がある基質であるが,LAの摂取がALAより多くなると,AA(20:4n-6)の総生成量がEPA(20:5n-3)より多くなる (6)。ALAからDHAへの変換能は,男性より女性のほうが高い。健常な若い男性におけるALA代謝の研究からは,摂取したALAの約8%がEPAに変換され,0~4%がDHAに変換される (7)。健常な若い女性において,摂取したALAの約21%がEPAに変換され,9%がDHAへ変換される (8)。男性に比べ若い女性の変換効率が良いことは,エストロゲンの影響によると考えられる (6,9)。ALAは,人が合成できないことから,必須ω-3脂肪酸とみなされるが,人によるEPAや特にDHAの変換が比較的効率が悪いということは,EPAとDHAもまた,ある種の状況下では必須となる可能性を示唆している (10,11)。

生物学的活性
細胞膜の構造及び機能
ω-6 PUFA及びω-3 PUFAは,細胞膜の重要な構成成分である。リン脂質に取り込まれると,それらは,細胞膜の流動性,弾力性,浸透性及び膜結合酵素の活性などの細胞膜特性に影響を及ぼす (12)。DHAは,選択的に網膜細胞膜とシナプス後神経細胞膜に取り込まれ,視覚機能及び神経系機能に重要な役割を果たすことが示唆されている。
視覚
DHAは,網膜の細胞膜に極めて高濃度認められる。網膜は,ω-3脂肪酸摂取量が低いときでも,DHAを保存し循環させる (13)。動物実験から,DHAが,網膜の正常な発達と機能に必要であることが示唆されている。さらに,これらの研究からは,DHAの不足が網膜機能に永続性の異常を起こす網膜発達時期に,決定的期間があることが示唆されている。最近の研究から,網膜に当たる光を脳で視覚イメージに変換する視覚伝達系に重要な役割を持つ視覚色素ロドプシン(光受容タンパク質)の再生に,DHAが重要な役割を持つことが示されている (14)。
神経系
脳灰白質のリン脂質は高い割合でDHAやAAを含有し,それらが中枢神経系の機能に重要であることが示唆されている (15)。動物実験において,脳内DHA枯渇が学習機能を欠損させることが認められているため,脳のDHA含有量は特に重要である。DHAが脳機能にどのように影響を与えるかはわかっていないが,神経細胞膜のDHA含量変化が,神経伝達物質の利用能だけでなく,イオンチャンネルや膜関連受容体の機能を変化させる可能性がある (16)。
エイコサノイド(イコサノイド)合成
炭素数20のPUFA由来エイコサノイド類は,免疫反応や炎症反応に決定的役割を果たす潜在的な化学伝達物質である。炎症反応中に,細胞膜中のDGLA,AA及びEPAが,シクロオキシゲナーゼやリポキシゲナーゼと呼ばれる酵素によって代謝され,それぞれ,プロスタグランジン類やロイコトリエン類を生成する(Figure 2)。典型的な洋食を摂取する人々において,細胞膜中のAA量は,EPA量よりかなり多く,EPAよりAAに由来するエイコサノイドの生成が多く起きる。しかしながら,ω-3脂肪酸の摂取量を増やすことは細胞膜のEPA量を増加させ,その結果,EPAに由来するエイコサノイドの割合を高めることになる。AA由来エイコサノイドに対する生理反応は,EPA由来エイコサノイドとの反応とは異なる。一般に,EPA由来エイコサノイドは,炎症,血管収縮及び血液凝固の誘発能が,AA由来エイコサノイドより低い (3,17)。
遺伝子発現の制御
培養細胞と動物試験の結果から,ω-6及びω-3脂肪酸は,脂肪酸代謝や炎症に関与する遺伝子を含む多くの遺伝子発現を調節することが示唆されている (17,18)。そのメカニズムはさらに解明する必要があるが,ω-6脂肪酸及びω-3脂肪酸は,ペルオキソーム増殖因子活性化レセプター(PPARs)及び肝臓Xレセプター(LXRs)など,特異的な転写因子と相互作用することによって,遺伝子発現を制御するのかもしれない (19)。これらの制御経路には,複数のメカニズムが関与している (20)。多くの場合,PUFAは,遺伝子発現をコントロールする疎水性ホルモン類(例えば,ステロイドホルモン類)のように働く。この場合,PUFAはPPARsのような受容体に直接結合する。これらの受容体は,遺伝子のプロモーターと結合し,遺伝子の転写を増減させる機能を持つ。他には,PUFAは,細胞核内の転写因子の数量を制御する (20)。これらの因子に関して,PUFAの制御メカニズムはあまりわかっていない。2つの例はNFκBとSREBP-1である。NFκBは,炎症に関係する複数の遺伝子発現制御に関与する転写因子である。例えば,ω-3 PUFAは,炎症誘発性のエイコサノイドやサイトカインの産生を阻害するNFκBの核内含量を低減させる。SREBP-1は,新規の脂質生成とPUFA合成の両方の脂肪酸合成を制御する主要な転写因子である (21)。食事からのPUFAはSREBP-1活性を抑制し,脂肪酸合成やPUFA合成に関与する酵素の発現を低下させる (22,23)。このように,食事からのPUFAは,全ての脂肪酸合成のフィードバック阻害剤として機能する。
欠乏症
必須脂肪酸の欠乏症
必須脂肪酸欠乏症の臨床症状は,乾燥した鱗状発疹,乳幼児の発育遅延,感染症に対する感受性増加及び傷の治癒が遅いなどがある (24)。ω-3,ω-6及びω-9脂肪酸は同一の脱飽和酵素を競合する。脱飽和酵素は,ω-3 >ω-6 >ω-9の順で脂肪酸類に選択性を示す。このため,ω-9脂肪酸であるエイコサトリエン酸(20:3n-9,ミード酸,5,8,11-エイコサトリエン酸)は,ω-3脂肪酸とω-6脂肪酸の食事摂取量が極めて少ない場合にのみ増加する。したがって,ミード酸は必須脂肪酸欠乏症のマーカーの一つとなる (25)。血漿中のエイコサトリエン酸:アラキドン酸(トリエン:テトラエン)の比が0.2以上の場合,一般的に必須脂肪酸欠乏症の症状とみなされる (24,26)。脂肪を含まないグルコースとアミノ酸混合物を完全非経口栄養法で投与された患者において,必須脂肪酸欠乏症の生化学的徴候が7~10日ほどの短期間で発生した (27)。これらの場合,持続性のグルコース点滴が,高いインスリン循環レベルを起こし,脂肪組織に蓄積された必須脂肪酸の遊離を阻害していた。グルコースフリーのアミノ酸溶液を用いた場合,最大14日までの非経口栄養は,必須脂肪酸欠乏症の生化学的徴候を起こさなかった。必須脂肪酸の欠乏は,慢性の脂肪吸収不良患者 (28)及び嚢胞性線維症患者 (29)でも起こることが認められている。近年では,必須脂肪酸欠乏がタンパク質-エネルギー栄養失調の病理学で一役担うかもしれないといわれている (25)。
ω-3脂肪酸欠乏症
ω-3脂肪酸の欠乏症例は少なくとも一例報告されている。極微量のALAを含む脂質エマルジョンを静脈注射された少女が,視覚障害と感覚神経障害を発症した。これらの症状は,より多いALAを含むエマルジョンを投与したときに解消した (30)。ω-3脂肪酸摂取量が不足すると,血漿中のDHA濃度が低下するが,カットオフ値は決まっていない。ω-3脂肪酸の欠乏単独では,血漿中のトリエン:テトラエン比の増加は起こさない (1)。しかしながら,げっ歯類の試験において,n-3 PUFA欠乏が学習と記憶機能に関して重要な障害を示した (31,32)。これらの研究が,認知機能発達と認知機能低下に及ぼすω-3 PUFAの影響を評価するための人における臨床試験についての必要性を提起した(www.clinicaltrials.gov)。
疾病の予防
視覚発達と神経発達
妊娠の最終三半期は,脳及び網膜におけるDHA蓄積に重要な期間であるため,早産児は,視覚発達と神経発達において,DHA欠乏による悪影響を特に受けやすいと考えられる (33)。母乳はALAやEPAの他にDHAを含むが,最近まで,ALAが通常の乳児用調製乳中に存在する唯一のω-3脂肪酸であった。早産児はALA からDHAを合成できるが,概して,更なる食事からの摂取なしに,血漿中及び細胞内のDHA濃度の低下を防止するための十分な量を合成できない。そこで,早産児用調製乳が,調製乳授乳児の血漿中及び細胞中のDHAレベルを母乳授乳児のレベルまで引き上げるために,十分な量のDHAで補われることが提案された (34)。DHAを強化された調製乳は,早産や正常産児において,血漿中及び赤血球中のDHA濃度を上昇させるが,DHA添加の有無による調製乳で授乳された乳児において,視力及び神経の発達の尺度を検定した無作為対照試験の結果は,様々である (35-38)。いくつかの対照試験では,DHAを添加された調製乳を授乳された健常な早産乳児が,DHAを添加しない調製乳を授乳された乳児より,2~4月齢において,微妙ではあるが有意な視力の改善が認められた (39)が,大部分の無作為対照試験では,DHAの添加有無による調製乳を授乳された健常な早産児間で視力に差が認められなかった (36)。同様に,12ヵ月と24ヵ月齢での乳児発育の一般的尺度を評価した2つの無作為対照試験で,DHA添加の有無により調製乳授乳早産児で差は認められなかった (40,41)。一方,最近の2例の無作為対照試験で,18ヵ月齢乳児の発育が評価され,早産児におけるDHA補給の有効性が報告されたが,このうち一方の試験では有意な効果が認められたのは男児のみであった (42,43)。DHAを強化された乳児用調製乳は,通常乳児用にも市販されているが,正常産児におけるこれら調製乳の視力や発育についての結果は,やはり様々である (37,44-47,38,48)。DHAは,視力発達と神経発達にとって重要と考えられるが,DHAを強化された乳児用調製乳が,早産または通常産の乳児において視力発達や神経発達の効果があるかどうか依然不明である (49)。
妊娠期及び授乳期
乳児のDHA必要量は大きな研究課題であるが,母親が胎児と母乳授乳児とって唯一のω-脂肪酸供給源であると言う事実にも拘わらず,母胎のω-3脂肪酸必要量の調査は比較的少ない (50)。妊娠時の無作為対照試験の結果からは,ω-3脂肪酸補給は,妊娠糖尿病,妊娠が誘発する高血圧や子癇前症の発生率を減少させないことが示唆されている (51-53) が,妊娠期間のわずかな延長が特にω-3脂肪酸摂取量が少ない女性で起こる可能性がある。健常なデンマーク女性において,EPA+DHA 2.7 g/日を魚油として補給したとき,平均で4日まで妊娠期間が長くなった (52)。さらにその後,米国の低収入層において,妊娠最終三半期の間にDHA強化卵からのわずか0.13 g/日の摂取により,平均6日まで妊娠期間が延長された (53)。低リスク妊娠女性における6例の無作為対照試験のメタアナリシスから,妊娠時のω-3 PUFA補給が,1.6日までの妊娠期延長をもたらすことが認められた (54)。ヨーロッパの高リスク妊娠女性において,妊娠最後3半期でのEPA+DHA 2.7 g/日の魚油で補給したとき,早産リスクが33%から21%へ減少した (55)。しかしながら,高リスク妊娠女性における無作為対照試験のメタアナリシスでは,長鎖PUFAによる補給が,妊娠期間や早産の発生率に影響はないが,初期の早産(妊娠34週間以下)の発生率を低減することが認められた (56)。世界周産期学会,早期栄養アカデミー(Early Nutrition Academy)及び子供健康基金(Child Health Foundation)は,妊娠時及び授乳期の女性が,一日少なくとも平均200 mgのDHAを摂取すること(週1~2回の魚料理)を推奨した (57)。
妊娠期または授乳期の長鎖PUFA補給が産児の神経系発達に及ぼす影響は,活発に研究されている分野である。ノルウェーにおいて,妊娠時及び授乳の最初の3ヵ月にタラ肝油(EPA+DHAを2 g/日)を補給された母親から生まれた子供が,母親がタラ肝油を補給されなかった子供と比較して,4歳時における感情処理テスト(mental processing test)で高スコアを記録した (58)。しかしながら,子供が4歳のとき試験を実施できたのは,参加者の14%だけであった。二重盲検無作為対照試験において,妊娠時(出産までの20週間)に魚油(DHA 2.2 gとEPA 1.1 g)を補給された母親から生まれた子供が,オリーブ油を補給された母親の子供と比較して,2.5歳において,目と手の共同作業で高いスコアを示した (59)。DHAを含むシリアルバー(DHA 300 mg/バー,平均5バー/週)またはプラセボシリアルバーを29人の妊娠女性(妊娠24週から出産まで)に摂取してもらった小規模試験において,母胎のDHA補給が生後9ヵ月の乳児の問題解決スキルと相関を示した (60)。2つの乳児群で,認知記憶作業に有意差はなかった。授乳期間中だけにω-3脂肪酸を母親に与えた子供における認知機能を評価した無作為対照試験の結果は,様々であった (38)。いくつかの結果は有望ではあるが,妊娠期または授乳期における長鎖PUFA補給が,子供における長期の知覚発達に有効かどうか判断するために,さらに多くの研究が必要である。現在のところ,妊娠時及び授乳期に適度の魚を摂取(例えば,週1~2食)することによって,長鎖ω-3脂肪酸を摂取することと関係する潜在的利益は,共存する汚染物質の曝露リスクを上回っているが,高レベルのメチル水銀を含む魚は避ける必要がある (61)。魚の汚染に関する情報と出産年齢の女性による魚の摂取のためのガイドラインについては,下記「魚の汚染」を参照のこと。
心血管系疾患
ω-6脂肪酸:リノール酸
LAは,食事中に最も多く含まれるPUFAである。PUFA摂取量と冠動脈心疾患(CHD)との間の相関関係を調査した前向きコホート研究の結果は,いくぶん不一致が見られる (62)。すべてではないがいくつかの前向きコホート研究からは,PUFAとLAの高摂取が,CHDリスク (63-65) や心血管に関連する死亡率 (66) の有意な低減と相関がみられている。食事からの脂肪摂取量がCHDリスクに及ぼす影響を試験した最大の前向きコホート研究は,78,000人女性を20年間追跡したNurses’ Health Studyである。このコホートにおいて,総PUFA摂取量(エネルギーの7.4%)とLA摂取量が最も高い群が,総PUFA(エネルギーの5%)とLAの摂取量が最も低い群よりCHDリスクが25%低かった (64)。飽和脂肪酸(SFA)摂取量はCHDリスクと相関がなかったが,PUFA:SFA摂取量の比は,CHDリスクと逆相関が認められた。管理された飼養試験において,飼料中のSFAをPUFAに置き換えることで,血清中の総コレステロール濃度とLDLコレステロール濃度がかなり低下した (67)。実際,LAは,食事中のSFAと置換したとき,血清中の総コレステロールとLDLコレステロールの濃度を最も下げる能力のある脂肪酸である (68)。いくつかの食事介入試験によって,CHDによる疾病率(病気)と死亡率に関して,SFAの多い食事(エネルギーの18~19%)とSFAが低く(エネルギーの8~9%)PUFAが高い(エネルギーの14~21%)食事について比較された (62)。PUFA増加のほとんどはLAにより供給されたが,これらの試験ではALA摂取量も増加させた (67)。いくつかの男性での食事介入試験では,食事中のSFAをPUFAに置き換えることで,CHDによる疾病発症率や死亡率を減少させることが認められた (69-72)。一方で,女性における2例の同様な食事介入試験では,CHDによる疾病率や死亡率の有意な低減はみられなかった (73,75)。米国心臓病協会は,最近の科学助言において,ω-6 PUFAsから得られる総カロリーの5~10%が,CHDリスク低減と相関があると結論している (75)。
ω-3脂肪酸;α-リノレン酸(ALA)
いくつかの前向きコホート研究で,食事からのALA摂取量とCHDリスクとの間の相関が試験された。米国男性45,000人以上を14年間追跡したコホート研究において,食事ALA摂取量の1 g/日の増加が,CHDリスクの16%低減と相関がみられた (76)。また,ほとんど水産食品を食べない人において,食事中ALA摂取量の1 g/日増加が,CHDリスクの47%減少と相関していた。米国人女性76,000人以上を10年間追跡したコホート研究において,ALA摂取量が最大(1.4 g/日程度)の人は,最小摂取量(0.7 g/日程度)の女性より,致命的なCHDリスクが45%低かった (77)。興味深いことに,油と酢のサラダドレッシングが,この集団において大きな食事ALAの摂取源であった。油と酢のサラダドレッシングを週5~6回摂取する女性は,野菜摂取量で補正した後でも,あまりドレッシングを摂取しない人より致命的なCHDリスクが54%低かった。米国人男性6,000人以上の小規模コホート研究において,ALAの最大摂取者が,次の10年間で,最小摂取群よりCHDによる死亡リスクが40%低かった (78)。逆に,ヨーロッパにおける2例の研究では,食事からのALA摂取量とCHDリスクとの間に相関は認められなかった (79,80)。付け加えると,Nurses’ Health Study(76,763人の女性を18年間追跡)において,食事からのALA摂取量は,致命的なCHDや死に至らない心筋梗塞と相関がみられなかったが,心臓突然死とは逆相関が認められた(下記参照)(81)。水産食品からの長鎖ω-3脂肪酸の高い摂取量を支持する科学的証拠は必ずしも一致していないが,多くの前向き研究からは,比較的高いALA摂取量(2~3 g/日)が,特に魚摂取量が低い集団において,CHDリスクの有意な低減と相関することが認められている (82)。LAと異なり,高いALA摂取による心臓保護効果は,血清中の脂質プロファイル変化と関連するとは考えられていない。14例の無作為対照試験のメタアナリシスから,ALA補給が,総コレステロール,LDLコレステロール,トリグリセライドのレベルの影響がなかったと結論された (83)。一方,いくつかの管理された臨床試験からは,ALA摂取量の増加が,心筋梗塞(MI)や脳卒中などの心血管系症例のリスクに強く関係している炎症マーカーである,C-反応性タンパク質(CRP)の血清中濃度を減少させることが認められている (84-86)。
長鎖ω-3脂肪酸:エイコサペンタエン酸及びドコサヘキサエン酸
長鎖ω-3脂肪酸(EPAとDHA)が,1) 突然心臓死を起こす可能性がある不整脈を予防する,2) 心筋梗塞(MI)や脳卒中を起こす可能性がある血栓症(凝血塊)リスクを低下させる,3) 血清中のトリグリセライドレベルを低下させる,4) 動脈硬化性プラークの成長を遅らせる,5) 血管内皮機能を改善する,6) 血圧を少し下げる,及び7) 炎症を低減させる,ことによって,心血管系疾患リスクを低下できるという科学的証拠が蓄積されつつある (87)。無作為対照試験の最近の系統的レビューから,魚や魚油サプリメントからのEPAやDHA摂取が,全ての死亡原因,心臓死,突然死を低減させることと相関があることが認められた (88)。しかしながら,別の無作為対照試験と前向きコホート研究の系統的レビューとメタアナリシスからは,長鎖ω-3脂肪酸は,死亡率全体や心血管系症例のリスクを有意に低減しないと結論された (89)。
冠動脈心疾患(Coronary Heart Disease):いくつかの前向きコホート研究からは,少なくとも週一回魚を食べる男性が,魚を食べない人よりCHDによる死亡率が低いことが認められている (90-92)。そのような研究の一例で,1,822人男性を30年間追跡され,CHDによる死亡率が,少なくとも一日あたり平均35 g(1オンス)の魚を摂取する男性において,魚を食べない人より38%低く,一方でMIによる死亡率は67%低いことが認められた (93)。魚の摂取による心臓予防効果は,典型的な洋食を摂取する人に限定されるものではないかもしれない。18,000人以上の男性を10年間追跡した中国の研究において,魚介類を毎週200 g(7オンス)以上摂取する人は,週50 g(2オンス)以下の摂取の人より,致命的なMIリスクが59%低いことが認められた (94)。女性における高いω-3脂肪酸と魚の摂取の影響に関して利用できる情報はあまりない。84,000人以上の女性を16年間追跡したNurses’ Health Studyにおいて,少なくとも週一回魚を食べる女性は,魚を月一回以下しか食べない女性より,CHDによる死亡率が29~34%低かった (95)。2,445人のフィンランド女性による前向き研究において,魚摂取量の最大五分位の人(41 g/日以上;平均70 g/日)は,最小五分位の人(8 g/日以下;平均4.2 g/日)と比較し41%低いCHDリスクであった (96)。
41,748人の日本人男女を対象とした大規模な前向き研究において,魚の高い摂取量がCHDリスクの更なる低減との関係が認められた。この研究において,魚を週8回摂取する人が,一回しか摂取しない人と比べて,非致死的な冠動脈症例リスクが57%低く,MIリスクが56%低かった (97)。一方,8,879人の日本人男女のやや小規模な前向き研究では,1日2回の魚摂取が,週1~2回の魚摂取と比較したとき,総死亡率やCHD死亡率のリスクを低減しなかったことが報告された (98)。
心臓突然死(Sudden Cardiac Death):心臓突然死(SCD)は,致命的な心室性不整脈の結果であり,通常CHDを病む人で起こる。培養細胞を用いた研究から,長鎖ω-3脂肪酸が,イオンチャンネル透過性を調整することにより心筋細胞(ミオサイト)の興奮性を低下させることが示唆されている (99)。疫学研究の結果からは,定期的な魚の摂取が,心臓突然死リスクと逆相関することが示唆されている。20,000人以上の男性を11年間追跡した大規模前向きコホート研究において,最低週一回魚を食べる人が,月一回以下で魚を食べる人より心臓突然死のリスクが52%低かった (100)。EPAとDHAの血漿中レベルも心臓突然死リスクと逆相関が認められ,ω-3脂肪酸が,心臓突然死における魚摂取の有益効果に少なくとも一部分関与しているという考えを裏づけしていた (101)。さらにその後,45,000人以上の男性を14年間追跡した前向き研究で,少なくとも平均250 mg/日のEPA+DHA(毎週1~2の油の多い魚料理に相当)を食事から摂取する人において,250 mg/日以下の摂取量の人より突然心臓死リスクが約40~50%低いことが認められた (76)。食事からのEPA+DHA摂取量は,非致死性のMIや総CHD症例とは関係せず,長鎖ω-3脂肪酸の抗不整脈作用が,通常の食事からの摂取レベルで重要であることを示唆している。さらに,いくつかの観察研究や臨床試験からは,食事に魚や魚油を加えることが心臓突然死リスクを下げることが認められた (102)。比較的短鎖のω-3脂肪酸であるALA摂取がSCDリスクに影響するかどうかを調査した研究は少ない。76,763人女性を対象としたNurses' Health Studyにおいて,比較的高いALAの食事摂取が,SCDリスクの38~40%低減と相関がみられた (81)。45,722人男性を追跡したHealth Professionals Follow-up Studyでは,食事からのALA摂取量と心臓突然死との間に相関はみられなかった (76)。ω-3脂肪酸補給が,心室性不整脈リスクを低減するかどうかも明らかではない。最近の3例の臨床試験 (103-105)のメタアナリシスでは,植込み型の心臓除細動器をつけた患者において,心室性不整脈の予防効果がないと結論されたが,これらの患者はすでに心疾患を発症していた (106)。ω-3脂肪酸の状態が,心室性不整脈のリスクに影響するかどうか判定するためには,さらに多くの疫学研究や臨床試験が必要である (107)。
脳卒中(Stroke):虚血性脳卒中は,脳領域への血流が不十分な結果であり,脳に通じる動脈が,血栓によって塞がれたときに起こる。出血性脳卒中は,血管が破裂し脳に出血したときに起こる。米国において,脳卒中の70~80%は虚血性である (108)。魚やω-3脂肪酸の摂取量と脳卒中の総発症率との間の相関を試験した前向き研究では,魚の摂取量が多いと有益であることが認められたもの (109,110),効果がみられなかったもの (111-113) がある。さらにその後,2つの大規模前向き研究から,魚摂取量とω-3脂肪酸摂取量が多いことが,虚血性脳卒中リスクを有意に低下させることと相関し,出血性脳卒中には相関がなかったことが認められた。79,000人以上の女性を14年間追跡した研究において,少なくとも週2回魚を食べる女性は,月1回以下しか食べない人より,血栓性(虚血性)脳卒中のリスクが52%低かった (114)。同様に,43,000人以上の男性を12年間追跡した研究において,最低月に一回魚を食べる人では,月1回以下の人より虚血性脳卒中リスクが43%低かった (115)。長鎖ω-3脂肪酸の摂取が脳卒中発生率に及ぼす効果は,CHDほど十分には研究されていないが,利用できる証拠のメタアナリシスでは,多い魚摂取量が虚血性脳卒中のリスクを減少させ,出血性脳卒中リスクは低下させないことが示唆されている (116)。最近の研究結果は,高用量のEPA補給が,二次的な脳卒中予防,すなわち病歴のある人の脳卒中再発を予防するのに有効であることを示唆している (117)。
血清中トリグリセライド:17例の前向き研究のメタアナリシスから,高グリセライド血症(血清中トリグリセライドが> 200 mg/dl)が,心血管系疾患の独立したリスク因子であることが認められている (118)。人における数多くの管理された臨床試験からは,EPAとDHAの摂取量増加が血清中のトリグリセライド濃度を有意に低下させることが確認された (119)。EPAとDHAによるトリグリセライド低下作用は用量とともに高まる (120) が,臨床的に有意義な血中トリグリセライド濃度減少は,EPA+DHAの2 g/日用量で確認されている (3)。ω-3脂肪酸と心血管系疾患に関しての推奨の中で(下記「推奨摂取量」参照),米国心臓病協会は,EPA+DHA補給は,高トリグリセライド血症患者において有用かもしれないと述べている (87)。
要約:ω-3及びω-6 PUFAと心血管系疾患予防
疫学研究と無作為対照試験の結果は,食事からのSFAをω-6及びω-3 PUFAに置き換えると,LDLコレステロールを低下させ,心血管系疾患リスクを減少させることを示唆している。さらに,疫学研究の結果は,食事からのω-3脂肪酸摂取量増加が,LDLコレステロール低下以外のメカニズムによる心血管系疾患リスクの有意な低減と相関があることを提示している。特に,水産食品からのEPAとDHA摂取量増加は,心臓突然死の有意な低減と相関が認められ,長鎖のω-3脂肪酸が,週に油が多い魚を2食程度の量に相当する摂取レベルで抗不整脈作用を持つことを示唆している。この魚の量は,EPA+DHAのおよそ400~500 mg/日を供給することになる (121)。そこで,米国医薬品機構が,EPA+DHAについての食事摂取基準(DRI)を設定すべきと提案する研究者もいる (122)。
アルツハイマー病と認知症
アルツハイマー病は,高齢者における最も一般的な認知症原因である。アルツハイマー病は,脳内のアミロイドプラーク形成及び神経細胞の退化により特徴付けられる。記憶喪失や意識障害などの疾病症状は,時間とともに悪化する (123)。いくつかの疫学研究から,認知機能障害 (124),認知症 (125) 及びアルツハイマー病 (125,126) のリスク低下と,魚の高摂取との相関が認められている。脳内の主要なω-3脂肪酸であるDHAは,アルツハイマー病に対し予防効果があると思われる (127)。観察研究から,低いDHA状態は,アルツハイマー病 (128-130) だけでなく他の認知症 (129) のリスク増加と相関があると認められている。Framingham Heart Studyのコホートにおいて,血漿中のホスファチジルコリンDHA含有量の最大四分位である男女が,最小四分位の人と比べ,全認知症発症リスクを47%低下させ,アルツハイマー病発症リスクを39%減少させた (131)。最大四分位の人は,魚を週平均3食摂取していた(DHAの0.18 g/日)(131)。このように,低いDHA状態は,アルツハイマー病などの認知症の,そして老化と関連した認知障害のリスク因子である可能性がある。
疾病の治療
冠動脈心疾患
食事介入試験
総死亡率と致命的なMIは,男性のMI生存者に油脂の多い魚を週200~400 g(7~14オンス),すなわち長鎖ω-3脂肪酸(EPA+DHA)の追加推定量として500~800 mg/日,増やすことを助言することにより,29%減少した (132)。別の食事介入試験では,初めてのMIで生存した患者について,通常の治療をされるか,またはω-3脂肪酸(特にALA)が多く,典型的な洋食よりω-6脂肪酸が低い地中海食を用いる場合に任意に割り当てられた。ほぼ4年後,地中海食の群は,通常療養の群より,心臓死と非致死性MIのリスクが38%低かった (133)。高い血漿中のALAレベルは,良好な転帰に相関がみられたが,地中海食の効用は,一価不飽和脂肪酸と野菜・果実の摂取量も増えたため,ALA摂取量へ完全に関連付けすることはできない。平均46ヵ月間で,地中海食または低脂肪食を摂ったMI生存者について,その後の介入研究で生存率が比較された。総死亡率と心血管系関連の死亡率は,2つの介入群間で差がみられなかった (134)。
食事への補給試験
現在までで最も大規模なω-3脂肪酸を補給する無作為対照試験において,3.5年間EPA+DHAを850 mg/日供給されたCHD患者が,補給されない患者と比較し,心臓突然死リスクは45%低かった。サプリメント使用者は,非使用者より全ての死亡症例でも20%のリスク低下であった (135)。興味深いことに,総死亡率における有意な減少を確認するためにかかった期間は,服用3ヵ月だけであり,心臓突然死の有意な減少確認は4ヵ月で確認できた (136)。もう一つの補給試験において,急性MIで入院した患者に,任意に魚油を含むカプセル(EPA+DHAを1.8 g/日),マスタード油(ALA 2.9 g/日)または対照群が投与された (137)。1年後,非致死性MIを含む総心臓系症例は,対照群と比較し,魚油投与群とマスタード油投与群で有意に少なかった。対照的に,比較的魚の摂取量が多いノルウェー地方において,急性のMI患者において,コーン油と比較して,EPA+DHAの3.5 g/日による補給からはいかなる効果も認められなかった (138)。食事からまたはサプリメントからのω-3脂肪酸についての11例の無作為対照試験の結果を集めたメタアナリシスから,ω-3脂肪酸摂取量の増加は,CHD患者における心臓突然死による総死亡率及びMIによる死亡率を有意に減少させることが示された (139)。
2例の無作為対照試験により,冠状動脈造影法により測定する冠動脈アテローム硬化の進行に関する魚油補給の効果を調査された。冠動脈疾患患者59人の研究では,オリーブ油と比較して,EPA+DHAを6 g/日に相当する魚油を補給された2年後の有効性は認められなかったが (140),223患者による大規模試験では,EPA+DHAを3ヵ月間3.3 g/日補給,及び追加で21ヵ月間1.65 g/日補給にすることより,冠動脈硬化の進行において,対照群より少し減少が認められた (141)。多くの無作為対照試験により,経皮的冠動脈形成術(PTCA)後の冠動脈再狭窄に及ぼす魚油補給の効果が調査された。12例の無作為対照試験の結果を結合させたメタアナリシスにより,魚油の補給が,冠動脈再狭窄を14%減少させたが,この減少は統計的有意性には至らなかった (142)。冠動脈再狭窄試験における魚油の補給は,2.6~6.0 g/日の範囲であった。
要約
CHDと診断された患者における無作為対照試験結果からは,食事からとサプリメントによるω-3脂肪酸について有益な効果が示唆されている。これらの試験結果に基づき,米国心臓病協会は,CHD診断患者は,約1 g/日のEPA+DHAを摂取することを推奨している(下記「推奨摂取量」参照)(143)。
糖尿病
心血管系疾患は,糖尿病(DM)患者の主な死亡原因である。高トリグリセライド血症(血清中のトリグリセライド >200 mg/dl)は,タイプ2糖尿病患者において共通する脂質代謝異常であり,多くの無作為対照試験から,糖尿病者において,魚油の補給が血清中のトリグリセライドレベルを有意に低下させることが認められている(上記「血中トリグリセライド」参照)(144)。初期の管理されていない試験からは,魚油の補給が血中グルコース(血糖)制御に悪性の影響を及ぼすとの懸念が提起されたが (145,146),無作為の管理された試験では,魚油補給が長期の血糖値制御に悪性の影響を及ぼすことは概して認められていない (147)。800人以上の糖尿病患者がかかわる18例の無作為対照試験結果の系統的レビューから,魚油の補給が,血清中トリグリセライドを有意に低下させ,特に高トリグリセライド血症患者で低下が有意であった (144)。2型糖尿病やメタボリックシンドロームの人における18例の無作為対照試験のメタアナリシスでは,魚油補給が,対照群との比較で31 mg/dlまで血清中トリグリセライドを減少させることが認められたが,血清中コレステロール濃度,空腹時グルコース濃度またはヘモグロビンA1c濃度には影響がみられなかった (147)。より最近の2型糖尿病での無作為対照試験のメタアナリシスでは,ω-3脂肪酸補給が,血清中トリグリセライド濃度を25%まで低下させることが認められた (148)。一方で,魚油補給は,LDLコレステロールレベルをわずかに増加させていた (144,148,149)。魚油補給が,糖尿病における心血管系疾患転帰に及ぼす影響を調査した管理された試験はほとんどないが,2型糖尿病と診断され研究開始時点で心血管系疾患やがんを患っていなかった5,103女性を追跡した前向き研究において,16年の追跡期間を通して,魚の高い摂取量が,CHDリスクの有意な減少と相関がみられた (150)。従って,EPAとDHA摂取量の増加は,糖尿病の人,特に血清中トリグリセライドが高い人には有効であるかもしれない (151)。さらに,3 mg/日以下の日常的なEPA+DHA摂取は,糖尿病における長期の血糖コントロールに悪性の影響を及ぼすという証拠はほとんどない (144,152)。米国糖尿病協会は,糖尿病患者は,週に2~3回,3オンスの魚料理を摂取することによって,ω-3脂肪酸摂取量を増やすことを推奨している (153)。
炎症性疾患
リウマチ性関節炎
リウマチ性関節炎患者における無作為対照試験の3例のメタアナリシスにおいて,魚油補給が,身体検査における関節の痛みを有意に減少させたことが認められた (147,154,155)。これらのメタアナリシスで最も新しいものでは,痛みの程度の改善や朝硬直の期間とω-3 PUFA補給との間にも相関が示された (155)。概して,臨床的な有効性は, EPA+DHAの2.7 g/日の最小用量で認められ,少なくとも12週間の服用までは効果が現われなかった (155)。これらのメタアナリスの2例は,魚油補給が炎症の指標である赤血球沈降速度(ESR)に及ぼす影響も評価された (147,154)。魚油補給は,ESRに有意な影響は認めなかった。長鎖ω-3脂肪酸補給が,リウマチ性関節炎患者における非ステロイド系抗炎症薬(NSAID)やコルチコステロイドの使用に及ぼす影響を試験した7例の研究のうち6例により,抗炎症薬の必要量を減らすことが確認された (147)。
炎症性腸疾患
長鎖ω-3脂肪酸補給についての臨床試験から,炎症性腸疾患患者においては,有益な効果がリウマチ性関節炎患者より少ないことが一致している。クローン病患者における魚油補給についての2例の無作為対照試験では有効性は報告されていないが (156,157),一例の試験から,EPA+DHAを2.7 g/日補給されたクローン病患者が,有意に高い比率で,対照群より12ヵ月間寛解(症状が好転すること)が持続した (158)。クローン病の子供38人(5~16歳)における無作為対照試験において,標準的な5-アミノサリチル酸治療に加えてω-3 PUFA(EPA 1.2 g/日とDHA 0.6 g/日)を補給したとき,1年間の再発率が有意に減少した (159)。潰瘍性大腸炎患者でEPA+DHA補給(3~12ヵ月間 4.2~5.4 g/日)した無作為対照試験で,体重増加,コルチコステロイド服用の減少,疾病程度の改善及び組織学的症状の改善など,少なくとも一つの転帰尺度に有意な改善が報告された (160-162)。対照的に,寛解した潰瘍性大腸炎患者へのEPA+DHAの5.1 g/日補給は,2年間の再発率に有意な変化を示さなかった (163)。長鎖ω-3脂肪酸の補給が潰瘍性大腸炎にどのような治療効果を示すかは,さらに研究が必要である (164)。
喘息
AA(20:4n-6)由来の炎症誘発性エイコサノイド(ロイコトリエン)は,喘息の病理に重要な役割を持つと考えられている (17)。ω-3脂肪酸摂取量を増やすと,AA由来ロイコトリエン(炎症に関与する不飽和脂質メディエーター)生成を減少させることが認められたため,喘息におけるω-3脂肪酸補給の効果について,多くの臨床試験が行われた。ω-3脂肪酸補給が喘息患者における炎症性メディエーターの産生を低減するといういくつかの証拠があるが (165,166),管理された試験において,ω-3脂肪酸補給が臨床的に重度の喘息を低減させるという証拠は不一致がみられる (167)。長鎖ω-3脂肪酸補給の喘息である成人や子供についての無作為対照試験の系統的レビューからは,肺機能検査,喘息症状,医薬品使用または気管支過敏症など,臨床試験結果に一貫した影響を認めなかった (168-171)。
イムノグロブリンA腎症(IgA腎症)
イムノグロブリンA(IgA)腎症は,腎糸球体へのIgA沈着により起こる腎臓障害である。IgA腎症の原因は不明であるが,進行性の腎不全が最終的に患者の15~40%で発症する (171)。腎糸球体のIgA沈着は炎症性メディエーターの産生増加により起こるため,ω-3脂肪酸補給は,炎症反応を調節し腎機能を保護できる可能性がある。複数機関による無作為対照試験において,IgA腎症患者に魚油(DHA 1.8 g/日+DHA 1.2 g/日)を2年間補給することにより,有意な腎機能の減退を遅らせることが報告された (172)。2年の処置期間で,33%の対照群において,血清中クレアチニンの50%増加(すなわち,腎機能低下の証拠)がみられ,魚油投与群では機能低下は6%だけであった。これらの結果は,平均6年の追跡で持続したが (173),比較的高い用量の魚油では改善が認められなかった (174)。さらに小規模の2年間試験で,低用量のω-3脂肪酸(EPA 0.85 g/日+DHA 0.57 g/日)が,高リスクのIgA腎症患者における腎疾患の進行を遅らせた (175)。対照的に,いくつかの研究では,IgA腎症患者におけるω-3 PUFA補給の有意な効果は認められなかった (176-179)。興味深いことに,6ヵ月間の魚油補給(EPA+DHA 3 g/日)は,IgA腎症患者において,炎症性メディエーターの尿中排泄を減少させなかった (180)。魚油補給についての無作為対照試験の2例のメタアナリシスから,IgA腎症患者全体において,統計的有意な有効性を見出せなかった (181,182)。利用できる無作為対照試験の一致しない結果から,魚油補給が,成人や子供において,IgA腎症の進行を防止できるかどうか明らかではない (147)。
大うつ病と双極性障害(躁うつ病)
異なる国々の生態学的研究データからは,水産食品の摂取と大うつ病 (183) と双極性障害 (184) の国内発生率との間に逆相関があることが示唆されている。いくつかの小規模研究では,うつ病を病んでいる人の血漿 (185-187) 及び脂肪組織(脂肪)(188) 中のω-3脂肪酸濃度が,対照群より低いことが認められた。ω-3脂肪酸摂取量がうつ病の発症にどのように影響するかは不明であるが,神経伝達系の調節やエイコサノイド産生が,可能性のあるメカニズムとして提案されている (189)。うつ病における長鎖ω-3脂肪酸による補給についての無作為対照試験の結果は,様々である。うつ病治療を受けている人の治療に魚油サプリメント(8g/日)を加えた場合,同じ量のオリーブ油を12週間加えたときと比較し,有意な効果はなかった (190)。大うつ病と診断された患者において,4ヵ月の魚油補給(DHA 2.2 g/日+EPA 0.6 g/日)は,標準的治療以上のいかなる効果も得られなかった (191)。軽度から中度のうつ病者において,低用量(DHA 0.85 g/日+EPA 0.63 g/日)を,12週間摂取したとき効果はみられなかった (192)。2 g/日のDHAを6週間補給した場合,大うつ病治療において,対照群より有意に良好な効果はみられなかった (193)。一方,大うつ病と診断された中国人患者における小規模の管理された試験において,EPA+DHAを6.6 g/日で8週間補給したとき,ハミルトンうつ病評価尺度のスコアが対照群より改善された (194)。もう一つの小規模無作為対照試験において,境界型人格障害と診断された女性30人が試験され,8週間EPAエチルを1 g/日で任意に処置された女性20人が,プラセボ処置された任意の10人よりうつ症状が少し改善された (195)。さらに,最近の予備試験結果から,ω-3脂肪酸補給が,大うつ病の子供の治療に有用であることが示唆された (196)。
単極性うつ病と双極性障害は,両方とも大うつ病を発生するが,異なる精神状態と考えられる。双極性障害患者に高用量のEPA(6.2 g/日)とDHA(3.4 g/日)による効果を調査した無作為対照試験において,EPA+DHAを補給された人は,オリーブ油の対照より,4ヵ月の観察期間において症状回復期間が有意に長いことが認められた (197)。EPA+DHAを補給された患者もまた,プラセボよりうつ状態が軽減された。しかしながら,4週間EPAエチルを6 g/日服用した患者が,いかなる双極性障害からの回復も経験しなかった報告もある (198)。EPAの低用量は,双極性障害を治療する際に,より有効である場合がある。小規模の研究において,EPAを1.5g/日または2g/日,6ヵ月服用した患者には,双極性障害を伴ううつ病に若干の回復があることが明らかになった (199)。双極性の人における12週間の二重盲検プラセボ対照試験により,EPAエチルを1 g/日または2 g/日のいずれかを摂った人は,うつ症状の有意な改善を経験したが,プラセボ群と比較し,どちらの試験群も躁状態の計測に差はなかった (200)。さらに,いくつかの最近の無作為対照試験のメタアナリシスでは,ω-3 PUFA補給が,単極性うつ病や双極性うつ病の治療に有効であると結論されている (201, 202)。しかしながら,別の系統的レビューやメタアナリシスでは,うつ病にω-3 PUFA補給を用いることについての示唆はほとんどないと結論された (203)。大うつ病及び双極性障害に関する長鎖ω-3脂肪酸補給の効果を検証するために,大規模な長期無作為対照試験が必要である。
統合失調症(精神分裂病)
限られた数の統合失調症患者の赤血球細胞 (204, 205) 及び脳 (206) 中のω-3脂肪酸レベル減少についての知見は,管理されていない補給研究の結果 (207) とともに,統合失調症のための通常の抗精神薬の補助として,長鎖ω-3脂肪酸サプリメント使用についての関心を生み出した。45人の統合失調症患者による予備的試験から,後遺症の軽減において,標準的な抗精神治療にEPA 2 g/日を加えることが,DHA 2 g/日の補完やプラセボより優っていたことが認められた (208)。再発を起こした統合失調症患者にEPA補給を単独で治療に用いた場合,EPAを2 g/日補給された患者の14人中の8人が,12週間の試験期間の終わりまで抗精神薬投与を必要とし,プラセボ群では12人中12人が必要とした (208)。統合失調症患者に標準的な抗精神薬治療の補助としてEPAエチルを用いた無作為対照試験の結果は,いくらか統一性を欠いていた。ある試験では,標準の抗精神薬治療に12週間EPAエチルを3 g/日追加したとき,症状が改善され,運動異常(ジスキネジア)のスコアが減少し (209),類似の12週間試験では,EPAエチル2 g/日で運動異常のある患者に効果はみられなかった (210)。別の試験では,16週間EPAエチルを3 g/日補給した場合に,症状,情緒または認知機能などの改善にプラセボ群と変化がなかった (211)。EPAエチルを1,2,4 g/日で他の治療薬に添加して比較したプラセボ対照試験において,EPAエチルの補給は,抗精神薬クロザピン投与されている統合失調症患者の症状を改善したが,他の薬物投与群では改善はみられなかった (212)。数少ない証拠から,EPA補給が,統合失調症患者における抗精神薬治療の補助に有用であることが示唆されているが,臨床的に関連する状態変化を扱う大規模な長期試験が必要である (213)。
アルツハイマー病と認知症
いくつかの疫学研究が,DHA状態の減少をアルツハイマー病や他の認知症と関連付けている(上記)。動物実験での結果は有望ではあるが (214),DHA補給が,人におけるアルツハイマー病治療に有用かどうかはわかっていない。最近の,軽度から中程度のアルツハイマー病患者295人による二重盲検プラセボ対照試験では,18ヵ月間,2 g/日のDHA補給が対照と比べ認知機能の有効性は認められなかった (215)。
摂取源
食品からの摂取源
ω-6脂肪酸
リノール酸(LA):
LAの摂取源は,大豆,ベニバナなどの植物油,コーン油,ナッツ類,種実類並びにいくつかの野菜である。米国の食事調査では,平均的な成人のLA摂取量は,男性で12~17 g/日,女性で9~11 g/日である (1)。LAが多く含まれるいくつかの食品を下表に示した。
| 食品 | 一食 | リノール酸(g) |
|---|---|---|
| ベニバナ油 | スプーン1杯 |
10.1
|
| ヒマワリ種子(油焙煎) | 1オンス |
9.7
|
| 松の実 | 1オンス |
9.4
|
| ヒマワリ油 | スプーン1杯 |
8.9
|
| コーン油 | スプーン1杯 |
7.3
|
| 大豆油 | スプーン1杯 |
6.9
|
| ペカン(油焙煎) | 1オンス |
6.4
|
| ブラジルナッツ | 1オンス |
5.8
|
| ゴマ油 | スプーン1杯 |
5.6
|
アラキドン酸(AA):
動物は,植物と違いLAをAAに変換する。従って,AAは,肉,家禽類及び卵に少量存在する。
ω-3脂肪酸
α-リノレン酸(ALA):
亜麻仁,クルミ及びそれらの油は,最も多いALA摂取源である。キャノーラ油(菜種油)も優れたALA摂取源である。米国の食事調査から,成人の平均摂取量は男性1.2~1.6 g/日,女性で0.9~1.1 g/日である (1)。ALAを多く含むいくつか食品を下表に示した。
| 食品 | 一食 | α-リノレン酸(g) |
|---|---|---|
| 亜麻仁油 | スプーン1杯 |
7.3
|
| クルミ(英国) | 1オンス |
2.6
|
| 亜麻仁種子(粉末) | スプーン1杯 |
1.6
|
| クルミ油 | スプーン1杯 |
1.4
|
| キャノーラ油 | スプーン1杯 |
1.3
|
| 大豆油 | スプーン1杯 |
0.9
|
| マスタードオイル | スプーン1杯 |
0.8
|
| 豆腐(包装) | カップ1/2 |
0.7
|
| Tofu, firm | 1オンス |
0.6
|
エイコサペンタエン酸(EPA)とドコサヘキサエン酸(DHA):
油の多い魚が主要なEPAとDHA摂取源である。米国の食事調査から,平均的な成人のEPA摂取量は0.04~0.07 g/日,DHAの成人平均摂取量は0.05~0.09 g/日の範囲である (1)。ω-3脂肪酸が豊富な卵類も米国では入手できる。EPA及びDHAが多く含むいくつかの食品を下表に示した。
| 食品 | 一食 | EPA(g) | DHA(g) | EPA+DHAを1g供給する量 |
|---|---|---|---|---|
| ニシン(太平洋) | 3オンス* |
1.06
|
0.75
|
1.5オンス
|
| サケ(タイヘイヨウサケ) | 3オンス |
0.86
|
0.62
|
2オンス
|
| イワシ(太平洋) | 3オンス |
0.45
|
0.74
|
2.5オンス
|
| サケ(大西洋) | 3オンス |
0.28
|
0.95
|
2.5オンス
|
| カキ(太平洋) | 3オンス |
0.75
|
0.43
|
2.5オンス
|
| サケ(ベニザケ) | 3オンス |
0.45
|
0.60
|
3オンス
|
| ニジマス | 3オンス |
0.40
|
0.44
|
3.5オンス
|
| ビンチョウマグロ(缶詰) | 3オンス |
0.20
|
0.54
|
4オンス
|
| アメリカイチョウガニ | 3オンス |
0.24
|
0.10
|
9オンス
|
| ライトツナ(缶詰) | 3オンス |
0.04
|
0.19
|
12オンス
|
| *魚の3オンスは,大体トランプ一式の大きさ | ||||
EPAとDHAの生合成
人は,一連の脱飽和反応と炭素鎖延伸反応により,LAからAAを,ALAからEPAとDHAを合成することができる(「代謝及び生体利用能」参照)。
サプリメント
ω-6脂肪酸
ルリジサ種子油,月見草油,カシス種子油は,γ-リノレン酸(GLA)が多く含まれ,しばしばGLAサプリメントまたは必須脂肪酸サプリメントとして販売される (217)。
ω-3脂肪酸
亜麻仁油(flax seed oil; flax oilまたはlinseed oilともいわれる)は,ALAサプリメントとして市販されている。多くの魚油が,ω-3脂肪酸サプリメントとして市場に出ている。EPAとDHAのエチルエステル(EPAエチル,DHAエチル)は,長鎖ω-3脂肪酸が濃縮されたものである。EPAやDHAの含有量が,魚油やエチルエステル製剤中で変動することが予想されるため,特定サプリメントのEPA含量やDHA含量を測定した表示を読む必要がある。藻類やカビ類に由来するDHAサプリメントも販売されている。全てのω-3脂肪酸サプリメントは,食事とともに摂取するとより効果的に吸収される。一日用量を2~3回に小分けすると,胃腸内の副作用リスクが軽減される(下記「安全性」参照)。タラ肝油はEPAとDHAの豊富な摂取源であるが,いくつかのタラ肝油製剤は,既成ビタミンA(レチノール)を過剰に含有している (217)。
乳児用調製乳
2001年に,FDAは,米国内の乳児用調製乳へのDHAとAA添加の許可を開始した (218)。現在,製造者は,乳児用調製乳のラベルにDHA及びAAの添加量を表示することは要求されていない。しかしながら,大部分の乳児用調製乳の製造者はこの表示をしている。米国において製剤に添加する量は,DHAが8~17 mg/100 カロリー(5 液量オンス),AAが16~34 mg/100 カロリーの範囲である。例えば,DHA強化粉ミルクを毎日20 液量オンス飲む乳児は,DHAを32~68 mg/日,AAを64~136 mg/日摂取することになる。
安全性
有害作用(副作用)
γ-リノレン酸(18:3n-6)
γ-リノレン酸サプリメントは,一般に許容されており,重大な副作用は,12ヵ月間で最大2.8 g/日までの用量で認められていない (219)。ルリジサ種子油,月見草油及びカシス種子油の高用量は,胃腸の不調,軟便及び下痢を引き起こす可能性がある (217)。月見草オイルサプリメントが,診断未確定の側頭葉てんかんの人に発作活性を誘発する症例報告があるため (220),発作病歴や発作障害のある人は,月見草オイルなどのγ-リノレン酸が多い油を避けることが,一般に推奨されている (217)。
α-リノレン酸(18:3n-3)
亜麻仁油は一般的に容認されているが,高用量では軟便や下痢を起こす可能性がある (221)。アレルギー反応及びアナフィラキシー反応が,亜麻仁や亜麻仁油摂取により報告されている (222)。
エイコサペンタエン酸(20:5n-3)及びドコサヘキサエン酸(22:6n-3)
魚油やその他のEPAやDHAサプリメントを服用した人において,重大な有害反応は報告されていない。魚油やEPAとDHAサプリメントの最も一般的な有害作用は,生臭い後味である。げっぷや胸焼けも報告されている。さらに,高用量では吐き気や軟便を引き起こす可能性がある。
多量出血の可能性:ω-脂肪酸,特にEPAとDHAの高摂取が出血時間を長くする可能性はよく研究されており,ω-3脂肪酸の心臓予防効果に関係しているかもしれない。過剰に長い出血時間や出血性脳卒中の発生率増加が,EPA+DHAの摂取量が極めて高い(6.5 g/日)グリーンランドエスキモーの人で認められているが,EPA及びDHAの高摂取が,これらの観察結果に関与する唯一の因子であるかどうかは不明である (1)。米国FDAは,最大3 g/日までの長鎖ω-3脂肪酸(EPAとDHA)摂取量が,食事中の含有で一般に安全とみなされる(GRAS)と規定し,利用できる証拠からは,3 g/日以下の摂取量では,臨床的に有意な出血を起こすことはないと考えられる (3)。医薬品協会は,ω-3脂肪酸の耐容上限摂取量(UL)を設定していないが,EPAやDHAサプリメントの使用による注意は,特に過剰出血リスクの高い人に向けられている(「薬物と栄養成分相互作用」参照)(1)。
免疫抑制の可能性:ω-3脂肪酸摂取量が多いことから起こる炎症反応の抑制は,炎症性疾患や自己免疫性疾患の人には有効であるが,ω-3脂肪酸の抗炎症効果のある用量は,病原菌を破壊する免疫系の作用を低下させる可能性がある (223)。生体外(ex vivo)免疫細胞機能をベースラインとω-3脂肪酸(主にEPAとDHA)の抗炎症作用量補給した人とで比較した研究において,EPA 0.9 g/日とDHA 0.6 g/日ほどの低用量で免疫抑制作用が確認された (1)。これらの結果がin vivoでの免疫反応の損傷へ適用できるかどうか不明ではあるが,免疫系を損なっている人でω-3脂肪酸補給をしようとする場合,注意が必要である。
乳児用調製乳
DHA強化乳児用調製乳についての初期研究で,EPAやDHAの多い魚油がDHA供給源として用いられた。しかしながら,魚油を添加した調製乳を飲んだ早産児数名が,血漿中のAA濃度を減少させ,発育遅延と相関がみられた (224)。この作用は,高濃度のEPAが正常な発育に必須のAA合成を阻害する作用があることに起因していた。その結果,EPAは排除され,AAがDHA強化乳へ添加された。現在米国で利用できる乳児用調製乳は,魚油というよりはむしろ藻類やカビに由来するAAとDHAだけが含まれている。無作為対照試験からは,最大1年まで,AAやDHAを強化された調製乳を授乳された乳児において,発育に関する有害な影響は認められていない (36,37)。
妊娠期と授乳期
ルリジサ種子油,月見草油,カシス種子油及び亜麻仁油などω-3及びω-6脂肪酸サプリメントの安全性は,妊娠期や授乳期の女性については確認されていない (217)。妊娠時及び授乳時における魚油補給についての研究からは,いかなる重大な有害影響は報告されていない(「魚及びサプリメントの汚染物質」参照)。
魚中の汚染物質
魚種の中には,メチル水銀,PCBsまたは他の環境汚染物質を有意なレベルで含有するものがある (61)。一般に,メカジキのような比較的大きな捕食性の魚は,これらの汚染物質をかなり高レベル含有する傾向がある。調理前に皮膚,脂肪及び内臓を除去し,調理中に魚から脂肪を排出させると,PCBsのような多くの脂溶性汚染物質による曝露が低減される (225)。しかしながら,メチル水銀は魚の筋肉に認められるため,これらの調理措置ではメチル水銀曝露を低減できない。有機水銀化合物は毒性があり,過剰曝露は,脳や腎臓の障害を起こす可能性がある。発育中の胎児,乳児及び幼児は特に脳における水銀の毒性作用を受けやすい。メチル水銀による曝露を少なくするために,米国の保健社会福祉省(DHHS)及び環境保護庁(EPA)は,妊娠可能な女性,妊婦及び母乳授乳女性について,次の合同推奨を行った (170)。
1) 高レベルでメチル水銀を含むサメ,メカジキ,大きなサバまたはアマダイ(ゴールデンバス,ゴールデンスナッパーとも呼ばれる)を食べないこと。
2) 水銀の少ない多種の魚を週12オンス(平均2食)以下で食べること。
- 水銀が少なくて最もよく食べられている5種の魚は,マグロ缶詰,エビ,サケ,ナマズ及びタラ(ポロック)である。
- シロ(ビンチョウ)マグロ缶詰及びマグロステーキの摂取は,週6オンス(平均1食)までに制限する。
3) 地方の湖,河川及び近海で友人や家族が捕獲した魚の安全性に関して地方当局に確認すること。
幼児に魚を食べさせる場合,DHHSとEPAは上記ガイドラインに従うが,平均で3オンスのような,より少量を食事に出すことを推奨している。
魚中のメチル水銀に関するFDA/EPA消費者委員会の追加情報は,オンライン冊子で参照できる。市販魚介類中の水銀レベルについての追加情報は,FDAから入手可能である。
サプリメント中の汚染物質
魚油由来のω-3脂肪酸がメチル水銀,PCBs及びダイオキシン類を含む可能性に関する懸念は生ずるが,米国のいくつかの試験所の分析では,市販されているω-3脂肪酸サプリメントにメチル水銀,PCBs及びダイオキシン類は含まれないことが確認されている (226-228)。ω-3脂肪酸サプリメント中にメチル水銀が存在しないことは,水銀が魚の脂肪よりは筋肉に蓄積されやすいという事実によって説明できる (3)。一般に,魚体の油は,魚の肝油よりPCBsなどの脂溶性汚染物質レベルは低い。さらに,より高度に精製,脱臭された魚油もまた,PCBsレベルが低い (229)。潜在的に肝毒性があり発がん物質であるピロリジジンアルカロイド類は,ルリジサ植物の各部位で認められる。ルリジサ油サプリメントを摂取する人は,ピロリジジンアルカロイドを含まないことが証明された製品を使用すべきである (217)。
薬剤との相互作用
月見草油やルリジサ種子油などのγ-リノレン酸サプリメントは,クロルプロマジンのようなフェノチアジン系薬物治療を受けている人に発作リスクを高める可能性がある (220)。高用量のカシス種子油,ルリジサ種子油,月見草油,亜麻仁油及び魚油は,血小板凝集を阻害するため,これらのサプリメントは,抗凝血剤治療を受けている人には注意して使用すべきである。特に,アスピリン,クロピドグレル(Plavix),ダルテパリン(Fragmin),ジピリダモール(Persantine),エノキサパリン(Lovenox),ヘパリン,チクロピジン(Ticlid)及びワルファリン(Coumadin)などの血液凝固防止剤と併せて,長鎖ω-3脂肪酸(EPAとDHA)サプリメントや魚油を摂取する人は,標準的なプロトロンビン時間アッセイ(INR)を用いて,その血液凝固状態を監視する必要がある。一つの小規模研究では,3 g/日または6 g/日の魚油は,4週間の間ワルファリン投与患者10人においてINR値に影響を与えないことが確認されている (230)。一方,魚油用量を1 g/日から2 g/日へ2倍にしたとき,ワルファリン用量の減少が必要であった人の症例報告もある (231)。
栄養成分との相互作用
ビタミンE
体外において,PUFAはSFAより容易に酸敗(酸化)する。ビタミンEなどの脂溶性酸化防止剤は,PUFAの酸化防止に重要な役割を持つ。体内では,動物実験と人による限られた試験結果から,脂質過酸化を防止するために必要なビタミンE量がPUFA摂取により増加することが示唆されている (232)。広く用いられているビタミンEの推奨摂取量の一つは,食事からのPUFAのgあたり,α-トコフェロール0.6 mgである。この推奨量は,小規模な男性による研究と米国食事におけるα-トコフェロールとLAの比率に基づいており,より包括的な研究で検証されてはいない。EPAとDHAは体外では容易に酸化されるが,EPAとDHAが,体内で酸化的損傷を受けやすいかどうか今のところ不明である (233)。高いビタミンE摂取量が,EPAとDHAの摂取量を増やしととき,酸化的損傷のバイオマーカーを減少させることは認められていないが (234,235),PUFA摂取量,特にω-3 PUFA摂取量の増加は,ビタミンE摂取量の増加を伴わせるべきと考えている専門家もいる (1)。
推奨摂取量
米国医薬品協会(US Institute of Medicine)
2002年に,米国医薬品協会の食品栄養委員会は,ω-6及びω-3脂肪酸についての適正摂取量(AI)を設定した。それを下表に示す (1)。
| 人生期 | 年齢 | 摂取源 | 男性(g/日) | 女性(g/日) |
|---|---|---|---|---|
| 乳児 | 0-6ヵ月 | ω-6 PUFA* | 4.4 | 4.4 |
| 乳児 | 7-12ヵ月 | ω-6 PUFA* | 4.6 | 4.6 |
| 幼児 | 1-3歳 | LA** | 7 | 7 |
| 子供 | 4-8歳 | LA | 10 | 10 |
| 子供 | 9-13歳 | LA | 12 | 10 |
| 青少年 | 14-18歳 | LA | 16 | 11 |
| 成人 | 19-50歳 | LA | 17 | 12 |
| 成人 | 51歳以上 | LA | 14 | 11 |
| 妊婦 | 全年齢群 | LA | - | 13 |
| 授乳女性 | 全年齢群 | LA | - | 13 |
|
*母乳中に存在する様々なω-6多価不飽和脂肪酸(PUFA)が,乳児に対するAIに寄与している。 ** LA;リノール酸 |
||||
| 人生期 | 年齢 | 摂取源 | 男性(g/日) | 女性(g/日) |
|---|---|---|---|---|
| 乳児 | 0-6ヵ月 | ALA, EPA, DHA* |
0.5
|
0.5
|
| 乳児 | 7-12ヵ月 | ALA, EPA, DHA |
0.5
|
0.5
|
| 幼児 | 1-3歳 | ALA |
0.7
|
0.7
|
| 子供 | 4-8歳 | ALA |
0.9
|
0.9
|
| 子供 | 9-13歳 | ALA |
1.2
|
1.0
|
| 青少年 | 14-18歳 | ALA |
1.6
|
1.1
|
| 成人 | 19歳以上 | ALA |
1.6
|
1.1
|
| 妊婦 | 全年齢群 | ALA |
-
|
1.4
|
| 授乳女性 | 全年齢群 | ALA |
-
|
1.3
|
| *母乳中に存在する全てのω-3多価不飽和脂肪酸が,乳児に対するAIに寄与している。ALA;α-リノレン酸,EPA;エイコサペンタエン酸,DHA;ドコサヘキサエン酸 | ||||
国際的な推奨
欧州委員会は,ω-6脂肪酸摂取量をエネルギーの4~8%,ω-3脂肪酸摂取量をALA 2g/日,長鎖ω-3脂肪酸(EPAとDHA)摂取量200 mg/日を推奨している (236)。世界保健機構(WHO)は,ω-6脂肪酸をエネルギーの5~8%,ω-3脂肪酸摂取量をエネルギーの1~2%と推奨している (147)。一方,日本脂質栄養学会は,ω-3脂肪酸を,EPA+DHAとして約1 g/日を含み平均2.6 g/日摂取する日本人では,LA摂取量をエネルギーの3~4%まで減らすよう推奨している (237)。
米国心臓病協会の推奨
米国心臓病協会は,CHD履歴のない人は,ALAの多い油や食品を摂取することに加えて,少なくとも週2回は魚(できれば油の多い)を食べることを推奨している (143)。妊婦や子供は,一般に高レベルのメチル水銀を含む魚を避けるべきである(「魚中の汚染物質」参照)。CHDと診断された人は,好ましくは油の多い魚からEPA+DHAを約1 g/日摂取し,医者と相談してEPA+DHAサプリメントも検討することが推奨されている。血清中トリグリセライドを下げる必要のある患者は,医者の管理下でEPA+DHAサプリメントを2~4 g/日摂取してもよい。
Authors and Reviewers
Written in December 2005 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in April 2009 by:
Victoria J. Drake, Ph.D.
Linus Pauling Institute
Oregon State University
Reviewed in April 2009 by:
Donald B. Jump, Ph.D.
Professor of Nutrition and
Exercise Sciences Principal Investigator,
Linus Pauling Institute
Oregon State University
Copyright 2003-2024 Linus Pauling Institute
References
1. Food and Nutrition Board, Institute of Medicine. Dietary Reference Intakes for Energy, Carbohydrate, Fiber, Fat, Fatty Acids, Cholesterol, Protein, and Amino Acids. Washington, D.C.: National Academies Press; 2002. (National Academies Press)
2. Simopoulos AP, Leaf A, Salem N, Jr. Workshop statement on the essentiality of and recommended dietary intakes for omega-6 and omega-3 fatty acids. Prostaglandins Leukot Essent Fatty Acids. 2000;63(3):119-121. (PubMed)
3. Kris-Etherton PM, Harris WS, Appel LJ. Fish consumption, fish oil, omega-3 fatty acids, and cardiovascular disease. Circulation. 2002;106(21):2747-2757. (PubMed)
4. Lichtenstein AH, Jones PJ. Lipids: absorption and transport. In: Bowman BA, Russel RM,eds. Present Knowledge in Nutrition. 8th ed. Washington, D.C.: ILSI Press; 2001:93-103.
5. Nakamura MT, Nara TY. Structure, function, and dietary regulation of delta6, delta5, and delta9 desaturases. Annu Rev Nutr. 2004;24:345-376. (PubMed)
6. Burdge G. Alpha-linolenic acid metabolism in men and women: nutritional and biological implications. Curr Opin Clin Nutr Metab Care. 2004;7(2):137-144. (PubMed)
7. Burdge GC, Jones AE, Wootton SA. Eicosapentaenoic and docosapentaenoic acids are the principal products of alpha-linolenic acid metabolism in young men*. Br J Nutr. 2002;88(4):355-364. (PubMed)
8. Burdge GC, Wootton SA. Conversion of alpha-linolenic acid to eicosapentaenoic, docosapentaenoic and docosahexaenoic acids in young women. Br J Nutr. 2002;88(4):411-420. (PubMed)
9. Giltay EJ, Gooren LJ, Toorians AW, Katan MB, Zock PL. Docosahexaenoic acid concentrations are higher in women than in men because of estrogenic effects. Am J Clin Nutr. 2004;80(5):1167-1174. (PubMed)
10. Muskiet FA, Fokkema MR, Schaafsma A, Boersma ER, Crawford MA. Is docosahexaenoic acid (DHA) essential? Lessons from DHA status regulation, our ancient diet, epidemiology and randomized controlled trials. J Nutr. 2004;134(1):183-186. (PubMed)
11. Cunnane SC. Problems with essential fatty acids: time for a new paradigm? Prog Lipid Res. 2003;42(6):544-568. (PubMed)
12. Stillwell W, Wassall SR. Docosahexaenoic acid: membrane properties of a unique fatty acid. Chem Phys Lipids. 2003;126(1):1-27. (PubMed)
13. Jeffrey BG, Weisingerb HS, Neuringer M, Mitcheli DC. The role of docosahexaenoic acid in retinal function. Lipids. 2001;36(9):859-871. (PubMed)
14. SanGiovanni JP, Chew EY. The role of omega-3 long-chain polyunsaturated fatty acids in health and disease of the retina. Prog Retin Eye Res. 2005;24(1):87-138. (PubMed)
15. Innis SM. Perinatal biochemistry and physiology of long-chain polyunsaturated fatty acids. J Pediatr. 2003;143(4 Suppl):S1-8. (PubMed)
16. Chalon S, Vancassel S, Zimmer L, Guilloteau D, Durand G. Polyunsaturated fatty acids and cerebral function: focus on monoaminergic neurotransmission. Lipids. 2001;36(9):937-944. (PubMed)
17. Calder PC. Dietary modification of inflammation with lipids. Proc Nutr Soc. 2002;61(3):345-358. (PubMed)
18. Price PT, Nelson CM, Clarke SD. Omega-3 polyunsaturated fatty acid regulation of gene expression. Curr Opin Lipidol. 2000;11(1):3-7. (PubMed)
19. Sampath H, Ntambi JM. Polyunsaturated fatty acid regulation of gene expression. Nutr Rev. 2004;62(9):333-339. (PubMed)
20. Jump DB. Fatty acid regulation of gene transcription. Crit Rev Clin Lab Sci. 2004;41(1):41-78. (PubMed)
21. Jump DB, Botolin D, Wang Y, Xu J, Demeure O, Christian B. Docosahexaenoic acid (DHA) and hepatic gene transcription. Chem Phys Lipids. 2008;153(1):3-13. (PubMed)
22. Jump DB. N-3 polyunsaturated fatty acid regulation of hepatic gene transcription. Curr Opin Lipidol. 2008;19(3):242-247. (PubMed)
23. Jump DB, Botolin D, Wang Y, Xu J, Christian B, Demeure O. Fatty acid regulation of hepatic gene transcription. J Nutr. 2005;135(11):2503-2506. (PubMed)
24. Jeppesen PB, Hoy CE, Mortensen PB. Essential fatty acid deficiency in patients receiving home parenteral nutrition. Am J Clin Nutr. 1998;68(1):126-133. (PubMed)
25. Smit EN, Muskiet FA, Boersma ER. The possible role of essential fatty acids in the pathophysiology of malnutrition: a review. Prostaglandins Leukot Essent Fatty Acids. 2004;71(4):241-250. (PubMed)
26. Mascioli EA, Lopes SM, Champagne C, Driscoll DF. Essential fatty acid deficiency and home total parenteral nutrition patients. Nutrition. 1996;12(4):245-249. (PubMed)
27. Stegink LD, Freeman JB, Wispe J, Connor WE. Absence of the biochemical symptoms of essential fatty acid deficiency in surgical patients undergoing protein sparing therapy. Am J Clin Nutr. 1977;30(3):388-393. (PubMed)
28. Jeppesen PB, Hoy CE, Mortensen PB. Deficiencies of essential fatty acids, vitamin A and E and changes in plasma lipoproteins in patients with reduced fat absorption or intestinal failure. Eur J Clin Nutr. 2000;54(8):632-642. (PubMed)
29. Lepage G, Levy E, Ronco N, Smith L, Galeano N, Roy CC. Direct transesterification of plasma fatty acids for the diagnosis of essential fatty acid deficiency in cystic fibrosis. J Lipid Res. 1989;30(10):1483-1490. (PubMed)
30. Holman RT, Johnson SB, Hatch TF. A case of human linolenic acid deficiency involving neurological abnormalities. Am J Clin Nutr. 1982;35(3):617-623. (PubMed)
31. Fedorova I, Hussein N, Baumann MH, Di Martino C, Salem N, Jr. An n-3 fatty acid deficiency impairs rat spatial learning in the Barnes maze. Behav Neurosci. 2009;123(1):196-205. (PubMed)
32. Fedorova I, Salem N, Jr. Omega-3 fatty acids and rodent behavior. Prostaglandins Leukot Essent Fatty Acids. 2006;75(4-5):271-289. (PubMed)
33. Uauy R, Hoffman DR, Peirano P, Birch DG, Birch EE. Essential fatty acids in visual and brain development. Lipids. 2001;36(9):885-895. (PubMed)
34. Larque E, Demmelmair H, Koletzko B. Perinatal supply and metabolism of long-chain polyunsaturated fatty acids: importance for the early development of the nervous system. Ann N Y Acad Sci. 2002;967:299-310. (PubMed)
35. Uauy R, Hoffman DR, Mena P, Llanos A, Birch EE. Term infant studies of DHA and ARA supplementation on neurodevelopment: results of randomized controlled trials. J Pediatr. 2003;143(4 Suppl):S17-25. (PubMed)
36. Simmer K, Patole S. Longchain polyunsaturated fatty acid supplementation in preterm infants. Cochrane Database Syst Rev. 2004;(1):CD000375. (PubMed)
37. Simmer K. Longchain polyunsaturated fatty acid supplementation in infants born at term. Cochrane Database Syst Rev. 2001;(4):CD000376. (PubMed)
38. Eilander A, Hundscheid DC, Osendarp SJ, Transler C, Zock PL. Effects of n-3 long chain polyunsaturated fatty acid supplementation on visual and cognitive development throughout childhood: a review of human studies. Prostaglandins Leukot Essent Fatty Acids. 2007;76(4):189-203. (PubMed)
39. SanGiovanni JP, Parra-Cabrera S, Colditz GA, Berkey CS, Dwyer JT. Meta-analysis of dietary essential fatty acids and long-chain polyunsaturated fatty acids as they relate to visual resolution acuity in healthy preterm infants. Pediatrics. 2000;105(6):1292-1298. (PubMed)
40. O'Connor DL, Hall R, Adamkin D, et al. Growth and development in preterm infants fed long-chain polyunsaturated fatty acids: a prospective, randomized controlled trial. Pediatrics. 2001;108(2):359-371. (PubMed)
41. Fewtrell MS, Morley R, Abbott RA, et al. Double-blind, randomized trial of long-chain polyunsaturated fatty acid supplementation in formula fed to preterm infants. Pediatrics. 2002;110(1 Pt 1):73-82. (PubMed)
42. Fewtrell MS, Abbott RA, Kennedy K, et al. Randomized, double-blind trial of long-chain polyunsaturated fatty acid supplementation with fish oil and borage oil in preterm infants. J Pediatr. 2004;144(4):471-479. (PubMed)
43. Clandinin MT, Van Aerde JE, Merkel KL, et al. Growth and development of preterm infants fed infant formulas containing docosahexaenoic acid and arachidonic acid. J Pediatr. 2005;146(4):461-468. (PubMed)
44. Birch EE, Castaneda YS, Wheaton DH, Birch DG, Uauy RD, Hoffman DR. Visual maturation of term infants fed long-chain polyunsaturated fatty acid-supplemented or control formula for 12 mo. Am J Clin Nutr. 2005;81(4):871-879. (PubMed)
45. Auestad N, Scott DT, Janowsky JS, et al. Visual, cognitive, and language assessments at 39 months: a follow-up study of children fed formulas containing long-chain polyunsaturated fatty acids to 1 year of age. Pediatrics. 2003;112(3 Pt 1):e177-183. (PubMed)
46. Gibson RA, Chen W, Makrides M. Randomized trials with polyunsaturated fatty acid interventions in preterm and term infants: functional and clinical outcomes. Lipids. 2001;36(9):873-883. (PubMed)
47. Birch EE, Garfield S, Castaneda Y, Hughbanks-Wheaton D, Uauy R, Hoffman D. Visual acuity and cognitive outcomes at 4 years of age in a double-blind, randomized trial of long-chain polyunsaturated fatty acid-supplemented infant formula. Early Hum Dev. 2007;83(5):279-284. (PubMed)
48. McCann JC, Ames BN. Is docosahexaenoic acid, an n-3 long-chain polyunsaturated fatty acid, required for development of normal brain function? An overview of evidence from cognitive and behavioral tests in humans and animals. Am J Clin Nutr. 2005;82(2):281-295. (PubMed)
49. Koo WW. Efficacy and safety of docosahexaenoic acid and arachidonic acid addition to infant formulas: can one buy better vision and intelligence? J Am Coll Nutr. 2003;22(2):101-107. (PubMed)
50. Makrides M, Gibson RA. Long-chain polyunsaturated fatty acid requirements during pregnancy and lactation. Am J Clin Nutr. 2000;71(1 Suppl):307S-311S. (PubMed)
51. Onwude JL, Lilford RJ, Hjartardottir H, Staines A, Tuffnell D. A randomised double blind placebo controlled trial of fish oil in high risk pregnancy. Br J Obstet Gynaecol. 1995;102(2):95-100. (PubMed)
52. Olsen SF, Sorensen JD, Secher NJ, et al. Randomised controlled trial of effect of fish-oil supplementation on pregnancy duration. Lancet. 1992;339(8800):1003-1007. (PubMed)
53. Smuts CM, Huang M, Mundy D, Plasse T, Major S, Carlson SE. A randomized trial of docosahexaenoic acid supplementation during the third trimester of pregnancy. Obstet Gynecol. 2003;101(3):469-479. (PubMed)
54. Szajewska H, Horvath A, Koletzko B. Effect of n-3 long-chain polyunsaturated fatty acid supplementation of women with low-risk pregnancies on pregnancy outcomes and growth measures at birth: a meta-analysis of randomized controlled trials. Am J Clin Nutr. 2006;83(6):1337-1344. (PubMed)
55. Olsen SF, Secher NJ, Tabor A, Weber T, Walker JJ, Gluud C. Randomised clinical trials of fish oil supplementation in high risk pregnancies. Fish Oil Trials In Pregnancy (FOTIP) Team. Bjog. 2000;107(3):382-395. (PubMed)
56. Horvath A, Koletzko B, Szajewska H. Effect of supplementation of women in high-risk pregnancies with long-chain polyunsaturated fatty acids on pregnancy outcomes and growth measures at birth: a meta-analysis of randomized controlled trials. Br J Nutr. 2007;98(2):253-259. (PubMed)
57. Koletzko B, Lien E, Agostoni C, et al. The roles of long-chain polyunsaturated fatty acids in pregnancy, lactation and infancy: review of current knowledge and consensus recommendations. J Perinat Med. 2008;36(1):5-14. (PubMed)
58. Helland IB, Smith L, Saarem K, Saugstad OD, Drevon CA. Maternal supplementation with very-long-chain n-3 fatty acids during pregnancy and lactation augments children's IQ at 4 years of age. Pediatrics. 2003;111(1):e39-44. (PubMed)
59. Dunstan JA, Simmer K, Dixon G, Prescott SL. Cognitive assessment of children at age 2(1/2) years after maternal fish oil supplementation in pregnancy: a randomised controlled trial. Arch Dis Child Fetal Neonatal Ed. 2008;93(1):F45-50. (PubMed)
60. Judge MP, Harel O, Lammi-Keefe CJ. Maternal consumption of a docosahexaenoic acid-containing functional food during pregnancy: benefit for infant performance on problem-solving but not on recognition memory tasks at age 9 mo. Am J Clin Nutr. 2007;85(6):1572-1577. (PubMed)
61. Mozaffarian D, Rimm EB. Fish intake, contaminants, and human health: evaluating the risks and the benefits. JAMA. 2006;296(15):1885-1899. (PubMed)
62. Kris-Etherton PM, Hecker KD, Binkoski AE. Polyunsaturated fatty acids and cardiovascular health. Nutr Rev. 2004;62(11):414-426. (PubMed)
63. Shekelle RB, Shryock AM, Paul O, et al. Diet, serum cholesterol, and death from coronary heart disease. The Western Electric study. N Engl J Med. 1981;304(2):65-70. (PubMed)
64. Oh K, Hu FB, Manson JE, Stampfer MJ, Willett WC. Dietary fat intake and risk of coronary heart disease in women: 20 years of follow-up of the nurses' health study. Am J Epidemiol. 2005;161(7):672-679. (PubMed)
65. Ascherio A, Rimm EB, Giovannucci EL, Spiegelman D, Stampfer M, Willett WC. Dietary fat and risk of coronary heart disease in men: cohort follow up study in the United States. BMJ. 1996;313(7049):84-90. (PubMed)
66. Laaksonen DE, Nyyssonen K, Niskanen L, Rissanen TH, Salonen JT. Prediction of cardiovascular mortality in middle-aged men by dietary and serum linoleic and polyunsaturated fatty acids. Arch Intern Med. 2005;165(2):193-199. (PubMed)
67. Sacks FM, Katan M. Randomized clinical trials on the effects of dietary fat and carbohydrate on plasma lipoproteins and cardiovascular disease. Am J Med. 2002;113 Suppl 9B:13S-24S. (PubMed)
68. Mensink RP, Katan MB. Effect of dietary fatty acids on serum lipids and lipoproteins. A meta-analysis of 27 trials. Arterioscler Thromb. 1992;12(8):911-919. (PubMed)
69. Controlled trial of soya-bean oil in myocardial infarction. Lancet. 1968;2(7570):693-699. (PubMed)
70. Dayton S, Pearce ML, Goldman H, et al. Controlled trial of a diet high in unsaturated fat for prevention of atherosclerotic complications. Lancet. 1968;2(7577):1060-1062. (PubMed)
71. Leren P. The Oslo diet-heart study. Eleven-year report. Circulation. 1970;42(5):935-942. (PubMed)
72. Turpeinen O, Karvonen MJ, Pekkarinen M, Miettinen M, Elosuo R, Paavilainen E. Dietary prevention of coronary heart disease: the Finnish Mental Hospital Study. Int J Epidemiol. 1979;8(2):99-118. (PubMed)
73. Frantz ID, Jr., Dawson EA, Ashman PL, et al. Test of effect of lipid lowering by diet on cardiovascular risk. The Minnesota Coronary Survey. Arteriosclerosis. 1989;9(1):129-135. (PubMed)
74. Miettinen M, Turpeinen O, Karvonen MJ, Pekkarinen M, Paavilainen E, Elosuo R. Dietary prevention of coronary heart disease in women: the Finnish mental hospital study. Int J Epidemiol. 1983;12(1):17-25. (PubMed)
75. Harris WS, Mozaffarian D, Rimm E, et al. Omega-6 fatty acids and risk for cardiovascular disease: a science advisory from the American Heart Association Nutrition Subcommittee of the Council on Nutrition, Physical Activity, and Metabolism; Council on Cardiovascular Nursing; and Council on Epidemiology and Prevention. Circulation. 2009;119(6):902-907. (PubMed)
76. Mozaffarian D, Ascherio A, Hu FB, et al. Interplay between different polyunsaturated fatty acids and risk of coronary heart disease in men. Circulation. 2005;111(2):157-164. (PubMed)
77. Hu FB, Stampfer MJ, Manson JE, et al. Dietary intake of alpha-linolenic acid and risk of fatal ischemic heart disease among women. Am J Clin Nutr. 1999;69(5):890-897. (PubMed)
78. Dolecek TA. Epidemiological evidence of relationships between dietary polyunsaturated fatty acids and mortality in the multiple risk factor intervention trial. Proc Soc Exp Biol Med. 1992;200(2):177-182. (PubMed)
79. Pietinen P, Ascherio A, Korhonen P, et al. Intake of fatty acids and risk of coronary heart disease in a cohort of Finnish men. The Alpha-Tocopherol, Beta-Carotene Cancer Prevention Study. Am J Epidemiol. 1997;145(10):876-887. (PubMed)
80. Oomen CM, Ocke MC, Feskens EJ, Kok FJ, Kromhout D. alpha-Linolenic acid intake is not beneficially associated with 10-y risk of coronary artery disease incidence: the Zutphen Elderly Study. Am J Clin Nutr. 2001;74(4):457-463. (PubMed)
81. Albert CM, Oh K, Whang W, et al. Dietary alpha-linolenic acid intake and risk of sudden cardiac death and coronary heart disease. Circulation. 2005;112(21):3232-3238. (PubMed)
82. Mozaffarian D. Does alpha-linolenic acid intake reduce the risk of coronary heart disease? A review of the evidence. Altern Ther Health Med. 2005;11(3):24-30; quiz 31, 79. (PubMed)
83. Wendland E, Farmer A, Glasziou P, Neil A. Effect of alpha linolenic acid on cardiovascular risk markers: a systematic review. Heart. 2006;92(2):166-169. (PubMed)
84. Bemelmans WJ, Lefrandt JD, Feskens EJ, et al. Increased alpha-linolenic acid intake lowers C-reactive protein, but has no effect on markers of atherosclerosis. Eur J Clin Nutr. 2004;58(7):1083-1089. (PubMed)
85. Rallidis LS, Paschos G, Liakos GK, Velissaridou AH, Anastasiadis G, Zampelas A. Dietary alpha-linolenic acid decreases C-reactive protein, serum amyloid A and interleukin-6 in dyslipidaemic patients. Atherosclerosis. 2003;167(2):237-242. (PubMed)
86. Zhao G, Etherton TD, Martin KR, West SG, Gillies PJ, Kris-Etherton PM. Dietary alpha-linolenic acid reduces inflammatory and lipid cardiovascular risk factors in hypercholesterolemic men and women. J Nutr. 2004;134(11):2991-2997. (PubMed)
87. Kris-Etherton PM, Harris WS, Appel LJ. Omega-3 fatty acids and cardiovascular disease: new recommendations from the American Heart Association. Arterioscler Thromb Vasc Biol. 2003;23(2):151-152. (PubMed)
88. Wang C, Harris WS, Chung M, et al. n-3 Fatty acids from fish or fish-oil supplements, but not alpha-linolenic acid, benefit cardiovascular disease outcomes in primary- and secondary-prevention studies: a systematic review. Am J Clin Nutr. 2006;84(1):5-17. (PubMed)
89. Hooper L, Thompson RL, Harrison RA, et al. Risks and benefits of omega 3 fats for mortality, cardiovascular disease, and cancer: systematic review. BMJ. 2006;332(7544):752-760. (PubMed)
90. Kromhout D, Bosschieter EB, de Lezenne Coulander C. The inverse relation between fish consumption and 20-year mortality from coronary heart disease. N Engl J Med. 1985;312(19):1205-1209. (PubMed)
91. Kromhout D, Feskens EJ, Bowles CH. The protective effect of a small amount of fish on coronary heart disease mortality in an elderly population. Int J Epidemiol. 1995;24(2):340-345. (PubMed)
92. Dolecek TA, Granditis G. Dietary polyunsaturated fatty acids and mortality in the Multiple Risk Factor Intervention Trial (MRFIT). World Rev Nutr Diet. 1991;66:205-216. (PubMed)
93. Daviglus ML, Stamler J, Orencia AJ, et al. Fish consumption and the 30-year risk of fatal myocardial infarction. N Engl J Med. 1997;336(15):1046-1053. (PubMed)
94. Yuan JM, Ross RK, Gao YT, Yu MC. Fish and shellfish consumption in relation to death from myocardial infarction among men in Shanghai, China. Am J Epidemiol. 2001;154(9):809-816. (PubMed)
95. Hu FB, Bronner L, Willett WC, et al. Fish and omega-3 fatty acid intake and risk of coronary heart disease in women. JAMA. 2002;287(14):1815-1821. (PubMed)
96. Jarvinen R, Knekt P, Rissanen H, Reunanen A. Intake of fish and long-chain n-3 fatty acids and the risk of coronary heart mortality in men and women. Br J Nutr. 2006;95(4):824-829. (PubMed)
97. Iso H, Kobayashi M, Ishihara J, et al. Intake of fish and n3 fatty acids and risk of coronary heart disease among Japanese: the Japan Public Health Center-Based (JPHC) Study Cohort I. Circulation. 2006;113(2):195-202. (PubMed)
98. Nakamura Y, Ueshima H, Okamura T, et al. Association between fish consumption and all-cause and cause-specific mortality in Japan: NIPPON DATA80, 1980-99. Am J Med. 2005;118(3):239-245. (PubMed)
99. Leaf A, Xiao YF, Kang JX, Billman GE. Prevention of sudden cardiac death by n-3 polyunsaturated fatty acids. Pharmacol Ther. 2003;98(3):355-377. (PubMed)
100. Albert CM, Hennekens CH, O'Donnell CJ, et al. Fish consumption and risk of sudden cardiac death. JAMA. 1998;279(1):23-28. (PubMed)
101. Albert CM, Campos H, Stampfer MJ, et al. Blood levels of long-chain n-3 fatty acids and the risk of sudden death. N Engl J Med. 2002;346(15):1113-1118. (PubMed)
102. Mozaffarian D. Fish and n-3 fatty acids for the prevention of fatal coronary heart disease and sudden cardiac death. Am J Clin Nutr. 2008;87(6):1991S-1996S. (PubMed)
103. Leaf A, Albert CM, Josephson M, et al. Prevention of fatal arrhythmias in high-risk subjects by fish oil n-3 fatty acid intake. Circulation. 2005;112(18):2762-2768. (PubMed)
104. Raitt MH, Connor WE, Morris C, et al. Fish oil supplementation and risk of ventricular tachycardia and ventricular fibrillation in patients with implantable defibrillators: a randomized controlled trial. JAMA. 2005;293(23):2884-2891. (PubMed)
105. Brouwer IA, Zock PL, Camm AJ, et al. Effect of fish oil on ventricular tachyarrhythmia and death in patients with implantable cardioverter defibrillators: the Study on Omega-3 Fatty Acids and Ventricular Arrhythmia (SOFA) randomized trial. JAMA. 2006;295(22):2613-2619. (PubMed)
106. Jenkins DJ, Josse AR, Beyene J, et al. Fish-oil supplementation in patients with implantable cardioverter defibrillators: a meta-analysis. Cmaj. 2008;178(2):157-164. (PubMed)
107. London B, Albert C, Anderson ME, et al. Omega-3 fatty acids and cardiac arrhythmias: prior studies and recommendations for future research: a report from the National Heart, Lung, and Blood Institute and Office Of Dietary Supplements Omega-3 Fatty Acids and their Role in Cardiac Arrhythmogenesis Workshop. Circulation. 2007;116(10):e320-335. (PubMed)
108. American Stroke Association. What is a stroke? http://www.strokeassociation.org/presenter.jhtml?identifier=2528. Accessed 11/25/02.
109. Keli SO, Feskens EJ, Kromhout D. Fish consumption and risk of stroke. The Zutphen Study. Stroke. 1994;25(2):328-332. (PubMed)
110. Gillum RF, Mussolino ME, Madans JH. The relationship between fish consumption and stroke incidence. The NHANES I Epidemiologic Follow-up Study (National Health and Nutrition Examination Survey). Arch Intern Med. 1996;156(5):537-542. (PubMed)
111. Morris MC, Manson JE, Rosner B, Buring JE, Willett WC, Hennekens CH. Fish consumption and cardiovascular disease in the physicians' health study: a prospective study. Am J Epidemiol. 1995;142(2):166-175. (PubMed)
112. Orencia AJ, Daviglus ML, Dyer AR, Shekelle RB, Stamler J. Fish consumption and stroke in men. 30-year findings of the Chicago Western Electric Study. Stroke. 1996;27(2):204-209. (PubMed)
113. Myint PK, Welch AA, Bingham SA, et al. Habitual fish consumption and risk of incident stroke: the European Prospective Investigation into Cancer (EPIC)-Norfolk prospective population study. Public Health Nutr. 2006;9(7):882-888. (PubMed)
114. Iso H, Rexrode KM, Stampfer MJ, et al. Intake of fish and omega-3 fatty acids and risk of stroke in women. JAMA. 2001;285(3):304-312. (PubMed)
115. He K, Rimm EB, Merchant A, et al. Fish consumption and risk of stroke in men. JAMA. 2002;288(24):3130-3136. (PubMed)
116. He K, Song Y, Daviglus ML, et al. Fish consumption and incidence of stroke: a meta-analysis of cohort studies. Stroke. 2004;35(7):1538-1542. (PubMed)
117. Tanaka K, Ishikawa Y, Yokoyama M, et al. Reduction in the recurrence of stroke by eicosapentaenoic acid for hypercholesterolemic patients: subanalysis of the JELIS trial. Stroke. 2008;39(7):2052-2058. (PubMed)
118. Austin MA, Hokanson JE, Edwards KL. Hypertriglyceridemia as a cardiovascular risk factor. Am J Cardiol. 1998;81(4A):7B-12B. (PubMed)
119. Harris WS. n-3 fatty acids and serum lipoproteins: human studies. Am J Clin Nutr. 1997;65(5 Suppl):1645S-1654S. (PubMed)
120. Balk EM, Lichtenstein AH, Chung M, Kupelnick B, Chew P, Lau J. Effects of omega-3 fatty acids on serum markers of cardiovascular disease risk: a systematic review. Atherosclerosis. 2006;189(1):19-30. (PubMed)
121. Harris WS, Kris-Etherton PM, Harris KA. Intakes of long-chain omega-3 fatty acid associated with reduced risk for death from coronary heart disease in healthy adults. Curr Atheroscler Rep. 2008;10(6):503-509. (PubMed)
122. Harris WS, Mozaffarian D, Lefevre M, et al. Towards establishing dietary reference intakes for eicosapentaenoic and docosahexaenoic acids. J Nutr. 2009;139(4):804S-819S. (PubMed)
123. Maccioni RB, Munoz JP, Barbeito L. The molecular bases of Alzheimer's disease and other neurodegenerative disorders. Arch Med Res. 2001;32(5):367-381. (PubMed)
124. Kalmijn S, van Boxtel MP, Ocke M, Verschuren WM, Kromhout D, Launer LJ. Dietary intake of fatty acids and fish in relation to cognitive performance at middle age. Neurology. 2004;62(2):275-280. (PubMed)
125. Kalmijn S, Launer LJ, Ott A, Witteman JC, Hofman A, Breteler MM. Dietary fat intake and the risk of incident dementia in the Rotterdam Study. Ann Neurol. 1997;42(5):776-782. (PubMed)
126. Morris MC, Evans DA, Bienias JL, et al. Consumption of fish and n-3 fatty acids and risk of incident Alzheimer disease. Arch Neurol. 2003;60(7):940-946. (PubMed)
127. van Marum RJ. Current and future therapy in Alzheimer's disease. Fundam Clin Pharmacol. 2008;22(3):265-274. (PubMed)
128. Kyle DJ, Schaefer E, Patton G, Beiser A. Low serum docosahexaenoic acid is a significant risk factor for Alzheimer's dementia. Lipids. 1999;34 Suppl:S245. (PubMed)
129. Conquer JA, Tierney MC, Zecevic J, Bettger WJ, Fisher RH. Fatty acid analysis of blood plasma of patients with Alzheimer's disease, other types of dementia, and cognitive impairment. Lipids. 2000;35(12):1305-1312. (PubMed)
130. Tully AM, Roche HM, Doyle R, et al. Low serum cholesteryl ester-docosahexaenoic acid levels in Alzheimer's disease: a case-control study. Br J Nutr. 2003;89(4):483-489. (PubMed)
131. Schaefer EJ, Bongard V, Beiser AS, et al. Plasma phosphatidylcholine docosahexaenoic acid content and risk of dementia and Alzheimer disease: the Framingham Heart Study. Arch Neurol. 2006;63(11):1545-1550. (PubMed)
132. Burr ML, Fehily AM, Gilbert JF, et al. Effects of changes in fat, fish, and fibre intakes on death and myocardial reinfarction: diet and reinfarction trial (DART). Lancet. 1989;2(8666):757-761. (PubMed)
133. de Lorgeril M, Salen P, Martin JL, Monjaud I, Delaye J, Mamelle N. Mediterranean diet, traditional risk factors, and the rate of cardiovascular complications after myocardial infarction: final report of the Lyon Diet Heart Study. Circulation. 1999;99(6):779-785. (PubMed)
134. Tuttle KR, Shuler LA, Packard DP, et al. Comparison of low-fat versus Mediterranean-style dietary intervention after first myocardial infarction (from The Heart Institute of Spokane Diet Intervention and Evaluation Trial). Am J Cardiol. 2008;101(11):1523-1530. (PubMed)
135. Dietary supplementation with n-3 polyunsaturated fatty acids and vitamin E after myocardial infarction: results of the GISSI-Prevenzione trial. Gruppo Italiano per lo Studio della Sopravvivenza nell'Infarto miocardico. Lancet. 1999;354(9177):447-455. (PubMed)
136. Marchioli R, Barzi F, Bomba E, et al. Early protection against sudden death by n-3 polyunsaturated fatty acids after myocardial infarction: time-course analysis of the results of the Gruppo Italiano per lo Studio della Sopravvivenza nell'Infarto Miocardico (GISSI)-Prevenzione. Circulation. 2002;105(16):1897-1903. (PubMed)
137. Singh RB, Niaz MA, Sharma JP, Kumar R, Rastogi V, Moshiri M. Randomized, double-blind, placebo-controlled trial of fish oil and mustard oil in patients with suspected acute myocardial infarction: the Indian experiment of infarct survival--4. Cardiovasc Drugs Ther. 1997;11(3):485-491. (PubMed)
138. Nilsen DW, Albrektsen G, Landmark K, Moen S, Aarsland T, Woie L. Effects of a high-dose concentrate of n-3 fatty acids or corn oil introduced early after an acute myocardial infarction on serum triacylglycerol and HDL cholesterol. Am J Clin Nutr. 2001;74(1):50-56. (PubMed)
139. Bucher HC, Hengstler P, Schindler C, Meier G. N-3 polyunsaturated fatty acids in coronary heart disease: a meta-analysis of randomized controlled trials. Am J Med. 2002;112(4):298-304. (PubMed)
140. Sacks FM, Stone PH, Gibson CM, Silverman DI, Rosner B, Pasternak RC. Controlled trial of fish oil for regression of human coronary atherosclerosis. HARP Research Group. J Am Coll Cardiol. 1995;25(7):1492-1498. (PubMed)
141. von Schacky C, Angerer P, Kothny W, Theisen K, Mudra H. The effect of dietary omega-3 fatty acids on coronary atherosclerosis. A randomized, double-blind, placebo-controlled trial. Ann Intern Med. 1999;130(7):554-562. (PubMed)
142. Balk E, Chung M, Lichtenstein A, et al. Effects of omega-3 fatty acids on cardiovascular risk factors and intermediate markers of cardiovascular disease. Evid Rep Technol Assess (Summ). 2004;(93):1-6. (PubMed)
143. Lichtenstein AH, Appel LJ, Brands M, et al. Diet and lifestyle recommendations revision 2006: a scientific statement from the American Heart Association Nutrition Committee. Circulation. 2006;114(1):82-96. (PubMed)
144. Montori VM, Farmer A, Wollan PC, Dinneen SF. Fish oil supplementation in type 2 diabetes: a quantitative systematic review. Diabetes Care. 2000;23(9):1407-1415. (PubMed)
145. Glauber H, Wallace P, Griver K, Brechtel G. Adverse metabolic effect of omega-3 fatty acids in non-insulin-dependent diabetes mellitus. Ann Intern Med. 1988;108(5):663-668. (PubMed)
146. Friday KE, Childs MT, Tsunehara CH, Fujimoto WY, Bierman EL, Ensinck JW. Elevated plasma glucose and lowered triglyceride levels from omega-3 fatty acid supplementation in type II diabetes. Diabetes Care. 1989;12(4):276-281. (PubMed)
147. MacLean CH, Mojica WA, Morton SC, et al. Effects of omega-3 fatty acids on lipids and glycemic control in type II diabetes and the metabolic syndrome and on inflammatory bowel disease, rheumatoid arthritis, renal disease, systemic lupus erythematosus, and osteoporosis. Evid Rep Technol Assess (Summ). 2004;(89):1-4. (PubMed)
148. Hartweg J, Farmer AJ, Perera R, Holman RR, Neil HA. Meta-analysis of the effects of n-3 polyunsaturated fatty acids on lipoproteins and other emerging lipid cardiovascular risk markers in patients with type 2 diabetes. Diabetologia. 2007;50(8):1593-1602. (PubMed)
149. Farmer A, Montori V, Dinneen S, Clar C. Fish oil in people with type 2 diabetes mellitus. Cochrane Database Syst Rev. 2001;(3):CD003205. (PubMed)
150. Hu FB, Cho E, Rexrode KM, Albert CM, Manson JE. Fish and long-chain omega-3 fatty acid intake and risk of coronary heart disease and total mortality in diabetic women. Circulation. 2003;107(14):1852-1857. (PubMed)
151. Nettleton JA, Katz R. n-3 long-chain polyunsaturated fatty acids in type 2 diabetes: a review. J Am Diet Assoc. 2005;105(3):428-440. (PubMed)
152. Friedberg CE, Janssen MJ, Heine RJ, Grobbee DE. Fish oil and glycemic control in diabetes. A meta-analysis. Diabetes Care. 1998;21(4):494-500. (PubMed)
153. Franz MJ, Bantle JP, Beebe CA, et al. Evidence-based nutrition principles and recommendations for the treatment and prevention of diabetes and related complications. Diabetes Care. 2003;26 Suppl 1:S51-61. (PubMed)
154. Fortin PR, Lew RA, Liang MH, et al. Validation of a meta-analysis: the effects of fish oil in rheumatoid arthritis. J Clin Epidemiol. 1995;48(11):1379-1390. (PubMed)
155. Goldberg RJ, Katz J. A meta-analysis of the analgesic effects of omega-3 polyunsaturated fatty acid supplementation for inflammatory joint pain. Pain. 2007;129(1-2):210-223. (PubMed)
156. Lorenz R, Weber PC, Szimnau P, Heldwein W, Strasser T, Loeschke K. Supplementation with n-3 fatty acids from fish oil in chronic inflammatory bowel disease--a randomized, placebo-controlled, double-blind cross-over trial. J Intern Med Suppl. 1989;225(731):225-232. (PubMed)
157. Lorenz-Meyer H, Bauer P, Nicolay C, et al. Omega-3 fatty acids and low carbohydrate diet for maintenance of remission in Crohn's disease. A randomized controlled multicenter trial. Study Group Members (German Crohn's Disease Study Group). Scand J Gastroenterol. 1996;31(8):778-785. (PubMed)
158. Belluzzi A, Brignola C, Campieri M, Pera A, Boschi S, Miglioli M. Effect of an enteric-coated fish-oil preparation on relapses in Crohn's disease. N Engl J Med. 1996;334(24):1557-1560. (PubMed)
159. Romano C, Cucchiara S, Barabino A, Annese V, Sferlazzas C. Usefulness of omega-3 fatty acid supplementation in addition to mesalazine in maintaining remission in pediatric Crohn's disease: a double-blind, randomized, placebo-controlled study. World J Gastroenterol. 2005;11(45):7118-7121. (PubMed)
160. Aslan A, Triadafilopoulos G. Fish oil fatty acid supplementation in active ulcerative colitis: a double-blind, placebo-controlled, crossover study. Am J Gastroenterol. 1992;87(4):432-437. (PubMed)
161. Hawthorne AB, Daneshmend TK, Hawkey CJ, et al. Treatment of ulcerative colitis with fish oil supplementation: a prospective 12 month randomised controlled trial. Gut. 1992;33(7):922-928. (PubMed)
162. Stenson WF, Cort D, Rodgers J, et al. Dietary supplementation with fish oil in ulcerative colitis. Ann Intern Med. 1992;116(8):609-614. (PubMed)
163. Loeschke K, Ueberschaer B, Pietsch A, et al. n-3 fatty acids only delay early relapse of ulcerative colitis in remission. Dig Dis Sci. 1996;41(10):2087-2094. (PubMed)
164. De Ley M, de Vos R, Hommes DW, Stokkers P. Fish oil for induction of remission in ulcerative colitis. Cochrane Database Syst Rev. 2007;(4):CD005986. (PubMed)
165. Hodge L, Salome CM, Hughes JM, et al. Effect of dietary intake of omega-3 and omega-6 fatty acids on severity of asthma in children. Eur Respir J. 1998;11(2):361-365. (PubMed)
166. Okamoto M, Mitsunobu F, Ashida K, et al. Effects of dietary supplementation with n-3 fatty acids compared with n-6 fatty acids on bronchial asthma. Intern Med. 2000;39(2):107-111. (PubMed)
167. Wong KW. Clinical efficacy of n-3 fatty acid supplementation in patients with asthma. J Am Diet Assoc. 2005;105(1):98-105. (PubMed)
168. Schachter HM, Reisman J, Tran K, et al. Health effects of omega-3 fatty acids on asthma. Evid Rep Technol Assess (Summ). 2004;(91):1-7. (PubMed)
169. Woods RK, Thien FC, Abramson MJ. Dietary marine fatty acids (fish oil) for asthma in adults and children. Cochrane Database Syst Rev. 2002;(3):CD001283. (PubMed)
170. Reisman J, Schachter HM, Dales RE, et al. Treating asthma with omega-3 fatty acids: where is the evidence? A systematic review. BMC Complement Altern Med. 2006;6:26. (PubMed)
171. Donadio JV, Grande JP. IgA nephropathy. N Engl J Med. 2002;347(10):738-748. (PubMed)
172. Donadio JV, Jr., Bergstralh EJ, Offord KP, Spencer DC, Holley KE. A controlled trial of fish oil in IgA nephropathy. Mayo Nephrology Collaborative Group. N Engl J Med. 1994;331(18):1194-1199. (PubMed)
173. Donadio JV, Jr., Grande JP, Bergstralh EJ, Dart RA, Larson TS, Spencer DC. The long-term outcome of patients with IgA nephropathy treated with fish oil in a controlled trial. Mayo Nephrology Collaborative Group. J Am Soc Nephrol. 1999;10(8):1772-1777. (PubMed)
174. Donadio JV, Jr., Larson TS, Bergstralh EJ, Grande JP. A randomized trial of high-dose compared with low-dose omega-3 fatty acids in severe IgA nephropathy. J Am Soc Nephrol. 2001;12(4):791-799. (PubMed)
175. Alexopoulos E, Stangou M, Pantzaki A, Kirmizis D, Memmos D. Treatment of severe IgA nephropathy with omega-3 fatty acids: the effect of a "very low dose" regimen. Ren Fail. 2004;26(4):453-459. (PubMed)
176. Bennett WM, Walker RG, Kincaid-Smith P. Treatment of IgA nephropathy with eicosapentanoic acid (EPA): a two-year prospective trial. Clin Nephrol. 1989;31(3):128-131. (PubMed)
177. Cheng IK, Chan PC, Chan MK. The effect of fish-oil dietary supplement on the progression of mesangial IgA glomerulonephritis. Nephrol Dial Transplant. 1990;5(4):241-246. (PubMed)
178. Pettersson EE, Rekola S, Berglund L, et al. Treatment of IgA nephropathy with omega-3-polyunsaturated fatty acids: a prospective, double-blind, randomized study. Clin Nephrol. 1994;41(4):183-190. (PubMed)
179. Hogg RJ, Lee J, Nardelli N, et al. Clinical trial to evaluate omega-3 fatty acids and alternate day prednisone in patients with IgA nephropathy: report from the Southwest Pediatric Nephrology Study Group. Clin J Am Soc Nephrol. 2006;1(3):467-474. (PubMed)
180. Branten AJ, Klasen IS, Wetzels JF. Short-term effects of fish oil treatment on urinary excretion of high- and low-molecular weight proteins in patients with IgA nephropathy. Clin Nephrol. 2002;58(4):267-274. (PubMed)
181. Dillon JJ. Fish oil therapy for IgA nephropathy: efficacy and interstudy variability. J Am Soc Nephrol. 1997;8(11):1739-1744. (PubMed)
182. Strippoli GF, Manno C, Schena FP. An "evidence-based" survey of therapeutic options for IgA nephropathy: assessment and criticism. Am J Kidney Dis. 2003;41(6):1129-1139. (PubMed)
183. Hibbeln JR. Fish consumption and major depression. Lancet. 1998;351(9110):1213. (PubMed)
184. Noaghiul S, Hibbeln JR. Cross-national comparisons of seafood consumption and rates of bipolar disorders. Am J Psychiatry. 2003;160(12):2222-2227. (PubMed)
185. Maes M, Christophe A, Delanghe J, Altamura C, Neels H, Meltzer HY. Lowered omega3 polyunsaturated fatty acids in serum phospholipids and cholesteryl esters of depressed patients. Psychiatry Res. 1999;85(3):275-291. (PubMed)
186. Peet M, Murphy B, Shay J, Horrobin D. Depletion of omega-3 fatty acid levels in red blood cell membranes of depressive patients. Biol Psychiatry. 1998;43(5):315-319. (PubMed)
187. Tiemeier H, van Tuijl HR, Hofman A, Kiliaan AJ, Breteler MM. Plasma fatty acid composition and depression are associated in the elderly: the Rotterdam Study. Am J Clin Nutr. 2003;78(1):40-46. (PubMed)
188. Mamalakis G, Tornaritis M, Kafatos A. Depression and adipose essential polyunsaturated fatty acids. Prostaglandins Leukot Essent Fatty Acids. 2002;67(5):311-318. (PubMed)
189. Locke CA, Stoll AL. Omega-3 fatty acids in major depression. World Rev Nutr Diet. 2001;89:173-185. (PubMed)
190. Silvers KM, Woolley CC, Hamilton FC, Watts PM, Watson RA. Randomised double-blind placebo-controlled trial of fish oil in the treatment of depression. Prostaglandins Leukot Essent Fatty Acids. 2005;72(3):211-218. (PubMed)
191. Grenyer BF, Crowe T, Meyer B, et al. Fish oil supplementation in the treatment of major depression: a randomised double-blind placebo-controlled trial. Prog Neuropsychopharmacol Biol Psychiatry. 2007;31(7):1393-1396. (PubMed)
192. Rogers PJ, Appleton KM, Kessler D, et al. No effect of n-3 long-chain polyunsaturated fatty acid (EPA and DHA) supplementation on depressed mood and cognitive function: a randomised controlled trial. Br J Nutr. 2008;99(2):421-431. (PubMed)
193. Marangell LB, Martinez JM, Zboyan HA, Kertz B, Kim HF, Puryear LJ. A double-blind, placebo-controlled study of the omega-3 fatty acid docosahexaenoic acid in the treatment of major depression. Am J Psychiatry. 2003;160(5):996-998. (PubMed)
194. Su KP, Huang SY, Chiu CC, Shen WW. Omega-3 fatty acids in major depressive disorder. A preliminary double-blind, placebo-controlled trial. Eur Neuropsychopharmacol. 2003;13(4):267-271. (PubMed)
195. Zanarini MC, Frankenburg FR. omega-3 Fatty acid treatment of women with borderline personality disorder: a double-blind, placebo-controlled pilot study. Am J Psychiatry. 2003;160(1):167-169. (PubMed)
196. Nemets H, Nemets B, Apter A, Bracha Z, Belmaker RH. Omega-3 treatment of childhood depression: a controlled, double-blind pilot study. Am J Psychiatry. 2006;163(6):1098-1100. (PubMed)
197. Stoll AL, Severus WE, Freeman MP, et al. Omega 3 fatty acids in bipolar disorder: a preliminary double-blind, placebo-controlled trial. Arch Gen Psychiatry. 1999;56(5):407-412. (PubMed)
198. Keck PE, Jr., Mintz J, McElroy SL, et al. Double-blind, randomized, placebo-controlled trials of ethyl-eicosapentanoate in the treatment of bipolar depression and rapid cycling bipolar disorder. Biol Psychiatry. 2006;60(9):1020-1022. (PubMed)
199. Osher Y, Bersudsky Y, Belmaker RH. Omega-3 eicosapentaenoic acid in bipolar depression: report of a small open-label study. J Clin Psychiatry. 2005;66(6):726-729. (PubMed)
200. Frangou S, Lewis M, McCrone P. Efficacy of ethyl-eicosapentaenoic acid in bipolar depression: randomised double-blind placebo-controlled study. Br J Psychiatry. 2006;188:46-50. (PubMed)
201. Lin PY, Su KP. A meta-analytic review of double-blind, placebo-controlled trials of antidepressant efficacy of omega-3 fatty acids. J Clin Psychiatry. 2007;68(7):1056-1061. (PubMed)
202. Freeman MP, Hibbeln JR, Wisner KL, et al. Omega-3 fatty acids: evidence basis for treatment and future research in psychiatry. J Clin Psychiatry. 2006;67(12):1954-1967. (PubMed)
203. Appleton KM, Hayward RC, Gunnell D, et al. Effects of n-3 long-chain polyunsaturated fatty acids on depressed mood: systematic review of published trials. Am J Clin Nutr. 2006;84(6):1308-1316. (PubMed)
204. Assies J, Lieverse R, Vreken P, Wanders RJ, Dingemans PM, Linszen DH. Significantly reduced docosahexaenoic and docosapentaenoic acid concentrations in erythrocyte membranes from schizophrenic patients compared with a carefully matched control group. Biol Psychiatry. 2001;49(6):510-522. (PubMed)
205. Kemperman RF, Veurink M, van der Wal T, et al. Low essential fatty acid and B-vitamin status in a subgroup of patients with schizophrenia and its response to dietary supplementation. Prostaglandins Leukot Essent Fatty Acids. 2006;74(2):75-85. (PubMed)
206. Horrobin DF, Manku MS, Hillman H, Iain A, Glen M. Fatty acid levels in the brains of schizophrenics and normal controls. Biol Psychiatry. 1991;30(8):795-805. (PubMed)
207. Laugharne JD, Mellor JE, Peet M. Fatty acids and schizophrenia. Lipids. 1996;31 Suppl:S163-165. (PubMed)
208. Peet M, Brind J, Ramchand CN, Shah S, Vankar GK. Two double-blind placebo-controlled pilot studies of eicosapentaenoic acid in the treatment of schizophrenia. Schizophr Res. 2001;49(3):243-251. (PubMed)
209. Emsley R, Myburgh C, Oosthuizen P, van Rensburg SJ. Randomized, placebo-controlled study of ethyl-eicosapentaenoic acid as supplemental treatment in schizophrenia. Am J Psychiatry. 2002;159(9):1596-1598. (PubMed)
210. Emsley R, Niehaus DJ, Koen L, et al. The effects of eicosapentaenoic acid in tardive dyskinesia: a randomized, placebo-controlled trial. Schizophr Res. 2006;84(1):112-120. (PubMed)
211. Fenton WS, Dickerson F, Boronow J, Hibbeln JR, Knable M. A placebo-controlled trial of omega-3 fatty acid (ethyl eicosapentaenoic acid) supplementation for residual symptoms and cognitive impairment in schizophrenia. Am J Psychiatry. 2001;158(12):2071-2074. (PubMed)
212. Peet M, Horrobin DF. A dose-ranging exploratory study of the effects of ethyl-eicosapentaenoate in patients with persistent schizophrenic symptoms. J Psychiatr Res. 2002;36(1):7-18. (PubMed)
213. Joy CB, Mumby-Croft R, Joy LA. Polyunsaturated fatty acid supplementation for schizophrenia. Cochrane Database Syst Rev. 2003;(2):CD001257. (PubMed)
214. Hooijmans CR, Kiliaan AJ. Fatty acids, lipid metabolism and Alzheimer pathology. Eur J Pharmacol. 2008;585(1):176-196. (PubMed)
215. National Institutes of Health. DHA (Docosahexaenoic Acid), an Omega 3 Fatty Acid, in Slowing the Progression of Alzheimer's Disease. ClinicalTrials.gov (Web page). Available at:http://clinicaltrials.gov/ct2/show/NCT00440050?term=DHA+Alzheimer&rank=1. Accessed 12/8/08.
216. US Department of Agriculture, Agricultural Research Service. USDA National Nutrient Database for Standard Reference, Release 21. 2008. http://www.nal.usda.gov/fnic/foodcomp/search/. Accessed 11/7/08.
217. Hendler SS, Rorvik DR (eds). PDR for Nutritional Supplements. Montvale: Medical Economics Company, Inc; 2001.
218. US Food and Drug Administration Center for Food Safety and Applied Nutrition. Agency Response Letter: GRAS Notice No. GRN 000080. 2001. http://www.cfsan.fda.gov/~rdb/opa-g080.html. Accessed 11/7/08.
219. Zurier RB, Rossetti RG, Jacobson EW, et al. gamma-Linolenic acid treatment of rheumatoid arthritis. A randomized, placebo-controlled trial. Arthritis Rheum. 1996;39(11):1808-1817. (PubMed)
220. Vaddadi KS. The use of gamma-linolenic acid and linoleic acid to differentiate between temporal lobe epilepsy and schizophrenia. Prostaglandins Med. 1981;6(4):375-379. (PubMed)
221. Nordstrom DC, Honkanen VE, Nasu Y, Antila E, Friman C, Konttinen YT. Alpha-linolenic acid in the treatment of rheumatoid arthritis. A double-blind, placebo-controlled and randomized study: flaxseed vs. safflower seed. Rheumatol Int. 1995;14(6):231-234. (PubMed)
222. Alonso L, Marcos ML, Blanco JG, et al. Anaphylaxis caused by linseed (flaxseed) intake. J Allergy Clin Immunol. 1996;98(2):469-470. (PubMed)
223. Harbige LS. Fatty acids, the immune response, and autoimmunity: a question of n-6 essentiality and the balance between n-6 and n-3. Lipids. 2003;38(4):323-341. (PubMed)
224. Carlson SE, Cooke RJ, Werkman SH, Tolley EA. First year growth of preterm infants fed standard compared to marine oil n-3 supplemented formula. Lipids. 1992;27(11):901-907. (PubMed)
225. Environmental Protection Agency. Fish Advisories. http://www.epa.gov/waterscience/fish/. Accessed 4/28/03.
226. Fish or pills? Consumer Reports. 2003;68(7):30-32.
227. ConsumerLab. Product Review: Omega-3 Fatty Acids (EPA and DHA) from Fish/Marine Oils. http://www.consumerlab.com/results/omega3.asp. Accessed 4/14/01.
228. Melanson SF, Lewandrowski EL, Flood JG, Lewandrowski KB. Measurement of organochlorines in commercial over-the-counter fish oil preparations: implications for dietary and therapeutic recommendations for omega-3 fatty acids and a review of the literature. Arch Pathol Lab Med. 2005;129(1):74-77. (PubMed)
229. Hilbert G, Lillemark L, Balchen S, Hojskov CS. Reduction of organochlorine contaminants from fish oil during refining. Chemosphere. 1998;37(7):1241-1252. (PubMed)
230. Bender NK, Kraynak MA, Chiquette E, Linn WD, Clark GM, Bussey HI. Effects of marine fish oils on the anticoagulation status of patients receiving chronic warfarin therapy. J Thromb Thrombolysis. 1998;5(3):257-261. (PubMed)
231. Buckley MS, Goff AD, Knapp WE. Fish oil interaction with warfarin. Ann Pharmacother. 2004;38(1):50-52. (PubMed)
232. Valk EE, Hornstra G. Relationship between vitamin E requirement and polyunsaturated fatty acid intake in man: a review. Int J Vitam Nutr Res. 2000;70(2):31-42. (PubMed)
233. Higdon JV, Liu J, Du SH, Morrow JD, Ames BN, Wander RC. Supplementation of postmenopausal women with fish oil rich in eicosapentaenoic acid and docosahexaenoic acid is not associated with greater in vivo lipid peroxidation compared with oils rich in oleate and linoleate as assessed by plasma malondialdehyde and F(2)-isoprostanes. Am J Clin Nutr. 2000;72(3):714-722. (PubMed)
234. Wander RC, Du SH, Ketchum SO, Rowe KE. alpha-Tocopherol influences in vivo indices of lipid peroxidation in postmenopausal women given fish oil. J Nutr. 1996;126(3):643-652. (PubMed)
235. Wander RC, Du SH. Oxidation of plasma proteins is not increased after supplementation with eicosapentaenoic and docosahexaenoic acids. Am J Clin Nutr. 2000;72(3):731-737. (PubMed)
236. European Commission Directorate General for Health and Consumer Protection. Eurodiet: Nutrition and Diet for Healthy Lifestyles in Europe. 2001. Available at:http://eurodiet.med.uoc.gr/. Accessed 11/7/08.
237. Hamazaki T, Okuyama H. The Japan Society for Lipid Nutrition recommends to reduce the intake of linoleic acid. A review and critique of the scientific evidence. World Rev Nutr Diet. 2003;92:109-132. (PubMed)
238. Park WJ, Kothapalli KS, Lawrence P, Tyburczy C, Brenna JT. An alternate pathway to long chain polyunsaturates: The FADS2 gene product u8-desaturates 20:2n-6 and 20:3n-3. J Lipid Res. 2009;50(6):1195-202. (PubMed)
239. Serhan CN, Yacoubian S, Yang R. Anti-inflammatory and proresolving lipid mediators. Annu Rev Pathol. 2008;3:279-312. (PubMed)
240. Calder PC. Polyunsaturated fatty acids and inflammation. Prostaglandins Leukot Essent Fatty Acids. 2006;75(3):197-202. (PubMed)
繊維
要約
- 食物繊維はリグニンや複雑な炭水化物を含む多様な化合物群で、ヒトの小腸の酵素では消化できない。(詳細はこちら)
- 各種の食物繊維はそれぞれ化学的には独特のものではあるが、それらの生理作用をよりよく理解するために、それらの溶解性、粘性、および発酵性に基づいて分類する試みがなされてきた。(詳細はこちら)
- えん麦製品や豆類などに含まれる粘性のある食物繊維は血清LDLコレステロール濃度を低下させ、血糖とインスリンの応答を正常化する可能性がある。(詳細はこちら)
- 食物繊維を多く摂取すると、便秘や憩室性疾患を防いで腸の健康を促進する。(詳細はこちら)
- 大規模な前向きコホート研究で、全粒穀物、豆類、果物、および非でんぷん質の野菜などの食物繊維が豊富な食事は、心血管疾患および2型糖尿病のリスクを下げるという説得力のある一貫したエビデンス(科学的証拠)が示された。(詳細はこちら)
- 症例対照研究で食物繊維の摂取の少ない者は結・直腸がんが多いという結果が示されているが、最近の大規模前向きコホート研究と4例の臨床介入試験の結果からは、食物繊維の摂取と結・直腸がんのリスクとの関連は裏付けられなかった。(詳細はこちら)
- 食物性繊維の摂取と乳がんの発生に関する観察研究では、一貫しない結果が報告されている。(詳細はこちら)
- 1型および2型糖尿病患者による多数の対照臨床試験で食物繊維の摂取を増やすと、血糖コントロールや血清脂質プロファイルが改善した。(詳細はこちら)
- 2001年には米国医学研究所の食品栄養委員会が毎日の全食物繊維摂取の推奨目安量を設定した。50歳以下の成人では男性で38g/日、女性で25g/日が推奨されている。51歳以上の成人は、男性で30g/日、女性で21g/日である。(詳細はこちら)
序説
すべての食物性繊維は小腸では消化しづらく、そのままの形で結腸(大腸の一部)に届く(1)。大部分の食物繊維は炭水化物であるが、それらがヒトの酵素によって消化されやすいか否かを決定する重要な要因の一つに、糖の分子同士を連結する化学結合(グリコシド結合)の立体構造の差異がある。ヒトは大部分のβ-グルコシド結合を加水分解する(ばらばらにする)ことができる消化酵素を欠いている。そのためα-1,4グリコシド結合を持つグルコースポリマーであるアミロースはヒトの酵素で消化できるが、β-1,4グルコシド結合を持つグルコースポリマーであるセルロースは消化不能である(図参照)。
食物繊維の定義
栄養科学者や臨床医は一般に、健康的な食事が食物繊維の豊富な食品を多く含むべきであることには賛同するが、実際の食物繊維の定義についての同意を得ることはより難しい(2-4)。1970年代には、食物繊維とは、ヒトの酵素で消化しにくい植物細胞の残余であると定義されていた(5)。この定義はリグニンと呼ばれる植物細胞壁の成分や、植物に含まれる消化不能の炭水化物を含む。しかしながらこの定義では、非消化性の炭水化物で動物性食品に由来するもの(キチン質など)や、人工的に合成されたもの(フラクトオリゴ糖など)、およびヒトの消化酵素では消化できない消化可能な炭水化物(難消化性デンプンなど)が除外されてしまう(6)。これらの化合物は、植物性食品に含まれる繊維(食物繊維)の特徴の多くを備えている。
米国医学研究所:食物繊維、機能性食物繊維、および全食物繊維
2001年に食物繊維摂取の推奨量を確立する前に、米国医学研究所によって召集された専門家パネルは、元々植物性食品に自然に含まれている食物繊維(食物性繊維)と、食物に添加したり栄養補助食品として使用されている単離または合成された食物繊維(機能性繊維)の区別をする定義をした(4)。しかしながら、これらの定義には議論があり、食物性繊維にはその他の分類体系もある(下記の「その他の分類体系」の項を参照)。
食物繊維
- リグニン:リグニンは糖質ではなく、木質植物の細胞壁や種子にある複雑な三次元構造を持つポリフェノール系化合物である(7)。
- セルロース:セルロースはすべての植物の細胞壁にあるβ-1,4グルコシド結合を持つグルコースポリマーである(図参照)(6)。
- β-グルカン(類):β-グルカンはβ-1,4グルコシド結合とβ-1,3グルコシド結合が混在するグルコースのポリマーである(図参照)。えん麦と大麦はβ-グルカンが特に豊富である(7)。
- ヘミセルロース(類):ヘミセルロースは6つの炭素原子でできた糖(六炭糖)および5つの炭素原子でできた糖(五炭糖)を含む多様な多糖類(糖のポリマー)である(6)。セルロースと同様に、ヘミセルロースは植物の細胞壁に見られる。
- ペクチン(類):ペクチンは、特に果物やベリー類に豊富に含まれる粘性の多糖類である(4)。
- ガム(類):ガムは種子によく見られる粘性の多糖類である(4)。
- イヌリンおよびフラクトオリゴ糖類(オリゴフルクトース):イヌリンは長さが違う果糖鎖の混合物で、糖鎖の末端がしばしばブドウ糖分子で終わっている(8)。フラクトオリゴ糖類はイヌリンよりも短い果糖鎖の混合物で、糖鎖の末端がブドウ糖または果糖で終わることもある。イヌリンもフラクトオリゴ糖類も、玉ねぎや菊芋などの天然の植物に含まれる。
- 難消化性デンプン:天然の難消化性デンプンは植物細胞壁に隔離されていて、ヒトの消化酵素では消化できない(4)。バナナや豆類が天然の難消化性デンプン供給源となる。難消化性デンプンは食品の加工、冷却、および再加熱によっても形成されることがある。
機能性食物繊維
米国医学研究所の定義によれば、機能性食物繊維は「ヒトに有益な生理作用をもたらす単離された消化不能な炭水化物からできている」(4)。機能性食物繊維は、天然の植物や動物から単離または抽出された消化不能な炭水化物か、製造または合成されたものである。しかしながら、米国医学研究所から機能性食物繊維と指定されるには、ヒトで生理学的に十分有益であるというエビデンス(科学的根拠)を示す必要がある。米国医学研究所で機能性食物繊維であるとされたものには以下のものが含まれる:
- 上記の単離または抽出された食物繊維
- サイリウム:サイリウムは植物の粘液であり、オオバコの種子の殻から単離される。殻は通常、別名をブロンドサイリウムというインドオオバコの種子から得られる。インドオオバコはイスパギュラハスクとしても知られている(4)。
- キチンおよびキトサン:キチンはカニやロブスターなどの甲殻類の外殻から抽出される消化不能の炭水化物である。Β-1,4グルコシド結合で結ばれたアセチルグルコサミン単位で構成された長いポリマーである。キチンを脱アセチル化したものは、非消化性グルコサミンポリマーであるキトサンの製造に使用される(9)。
- フラクトオリゴ糖:フラクトオリゴ糖は、ブドウ糖単位が末端にある短い合成果糖鎖である。食品添加物として使用される(8)。
- ポリデキストロースおよびポリオール:ポリデキストロースおよびポリオールは、食品への増量剤や砂糖代替物として使用される人工多糖類である(4)。
- 難消化性デキストリン:難消化性デキストリンは、別名で難消化性マルトデキストリンとも呼ばれる消化不能の多糖類である。デンプンが加熱され、酵素で処理される際に形成される。食品添加物として使用される(4)。
全食物繊維
全食物繊維は、米国医学研究所で「食物繊維および機能性繊維の総量」と定義されている(4)。
その他の分類体系
粘性および非粘性食物繊維
食物繊維には、水中で非常に粘性のある水溶液またはゲルを作るものがある。この特性は、一部の食物繊維が胃での消化を遅くしたり、小腸でのいくつかの栄養素の吸収を遅くしたり、血清コレステロールを下げたりする性質と関連している。粘性のある食物繊維には、ペクチン、β-グルカン、ある種のガム(グアーガムなど)、および粘液(サイリウムなど)がある。セルロース、リグニン、および一部のヘミセルロースは非粘性食物繊維である(6,7)。
発酵性および非発酵性食物繊維
食物繊維には、大腸にふつうに棲むバクテリアによって容易に発酵されるものがある。発酵は大腸のバクテリアの量を増やすだけでなく、短鎖の脂肪酸(酢酸、プロピオン酸、および酪酸)やガスを形成する(1)。短鎖の脂肪酸は吸収されてから、代謝されてエネルギーを生成し得る。おもしろいことに、大腸細胞(大腸を覆う上皮細胞)のエネルギー源は酪酸である。ペクチン、β-グルカン、グアーガム、イヌリン、およびフラクトオリゴ糖類はたやすく発酵されるが、セルロースやリグニンは大腸で発酵し難い(6,7)。発酵性食物繊維の豊富な食品は、えん麦や大麦、そして果物や野菜である。セルロースが豊富な穀物の食物繊維、たとえば小麦のふすまなどは、バクテリアによる発酵を比較的受けにくい(1)。
可溶性および不溶性食物繊維
「可溶性食物繊維」は、もともと分析上の用語である(10)。可溶性食物繊維は水に溶けるが、不溶性食物繊維は溶けない。本来、食物繊維の可溶性はその生理効果を予測するものだと思われていた。たとえば、可溶性食物繊維は粘性のあるゲルを形成しやすく、大腸のバクテリアによって発酵されやすいと考えられていた。研究が進んで、可溶性は食物繊維の生理作用を確実に予測するものではないということが明らかになった。しかしながら、「可溶性」や「不溶性」食物繊維という用語は、未だに多くの栄養および健康管理の専門家によって使われており、米国食品医薬品局(FDA)の栄養表示にも用いられている。β-グルカン、ガム、植物の粘液(サイリウムなど)、ペクチン、およびある種のヘミセルロースは可溶性食物繊維であり、セルロース、リグニン、ある種のペクチン、およびヘミセルロースの一部は不溶性食物繊維である(10)。えん麦製品および豆科作物(乾燥した豆類、えんどう豆、およびレンズ豆など)は、可溶性食物繊維が豊富である。
生物活性
血清コレステロールの低下
多数の対照臨床試験で、粘性のある食物性繊維、特に豆科作物(乾燥した豆類、えんどう豆、およびレンズ豆など)(11-13)やえん麦製品(14-19)の摂取を増大させると、血清総コレステロールおよびLDLコレステロールが減少することがわかった。そのような発見に基づき米国食品医薬品局は、1サービング(SV)あたり少なくとも0.75gの全粒えん麦由来の可溶性食物繊維を含む食品のラベルに、次のような健康効能を謳うことを承認した。「飽和脂肪およびコレステロールの少ない食事の一部として含まれる、えん麦ふすまなどの食品に由来する可溶性食物繊維は、心臓病のリスクを下げる可能性がある」(20)。ペクチン、グアーガム、およびサイリウムなどの粘性のある食物繊維を含むサプリメントの摂取は、食物繊維の少ないプラセボに比べて、総コレステロールおよびLDLコレステロールの濃度を下げることがわかっている(17,21-26)。これらの研究の多くは比較的高い食物繊維摂取量について調べたものであるが、67例の対照試験の結果をまとめたメタ解析では、粘性のある食物繊維の摂取を1日に10gと控えめに増加させても、平均で22mg/dL (0.57mmol/L)のLDLコレステロールの低下と、平均で17mg/dL (0.45mmol/L)の総コレステロールの低下が見られた(17)。
食後血糖の低下
粘性のある食物性繊維(27,28)や単離された粘性食物繊維(29-32)を、炭水化物を含む食事に加えると、血糖とインスリンの応答に著しい向上があることが多数の対照臨床試験でわかっている(33)。急激で大きな血糖濃度の上昇は、膵臓のβ細胞にインスリンの分泌を増大させる強力な信号となる。何年にもわたる周期的な血糖増加とインスリンの過剰分泌は2型糖尿病と心血管疾患(下の「疾病予防」の項を参照)の発症リスクを上昇させると考えられている。2つの食事で炭水化物の含有量が同じならば、食物繊維、特に粘性のある食物繊維があると一般的に血糖上昇がより低く抑えられたものとなり、したがってインスリン濃度を有意に低下させる(33)。
大便の軟化
食物性繊維および食物繊維サプリメントの摂取増加は、大便を軟化させ嵩を増やし、大腸での通過を速めることで便秘を予防したり改善したりする(34)。小麦ふすま、果物、および野菜は、最も堅実に大便の嵩を増やし腸での通過時間を短縮する食物繊維源であることがわかっている(35)。便秘治療に効果があることがわかっている食物繊維のサプリメントには、セルロースやサイリウムが含まれる(4)。食物繊維の摂取を増やすことによる軟便効果を最大化するのに、十分な水分摂取も必要である(36)。食物繊維の摂取を増やすだけでなく、少なくとも約2リットルの水分を毎日摂ることが、便秘の予防や治療に役立つとして通常的に推奨されている(37)。
疾病の予防
食物繊維の高摂取と慢性疾患のリスク低下の関連を見出している観察研究では、一般に食物繊維そのものではなく、食物繊維の豊富な食品のみを評価しているため、観察された有益性が食物繊維に関連しているのか、それとも食物繊維の豊富な食品に共通に見られる植物性化学物質やその他の栄養素に関連するものなのかを決定することが難しくなっている。対照的に、介入試験では単離された食物繊維を使用して、特定の食物繊維成分が有益な健康効果を有するかどうかを決定することが多い。
心血管系疾患
前向きコホート研究では、食物繊維の豊富な食品を多く摂取すると、冠動脈疾患リスク(38-48)や心血管関連の死亡率(48-51)が大きく低下することが一貫してわかっている。米国およびヨーロッパにおける食物性繊維の摂取に関する10例の前向きコホート研究の統合解析では、全食物性繊維総量を10g/日増加させるごとに心筋梗塞などの冠動脈性疾患の発症リスクが14%減少し、冠動脈疾患による死亡が24%減少することがわかった(51)。食物繊維の摂取と冠動脈疾患による死亡との、この逆相関は穀物と果物の食物繊維について特に高かった。3例の大規模な前向きコホート研究(42,43,45)では、エネルギー1,000kcalあたりおよそ14gの食物性繊維の摂取により、冠動脈疾患リスクの実質的低下(16%-33%)が見られた。これらの結果は米国医学研究所の食物繊維摂取の推奨目安量の根拠となっている(下記の「摂取の推奨量」の項参照)(4)。
粘性のある食物性繊維や食物繊維サプリメントが有するコレステロール低下効果は、おそらく食物性繊維の心臓保護的効果に寄与しているであろうが(「血清コレステロールの低下」の項参照)、その他のメカニズムも働いているようである。血糖とインスリンの応答に対する食物繊維摂取の有益な効果がこの観察されている冠動脈疾患リスクの低減にも寄与しているのかもしれない(52)。食物繊維が少なく血糖負荷の高い食事は、心血管疾患の2つのリスク要因である血清中の中性脂肪濃度の増加とHDLコレステロール濃度の低下に関連している(53,54)。マグネシウムやカリウムのような特定の微量栄養素を豊富に含む食物繊維の多い食事は、心血管疾患のもう1つの重要なリスク要因である血圧を下げることに役立つ可能性がある。いくつかの観察研究では、食物繊維の摂取と血圧(55)または高血圧(56)との逆相関が見られている。24例のランダム化プラセボ対照試験のメタ解析では、食物性繊維の補給(平均で11.5g/日)によって最高血圧が1.13mmHg、最低血圧が1.26mmHg低下することがわかった(57)。同様に、別の25例のランダム化対照試験のメタ解析では、食物繊維の増加(対照群に比べて中央値で10.7g/日 多い)で、最高血圧が1.15mmHg、最低血圧が1.65mmHg下がった(58)。どちらの解析も最高血圧ではなく最低血圧の低下が統計的に有意であった。加えて、食物繊維の摂取が多いと、心筋梗塞や脳卒中のような心血管事例のリスクに強く関連している炎症性バイオマーカーであるC反応性タンパク質(59,60)の濃度が下がる可能性があることが、最近の研究でわかった(61)。このように、食物繊維の心臓保護効果にはいくつかのメカニズムが貢献しているようである。粘性のある食物繊維や食物繊維サプリメントはLDLコレステロール濃度を下げるのに最も効果的であるように見える。しかし大規模な疫学的研究により、全粒穀物、豆類、果物、および非デンプン性野菜からのすべての食物繊維を豊富に含む食事が、冠動脈疾患のリスクを有意に下げるという、強力で一貫したエビデンスが示されている(62)。
2型糖尿病
米国では、精製された炭水化物の摂取増加と食物繊維の摂取減少に並行して、2型糖尿病が流行病に近いくらいの割合で蔓延してきた(63)。多数の前向きコホート研究で、食物繊維、特に全粒穀物の食物繊維が豊富な食事が、2型糖尿病の発症リスクの大幅な低減と関連していることが明らかになった(64-74)。2型糖尿病予防に関する食物性繊維の摂取増加のみの効果を評価した介入試験はないが、2例の重要な介入試験において、食物繊維の摂取増加など、いくつかの生活様式の改善により、耐糖能異常の成人が2型糖尿病を発症するリスクが低減されることがわかった(75,76)。肥満、運動不足、および遺伝的体質を含む多くの要因が2型糖尿病の発症リスクを増加させるとはいえ、観察研究および介入試験の結果は、食物繊維の多い食事が、特にリスクの高い個人に関して耐糖能を向上させ、2型糖尿病のリスクを減らすことを示している。
がん
結直腸がん
1990年以前に行われた症例対照研究の大多数で、結直腸がん(大腸がん)の発症は食物繊維の摂取が多い人々に少ないことがわかった(77,78)。最近のコホート内症例対照研究で、食物摂取の頻度に関する質問表で食物繊維の摂取を評価するのではなく、食物を摂取した記録で評価すると、食物繊維の摂取と結直腸がんのリスクに逆相関があることがわかった(79)。今日までのところ、大部分の前向きコホート研究では、食物性繊維の摂取の程度と結直腸がんのリスクの間に有意な関連は見つかっていない(80-89)。725,628人の成人のデータを解析した13例の前向きコホート研究の統合解析では、いろいろな食事要因を考慮に入れると、食物繊維の高摂取が結直腸がんの予防になるという結果にはならかった(90)。しかしながら、今日までで最も大規模な食事とがんに関する前向き研究、すなわち、519,978人の男女が参加した“欧州のがんと栄養に関する前向き研究”(EPIC)では、食品からの食物繊維は大腸がんの発症から体を守るということがわかった(91)。このEPICの研究には、食物繊維の摂取と結直腸がんが無関係であると報告した上記の統合解析は含まれていない(90)。
さらに4例の対照臨床試験では、食物繊維を摂取することで結直腸腺腫(前がん性ポリープ)の再発から身体を保護する効果があると示すことができなかった。4年間における結直腸腺腫の再発率は、毎日約33gの食物繊維を果物や野菜を豊富に含む低脂肪食から摂取した人達と、食物繊維を毎日約19g摂取した対照群との間で有意差がなかった(92)。別の試験では、毎日13.5gの小麦ふすまの食物繊維を摂った者と毎日2g摂った者との間で、3年間の結直腸腺腫の再発率に有意差は認められなかった(93)。より直近では、4年間の介入試験で7.5g/日の小麦ふすまを摂取しても、結直腸腺腫の再発には何の効果もなかった(94)。驚いたことに、別の介入試験では3.5g/日のサイリウムを3年間摂取すると、プラセボに比べて腺腫の再発が有意に増加した(95)。
症例対照研究や大部分の前向きコホート研究の結果と、最近の介入試験の結果との間の食い違いの原因については、科学者間でかなりの論争を巻き起こした。これらの研究で見られた食物繊維の保護的効果が無かった理由としては、これらの研究で大部分の人が摂取した食物繊維の種類や摂取量が結直腸がんの予防には不適切であったか(4)、あるいは、脂肪などのその他の食事要因が食物繊維と相互作用し、食物繊維の結直腸がんに対する効果に影響を及ぼした可能性がある(1,96)。観察研究での食物繊維の摂取評価法も、異なった結果の原因であった可能性がある(79)。結直腸がんリスクとその進行に対して、食物繊維および食物繊維サプリメントが及ぼす複雑な効果をきちんと理解するためには、さらなる研究が明らかに必要である。
乳がん
初期の多数の症例対照研究で、食物繊維の摂取と乳がんの発生に有意の逆相関があるとわかったが(97-100)、多くの前向きコホート研究では食物繊維の摂取と乳がんリスクの有意の減少との間に関連は見られなかった(101-108)。3例の研究で、食物性繊維が乳がんリスクに対して防衛的効果があると報告している。英国での前向きコホート研究では、食物性繊維の摂取は閉経前の女性では乳がんリスクと逆相関があったが、閉経後の女性ではそうでなかった(109)。加えて、スウェーデンでの前向きコホート研究では、食物繊維の摂取が最も多い閉経後の女性(平均で約26g/日)は、食物繊維の摂取が最も少ない女性(平均で約13g/日)に比べて乳がんリスクが40%低かった(110)。食物繊維の摂取が最も多く脂肪の摂取が最も少ない女性は、乳がんのリスクが最も少なかった。より最近では、185,000人以上の米国の閉経後の女性群による前向きコホート研究で、食物繊維の摂取が最も多い(中央値で26g/日)人達は、食物繊維の摂取が最も少ない(中央値で11g/日)人達に比べて、すべての形態の乳がんに対して13%リスクが低く、ホルモン受容体陰性腫瘍(エストロゲン受容体陰性ER-/プロゲステロン受容体陰性PR-)のリスクが44%低かった(111)。10例の前向きコホート研究を2011年にメタ解析したところ、食物性繊維の摂取が最も多い女性では、控えめで11%という乳がんリスクの低下が見られた(112)。閉経前および閉経後の女性の小規模短期介入試験の結果では、低脂肪(エネルギーで10%-25%)で食物繊維の多い(25-40g/日)食事は、エストロゲンの排出を増やしエストロゲンの代謝を促してエストロゲン状でない形態にすることで、体内を循環するエストロゲンの濃度を下げる可能性があることを示唆している(113,114)。しかしながら、内因性エストロゲン濃度に対して食物繊維がもたらした効果が、乳がんリスクに対して臨床的に有意な影響を及ぼすか否かは不明である(4)。全体的に、食物繊維の摂取と乳がんの発症とを調べた観察研究は、結果がまちまちである。そのような研究では、見つかった関連性は果物や野菜などの食物繊維が豊富な食品の摂取と混同されている可能性がある。
憩室性疾患
いくつかの観察研究では、憩室症になるリスクの低下と食物繊維の高摂取を関連付けている(115,116)。憩室症とは大腸に小嚢(憩室)が形成されることが特徴で、比較的よくある症状である。しかしながら、2,104人の成人を対象とした最近の横断的研究によると、食品を食べる頻度に関する質問票で食物繊維の摂取が最多の人達は、食物繊維の摂取が最少の人達に比べて大腸に憩室(大腸内視鏡検査で確認)を有する割合が高かった(117)。憩室症であっても大部分の人達は何の症状もないが、そのうちの約15%-20%は憩室炎という痛みや炎症をおこす(118)。ある大規模前向きコホート研究で、不溶性食物繊維の摂取が最多の(中央値で22.7g/日)男性たちは、その摂取が最少の(中央値で10.1g/日)男性たちに比べて、憩室性疾患の症状の発生リスクが37%低かった。憩室性疾患に対して食物繊維が身体を保護する効果は、セルロースとリグニンで最も強かった(119)。食物繊維と憩室性疾患との関連を明確にするための研究がさらに必要である。
体重コントロール
食物繊維の高摂取はエネルギーが少ないだけでなく、食後の満腹感を長引かせて(飽満感)、体重増加を予防したり体重減少を促進したりするのに役立つというエビデンスがある(120)。観察研究では、食物繊維の摂取が多い成人ほど摂取の少ない成人よりも痩せ型で(121,122)、肥満になりにくい(123,124)。ある大規模前向きコホート研究では、12年間にわたって高食物繊維食品の摂取量を平均で9g/日増やした女性たちは、高食物繊維食品摂取を平均で3g/日減らした女性たちに比べて、最低で25kg以上の大幅な体重増加になる可能性が半分だった(125)。食物繊維摂取の増加が体重減少に及ぼす効果を調べた短期間の臨床試験の結果はまちまちである。全体的には、2001年以前に行われた臨床試験のシステマティックレビュー(系統的レビュー)で、食品またはサプリメントからの食物繊維の摂取を14g/日増加させると、4ヶ月でエネルギー摂取が10%減少し、体重が平均で約1.9kg減った(120)。しかしながら、より最近の臨床試験では、食物繊維の豊富な穀物(126)や食物繊維のサプリメント(127)が体重減少を促進するという結果は見られなかった。61例のランダム化対照試験に関して2011年に行われたシステマティックレビューでは、異なるタイプの食物繊維が体重に及ぼす効果を調べた(128)。この解析ではデキストリンと海洋性の多糖類がすべての研究で体重減少を引き起こし、キトサン、アラビノキシラン、およびフルクタンは少なくとも3分の2の研究で体重減少を起こした。平均的体重減少はフルクタンおよび海洋性多糖類のグループで最も大きかった(どちらのグループでも体重79kgの人で4週間に約1.3kg)。すべての食物繊維のタイプを合わせると、体重79kgの人で4週間でわずか平均0.3kgの体重減少であった(128)。食物繊維の豊富な食品、特に全粒穀物の摂取が多い人達は健全な体重維持をしやすいようであるが、長期間にわたっての体重コントロールに食物繊維のみが果たす役割は未だに明らかではない。体重への効果は、特定のタイプの食物繊維によるのかもしれない。
総死亡率
いくつかの前向きコホート研究で、食物繊維の高摂取が、すべての死因による死亡率の低下と関連することがわかった。388,122人の年配者を平均で9年間追跡したNIH-AARP(米国国立衛生研究所-全米退職者協会)の食と健康調査からの最近の報告で、男性も女性も食物繊維の摂取が5段階の中で最も高い人達は、最も低い人達に比べて死亡率が22%低いことがわかった(50)。より小規模の前向き研究でも、全食物繊維摂取量と総死亡率との間の逆相関が報告されており(44,48,129)、また、穀物繊維の摂取と総死亡率との逆相関が50,000人以上の参加者による看護師健康調査(米国)でもわかっている(130)。しかし、全食物繊維摂取または可溶性食物繊維摂取と総死亡率との関連は、単回の24時間(食事)思い出し法で食物繊維の摂取を調べた前向き研究である米国の国民健康栄養調査(NHANES)I疫学追跡調査では見いだせなかった(46)。
疾病の治療
糖尿病
1型または2型糖尿病の患者による多数の対照臨床試験で、食品(131,132)や粘性食物繊維サプリメント(133-135)からの食物繊維の摂取を増やすと、血糖コントロールのマーカー、特に食後の血糖濃度と血清脂質プロファイルが向上した。糖尿病患者における高食物繊維の食事(20g/1,000kcal以上)と低食物繊維の食事(10g/1,000kcal未満)の効果を比べた23例の臨床試験結果のメタ解析で、高食物繊維の食事は食後の血糖濃度を13%-21%下げ、血清LDLコレステロール濃度を8%-16%低下させ、血清中性脂肪濃度を8%-13%減少させた(136)。このメタ解析からのエビデンスに基づき、著者たちは25-50g/日(15-25g/1,000kcal)の食物性繊維の摂取を糖尿病の人達に勧めているが、これは少なくとも25-35g/日という多くの国際的な糖尿病関連団体の推奨値と一致している(137-139)。一般に、糖尿病の人達は全粒穀物、豆類、ナッツ類、果物、および非デンプン性野菜の摂取増加によって食物繊維の高摂取を図るべきであるという推奨は、対照臨床試験の結果からは妥当である。非粘性の食物繊維のみを増やすことが有益だという臨床試験からのエビデンスがほとんどないので(140)、糖尿病の人々は小麦ふすまのような非粘性の食品源だけからの食物繊維の摂取増は避けるべきである(136)。
過敏性大腸症候群
過敏性大腸症候群は腸の機能性障害であり、腹痛発作または腸の動きの変化に伴う便秘や下痢などの不快感が特徴である(141)。過敏性大腸症候群と診断された人達は医療関係者に食物性繊維の摂取を増やすよう奨励されることが多いが、サイリウム、メチルセルロース、および小麦ふすまを使った対照臨床試験の結果はまちまちである(142-144)。12例のランダム化対照試験のシステマティックレビューおよびメタ解析で、食物繊維の有益な効果が見られたのはイスパキュラ外皮(サイリウム)だけに限られた(143)。より最近では、過敏性大腸症候群の患者(275人)による3ヶ月間のランダム化プラセボ対照試験で、サイリウム(10g/日)の補足(補足でもよいが補給で統一したらと思います、以下同じ)が最初の2ヶ月間で腹痛や不快感に関する症状を軽減させ、3ヶ月間の補足(補給?)後に症状の重症度が改善された(145)。プラセボと比べて、不溶性のふすま繊維の補足(補給?)(10g/日)により、3ヶ月間の補足(補給?)後に腹痛や不快感が軽減されたが、症状の重症度には変化がなかった(145)。加えて、過敏性大腸症候群の患者に対する食物繊維の補足(補給?)に関する17例のランダム化臨床試験のシステマティックレビューでは、主にサイリウム由来の可溶性食物繊維の補足(補給?)が過敏性大腸症候群の症状を全体的に有意に向上させたが、とうもろこしや小麦のふすまなどの不溶性食物繊維の補給(これで統一)では、過敏性大腸症候群の症状は改善しなかった(146)。一般に食物繊維のサプリメントは過敏性大腸症候群の患者の便秘を改善するが、過敏性大腸症候群に特有の腹痛の改善はしない。したがってランダム化対照試験の結果は、可溶性または粘性食物繊維の摂取を徐々に12-30g/日まで増やすと、過敏性大腸症候群の主な症状が便秘である患者には有益である可能性があることを示唆している(147)。しかし食物繊維のサプリメントは、下痢が主な症状である患者の症状を実際に悪化させる可能性がある(148)。いくつかの臨床試験で、水溶性で非ゲル性の食物繊維である部分水解グアーガム(5g/日)は、下痢の過敏性大腸症候群患者および便秘の過敏性大腸症候群の患者の症状を改善する可能性があることがわかった(149)。過敏性大腸症候群の患者は、食物繊維の摂取を徐々に増やすよう推奨されるべきである。なぜなら、粘性が有り、容易に発酵可能な食物繊維は、ガスの発生や腹部膨満感を増長する可能性があるからである。
摂取源
食品の摂取源
米国での食物性繊維の摂取は、平均で男性が16-18g/日、女性が12-14g/日であり、推奨される摂取量レベルのはるか下である(下記の「推奨量」の項参照)(4)。豆類、ナッツ類、全粒穀物、ふすま製品、果物、および非デンプン性野菜などは食物繊維の良好な摂取源である。豆類と全粒穀物、およびナッツ類は、果物や野菜よりも一般的に食物繊維の含有量が多い。すべての植物性食品には、可溶性および不溶性の食物繊維が混在して含まれている(10)。えんばく製品と豆類は可溶性および粘性食物繊維が豊富である。小麦ふすまと全粒穀物は、不溶性および非粘性食物繊維が豊富である。いくつかの食物繊維が豊富な食品の全食物繊維含有量を下表(表1)に示す。食物繊維の摂取を増やすやり方として、果物や非デンプン性野菜の摂取を増やしたり、豆類の摂取を増やしたり、朝食に全粒穀物やオートミールを食べたり、精白した穀物を全粒穀物に代えたり、健康的でないおやつの代わりにナッツ類やポップコーンにしたりするなどの方法がある。特定の食品の食物繊維含有量に関するより詳細な情報については、USDA(米国農務省)の米国栄養素データベースを検索のこと。
単離された食物繊維とサプリメント
β-グルカン類
β-グルカンは粘性のある発酵しやすい可溶性食物繊維で、天然では、えん麦、大麦、マッシュルーム、酵母、バクテリア、および藻類に含まれている(151)。えん麦、マッシュルーム、および酵母から抽出されたβ-グルカンは、処方箋なしで様々な栄養補助食品として入手可能である。
ペクチン
ペクチン類は粘性のある食物繊維で、柑橘の皮やりんごの果肉から抽出されることが多い。ペクチン類は広く食品のゲル化剤として利用されるが、処方箋なしの栄養補助食品としても入手可能である(9)。
イヌリン類およびフラクトオリゴ糖類(オリゴフルクトース)
イヌリン類とフラクトオリゴ糖類(オリゴフルクトース)は、チコリの根から抽出されたり、ショ糖から合成されたりして、食品添加物として利用される(8)。単離されたイヌリンはサラダドレッシングなどの製品の脂肪の代替として添加され、一方、甘味のあるフラクトオリゴ糖類はフルーツヨーグルトやデザートのような製品に添加される。イヌリンとフラクトオリゴ糖類は、ヒトの大腸で有益な善玉菌、ビフィズス菌の成長を刺激する能力があることから、プレバイオティクスにも分類される非常に発酵されやすい食物繊維である(152)。ビフィズス菌の成長を助長することは、下痢を起こすことがわかっている病原性バクテリアの成長を抑制したり、免疫応答を強化して、腸の健康を促進する可能性がある(153)。イヌリンやフラクトオリゴ糖類を含む多くの栄養補助食品がプレバイオティクスとして市販されているが、プレバイオティクスの健康効果は、ヒトでは未だ確定的には示されていない(154,155)。
グアーガム
グアーガムは粘性のある発酵性の食物繊維で、インドのクラスタ豆から採取される(4)。増粘剤または乳化剤として多くの食品に使用される。グアーガムを含む栄養補助食品は減量に役立つとして市販されてきたが、11例のランダム化対照試験の結果をまとめたメタ解析では、グアーガムのサプリメントは体重減少には有効でないことが分かった(156)。
サイリウム
サイリウムは粘性のある可溶性食物繊維で、オオバコの種子の殻から単離され、緩下剤、すぐに食べられるシリアル、および栄養補助食品として処方箋なしで入手可能である(9)。米国食品医薬品局は、1サービング(SV)あたり少なくとも1.7gのサイリウム由来の可溶性食物繊維を含む食品のラベルに次のような健康効果を謳うことを認めた:「サイリウム由来の可溶性食物繊維を1日あたり7g含む、飽和脂肪とコレステロールの少ない食事は、心臓疾患のリスクを下げる可能性がある」(20)。
キトサン
キトサンは、キチンから得られる消化不能のグルコサミンポリマーである。動物実験では、食品と一緒に投与されたキトサンは脂肪の吸収を低下させた(157)。その結果、キトサンは体重減少とコレステロール低下に役立つ栄養補助食品として市販されてきた。ヒトでの対照臨床試験では、一般的にキトサンの補給がプラセボに比べて体重減少の促進に有効であるとはわかっていない(158)。一方、ヒトでの臨床試験では、キトサン補給によって、総コレステロールおよびLDLコレステロール濃度がプラセボに比べて控えめに減少したという結果になったものもあるが(159,160)、何の変化もなかったものもある(161,162)。キトサンは米国では処方箋なしで栄養補助食品として入手可能である。
注記:すべての食物繊維のサプリメントは、十分な水分とともに摂取されねばならない。大部分の臨床医は、少なくとも240mlの水で食物繊維サプリメントを摂り、少なくとも全部で約2リットルの水分を毎日摂るように勧めている(163,164)。
安全性
悪影響
食物繊維
急に食物繊維の摂取を増やすと、腹痛発作、腹部膨満感、またはガスが溜まる、などを経験する人がいる(163,164)。食物繊維の豊富な食品の摂取を徐々に増やしたり、少なくとも約2リットル/日の水分を摂取したりすることで、これらの症状を最小限にしたり、避けることができる。えん麦ふすまや小麦ふすまの大量摂取に関連する腸閉塞の報告が稀にあるが、それらは通常、腸の運動に障害があるか咀嚼困難な人達に見られる(165-168)。米国医学研究所では、食物繊維または機能性食物繊維の許容上限摂取量を設定していない(4)。
単離された食物繊維および食物繊維サプリメント
胃腸症状:次の食物繊維は、腹部痙攣、腹部膨満感、ガス、下痢などを含む胃腸の苦痛を引き起こすことがわかっている:グアーガム、イヌリンとオリゴフルクトース、フラクトオリゴ糖類、ポリデキストロース、難消化性デンプン、およびサイリウム(4)。体重減少にグアーガム入りサプリメントを使用すると、食道閉塞および小腸閉塞を伴うことがある(169)。加えて、摂取時に水分を十分に摂らなかったり、嚥下障害や胃腸運動に障害のある人が摂取したりすると、サイリウムによる腸閉塞が起こるケースがいくつか報告されている(170,171)。
結直腸腺腫:結直腸腺腫(前がん性ポリープ)の病歴のある患者による、あるランダム化対照試験で、3.5g/日のサイリウムを3年間補給したところ、プラセボに比較して、著しく結直腸腺腫の再発が増えた(上記の「結直腸がん」の項参照)(95)。
アレルギーとアナフィラキシー:キチンとキトサンは、カニやロブスターなどの甲殻類の殻から単離されている可能性があるので、甲殻類アレルギーの人達はキチンやキトサンのサプリメントの摂取を避けるべきである(9)。イヌリンの静脈内投与後と(172)、チコリから抽出されたイヌリンを含むマーガリンの摂取(173)で、アナフィラキシーが報告されている。アナフィラキシーはサイリウムを含むシリアルの摂取後にも報告され、サイリウムの粉末に職業上、接していた人達における喘息が時折報告されている(174)。
薬物の相互作用
同時に摂取すると、サイリウムはリチウム、カルバマゼピン(テグレトール)、ジゴキシン(ラノキシン)、およびワルファリン(クマジン)の吸収を減らす可能性がある(9)。グアーガムはジゴキシン、アセトアミノフェン(タイレノール)、およびブメタニド(ブメックス)の吸収を遅らせる可能性があり、また、同時に摂取すると、メトフォルミン(グルコファージ)、ペニシリン、およびいくつかの処方のグリブリド(グリナーゼ)の吸収を減らす可能性がある(175)。同時摂取をすると、ペクチンはロバスタチン(メバコール)の吸収を減らす可能性がある(176)。カオリンとペクチンの併用投与は、クリンダマイシン、テトラサイクリン、およびジゴキシンの吸収を減らすことが報告されているが、この相互作用にカオリンまたはペクチンが関与しているかどうかは不明である(9)。一般に、食物繊維サプリメント摂取の少なくとも1時間前または2時間後に、薬を飲むべきである。
他の栄養素との相互作用
穀物の食物繊維を食事に添加すると、食事に含まれる鉄、亜鉛、カルシウム、およびマグネシウムの吸収が減ることが一般に知られているが、これは食物繊維そのものではなく、穀物の食物繊維に存在するフィチン酸塩が関係しているようである(177)。一般に、バランスのとれた食事の一部としての食物性繊維は、推奨される摂取量を摂っている健康な人達のカルシウム、マグネシウム、鉄、または亜鉛の栄養状態に悪影響を及ぼすとは考えられていない(4)。動物実験およびヒトに関する限られた研究から得られたエビデンスによると、イヌリンとオリゴフルクトースはカルシウムの吸収をよくする可能性がある(178,179)。ペクチンやグアーガムを食事に加えると、その食事からのβ-カロテン、リコピン、およびルテインといったカロテノイド類の吸収が有意に減少した(180,181)。
摂取の推奨量
全食物繊維の目安量
食物繊維が豊富な食事は心血管疾患リスクの著しい低下と関連があるという前向きコホート研究からの一貫したエビデンスに照らし合わせて、米国医学研究所の食品栄養委員会は食物繊維に関する推奨摂取量を2001年に初めて設定した(4)。全食物繊維摂取の推奨目安量は、消費カロリー1,000kcalにつき約14gの食物性繊維の摂取が冠動脈性心疾患(42,43,45)および2型糖尿病(66,67)のリスクの有意な減少と関連があるといういくつかの大規模前向きコホート研究の結果に基づいている。50歳以下の成人では、全食物繊維摂取の推奨目安量は男性で38g/日、女性で25g/日である。51歳以上の成人は、男性で30g/日、女性で21g/日である。すべての年齢の男性および女性の推奨目安量は以下の表のようになる(4)。
| ライフステージ | 年齢 | 男性(g/日) | 女性(g/日) |
|---|---|---|---|
| 幼児 | 0-6ヶ月 | 未決定 | 未決定 |
| 幼児 | 7-12ヶ月 | 未決定 | 未決定 |
| 子供 | 1-3歳 | 19 | 19 |
| 子供 | 4-8歳 | 25 | 25 |
| 子供 | 9-13歳 | 31 | 26 |
| 青少年 | 14-18歳 | 38 | 26 |
| 成人 | 19-50歳 | 38 | 25 |
| 成人 | 51歳以上 | 30 | 21 |
| 妊娠期 | 全年齢 | - | 28 |
| 授乳期 | 全年齢 | - | 29 |
食物繊維摂取を増やすための提言
- 毎日少なくとも5サービング(SV)の果物と野菜を食べる(「果物および野菜」の項参照)。
- 精白した穀物を全粒穀物に代える(「全粒穀物」の項参照)。
- 朝食にオートミール、全粒穀物のシリアル、またはふすまのシリアルを摂る。
- 少なくとも1週間に1回、大豆、インゲン豆、そら豆、えんどう豆、レンズ豆などを食べる(「豆類」の項参照)。
- ポテトチップやキャンディーなどの不健康なおやつをナッツ類やポップコーンにする(ナッツ類の項参照)。
Authors and Reviewers
Originally written in 2004 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in December 2005 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in August 2009 by:
Victoria J. Drake, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in April 2012 by:
Victoria J. Drake, Ph.D.
Linus Pauling Institute
Oregon State University
Reviewed in April 2012 by:
David M. Klurfeld, Ph.D.
National Program Leader, Human Nutrition
USDA Agricultural Research Service
Copyright 2004-2023 Linus Pauling Institute
References
1. Lupton JR. Microbial degradation products influence colon cancer risk: the butyrate controversy. J Nutr. 2004;134(2):479-482. (PubMed)
2. Ha MA, Jarvis MC, Mann JI. A definition for dietary fibre. Eur J Clin Nutr. 2000;54(12):861-864. (PubMed)
3. DeVries JW. On defining dietary fibre. Proc Nutr Soc. 2003;62(1):37-43. (PubMed)
4. Institute of Medicine. Dietary, Functional, and Total Fiber. Dietary Reference Intakes for Energy, Carbohydrate, Fiber, Fat, Fatty Acids, Cholesterol, Protein, and Amino Acids. Washington, D. C.: The National Academies Press; 2002:265-334. (The National Academies Press)
5. Trowell H. Dietary fibre, ischaemic heart disease and diabetes mellitus. Proc Nutr Soc. 1973;32(3):151-157. (PubMed)
6. Lupton JR, Turner ND. Dietary Fiber. In: Stipanuk MH, ed. Biochemical and Physiological Aspects of Human Nutrition. Philadelphia: W. B. Saunders; 2000:143-154.
7. Gallaher CM, Schneeman BO. Dietary Fiber. In: Bowman BA, Russell RM, eds. Present Knowledge in Nutrition. 8th ed. Washington, D.C.: ILSI Press; 2001:83-91.
8. Niness KR. Inulin and oligofructose: what are they? J Nutr. 1999;129(7 Suppl):1402S-1406S. (PubMed)
9. Hendler SS, Rorvik DR (eds). PDR for Nutritional Supplements. 2nd ed. Montvale: Physicians' Desk Reference Inc.; 2008.
10. Marlett JA. Content and composition of dietary fiber in 117 frequently consumed foods. J Am Diet Assoc. 1992;92(2):175-186. (PubMed)
11. Bazzano LA, Thompson AM, Tees MT, Nguyen CH, Winham DM. Non-soy legume consumption lowers cholesterol levels: a meta-analysis of randomized controlled trials. Nutr Metab Cardiovasc Dis. 2011;21(2):94-103. (PubMed)
12. Zhang Z, Lanza E, Kris-Etherton PM, et al. A high legume low glycemic index diet improves serum lipid profiles in men. Lipids. 2010;45(9):765-775. (PubMed)
13 Anderson JW, Major AW. Pulses and lipaemia, short- and long-term effect: potential in the prevention of cardiovascular disease. Br J Nutr. 2002;88(Suppl 3):S263-271. (PubMed)
14. Wolever TM, Tosh SM, Gibbs AL, et al. Physicochemical properties of oat beta-glucan influence its ability to reduce serum LDL cholesterol in humans: a randomized clinical trial. Am J Clin Nutr. 2010;92(4):723-732. (PubMed)
15. Naumann E, van Rees AB, Onning G, Oste R, Wydra M, Mensink RP. Beta-glucan incorporated into a fruit drink effectively lowers serum LDL-cholesterol concentrations. Am J Clin Nutr. 2006;83(3):601-605. (PubMed)
16. Ripsin CM, Keenan JM, Jacobs DR, Jr., et al. Oat products and lipid lowering. A meta-analysis. JAMA. 1992;267(24):3317-3325. (PubMed)
17. Brown L, Rosner B, Willett WW, Sacks FM. Cholesterol-lowering effects of dietary fiber: a meta-analysis. Am J Clin Nutr. 1999;69(1):30-42. (PubMed)
18. Queenan KM, Stewart ML, Smith KN, Thomas W, Fulcher RG, Slavin JL. Concentrated oat beta-glucan, a fermentable fiber, lowers serum cholesterol in hypercholesterolemic adults in a randomized controlled trial. Nutr J. 2007;6:6. (PubMed)
19. Reyna-Villasmil N, Bermudez-Pirela V, Mengual-Moreno E, et al. Oat-derived beta-glucan significantly improves HDLC and diminishes LDLC and non-HDL cholesterol in overweight individuals with mild hypercholesterolemia. Am J Ther. 2007;14(2):203-212. (PubMed)
20. Food and Drug Administration. Food labeling: health claims; soluble dietary fiber from certain foods and coronary heart disease. Final rule. Fed Regist. 2003;68(144):44207-44209.
21. Wei ZH, Wang H, Chen XY, et al. Time- and dose-dependent effect of psyllium on serum lipids in mild-to-moderate hypercholesterolemia: a meta-analysis of controlled clinical trials. Eur J Clin Nutr. 2009;63(7):821-827. (PubMed)
22. Pal S, Khossousi A, Binns C, Dhaliwal S, Ellis V. The effect of a fibre supplement compared to a healthy diet on body composition, lipids, glucose, insulin and other metabolic syndrome risk factors in overweight and obese individuals. Br J Nutr. 2011;105(1):90-100. (PubMed)
23. Anderson JW, Allgood LD, Lawrence A, et al. Cholesterol-lowering effects of psyllium intake adjunctive to diet therapy in men and women with hypercholesterolemia: meta-analysis of 8 controlled trials. Am J Clin Nutr. 2000;71(2):472-479. (PubMed)
24. Butt MS, Shahzadi N, Sharif MK, Nasir M. Guar gum: a miracle therapy for hypercholesterolemia, hyperglycemia and obesity. Crit Rev Food Sci Nutr. 2007;47(4):389-396. (PubMed)
25. Theuwissen E, Mensink RP. Water-soluble dietary fibers and cardiovascular disease. Physiol Behav. 2008;94(2):285-292. (PubMed)
26. Bazzano LA. Effects of soluble dietary fiber on low-density lipoprotein cholesterol and coronary heart disease risk. Curr Atheroscler Rep. 2008;10(6):473-477. (PubMed)
27. Schafer G, Schenk U, Ritzel U, Ramadori G, Leonhardt U. Comparison of the effects of dried peas with those of potatoes in mixed meals on postprandial glucose and insulin concentrations in patients with type 2 diabetes. Am J Clin Nutr. 2003;78(1):99-103. (PubMed)
28. Kabir M, Oppert JM, Vidal H, et al. Four-week low-glycemic index breakfast with a modest amount of soluble fibers in type 2 diabetic men. Metabolism. 2002;51(7):819-826. (PubMed)
29. Brand-Miller JC, Atkinson FS, Gahler RJ, Kacinik V, Lyon MR, Wood S. Effects of PGX, a novel functional fibre, on acute and delayed postprandial glycaemia. Eur J Clin Nutr. 2010;64(12):1488-1493. (PubMed)
30. Jenkins AL, Kacinik V, Lyon MR, Wolever TM. Reduction of postprandial glycemia by the novel viscous polysaccharide PGX, in a dose-dependent manner, independent of food form. J Am Coll Nutr. 2010;29(2):92-98. (PubMed)
31 Williams JA, Lai CS, Corwin H, et al. Inclusion of guar gum and alginate into a crispy bar improves postprandial glycemia in humans. J Nutr. 2004;134(4):886-889. (PubMed)
32. Sierra M, Garcia JJ, Fernandez N, Diez MJ, Calle AP, Sahagun AM. Effects of ispaghula husk and guar gum on postprandial glucose and insulin concentrations in healthy subjects. Eur J Clin Nutr. 2001;55(4):235-243. (PubMed)
33. Wolever TM, Jenkins DA. Effect of Dietary Fiber and Foods on Carbohydrate Metabolism. In: Spiller GA, ed. CRC Handbook of Dietary Fiber in Human Nutrition. 3rd ed. Boca Raton: CRC Press; 2001:321-360.
34. Marlett JA, McBurney MI, Slavin JL. Position of the American Dietetic Association: health implications of dietary fiber. J Am Diet Assoc. 2002;102(7):993-1000. (PubMed)
35. Cummings JH. The effect of dietary fiber on fecal weight and composition. In: Spiller GA, ed. Fiber in Human Nutrition. 3rd ed. Boca Raton: CRC Press; 2001:183-252.
36. Anti M, Pignataro G, Armuzzi A, et al. Water supplementation enhances the effect of high-fiber diet on stool frequency and laxative consumption in adult patients with functional constipation. Hepatogastroenterology. 1998;45(21):727-732. (PubMed)
37. American Academy of Family Physicians. Constipation: Keeping Your Bowels Moving Smoothly [Web page]. April 2000. http://familydoctor.org/online/famdocen/home/common/digestive/basics/037.html. Accessed 9/14/04.
38. Fraser GE, Sabate J, Beeson WL, Strahan TM. A possible protective effect of nut consumption on risk of coronary heart disease. The Adventist Health Study. Arch Intern Med. 1992;152(7):1416-1424. (PubMed)
39. Humble CG, Malarcher AM, Tyroler HA. Dietary fiber and coronary heart disease in middle-aged hypercholesterolemic men. Am J Prev Med. 1993;9(4):197-202. (PubMed)
40. Jacobs DR, Jr., Meyer KA, Kushi LH, Folsom AR. Whole-grain intake may reduce the risk of ischemic heart disease death in postmenopausal women: the Iowa Women's Health Study. Am J Clin Nutr. 1998;68(2):248-257. (PubMed)
41. Khaw KT, Barrett-Connor E. Dietary fiber and reduced ischemic heart disease mortality rates in men and women: a 12-year prospective study. Am J Epidemiol. 1987;126(6):1093-1102. (PubMed)
42. Pietinen P, Rimm EB, Korhonen P, et al. Intake of dietary fiber and risk of coronary heart disease in a cohort of Finnish men. The Alpha-Tocopherol, Beta-Carotene Cancer Prevention Study. Circulation. 1996;94(11):2720-2727. (PubMed)
43. Rimm EB, Ascherio A, Giovannucci E, Spiegelman D, Stampfer MJ, Willett WC. Vegetable, fruit, and cereal fiber intake and risk of coronary heart disease among men. JAMA. 1996;275(6):447-451. (PubMed)
44. Todd S, Woodward M, Tunstall-Pedoe H, Bolton-Smith C. Dietary antioxidant vitamins and fiber in the etiology of cardiovascular disease and all-causes mortality: results from the Scottish Heart Health Study. Am J Epidemiol. 1999;150(10):1073-1080. (PubMed)
45. Wolk A, Manson JE, Stampfer MJ, et al. Long-term intake of dietary fiber and decreased risk of coronary heart disease among women. JAMA. 1999;281(21):1998-2004. (PubMed)
46. Bazzano LA, He J, Ogden LG, Loria CM, Whelton PK. Dietary fiber intake and reduced risk of coronary heart disease in US men and women: the National Health and Nutrition Examination Survey I Epidemiologic Follow-up Study. Arch Intern Med. 2003;163(16):1897-1904. (PubMed)
47. Mozaffarian D, Kumanyika SK, Lemaitre RN, Olson JL, Burke GL, Siscovick DS. Cereal, fruit, and vegetable fiber intake and the risk of cardiovascular disease in elderly individuals. JAMA. 2003;289(13):1659-1666. (PubMed)
48. Streppel MT, Ocke MC, Boshuizen HC, Kok FJ, Kromhout D. Dietary fiber intake in relation to coronary heart disease and all-cause mortality over 40 y: the Zutphen Study. Am J Clin Nutr. 2008;88(4):1119-1125. (PubMed)
49. Eshak ES, Iso H, Date C, et al. Dietary fiber intake is associated with reduced risk of mortality from cardiovascular disease among Japanese men and women. J Nutr. 2010;140(8):1445-1453. (PubMed)
50. Park Y, Subar AF, Hollenbeck A, Schatzkin A. Dietary fiber intake and mortality in the NIH-AARP diet and health study. Arch Intern Med. 2011;171(12):1061-1068. (PubMed)
51. Pereira MA, O'Reilly E, Augustsson K, et al. Dietary fiber and risk of coronary heart disease: a pooled analysis of cohort studies. Arch Intern Med. 2004;164(4):370-376. (PubMed)
52. Liu S, Willett WC. Dietary glycemic load and atherothrombotic risk. Curr Atheroscler Rep. 2002;4(6):454-461. (PubMed)
53. Ford ES, Liu S. Glycemic index and serum high-density lipoprotein cholesterol concentration among US adults. Arch Intern Med. 2001;161(4):572-576. (PubMed)
54. Liu S, Manson JE, Stampfer MJ, et al. Dietary glycemic load assessed by food-frequency questionnaire in relation to plasma high-density-lipoprotein cholesterol and fasting plasma triacylglycerols in postmenopausal women. Am J Clin Nutr. 2001;73(3):560-566. (PubMed)
55. Ascherio A, Hennekens C, Willett WC, et al. Prospective study of nutritional factors, blood pressure, and hypertension among US women. Hypertension. 1996;27(5):1065-1072. (PubMed)
56. Ascherio A, Rimm EB, Giovannucci EL, et al. A prospective study of nutritional factors and hypertension among US men. Circulation. 1992;86(5):1475-1484. (PubMed)
57. Streppel MT, Arends LR, van 't Veer P, Grobbee DE, Geleijnse JM. Dietary fiber and blood pressure: a meta-analysis of randomized placebo-controlled trials. Arch Intern Med. 2005;165(2):150-156. (PubMed)
58. Whelton SP, Hyre AD, Pedersen B, Yi Y, Whelton PK, He J. Effect of dietary fiber intake on blood pressure: a meta-analysis of randomized, controlled clinical trials. J Hypertens. 2005;23(3):475-481. (PubMed)
59. King DE, Egan BM, Woolson RF, Mainous AG, 3rd, Al-Solaiman Y, Jesri A. Effect of a high-fiber diet vs a fiber-supplemented diet on C-reactive protein level. Arch Intern Med. 2007;167(5):502-506. (PubMed)
60. Ma Y, Griffith JA, Chasan-Taber L, et al. Association between dietary fiber and serum C-reactive protein. Am J Clin Nutr. 2006;83(4):760-766. (PubMed)
61. Patel VB, Robbins MA, Topol EJ. C-reactive protein: a 'golden marker' for inflammation and coronary artery disease. Cleve Clin J Med. 2001;68(6):521-524, 527-534. (PubMed)
62. Lupton JR, Turner ND. Dietary fiber and coronary disease: does the evidence support an association? Curr Atheroscler Rep. 2003;5(6):500-505. (PubMed)
63. Gross LS, Li L, Ford ES, Liu S. Increased consumption of refined carbohydrates and the epidemic of type 2 diabetes in the United States: an ecologic assessment. Am J Clin Nutr. 2004;79(5):774-779. (PubMed)
64. Wannamethee SG, Whincup PH, Thomas MC, Sattar N. Associations between dietary fiber and inflammation, hepatic function, and risk of type 2 diabetes in older men: potential mechanisms for the benefits of fiber on diabetes risk. Diabetes Care. 2009;32(10):1823-1825. (PubMed)
65. Hopping BN, Erber E, Grandinetti A, Verheus M, Kolonel LN, Maskarinec G. Dietary fiber, magnesium, and glycemic load alter risk of type 2 diabetes in a multiethnic cohort in Hawaii. J Nutr. 2010;140(1):68-74. (PubMed)
66. Salmeron J, Ascherio A, Rimm EB, et al. Dietary fiber, glycemic load, and risk of NIDDM in men. Diabetes Care. 1997;20(4):545-550. (PubMed)
67. Salmeron J, Manson JE, Stampfer MJ, Colditz GA, Wing AL, Willett WC. Dietary fiber, glycemic load, and risk of non-insulin-dependent diabetes mellitus in women. JAMA. 1997;277(6):472-477. (PubMed)
68. Meyer KA, Kushi LH, Jacobs DR, Jr., Slavin J, Sellers TA, Folsom AR. Carbohydrates, dietary fiber, and incident type 2 diabetes in older women. Am J Clin Nutr. 2000;71(4):921-930. (PubMed)
69. Stevens J, Ahn K, Juhaeri, Houston D, Steffan L, Couper D. Dietary fiber intake and glycemic index and incidence of diabetes in African-American and white adults: the ARIC study. Diabetes Care. 2002;25(10):1715-1721. (PubMed)
70. Montonen J, Knekt P, Jarvinen R, Aromaa A, Reunanen A. Whole-grain and fiber intake and the incidence of type 2 diabetes. Am J Clin Nutr. 2003;77(3):622-629. (PubMed)
71. Schulze MB, Liu S, Rimm EB, Manson JE, Willett WC, Hu FB. Glycemic index, glycemic load, and dietary fiber intake and incidence of type 2 diabetes in younger and middle-aged women. Am J Clin Nutr. 2004;80(2):348-356. (PubMed)
72. Ventura E, Davis J, Byrd-Williams C, et al. Reduction in risk factors for type 2 diabetes mellitus in response to a low-sugar, high-fiber dietary intervention in overweight Latino adolescents. Arch Pediatr Adolesc Med. 2009;163(4):320-327. (PubMed)
73. Krishnan S, Rosenberg L, Singer M, et al. Glycemic index, glycemic load, and cereal fiber intake and risk of type 2 diabetes in US black women. Arch Intern Med. 2007;167(21):2304-2309. (PubMed)
74. Schulze MB, Schulz M, Heidemann C, Schienkiewitz A, Hoffmann K, Boeing H. Fiber and magnesium intake and incidence of type 2 diabetes: a prospective study and meta-analysis. Arch Intern Med. 2007;167(9):956-965. (PubMed)
75. Knowler WC, Barrett-Connor E, Fowler SE, et al. Reduction in the incidence of type 2 diabetes with lifestyle intervention or metformin. N Engl J Med. 2002;346(6):393-403. (PubMed)
76. Tuomilehto J, Lindstrom J, Eriksson JG, et al. Prevention of type 2 diabetes mellitus by changes in lifestyle among subjects with impaired glucose tolerance. N Engl J Med. 2001;344(18):1343-1350. (PubMed)
77. Trock B, Lanza E, Greenwald P. Dietary fiber, vegetables, and colon cancer: critical review and meta-analyses of the epidemiologic evidence. J Natl Cancer Inst. 1990;82(8):650-661. (PubMed)
78. Howe GR, Benito E, Castelleto R, et al. Dietary intake of fiber and decreased risk of cancers of the colon and rectum: evidence from the combined analysis of 13 case-control studies. J Natl Cancer Inst. 1992;84(24):1887-1896. (PubMed)
79. Dahm CC, Keogh RH, Spencer EA, et al. Dietary fiber and colorectal cancer risk: a nested case-control study using food diaries. J Natl Cancer Inst. 2010;102(9):614-626. (PubMed)
80. Steinmetz KA, Kushi LH, Bostick RM, Folsom AR, Potter JD. Vegetables, fruit, and colon cancer in the Iowa Women's Health Study. Am J Epidemiol. 1994;139(1):1-15. (PubMed)
81. Kato I, Akhmedkhanov A, Koenig K, Toniolo PG, Shore RE, Riboli E. Prospective study of diet and female colorectal cancer: the New York University Women's Health Study. Nutr Cancer. 1997;28(3):276-281. (PubMed)
82. Pietinen P, Malila N, Virtanen M, et al. Diet and risk of colorectal cancer in a cohort of Finnish men. Cancer Causes Control. 1999;10(5):387-396. (PubMed)
83. Terry P, Giovannucci E, Michels KB, et al. Fruit, vegetables, dietary fiber, and risk of colorectal cancer. J Natl Cancer Inst. 2001;93(7):525-533. (PubMed)
84. Mai V, Flood A, Peters U, Lacey JV, Jr., Schairer C, Schatzkin A. Dietary fibre and risk of colorectal cancer in the Breast Cancer Detection Demonstration Project (BCDDP) follow-up cohort. Int J Epidemiol. 2003;32(2):234-239. (PubMed)
85. Lin J, Zhang SM, Cook NR, et al. Dietary intakes of fruit, vegetables, and fiber, and risk of colorectal cancer in a prospective cohort of women (United States). Cancer Causes Control. 2005;16(3):225-233. (PubMed)
86. Michels KB, Fuchs CS, Giovannucci E, et al. Fiber intake and incidence of colorectal cancer among 76,947 women and 47,279 men. Cancer Epidemiol Biomarkers Prev. 2005;14(4):842-849. (PubMed)
87. Shin A, Li H, Shu XO, Yang G, Gao YT, Zheng W. Dietary intake of calcium, fiber and other micronutrients in relation to colorectal cancer risk: Results from the Shanghai Women's Health Study. Int J Cancer. 2006;119(12):2938-2942. (PubMed)
88. Otani T, Iwasaki M, Ishihara J, Sasazuki S, Inoue M, Tsugane S. Dietary fiber intake and subsequent risk of colorectal cancer: the Japan Public Health Center-based prospective study. Int J Cancer. 2006;119(6):1475-1480. (PubMed)
89. Schatzkin A, Mouw T, Park Y, et al. Dietary fiber and whole-grain consumption in relation to colorectal cancer in the NIH-AARP Diet and Health Study. Am J Clin Nutr. 2007;85(5):1353-1360. (PubMed)
90. Park Y, Hunter DJ, Spiegelman D, et al. Dietary fiber intake and risk of colorectal cancer: a pooled analysis of prospective cohort studies. JAMA. 2005;294(22):2849-2857. (PubMed)
91. Bingham SA, Day NE, Luben R, et al. Dietary fibre in food and protection against colorectal cancer in the European Prospective Investigation into Cancer and Nutrition (EPIC): an observational study. Lancet. 2003;361(9368):1496-1501. (PubMed)
92. Schatzkin A, Lanza E, Corle D, et al. Lack of effect of a low-fat, high-fiber diet on the recurrence of colorectal adenomas. Polyp Prevention Trial Study Group. N Engl J Med. 2000;342(16):1149-1155. (PubMed)
93. Alberts DS, Martinez ME, Roe DJ, et al. Lack of effect of a high-fiber cereal supplement on the recurrence of colorectal adenomas. Phoenix Colon Cancer Prevention Physicians' Network. N Engl J Med. 2000;342(16):1156-1162. (PubMed)
94. Ishikawa H, Akedo I, Otani T, et al. Randomized trial of dietary fiber and Lactobacillus casei administration for prevention of colorectal tumors. Int J Cancer. 2005;116(5):762-767. (PubMed)
95. Bonithon-Kopp C, Kronborg O, Giacosa A, Rath U, Faivre J. Calcium and fibre supplementation in prevention of colorectal adenoma recurrence: a randomised intervention trial. European Cancer Prevention Organisation Study Group. Lancet. 2000;356(9238):1300-1306. (PubMed)
96. Giovannucci E, Stampfer MJ, Colditz G, Rimm EB, Willett WC. Relationship of diet to risk of colorectal adenoma in men. J Natl Cancer Inst. 1992;84(2):91-98. (PubMed)
97. Van 't Veer P, Kolb CM, Verhoef P, et al. Dietary fiber, beta-carotene and breast cancer: results from a case-control study. Int J Cancer. 1990;45(5):825-828.
98. Baghurst PA, Rohan TE. High-fiber diets and reduced risk of breast cancer. Int J Cancer. 1994;56(2):173-176. (PubMed)
99. Yuan JM, Wang QS, Ross RK, Henderson BE, Yu MC. Diet and breast cancer in Shanghai and Tianjin, China. Br J Cancer. 1995;71(6):1353-1358. (PubMed)
100. Ronco A, De Stefani E, Boffetta P, Deneo-Pellegrini H, Mendilaharsu M, Leborgne F. Vegetables, fruit, and related nutrients and risk of breast cancer: a case-control study in Uruguay. Nutr Cancer. 1999;35(2):111-119. (PubMed)
101. Belle FN, Kampman E, McTiernan A, et al. Dietary fiber, carbohydrates, glycemic index, and glycemic load in relation to breast cancer prognosis in the HEAL cohort. Cancer Epidemiol Biomarkers Prev. 2011;20(5):890-899. (PubMed)
102. Graham S, Zielezny M, Marshall J, et al. Diet in the epidemiology of postmenopausal breast cancer in the New York State Cohort. Am J Epidemiol. 1992;136(11):1327-1337. (PubMed)
103. Terry P, Jain M, Miller AB, Howe GR, Rohan TE. No association among total dietary fiber, fiber fractions, and risk of breast cancer. Cancer Epidemiol Biomarkers Prev. 2002;11(11):1507-1508. (PubMed)
104. Cho E, Spiegelman D, Hunter DJ, Chen WY, Colditz GA, Willett WC. Premenopausal dietary carbohydrate, glycemic index, glycemic load, and fiber in relation to risk of breast cancer. Cancer Epidemiol Biomarkers Prev. 2003;12(11 Pt 1):1153-1158. (PubMed)
105. Holmes MD, Liu S, Hankinson SE, Colditz GA, Hunter DJ, Willett WC. Dietary carbohydrates, fiber, and breast cancer risk. Am J Epidemiol. 2004;159(8):732-739. (PubMed)
106. Lajous M, Boutron-Ruault MC, Fabre A, Clavel-Chapelon F, Romieu I. Carbohydrate intake, glycemic index, glycemic load, and risk of postmenopausal breast cancer in a prospective study of French women. Am J Clin Nutr. 2008;87(5):1384-1391. (PubMed)
107. Wen W, Shu XO, Li H, et al. Dietary carbohydrates, fiber, and breast cancer risk in Chinese women. Am J Clin Nutr. 2009;89(1):283-289. (PubMed)
108. Maruti SS, Lampe JW, Potter JD, Ready A, White E. A prospective study of bowel motility and related factors on breast cancer risk. Cancer Epidemiol Biomarkers Prev. 2008;17(7):1746-1750. (PubMed)
109. Cade JE, Burley VJ, Greenwood DC. Dietary fibre and risk of breast cancer in the UK Women's Cohort Study. Int J Epidemiol. 2007;36(2):431-438. (PubMed)
110. Mattisson I, Wirfalt E, Johansson U, Gullberg B, Olsson H, Berglund G. Intakes of plant foods, fibre and fat and risk of breast cancer--a prospective study in the Malmo Diet and Cancer cohort. Br J Cancer. 2004;90(1):122-127. (PubMed)
111. Park Y, Brinton LA, Subar AF, Hollenbeck A, Schatzkin A. Dietary fiber intake and risk of breast cancer in postmenopausal women: the National Institutes of Health-AARP Diet and Health Study. Am J Clin Nutr. 2009;90(3):664-671. (PubMed)
112. Dong JY, He K, Wang P, Qin LQ. Dietary fiber intake and risk of breast cancer: a meta-analysis of prospective cohort studies. Am J Clin Nutr. 2011;94(3):900-905. (PubMed)
113. Rock CL, Flatt SW, Thomson CA, et al. Effects of a high-fiber, low-fat diet intervention on serum concentrations of reproductive steroid hormones in women with a history of breast cancer. J Clin Oncol. 2004;22(12):2379-2387. (PubMed)
114. Kasim-Karakas SE, Almario RU, Gregory L, Todd H, Wong R, Lasley BL. Effects of prune consumption on the ratio of 2-hydroxyestrone to 16alpha-hydroxyestrone. Am J Clin Nutr. 2002;76(6):1422-1427. (PubMed)
115. Korzenik JR. Case closed? Diverticulitis: epidemiology and fiber. J Clin Gastroenterol. 2006;40(Suppl 3):S112-116. (PubMed)
116. Bogardus ST, Jr. What do we know about diverticular disease? A brief overview. J Clin Gastroenterol. 2006;40(Suppl 3):S108-111. (PubMed)
117. Peery AF, Barrett PR, Park D, et al. A high-fiber diet does not protect against asymptomatic diverticulosis. Gastroenterology. 2012;142(2):266-272e1. (PubMed)
118. Farrell RJ, Farrell JJ, Morrin MM. Diverticular disease in the elderly. Gastroenterol Clin North Am. 2001;30(2):475-496. (PubMed)
119. Aldoori WH, Giovannucci EL, Rockett HR, Sampson L, Rimm EB, Willett WC. A prospective study of dietary fiber types and symptomatic diverticular disease in men. J Nutr. 1998;128(4):714-719. (PubMed)
120. Howarth NC, Saltzman E, Roberts SB. Dietary fiber and weight regulation. Nutr Rev. 2001;59(5):129-139. (PubMed)
121. Du H, van der AD, Boshuizen HC, et al. Dietary fiber and subsequent changes in body weight and waist circumference in European men and women. Am J Clin Nutr. 2010;91(2):329-336. (PubMed)
122. Appleby PN, Thorogood M, Mann JI, Key TJ. Low body mass index in non-meat eaters: the possible roles of animal fat, dietary fibre and alcohol. Int J Obes Relat Metab Disord. 1998;22(5):454-460. (PubMed)
123. Miller WC, Niederpruem MG, Wallace JP, Lindeman AK. Dietary fat, sugar, and fiber predict body fat content. J Am Diet Assoc. 1994;94(6):612-615. (PubMed)
124. Davis JN, Hodges VA, Gillham MB. Normal-weight adults consume more fiber and fruit than their age- and height-matched overweight/obese counterparts. J Am Diet Assoc. 2006;106(6):833-840. (PubMed)
125. Liu S, Willett WC, Manson JE, Hu FB, Rosner B, Colditz G. Relation between changes in intakes of dietary fiber and grain products and changes in weight and development of obesity among middle-aged women. Am J Clin Nutr. 2003;78(5):920-927. (PubMed)
126. Saltzman E, Moriguti JC, Das SK, et al. Effects of a cereal rich in soluble fiber on body composition and dietary compliance during consumption of a hypocaloric diet. J Am Coll Nutr. 2001;20(1):50-57. (PubMed)
127. Howarth NC, Saltzman E, McCrory MA, et al. Fermentable and nonfermentable fiber supplements did not alter hunger, satiety or body weight in a pilot study of men and women consuming self-selected diets. J Nutr. 2003;133(10):3141-3144. (PubMed)
128. Wanders AJ, van den Borne JJ, de Graaf C, et al. Effects of dietary fibre on subjective appetite, energy intake and body weight: a systematic review of randomized controlled trials. Obes Rev. 2011;12(9):724-739. (PubMed)
129 Lubin F, Lusky A, Chetrit A, Dankner R. Lifestyle and ethnicity play a role in all-cause mortality. J Nutr. 2003;133(4):1180-1185. (PubMed)
130. Baer HJ, Glynn RJ, Hu FB, et al. Risk factors for mortality in the nurses' health study: a competing risks analysis. Am J Epidemiol. 2011;173(3):319-329. (PubMed)
131. Giacco R, Parillo M, Rivellese AA, et al. Long-term dietary treatment with increased amounts of fiber-rich low-glycemic index natural foods improves blood glucose control and reduces the number of hypoglycemic events in type 1 diabetic patients. Diabetes Care. 2000;23(10):1461-1466. (PubMed)
132. Chandalia M, Garg A, Lutjohann D, von Bergmann K, Grundy SM, Brinkley LJ. Beneficial effects of high dietary fiber intake in patients with type 2 diabetes mellitus. N Engl J Med. 2000;342(19):1392-1398. (PubMed)
133. Groop PH, Aro A, Stenman S, Groop L. Long-term effects of guar gum in subjects with non-insulin-dependent diabetes mellitus. Am J Clin Nutr. 1993;58(4):513-518. (PubMed)
134. Sierra M, Garcia JJ, Fernandez N, Diez MJ, Calle AP. Therapeutic effects of psyllium in type 2 diabetic patients. Eur J Clin Nutr. 2002;56(9):830-842. (PubMed)
135. Anderson JW, Allgood LD, Turner J, Oeltgen PR, Daggy BP. Effects of psyllium on glucose and serum lipid responses in men with type 2 diabetes and hypercholesterolemia. Am J Clin Nutr. 1999;70(4):466-473. (PubMed)
136. Anderson JW, Randles KM, Kendall CW, Jenkins DJ. Carbohydrate and fiber recommendations for individuals with diabetes: a quantitative assessment and meta-analysis of the evidence. J Am Coll Nutr. 2004;23(1):5-17. (PubMed)
137. American Diabetes Association position statement: evidence-based nutrition principles and recommendations for the treatment and prevention of diabetes and related complications. J Am Diet Assoc. 2002;102(1):109-118. (PubMed)
138. Dietary recommendations for people with diabetes: an update for the 1990s. Nutrition Subcommittee of the British Diabetic Association's Professional Advisory Committee. Diabet Med. 1992;9(2):189-202. (PubMed)
139. Canadian Diabetes Association, National Nutrition Committee. Guidelines for the Nutritional Management of Diabetes Mellitus in the New Millennium: A Position Statement of the Canadian Diabetes Association. Can J Diabetes Care. 1999;23(3):56-69.
140. Jenkins DJ, Kendall CW, Augustin LS, et al. Effect of wheat bran on glycemic control and risk factors for cardiovascular disease in type 2 diabetes. Diabetes Care. 2002;25(9):1522-1528. (PubMed)
141. Horwitz BJ, Fisher RS. The irritable bowel syndrome. N Engl J Med. 2001;344(24):1846-1850. (PubMed)
142. Jailwala J, Imperiale TF, Kroenke K. Pharmacologic treatment of the irritable bowel syndrome: a systematic review of randomized, controlled trials. Ann Intern Med. 2000;133(2):136-147. (PubMed)
143. Ford AC, Talley NJ, Spiegel BM, et al. Effect of fibre, antispasmodics, and peppermint oil in the treatment of irritable bowel syndrome: systematic review and meta-analysis. BMJ. 2008;337:a2313. (PubMed)
144. Quartero AO, Meineche-Schmidt V, Muris J, Rubin G, de Wit N. Bulking agents, antispasmodic and antidepressant medication for the treatment of irritable bowel syndrome. Cochrane Database Syst Rev. 2005;(2):CD003460. (PubMed)
145. Bijkerk CJ, de Wit NJ, Muris JW, Whorwell PJ, Knottnerus JA, Hoes AW. Soluble or insoluble fibre in irritable bowel syndrome in primary care? Randomised placebo controlled trial. BMJ. 2009;339:b3154. (PubMed)
146. Bijkerk CJ, Muris JW, Knottnerus JA, Hoes AW, de Wit NJ. Systematic review: the role of different types of fibre in the treatment of irritable bowel syndrome. Aliment Pharmacol Ther. 2004;19(3):245-251. (PubMed)
147. Viera AJ, Hoag S, Shaughnessy J. Management of irritable bowel syndrome. Am Fam Physician. 2002;66(10):1867-1874. (PubMed)
148. Mertz HR. Irritable bowel syndrome. N Engl J Med. 2003;349(22):2136-2146. (PubMed)
149. Giannini EG, Mansi C, Dulbecco P, Savarino V. Role of partially hydrolyzed guar gum in the treatment of irritable bowel syndrome. Nutrition. 2006;22(3):334-342. (PubMed)
150. US Department of Agriculture, Agricultural Research Service. USDA Nutrient Database for Standard Reference. Release 24. 2011. Available at: http://ndb.nal.usda.gov/ndb/foods/list. Accessed 4/6/12.
151. Hendler SS, Rorvik DR (eds). PDR for Nutritional Supplements. Montvale: Medical Economics Company, Inc; 2001.
152. Gibson GR, Beatty ER, Wang X, Cummings JH. Selective stimulation of bifidobacteria in the human colon by oligofructose and inulin. Gastroenterology. 1995;108(4):975-982. (PubMed)
153. Kolida S, Tuohy K, Gibson GR. Prebiotic effects of inulin and oligofructose. Br J Nutr. 2002;87(Suppl 2):S193-197. (PubMed)
154. Cummings JH, Macfarlane GT. Gastrointestinal effects of prebiotics. Br J Nutr. 2002;87(Suppl 2):S145-151. (PubMed)
155. Duggan C, Penny ME, Hibberd P, et al. Oligofructose-supplemented infant cereal: 2 randomized, blinded, community-based trials in Peruvian infants. Am J Clin Nutr. 2003;77(4):937-942. (PubMed)
156. Pittler MH, Ernst E. Guar gum for body weight reduction: meta-analysis of randomized trials. Am J Med. 2001;110(9):724-730. (PubMed)
157. Gallaher CM, Munion J, Hesslink R, Jr., Wise J, Gallaher DD. Cholesterol reduction by glucomannan and chitosan is mediated by changes in cholesterol absorption and bile acid and fat excretion in rats. J Nutr. 2000;130(11):2753-2759. (PubMed)
158. Pittler MH, Ernst E. Dietary supplements for body-weight reduction: a systematic review. Am J Clin Nutr. 2004;79(4):529-536. (PubMed)
159. Bokura H, Kobayashi S. Chitosan decreases total cholesterol in women: a randomized, double-blind, placebo-controlled trial. Eur J Clin Nutr. 2003;57(5):721-725. (PubMed)
160. Wuolijoki E, Hirvela T, Ylitalo P. Decrease in serum LDL cholesterol with microcrystalline chitosan. Methods Find Exp Clin Pharmacol. 1999;21(5):357-361. (PubMed)
161. Metso S, Ylitalo R, Nikkila M, Wuolijoki E, Ylitalo P, Lehtimaki T. The effect of long-term microcrystalline chitosan therapy on plasma lipids and glucose concentrations in subjects with increased plasma total cholesterol: a randomised placebo-controlled double-blind crossover trial in healthy men and women. Eur J Clin Pharmacol. 2003;59(10):741-746. (PubMed)
162. Ho SC, Tai ES, Eng PH, Tan CE, Fok AC. In the absence of dietary surveillance, chitosan does not reduce plasma lipids or obesity in hypercholesterolaemic obese Asian subjects. Singapore Med J. 2001;42(1):006-010. (PubMed)
163. American Academy of Family Physicians. Fiber: How to Increase the Amount in Your Diet [Web page]. March, 2004. Available at: http://www.aafp.org/afp/2004/0215/p930.html. Accessed 4/13/12.
164. Papazian R. Bulking Up Fiber's Healthful Reputation: More Benefits of 'Roughage Are Discovered'. Food and Drug Administration, [Web page]. September, 1998. http://vm.cfsan.fda.gov/~dms/fdafiber.html. Accessed 8/27/09.
165. Rosario PG, Gerst PH, Prakash K, Albu E. Dentureless distention: oat bran bezoars cause obstruction. J Am Geriatr Soc. 1990;38(5):608. (PubMed)
166. Miller DL, Miller PF, Dekker JJ. Small-bowel obstruction from bran cereal. JAMA. 1990;263(6):813-814. (PubMed)
167. Cooper SG, Tracey EJ. Small-bowel obstruction caused by oat-bran bezoar. N Engl J Med. 1989;320(17):1148-1149. (PubMed)
168. McClurken JB, Carp NZ. Bran-induced small-intestinal obstruction in a patient with no history of abdominal operation. Arch Surg. 1988;123(1):98-100. (PubMed)
169. Lewis JH. Esophageal and small bowel obstruction from guar gum-containing "diet pills": analysis of 26 cases reported to the Food and Drug Administration. Am J Gastroenterol. 1992;87(10):1424-1428. (PubMed)
170. Agha FP, Nostrant TT, Fiddian-Green RG. "Giant colonic bezoar:" a medication bezoar due to psyllium seed husks. Am J Gastroenterol. 1984;79(4):319-321. (PubMed)
171. Schneider RP. Perdiem causes esophageal impaction and bezoars. South Med J. 1989;82(11):1449-1450. (PubMed)
172. Chandra R, Barron JL. Anaphylactic reaction to intravenous sinistrin (Inutest). Ann Clin Biochem. 2002;39(Pt 1):76. (PubMed)
173. Gay-Crosier F, Schreiber G, Hauser C. Anaphylaxis from inulin in vegetables and processed food. N Engl J Med. 2000;342(18):1372. (PubMed)
174. Khalili B, Bardana EJ, Jr., Yunginger JW. Psyllium-associated anaphylaxis and death: a case report and review of the literature. Ann Allergy Asthma Immunol. 2003;91(6):579-584. (PubMed)
175. Fugh-Berman A. Herb-drug interactions. Lancet. 2000;355(9198):134-138. (PubMed)
176. Richter WO, Jacob BG, Schwandt P. Interaction between fibre and lovastatin. Lancet. 1991;338(8768):706. (PubMed)
177. Greger JL. Nondigestible carbohydrates and mineral bioavailability. J Nutr. 1999;129(7 Suppl):1434S-1435S. (PubMed)
178. Bosscher D, Van Caillie-Bertrand M, Van Cauwenbergh R, Deelstra H. Availabilities of calcium, iron, and zinc from dairy infant formulas is affected by soluble dietary fibers and modified starch fractions. Nutrition. 2003;19(7-8):641-645. (PubMed)
179. Scholz-Ahrens KE, Schrezenmeir J. Inulin, oligofructose and mineral metabolism - experimental data and mechanism. Br J Nutr. 2002;87(Suppl 2):S179-186. (PubMed)
180. Rock CL, Swendseid ME. Plasma beta-carotene response in humans after meals supplemented with dietary pectin. Am J Clin Nutr. 1992;55(1):96-99. (PubMed)
181. Riedl J, Linseisen J, Hoffmann J, Wolfram G. Some dietary fibers reduce the absorption of carotenoids in women. J Nutr. 1999;129(12):2170-2176. (PubMed)
食事性因子
植物性化合物
植物性化学物質は、厳密には植物によって生成される化学物質と定義される。しかしこの用語は、必須栄養素ではないものの健康に影響するかもしれない植物由来の化学物質を表すことに一般的に使用されている。果物、野菜、豆類、全粒穀物、およびナッツの豊富な食事の健康への有益さを裏付ける豊富なエビデンス(科学的根拠)があるが、これらの効果が特定の栄養素や植物性化学物質によるものだとするエビデンスは限られている。植物性食品は生理活性化合物の複雑な混合物であるので、個々の植物性化学物質の潜在的健康効果の情報は、それらの植物性化学物質を含む食物の健康効果の情報にリンクしている。
詳細情報については、リストから植物性化学物質を選択のこと。
ライナス・ポーリング研究所の微量栄養素情報センター発信の食事性の植物性化学物質に関する情報は、「An Evidence-based Approach to Phytochemicals and Other Dietary Factors(植物性化学物質およびその他の食事性要因へのエビデンスに基づくアプローチ)」と題する本によって現在利用可能である。この本は ライナス・ポーリング研究所 または Thieme Medical Publishersから購入可能である。
カロテノイド
目次
α-カロテン、β-カロテン、β-クリプトキサンチン、リコピン、ルテイン、ゼアキサンチン
要約
- カロテノイド類(以下、カロテノイド)は植物によって合成される黄色、オレンジ、および赤の色素である。北米の食事で最も一般的なカロテノイドは、α-カロテン、β-カロテン、β-クリプトキサンチン、ルテイン、ゼアキサンチン、およびリコピンである。
- α-カロテン、β-カロテン、およびβ-クリプトキサンチンはビタミンA前駆体カロテノイドで、体内でレチノール(ビタミンA)に変換されうる。ルテイン、ゼアキサンチン、およびリコピンはビタミンA活性がない。(詳細はこちら)
- 現在では、ヒトでのカロテノイドの生物学的効果が、その抗酸化作用またはその他の非抗酸化作用に関連しているのかどうか不明である。(詳細はこちら)
- カロテノイドの豊富な果物や野菜が多い食事が心血管疾患やある種のがんのリスクの減少と関連しているという疫学的研究の結果があるが、大規模な無作為化対照試験では、心血管疾患やがんのリスクがβ-カロテンの高用量サプリメントによって減ることはなかった (詳細はこちら)。
- 2例の無作為化対照試験で、高用量β-カロテンサプリメントの摂取が多いと、喫煙者およびアスベスト作業経験者の肺がんリスクが増加したことがわかった。(詳細はこちら)
- トマトやトマト製品からのリコピンの摂取が多かった男性は摂取の少ない男性よりも前立腺がんを発症しにくいという疫学的研究がいくつかあるが、リコピンのサプリメントが前立腺がんの発症や重症度を軽減するのかは不明である。(詳細はこちら)
- 目の網膜と水晶体にあるカロテノイドは、ルテインとゼアキサンチンだけである。ルテインとゼアキサンチンの豊富な食事が加齢性黄斑変性や白内障の進行を遅らせる可能性があるという疫学的研究があるが、ルテインとゼアキサンチンのサプリメントがこれらの加齢性疾患の進行を遅らせるのかどうかは不明である。(詳細はこちら)
- カロテノイドは食事に含まれる脂肪といっしょに摂取すると、一番良く吸収される。カロテノイドを含む野菜を刻んだりピューレにしたり油といっしょに加熱したりすると、それらが含むカロテノイドの生物活性が一般的に高まる。(詳細はこちら)
序説
カロテノイドは植物、藻類、および光合成バクテリアによって合成される600種以上の自然界に存在する色素類である。これらの色彩豊かな分子が多くの植物の黄色、オレンジ、そして赤い色の元となっている(1)。ヒトの食事では、カロテノイドの大部分が果物と野菜によるものである。α-カロテン、β-カロテン、β-クリプトキサンチン、ルテイン、リコピン、およびゼアキサンチンが食事に含まれる最も一般的なカロテノイドである。α-カロテン、β-カロテン、およびβ-クリプトキサンチンはビタミンA前駆体で、体内でレチノールに変換されうる(図1参照)。ルテイン、 リコピン、およびゼアキサンチンはレチノールに変換されないので、ビタミンA活性がない(図2参照)。カロテノイドは、カロテン類(α-カロテン、β-カロテン、およびリコピン)と、キサントフィル類(β-クリプトキサンチン、ルテイン、およびゼアキサンチン)という2つの種類に大きく分けられる。
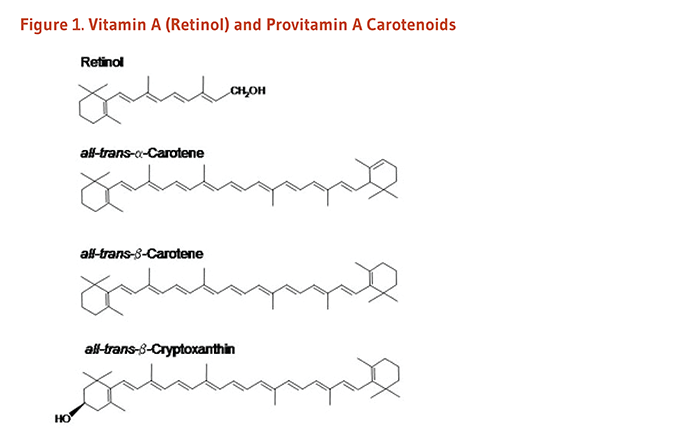

代謝と生物学的利用度
食事からのカロテノイドが小腸で吸収されるには、それらが食品マトリックス(食品組織を構成する細胞間質など)から遊離して混合ミセル(胆汁酸塩と数種類の脂質の混合物)に組み込まれなければならない(2)。したがって、カロテノイドの吸収には食事に脂肪が含まれていることが必要である。食事にわずか3~5gでも脂肪があれば、カロテノイドの吸収を確実にするのに十分である(3,4)。植物食品のマトリックスから遊離される必要がないので、サプリメント中の(油分に含まれた)カロテノイドは、食品のカロテノイドよりも効率的に吸収される(4)。小腸を作りあげている細胞(腸細胞)の中で、カロテノイドは中性脂肪の豊富なカイロミクロンと呼ばれるリポ蛋白質に組み込まれ、血液中に放出される(2)。中性脂肪はリポ蛋白質リパーゼと呼ばれる酵素によって血液中のカイロミクロンから取り除かれ、カイロミクロンレムナントが生成される。カイロミクロンレムナントは肝臓に取り込まれ、そこでカロテノイドはリポ蛋白質に取り込まれて血液中に戻される。腸や肝臓では、ビタミンA前駆体であるカロテノイドは開裂して、ビタミンAの一種であるレチノールを生成するかも知れない。ビタミンA前駆体カロテノイドからビタミンAへの変換は、個人のビタミンAの栄養状態によって影響を受ける(5)。ヒトでの調節機構は未だにはっきりしないが、ビタミンAが豊富に体内に貯蔵されていると、ビタミンA前駆体カロテノイドの開裂が抑制されるようである。
生物活性
ビタミンA活性
ビタミンAは正常な成長や発達、免疫機能、および視覚に欠かせない。現在では、ヒトで認知されているカロテノイドの唯一不可欠の機能は、ビタミンAの供給源となるビタミンA前駆体カロテノイド(α-カロテン、β-カロテン、およびβ-クリプトキサンチン)としての機能である(6)。食品に含まれるβ-カロテンのビタミンAとしての活性はレチノール(既成ビタミンA)の12分の1であり、α-カロテンやβ-クリプトキサンチンのそれはいずれもレチノールの24分の1である(6)。
抗酸化活性
植物では、光合成で発生するオキシダント(酸化剤)である一重項酸素を抑える(不活性化する)という重要な抗酸化機能をカロテノイドが担っている(7)。試験管内での研究結果からは、リコピンが最も一重項酸素の抑制作用が高いカロテノイドの一つであることが示されている(8)。植物では重要なことではあるが、一重項酸素の抑制とヒトの健康との関連性は、植物ほど明らかではない。試験管での研究では、カロテノイドがある条件下で脂肪の酸化(脂質過酸化反応)も抑制することが示されているが、ヒトにおけるそれらの作用はもっと複雑なようだ(9)。現在では、ヒトでのカロテノイドの生物学的効果がその抗酸化活性の結果なのかその他の非抗酸化メカニズムによるものなのかはっきりしていない。
光のフィルタリング
すべてのカロテノイドに共通な二重結合と単結合が交互につながった長い構造によって、カロテノイドは可視光を吸収することができる(7)。この特徴は眼にとって特に関係があり、眼ではルテインとゼアキサンチンが青の光を効率よく吸収する。眼の視覚構造に重要な箇所に到達する青い光を減らすことは、光によって引き起こされる酸化ダメージから眼を守っている可能性がある(10)。
細胞間情報伝達
カロテノイドはコネキシンという蛋白質の合成を助長して、近接する培養細胞間の情報伝達を促進している(11)。コネキシンは細胞膜の間の細孔(ギャップ結合)を形成し、小分子の交換による細胞間の情報伝達を可能にする。この種の細胞間情報伝達は細胞が分化状態を保つのに重要であり、がんの細胞では失われていることも多い。カロテノイドはコネキシン蛋白質の情報をコード化する遺伝子の発現を促進して、細胞間情報伝達を促す。これは様々なカロテノイドが有しているビタミンA活性や抗酸化活性とは無関係な作用のようである(12)。
免疫系の活性
ビタミンAは免疫系の機能の正常な作用に不可欠であるので、ビタミンA前駆体カロテノイドの効能がカロテノイドのビタミンA活性に関連するのか、それともその他の活性に関連するのかを見極めることは困難である。β-カロテンの補給によって免疫の機能を示すいくつかのバイオマーカーの値が向上したという臨床試験もある(13-15)が、ビタミンA活性のないカロテノイドであるリコピンやルテインの摂取を増加させても、ヒトの免疫機能に関するバイオマーカーの値が同様に向上することはなかった(16-18)。
欠乏症
ビタミンA前駆体カロテノイド(α-カロテン、β-カロテン、およびβ-クリプトキサンチン)を摂取すれば、ビタミンA欠乏症を防ぐことができる。しかし、適切な量のビタミンAを摂取すれば、カロテノイドの量が少ない食事をしても明白な欠乏症は見られない(6)。2000年に、それまでに発表された科学的研究を再調査した結果、カロテノイド摂取の推奨量(RDA)や目安量(AI)を設定するには現在のエビデンスでは不十分と米国医学研究所の食品栄養委員会は判断した。そこで委員会はビタミンAについての推奨量を設定した。米国国立がん研究所、米国がん協会、および米国心臓協会による多様な果物や野菜の摂取の推奨は、カロテノイドの摂取増加を部分的に意図している。
疾病予防
肺がん
食事からのカロテノイド
β-カロテンは食品やヒトの血液で初めて測定されたカロテノイドである。初期の観察研究の結果から肺がんリスクとβ-カロテン摂取との間に逆相関があることが示唆され、それはβ-カロテンの血中濃度の測定で評価されることが多かった(19,20)。より最近になって食品中のその他のカロテノイドのデータベースが開発されてくると、カロテノイド全体および個々のカロテノイドの食事からの摂取がより正確に推定できるようになった。初期の後ろ向き研究と対照的に、最近の前向きコホート研究では、β-カロテンの摂取と肺がんリスクとの間の一貫した逆相関は見られてはいない。食事からのカロテノイドの摂取と肺がんリスクに関して12万人以上の男女を少なくとも10年間追跡した米国での2つの大規模前向きコホート研究の分析では、食事からのβ-カロテンの摂取と肺がんリスクとの間に有意な相関(関係)は見つからなかった(21)。しかしながら、全カロテノイド、α-カロテン、およびリコピンの摂取が最も多かった男女は、摂取が最少であった男女よりも有意に肺がんリスクが低かった。27,000人以上の男性喫煙者を14年間調べたフィンランドでの研究では、β-カロテンを除いて全カロテノイド、リコピン、β-クリプトキサンチン、ルテイン、およびゼアキサンチンの食事からの摂取が肺がんリスクを有意に減らしていた(22)。一方で、58,000人以上のオランダ人男性を対象にした6年間の研究では、β-クリプトキサンチン、ルテイン、およびゼアキサンチンの食事からの摂取だけが肺がんリスクと逆相関があった(23)。北米およびヨーロッパにおける6つの前向きコホート研究を統合した結果でも、食事からのβ-カロテン摂取と肺がんリスクとの関連は見られなかったが、β-クリプトキサンチン摂取が最も多い者は摂取が最少である者に比べて24%肺がんリスクが低かった(24)。肺がんには喫煙が最も大きなリスク要因であるが、食事からのカロテノイド摂取を正確に推定する最近の前向き研究の結果は、β-カロテンだけでなく多種のカロテノイドの豊富な食事が肺がんリスクの低減と関連している可能性を示している。しかしながら、最近の前向きコホート研究のシステマティック・レビューでは、肺がんの発症に対する食事からのカロテノイドの予防的効果は小さく、統計的に有意ではないと結論づけられている(25)。
β-カロテンのサプリメント
肺がんの発症に対するβ-カロテンの補給の効果は、3つの大規模な無作為化プラセボ対照試験で調べられている。フィンランドでは、α-トコフェロール・β-カロテンがん予防試験(ATBC)で29,000人以上の男性喫煙者に20mg/日のβ-カロテンおよび/または50mg/日のα-トコフェロールを与えた効果を調べた(26)。米国ではβ-カロテンおよびレチノール有効性試験(CARET)で、30mg/日のβ-カロテンと25,000IU/日のレチノール(ビタミンA)の組み合わせを、喫煙者、以前に喫煙していた者、または職業的にアスベストに接していた18,000人以上の男女に与えた効果を調べた(27)。意外なことに、β-カロテンのサプリメントを摂っていたグループの肺がんリスクが、ATBCの参加者で6年後に16%増加し、CARETの参加者でも4年後に28%増加した。米国で22,000人以上の男性医師を対象にした医師健康調査では、がんリスクに対するβ-カロテン補給(50mgを1日おき)の効果を調べたが、喫煙者はそのうちのわずか11%であった(28)。そのようにリスクが低い集団では、12年以上のβ-カロテン補給は肺がんリスクの上昇とは無関連であった。肺がんリスクの増加の理由は明らかでないが、いくつかのメカニズムが提唱されている(29)。多くの専門家は、特に喫煙者やその他のハイリスク集団においては、高用量β-カロテン補給の危険性の方ががん予防効果を凌ぐのではないかと考えている(30,31)。β-カロテンは、単体でサプリメントとして売られているだけでなく、 目の健康を促すとして売られているサプリメントにも含まれている(32)。
前立腺がん
食事からのリコピン
いくつかの前向きコホート研究の結果から、リコピンが豊富な食事は、前立腺がん、中でも特に悪性の前立腺がんのリスク低減と関連があることが示唆された(33)。47,000人以上の医療関係者を8年間追跡した前向き研究で、リコピンの摂取が最大の者は最少の者に比べて21%前立腺がんのリスクが低かった(34)。(リコピン摂取全体の82%を占める)トマトやトマト製品の摂取が最大の者は、最少の者に比べて前立腺がんのリスクが35%低く、悪性の前立腺がんのリスクも53%低かった。同様に、セブンスデー・アドベンチスト協会の男性を対象にした前向き研究では、トマトの摂取が最大の者は前立腺がんのリスクが有意に低いことがわかった(35)。また、米国の医師を対象にした前向き研究でも、血漿中のリコピン濃度が最も高い者は、悪性の前立腺がんの発症リスクが有意に低かった(36)。しかしながら、58,000人以上のオランダ人男性を対象にした前向き研究では、食事からのリコピンの摂取は前立腺がんのリスクと関連がなかった(37)。11例の症例対照研究と10例の前向き研究の結果をまとめてメタ解析したところ、食事からのリコピンまたはトマトの摂取が最大の男性は、前立腺がんリスクが11~19%と控えめながら低かった(38)。より最近では、29,361人の男性を4.2年間追跡した前向きコホート研究で、食事からのリコピンの摂取と前立腺がんのリスクには関連が見られなかった(39)。加えて、最近の大規模前向き研究では、血漿中のリコピン濃度または血漿中の全カロテノイド濃度と、前立腺がん全体のリスクとの関連は見られなかった(40)。リコピンが前立腺がんの予防に役立つ可能性への科学的関心は相当あるものの、いくつかの疫学的研究で見られた前立腺がんリスクの低減がリコピン自体に関連するものなのか、トマトに含まれるその他の化合物によるものなのか、リコピンの豊富な食事に関連したその他の要因によるものなのかは不明である。現在までのところ、前立腺がんの患者にリコピンを使った短期食事介入研究の結果は有望である(41)。しかし、前立腺がんの予防や治療のためにリコピンのサプリメントを長期間使用することの安全性や効能は不明である(41)。この問題を扱うには、大規模な対照臨床試験が必要であろう。
心血管系疾患
食事からのカロテノイド
脂肪にとても溶けやすいが水には非常に溶けにくいため、カロテノイドはコレステロールやその他の脂肪とともにリポ蛋白質に含まれて血液中を循環する。低密度リポ蛋白質(LDL)の酸化がアテローム性動脈硬化症の発症に関わっているというエビデンスから、心血管疾患の予防におけるカロテノイドなどの抗酸化化合物の役割が調べられた(42)。頸動脈の内層の厚さは、超音波技術を用いて非侵襲的に測定可能である。この頸動脈内中膜複合体厚の測定値は、アテローム性動脈硬化症の信頼し得るマーカーとされている(43)。いくつかの症例対照研究および横断的研究で、血中のカロテノイド濃度の高値と頸動脈内中膜複合体厚の低値との有意な相関がわかった(44-49)。ベースライン時(研究開始時)の血漿カロテノイド濃度が高いと心血管疾患のリスクが有意に低いという前向き研究もある(50-54)が、その関連が見られなかった研究もある(55-58)。数例の前向き研究の結果で、カロテノイドの豊富な果物や野菜の摂取が多い者は心血管疾患のリスクが低いということが示唆された(58-61)が、この効果がカロテノイドによるものなのか、カロテノイドの豊富な果物や野菜の多い食事に関連するその他の要因によるものなのかは不明である。
β-カロテンのサプリメント
カロテノイドの豊富な果物や野菜を食事から多く摂取すると、心血管疾患のリスクが減る可能性があることを示唆する疫学的研究とは対照的に、4つの無作為化対照試験で20~50mg/日のβ-カロテンのサプリメントを摂取しても心血管疾患の予防に効果があるというエビデンスは見られなかった(26,28,62,63)。これらの無作為化対照試験の結果に基づいて、β-カロテンのサプリメントは中年および老年の成人の心血管疾患の予防に有効ではないとする十分なエビデンスがあると米国予防医学専門委員会は結論づけた(31,64)。したがって、観察研究ではβ-カロテンの豊富な食事が一般的に心血管疾患リスクの低減と関連があるとしているものの、β-カロテンの補給が心血管疾患を減らすというエビデンスはない(65)。
加齢黄斑変性
西洋諸国では、目の網膜の中心にある黄斑の変性が年配の成人における失明の主因となっている。異常のある水晶体を入れ替えられる白内障と異なり、加齢黄斑変性には治療法がない。したがって、この病気の予防や進行の遅延が試みられている。
食事からのルテインとゼアキサンチン
網膜に存在するカロテノイドはルテインとゼアキサンチンだけである。ルテインとゼアキサンチンは黄斑に高濃度で存在し、青い光を効率的に吸収する。目から入る青い光がその下にある視覚に関わる構造に大量に到達するのを防ぐことで、加齢黄斑変性を引き起こす原因であると思われる光による酸化ダメージからルテインとゼアキサンチンが目を守っている可能性がある(10)。証明はされていないが、ルテインとゼアキサンチンは網膜でできる酸化剤を直接中和しているということも考えられる。疫学的研究では、ルテインとゼアキサンチンの高摂取と加齢黄斑変性のリスク低下が関連しているというエビデンスもある(66)。しかしながら、この関係は決して明快ではない。横断研究および後ろ向き症例対照研究で、食事中(67-69)、血液中(70,71)、および網膜(72,73)でのルテインとゼアキサンチンの濃度が高いと加齢黄斑変性の発症が少ないという関連があったが、いくつかの前向きコホート研究では、ベースライン時のルテインおよびゼアキサンチンの食事からの摂取または血清濃度と加齢黄斑変性を経年的に発症するリスクとの間に何の関係もなかった(74-77)。ルテインおよびゼアキサンチンの摂取を増やすことで加齢黄斑変性のリスクを減らせる可能性には非常に関心が高いものの、さらなる無作為化対照試験のデータがなければこれらのサプリメントを推奨することは時期尚早である(78)。加齢性眼疾患研究2(AREDS2)という臨床試験では、症状が進んだ加齢黄斑変性の進行に対する、ルテイン(10mg/日)およびゼアキサンチン(2mg/日)に加えてβ-カロテン、ビタミンC、ビタミンE、亜鉛、銅を組み合わせたサプリメント(’AREDS’サプリメント)の補給は、何ら抑制効果を示さなかった(79)。今日までに利用可能な科学的エビデンスから、果物や野菜から少なくとも6mg/日のルテインおよびゼアキサンチンを摂取すると、加齢黄斑変性のリスクを減らせる可能性がある(67-69)。
ルテインのサプリメント
萎縮性加齢黄斑変性の患者の無作為化対照試験では、10mg/日のルテインの補給によって1年後に視力がプラセボに比べて少し向上した(80)。しかし、何人かの研究者は萎縮性加齢黄斑変性の患者に対する長期間のルテイン補給の効果を評価するには、さらなる研究が必要であると結論づけている。AREDS2ではルテイン(10mg/日)とゼアキサンチン(2mg/日)に加えてβ-カロテン、ビタミンC、ビタミンE、亜鉛、銅を組み合わせたサプリメント(’AREDS’サプリメント)は重度の加齢黄斑変性への進行を遅らせなかったが、サブグループ分析ではルテインとゼアキサンチンの摂取量が最も低い人々には有益であることが明らかになった(79)。
β-カロテンのサプリメント
加齢黄斑変性に対するカロテノイド補給の効果を調べる最初の無作為化対照試験(AREDS1)では、β-カロテンをビタミンC、ビタミンE、および亜鉛といっしょに使った。それというのは、試験の始まった当時ではルテインとゼアキサンチンはサプリメントとして市販されていなかったからである(81)。抗酸化物質と亜鉛のこの組み合わせは、少なくとも片方の眼に中度から重篤な黄斑変性の徴候がある個人の黄斑変性が進行するリスクを下げたが、β-カロテンは網膜に存在しないので、この有益性はβ-カロテンに関連していないであろう。フィンランドで男性喫煙者に20mg/日のβ-カロテンを6年間補給しても、プラセボに比べて加齢黄斑変性のリスクが低くなることはなかった(82)。22,071人の健康な米国人男性のコホートにおけるプラセボ対照試験では、β-カロテンを補給(1日おきに50mg)しても加齢黄斑変性の初期段階である加齢黄斑症の発症に効果はなかった(83)。無作為化対照試験に関する最近のシステマティック・レビューでは、β-カロテンの補給が加齢黄斑変性の発症を予防または遅延するというエビデンスはないと結論づけている(84,85)。
白内障
紫外線や酸化剤は眼の水晶体の蛋白質を傷つけ、白内障として知られる混濁に至る構造的変化をひきおこすことがある。人々が老いるにつれて、水晶体の蛋白質に積み重なったダメージが視覚に影響するほど大きな白内障になることもしばしばある(7)。
食事からのルテインとゼアキサンチン
ルテインとゼアキサンチンだけがヒトの水晶体に見られるカロテノイドであるという観察結果から、ルテインとゼアキサンチンの摂取を増やすと白内障の進行の予防や遅延ができるのではないかという関心が高まった(10)。4つの大規模前向き研究で、ルテインやゼアキサンチンが豊富な食品、特にホウレンソウ、ケール、およびブロッコリーの摂取が最も多い男女は、白内障の摘出(86,87)や発症(88-90)の可能性が18~50%低かった。これらの発見がルテインおよびゼアキサンチンの摂取に特異的に関係しているのか、またはカロテノイドの豊富な食事に関連したその他の要素に関係しているのかを見極めるさらなる研究が必要である(66)。
β-カロテンの補給
カロテノイドを豊富に食事から摂取したりカロテノイドの血中濃度が高い人々には白内障が少ないという疫学的研究のエビデンスから、抗酸化物質に関するいくつかの大規模な無作為化対照試験にβ-カロテンのサプリメントも含まれることになった。これらの試験の結果はやや不一致が見られる。6年間以上β-カロテンを補給(20mg/日)しても、フィンランドの男性喫煙者では白内障の罹患率や白内障の手術の頻度に影響はなかった(82)。対照的に、米国の医師を対象に12年間調べた研究では、β-カロテンの補給(50mgを1日おき)が喫煙者の白内障リスクを低減したが、非喫煙者ではそうでなかった(91)。ここで、β-カロテンの補給は喫煙者の肺がんリスクを増大させることが示されたことを思い出してもらいたい(「肺がん」の項参照)。β-カロテン、ビタミンC,ビタミンEを含む抗酸化物質の白内障の進行に対する効果が3つの無作為化対照試験で調べられた。2つの試験では5年間(92)または6年以上(93)補給しても何の効果もなかったが、1つの試験では3年間の補給で白内障の進行に少しの減少が見られた(94)。全体的に無作為化対照試験の結果では、加齢による白内障の進行を遅らせるのにβ-カロテンを補給する有益性がそれによるリスクの可能性よりも大きいとは示されていない。
摂取源
食品の摂取源
北米での食事で最もよく見られるカロテノイドはα-カロテン、β-カロテン、β-クリプトキサンチン、リコピン、ルテイン、およびゼアキサンチンである(6)。食品に含まれるカロテノイドは主にオールトランス型(図1および図2参照)で、加熱によってその他の異性体もできる可能性がある。ほとんどの食品からのカロテノイドの生物学的利用度がサプリメントに比べて比較的低いのは、それらが植物体マトリックス中の蛋白質に弱く結合しているという事実に一部起因する(2)。刻んだり均質化したり加熱したりすると植物体マトリックスが壊れ、カロテノイドの生物学的利用度が高くなる(4)。トマトからのリコピンの生物学的利用度は、トマトを油中で加熱することで著しく向上する(95,96)。
α-カロテンとβ-カロテン
α-カロテンとβ-カロテンはビタミンA前駆体カロテノイドで、体内でビタミンAに変換され得る。食品中のβ-カロテンのビタミンA活性は、レチノール(既成ビタミンA)の12分の1である。したがって、1μg(0.001mg)のレチノールを摂るには、食品からのβ-カロテンは12μg必要である。食品中のα-カロテンのビタミンA活性は、レチノールの24分の1である。したがって、1μg(0.001mg)のレチノールを摂るには、食品からのα-カロテンは24μg必要である。にんじんや冬かぼちゃのようなオレンジや黄色の野菜は、α-カロテンやβ-カロテンの豊富な食品である。ホウレンソウもβ-カロテンの豊富な摂取源であるが、葉に含まれる葉緑素が黄色がかったオレンジ色の色素を隠してしまっている。α-カロテンやβ-カロテンのよい摂取源となる食品のリストを表1と2に示す(97)。
β-クリプトキサンチン
α-カロテンやβ-カロテンと同様に、β-クリプトキサンチンはビタミンA前駆体カロテノイドである。食品からのβ-クリプトキサンチンのビタミンA活性は、レチノールの24分の1である。したがって、1μg(0.001mg)のレチノールを摂るには、食品からのβ-クリプトキサンチンが24μg必要である。赤いとうがらしやオレンジなどの赤や橙色の野菜や果物は、β-クリプトキサンチンが特に豊富な食品である。β-クリプトキサンチンのよい摂取源となる食品のリストを表3に示す(97)。
リコピン
リコピンはトマト、ピンクグレープフルーツ、スイカ、およびグアバの赤い色の元となっている。米国の食事のリコピンの80%は、トマトや、トマトソース、トマトペースト、およびケチャップなどのトマト製品によるものであると推定されている(98)。リコピンはビタミンA前駆体カロテノイドではないので、体内でビタミンAに変わることができない。リコピンの豊富な食品のリストを下の表4に示す(97)。
ルテインとゼアキサンチン
ルテインとゼアキサンチンは異なる化合物であるが、ともにキサントフィルとして知られるカロテノイドに属する。これらはビタミンA前駆体カロテノイドではない。食品中のルテインとゼアキサンチンの量を測る方法ではこれらを分けないものもあるので、ルテインおよびゼアキサンチン、またはルテイン+ゼアキサンチンと表されることが一般的である。ルテインとゼアキサンチンは、様々な果物や野菜に含まれている。ホウレンソウやケールのような濃い緑色の葉物野菜は、ルテインとゼアキサンチンが特に豊富な食品である。ルテイン強化卵(ルテインの豊富なえさを食べさせた鶏の卵)のルテインの生物学的利用性は、ホウレンソウやルテインのサプリメントよりもはるかに高かったという研究がある(99)。ルテインとゼアキサンチンのよい摂取源となる食品のリストを表5に示す(97)。
食品中のカロテノイド含有量についての詳細は、米国農務省の国民栄養データベースを参照のこと。
サプリメント
精製されたカロテノイドやカロテノイドの組み合わせを含む栄養補助食品は、米国では処方箋なしで市販されている。カロテノイドは脂肪を含む食事といっしょに摂取すると、一番よく吸収される。
β-カロテン
ビタミンA活性を持つので、β-カロテンはマルチビタミンサプリメントに含まれるビタミンAの全部または一部として使用されることもある。サプリメントからのβ-カロテンのビタミンA活性は、食事からのそれよりもずっと高い。サプリメントからのわずか2μg(0.002mg)のβ-カロテンが、1μgのレチノール(既に形成されたビタミンA)に相当する。サプリメント中のβ-カロテンの含有量は、マイクログラム(μg)ではなく国際単位(IU)で表記されることも多く、3,000μg(3mg)のβ-カロテンが5,000IUのビタミンAに相当する。市販のサプリメントの大部分は、5,000~25,000IUのβ-カロテンを含む(100)。
リコピン
リコピンにはビタミンA活性がない。合成されたリコピンや、トマトを主とする天然食品由来のリコピンは、栄養補助食品として入手可能である。多くの市販のサプリメントは、5~20mgのリコピンを含む(100)。
ルテインとゼアキサンチン
ルテインとゼアキサンチンはビタミンA活性がない。ルテインとゼアキサンチンのサプリメントは、遊離のカロテノイドまたはそれらのエステル(脂肪酸にエステル結合したもの)として売られている。ある研究ではルテインとルテインのエステルは生物学的利用性が同じであるとしている(99)が、他の研究ではルテインのエステルの方がルテインよりも生物学的利用性が高かった(101)。市販のルテインとゼアキサンチンのサプリメントの多くは、ルテインがゼアキサンチンよりもずっと多く含まれている(102)。そのようなサプリメントは4~20mgのルテインと0.2~1mgのゼアキサンチンを含むことが典型的であるが、その他の含量のものもある(100)。ルテインのみ、またはゼアキサンチンのみを含むサプリメントも売られている。
安全性
毒性
β-カロテン
β-カロテンはビタミンAに変換されうるが、体内にビタミンAが十分に蓄えられている際には、β-カロテンからビタミンAへの変換は少なくなる。これがβ-カロテンを高用量で服用してもビタミンA毒性を引き起こさない理由であるかもしれない(103)。高用量β-カロテン(180mg/日まで)は、光過敏症である骨髄性プロトポルフィリン症の治療に有害な副作用なしで用いられてきた(6)。
リコピン、ルテイン、およびゼアキサンチン
有害性の報告はない(104)。
悪影響
β-カロテン
肺がんリスクの増加:喫煙者およびアスベスト作業・従事経験者を対象にした2つの無作為化対照試験で、20~30mg/日のβ-カロテンを4~6年間補給すると、プラセボに比べて16~28%という有意な肺がんリスク増加が見られた(「肺がん」の項参照)。この原因は明らかではないが、喫煙者やその他のハイリスク集団では、特に、高用量のβ-カロテンの服用リスクが慢性疾患の予防の可能性よりも大きいと多くの専門家は感じている(30,31)。
柑皮症:高用量(30mg/日以上)のβ-カロテンサプリメントやカロテンの豊富な食品の大量摂取は、柑皮症という皮膚の黄変に至る。柑皮症は健康上の問題はなく、β-カロテンのサプリメント摂取をやめたり、食事からのカロテンの摂取を減らしたりすれば問題は無くなる。
リコピン
リコピンによる柑皮症:リコピンの豊富な食品やサプリメントの高摂取は、リコピンによる柑皮症である濃いオレンジ色の皮膚の変色をもたらす。リコピンはカロテンよりももっと色が鮮烈なので、カロテンの柑皮症よりも少ない摂取量でも起こる可能性がある(6)。
ルテインおよびゼアキサンチン
ルテインとゼアキサンチンによる悪影響は報告されていない(102)。
妊娠期および授乳期の安全性
β-カロテン
ビタミンAとはちがって、妊娠中の女性が高用量のβ-カロテンを服用しても、先天性異常のリスクの増加との関連は無い(6)。しかしながら、妊娠期や授乳期の高用量β-カロテンサプリメントの安全性は、あまりよく研究されて来ていない。食事からのβ-カロテン摂取を制限すべき理由はないが、医師からの処方がないのであれば、妊娠中または授乳中の女性は3mg/日(5,000IU/日)より多くのβ-カロテンをサプリメントから摂取するのは避けるべきである(102,103)。
その他のカロテノイド
妊娠期および授乳期におけるβ-カロテン以外のカロテノイドのサプリメントの安全性は確立されていないので、妊娠中および授乳中の女性はサプリメントではなく食品からカロテノイドを摂取すべきである。妊娠中にカロテノイドの豊富な果物や野菜の摂取を制限する根拠はない(102,105)。
薬物との相互作用
コレステロール低下剤であるコレスチラミン(クエストラン)やコレスチポール(コレスチド)は、鉱物油や肥満治療薬のオルリスタット(ゼニカル)と同様に、脂溶性のビタミンやカロテノイドの吸収を低減させる可能性がある(102)。痛風の治療に使われるコルヒチンは腸管吸収障害を起こす可能性がある。しかしながら、1~2mg/日のコルヒチンを長期間服用しても、ある研究では血清β-カロテン濃度に影響はなかった(106)。オメプラゾール(プリロセック、ロセック)、ランソプラゾール(プレバシッド)、ラベプラゾール(パリエット)、およびパントプラゾール(プロトニックス、パントロック)のようなプロトンポンプ阻害薬を使って胃のpHを上げると、β-カロテンサプリメントを単回投与した際に吸収が低下したが、食事からのカロテノイドの吸収が影響を受けるのかどうかは不明である(107)。
抗酸化物質のサプリメントとHMG-CoA還元酵素阻害薬(スタチン)
間違い無く冠動脈性心疾患を有し、且つ、血清高密度リポ蛋白質(HDL)濃度の低い160人の患者を対象にした3年間の無作為化対照試験で、シンバスタチン(ゾコール)とナイアシンの組み合わせは、HDL2濃度を上昇させ、冠動脈狭窄の進行を抑制し、心筋梗塞や脳卒中を含む心血管疾患の頻度を減らした(108)。驚いたことに、抗酸化物質の組み合わせ(毎日1,000mgのビタミンC、800IUのα-トコフェロール、100mcgのセレン、および25mgのβ-カロテン)をシンバスタチンとナイアシンの組み合わせといっしょに摂取すると、これらの保護的効果はなくなった。この治験では抗酸化物質が同時に摂取されているので、β-カロテン単体での役割は決定できない。対照的に、冠動脈疾患や糖尿病の20,000人以上の男女を対象にしたシンバスタチンと抗酸化物質(毎日600mgのビタミンE、250mgのビタミンC、および20mgのβ-カロテン)の組み合わせによるもっと大規模な無作為化対照試験では、抗酸化物質の組み合わせはシンバスタチンによる治療の心臓保護効果を5年間にわたって消滅させることはなかった(109)。このことは、先の試験では抗酸化物質の組み合わせがナイアシンの持つHDL濃度上昇効果を阻害した可能性を示唆している。抗酸化物質のサプリメントと、ナイアシンやHMG-CoA還元酵素阻害薬(スタチン)といったコレステロール低下剤との相互作用の可能性を解明するには、さらなる研究が必要である。
食品との相互作用
オレストラTM
対照摂食試験で、脂肪代替品のオレストラTM(ショ糖ポリエステル)を18g/日摂取すると、3週間で血清カロテノイド濃度が27%減った(110)。オレストラを含むスナックが市場に出る前と後で人々を調べた研究では、オレストラを少なくとも2g/日摂取していた人々の血清総カロテノイド濃度が15%減った(111)。成人を対象にしたある研究では、オレストラを週に4.4gより多く摂取する人は、オレストラを摂取しない人に比べて血清総カロテノイド濃度が9.7%減った(112)。
植物ステロールまたはスタノールを含む食品
植物ステロールを含むスプレッド(パンに塗るもの)を定常的に摂取していると、いくつかのカロテノイド、特にα-カロテン、β-カロテン、およびリコピンの血漿濃度が10~20%程度、控えめに減少したとする研究がいくつかある(「植物ステロール」の項参照)(113,114)。しかし、植物ステロールまたはスタノールを含むマーガリンを食べる者に、カロテノイドの豊富な果物や野菜の摂取量を毎日少し余分に摂るように指導すると、血漿カロテノイド濃度の減少が予防できた(115,116)。
アルコール
アルコールの摂取とカロテノイドの代謝の関係はよくわかっていない。定常的にアルコールを摂取していると、β-カロテンからレチノールへの変換が阻害されるというエビデンスがある(117)。2例の無作為化対照試験における高用量のβ-カロテン補給に関連する肺がんリスクの上昇は、アルコールの摂取がより多い者に顕著であった(27,118)。
カロテノイド同士の相互作用
高用量のβ-カロテンは、ルテインやリコピンと同時に摂取するとそれらの吸収が競合することが代謝の研究から示唆されている(119-121)。しかし、長期間の臨床試験では、高用量のβ-カロテンサプリメントの摂取は血清カロテノイド濃度に悪影響を及ぼさなかった(122-125)。
Authors and Reviewers
Originally written in 2004 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Updated in December 2005 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in May 2009 by:
Victoria J. Drake, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in July 2016 by:
Barbara Delage, Ph.D.
Linus Pauling Institute
Oregon State University
Reviewed in August 2016 by:
Elizabeth J. Johnson, Ph.D., Research Scientist
Antioxidants Research Laboratory
Jean Mayer USDA Human Nutrition Research Center on Aging
Assistant Professor, Friedman School of Nutrition Science
Tufts University
Copyright 2004-2024 Linus Pauling Institute
References
1. International Agency for Research on Cancer. IARC Handbooks of Cancer Prevention: Carotenoids. Lyon: International Agency for Research on Cancer; 1998.
2. Yeum KJ, Russell RM. Carotenoid bioavailability and bioconversion. Annu Rev Nutr. 2002;22:483-504. (PubMed)
3. Jalal F, Nesheim MC, Agus Z, Sanjur D, Habicht JP. Serum retinol concentrations in children are affected by food sources of beta-carotene, fat intake, and anthelmintic drug treatment. Am J Clin Nutr. 1998;68(3):623-629. (PubMed)
4. van Het Hof KH, West CE, Weststrate JA, Hautvast JG. Dietary factors that affect the bioavailability of carotenoids. J Nutr. 2000;130(3):503-506. (PubMed)
5. During A, Harrison EH. Intestinal absorption and metabolism of carotenoids: insights from cell culture. Arch Biochem Biophys. 2004;430(1):77-88. (PubMed)
6. Institute of Medicine, Food and Nutrition Board. Beta-carotene and other carotenoids. Dietary reference intakes for vitamin C, vitamin E, selenium, and carotenoids. Washington, D.C.: National Academy Press; 2000:325-400.
7. Halliwell B, Gutteridge JMC. Free Radicals in Biology and Medicine. Third ed. New York, NY: Oxford University Press; 1999.
8. Di Mascio P, Kaiser S, Sies H. Lycopene as the most efficient biological carotenoid singlet oxygen quencher. Arch Biochem Biophys. 1989;274(2):532-538. (PubMed)
9. Young AJ, Lowe GM. Antioxidant and prooxidant properties of carotenoids. Arch Biochem Biophys. 2001;385(1):20-27. (PubMed)
10. Krinsky NI, Landrum JT, Bone RA. Biologic mechanisms of the protective role of lutein and zeaxanthin in the eye. Annu Rev Nutr. 2003;23:171-201. (PubMed)
11. Bertram JS. Carotenoids and gene regulation. Nutr Rev. 1999;57(6):182-191. (PubMed)
12. Stahl W, Nicolai S, Briviba K, et al. Biological activities of natural and synthetic carotenoids: induction of gap junctional communication and singlet oxygen quenching. Carcinogenesis. 1997;18(1):89-92. (PubMed)
13. van Poppel G, Spanhaak S, Ockhuizen T. Effect of beta-carotene on immunological indexes in healthy male smokers. Am J Clin Nutr. 1993;57(3):402-407. (PubMed)
14. Hughes DA, Wright AJ, Finglas PM, et al. The effect of beta-carotene supplementation on the immune function of blood monocytes from healthy male nonsmokers. J Lab Clin Med. 1997;129(3):309-317. (PubMed)
15. Santos MS, Gaziano JM, Leka LS, Beharka AA, Hennekens CH, Meydani SN. Beta-carotene-induced enhancement of natural killer cell activity in elderly men: an investigation of the role of cytokines. Am J Clin Nutr. 1998;68(1):164-170. (PubMed)
16. Hughes DA, Wright AJ, Finglas PM, et al. Effects of lycopene and lutein supplementation on the expression of functionally associated surface molecules on blood monocytes from healthy male nonsmokers. J Infect Dis. 2000;182 Suppl 1:S11-15. (PubMed)
17. Watzl B, Bub A, Blockhaus M, et al. Prolonged tomato juice consumption has no effect on cell-mediated immunity of well-nourished elderly men and women. J Nutr. 2000;130(7):1719-1723. (PubMed)
18. Corridan BM, O'Donoghue M, Hughes DA, Morrissey PA. Low-dose supplementation with lycopene or beta-carotene does not enhance cell-mediated immunity in healthy free-living elderly humans. Eur J Clin Nutr. 2001;55(8):627-635. (PubMed)
19. Peto R, Doll R, Buckley JD, Sporn MB. Can dietary beta-carotene materially reduce human cancer rates? Nature. 1981;290(5803):201-208. (PubMed)
20. Ziegler RG. A review of epidemiologic evidence that carotenoids reduce the risk of cancer. J Nutr. 1989;119(1):116-122. (PubMed)
21. Michaud DS, Feskanich D, Rimm EB, et al. Intake of specific carotenoids and risk of lung cancer in 2 prospective US cohorts. Am J Clin Nutr. 2000;72(4):990-997. (PubMed)
22. Holick CN, Michaud DS, Stolzenberg-Solomon R, et al. Dietary carotenoids, serum beta-carotene, and retinol and risk of lung cancer in the alpha-tocopherol, beta-carotene cohort study. Am J Epidemiol. 2002;156(6):536-547. (PubMed)
23. Voorrips LE, Goldbohm RA, Brants HA, et al. A prospective cohort study on antioxidant and folate intake and male lung cancer risk. Cancer Epidemiol Biomarkers Prev. 2000;9(4):357-365. (PubMed)
24. Mannisto S, Smith-Warner SA, Spiegelman D, et al. Dietary Carotenoids and Risk of Lung Cancer in a Pooled Analysis of Seven Cohort Studies. Cancer Epidemiol Biomarkers Prev. 2004;13(1):40-48. (PubMed)
25. Gallicchio L, Boyd K, Matanoski G, et al. Carotenoids and the risk of developing lung cancer: a systematic review. Am J Clin Nutr. 2008;88(2):372-383. (PubMed)
26. The effect of vitamin E and beta carotene on the incidence of lung cancer and other cancers in male smokers. The Alpha-Tocopherol, Beta Carotene Cancer Prevention Study Group. N Engl J Med. 1994;330(15):1029-1035. (PubMed)
27. Omenn GS, Goodman GE, Thornquist MD, et al. Risk factors for lung cancer and for intervention effects in CARET, the Beta-Carotene and Retinol Efficacy Trial. J Natl Cancer Inst. 1996;88(21):1550-1559. (PubMed)
28. Hennekens CH, Buring JE, Manson JE, et al. Lack of effect of long-term supplementation with beta carotene on the incidence of malignant neoplasms and cardiovascular disease. N Engl J Med. 1996;334(18):1145-1149. (PubMed)
29. Palozza P, Simone R, Mele MC. Interplay of carotenoids with cigarette smoking: implications in lung cancer. Curr Med Chem. 2008;15(9):844-854. (PubMed)
30. Vainio H, Rautalahti M. An international evaluation of the cancer preventive potential of carotenoids. Cancer Epidemiol Biomarkers Prev. 1998;7(8):725-728. (PubMed)
31. US Preventive Services Task Force. Routine vitamin supplementation to prevent cancer and cardiovascular disease: recommendations and rationale. Ann Intern Med. 2003;139(1):51-55. (PubMed)
32. Tanvetyanon T, Bepler G. Beta-carotene in multivitamins and the possible risk of lung cancer among smokers versus former smokers: a meta-analysis and evaluation of national brands. Cancer. 2008;113(1):150-157. (PubMed)
33. Giovannucci E. A review of epidemiologic studies of tomatoes, lycopene, and prostate cancer. Exp Biol Med (Maywood). 2002;227(10):852-859. (PubMed)
34. Giovannucci E, Ascherio A, Rimm EB, Stampfer MJ, Colditz GA, Willett WC. Intake of carotenoids and retinol in relation to risk of prostate cancer. J Natl Cancer Inst. 1995;87(23):1767-1776. (PubMed)
35. Mills PK, Beeson WL, Phillips RL, Fraser GE. Cohort study of diet, lifestyle, and prostate cancer in Adventist men. Cancer. 1989;64(3):598-604. (PubMed)
36. Gann PH, Ma J, Giovannucci E, et al. Lower prostate cancer risk in men with elevated plasma lycopene levels: results of a prospective analysis. Cancer Res. 1999;59(6):1225-1230. (PubMed)
37. Schuurman AG, Goldbohm RA, Brants HA, van den Brandt PA. A prospective cohort study on intake of retinol, vitamins C and E, and carotenoids and prostate cancer risk (Netherlands). Cancer Causes Control. 2002;13(6):573-582. (PubMed)
38. Etminan M, Takkouche B, Caamano-Isorna F. The role of tomato products and lycopene in the prevention of prostate cancer: a meta-analysis of observational studies. Cancer Epidemiol Biomarkers Prev. 2004;13(3):340-345. (PubMed)
39. Kirsh VA, Mayne ST, Peters U, et al. A prospective study of lycopene and tomato product intake and risk of prostate cancer. Cancer Epidemiol Biomarkers Prev. 2006;15(1):92-98. (PubMed)
40. Key TJ, Appleby PN, Allen NE, et al. Plasma carotenoids, retinol, and tocopherols and the risk of prostate cancer in the European Prospective Investigation into Cancer and Nutrition study. Am J Clin Nutr. 2007;86(3):672-681. (PubMed)
41. Dahan K, Fennal M, Kumar NB. Lycopene in the prevention of prostate cancer. J Soc Integr Oncol. 2008;6(1):29-36. (PubMed)
42. Kritchevsky SB. beta-Carotene, carotenoids and the prevention of coronary heart disease. J Nutr. 1999;129(1):5-8. (PubMed)
43. Bots ML, Grobbee DE. Intima media thickness as a surrogate marker for generalised atherosclerosis. Cardiovasc Drugs Ther. 2002;16(4):341-351. (PubMed)
44. Rissanen TH, Voutilainen S, Nyyssonen K, Salonen R, Kaplan GA, Salonen JT. Serum lycopene concentrations and carotid atherosclerosis: the Kuopio Ischaemic Heart Disease Risk Factor Study. Am J Clin Nutr. 2003;77(1):133-138. (PubMed)
45. Dwyer JH, Paul-Labrador MJ, Fan J, Shircore AM, Merz CN, Dwyer KM. Progression of Carotid Intima-Media Thickness and Plasma Antioxidants: The Los Angeles Atherosclerosis Study. Arterioscler Thromb Vasc Biol. 2003. (PubMed)
46. McQuillan BM, Hung J, Beilby JP, Nidorf M, Thompson PL. Antioxidant vitamins and the risk of carotid atherosclerosis. The Perth Carotid Ultrasound Disease Assessment study (CUDAS). J Am Coll Cardiol. 2001;38(7):1788-1794. (PubMed)
47. Rissanen T, Voutilainen S, Nyyssonen K, Salonen R, Salonen JT. Low plasma lycopene concentration is associated with increased intima-media thickness of the carotid artery wall. Arterioscler Thromb Vasc Biol. 2000;20(12):2677-2681. (PubMed)
48. D'Odorico A, Martines D, Kiechl S, et al. High plasma levels of alpha- and beta-carotene are associated with a lower risk of atherosclerosis: results from the Bruneck study. Atherosclerosis. 2000;153(1):231-239. (PubMed)
49. Iribarren C, Folsom AR, Jacobs DR, Jr., Gross MD, Belcher JD, Eckfeldt JH. Association of serum vitamin levels, LDL susceptibility to oxidation, and autoantibodies against MDA-LDL with carotid atherosclerosis. A case-control study. The ARIC Study Investigators. Atherosclerosis Risk in Communities. Arterioscler Thromb Vasc Biol. 1997;17(6):1171-1177. (PubMed)
50. Sesso HD, Buring JE, Norkus EP, Gaziano JM. Plasma lycopene, other carotenoids, and retinol and the risk of cardiovascular disease in women. Am J Clin Nutr. 2004;79(1):47-53. (PubMed)
51. Rissanen TH, Voutilainen S, Nyyssonen K, et al. Low serum lycopene concentration is associated with an excess incidence of acute coronary events and stroke: the Kuopio Ischaemic Heart Disease Risk Factor Study. Br J Nutr. 2001;85(6):749-754. (PubMed)
52. Street DA, Comstock GW, Salkeld RM, Schuep W, Klag MJ. Serum antioxidants and myocardial infarction. Are low levels of carotenoids and alpha-tocopherol risk factors for myocardial infarction? Circulation. 1994;90(3):1154-1161. (PubMed)
53. Ito Y, Kurata M, Suzuki K, Hamajima N, Hishida H, Aoki K. Cardiovascular disease mortality and serum carotenoid levels: a Japanese population-based follow-up study. J Epidemiol. 2006;16(4):154-160. (PubMed)
54. Buijsse B, Feskens EJ, Kwape L, Kok FJ, Kromhout D. Both alpha- and beta-carotene, but not tocopherols and vitamin C, are inversely related to 15-year cardiovascular mortality in Dutch elderly men. J Nutr. 2008;138(2):344-350. (PubMed)
55. Sesso HD, Buring JE, Norkus EP, Gaziano JM. Plasma lycopene, other carotenoids, and retinol and the risk of cardiovascular disease in men. Am J Clin Nutr. 2005;81(5):990-997. (PubMed)
56. Hak AE, Stampfer MJ, Campos H, et al. Plasma carotenoids and tocopherols and risk of myocardial infarction in a low-risk population of US male physicians. Circulation. 2003;108(7):802-807. (PubMed)
57. Evans RW, Shaten BJ, Day BW, Kuller LH. Prospective association between lipid soluble antioxidants and coronary heart disease in men. The Multiple Risk Factor Intervention Trial. Am J Epidemiol. 1998;147(2):180-186. (PubMed)
58. Sahyoun NR, Jacques PF, Russell RM. Carotenoids, vitamins C and E, and mortality in an elderly population. Am J Epidemiol. 1996;144(5):501-511. (PubMed)
59. Rimm EB, Stampfer MJ, Ascherio A, Giovannucci E, Colditz GA, Willett WC. Vitamin E consumption and the risk of coronary heart disease in men. N Engl J Med. 1993;328(20):1450-1456. (PubMed)
60. Gaziano JM, Manson JE, Branch LG, Colditz GA, Willett WC, Buring JE. A prospective study of consumption of carotenoids in fruits and vegetables and decreased cardiovascular mortality in the elderly. Ann Epidemiol. 1995;5(4):255-260. (PubMed)
61. Osganian SK, Stampfer MJ, Rimm E, Spiegelman D, Manson JE, Willett WC. Dietary carotenoids and risk of coronary artery disease in women. Am J Clin Nutr. 2003;77(6):1390-1399. (PubMed)
62. Greenberg ER, Baron JA, Karagas MR, et al. Mortality associated with low plasma concentration of beta carotene and the effect of oral supplementation. JAMA. 1996;275(9):699-703. (PubMed)
63. Omenn GS, Goodman GE, Thornquist MD, et al. Effects of a combination of beta carotene and vitamin A on lung cancer and cardiovascular disease. N Engl J Med. 1996;334(18):1150-1155. (PubMed)
64. Morris CD, Carson S. Routine vitamin supplementation to prevent cardiovascular disease: a summary of the evidence for the US Preventive Services Task Force. Ann Intern Med. 2003;139(1):56-70. (PubMed)
65. Voutilainen S, Nurmi T, Mursu J, Rissanen TH. Carotenoids and cardiovascular health. Am J Clin Nutr. 2006;83(6):1265-1271. (PubMed)
66. Mares-Perlman JA, Millen AE, Ficek TL, Hankinson SE. The body of evidence to support a protective role for lutein and zeaxanthin in delaying chronic disease. Overview. J Nutr. 2002;132(3):518S-524S. (PubMed)
67. Snellen EL, Verbeek AL, Van Den Hoogen GW, Cruysberg JR, Hoyng CB. Neovascular age-related macular degeneration and its relationship to antioxidant intake. Acta Ophthalmol Scand. 2002;80(4):368-371. (PubMed)
68. Mares-Perlman JA, Fisher AI, Klein R, et al. Lutein and zeaxanthin in the diet and serum and their relation to age-related maculopathy in the third national health and nutrition examination survey. Am J Epidemiol. 2001;153(5):424-432. (PubMed)
69. Seddon JM, Ajani UA, Sperduto RD, et al. Dietary carotenoids, vitamins A, C, and E, and advanced age-related macular degeneration. Eye Disease Case-Control Study Group. JAMA. 1994;272(18):1413-1420. (PubMed)
70. Gale CR, Hall NF, Phillips DI, Martyn CN. Lutein and zeaxanthin status and risk of age-related macular degeneration. Invest Ophthalmol Vis Sci. 2003;44(6):2461-2465. (PubMed)
71. Antioxidant status and neovascular age-related macular degeneration. Eye Disease Case-Control Study Group. Arch Ophthalmol. 1993;111(1):104-109. (PubMed)
72. Bone RA, Landrum JT, Mayne ST, Gomez CM, Tibor SE, Twaroska EE. Macular pigment in donor eyes with and without AMD: a case-control study. Invest Ophthalmol Vis Sci. 2001;42(1):235-240. (PubMed)
73. Beatty S, Murray IJ, Henson DB, Carden D, Koh H, Boulton ME. Macular pigment and risk for age-related macular degeneration in subjects from a Northern European population. Invest Ophthalmol Vis Sci. 2001;42(2):439-446. (PubMed)
74. Cho E, Seddon JM, Rosner B, Willett WC, Hankinson SE. Prospective study of intake of fruits, vegetables, vitamins, and carotenoids and risk of age-related maculopathy. Arch Ophthalmol. 2004;122(6):883-892. (PubMed)
75. Flood V, Smith W, Wang JJ, Manzi F, Webb K, Mitchell P. Dietary antioxidant intake and incidence of early age-related maculopathy: the Blue Mountains Eye Study. Ophthalmology. 2002;109(12):2272-2278. (PubMed)
76. Mares-Perlman JA, Klein R, Klein BE, et al. Association of zinc and antioxidant nutrients with age-related maculopathy. Arch Ophthalmol. 1996;114(8):991-997. (PubMed)
77. Mares-Perlman JA, Brady WE, Klein R, et al. Serum antioxidants and age-related macular degeneration in a population-based case-control study. Arch Ophthalmol. 1995;113(12):1518-1523. (PubMed)
78. Mares-Perlman JA. Too soon for lutein supplements. Am J Clin Nutr. 1999;70(4):431-432. (PubMed)
79. Coleman H, Chew E. Nutritional supplementation in age-related macular degeneration. Curr Opin Ophthalmol. 2007;18(3):220-223. (PubMed)
80. Richer S, Stiles W, Statkute L, et al. Double-masked, placebo-controlled, randomized trial of lutein and antioxidant supplementation in the intervention of atrophic age-related macular degeneration: the Veterans LAST study (Lutein Antioxidant Supplementation Trial). Optometry. 2004;75(4):216-230. (PubMed)
81. A randomized, placebo-controlled, clinical trial of high-dose supplementation with vitamins C and E, beta carotene, and zinc for age-related macular degeneration and vision loss: AREDS report no. 8. Arch Ophthalmol. 2001;119(10):1417-1436. (PubMed)
82. Teikari JM, Laatikainen L, Virtamo J, et al. Six-year supplementation with alpha-tocopherol and beta-carotene and age-related maculopathy. Acta Ophthalmol Scand. 1998;76(2):224-229. (PubMed)
83. Christen WG, Manson JE, Glynn RJ, et al. Beta carotene supplementation and age-related maculopathy in a randomized trial of US physicians. Arch Ophthalmol. 2007;125(3):333-339. (PubMed)
84. Evans JR, Henshaw K. Antioxidant vitamin and mineral supplements for preventing age-related macular degeneration. Cochrane Database Syst Rev. 2008;(1):CD000253. (PubMed)
85. Evans J. Antioxidant supplements to prevent or slow down the progression of AMD: a systematic review and meta-analysis. Eye. 2008;22(6):751-760. (PubMed)
86. Brown L, Rimm EB, Seddon JM, et al. A prospective study of carotenoid intake and risk of cataract extraction in US men. Am J Clin Nutr. 1999;70(4):517-524. (PubMed)
87. Chasan-Taber L, Willett WC, Seddon JM, et al. A prospective study of carotenoid and vitamin A intakes and risk of cataract extraction in US women. Am J Clin Nutr. 1999;70(4):509-516. (PubMed)
88. Lyle BJ, Mares-Perlman JA, Klein BE, Klein R, Greger JL. Antioxidant intake and risk of incident age-related nuclear cataracts in the Beaver Dam Eye Study. Am J Epidemiol. 1999;149(9):801-809. (PubMed)
89. Christen WG, Manson JE, Glynn RJ, et al. A randomized trial of beta carotene and age-related cataract in US physicians. Arch Ophthalmol. 2003;121(3):372-378. (PubMed)
90. Moeller SM, Voland R, Tinker L, et al. Associations between age-related nuclear cataract and lutein and zeaxanthin in the diet and serum in the Carotenoids in the Age-Related Eye Disease Study, an Ancillary Study of the Women's Health Initiative. Arch Ophthalmol. 2008;126(3):354-364. (PubMed)
91. Christen WG, Manson JE, Glynn RJ, et al. A randomized trial of beta carotene and age-related cataract in US physicians. Arch Ophthalmol. 2003;121(3):372-378. (PubMed)
92. Gritz DC, Srinivasan M, Smith SD, et al. The Antioxidants in Prevention of Cataracts Study: effects of antioxidant supplements on cataract progression in South India. Br J Ophthalmol. 2006;90(7):847-851. (PubMed)
93. A randomized, placebo-controlled, clinical trial of high-dose supplementation with vitamins C and E and beta carotene for age-related cataract and vision loss: AREDS report no. 9. Arch Ophthalmol. 2001;119(10):1439-1452. (PubMed)
94. Chylack LT, Jr., Brown NP, Bron A, et al. The Roche European American Cataract Trial (REACT): a randomized clinical trial to investigate the efficacy of an oral antioxidant micronutrient mixture to slow progression of age-related cataract. Ophthalmic Epidemiol. 2002;9(1):49-80. (PubMed)
95. Gartner C, Stahl W, Sies H. Lycopene is more bioavailable from tomato paste than from fresh tomatoes. Am J Clin Nutr. 1997;66(1):116-122. (PubMed)
96. Stahl W, Sies H. Uptake of lycopene and its geometrical isomers is greater from heat-processed than from unprocessed tomato juice in humans. J Nutr. 1992;122(11):2161-2166. (PubMed)
97. US Department of Agriculture, Agricultural Research Service. USDA Nutrient Database for Standard Reference, Release 21. 2008. Available at: http://www.nal.usda.gov/fnic/foodcomp/search/. Accessed March 16, 2009.
98. Clinton SK. Lycopene: chemistry, biology, and implications for human health and disease. Nutr Rev. 1998;56(2 Pt 1):35-51. (PubMed)
99. Chung HY, Rasmussen HM, Johnson EJ. Lutein bioavailability is higher from lutein-enriched eggs than from supplements and spinach in men. J Nutr. 2004;134(8):1887-1893. (PubMed)
100. Natural Medicines Comprehensive Database [Web site]. Available at: http://www.naturaldatabase.com. Accessed 5/22/09.
101. Bowen PE, Herbst-Espinosa SM, Hussain EA, Stacewicz-Sapuntzakis M. Esterification does not impair lutein bioavailability in humans. J Nutr. 2002;132(12):3668-3673. (PubMed)
102. Hendler SS, Rorvik DR, eds. PDR for Nutritional Supplements. Montvale: Medical Economics Company, Inc; 2001.
103. Beta-Carotene. Natural Medicines Comprehensive Database [Web site]. December 29, 2003. Available at: http://www.naturaldatabase.com/monograph.asp?mono_id=999&brand_id=. Accessed December 29, 2003.
104. Solomons NW. Vitamin A and carotenoids. In: Bowman BA, Russell RM, eds. Present Knowledge in Nutrition. 8th ed. Washington, D.C.: ILSI Press; 2001:127-145.
105. Lutein. Natural Medicines Comprehensive Database [Web site]. December 29, 2003. Available at: http://www.naturaldatabase.com/monograph.asp?mono_id=754&brand_id=. Accessed December 29, 2003.
106. Ehrenfeld M, Levy M, Sharon P, Rachmilewitz D, Eliakim M. Gastrointestinal effects of long-term colchicine therapy in patients with recurrent polyserositis (familial mediterranean fever). Dig Dis Sci. 1982;27(8):723-727. (PubMed)
107. Tang G, Serfaty-Lacrosniere C, Camilo ME, Russell RM. Gastric acidity influences the blood response to a beta-carotene dose in humans. Am J Clin Nutr. 1996;64(4):622-626. (PubMed)
108. Brown BG, Zhao XQ, Chait A, et al. Simvastatin and niacin, antioxidant vitamins, or the combination for the prevention of coronary disease. N Engl J Med. 2001;345(22):1583-1592. (PubMed)
109. Collins R, Peto R, Armitage J. The MRC/BHF Heart Protection Study: preliminary results. Int J Clin Pract. 2002;56(1):53-56. (PubMed)
110. Koonsvitsky BP, Berry DA, Jones MB, et al. Olestra affects serum concentrations of alpha-tocopherol and carotenoids but not vitamin D or vitamin K status in free-living subjects. J Nutr. 1997;127(8 Suppl):1636S-1645S. (PubMed)
111. Thornquist MD, Kristal AR, Patterson RE, et al. Olestra consumption does not predict serum concentrations of carotenoids and fat-soluble vitamins in free-living humans: early results from the sentinel site of the olestra post-marketing surveillance study. J Nutr. 2000;130(7):1711-1718. (PubMed)
112. Neuhouser ML, Rock CL, Kristal AR, et al. Olestra is associated with slight reductions in serum carotenoids but does not markedly influence serum fat-soluble vitamin concentrations. Am J Clin Nutr. 2006;83(3):624-631. (PubMed)
113. Katan MB, Grundy SM, Jones P, Law M, Miettinen T, Paoletti R. Efficacy and safety of plant stanols and sterols in the management of blood cholesterol levels. Mayo Clin Proc. 2003;78(8):965-978. (PubMed)
114. Weststrate JA, Meijer GW. Plant sterol-enriched margarines and reduction of plasma total- and LDL-cholesterol concentrations in normocholesterolaemic and mildly hypercholesterolaemic subjects. Eur J Clin Nutr. 1998;52(5):334-343. (PubMed)
115. Ntanios FY, Duchateau GS. A healthy diet rich in carotenoids is effective in maintaining normal blood carotenoid levels during the daily use of plant sterol-enriched spreads. Int J Vitam Nutr Res. 2002;72(1):32-39. (PubMed)
116. Noakes M, Clifton P, Ntanios F, Shrapnel W, Record I, McInerney J. An increase in dietary carotenoids when consuming plant sterols or stanols is effective in maintaining plasma carotenoid concentrations. Am J Clin Nutr. 2002;75(1):79-86. (PubMed)
117. Leo MA, Lieber CS. Alcohol, vitamin A, and beta-carotene: adverse interactions, including hepatotoxicity and carcinogenicity. Am J Clin Nutr. 1999;69(6):1071-1085. (PubMed)
118. Albanes D, Heinonen OP, Taylor PR, et al. Alpha-Tocopherol and beta-carotene supplements and lung cancer incidence in the alpha-tocopherol, beta-carotene cancer prevention study: effects of base-line characteristics and study compliance. J Natl Cancer Inst. 1996;88(21):1560-1570. (PubMed)
119. van den Berg H. Carotenoid interactions. Nutr Rev. 1999;57(1):1-10. (PubMed)
120. Micozzi MS, Brown ED, Edwards BK, et al. Plasma carotenoid response to chronic intake of selected foods and beta-carotene supplements in men. Am J Clin Nutr. 1992;55(6):1120-1125. (PubMed)
121. Kostic D, White WS, Olson JA. Intestinal absorption, serum clearance, and interactions between lutein and beta-carotene when administered to human adults in separate or combined oral doses. Am J Clin Nutr. 1995;62(3):604-610. (PubMed)
122. Albanes D, Virtamo J, Taylor PR, Rautalahti M, Pietinen P, Heinonen OP. Effects of supplemental beta-carotene, cigarette smoking, and alcohol consumption on serum carotenoids in the Alpha-Tocopherol, Beta-Carotene Cancer Prevention Study. Am J Clin Nutr. 1997;66(2):366-372. (PubMed)
123. Nierenberg DW, Dain BJ, Mott LA, Baron JA, Greenberg ER. Effects of 4 y of oral supplementation with beta-carotene on serum concentrations of retinol, tocopherol, and five carotenoids. Am J Clin Nutr. 1997;66(2):315-319. (PubMed)
124. Wahlqvist ML, Wattanapenpaiboon N, Macrae FA, Lambert JR, MacLennan R, Hsu-Hage BH. Changes in serum carotenoids in subjects with colorectal adenomas after 24 mo of beta-carotene supplementation. Australian Polyp Prevention Project Investigators. Am J Clin Nutr. 1994;60(6):936-943. (PubMed)
125. Mayne ST, Cartmel B, Silva F, et al. Effect of supplemental beta-carotene on plasma concentrations of carotenoids, retinol, and alpha-tocopherol in humans. Am J Clin Nutr. 1998;68(3):642-647. (PubMed)
クルクミン
目次
要約
- ターメリックはショウガ科に属するウコンの地下茎から作られる香辛料である。クルクミノイドはターメリックの黄色の元となるポリフェノール化合物で、クルクミンはターメリックに含まれるクルクミノイドの主要成分である。
- 結直腸がん(大腸がん)患者を対象とした第I相臨床試験の結果、生物活性を呈する濃度のクルクミンがクルクミンの経口補給後に消化管に到達することがわかった。そのような試験は、消化管のがんのリスクのある人々に対するさらなる臨床評価の裏付けとなっている。(詳細はこちら)
- 嚢胞性線維症の個人におけるクルクミンの安全性と有効性が臨床試験で評価されるまで、嚢胞性線維症の療法としてのクルクミンの使用を嚢胞性線維症財団は推奨しない。(詳細はこちら)
- クルクミンはヒトで抗炎症作用があることを示唆する予備的な試験がいくつかあるが、炎症性疾患の治療にクルクミンの経口補給が有効であるかを決定するには、大規模無作為化対照試験が必要である。(詳細はこちら)
- アルツハイマー病の動物モデルで有望な発見があったため、初期のアルツハイマー病の患者に対するクルクミン補給の臨床試験が進行中である。(詳細はこちら)
序説
ターメリックは、ショウガ科に属するウコンの地下茎から作られる香辛料である。地下茎は地下に伸びる水平な茎で、そこからシュート(苗条)や根が出る。ターメリックの鮮やかな黄色は、クルクミノイドとして知られる脂溶性のポリフェノール色素に主に由来する(図1)。ターメリックの主要なクルクミノイドであるクルクミンは、その中で最も活性のある成分であると一般的に考えられている(1)。ターメリックに含まれるその他のクルクミノイドには、デメトキシクルクミンやビスデメトキシクルクミンなどがある。香辛料や顔料としての使い方の他に、ターメリックはインドで数世紀にわたって薬用に使われてきた。最近では、クルクミンに抗炎症作用や抗がん作用があるかもしれないというエビデンス(科学的根拠)によって、病気の予防や治療にクルクミンを使用する可能性に改めて科学的関心が寄せられている。
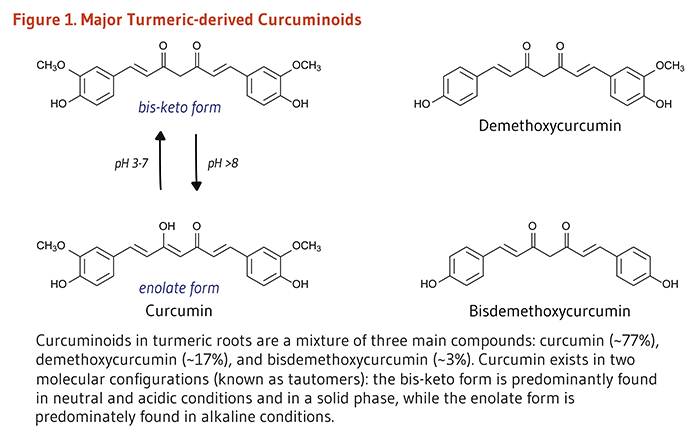
代謝と生物学的利用性
ヒトでの臨床試験では、経口投与されたクルクミンの全身的な生物学的利用性は比較的低く(1-3)、経口摂取の後ではクルクミンそのものではなく、大半はクルクミンの代謝物が血漿や血清に検出される(4,5)。腸や肝臓では、クルクミンはすぐにクルクミンのグルクロン酸抱合体や硫酸抱合体を形成するか、ヘキサヒドロクルクミンに還元される(図2)(6)。クルクミンの代謝物は、元の化合物と同じ生物活性を持っていない可能性がある。ある研究では、クルクミンが変化したり還元されたりした代謝物は、ヒトの培養大腸細胞で炎症を起こす酵素の発現を効果的に抑制することがクルクミンそのものよりもできなかった(7)。台湾で行われた臨床試験では、血清クルクミン濃度は経口投与後1~2時間でピークとなり、投与量が4、6、8gでピークの濃度がそれぞれ0.5、0.6、1.8マイクロモル/リットルであった(8)。クルクミンは、4g/日より低い投与量では血清中で検出できないのかもしれない。最近では、英国で行われた臨床試験で、3.6gのクルクミンの経口投与後1時間で、クルクミン、クルクミンの硫酸抱合体、およびクルクミンのグルクロン酸抱合体の血漿濃度は、10ナノモル/リットル(0.01マイクロモル/リットル)のオーダーであった(9)。クルクミンとその代謝物は、3.6g/日よりも少ない用量では血漿で検出されない可能性がある。クルクミンとそのグルクロン酸抱合体および硫酸抱合体は、3.6g/日の用量で投与された後に尿でも検出されている。経口投与されたクルクミンは、消化管の組織に蓄積するというエビデンスがある。たとえば、結直腸がんの患者が手術の前に3.6g/日のクルクミンを7日間経口摂取したところ、クルクミンはがんの結直腸組織でも正常な結直腸組織でも検出された(10)。対照的に、結直腸がんが肝臓に転移した患者の肝臓組織では、同量のクルクミンの経口摂取後にクルクミンは検出されなかった(11)。このことから、クルクミンの経口投与では消化管以外の組織にクルクミンを効果的に届けることができなかったということが示唆される。

生物活性
抗酸化活性
クルクミンは、試験管内(ガラス容器内)では活性酸素種や活性窒素種の効果的な捕捉剤である(12,13)。しかしながら、クルクミンが生体内で抗酸化物質として直接働くのかどうかは不明である。ヒトでの経口投与による生物学的利用性が限られている(「代謝と生物学的利用性」の項参照)ため、血漿および組織でのクルクミン濃度は、αトコフェロール(ビタミンE)などのその他の脂溶性抗酸化物質に比べてずっと低いであろう。しかし、クルクミンを7日間経口補給(3.6g/日)すると結直腸の悪性組織における酸化DNA付加体が減るという発見は、経口摂取されたクルクミンがDNAの酸化ダメージを抑制するほど十分な濃度で消化管に届くということを示唆している可能性がある(11)。直接的な抗酸化活性だけでなく、クルクミンは炎症を起こす酵素の活性を抑制したり、重要な細胞内抗酸化物質であるグルタチオンの合成を強化したりして、間接的に抗酸化物質として機能しているのかもしれない。
抗炎症活性
細胞膜におけるアラキドン酸の代謝は、エイコサノイドとして知られる強力な化学伝達物質を生成することで、炎症反応に重要な役割を果たしている(14)。膜リン脂質はホスホリパーゼA2(PLA2)によって加水分解され、アラキドン酸を放出する。これはシクロオキシゲナーゼ(COX)によって代謝されてプロスタグランジンとトロンボキサンを生成するか、リポキシゲナーゼ(LOX)によって代謝されてロイコトリエンを生成するのかもしれない。クルクミンは、培養細胞中ではPLA2,COX-2,および5-LOXの活性を抑制することがわかっている(15)。クルクミンは5-LOXの触媒活性を直接抑制していたが、PLA2のリン酸化反応を防いでその活性を抑制し、またCOX-2の転写を主に抑制することでその活性も抑制していた。核内因子κB(NF-κB)はDNAを結合させ、COX-2遺伝子や、誘導型一酸化窒素合成酵素(iNOS)などのその他の炎症誘発性遺伝子の転写を促進する。マクロファージなどの炎症細胞の中では、iNOSは一酸化窒素の合成に触媒作用をし、その一酸化窒素がスーパーオキシド(超酸化物)と反応して、蛋白質やDNAを損傷する可能性のある活性窒素種であるペルオキシナイトライト(過酸化亜硝酸)を生成する可能性がある。クルクミンは、NF-κBに依存する遺伝子の転写(16)や、培養細胞や動物試験におけるCOX-2やiNOSの誘発(17,18)を抑制することがわかっている。
グルタチオンの合成
グルタチオンは、細胞のストレス適応に重大な役割を果たす重要な細胞内抗酸化物質である(19)。ストレスに関連して細胞のグルタチオン濃度が上昇するのは、グルタチオン合成の律速酵素であるグルタミン酸システインリガーゼ(GCL)の発現が増大する結果である。培養細胞の研究では、GCLをコード化する遺伝子の転写を増進することでクルクミンが細胞のグルタチオン濃度を上げる可能性があることが示唆されている(20,21)。
発がん性物質の代謝に関連する生体内変換酵素への影響
生体内変換酵素は、薬物や発がん性物質を含む様々な生物活性化合物の代謝や除去に重要な役割を果している。一般に、シトクロムP450(CYP)ファミリーを含む第I相生体内変換酵素は、疎水性(脂溶性)化合物の反応性を上げるような触媒作用をし、第II相生体内変換酵素が触媒となる反応の準備をする。第II相酵素が触媒作用をする反応は、一般的に水溶性を上げてこれらの化合物の除去を促進する(22)。生体内変換酵素の活性を上げると発がんの可能性のある物質の除去を強化するかもしれないが、発がん物質の前駆体(前発がん物質)の中には、第I相酵素によって活動的な発がん物質に代謝されてしまうものもある(23)。CYP1A1は、いくつかの化学発がん性物質の代謝活性化に関係している。培養細胞や動物実験では、クルクミンは前発がん物質の生体内活性化またはCYP1A1活性の測定値を抑制することがわかっている(24-27)。第II相生体内変換酵素の活性を高めることは、一般的に発がんの可能性のある物質の除去を強化すると考えられている。いくつかの動物実験で、グルタチオンS転移酵素(GST)などの第II相酵素の活性が食事からのクルクミンによって高まったことがわかった(26,28,29)。しかしながら、0.45~3.6g/日のクルクミンを最長4ヶ月摂取しても、ヒトでの白血球のGST活性は上がらなかった(9)。
細胞周期停止とアポトーシスの誘発
細胞分裂後には、細胞周期としてまとめられる一連の段階を経てから細胞が再び分裂する。DNAの損傷の後では細胞周期は過渡的に停止し、DNAの修復をするか、損傷が修復できないものである場合には細胞死(アポトーシス)に至る経路を活性化する(30)。細胞周期の調整が不良であると、がんの発症に寄与する突然変異の伝播に至る可能性がある。クルクミンは様々な培養がん細胞株で、細胞周期の停止やアポトーシスを誘発することがわかっている(1,31-35)。クルクミンがアポトーシスを誘発するメカニズムはいろいろであるが、いくつかの細胞シグナル伝達経路に対する抑制効果を含むのかもしれない。しかし、クルクミンによるがん細胞のアポトーシスの誘発がすべての研究で見られたわけではない。クルクミンは、腫瘍抑制蛋白質p53によって誘発されるアポトーシスをヒトの培養大腸がん細胞で抑制した(36,37)。また、ある一つの研究では、培養乳がん細胞内でいくつかの化学療法薬によって誘発されるアポトーシスを、1~10マイクロモル/リットルの濃度のクルクミンが抑制したことがわかった(38)。
腫瘍浸潤および血管新生の抑制
がん細胞は、マトリックスメタロプロテイナーゼ(細胞外基質分解酵素)と呼ばれる酵素の助けを借りて正常な組織に侵入していく。培養細胞の研究では、クルクミンはいくつかのマトリックスメタロプロテイナーゼの活性を抑制することがわかっている(39-43)。浸潤性の腫瘍は急速な成長を促進するため、血管新生として知られるプロセスによって新しい血管も形成しなければならない。培養された血管内皮細胞(44,45)および動物モデル(46)において、クルクミンは血管新生を抑制したことがわかった。
注記:上記の生物活性の多くは、クルクミンを経口摂取したヒトの細胞で見られるであろうより高い濃度でクルクミンを与えた培養細胞で観察されたものであることを心に留めておくことが大切である。(「代謝と生物学的利用性」の項参照)。
疾病予防
がん
クルクミンがいくつかの異なるメカニズムで培養がん細胞でアポトーシスを誘発するという効力から、クルクミンをある種のがんの予防に使う可能性について科学的関心が喚起された(1)。口腔がん(47,48)、胃がん(49,50)、肝臓がん(51)、および大腸がん(52-54)の動物モデルでは、化学的に誘発されるがんの発症がクルクミンの経口投与で抑制されることがわかっている。APC Min/+マウスは、多数の結腸直腸腺腫(大腸腺腫)というポリープを作ることと結直腸がんのリスクが高いことが特徴の遺伝性疾患であるヒトの家族性大腸腺腫症に似たApc(大腸腺腫症)遺伝子に変異がある。クルクミンの経口投与は、APC Min/+マウスの腸腺腫の発症を抑制することがわかった(55,56)。対照的に、動物モデルでは乳がんの発症がクルクミンの経口投与で一貫して抑制されたわけではなかった(52,57,58)。
動物実験の結果は有望であり、結直腸がんで特に有望であるが、クルクミンやターメリックの高摂取がヒトのがんリスクの低下と関連があるというエビデンスは現在ほとんどない。台湾での第I相臨床試験では、口(口腔白板症)、子宮頸部(高悪性度の子宮頸部上皮内腫瘍)、皮膚(扁平上皮がん)、または胃(腸上皮化生)の前癌性病変の患者が最大8g/日のクルクミンを3ヶ月間経口摂取した効果を調べた(8)。口腔白板症の7人のうち2人で、子宮頸部上皮内腫瘍の4人のうち1人で、 扁平上皮がんの6人のうち2人で、腸上皮化生の6人のうち1人で、組織的な改善が生体組織検査で見られた。しかしながら、口腔白板症の7人のうちの1人と 子宮頸部上皮内腫瘍の4人のうち1人が、試験の終了までにがんを発症した。この研究はクルクミンの経口投与の生物学的利用性と安全性を主に調べるもので、比較のための対照群がないことから、この結果の解釈は限定されたものになる。動物研究での有望な発見の結果、腺腫のような前癌性結直腸病変に対するクルクミンの経口投与の効果を評価することを意図したヒトでの対照臨床試験がいくつか進行中である(59)。
疾病の治療
がん
様々ながんの細胞株でアポトーシスを誘発するクルクミンの効力とその低毒性によって、クルクミンを使ったがんの治療や予防の可能性への科学的興味が喚起された(60)。現在までのところ、がんの患者に対するクルクミン補給の対照臨床試験のほとんどは第I相の段階である。第I相試験は、生物学的利用性、安全性、および新しい治療法の効果への初期的なエビデンスの見極めを目的とした少人数のグループでの試験である(61)。進行した結直腸がん患者の第I相臨床試験では、最大で3.6g/日を4ヶ月間投与しても良好な許容性が示されたが、経口投与されたクルクミンの体内での生物学的利用性は低かった(62)。肝臓への転移のある結直腸がんの患者が3.6g/日のクルクミンを7日間経口摂取したら、肝臓組織でクルクミン代謝物が微量に測定されたが、クルクミンそのものは検出されなかった(11)。対照的に、進行した結直腸がんの患者が3.6g/日のクルクミンを7日間経口摂取したところ、クルクミンは正常な結直腸組織でも悪性の結直腸組織でも測定可能であった(10)。これらの発見は、クルクミンは消化管のがんではその他の組織よりも治療薬としてより効果的であろうことを示唆している。第II相の試験は、より大人数に対して新しい治療法の有効性を調べ、また短期間の副作用や安全性をさらに評価するための臨床試験である。結直腸がんの患者へのクルクミンの第II相臨床試験が現在進行中である(59)。進行したすい臓がんの患者によるクルクミンの第II相臨床試験では、クルクミンは21人の患者のうち2人の患者で何らかの抗がん作用を示したことがわかったが、クルクミンの生物学的利用性は極端に悪かった(63)。全身での生物学的利用性が低いこととクルクミンが疎水性であることから、著者たちはリポゾームに封入したクルクミンの静脈内投与を将来の臨床試験で使用することを提案している(63)。
炎症性疾患
培養細胞や動物の研究ではクルクミンの抗炎症活性が見られるものの、炎症性の病状の治療でのクルクミンの有効性を調べた対照臨床試験はほとんどない。関節リュウマチの患者18人でクルクミンと非ステロイド性の抗炎症薬(NSAID)を比べる予備的な介入試験で、クルクミン補給(1,200mg/日)を2週間した後の朝硬直、歩行時間、および関節の腫れの改善は、フェニルブタゾン(NSAID)での治療(300mg/日)を2週間行った後の改善に匹敵するものだった(64)。鼠径ヘルニアまたは水瘤の治療手術を受けた40人の男性によるプラセボ対照試験では、5日間のクルクミンの経口投与(1,200mg/日)は、手術後の浮腫、圧痛、および痛みを軽減するのにプラセボよりも効果的で、フェニルブタゾンでの治療(300mg/日)と遜色ないものだった(65)。2つの非対照試験では、クルクミンの経口投与(1,125mg/日)を12週間以上続けると、前部ぶどう膜炎と突発性の炎症性眼窩偽腫瘍という眼の炎症性の2つの症状が改善した(66,67)。しかしながら対照群がないので、これらの病状に対するクルクミンの抗炎症効果に関して結論を出すのは難しい。クルクミンの経口投与が関節リュウマチのような炎症性疾患の治療に有効であるかどうかを決定するより大規模な無作為化対照試験が必要である。
嚢胞性線維症
嚢胞性線維症は、嚢胞性線維症膜コンダクタンス制御因子(CFTR)遺伝子の突然変異で起こる遺伝性疾患である(62)。CFTRは塩素イオンチャネル(クロライドチャネル)として作用する膜貫通蛋白質で、イオンと体液の輸送に重大な役割を果たす。肺では、CFTRの突然変異は終いに粘液濃度の上昇と粘液のクリアランス(排出)の減少に至り、肺の進行性疾患を引き起こす。嚢胞性線維症の発症に寄与する最も一般的なCFTRの突然変異はDeltaF508変異であり、CFTR蛋白質が細胞膜に到達する前に間違って折りたたまれたり、分解されたりする。しかし、突然変異した蛋白質が細胞膜に入り込めば、塩素イオンチャネルとして機能する能力もいくらか残っている。DeltaF508変異のあるマウスに関する2004年の研究では、クルクミンの経口投与で異常なイオンの輸送が矯正され、これらのマウスの生存が伸びた(68)。しかしながら、ヒトと異なり、DeltaF508変異のあるマウスは肺の合併症を起こさずに、嚢胞性線維症の消化系での合併症だけを発症する。また、マウスモデルでの治療による利点は、ヒトでも常に現れるとは限らない(62)。最近では同じマウスモデルに同じ用量のクルクミンを投与した別のグループの研究では、クルクミンの有益性が再現できなかった(69)。クルクミン補給がヒトの嚢胞性線維症に有効であるかどうかは不明である。嚢胞性線維症財団が資金提供した第I相臨床試験では、欠陥のあるCFTR蛋白質の機能をクルクミンは補正できなかった。より高用量のクルクミンを使用した追跡調査が現在進行中である(70)。嚢胞性線維症の個人に対するクルクミンの安全性と有効性が臨床試験で評価されるまでは、嚢胞性線維症財団は嚢胞性線維症の治療でのクルクミンの使用を推奨しない(71)。
アルツハイマー病
アルツハイマー病では、アミロイドβと呼ばれるペプチドが凝集物(オリゴマー)を形成し、脳に集積してアミロイド斑という沈着物を作る(72)。炎症や酸化ダメージもアルツハイマー病の進行に伴っておこる(73)。クルクミンは、ガラス容器内ではアミロイドβオリゴマーの形成を抑制することが知られている(74)。アルツハイマー病の動物モデルでは、クルクミンは末梢に注入されると血液脳関門を通過することがわかっている(74)。アルツハイマー病の動物モデルでは、食事からクルクミンを摂取することで、炎症や酸化ダメージ、脳のアミロイド斑負荷、およびアミロイドβに誘発された記憶欠損に関連するバイオマーカー値が減少した(74-77)。ヒトにおいて、口から摂取されたクルクミンが血液脳関門を通過したりアルツハイマー病の進行を抑制したりするのかどうかは不明である。動物モデルでの有望な発見の結果、初期のアルツハイマー病患者へのクルクミンの経口補給の臨床試験が進行中である(59,78)。アルツハイマー病の27人に対する6ヶ月の試験の結果、最大4g/日のクルクミンの経口補給は安全であるとわかった(4)。アルツハイマー病にクルクミンの経口補給が有効であるかを決定するより大規模な対照臨床試験が必要である。
摂取源
食品の摂取源
ターメリックはウコンの地下茎をすりおろして乾燥させたものである(79)。インド、東南アジア、および中東の料理で香辛料として使用される。クルクミノイドはターメリックの約2~9%を占める(80)。クルクミンはターメリックで最も多いクルクミノイドで、クルクミノイド全体の約75%を占める。一方、デメトキシクルクミンは10~20%で、ビスデメトキシクルクミンは一般に5%未満である。カレー粉はターメリックとその他のスパイスを含むが、カレー粉のクルクミンの量は変異が大きく、比較的少ないことがしばしばである(81)。クルクミンの抽出物も食品着色料として使用される(82)。
サプリメント
クルクミン抽出物は、米国では処方箋なしで栄養補助食品として入手可能である。これらの抽出物のラベルの多くには95%クルクミノイドを含むよう規格化されていると記載されているが、そのような主張は米国食品医薬品局(FDA)によって厳密に規制されているわけではない。クルクミン製品の中にはピペリンも含むものがあり、これによってクルクミンの代謝を抑制してクルクミンの生物学的利用性が向上する可能性がある。しかし、ピペリンは薬品の代謝にも影響する可能性がある(「薬物との相互作用」の項参照)。がんの化学予防や治療的使用のための最適なクルクミンの用量はまだ確立されていない。ヒトでは3.6g/日未満の用量が生物学的に活性を持つのかどうか不明である(「代謝と生物学的利用性」の項参照)。
安全性
悪影響
米国では、ターメリックは食品添加物として安全であるとFDAによって一般的に認識(GRASと表記される合格証で認定)されている(82)。クルクミンの高用量摂取によるヒトでの深刻な悪影響の報告はない。24人の成人による用量漸増試験では、1回に最大で12gまでの経口摂取は安全であり、悪影響は用量に関連するものではなかった(5)。台湾での第I相試験では、最大8g/日のクルクミン補給を3ヶ月間しても、前がん病変または非侵襲性がんの患者は良好な耐容性を示した(8)。英国での別の臨床試験では、0.45~3.6g/日のクルクミンを4ヶ月間補給しても進行した結直腸がんの患者は一般に良好な耐容性を示したが、2人の患者が下痢になり、別の1人は吐き気があったと報告された(9)。血清アルカリホスファターゼおよび乳酸デヒドロゲナーゼ濃度の上昇も何人かの参加者で見られたが、これらの増加がクルクミン補給によるものなのかがんの進行によるものなのか不明である(1)。20~40mgのクルクミン補給は、健康な人では胆のうの収縮を促進することが報告されている(83,84)。胆のう収縮の促進は、胆のうの空化を促すことで胆石の形成リスクを下げるかもしれないが、胆石をすでに患っている患者には症状の発生リスクを上げる可能性がある。
妊娠期および授乳期
ターメリックを香辛料として食事で摂取しても妊娠や授乳に悪影響があるというエビデンスはないが、妊娠期や授乳期におけるクルクミンのサプリメント摂取の安全性は確立していない。
薬物との相互作用
クルクミンはガラス容器内で血小板凝縮を抑制することがわかっている(85,86)ことから、アスピリン、クロピドグレル(プラビックス)、ダルテパリン(フラグミン)、エノキサパリン(ラブノックス)、ヘパリン、チクロピジン(チクリッド)、およびワルファリン(クマジン)などの抗凝固薬や抗血小板作用の薬を飲んでいる患者は、クルクミン補給によって出血のリスクが高くなる可能性がある。培養乳がん細胞では、1~10マイクロモル/リットルの濃度のクルクミンは、化学療法薬、カンプトテシン、メクロレタミン、およびドキソルビシンによって誘発されるアポトーシスを抑制した(38)。乳がんの動物モデルでは、食事からのクルクミンはシクロホスファミドに誘発される腫瘍の退縮を抑制した。クルクミンの経口投与によってヒトのがんの化学療法薬を抑制するほどの高濃度でクルクミンが胸部組織に濃縮されることになるのかどうか不明である(11)が、乳がんでの化学療法を受けている女性はクルクミンのサプリメントは避けたほうがよいかもしれない(38)。クルクミンのサプリメントには、クルクミンの生物学的利用性を高めるためにピペリンを含むものもある。しかしながら、ピペリンはフェニトイン(ディランチン)、プロプラノロール(インデラル)、およびテオフィリンを含むいくつかの薬物の生物学的利用性を高めてその除去を遅らせる可能性がある(87,88)。
Authors and Reviewers
Originally written in 2005 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in January 2009 by:
Victoria J. Drake, Ph.D.
Linus Pauling Institute
Oregon State University
Reviewed in January 2009 by:
Chung S. Yang, Ph.D.
Professor II and Chair
Department of Chemical Biology
Ernest Mario School of Pharmacy
Rutgers, The State University of New Jersey
Copyright 2005-2024 Linus Pauling Institute
References
1. Sharma RA, Gescher AJ, Steward WP. Curcumin: The story so far. Eur J Cancer. 2005;41(13):1955-1968. (PubMed)
2. Anand P, Kunnumakkara AB, Newman RA, Aggarwal BB. Bioavailability of curcumin: problems and promises. Mol Pharm. 2007;4(6):807-818. (PubMed)
3. Maheshwari RK, Singh AK, Gaddipati J, Srimal RC. Multiple biological activities of curcumin: a short review. Life Sci. 2006;78(18):2081-2087. (PubMed)
4. Baum L, Lam CW, Cheung SK, et al. Six-month randomized, placebo-controlled, double-blind, pilot clinical trial of curcumin in patients with Alzheimer disease. J Clin Psychopharmacol. 2008;28(1):110-113. (PubMed)
5. Lao CD, Ruffin MTt, Normolle D, et al. Dose escalation of a curcuminoid formulation. BMC Complement Altern Med. 2006;6:10. (PubMed)
6. Ireson CR, Jones DJ, Orr S, et al. Metabolism of the cancer chemopreventive agent curcumin in human and rat intestine. Cancer Epidemiol Biomarkers Prev. 2002;11(1):105-111. (PubMed)
7. Ireson C, Orr S, Jones DJ, et al. Characterization of metabolites of the chemopreventive agent curcumin in human and rat hepatocytes and in the rat in vivo, and evaluation of their ability to inhibit phorbol ester-induced prostaglandin E2 production. Cancer Res. 2001;61(3):1058-1064. (PubMed)
8. Cheng AL, Hsu CH, Lin JK, et al. Phase I clinical trial of curcumin, a chemopreventive agent, in patients with high-risk or pre-malignant lesions. Anticancer Res. 2001;21(4B):2895-2900. (PubMed)
9. Sharma RA, Euden SA, Platton SL, et al. Phase I clinical trial of oral curcumin: biomarkers of systemic activity and compliance. Clin Cancer Res. 2004;10(20):6847-6854. (PubMed)
10. Garcea G, Berry DP, Jones DJ, et al. Consumption of the putative chemopreventive agent curcumin by cancer patients: assessment of curcumin levels in the colorectum and their pharmacodynamic consequences. Cancer Epidemiol Biomarkers Prev. 2005;14(1):120-125. (PubMed)
11. Garcea G, Jones DJ, Singh R, et al. Detection of curcumin and its metabolites in hepatic tissue and portal blood of patients following oral administration. Br J Cancer. 2004;90(5):1011-1015. (PubMed)
12. Sreejayan, Rao MN. Nitric oxide scavenging by curcuminoids. J Pharm Pharmacol. 1997;49(1):105-107. (PubMed)
13. Sreejayan N, Rao MN. Free radical scavenging activity of curcuminoids. Arzneimittelforschung. 1996;46(2):169-171. (PubMed)
14. Steele VE, Hawk ET, Viner JL, Lubet RA. Mechanisms and applications of non-steroidal anti-inflammatory drugs in the chemoprevention of cancer. Mutat Res. 2003;523-524:137-144. (PubMed)
15. Hong J, Bose M, Ju J, et al. Modulation of arachidonic acid metabolism by curcumin and related beta-diketone derivatives: effects on cytosolic phospholipase A(2), cyclooxygenases and 5-lipoxygenase. Carcinogenesis. 2004;25(9):1671-1679. (PubMed)
16. Plummer SM, Holloway KA, Manson MM, et al. Inhibition of cyclo-oxygenase 2 expression in colon cells by the chemopreventive agent curcumin involves inhibition of NF-kappaB activation via the NIK/IKK signalling complex. Oncogene. 1999;18(44):6013-6020. (PubMed)
17. Brouet I, Ohshima H. Curcumin, an anti-tumour promoter and anti-inflammatory agent, inhibits induction of nitric oxide synthase in activated macrophages. Biochem Biophys Res Commun. 1995;206(2):533-540. (PubMed)
18. Nanji AA, Jokelainen K, Tipoe GL, Rahemtulla A, Thomas P, Dannenberg AJ. Curcumin prevents alcohol-induced liver disease in rats by inhibiting the expression of NF-kappa B-dependent genes. Am J Physiol Gastrointest Liver Physiol. 2003;284(2):G321-327. (PubMed)
19. Dickinson DA, Levonen AL, Moellering DR, et al. Human glutamate cysteine ligase gene regulation through the electrophile response element. Free Radic Biol Med. 2004;37(8):1152-1159. (PubMed)
20. Dickinson DA, Iles KE, Zhang H, Blank V, Forman HJ. Curcumin alters EpRE and AP-1 binding complexes and elevates glutamate-cysteine ligase gene expression. Faseb J. 2003;17(3):473-475. (PubMed)
21. Zheng S, Yumei F, Chen A. De novo synthesis of glutathione is a prerequisite for curcumin to inhibit hepatic stellate cell (HSC) activation. Free Radic Biol Med. 2007;43(3):444-453. (PubMed)
22. Lampe JW, Peterson S. Brassica, biotransformation and cancer risk: genetic polymorphisms alter the preventive effects of cruciferous vegetables. J Nutr. 2002;132(10):2991-2994. (PubMed)
23. Baird WM, Hooven LA, Mahadevan B. Carcinogenic polycyclic aromatic hydrocarbon-DNA adducts and mechanism of action. Environ Mol Mutagen. 2005;45(2-3):106-114. (PubMed)
24. Ciolino HP, Daschner PJ, Wang TT, Yeh GC. Effect of curcumin on the aryl hydrocarbon receptor and cytochrome P450 1A1 in MCF-7 human breast carcinoma cells. Biochem Pharmacol. 1998;56(2):197-206. (PubMed)
25. Rinaldi AL, Morse MA, Fields HW, et al. Curcumin activates the aryl hydrocarbon receptor yet significantly inhibits (-)-benzo(a)pyrene-7R-trans-7,8-dihydrodiol bioactivation in oral squamous cell carcinoma cells and oral mucosa. Cancer Res. 2002;62(19):5451-5456. (PubMed)
26. Singh SV, Hu X, Srivastava SK, et al. Mechanism of inhibition of benzo[a]pyrene-induced forestomach cancer in mice by dietary curcumin. Carcinogenesis. 1998;19(8):1357-1360. (PubMed)
27. Thapliyal R, Maru GB. Inhibition of cytochrome P450 isozymes by curcumins in vitro and in vivo. Food Chem Toxicol. 2001;39(6):541-547. (PubMed)
28. Iqbal M, Sharma SD, Okazaki Y, Fujisawa M, Okada S. Dietary supplementation of curcumin enhances antioxidant and phase II metabolizing enzymes in ddY male mice: possible role in protection against chemical carcinogenesis and toxicity. Pharmacol Toxicol. 2003;92(1):33-38. (PubMed)
29. Susan M, Rao MN. Induction of glutathione S-transferase activity by curcumin in mice. Arzneimittelforschung. 1992;42(7):962-964. (PubMed)
30. Stewart ZA, Westfall MD, Pietenpol JA. Cell-cycle dysregulation and anticancer therapy. Trends Pharmacol Sci. 2003;24(3):139-145. (PubMed)
31. Duvoix A, Blasius R, Delhalle S, et al. Chemopreventive and therapeutic effects of curcumin. Cancer Lett. 2005;223(2):181-190. (PubMed)
32. Surh YJ, Chun KS. Cancer chemopreventive effects of curcumin. Adv Exp Med Biol. 2007;595:149-172. (PubMed)
33. Singh S, Khar A. Biological effects of curcumin and its role in cancer chemoprevention and therapy. Anticancer Agents Med Chem. 2006;6(3):259-270. (PubMed)
34. Kuttan G, Kumar KB, Guruvayoorappan C, Kuttan R. Antitumor, anti-invasion, and antimetastatic effects of curcumin. Adv Exp Med Biol. 2007;595:173-184. (PubMed)
35. Kunnumakkara AB, Anand P, Aggarwal BB. Curcumin inhibits proliferation, invasion, angiogenesis and metastasis of different cancers through interaction with multiple cell signaling proteins. Cancer Lett. 2008;269(2):199-225. (PubMed)
36. Moos PJ, Edes K, Mullally JE, Fitzpatrick FA. Curcumin impairs tumor suppressor p53 function in colon cancer cells. Carcinogenesis. 2004;25(9):1611-1617. (PubMed)
37. Tsvetkov P, Asher G, Reiss V, Shaul Y, Sachs L, Lotem J. Inhibition of NAD(P)H:quinone oxidoreductase 1 activity and induction of p53 degradation by the natural phenolic compound curcumin. Proc Natl Acad Sci U S A. 2005;102(15):5535-5540. (PubMed)
38. Somasundaram S, Edmund NA, Moore DT, Small GW, Shi YY, Orlowski RZ. Dietary curcumin inhibits chemotherapy-induced apoptosis in models of human breast cancer. Cancer Res. 2002;62(13):3868-3875. (PubMed)
39. Banerji A, Chakrabarti J, Mitra A, Chatterjee A. Effect of curcumin on gelatinase A (MMP-2) activity in B16F10 melanoma cells. Cancer Lett. 2004;211(2):235-242. (PubMed)
40. Ohashi Y, Tsuchiya Y, Koizumi K, Sakurai H, Saiki I. Prevention of intrahepatic metastasis by curcumin in an orthotopic implantation model. Oncology. 2003;65(3):250-258. (PubMed)
41. Menon LG, Kuttan R, Kuttan G. Anti-metastatic activity of curcumin and catechin. Cancer Lett. 1999;141(1-2):159-165. (PubMed)
42. Mitra A, Chakrabarti J, Banerji A, Chatterjee A, Das BR. Curcumin, a potential inhibitor of MMP-2 in human laryngeal squamous carcinoma cells HEp2. J Environ Pathol Toxicol Oncol. 2006;25(4):679-690. (PubMed)
43. Hong JH, Ahn KS, Bae E, Jeon SS, Choi HY. The effects of curcumin on the invasiveness of prostate cancer in vitro and in vivo. Prostate Cancer Prostatic Dis. 2006;9(2):147-152. (PubMed)
44. Thaloor D, Singh AK, Sidhu GS, Prasad PV, Kleinman HK, Maheshwari RK. Inhibition of angiogenic differentiation of human umbilical vein endothelial cells by curcumin. Cell Growth Differ. 1998;9(4):305-312. (PubMed)
45. Bhandarkar SS, Arbiser JL. Curcumin as an inhibitor of angiogenesis. Adv Exp Med Biol. 2007;595:185-195. (PubMed)
46. Arbiser JL, Klauber N, Rohan R, et al. Curcumin is an in vivo inhibitor of angiogenesis. Mol Med. 1998;4(6):376-383. (PubMed)
47. Krishnaswamy K, Goud VK, Sesikeran B, Mukundan MA, Krishna TP. Retardation of experimental tumorigenesis and reduction in DNA adducts by turmeric and curcumin. Nutr Cancer. 1998;30(2):163-166. (PubMed)
48. Li N, Chen X, Liao J, et al. Inhibition of 7,12-dimethylbenz[a]anthracene (DMBA)-induced oral carcinogenesis in hamsters by tea and curcumin. Carcinogenesis. 2002;23(8):1307-1313. (PubMed)
49. Ikezaki S, Nishikawa A, Furukawa F, et al. Chemopreventive effects of curcumin on glandular stomach carcinogenesis induced by N-methyl-N'-nitro-N-nitrosoguanidine and sodium chloride in rats. Anticancer Res. 2001;21(5):3407-3411. (PubMed)
50. Huang MT, Lou YR, Ma W, Newmark HL, Reuhl KR, Conney AH. Inhibitory effects of dietary curcumin on forestomach, duodenal, and colon carcinogenesis in mice. Cancer Res. 1994;54(22):5841-5847. (PubMed)
51. Chuang SE, Kuo ML, Hsu CH, et al. Curcumin-containing diet inhibits diethylnitrosamine-induced murine hepatocarcinogenesis. Carcinogenesis. 2000;21(2):331-335. (PubMed)
52. Pereira MA, Grubbs CJ, Barnes LH, et al. Effects of the phytochemicals, curcumin and quercetin, upon azoxymethane-induced colon cancer and 7,12-dimethylbenz[a]anthracene-induced mammary cancer in rats. Carcinogenesis. 1996;17(6):1305-1311. (PubMed)
53. Rao CV, Rivenson A, Simi B, Reddy BS. Chemoprevention of colon carcinogenesis by dietary curcumin, a naturally occurring plant phenolic compound. Cancer Res. 1995;55(2):259-266. (PubMed)
54. Kawamori T, Lubet R, Steele VE, et al. Chemopreventive effect of curcumin, a naturally occurring anti-inflammatory agent, during the promotion/progression stages of colon cancer. Cancer Res. 1999;59(3):597-601. (PubMed)
55. Mahmoud NN, Carothers AM, Grunberger D, et al. Plant phenolics decrease intestinal tumors in an animal model of familial adenomatous polyposis. Carcinogenesis. 2000;21(5):921-927. (PubMed)
56. Perkins S, Verschoyle RD, Hill K, et al. Chemopreventive efficacy and pharmacokinetics of curcumin in the min/+ mouse, a model of familial adenomatous polyposis. Cancer Epidemiol Biomarkers Prev. 2002;11(6):535-540. (PubMed)
57. Huang MT, Lou YR, Xie JG, et al. Effect of dietary curcumin and dibenzoylmethane on formation of 7,12-dimethylbenz[a]anthracene-induced mammary tumors and lymphomas/leukemias in Sencar mice. Carcinogenesis. 1998;19(9):1697-1700. (PubMed)
58. Singletary K, MacDonald C, Iovinelli M, Fisher C, Wallig M. Effect of the beta-diketones diferuloylmethane (curcumin) and dibenzoylmethane on rat mammary DNA adducts and tumors induced by 7,12-dimethylbenz[a]anthracene. Carcinogenesis. 1998;19(6):1039-1043. (PubMed)
59. National Institutes of Health. Clinical Trials.gov. 2005. Available at: http://clinicaltrials.gov/ Accessed 1/13/09.
60. Karunagaran D, Rashmi R, Kumar TR. Induction of apoptosis by curcumin and its implications for cancer therapy. Curr Cancer Drug Targets. 2005;5(2):117-129. (PubMed)
61. National Institutes of Health. An Introduction to Clinical Trials. 2005. Available at: http://clinicaltrials.gov/ct/info/whatis. Accessed 1/13/09.
62. Mall M, Kunzelmann K. Correction of the CF defect by curcumin: hypes and disappointments. Bioessays. 2005;27(1):9-13. (PubMed)
63. Dhillon N, Aggarwal BB, Newman RA, et al. Phase II trial of curcumin in patients with advanced pancreatic cancer. Clin Cancer Res. 2008;14(14):4491-4499. (PubMed)
64. Deodhar SD, Sethi R, Srimal RC. Preliminary study on antirheumatic activity of curcumin (diferuloyl methane). Indian J Med Res. 1980;71:632-634.
65. Satoskar RR, Shah SJ, Shenoy SG. Evaluation of anti-inflammatory property of curcumin (diferuloyl methane) in patients with postoperative inflammation. Int J Clin Pharmacol Ther Toxicol. 1986;24(12):651-654. (PubMed)
66. Lal B, Kapoor AK, Agrawal PK, Asthana OP, Srimal RC. Role of curcumin in idiopathic inflammatory orbital pseudotumours. Phytother Res. 2000;14(6):443-447. (PubMed)
67. Lal B, Kapoor AK, Asthana OP, et al. Efficacy of curcumin in the management of chronic anterior uveitis. Phytother Res. 1999;13(4):318-322. (PubMed)
68. Egan ME, Pearson M, Weiner SA, et al. Curcumin, a major constituent of turmeric, corrects cystic fibrosis defects. Science. 2004;304(5670):600-602. (PubMed)
69. Song Y, Sonawane ND, Salinas D, et al. Evidence against the rescue of defective DeltaF508-CFTR cellular processing by curcumin in cell culture and mouse models. J Biol Chem. 2004;279(39):40629-40633. (PubMed)
70. Cystic Fibrosis Foundation. Drug Development Pipeline. [Web page]. http://www.cff.org/research/DrugDevelopmentPipeline/. Accessed 1/13/09.
71. Cystic Fibrosis Foundation. Curcumin: Information for Patients and Families. 2004. http://www.cff.org/images/customcontent/CurcuminQAFinal.pdf. Accessed 1/13/09.
72. Gandy S. The role of cerebral amyloid beta accumulation in common forms of Alzheimer disease. J Clin Invest. 2005;115(5):1121-1129. (PubMed)
73. Cole GM, Morihara T, Lim GP, Yang F, Begum A, Frautschy SA. NSAID and Antioxidant Prevention of Alzheimer's Disease: Lessons from In Vitro and Animal Models. Ann N Y Acad Sci. 2004;1035:68-84. (PubMed)
74. Yang F, Lim GP, Begum AN, et al. Curcumin inhibits formation of amyloid beta oligomers and fibrils, binds plaques, and reduces amyloid in vivo. J Biol Chem. 2005;280(7):5892-5901. (PubMed)
75. Lim GP, Chu T, Yang F, Beech W, Frautschy SA, Cole GM. The curry spice curcumin reduces oxidative damage and amyloid pathology in an Alzheimer transgenic mouse. J Neurosci. 2001;21(21):8370-8377. (PubMed)
76. Frautschy SA, Hu W, Kim P, et al. Phenolic anti-inflammatory antioxidant reversal of Abeta-induced cognitive deficits and neuropathology. Neurobiol Aging. 2001;22(6):993-1005. (PubMed)
77. Pan R, Qiu S, Lu DX, Dong J. Curcumin improves learning and memory ability and its neuroprotective mechanism in mice. Chin Med J (Engl). 2008;121(9):832-839. (PubMed)
78. Kelley BJ, Knopman DS. Alternative medicine and Alzheimer disease. Neurologist. 2008;14(5):299-306. (PubMed)
79. Joe B, Vijaykumar M, Lokesh BR. Biological properties of curcumin-cellular and molecular mechanisms of action. Crit Rev Food Sci Nutr. 2004;44(2):97-111. (PubMed)
80. Lechtenberg M, Quandt B, Nahrstedt A. Quantitative determination of curcuminoids in Curcuma rhizomes and rapid differentiation of Curcuma domesticaVal. and Curcuma xanthorrhiza Roxb. by capillary electrophoresis. Phytochem Anal. 2004;15(3):152-158. (PubMed)
81. Tayyem RF, Heath DD, Al-Delaimy WK, Rock CL. Curcumin content of turmeric and curry powders. Nutr Cancer. 2006;55(2):126-131. (PubMed)
82. US Food and Drug Administration. Food Additive Status List. 2005. http://www.cfsan.fda.gov/~dms/opa-appa.html. Accessed 1/13/09.
83. Rasyid A, Lelo A. The effect of curcumin and placebo on human gall-bladder function: an ultrasound study. Aliment Pharmacol Ther. 1999;13(2):245-249. (PubMed)
84. Rasyid A, Rahman AR, Jaalam K, Lelo A. Effect of different curcumin dosages on human gall bladder. Asia Pac J Clin Nutr. 2002;11(4):314-318. (PubMed)
85. Shah BH, Nawaz Z, Pertani SA, et al. Inhibitory effect of curcumin, a food spice from turmeric, on platelet-activating factor- and arachidonic acid-mediated platelet aggregation through inhibition of thromboxane formation and Ca2+ signaling. Biochem Pharmacol. 1999;58(7):1167-1172. (PubMed)
86. Srivastava KC, Bordia A, Verma SK. Curcumin, a major component of food spice turmeric (Curcuma longa) inhibits aggregation and alters eicosanoid metabolism in human blood platelets. Prostaglandins Leukot Essent Fatty Acids. 1995;52(4):223-227. (PubMed)
87. Bano G, Raina RK, Zutshi U, Bedi KL, Johri RK, Sharma SC. Effect of piperine on bioavailability and pharmacokinetics of propranolol and theophylline in healthy volunteers. Eur J Clin Pharmacol. 1991;41(6):615-617. (PubMed)
88. Velpandian T, Jasuja R, Bhardwaj RK, Jaiswal J, Gupta SK. Piperine in food: interference in the pharmacokinetics of phenytoin. Eur J Drug Metab Pharmacokinet. 2001;26(4):241-247. (PubMed)
フラボノイド類
目次
要約
- フラボノイド類(以下、単にフラボノイドとする)は植物によって合成される多数のポリフェノール化合物である。(詳細はこちら)
- 果物や野菜の豊富な食事に関連するフラボノイドの健康への潜在的有益性に関心が持たれている。(詳細はこちら)
- フラボノイドの生物学的効果の多くは、その抗酸化活性よりも細胞シグナル伝達経路の調整能力に関係しているようである。(詳細はこちら)
- フラボノイドの豊富な食品の高摂取は心血管疾患のリスク低下と関連があるものの、フラボノイドそのものに心臓保護効果があるのかどうかはわかっていない。(詳細はこちら)
- 動物研究では有望な結果になっているが、フラボノイドの高摂取がヒトのがん予防に役立つかどうかは不明である。(詳細はこちら)
- フラボノイドの摂取がヒトの神経変性疾患のリスクにどのように影響するのか不明である。(詳細はこちら)
- フラボノイドの豊富な食品の高摂取は、いくつかの研究で慢性疾患のリスク減少と関連があるものの、単離されたフラボノイドのサプリメントや抽出物がフラボノイドの豊富な食品と同じ効果をもたらすかどうかはわからない。
序説
フラボノイドは植物によって合成される多数のポリフェノール化合物で、共通の化学構造を持つ(図1)。フラボノイドは複数の下位クラスにさらに分類されることもある(表1)。過去10年で、果物や野菜の豊富な食事に関連する健康効果のいくつかを説明する様々な食事性フラボノイドの可能性への関心が高まった。本項では、食事中のフラボノイドが健康を促進しヒトの病気を予防するという仮説に対する科学的エビデンスについて概説する。エストロゲン様活性のあるフラボノイド類であるイソフラボン類の健康効果に関する詳細は、「大豆イソフラボン類」の項の記事を参照されたい。フラボノイドの豊富な食品の健康効果の詳細は、別項の「果物および野菜」 および「茶飲料」の記載内容を参照されたい。

| フラボノイドの下位クラス | 食事中のフラボノイド | 一般的な食品源 |
|---|---|---|
| アントシアニジン類 | シアニジン、デルフィニジン、マルビジン、ペラルゴニジン、ペオニジン、ペツニジン | 赤、青、および紫のベリー類、赤および紫のぶどう、赤ワイン |
|
単量体(カテキン)類: カテキン、エピカテキン、エピガロカテキン、エピカテキンガレート、エピガロカテキンガレート 二量体および重合体: テアフラビン類、, テアルビジン類、プロアントシアニジン類 |
カテキン類: 茶(特に緑茶、白茶)、チョコレート、ぶどう、ベリー類、りんご |
|
| フラバノン類 | ヘスペレチン、ナリンゲニン、エリオジクチオール | オレンジ、グレープフルーツ、レモンなどの柑橘類およびそのジュース |
| フラボノール類 | ケルセチン、ケンプフェロール、ミリセチン、イソラムネチン | 黄タマネギ、わけぎ、ケール、ブロッコリ、りんご、ベリー類、茶などに広く分布 |
| フラボン類 | アピゲニン、ルテオリン | パセリ、タイム、セロリ、唐辛子 |
| イソフラボン類 | ダイゼイン、ゲニステイン、グリシテイン | 大豆、大豆食品、豆類 |

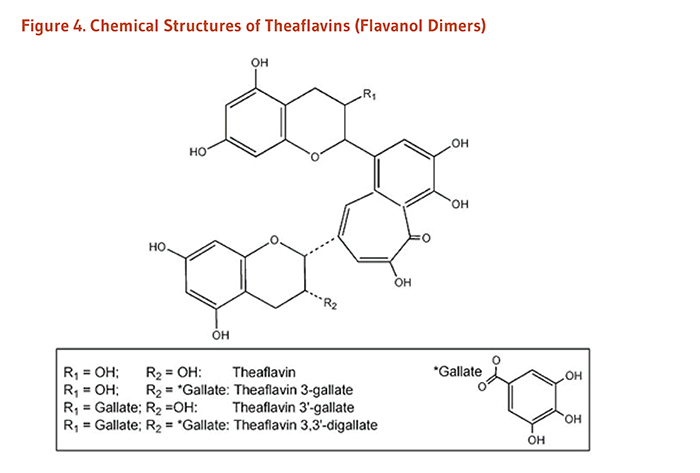





代謝と生物学的利用能
1つまたはそれ以上の糖分子に結合したフラボノイドはフラボノイド配糖体(グリコシド)として知られ、糖分子に結合していないものはアグリコンと呼ばれる。フラバノール類(カテキン類とプロアントシアニジン類)を除いて、フラボノイドは植物およびほとんどの食品でグリコシドとして存在する(2)。調理の後でも、ほとんどのフラボノイドのグリコシドは小腸にそのまま到達する。フラボノイドアグリコンとフラボノイドグルコシド(グルコースに結合したもの)だけが小腸で吸収され、急速に代謝されてメチル化物、グルクロン酸抱合体、または硫酸化物となる(3)。通常は結腸に住み着いているバクテリアも、フラボノイドの代謝と吸収に重要な役割を果たす。結腸に到達したフラボノイドまたはフラボノイド代謝物は、バクテリアの酵素によってさらに代謝され吸収されることもある。特定のフラボノイド代謝物を生成できる能力は個人によって異なり、結腸の微生物叢環境に依るのかもしれない(4,5)。フラボノイドの吸収が限られることや急速に排出されることから、一般にフラボノイドの生物学的利用能は比較的低い。生物学的利用能は、様々なフラボノイドによって異なる。イソフラボン類は最も生物学的に利用性の高いグループのフラボノイドであるが、フラバノール類(プロアントシアニジン類および茶のカテキン類)とアントシアニン類の吸収は非常に悪い(6)。フラボノイドは急速かつ広範囲に代謝されるので、フラボノイド代謝物の生物学的活性は元の化合物のそれと同じであるとは限らない((7)の文献で概説)。培養細胞におけるフラボノイドの研究からのデータを評価する際には、フラボノイドの濃度と使用されたフラボノイド代謝物が生理学的に妥当かどうかを考慮することが大切である(8)。ヒトでは、大豆イソフラボン類および柑橘類フラバノン類の血漿濃度の最大値は、経口摂取後に10マイクロモル/リットルを超えたことがない。アントシアニン類、フラバノール類、およびフラボノール類(茶由来のものを含む)の摂取後の血漿濃度の最大値は、一般に1マイクロモル/リットル未満である(3)。
生物学的活性
直接的抗酸化活性
フラボノイドは、試験管内(インビトロ)ではフリーラジカル(遊離基)を効果的に除去する(9,10)。しかし、フラボノイドを非常にたくさん摂取しても、ヒトの血漿および細胞内フラボノイド濃度は、アスコルビン酸(ビタミンC)、尿酸、またはグルタチオンといったその他の抗酸化物質の100~1000分の1以下であろう。しかもほとんどの血液循環中のフラボノイドは、実際はフラボノイド代謝物であり、そのいくつかはもとのフラボノイドよりも抗酸化活性が低い。これらの理由から、生体内の血漿および組織内での抗酸化機能に食事由来のフラボノイドが果たす相対的な貢献度は、非常に小さいか無視できる程度であろう(7,11,12)。
金属キレート化
鉄や銅といった金属のイオンは、フリーラジカルの生成に触媒として機能する。フラボノイドが金属イオンをキレート化する(結合する)性質は、インビトロでの抗酸化活性に寄与しているようである(13,14)。生物体内ではほとんどの鉄および銅はタンパク質と結合し、フリーラジカルを生成する反応への関与は限られている。フラボノイドの金属キレート化活性は、鉄または銅が過剰な病的状態では有益であるかもしれないが、フラボノイドまたはその代謝物が生体内で有効な金属キレート剤として機能するかどうかは不明である(11)。
細胞シグナル伝達経路への効果
細胞は特定のタンパク質の利用性を増やしたり減らしたりすることで、様々なストレスやシグナルに対して応答することができる。特定の遺伝子の発現に変化をもたらす複雑な一連の事象は,細胞シグナル伝達経路またはシグナル伝達経路として知られている。これらの経路は、成長、増殖、および死(アポトーシス)を含む多数の細胞プロセスを調整している。フラボノイドの生物学的効果は、その抗酸化活性に関係すると初めは仮定されていた。しかし培養細胞での実験によるエビデンスから、フラボノイドの生物学的効果の多くは、その細胞シグナル伝達経路を調整する能力に関係するということが示唆されている(7)。細胞シグナル伝達経路に影響するのに必要なフラボノイドの細胞内濃度は、細胞の抗酸化能力に影響するのに必要な濃度よりもかなり低い。フラボノイドの代謝物は、その抗酸化活性がなくなっても細胞シグナル伝達タンパク質と反応する性質を保持している可能性がある(15,16)。シグナル伝達が有効に行われるには、特定の部位で標的タンパク質のリン酸化を促すキナーゼというタンパク質が必要である。シグナル伝達タンパク質の特定のリン酸化や脱リン酸化の一連の反応は、DNAの特定の応答エレメントと結びつき様々な遺伝子の転写を促進あるいは抑制するタンパク質である転写因子の活性に最終的に影響する。多数の培養細胞での研究結果から、選択的にキナーゼを抑制することでフラボノイドが慢性疾患に影響を及ぼしている可能性があることが示唆されている(7,17)。細胞の成長や増殖も成長因子によって調整されており、成長因子は細胞膜の特定の受容体と結合することで細胞シグナル伝達反応を起こす。フラボノイドは受容体のリン酸化の抑制、または成長因子と受容体の結合を妨げることで、成長因子のシグナル伝達を変えるのかもしれない(18)。
フラボノイドが細胞シグナル伝達経路を調整することで、がん予防に役立つかもしれない。それには以下のような方法がある。
第二相解毒酵素の活性を刺激する(19,20):第二相解毒酵素は、有害な可能性のある化合物または発がん性のある化合物の排泄を促進する反応の触媒作用をする。
正常な細胞周期の調整を保持する(21,22):細胞は一度分裂すると、細胞周期として知られる一連の段階を経てから再び分裂する。DNA損傷の後、細胞周期は損傷チェックポイントにおいて一時的に停止し、DNA修復をしたり、損傷が修復不能な場合の細胞死(アポトーシス)に至る経路を活性化させたりする(23)。細胞周期の調整に不具合があると、がんの発症に寄与する突然変異が伝播してしまう可能性がある。
細胞増殖を抑制しアポトーシスへと導く(24-26):正常な細胞と違って、がん細胞は急速に増殖し、アポトーシスを起こす細胞死のシグナルに応答する能力を失う。
腫瘍浸潤および血管新生の抑制(27,28):がん細胞は、マトリックスメタロプロテアーゼと呼ばれる酵素の助けを借りて、正常な組織に浸潤していく。その急速な成長を促進するため、浸潤する腫瘍は血管新生として知られるプロセスによって新たな血管を作らねばならない。
炎症を減らす(29-31):炎症は炎症性酵素によるフリーラジカルの生成を局所的に増やしたり、細胞増殖や血管新生を促してアポトーシスを抑制する炎症メディエーター(仲介物質)の放出に至ったりする可能性がある(32)。
フラボノイドによって細胞シグナル伝達経路を調整することは、以下のように心臓血管疾患の予防に役立つ可能性がある。
炎症の減少(29-31):アテローム性動脈硬化症は、現在では炎症性疾患として認識されており、炎症に関するいくつかの測定値が心筋梗塞(心臓発作)のリスク増加と関連している(33)。
血管細胞接着分子の発現の低下(34,35):アテローム性動脈硬化症の発症における初期の事象の一つが、炎症性の白血球が血液から動脈壁に移動することである。この事象は、血管の内壁を形成する血管内皮細胞による接着分子の発現に依存している(36)。
内皮型一酸化窒素合成酵素(eNOS)活性の上昇(37):eNOSは、血管内皮細胞による一酸化窒素生成の触媒作用をする酵素である。一酸化窒素は、動脈弛緩(血管拡張)を維持するのに必要である。一酸化窒素による血管拡張が損なわれることは、心臓血管疾患のリスク上昇と関連がある(38)。
血小板凝集の減少(39,40):血小板凝集は冠状動脈や大脳動脈を詰まらせることもある血餅の形成における第一段階の一つであり、それぞれ心筋梗塞や脳卒中に至る。血小板凝集の抑制は、心臓血管疾患の一次予防および二次予防における重要な方策であると考えられている(41)。
疾病予防
心臓血管疾患
疫学的エビデンス
米国およびヨーロッパで行われたいくつかの前向きコホート研究で、食事からのフラボノイド摂取量の値と冠動脈心疾患(CHD)リスクの関係が調べられた(42-49)。フラボノイドの高摂取がCHDリスクの大きな減少と関連しているとする研究もあった(42-46,50)が、何の関係もないとする研究もあった(47-49,51)。一般にこれらの研究集団でフラボノイド全体の摂取の大部分を占める食品は、紅茶、りんご、およびタマネギであった。オランダのある研究では、ココアも食事由来のフラボノイドの重要な食品源であることがわかった。食事由来ラボノイドの摂取量と脳卒中リスクとの関係を調べた7つの前向きコホート研究のうち、2つだけがフラボノイドの高摂取は脳卒中リスクの有意な減少と関連があるとしている(45,52)が、その他の5つでは何の関係も見い出せなかった(46,49,50,53,54)。前向きコホート研究のデータは、フラボノイドの豊富な食品の高摂取がCHDから体を守るのに役立つかもしれないと示唆しているが、しかしながら、そのような保護性がフラボノイドによるのか、フラボノイドの豊富な食品に含まれるその他の栄養素や植物性化学物質によるものなのか、それとも食品全体によるものなのかは決定できていない(55)。
血管内皮機能
血管内皮細胞は、動脈弛緩(血管拡張)を促進する化合物である一酸化窒素を生成することによって、心臓血管の健康を維持するのに重要な役割を果たしている(56)。血管内皮の一酸化窒素生成による動脈の血管拡張は、内皮依存性血管拡張と呼ばれる。フラボノイドの豊富な食品および飲料が内皮依存性血管拡張に及ぼす効果を調べた臨床試験がいくつかある。2つの対照臨床試験では、4~5杯(900~1,250ml)の紅茶を4週間毎日摂取したところ、同量のカフェインのみ、または、お湯の場合と比べて、冠動脈疾患の患者(57)および血清コレステロール濃度がやや高い患者(58)の内皮依存性血管拡張が有意に改善した。その他の小規模臨床試験でも、約3杯(640ml)の紫ぶどうジュース(59)またはフラボノイドが多いビターの板チョコレート(60)を2週間毎日摂取したところ、同様の内皮依存性血管拡張の改善が見られた。もっと最近では、コレステロール濃度の高い32人の閉経後の女性にココアを6週間飲んでもらう介入試験で、ココアを毎日摂取することで内皮機能に有意な向上が見られた(61)。内皮機能の向上は、従来の投薬を受けている2型糖尿病患者がフラバノールの豊富なココアを30日間補給した後でも見られた(62)。フラバノールのエピカテキンが、フラバノールの豊富なココアに含まれる血管拡張効果の元になる化合物の一つであるようだ(63)。興味深いことに、44人の年配の成人による最近の無作為化対照試験では、フラボノイドの豊富なビターチョコレートを少量(6.3g/日を18週間。30カロリーに相当)与えたところ、フラボノイドの入っていないホワイトチョコレートに比べて、一酸化窒素生成の指標である血漿Sニトロソグルタチオン濃度が高くなった(64)。
内皮の一酸化窒素生成は、血餅形成の第一段階の一つである血小板の接着や凝集も抑制する(56)。フラボノイドの高摂取が、体外(ex vivo)での血小板凝集を示す様々な測定値を減少させる可能性については、多数の臨床試験で調べられており、そのような試験ではまちまちの結果が報告されている。一般に、果物および/または野菜の摂取を増やしてフラボノイドの摂取を増やしても、体外での血小板凝集に大きな影響はない(41,65,66)し、紅茶の摂取を増やしても同様である(67,68)。しかしながら、健康な成人によるいくつかの小規模臨床試験では、ぶどうジュース(約500ml/日)を7~14日間摂取後に、血小板凝集の体外での測定値が有意に減少した(69-71)。同様の血小板凝集の抑制が急激または短期間のビターチョコレートの摂取後(72)やフラボノイドの豊富なココア飲料の急激な摂取後(73,74)に報告されている。加えて、32人の健康な成人によるプラセボ対照試験では、ココアからのフラバノールおよびプロシアニジンの4週間にわたる摂取によって、血小板の凝集と機能が抑制されたことがわかった(75)。いくつかの対照臨床試験の結果で、紅茶、紫ぶどうジュース、およびココアを含むフラボノイドの豊富な食品や飲料の比較的高い摂取が、血管内皮機能を向上させる可能性があることが示唆された。しかし、これらの短期間での向上が、心臓血管疾患リスクの長期にわたる減少に至るのか不明である。
がん
肺がん(76)、口腔がん(77)、食道がん(78)、胃がん(79)、結腸がん(80)、皮膚がん(81)、前立腺がん(82,83)、および乳がん(84)の動物モデルで、化学的に誘発されたがんの発症を様々なフラボノイドが抑制することが知られているが、疫学的研究では食事由来のフラボノイドの高摂取がヒトのがんリスクの大幅な減少と関連しているという説得力のあるエビデンスは示されていない。食品の摂取頻度を質問して食事由来のフラボノイドの摂取量を評価するほとんどの前向きコホート研究では、フラボノイドの摂取ががんリスクと逆相関があるとはわかっていない(85)。ヨーロッパでの2つの前向きコホート研究では、フラボン類およびフラボノール類(86,87)、カテキン類(88)、または茶(89)の食事からの摂取と様々ながんのリスクには何の関係もなかった。米国の閉経後の女性群では、果物や野菜からではなく茶からのカテキンの摂取が直腸がんのリスクと逆相関があったが、その他のがんでは関係がなかった(90)。平均的なフラボノイド摂取が比較的低いフィンランドでの2つの前向きコホート研究で、フラボノール類とフラボン類の食事からの摂取が最も多い男性は、摂取が最も少ない男性よりも肺がん発症のリスクが有意に低いことがわかった(44,45)。個々の食事由来フラボノイドについて分析をすると、主にりんごからの食事由来ケルセチンの摂取が肺がんリスクと逆相関があり、ミリセチンの摂取が前立腺がんのリスクと逆相関があった(45)。ある集団では茶はフラボノイド(フラバノール類およびフラボノール類)の重要な摂取源であるが、ほとんどの前向きコホート研究では茶の摂取ががんのリスクと逆相関があるという結果は見つかっていない((91)の文献で概説)。症例対照研究の結果は、食べたものを思い出す際の偏りにより影響を受けやすいが、この結果もまちまちであった。いくつかの研究では、肺がん(92)、胃がん(93,94)、および乳がん(95)と診断された人々にフラボノイド摂取が少なかったが、その他の多くの研究では、がんの患者と対照群の間にフラボノイド摂取の大きな差は見られなかった(96,97)。食品からのフラボノイドの摂取が少ないと特定のがんリスクが上昇するというエビデンスは限定されているが、それがフラボノイド摂取不足に関係するのか、それともフラボノイドの豊富な食品に含まれるその他の栄養素や植物性化学物質に関係するのかは不明である。フラボノイドの豊富な食品とがんとの関係の詳細については、「果物と野菜」、および「茶飲料」の項の記事を参照されたい。特定のフラボノイドががんの予防や治療に有益であるかを決定する臨床試験が必要であるが、いくつかの臨床試験が進行中である。(詳細はhttp://www.cancer.gov/about-cancer/treatment/clinical-trialsを参照のこと)
神経変性疾患
炎症、酸化ストレス、および遷移金属の蓄積が、パーキンソン病およびアルツハイマー病を含むいくつかの神経変性疾患の病理に関わっているようである(98)。フラボノイドは抗炎症特性、抗酸化特性、および金属キレート化特性があるので、フラボノイドの豊富な食事または個々のフラボノイドが神経を保護する可能性に興味が持たれる。現在のところ、様々な食事に由来するフラボノイドやフラボノイド代謝物のどれがヒトの血液脳関門を超えることができるのかといったところまではわかっていない(99,100)。フラボノイドの豊富な食事やフラボノイドの投与が、いくつかの動物を用いた研究で、老化および炎症に伴う認知障害を予防することはわかっている(101-104)が、前向きコホート研究では、フラボノイドの摂取とヒトの認知症または神経変性疾患のリスクとの間に一貫した逆相関は見出されていない(105-109)。日系アメリカ人男性の集団を25~30年間追跡した結果では、中年の頃に茶からフラボノイド摂取をしても、晩年のアルツハイマー病やその他の認知症リスクとの相関はなかった(105)。驚いたことに、中年の頃にイソフラボンの豊富な豆腐の摂取が多いと、晩年の認知障害や脳萎縮と関連があった(「大豆イソフラボン」の項の記事参照)(106)。オランダの成人による前向き研究では、毎日のフラボノイド摂取が12mg増えるごとにアルツハイマー病のリスクが50%低下した現在喫煙中の者以外は、食事由来の全フラボノイド摂取量はパーキンソン病の発症リスク(107)またはアルツハイマー病の発症リスク(108)と関連がなかった。対照的に、年配のフランス人男性および女性の研究では、フラボノイド摂取が最も少ない者はその後の5年間に認知症を発症するリスクが、最も高摂取な者に比べて50%高いことがわかった(109)。より最近では1,640人の年配の男女の研究で、食事由来フラボノイドの摂取が多い(13.6mg/日より多い)者は、フラボノイド摂取の少ない(0~10.4mg/日)者に比べて、研究開始時の認知行動能力がより高く、10年間にわたって加齢に関連する認知機能低下が有意に少なかった(110)。加えて、202人の閉経後の女性を対象にした無作為化二重盲検プラセボ対照臨床試験では、25.6gの大豆タンパク質(イソフラボンを99mg含有)を1年間毎日補給しても、認知機能の向上は見られなかったと報告された(111)。しかし、77人の閉経後の女性による無作為化二重盲検プラセボ対照交差試験では、60mg/日のイソフラボンを6ヶ月にわたって補給したところ、認知行動能力の測定値がいくつか向上した(112)。加齢化する脳を保護するかもしれないフラボノイドに関心が持たれているが、フラボノイドの摂取がヒトの神経変性疾患リスクにどのように影響するのか不明である。
摂取源
食品源
フラボノイドの食事からの摂取源には、茶、赤ワイン、果物、野菜、および豆類がある。個々のフラボノイドの摂取は、茶、赤ワイン、大豆製品、または果物や野菜が一般的に摂取されているかどうかでかなり異なる可能性がある((3)の文献で概説)。個々のフラボノイドの摂取は異なっても、西洋諸国でのフラボノイド全体の摂取は平均で約150~200mg/日のようである(3,113)。いくつかのフラボノイドが豊富な食品のフラボノイド含有量を表2と3に示す。農業のやり方、環境要因、熟成、処理方法、貯蔵、および調理などの様々な要因が食品のフラボノイド含有量に影響する可能性があるので、これらの値は近似値とみなされるべきである。食品のフラボノイド含有量についての詳細は、特定の食品についてのフラボノイドおよびプロアントシアニジン含有量に関するUSDAのデータベースを参照されたい。大豆食品のイソフラボン含有量に関しては、「大豆イソフラボン」の項の記事を参照するか、特定の食品についてのイソフラボン含有量に関するUSDAのデータベースを参照されたい。
| アントシアニンが豊富な食品 | アントシアニン類 | フラバノール類 | プロアントシアニジン類 |
|---|---|---|---|
| ブラックベリー | 89-211 | 13-19 | 6-47 |
| ブルーベリー | 67-183 | 1 | 88-261 |
| 赤ぶどう | 25-92 | 2 | 44-76 |
| 赤ラズベリー | 10-84 | 9 | 5-59 |
| いちご | 15-75 | - | 97-183 |
| 赤ワイン | 1-35 | 1-55 | 24-70 |
| セイヨウスモモ | 2-25 | 1-6 | 106-334 |
| 紫(赤)キャベツ | 25 | 0 | - |
| 紫タマネギ | 13- 25 | - | - |
| 果肉の赤いオレンジのジュース | 3-10 | - | - |
| フラバノールの豊富な食品 | アントシアニン類 | フラバノール類 | プロアントシアニジン類 |
| 緑茶 | - | 24-216 | - |
| 紅茶 | - | 5-158 | 4 |
| ビターチョコレート | - | 43-63 | 90-322 |
| 皮付きレッドデリシャスりんご | 1-4 | 2-12 | 89-148 |
| アンズ | - | 10-25 | 8-13 |
| フラボンの豊富な食品 | アントシアニン類 | フラバノール類 | プロアントシアニジン類 |
| 生のパセリ | - | - | - |
| 生のタイム | - | - | - |
| 緑色のセロリの芯 | - | - | - |
| セロリ | - | - | - |
| 生のオレガノ | - | - | - |
| 緑色の唐辛子 | - | - | - |
| フラバノンの豊富な食品 | アントシアニン類 | フラバノール類 | プロアントシアニジン類 |
| 生のレモンジュース | - | - | - |
| 生のグレープフルーツジュース | - | - | - |
| 生のオレンジジュース | - | - | - |
| 生のグレープフルーツ | - | - | - |
| 生のオレンジ | - | - | - |
| フラボノールの豊富な食品 | アントシアニン類 | フラバノール類 | プロアントシアニジン類 |
| 黄タマネギ | - | 0 | - |
| ケール | - | - | - |
| ネギ | - | 0 | - |
| ブロッコリ | - | 0 | - |
| *生の食品の重さ100gまたは液体100mlについての含有量。100gは約3.5オンス、100mlは約3.5液量オンス。 | |||
| アントシアニンの豊富な食品 | フラボン類 | フラボノール類 | フラバノン類 |
|---|---|---|---|
| ブラックベリー | - | 0-2 | - |
| ブルーベリー | - | 2-16 | - |
| 赤ぶどう | - | 3-4 | - |
| 赤ラズベリー | - | 1 | - |
| いちご | - | 1-4 | - |
| 赤ワイン | 0 | 2-30 | - |
| セイヨウスモモ | 0 | 1-2 | - |
| 紫(赤)キャベツ | 0-1 | 0-1 | - |
| 紫タマネギ | 0 | 4-100 | - |
| 果肉の赤いオレンジのジュース | - | - | 10-22 |
| フラバノールの豊富な食品 | フラボン類 | フラボノール類 | フラバノン類 |
| 緑茶 | 0-1 | 3-9 | - |
| 紅茶 | 0 | 1-7 | - |
| ビターチョコレート | - | - | - |
| 皮付きレッドデリシャスりんご | 0 | 2-6 | - |
| アンズ | 0 | 2-5 | - |
| フラボンの豊富な食品 | フラボン類 | フラボノール類 | フラバノン類 |
| 生のパセリ | 24-634 | 8-10 | - |
| 生のタイム | 56 | 0 | - |
| 緑色のセロリの芯 | 23 | - | - |
| セロリ | 0-15 | 4 | - |
| 生のオレガノ | 2-7 | 0 | - |
| 緑色の唐辛子 | 5 | 13-21 | - |
| フラバノンの豊富な食品 | フラボン類 | フラボノール類 | フラバノン類 |
| 生のレモンジュース | 0 | 0-2 | 2-175 |
| 生のグレープフルーツジュース | 0 | 0 | 10-104 |
| 生のオレンジジュース | 0-1 | 0 | 5-47 |
| 生のグレープフルーツ | - | 1 | 55 |
| 生のオレンジ | - | - | 42-53 |
| フラボノールの豊富な食品 | フラボン類 | フラボノール類 | フラバノン類 |
| 黄タマネギ | 0 | 3-120 | - |
| ケール | 0 | 30-60 | - |
| ネギ | 0 | 3-22 | - |
| ブロッコリ | 0 | 4-13 | - |
| *生の食品の重さ100gまたは液体100mlについての含有量。100gは約3.5オンス、100mlは約3.5液量オンス。 | |||
サプリメント
アントシアニン類
アントシアニンの豊富なビルベリー、エルダーベリー、黒すぐり、ブルーベリー、赤ぶどう、およびベリー類の抽出物は、米国では処方箋なしで栄養補助食品として入手可能である。これらの製品のアントシアニンの含有量は、かなり異なる可能性がある。用量ごとのアントシアニンの量のリストを示した規格化された抽出物が入手可能である。
フラバノール類
米国では多数の茶抽出物が栄養補助食品として入手可能で、茶カテキンまたは茶ポリフェノールというラベルが付いていることもある。緑茶の抽出物は最も一般的に市販されているが、紅茶やウーロン茶の抽出物も入手可能である。緑茶抽出物は一般的にカテキン(フラバノール単量体)の量が多く、紅茶抽出物はテアフラビンやテアルビジン(茶に含まれるフラバノール重合体)が豊富である。ウーロン茶の抽出物は、フラバノール含有量では緑茶と紅茶の抽出物の中間にあたる。茶の抽出物にはカフェインを含むものも、カフェイン抜きのものもある。フラバノールとカフェインの含有量は製品によってかなり異なるので、各サプリメントを毎日摂取することによるフラバノールやカフェインの量を決めるには、ラベルをチェックするか、メーカーに問い合わせることが大切である。茶のフラバノールについての詳細は、「茶飲料」の項の記事を参照されたい。
フラバノン類
柑橘類のバイオフラボノイドサプリメントは、ヘスペレチンのグリコシド(ヘスペリジン)、ナリンゲニンのグリコシド(ナリンジン)、およびエリオジクチオールのグリコシド(エリオシトリン)を含む可能性がある。ヘスペリジンはヘスペリジン複合体サプリメントとしても入手可能である(114)。
フラボン類
柑橘類の皮は、タンゲレチン、ノビレチン、およびシネンセチンといったポリメトキシフラボンが豊富である(3)。これらの天然起源フラボン類の食事からの摂取は一般に低いものの、柑橘類のバイオフラボノイドサプリメントにはしばしば含まれている。
フラボノール類
フラボノールアグリコンであるケルセチンおよびそのグリコシドであるルチンは、米国では処方箋なしで栄養補助食品として入手可能である。ルチンにはルチノシド、ケルセチン-3-ルチノシド、およびソフォリンなどという名称もある(114)。柑橘類のバイオフラボノイドサプリメントもケルセチンやルチンを含んでいる可能性がある。
安全性
悪影響
植物性食品に由来するフラボノイド類の高摂取に関連する悪影響はない。悪影響がないことは、ほとんどのフラボノイドの生物学的利用能が比較的低いことと、急速に代謝および除去されることで説明ができるかもしれない。
ケルセチン
ケルセチンのサプリメント(1,000mg/日を1ヶ月)を摂取した何人かの男性が、吐き気、頭痛、または四肢の刺痛を報告した(115)。第一相臨床試験でケルセチンを静脈投与された何名かのがん患者が、吐き気、嘔吐、発汗、のぼせ、および呼吸困難を報告した(116)。その試験では、945mg/m2、あるいはそれ以上の用量のケルセチンの静脈投与は腎毒性に関連があった。
茶抽出物
茶(学名Camellia sinensis)抽出物のサプリメントを摂取した後の肝毒性の報告がいくつかある(117,118)。カフェイン入りの緑茶抽出物の臨床試験で、6g/日を3~6回に分けて摂取したがん患者は、吐き気、嘔吐、腹痛、および下痢を含む軽度から中度の胃腸の副作用を報告した(119,120)。激越(興奮)、不穏状態、不眠、震え、めまい、および錯乱を含む中枢神経系の症状も報告されている。あるケースでは、入院を必要とするくらい錯乱が重篤であった(119)。これらの副作用は、緑茶抽出物に含まれるカフェインに関連しているようである(120)。健康な個人でカフェイン抜きの緑茶抽出物(800mg/日のEGCG)の安全性を評価する4週間の臨床試験で、参加者の何人かが軽度の吐き気、胃のむかつき、めまい、または筋肉痛を訴えた(121)。
妊娠期および授乳期
妊娠期および授乳期におけるフラボノイドサプリメント摂取の安全性は確立されていない(114)。
薬物相互作用
グレープフルーツジュースとフラボノイドによるCYP3A4の阻害
たった200ml(7液量オンス)のグレープフルーツジュースでも、腸の薬物代謝酵素であるシトクロムP450(CYP)3A4を不可逆的に阻害することがわかっている(122)。グレープフルーツの最も強力なCYP3A4阻害物質はフラノクマリン類、特にジヒドロキシベルガモチンであると考えられるが、フラボノイドのナリンゲニンとケルセチンも、試験管内でCYP3A4を阻害することがわかっている。腸のCYP3A4を阻害すると、HMG-CoA還元酵素阻害薬(アトルバスタチン、ロバスタチン、およびシンバスタチン)、カルシウムチャネル拮抗薬(フェロジピン、ニカルジピン、ニソルジピン、ニトレンジピン、およびベラパミル)、抗不整脈薬(アミオダロン)、HIVプロテアーゼ阻害薬(サキナビル)、免疫抑制剤(シクロスポリン)、抗ヒスタミン薬(テルフェナジン)、胃腸刺激薬(シサプリド)、ベンゾジアゼピン(ジアゼパム、ミダゾラム、およびトリアゾラム)、抗けいれん薬(カルバマゼピン)、抗不安薬(ブスピロン)、選択的セロトニン再取込阻害薬(セルトラリン)、および勃起不全治療薬(シルデナフィル)などの多くの薬物の生物学的利用能および毒性のリスクを上げる可能性がある(123)。グレープフルーツジュースは、アンジオテンシンII受容体拮抗薬であるロサルタンの治療効果を下げる可能性がある。薬物相互作用の悪影響の可能性があるので、臨床医の中にはCYP3A4による広範な前全身的代謝を受ける薬を服用している患者は、潜在的毒性を避けるためにグレープフルーツジュースをまったく飲まないようにアドバイスする者もいる(122)。
グレープフルーツジュースとフラボノイドによるP糖タンパク質の阻害
P糖タンパク質は、多数の薬物の吸収を減らす排出輸送体である。グレープフルーツジュースの摂取がP糖タンパク質の活性を抑制するというエビデンスがある(122)。ケルセチン、ナリンゲニン、および緑茶フラバノールであるエピガロカテキンガレート(EGCG)は、培養細胞でP糖タンパク質の排出活性を抑制することがわかっている(124)。したがって、これらのフラボノイドを非常に多く摂取したり補給したりするとフラボノイドの生物学的利用性が上昇し、P糖タンパク質の基質である薬物の毒性を高める可能性がある。P糖タンパク質の基質であることがわかっている薬物は、ジゴキシン、抗高血圧症薬、抗不整脈薬、化学療法薬(抗がん剤)、抗真菌薬、HIVプロテアーゼ阻害薬、免疫抑制剤、H2受容体拮抗薬、およびいくつかの抗生物質や、その他などである((125)の文献で概説)。
抗凝固薬および血小板凝集阻害薬
紫ぶどうジュース(500ml/日)やビターチョコレート(235mg/日のフラバノール類)からフラボノイドを高摂取すると、体外での試験では血小板凝集を阻害することがわかっている(69-71,75)。理論的には、ワルファリン(クマジン)などの抗凝固薬、クロピドグレル(プラビックス)、ジピリダモール(ペルサンチン)などの血小板凝集阻害薬、非ステロイド系抗炎症薬(NSAID)、およびアスピリンなどと一緒に摂取すると、(サプリメントなどからの)フラボノイドの高摂取が出血のリスクを高める可能性がある。
他の栄養素との相互作用
非ヘム鉄
フラボノイドは、非ヘム鉄と結びついて腸での鉄の吸収を阻害することがある。非ヘム鉄は、植物性食品、乳製品、および鉄のサプリメントに含まれる鉄の主要な形態である。食事と一緒に1杯の紅茶やココアを摂取すると、食事に含まれる非ヘム鉄の吸収を約70%減らすことがわかっている(126,127)。食事や鉄サプリメントからの鉄の吸収を最大化するには、フラボノイドの豊富な飲料やフラボノイドのサプリメントを同時に摂取するべきではない。
ビタミンC
培養細胞での研究で、多くのフラボノイドが細胞へのビタミンCの輸送を阻害することが示され、ケルセチンとビタミンCを補給したラットは腸でのビタミンCの吸収が減った(128)。これらの発見のヒトにおける重要性を決定するさらなる研究が必要である。
Authors and Reviewers
Originally written in 2005 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in June 2008 by:
Victoria J. Drake, Ph.D.
Linus Pauling Institute
Oregon State University
Reviewed in June 2008 by:
Roderick H. Dashwood, Ph.D.
Director, Cancer Chemoprotection Program, Linus Pauling Institute
Professor of Environmental & Molecular Toxicology
Leader, Environmental Mutagenesis & Carcinogenesis Core, Environmental Health Sciences Center
Oregon State University
Copyright 2005-2024 Linus Pauling Institute
References
1. Beecher GR. Overview of dietary flavonoids: nomenclature, occurrence and intake. J Nutr. 2003;133(10):3248S-3254S. (PubMed)
2. Williamson G. Common features in the pathways of absorption and metabolism of flavonoids. In: Meskin MS, R. BW, Davies AJ, Lewis DS, Randolph RK, eds. Phytochemicals: Mechanisms of Action. Boca Raton: CRC Press; 2004:21-33.
3. Manach C, Scalbert A, Morand C, Remesy C, Jimenez L. Polyphenols: food sources and bioavailability. Am J Clin Nutr. 2004;79(5):727-747. (PubMed)
4. Setchell KD, Brown NM, Lydeking-Olsen E. The clinical importance of the metabolite equol-a clue to the effectiveness of soy and its isoflavones. J Nutr. 2002;132(12):3577-3584. (PubMed)
5. Yuan JP, Wang JH, Liu X. Metabolism of dietary soy isoflavones to equol by human intestinal microflora--implications for health. Mol Nutr Food Res. 2007;51(7):765-781. (PubMed)
6. Manach C, Williamson G, Morand C, Scalbert A, Remesy C. Bioavailability and bioefficacy of polyphenols in humans. I. Review of 97 bioavailability studies. Am J Clin Nutr. 2005;81(1 Suppl):230S-242S. (PubMed)
7. Williams RJ, Spencer JP, Rice-Evans C. Flavonoids: antioxidants or signalling molecules? Free Radic Biol Med. 2004;36(7):838-849. (PubMed)
8. Kroon PA, Clifford MN, Crozier A, et al. How should we assess the effects of exposure to dietary polyphenols in vitro? Am J Clin Nutr. 2004;80(1):15-21. (PubMed)
9. Heijnen CG, Haenen GR, van Acker FA, van der Vijgh WJ, Bast A. Flavonoids as peroxynitrite scavengers: the role of the hydroxyl groups. Toxicol In Vitro. 2001;15(1):3-6. (PubMed)
10. Chun OK, Kim DO, Lee CY. Superoxide radical scavenging activity of the major polyphenols in fresh plums. J Agric Food Chem. 2003;51(27):8067-8072. (PubMed)
11. Frei B, Higdon JV. Antioxidant activity of tea polyphenols in vivo: evidence from animal studies. J Nutr. 2003;133(10):3275S-3284S. (PubMed)
12. Lotito SB, Frei B. Consumption of flavonoid-rich foods and increased plasma antioxidant capacity in humans: cause, consequence, or epiphenomenon? Free Radic Biol Med. 2006;41(12):1727-1746. (PubMed)
13. Mira L, Fernandez MT, Santos M, Rocha R, Florencio MH, Jennings KR. Interactions of flavonoids with iron and copper ions: a mechanism for their antioxidant activity. Free Radic Res. 2002;36(11):1199-1208. (PubMed)
14. Cheng IF, Breen K. On the ability of four flavonoids, baicilein, luteolin, naringenin, and quercetin, to suppress the Fenton reaction of the iron-ATP complex. Biometals. 2000;13(1):77-83. (PubMed)
15. Spencer JP, Rice-Evans C, Williams RJ. Modulation of pro-survival Akt/protein kinase B and ERK1/2 signaling cascades by quercetin and its in vivo metabolites underlie their action on neuronal viability. J Biol Chem. 2003;278(37):34783-34793. (PubMed)
16. Spencer JP, Schroeter H, Crossthwaithe AJ, Kuhnle G, Williams RJ, Rice-Evans C. Contrasting influences of glucuronidation and O-methylation of epicatechin on hydrogen peroxide-induced cell death in neurons and fibroblasts. Free Radic Biol Med. 2001;31(9):1139-1146. (PubMed)
17. Hou Z, Lambert JD, Chin KV, Yang CS. Effects of tea polyphenols on signal transduction pathways related to cancer chemoprevention. Mutat Res. 2004;555(1-2):3-19. (PubMed)
18. Lambert JD, Yang CS. Mechanisms of cancer prevention by tea constituents. J Nutr. 2003;133(10):3262S-3267S. (PubMed)
19. Kong AN, Owuor E, Yu R, et al. Induction of xenobiotic enzymes by the MAP kinase pathway and the antioxidant or electrophile response element (ARE/EpRE). Drug Metab Rev. 2001;33(3-4):255-271. (PubMed)
20. Walle UK, Walle T. Induction of human UDP-glucuronosyltransferase UGT1A1 by flavonoids-structural requirements. Drug Metab Dispos. 2002;30(5):564-569. (PubMed)
21. Chen JJ, Ye ZQ, Koo MW. Growth inhibition and cell cycle arrest effects of epigallocatechin gallate in the NBT-II bladder tumour cell line. BJU Int. 2004;93(7):1082-1086. (PubMed)
22. Wang W, VanAlstyne PC, Irons KA, Chen S, Stewart JW, Birt DF. Individual and interactive effects of apigenin analogs on G2/M cell-cycle arrest in human colon carcinoma cell lines. Nutr Cancer. 2004;48(1):106-114. (PubMed)
23. Stewart ZA, Westfall MD, Pietenpol JA. Cell-cycle dysregulation and anticancer therapy. Trends Pharmacol Sci. 2003;24(3):139-145. (PubMed)
24. Sah JF, Balasubramanian S, Eckert RL, Rorke EA. Epigallocatechin-3-gallate inhibits epidermal growth factor receptor signaling pathway. Evidence for direct inhibition of ERK1/2 and AKT kinases. J Biol Chem. 2004;279(13):12755-12762. (PubMed)
25. Kavanagh KT, Hafer LJ, Kim DW, et al. Green tea extracts decrease carcinogen-induced mammary tumor burden in rats and rate of breast cancer cell proliferation in culture. J Cell Biochem. 2001;82(3):387-398. (PubMed)
26. Ramos S. Effects of dietary flavonoids on apoptotic pathways related to cancer chemoprevention. J Nutr Biochem. 2007;18(7):427-442. (PubMed)
27. Bagli E, Stefaniotou M, Morbidelli L, et al. Luteolin inhibits vascular endothelial growth factor-induced angiogenesis; inhibition of endothelial cell survival and proliferation by targeting phosphatidylinositol 3'-kinase activity. Cancer Res. 2004;64(21):7936-7946. (PubMed)
28. Kim MH. Flavonoids inhibit VEGF/bFGF-induced angiogenesis in vitro by inhibiting the matrix-degrading proteases. J Cell Biochem. 2003;89(3):529-538. (PubMed)
29. O'Leary KA, de Pascual-Tereasa S, Needs PW, Bao YP, O'Brien NM, Williamson G. Effect of flavonoids and vitamin E on cyclooxygenase-2 (COX-2) transcription. Mutat Res. 2004;551(1-2):245-254. (PubMed)
30. Sakata K, Hirose Y, Qiao Z, Tanaka T, Mori H. Inhibition of inducible isoforms of cyclooxygenase and nitric oxide synthase by flavonoid hesperidin in mouse macrophage cell line. Cancer Lett. 2003;199(2):139-145. (PubMed)
31. Cho SY, Park SJ, Kwon MJ, et al. Quercetin suppresses proinflammatory cytokines production through MAP kinases andNF-kappaB pathway in lipopolysaccharide-stimulated macrophage. Mol Cell Biochem. 2003;243(1-2):153-160. (PubMed)
32. Steele VE, Hawk ET, Viner JL, Lubet RA. Mechanisms and applications of non-steroidal anti-inflammatory drugs in the chemoprevention of cancer. Mutat Res. 2003;523-524:137-144. (PubMed)
33. Blake GJ, Ridker PM. C-reactive protein and other inflammatory risk markers in acute coronary syndromes. J Am Coll Cardiol. 2003;41(4 Suppl S):37S-42S. (PubMed)
34. Choi JS, Choi YJ, Park SH, Kang JS, Kang YH. Flavones mitigate tumor necrosis factor-alpha-induced adhesion molecule upregulation in cultured human endothelial cells: role of nuclear factor-kappa B. J Nutr. 2004;134(5):1013-1019. (PubMed)
35. Ludwig A, Lorenz M, Grimbo N, et al. The tea flavonoid epigallocatechin-3-gallate reduces cytokine-induced VCAM-1 expression and monocyte adhesion to endothelial cells. Biochem Biophys Res Commun. 2004;316(3):659-665. (PubMed)
36. Stocker R, Keaney JF, Jr. Role of oxidative modifications in atherosclerosis. Physiol Rev. 2004;84(4):1381-1478. (PubMed)
37. Anter E, Thomas SR, Schulz E, Shapira OM, Vita JA, Keaney JF, Jr. Activation of endothelial nitric-oxide synthase by the p38 MAPK in response to black tea polyphenols. J Biol Chem. 2004;279(45):46637-46643. (PubMed)
38. Duffy SJ, Vita JA. Effects of phenolics on vascular endothelial function. Curr Opin Lipidol. 2003;14(1):21-27. (PubMed)
39. Deana R, Turetta L, Donella-Deana A, et al. Green tea epigallocatechin-3-gallate inhibits platelet signalling pathways triggered by both proteolytic and non-proteolytic agonists. Thromb Haemost. 2003;89(5):866-874. (PubMed)
40. Bucki R, Pastore JJ, Giraud F, Sulpice JC, Janmey PA. Flavonoid inhibition of platelet procoagulant activity and phosphoinositide synthesis. J Thromb Haemost. 2003;1(8):1820-1828. (PubMed)
41. Hubbard GP, Wolffram S, Lovegrove JA, Gibbins JM. The role of polyphenolic compounds in the diet as inhibitors of platelet function. Proc Nutr Soc. 2003;62(2):469-478. (PubMed)
42. Geleijnse JM, Launer LJ, Van der Kuip DA, Hofman A, Witteman JC. Inverse association of tea and flavonoid intakes with incident myocardial infarction: the Rotterdam Study. Am J Clin Nutr. 2002;75(5):880-886. (PubMed)
43. Hertog MG, Feskens EJ, Kromhout D. Antioxidant flavonols and coronary heart disease risk. Lancet. 1997;349(9053):699. (PubMed)
44. Hirvonen T, Pietinen P, Virtanen M, et al. Intake of flavonols and flavones and risk of coronary heart disease in male smokers. Epidemiology. 2001;12(1):62-67. (PubMed)
45. Knekt P, Kumpulainen J, Jarvinen R, et al. Flavonoid intake and risk of chronic diseases. Am J Clin Nutr. 2002;76(3):560-568. (PubMed)
46. Yochum L, Kushi LH, Meyer K, Folsom AR. Dietary flavonoid intake and risk of cardiovascular disease in postmenopausal women. Am J Epidemiol. 1999;149(10):943-949. (PubMed)
47. Hertog MG, Sweetnam PM, Fehily AM, Elwood PC, Kromhout D. Antioxidant flavonols and ischemic heart disease in a Welsh population of men: the Caerphilly Study. Am J Clin Nutr. 1997;65(5):1489-1494. (PubMed)
48. Rimm EB, Katan MB, Ascherio A, Stampfer MJ, Willett WC. Relation between intake of flavonoids and risk for coronary heart disease in male health professionals. Ann Intern Med. 1996;125(5):384-389. (PubMed)
49. Sesso HD, Gaziano JM, Liu S, Buring JE. Flavonoid intake and the risk of cardiovascular disease in women. Am J Clin Nutr. 2003;77(6):1400-1408. (PubMed)
50. Mink PJ, Scrafford CG, Barraj LM, et al. Flavonoid intake and cardiovascular disease mortality: a prospective study in postmenopausal women. Am J Clin Nutr. 2007;85(3):895-909. (PubMed)
51. Lin J, Rexrode KM, Hu F, et al. Dietary intakes of flavonols and flavones and coronary heart disease in US women. Am J Epidemiol. 2007;165(11):1305-1313. (PubMed)
52. Keli SO, Hertog MG, Feskens EJ, Kromhout D. Dietary flavonoids, antioxidant vitamins, and incidence of stroke: the Zutphen study. Arch Intern Med. 1996;156(6):637-642. (PubMed)
53. Hirvonen T, Virtamo J, Korhonen P, Albanes D, Pietinen P. Intake of flavonoids, carotenoids, vitamins C and E, and risk of stroke in male smokers. Stroke. 2000;31(10):2301-2306. (PubMed)
54. Knekt P, Isotupa S, Rissanen H, et al. Quercetin intake and the incidence of cerebrovascular disease. Eur J Clin Nutr. 2000;54(5):415-417. (PubMed)
55. Liu RH. Health benefits of fruit and vegetables are from additive and synergistic combinations of phytochemicals. Am J Clin Nutr. 2003;78(3 Suppl):517S-520S. (PubMed)
56. Vita JA. Tea consumption and cardiovascular disease: effects on endothelial function. J Nutr. 2003;133(10):3293S-3297S. (PubMed)
57. Duffy SJ, Keaney JF, Jr., Holbrook M, et al. Short- and long-term black tea consumption reverses endothelial dysfunction in patients with coronary artery disease. Circulation. 2001;104(2):151-156. (PubMed)
58. Hodgson JM, Puddey IB, Burke V, Watts GF, Beilin LJ. Regular ingestion of black tea improves brachial artery vasodilator function. Clin Sci (Lond). 2002;102(2):195-201. (PubMed)
59. Stein JH, Keevil JG, Wiebe DA, Aeschlimann S, Folts JD. Purple grape juice improves endothelial function and reduces the susceptibility of LDL cholesterol to oxidation in patients with coronary artery disease. Circulation. 1999;100(10):1050-1055. (PubMed)
60. Engler MB, Engler MM, Chen CY, et al. Flavonoid-rich dark chocolate improves endothelial function and increases plasma epicatechin concentrations in healthy adults. J Am Coll Nutr. 2004;23(3):197-204. (PubMed)
61. Wang-Polagruto JF, Villablanca AC, Polagruto JA, et al. Chronic consumption of flavanol-rich cocoa improves endothelial function and decreases vascular cell adhesion molecule in hypercholesterolemic postmenopausal women. J Cardiovasc Pharmacol. 2006;47 Suppl 2:S177-186; discussion S206-179. (PubMed)
62. Balzer J, Rassaf T, Heiss C, et al. Sustained benefits in vascular function through flavanol-containing cocoa in medicated diabetic patients a double-masked, randomized, controlled trial. J Am Coll Cardiol. 2008;51(22):2141-2149. (PubMed)
63. Schroeter H, Heiss C, Balzer J, et al. (-)-Epicatechin mediates beneficial effects of flavanol-rich cocoa on vascular function in humans. Proc Natl Acad Sci U S A. 2006;103(4):1024-1029. (PubMed)
64. Taubert D, Roesen R, Lehmann C, Jung N, Schomig E. Effects of low habitual cocoa intake on blood pressure and bioactive nitric oxide: a randomized controlled trial. JAMA. 2007;298(1):49-60. (PubMed)
65. Freese R, Vaarala O, Turpeinen AM, Mutanen M. No difference in platelet activation or inflammation markers after diets rich or poor in vegetables, berries and apple in healthy subjects. Eur J Nutr. 2004;43(3):175-182. (PubMed)
66. Janssen K, Mensink RP, Cox FJ, et al. Effects of the flavonoids quercetin and apigenin on hemostasis in healthy volunteers: results from an in vitro and a dietary supplement study. Am J Clin Nutr. 1998;67(2):255-262. (PubMed)
67. Duffy SJ, Vita JA, Holbrook M, Swerdloff PL, Keaney JF, Jr. Effect of acute and chronic tea consumption on platelet aggregation in patients with coronary artery disease. Arterioscler Thromb Vasc Biol. 2001;21(6):1084-1089. (PubMed)
68. Hodgson JM, Puddey IB, Burke V, Beilin LJ, Mori TA, Chan SY. Acute effects of ingestion of black tea on postprandial platelet aggregation in human subjects. Br J Nutr. 2002;87(2):141-145. (PubMed)
69. Freedman JE, Parker C, 3rd, Li L, et al. Select flavonoids and whole juice from purple grapes inhibit platelet function and enhance nitric oxide release. Circulation. 2001;103(23):2792-2798. (PubMed)
70. Keevil JG, Osman HE, Reed JD, Folts JD. Grape juice, but not orange juice or grapefruit juice, inhibits human platelet aggregation. J Nutr. 2000;130(1):53-56. (PubMed)
71. Polagruto JA, Schramm DD, Wang-Polagruto JF, Lee L, Keen CL. Effects of flavonoid-rich beverages on prostacyclin synthesis in humans and human aortic endothelial cells: association with ex vivo platelet function. J Med Food. 2003;6(4):301-308. (PubMed)
72. Innes AJ, Kennedy G, McLaren M, Bancroft AJ, Belch JJ. Dark chocolate inhibits platelet aggregation in healthy volunteers. Platelets. 2003;14(5):325-327. (PubMed)
73. Rein D, Paglieroni TG, Pearson DA, et al. Cocoa and wine polyphenols modulate platelet activation and function. J Nutr. 2000;130(8S Suppl):2120S-2126S. (PubMed)
74. Rein D, Paglieroni TG, Wun T, et al. Cocoa inhibits platelet activation and function. Am J Clin Nutr. 2000;72(1):30-35. (PubMed)
75. Murphy KJ, Chronopoulos AK, Singh I, et al. Dietary flavanols and procyanidin oligomers from cocoa (Theobroma cacao) inhibit platelet function. Am J Clin Nutr. 2003;77(6):1466-1473. (PubMed)
76. Yang CS, Yang GY, Landau JM, Kim S, Liao J. Tea and tea polyphenols inhibit cell hyperproliferation, lung tumorigenesis, and tumor progression. Exp Lung Res. 1998;24(4):629-639. (PubMed)
77. Balasubramanian S, Govindasamy S. Inhibitory effect of dietary flavonol quercetin on 7,12-dimethylbenz[a]anthracene-induced hamster buccal pouch carcinogenesis. Carcinogenesis. 1996;17(4):877-879. (PubMed)
78. Li ZG, Shimada Y, Sato F, et al. Inhibitory effects of epigallocatechin-3-gallate on N-nitrosomethylbenzylamine-induced esophageal tumorigenesis in F344 rats. Int J Oncol. 2002;21(6):1275-1283. (PubMed)
79. Yamane T, Nakatani H, Kikuoka N, et al. Inhibitory effects and toxicity of green tea polyphenols for gastrointestinal carcinogenesis. Cancer. 1996;77(8 Suppl):1662-1667. (PubMed)
80. Guo JY, Li X, Browning JD, Jr., et al. Dietary soy isoflavones and estrone protect ovariectomized ERalphaKO and wild-type mice from carcinogen-induced colon cancer. J Nutr. 2004;134(1):179-182. (PubMed)
81. Huang MT, Xie JG, Wang ZY, et al. Effects of tea, decaffeinated tea, and caffeine on UVB light-induced complete carcinogenesis in SKH-1 mice: demonstration of caffeine as a biologically important constituent of tea. Cancer Res. 1997;57(13):2623-2629. (PubMed)
82. Gupta S, Hastak K, Ahmad N, Lewin JS, Mukhtar H. Inhibition of prostate carcinogenesis in TRAMP mice by oral infusion of green tea polyphenols. Proc Natl Acad Sci U S A. 2001;98(18):10350-10355. (PubMed)
83. Haddad AQ, Venkateswaran V, Viswanathan L, Teahan SJ, Fleshner NE, Klotz LH. Novel antiproliferative flavonoids induce cell cycle arrest in human prostate cancer cell lines. Prostate Cancer Prostatic Dis. 2006;9(1):68-76. (PubMed)
84. Yamagishi M, Natsume M, Osakabe N, et al. Effects of cacao liquor proanthocyanidins on PhIP-induced mutagenesis in vitro, and in vivo mammary and pancreatic tumorigenesis in female Sprague-Dawley rats. Cancer Lett. 2002;185(2):123-130. (PubMed)
85. Ross JA, Kasum CM. Dietary flavonoids: bioavailability, metabolic effects, and safety. Annu Rev Nutr. 2002;22:19-34. (PubMed)
86. Goldbohm RA, Van den Brandt PA, Hertog MG, Brants HA, Van Poppel G. Flavonoid intake and risk of cancer: a prospective cohort study. Am J Epidemiol. 1995;41:s61.
87. Hertog MG, Feskens EJ, Hollman PC, Katan MB, Kromhout D. Dietary flavonoids and cancer risk in the Zutphen Elderly Study. Nutr Cancer. 1994;22(2):175-184. (PubMed)
88. Arts IC, Hollman PC, Bueno De Mesquita HB, Feskens EJ, Kromhout D. Dietary catechins and epithelial cancer incidence: the Zutphen elderly study. Int J Cancer. 2001;92(2):298-302. (PubMed)
89. Goldbohm RA, Hertog MG, Brants HA, van Poppel G, van den Brandt PA. Consumption of black tea and cancer risk: a prospective cohort study. J Natl Cancer Inst. 1996;88(2):93-100. (PubMed)
90. Arts IC, Jacobs DR, Jr., Gross M, Harnack LJ, Folsom AR. Dietary catechins and cancer incidence among postmenopausal women: the Iowa Women's Health Study (United States). Cancer Causes Control. 2002;13(4):373-382. (PubMed)
91. Higdon JV, Frei B. Tea catechins and polyphenols: health effects, metabolism, and antioxidant functions. Crit Rev Food Sci Nutr. 2003;43(1):89-143. (PubMed)
92. De Stefani E, Ronco A, Mendilaharsu M, Deneo-Pellegrini H. Diet and risk of cancer of the upper aerodigestive tract--II. Nutrients. Oral Oncol. 1999;35(1):22-26. (PubMed)
93. Garcia-Closas R, Gonzalez CA, Agudo A, Riboli E. Intake of specific carotenoids and flavonoids and the risk of gastric cancer in Spain. Cancer Causes Control. 1999;10(1):71-75. (PubMed)
94. Lagiou P, Samoli E, Lagiou A, et al. Flavonoids, vitamin C and adenocarcinoma of the stomach. Cancer Causes Control. 2004;15(1):67-72. (PubMed)
95. Peterson J, Lagiou P, Samoli E, et al. Flavonoid intake and breast cancer risk: a case--control study in Greece. Br J Cancer. 2003;89(7):1255-1259. (PubMed)
96. Garcia R, Gonzalez CA, Agudo A, Riboli E. High intake of specific carotenoids and flavonoids does not reduce the risk of bladder cancer. Nutr Cancer. 1999;35(2):212-214. (PubMed)
97. Garcia-Closas R, Agudo A, Gonzalez CA, Riboli E. Intake of specific carotenoids and flavonoids and the risk of lung cancer in women in Barcelona, Spain. Nutr Cancer. 1998;32(3):154-158. (PubMed)
98. Ramassamy C. Emerging role of polyphenolic compounds in the treatment of neurodegenerative diseases: a review of their intracellular targets. Eur J Pharmacol. 2006;545(1):51-64. (PubMed)
99. Youdim KA, Qaiser MZ, Begley DJ, Rice-Evans CA, Abbott NJ. Flavonoid permeability across an in situ model of the blood-brain barrier. Free Radic Biol Med. 2004;36(5):592-604. (PubMed)
100. Schmitt-Schillig S, Schaffer S, Weber CC, Eckert GP, Muller WE. Flavonoids and the aging brain. J Physiol Pharmacol. 2005;56 Suppl 1:23-36. (PubMed)
101. Goyarzu P, Malin DH, Lau FC, et al. Blueberry supplemented diet: effects on object recognition memory and nuclear factor-kappa B levels in aged rats. Nutr Neurosci. 2004;7(2):75-83. (PubMed)
102. Joseph JA, Denisova NA, Arendash G, et al. Blueberry supplementation enhances signaling and prevents behavioral deficits in an Alzheimer disease model. Nutr Neurosci. 2003;6(3):153-162. (PubMed)
103. Joseph JA, Shukitt-Hale B, Denisova NA, et al. Reversals of age-related declines in neuronal signal transduction, cognitive, and motor behavioral deficits with blueberry, spinach, or strawberry dietary supplementation. J Neurosci. 1999;19(18):8114-8121. (PubMed)
104. Patil CS, Singh VP, Satyanarayan PS, Jain NK, Singh A, Kulkarni SK. Protective effect of flavonoids against aging- and lipopolysaccharide-induced cognitive impairment in mice. Pharmacology. 2003;69(2):59-67. (PubMed)
105. Laurin D, Masaki KH, Foley DJ, White LR, Launer LJ. Midlife dietary intake of antioxidants and risk of late-life incident dementia: the Honolulu-Asia Aging Study. Am J Epidemiol. 2004;159(10):959-967. (PubMed)
106. White LR, Petrovitch H, Ross GW, et al. Brain aging and midlife tofu consumption. J Am Coll Nutr. 2000;19(2):242-255. (PubMed)
107. de Rijk MC, Breteler MM, den Breeijen JH, et al. Dietary antioxidants and Parkinson disease. The Rotterdam Study. Arch Neurol. 1997;54(6):762-765. (PubMed)
108. Engelhart MJ, Geerlings MI, Ruitenberg A, et al. Dietary intake of antioxidants and risk of Alzheimer disease. JAMA. 2002;287(24):3223-3229. (PubMed)
109. Commenges D, Scotet V, Renaud S, Jacqmin-Gadda H, Barberger-Gateau P, Dartigues JF. Intake of flavonoids and risk of dementia. Eur J Epidemiol. 2000;16(4):357-363. (PubMed)
110. Letenneur L, Proust-Lima C, Le Gouge A, Dartigues JF, Barberger-Gateau P. Flavonoid intake and cognitive decline over a 10-year period. Am J Epidemiol. 2007;165(12):1364-1371. (PubMed)
111. Kreijkamp-Kaspers S, Kok L, Grobbee DE, et al. Effect of soy protein containing isoflavones on cognitive function, bone mineral density, and plasma lipids in postmenopausal women: a randomized controlled trial. JAMA. 2004;292(1):65-74. (PubMed)
112. Casini ML, Marelli G, Papaleo E, Ferrari A, D'Ambrosio F, Unfer V. Psychological assessment of the effects of treatment with phytoestrogens on postmenopausal women: a randomized, double-blind, crossover, placebo-controlled study. Fertil Steril. 2006;85(4):972-978. (PubMed)
113. Gu L, Kelm MA, Hammerstone JF, et al. Concentrations of proanthocyanidins in common foods and estimations of normal consumption. J Nutr. 2004;134(3):613-617. (PubMed)
114. Hendler SS, Rorvik DR, eds. PDR for Nutritional Supplements. Montvale: Medical Economics Company, Inc; 2001.
115. Shoskes DA, Zeitlin SI, Shahed A, Rajfer J. Quercetin in men with category III chronic prostatitis: a preliminary prospective, double-blind, placebo-controlled trial. Urology. 1999;54(6):960-963. (PubMed)
116. Ferry DR, Smith A, Malkhandi J, et al. Phase I clinical trial of the flavonoid quercetin: pharmacokinetics and evidence for in vivo tyrosine kinase inhibition. Clin Cancer Res. 1996;2(4):659-668. (PubMed)
117. Bonkovsky HL. Hepatotoxicity associated with supplements containing Chinese green tea (Camellia sinensis). Ann Intern Med. 2006;144(1):68-71. (PubMed)
118. Javaid A, Bonkovsky HL. Hepatotoxicity due to extracts of Chinese green tea (Camellia sinensis): a growing concern. J Hepatol. 2006;45(2):334-335; author reply 335-336. (PubMed)
119. Jatoi A, Ellison N, Burch PA, et al. A phase II trial of green tea in the treatment of patients with androgen independent metastatic prostate carcinoma. Cancer. 2003;97(6):1442-1446. (PubMed)
120. Pisters KM, Newman RA, Coldman B, et al. Phase I trial of oral green tea extract in adult patients with solid tumors. J Clin Oncol. 2001;19(6):1830-1838. (PubMed)
121. Chow HH, Cai Y, Hakim IA, et al. Pharmacokinetics and safety of green tea polyphenols after multiple-dose administration of epigallocatechin gallate and polyphenon E in healthy individuals. Clin Cancer Res. 2003;9(9):3312-3319. (PubMed)
122. Bailey DG, Dresser GK. Interactions between grapefruit juice and cardiovascular drugs. Am J Cardiovasc Drugs. 2004;4(5):281-297. (PubMed)
123. Dahan A, Altman H. Food-drug interaction: grapefruit juice augments drug bioavailability--mechanism, extent and relevance. Eur J Clin Nutr. 2004;58(1):1-9. (PubMed)
124. Zhou S, Lim LY, Chowbay B. Herbal modulation of P-glycoprotein. Drug Metab Rev. 2004;36(1):57-104. (PubMed)
125. Marzolini C, Paus E, Buclin T, Kim RB. Polymorphisms in human MDR1 (P-glycoprotein): recent advances and clinical relevance. Clin Pharmacol Ther. 2004;75(1):13-33. (PubMed)
126. Hurrell RF, Reddy M, Cook JD. Inhibition of non-haem iron absorption in man by polyphenolic-containing beverages. Br J Nutr. 1999;81(4):289-295. (PubMed)
127. Zijp IM, Korver O, Tijburg LB. Effect of tea and other dietary factors on iron absorption. Crit Rev Food Sci Nutr. 2000;40(5):371-398. (PubMed)
128. Song J, Kwon O, Chen S, et al. Flavonoid inhibition of sodium-dependent vitamin C transporter 1 (SVCT1) and glucose transporter isoform 2 (GLUT2), intestinal transporters for vitamin C and Glucose. J Biol Chem. 2002;277(18):15252-15260. (PubMed)
129. US Department of Agriculture. USDA database for the flavonoid content of selected foods. Available at: http://www.nal.usda.gov/fnic/foodcomp/Data/Flav/flav.html. Accessed 9/13/04.
130. US Department of Agriculture. USDA database for the proanthocyanidin content of selected foods. Available at: http://www.nal.usda.gov/fnic/foodcomp/Data/PA/PA.html. Accessed 9/13/04.
131. Vrhovsek U, Rigo A, Tonon D, Mattivi F. Quantitation of polyphenols in different apple varieties. J Agric Food Chem. 2004;52(21):6532-6538. (PubMed)
132. Moyer RA, Hummer KE, Finn CE, Frei B, Wrolstad RE. Anthocyanins, phenolics, and antioxidant capacity in diverse small fruit: vaccinium, rubus, and ribes. J Agric Food Chem. 2002;50(3):519-525. (PubMed)
133. Lee HS. Characterization of major anthocyanins and the color of red-fleshed Budd Blood orange (Citrus sinensis). J Agric Food Chem. 2002;50(5):1243-1246. (PubMed)
134. Ryan JM, Revilla E. Anthocyanin composition of Cabernet Sauvignon and Tempranillo grapes at different stages of ripening. J Agric Food Chem. 2003;51(11):3372-3378. (PubMed)
135. Henning SM, Fajardo-Lira C, Lee HW, Youssefian AA, Go VL, Heber D. Catechin content of 18 teas and a green tea extract supplement correlates with the antioxidant capacity. Nutr Cancer. 2003;45(2):226-235. (PubMed)
レスベラトロール
目次
要約
- レスベラトロールは、ぶどう、赤ワイン、紫色のぶどうジュース、ピーナッツ、およびある種のベリー類に含まれるポリフェノール化合物である。(詳細はこちら)
- 経口摂取すると、レスベラトロールはヒトでの吸収が良いように見える。しかし急速に代謝され体外に排出されるため、その生物学的利用性は比較的低い。(詳細はこちら)
- 赤ワインに含まれることが報告され、「フレンチ・パラドックス」を説明しやすいのではないかという憶測から、レスベラトロールの潜在的な健康有益性に関心が持たれた。(詳細はこちら)
- 適度なアルコール摂取は冠動脈心疾患のリスクを20~30%下げるという一貫した相関があるが、赤ワイン中のレスベラトロールなどのポリフェノールがさらにリスク低減をもたらすか否かは未だに不明である。(詳細はこちら)
- レスベラトロールはある動物モデルのがん細胞や培養したがん細胞の成長を抑制することができるが、レスベラトロールの大量摂取がヒトのがんを予防できるか否かはわかっていない。(詳細はこちら)
- 酵母、蠕虫、ショウジョウバエ、魚、および高カロリー食のマウスの寿命がレスベラトロールの投与で延びたものの、ヒトで同様の効果があるかは不明である。(詳細はこちら)
- 現在では、人体におけるレスベラトロールの効果はよくわかっていない。
序説
レスベラトロール(3,4',5-トリヒドロキシスチルベン)は、スチルベンと呼ばれるポリフェノール化合物の一種である(1)。ある種の植物は、ストレス、傷、真菌感染、または紫外線などに反応して、レスベラトロールやその他のスチルベンを生成する(2)。レスベラトロールは脂溶性化合物で、トランス型とシス型がある(図1参照)。シス型およびトランス型のどちらも、グルコシド(ブドウ糖分子に結合したもの)としても存在する。レスベラトロール-3-O-(β)グルコシドはピセイドと呼ばれる(3)。1992年に赤ワインに含まれることが最初に報告され(4)、「フレンチ・パラドックス」(下の「心血管疾患」の項目参照)を説明しやすくするのではないかという憶測から、レスベラトロールの潜在的な健康有益性に関心が持たれた。最近では、レスベラトロールががんの発生を抑制(5)し、培養した細胞や動物モデルの寿命を延ばす(6)可能性についての報告に関心が集まっている。
代謝と生物学的利用性
トランス型レスベラトロールは、経口摂取するとヒトでの吸収が良いように見える。しかし急速に代謝され体外に排出されるため、その生物学的利用性は比較的低い(7,8)。レスベラトロールの代謝物は、トランス型レスベラトロールを経口摂取した場合に主に検出される。トランス型レスベラトロール25mgを6人の健康な男女が経口摂取したところ、代謝されていないレスベラトロールの痕跡のみが血漿に検出された。レスベラトロールとその代謝物の血漿濃度は、60分ほどして約2マイクロモル/リットル(491マイクログラム/リットル)の最高値になった(7)。12人の健康な男性がトランス型レスベラトロールを体重70kgあたり25mg経口投与された研究では、レスベラトロールとその代謝物の血清濃度は投与後30分で最高値になった。レスベラトロール全体(レスベラトロールとその代謝物)の濃度は416~471マイクログラム/リットルの範囲で、レスベラトロールがワイン、野菜ジュース、またはぶどうジュースのいずれの形態で投与されたかによって違った(9)。レスベラトロールのグルコシド(ピセイド)を主に含むぶどうジュースからのレスベラトロールの生物学的利用性は、トランス型レスベラトロールよりもさらに低い可能性が別の研究結果から示されている(10)。最近の研究では、食事(低脂肪または高脂肪)と一緒にワインを摂取しても空腹で摂取しても、赤ワインのトランス型レスベラトロールの生物学的利用性に違いはないと報告されている(11)。
ヒトでのレスベラトロールの生物学的利用性に関する情報は重要である。なぜなら、レスベラトロールに関する基礎的な研究の多くは、経口摂取後のヒトの血漿での最高濃度よりもしばしば10~100倍も高いような代謝されていないレスベラトロールにさらされた培養細胞においてなされてきたからである(12)。消化管の内壁の細胞は代謝されていないレスベラトロールにさらされるが、ヒトでの研究はその他の組織が主にレスベラトロールの代謝物にさらされることを示唆している。レスベラトロール代謝物の生物活性についてはほとんどわかっていないし、レスベラトロール代謝物をレスベラトロールにまた転換できる組織があるのか不明である(7)。
生物活性
直接的酸化防止活性
試験管内では、レスベラトロールはフリーラジカル(遊離基)やその他のオキシダント(酸化物質)を効果的に除去(中和)(13)し、低比重リポタンパク質(LDL)の酸化を抑制する(14,15)。しかし、レスベラトロールが生体内で重要な抗酸化物質であるというエビデンス(根拠)はほとんどない(16)。レスベラトロールの経口摂取では、ヒトにおけるレスベラトロールの体内循環中の濃度および細胞内濃度は、ビタミンC、尿酸、ビタミンE、およびグルタチオンといったその他の重要な抗酸化物質よりもずっと低いようである。加えて、体内循環しているレスベラトロールの大部分を占めるレスベラトロール代謝物の抗酸化活性は、レスベラトロールより低いかもしれない。
エストロゲン性および抗エストロゲン性活性
内在性エストロゲンはヒトおよびその他の哺乳類が合成するステロイドホルモンで、細胞内のエストロゲン受容体と結合する。エストロゲンとその受容体の複合体はDNAの非反復配列(エストロゲン応答配列;ERE)と相互作用し、エストロゲン応答性遺伝子の発現を調整する(17)。エストロゲン受容体と結びつき内在性エストロゲンと同様の反応を誘発する化合物は、エストロゲン作動薬とみなされる。一方でエストロゲン受容体と結合はするが内在性エストロゲンによって誘発される反応を防止したり抑制したりする化合物は、エストロゲン拮抗薬とみなされる。レスベラトロールの化学構造は合成エストロゲン作動薬であるジエチルスチルベストロールと非常に似通っており(図2参照)、レスベラトロールがエストロゲン作動薬として機能する可能性を示唆している。しかしながら、培養細胞での実験では、レスベラトロールはある条件下でエストロゲン作動薬として働き、その他の条件下ではエストロゲン拮抗薬として機能する(18,19)。エストロゲン受容体陽性の乳がん細胞では、レスベラトロールは内在性エストロゲンである17β-エストラジオールがない場合にエストロゲン作動薬として機能し、17β-エストラジオールがある場合にはエストロゲン拮抗薬として機能した(20,21)。現時点では、細胞のタイプ、エストロゲン受容体のイソ型(ERαまたはERβ)、および内在性エストロゲンの存在などの要素によって、エストロゲン作動薬または拮抗薬として作用する可能性があるようである(17)。
がん予防に関連する生物活性
生体内変換酵素への効果
ある種の化合物は、体内でチトクロームP450酵素によって代謝されるまで発がん性を持たない(2)。あるチトクロームP450酵素の発現および活動を抑制することで(22,23)、レスベラトロールはこれらの活性化された発がん性物質への接触を減らしてがんを予防することに役立っているのかもしれない。対照的に、第II相生体内変換酵素(第II相代謝酵素)の活動を増進することは、有毒または発がんの可能性のある化学物質の排泄を一般的に促す。レスベラトロールは、培養細胞において第II相代謝酵素であるNAD(P)H、つまりキノンレダクターゼ(キノン還元酵素)の発現と活性を増進することがわかっている(5,24)。
通常の細胞周期制御の保全
DNA損傷の後、DNA修復またはその損傷が修復不能であるならば細胞死(アポトーシス)に至る経路の活性化へと、細胞周期が過渡的に抑止される(25)。細胞周期制御に欠陥があると、がんの発現に寄与する突然変異の伝播に陥りかねない。レスベラトロールは、培養されたがん細胞に添加されると、細胞周期抑止を誘発することがわかっている(26)。
増殖の抑制とアポトーシスの誘発
正常な細胞と異なり、がん細胞は急速に増殖し、アポトーシスを起こす細胞死信号に反応しない。レスベラトロールは多くのがん細胞株で増殖を抑制し、細胞死を誘発することがわかっている(2,27で再調査)。
腫瘍浸潤の抑制と血管新生
がん細胞は、マトリックスメタロプロテアーゼ(マトリックスメタロプロテイナーゼ)という酵素の助成によって、正常な組織を浸潤する。レスベラトロールは、少なくとも1種類のマトリックスメタロプロテアーゼの活動を抑制することがわかっている(28)。急激な増殖を促進するため、浸潤がんは血管新生というプロセスによって新しい血管も作らねばならない。レスベラトロールは、ガラス容器内では血管新生を抑制することがわかっている(29-31)。
抗炎症効果
炎症は細胞増殖や血管新生を促し、アポトーシスを抑制する(32)。レスベラトロールは、ガラス容器内でシクロオキシゲナーゼやリポキシゲナーゼを含むいくつかの炎症酵素の活動を抑制することがわかっている(33,34)。レスベラトロールはNFkBまたはAP-1といった炎症誘発性転写因子も抑制する可能性がある(35,36)。
心血管疾患予防に関連する生物活性
血管細胞癒着分子の発現の抑制
アテローム性動脈硬化は現在では炎症性疾患と認識されており、炎症に関するいくつかの測定値は心筋梗塞のリスク上昇と関連している(37)。アテローム性動脈硬化の発生初期の事象の一つが、炎症を起こす白血球が血液から動脈壁に血管細胞癒着分子によって動員されることである(38)。レスベラトロールは、培養された内皮細胞において癒着分子が発現するのを抑制することがわかっている(39,40)。
血管平滑筋細胞増殖の抑制
血管平滑筋細胞の増殖は、動脈硬化の進行に重要な役割を果たす(41)。レスベラトロールは培養された血管平滑筋細胞の増殖を抑制することがわかっている(42,43)。
内皮性一酸化窒素合成酵素(eNOS)の活動の刺激
eNOSは血管内皮細胞による一酸化窒素(NO)生成の触媒作用を起こす酵素である。一酸化窒素は動脈弛緩(血管拡張)の維持に必要であり、一酸化窒素依存性血管拡張がうまくいかないと、心血管疾患のリスクが高くなる(44)。レスベラトロールは、培養された内皮細胞でeNOSの活動を刺激することがわかっている(45,46)。
血小板凝縮の抑制
血小板凝縮は、冠状動脈や大脳動脈をつまらせる可能性のある血栓形成の第一段階の一つであり、それぞれ心筋梗塞および脳卒中に至る。レスベラトロールは、ガラス容器内で血小板凝縮を抑制することがわかっている(47,48)。
注意:上記の生命活動の多くは、レスベラトロールを経口摂取したヒトの体内よりも高いであろう濃度でレスベラトロールを投与して培養した細胞で見られたものであるということを覚えておくことが大切である(上記の「代謝と生物学的利用性」の項目を参照)。
疾病の予防
心血管疾患
赤ワインのポリフェノール
心血管疾患リスクの大幅な減少は、適度なアルコール飲料の摂取と関連している(49,50)。比較的高レベルの食事性飽和脂肪摂取および喫煙にもかかわらず冠動脈心疾患による死亡率がフランスで比較的低いという「フレンチ・パラドックス」から、定期的に赤ワインを摂取することが心血管疾患への付加的な予防になっているのではないかという考えが導かれた(51,52)。赤ワインはレスベラトロールや、それ以上の濃度のフラボノイドを含む。これらのポリフェノール化合物は、試験管内やアテローム性動脈硬化の動物モデルで、抗酸化効果、抗炎症効果、およびその他の潜在的アテローム産生抑制効果を示す(53)。しかしながら、赤ワインのポリフェノール摂取を増加させると、そのアルコール含有量に関連した以上に付加的な心血管疾患予防効果があるのかどうかは不明である(「アルコール飲料」の記事を参照のこと)。この問題を扱った疫学的研究の結果はまちまちである。いくつかの大規模前向き研究では、ワインを飲む者はビールや蒸留酒を飲む者よりも心血管疾患のリスクが低い(54-56)となっているが、何の差も見られなかった研究もある(57-59)。ワインを好む者とビールや蒸留酒を好む者との社会経済的な差異およびライフスタイルの違いで、いくつかの研究で見られた付加的な効果の一部が説明できるのかもしれない。ワインを好む者は、その他のアルコール飲料を好む者より高収入、高学歴、低喫煙、および果物や野菜の高摂取と飽和脂肪の低摂取の傾向があることがいくつかの研究でわかっている(59-64)。適度なアルコール摂取では一貫して冠動脈心疾患リスクが20~30%低下するが、赤ワインのポリフェノールが付加的なリスク低下をもたらすのかどうかは不明である。興味深いことに、げっ歯類にアルコールを含まない赤ワインを与える研究では、心血管疾患に関連する様々なパラメータの値に向上が見られた(65,66)。さらに、ヒトでのプラセボ対照研究では、赤ぶどうのポリフェノール抽出物を与えられた心臓病患者に内皮機能の急激な改善が見られた(67)。しかしながら、赤ワインを飲むことがそのアルコール含有量に由来する以上に心血管に有益であるのかどうかを決定するには、さらなる研究が必要である。
レスベラトロール
レスベラトロールは、血小板凝縮の抑制(47,48,68)、一酸化窒素の生成を促すことでの血管拡張の促進(46,69)、および炎症を起こす酵素の抑制(34,70,71)など、心臓を保護する可能性のあるいくつかの効果をガラス容器内では発揮することがわかっている。しかしながら、これらの効果を引き起こすのに必要なレスベラトロールの濃度は、レスベラトロールを経口摂取した後のヒトの血漿での濃度よりも高いことが多い(7)。いくつかの動物研究の結果は、レスベラトロールの高用量経口摂取が血栓症(凝血塊の形成)リスクおよびアテローム性動脈硬化症リスクを低減させる可能性を示唆している(72,73)。しかし少なくとも1つの研究では、レスベラトロールを与えられた動物にアテローム性動脈硬化が増えた(74)。赤ワインにレスベラトロールが含まれることは、レスベラトロールが心血管疾患を防ぐ可能性について多大な興味をいだかせるものではある。しかし、レスベラトロールにヒトの心臓保護効果があるという説得力のあるエビデンスはなく、グラスに1~2杯の赤ワインに含まれる量くらいではなおさらである(「摂取源」の項目参照)。
がん
レスベラトロールは、乳がん、前立腺がん、胃がん、大腸がん、すい臓がん、および甲状腺がんなどのヒトの様々ながん細胞株の増殖を抑制することがわかっている(2)。動物モデルでは、発がん性化学物質によって引き起こされた食道がん(75)、腸がん(72)、および乳がん(20,77)の発生が、レスベラトロールの経口投与で抑制された。しかしながら、タバコの煙に含まれる発がん性物質による肺がん発生の抑制には、レスベラトロールの経口投与は効果がなかった(78,79)。遺伝的に大腸がんにかかりやすくしたマウスにレスベラトロールを経口投与した効果はまちまちである(80,81)。また、発がん性物質である1,2ジメチルヒドラジンを投与したラット(ネズミ)の大腸がん発生が、レスベラトロールの経口投与で予防されたとする研究もある(82-84)。レスベラトロールの高摂取がヒトのがん予防に役立つかは不明である。この問題を扱い、レスベラトロールががんの治療にも有益か否かも決定する臨床試験が現在進行中である(85)。ヒトでのレスベラトロールの代謝に関する研究では、レスベラトロールを多量に食事で摂取しても、培養細胞の研究で見られた予防効果を実現する組織濃度まで上がらないのではないかということが示唆されている(7,12)。
長寿
カロリー制限は、哺乳類を含む多くの種で寿命を延ばすことが知られている(86)。酵母では、カロリー制限がSir2という酵素の活動を刺激する(87)。カロリー制限なしで酵母にレスベラトロールを供与するとSir2の活動が増え、酵母の複製的寿命が70%延びた(6)。レスベラトロールの供与は、同様のメカニズムで蠕虫(線虫)やショウジョウバエ(キイロショウジョウバエ)の寿命を延ばした(88)。加えて、レスベラトロールは脊椎動物である魚(ノソブランキウス・フルゼリ)の寿命を、投与量に従って延ばした(89)。しかしながら、より高度な動物でレスベラトロールが同様の効果を持っているかは不明である。最近の研究で、標準的な食事を与えられたマウスと同様なくらいに、レスベラトロールが高カロリー食のマウスの寿命を延ばしたと報告されている(90)。レスベラトロールは、ヒトの相同な酵素(Sirt1)の活動を試験管内で増やす(6)が、レスベラトロールがヒトの寿命を延ばすかは不明である。しかも、ヒトでSirt1の活動を増やすためのレスベラトロール濃度は、経口摂取のあとでヒトの血漿で測定される濃度よりもかなり高い。興味深いことに、最近のマウスでの加齢研究で、低用量の食事性レスベラトロールが、カロリー制限によって引き起こされるのと同様に心臓、脳、および骨格筋で遺伝子発現を変化させることがわかった(91)。カロリー制限と同様に、この研究ではレスベラトロールが加齢に関連する心臓機能低下を鈍らせた。これらの発見がヒトにも当てはまるかどうかを決定するには、臨床試験が必要であろう。
摂取源
食物の摂取源
レスベラトロールは、ぶどう、ワイン、ぶどうジュース、ピーナッツ、およびブルーベリー、ビルベリー、クランベリーといったスノキ属のベリー類に含まれる(92-94)。ぶどうでは、レスベラトロールは皮にのみ含まれる(95)。ぶどうの皮のレスベラトロール量は、ぶどうの栽培品種、原産地、および真菌感染の有無などで異なる(96)。ぶどうの皮と接する発酵時間の長さが、ワインのレスベラトロール含有量を決めるのに重要である。したがって、白ワインやロゼワインは、一般的に赤ワインよりもレスベラトロール含有量が少ない(4)。赤色または紫色のぶどうジュースは、レスベラトロールの優良な摂取源となりうる(3)。ぶどうやぶどうジュースでの主要なレスベラトロールの形態は、トランス型レスベラトロールグルコシド(トランスピセイド)である。しかし、ワインは発酵による糖の切断の結果と思われるレスベラトロールアグリコンも多量に含んでいる(92)。多くのワインは、発酵で生成されるかビニフェリン(レスベラトロールの重合体)から発生するであろうシス型のレスベラトロール(図1参照)も多く含む(97)。赤ワインはレスベラトロールを比較的豊富に含む摂取源であるが、レスベラトロール以外のポリフェノールもかなり高濃度に含む(「フラボノイド」の記事を参照)(98)。いくつかの飲料や食物に含まれるレスベラトロールの全含有量を下の表に示す。食物や飲料に含まれるレスベラトロールの含有量はかなり幅があるので、これらの値は近似値と見なされるべきである。
| 飲料 | 全レスベラトロール量(mg/リットル) | 約140mlのグラス1杯分の全レスベラトロール量(mg) |
|---|---|---|
| 白ワイン(スペイン産) | 0.05-1.80 | 11.9 |
| ロゼワイン(スペイン産) | 0.43-3.52 | 0.06-0.53 |
| 赤ワイン(スペイン産) | 1.92-12.59 | 0.29-1.89 |
| 赤ワイン(全体) | 1.98-7.13 | 0.30-1.07 |
| 赤ぶどうジュース(スペイン産) | 1.14-8.69 | 0.17-1.30 |
| 食品 | 分量 | 全レスベラトロール量(mg) |
|---|---|---|
| ピーナッツ(生) | 146 g | 0.01-0.26 |
| ピーナッツ(ゆでたもの) | 180 g | 0.32-1.28 |
| ピーナッツバター | 258 g | 0.04-0.13 |
| 赤ぶどう | 160 g | 0.24-1.25 |
サプリメント
米国で入手可能なたいていのレスベラトロールのサプリメントは、別名が虎杖根というイタドリの根の抽出物を含む(102)。米国では、レスベラトロールやその他のポリフェノールを含む赤ワインや赤ぶどうの抽出物が、栄養補助食品として入手可能である。レスベラトロールのサプリメントは10~50mgのレスベラトロールを含むであろうが、ヒトの慢性的疾患の予防に有効な用量は不明である。
安全性
悪影響
レスベラトロールのヒトへの有害性や悪影響は知られていないが、今日まで対照臨床試験が少ない。レスベラトロールの経口摂取の安全性を10人の治験者で評価した最近の試験では、1回5グラムまでの服用でも重大な悪影響がなかった(103)。ラットでは、体重1kg換算で300mgまでの用量のトランス型レスベラトロールを毎日4週間経口投与しても、明瞭な悪影響はなかった(104,105)。
妊娠期および授乳期
レスベラトロールを含むサプリメントの妊娠期および授乳期での安全性は確立していない(102)。どの妊娠段階でもアルコール摂取の安全な量が確立していないため(106)、妊娠中の女性はレスベラトロールの摂取源としてワインを飲むことは避けるべきである。
エストロゲン感受性のがん
ヒトにおけるレスベラトロールのエストロゲン様作用についてもっと多くのことがわかるまで、乳がん、卵巣がん、および子宮がんといったエストロゲン感受性のがんの病歴のある女性は、レスベラトロールのサプリメントの摂取を避けるべきである(上記の「エストロゲン性および抗エストロゲン性活性」の項目を参照)。
薬物相互作用
抗凝固薬および血小板凝集抑制薬
レスベラトロールは、ガラス容器内でヒトの血小板凝集を抑制することが知られている(48,107)。理論的には、(サプリメントなどからの)レスベラトロールの高摂取は、ワルファリン(クマジン)などの抗凝固薬、クロピドグレル(プラビックス)やジピリダモール(ペルサンチン)などの血小板凝集抑制薬、およびアスピリン、イブプロフェン、およびその他の抗炎症薬(NSAID)と一緒の服用で出血のリスクを高める。
チトクロームP450 3A4によって代謝される薬物
レスベラトロールは、ガラス容器内でチトクローム(シトクローム)P450 3A4(CYP3A4)の活動を抑制することが報告されている(108,109)。この相互作用はヒトでは報告されていないが、(サプリメントなどからの)レスベラトロールの高摂取は、理論的にはCYP3A4による広範な初回通過代謝を受ける薬物の生物学的利用性や有毒性を高める可能性がある。CYP3A4により代謝される薬物は、HMG-CoA還元酵素抑制薬(アトルバスタチン、ロバスタチン、およびシンバスタチン)、カルシウムチャンネル拮抗薬(フェロジピン、ニカルジピン、ニフェジピン、ニソルジピン、ニトレンジピン、ニモジピン、およびベラパミル)、抗不整脈薬(アミオダロン)、HIVプロテアーゼ阻害薬(サキナビル)、免疫抑制剤(シクロスポリンおよびタクロリムス)、抗ヒスタミン薬(テルフェナジン)、ベンゾジアゼピン(ミダゾラムおよびトリアゾラム)、および勃起不全の治療薬(シルデナフィル)などを含むが、これらに限らない。
Authors and Reviewers
Originally written in 2005 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in May 2008 by:
Victoria J. Drake, Ph.D.
Linus Pauling Institute
Oregon State University
Reviewed in May 2008 by:
William P. Steward, M.D., Ph.D.
Professor of Oncology
Co-Director of Cancer Biomarkers and Prevention Group
Department of Oncology
University of Leicester
Copyright 2005-2024 Linus Pauling Institute
References
1. Soleas GJ, Diamandis EP, Goldberg DM. Resveratrol: a molecule whose time has come? And gone? Clin Biochem. 1997;30(2):91-113. (PubMed)
2. Aggarwal BB, Bhardwaj A, Aggarwal RS, Seeram NP, Shishodia S, Takada Y. Role of resveratrol in prevention and therapy of cancer: preclinical and clinical studies. Anticancer Res. 2004;24(5A):2783-2840. (PubMed)
3. Romero-Perez AI, Ibern-Gomez M, Lamuela-Raventos RM, de La Torre-Boronat MC. Piceid, the major resveratrol derivative in grape juices. J Agric Food Chem. 1999;47(4):1533-1536. (PubMed)
4. Siemann EH, Creasey LL. Concentration of the phytoalexin resveratrol in wine. Am J Enol Vitic. 1992;43(1):49-52.
5. Jang M, Cai L, Udeani GO, et al. Cancer chemopreventive activity of resveratrol, a natural product derived from grapes. Science. 1997;275(5297):218-220. (PubMed)
6. Howitz KT, Bitterman KJ, Cohen HY, et al. Small molecule activators of sirtuins extend Saccharomyces cerevisiae lifespan. Nature. 2003;425(6954):191-196. (PubMed)
7. Walle T, Hsieh F, Delegge MH, Oatis JE, Jr., Walle UK. High absorption but very low bioavailability of oral resveratrol in humans. Drug Metab Dispos. 2004;32(12):1377-1382. (PubMed)
8. Wenzel E, Somoza V. Metabolism and bioavailability of trans-resveratrol. Mol Nutr Food Res. 2005;49(5):472-481. (PubMed)
9. Goldberg DM, Yan J, Soleas GJ. Absorption of three wine-related polyphenols in three different matrices by healthy subjects. Clin Biochem. 2003;36(1):79-87. (PubMed)
10. Meng X, Maliakal P, Lu H, Lee MJ, Yang CS. Urinary and plasma levels of resveratrol and quercetin in humans, mice, and rats after ingestion of pure compounds and grape juice. J Agric Food Chem. 2004;52(4):935-942. (PubMed)
11. Vitaglione P, Sforza S, Galaverna G, et al. Bioavailability of trans-resveratrol from red wine in humans. Mol Nutr Food Res. 2005;49(5):495-504. (PubMed)
12. Gescher AJ, Steward WP. Relationship between mechanisms, bioavailibility, and preclinical chemopreventive efficacy of resveratrol: a conundrum. Cancer Epidemiol Biomarkers Prev. 2003;12(10):953-957. (PubMed)
13. Stojanovic S, Sprinz H, Brede O. Efficiency and mechanism of the antioxidant action of trans-resveratrol and its analogues in the radical liposome oxidation. Arch Biochem Biophys. 2001;391(1):79-89. (PubMed)
14. Brito P, Almeida LM, Dinis TC. The interaction of resveratrol with ferrylmyoglobin and peroxynitrite; protection against LDL oxidation. Free Radic Res. 2002;36(6):621-631. (PubMed)
15. Frankel EN, Waterhouse AL, Kinsella JE. Inhibition of human LDL oxidation by resveratrol. Lancet. 1993;341(8852):1103-1104. (PubMed)
16. Bradamante S, Barenghi L, Villa A. Cardiovascular protective effects of resveratrol. Cardiovasc Drug Rev. 2004;22(3):169-188. (PubMed)
17. Tangkeangsirisin W, Serrero G. Resveratrol in the chemoprevention and chemotherapy of breast cancer. In: Bagchi D, Preuss HG, eds. Phytopharmaceuticals in Cancer Chemoprevention. Boca Raton: CRC Press; 2005:449-463.
18. Bowers JL, Tyulmenkov VV, Jernigan SC, Klinge CM. Resveratrol acts as a mixed agonist/antagonist for estrogen receptors alpha and beta. Endocrinology. 2000;141(10):3657-3667. (PubMed)
19. Gehm BD, McAndrews JM, Chien PY, Jameson JL. Resveratrol, a polyphenolic compound found in grapes and wine, is an agonist for the estrogen receptor. Proc Natl Acad Sci U S A. 1997;94(25):14138-14143. (PubMed)
20. Bhat KP, Lantvit D, Christov K, Mehta RG, Moon RC, Pezzuto JM. Estrogenic and antiestrogenic properties of resveratrol in mammary tumor models. Cancer Res. 2001;61(20):7456-7463. (PubMed)
21. Lu R, Serrero G. Resveratrol, a natural product derived from grape, exhibits antiestrogenic activity and inhibits the growth of human breast cancer cells. J Cell Physiol. 1999;179(3):297-304. (PubMed)
22. Chen ZH, Hurh YJ, Na HK, et al. Resveratrol inhibits TCDD-induced expression of CYP1A1 and CYP1B1 and catechol estrogen-mediated oxidative DNA damage in cultured human mammary epithelial cells. Carcinogenesis. 2004;25(10):2005-2013. (PubMed)
23. Ciolino HP, Yeh GC. Inhibition of aryl hydrocarbon-induced cytochrome P-450 1A1 enzyme activity and CYP1A1 expression by resveratrol. Mol Pharmacol. 1999;56(4):760-767. (PubMed)
24. Yang SH, Kim JS, Oh TJ, et al. Genome-scale analysis of resveratrol-induced gene expression profile in human ovarian cancer cells using a cDNA microarray. Int J Oncol. 2003;22(4):741-750. (PubMed)
25. Stewart ZA, Westfall MD, Pietenpol JA. Cell-cycle dysregulation and anticancer therapy. Trends Pharmacol Sci. 2003;24(3):139-145. (PubMed)
26. Joe AK, Liu H, Suzui M, Vural ME, Xiao D, Weinstein IB. Resveratrol induces growth inhibition, S-phase arrest, apoptosis, and changes in biomarker expression in several human cancer cell lines. Clin Cancer Res. 2002;8(3):893-903. (PubMed)
27. Fulda S, Debatin KM. Resveratrol modulation of signal transduction in apoptosis and cell survival: a mini-review. Cancer Detect Prev. 2006;30(3):217-223. (PubMed)
28. Woo JH, Lim JH, Kim YH, et al. Resveratrol inhibits phorbol myristate acetate-induced matrix metalloproteinase-9 expression by inhibiting JNK and PKC delta signal transduction. Oncogene. 2004;23(10):1845-1853. (PubMed)
29. Igura K, Ohta T, Kuroda Y, Kaji K. Resveratrol and quercetin inhibit angiogenesis in vitro. Cancer Lett. 2001;171(1):11-16. (PubMed)
30. Lin MT, Yen ML, Lin CY, Kuo ML. Inhibition of vascular endothelial growth factor-induced angiogenesis by resveratrol through interruption of Src-dependent vascular endothelial cadherin tyrosine phosphorylation. Mol Pharmacol. 2003;64(5):1029-1036. (PubMed)
31. Chen Y, Tseng SH. Review. Pro- and anti-angiogenesis effects of resveratrol. In Vivo. 2007;21(2):365-370. (PubMed)
32. Steele VE, Hawk ET, Viner JL, Lubet RA. Mechanisms and applications of non-steroidal anti-inflammatory drugs in the chemoprevention of cancer. Mutat Res. 2003;523-524:137-144. (PubMed)
33. Donnelly LE, Newton R, Kennedy GE, et al. Anti-inflammatory effects of resveratrol in lung epithelial cells: molecular mechanisms. Am J Physiol Lung Cell Mol Physiol. 2004;287(4):L774-783. (PubMed)
34. Pinto MC, Garcia-Barrado JA, Macias P. Resveratrol is a potent inhibitor of the dioxygenase activity of lipoxygenase. J Agric Food Chem. 1999;47(12):4842-4846. (PubMed)
35. Shankar S, Singh G, Srivastava RK. Chemoprevention by resveratrol: molecular mechanisms and therapeutic potential. Front Biosci. 2007;12:4839-4854. (PubMed)
36. de la Lastra CA, Villegas I. Resveratrol as an anti-inflammatory and anti-aging agent: mechanisms and clinical implications. Mol Nutr Food Res. 2005;49(5):405-430. (PubMed)
37. Blake GJ, Ridker PM. C-reactive protein and other inflammatory risk markers in acute coronary syndromes. J Am Coll Cardiol. 2003;41(4 Suppl S):37S-42S. (PubMed)
38. Stocker R, Keaney JF, Jr. Role of oxidative modifications in atherosclerosis. Physiol Rev. 2004;84(4):1381-1478. (PubMed)
39. Carluccio MA, Siculella L, Ancora MA, et al. Olive oil and red wine antioxidant polyphenols inhibit endothelial activation: antiatherogenic properties of Mediterranean diet phytochemicals. Arterioscler Thromb Vasc Biol. 2003;23(4):622-629. (PubMed)
40. Ferrero ME, Bertelli AE, Fulgenzi A, et al. Activity in vitro of resveratrol on granulocyte and monocyte adhesion to endothelium. Am J Clin Nutr. 1998;68(6):1208-1214. (PubMed)
41. Faxon DP, Fuster V, Libby P, et al. Atherosclerotic Vascular Disease Conference: Writing Group III: pathophysiology. Circulation. 2004;109(21):2617-2625. (PubMed)
42. Mnjoyan ZH, Fujise K. Profound negative regulatory effects by resveratrol on vascular smooth muscle cells: a role of p53-p21(WAF1/CIP1) pathway. Biochem Biophys Res Commun. 2003;311(2):546-552. (PubMed)
43. Haider UG, Sorescu D, Griendling KK, Vollmar AM, Dirsch VM. Resveratrol increases serine15-phosphorylated but transcriptionally impaired p53 and induces a reversible DNA replication block in serum-activated vascular smooth muscle cells. Mol Pharmacol. 2003;63(4):925-932. (PubMed)
44. Duffy SJ, Vita JA. Effects of phenolics on vascular endothelial function. Curr Opin Lipidol. 2003;14(1):21-27. (PubMed)
45. Klinge CM, Blankenship KA, Risinger KE, et al. Resveratrol and estradiol rapidly activate MAPK signaling through estrogen receptors alpha and beta in endothelial cells. J Biol Chem. 2005; 280(9):7460-7468. (PubMed)
46. Wallerath T, Deckert G, Ternes T, et al. Resveratrol, a polyphenolic phytoalexin present in red wine, enhances expression and activity of endothelial nitric oxide synthase. Circulation. 2002;106(13):1652-1658. (PubMed)
47. Kirk RI, Deitch JA, Wu JM, Lerea KM. Resveratrol decreases early signaling events in washed platelets but has little effect on platalet in whole blood. Blood Cells Mol Dis. 2000;26(2):144-150. (PubMed)
48. Pace-Asciak CR, Hahn S, Diamandis EP, Soleas G, Goldberg DM. The red wine phenolics trans-resveratrol and quercetin block human platelet aggregation and eicosanoid synthesis: implications for protection against coronary heart disease. Clin Chim Acta. 1995;235(2):207-219. (PubMed)
49. Klatsky AL. Drink to your health? Sci Am. 2003;288(2):74-81. (PubMed)
50. Corrao G, Rubbiati L, Bagnardi V, Zambon A, Poikolainen K. Alcohol and coronary heart disease: a meta-analysis. Addiction. 2000;95(10):1505-1523. (PubMed)
51. Criqui MH, Ringel BL. Does diet or alcohol explain the French paradox? Lancet. 1994;344(8939-8940):1719-1723. (PubMed)
52. St Leger AS, Cochrane AL, Moore F. Factors associated with cardiac mortality in developed countries with particular reference to the consumption of wine. Lancet. 1979;1(8124):1017-1020. (PubMed)
53. German JB, Walzem RL. The health benefits of wine. Annu Rev Nutr. 2000;20:561-593. (PubMed)
54. Gronbaek M, Becker U, Johansen D, et al. Type of alcohol consumed and mortality from all causes, coronary heart disease, and cancer. Ann Intern Med. 2000;133(6):411-419. (PubMed)
55. Klatsky AL, Friedman GD, Armstrong MA, Kipp H. Wine, liquor, beer, and mortality. Am J Epidemiol. 2003;158(6):585-595. (PubMed)
56. Renaud SC, Gueguen R, Siest G, Salamon R. Wine, beer, and mortality in middle-aged men from eastern France. Arch Intern Med. 1999;159(16):1865-1870. (PubMed)
57. Mukamal KJ, Conigrave KM, Mittleman MA, et al. Roles of drinking pattern and type of alcohol consumed in coronary heart disease in men. N Engl J Med. 2003;348(2):109-118. (PubMed)
58. Rimm EB, Klatsky A, Grobbee D, Stampfer MJ. Review of moderate alcohol consumption and reduced risk of coronary heart disease: is the effect due to beer, wine, or spirits. BMJ. 1996;312(7033):731-736. (PubMed)
59. Wannamethee SG, Shaper AG. Type of alcoholic drink and risk of major coronary heart disease events and all-cause mortality. Am J Public Health. 1999;89(5):685-690. (PubMed)
60. Barefoot JC, Gronbaek M, Feaganes JR, McPherson RS, Williams RB, Siegler IC. Alcoholic beverage preference, diet, and health habits in the UNC Alumni Heart Study. Am J Clin Nutr. 2002;76(2):466-472. (PubMed)
61. McCann SE, Sempos C, Freudenheim JL, et al. Alcoholic beverage preference and characteristics of drinkers and nondrinkers in western New York (United States). Nutr Metab Cardiovasc Dis. 2003;13(1):2-11. (PubMed)
62. Mortensen EL, Jensen HH, Sanders SA, Reinisch JM. Better psychological functioning and higher social status may largely explain the apparent health benefits of wine: a study of wine and beer drinking in young Danish adults. Arch Intern Med. 2001;161(15):1844-1848. (PubMed)
63. Johansen D, Friis K, Skovenborg E, Gronbaek M. Food buying habits of people who buy wine or beer: cross sectional study. BMJ. 2006;332(7540):519-522. (PubMed)
64. Ruidavets JB, Bataille V, Dallongeville J, et al. Alcohol intake and diet in France, the prominent role of lifestyle. Eur Heart J. 2004;25(13):1153-1162. (PubMed)
65. Stocker R, O'Halloran RA. Dealcoholized red wine decreases atherosclerosis in apolipoprotein E gene-deficient mice independently of inhibition of lipid peroxidation in the artery wall. Am J Clin Nutr. 2004;79(1):123-130. (PubMed)
66. De Curtis A, Murzilli S, Di Castelnuovo A, et al. Alcohol-free red wine prevents arterial thrombosis in dietary-induced hypercholesterolemic rats: experimental support for the 'French paradox'. J Thromb Haemost. 2005;3(2):346-350. (PubMed)
67. Lekakis J, Rallidis LS, Andreadou I, et al. Polyphenolic compounds from red grapes acutely improve endothelial function in patients with coronary heart disease. Eur J Cardiovasc Prev Rehabil. 2005;12(6):596-600. (PubMed)
68. Wang Z, Huang Y, Zou J, Cao K, Xu Y, Wu JM. Effects of red wine and wine polyphenol resveratrol on platelet aggregation in vivo and in vitro. Int J Mol Med. 2002;9(1):77-79. (PubMed)
69. Chen CK, Pace-Asciak CR. Vasorelaxing activity of resveratrol and quercetin in isolated rat aorta. Gen Pharmacol. 1996;27(2):363-366. (PubMed)
70. Szewczuk LM, Forti L, Stivala LA, Penning TM. Resveratrol is a peroxidase-mediated inactivator of COX-1 but not COX-2: a mechanistic approach to the design of COX-1 selective agents. J Biol Chem. 2004;279(21):22727-22737. (PubMed)
71. Tsai SH, Lin-Shiau SY, Lin JK. Suppression of nitric oxide synthase and the down-regulation of the activation of NFkappaB in macrophages by resveratrol. Br J Pharmacol. 1999;126(3):673-680. (PubMed)
72. Fukao H, Ijiri Y, Miura M, et al. Effect of trans-resveratrol on the thrombogenicity and atherogenicity in apolipoprotein E-deficient and low-density lipoprotein receptor-deficient mice. Blood Coagul Fibrinolysis. 2004;15(6):441-446. (PubMed)
73. Wang Z, Zou J, Huang Y, Cao K, Xu Y, Wu JM. Effect of resveratrol on platelet aggregation in vivo and in vitro. Chin Med J (Engl). 2002;115(3):378-380. (PubMed)
74. Wilson T, Knight TJ, Beitz DC, Lewis DS, Engen RL. Resveratrol promotes atherosclerosis in hypercholesterolemic rabbits. Life Sci. 1996;59(1):PL15-21. (PubMed)
75. Li ZG, Hong T, Shimada Y, et al. Suppression of N-nitrosomethylbenzylamine (NMBA)-induced esophageal tumorigenesis in F344 rats by resveratrol. Carcinogenesis. 2002;23(9):1531-1536. (PubMed)
76. Tessitore L, Davit A, Sarotto I, Caderni G. Resveratrol depresses the growth of colorectal aberrant crypt foci by affecting bax and p21(CIP) expression. Carcinogenesis. 2000;21(8):1619-1622. (PubMed)
77. Banerjee S, Bueso-Ramos C, Aggarwal BB. Suppression of 7,12-dimethylbenz(a)anthracene-induced mammary carcinogenesis in rats by resveratrol: role of nuclear factor-kappaB, cyclooxygenase 2, and matrix metalloprotease 9. Cancer Res. 2002;62(17):4945-4954. (PubMed)
78. Hecht SS, Kenney PM, Wang M, et al. Evaluation of butylated hydroxyanisole, myo-inositol, curcumin, esculetin, resveratrol and lycopene as inhibitors of benzo(a)pyrene plus 4-(methylnitrosamino)-1-(3-pyridyl)-1-butanone-induced lung tumorigenesis in A/J mice. Cancer Lett. 1999;137(2):123-130. (PubMed)
79. Berge G, Ovrebo S, Eilertsen E, Haugen A, Mollerup S. Analysis of resveratrol as a lung cancer chemopreventive agent in A/J mice exposed to benzo(a)pyrene. Br J Cancer. 2004;91(7):1380-1383. (PubMed)
80. Ziegler CC, Rainwater L, Whelan J, McEntee MF. Dietary resveratrol does not affect intestinal tumorigenesis in Apc(Min/+) mice. J Nutr. 2004;134(1):5-10. (PubMed)
81. Schneider Y, Duranton B, Gosse F, Schleiffer R, Seiler N, Raul F. Resveratrol inhibits intestinal tumorigenesis and modulates host-defense-related gene expression in an animal model of human familial adenomatous polyposis. Nutr Cancer. 2001;39(1):102-107. (PubMed)
82. Sengottuvelan M, Nalini N. Dietary supplementation of resveratrol suppresses colonic tumour incidence in 1,2-dimethylhydrazine-treated rats by modulating biotransforming enzymes and aberrant crypt foci development. Br J Nutr. 2006;96(1):145-153. (PubMed)
83. Sengottuvelan M, Senthilkumar R, Nalini N. Modulatory influence of dietary resveratrol during different phases of 1,2-dimethylhydrazine induced mucosal lipid-peroxidation, antioxidant status and aberrant crypt foci development in rat colon carcinogenesis. Biochim Biophys Acta. 2006;1760(8):1175-1183. (PubMed)
84. Sengottuvelan M, Viswanathan P, Nalini N. Chemopreventive effect of trans-resveratrol--a phytoalexin against colonic aberrant crypt foci and cell proliferation in 1,2-dimethylhydrazine induced colon carcinogenesis. Carcinogenesis. 2006;27(5):1038-1046. (PubMed)
85. Baur JA, Sinclair DA. Therapeutic potential of resveratrol: the in vivo evidence. Nat Rev Drug Discov. 2006;5(6):493-506. (PubMed)
86. Heilbronn LK, Ravussin E. Calorie restriction and aging: review of the literature and implications for studies in humans. Am J Clin Nutr. 2003;78(3):361-369. (PubMed)
87. Lin SJ, Defossez PA, Guarente L. Requirement of NAD and SIR2 for life-span extension by calorie restriction in Saccharomyces cerevisiae. Science. 2000;289(5487):2126-2128. (PubMed)
88. Wood JG, Rogina B, Lavu S, et al. Sirtuin activators mimic caloric restriction and delay ageing in metazoans. Nature. 2004;430(7000):686-689. (PubMed)
89. Valenzano DR, Terzibasi E, Genade T, Cattaneo A, Domenici L, Cellerino A. Resveratrol prolongs lifespan and retards the onset of age-related markers in a short-lived vertebrate. Curr Biol. 2006;16(3):296-300. (PubMed)
90. Baur JA, Pearson KJ, Price NL, et al. Resveratrol improves health and survival of mice on a high-calorie diet. Nature. 2006;444(7117):337-342. (PubMed)
91. Barger JL, Kayo T, Vann JM, et al. A low dose of dietary resveratrol partially mimics caloric restriction and retards aging parameters in mice. PLoS One. 2008;3(6):e2264. (PubMed)
92. Burns J, Yokota T, Ashihara H, Lean ME, Crozier A. Plant foods and herbal sources of resveratrol. J Agric Food Chem. 2002;50(11):3337-3340. (PubMed)
93. Rimando AM, Kalt W, Magee JB, Dewey J, Ballington JR. Resveratrol, pterostilbene, and piceatannol in vaccinium berries. J Agric Food Chem. 2004;52(15):4713-4719. (PubMed)
94. Sanders TH, McMichael RW, Jr., Hendrix KW. Occurrence of resveratrol in edible peanuts. J Agric Food Chem. 2000;48(4):1243-1246. (PubMed)
95. Creasey LL, Coffee M. Phytoalexin production potential of grape berries. J Am Soc Hortic Sci. 1988;113(2):230-234.
96. Fremont L. Biological effects of resveratrol. Life Sci. 2000;66(8):663-673. (PubMed)
97. Goldberg DM, Karumanchiri A, Ng E, Yan J, Eleftherios P, Soleas G. Direct gas chromatographic-mass spectrometric method to assay cis-resveratrol in wines: preliminary survey of its concentration in commercial wines. J Agric Food Chem. 1995;43(5):1245-1250.
98. Burns J, Gardner PT, Matthews D, Duthie GG, Lean ME, Crozier A. Extraction of phenolics and changes in antioxidant activity of red wines during vinification. J Agric Food Chem. 2001;49(12):5797-5808. (PubMed)
99. Moreno-Labanda JF, Mallavia R, Perez-Fons L, Lizama V, Saura D, Micol V. Determination of piceid and resveratrol in Spanish wines deriving from Monastrell (Vitis vinifera L.) grape variety. J Agric Food Chem. 2004;52(17):5396-5403. (PubMed)
100. Romero-Perez AI, Lamuela-Raventos RM, Waterhouse AL, de la Torre-Boronat MC. Levels of cis- and trans-resveratrol and their glucosides in white and rosé Vitis vinifera wines from Spain. J Agric Food Chem. 1996;44(8):2124-2128.
101. Sobolev VS, Cole RJ. trans-resveratrol content in commercial peanuts and peanut products. J Agric Food Chem. 1999;47(4):1435-1439. (PubMed)
102. Hendler SS, Rorvik DR, eds. PDR for Nutritional Supplements. Montvale: Medical Economics Company, Inc; 2001.
103. Boocock DJ, Faust GE, Patel KR, et al. Phase I dose escalation pharmacokinetic study in healthy volunteers of resveratrol, a potential cancer chemopreventive agent. Cancer Epidemiol Biomarkers Prev. 2007;16(6):1246-1252. (PubMed)
104. Crowell JA, Korytko PJ, Morrissey RL, Booth TD, Levine BS. Resveratrol-associated renal toxicity. Toxicol Sci. 2004;82(2):614-619. (PubMed)
105. Juan ME, Vinardell MP, Planas JM. The daily oral administration of high doses of trans-resveratrol to rats for 28 days is not harmful. J Nutr. 2002;132(2):257-260. (PubMed)
106. American Academy of Pediatrics. Committee on Substance Abuse and Committee on Children With Disabilities. Fetal alcohol syndrome and alcohol-related neurodevelopmental disorders. Pediatrics. 2000;106(2 Pt 1):358-361. (PubMed)
107. Bertelli AA, Giovannini L, Giannessi D, et al. Antiplatelet activity of synthetic and natural resveratrol in red wine. Int J Tissue React. 1995;17(1):1-3. (PubMed)
108. Piver B, Berthou F, Dreano Y, Lucas D. Inhibition of CYP3A, CYP1A and CYP2E1 activities by resveratrol and other non volatile red wine components. Toxicol Lett. 2001;125(1-3):83-91. (PubMed)
109. Regev-Shoshani G, Shoseyov O, Kerem Z. Influence of lipophilicity on the interactions of hydroxy stilbenes with cytochrome P450 3A4. Biochem Biophys Res Commun. 2004;323(2):668-673. (PubMed)
大豆イソフラボン
目次
要約
- イソフラボンは、フィトエストロゲン(エストロゲン活性を有する植物由来の化合物)の一種である。ヒトの食事において、イソフラボンをもっとも豊富に含むものが大豆と大豆製品である。(詳細はこちら)
- 無作為化(比較)対照試験の結果として、50g/日の動物性タンパク質の摂取を大豆タンパク質に代えることによって、LDLコレステロールが、僅かに約3%弱減少することが示唆されている。精製した大豆イソフラボンを含むサプリメントでは、血清脂質プロファイルに良好な影響を及ぼす傾向はみられていない。(詳細はこちら)
- 一日あたり90mg未満の大豆イソフラボンの摂取は、骨吸収を妨げ、骨形成を活発化するかもしれない。(詳細はこちら)
- 概して、多くの観察研究の結果は、成人において大豆イソフラボンの高用量の摂取が乳がんを予防するという見解を支持していない。限られた研究にて、若い頃に大豆食品をより多く摂取することが、成人期における乳がんの危険性を減少させるかもしれないことが示唆されている。(詳細はこちら)
- 科学者は、大豆イソフラボンが前立腺ガンの進行を防ぐか、もしくは抑制する可能性について興味を抱いているが、観察研究において大豆イソフラボンが前立腺ガンを予防するという証拠は限られており、一貫性がない。(詳細はこちら)
- 現在までに、更年期症状に対する大豆イソフラボン摂取の影響に関する研究は、さまざまな結果が報告されている。(詳細はこちら)
- 大豆イソフラボンに関するいくつかの健康効果は、イソフラボンの代謝物質であるエクオールが生産されるかどうかに依存しているかもしれない。(詳細はこちら)
- 大豆や大豆製品を主とする食事は安全で潜在的に有益に見えるけれども、大豆イソフラボンのサプリメントを高用量、長期に渡って摂取したときの安全性はまだわかっていない。(詳細はこちら)
- 現在、大豆を主成分とする調製粉乳で育てられた幼児が、牛乳を主成分とする調製粉乳で育てられた幼児よりも、有害な影響を受けるリスクがより大きいという、確定的な証拠は全くない。(詳細はこちら)
序説
イソフラボンは、エストロゲン様の作用を有するポリフェノール化合物である。この理由から、それらはフィトエストロゲン(エストロゲン活性を有する植物由来の化合物)として分類される(1)。ヒトの食事においてイソフラボンをもっとも豊富に含むものが、豆類(特に大豆)である。大豆において、イソフラボンは配糖体(糖が結合した化合物)として存在する。 大豆または大豆製品の発酵や消化の過程において、イソフラボン配糖体から糖分子が遊離し、その結果、そのアグリコンであるイソフラボンが生じる。大豆イソフラボン配糖体は、ゲニスチン、ダイジン、グリシチンと呼ばれ、一方、それらのアグリコンはゲニステイン、ダイドゼイン、グリシテイン(Figure 1.イソフラボンのアグリコン部分の化学構造)と呼ばれる。特に明記しない限り、本稿に記載されている多くのイソフラボンの量は、その配糖体ではなく、アグリコンを指す。

代謝と生物学的利用能
大豆イソフラボンの生物学的影響はそれらの代謝に強く影響される。そして、大豆イソフラボンの代謝は、ヒトの腸に生息するバクテリアの活動に依存している(2)。たとえば、大豆イソフラボンのダイドゼインは、腸においてダイドゼインより高いエストロゲン様活性を有する代謝物質であるエクオールや若しくはより低いエストロゲン様活性を持つ他の代謝物質に代謝される可能性がある。大豆を摂取後に尿中に排出されるエクオールを測定する研究では、西洋人の約33%が、ダイドゼインをエクオールに代謝することが示されている(3)。このように、イソフラボンの代謝における個体差が、これらのフィトエストロゲンの生物活性と密接に関連する可能性がある。
生物活性
エストロゲン活性と抗エストロゲン活性
大豆イソフラボンは、エストロゲン様、あるいはホルモン様の弱い活性を有することが知られている。エストロゲンは、細胞内でエストロゲン受容体と結合することによって、効用を発揮するシグナル分子である(Figure 2)。エストロゲン受容体の複合体は、エストロゲン応答性遺伝子の発現を変化させるためにDNAと相互作用する。エストロゲン受容体は、再生に関連する組織以外にも、骨、肝臓、心臓と脳を含む数多くの組織中に存在する(4)。大豆イソフラボンと他のフィトエストロゲンは、エストロゲン受容体と結合することができる。そして、いくつかの組織ではエストロゲン様の効用を示し、また別の組織ではエストロゲンに対してアンタゴニス(阻害剤)として機能する(5)。再生組織中における抗エストロゲン効果が、ホルモン関連の癌(乳がん、子宮癌、前立腺癌)における危険性の低下を助けることが示唆されている。一方、他の組織におけるエストロゲン効果は、骨密度を維持し、血中脂質プロファイル(コレステロール値)の改善に役立つことも示唆されている。このような知見より、科学者は、フィトエストロゲンの組織選択的活性に興味を抱いている。ヒトにおいて、大豆イソフラボンが発揮するエストロゲン効果と抗エストロゲン効果の程度については、現在、かなり多くの科学的研究の焦点となっている。

エストロゲン受容体に依存しない活性
大豆イソフラボンとそれらの代謝物質は、エストロゲン受容体との相互作用と無関係な生物活性も有する(6)。大豆イソフラボンが、エストロゲン代謝に関係する特定の酵素による合成および活性を阻害することによって、内在性エストロゲンとアンドロゲンの生物活性を変えるかもしれない(7-9)。また、大豆イソフラボンは、チロシン・キナーゼ(細胞増殖を促進するシグナル経路で決定的な役割を果たす酵素)を阻害することがわかっている(10)。その上、イソフラボンは、in vitro 実験において抗酸化剤として機能することができる(11)。しかしながら、それらがヒトの抗酸化状態に貢献する程度については、まだ明白でない。一日あたり2mgのイソフラボンを含む大豆タンパク質を摂取させた場合より、一日あたり56mgのイソフラボンを含む大豆タンパク質を摂取させた場合のほうが、2週間後における血漿 F2-イソプロスタン(生体内における過酸化脂質のバイオマーカー)の値がかなり低下した(12)。しかしながら、50-100mgの精製した大豆イソフラボンを含むサプリメントの日々の摂取では、血漿または尿中の F2-イソプロスタンの値に有意な変化は確認されなかった(13,14)。
疾患予防
心血管疾患
血清コレステロール
1995年以前に実施された対照臨床試験にて、一日あたりに摂取する25-50gのタンパク質を動物性タンパク質から大豆タンパク質に代えることにより血清LDLコレステロール値がおよそ13%低下すると示唆された(15)。しかしながら、最近のより良い対照試験では、大豆タンパク質のLDLコレステロール低下効果はずっと小さいことが示されている。22例の無作為化対照試験に対する最近のレビューでは、一日あたりに摂取するタンパク質の50gを動物性タンパク質から大豆タンパク質に代えることにより、LDLコレステロールが約3%だけ低下すると結論づけている(16)。イソフラボンを含んでいない大豆タンパク質より、イソフラボンを含んでいる大豆タンパク質のほうがLDLコレステロールの低下により有効であるという証拠は限定的であるが(17,18)、しかし、大豆イソフラボンだけ(サプリメントや抽出物として)の摂取では、血清脂質プロファイルに良い影響を与えているようには見えない(16,19-21)。大豆タンパク質とコレステロールに関するさらなる情報については、「豆類」に関する項目を参照。
動脈の機能に対する影響
心血管疾患予防において、正常な動脈機能を維持することは、重要な役割を担っている。心血管疾患にかかる危険性が高い人々は、血管の内表面に沿って並んでいる内皮細胞から生産される一酸化窒素に応答して拡張する動脈の働き(内皮依存性血管拡張)が損なわれている(22)。現在までに実施された大豆イソフラボンの動脈機能に対する効用についての無作為化対照試験の結果は、まちまちである。しかしながら、閉経後の女性達に一日あたり最高80mgの大豆イソフラボン(23-25)、または最高60gのイソフラボン(26-30)を含む大豆タンパク質を補った、多くのプラセボ対照試験において、内皮依存性血管拡張についての顕著な改善は確認されなかった。動脈の硬さは、動脈機能のもう一つの基準である。動脈の硬さの測定は、動脈の伸展性を評価する。そして、動脈の硬さとアテローム性動脈硬化症の間の強い関係が認められている(31)。プラセボ対照臨床試験にて、3ヶ月間、40g/日の大豆タンパク質(118mg/日の大豆イソフラボンを含む)を摂取した男性および閉経後の女性においてみられた結果と同様に(29)、5週間の80mg/日の大豆イソフラボン抽出物をサプリメントとして摂取した閉経後の女性は、動脈の硬さが有意に低減した(32)。大部分の研究では、大豆タンパク質またはイソフラボンの補足が内皮依存性血管拡張を改善することを示していないが、予備段階の研究では、大豆イソフラボンのサプリメントの摂取が、動脈の硬さを低減させるかもしれないことを示唆している。しかしながら、最近実施された高血圧のヒトを対象とした無作為化対照・交差試験における、6ヶ月間の118mg/日のイソフラボンを含む大豆タンパク質の摂取では、動脈の硬さを含む動脈機能の測定において改善は確認されなかった(33)。大豆イソフラボンによるサプリメントが動脈の機能を向上させるかどうか決定するためには、さらなる研究が必要である。
ホルモンに関連する癌
乳癌
大豆食品から平均25〜50mg/日のイソフラボンを摂取するアジアにおける乳がん発生率は、西欧諸国において平均2mg/日未満のイソフラボンを摂取する非アジア系女性の乳がん発生率に比べて、より低い(34,35,36)。しかしながら、この違いには遺伝的要因や生活様式の違いなどの多くの要因が関与しているかもしれない。食事での大豆の摂取と乳がんに関する疫学的研究論文では、矛盾する結果が報告されている(豆類の項目参照)。2、3の研究では、思春期における、大豆のより高い摂取量が、将来の(37,38)乳がんになる危険性を低減させるかもしれないことが示唆されている(37,38)。現時点では、大豆イソフラボンのサプリメントを摂取ことが、乳がんの危険性を減少させるという証拠はほとんどない。大豆の消費と乳がんの危険性に関する、これ以上の情報については、豆類の項目を参照してください。
子宮内膜癌
子宮内膜(子宮の)癌の発達は、長期にわたるエストロゲン暴露(女性ホルモンの一種、プロゲステロンでバランスが取られていないため、エストロゲンが持続分泌している状態)に関連しているので、抗エストロゲン活性を有するフィトエストロゲンを多く摂取することで、子宮内膜癌を予防することができると提案されている(39)。この考えを支持し、3件の後ろ向き症例対照研究において、子宮内膜癌の女性が、癌でない対照群と比較して食品からの大豆イソフラボン摂取量が低いことが判明している(39-41)。しかしながら、閉経後の女性に対し、6ヶ月間、120mg/日のイソフラボンを含む大豆タンパク質を摂取させたが、外因性エストラジオールの投与によって誘発される子宮内膜増殖症を防ぐことができなかった(42)。症例対照研究において、大豆食品の消費と子宮内膜癌が逆相関することに関するいくつかの証拠が示唆されているが、大豆イソフラボンのサプリメントを摂取することが子宮内膜癌に罹るリスクを低減するという介入試験における証拠はない。
前立腺癌
米国の前立腺癌における死亡率は、日本や中国などのアジア諸国に比べて非常に高い。しかしながら、疫学的研究において大豆食品の高い摂取量が前立腺癌の発症リスクを低減するという確固たる証拠は示されていない。大豆食品と前立腺癌の危険性に関する詳細な情報については、豆類の項目を参照してください。細胞培養実験と動物実験において、大豆イソフラボンが前立腺癌の進行を抑制するという潜在的な効果が示唆されている(44)。前立腺癌を発症していない男性における最高1年間の大豆イソフラボン・サプリメントの摂取では、前立腺特異的抗原(PSA)の血清濃度の有意な低下はみられなかったが(45-47)、前立腺癌患者における2例の小規模な研究においては、大豆イソフラボン・サプリメントの摂取が、前立腺腫瘍の成長と関連する前立腺特異的抗原(PSA)の血清濃度の上昇を緩やかにするようである(48,49)。前立腺癌患者に関する1例の小規模、且つ、短期(<1ヵ月)の研究では、無作為に低フィトエストロゲン食(50)を摂った男性達と比較して、無作為に高フィトエストロゲン食を摂った男性達が、統計的に有意なPSA濃度の改善を示すことが明らかとなった(50)。PSA性再発前立腺癌の男性を対象とした豆乳サプリメント(141mg/日のイソフラボン)の摂取試験の結果、試験以前はPSA値が毎年56%増加していたのと比較して、12ヶ月以上の試験期間中では、平均20%程度の増加に留まっていたことが判明した(51)。2006年に発表されたレビューにおいて、前立腺癌患者に対するイソフラボン・サプリメントの摂取試験8例中4例において、PSA濃度において好ましい影響がみられたことが報告されている(52)。その上、最近の8つの研究のメタ解析において、イソフラボンの摂取が前立腺癌の危険性を低減することと関係していることがわかったが、しかし、その相関は統計的に有意でなかった(53)。このような予備調査結果は有望視されるが、大豆イソフラボン・サプリメントが前立腺癌の予防や治療に効能を有するか否かを決定するためには、現在進行中である、より大規模な無作為化対照試験の結果が必要である(54)。
骨粗鬆症
西洋人より、大豆食品を消費しているアジア人の方が、一般的に股関節部骨折率が低いことが知られているが、西洋人における大豆イソフラボンの消費を増やすことが骨粗鬆症を防止するのを助けるかどうかはまだ明らかではない(55)。大豆の摂取量の増加が骨形成と骨吸収の生化学的マーカーに及ぼす影響を評価するための短期臨床試験(6ヵ月以下)の結果は、矛盾している。閉経後の女性を対象としたいくつかの比較対照試験において、大豆食品、大豆タンパク質または大豆イソフラボンの摂取量を増やすことが、骨吸収と骨形成のマーカーを改善するか(56-59)、骨損失を減らすこと(59,60)が示唆されている。しかしながら、別の試験では、大豆の摂取量の増加が有意な利点を示すことはなかった(61-64)。大豆の摂取量の増加が骨密度(BMD)の低下や骨粗鬆症骨折を実際に防ぐことができるかどうかを確定するためには、より長期間の無作為化対照試験が必要である。2件の比較対照臨床試験において、イソフラボンを含んでいる大豆タンパク質のサプリメントを摂取した閉経後の女性が、同量のミルクタンパク質のサプリメントを摂取した場合よりも、6ヵ月にわたるBMD損失がかなり低いと示されている(62,65)。しかしながら、閉経後の女性を対象とした、より長期間の2つの試験では、イソフラボンを含んでいる大豆タンパク質のサプリメントを摂取した場合とミルクタンパク質を摂取した場合との間にBMD損失における有意差はみられなかった(66,67)。2年間の臨床試験の結果、イソフラボンを含有する豆乳を毎日摂取すると、イソフラボンを含まない豆乳を摂取した場合に比べて、腰椎におけるBMD損失をかなり減少させることが示された(68)。しかしながら、別の3つの試験では、イソフラボンを含有している大豆タンパク質のサプリメントを摂取した閉経後の女性と、イソフラボンを含まないか、もしくは極微量しか含まない大豆タンパク質のサプリメントを摂取した閉経後女性の間に、BDM損失における有意差はみられなかった(68-71)。80mg/日の精製した大豆イソフラボンを摂取した台湾の女性は、プラセボ群に比べて、1年間にわたって腰の骨密度の損失がより低かった。しかしながら、その有意差は、更年期から少なくとも4年経過していて、低体重であって、低いカルシウム摂取量の女性に限られていた(72)。台湾の女性におけるもう一つの研究において、1年間、100mg/日の精製した大豆イソフラボンを摂取した場合、対照群と比較して骨損失をより抑えることが示唆された。しかしながら、200mg/日のイソフラボンのサプリメントを摂取した女性では、全く効果がみられなかった(73)。さらに、ヨーロッパの閉経後の女性を対象とした無作為化対照試験において、1年間、イソフラボンを多く含む食物(110mg/日のイソフラボン)のサプリメントを摂取しても、BMDに有意な影響を及ぼさないことが示されている。最近行われた、60才以上の閉経後の女性を対象とした1年間のプラセボ対照試験では、大豆タンパク質(18g/日)、イソフラボン(105mg/日)、それら単独あるいは併用で、BMDに全く影響を及ぼさないことが示されている(75)。現在までの研究結果は矛盾しているが、しかしながら、近年報告された9件の無作為化対照試験(試験期間、1〜12ヵ月)のメタ解析では、<90mg/日の量での大豆イソフラボンの摂取は、骨吸収を妨げて、骨形成を促すと結論している(76)。一部の著者は、大豆イソフラボンが骨の健康に与える効果は、被験者がイソフラボン代謝物質であるエクオール(上記の代謝とバイオアベイラビリティーの項目参照)を生産するかどうかに依存していると、提案している(77-80)。このことにより、臨床試験間における異なる結果を説明することができるかもしれない。このように、イソフラボンの豊富な食事が骨の損失を防ぐ効果を有するという証拠がいくつかあるが、一方、大豆イソフラボンの摂取量を増やすことが、骨粗鬆症や骨粗鬆症骨折の危険性を低減させるかどうかは明瞭ではない。
認知機能低下
大豆イソフラボンの認知機能への影響に関する科学的な研究は十分ではない。大豆の摂取と認知機能の関係について、中年の時期に少なくとも一週間に2回は豆腐を食べていたというハワイの人たちは、週に1回以下しか食べなかったという人よりも、20-25年後の認知機能テストでは悪いスコアを示しているようだということを調べた観察研究がある(81)。また、老齢の男女に関するインドネシアの研究では、豆腐の摂取は記憶力を悪くする方向に働いており、テンペ(tempe)の摂取は記憶力を改善する方向に働いていた(82)。一方、閉経後の女性に対するいくつかの小規模な臨床試験では、大豆イソフラボンの摂取増加はいくつかの認知機能テストにおける成績の緩やかな改善を6か月間にわたり引き起こしていたかも知れないとしている。60 mg/日のイソフラボンを6-12週間投与された閉経後の女性グループは、絵を覚えているかという認知機能テスト(短期間の記憶力)、反転学習則テスト(learning rule reversals、思考力の柔軟性)、仕事を計画的に行う能力において、プラセボを投与された女性グループよりも良い結果を示した(83,84)。もっと長期の試験としては、6カ月間110 mg/日のイソフラボンのサプリメントを与えられた閉経後の女性グループは、プラセボを与えられた女性グループよりも話し方が流暢になった(85)。6カ月間の交叉試験において、60 mg/日のイソフラボンを投与された女性グループは、プラセボを投与された女性グループよりも、認知能力および全体的な雰囲気の面で大きな改善が見られた(86)。しかしながら、より大規模なプラセボ対照試験では、80mg/日のイソフラボンを6カ月間、あるいは99 mg/日のイソフラボンを1年間投与された閉経後の女性グループでは、記憶力、注意力、話し方の流暢性、動きのコントロール、知能障害を含めた一連の認知機能テストの面で効果は見られなかった(67,87)。最近の8例の試験結果(そのうちの7例が閉経後の女性に対する試験であるが)に関するレビューでは、その半数がイソフラボンの処方は認知機能の改善に関連していたと報告している(88)。
疾患治療
更年期症状
ほてり(Hot flushes, flashes)というのは、女性が更年期症状に関して医師の診察を受けることになる主たるきっかけである(89)。ホルモン置換療法に対する強い副作用の心配(90,91)が、更年期症状を経験している女性における植物エストロゲンサプリメント利用に対する関心の高まりにつながっている(92)。ほてりの頻度が増えるにつれて大豆イソフラボンの摂取量を増したときの影響が、多くの無作為化対照試験で調べられている(93-95)。これまでに、そのような試験に対するレビューが少なくとも4件報告されている。2002年に発表されたレビューでは、大豆食品に関する8件の無作為化対照試験のうち1件のみで、ほてりの頻度が有意に減少しており、大豆イソフラボン抽出物に関する5件の対照試験のうち3件で、ほてりの頻度の有意な減少が報告されている(96)。一般に、観測された、いずれの減少もプラセボと比較してやや低いという程度の値(10〜20%)であった。2004年に、10例の無作為化対照試験について調べた系統的レビューでは、4例でのみ、ほてりのような更年期症状の治療における大豆イソフラボン抽出物の有効性が報告されていることを明らかにした(95)。さらに最近になって、もう一つの系統的レビューと12例の無作為化対照試験のメタ解析により、大豆イソフラボンの投与がほてりの回数をわずかではあるが減少させることと関連していることが明らかにされた。この分析において、毎日のほてりの回数が多い女性ほどイソフラボン療法により症状が軽減されていることがわかった(94)。様々な試験について、サプリメントに含まれる特異的なイソフラボンにより分析したレビューで、主としてゲニステインを含むサプリメントの使用が、ほてりの症状を軽減させることが明らかになった(97)。興味深いことに、最近の研究では、イソフラボン代謝産物、エクオール(上記の代謝とバイオアベイラビリティを参照)を産生している女性、すなわちイソフラボン代謝産物が尿中に検出された女性のみが、大豆イソフラボンサプリメントを飲んだ後に、ほてりなどの更年期症状の軽減を経験していたことがわかった(98)。特に乳がんからの生存者は、乳がんの再発を予防することを目的とした治療法によって、より頻繁、且つ深刻なほてりを経験しているかも知れない(99)。しかし、乳がん生存者における無作為化対照試験では、いずれも、大豆イソフラボンの投与がプラセボよりも有意に、ほてりの頻度や重症度を軽減するという効果が認められなかった(100-103)。現在まで、更年期症状に対する大豆イソフラボン摂取の効果に関する研究では、いろいろと交錯する結果が報告されている。
供給源
食料源
イソフラボンは多数の豆類、穀物、野菜の中に少量づつ存在するが、大豆は人間の食物の中では最も濃厚なイソフラボン源である(104,105)。最近の調査では、日本、中国および他のアジア諸国における食物からの平均的なイソフラボン摂取量は、25-50 mg /日の範囲であると報告されている(34)。欧米諸国における食物からのイソフラボンの摂取量はかなり低く、平均的なイソフラボン摂取量は2 mg /日と報告されている(35,36)。アジアにおける大豆を原料とする伝統的な食品としては、豆腐、テンペ、味噌、納豆などがある。枝豆は大豆の品種に入り、収穫されたら緑色の段階で食べられている。欧米諸国で人気を集めている大豆製品は、大豆ベースの肉代替品、豆乳、大豆チーズ、大豆ヨーグルトである。大豆タンパク質分離物のイソフラボン含有量は、その分離方法に依存する。一般的に、エタノール洗浄プロセスによって分離された大豆タンパク質では大部分のイソフラボンが除去されているが、水による洗浄プロセスによって分離されたものでは残っている傾向がある(106)。大豆イソフラボンが豊富ないくつかの食品については、イソフラボン含有量とともに表1にリストアップされている(107)。大豆食品のイソフラボン含有量は、ブランド間で、あるいは同じブランドであっても異なるロット間で大幅に異なり得るので、これらの値はあくまで目安として見なければならない(106)。大豆イソフラボンの豊富な食物が健康に役立つ可能性があるのならば、大豆食品中の大豆イソフラボンの含有量の正確、且つ首尾一貫した表示が必要である。食品中のイソフラボン含有量の詳細情報については、米国農務省の栄養データ研究所(USDA nutrient data laboratory)から入手可能である。
| 食品 | サービング(1食分) | 全イソフラボン(mg) | ダイゼイン(mg) | ゲニステイン(mg) | |
|---|---|---|---|---|---|
| 大豆タンパク質濃縮物 | 3.5オンス | 94.6 | 38.2 | 52.8 | |
| 大豆タンパク質濃縮物(アルコール洗浄) | 3.5オンス | 11.5 | 5.8 | 5.3 | |
| ミソ | ½カップ | 57 | 22.6 | 32 | |
| 茹でた大豆 | ½カップ | 56 | 26.5 | 26.9 | |
| テンペ | 3オンス | 51.5 | 19.3 | 30.7 | |
| 大豆(乾燥焼き) | 1オンス | 41.6 | 17.4 | 21.2 | |
| 豆乳 | 1カップ | 6.2 | 2.4 | 3.7 | |
| 豆腐ヨーグルト | ½カップ | 21.3 | 7.5 | 12.3 | |
| 豆腐 | 3オンス | 19.2 | 8.1 | 10.1 | |
| 大豆ホットドッグ | 1つ | 11 | 3 | 6 | |
| 大豆ソーセージ | 3本 | 10.8 | 3.3 | 6.9 | |
| 大豆チーズ、モッツァレッラ | 1オンス | 1.9 | 0.5 | 0.6 | |
| *大豆食品のイソフラボン含有量は、銘柄の違いや、同一銘柄であってもロットの違いにより、大豆食品に含まれるイソフラボン量は大きく左右される(106);そのため、これらの値は、ある指標として利用されるべきものである。 | |||||
サプリメント
大豆イソフラボン抽出物製品やサプリメントは、米国では栄養補助食品として処方箋なしで利用可能である。これらの製品は標準化されておらず、販売されている大豆イソフラボンの量は大幅に異なっている。また、一部の製品では品質管理も問題である(108)。米国で販売されているイソフラボンサプリメント中のイソフラボン含有量について中立の研究所で試験した結果、試験した製品の約50%で製品中のイソフラボン含有量は、ラベルに書かれている量と10%以上異なっていた(109)。
乳児用調製粉乳
大豆ベースの乳児用調製粉乳は、大豆タンパク質分離物から作られており、かなりの量の大豆イソフラボンを含んでいる。 1997年、米国で市販されている大豆ベースの乳児用調製粉乳の総イソフラボン含有量は、32-47mg/L(〜34液量オンス)であった(110)。
(以下、翻訳者は表の各欄を個別に訳してるので、そのまま記載します。 倉田 )
安全性
大豆イソフラボンは、人間によって大豆ベースの食べ物の一部として副作用の徴候もなく長い間消費されてきた(105)。いくつかのアジアの諸国では、食餌中にイソフラボンを摂取している人の75パーセントは、65 mg /日以上も摂取していることが報告されている(111)。大豆または大豆含有製品を多く含んでいる食物は、安全で且つ、基本的に有益であると思われるが、大豆イソフラボンを長期的に多量に摂り続けることの安全性はまだ知られていない。ある一つの研究では、高齢の男性と女性が大豆イソフラボンを毎日100mg、6ヶ月間摂取しても、何も問題はなかった(112)。しかし、イソフラボンの安全性を評価するためには、長期間の研究がさらに必要である。
副作用
乳癌生存者のための安全
乳癌生存者に対する大豆イソフラボンや他の植物性エストロゲンの多量摂取に関する安全性は、科学者や臨床医の間でかなりの議論の余地がある領域である(99,113)。乳がんの再発および乳癌患者に対する大豆イソフラボンの多量摂取の効果については、まだ十分に検討されてきていない。細胞培養と動物実験の結果は相反しているが、ある研究者は大豆イソフラボンが、エストロゲン受容体陽性(ER +)の乳癌細胞(114,115)の増殖を促進することを報告している。大豆イソフラボンやゲニステインの多量摂取は、マウスに移植したER +乳癌細胞の増殖を阻害するタモキシフェンの活性を阻害したが(116)、同様の効果がヒトでも見られるかどうかは知られていない。最近の中国における5042人の女性の乳癌生存者に対して、3.9年間(中央値)にわたり追跡した前向き研究では、イソフラボンが豊富な大豆食品の摂取は、死亡リスクの29%の低減、及び、再発リスクの32%の低減と有意に関連していることを示した(117)。その研究では、大豆イソフラボンの摂取は死亡のリスクを有意ではないが21%減少させること、および癌の再発のリスクを有意に23%減少させることと関連していることが示された(117)。非常に限られた臨床試験データではあるが、大豆イソフラボンの多量の摂取(38-45 mg /日)は、人間の乳房組織中でエストロゲン作用を発揮することを示唆している(118,119)。しかし、乳癌の女性における生検で確認された結果では、大豆イソフラボンを取らなかった対照群と比較したところ、200 mg /日の大豆イソフラボンを補給した場合、手術前の2-6週間に亘って腫瘍の成長が見られなかった(120)。これらの与えられた利用可能データからは、一部の専門家は乳癌、特にER +乳癌の既往歴のある女性は、大豆イソフラボンを含む植物エストロゲンの摂取量を増やすべきではない、と思うだろう(99)。しかし別の専門家は、適度に大豆食品を摂取している乳癌生存者にそれをやめさせるだけの十分な証拠はないと言うだろうし(113)、上に述べた最近の研究(117)では、大豆食品の適度な摂取(11 g /日の大豆タンパク質)は乳癌生存者に有益であることさえも示している。このように矛盾する結果が出ていることから、乳癌生存者における多量の大豆イソフラボン摂取の安全性の確認には、さらに多くの研究が必要である。
大豆ベースの乳児用調製粉乳
大豆タンパク分離物から作られた乳児用調製粉乳は、1960年代半ばから市販されている(121)。米国で販売されている乳児用調製粉乳の25%は大豆ベースの調製粉乳である(122)。大豆ベースの調製粉乳を摂った乳幼児は、比較的多量のイソフラボンに曝され、それらを吸収・代謝するので、生殖能力や免疫機能だけでなく成長や発達の過程における潜在的・長期的な影響に対して関心が提起されている(110,123)。大豆ベースの調製粉乳を与えられた乳児と牛乳ベースの調製粉乳を与えられた乳児を比較した少なくとも6件の臨床試験の結果は、大豆ベースの調製粉乳は生後一年目の成長と発達度の面では正常であることを支持している(124)。母乳、牛乳ベースの調製粉乳、大豆ベースの調製粉乳で育てられた子供の将来に亘る成長と発達度を評価するための前向き研究が、アーカンソー州の児童栄養センターで現在進行中である。調査を開始して5年後でも、大豆ベースの調製粉乳の副作用は観察されていないし、また、それぞれのグループ間で成長と発達度についても差は見られていない(125)。さらに、20-34歳の男女811人に対する後ろ向き研究で、乳幼児の時期に大豆ベースの調製粉乳と牛乳ベースの調製粉乳で育てられた人の比較を行ったところ、大豆ベースの調製粉乳で育てられた女性の方が牛乳ベースで育てられた女性よりも有意に多量の喘息やアレルギー薬を利用していることが報告されたものの、身長、体重、思春期(成熟期)、一般的な健康状態、妊娠結果などの間には差が見られなかった(126)。アメリカ小児科学会(The American Academy of Pediatrics)は最近、大豆ベースの調製粉乳の使用のための指示および禁忌事項を説明する報告書を刊行した(122)。現時点では、大豆ベースの調製粉乳で育てられている乳児の方が、牛乳ベースの調製粉乳で育てられている乳児よりも大きな副作用の危険にさらされているという説得力のある証拠はない。しかし、大豆ベースの調製粉乳で育てられた乳児の成長と発達度に関する長期的な研究は現在でも進行中である(127,128)。
甲状腺機能
培養細胞および動物を用いた研究において、大豆イソフラボンは甲状腺ホルモンの合成にとって必要な酵素である甲状腺ペルオキシダーゼ活性を阻害することが見出されている(129,130)。しかし、大豆イソフラボンの多量摂取は、食物からのヨウ素の摂取量が十分である限り、甲状腺機能低下症のリスクを増大させるようには見えない(131)。1960年代に大豆ベースの調製粉乳にヨウ素が添加されて以来、大豆ベースの調製粉乳で育てられた乳児における甲状腺機能低下症の症例は全く報告されていない(132)。十分にヨウ素を摂取している閉経前と閉経後の女性を中心とするいくつかの臨床試験では、大豆イソフラボンの摂取量の増加が、体内の甲状腺ホルモンレベルに臨床的に有意な変化をもたらすという結果は得られていない(133-137)。
妊娠
現在までに、ヒトにおけるイソフラボンの豊富な食事が、胎児の発育や妊娠の結果に与える影響に関する研究は行われていないし、妊娠中のイソフラボン摂取の安全性についても確立されていない。
薬物との相互作用
大腸の細菌は大豆イソフラボンの代謝に重要な役割を果たすので、抗生物質療法が大腸の細菌の生物学的活性を低下させることもあり得る(138)。動物実験におけるいくつかの根拠から、大豆イソフラボン、特にゲニステインの多量摂取は、タモキシフェン(tamoxifen、Norvadex)の抗腫瘍効果を阻害する可能性があることが示唆されている (116)。人間における潜在的な相互作用について更に知見が得られるまでは、乳がんを治療または予防するためにタモキシフェンや他の選択的エストロゲン受容体モジュレーター類(SERMs)を服用している人達は、大豆タンパク質サプリメントまたはイソフラボン抽出物を摂取することは避けるべきである(「乳癌生存者のための安全」を参照)。大豆タンパク質の多量摂取は、抗凝固薬であるワーファリンの効果を妨げる可能性がある。 4週間にわたり毎日約16オンスの豆乳を飲用することにより、ワーファリンに特有のことであるが治療可能値以下のINR(プロトロンビン時間)になったという症例報告が1件ある(139)。豆乳を中止して二週間後、INR値は治療可能レベルに戻った。大豆ベースの調製粉乳で育てられた先天性甲状腺機能低下症の乳児においては、甲状腺ホルモンの代替物として必要なレボチロキシン(levothyroxine)の適正量が多くなることが分かっている(132,140)。レボチロキシンを服用しながら大豆タンパク質サプリメントを同時にとっている甲状腺機能低下症の成人においても、甲状腺ホルモンの代替物として必要とされるレボチロキシンの適正量が増加した(141)。
Authors and Reviewers
Originally written in 2004 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in January 2006 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in December 2009 by:
Victoria J. Drake, Ph.D.
Linus Pauling Institute
Oregon State University
Reviewed in December 2009 by:
Alison M. Duncan, Ph.D., R.D.
Associate Professor
Department of Human Health and Nutritional Sciences
University of Guelph
Guelph, Ontario, Canada
Copyright 2004-2024 Linus Pauling Institute
References
1. Lampe JW. Isoflavonoid and lignan phytoestrogens as dietary biomarkers. J Nutr. 2003;133 Suppl 3:956S-964S. (PubMed)
2. Rowland I, Faughnan M, Hoey L, Wahala K, Williamson G, Cassidy A. Bioavailability of phyto-oestrogens. Br J Nutr. 2003;89 Suppl 1:S45-58. (PubMed)
3. Setchell KD, Brown NM, Lydeking-Olsen E. The clinical importance of the metabolite equol-a clue to the effectiveness of soy and its isoflavones. J Nutr. 2002;132(12):3577-3584. (PubMed)
4. National Cancer Institute. Understanding Estrogen Receptors/SERMs. National Cancer Institute. January, 2005. http://www.cancer.gov/cancertopics/understandingcancer/estrogenreceptors.
5. Wang LQ. Mammalian phytoestrogens: enterodiol and enterolactone. J Chromatogr B Analyt Technol Biomed Life Sci. 2002;777(1-2):289-309. (PubMed)
6. Barnes S, Boersma B, Patel R, et al. Isoflavonoids and chronic disease: mechanisms of action. Biofactors. 2000;12(1-4):209-215. (PubMed)
7. Kao YC, Zhou C, Sherman M, Laughton CA, Chen S. Molecular basis of the inhibition of human aromatase (estrogen synthetase) by flavone and isoflavone phytoestrogens: A site-directed mutagenesis study. Environ Health Perspect. 1998;106(2):85-92. (PubMed)
8. Whitehead SA, Cross JE, Burden C, Lacey M. Acute and chronic effects of genistein, tyrphostin and lavendustin A on steroid synthesis in luteinized human granulosa cells. Hum Reprod. 2002;17(3):589-594. (PubMed)
9. Holzbeierlein JM, McIntosh J, Thrasher JB. The role of soy phytoestrogens in prostate cancer. Curr Opin Urol. 2005;15(1):17-22. (PubMed)
10. Akiyama T, Ishida J, Nakagawa S, et al. Genistein, a specific inhibitor of tyrosine-specific protein kinases. J Biol Chem. 1987;262(12):5592-5595. (PubMed)
11. Ruiz-Larrea MB, Mohan AR, Paganga G, Miller NJ, Bolwell GP, Rice-Evans CA. Antioxidant activity of phytoestrogenic isoflavones. Free Radic Res. 1997;26(1):63-70. (PubMed)
12. Wiseman H, O'Reilly JD, Adlercreutz H, et al. Isoflavone phytoestrogens consumed in soy decrease F(2)-isoprostane concentrations and increase resistance of low-density lipoprotein to oxidation in humans. Am J Clin Nutr. 2000;72(2):395-400. (PubMed)
13. Hodgson JM, Puddey IB, Croft KD, Mori TA, Rivera J, Beilin LJ. Isoflavonoids do not inhibit in vivo lipid peroxidation in subjects with high-normal blood pressure. Atherosclerosis. 1999;145(1):167-172. (PubMed)
14. Djuric Z, Chen G, Doerge DR, Heilbrun LK, Kucuk O. Effect of soy isoflavone supplementation on markers of oxidative stress in men and women. Cancer Lett. 2001;172(1):1-6. (PubMed)
15. Anderson JW, Johnstone BM, Cook-Newell ME. Meta-analysis of the effects of soy protein intake on serum lipids. N Engl J Med. 1995;333(5):276-282. (PubMed)
16. Sacks FM, Lichtenstein A, Van Horn L, Harris W, Kris-Etherton P, Winston M. Soy protein, isoflavones, and cardiovascular health: an American Heart Association Science Advisory for professionals from the Nutrition Committee. Circulation. 2006;113(7):1034-1044. (PubMed)
17. Zhan S, Ho SC. Meta-analysis of the effects of soy protein containing isoflavones on the lipid profile. Am J Clin Nutr. 2005;81(2):397-408. (PubMed)
18. Zhuo XG, Melby MK, Watanabe S. Soy isoflavone intake lowers serum LDL cholesterol: a meta-analysis of 8 randomized controlled trials in humans. J Nutr. 2004;134(9):2395-2400. (PubMed)
19. Lichtenstein AH, Jalbert SM, Adlercreutz H, et al. Lipoprotein response to diets high in soy or animal protein with and without isoflavones in moderately hypercholesterolemic subjects. Arterioscler Thromb Vasc Biol. 2002;22(11):1852-1858. (PubMed)
20. Weggemans RM, Trautwein EA. Relation between soy-associated isoflavones and LDL and HDL cholesterol concentrations in humans: a meta-analysis. Eur J Clin Nutr. 2003;57(8):940-946. (PubMed)
21. Dewell A, Hollenbeck PL, Hollenbeck CB. Clinical review: a critical evaluation of the role of soy protein and isoflavone supplementation in the control of plasma cholesterol concentrations. J Clin Endocrinol Metab. 2006;91(3):772-780. (PubMed)
22. Landmesser U, Hornig B, Drexler H. Endothelial function: a critical determinant in atherosclerosis? Circulation. 2004;109(21 Suppl 1):II27-33. (PubMed)
23. Squadrito F, Altavilla D, Crisafulli A, et al. Effect of genistein on endothelial function in postmenopausal women: a randomized, double-blind, controlled study. Am J Med. 2003;114(6):470-476. (PubMed)
24. Simons LA, von Konigsmark M, Simons J, Celermajer DS. Phytoestrogens do not influence lipoprotein levels or endothelial function in healthy, postmenopausal women. Am J Cardiol. 2000;85(11):1297-1301. (PubMed)
25. Katz DL, Evans MA, Njike VY, et al. Raloxifene, soy phytoestrogens and endothelial function in postmenopausal women. Climacteric. 2007;10(6):500-507. (PubMed)
26. Kreijkamp-Kaspers S, Kok L, Bots ML, Grobbee DE, Lampe JW, van der Schouw YT. Randomized controlled trial of the effects of soy protein containing isoflavones on vascular function in postmenopausal women. Am J Clin Nutr. 2005;81(1):189-195. (PubMed)
27. Steinberg FM, Guthrie NL, Villablanca AC, Kumar K, Murray MJ. Soy protein with isoflavones has favorable effects on endothelial function that are independent of lipid and antioxidant effects in healthy postmenopausal women. Am J Clin Nutr. 2003;78(1):123-130. (PubMed)
28. Blum A, Lang N, Vigder F, et al. Effects of soy protein on endothelium-dependent vasodilatation and lipid profile in postmenopausal women with mild hypercholesterolemia. Clin Invest Med. 2003;26(1):20-26. (PubMed)
29. Teede HJ, Dalais FS, Kotsopoulos D, Liang YL, Davis S, McGrath BP. Dietary soy has both beneficial and potentially adverse cardiovascular effects: a placebo-controlled study in men and postmenopausal women. J Clin Endocrinol Metab. 2001;86(7):3053-3060. (PubMed)
30. Evans M, Njike VY, Hoxley M, Pearson M, Katz DL. Effect of soy isoflavone protein and soy lecithin on endothelial function in healthy postmenopausal women. Menopause. 2007;14(1):141-149. (PubMed)
31. van Popele NM, Grobbee DE, Bots ML, et al. Association between arterial stiffness and atherosclerosis: the Rotterdam Study. Stroke. 2001;32(2):454-460. (PubMed)
32. Nestel PJ, Yamashita T, Sasahara T, et al. Soy isoflavones improve systemic arterial compliance but not plasma lipids in menopausal and perimenopausal women. Arterioscler Thromb Vasc Biol. 1997;17(12):3392-3398. (PubMed)
33. Teede HJ, Giannopoulos D, Dalais FS, Hodgson J, McGrath BP. Randomised, controlled, cross-over trial of soy protein with isoflavones on blood pressure and arterial function in hypertensive subjects. J Am Coll Nutr. 2006;25(6):533-540. (PubMed)
34. Messina M, Nagata C, Wu AH. Estimated Asian adult soy protein and isoflavone intakes. Nutr Cancer. 2006;55(1):1-12. (PubMed)
35. van Erp-Baart MA, Brants HA, Kiely M, et al. Isoflavone intake in four different European countries: the VENUS approach. Br J Nutr. 2003;89 Suppl 1:S25-30. (PubMed)
36. de Kleijn MJ, van der Schouw YT, Wilson PW, et al. Intake of dietary phytoestrogens is low in postmenopausal women in the United States: the Framingham study(1-4). J Nutr. 2001;131(6):1826-1832. (PubMed)
37. Shu XO, Jin F, Dai Q, et al. Soyfood intake during adolescence and subsequent risk of breast cancer among Chinese women. Cancer Epidemiol Biomarkers Prev. 2001;10(5):483-488. (PubMed)
38. Wu AH, Wan P, Hankin J, Tseng CC, Yu MC, Pike MC. Adolescent and adult soy intake and risk of breast cancer in Asian-Americans. Carcinogenesis. 2002;23(9):1491-1496. (PubMed)
39. Horn-Ross PL, John EM, Canchola AJ, Stewart SL, Lee MM. Phytoestrogen intake and endometrial cancer risk. J Natl Cancer Inst. 2003;95(15):1158-1164. (PubMed)
40. Goodman MT, Wilkens LR, Hankin JH, Lyu LC, Wu AH, Kolonel LN. Association of soy and fiber consumption with the risk of endometrial cancer. Am J Epidemiol. 1997;146(4):294-306. (PubMed)
41. Xu WH, Zheng W, Xiang YB, et al. Soya food intake and risk of endometrial cancer among Chinese women in Shanghai: population based case-control study. BMJ. 2004;328(7451):1285. (PubMed)
42. Murray MJ, Meyer WR, Lessey BA, Oi RH, DeWire RE, Fritz MA. Soy protein isolate with isoflavones does not prevent estradiol-induced endometrial hyperplasia in postmenopausal women: a pilot trial. Menopause. 2003;10(5):456-464. (PubMed)
43. Messina MJ. Emerging evidence on the role of soy in reducing prostate cancer risk. Nutr Rev. 2003;61(4):117-131. (PubMed)
44. Steiner C, Arnould S, Scalbert A, Manach C. Isoflavones and the prevention of breast and prostate cancer: new perspectives opened by nutrigenomics. Br J Nutr. 2008;99 E Suppl 1:ES78-108. (PubMed)
45. Adams KF, Chen C, Newton KM, Potter JD, Lampe JW. Soy isoflavones do not modulate prostate-specific antigen concentrations in older men in a randomized controlled trial. Cancer Epidemiol Biomarkers Prev. 2004;13(4):644-648. (PubMed)
46. Jenkins DJ, Kendall CW, D'Costa MA, et al. Soy consumption and phytoestrogens: effect on serum prostate specific antigen when blood lipids and oxidized low-density lipoprotein are reduced in hyperlipidemic men. J Urol. 2003;169(2):507-511. (PubMed)
47. Urban D, Irwin W, Kirk M, et al. The effect of isolated soy protein on plasma biomarkers in elderly men with elevated serum prostate specific antigen. J Urol. 2001;165(1):294-300. (PubMed)
48. Fischer L, Mahoney C, Jeffcoat AR, et al. Clinical characteristics and pharmacokinetics of purified soy isoflavones: multiple-dose administration to men with prostate neoplasia. Nutr Cancer. 2004;48(2):160-170. (PubMed)
49. Hussain M, Banerjee M, Sarkar FH, et al. Soy isoflavones in the treatment of prostate cancer. Nutr Cancer. 2003;47(2):111-117. (PubMed)
50. Dalais FS, Meliala A, Wattanapenpaiboon N, et al. Effects of a diet rich in phytoestrogens on prostate-specific antigen and sex hormones in men diagnosed with prostate cancer. Urology. 2004;64(3):510-515. (PubMed)
51. Pendleton JM, Tan WW, Anai S, et al. Phase II trial of isoflavone in prostate-specific antigen recurrent prostate cancer after previous local therapy. BMC Cancer. 2008;8:132. (PubMed)
52. Messina M, Kucuk O, Lampe JW. An overview of the health effects of isoflavones with an emphasis on prostate cancer risk and prostate-specific antigen levels. J AOAC Int. 2006;89(4):1121-1134. (PubMed)
53. Yan L, Spitznagel EL. Soy consumption and prostate cancer risk in men: a revisit of a meta-analysis. Am J Clin Nutr. 2009;89(4):1155-1163. (PubMed)
54. Goetzl MA, Van Veldhuizen PJ, Thrasher JB. Effects of soy phytoestrogens on the prostate. Prostate Cancer Prostatic Dis. 2007;10(3):216-223. (PubMed)
55. Setchell KD, Lydeking-Olsen E. Dietary phytoestrogens and their effect on bone: evidence from in vitro and in vivo, human observational, and dietary intervention studies. Am J Clin Nutr. 2003;78(3 Suppl):593S-609S. (PubMed)
56. Chiechi LM, Secreto G, D'Amore M, et al. Efficacy of a soy rich diet in preventing postmenopausal osteoporosis: the Menfis randomized trial. Maturitas. 2002;42(4):295-300. (PubMed)
57. Scheiber MD, Liu JH, Subbiah MT, Rebar RW, Setchell KD. Dietary inclusion of whole soy foods results in significant reductions in clinical risk factors for osteoporosis and cardiovascular disease in normal postmenopausal women. Menopause. 2001;8(5):384-392. (PubMed)
58. Arjmandi BH, Khalil DA, Smith BJ, et al. Soy protein has a greater effect on bone in postmenopausal women not on hormone replacement therapy, as evidenced by reducing bone resorption and urinary calcium excretion. J Clin Endocrinol Metab. 2003;88(3):1048-1054. (PubMed)
59. Harkness LS, Fiedler K, Sehgal AR, Oravec D, Lerner E. Decreased bone resorption with soy isoflavone supplementation in postmenopausal women. J Womens Health (Larchmt). 2004;13(9):1000-1007. (PubMed)
60. Ye YB, Tang XY, Verbruggen MA, Su YX. Soy isoflavones attenuate bone loss in early postmenopausal Chinese women : a single-blind randomized, placebo-controlled trial. Eur J Nutr. 2006;45(6):327-334. (PubMed)
61. Wangen KE, Duncan AM, Merz-Demlow BE, et al. Effects of soy isoflavones on markers of bone turnover in premenopausal and postmenopausal women. J Clin Endocrinol Metab. 2000;85(9):3043-3048. (PubMed)
62. Alekel DL, Germain AS, Peterson CT, Hanson KB, Stewart JW, Toda T. Isoflavone-rich soy protein isolate attenuates bone loss in the lumbar spine of perimenopausal women. Am J Clin Nutr. 2000;72(3):844-852. (PubMed)
63. Dalais FS, Ebeling PR, Kotsopoulos D, McGrath BP, Teede HJ. The effects of soy protein containing isoflavones on lipids and indices of bone resorption in postmenopausal women. Clin Endocrinol (Oxf). 2003;58(6):704-709. (PubMed)
64. Cheong JM, Martin BR, Jackson GS, et al. Soy isoflavones do not affect bone resorption in postmenopausal women: a dose-response study using a novel approach with 41Ca. J Clin Endocrinol Metab. 2007;92(2):577-582. (PubMed)
65. Potter SM, Baum JA, Teng H, Stillman RJ, Shay NF, Erdman JW, Jr. Soy protein and isoflavones: their effects on blood lipids and bone density in postmenopausal women. Am J Clin Nutr. 1998;68(6 Suppl):1375S-1379S. (PubMed)
66. Arjmandi BH, Lucas EA, Khalil DA, et al. One year soy protein supplementation has positive effects on bone formation markers but not bone density in postmenopausal women. Nutr J. 2005;4(1):8. (PubMed)
67. Kreijkamp-Kaspers S, Kok L, Grobbee DE, et al. Effect of soy protein containing isoflavones on cognitive function, bone mineral density, and plasma lipids in postmenopausal women: a randomized controlled trial. JAMA. 2004;292(1):65-74. (PubMed)
68. Lydeking-Olsen E, Beck-Jensen JE, Setchell KD, Holm-Jensen T. Soymilk or progesterone for prevention of bone loss--a 2 year randomized, placebo-controlled trial. Eur J Nutr. 2004;43(4):246-257. (PubMed)
69. Gallagher JC, Satpathy R, Rafferty K, Haynatzka V. The effect of soy protein isolate on bone metabolism. Menopause. 2004;11(3):290-298. (PubMed)
70. Vitolins M, Anthony M, Lenschik L, Bland DR, Burke GL. Does soy protein and its isoflavones prevent bone loss in peri- and post-menopausal women? Results of a two year randomized clinical trial. J Nutr. 2002;132:582S (abstract).
71. Newton KM, LaCroix AZ, Levy L, et al. Soy protein and bone mineral density in older men and women: a randomized trial. Maturitas. 2006;55(3):270-277. (PubMed)
72. Chen YM, Ho SC, Lam SS, Ho SS, Woo JL. Beneficial effect of soy isoflavones on bone mineral content was modified by years since menopause, body weight, and calcium intake: a double-blind, randomized, controlled trial. Menopause. 2004;11(3):246-254. (PubMed)
73. Huang HY, Yang HP, Yang HT, Yang TC, Shieh MJ, Huang SY. One-year soy isoflavone supplementation prevents early postmenopausal bone loss but without a dose-dependent effect. J Nutr Biochem. 2006;17(8):509-517. (PubMed)
74. Brink E, Coxam V, Robins S, Wahala K, Cassidy A, Branca F. Long-term consumption of isoflavone-enriched foods does not affect bone mineral density, bone metabolism, or hormonal status in early postmenopausal women: a randomized, double-blind, placebo controlled study. Am J Clin Nutr. 2008;87(3):761-770. (PubMed)
75. Kenny AM, Mangano KM, Abourizk RH, et al. Soy proteins and isoflavones affect bone mineral density in older women: a randomized controlled trial. Am J Clin Nutr. 2009;90(1):234-242. (PubMed)
76. Ma DF, Qin LQ, Wang PY, Katoh R. Soy isoflavone intake inhibits bone resorption and stimulates bone formation in menopausal women: meta-analysis of randomized controlled trials. Eur J Clin Nutr. 2008;62(2):155-161. (PubMed)
77. Wu J, Oka J, Ezaki J, et al. Possible role of equol status in the effects of isoflavone on bone and fat mass in postmenopausal Japanese women: a double-blind, randomized, controlled trial. Menopause. 2007;14(5):866-874. (PubMed)
78. Vatanparast H, Chilibeck PD. Does the effect of soy phytoestrogens on bone in postmenopausal women depend on the equol-producing phenotype? Nutr Rev. 2007;65(6 Pt 1):294-299. (PubMed)
79. Ishimi Y. Soybean isoflavones in bone health. Forum Nutr. 2009;61:104-116. (PubMed)
80. Frankenfeld CL, McTiernan A, Thomas WK, et al. Postmenopausal bone mineral density in relation to soy isoflavone-metabolizing phenotypes. Maturitas. 2006;53(3):315-324. (PubMed)
81. White LR, Petrovitch H, Ross GW, et al. Brain aging and midlife tofu consumption. J Am Coll Nutr. 2000;19(2):242-255. (PubMed)
82. Hogervorst E, Sadjimim T, Yesufu A, Kreager P, Rahardjo TB. High tofu intake is associated with worse memory in elderly Indonesian men and women. Dement Geriatr Cogn Disord. 2008;26(1):50-57. (PubMed)
83. Duffy R, Wiseman H, File SE. Improved cognitive function in postmenopausal women after 12 weeks of consumption of a soya extract containing isoflavones. Pharmacol Biochem Behav. 2003;75(3):721-729. (PubMed)
84. File SE, Hartley DE, Elsabagh S, Duffy R, Wiseman H. Cognitive improvement after 6 weeks of soy supplements in postmenopausal women is limited to frontal lobe function. Menopause. 2005;12(2):193-201. (PubMed)
85. Kritz-Silverstein D, Von Muhlen D, Barrett-Connor E, Bressel MA. Isoflavones and cognitive function in older women: the SOy and Postmenopausal Health In Aging (SOPHIA) Study. Menopause. 2003;10(3):196-202. (PubMed)
86. Casini ML, Marelli G, Papaleo E, Ferrari A, D'Ambrosio F, Unfer V. Psychological assessment of the effects of treatment with phytoestrogens on postmenopausal women: a randomized, double-blind, crossover, placebo-controlled study. Fertil Steril. 2006;85(4):972-978. (PubMed)
87. Ho SC, Chan AS, Ho YP, et al. Effects of soy isoflavone supplementation on cognitive function in Chinese postmenopausal women: a double-blind, randomized, controlled trial. Menopause. 2007;14(3 Pt 1):489-499. (PubMed)
88. Zhao L, Brinton RD. WHI and WHIMS follow-up and human studies of soy isoflavones on cognition. Expert Rev Neurother. 2007;7(11):1549-1564. (PubMed)
89. Tice JA, Ettinger B, Ensrud K, Wallace R, Blackwell T, Cummings SR. Phytoestrogen supplements for the treatment of hot flashes: the Isoflavone Clover Extract (ICE) Study: a randomized controlled trial. JAMA. 2003;290(2):207-214. (PubMed)
90. Nelson HD, Humphrey LL, Nygren P, Teutsch SM, Allan JD. Postmenopausal hormone replacement therapy: scientific review. JAMA. 2002;288(7):872-881. (PubMed)
91. Farquhar C, Marjoribanks J, Lethaby A, Suckling JA, Lamberts Q. Long term hormone therapy for perimenopausal and postmenopausal women. Cochrane Database Syst Rev. 2009;(2):CD004143. (PubMed)
92. Nelson HD, Vesco KK, Haney E, et al. Nonhormonal therapies for menopausal hot flashes: systematic review and meta-analysis. JAMA. 2006;295(17):2057-2071. (PubMed)
93. Kronenberg F, Fugh-Berman A. Complementary and alternative medicine for menopausal symptoms: a review of randomized, controlled trials. Ann Intern Med. 2002;137(10):805-813. (PubMed)
94. Howes LG, Howes JB, Knight DC. Isoflavone therapy for menopausal flushes: a systematic review and meta-analysis. Maturitas. 2006;55(3):203-211. (PubMed)
95. Huntley AL, Ernst E. Soy for the treatment of perimenopausal symptoms--a systematic review. Maturitas. 2004;47(1):1-9. (PubMed)
96. Krebs EE, Ensrud KE, MacDonald R, Wilt TJ. Phytoestrogens for treatment of menopausal symptoms: a systematic review. Obstet Gynecol. 2004;104(4):824-836. (PubMed)
97. Williamson-Hughes PS, Flickinger BD, Messina MJ, Empie MW. Isoflavone supplements containing predominantly genistein reduce hot flash symptoms: a critical review of published studies. Menopause. 2006;13(5):831-839. (PubMed)
98. Jou HJ, Wu SC, Chang FW, Ling PY, Chu KS, Wu WH. Effect of intestinal production of equol on menopausal symptoms in women treated with soy isoflavones. Int J Gynaecol Obstet. 2008;102(1):44-49. (PubMed)
99. Duffy C, Cyr M. Phytoestrogens: potential benefits and implications for breast cancer survivors. J Womens Health (Larchmt). 2003;12(7):617-631. (PubMed)
100. MacGregor CA, Canney PA, Patterson G, McDonald R, Paul J. A randomised double-blind controlled trial of oral soy supplements versus placebo for treatment of menopausal symptoms in patients with early breast cancer. Eur J Cancer. 2005;41(5):708-714. (PubMed)
101. Nikander E, Kilkkinen A, Metsa-Heikkila M, et al. A randomized placebo-controlled crossover trial with phytoestrogens in treatment of menopause in breast cancer patients. Obstet Gynecol. 2003;101(6):1213-1220. (PubMed)
102. Van Patten CL, Olivotto IA, Chambers GK, et al. Effect of soy phytoestrogens on hot flashes in postmenopausal women with breast cancer: a randomized, controlled clinical trial. J Clin Oncol. 2002;20(6):1449-1455. (PubMed)
103. Quella SK, Loprinzi CL, Barton DL, et al. Evaluation of soy phytoestrogens for the treatment of hot flashes in breast cancer survivors: A North Central Cancer Treatment Group Trial. J Clin Oncol. 2000;18(5):1068-1074. (PubMed)
104. Fletcher RJ. Food sources of phyto-oestrogens and their precursors in Europe. Br J Nutr. 2003;89 Suppl 1:S39-43. (PubMed)
105. Munro IC, Harwood M, Hlywka JJ, et al. Soy isoflavones: a safety review. Nutr Rev. 2003;61(1):1-33. (PubMed)
106. Setchell KD, Cole SJ. Variations in isoflavone levels in soy foods and soy protein isolates and issues related to isoflavone databases and food labeling. J Agric Food Chem. 2003;51(14):4146-4155. (PubMed)
107. USDA-Iowa State University Isoflavones Database. United States Department of Agriculture [Web page]. March 15, 2002. http://www.nal.usda.gov/fnic/foodcomp/Data/isoflav/isoflav.html. Accessed April 14, 2004.
108. Chua R, Anderson K, Chen J, Hu M. Quality, labeling accuracy, and cost comparison of purified soy isoflavonoid products. J Altern Complement Med. 2004;10(6):1053-1060. (PubMed)
109. Setchell KD, Brown NM, Desai P, et al. Bioavailability of pure isoflavones in healthy humans and analysis of commercial soy isoflavone supplements. J Nutr. 2001;131(4 Suppl):1362S-1375S. (PubMed)
110. Setchell KD, Zimmer-Nechemias L, Cai J, Heubi JE. Isoflavone content of infant formulas and the metabolic fate of these phytoestrogens in early life. Am J Clin Nutr. 1998;68(6 Suppl):1453S-1461S. (PubMed)
111. Chen Z, Zheng W, Custer LJ, et al. Usual dietary consumption of soy foods and its correlation with the excretion rate of isoflavonoids in overnight urine samples among Chinese women in Shanghai. Nutr Cancer. 1999;33(1):82-87. (PubMed)
112. Gleason CE, Carlsson CM, Barnet JH, et al. A preliminary study of the safety, feasibility and cognitive efficacy of soy isoflavone supplements in older men and women. Age Ageing. 2009;38(1):86-93. (PubMed)
113. Messina MJ, Loprinzi CL. Soy for breast cancer survivors: a critical review of the literature. J Nutr. 2001;131(11 Suppl):3095S-3108S. (PubMed)
114. Allred CD, Allred KF, Ju YH, Virant SM, Helferich WG. Soy diets containing varying amounts of genistein stimulate growth of estrogen-dependent (MCF-7) tumors in a dose-dependent manner. Cancer Res. 2001;61(13):5045-5050. (PubMed)
115. Ju YH, Allred CD, Allred KF, Karko KL, Doerge DR, Helferich WG. Physiological concentrations of dietary genistein dose-dependently stimulate growth of estrogen-dependent human breast cancer (MCF-7) tumors implanted in athymic nude mice. J Nutr. 2001;131(11):2957-2962. (PubMed)
116. Ju YH, Doerge DR, Allred KF, Allred CD, Helferich WG. Dietary genistein negates the inhibitory effect of tamoxifen on growth of estrogen-dependent human breast cancer (MCF-7) cells implanted in athymic mice. Cancer Res. 2002;62(9):2474-2477. (PubMed)
117. Shu XO, Zheng Y, Cai H, et al. Soy food intake and breast cancer survival. JAMA. 2009;302(22):2437-2443.
118. Petrakis NL, Barnes S, King EB, et al. Stimulatory influence of soy protein isolate on breast secretion in pre- and postmenopausal women. Cancer Epidemiol Biomarkers Prev. 1996;5(10):785-794. (PubMed)
119. Hargreaves DF, Potten CS, Harding C, et al. Two-week dietary soy supplementation has an estrogenic effect on normal premenopausal breast. J Clin Endocrinol Metab. 1999;84(11):4017-4024. (PubMed)
120. Sartippour MR, Rao JY, Apple S, et al. A pilot clinical study of short-term isoflavone supplements in breast cancer patients. Nutr Cancer. 2004;49(1):59-65. (PubMed)
121. American Academy of Pediatrics Committee on Nutrition. Soy protein-based formulas: recommendations for use in infant feeding. Pediatrics. 1998;101(1 Pt 1):148-153. (PubMed)
122. Bhatia J, Greer F. Use of soy protein-based formulas in infant feeding. Pediatrics. 2008;121(5):1062-1068. (PubMed)
123. Setchell KD, Zimmer-Nechemias L, Cai J, Heubi JE. Isoflavone content of infant formulas and the metabolic fate of these phytoestrogens in early life. Am J Clin Nutr. 1998;68(6 Suppl):1453S-1461S. (PubMed)
124. Mendez MA, Anthony MS, Arab L. Soy-based formulae and infant growth and development: a review. J Nutr. 2002;132(8):2127-2130. (PubMed)
125. Badger TM, Gilchrist JM, Pivik RT, et al. The health implications of soy infant formula. Am J Clin Nutr. 2009;89(5):1668S-1672S. (PubMed)
126. Strom BL, Schinnar R, Ziegler EE, et al. Exposure to soy-based formula in infancy and endocrinological and reproductive outcomes in young adulthood. JAMA. 2001;286(7):807-814. (PubMed)
127. US Department of Agriculture, Agricultural Research Service. Study Examines Long-Term Health Effects of Soy Infant Formula. 2004. Available at: http://www.ars.usda.gov/is/AR/archive/jan04/soy0104.htm.
128. Turck D. Soy protein for infant feeding: what do we know? Curr Opin Clin Nutr Metab Care. 2007;10(3):360-365. (PubMed)
129. Divi RL, Chang HC, Doerge DR. Anti-thyroid isoflavones from soybean: isolation, characterization, and mechanisms of action. Biochem Pharmacol. 1997;54(10):1087-1096. (PubMed)
130. Doerge DR, Sheehan DM. Goitrogenic and estrogenic activity of soy isoflavones. Environ Health Perspect. 2002;110 Suppl 3:349-353. (PubMed)
131. Messina M, Redmond G. Effects of soy protein and soybean isoflavones on thyroid function in healthy adults and hypothyroid patients: a review of the relevant literature. Thyroid. 2006;16(3):249-258. (PubMed)
132. Chorazy PA, Himelhoch S, Hopwood NJ, Greger NG, Postellon DC. Persistent hypothyroidism in an infant receiving a soy formula: case report and review of the literature. Pediatrics. 1995;96(1 Pt 1):148-150. (PubMed)
133. Bruce B, Messina M, Spiller GA. Isoflavone supplements do not affect thyroid function in iodine-replete postmenopausal women. J Med Food. 2003;6(4):309-316. (PubMed)
134. Persky VW, Turyk ME, Wang L, et al. Effect of soy protein on endogenous hormones in postmenopausal women. Am J Clin Nutr. 2002;75(1):145-153. (PubMed)
135. Duncan AM, Merz BE, Xu X, Nagel TC, Phipps WR, Kurzer MS. Soy isoflavones exert modest hormonal effects in premenopausal women. J Clin Endocrinol Metab. 1999;84(1):192-197. (PubMed)
136. Duncan AM, Underhill KE, Xu X, Lavalleur J, Phipps WR, Kurzer MS. Modest hormonal effects of soy isoflavones in postmenopausal women. J Clin Endocrinol Metab. 1999;84(10):3479-3484. (PubMed)
137. Dillingham BL, McVeigh BL, Lampe JW, Duncan AM. Soy protein isolates of varied isoflavone content do not influence serum thyroid hormones in healthy young men. Thyroid. 2007;17(2):131-137. (PubMed)
138. Natural Medicines Comprehensive Database. Soy. 2004. Available at: http://www.naturaldatabase.com/monograph.asp?mono_id=975&brand_id=.
139. Cambria-Kiely JA. Effect of soy milk on warfarin efficacy. Ann Pharmacother. 2002;36(12):1893-1896. (PubMed)
140. Jabbar MA, Larrea J, Shaw RA. Abnormal thyroid function tests in infants with congenital hypothyroidism: the influence of soy-based formula. J Am Coll Nutr. 1997;16(3):280-282. (PubMed)
141. Bell DS, Ovalle F. Use of soy protein supplement and resultant need for increased dose of levothyroxine. Endocr Pract. 2001;7(3):193-194. (PubMed)
植物ステロール
目次
概要
- 植物ステロールとは、コレステロールに構造や機能が似た植物由来の化合物である。(詳細はこちら)
- 初期の人類の食事は1g/日くらいまで植物ステロールが豊富だったが、今日の西欧風の典型的な食事は、植物ステロールが比較的少ない。(詳細はこちら)
- 植物ステロールは腸でのコレステロール吸収を抑制する。(詳細はこちら)
- 多くの臨床試験で、少なくとも0.8gの植物性ステロールまたはスタノールを強化した食品を毎日摂取すると、血清LDLコレステロールが低下することが実証された。(詳細はこちら)
- いくつかの疫学研究で植物ステロールを含む植物性の食品を高摂取するとがんのリスクが減少するという関連がわかったが、植物性の食品に含まれる植物ステロールまたはその他の化合物が予防的要因なのかどうかは明らかでない。(詳細はこちら)
- いくつかの臨床試験の結果で、比較的低用量の植物ステロールの補給が良性前立腺過形成の尿路症状を改善することができると示唆されたが、この発見を確認するさらなる研究が必要である。(詳細はこちら)
- 植物ステロールを豊富に含む食品は、未精製の植物油、全粒穀物、ナッツ、および豆類などである。(詳細はこちら)
- 植物性ステロールまたはスタノールを添加された食品や飲料は、今では世界中の多くの国で市販されている。また、多くの国がそのような商品の健康強調表示を認めている。(詳細はこちら)
序説
ヒトの進化の大部分で、大量の植物性食品が消費されたことであろう(1)。食物繊維や植物性タンパク質が豊富なことに加えて、我々の祖先の食事はコレステロールに似た構造と機能を持つ植物由来のステロールである植物ステロールが豊富であった。現代の食事に植物ステロールを含む植物性食品を再導入することで、血清脂質(コレステロール)プロフィールを改善し心血管疾患リスクを減少させることができるというエビデンスがどんどん増えてきている(2)。コレステロールはヒトを含む動物の体内での主要なステロールであるが、植物には様々なステロールが見られる(3)。栄養学者は2つのグループの植物ステロールを把握している。それらは(1)ステロールの環状構造部分に二重結合を持つステロール(図1参照)、および(2)ステロールの環状構造部分に二重結合がないスタノール(図2参照)である。植物やヒトの食事に最も豊富なステロールは、シトステロールとカンペステロールである。スタノールも植物には含まれるが、食事性の植物ステロール全体のわずか10%くらいでしかない。ヒトの血液や組織中のコレステロールは、食事や内因性のコレステロール合成に由来するものである。対照的に、ヒトの血液や組織中のすべての植物ステロールは食事由来である。なぜならばヒトは植物ステロールを合成できないからだ(4)。
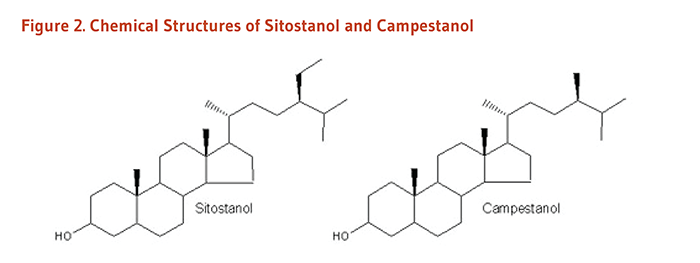
定義
植物ステロール:植物由来のステロールやスタノールの総称。
植物性ステロールまたはスタノール:植物由来のステロールまたはスタノールに一般的に使用される用語で、これらの植物性化学物質は食品やサプリメントに添加される。
植物ステロールもしくはスタノール・エステル:脂肪酸とステロールまたはスタノールとの間にエステル結合を作ることによってエステル化した植物性ステロールまたはスタノールのこと。エステル化は腸の細胞内や工業的プロセスで起こる。エステル化は植物性ステロールやスタノールをより脂溶性にするので、マーガリンやサラダドレッシングなどの脂肪を含む食品に溶けやすくなる。本記事では、植物ステロールやスタノール・エステルの重さを、それに相当するエステル化されていないステロールやスタノールの重さで表す。
代謝と生物学的利用性
食事性コレステロールの吸収と代謝
食事性のコレステロールは、腸の内面に並ぶ細胞(腸細胞)によって吸収されるために、混合ミセルに混ざり込まなければならない(5)。混合ミセルは、脂肪を含む食事をした後に小腸で作られる胆汁塩、脂質(脂肪)、およびステロールの混合物である。腸細胞の内部では、コレステロールがエステル化されカイロミクロンとして知られる中性脂肪(トリグリセリド)が豊富なリポタンパク質に取り込まれ、これが体内を循環していく(6)。循環中のカイロミクロンから中性脂肪がなくなるにつれ、それらはカイロミクロンレムナントになり肝臓で吸収される。肝臓ではカイロミクロンレムナント由来のコレステロールが他のリポタンパク質に作り戻されて体内を循環して輸送されたり、小腸へと分泌される胆汁になったりする。
食事性植物ステロールの吸収と代謝
様々な食事には似たような量の植物ステロールとコレステロールが含まれていることが典型的であるが、ヒトでは血清植物ステロール濃度は血清コレステロール濃度よりも数百倍低いことが通常である(7)。食事性植物ステロールの10%未満が体内で吸収されるのに対して、食事性コレステロールは50~60%が吸収される(8)。コレステロールと同様に、植物ステロールも腸細胞で吸収される前に混合ミセルに組み込まれなければならない。いったん腸細胞に入ると、ABCG5とABCG8として知られるATP結合カセット(ABC)タンパク質のペアから成る排出輸送体の活性によって植物ステロールの体内吸収は阻害される(4)。ABCG5とABCG8は互いに輸送体の半分ずつを構成し、輸送体は植物ステロールと非エステル化されたコレステロールを腸細胞から腸管腔へと染み出させる。植物ステロールはABCG5/G8輸送体によってコレステロールよりもずっと多く腸に戻されるので、食事性の植物ステロールはコレステロールよりも腸での吸収がずっと少なくなる。腸細胞の内部では、植物ステロールはコレステロールほどたやすくエステル化されないので、コレステロールよりもずっと低い濃度でカイロミクロンに組み込まれる。カイロミクロンに組み込まれたこれらの植物ステロールは体内循環にのり、肝臓で吸収される。いったん肝臓内に入ってしまうと、植物ステロールは肝臓のABCG5/G8輸送体によって急速に胆汁の中に分泌される。コレステロールも胆汁に分泌されるかもしれないが、植物ステロールが胆汁に分泌される割合のほうがコレステロールの分泌よりもずっと高い(9)。したがって、植物ステロールの血清濃度がコレステロールよりも相対的に低いことは、腸での吸収が減ることと植物ステロールの胆汁への分泌が増えることで説明ができる。
生物学的活性
コレステロール吸収とリポタンパク質代謝への効果
植物性ステロールまたはスタノールを高摂取すると、ヒトの血清総LDLコレステロール濃度を減らせることはよくわかっている(「心血管疾患」の項参照)(10,11)。腸管腔では、植物ステロールは混合ミセルからコレステロールを分離しコレステロールの吸収を抑制する(12)。1.5~1.8g/日の植物性ステロールまたはスタノールの摂取で、ヒトのコレステロール吸収が30~40%減る(13,14)。より高用量(2.2g/日の植物性ステロール)では、コレステロール吸収は60%減った(15)。コレステロール吸収が減ることで、組織でのLDL受容体の発現が増え、その結果として血中のLDLの除去が進む(16)。コレステロールの吸収が減ることは、コレステロールの合成が増えることとも関連している。また、植物ステロール摂取を増加させると、ヒトの内因性コレステロール合成が増えることもわかっている(13)。植物ステロール摂取の増加によってコレステロール合成が増加するにもかかわらず、血清LDLコレステロール濃度が正味では減ることになる。
その他の生物学的活性
培養細胞や動物モデルの実験では、植物ステロールはコレステロール低下とは無関係の生物学的活性があるかもしれないことが示唆される。しかし、ヒトにおけるそれらの重要性は未知である。
細胞膜特性の変化
コレステロールは哺乳類の細胞膜の重要な構造成分である(17)。コレステロールを植物ステロールで置換すると、ガラス容器内(in vitro)では細胞膜の物性が変わることがわかっており、これはシグナル伝達または膜結合酵素の活性に影響する可能性がある「19,20)。出血性脳卒中の動物モデルからの限定的なエビデンスでは、植物性ステロールまたはスタノールを非常に多く摂取すると、赤血球の細胞膜のコレステロールが移動されて血球の変形能が下がり壊れやすくなる可能性が高くなることが示された(21,22)。しかし、植物ステロール(1g/1,000kcal)を4週間毎日補給しても、ヒトの赤血球の壊れやすさは変わらなかった(23)。
テストステロン代謝の変化
動物モデルからの限定的なエビデンスで、植物ステロールを非常に多く摂取すると、テストステロンをより強力な代謝物であるジヒドロテストステロンに変換する膜結合酵素である5αレダクターゼ(5α還元酵素、5αリダクターゼ)を抑制することによって、テストステロンの代謝が変わってしまう可能性があると示唆された(24,25)。植物ステロールの摂取がヒトでテストステロンの代謝を変えるのかどうかは不明である。1.6g/日の植物ステロールエステルを1年間摂取した男性の遊離テストステロンまたは血清総テストステロン濃度に大きな変化は見られなかった(26)。
がん細胞のアポトーシスの誘発
正常な細胞と異なり、がん細胞はアポトーシス(プログラム化された細胞死)を開始させる細胞死シグナルに反応する能力がない。培養されたヒトの前立腺がん(27)、乳がん(28)、および結腸がん(29)にシトステロールを加えると、アポトーシスを誘発することがわかっている。
抗炎症作用
培養細胞や動物研究からの限定的なデータでは、植物ステロールはマクロファージや好中球といった免疫細胞の炎症活性を減衰させるかもしれないことが示唆されている(30,31)。
疾病予防
心血管疾患
植物性ステロールまたはスタノールを強化した食品
LDLコレステロール:遊離またはエステル化された植物性ステロールまたはスタノールを強化した食品を毎日摂取することで、血清総コレステロール濃度および血清LDLコレステロール濃度が下がることが多くの臨床試験でわかっている(10,32-35)。18の対照臨床試験の結果をまとめたメタ解析で、平均2g/日の植物性ステロールまたはスタノールを含むスプレッドの摂取によって、血清LDLコレステロール濃度が9~14%下がったことがわかった(36)。23の対照臨床試験の結果をまとめたより最近のメタ解析で、平均3.4g/日の植物性ステロールまたはスタノールを含む植物性食品の摂取で、LDLコレステロール濃度が約11%減ったことがわかった(37)。別のメタ解析では、植物性ステロール強化食品の23の臨床試験および植物性スタノール強化食品の27の臨床試験の結果を別々に調べた(11)。少なくとも2g/日の用量で、植物ステロールおよびスタノールのどちらもLDLコレステロール濃度を約10%減らした。2g/日よりも高用量だと、植物性ステロールまたはスタノールのコレステロール低減効果を大きく向上させることはなかった。直近では、59の無作為化対照試験の結果を分析したメタ解析で、試験開始時のLDLコレステロール濃度が高い者の方がLDLコレステロール濃度が大きく低下したことがわかった(38)。より少ない用量の植物性ステロールまたはスタノールの研究結果では、臨床的に有意義な少なくとも5%のLDLコレステロール低下が、0.8~1.0g/日の用量で起きることが示唆された(39-43)。一般的に、植物性ステロールと植物性スタノールのコレステロール低下の効能を比べた試験では、これらはどちらも同等であるとわかった(44-46)。これらの研究では4週間よりも長く行われたものはほとんどないが、植物性ステロールおよびスタノールのコレステロール低減効果は1年までも続くことが、少なくとも2つの研究でわかった(26,47)。対照臨床試験からのデータに加えて、自由に生活している状態での植物ステロール/スタノールを強化したマーガリンの習慣的摂取について調べた5年間の研究でも、コレステロール濃度に有益な効果が見られた(48)。最近では、長期間のLDLコレステロール低減効果を維持するのに植物性ステロールはスタノールほど効果的でないのではないかという懸念が持ち上がった(49-51)。これらの懸念に対処する植物性ステロールと植物性スタノールの効能を直接比べる長期間の試験が必要である(11)。
冠動脈性心疾患のリスク:植物性ステロールまたはスタノールを強化した食品の長期摂取が冠動脈性心疾患(CHD)のリスクに与える効果は不明である。多くの介入試験の結果は、薬物治療や食事の変更による10%のLDLコレステロール低下はCHDリスクを20%も下げる可能性を示唆している(52)。米国のコレステロール教育プログラムの成人治療委員会IIIは、植物ステロールもしくはスタノール・エステル(2g/日)の摂取をLDLコレステロールが高い者への最大限の食事療法の一部に含めた(53)。飽和脂肪が少なく、果物や野菜、全粒穀物、および食物繊維が豊富な心臓に良い食事に植物性ステロールまたはスタノールを強化した食品を足すことで、CHDリスクの低減にさらに効果的になる可能性がある。たとえば、飽和脂肪を一価不飽和脂肪や多価不飽和脂肪で置き換えた食事にすると、30日後に血清LDLコレステロールが9%減ったが、同じ食事に1.7g/日の植物性ステロールを追加すると24%の減少となった(54)。より最近の結果では、植物性ステロール(1g/1,000kcal)、大豆タンパク、アーモンド、および粘性食物繊維を含むコレステロール低下食品の組み合わせの食事を1ヶ月続けると血清LDLコレステロール濃度が平均で30%低下し、これはスタチン(HMG-CoA還元酵素を抑制する薬物)によってもたらさらる低減と大きく変わらなかった(55)。しかし、1年間そのようなコレステロール低減食をした個人の解析で、LDLコレステロールの減少は平均で13%でしかなかったものの、ほぼ3分の1の参加者ではLDLコレステロール低下が20%より大きかった(56)。植物性ステロールは、観察されたコレステロール濃度の低減に寄与したこの食事の主要成分であった(57)。米国食品医薬品局(FDA)は、植物ステロールもしくはスタノール・エステルを強化した食品の定期的な摂取は心疾患のリスクを低減させるかもしれないという健康強調表示を食品のラベルに使用することを認めている(58)。
食物性植物ステロール
植物性ステロールまたはスタノールを強化した食品の毎日の摂取がLDLコレステロール濃度を大きく減らす可能性があることを発見した臨床試験は、食事に天然に含まれている植物ステロールを考慮していない(59)。血清LDLコレステロール濃度に対する食物性植物ステロール摂取の影響を考慮した研究は比較的少ない。食物性植物ステロール摂取は、様々な集団で約150~450mg/日にわたると推定されている(60)。限定的なエビデンスでは、食物性植物ステロールはコレステロールの吸収を減らすのに重要な役割を果たしているかもしれないことが示唆されている。英国での横断研究で、食物性植物ステロール摂取は、飽和脂肪や食物繊維摂取についての調整をした後ですら血清総コレステロール濃度および血清LDLコレステロール濃度と逆相関があった(61)。同様に、スウェーデンの集団の解析で、食物性植物ステロール摂取は男女の総コレステロールと女性のLDLコレステロールとの間に逆相関があることがわかった(62)。1回の食事によるテストで、コーンオイルから150mgの植物ステロールを除去すると、コレステロール吸収が38%増え(63)、小麦胚芽から328mgの植物ステロールを除去するとコレステロール吸収が43%増えた(64)。さらなる研究が必要ではあるが、これらの発見は植物性食品由来の食物性植物ステロールの摂取が心血管の健康に重大な影響がある可能性を示唆している。
がん
動物研究からの限定的なデータで、非常に多量の植物ステロール摂取、特にシトステロールの摂取は乳がんや前立腺がんの成長を抑制するかもしれないことが示唆された(65-67)。ヒトの食事性植物ステロール摂取とがんのリスクの関連を調べた疫学研究はわずかである。これは、一般的に食べられている食品の植物ステロール含有量に関するデータベースが最近になってやっと開発されてきたからである。ウルグアイでの一連の症例対照研究で、食事性植物ステロール摂取は、胃がん、肺がん、または乳がんと診断された者の方ががんのない対照群の者よりも低いことがわかった(68-70)。米国での症例対照研究で、乳がんまたは子宮内膜がん(子宮がん)と診断された女性は、がんのない女性よりも食事性植物ステロール摂取が少なかったことがわかった(71,72)。対照的に米国での別の症例対照研究では、前立腺がんと診断された男性はがんのない男性よりも食事性カンペステロール摂取が多かったことがわかったが、植物ステロール全体の摂取は前立腺がんリスクと関連がなかった(73)。植物ステロールを含む植物性食品の高摂取とがんリスクの低下との関連がわかったとする疫学研究もあるものの、その防護的要因が植物性食品の植物ステロールなのかその他の化合物なのかは不明である。
疾病治療
良性前立腺過形成(BPH)
良性前立腺過形成(BPH)は、前立腺の非がん性肥大を表す用語である。肥大化した前立腺は尿道を圧迫する可能性があり、その結果排尿が困難になる。植物ステロールの混合物(βシトステロールとして市販されている)を含む植物抽出物はしばしば、BPHに関連する泌尿器症状のための薬草療法に含まれる。しかし、BPHの症状のある男性に対する植物ステロールサプリメントの効能を調べた対照試験は比較的少ない。BPHの症状のある200人の男性による6ヶ月間の研究で、60mg/日のβシトステロール剤によってプラセボに比べて症状のスコアが改善し、最大尿流が増え、排尿後残尿量が減った(74)。追跡研究で、βシトステロールによる治療を続けた38人の参加者でこれらの改善が18ヶ月まで維持されたと報告された(75)。同様にBPHの症状のある177人の男性による6ヶ月の研究で、130mg/日の別のβシトステロール剤によってプラセボより症状のスコアが改善し、最大尿流が増え、排尿後残尿量が減った(76)。これらとその他の2つの対照臨床試験の結果をまとめたシステマティックレビュー(系統的総括)で、βシトステロール抽出物は最大尿流を平均で3.9ml/秒増やし、排尿後残尿量を平均で29ml減らしたことがわかった(77)。いくつかの臨床試験の結果から、比較的低用量の植物ステロールがBPHに関連する下部尿路の症状を改善する可能性があるということが示唆されるが、これらの結果を確認するさらなる研究が必要である(78)。
摂取源
食品
今日のほとんどの先進国での典型的な食事と異なり、我々の祖先の食事は植物ステロールが豊富で、おそらく1,000mg/日も含まれていたであろう(1)。今日の食物性植物ステロール摂取は、集団によって150~450mg/日とばらつくであろうと推定される(3)。菜食主義者、特に完全菜食主義者は一般的に食物性植物ステロール摂取が最も多い(79)。植物ステロールはすべての植物性食品に含まれるが、最も多いのは植物油、ナッツ油、およびオリーブ油などの未精製植物油である(3)。ナッツ、種子、全粒穀物、および豆類も植物ステロールの良好な食品源である(5)。いくつかの食品の植物ステロール含有量を表1に示す。特定の食品についての栄養素含有量については、米国農務省の食品成分データベースを参照のこと。
| 食品 | 分量 | 植物ステロール(mg) |
|---|---|---|
| 小麦胚芽 | 約120ml(57g) | 197 |
| こめ油(米糠油) | 大さじ1(14g) | 162 |
| ごま油 | 大さじ1(14g) | 102 |
| コーン油 | 大さじ1(14g) | 117 |
| キャノーラ油 | 大さじ1(14g) | 92 |
| ピーナッツ | 約28g | 62 |
| 小麦ふすま | 約120ml(29g) | 58 |
| アーモンド | 約28g | 39 |
| 芽キャベツ | 約120ml(78g) | 34 |
| ライ麦パン | 2切れ(64g) | 33 |
| マカデミアナッツ | 約28g | 33 |
| オリーブ油 | 大さじ1(14g) | 22 |
| Take Control(登録商標)スプレッド | 大さじ1(14g) | 1,650mgの植物ステロールエステル(1,000mgの遊離ステロール) |
| Benecol(登録商標)スプレッド | 大さじ1(14g) | 850mgの植物ステロールエステル(500mgの遊離ステロール) |
植物性ステロールおよび植物性スタノールを強化した食品
コレステロール低減効果を実証した臨床試験の大部分では、マーガリンやマヨネーズのような脂肪を含む食品に溶かした植物性ステロールもしくはスタノール・エステルが使用された(11)。より最近の研究で、植物性ステロールまたはスタノールを適切に溶かせば低脂肪または無脂肪の食品ですらそれらを効果的に体に届けることができることが示された(10,59)。低脂肪ヨーグルト(43,84-86)、低脂肪乳(87-89)低脂肪チーズ(90)、ビターチョコレート(91)、およびオレンジジュース(92,93)に添加された植物性ステロールまたはスタノールが、対照臨床試験でLDLコレステロールを低下させたことが報告された。マーガリン、マヨネーズ、植物油、サラダドレッシング、ヨーグルト、牛乳、豆乳、オレンジジュース、棒状のスナック菓子、および肉などの植物性ステロールまたはスタノールを添加した様々な食品が、米国、ヨーロッパ、アジア、オーストラリア、およびニュージーランドで市販されている(10)。最近のメタ解析で、スプレッド、マヨネーズ、サラダドレッシング、牛乳、またはヨーグルトに添加された植物性ステロール/スタノールは、チョコレート、オレンジジュース、チーズ、肉、および棒状のシリアル菓子などのその他の製品に加えられる場合よりも、LDLコレステロール濃度を低下させるのにより効果的であったことがわかった(38)。LDLコレステロールを低下させるのに効果的な用量は最大で2g/日(11)、最少で0.8~1.0g/日(10)であることが、今までの研究から示される。コレステロール低減効果を実証した臨床試験の大半では、1日分の用量の植物性ステロールまたはスタノールを2~3回の食事に分けていたが、これはLDLコレステロール低減により効果的かもしれない(38)。しかし、1日分の植物性ステロールまたはスタノールを1回の食事で摂取しても、いくつかの臨床試験ではLDLコレステロールが下がったことがわかった(43,85,86,94,95)。
サプリメント
βシトステロールとして市販されている植物ステロールのサプリメントは、米国では処方箋なしで入手可能である。60~130mg/日のβシトステロールが良性前立腺過形成(BPH)の症状を軽減することが、いくつかの臨床試験でわかっている(「良性前立腺過形成」の項参照)。0.5gの植物ステロールを含む噛むソフトカプセル(ゲル)が、2g/日の推奨量でコレステロール低下に効くとして市販されている。植物ステロールのサプリメントは、脂肪を含む食事と一緒に摂取すべきである。
安全性
米国では、様々な食製品に添加された植物性ステロールやスタノールは、FDAによって一般的に安全であると認められている(GRAS認証)(96)。またEUの食品科学委員会は、様々な食製品に添加された植物性ステロールやスタノールはヒトが摂取しても安全であると結論づけた(97)。しかしながら委員会は、食製品からの植物性ステロールやスタノールの摂取は3g/日を超えるべきではないと推奨している。なぜならこれより多く摂取しても健康への有益性のエビデンスがないことと、高摂取による望ましくない効果があるかもしれないからである。
悪影響
植物性ステロールまたはスタノールを1年間まで定期的に摂取しても、それに関連する悪影響はほとんどない。1.6g/日の植物性ステロールを強化したスプレッドを摂取した者は、対照となるスプレッドを1年間まで摂取した者と比べても何の悪影響も報告しなかった(26)。また1.8~2.6g/日の植物スタノールを強化したスプレッドを1年間まで摂取した者も、何の悪影響も報告しなかった(47)。マーガリンに含まれる最大8.6g/日までの植物ステロールを3~4週間摂取しても健康な男女には良好な耐用性があり、腸内細菌や女性ホルモン濃度に悪い影響を及ぼすことはなかった(98)。植物ステロールは通常良好な耐用性が見られるが、吐き気、消化不良、下痢、および便秘が時として報告されることもあった(74,76)。
シトステロール血症(フィトステロール血症)
シトステロール血症はフィトステロール血症としても知られ、ABCG5またはABCG8遺伝子のどちらのコピーにも起こる突然変異を受け継ぐことによって起こる非常に稀な遺伝性疾患である(99)。どちらかの輸送タンパク質の突然変異がホモ接合である個人は、腸での植物ステロール吸収が増え胆汁中への排出が減ることで、血清植物ステロール濃度が劇的に高くなる。血清コレステロール濃度が正常またはやや高くても、シトステロール血症の個人は早発性アテローム性動脈硬化のリスクが高い。シトステロール血症の個人は、植物性ステロールが添加された食品またはサプリメントを避けるべきである(10)。より一般的であるシトステロール血症のヘテロ接合保因者における植物性ステロール摂取の効果が、2つの研究で調べられた。2人のヘテロ接合保因者が3g/日の植物性ステロール摂取を4週間(100)しても、12人のヘテロ接合保因者が2.2g/日の植物性ステロールを6~12週間摂取しても、血清植物ステロール濃度が異常に高くなることはなかった(101)。
妊娠と授乳
食品やサプリメントに添加された植物性ステロールまたはスタノールは、妊婦や授乳婦への安全性が研究されていないので、妊婦や授乳婦に勧められない(10)。現在、菜食主義者の女性のように天然の植物ステロールを食事で高摂取しても、妊娠や授乳に悪影響があるというエビデンスはない。
薬物相互作用
植物性ステロールまたはスタノールのコレステロール低減効果は、HMG-CoA還元酵素阻害薬(スタチン)の効果を補足するかもしれない(102,103)。対照臨床試験の結果では、スタチンを治療に使用している個人が2~3g/日の植物性ステロールまたはスタノールを摂取すると、LDLコレステロールがさらに7~11%減少するかもしれないことが示唆されていて、これはスタチンの用量を2倍にすることに匹敵する(50,104-106)。抗凝固作用のためにワルファリン(クマジンまたはコウマディン)を使用している患者が4.5g/日のスタノールエステルを8週間摂取しても、プロトロンビン時間(INR)に影響はなかった(107)。
栄養素との相互作用
脂溶性ビタミン(ビタミンA,D,E,K)
植物性ステロールやスタノールがコレステロールの吸収を減らし血清LDLコレステロール濃度を下げることから、脂溶性ビタミンの状態に対するその効果も臨床試験で研究された。血漿ビタミンA(レチノール)濃度は、植物性ステロールもしくはスタノール・エステルを1年まで摂取しても影響がなかった(11,26)。血漿ビタミンD(25ヒドロキシビタミンD3)濃度には大部分の研究で何の変化もなかったが、1つのプラセボ対照試験で1.6g/日のステロールエステルを1年間摂取した個人に血漿25ヒドロキシビタミンD3濃度に小さい(7%)が統計的に有意義な減少が見られた(26)。ビタミンKの状態に植物性ステロールまたはスタノール摂取が悪影響するというエビデンスはほとんどない。1.6g/日のステロールエステルを6ヶ月間摂取したら血漿ビタミンK濃度が取るに足らない14%の減少になったという関連があったが、ビタミンKの状態の機能的指標であるカルボキシル化されたオステオカルシンには影響がなかった(26)。より短期間のその他の研究では、植物ステロールやスタノール・エステルの摂取は、ビタミンK1(108,109)、またはビタミンK依存性凝固因子(110)の血漿濃度に大きく影響しなかった。植物性ステロールまたはスタノールを強化した食品の摂取は、多くの研究で血漿ビタミンE(α-トコフェロール)濃度を減少させるとわかっている。しかし、α-トコフェロールの濃度をLDLコレステロール濃度に標準化した場合には、これらの減少は一般的にそれほどでもない。このことは、観察された血漿α-トコフェロール濃度の減少が一部にはその担体リポタンパク質であるLDLコレステロールの減少によるものであるということを示唆している。一般に、1.5g/日以上の植物性ステロールやスタノールを強化した食品の摂取は、栄養状態のよい集団では脂溶性ビタミンの栄養状態に悪影響を及ぼさないことがわかっている。
カロテノイド
食事性のカロテノイドはリポタンパク質で循環する脂溶性植物化学物質である。多くの研究で、植物性ステロールまたはスタノールを強化した食品の短期または長期の摂取後に、10~20%の血漿カロテノイド濃度の減少が観察された(11)。血清総コレステロール濃度またはLDLコレステロール濃度に標準化された場合でも、αカロテン、βカロテン、およびリコピンの減少は持続するかもしれない。このことは、植物ステロールがこれらのカロテノイドの吸収を妨げる可能性があることを示唆している(111)。血漿カロテノイド濃度の減少が健康リスクをもたらすのかどうか不明であるが、いくつかの研究でカロテノイドの豊富な果物や野菜の摂取を増やすと、植物ステロールによる血漿カロテノイドの減少を防げる可能性があることがわかった(112)。あるケースでは、カロテノイドの豊富な野菜1食分を含む5食分の果物や野菜を毎日摂取するようにすると、2.5g/日の植物ステロールもしくはスタノール・エステルを摂取する者の血漿カロテノイド濃度を維持するのに十分であった(113)。
Authors and Reviewers
Originally written in 2005 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in September 2008 by:
Victoria J. Drake, Ph.D.
Linus Pauling Institute
Oregon State University
Reviewed in September 2008 by:
Peter J.H. Jones, Ph.D.
Professor of Nutrition
Director, Mary Emily Clinical Nutrition Research Center
School of Dietetics and Human Nutrition
McGill University
Copyright 2005-2024 Linus Pauling Institute
References
1. Jenkins DJ, Kendall CW, Marchie A, et al. The Garden of Eden--plant based diets, the genetic drive to conserve cholesterol and its implications for heart disease in the 21st century. Comp Biochem Physiol A Mol Integr Physiol. 2003;136(1):141-151. (PubMed)
2. Kendall CW, Jenkins DJ. A dietary portfolio: maximal reduction of low-density lipoprotein cholesterol with diet. Curr Atheroscler Rep. 2004;6(6):492-498. (PubMed)
3. Ostlund RE, Jr. Phytosterols in human nutrition. Annu Rev Nutr. 2002;22:533-549. (PubMed)
4. Sudhop T, Lutjohann D, von Bergmann K. Sterol transporters: targets of natural sterols and new lipid lowering drugs. Pharmacol Ther. 2005;105(3):333-341. (PubMed)
5. de Jong A, Plat J, Mensink RP. Metabolic effects of plant sterols and stanols (Review). J Nutr Biochem. 2003;14(7):362-369. (PubMed)
6. Plat J, Mensink RP. Plant stanol and sterol esters in the control of blood cholesterol levels: mechanism and safety aspects. Am J Cardiol. 2005;96(1 Suppl):15-22. (PubMed)
7. von Bergmann K, Sudhop T, Lutjohann D. Cholesterol and Plant Sterol Absorption: Recent Insights. Am J Cardiol. 2005;96(1S):10-14. (PubMed)
8. Ostlund RE, Jr., McGill JB, Zeng CM, et al. Gastrointestinal absorption and plasma kinetics of soy Delta(5)-phytosterols and phytostanols in humans. Am J Physiol Endocrinol Metab. 2002;282(4):E911-916. (PubMed)
9. Sudhop T, Sahin Y, Lindenthal B, et al. Comparison of the hepatic clearances of campesterol, sitosterol, and cholesterol in healthy subjects suggests that efflux transporters controlling intestinal sterol absorption also regulate biliary secretion. Gut. 2002;51(6):860-863. (PubMed)
10. Berger A, Jones PJ, Abumweis SS. Plant sterols: factors affecting their efficacy and safety as functional food ingredients. Lipids Health Dis. 2004;3(1):5. (PubMed)
11. Katan MB, Grundy SM, Jones P, Law M, Miettinen T, Paoletti R. Efficacy and safety of plant stanols and sterols in the management of blood cholesterol levels. Mayo Clin Proc. 2003;78(8):965-978. (PubMed)
12. Nissinen M, Gylling H, Vuoristo M, Miettinen TA. Micellar distribution of cholesterol and phytosterols after duodenal plant stanol ester infusion. Am J Physiol Gastrointest Liver Physiol. 2002;282(6):G1009-1015. (PubMed)
13. Jones PJ, Raeini-Sarjaz M, Ntanios FY, Vanstone CA, Feng JY, Parsons WE. Modulation of plasma lipid levels and cholesterol kinetics by phytosterol versus phytostanol esters. J Lipid Res. 2000;41(5):697-705. (PubMed)
14. Normen L, Dutta P, Lia A, Andersson H. Soy sterol esters and beta-sitostanol ester as inhibitors of cholesterol absorption in human small bowel. Am J Clin Nutr. 2000;71(4):908-913. (PubMed)
15. Richelle M, Enslen M, Hager C, et al. Both free and esterified plant sterols reduce cholesterol absorption and the bioavailability of beta-carotene and alpha-tocopherol in normocholesterolemic humans. Am J Clin Nutr. 2004;80(1):171-177. (PubMed)
16. Plat J, Mensink RP. Effects of plant stanol esters on LDL receptor protein expression and on LDL receptor and HMG-CoA reductase mRNA expression in mononuclear blood cells of healthy men and women. FASEB J. 2002;16(2):258-260. (PubMed)
17. Mouritsen OG, Zuckermann MJ. What's so special about cholesterol? Lipids. 2004;39(11):1101-1113. (PubMed)
18. Halling KK, Slotte JP. Membrane properties of plant sterols in phospholipid bilayers as determined by differential scanning calorimetry, resonance energy transfer and detergent-induced solubilization. Biochim Biophys Acta. 2004;1664(2):161-171. (PubMed)
19. Awad AB, Chen YC, Fink CS, Hennessey T. beta-Sitosterol inhibits HT-29 human colon cancer cell growth and alters membrane lipids. Anticancer Res. 1996;16(5A):2797-2804. (PubMed)
20. Leikin AI, Brenner RR. Fatty acid desaturase activities are modulated by phytosterol incorporation in microsomes. Biochim Biophys Acta. 1989;1005(2):187-191. (PubMed)
21. Ratnayake WM, L'Abbe MR, Mueller R, et al. Vegetable oils high in phytosterols make erythrocytes less deformable and shorten the life span of stroke-prone spontaneously hypertensive rats. J Nutr. 2000;130(5):1166-1178. (PubMed)
22. Ratnayake WM, Plouffe L, L'Abbe MR, Trick K, Mueller R, Hayward S. Comparative health effects of margarines fortified with plant sterols and stanols on a rat model for hemorrhagic stroke. Lipids. 2003;38(12):1237-1247. (PubMed)
23. Jones PJ, Raeini-Sarjaz M, Jenkins DJ, et al. Effects of a diet high in plant sterols, vegetable proteins, and viscous fibers (dietary portfolio) on circulating sterol levels and red cell fragility in hypercholesterolemic subjects. Lipids. 2005;40(2):169-174. (PubMed)
24. Awad AB, Hartati MS, Fink CS. Phytosterol feeding induces alteration in testosterone metabolism in rat tissues. J Nutr Biochem. 1998;9(12):712-717.
25. Cabeza M, Bratoeff E, Heuze I, Ramirez E, Sanchez M, Flores E. Effect of beta-sitosterol as inhibitor of 5 alpha-reductase in hamster prostate. Proc West Pharmacol Soc. 2003;46:153-155. (PubMed)
26. Hendriks HF, Brink EJ, Meijer GW, Princen HM, Ntanios FY. Safety of long-term consumption of plant sterol esters-enriched spread. Eur J Clin Nutr. 2003;57(5):681-692. (PubMed)
27. von Holtz RL, Fink CS, Awad AB. beta-Sitosterol activates the sphingomyelin cycle and induces apoptosis in LNCaP human prostate cancer cells. Nutr Cancer. 1998;32(1):8-12. (PubMed)
28. Awad AB, Roy R, Fink CS. Beta-sitosterol, a plant sterol, induces apoptosis and activates key caspases in MDA-MB-231 human breast cancer cells. Oncol Rep. 2003;10(2):497-500. (PubMed)
29. Choi YH, Kong KR, Kim YA, et al. Induction of Bax and activation of caspases during beta-sitosterol-mediated apoptosis in human colon cancer cells. Int J Oncol. 2003;23(6):1657-1662. (PubMed)
30. Awad AB, Toczek J, Fink CS. Phytosterols decrease prostaglandin release in cultured P388D1/MAB macrophages. Prostaglandins Leukot Essent Fatty Acids. 2004;70(6):511-520. (PubMed)
31. Navarro A, De las Heras B, Villar A. Anti-inflammatory and immunomodulating properties of a sterol fraction from Sideritis foetens Clem. Biol Pharm Bull. 2001;24(5):470-473. (PubMed)
32. St-Onge MP, Jones PJ. Phytosterols and human lipid metabolism: efficacy, safety, and novel foods. Lipids. 2003;38(4):367-375. (PubMed)
33. Moruisi KG, Oosthuizen W, Opperman AM. Phytosterols/stanols lower cholesterol concentrations in familial hypercholesterolemic subjects: a systematic review with meta-analysis. J Am Coll Nutr. 2006;25(1):41-48. (PubMed)
34. Ellegard LH, Andersson SW, Normen AL, Andersson HA. Dietary plant sterols and cholesterol metabolism. Nutr Rev. 2007;65(1):39-45. (PubMed)
35. Van Horn L, McCoin M, Kris-Etherton PM, et al. The evidence for dietary prevention and treatment of cardiovascular disease. J Am Diet Assoc. 2008;108(2):287-331. (PubMed)
36. Law M. Plant sterol and stanol margarines and health. BMJ. 2000;320(7238):861-864. (PubMed)
37. Chen JT, Wesley R, Shamburek RD, Pucino F, Csako G. Meta-analysis of natural therapies for hyperlipidemia: plant sterols and stanols versus policosanol. Pharmacotherapy. 2005;25(2):171-183. (PubMed)
38. AbuMweis SS, Barake R, Jones P. Plant sterols/stanols as cholesterol lowering agents: A meta-analysis of randomized controlled trials. Food & Nutrition Research. 2008; DOI: 10.3402/fnr.v52i0.1811. (PubMed)
39. Hendriks HF, Weststrate JA, van Vliet T, Meijer GW. Spreads enriched with three different levels of vegetable oil sterols and the degree of cholesterol lowering in normocholesterolaemic and mildly hypercholesterolaemic subjects. Eur J Clin Nutr. 1999;53(4):319-327. (PubMed)
40. Miettinen TA, Vanhanen H. Dietary sitostanol related to absorption, synthesis and serum level of cholesterol in different apolipoprotein E phenotypes. Atherosclerosis. 1994;105(2):217-226. (PubMed)
41. Pelletier X, Belbraouet S, Mirabel D, et al. A diet moderately enriched in phytosterols lowers plasma cholesterol concentrations in normocholesterolemic humans. Ann Nutr Metab. 1995;39(5):291-295. (PubMed)
42. Sierksma A, Weststrate JA, Meijer GW. Spreads enriched with plant sterols, either esterified 4,4-dimethylsterols or free 4-desmethylsterols, and plasma total- and LDL-cholesterol concentrations. Br J Nutr. 1999;82(4):273-282. (PubMed)
43. Volpe R, Niittynen L, Korpela R, et al. Effects of yoghurt enriched with plant sterols on serum lipids in patients with moderate hypercholesterolaemia. Br J Nutr. 2001;86(2):233-239. (PubMed)
44. Hallikainen MA, Sarkkinen ES, Gylling H, Erkkila AT, Uusitupa MI. Comparison of the effects of plant sterol ester and plant stanol ester-enriched margarines in lowering serum cholesterol concentrations in hypercholesterolaemic subjects on a low-fat diet. Eur J Clin Nutr. 2000;54(9):715-725. (PubMed)
45. Vanstone CA, Raeini-Sarjaz M, Parsons WE, Jones PJ. Unesterified plant sterols and stanols lower LDL-cholesterol concentrations equivalently in hypercholesterolemic persons. Am J Clin Nutr. 2002;76(6):1272-1278. (PubMed)
46. Weststrate JA, Meijer GW. Plant sterol-enriched margarines and reduction of plasma total- and LDL-cholesterol concentrations in normocholesterolaemic and mildly hypercholesterolaemic subjects. Eur J Clin Nutr. 1998;52(5):334-343. (PubMed)
47. Miettinen TA, Puska P, Gylling H, Vanhanen H, Vartiainen E. Reduction of serum cholesterol with sitostanol-ester margarine in a mildly hypercholesterolemic population. N Engl J Med. 1995;333(20):1308-1312. (PubMed)
48. Wolfs M, de Jong N, Ocke MC, Verhagen H, Monique Verschuren WM. Effectiveness of customary use of phytosterol/-stanol enriched margarines on blood cholesterol lowering. Food Chem Toxicol. 2006;44(10):1682-1688. (PubMed)
49. Miettinen TA, Gylling H. Plant stanol and sterol esters in prevention of cardiovascular diseases. Ann Med. 2004;36(2):126-134. (PubMed)
50. O'Neill FH, Brynes A, Mandeno R, et al. Comparison of the effects of dietary plant sterol and stanol esters on lipid metabolism. Nutr Metab Cardiovasc Dis. 2004;14(3):133-142. (PubMed)
51. O'Neill FH, Sanders TA, Thompson GR. Comparison of efficacy of plant stanol ester and sterol ester: short-term and longer-term studies. Am J Cardiol. 2005;96(1A):29D-36D. (PubMed)
52. National Cholesterol Education Program. Third Report of the National Cholesterol Education Program Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III). National Heart Lung and Blood Institute, National Institutes of Health. 2002. http://www.nhlbi.nih.gov/guidelines/cholesterol/atp3_rpt.htm.
53. Grundy SM. Stanol Esters as a Component of Maximal Dietary Therapy in the National Cholesterol Education Program Adult Treatment Panel III Report. Am J Cardiol. 2005;96(1 Suppl):47-50. (PubMed)
54. Jones PJ, Ntanios FY, Raeini-Sarjaz M, Vanstone CA. Cholesterol-lowering efficacy of a sitostanol-containing phytosterol mixture with a prudent diet in hyperlipidemic men. Am J Clin Nutr. 1999;69(6):1144-1150. (PubMed)
55. Jenkins DJ, Kendall CW, Marchie A, et al. Direct comparison of a dietary portfolio of cholesterol-lowering foods with a statin in hypercholesterolemic participants. Am J Clin Nutr. 2005;81(2):380-387. (PubMed)
56. Jenkins DJ, Kendall CW, Faulkner DA, et al. Assessment of the longer-term effects of a dietary portfolio of cholesterol-lowering foods in hypercholesterolemia. Am J Clin Nutr. 2006;83(3):582-591. (PubMed)
57. Jenkins DJ, Kendall CW, Nguyen TH, et al. Effect of plant sterols in combination with other cholesterol-lowering foods. Metabolism. 2008;57(1):130-139. (PubMed)
58. Food and Drug Administration. Health claims: plant sterol/stanol esters and risk of coronary heart disease (CHD). US Government Printing Office. 2002. Available at: http://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfcfr/cfrsearch.cfm?fr=101.83. Accessed 3/3/15.
59. Ostlund RE, Jr. Phytosterols and cholesterol metabolism. Curr Opin Lipidol. 2004;15(1):37-41. (PubMed)
60. Ostlund RE, Jr., Racette SB, Stenson WF. Effects of trace components of dietary fat on cholesterol metabolism: phytosterols, oxysterols, and squalene. Nutr Rev. 2002;60(11):349-359. (PubMed)
61. Andersson SW, Skinner J, Ellegard L, et al. Intake of dietary plant sterols is inversely related to serum cholesterol concentration in men and women in the EPIC Norfolk population: a cross-sectional study. Eur J Clin Nutr. 2004;58(10):1378-1385. (PubMed)
62. Klingberg S, Ellegard L, Johansson I, et al. Inverse relation between dietary intake of naturally occurring plant sterols and serum cholesterol in northern Sweden. Am J Clin Nutr. 2008;87(4):993-1001. (PubMed)
63. Ostlund RE, Jr., Racette SB, Okeke A, Stenson WF. Phytosterols that are naturally present in commercial corn oil significantly reduce cholesterol absorption in humans. Am J Clin Nutr. 2002;75(6):1000-1004. (PubMed)
64. Ostlund RE, Jr., Racette SB, Stenson WF. Inhibition of cholesterol absorption by phytosterol-replete wheat germ compared with phytosterol-depleted wheat germ. Am J Clin Nutr. 2003;77(6):1385-1389. (PubMed)
65. Ju YH, Clausen LM, Allred KF, Almada AL, Helferich WG. beta-Sitosterol, beta-Sitosterol Glucoside, and a Mixture of beta-Sitosterol and beta-Sitosterol Glucoside Modulate the Growth of Estrogen-Responsive Breast Cancer Cells In Vitro and in Ovariectomized Athymic Mice. J Nutr. 2004;134(5):1145-1151. (PubMed)
66. Awad AB, Fink CS, Williams H, Kim U. In vitro and in vivo (SCID mice) effects of phytosterols on the growth and dissemination of human prostate cancer PC-3 cells. Eur J Cancer Prev. 2001;10(6):507-513. (PubMed)
67. Awad AB, Downie A, Fink CS, Kim U. Dietary phytosterol inhibits the growth and metastasis of MDA-MB-231 human breast cancer cells grown in SCID mice. Anticancer Res. 2000;20(2A):821-824. (PubMed)
68. De Stefani E, Boffetta P, Ronco AL, et al. Plant sterols and risk of stomach cancer: a case-control study in Uruguay. Nutr Cancer. 2000;37(2):140-144. (PubMed)
69. Mendilaharsu M, De Stefani E, Deneo-Pellegrini H, Carzoglio J, Ronco A. Phytosterols and risk of lung cancer: a case-control study in Uruguay. Lung Cancer. 1998;21(1):37-45. (PubMed)
70. Ronco A, De Stefani E, Boffetta P, Deneo-Pellegrini H, Mendilaharsu M, Leborgne F. Vegetables, fruits, and related nutrients and risk of breast cancer: a case-control study in Uruguay. Nutr Cancer. 1999;35(2):111-119. (PubMed)
71. McCann SE, Freudenheim JL, Marshall JR, Brasure JR, Swanson MK, Graham S. Diet in the epidemiology of endometrial cancer in western New York (United States). Cancer Causes Control. 2000;11(10):965-974. (PubMed)
72. McCann SE, Freudenheim JL, Marshall JR, Graham S. Risk of human ovarian cancer is related to dietary intake of selected nutrients, phytochemicals and food groups. J Nutr. 2003;133(6):1937-1942. (PubMed)
73. Strom SS, Yamamura Y, Duphorne CM, et al. Phytoestrogen intake and prostate cancer: a case-control study using a new database. Nutr Cancer. 1999;33(1):20-25. (PubMed)
74. Berges RR, Windeler J, Trampisch HJ, Senge T. Randomised, placebo-controlled, double-blind clinical trial of beta-sitosterol in patients with benign prostatic hyperplasia. Beta-sitosterol Study Group. Lancet. 1995;345(8964):1529-1532. (PubMed)
75. Berges RR, Kassen A, Senge T. Treatment of symptomatic benign prostatic hyperplasia with beta-sitosterol: an 18-month follow-up. BJU Int. 2000;85(7):842-846. (PubMed)
76. Klippel KF, Hiltl DM, Schipp B. A multicentric, placebo-controlled, double-blind clinical trial of beta-sitosterol (phytosterol) for the treatment of benign prostatic hyperplasia. German BPH-Phyto Study group. Br J Urol. 1997;80(3):427-432. (PubMed)
77. Wilt TJ, MacDonald R, Ishani A. beta-sitosterol for the treatment of benign prostatic hyperplasia: a systematic review. BJU Int. 1999;83(9):976-983. (PubMed)
78. Dreikorn K. The role of phytotherapy in treating lower urinary tract symptoms and benign prostatic hyperplasia. World J Urol. 2002;19(6):426-435. (PubMed)
79. Nair PP, Turjman N, Kessie G, et al. Diet, nutrition intake, and metabolism in populations at high and low risk for colon cancer. Dietary cholesterol, beta-sitosterol, and stigmasterol. Am J Clin Nutr. 1984;40(4 Suppl):927-930. (PubMed)
80. US Department of Agriculture, Agricultural Research Service. USDA Nutrient Database for Standard Reference, Release 20. 2007. Available at: http://www.nal.usda.gov/fnic/foodcomp/search/. Accessed 7/24/08.
81. Normen L, Bryngelsson S, Johnsson M, et al. The phytosterol content of some cereal foods commonly consumed in Sweden and in the Netherlands. J Food Compos Anal. 2002;15(6):693-704.
82. Normen L, Johnsson M, Andersson H, van Gameren Y, Dutta P. Plant sterols in vegetables and fruits commonly consumed in Sweden. Eur J Nutr. 1999;38(2):84-89. (PubMed)
83. Phillips KM, Ruggio DM, Toivo JI, Swank MA, Simpkins AH. Free and esterified sterol composition of edible oils and fats. J Food Compos Anal. 2002;15(2):123-142.
84. Mensink RP, Ebbing S, Lindhout M, Plat J, van Heugten MM. Effects of plant stanol esters supplied in low-fat yoghurt on serum lipids and lipoproteins, non-cholesterol sterols and fat soluble antioxidant concentrations. Atherosclerosis. 2002;160(1):205-213. (PubMed)
85. Plana N, Nicolle C, Ferre R, et al. Plant sterol-enriched fermented milk enhances the attainment of LDL-cholesterol goal in hypercholesterolemic subjects. Eur J Nutr. 2008;47(1):32-39. (PubMed)
86. Doornbos AM, Meynen EM, Duchateau GS, van der Knaap HC, Trautwein EA. Intake occasion affects the serum cholesterol lowering of a plant sterol-enriched single-dose yoghurt drink in mildly hypercholesterolaemic subjects. Eur J Clin Nutr. 2006;60(3):325-333. (PubMed)
87. Noakes M, Clifton PM, Doornbos AME, Trautwein EA. Plant sterol ester-enriched milk and yoghurt effectively reduce serum cholesterol in modestly hypercholesterolemic subjects. Eur J Clin Nutr. 2005;44(4):214-222. (PubMed)
88. Thomsen AB, Hansen HB, Christiansen C, Green H, Berger A. Effect of free plant sterols in low-fat milk on serum lipid profile in hypercholesterolemic subjects. Eur J Clin Nutr. 2004;58(6):860-870. (PubMed)
89. Seppo L, Jauhiainen T, Nevala R, Poussa T, Korpela R. Plant stanol esters in low-fat milk products lower serum total and LDL cholesterol. Eur J Nutr. 2007;46(2):111-117. (PubMed)
90. Jauhiainen T, Salo P, Niittynen L, Poussa T, Korpela R. Effects of low-fat hard cheese enriched with plant stanol esters on serum lipids and apolipoprotein B in mildly hypercholesterolaemic subjects. Eur J Clin Nutr. 2006;60(11):1253-1257. (PubMed)
91. Allen RR, Carson L, Kwik-Uribe C, Evans EM, Erdman JW, Jr. Daily consumption of a dark chocolate containing flavanols and added sterol esters affects cardiovascular risk factors in a normotensive population with elevated cholesterol. J Nutr. 2008;138(4):725-731. (PubMed)
92. Devaraj S, Jialal I, Vega-Lopez S. Plant sterol-fortified orange juice effectively lowers cholesterol levels in mildly hypercholesterolemic healthy individuals. Arterioscler Thromb Vasc Biol. 2004;24(3):e25-28. (PubMed)
93. Devaraj S, Autret BC, Jialal I. Reduced-calorie orange juice beverage with plant sterols lowers C-reactive protein concentrations and improves the lipid profile in human volunteers. Am J Clin Nutr. 2006;84(4):756-761. (PubMed)
94. Matvienko OA, Lewis DS, Swanson M, et al. A single daily dose of soybean phytosterols in ground beef decreases serum total cholesterol and LDL cholesterol in young, mildly hypercholesterolemic men. Am J Clin Nutr. 2002;76(1):57-64. (PubMed)
95. Plat J, van Onselen EN, van Heugten MM, Mensink RP. Effects on serum lipids, lipoproteins and fat soluble antioxidant concentrations of consumption frequency of margarines and shortenings enriched with plant stanol esters. Eur J Clin Nutr. 2000;54(9):671-677. (PubMed)
96. Food and Drug Administration. GRAS Notice No. GRN 000112. 2003. http://www.fda.gov/Food/IngredientsPackagingLabeling/GRAS/NoticeInventory/ucm153924.htm. Accessed 3/3/15.
97. Scientific Committee on Food. Opinion on Applications for Approval of a Variety of Plant Sterol-Enriched Foods. 2003. Available at: http://ec.europa.eu/food/fs/sc/scf/out174_en.pdf.
98. Ayesh R, Weststrate JA, Drewitt PN, Hepburn PA. Safety evaluation of phytosterol esters. Part 5. Faecal short-chain fatty acid and microflora content, faecal bacterial enzyme activity and serum female sex hormones in healthy normolipidaemic volunteers consuming a controlled diet either with or without a phytosterol ester-enriched margarine. Food Chem Toxicol. 1999;37(12):1127-1138. (PubMed)
99. Berge KE. Sitosterolemia: a gateway to new knowledge about cholesterol metabolism. Ann Med. 2003;35(7):502-511. (PubMed)
100. Stalenhoef AF, Hectors M, Demacker PN. Effect of plant sterol-enriched margarine on plasma lipids and sterols in subjects heterozygous for phytosterolaemia. J Intern Med. 2001;249(2):163-166. (PubMed)
101. Kwiterovich PO, Jr., Chen SC, Virgil DG, Schweitzer A, Arnold DR, Kratz LE. Response of obligate heterozygotes for phytosterolemia to a low-fat diet and to a plant sterol ester dietary challenge. J Lipid Res. 2003;44(6):1143-1155. (PubMed)
102. Normen L, Holmes D, Frohlich J. Plant sterols and their role in combined use with statins for lipid lowering. Curr Opin Investig Drugs. 2005;6(3):307-316. (PubMed)
103. Thompson GR. Additive effects of plant sterol and stanol esters to statin therapy. Am J Cardiol. 2005;96(1 Suppl):37-39. (PubMed)
104. Blair SN, Capuzzi DM, Gottlieb SO, Nguyen T, Morgan JM, Cater NB. Incremental reduction of serum total cholesterol and low-density lipoprotein cholesterol with the addition of plant stanol ester-containing spread to statin therapy. Am J Cardiol. 2000;86(1):46-52. (PubMed)
105. Neil HA, Meijer GW, Roe LS. Randomised controlled trial of use by hypercholesterolaemic patients of a vegetable oil sterol-enriched fat spread. Atherosclerosis. 2001;156(2):329-337. (PubMed)
106. Simons LA. Additive effect of plant sterol-ester margarine and cerivastatin in lowering low-density lipoprotein cholesterol in primary hypercholesterolemia. Am J Cardiol. 2002;90(7):737-740. (PubMed)
107. Nguyen TT, Dale LC. Plant stanol esters and vitamin K. Mayo Clin Proc. 1999;74(6):642-643. (PubMed)
108. Raeini-Sarjaz M, Ntanios FY, Vanstone CA, Jones PJ. No changes in serum fat-soluble vitamin and carotenoid concentrations with the intake of plant sterol/stanol esters in the context of a controlled diet. Metabolism. 2002;51(5):652-656. (PubMed)
109. Korpela R, Tuomilehto J, Hogstrom P, et al. Safety aspects and cholesterol-lowering efficacy of low fat dairy products containing plant sterols. Eur J Clin Nutr. 2006;60(5):633-642. (PubMed)
110. Plat J, Mensink RP. Vegetable oil based versus wood based stanol ester mixtures: effects on serum lipids and hemostatic factors in non-hypercholesterolemic subjects. Atherosclerosis. 2000;148(1):101-112. (PubMed)
111. Plat J, Mensink RP. Effects of diets enriched with two different plant stanol ester mixtures on plasma ubiquinol-10 and fat-soluble antioxidant concentrations. Metabolism. 2001;50(5):520-529. (PubMed)
112. Ntanios FY, Duchateau GS. A healthy diet rich in carotenoids is effective in maintaining normal blood carotenoid levels during the daily use of plant sterol-enriched spreads. Int J Vitam Nutr Res. 2002;72(1):32-39. (PubMed)
113. Noakes M, Clifton P, Ntanios F, Shrapnel W, Record I, McInerney J. An increase in dietary carotenoids when consuming plant sterols or stanols is effective in maintaining plasma carotenoid concentrations. Am J Clin Nutr. 2002;75(1):79-86. (PubMed)
コエンザイムQ10
要約
- コエンザイムQ10は主に体内で合成される脂溶性の化合物で、食事からも摂取される。
- コエンザイムQ10はミトコンドリアでのATP合成に必要で、細胞膜やリポタンパク質で抗酸化物質として機能する。(詳細はこちら)
- 健康な個人では欠乏症を予防するのに充分なコエンザイムQ10が体内合成と食事からの摂取で供給されるようであるが、組織でのコエンザイムQ10濃度は加齢とともに減少する。(詳細はこちら)
- 血漿、リポタンパク質、および血管内のコエンザイムQ10濃度はコエンザイムQ10の経口補給で上昇するが、組織での濃度が上がるのかどうかは不明であり、健康な個人では特にそうである。(詳細はこちら)
- コエンザイムQ10の補給で、遺伝性のミトコンドリア性障害のある何人かの患者に臨床的および代謝的改善があった。(詳細はこちら)
- コエンザイムQ10の補給は、うっ血性心不全に対する従来の医学的療法への有益な補足療法であるかもしれないが、さらなる研究が必要である。(詳細はこちら)
- 心血管疾患、神経変性疾患、がん、および糖尿病にコエンザイムQ10の補給が果たす役割について、さらに研究が必要である。(詳細はこちら)
- コエンザイムQ10補給は、運動能力を向上させるわけではないようである。(詳細はこちら)
- コエンザイムQ10のサプリメントは比較的安全であるが、ワルファリンの抗凝固剤としての効能を低減させるかもしれない。(詳細はこちら)
- HMG-CoA還元酵素阻害剤として知られるコレステロール低下剤(スタチン)の使用は血液循環中のコエンザイムQ10濃度を下げるが、これらの薬物を服用している患者にコエンザイムQ10補給が健康上の利益をもたらすかどうかは不明である。(詳細はこちら)
序説
コエンザイムQ10はユビキノン族の化合物の1つである。ヒトを含むすべての動物は、ユビキノンを合成することができる。したがって、コエンザイムQ10はビタミンとは考えられていない(1)。ユビキノンという名称は、これらの化合物が生物に偏在し(ユビキタス)、その化学構造にベンゾキノンとして知られる官能基を含むことに由来する。ユビキノンは、1~12までのイソプレン(炭素5個)単位を持つ脂溶性分子である。ヒトに見られるユビキノンであるユビデカレノン、別名コエンザイムQ10は、ベンゾキノンの「頭部」に10のイソプレン単位(全部で炭素原子50個)から成る「尾部」が付いている(図1参照)(2)。
生物活性
コエンザイムQ10は脂質(脂肪)に溶け、実質的にすべての細胞膜とリポタンパク質に見られる(2)。コエンザイムQ10のベンゾキノン頭部基が持つ電子を受け入れたり渡したりする性質は、その生化学的機能における重要な特性である。コエンザイムQ10は3つの酸化状態で存在する(上記の図1参照)。それらは(1)完全に還元されたユビキノールの形態(CoQ10H2)、(2)セミキノンラジカル中間体(CoQ10H・)、および(3)完全に酸化されたユビキノンの形態(CoQ10)である。
ミトコンドリアでのATP合成
細胞で使用されるエネルギー形態であるアデノシン三リン酸(ATP)への炭水化物や脂肪からのエネルギー変換では、ミトコンドリア内膜にコエンザイムQが必要である。ミトコンドリアでの電子伝達系の一部として、コエンザイムQは脂肪酸およびブドウ糖の代謝で発生する還元当量の電子を受け取り、それらを電子受容体に渡す。同時にコエンザイムQはミトコンドリア内膜の外にあるプロトン(陽子)を輸送し、膜をはさんでプロトン濃度勾配を発生させる。プロトンがミトコンドリア内部に流れ戻る際に放出されるエネルギーが、ATPを生成するのに使用される(2)。
リソソームでの機能
リソソームは、細胞残屑の消化に特化した細胞小器官である。リソソーム内の消化酵素は、酸性のpHで最適に機能する。このことは、酵素がプロトンの供給を永続的に受ける必要があることを意味する。これらの消化酵素と細胞の残りの部分を隔てるリソソーム膜は、コエンザイムQ10濃度が比較的高い。最適なpHを維持するために、コエンザイムQ10がリソソーム膜を挟んでのプロトンの伝達に重要な役割を果たしていることが、研究から示唆される(2,3)。
抗酸化機能
還元された形態であるCoQ10H2は、効果的な脂溶性抗酸化物質である。細胞膜にかなりの量のCoQ10H2があって、酸化されたCoQ10をCoQ10H2に還元できる酵素がともにあることから、CoQ10H2が細胞の重要な抗酸化物質であるという考えが裏付けられる(2)。細胞膜と低密度リポタンパク質(LDL)が体外(ex vivo)で酸化条件にさらされると、CoQ10H2は脂質の過酸化を抑制することがわかっている。LDLが体外で酸化されると、CoQ10H2は真っ先に消費される抗酸化物質である。また、CoQ10H2があると、酸化された脂質の生成やαトコフェロール(α-TOH。生物学的に最も活性のあるビタミンEの形態)の消費が抑えられる(4)。独立したミトコンドリアでは、脂質の過酸化に伴う酸化ダメージからコエンザイムQ10が膜のタンパク質とDNAを守ることができる(1)。フリーラジカルを直接中和できることに加えて、CoQ10H2はα-TOHの一電子酸化体であるαトコフェロキシルラジカル(α-TO・)からα-TOHを生成することができる。
栄養素との相互作用
ビタミンE
αトコフェロール(ビタミンE)とコエンザイムQ10は、細胞膜とリポタンパク質における主要な脂溶性抗酸化物質である。α-TOHが脂質ペルオキシルラジカル(LOO・)などのフリーラジカルを中和する際に、それ自体が酸化されてα-TO・を生成し、これは試験管中では特定の条件下でリポタンパク質の脂質の酸化を促進できる。コエンザイムQ10の還元された形態(CoQ10H2)がα-TO・と反応すると、α-TOHが再生成され、セミキノンラジカル(CoQ10H・)が作られる。CoQ10H・は酸素(O2)と反応してスーパーオキシドアニオンラジカル(O2・-)を生成することができ、これはLOO・よりもずっと酸化力の弱いラジカルである。しかし、CoQ10H・はα-TO・をα-TOHに還元することもでき、その結果完全に酸化されたコエンザイムQ10(CoQ10)が生成され、これは酸素(O2)と反応してO2・-を作ることはない(図2参照)(4,5)。

欠乏症
コエンザイムQ10欠乏症の症状は一般に報告されていない。したがって健康な個人には充分なコエンザイムQ10が正常な生合成や多様な食事で供給されていると一般的に考えられている(6)。食事からの摂取は血漿のコエンザイムQ10の約25%を占めると推定されるが、コエンザイムQ10の食事からの摂取量の推奨は、米国医学研究所やその他の機関から現在特になされていない(7)。食事からの摂取が組織でのコエンザイムQ10の濃度にどの程度寄与しているかは明らかでない。
原発性(先天性)のコエンザイムQ10欠乏症は、コエンザイムQ10の生合成における遺伝子的欠陥によっておきるまれな常染色体劣性疾患である。結果としてコエンザイムQ10が組織で低濃度になることが、神経および筋肉の機能をひどく損なう。経口でのコエンザイムQ10補給は、原発性コエンザイムQ10欠乏症患者の神経症状および筋肉の症状を改善させることもあることが示されてきた(8)。いくつかの異なる組織で加齢によって次第にコエンザイムQ10の濃度が減ることがわかっているが(1,9)、この加齢に伴う低下が欠乏症をおこすのかどうかは不明である(「疾病予防」の項参照)。血漿でのコエンザイムQ10の濃度低下は、糖尿病、がん、およびうっ血性心不全の者にも見られる(「疾病治療」の項参照)。コレステロールとコエンザイムQ10の生合成にともに重要な酵素であるHMG-CoA還元酵素の活性を抑制する脂質低下剤は血漿でのコエンザイムQ10濃度を低下させる(「薬物相互作用」の項のHMG-CoA還元酵素抑制剤(スタチン)の箇所を参照)が、これが臨床的または症状的な意味があるのかどうかは不明なままである。
疾病予防
老化
老化のミトコンドリア・フリーラジカル説によれば、老化に伴う機能低下に活性酸素種(ROS)による細胞構造への酸化ダメージが重要な役割を果たしている(10)。ROSはミトコンドリアでATP生成の際の副産物として作られる。抗酸化物質で中和されないと、ROSは時間がたつにつれてミトコンドリアを損ない、それらの機能を非効率的にしたり、尽きることのないサイクルでより損傷性の強いROSを生成したりする可能性がある。コエンザイムQ10はミトコンドリアでのATPの合成に重要な役割を果たし、ミトコンドリア膜で抗酸化物質として機能する。さらに、コエンザイムQ10の組織での濃度は老化とともに減少することが報告されている(9)。老化の顕著な特徴の一つは多くの組織でのエネルギー代謝の減少であり、肝臓、心臓、および骨格筋では特にそうである。組織でのコエンザイムQ10濃度が老化で減少することが、この代謝減少に関わっているのではないかと提唱されている(11)。最近の研究では、生涯に渡って食べ物からコエンザイムQ10を補給するとコエンザイムQ10の組織での濃度が増えたが、ネズミの寿命が延びることはなかった(12,13)。しかしながら、ある研究ではコエンザイムQ10補給で加齢によるDNA損傷の増え方がゆるくなった(14)。現在では、コエンザイムQ10補給がヒトの寿命を延ばしたり老化による機能低下を防いだりするという科学的根拠はない。
心血管疾患
動脈壁での低密度リポタンパク質(LDL)の酸化修飾は、アテローム性動脈硬化症の発症に至る初期の事象を表すと考えられている。還元された形態のコエンザイムQ10(CoQ10H2)は、試験管内(in vitro)でLDLの酸化を抑制し、α-TO・をα-TOHに還元してα-TOHとともにLDLの酸化を阻害する。CoQ10H2(またはビタミンC)のような共に働く酸化防止剤がないと、α-TOHは特定の条件下では試験管内でLDLの酸化を促進することがある(4)。コエンザイムQ10を補給すると、ヒトのLDL中でのCoQ10H2の濃度が高まる(15)。アテローム性動脈硬化症の動物モデルであるアポリポタンパク質E欠乏症のマウスの研究で、薬理学的用量を超える量のコエンザイムQ10補給をしたら、アテローム性動脈硬化症の病変の発生が大きく抑制されたことがわかった(16)。興味深いことに、これらのマウスにα-TOHとコエンザイムQ10を同時に補給すると、α-TOHまたはコエンザイムQ10単独での補給よりもアテローム性動脈硬化症の抑制にさらに効果的であった(17)。アテローム性動脈硬化症発症の別の重要なステップは、血管壁に単球という免疫細胞が集まることである。これは細胞接着分子(インテグリン)の単球での発現に一部依存する。10人の健康な男女に200mg/日のコエンザイムQ10を10週間補給したら、インテグリンの単球での発現が大きく減った。このことは、コエンザイムQ10によるアテローム性動脈硬化症の抑制に別のメカニズムがある可能性を示唆する(18)。コエンザイムQ10の補給がLDLの酸化やアテローム性動脈硬化症の抑制剤として有望であるようだが、コエンザイムQ10補給がヒトのアテローム性動脈硬化症の発症や進行を抑制することができるかどうかを決定するさらなる研究が必要である。
疾病治療
ミトコンドリア脳筋症
ミトコンドリア脳筋症は、ミトコンドリアの電子伝達系の機能における多くの遺伝的異常による多様な遺伝性疾患群である。コエンザイムQ10補給は、様々なタイプのミトコンドリア脳筋症の何人かの患者に臨床的および代謝的改善をもたらした(19)。神経筋や広範な組織でのコエンザイムQ10の欠乏症は、ミトコンドリア脳筋症の人々のうちの非常に小さな集団に見られる(20,21)。コエンザイムQ10の生合成に遺伝的欠陥のあるこれらの稀な集団には、コエンザイムQ10の補給によって実質的な改善がもたらされた(22,23)。コエンザイムQ10補給がその他のミトコンドリア疾患のある患者に治療上の有益性があるのかどうかは不明である。この問題を調べる第Ⅲ相の臨床試験が現在進行中である(23)。
心血管疾患
うっ血性心不全
体全体の需要に合う十分な血液を送り出す心臓の能力に障害がある状態は、うっ血性心不全として知られる。冠動脈疾患では、冠動脈にアテローム性動脈硬化症のプラークが溜まると、心筋の一部が適切な血液供給を受けることができず、心臓障害や血液供給能力障害となる可能性がある。心筋梗塞(MI)も心筋を痛め、心不全に至るかもしれない。運動をすると弱った心臓に負担がかかるため、心不全の重篤度のモニターに運動負荷試験の測定値が頻繁に用いられる。心臓超音波検査も、心臓のポンプ機能の客観的測定値である左室駆出率を決定するのに用いられる(25)。心筋のコエンザイムQ10濃度は、より重篤な心不全の患者では軽度の患者よりも低いという発見から、心不全患者へのコエンザイムQ10補給の臨床試験がいくつか行われた(26)。従来の医学的治療と同時にサプリメントでのコエンザイムQ10(100~300mg/日を1~3ヶ月)をうっ血性心不全患者に投与する何件かの小規模介入試験では、いくつかの心機能の測定値の改善が実証された(27-29)。しかしながら、従来の医学的治療とともに食事に100~200mg/日のコエンザイムQ10を足しても、心不全患者の左室駆出率または運動負荷試験結果が大きく改善することはなかったとする研究者もいる(30,31)。10の無作為化対照試験の2006年のメタ解析で、心不全患者にコエンザイムQ10補給(99~200mg/日を1~6ヶ月)をしたら、3.7%という大きな左室駆出率の改善があったことがわかった。この効果はアンジオテンシン変換酵素阻害剤を服用していない患者でより強かった(32)。コエンザイムQ10補給で心拍出量の少々の増加(0.28L/分)も見られたが、この解析には2つの試験(60mg/日を1ヶ月または200mg/日を3ヶ月)しか含まれていない(32)。236人の心不全患者の最近の研究で、血漿のコエンザイムQ10濃度が低いことと死亡率が高くなることとの関連があった(33)。しかし、1,191人の心不全患者によるより大規模な研究で、血漿のコエンザイムQ10濃度は進行した心疾患のバイオマーカーであって、心不全患者の臨床的症状を独立して予見するものではないことがわかった(34)。コエンザイムQ10補給が有益であるかもしれないというエビデンス(科学的根拠)もあるものの、コエンザイムQ10補給がうっ血性心不全の治療において従来からの医学的治療法を補足する価値があるのかどうかを決定するよく考案された大規模介入研究が必要である。そのような研究の一つが現在進行中である。
心筋梗塞と心臓手術
心筋梗塞(MI)の結果として、または心臓手術の間に、心筋が酸素欠乏(局所貧血)になるかもしれない。心筋への酸素供給が回復(再灌流)した際のROSの生成増加が、虚血再灌流の間に起こる心筋障害に大きく寄与していると考えられている。動物をコエンザイムQ10で前処置しておくと、虚血再灌流による心筋障害を減らすことがわかっている(35)。虚血再灌流障害の別の原因となりうるのは、冠動脈バイパス手術(CABG)のようなある種の心臓手術中の大動脈遮断である。4つのプラセボ対照試験のうちの3つで、コエンザイムQ10補給による前処置(100~300mg/日を手術前の7~14日間)をしておくと、CABG手術後の短期的な結果測定にいくらかの利点があった(36,37)。コエンザイムQ10の手術前補給が有益ではなかったとしたプラセボ対照試験では、患者は手術の12時間前に600mgのコエンザイムQ10を与えられていた(38)。このことから、手術前のコエンザイムQ10補給が有益であるためには、CABG手術の少なくとも1週間前からの補給が必要であるかもしれないことが示唆される。結果は有望ではあるが、これらの試験は比較的少人数で行われており、またCABG手術のすぐ後の結果しか調べていない。
狭心症
心筋虚血症は、狭心症として知られる胸の痛みを起こす可能性がある。狭心症の人々はしばしば、たとえば運動中に酸素の需要が心筋に酸素を送る冠動脈循環の能力を超える際に狭心症の症状を起こす。5つの小規模プラセボ対照試験で、慢性安定狭心症の患者に従来の医学的治療法に加えて経口コエンザイムQ10補給(60~600mg/日)をした効果を調べた(28)。研究の大部分で、プラセボに比べてコエンザイムQ10補給は運動負荷試験の結果を向上させ、心筋虚血症による心電図変化が減ったり遅れたりした。しかし、その中の2つの研究のみでコエンザイムQ10補給によって症状の頻度やニトログリセリンの使用がかなり減ったりしただけであった。現在では、コエンザイムQ10補給が従来の狭心症治療に役立つ補足的な治療であると示唆するエビデンスは限られている。
高血圧
ヒトでのいくつかの小規模な非対照試験の結果で、コエンザイムQ10補給が高血圧の治療に有益であるかもしれないということが示唆された(37)。最近では2つの短期間プラセボ対照試験で、コエンザイムQ10補給で高血圧の個人の血圧がやや低下したことがわかった。高血圧と冠動脈疾患のある患者に従来の医学的治療に加えて120mg/日のコエンザイムQ10を8週間補給したら、ビタミンB複合体を含むプラセボに比べて収縮期血圧が平均12mmHg、拡張期血圧が平均6mmHg下がった(39)。孤立性収縮期高血圧症の患者にコエンザイムQ10(120mg/日)とビタミンE(300 IU/日)を一緒に12週間補給したら、300 IU/日のビタミンEのみの場合と比べて収縮期血圧が平均で17mmHg下がった(40)。362人の高血圧患者を含む12の臨床試験の2007年のメタ解析で、コエンザイムQ10補給によって収縮期血圧が11~17mmHg、拡張期血圧が8~10mmHg下がったことがわかった(41)。このメタ解析に含まれた4つの無作為化対照試験では、100~120mg/日の用量のコエンザイムQ10を使用していた。
血管内皮機能(血管の拡張)
血管内皮として知られる血管の内面の正常な機能は、心血管疾患の予防に重要な役割を果たす(42)。アテローム性動脈硬化症は血管内皮機能の障害に関連しており、血管が緩んで正常な血流を通す能力がそれによって危うくなる。血清コレステロール濃度の高い個人や冠動脈疾患や糖尿病の患者においては、内皮依存性血管弛緩(血管拡張)がうまくいかない。あるプラセボ対照試験で、コエンザイムQ10補給(200mg/日)を12週間したら、血清脂質プロフィールに異常のある糖尿病患者の内皮依存性血管拡張が改善したとわかったが、非糖尿病の個人に見られるような程度まで回復したわけではなかった(43)。スタチン(HMG-CoA還元酵素阻害剤)を服用している23人の2型糖尿病患者による別のプラセボ対照試験で、200mg/日のコエンザイムQ10を12週間服用したら、上腕動脈の血流依存性血管拡張反応が改善したが、硝酸塩による血管拡張反応(ニトログリセリン誘発性血管拡張反応)は改善しなかったことがわかった(44)。しかし、80人の2型糖尿病患者によるプラセボ対照試験で、この補給の手順では内皮機能が向上しなかったことがわかった(45)。
血清コレステロール濃度が高く内皮障害があるがそれ以外は健康な12人の研究で、150mg/日のコエンザイムQ10補給は内皮依存性血管拡張に影響がなかった(46)。内皮障害のある25人の男性による前向き無作為化交差試験で、コエンザイムQ10補給(150mg/日)によって脂質低下剤と同じように内皮機能がかなり向上したことがわかった(47)。しかしこの研究はプラセボ対照試験ではなく、大切なことには著者らが被験者の血流依存性血管拡張の調査開始時平均が0未満だったと報告していることに言及しておくことが重要である。冠動脈疾患のある22人の患者による一つの無作為化二重盲検プラセボ対照試験で、300mg/日のコエンザイムQ10を1ヶ月補給したら、内皮依存性血管拡張反応が改善した(48)。虚血性の左心室収縮機能障害のある56人の患者による別の無作為化二重盲検プラセボ対照試験で、300mg/日のコエンザイムQ10を8週間補給したら、内皮機能障害の測定値が大きく向上したと報告された(49)。194人の被験者を含む5つの無作為化対照試験の結果を調べた2011年のメタ解析で、コエンザイムQ10補給(150~300mg/日を4~12週間)によって、血流依存性の内皮性血管拡張が臨床的に意義のある1.7%増加になったことがわかった(50)。内皮機能障害におけるコエンザイムQ10の治療的役割をさらに明らかにする大規模研究が必要である。
糖尿病
糖尿病は、酸化ストレスが増えエネルギー代謝に障害がある状態である。血漿コレステロール濃度を正規化した場合に、還元型コエンザイムQ10(CoQ10H2)の血漿濃度が糖尿病患者では健康な対照者よりも低いことがわかっている(51,52)。しかし、100mg/日のコエンザイムQ10を3ヶ月補給しても、プラセボに比べて1型糖尿病(インスリン依存性)患者の血糖コントロールが改善したりインスリン需要が減ったりはしなかった(53)。同様に、200mg/日のコエンザイムQ10を12週間または6ヶ月補給しても、2型(非インスリン依存性)糖尿病患者の血糖コントロールや血清脂質プロフィールは改善しなかった(45,54)。コエンザイムQ10補給はどちらの研究でも血糖コントロールに影響しなかったため、両研究の著者らはコエンザイムQ10補給が糖尿病患者の心血管疾患の補足的療法として安全に使用できると結論づけた。
ミトコンドリア遺伝子変異糖尿病(MIDD)は、母からのみ遺伝するミトコンドリアDNAの突然変異の結果として起こる。ミトコンドリア糖尿病は糖尿病全体の1%未満であるが、長期間のコエンザイムQ10補給(150mg/日)がこれらの患者のインスリン分泌を改善し、聴覚喪失の進行を予防するかもしれないというエビデンスがある(55,56)。
神経変性疾患
パーキンソン病
パーキンソン病は体の震え、筋肉のこわばり、および動作緩慢が特徴的な神経変性疾患である。65歳以上のアメリカ人の約1%が罹患していると推定される。パーキンソン病の原因は全部わかっているわけではないが、ミトコンドリアにおける電子伝達系の複合体Iの活性低下と、黒質と呼ばれる脳の一部での酸化ストレス増加が関わっていると考えられている。コエンザイムQ10は複合体Iの電子受容体であり抗酸化物質でもあり、またパーキンソン病の個々人の血小板では、還元型コエンザイムQ10の酸化型に対する比率の低下が見られる(57,58)。ある研究においては、パーキンソン病を治療していない患者の脳脊髄液では、健康な対照者に比べて酸化型コエンザイムQ10濃度が高いこともわかった(59)。さらに、パーキンソン病患者の死後のコエンザイムQ10濃度の研究で、同年の対照者に比べて脳の皮質領域でのコエンザイムQ10全体の濃度が低いことがわかったが、線条体、黒質、および小脳を含むその他の脳領域では差がなかった(60)。ある16ヶ月の無作為化プラセボ対照試験で、初期のパーキンソン病である80人の患者に300、600、または1,200mg/日のコエンザイムQ10補給をした安全性と効能を評価した(61)。コエンザイムQ10補給は全部の用量で忍容性が良好であり、プラセボに比べてパーキンソン病患者の機能低下が遅くなったという関連があった。しかし、その差は1,200mg/日の用量の群でのみ統計的に有意義であった。より小規模なプラセボ対照試験で360mg/日のコエンザイムQ10を4週間経口投与したら、パーキンソン病患者にやや有益であったことが示された(62)。より最近では、中等症のパーキンソン病患者106人による無作為化二重盲検プラセボ対照試験で、300mg/日のコエンザイムQ10ナノ粒子を3ヶ月補給しても、何の治療効果もなかったことが報告された(63)。別の試験で2,400mg/日のコエンザイムQ10を12ヶ月補給しても、初期のパーキンソン病には有効ではなかったことがわかった(64)。パーキンソン病患者に対するコエンザイムQ10(1,200~2,400mg/日)とビタミンE(1,200 IU/日)補給の第Ⅲ相臨床試験は、そのような治療がパーキンソン病治療に有効ではないであろうということから、最近終了となった(65)。
ハンチントン病
ハンチントン病は、線条体の中型有棘ニューロンとして知られる神経細胞が選択的に変性することが特徴的な遺伝性神経変性障害である。運動障害や認知機能低下などの症状は40代で発症することが典型的で、時とともに悪化する。ミトコンドリアの機能障害とグルタミン酸媒介の神経毒性がハンチントン病の病理にかかわっているかもしれないことを、動物モデルが示している。コエンザイムQ10補給は、ハンチントン病の動物モデルで脳の病変範囲を減らし、ハンチントン病患者の脳の乳酸濃度を下げることがわかっている(66,67)。ハンチントン病のタンパク質を発現する遺伝子改変マウス(HD-N171-82Qマウス)にコエンザイムQ10(餌の0.2%)とレマセミド(餌の0.007%)の組み合わせを与えると、運動能力および/または生存率が向上した(68,69)。レマセミドはグルタミン酸塩で活性化される神経受容体の拮抗薬である。
ハンチントン病のR6/2マウスモデルは、ヒトの症状と同じような行動および神経症状の進行的悪化を示す(70)。したがって、R6/2マウスはハンチントン病の治療可能性を探るのに理想的なモデルであるかもしれない。これらのマウスを使って行われた全部ではないがいくつかの研究で、コエンザイムQ10を食事に混ぜて補給(餌の0.2%)すると運動能力と全体の生存率が向上し、体重減少の予防に役立ったことが示された。コエンザイムQ10補給は、脳の萎縮、脳室拡張、および線条体ニューロンの萎縮などのハンチントン病の様々な特徴の低減にも関連していた(68,71)。興味深いことに、コエンザイムQ10をレマセミド、抗生物質のミノサイクリン、またはクレアチンと同時投与すると、測定されたパラメータの大部分でさらに大きく改善が示された(68,71,72)。
今日までのところわずか1つだけの臨床試験において、コエンザイムQ10がハンチントン病の患者に効能があるかどうかが調べられた。コエンザイムQ10,レマセミド、またはその両方を347人の初期のハンチントン病患者に投与する30ヶ月の無作為化プラセボ対照試験で、コエンザイムQ10もレマセミドも機能全体の能力低下を大きく変化させることはなかったが、コエンザイムQ10補給(レマセミド有りまたは無しで)では、有意とはいえない13%の低下となった(73)。8人の健康な被験者とハンチントン病の20人の患者でコエンザイムQ10補給の用量を増やす(1,200mg/日、2,400mg/日および3,600mg/日)安全性と忍容性を調べる20週間の最近のパイロット試験で、22人の被験者が試験を終了した(74)。すべての用量は全体的に忍容性がよく、胃腸の症状が最も多く報告された悪影響であった。研究の終了時のコエンザイムQ10の血中濃度は、中用量の摂取結果の濃度より高くはなかった。このことから、2,400mg/日という用量は効果的にコエンザイムQ10の血中濃度を最大化し、それ以上の用量による副作用を避けることができるのではないかということが示唆される(74)。2,400mg/日のコエンザイムQ10またはプラセボを5年間投与する第Ⅲ相の臨床試験は、現在ハンチントン病の参加者を募集中である(75)。今のところ、ハンチントン病の患者にコエンザイムQ10を勧めるエビデンスは不十分である。
フリードライヒ運動失調症
フリードライヒ運動失調症(FRDA)は、主にミトコンドリアにあってその機能が不明なタンパク質であるフラタキシンを符号化する遺伝子の突然変異によっておこる常染色体劣性遺伝子性の神経変性疾患である。フラタキシンの発現が減少するとミトコンドリアに鉄の蓄積がおこり、それによって酸化ストレスが増加し、ミトコンドリアのアコニターゼを含む鉄硫黄含有タンパク質の不均衡がおこり、ミトコンドリアの呼吸鎖の活性が低下する(76)。臨床的には、FRDAは手足の運動失調および感覚神経の変性による中枢神経系の異常が特徴的な進行性疾患である(77,78)。さらに、FRDAの患者は肥大型心筋症や糖尿病の症状になる(79)。10人のFRDA患者にコエンザイムQ10(200mg/日)とビタミンE(2,100 IU/日)を投与したパイロット研究で、心筋および骨格筋のエネルギー代謝がわずか3ヶ月の治療で向上したことがわかった(80)。47ヶ月での追跡評価で、心筋および骨格筋の改善が維持されFRDA患者の心臓機能の測定値である左室内径短縮率が大きく増加したことが示された。また、この治療は神経機能の進行的低下を防ぐのにも有効であった(81)。最近の研究で、FRDA患者にはコエンザイムQ10とビタミンE両方の欠乏症がいたって一般的で、コエンザイムQ10を30mg/日、ビタミンEを4 IU/日といった低用量でこれらの化合物を同時補給しても、この疾患の症状を改善するかもしれないことがわかった(82)。コエンザイムQ10をビタミンEと同時に投与することがFRDAの治療に有益であるかどうかを決定する大規模無作為化臨床試験が必要である。
がん
がんの治療薬としてのコエンザイムQ10の可能性に対する関心は、胚、膵臓、そして特に乳がんの患者は健康な対照者よりも血漿コエンザイムQ10濃度が低くなりがちだという観察研究によって喚起された(83)。いくつかの症例報告や非対照試験で、コエンザイムQ10補給が従来の乳がん治療の補足として有益であるかもしれないことが示唆されている(84)。しかし対照臨床試験が不足しているため、コエンザイムQ10をがん患者に補給することに効果があるのかを決定することは不可能である。
パフォーマンス
運動能力
コエンザイムQ10補給によって運動負荷試験の結果が向上するミトコンドリア脳筋症の個々人もいる(「欠乏症」の項参照)が(19)、それが健康な個人の運動能力を向上させるというエビデンスはほとんどない。少なくとも7つのプラセボ対照試験で、トレーニングをしている男性とそうでない男性に100~150mg/日のコエンザイムQ10補給を3~8週間して、運動能力への効果を調べた。大部分の試験では、最大酸素摂取量(VO2 max)や疲労困憊に至るまでの運動時間などの有酸素運動能力測定値に関して、コエンザイムQ10を摂取した群とプラセボを摂取した群で何の有意義な差も見られなかった(85-89)。ある研究で8週間のコエンザイムQ10補給によって自転車こぎの最大運動量がプラセボに比べてわずかに(4%)増加したことがわかったが、有酸素パワーの測定値は増加しなかった(90)。実は2つの研究では、無酸素(86)および有酸素(85)運動能力の測定でプラセボ補給の方がコエンザイムQ10よりも測定値に有意義な改善があったことがわかった。女性の運動能力に対する補給効果の研究は不足しているが、コエンザイムQ10補給に対する反応に性差があると疑う理由はほとんどない。
摂取源
生合成
コエンザイムQ10はヒトのほとんどの組織で合成される。コエンザイムQ10の生合成には3つの主要ステップがある。(1)チロシンもしくはフェニルアラニンという2つのアミノ酸からベンゾキノン構造を合成する;(2)アセチルコエンザイムA(CoA)からメバロン酸経路でイソプレン側鎖を合成する;そして(3)これらの構造を結合または縮合する。ヒドロキシメチルグルタリル(HMG)CoA還元酵素という酵素が、コエンザイムQ10合成およびコレステロール合成の統制に重大な役割を果たす(1,6)。
ベンゾキノンの生合成(チロシンから4ヒドロキシフェニルピルビン酸への変換)の第一ステップでは、ピリドキサール5'リン酸の形態のビタミンB6が必要である。したがってコエンザイムQ10の生合成には、ビタミンB6の栄養状態が適切であることが不可欠である。29人の患者と健康なボランティアによるパイロット研究で、コエンザイムQ10の血中濃度とビタミンB6の栄養状態の測定値の間に有意義な正の相関があったことがわかった(91)。しかしながら、この関連の臨床的重要性を決定するさらなる研究が必要である。
食品の摂取源
食品摂取頻度の研究に基いて、デンマークではコエンザイムQ10の食事からの平均的摂取量が3~5mg/日と推定された(6,7)。大部分の人はおそらく10mg/日未満の食事性コエンザイムQ10を摂取している。食事性コエンザイムQ10の豊富な摂取源は主に、肉、鳥肉、および魚である。コエンザイムQ10が比較的豊富なその他の食品は、大豆油やキャノーラ油、およびナッツ類である。果物、野菜、卵、および乳製品にはコエンザイムQ10が程よく含まれている。野菜や卵を油で炒める際に約14~32%のコエンザイムQ10が失われるが、これらの食品のコエンザイムQ10の含有量は茹でても変わらない。コエンザイムQ10の比較的豊富な食品源とその含有量をミリグラム(mg)単位で表1に示す(92-94)。
サプリメント
コエンザイムQ10は、米国では処方箋なしで栄養補助食品として市販されている。成人に対する補給用量は30~100mg/日の範囲で、通常の食事性コエンザイムQ10摂取よりもかなり高い。成人に対する治療用の用量は一般的に100~300mg/日であるが、初期のパーキンソン病の治療に医師の監督下で3,000mg/日といった高用量で用いられたことがあった(95)。サプリメントの用量が高くなるにつれてコエンザイムQ10の吸収が減り、ヒトでは腸でのコエンザイムQ10の吸収は10%未満であろう。コエンザイムQ10は脂溶性なので、食事の脂肪と一緒に摂取すると一番吸収がよい。100mg/日より高い用量は、一般的に1日に2~3回に分けられる(7,96)。
経口コエンザイムQ10補給で組織での濃度が上がるか?
コエンザイムQ10の経口補給は、ヒトの血中およびリポタンパク質中のコエンザイムQ10濃度を上げることが知られている(2,12,15)。しかしながら、内因性コエンザイムQ10生合成が正常な個人において、経口補給でその他の組織でのコエンザイムQ10濃度が上がるかどうか不明である。若い健康な動物にコエンザイムQ10の経口補給をしても、肝臓、脾臓、および血管以外の組織での濃度は一般的に上昇しない(97,98)。健康な男性に120mg/日を3週間補給しても、骨格筋でのコエンザイムQ10濃度は上昇しなかった(99)。しかし、コエンザイムQ10欠乏になっている組織でのコエンザイムQ10濃度は、補給によって上がるかもしれない。たとえば、年取ったラットの脳のコエンザイムQ10濃度は経口補給で上昇した(100)。また、心臓手術の少なくとも7日前から300mg/日のコエンザイムQ10またはプラセボを補給した24人の年配者の研究では、コエンザイムQ10を摂取した者では心房組織でのコエンザイムQ10濃度が大きく上昇し、特に70歳以上の者ではそうであった(36)。さらに、左心室機能不全の患者の研究で、心臓手術前に150mg/日のコエンザイムQ10を4週間補給したら、心臓でのコエンザイムQ10濃度が上がったが骨格筋ではそうではなかった(101)。これは明らかにさらなる研究を要する分野である。
安全性
毒性
1,200mg/日の用量のコエンザイムQ10を最大16ヶ月まで経口補給しても(61)、600mg/日を最大30ヶ月まで補給しても(73)、大きな副作用の報告はない。実際、1,200mg/日という用量が最近、コエンザイムQ10の実質安全量(OSL)として提唱された(102)。吐き気、下痢、食欲不振、胸焼け、および腹部不快感などの胃腸症状が出る者もいる。これらの悪影響は、1日に100mg超の用量を2~3回に分けて摂取すると最小化されるかもしれない。妊婦や授乳婦への安全性の対照研究がないので、妊婦や授乳婦がコエンザイムQ10のサプリメントを摂取することは避けるべきである(96,103)。
薬物相互作用
ワルファリン
ワルファリン(クマジンまたはコーマディン)とコエンザイムQ10サプリメントの併用は、少なくとも4件のケースでワルファリンの抗凝固作用を低減させたことが報告されている(104)。ワルファリンを服用する個人は、抗凝固治療を管理している医療提供者に相談することなしにコエンザイムQ10のサプリメント摂取を始めるべきではない。ワルファリンとコエンザイムQ10を併用することになるならば、凝固時間(プロトロンビン時間:PT-INR)を評価する血液検査が頻繁にチェックされるべきであり、最初の2週間は特にそうである。
HMG-CoA還元酵素阻害剤(スタチン)
今ではコレステロールやコエンザイムQ10の生合成における他の律速段階もあることが認識されているものの、HMG-CoA還元酵素はコレステロール合成およびコエンザイムQ10合成の統制に重大な役割を果たす酵素である。スタチンとしても知られるHMG-CoA還元酵素阻害剤は広く使用されているコレステロール低下薬であり、コエンザイムQ10の内因性合成も低減するかもしれない。シンバスタチン(ゾコー)、プラバスタチン(プラバコール)、ロバスタチン(メバコール、アルトコール、アルトプレブ)、ロスバスタチン(クレストール)、およびアトルバスタチン(リピトール)などのスタチンを治療目的に使用すると、血漿または血清中のコエンザイムQ10濃度が下がることが示されている(105-114)。しかしながら、血中コエンザイムQ10濃度は全脂質または全コレステロール濃度に対して正規化されたもののみを報告すべきである。なぜならば、コエンザイムQ10はリポタンパク質とともに循環し、コエンザイムQ10濃度は血液循環中の脂質の濃度に高く依存するからである(115,116)。スタチンの脂質低減効果を考えると、これらの薬物が血液循環中の脂質の減少に関係なくコエンザイムQ10濃度を実際に下げるのかどうかは明らかでない。また、標的とする臓器でのコエンザイムQ10濃度を調べた研究はほとんどなく、スタチンの治療が体の組織でのコエンザイムQ10濃度に影響するのかどうか不明である(111,113,117)。今のところ、コエンザイムQ10補給がHMG-CoA還元酵素阻害剤を服用している者に有益であるかどうかを決定するさらなる研究が必要である。
Authors and Reviewers
Originally written in 2003 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in February 2007 by:
Victoria J. Drake, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in March 2012 by:
Victoria J. Drake, Ph.D.
Linus Pauling Institute
Oregon State University
Reviewed in March 2012 by:
Roland Stocker, Ph.D.
Centre for Vascular Research
School of Medical Sciences (Pathology) and
Bosch Institute
Sydney Medical School
The University of Sydney
Sydney, New South Wales, Australia
Copyright 2003-2024 Linus Pauling Institute
References
1. Ernster L, Dallner G. Biochemical, physiological and medical aspects of ubiquinone function. Biochim Biophys Acta. 1995;1271(1):195-204. (PubMed)
2. Crane FL. Biochemical functions of coenzyme Q10. J Am Coll Nutr. 2001;20(6):591-598. (PubMed)
3. Nohl H, Gille L. The role of coenzyme Q in lysosomes. In: Kagan VEQ, P. J. (ed). Coenzyme Q: Molecular Mechanisms in Health and Disease. Boca Raton: CRC Press; 2001:99-106.
4. Thomas SR, Stocker R. Mechanisms of antioxidant action of ubiquinol-10 for low-density lipoprotein. In: Kagan VE, Quinn PJ,eds. Coenzyme Q: Molecular Mechanisms in Health and Disease. Boca Raton: CRC Press; 2001:131-150.
5. Kagan VE, Fabisak JP, Tyurina YY. Independent and concerted antioxidant functions of coenzyme Q. In: Kagan VE, Quinn PJ, eds. Coenzyme Q: Molecular Mechanisms in Health and Disease. Boca Raton: CRC Press; 2001:119-130.
6. Overvad K, Diamant B, Holm L, Holmer G, Mortensen SA, Stender S. Coenzyme Q10 in health and disease. Eur J Clin Nutr. 1999;53(10):764-770. (PubMed)
7. Weber C. Dietary intake and absorption of coenzyme Q. In: Kagan VE, Quinn PJ,eds. Coenzyme Q: Molecular Mechanisms in Health and Disease. Boca Raton: CRC Press; 2001:209-215.
8. Rustin P, Munnich A, Rotig A. Mitochondrial respiratory chain dysfunction caused by coenzyme Q deficiency. Methods Enzymol. 2004;382:81-88. (PubMed)
9. Kalen A, Appelkvist EL, Dallner G. Age-related changes in the lipid compositions of rat and human tissues. Lipids. 1989;24(7):579-584. (PubMed)
10. Beckman KB, Ames BN. Mitochondrial aging: open questions. Ann N Y Acad Sci. 1998;854:118-127. (PubMed)
11. Alho H, Lonnrot K. Coenzyme Q supplementation and longevity. In: Kagan VE, Quinn PJ,eds. Coenzyme Q: Molecular Mechanisms in Health and Disease. Boca Raton: CRC Press; 2001:371-380.
12. Singh RB, Niaz MA, Kumar A, Sindberg CD, Moesgaard S, Littarru GP. Effect on absorption and oxidative stress of different oral Coenzyme Q10 dosages and intake strategy in healthy men. Biofactors. 2005;25(1-4):219-224. (PubMed)
13. Sohal RS, Kamzalov S, Sumien N, et al. Effect of coenzyme Q10 intake on endogenous coenzyme Q content, mitochondrial electron transport chain, antioxidative defenses, and life span of mice. Free Radic Biol Med. 2006;40(3):480-487. (PubMed)
14. Quiles JL, Ochoa JJ, Battino M, et al. Life-long supplementation with a low dosage of coenzyme Q10 in the rat: effects on antioxidant status and DNA damage. Biofactors. 2005;25(1-4):73-86. (PubMed)
15. Mohr D, Bowry VW, Stocker R. Dietary supplementation with coenzyme Q10 results in increased levels of ubiquinol-10 within circulating lipoproteins and increased resistance of human low-density lipoprotein to the initiation of lipid peroxidation. Biochim Biophys Acta. 1992;1126(3):247-254. (PubMed)
16. Witting PK, Pettersson K, Letters J, Stocker R. Anti-atherogenic effect of coenzyme Q10 in apolipoprotein E gene knockout mice. Free Radic Biol Med. 2000;29(3-4):295-305. (PubMed)
17. Thomas SR, Leichtweis SB, Pettersson K, et al. Dietary cosupplementation with vitamin E and coenzyme Q(10) inhibits atherosclerosis in apolipoprotein E gene knockout mice. Arterioscler Thromb Vasc Biol. 2001;21(4):585-593. (PubMed)
18. Turunen M, Wehlin L, Sjoberg M, et al. beta2-Integrin and lipid modifications indicate a non-antioxidant mechanism for the anti-atherogenic effect of dietary coenzyme Q10. Biochem Biophys Res Commun. 2002;296(2):255-260. (PubMed)
19. Shoffner JM. Oxidative phosphorylation diseases. In: Scriver CR, Beaudet AL, Sly WS, Valle D,eds. The metabolic and molecular bases of inherited disease. 8th ed. Volume 2. New York: McGraw-Hill; 2001:2367-2392.
20. Rotig A, Appelkvist EL, Geromel V, et al. Quinone-responsive multiple respiratory-chain dysfunction due to widespread coenzyme Q10 deficiency. Lancet. 2000;356(9227):391-395. (PubMed)
21. Boitier E, Degoul F, Desguerre I, et al. A case of mitochondrial encephalomyopathy associated with a muscle coenzyme Q10 deficiency. J Neurol Sci. 1998;156(1):41-46. (PubMed)
22. Munnich A, Rotig A, Cormier-Daire V, Rustin P. Clinical presentation of respiratory chain deficiency. In: Scriver CR, Beaudet AL, Sly WS, Valle D,eds. The metabolic and molecular bases of inherited disease. 8th ed. Volume 2. New York: McGraw-Hill; 2001:2261-2274.
23. Horvath R, Gorman G, Chinnery PF. How can we treat mitochondrial encephalomyopathies? Approaches to therapy. Neurotherapeutics. 2008;5:558-568. (PubMed)
24. National Institutes of Health. Phase III Trial of Coenzyme Q10 in Mitochondrial Disease. ClinicalTrials.gov [Web page]. Available at: http://www.clinicaltrials.gov/ct2/show/NCT00432744?term=coenzyme+Q10+AND+mitochondrial&rank=1. Accessed 2/23/12.
25. Trupp RJ, Abraham WT. Congestive heart failure. In: Rakel RE, Bope ET,eds. Rakel: Conn's Current Therapy 2002. 54th ed. New York: W. B. Saunders Company; 2002:306-313.
26. Folkers K, Vadhanavikit S, Mortensen SA. Biochemical rationale and myocardial tissue data on the effective therapy of cardiomyopathy with coenzyme Q10. Proc Natl Acad Sci U S A. 1985;82(3):901-904. (PubMed)
27. Belardinelli R, Mucaj A, Lacalaprice F, et al. Coenzyme Q10 and exercise training in chronic heart failure. Eur Heart J. 2006; 27(22):2675-2681. (PubMed)
28. Tran MT, Mitchell TM, Kennedy DT, Giles JT. Role of coenzyme Q10 in chronic heart failure, angina, and hypertension. Pharmacotherapy. 2001;21(7):797-806. (PubMed)
29. Belardinelli R, Mucaj A, Lacalaprice F, et al. Coenzyme Q10 improves contractility of dysfunctional myocardium in chronic heart failure. Biofactors. 2005;25(1-4):137-145. (PubMed)
30. Khatta M, Alexander BS, Krichten CM, et al. The effect of coenzyme Q10 in patients with congestive heart failure. Ann Intern Med. 2000;132(8):636-640. (PubMed)
31. Watson PS, Scalia GM, Galbraith A, Burstow DJ, Bett N, Aroney CN. Lack of effect of coenzyme Q on left ventricular function in patients with congestive heart failure. J Am Coll Cardiol. 1999;33(6):1549-1552. (PubMed)
32. Sander S, Coleman CI, Patel AA, Kluger J, White CM. The impact of coenzyme Q10 on systolic function in patients with chronic heart failure. J Card Fail. 2006;12:464-472. (PubMed)
33. Molyneux SL, Florkowski CM, George PM, et al. Coenzyme Q10: an independent predictor of mortality in chronic heart failure. J Am Coll Cardiol. 2008;52:1435-1441. (PubMed)
34. McMurray JJ, Dunselman P, Wedel H, et al. Coenzyme Q10, rosuvastatin, and clinical outcomes in heart failure: a pre-specified substudy of CORONA (controlled rosuvastatin multinational study in heart failure). J Am Coll Cardiol. 2010;56:1196-1204. (PubMed)
35. Lonnrot K, Tolvanen JP, Porsti I, Ahola T, Hervonen A, Alho H. Coenzyme Q10 supplementation and recovery from ischemia in senescent rat myocardium. Life Sci. 1999;64(5):315-323. (PubMed)
36. Rosenfeldt FL, Pepe S, Linnane A, et al. The effects of ageing on the response to cardiac surgery: protective strategies for the ageing myocardium. Biogerontology. 2002;3(1-2):37-40. (PubMed)
37. Langsjoen PH, Langsjoen AM. Overview of the use of CoQ10 in cardiovascular disease. Biofactors. 1999;9(2-4):273-284. (PubMed)
38. Taggart DP, Jenkins M, Hooper J, et al. Effects of short-term supplementation with coenzyme Q10 on myocardial protection during cardiac operations. Ann Thorac Surg. 1996;61(3):829-833. (PubMed)
39. Singh RB, Niaz MA, Rastogi SS, Shukla PK, Thakur AS. Effect of hydrosoluble coenzyme Q10 on blood pressures and insulin resistance in hypertensive patients with coronary artery disease. J Hum Hypertens. 1999;13(3):203-208. (PubMed)
40. Burke BE, Neuenschwander R, Olson RD. Randomized, double-blind, placebo-controlled trial of coenzyme Q10 in isolated systolic hypertension. South Med J. 2001;94(11):1112-1117. (PubMed)
41. Rosenfeldt FL, Haas SJ, Krum H, et al. Coenzyme Q10 in the treatment of hypertension: a meta-analysis of the clinical trials. J Hum Hypertens. 2007;21:297-306. (PubMed)
42. Ross R. Atherosclerosis--an inflammatory disease. N Engl J Med. 1999;340(2):115-126. (PubMed)
43. Watts GF, Playford DA, Croft KD, Ward NC, Mori TA, Burke V. Coenzyme Q(10) improves endothelial dysfunction of the brachial artery in Type II diabetes mellitus. Diabetologia. 2002;45(3):420-426. (PubMed)
44. Hamilton SJ, Chew GT, Watts GF. Coenzyme Q10 improves endothelial dysfunction in statin-treated type 2 diabetic patients. Diabetes Care. 2009;32:810-812. (PubMed)
45. Lim SC, Lekshminarayanan R, Goh SK, et al. The effect of coenzyme Q10 on microcirculatory endothelial function of subjects with type 2 diabetes mellitus. Atherosclerosis. 2008;196:966-969. (PubMed)
46. Raitakari OT, McCredie RJ, Witting P, et al. Coenzyme Q improves LDL resistance to ex vivo oxidation but does not enhance endothelial function in hypercholesterolemic young adults. Free Radic Biol Med. 2000;28(7):1100-1105. (PubMed)
47. Kuettner A, Pieper A, Koch J, Enzmann F, Schroeder S. Influence of coenzyme Q(10) and cerivastatin on the flow-mediated vasodilation of the brachial artery: results of the ENDOTACT study. Int J Cardiol. 2005;98(3):413-419. (PubMed)
48. Tiano L, Belardinelli R, Carnevali P, Principi F, Seddaiu G, Littarru GP. Effect of coenzyme Q10 administration on endothelial function and extracellular superoxide dismutase in patients with ischaemic heart disease: a double-blind, randomized controlled study. Eur Heart J. 2007;28:2249-2255. (PubMed)
49. Dai YL, Luk TH, Yiu KH, et al. Reversal of mitochondrial dysfunction by coenzyme Q10 supplement improves endothelial function in patients with ischaemic left ventricular systolic dysfunction: a randomized controlled trial. Atherosclerosis. 2011;216:395-401. (PubMed)
50. Gao L, Mao Q, Cao J, Wang Y, Zhou X, Fan L. Effects of coenzyme Q10 on vascular endothelial function in humans: A meta-analysis of randomized controlled trials. Atherosclerosis. 2011;221(2):311-316. (PubMed)
51. McDonnell MG, Archbold GP. Plasma ubiquinol/cholesterol ratios in patients with hyperlipidaemia, those with diabetes mellitus and in patients requiring dialysis. Clin Chim Acta. 1996;253(1-2):117-126. (PubMed)
52. Lim SC, Tan HH, Goh SK, et al. Oxidative burden in prediabetic and diabetic individuals: evidence from plasma coenzyme Q(10). Diabet Med. 2006;23:1344-1349. (PubMed)
53. Henriksen JE, Andersen CB, Hother-Nielsen O, Vaag A, Mortensen SA, Beck-Nielsen H. Impact of ubiquinone (coenzyme Q10) treatment on glycaemic control, insulin requirement and well-being in patients with Type 1 diabetes mellitus. Diabet Med. 1999;16(4):312-318. (PubMed)
54. Eriksson JG, Forsen TJ, Mortensen SA, Rohde M. The effect of coenzyme Q10 administration on metabolic control in patients with type 2 diabetes mellitus. Biofactors. 1999;9(2-4):315-318. (PubMed)
55. Alcolado JC, Laji K, Gill-Randall R. Maternal transmission of diabetes. Diabet Med. 2002;19(2):89-98. (PubMed)
56. Suzuki S, Hinokio Y, Ohtomo M, et al. The effects of coenzyme Q10 treatment on maternally inherited diabetes mellitus and deafness, and mitochondrial DNA 3243 (A to G) mutation. Diabetologia. 1998;41(5):584-588. (PubMed)
57. Gotz ME, Gerstner A, Harth R, et al. Altered redox state of platelet coenzyme Q10 in Parkinson's disease. J Neural Transm. 2000;107(1):41-48. (PubMed)
58. Shults CW, Haas RH, Passov D, Beal MF. Coenzyme Q10 levels correlate with the activities of complexes I and II/III in mitochondria from parkinsonian and nonparkinsonian subjects. Ann Neurol. 1997;42(2):261-264. (PubMed)
59. Isobe C, Abe T, Terayama Y. Levels of reduced and oxidized coenzyme Q-10 and 8-hydroxy-2'-deoxyguanosine in the cerebrospinal fluid of patients with living Parkinson's disease demonstrate that mitochondrial oxidative damage and/or oxidative DNA damage contributes to the neurodegenerative process. Neurosci Lett. 2010;469:159-63. (PubMed)
60. Hargreaves IP, Lane A, Sleiman PM. The coenzyme Q10 status of the brain regions of Parkinson's disease patients. Neurosci Lett. 2008;447:17-19. (PubMed)
61. Shults CW, Oakes D, Kieburtz K, et al. Effects of coenzyme Q10 in early Parkinson disease: evidence of slowing of the functional decline. Arch Neurol. 2002;59(10):1541-1550. (PubMed)
62. Muller T, Buttner T, Gholipour AF, Kuhn W. Coenzyme Q10 supplementation provides mild symptomatic benefit in patients with Parkinson's disease. Neurosci Lett. 2003;341(3):201-204. (PubMed)
63. Storch A, Jost WH, Vieregge P, et al. Randomized, double-blind, placebo-controlled trial on symptomatic effects of coenzyme Q(10) in Parkinson disease. Arch Neurol. 2007;64:938-44. (PubMed)
64. A randomized clinical trial of coenzyme Q10 and GPI-1485 in early Parkinson disease. Neurology. 2007;68:20-28. (PubMed)
65. National Institutes of Health. Effects of Coenzyme Q10 (CoQ) in Parkinson Disease (QE3). ClinicalTrials.gov [Web page]. Available at: http://www.clinicaltrials.gov/ct2/show/NCT00740714?term=coenzyme+Q&rank=2. Accessed 2/15/12.
66. Koroshetz WJ, Jenkins BG, Rosen BR, Beal MF. Energy metabolism defects in Huntington's disease and effects of coenzyme Q10. Ann Neurol. 1997;41(2):160-165. (PubMed)
67. Beal MF. Coenzyme Q10 as a possible treatment for neurodegenerative diseases. Free Radic Res. 2002;36(4):455-460. (PubMed)
68. Ferrante RJ, Andreassen OA, Dedeoglu A, et al. Therapeutic effects of coenzyme Q10 and remacemide in transgenic mouse models of Huntington's disease. J Neurosci. 2002;22(5):1592-1599. (PubMed)
69. Schilling G, Coonfield ML, Ross CA, Borchelt DR. Coenzyme Q10 and remacemide hydrochloride ameliorate motor deficits in a Huntington's disease transgenic mouse model. Neurosci Lett. 2001;315(3):149-153. (PubMed)
70. Stack EC, Kubilus JK, Smith K, et al. Chronology of behavioral symptoms and neuropathological sequela in R6/2 Huntington's disease transgenic mice. J Comp Neurol. 2005;490(4):354-370. (PubMed)
71. Stack EC, Smith KM, Ryu H, et al. Combination therapy using minocycline and coenzyme Q10 in R6/2 transgenic Huntington's disease mice. Biochim Biophys Acta. 2006;1762(3):373-380. (PubMed)
72. Yang L, Calingasan NY, Wille EJ, et al. Combination therapy with coenzyme Q10 and creatine produces additive neuroprotective effects in models of Parkinson's and Huntington's diseases. Journal Neurochem. 2009;109:1427-1439. (PubMed)
73. A randomized, placebo-controlled trial of coenzyme Q10 and remacemide in Huntington's disease. Neurology. 2001;57(3):397-404. (PubMed)
74. Hyson HC, Kieburtz K, Shoulson I, et al. Safety and tolerability of high-dosage coenzyme Q10 in Huntington's disease and healthy subjects. Mov Disord. 2010;25:1924-1928. (PubMed)
75. National Institutes of Health. Coenzyme Q10 in Huntington's Disease (HD) (2CARE). ClinicalTrials.gov [Web page]. Available at: http://www.clinicaltrials.gov/ct2/show/NCT00608881?term=coenzyme+Q10+and+huntington&rank=1. Accessed 3/15/12.
76. Gatchel JR, Zoghbi HY. Diseases of unstable repeat expansion: mechanisms and common principles. Nat Rev Genet. 2005;6(10):743-755. (PubMed)
77. Cooper JM, Schapira AH. Friedreich's Ataxia: disease mechanisms, antioxidant and Coenzyme Q10 therapy. Biofactors. 2003;18(1-4):163-171. (PubMed)
78. Taroni F, DiDonato S. Pathways to motor incoordination: the inherited ataxias. Nat Rev Neurosci. 2004;5(8):641-655. (PubMed)
79. Lodi R, Tonon C, Calabrese V, Schapira AH. Friedreich's ataxia: from disease mechanisms to therapeutic interventions. Antioxid Redox Signal. 2006;8(3-4):438-443. (PubMed)
80. Lodi R, Hart PE, Rajagopalan B, et al. Antioxidant treatment improves in vivo cardiac and skeletal muscle bioenergetics in patients with Friedreich's ataxia. Ann Neurol. 2001;49(5):590-596. (PubMed)
81. Hart PE, Lodi R, Rajagopalan B, et al. Antioxidant treatment of patients with Friedreich ataxia: four-year follow-up. Arch Neurol. 2005;62(4):621-626. (PubMed)
82. Cooper JM, Korlipara LV, Hart PE, Bradley JL, Schapira AH. Coenzyme Q10 and vitamin E deficiency in Friedreich's ataxia: predictor of efficacy of vitamin E and coenzyme Q10 therapy. Eur J Neurol. 2008;15:1371-1379. (PubMed)
83. Folkers K, Osterborg A, Nylander M, Morita M, Mellstedt H. Activities of vitamin Q10 in animal models and a serious deficiency in patients with cancer. Biochem Biophys Res Commun. 1997;234(2):296-299. (PubMed)
84. Hodges S, Hertz N, Lockwood K, Lister R. CoQ10: could it have a role in cancer management? Biofactors. 1999;9(2-4):365-370. (PubMed)
85. Laaksonen R, Fogelholm M, Himberg JJ, Laakso J, Salorinne Y. Ubiquinone supplementation and exercise capacity in trained young and older men. Eur J Appl Physiol Occup Physiol. 1995;72(1-2):95-100. (PubMed)
86. Malm C, Svensson M, Ekblom B, Sjodin B. Effects of ubiquinone-10 supplementation and high intensity training on physical performance in humans. Acta Physiol Scand. 1997;161(3):379-384. (PubMed)
87. Weston SB, Zhou S, Weatherby RP, Robson SJ. Does exogenous coenzyme Q10 affect aerobic capacity in endurance athletes? Int J Sport Nutr. 1997;7(3):197-206. (PubMed)
88. Porter DA, Costill DL, Zachwieja JJ, et al. The effect of oral coenzyme Q10 on the exercise tolerance of middle-aged, untrained men. Int J Sports Med. 1995;16(7):421-427. (PubMed)
89. Braun B, Clarkson PM, Freedson PS, Kohl RL. Effects of coenzyme Q10 supplementation on exercise performance, VO2max, and lipid peroxidation in trained cyclists. Int J Sport Nutr. 1991;1(4):353-365. (PubMed)
90. Bonetti A, Solito F, Carmosino G, Bargossi AM, Fiorella PL. Effect of ubidecarenone oral treatment on aerobic power in middle-aged trained subjects. J Sports Med Phys Fitness. 2000;40(1):51-57. (PubMed)
91. Willis R, Anthony M, Sun L, Honse Y, Qiao G. Clinical implications of the correlation between coenzyme Q10 and vitamin B6 status. Biofactors. 1999;9(2-4):359-363. (PubMed)
92. Mattila P, Kumpulainen J. Coenzymes Q9 and Q10: Contents in foods and dietary intake. J Food Comp Anal. 2001;14(4):409-417.
93. Kamei M, Fujita T, Kanbe T, et al. The distribution and content of ubiquinone in foods. Int J Vitam Nutr Res. 1986;56(1):57-63. (PubMed)
94. Weber C, Bysted A, Holmer G. Coenzyme Q10 in the diet--daily intake and relative bioavailability. Mol Aspects Med. 1997;18 Suppl:S251-254. (PubMed)
95. Shults CW, Flint Beal M, Song D, Fontaine D. Pilot trial of high dosages of coenzyme Q10 in patients with Parkinson's disease. Exp Neurol. 2004;188(2):491-494. (PubMed)
96. Hendler SS, Rorvik DR (eds). PDR for Nutritional Supplements. Montvale: Medical Economics Company, Inc; 2001.
97. Lonnrot K, Holm P, Lagerstedt A, Huhtala H, Alho H. The effects of lifelong ubiquinone Q10 supplementation on the Q9 and Q10 tissue concentrations and life span of male rats and mice. Biochem Mol Biol Int. 1998;44(4):727-737. (PubMed)
98. Zhang Y, Aberg F, Appelkvist EL, Dallner G, Ernster L. Uptake of dietary coenzyme Q supplement is limited in rats. J Nutr. 1995;125(3):446-453. (PubMed)
99. Svensson M, Malm C, Tonkonogi M, Ekblom B, Sjodin B, Sahlin K. Effect of Q10 supplementation on tissue Q10 levels and adenine nucleotide catabolism during high-intensity exercise. Int J Sport Nutr. 1999;9(2):166-180. (PubMed)
100. Matthews RT, Yang L, Browne S, Baik M, Beal MF. Coenzyme Q10 administration increases brain mitochondrial concentrations and exerts neuroprotective effects. Proc Natl Acad Sci U S A. 1998;95(15):8892-8897. (PubMed)
101. Keith M, Mazer CD, Mikhail P, Jeejeebhoy F, Briet F, Errett L. Coenzyme Q10 in patients undergoing CABG: Effect of statins and nutritional supplementation. Nutr Metab Cardiovasc Dis. (PubMed)
102. Hathcock JN, Shao A. Risk assessment for coenzyme Q10 (Ubiquinone). Regul Toxicol Pharmacol. 2006;45(3):282-288. (PubMed)
103. Natural Medicines Comprehensive Database. Therapeutic Research Faculty [Web site]. 11/07/02. Available at: http://www.naturaldatabase.com. Accessed 11/07/02, 2002.
104. Heck AM, DeWitt BA, Lukes AL. Potential interactions between alternative therapies and warfarin. Am J Health Syst Pharm. 2000;57(13):1221-1227; quiz 1228-1230. (PubMed)
105. Folkers K, Langsjoen P, Willis R, et al. Lovastatin decreases coenzyme Q levels in humans. Proc Natl Acad Sci U S A. 1990;87(22):8931-8934. (PubMed)
106. Colquhoun DM, Jackson R, Walters M, et al. Effects of simvastatin on blood lipids, vitamin E, coenzyme Q10 levels and left ventricular function in humans. Eur J Clin Invest. 2005;35(4):251-258. (PubMed)
107. Mabuchi H, Higashikata T, Kawashiri M, et al. Reduction of serum ubiquinol-10 and ubiquinone-10 levels by atorvastatin in hypercholesterolemic patients. J Atheroscler Thromb. 2005;12(2):111-119. (PubMed)
108. Bargossi AM, Battino M, Gaddi A, et al. Exogenous CoQ10 preserves plasma ubiquinone levels in patients treated with 3-hydroxy-3-methylglutaryl coenzyme A reductase inhibitors. Int J Clin Lab Res. 1994;24(3):171-176. (PubMed)
109. Watts GF, Castelluccio C, Rice-Evans C, Taub NA, Baum H, Quinn PJ. Plasma coenzyme Q (ubiquinone) concentrations in patients treated with simvastatin. J Clin Pathol. 1993;46(11):1055-1057. (PubMed)
110. Ghirlanda G, Oradei A, Manto A, et al. Evidence of plasma CoQ10-lowering effect by HMG-CoA reductase inhibitors: a double-blind, placebo-controlled study. J Clin Pharmacol. 1993;33(3):226-229. (PubMed)
111. Laaksonen R, Jokelainen K, Laakso J, et al. The effect of simvastatin treatment on natural antioxidants in low-density lipoproteins and high-energy phosphates and ubiquinone in skeletal muscle. Am J Cardiol. 1996;77(10):851-854. (PubMed)
112. Laaksonen R, Ojala JP, Tikkanen MJ, Himberg JJ. Serum ubiquinone concentrations after short- and long-term treatment with HMG-CoA reductase inhibitors. Eur J Clin Pharmacol. 1994;46(4):313-317. (PubMed)
113. Elmberger PG, Kalen A, Lund E, et al. Effects of pravastatin and cholestyramine on products of the mevalonate pathway in familial hypercholesterolemia. J Lipid Res. 1991;32(6):935-940. (PubMed)
114. Ashton E, Windebank E, Skiba M, et al. Why did high-dose rosuvastatin not improve cardiac remodeling in chronic heart failure? Mechanistic insights from the UNIVERSE study. Int J Cardiol. 2011;146:404-407. (PubMed)
115. Hughes K, Lee BL, Feng X, Lee J, Ong CN. Coenzyme Q10 and differences in coronary heart disease risk in Asian Indians and Chinese. Free Radic Biol Med. 2002;32(2):132-138. (PubMed)
116. Hargreaves IP, Duncan AJ, Heales SJ, Land JM. The effect of HMG-CoA reductase inhibitors on coenzyme Q10: possible biochemical/clinical implications. Drug Saf. 2005;28(8):659-676. (PubMed)
117. Laaksonen R, Jokelainen K, Sahi T, Tikkanen MJ, Himberg JJ. Decreases in serum ubiquinone concentrations do not result in reduced levels in muscle tissue during short-term simvastatin treatment in humans. Clin Pharmacol Ther. 1995;57(1):62-66. (PubMed)
リポ酸
目次
要約
- チオクト酸としても知られるリポ酸(しばしばα-リポ酸と呼ばれる)は、ヒトでも合成される天然由来の化学物質である。(詳細はこちら)
- 内因的に合成されたリポ酸はタンパク質と結合し、ミトコンドリアのいくつかの重要な多酵素複合体に対する補助因子として機能する。(詳細はこちら)
- リポ酸補給をすると、非結合リポ酸の血漿および細胞での濃度が過渡的に上昇する。(詳細はこちら)
- リポ酸は直接的な抗酸化物質であるが、生体内におけるラジカル除去活性の上昇は過渡的であろう。リポ酸はまた抗酸化防御を引き起こし、細胞のブドウ糖取り込みを強化し、様々な細胞シグナル分子や転写因子の活性を調整するのかもしれない。(詳細はこちら)
- 小規模無作為化対照研究からのエビデンスで、高用量のリポ酸は代謝障害のある者のブドウ糖利用の測定値を改善させるかもしれないことが示唆されている。(詳細はこちら)
- 経静脈または経口でのリポ酸治療は糖尿病性末梢神経障害の症状を軽減することに役立つかもしれないことが、公開されたエビデンスから示唆される。糖尿病性神経障害の治療へのリポ酸の効能をを調べる研究の多くはあるドイツの研究グループによって行われ、ドイツのリポ酸製造業者によって資金提供されていることに留意することが重要である。(詳細はこちら)
- 多発性硬化症のマウスモデルに投与すると、リポ酸が疾患の進行を遅くすることがわかった。進行性多発性硬化症の患者の運動性喪失や脳体積変化に対するリポ酸の効果を評価するように考案された2年間の臨床試験が進行中である。(詳細はこちら)
- アルツハイマー病患者にリポ酸補給が有益であるかどうかを示唆するエビデンスは、現在あまりに限定的である。(詳細はこちら)
- 肥満指数が高い者の体重管理に、リポ酸補給が何らかの有益性を示すかもしれない。(詳細はこちら)
- リポ酸は天然にはタンパク質と共役結合して食物中に存在するが、サプリメントは非結合の(遊離)リポ酸を含む。サプリメントを使用するなら、ライナス・ポーリング研究所は全般的に健康な者に対して200~400 mg/日という毎日の用量を推奨する。
序説
チオクト酸としても知られるリポ酸(しばしばα-リポ酸と呼ばれる)は、植物やヒトを含む動物によって合成される天然由来の有機硫黄化合物である(1,2)。リポ酸は特定のタンパク質に共役結合しており、それらはミトコンドリアのエネルギーおよびアミノ酸代謝に関わる必須多酵素複合体の一部として機能する(「生物活性」の項参照)。タンパク質に結合したリポ酸の生理学的機能に加えて、薬理学的用量の遊離(非結合性)リポ酸を治療に使用する可能性に科学的および医学的関心が高まっている(3)。リポ酸は2つのチオール(硫黄)基を含み、これらは酸化もしくは還元されうる。ジヒドロリポ酸は、リポ酸の還元型である(図1参照)(4)。リポ酸はまた非対称性の炭素も含み、これはリポ酸が鏡像異性体とも呼ばれる2つの光学異性体のうちの一つとして存在しうることを意味する。これらの鏡像異性体は、R-リポ酸とS-リポ酸という互いを鏡に写した像になっている(図1参照)。R型の鏡像異性体のみが内因的に合成され、タンパク質と共役結合する。R-リポ酸は食物中に天然に存在する(「食物の摂取源」の項参照)。遊離(非結合性)リポ酸のサプリメントはR-リポ酸であるか、もしくはR-リポ酸とS-リポ酸が半々(ラセミ)の混合物であるかもしれない(「サプリメント」の項参照)。
代謝と生物学的利用性
内因性生合成
リポ酸の合成は、Saccharomyces cerevisiaeという酵母について特徴が詳細に明らかにされてきたが、この過程に関わる全ての遺伝子がヒトで同定されたわけではない(5)。リポ酸は、脂肪酸の合成過程においてアシルキャリアタンパク質(ACP;「パントテン酸」のタイトルの記事参照)に結合した8炭素(C8:0)脂肪酸であるオクタン酸から、ミトコンドリア内で新規に合成される(図2参照)。リポイルトランスフェラーゼ2(オクタノイルトランスフェラーゼ2)と呼ばれる酵素が、オクタノイル-ACPからグリシン開裂系におけるHタンパク質の保存リシンへのオクタノイル部分の移動を触媒する(「生物活性」の項参照)。次の反応はHタンパク質に結合したオクタノイル部分の6位および8位に2つの硫黄原子を挿入することで、それによってジヒドロリポイル部分が生成される。この段階は、この反応において硫黄供与体として働く鉄-硫黄クラスターを含むリポ酸合成酵素(リポイルシンターゼともいう)によって触媒される(5)。最後に、グリシン開裂系のHタンパク質から多酵素複合体であるα-ケト酸脱水素酵素のE2成分にある保存リシン残基へのジヒドロリポイル部分の移動を、リポイルトランスフェラーゼ1酵素が触媒する(5)。ジヒドロリポイル部分の酸化は、ジヒドロリポアミド脱水素酵素によって触媒される(図2参照)。
食事性およびサプリメントのリポ酸
食物からリポ酸を摂取することで、ヒトの血漿や細胞で遊離リポ酸が検出可能なまでに増加することになるという発見はまだない(3,6)。対照的に、経口で高用量遊離リポ酸(50 mg以上)を摂取すると、血漿や細胞での遊離リポ酸濃度が過渡的にだが相当に増加する。ヒトでの薬理動態学的研究で、経口用量のR-リポ酸とS-リポ酸のラセミ混合物の約30~40%が吸収されることがわかった(6,7)。経口リポ酸サプリメントは、空腹時の方が食物と一緒に摂るよりもよく吸収された。食物と一緒にリポ酸を摂取すると、(食物なしの場合より)血漿リポ酸のピーク濃度が約30%、全体的な血漿リポ酸濃度が約20%減少した(8)。R-リポ酸の液体製剤はさらに吸収がよく、血漿でより安定であることがわかった。このことから糖尿病性神経障害のような症状の管理には、そちらの方が固体製剤よりも効能があるかもしれないことが示唆される(9,10)。
リポ酸の2つの異性体には、生物学的利用性の差もあるかもしれない。RとS-リポ酸(ラセミ混合物)の経口用量1回分の摂取後、R-リポ酸のピーク血漿濃度はS-リポ酸よりも40~50%高かったことがわかり、これはR鏡像異性体の方が選ばれて差異的に吸収されることを示唆している(6,8,11)。しかしながら、経口摂取後はどちらの鏡像異性体も急速に代謝され排泄される。血漿リポ酸濃度は一般的に1時間以内にピークとなり、急速に低下する(6,7,11,12)。細胞ではリポ酸は迅速にジヒドロリポ酸に還元され、in vitro(ガラス容器内)の研究ではジヒドロリポ酸はその後速やかに細胞から排出されることが示されている(3)。さらに、19人の健康な成人による予備研究では、RとS-リポ酸の生物学的利用性とR-リポ酸のそれは、年齢や性別によって異なるかもしれないことが示唆された(13)。
最後に、ヒトでは外因性リポ酸がATP(アデノシン三リン酸)やGTP(グアノシン三リン酸)で「活性化」されて、リポイルトランスフェラーゼによってリポ酸依存性酵素に組み込まれるというエビデンスはない(14)。結果として、内因性のリポ酸合成における欠陥(「欠乏症」の項参照)によって起こされるリポ酸依存性酵素活性が喪失しても、リポ酸の外因的供給では治せない(5)。
生物活性
タンパク質結合のリポ酸
酵素の補助因子
R-リポ酸は、アミノ酸の異化作用(分解)やエネルギー生産に関係する非常に重要な反応を触媒するいくつかのミトコンドリア多酵素複合体に必須の補助因子である(15)。R-リポ酸は各多酵素複合体の少なくとも1つのタンパク質における特定のリシン残基に共役結合している。そのような非タンパク質補助因子は、「補欠分子族」として知られる。
R-リポ酸は、次の多酵素複合体の生物活性の補欠分子族として機能する。
●グリシンの脱炭酸反応を触媒し、メチレン基(-CH2)のテトラヒドロ葉酸への付加と相まって核酸合成における重要な補助因子である5,10-メチレンテトラヒドロ葉酸を作るグリシン開裂系(図3参照)。グリシン開裂系内では、R-リポ酸はHタンパク質の保存リシンに共役結合している(図2、3参照)。
●以下の4つのα-ケト酸脱水素酵素複合体(図4参照)
(i)クエン酸回路を経してのエネルギー生産に重要な基質であるアセチル補酵素A(CoA)へとピルビン酸を変換する反応の触媒作用をするピルビン酸脱水素酵素複合体;
(ii)クエン酸回路の別の重要な中間体であるスクシニルCoAへとα-ケトグルタル酸を変換する反応を触媒するα-ケトグルタル酸脱水素酵素複合体;
(iii)ロイシン、イソロイシン、バリンという分岐鎖アミノ酸の異化経路におけるケト酸の脱炭酸反応に関わる分岐鎖α-ケト酸脱水素酵素複合体;
(iv)リシン、ヒドロキシリシン、およびトリプトファンの異化経路において2-オキソアジピン酸からグルタリルCoAへの脱炭酸反応を触媒する2-オキソアジピン酸脱水素酵素複合体。
これら4つのα-ケト酸脱水素酵素複合体は、E1、E2、E3という3つの酵素の活性がある。E1は、チアミンピロリン酸(TPP)依存性のα-ケト酸脱水素酵素である。R-リポ酸は、E2のアシルトランスフェラーゼの活性に不可欠な補欠分子族として機能する。E3は、フラビンアデニンジヌクレオチド(FAD)依存性ジヒドロリポアミド脱水素酵素である(図4参照)。R-リポ酸はまた、ピルビン酸脱水素酵素複合体のE3結合タンパク質(Xタンパク質成分)にも見られる(5)。
非結合のリポ酸
サプリメントの(非結合の)リポ酸の生物活性を考慮する際には、血漿および組織でのリポ酸増加が限定的および過渡的であるという本質を心に留めておくことが重要である(「代謝と生物学的利用性」の項参照)(3)。
抗酸化作用
活性酸素種および活性窒素種の除去:活性酸素種(ROS)および活性窒素種(RNS)は、DNA、タンパク質、および細胞膜の脂質に損傷を与える可能性のある非常に反応性の高い化合物である。リポ酸もジヒドロリポ酸も、生理学的に関連のあるROSやRNSを試験管内では直接的に除去(中和)できる((3)の文献でレビュー)。しかし直接的な除去反応が、in vivoで(生体内で)起こるのかどうかはわかっていない。経口補給で達成できるであろう遊離リポ酸の組織での最大濃度は、ビタミンCやグルタチオンのようなその他の細胞内抗酸化物質のそれの10分の1未満である。また遊離リポ酸は急速に細胞から取り除かれるため、直接的なラジカル除去作用の増加は持続しないであろう。
その他の抗酸化物質の再生:抗酸化物質がフリーラジカルを除去する際にはそれ自体が酸化され、それが還元されるまではさらにROSやRNSを除去することができない。試験管内では、ジヒドロリポ酸はコエンザイムQ10、ビタミンC、およびグルタチオンを含むいくつかの重要な抗酸化物質の酸化型を還元する能力を持つ強力な還元剤である(図5参照)(16,17)。ジヒドロリポ酸はまた、酸化されたビタミンC(「ビタミンE」のタイトルの記事参照)(18)または酸化されたコエンザイムQ10(「コエンザイムQ10」のタイトルの記事参照)(19)の再生によって、酸化されたα-トコフェロール(ビタミンE)を直接または間接的に還元するのかもしれない。ジヒドロリポ酸が生理学的な状況で効果的に抗酸化物質を再生するのかどうかは不明である(3)。
金属のキレート化:遊離鉄や遊離銅のような酸化還元活性のある金属イオンは、非常に反応性の高いフリーラジカルを生成する反応の触媒をすることによって、酸化ダメージを誘発することがある(20)。遊離金属イオンをフリーラジカルの生成を防ぐようなやり方でキレート化する化合物は、金属誘発性の酸化ダメージが病原として関わっているかもしれない神経変性疾患やその他の慢性疾患の治療に有望である(21)。リポ酸もジヒドロリポ酸も、試験管内では銅および鉄を介した酸化ダメージを阻害し、動物モデルでは過剰な鉄および銅の蓄積を阻害することがわかっている(24,25)。リポ酸はまた、重金属毒性に対する補助療法として役立つかもしれない。水銀の毒性に対してリポ酸をキレート剤として使用することを調べた臨床試験はないが、それはいくつかの哺乳動物では有効であると証明されている(26,27)。
抗酸化シグナル伝達経路の活性化:グルタチオンも、発がん性や毒素があるかもしれない物質の解毒や除去に関わる重要な細胞内抗酸化物質である。老いた動物における(若い動物に比べての)グルタチオンの合成低下や組織での濃度低下から、酸化ストレスや毒素にさらされた際の反応が低下する可能性が示唆される(28)。培養細胞や、リポ酸を与えられた老齢の動物において、リポ酸はグルタチオン濃度を上昇させることがわかっている(29,30)。リポ酸は、グルタチオン合成の律速酵素であるγグルタミルシステインリガーゼ(γ-GCL)の発現を上方制御すること(31)で、またグルタチオン合成に必要なアミノ酸であるシステインの細胞への取り込みを増やすこと(32)で、老いたラットにおけるグルタチオン合成を増やすことができるかもしれない。核内因子E2関連因子2(Nrf2)依存性経路の活性化を通して、リポ酸はγ-GCLやその他の抗酸化酵素の発現を上方制御することがわかっている(31,33)。
手短に言えば、Nrf2はサイトゾル(細胞基質)内のケルヒ様ECH関連タンパク質1(Keap1)に結合した転写因子である。Keap1は、Nrf2を放出することで酸化ストレスシグナルに反応する。放出の際には、抗酸化酵素や捕捉剤を符号化する遺伝子のプロモーター領域にある抗酸化剤応答配列(ARE)と結合可能な核にNrf2が移動する。リポ酸-ただしジヒドロリポ酸ではない-はKeap1の特定のスルフヒドリル残基と反応可能で、Nrf2の放出を起こす(34)。Nrf2/ARE標的遺伝子は、γ-GCL、NAD(P)Hキノン酸化還元酵素1(NQO-1)、ヘムオキシゲナーゼ1(HO-1)、カタラーゼ、およびスーパーオキシドディスムターゼ(SOD)を含むいくつかの抗酸化反応仲介物質を符号化する。たとえば、培養肝細胞や肥満もしくは糖尿病のラットの肝臓では、リポ酸でNrf2経路を上方制御すると、脂質過剰で誘発される脂肪肝や細胞死が防がれた(36)。Nrf2経路やその他の抗炎症性経路の活性化を通して、リポ酸はまたメトトレキサートで治療したラットの酸化ストレス誘発性肝臓障害から肝臓を保護した(37)。治療前および治療後にリポ酸を与えると、Nrf2を介したHO-1の上方制御によって、ラットのリポ多糖(LPS)誘発性病理組織学的肺変質がそれぞれ予防および回復した(38)。
ニコチンアミドアデニンジヌクレオチドリン酸(NADPH)酸化酵素(NOX)の阻害:NOXは酸素とNADPHからのスーパーオキシド生成を触媒する細胞膜結合酵素複合体であり、微生物に対する自然免疫防御に関わる(39)。リポ酸は、インスリン-ホスファチジルイノシトール3キナーゼ(PI3K)-プロテインキナーゼB(PKB/Akt)シグナル伝達経路を上方制御することで、脳虚血のラットモデルでNOX誘発性のスーパーオキシド生成を防ぎ、梗塞体積と神経学的欠損を制限した(40)。胃がん細胞をリポ酸で治療すると、NOXで発生するROSの生成と、ヘリコバクター・ピロリ菌(H.pylori)感染に誘発されたがん細胞増殖を低下させた(41)。
細胞のブドウ糖取り込みの調整
インスリンがインスリン受容体と結合するとタンパク質のリン酸化カスケードを刺激し、グルコース輸送体(GLUT4)の細胞膜への移動や細胞のブドウ糖取り込みの増加につながる(3,42)。リポ酸は培養細胞でインスリンシグナル伝達カスケードを活性化し(3,42,43)、GLUT4の細胞膜への移動を増やし、培養された動物性脂肪細胞および筋肉細胞でのブドウ糖取り込みを増やす(44,45)ことがわかっている。コンピュータモデルによる研究で、リポ酸はインスリン受容体の細胞内チロシンキナーゼ領域と結合し、この酵素の活性型を安定化させているかもしれないことが示唆された(43)。
その他のシグナル伝達経路の調整
Nrf2やインスリンシグナル伝達経路に加えて、リポ酸はその他の細胞シグナル伝達分子を標的にし、それによって代謝、ストレス反応、分裂、および生存といった様々な細胞プロセスに影響することがわかった。たとえば培養された内皮細胞では、酸化還元感受性で炎症促進性の転写因子である核内因子カッパB(NFKB)のサイトゾルから核への移動を促進する酵素であるIKK-βを、リポ酸が阻害することがわかっている(46)。リポ酸はまた、内皮一酸化窒素(NO)合成酵素(eNOS)のPKB/Akt依存性リン酸化とeNOSに触媒されたNO生成を増やすことで、年老いたラットのNO依存性血管拡張を高めることが示されている(47)。さらに、年老いたマウスの骨格筋においてAMPに活性化されたプロテインキナーゼ(AMKP)誘発性の転写因子PGC-1αの活性化を起こすことで、リポ酸はミトコンドリアでの生合成を増やした(48)。様々なモデルや異なる実験条件下でリポ酸の標的の可能性のある経路について、いくつかの文献レビューで述べられている(49~52)。
欠乏症
リポ酸欠乏症は、リポ酸生合成経路における遺伝性突然変異の稀な症例として述べられてきた。リポ酸代謝に欠陥のある患者で見つかっている突然変異は、鉄-硫黄クラスターの合成に関わる遺伝子や、リポ酸合成酵素(LIAS)、リポイルトランスフェラーゼ1(LIPT1)、およびジヒドロリポアミド脱水素酵素(DLD;α-ケト酸脱水素酵素複合体のE3成分)を符号化する遺伝子に影響する(5,53,54)。
疾病治療
糖尿病
慢性的に高い血中ブドウ糖濃度は、糖尿病の特徴である。1型糖尿病は膵臓のインスリン生成β細胞の自己免疫破壊によって起こり、インスリン生成が不十分になる。正常な血中ブドウ糖濃度(すなわち、空腹時血糖が100 mg/dL未満)を維持するために、インスリンを外部から補給することが必要である。対照的に、インスリンに反応しての組織でのブドウ糖取り込み障害(インスリン抵抗性と呼ばれる現象)が、2型糖尿病の発症に重要な役割をする(55)。2型糖尿病患者は最終的にインスリンが必要になるかもしれないが、インスリン感受性を強める介入が正常な血中ブドウ糖濃度を維持するために行われるかもしれない。「前糖尿病」という用語は、2型糖尿病発症リスクが高くなる初期の代謝異常を表すために時折使われる。留意したいのは、これらの患者は心血管疾患リスクも高いことだ。米国糖尿病学会によると、前糖尿病は空腹時血糖濃度が100 mg/dL~125 mg/dLの間であるということが特徴的な空腹時血糖異常の状態であること、および/または経口ブドウ糖負荷試験の後の2時間血糖濃度が140 mg/dL以上であることが特徴的な耐糖能障害の状態であることとして定義される(56)。
ブドウ糖の利用
ブドウ糖の利用に対する高用量リポ酸の効果は、初めに2型糖尿病の者について調べられた。13人の2型糖尿病患者による初期の臨床試験で、1,000 mgのリポ酸の単回静脈内注入によって、インスリン刺激性ブドウ糖処理(すなわちインスリン感受性)がプラセボ注入に比べて50%向上したことがわかった(57)。72人の2型糖尿病患者によるプラセボ対照研究で、600 mg/日、1,200 mg/日、または1,800 mg/日のリポ酸の経口投与で、治療後4週間のインスリン感受性が25%向上したことがわかった(58)。これら3種類のリポ酸用量における有意な差はなく、このことから600 mg/日が最大有効用量であるかもしれないことが示唆される(55)。しかし102人の被験者による最近の無作為化プラセボ対照研究で、16週間毎日600 mgのリポ酸(さらに800 mgのビタミンE(α-トコフェロール)を追加もしくは追加無しで)補給をしても、空腹時血糖、空腹時インスリン、または恒常性モデル評価によるインスリン抵抗性指標(HOMA-IR)と呼ばれるインスリン抵抗性測定値に何の効果もなかった(59)。2018年のシステマティックレビュー(概説)やメタ解析で、代謝障害(2型糖尿病に限らない)のある1,245人の被験者におけるブドウ糖利用のマーカーに対するリポ酸補給の効果を調べた20の無作為化対照試験(2007~2017年に発表)が確認された(60)。他の栄養素と一緒もしくは単独でリポ酸投与(200~1,800 mg/日を2週間~1年)をすると、空腹時血糖およびインスリン濃度、インスリン抵抗性、および過去数ヶ月間の血糖コントロールのマーカーである血中HbA1c濃度が下がったことがわかった(60)。
内皮機能
血管内皮として知られる血管の内皮は、心臓や血管の健康維持に重要な役割をする。特に、血管拡張と呼ばれる現象である動脈を含む全てのタイプの血管の弛緩を促進することで、一酸化窒素(NO)は血管の緊張と血流を調整する。NOが仲介する内皮依存性血管拡張の変化は、広汎な血管収縮や凝結異常に至り、アテローム性動脈硬化症発症の初期段階であると考えられている。慢性的な高血糖、インスリン抵抗性、酸化ストレス、および炎症促進性メカニズムの存在が、糖尿病患者の内皮機能障害に寄与する(61)。
上腕の血流依存性血管拡張反応(FMD)の測定値は、内皮機能の代替マーカーとしてしばしば使用される。内皮依存性血管拡張を測定するために、2つの技法が使用されている。一つは、アセチルコリンを注入した間の静脈閉塞プレチスモグラフィーによって前腕の血流を測定する。この侵襲性技法の使用によって、リポ酸の動脈内注入で2型糖尿病の39人の被験者で内皮依存性血管拡張が向上したが、11人の健康な対照群ではそうではなかったことがわかった(62)。2型糖尿病の30人の患者による最近の無作為化二重盲検プラセボ対照研究で、内皮依存性血管拡張剤であるアセチルコリンへの反応が600 mgのリポ酸の静脈内注入によって向上したが、内皮非依存性血管拡張剤である三硝酸グリセリンに対する反応は向上しなかったことがわかった(63)。血流仲介性血管拡張を測定する超音波を使用した非侵襲性である別の技法は、Xiang et al.によって行われた2つの追加的研究で使用された(64,65)。これらの無作為化プラセボ対照研究の結果から、静脈内リポ酸注入が空腹時血糖異常(64)や耐糖能異常(65)の患者の内皮機能を向上させるかもしれないことが示された。
ブドウ糖および脂質の代謝異常が特徴的症状であるメタボリック症候群と診断された58人の患者への経口リポ酸補給の効果を評価した一つの無作為化プラセボ対照試験では、300 mg/日のリポ酸を4週間補給したところ、血流仲介性血管拡張が44%向上したことが示された(66)。
糖尿病性神経障害
末梢神経障害:糖尿病患者の最大50%がとりわけ下肢の痛み、感覚の喪失、および脱力を起こすかもしれない神経障害の一種である末梢神経障害を発症する(67)。末梢神経障害は、糖尿病患者の下肢切断の主因でもある(68)。慢性的高血糖誘発性神経障害を説明するいくつかのメカニズムが提唱されており、ソルビトールの細胞内蓄積、糖化反応、および酸化ストレスやニトロソ化ストレスなどがある((69)の文献でレビュー)。いくつかの大規模無作為化対照試験の結果から、血糖を正常に近い濃度に維持することが糖尿病性神経障害や下肢切断のリスクを制限する最も重要なステップであることが示された(70~72)。しかし神経障害の予防における糖血症のコントロール強化の効能は、1型糖尿病患者の方が2型糖尿病患者よりも高い(73)。さらに、この血糖コントロール介入は低血糖発作のリスクを上げる(73)。
神経障害症状の管理における静脈内または経口での投与によるリポ酸の効能が、糖尿病患者で調べられてきた。無作為化対照試験のメタ解析では、300~600 mg/日のリポ酸注入を2~4週間することで、糖尿病性神経障害の症状が臨床的に有意義な程度まで大きく軽減したことが示唆された(55,74)。経口リポ酸補給の効能について、24人の2型糖尿病患者による初期の短期間研究で、600 mgのリポ酸を1日に3回3週間補給した者は、プラセボを摂取した者に比べて末梢神経障害の症状がよくなったことがわかった(75)。より大規模な臨床試験では、500人超の2型糖尿病患者および症候性末梢神経障害患者に次の治療のうちの一つを無作為にあてがった。それらは(i)600 mg/日のリポ酸静脈注入を3週間やり、1,800 mg/日の経口リポ酸補給を6ヶ月間、(ii)600 mg/日のリポ酸静脈注入を3週間やり、経口プラセボ補給を6ヶ月間、または(iii)プラセボの静脈注入を3週間やり、経口プラセボ補給を6ヶ月間のいずれかである(76)。医師によって評価された感覚および運動面における欠陥の改善エビデンスは3週間のリポ酸静脈注入による治療で観察されたかもしれないが、6ヶ月間の経口リポ酸治療の終わりには見られなかった。しかし糖尿病性神経障害のある181人の患者による別の無作為化二重盲検プラセボ対照試験で、5週間の600 mg/日、1,200 mg/日、または1,800 mg/日のいずれかの経口リポ酸補給によって、神経障害の症状が大きく改善したことがわかった(77)。この研究では、600 mg/日の用量でもそれより高い用量と同じ効果があった。最後に、遠位対称性感覚運動性多発神経障害のある421人の糖尿病患者による4年間の多機関臨床試験で、下肢および神経伝導の神経性障害を評価する総合点である主要エンドポイントにおいて、600 mg/日の経口リポ酸投与とプラセボとでは何の差も見られなかったことがわかった(78)。しかし、特定の神経性障害の測定値(二次的結果)は、リポ酸補給で改善した(78)。事後解析においては、正常な肥満指数(BMI)と血圧であるが心血管疾患、糖尿病、および神経障害が重い被験者ではとりわけ、経口リポ酸補給で神経障害的症状が軽減するかもしれないことが示唆された(79)。
自律神経障害:糖尿病の別の神経性合併症は心臓自律神経障害(CAN)であり、これは25%もの糖尿病患者に発生する(55)。CANは心臓および血管の神経支配をする神経線維の損傷が特徴的であり、心拍変動(心臓鼓動の間隔時間の変動性)の低下や死亡リスク上昇に至る(80)。2型糖尿病および心拍変動低下のある72人の患者による無作為化対照試験で、4ヶ月間800 mg/日の経口リポ酸補給をしたら、プラセボに比べて心拍変動の4つの測定値のうちの2つがかなり改善した(81)。
要約:全体的に、静脈注入または経口でのリポ酸による治療は糖尿病性末梢神経障害の症状を軽減するのに役立つかもしれないことが、公表されている研究では示唆されている。糖尿病性神経障害の治療にリポ酸を使用することは、現在ドイツで承認されている(4)。糖尿病性神経障害の治療におけるリポ酸の効能を調べた多くの研究は、主にドイツのある研究グループによって行われ、ドイツのリポ酸製造会社によって資金提供されていることに留意することが重要である(82)。
糖尿病性網膜症
慢性的な高血糖は網膜の血管を損ない、糖尿病性網膜症と呼ばれる視覚を脅かす可能性のある状態を起こすことがある(83)。あるプラセボ対照研究で、12人の1型糖尿病の者、48人の2型糖尿病の者、および20人の糖尿病のない者という80人の参加者の視覚能力に対するリポ酸の効果が調べられた。その結果、毎日300 mgのリポ酸の3ヶ月間経口投与によって、プラセボに比べて糖尿病患者のコントラスト感度の悪化が防がれ、健康な者ではそれが向上したことが示された(84)。
多発性硬化症
多発性硬化症は病因が未知の自己免疫疾患で、中枢神経系のミエリンと神経線維の進行的破壊が特徴的であり、これを患う者に神経性症状を引き起こす(85)。多発性硬化症には病気の進み方によって定義された4つの主要なタイプがある。それらは(i)臨床的に単独性の症状、(ii)再発寛解型多発性硬化症、(iii)二次性進行型多発性硬化症、および(iv)一次性進行型多発性硬化症である(詳細については米国多発性硬化症協会のウェブサイトを参照のこと)(86)。多発性硬化症のモデルである実験的自己免疫性脳脊髄膜炎(EAE)のマウスに経口(87)で、腹腔内(88)に、または皮下(89)にリポ酸を投与すると、疾患の進行を効果的に遅らせることがわかった。動物およびin vitroの研究では、自然免疫機能の中心的調整物質である環状アデノシン一リン酸(cAMP)の生成を促進するメカニズムを介してリポ酸が免疫調整特性を示し、おそらくは細胞接着分子の内皮での発現を減らしたり、マトリクスメタロプロテアーゼ(細胞外基質分解酵素、MMP)などの酵素の発現を阻害したり、および/または血液脳関門の浸透性を下げたり(87,89,93,94)して、脳や脊髄への免疫細胞の移動を阻害する(92)ことがわかった。
ヒトへのリポ酸補給について調べた研究は少ない。再発型または進行型多発性硬化症の30人の者へのリポ酸投与の安全性を評価するために考案された小規模予備研究で、2週間1,200~2,400 mg/日の経口リポ酸で治療したところ、全般的によい耐容性があったことがわかった(「安全性」の項参照)(95)。この研究では、血清リポ酸濃度が高いことと炎症マーカーであるMMP-9の最低血清濃度との関連があった(95)。別の研究では、多発性硬化症の被験者に1,200 mgの経口用量のリポ酸を投与すると、マウスで治療効果があるとわかっている血清リポ酸濃度と同様の濃度になることに役立つかもしれないことが示唆された(96)。再発寛解型多発性硬化症の52人の被験者(平均年齢30歳)による無作為化プラセボ対照研究で、リポ酸補給(1,200 mg/日を12週間)によって血中の全抗酸化能力が高まったが、特定の抗酸化酵素(スーパーオキシドジスムターゼおよびグルタチオンペルオキシダーゼ)の活性は高まらなかったことがわかった(97)。リポ酸補給はまた、いくつかのマーカー(IFN-γ、ICAM-1、TGF-γ、IL-4)の血清濃度、サイトカイン、およびその他の炎症を低減させたが、すべてのマーカーがそうだったわけではない(TNF-γ、IL-6、MMP-9)(98)。さらに、リポ酸補給は総合障害度評価尺度(EDSS)スコアで評価された多発性硬化症の症状の重篤度を下げたわけではない(98,99)。
進行型多発性硬化症患者の運動性喪失や脳体積変化に対するリポ酸(1,200 mg/日)の効果を評価するように考案された2年間の臨床試験が、現在進行中である(85)。
認知機能障害と認知症
加齢および神経変性疾患の動物モデルによる研究で、リポ酸投与によって空間記憶、学習能力、および/または運動機能の測定値が改善するかもしれないことが示された((100)の文献でレビュー)。
経口リポ酸補給によって、ヒトの加齢に関連した認知機能低下または病理的症状を遅くできるのかどうかはわからない。アセチルコリンエステラーゼ阻害薬も服用しているアルツハイマー病であろう患者および関連する認知症の患者9人による非対照オープンラベル試験で、600 mg/日の経口リポ酸補給で1年間にわたって認知機能が安定化したようだと報告された(101)。43人の患者を最長4年間追跡したその後の研究で、アセチルコリンエステラーゼ阻害薬とともにリポ酸(600 mg/日)を摂取した軽度認知症または初期の中度認知症の者は、文献で報告されたようなアルツハイマー病患者の典型的な認知機能低下に比べて、認知機能低下がゆっくりだったことがわかった(102)。しかしこれらの発見の重要性を、比較のための対照群なしで評価することは難しい。ある無作為化対照試験で、1,200 mg/日の経口リポ酸補給を10週間しても、HIVに関連した認知機能障害に何の有益性もなかったことがわかった(103)。アルツハイマー病の39人の患者による別の無作為化試験の結果では、魚油濃縮物(オメガ3脂肪酸が豊富)をリポ酸有り(600 mg/日)または無しで1年間補給したら、手段的日常生活動作(IADL)スコアで評価された認知的および機能的障害の進行が、プラセボに比べて遅くなったことが示唆された(104)。興味深いことに、魚油濃縮物をリポ酸と一緒に摂取した患者は、魚油濃縮物のみまたはプラセボを摂取した者に比べて、12ヶ月にわたって全体的認知機能(ミニメンタルステート検査(MMSE)で評価)が何も悪化しなかった(104)。これらの予備的発見を確認し、神経変性疾患の予防および/または管理におけるリポ酸補給の有益性をさらに評価する大規模試験が必要である。
体重管理
無作為化プラセボ対照試験の2018年のメタ解析で、肥満指数(BMI)が高い者へのリポ酸補給によって、カロリー制限なし(1つの研究を除く)であっても体重(9つの研究)およびBMI(11の研究)が穏やかながら有意義に減ったことがわかった(105)。サブグループ(部分集団)解析によって、体重過多の者は肥満の者より、不健康な者は健康な者より体重減少が大きく、さらに毎日の用量が600 mg以上で、また介入期間が10週間より短い場合に体重減少が大きかったことがわかった。リポ酸補給をしても、腹囲の減少はなかった(5つの研究)(105)。体重過多または肥満の被験者へのリポ酸補給で体重やBMIが実質的に減ることは、以前のメタ解析でも報告されていた(106)。
摂取源
内因性生合成
R-リポ酸はヒトによって内因的に合成される(「代謝と生物学的利用性」の項参照)。
食物の摂取源
R-リポ酸は、食物中でタンパク質中のリシン(リポイルリシン、図1参照)と共役結合して天然発生する。リポ酸は植物から動物まで幅広い食物源中で見られるが、リポ酸の量に関する情報または食物中のリポイルリシン含有量の情報は限られている。すなわち、公的なデータベースがない。リポイルリシン含有量の多い(約1~3μg/乾燥重量g)動物組織には腎臓、心臓、および肝臓があり、リポイルリシンの豊富な植物にはホウレンソウやブロッコリーがある(107)。それよりやや低いリポイルリシン(約0.5μg/乾燥重量g)は、トマト、豆、および芽キャベツに見られる。
サプリメント
食物中のリポ酸と異なり、サプリメント中のリポ酸はタンパク質と結合していない。さらに、栄養補助食品で摂取可能なリポ酸の量(50~600 mg)は、食事から得られるであろう量の1,000倍にもなるであろう。ドイツではリポ酸は糖尿病性神経障害の治療用に承認され、処方箋で入手可能である(108)。米国では、リポ酸は処方箋なしで栄養補助食品として市販されている。ほとんどのリポ酸サプリメントは、R-リポ酸とS-リポ酸(時としてd,l-リポ酸と注記される)のラセミ混合物を含む。R-リポ酸のみを含むとしているサプリメントは通常はより高価で、その純度についての情報は一般利用ができない(109)。食事と一緒にリポ酸を摂取するとその生物学的利用性が下がるので、リポ酸は一般的に食事の30分前に摂取するよう推奨される(「代謝と生物学的利用性」の項も参照)(8)。
ラセミ混合物とR-リポ酸のみの比較
R-リポ酸は植物や動物によって合成される異性体で、タンパク質と結合した形態でミトコンドリア酵素の補助因子として機能する(「生物活性」の項参照)。経口ラセミ混合物とR-リポ酸のサプリメントの生物学的利用性の直接的比較は公表されていない。R、S-リポ酸の摂取後、R-リポ酸のピーク血漿濃度はS-リポ酸のそれより40~50%高いことがわかり、このことからR-リポ酸の方が吸収が良いことが示唆される。そうではあるものの、どちらの異性体も急速に代謝され除去される(6,8,11)。ラットでは、R-リポ酸はS-リポ酸より骨格筋でのインスリン刺激性グルコース輸送と代謝の強化により効果的(110)であり、R-リポ酸は白内障の予防にR、S-リポ酸やS-リポ酸よりも効果的であった(111)。しかし、今まで公表されたヒトによる研究の全てでは、R、S-リポ酸(ラセミ混合物)を使用している。ラセミ混合物に含まれるS-リポ酸がR-リポ酸の重合を制限し、その生物学的利用性を高めているのかもしれないと示唆されている(52)。現在のところ、サプリメントのどの形態が臨床試験での使用に一番良いのかは未知なままである。
安全性
有害作用
一般的に、高用量リポ酸投与は深刻な副作用がほとんどないことがわかっている。糖尿病性末梢神経障害の治療に600 mg/日の用量で3週間(112)静脈投与しても、1,800 mg/日という高用量で6ヶ月間(113)、または1,200 mg/日で2年間(76)経口摂取しても、深刻な有害作用は起こらなかった。糖尿病性神経障害で600 mg/日のリポ酸を4年間摂取した患者とプラセボ群との間に、有害事象や深刻な有害事象の発生の大きな差はなかった(78)。多発性硬化症の参加者を含む予備研究でも、経口で2,400 mg/日を2週間摂取しても安全であったことがわかった(95)。静脈注入によるリポ酸投与後に、2例の軽度アナフィラキシー反応と、咽頭痙攣を含む1例の重篤なアナフィラキシー反応の報告があった(55)。経口リポ酸補給で最もよく報告される副作用は皮膚に影響するアレルギー反応で、発疹、じんましん、および痒みを含む。腹痛、吐き気、嘔吐、およびめまいも報告され、ある試験では吐き気、嘔吐、およびめまいの発生は用量に依存することがわかった(77)。さらに、経口で1,200 mg/日のリポ酸を摂取した者に尿の悪臭があった(95)。
妊娠と授乳
ある後ろ向き観察研究で、妊娠10~30週から37週の終わりの期間中に中断なく600 mgのリポ酸(ラセミ混合物)を毎日経口補給しても、母親やその新生児に何の有害作用もなかったことが報告された(114)。さらなるエビデンスがないため、妊娠中のリポ酸補給は厳密な医学的監督の元で考慮されるべきである。授乳中の女性へのリポ酸補給の安全性は確立されておらず、したがって思いとどまるべきである(115)。
子供
生後20ヶ月の乳児(体重10.5 kg)が誤って600 mgのリポ酸錠剤を4つ飲み込んでしまった後で、中毒症になった症例が報告された(116)。その乳児は痙攣、アシドーシス(酸性血症)、および意識不明で入院した。症状管理と急速なリポ酸除去で、5日間で後遺症なく完全に回復できた。ある思春期の少女は非常に高用量のリポ酸を非偶発的に摂取したことで多臓器不全になり、その後死亡した(117)。
薬物相互作用
理論的にはリポ酸補給はインスリン媒介性のブドウ糖利用を改善するかもしれない(「糖尿病」の項参照)ため、インスリンまたは経口の抗糖尿病薬を使用している糖尿病患者が低血糖になる潜在的リスクがある(118)。したがって、糖尿病の治療計画にリポ酸補給が加えられる場合は、血中ブドウ糖濃度を綿密に監視すべきである。しかし24人の健康なボランティアによる1つの研究で、単回の経口用量リポ酸(600 mg)とグリブリド(グリベンクラミドとも呼ばれる)またはアカルボース(プレコース/Prandase(プランダース)/グルコバイ)という経口抗糖尿病薬を同時に投与しても、何の重要な薬物相互作用も起きなかったことが報告された(119)。
栄養素相互作用
ビオチン
ビオチンの化学構造はリポ酸と似ているため、リポ酸が高濃度だと細胞膜を通した輸送でビオチンと競合するかもしれないというエビデンスがある(120,121)。ラットに高用量リポ酸を注射して投与すると、2つのビオチン依存性酵素の活性が30~35%下がった(122)が、経口または静脈でのリポ酸補給がヒトでのビオチン必要量を実際に増やすかどうかはわかっていない(123)。
Authors and Reviewers
Originally written in 2002 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in July 2003 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in April 2006 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in January 2012 by:
Victoria J. Drake, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in October 2018 by:
Barbara Delage, Ph.D.
Linus Pauling Institute
Oregon State University
Reviewed in January 2019 by:
Tory M. Hagen, Ph.D.
Principal Investigator, Linus Pauling Institute
Professor, Dept. of Biochemistry and Biophysics
Helen P. Rumbel Professor for Healthy Aging Research
Oregon State University
Copyright 2002-2024 Linus Pauling Institute
References
1. Reed LJ. A trail of research from lipoic acid to alpha-keto acid dehydrogenase complexes. J Biol Chem. 2001;276(42):38329-38336. (PubMed)
2. Carreau JP. Biosynthesis of lipoic acid via unsaturated fatty acids. Methods Enzymol. 1979;62:152-158. (PubMed)
3. Smith AR, Shenvi SV, Widlansky M, Suh JH, Hagen TM. Lipoic acid as a potential therapy for chronic diseases associated with oxidative stress. Curr Med Chem. 2004;11(9):1135-1146. (PubMed)
4. Kramer K, Packer L. R-alpha-lipoic acid. In: Kramer K, Hoppe P, Packer L, eds. Nutraceuticals in Health and Disease Prevention. New York: Marcel Dekker, Inc.; 2001:129-164.
5. Mayr JA, Feichtinger RG, Tort F, Ribes A, Sperl W. Lipoic acid biosynthesis defects. J Inherit Metab Dis. 2014;37(4):553-563. (PubMed)
6. Hermann R, Niebch G, Borbe H, et al. Enantioselective pharmacokinetics and bioavailability of different racemic alpha-lipoic acid formulations in healthy volunteers. Eur J Pharm Sci. 1996;4(3):167-174.
7. Teichert J, Hermann R, Ruus P, Preiss R. Plasma kinetics, metabolism, and urinary excretion of alpha-lipoic acid following oral administration in healthy volunteers. J Clin Pharmacol. 2003;43(11):1257-1267. (PubMed)
8. Gleiter CH, Schug BS, Hermann R, Elze M, Blume HH, Gundert-Remy U. Influence of food intake on the bioavailability of thioctic acid enantiomers. Eur J Clin Pharmacol. 1996;50(6):513-514. (PubMed)
9. Brufani M, Figliola R. (R)-alpha-lipoic acid oral liquid formulation: pharmacokinetic parameters and therapeutic efficacy. Acta Biomed. 2014;85(2):108-115. (PubMed)
10. Maglione E, Marrese C, Migliaro E, et al. Increasing bioavailability of (R)-alpha-lipoic acid to boost antioxidant activity in the treatment of neuropathic pain. Acta Biomed. 2015;86(3):226-233. (PubMed)
11. Breithaupt-Grogler K, Niebch G, Schneider E, et al. Dose-proportionality of oral thioctic acid--coincidence of assessments via pooled plasma and individual data. Eur J Pharm Sci. 1999;8(1):57-65. (PubMed)
12. Evans JL, Heymann CJ, Goldfine ID, Gavin LA. Pharmacokinetics, tolerability, and fructosamine-lowering effect of a novel, controlled-release formulation of alpha-lipoic acid. Endocr Pract. 2002;8(1):29-35. (PubMed)
13. Keith DJ, Butler JA, Bemer B, et al. Age and gender dependent bioavailability of R- and R,S-alpha-lipoic acid: a pilot study. Pharmacol Res. 2012;66(3):199-206. (PubMed)
14. Hiltunen JK, Autio KJ, Schonauer MS, Kursu VA, Dieckmann CL, Kastaniotis AJ. Mitochondrial fatty acid synthesis and respiration. Biochim Biophys Acta. 2010;1797(6-7):1195-1202. (PubMed)
15. Bustamante J, Lodge JK, Marcocci L, Tritschler HJ, Packer L, Rihn BH. Alpha-lipoic acid in liver metabolism and disease. Free Radic Biol Med. 1998;24(6):1023-1039. (PubMed)
16. Jones W, Li X, Qu ZC, Perriott L, Whitesell RR, May JM. Uptake, recycling, and antioxidant actions of alpha-lipoic acid in endothelial cells. Free Radic Biol Med. 2002;33(1):83-93. (PubMed)
17. Kozlov AV, Gille L, Staniek K, Nohl H. Dihydrolipoic acid maintains ubiquinone in the antioxidant active form by two-electron reduction of ubiquinone and one-electron reduction of ubisemiquinone. Arch Biochem Biophys. 1999;363(1):148-154. (PubMed)
18. May JM, Qu ZC, Mendiratta S. Protection and recycling of alpha-tocopherol in human erythrocytes by intracellular ascorbic acid. Arch Biochem Biophys. 1998;349(2):281-289. (PubMed)
19. Upston JM, Terentis AC, Stocker R. Tocopherol-mediated peroxidation of lipoproteins: implications for vitamin E as a potential antiatherogenic supplement. Faseb J. 1999;13(9):977-994. (PubMed)
20. Valko M, Morris H, Cronin MT. Metals, toxicity and oxidative stress. Curr Med Chem. 2005;12(10):1161-1208. (PubMed)
21. Doraiswamy PM, Finefrock AE. Metals in our minds: therapeutic implications for neurodegenerative disorders. Lancet Neurol. 2004;3(7):431-434. (PubMed)
22. Ou P, Tritschler HJ, Wolff SP. Thioctic (lipoic) acid: a therapeutic metal-chelating antioxidant? Biochem Pharmacol. 1995;50(1):123-126. (PubMed)
23. Suh JH, Zhu BZ, deSzoeke E, Frei B, Hagen TM. Dihydrolipoic acid lowers the redox activity of transition metal ions but does not remove them from the active site of enzymes. Redox Rep. 2004;9(1):57-61. (PubMed)
24. Suh JH, Moreau R, Heath SH, Hagen TM. Dietary supplementation with (R)-alpha-lipoic acid reverses the age-related accumulation of iron and depletion of antioxidants in the rat cerebral cortex. Redox Rep. 2005;10(1):52-60. (PubMed)
25. Yamamoto H, Watanabe T, Mizuno H, et al. The antioxidant effect of DL-alpha-lipoic acid on copper-induced acute hepatitis in Long-Evans Cinnamon (LEC) rats. Free Radic Res. 2001;34(1):69-80. (PubMed)
26. Patrick L. Mercury toxicity and antioxidants: Part 1: role of glutathione and alpha-lipoic acid in the treatment of mercury toxicity. Altern Med Rev. 2002;7(6):456-471. (PubMed)
27. Rooney JP. The role of thiols, dithiols, nutritional factors and interacting ligands in the toxicology of mercury. Toxicology. 2007;234(3):145-156. (PubMed)
28. Hagen TM, Vinarsky V, Wehr CM, Ames BN. (R)-alpha-lipoic acid reverses the age-associated increase in susceptibility of hepatocytes to tert-butylhydroperoxide both in vitro and in vivo. Antioxid Redox Signal. 2000;2(3):473-483. (PubMed)
29. Busse E, Zimmer G, Schopohl B, Kornhuber B. Influence of alpha-lipoic acid on intracellular glutathione in vitro and in vivo. Arzneimittelforschung. 1992;42(6):829-831. (PubMed)
30. Monette JS, Gomez LA, Moreau RF, et al. (R)-alpha-Lipoic acid treatment restores ceramide balance in aging rat cardiac mitochondria. Pharmacol Res. 2011;63(1):23-29. (PubMed)
31. Suh JH, Shenvi SV, Dixon BM, et al. Decline in transcriptional activity of Nrf2 causes age-related loss of glutathione synthesis, which is reversible with lipoic acid. Proc Natl Acad Sci U S A. 2004;101(10):3381-3386. (PubMed)
32. Suh JH, Wang H, Liu RM, Liu J, Hagen TM. (R)-alpha-lipoic acid reverses the age-related loss in GSH redox status in post-mitotic tissues: evidence for increased cysteine requirement for GSH synthesis. Arch Biochem Biophys. 2004;423(1):126-135. (PubMed)
33. Zhang J, Zhou X, Wu W, Wang J, Xie H, Wu Z. Regeneration of glutathione by alpha-lipoic acid via Nrf2/ARE signaling pathway alleviates cadmium-induced HepG2 cell toxicity. Environ Toxicol Pharmacol. 2017;51:30-37. (PubMed)
34. Fratantonio D, Speciale A, Molonia MS, et al. Alpha-lipoic acid, but not di-hydrolipoic acid, activates Nrf2 response in primary human umbilical-vein endothelial cells and protects against TNF-alpha induced endothelium dysfunction. Arch Biochem Biophys. 2018;655:18-25. (PubMed)
35. Sena CM, Cipriano MA, Botelho MF, Seica RM. Lipoic acid prevents high-fat diet-induced hepatic steatosis in Goto Kakizaki rats by reducing oxidative stress through Nrf2 activation. Int J Mol Sci. 2018;19(9). (PubMed)
36. Pilar Valdecantos M, Prieto-Hontoria PL, Pardo V, et al. Essential role of Nrf2 in the protective effect of lipoic acid against lipoapoptosis in hepatocytes. Free Radic Biol Med. 2015;84:263-278. (PubMed)
37. Fayez AM, Zakaria S, Moustafa D. Alpha lipoic acid exerts antioxidant effect via Nrf2/HO-1 pathway activation and suppresses hepatic stellate cells activation induced by methotrexate in rats. Biomed Pharmacother. 2018;105:428-433. (PubMed)
38. Lin YC, Lai YS, Chou TC. The protective effect of alpha-lipoic Acid in lipopolysaccharide-induced acute lung injury is mediated by heme oxygenase-1. Evid Based Complement Alternat Med. 2013;2013:590363. (PubMed)
39. Segal AW. The function of the NADPH oxidase of phagocytes and its relationship to other NOXs in plants, invertebrates, and mammals. Int J Biochem Cell Biol. 2008;40(4):604-618. (PubMed)
40. Dong Y, Wang H, Chen Z. Alpha-lipoic acid attenuates cerebral ischemia and reperfusion injury via insulin receptor and PI3K/Akt-dependent inhibition of NADPH oxidase. Int J Endocrinol. 2015;2015:903186. (PubMed)
41. Byun E, Lim JW, Kim JM, Kim H. alpha-Lipoic acid inhibits Helicobacter pylori-induced oncogene expression and hyperproliferation by suppressing the activation of NADPH oxidase in gastric epithelial cells. Mediators Inflamm. 2014;2014:380830. (PubMed)
42. Konrad D. Utilization of the insulin-signaling network in the metabolic actions of alpha-lipoic acid-reduction or oxidation? Antioxid Redox Signal. 2005;7(7-8):1032-1039. (PubMed)
43. Diesel B, Kulhanek-Heinze S, Holtje M, et al. Alpha-lipoic acid as a directly binding activator of the insulin receptor: protection from hepatocyte apoptosis. Biochemistry. 2007;46(8):2146-2155. (PubMed)
44. Estrada DE, Ewart HS, Tsakiridis T, et al. Stimulation of glucose uptake by the natural coenzyme alpha-lipoic acid/thioctic acid: participation of elements of the insulin signaling pathway. Diabetes. 1996;45(12):1798-1804. (PubMed)
45. Yaworsky K, Somwar R, Ramlal T, Tritschler HJ, Klip A. Engagement of the insulin-sensitive pathway in the stimulation of glucose transport by alpha-lipoic acid in 3T3-L1 adipocytes. Diabetologia. 2000;43(3):294-303. (PubMed)
46. Ying Z, Kampfrath T, Sun Q, Parthasarathy S, Rajagopalan S. Evidence that alpha-lipoic acid inhibits NF-kappaB activation independent of its antioxidant function. Inflamm Res. 2011;60(3):219-225. (PubMed)
47. Smith AR, Hagen TM. Vascular endothelial dysfunction in aging: loss of Akt-dependent endothelial nitric oxide synthase phosphorylation and partial restoration by (R)-alpha-lipoic acid. Biochem Soc Trans. 2003;31(Pt 6):1447-1449. (PubMed)
48. Wang Y, Li X, Guo Y, Chan L, Guan X. alpha-Lipoic acid increases energy expenditure by enhancing adenosine monophosphate-activated protein kinase-peroxisome proliferator-activated receptor-gamma coactivator-1alpha signaling in the skeletal muscle of aged mice. Metabolism. 2010;59(7):967-976. (PubMed)
49. Moura FA, de Andrade KQ, dos Santos JC, Goulart MO. Lipoic acid: its antioxidant and anti-inflammatory role and clinical applications. Curr Top Med Chem. 2015;15(5):458-483. (PubMed)
50. Packer L, Cadenas E. Lipoic acid: energy metabolism and redox regulation of transcription and cell signaling. J Clin Biochem Nutr. 2011;48(1):26-32. (PubMed)
51. Rochette L, Ghibu S, Richard C, Zeller M, Cottin Y, Vergely C. Direct and indirect antioxidant properties of alpha-lipoic acid and therapeutic potential. Mol Nutr Food Res. 2013;57(1):114-125. (PubMed)
52. Shay KP, Moreau RF, Smith EJ, Smith AR, Hagen TM. Alpha-lipoic acid as a dietary supplement: molecular mechanisms and therapeutic potential. Biochim Biophys Acta. 2009;1790(10):1149-1160. (PubMed)
53. Mayr JA, Zimmermann FA, Fauth C, et al. Lipoic acid synthetase deficiency causes neonatal-onset epilepsy, defective mitochondrial energy metabolism, and glycine elevation. Am J Hum Genet. 2011;89(6):792-797. (PubMed)
54. Tort F, Ferrer-Cortes X, Thio M, et al. Mutations in the lipoyltransferase LIPT1 gene cause a fatal disease associated with a specific lipoylation defect of the 2-ketoacid dehydrogenase complexes. Hum Mol Genet. 2014;23(7):1907-1915. (PubMed)
55. Ziegler D. Thioctic acid for patients with symptomatic diabetic polyneuropathy: a critical review. Treat Endocrinol. 2004;3(3):173-189. (PubMed)
56. Nathan DM, Davidson MB, DeFronzo RA, et al. Impaired fasting glucose and impaired glucose tolerance: implications for care. Diabetes Care. 2007;30(3):753-759. (PubMed)
57. Jacob S, Henriksen EJ, Schiemann AL, et al. Enhancement of glucose disposal in patients with type 2 diabetes by alpha-lipoic acid. Arzneimittelforschung. 1995;45(8):872-874. (PubMed)
58. Jacob S, Rett K, Henriksen EJ, Haring HU. Thioctic acid--effects on insulin sensitivity and glucose-metabolism. Biofactors. 1999;10(2-3):169-174. (PubMed)
59. de Oliveira AM, Rondo PH, Luzia LA, D'Abronzo FH, Illison VK. The effects of lipoic acid and alpha-tocopherol supplementation on the lipid profile and insulin sensitivity of patients with type 2 diabetes mellitus: a randomized, double-blind, placebo-controlled trial. Diabetes Res Clin Pract. 2011;92(2):253-260. (PubMed)
60. Akbari M, Ostadmohammadi V, Lankarani KB, et al. The effects of alpha-lipoic acid supplementation on glucose control and lipid profiles among patients with metabolic diseases: A systematic review and meta-analysis of randomized controlled trials. Metabolism. 2018;87:56-69. (PubMed)
61. Roberts AC, Porter KE. Cellular and molecular mechanisms of endothelial dysfunction in diabetes. Diab Vasc Dis Res. 2013;10(6):472-482. (PubMed)
62. Heitzer T, Finckh B, Albers S, Krohn K, Kohlschutter A, Meinertz T. Beneficial effects of alpha-lipoic acid and ascorbic acid on endothelium-dependent, nitric oxide-mediated vasodilation in diabetic patients: relation to parameters of oxidative stress. Free Radic Biol Med. 2001;31(1):53-61. (PubMed)
63. Heinisch BB, Francesconi M, Mittermayer F, et al. Alpha-lipoic acid improves vascular endothelial function in patients with type 2 diabetes: a placebo-controlled randomized trial. Eur J Clin Invest. 2010;40(2):148-154. (PubMed)
64. Xiang G, Pu J, Yue L, Hou J, Sun H. alpha-lipoic acid can improve endothelial dysfunction in subjects with impaired fasting glucose. Metabolism. 2011;60(4):480-485. (PubMed)
65. Xiang GD, Sun HL, Zhao LS, Hou J, Yue L, Xu L. The antioxidant alpha-lipoic acid improves endothelial dysfunction induced by acute hyperglycaemia during OGTT in impaired glucose tolerance. Clin Endocrinol (Oxf). 2008;68(5):716-723. (PubMed)
66. Sola S, Mir MQ, Cheema FA, et al. Irbesartan and lipoic acid improve endothelial function and reduce markers of inflammation in the metabolic syndrome: results of the Irbesartan and Lipoic Acid in Endothelial Dysfunction (ISLAND) study. Circulation. 2005;111(3):343-348. (PubMed)
67. National Institute of Diabetes and Digestive and Kidney Diseases. Diabetic Neuropathy. Available at: https://www.niddk.nih.gov/health-information/diabetes/overview/preventing-problems/nerve-damage-diabetic-neuropathies. Accessed 9/23/18.
68. Malik RA, Tesfaye S, Ziegler D. Medical strategies to reduce amputation in patients with type 2 diabetes. Diabet Med. 2013;30(8):893-900. (PubMed)
69. Obrosova IG. Diabetes and the peripheral nerve. Biochim Biophys Acta. 2009;1792(10):931-940. (PubMed)
70. Dy SM, Bennett WL, Sharma R, et al. AHRQ Comparative Effectiveness Reviews. Preventing complications and treating symptoms of diabetic peripheral neuropathy. Rockville (MD): Agency for Healthcare Research and Quality (US); 2017. (PubMed)
71. The Diabetes Control and Complications Trial Research Group. The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. The Diabetes Control and Complications Trial Research Group. N Engl J Med. 1993;329(14):977-986. (PubMed)
72. UK Prospective Diabetes Study (UKPDS) Group. Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33). Lancet. 1998;352(9131):837-853. (PubMed)
73. Callaghan BC, Little AA, Feldman EL, Hughes RA. Enhanced glucose control for preventing and treating diabetic neuropathy. Cochrane Database Syst Rev. 2012(6):Cd007543. (PubMed)
74. Han T, Bai J, Liu W, Hu Y. A systematic review and meta-analysis of alpha-lipoic acid in the treatment of diabetic peripheral neuropathy. Eur J Endocrinol. 2012;167(4):465-471. (PubMed)
75. Ruhnau KJ, Meissner HP, Finn JR, et al. Effects of 3-week oral treatment with the antioxidant thioctic acid (alpha-lipoic acid) in symptomatic diabetic polyneuropathy. Diabet Med. 1999;16(12):1040-1043. (PubMed)
76. Ziegler D, Hanefeld M, Ruhnau KJ, et al. Treatment of symptomatic diabetic polyneuropathy with the antioxidant alpha-lipoic acid: a 7-month multicenter randomized controlled trial (ALADIN III Study). ALADIN III Study Group. Alpha-lipoic acid in diabetic neuropathy. Diabetes Care. 1999;22(8):1296-1301. (PubMed)
77. Ziegler D, Ametov A, Barinov A, et al. Oral treatment with alpha-lipoic acid improves symptomatic diabetic polyneuropathy: the SYDNEY 2 trial. Diabetes Care. 2006;29(11):2365-2370. (PubMed)
78. Ziegler D, Low PA, Litchy WJ, et al. Efficacy and safety of antioxidant treatment with alpha-lipoic acid over 4 years in diabetic polyneuropathy: the NATHAN 1 trial. Diabetes Care. 2011;34(9):2054-2060. (PubMed)
79. Ziegler D, Low PA, Freeman R, Tritschler H, Vinik AI. Predictors of improvement and progression of diabetic polyneuropathy following treatment with alpha-lipoic acid for 4 years in the NATHAN 1 trial. J Diabetes Complications. 2016;30(2):350-356. (PubMed)
80. Balcioglu AS, Muderrisoglu H. Diabetes and cardiac autonomic neuropathy: Clinical manifestations, cardiovascular consequences, diagnosis and treatment. World J Diabetes. 2015;6(1):80-91. (PubMed)
81. Ziegler D, Schatz H, Conrad F, Gries FA, Ulrich H, Reichel G. Effects of treatment with the antioxidant alpha-lipoic acid on cardiac autonomic neuropathy in NIDDM patients. A 4-month randomized controlled multicenter trial (DEKAN Study). Deutsche Kardiale Autonome Neuropathie. Diabetes Care. 1997;20(3):369-373. (PubMed)
82. Nguyen N, Takemoto JK. A case for alpha-lipoic acid as an alternative treatment for diabetic polyneuropathy. J Pharm Pharm Sci. 2018;21(1s):177s-191s. (PubMed)
83. National Institute of Diabetes and Digestive and Kidney Diseases. Diabetic Eye Disease. Available at: https://www.niddk.nih.gov/health-information/diabetes/overview/preventing-problems/diabetic-eye-disease. Accessed 9/24/18.
84. Gebka A, Serkies-Minuth E, Raczynska D. Effect of the administration of alpha-lipoic acid on contrast sensitivity in patients with type 1 and type 2 diabetes. Mediators Inflamm. 2014;2014:131538. (PubMed)
85. National Multiple Sclerosis Society. Definition of Multiple Sclerosis (MS). Available at: https://www.nationalmssociety.org/What-is-MS/Definition-of-MS. Accessed 9/28/18.
86. National Multiple Sclerosis Society. Types of Multiple Sclerosis (MS). Available at: https://www.nationalmssociety.org/What-is-MS/Types-of-MS. Accessed 9/28/18.
87. Marracci GH, Jones RE, McKeon GP, Bourdette DN. Alpha lipoic acid inhibits T cell migration into the spinal cord and suppresses and treats experimental autoimmune encephalomyelitis. J Neuroimmunol. 2002;131(1-2):104-114. (PubMed)
88. Morini M, Roccatagliata L, Dell'Eva R, et al. Alpha-lipoic acid is effective in prevention and treatment of experimental autoimmune encephalomyelitis. J Neuroimmunol. 2004;148(1-2):146-153. (PubMed)
89. Schreibelt G, Musters RJ, Reijerkerk A, et al. Lipoic acid affects cellular migration into the central nervous system and stabilizes blood-brain barrier integrity. J Immunol. 2006;177(4):2630-2637. (PubMed)
90. Salinthone S, Schillace RV, Marracci GH, Bourdette DN, Carr DW. Lipoic acid stimulates cAMP production via the EP2 and EP4 prostanoid receptors and inhibits IFN gamma synthesis and cellular cytotoxicity in NK cells. J Neuroimmunol. 2008;199(1-2):46-55. (PubMed)
91. Schillace RV, Pisenti N, Pattamanuch N, et al. Lipoic acid stimulates cAMP production in T lymphocytes and NK cells. Biochem Biophys Res Commun. 2007;354(1):259-264. (PubMed)
92. George JD, Kim E, Spain R, Bourdette D, Salinthone S. Effects of lipoic acid on migration of human B cells and monocyte-enriched peripheral blood mononuclear cells in relapsing remitting multiple sclerosis. J Neuroimmunol. 2018;315:24-27. (PubMed)
93. Chaudhary P, Marracci GH, Bourdette DN. Lipoic acid inhibits expression of ICAM-1 and VCAM-1 by CNS endothelial cells and T cell migration into the spinal cord in experimental autoimmune encephalomyelitis. J Neuroimmunol. 2006;175(1-2):87-96. (PubMed)
94. Marracci GH, McKeon GP, Marquardt WE, Winter RW, Riscoe MK, Bourdette DN. Alpha lipoic acid inhibits human T-cell migration: implications for multiple sclerosis. J Neurosci Res. 2004;78(3):362-370. (PubMed)
95. Yadav V, Marracci G, Lovera J, et al. Lipoic acid in multiple sclerosis: a pilot study. Mult Scler. 2005;11(2):159-165. (PubMed)
96. Yadav V, Marracci GH, Munar MY, et al. Pharmacokinetic study of lipoic acid in multiple sclerosis: comparing mice and human pharmacokinetic parameters. Mult Scler. 2010;16(4):387-397. (PubMed)
97. Khalili M, Eghtesadi S, Mirshafiey A, et al. Effect of lipoic acid consumption on oxidative stress among multiple sclerosis patients: a randomized controlled clinical trial. Nutr Neurosci. 2014;17(1):16-20. (PubMed)
98. Khalili M, Azimi A, Izadi V, et al. Does lipoic acid consumption affect the cytokine profile in multiple sclerosis patients: a double-blind, placebo-controlled, randomized clinical trial. Neuroimmunomodulation. 2014;21(6):291-296. (PubMed)
99. Khalili M, Soltani M, Moghadam SA, Dehghan P, Azimi A, Abbaszadeh O. Effect of alpha-lipoic acid on asymmetric dimethylarginine and disability in multiple sclerosis patients: A randomized clinical trial. Electron Physician. 2017;9(7):4899-4905. (PubMed)
100. Molz P, Schroder N. Potential therapeutic effects of lipoic acid on memory deficits related to aging and neurodegeneration. Front Pharmacol. 2017;8:849. (PubMed)
101. Hager K, Marahrens A, Kenklies M, Riederer P, Munch G. Alpha-lipoic acid as a new treatment option for Azheimer type dementia. Arch Gerontol Geriatr. 2001;32(3):275-282. (PubMed)
102. Hager K, Kenklies M, McAfoose J, Engel J, Munch G. Alpha-lipoic acid as a new treatment option for Alzheimer's disease--a 48 months follow-up analysis. J Neural Transm Suppl. 2007(72):189-193. (PubMed)
103. Dana Consortium on the Therapy of HIV Dementia and Related Cognitive Disorders. A randomized, double-blind, placebo-controlled trial of deprenyl and thioctic acid in human immunodeficiency virus-associated cognitive impairment. Neurology. 1998;50(3):645-651. (PubMed)
104. Shinto L, Quinn J, Montine T, et al. A randomized placebo-controlled pilot trial of omega-3 fatty acids and alpha lipoic acid in Alzheimer's disease. J Alzheimers Dis. 2014;38(1):111-120. (PubMed)
105. Namazi N, Larijani B, Azadbakht L. Alpha-lipoic acid supplement in obesity treatment: A systematic review and meta-analysis of clinical trials. Clin Nutr. 2018;37(2):419-428. (PubMed)
106. Kucukgoncu S, Zhou E, Lucas KB, Tek C. Alpha-lipoic acid (ALA) as a supplementation for weight loss: results from a meta-analysis of randomized controlled trials. Obes Rev. 2017;18(5):594-601. (PubMed)
107. Lodge JK, Youn HD, Handelman GJ, et al. Natural sources of lipic acid: determination of lipoyllysine released from protease-digested tissues by high performance liquid chromatography incorporating electrochemical detection. J Appl Nutr. 1997;49(1 & 2):3-11.
108. Biewenga GP, Haenen GR, Bast A. The pharmacology of the antioxidant lipoic acid. Gen Pharmacol. 1997;29(3):315-331. (PubMed)
109. ConsumerLab.com. Alpha-Lipoic Acid Supplements Review July 2017. Available at: https://www.consumerlab.com/reviews/Alpha-Lipoic_Acid_Supplements/alphalipoic/. Accessed 9/27/18.
110. Streeper RS, Henriksen EJ, Jacob S, Hokama JY, Fogt DL, Tritschler HJ. Differential effects of lipoic acid stereoisomers on glucose metabolism in insulin-resistant skeletal muscle. Am J Physiol. 1997;273(1 Pt 1):E185-191. (PubMed)
111. Maitra I, Serbinova E, Tritschler HJ, Packer L. Stereospecific effects of R-lipoic acid on buthionine sulfoximine-induced cataract formation in newborn rats. Biochem Biophys Res Commun. 1996;221(2):422-429. (PubMed)
112. Ziegler D, Nowak H, Kempler P, Vargha P, Low PA. Treatment of symptomatic diabetic polyneuropathy with the antioxidant alpha-lipoic acid: a meta-analysis. Diabet Med. 2004;21(2):114-121. (PubMed)
113. Reljanovic M, Reichel G, Rett K, et al. Treatment of diabetic polyneuropathy with the antioxidant thioctic acid (alpha-lipoic acid): a two year multicenter randomized double-blind placebo-controlled trial (ALADIN II). Alpha Lipoic Acid in Diabetic Neuropathy. Free Radic Res. 1999;31(3):171-179. (PubMed)
114. Parente E, Colannino G, Picconi O, Monastra G. Safety of oral alpha-lipoic acid treatment in pregnant women: a retrospective observational study. Eur Rev Med Pharmacol Sci. 2017;21(18):4219-4227. (PubMed)
115. Natural Medicines. Alpha-Lipoic Acid/Safety - Professional Handout. Available at: https://naturalmedicines.therapeuticresearch.com. Accessed 9/26/18.
116. Karaarslan U, Isguder R, Bag O, Kisla M, Agin H, Unal N. Alpha lipoic acid intoxication, treatment and outcome. Clin Toxicol (Phila). 2013;51(6):522. (PubMed)
117. Hadzik B, Grass H, Mayatepek E, Daldrup T, Hoehn T. Fatal non-accidental alpha-lipoic acid intoxication in an adolescent girl. Klin Padiatr. 2014;226(5):292-294. (PubMed)
118. Natural Medicines. Alpha-Lipoic acid/Interactions with Drugs - Professional handout. Available at: https://naturalmedicines.therapeuticresearch.com. Accessed 9/25/18.
119. Gleiter CH, Schreeb KH, Freudenthaler S, et al. Lack of interaction between thioctic acid, glibenclamide and acarbose. Br J Clin Pharmacol. 1999;48(6):819-825. (PubMed)
120. Prasad PD, Wang H, Huang W, et al. Molecular and functional characterization of the intestinal Na+-dependent multivitamin transporter. Arch Biochem Biophys. 1999;366(1):95-106. (PubMed)
121. Balamurugan K, Vaziri ND, Said HM. Biotin uptake by human proximal tubular epithelial cells: cellular and molecular aspects. Am J Physiol Renal Physiol. 2005;288(4):F823-831. (PubMed)
122. Zempleni J, Trusty TA, Mock DM. Lipoic acid reduces the activities of biotin-dependent carboxylases in rat liver. J Nutr. 1997;127(9):1776-1781. (PubMed)
123. Zempleni J, Mock DM. Biotin biochemistry and human requirements. J Nutr Biochem. 1999;10(3):128-138. (PubMed)
食品と飲料
果実及び野菜
目次
概要
- 果実と野菜の摂取が多い食事パターンは,心血管系疾患リスクの有意な低減と一貫した相関が認められている。(詳細はこちら)
- 果実及び野菜の摂取量と発がんリスクとの間の相関について,前向きコホート研究から弱い裏づけがされており,特定の果実群や野菜群が,個別のがんリスク低減と相関するとのエビデンスがいくつか得られている。(詳細はこちら)
- 疫学研究及び対照臨床試験の結果からは,果実や野菜の豊富な食事が,骨量減少を予防するために有用であることが示唆されている。(詳細はこちら)
- 前向きコホート研究の結果からは,ビタミンCとカロテノイドの多い果実及び野菜の両方の摂取量が多いと,黄斑変性や白内障などの加齢による眼の病気のリスク低減と相関がある可能性が示唆されている。(詳細はこちら)
- 疾病管理予防センター(the Centers for Disease Control and Prevention)などの多くの機関が,毎日様々な果実と野菜を食べることを推奨している。推奨されるそれらの摂食回数は,年齢,性別,体質及び運動レベルにより左右される総カロリー量に依存する。(詳細はこちら)
緒言
健康的な食事についての最適な構成について様々な議論はあるが,果実及び野菜の重要性に関して,科学者間での異論はほとんどない。数多くの疫学研究や最近の臨床試験からは,果実と野菜を多く含む食事が慢性疾患のリスクを低減するとの一貫したエビデンスが提供されている (1)。一方で,野菜・果実中に存在する個々の微量栄養成分や植物性化学物質の極めて高い摂取が,同様に慢性疾患リスクを低減するというエビデンスは一貫性がなく,また比較的弱い。果実及び野菜は,互いに様々な相互作用を介して,健康増進と疾病予防に役立つ多数の生物活性のある植物性化学物質を含有している (2)。果実及び野菜は抗酸化成分を多く含み,酸化促進物質により誘発される酸化的損傷から体を保護する効果がある。これらの複雑な相互作用を利用する最良の方法は,様々な果実と野菜を食べることである。
疾病の予防
心血管系疾患
果実と野菜の摂取が比較的多い食事パターンは,冠動脈心疾患(CHD)及び脳卒中の有意なリスク低減と一貫した相関が認められている。11例の前向きコホート研究の結果を合わせたメタアナリシスから,果実・野菜の90%タイル摂取量の人〔一日5サービング(SV)あるいは、それ以上摂取する人;サービングサイズの追加情報は,下記の「果実や野菜の1サービングの例」を参照〕が,10%タイル摂取量の人より心筋梗塞のリスクが約15%低いことが認められた (3)。126,000人の男女が関与したHealth Professionals' Follow-up Study及びNurses’ Health Studyの中で,果実と野菜を一日8 SV以上摂取する人が,次の8~14年間の追跡期間において,一日に3 SV以下を摂取する人よりCHDの発症リスクが20%低かった (4)。同じコホートにおいて,虚血性脳卒中(脳領域への血流低下により起こる脳卒中)のリスクが,一日に少なくとも5 SV以上の果実と野菜を摂取する人では,一日3 SV以下の人より30%低かった (5)。Health Professionals' Follow-up Study及びNurses’ Health Studyの結果によると,一日に果実や野菜を1 SV余分に食べることが,CHDリスクを約4%まで低減し,虚血性脳卒中リスクを6%まで低減することになる。果実や野菜の摂取が低いことに起因する疾病の世界的負担を試算するためのメタアナリシスにおいて,疫学者は,果実及び野菜(ジャガイモを除く)それぞれの摂取量を600 g/日(約7 SV/1日)まで増加することが,CHDリスクを31%まで低減させ,虚血性脳卒中リスクを19%まで低減することになると結論した (1)。果実及び野菜の摂取量とCHDや脳卒中のリスクとの関係について,最近3例のメタアナリシスで調査された。9例のコホート研究が含まれるメタアナリシスにおいて,果実及び野菜の追加1 SVが,CHDリスクの4%低減と相関がみられた (6)。12例の研究を調査した別のメタアナリシスにおいて,果実や野菜を毎日5 SV以上摂取する人が,毎日3 SV以下摂取の人より,CHDリスクが17%低かったことが認められた (7)。果実及び野菜の摂取量について調べた8例の研究のメタアナリシスにおいて,1日3~5 SVまたは1日5 SV以上摂取する人は,1日3 SV以下しか摂取しない人と比較し,脳卒中のリスクがそれぞれ11%または26%低かった (8)。
高血圧は心臓疾患や脳卒中のリスクを高める (9)。常識的な食事に対し, より多くの果実や野菜を加えることは,血圧を下げるための一つの有望な方法である。高血圧予防のための食事アプローチ(DASH)研究において,高血圧の人とそうでない人459人が,任意に次の3つの食事群に割り当てられた。1) 果実・野菜約3 SV/日,及び低脂肪乳製品1 SV/日を供給する典型的米国人の食事,2) 果実・野菜約8 SV/日, 及び低脂肪乳製品1 SV/日を供給する果実・野菜食事,3) 果実・野菜約9 SV/日,及び低脂肪乳製品3 SV/日を供給する組合せ食事(以下,「DASH食事」と呼ぶ)(10)。8週間後,果実・野菜食事群(8 SV/日)の人の血圧は,典型的米国人食事の人より有意に低くなり,組合わせ(DASH)食事(果実・野菜9 SV/日)の人ではさらに血圧が低くなった。DASH食事計画についての追加情報は,National Heart, Lung, and Blood Institute ウェブサイト参照。
ビタミンC, 葉酸,カリウム,食物繊維及び各種の植物性化学物質などを含む多成分の複合物が果実や野菜の心臓保護効果に寄与している (11)。しかしながら,個々の微量栄養成分や植物性化学物質のサプリメント補給は,無作為対照研究において,あまり有意な心血管系症例の発生率低下の結果が得られていない。したがって,果実及び野菜の場合,それらの全体としての利点が,各部分の総和よりも大きいようである。
2型糖尿病
他の合併症に加えて,2型糖尿病(DM)は,2型糖尿病における主な死因である心血管系疾患のリスク増加と相関がある (12)。糖尿病における果実や野菜の多い食事の有益効果に関するエビデンスは,心臓病のようには一貫性がないが,少数の研究結果からは,果実や野菜の高摂取が血糖管理の改善と2型糖尿病の発症リスク低下と相関があることが示唆されている。ほぼ10,000人の米国成人のコホートにおいて,その後20年間の2型糖尿病発症リスクは,1日最低でも5 SVの果実や野菜を摂取する人の方が,摂取しない人と比較し,およそ20%低くかった (13)。40,000人以上の米国人女性を平均9年間追跡した別の前向きコホート研究において,コホート全体では,果実及び野菜の摂取は2型糖尿病発症リスクと何ら相関はみられなかったが,過体重女性において,緑黄色野菜の高い摂取量が, 2型糖尿病リスクの有意な低減と相関することが認められた (14)。20,000人以上を12年間追跡したコホート研究において,比較的高い果実及び野菜の摂取が,糖尿病リスクの低減と弱く相関していた (15)。71,346人女性が関与したNurses' Health Studyにおいて,果実と野菜の総摂取量は糖尿病リスクと相関が認められなかったが,その後の解析から,果実と緑葉野菜の摂取が,個々に糖尿病リスクの低減とある程度の相関が認められた (16)。5例のコホート研究の系統的レビューとメタアナリシスから,果実及び野菜は2型糖尿病と相関関係がないことが認められた (17)。しかしながら,英国における6,000人以上の糖尿病でない成人での横断研究において,果実及び野菜の摂取量が高い人は,長期間の血糖管理の指標である糖化ヘモグロビン(HbA1c)のレベルが有意に低かった (18)。果実や野菜中の血糖管理に効果のある化合物としては,食物繊維やマグネシウムが考えられる。
がん
数多くの症例対照研究の結果からは,果実や野菜を多く含む食事を食べると,多種多様のがん,特に消化器官(中咽頭,食道,胃,結腸及び直腸)のがん及び肺癌の発症リスクを低減することが示されている (19-21)。これらの研究結果のいくつかは,国立がん研究所の「1日5 SV」プログラムの基礎となったものであり,アメリカ人が果実と野菜の摂取を1日最低5 SV増やすことを意図したものであった。現在の米国政府の「もっと果実や野菜を」運動は,「1日5 SV」運動に替わるものである。症例対照研究と異なり,多くの最近の前向きコホート研究では,果実や野菜の総摂取量と各種がんリスクとの間に相関はほとんど認められていない (22-44)。この矛盾については,いくつかの考えられる説明がある。特定のがんと診断された人々の過去の食事をがんではない人々の食事と比較する症例対照研究では,多数の健常者の食事についての情報を収集し経時的にコホート内のがん発症を追跡する前向きコホート研究と比較して,参加者の選定と食事記憶についてのバイアスを受けやすい (45)。前向き研究からは,果実や野菜の総摂取量と発がんリスクとの間の相関については弱い結果であるが,特定の野菜や果実群の高い摂取量が,それぞれのがんのリスク低減と相関することを示す証拠がいくつか提供されている。8例の前向きコホート研究の統合解析において,果実の高摂取が肺癌リスクの低減と強くはないが有意な相関が認められ (28),いくつかの研究において膀胱癌のリスク低減とも相関が認められている (46)。男性において,アブラナ科野菜の高摂取が,膀胱癌 (47) 及び前立腺癌 (48) のリスクを有意に低減することが認められ,トマト製品の高摂取が前立腺癌の有意なリスク低減と相関がみられた (49)。
骨粗鬆症
いくつかの横断研究から,男性と女性において,果実及び野菜の高い摂取が骨密度(BMD)を有意に高め,骨吸収(減少)レベルを有意に低下させることが報告されている (50-53)。4年間BMDを追跡した研究において,高い果実と野菜の摂取量が,臀部BMD減少を有意に抑制することとの相関が高齢男性において認められたが,高齢女性では相関がみられなかった (50)。果実及び野菜は,体内の酸性度を緩衝化する働きを持つ炭酸水素イオンの前駆物質を多く含んでいる。炭酸水素イオンの量が正常なpHを維持する上で不足すると,生体は,食事で消費され代謝によって生成する酸類を中和するために,骨からアルカリ性のカルシウム塩を動員させる働きがある (54)。果実と野菜の摂取量が増加すると,食事中の正味酸含量が減少し,骨中のカルシウムが維持されるが,そうでない場合は正常なpHを維持するためにカルシウムが動員される。しかしながら,最近の276人の閉経後女性によるプラセボ対照試験の結果からは,クエン酸カリウムの補給,または果実・野菜の300 g/日追加のいずれかによりアルカリ性食事を補給したとき,2年間でBMDが増加せず,また加齢に関連する骨量の減少を遅らせないことが示唆された (55)。DASH研究の結果は,果実・野菜の摂取量と骨の健康との間の有用な関係を裏付けしている。血圧低下の他に,1日に3 SVから9 SVへと,果実と野菜の摂取量を増加させると,ほぼ50 mg/日まで尿中へのカルシウム損失を減少させ (10),骨代謝回転,特に1型コラーゲンのC-末端テロペプチドの血清中レベルを含む骨吸収,のバイオマーカーレベルを低下させた (56)。要約すると,疫学研究と比較臨床試験の結果からは,果実と野菜の豊富な食事は骨量減少を抑制する効果があることが示唆されているが,その特異的メカニズムは確実にはわかっていない。
加齢による眼の疾患
白内障
白内障は,紫外線に長期間曝露することにより誘発される眼水晶体中のタンパク質の酸化的損傷により起こると考えられている。水晶体の曇りや変色は,視覚の喪失を起こし加齢とともに症状が重くなる。いくつかの大規模前向きコホート研究の結果から,果実と野菜の多い食事,特にカロテノイドやビタミンCが豊富な果実と野菜の多い食事が,白内障の発症率とその重症度を低減することと相関があることが示唆されている (57-60)。米国の男性医療従事者に関する研究で,ブロッコリーとホウレンソウの両方の高い摂取が,白内障摘出手術の回数減と相関がみられた (57)。
黄斑変性
網膜の中央にある黄斑の変性は,米国において65歳以上の人々の失明の主原因である (61)。ルテイン及びゼアキサンチンは,網膜中に比較的高濃度で存在するカロテノイドである。これらのカロテノイド類は,光や酸化物質により誘発される網膜損傷を予防している可能性がある (62)。2つの症例対照研究において,カロテノイド類,特に緑色の濃い葉菜類などのルテインやゼアキサンチンが多く含まれる野菜の高摂取が,加齢に伴う黄斑変性(AMD)の発症リスクの有意な低減と相関が認められた (63,64)。118,000人以上の男女における前向きコホート研究において,果実類を1日に3 SV以上摂取する人は,1.5 SV以下の人と比べ,その後の12~18年の間で加齢黄斑変性の発症リスクが36%低かった (65)。興味深いことに,このコホートにおいて,野菜の摂取量は黄斑変性リスクと相関がなかった。より最近の研究では,50~79歳女性のコホートにおいて,ルテインとゼアキサンチンを合わせた摂取量は,中期AMDの罹患率との相関が認められなかった (66)。しかしながら,そのデータの追加解析から,ルテインとゼアキサンチンを安定して摂取している75歳以下の女性は,中期AMDの発症リスクが43%低いことが認められた (66)。
慢性閉塞性肺疾患
慢性閉塞性肺疾患(COPD)は,気道閉塞により特徴付けられる2つの慢性肺疾患である肺気腫と慢性気管支炎を合わせた用語である。喫煙が現在のところ最も重要なCOPDに対するリスク因子であるが,いくつかの疫学研究の結果からは,野菜摂取量とCOPDリスクとの間に有益な相関関係が示唆され,果実の摂取量との間にはさらに強い相関が認められている (67)。ヨーロッパにおけるいくつかの疫学研究結果では,果実の高い摂取量,特にリンゴの摂取量が,良好な肺機能の指標である努力呼気肺活量(FEV1)値の増進と相関することが認められている (68-70)。2,500人のウェールズ中年男性の研究において,週に少なくとも5個リンゴを食べる人は,5年間リンゴを食べなかった人より,肺機能の低下が有意に遅かった (69)。2,917人の欧州人男性を20年間追跡した研究において,1日の果実摂取量を各100 g(3.5オンス)増加させることが,COPDによる死亡リスクの24%減少と相関がみられた (71)。果実摂取量と肺の健康との間の有益な相関関係の理由は,今のところわかっていない。酸化ストレスが慢性の閉塞性肺疾患における病因であると考えられているため,ビタミンCやフラボノイド類のような果実中に存在する抗酸化物質が保護的役割を果たしている可能性を,現在科学者たちは調査している。小規模の男性喫煙者による症例対照研究において,高い果実や野菜の摂取量が,COPDリスクと逆相関しており (72),抗酸化仮説についての裏づけを提供している。興味深いことに,西洋的な食事パターン(精製した穀類,塩蔵赤身肉,フレンチフライ及びデザート類)と比較した場合,果実,野菜,魚類及び全粒穀類を多く配慮した食事パターンは,大規模な男性コホート (73) と女性コホート (74) において,COPDリスクの25~50%の低減と相関することが認められた。
神経変性疾患
果実及び野菜が多い食事が,アルツハイマー病やパーキンソン病のような人の神経変性疾患のリスクを低減するかどうか現在不明ではあるが,最近のこれら疾病についての動物実験では,ブルーベリー (75) やトマトのような果実の多い食事に保護作用のあることが示唆されている (76)。興味深いことに,1,836人の日系米国高齢者を平均6.3年間追跡した前向き研究において,いつも果実や野菜ジュースを摂取することが,アルツハイマー病の発症リスクの減少と相関することが認められた (77)。果実や野菜の摂取が,神経変性疾患に対する予防的効果があるかどうかを明らかにするためには,さらに多くの研究が必要である
摂取の推奨量
疾病管理予防センターを含む米国政府の多くの機関は様々な果物と野菜を日々摂取することを推奨しているが、その推奨のサービング数は年齢、性別、活動レベルによって決まる (78)。表1は果物または野菜の1サービングの例を示している。2005年版アメリカ人のための食生活指針では果物と野菜摂取の推奨に関しては同様であり、カロリー摂取との関連はあるが年齢または性別との関わりはない (79)。2カップ(4 SV)の果物と2 1/2カップ(5 SV)の野菜の摂取が2000 kcal/日を消費する人々に推奨され、一方で1.5カップ(3 SV)の果物と2カップ(4 SV)の野菜の摂取が1600 kcal/日を消費する人々に推奨されている。どちらの場合でも、濃緑、赤、橙、黄、青、紫の果物と野菜さらには豆類(エンドウ豆や豆)、タマネギ、ニンニクを含む様々な異なる果物と野菜の摂取が推奨されている。ライナスポーリング研究所の健康のための処方箋では、ジャガイモは毎日の果物と野菜摂取量の集計に含めるべきでないとの記述がある。さらに、アブラナ科野菜のようなある種の果物と野菜は、特定の健康上の利益をもたらすかもしれない(アブラナ科野菜の記事を参照)。さらに、食物繊維が豊富なまるごとの果実は糖分が過剰なフルーツジュースよりも推奨されている。
果実や野菜の1サービングの例
- 6液量オンスの果実や野菜ジュース(3/4カップ)
- 中サイズのリンゴやオレンジ1個
- バナナ(小さめ)1本
- 生野菜のサラダ1カップ
- 調理した野菜1/2カップ(野球ボールの大きさくらい)
- カットした果実または野菜1/2カップ
- 調理したえんどう豆またはビーンズ1/2カップ
- 乾燥フルーツ1/4カップ(ゴルフボールの大きさくらい)
| ビタミン類 | ミネラル類 | 植物性化学物質 |
|---|---|---|
| 葉酸 | マグネシウム | カロテノイド |
| ビタミンA | カリウム | クロロフィル |
| ビタミンC | セレン | 食物繊維 |
| ビタミンE | フラボノイド | |
| ビタミンK | インドール-3-カルビノール | |
| イソフラボン | ||
| イソチオシアネート | ||
| リグナン | ||
| 植物ステロール |
Authors and Reviewers
Originally written in 2003 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in December 2005 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in May 2009 by:
Victoria J. Drake, Ph.D.
Linus Pauling Institute
Oregon State University
Reviewed in May 2009 by:
Kaumudi Joshipura, Sc.D.
Professor of Epidemiology
Harvard School of Public Health
Associate Professor
Harvard School of Dental Medicine
Copyright 2003-2024 Linus Pauling Institute
References
1. Lock K, Pomerleau J, Causer L, Altmann DR, McKee M. The global burden of disease attributable to low consumption of fruit and vegetables: implications for the global strategy on diet. Bull World Health Organ. 2005;83(2):100-108. (PubMed)
2. Liu RH. Potential synergy of phytochemicals in cancer prevention: mechanism of action. J Nutr. 2004;134(12 Suppl):3479S-3485S. (PubMed)
3. Law MR, Morris JK. By how much does fruit and vegetable consumption reduce the risk of ischaemic heart disease? Eur J Clin Nutr. 1998;52(8):549-556. (PubMed)
4. Joshipura KJ, Hu FB, Manson JE, et al. The effect of fruit and vegetable intake on risk for coronary heart disease. Ann Intern Med. 2001;134(12):1106-1114. (PubMed)
5. Joshipura KJ, Ascherio A, Manson JE, et al. Fruit and vegetable intake in relation to risk of ischemic stroke. JAMA. 1999;282(13):1233-1239. (PubMed)
6. Dauchet L, Amouyel P, Hercberg S, Dallongeville J. Fruit and vegetable consumption and risk of coronary heart disease: a meta-analysis of cohort studies. J Nutr. 2006;136(10):2588-2593. (PubMed)
7. He FJ, Nowson CA, Lucas M, MacGregor GA. Increased consumption of fruit and vegetables is related to a reduced risk of coronary heart disease: meta-analysis of cohort studies. J Hum Hypertens. 2007;21(9):717-728. (PubMed)
8. He FJ, Nowson CA, MacGregor GA. Fruit and vegetable consumption and stroke: meta-analysis of cohort studies. Lancet. 2006;367(9507):320-326. (PubMed)
9. Chobanian AV, Bakris GL, Black HR, et al. Seventh Report of the Joint National Committee on Prevention, Detection, Evaluation, and Treatment of High Blood Pressure: the JNC 7 report. JAMA. 2003;289(19):2560-2572. (PubMed)
10. Appel LJ, Moore TJ, Obarzanek E, et al. A clinical trial of the effects of dietary patterns on blood pressure. DASH Collaborative Research Group. N Engl J Med. 1997;336(16):1117-1124. (PubMed)
11. Bazzano LA, Serdula MK, Liu S. Dietary intake of fruits and vegetables and risk of cardiovascular disease. Curr Atheroscler Rep. 2003;5(6):492-499. (PubMed)
12. Winer N, Sowers JR. Epidemiology of diabetes. J Clin Pharmacol. 2004;44(4):397-405. (PubMed)
13. Ford ES, Mokdad AH. Fruit and vegetable consumption and diabetes mellitus incidence among U.S. adults. Prev Med. 2001;32(1):33-39. (PubMed)
14. Liu S, Serdula M, Janket SJ, et al. A prospective study of fruit and vegetable intake and the risk of type 2 diabetes in women. Diabetes Care. 2004;27(12):2993-2996. (PubMed)
15. Harding AH, Wareham NJ, Bingham SA, et al. Plasma vitamin C level, fruit and vegetable consumption, and the risk of new-onset type 2 diabetes mellitus: the European prospective investigation of cancer--Norfolk prospective study. Arch Intern Med. 2008;168(14):1493-1499. (PubMed)
16. Bazzano LA, Li TY, Joshipura KJ, Hu FB. Intake of fruit, vegetables, and fruit juices and risk of diabetes in women. Diabetes Care. 2008;31(7):1311-1317. (PubMed)
17. Hamer M, Chida Y. Intake of fruit, vegetables, and antioxidants and risk of type 2 diabetes: systematic review and meta-analysis. J Hypertens. 2007;25(12):2361-2369. (PubMed)
18. Sargeant LA, Khaw KT, Bingham S, et al. Fruit and vegetable intake and population glycosylated haemoglobin levels: the EPIC-Norfolk Study. Eur J Clin Nutr. 2001;55(5):342-348. (PubMed)
19. Block G, Patterson B, Subar A. Fruit, vegetables, and cancer prevention: a review of the epidemiological evidence. Nutr Cancer. 1992;18(1):1-29. (PubMed)
20. World Cancer Research Fund. Food, Nutrition, and the Prevention of Cancer: a global perspective. Washington, D.C.: American Institute for Cancer Research; 1997.
21. Liu C, Russell RM. Nutrition and gastric cancer risk: an update. Nutr Rev. 2008;66(5):237-249. (PubMed)
22. van Gils CH, Peeters PH, Bueno-de-Mesquita HB, et al. Consumption of vegetables and fruits and risk of breast cancer. JAMA. 2005;293(2):183-193. (PubMed)
23. Tsubono Y, Otani T, Kobayashi M, Yamamoto S, Sobue T, Tsugane S. No association between fruit or vegetable consumption and the risk of colorectal cancer in Japan. Br J Cancer. 2005;92(9):1782-1784. (PubMed)
24. Sato Y, Tsubono Y, Nakaya N, et al. Fruit and vegetable consumption and risk of colorectal cancer in Japan: The Miyagi Cohort Study. Public Health Nutr. 2005;8(3):309-314. (PubMed)
25. Lin J, Zhang SM, Cook NR, et al. Dietary intakes of fruit, vegetables, and fiber, and risk of colorectal cancer in a prospective cohort of women (United States). Cancer Causes Control. 2005;16(3):225-233. (PubMed)
26. Key TJ, Allen N, Appleby P, et al. Fruits and vegetables and prostate cancer: no association among 1104 cases in a prospective study of 130544 men in the European Prospective Investigation into Cancer and Nutrition (EPIC). Int J Cancer. 2004;109(1):119-124. (PubMed)
27. Hung HC, Joshipura KJ, Jiang R, et al. Fruit and vegetable intake and risk of major chronic disease. J Natl Cancer Inst. 2004;96(21):1577-1584. (PubMed)
28. Smith-Warner SA, Spiegelman D, Yaun SS, et al. Fruits, vegetables and lung cancer: A pooled analysis of cohort studies. Int J Cancer. 2003;107(6):1001-1011. (PubMed)
29. McCullough ML, Robertson AS, Chao A, et al. A prospective study of whole grains, fruits, vegetables and colon cancer risk. Cancer Causes Control. 2003;14(10):959-970. (PubMed)
30. Michaud DS, Pietinen P, Taylor PR, Virtanen M, Virtamo J, Albanes D. Intakes of fruits and vegetables, carotenoids and vitamins A, E, C in relation to the risk of bladder cancer in the ATBC cohort study. Br J Cancer. 2002;87(9):960-965. (PubMed)
31. Flood A, Velie EM, Chaterjee N, et al. Fruit and vegetable intakes and the risk of colorectal cancer in the Breast Cancer Detection Demonstration Project follow-up cohort. Am J Clin Nutr. 2002;75(5):936-943. (PubMed)
32. Smith-Warner SA, Spiegelman D, Yaun SS, et al. Intake of fruits and vegetables and risk of breast cancer: a pooled analysis of cohort studies. JAMA. 2001;285(6):769-776. (PubMed)
33. Michels KB, Edward G, Joshipura KJ, et al. Prospective study of fruit and vegetable consumption and incidence of colon and rectal cancers. J Natl Cancer Inst. 2000;92(21):1740-1752. (PubMed)
34. Larsson SC, Andersson SO, Johansson JE, Wolk A. Fruit and vegetable consumption and risk of bladder cancer: a prospective cohort study. Cancer Epidemiol Biomarkers Prev. 2008;17(9):2519-2522. (PubMed)
35. Michels KB, Mohllajee AP, Roset-Bahmanyar E, Beehler GP, Moysich KB. Diet and breast cancer: a review of the prospective observational studies. Cancer. 2007;109(12 Suppl):2712-2749. (PubMed)
36. Freedman ND, Subar AF, Hollenbeck AR, Leitzmann MF, Schatzkin A, Abnet CC. Fruit and vegetable intake and gastric cancer risk in a large United States prospective cohort study. Cancer Causes Control. 2008;19(5):459-467. (PubMed)
37. George SM, Park Y, Leitzmann MF, et al. Fruit and vegetable intake and risk of cancer: a prospective cohort study. Am J Clin Nutr. 2009;89(1):347-353. (PubMed)
38. Holick CN, De Vivo I, Feskanich D, Giovannucci E, Stampfer M, Michaud DS. Intake of fruits and vegetables, carotenoids, folate, and vitamins A, C, E and risk of bladder cancer among women (United States). Cancer Causes Control. 2005;16(10):1135-1145. (PubMed)
39. Koushik A, Hunter DJ, Spiegelman D, et al. Fruits, vegetables, and colon cancer risk in a pooled analysis of 14 cohort studies. J Natl Cancer Inst. 2007;99(19):1471-1483. (PubMed)
40. Larsson SC, Hakansson N, Naslund I, Bergkvist L, Wolk A. Fruit and vegetable consumption in relation to pancreatic cancer risk: a prospective study. Cancer Epidemiol Biomarkers Prev. 2006;15(2):301-305. (PubMed)
41. McCullough ML, Bandera EV, Patel R, et al. A prospective study of fruits, vegetables, and risk of endometrial cancer. Am J Epidemiol. 2007;166(8):902-911. (PubMed)
42. Rohrmann S, Becker N, Linseisen J, et al. Fruit and vegetable consumption and lymphoma risk in the European Prospective Investigation into Cancer and Nutrition (EPIC). Cancer Causes Control. 2007;18(5):537-549. (PubMed)
43. Weikert S, Boeing H, Pischon T, et al. Fruits and vegetables and renal cell carcinoma: findings from the European prospective investigation into cancer and nutrition (EPIC). Int J Cancer. 2006;118(12):3133-3139. (PubMed)
44. Boffetta P, Couto E, Wichmann J, et al. Fruit and vegetable intake and overall cancer risk in the European Prospective Investigation Into Cancer and Nutrition (EPIC). J Natl Cancer Inst. 2010;102(8):529-37. (PubMed)
45. Willett W. Nutritional Epidemiology. 2nd ed. New York: Oxford University Press; 1998.
46. Riboli E, Norat T. Epidemiologic evidence of the protective effect of fruit and vegetables on cancer risk. Am J Clin Nutr. 2003;78(3 Suppl):559S-569S. (PubMed)
47. Michaud DS, Spiegelman D, Clinton SK, Rimm EB, Willett WC, Giovannucci EL. Fruit and vegetable intake and incidence of bladder cancer in a male prospective cohort. J Natl Cancer Inst. 1999;91(7):605-613. (PubMed)
48. Kirsh VA, Peters U, Mayne ST, et al. Prospective study of fruit and vegetable intake and risk of prostate cancer. J Natl Cancer Inst. 2007;99(15):1200-1209. (PubMed)
49. Giovannucci E, Rimm EB, Liu Y, Stampfer MJ, Willett WC. A prospective study of tomato products, lycopene, and prostate cancer risk. J Natl Cancer Inst. 2002;94(5):391-398. (PubMed)
50. Tucker KL, Hannan MT, Chen H, Cupples LA, Wilson PW, Kiel DP. Potassium, magnesium, and fruit and vegetable intakes are associated with greater bone mineral density in elderly men and women. Am J Clin Nutr. 1999;69(4):727-736. (PubMed)
51. New SA, Bolton-Smith C, Grubb DA, Reid DM. Nutritional influences on bone mineral density: a cross-sectional study in premenopausal women. Am J Clin Nutr. 1997;65(6):1831-1839. (PubMed)
52. New SA, Robins SP, Campbell MK, et al. Dietary influences on bone mass and bone metabolism: further evidence of a positive link between fruit and vegetable consumption and bone health? Am J Clin Nutr. 2000;71(1):142-151. (PubMed)
53. Prynne CJ, Mishra GD, O'Connell MA, et al. Fruit and vegetable intakes and bone mineral status: a cross sectional study in 5 age and sex cohorts. Am J Clin Nutr. 2006;83(6):1420-1428. (PubMed)
54. New SA. Nutrition Society Medal lecture. The role of the skeleton in acid-base homeostasis. Proc Nutr Soc. 2002;61(2):151-164. (PubMed)
55. Macdonald HM, Black AJ, Aucott L, et al. Effect of potassium citrate supplementation or increased fruit and vegetable intake on bone metabolism in healthy postmenopausal women: a randomized controlled trial. Am J Clin Nutr. 2008;88(2):465-474. (PubMed)
56. Lin PH, Ginty F, Appel LJ, et al. The DASH diet and sodium reduction improve markers of bone turnover and calcium metabolism in adults. J Nutr. 2003;133(10):3130-3136. (PubMed)
57. Brown L, Rimm EB, Seddon JM, et al. A prospective study of carotenoid intake and risk of cataract extraction in US men. Am J Clin Nutr. 1999;70(4):517-524. (PubMed)
58. Christen WG, Liu S, Schaumberg DA, Buring JE. Fruit and vegetable intake and the risk of cataract in women. Am J Clin Nutr. 2005;81(6):1417-1422. (PubMed)
59. Jacques PF, Chylack LT, Jr., Hankinson SE, et al. Long-term nutrient intake and early age-related nuclear lens opacities. Arch Ophthalmol. 2001;119(7):1009-1019. (PubMed)
60. Lyle BJ, Mares-Perlman JA, Klein BE, Klein R, Greger JL. Antioxidant intake and risk of incident age-related nuclear cataracts in the Beaver Dam Eye Study. Am J Epidemiol. 1999;149(9):801-809. (PubMed)
61. Cooper DA, Eldridge AL, Peters JC. Dietary carotenoids and certain cancers, heart disease, and age-related macular degeneration: a review of recent research. Nutr Rev. 1999;57(7):201-214. (PubMed)
62. Mares-Perlman JA, Millen AE, Ficek TL, Hankinson SE. The body of evidence to support a protective role for lutein and zeaxanthin in delaying chronic disease. Overview. J Nutr. 2002;132(3):518S-524S. (PubMed)
63. Seddon JM, Ajani UA, Sperduto RD, et al. Dietary carotenoids, vitamins A, C, and E, and advanced age-related macular degeneration. Eye Disease Case-Control Study Group. JAMA. 1994;272(18):1413-1420. (PubMed)
64. Snellen EL, Verbeek AL, Van Den Hoogen GW, Cruysberg JR, Hoyng CB. Neovascular age-related macular degeneration and its relationship to antioxidant intake. Acta Ophthalmol Scand. 2002;80(4):368-371. (PubMed)
65. Cho E, Seddon JM, Rosner B, Willett WC, Hankinson SE. Prospective study of intake of fruits, vegetables, vitamins, and carotenoids and risk of age-related maculopathy. Arch Ophthalmol. 2004;122(6):883-892. (PubMed)
66. Moeller SM, Parekh N, Tinker L, et al. Associations between intermediate age-related macular degeneration and lutein and zeaxanthin in the Carotenoids in Age-related Eye Disease Study (CAREDS): ancillary study of the Women's Health Initiative. Arch Ophthalmol. 2006;124(8):1151-1162. (PubMed)
67. Romieu I, Trenga C. Diet and obstructive lung diseases. Epidemiol Rev. 2001;23(2):268-287. (PubMed)
68. Tabak C, Smit HA, Rasanen L, et al. Dietary factors and pulmonary function: a cross sectional study in middle aged men from three European countries. Thorax. 1999;54(11):1021-1026. (PubMed)
69. Butland BK, Fehily AM, Elwood PC. Diet, lung function, and lung function decline in a cohort of 2512 middle aged men. Thorax. 2000;55(2):102-108. (PubMed)
70. Tabak C, Arts IC, Smit HA, Heederik D, Kromhout D. Chronic obstructive pulmonary disease and intake of catechins, flavonols, and flavones: the MORGEN Study. Am J Respir Crit Care Med. 2001;164(1):61-64. (PubMed)
71. Walda IC, Tabak C, Smit HA, et al. Diet and 20-year chronic obstructive pulmonary disease mortality in middle-aged men from three European countries. Eur J Clin Nutr. 2002;56(7):638-643. (PubMed)
72. Celik F, Topcu F. Nutritional risk factors for the development of chronic obstructive pulmonary disease (COPD) in male smokers. Clin Nutr. 2006;25(6):955-961. (PubMed)
73. Varraso R, Fung TT, Hu FB, Willett W, Camargo CA. Prospective study of dietary patterns and chronic obstructive pulmonary disease among US men. Thorax. 2007;62(9):786-791. (PubMed)
74. Varraso R, Fung TT, Barr RG, Hu FB, Willett W, Camargo CA, Jr. Prospective study of dietary patterns and chronic obstructive pulmonary disease among US women. Am J Clin Nutr. 2007;86(2):488-495. (PubMed)
75. Joseph JA, Denisova NA, Arendash G, et al. Blueberry supplementation enhances signaling and prevents behavioral deficits in an Alzheimer disease model. Nutr Neurosci. 2003;6(3):153-162. (PubMed)
76. Suganuma H, Hirano T, Arimoto Y, Inakuma T. Effect of tomato intake on striatal monoamine level in a mouse model of experimental Parkinson's disease. J Nutr Sci Vitaminol (Tokyo). 2002;48(3):251-254. (PubMed)
77. Dai Q, Borenstein AR, Wu Y, Jackson JC, Larson EB. Fruit and vegetable juices and Alzheimer's disease: the Kame Project. Am J Med. 2006;119(9):751-759. (PubMed)
78. Centers for Disease Control and Prevention. Eating a Variety of Fruits & Vegetables Every Day. (Web page). http://www.fruitsandveggiesmatter.gov/. Accessed 1/30/09.
79. US Department of Health and Human Services, US Department of Agriculture. Dietary Guidelines for Americans. 2005. http://health.gov/dietaryguidelines/dga2005/document/.
アブラナ科の野菜
要約
- アブラナ科の野菜は、グルコシノレートとして知られる硫黄含有化合物の豊富な供給源であるという意味で独特である。(詳細はこちら)
- アブラナ科の野菜を刻んだり噛んだりすると、イソチオシアネートやインドール3カルビノールといった生理活性グルコシノレート加水分解物が生成される。(詳細はこちら)
- いくつかの疫学的研究では、アブラナ科野菜の高摂取は肺がんや結直腸がんのリスク低下と関連づけられているが、ヒトのがんのリスクに対するアブラナ科野菜の効果に遺伝的差異が影響している可能性があるというエビデンス(科学的根拠)がある。(詳細はこちら)
- グルコシノレートの加水分解物は、ホルモンに影響されやすいがんの発症を阻害して性ホルモンの代謝や活性を変える可能性があるが、ヒトにおけるアブラナ科野菜の摂取と乳がんまたは前立腺がんとの逆相関のエビデンスは限定的であり、一貫性がない。(詳細はこちら)
- 米国国立がん研究所を含む多数の機関が多様な野菜や果物を毎日摂取することを推奨しており、推奨される摂取量は、年齢、性別、および運動の度合いによって異なる。しかしながら、アブラナ科野菜のみに対する推奨はなされていない。(詳細はこちら)
序説
アブラナ科野菜またはアブラナ属野菜は、アブラナ科または十字花科として植物学者に知られている科に属する植物の仲間であることからそう名付けられた。一般的に消費されている多くのアブラナ科野菜はアブラナ属に属し、ブロッコリー、芽キャベツ、キャベツ、カリフラワー、カラードグリーン、ケール、コールラビ、カラシナ、ルタバガ、カブ、パクチョイ、およびハクサイなどを含む(1)。ルッコラ、セイヨウワサビ、ダイコン、ワサビ、およびクレソンもアブラナ科野菜である。
アブラナ科の野菜は、ツンとする香りや辛味(苦味という人もいる)を出す硫黄含有化合物であるグルコシノレートの豊富な供給源であると言う点で独特である(2)。ミロシナーゼと呼ばれる植物の酵素類によるグルコシノレートの加水分解(ばらばらにすること)によって、生物活性を持つインドールやイソチオシアネートといった化合物が形成される(3)。ミロシナーゼは、無処置の植物細胞ではグルコシノレートから物理的に隔離されている。しかしながら、アブラナ科野菜を刻んだり噛んだりすると、ミロシナーゼがグルコシノレートに触れて、その加水分解の触媒作用をする。現在では、アブラナ科野菜やいくつかのグルコシノレート加水分解物の高摂取ががんの予防に役立つ可能性に興味が持たれている(「インドール3カルビノール」と「イソチオシアネート」の項参照)。
疾病予防
がん
他のほとんどの野菜と同様に、アブラナ科野菜はがんの予防に相乗的に役立つ可能性のある多様な栄養素や植物性化学物質の良好な供給源である(4)。ヒトにおけるアブラナ科野菜の摂取とがんのリスクとの関係を調べる際に難しいことの一つは、一般的に野菜が豊富な食事の恩恵と、特にアブラナ科野菜が豊富な食事による恩恵とを分離することである(5)。アブラナ科野菜がその他の野菜と異なっている一つの特徴は、グルコシノレート含有量が多いことである(6)。グルコシノレート加水分解物は、発がん性物質がDNAを傷つける前にその除去を促進するか、正常な細胞ががん細胞に変化するのを防ぐのに役立つように細胞シグナル伝達経路を変えることによって、がんの予防に役立っている可能性がある(7)。グルコシノレート加水分解物のいくつかは、エストロゲンのようなホルモンの代謝や活性を、ホルモンに影響されやすいがんの発症を防ぐように変えている可能性がある(8)。
1996年より前に発表された疫学的研究の広範な再調査で、87の症例対照研究の大部分(67%)で、ある種のアブラナ科野菜の摂取とがんのリスクの逆相関が見られた(9)。その時点では、その逆相関は肺がんと消化管のがんで最も強いように見えた。この後ろ向き症例対照研究の結果は、参加者ががんと診断される前に食事の情報を収集する前向きコホート研究よりも、(症例群と対照群の)参加者の選定および食事内容の思い出しにおけるバイアスによって歪められているようである(10)。過去10年間において、前向きコホート研究や個人の遺伝的変異を考慮した研究の結果は、アブラナ科野菜の摂取とある種のがんのリスクの関係が以前に思われていたよりももっと複雑であることを示唆している。
肺がん
肺がんリスクにアブラナ科野菜の摂取がもたらす効果を評価する際には、アブラナ科野菜の摂取を増やすことによる有益性は、喫煙をやめることに比べて小さいであろうことを覚えておくことが大切である(11,12)。いくつかの症例対照研究で、肺がんと診断された人々はがんでない対照群の人々に比べて、アブラナ科野菜の摂取がかなり少なかったことがわかっている(9)が、より最近の前向きコホート研究の結果はまちまちである。オランダ人男女(13)、アメリカ人女性(14)、およびフィンランド人男性(15)の前向き研究で、アブラナ科野菜の高摂取(1週間に4回以上)は肺がんリスクが大きく減ることと関連があった。しかし、アメリカ人男性(14)およびヨーロッパ人男女(11)による前向き研究では、逆相関は見られなかった。いくつかの研究の結果から、グルコシノレート加水分解物の代謝に影響する遺伝的要因が、肺がんリスクに対するアブラナ科野菜摂取の効果に影響している可能性が示されている(「遺伝的影響」の項参照)(16~21)。
結直腸がん
ある小規模な臨床試験で、ブロッコリーを250g/日と芽キャベツを250g/日摂取すると、よく焼かれた肉に含まれる発がんの可能性のある物質の尿中への排出が大きく増加したことがわかった。これは、アブラナ科野菜の高摂取が食事に含まれるある種の発がん性物質の排出を促進して、結直腸がんのリスクを減らす可能性を示唆している(22)。1990年より前に行われたいくつかの症例対照研究で、結直腸がんと診断された者は結直腸がんでない者よりも様々なアブラナ科野菜の摂取が少ないようだとわかっていた(23~26)。しかし、大部分の前向きコホート研究では、時間をかけて結直腸がんを発症するリスクとアブラナ科野菜の摂取との間に逆相関は見られなかった(27~32)。一つの例外はオランダ成人での前向き研究で、アブラナ科野菜の摂取が最も多い(平均で58g/日)男女は、摂取が最も少ない者(平均で11g/日)に比べて、大腸がんになる可能性が大きく低かった(33)。驚いたことに、その研究ではアブラナ科野菜の高摂取と女性の直腸がんのリスクの増加に相関があった。肺がんの場合のように、アブラナ科野菜の摂取と結直腸がんのリスクとの関係は、遺伝的要因によって複雑になっているのかもしれない。最近の数件の疫学的研究の結果では、アブラナ科野菜の摂取による予防的効果は、グルコシノレート加水分解物の代謝および除去能力における個人の遺伝的差異に影響されている可能性がある(「遺伝的影響」の項参照)(34~37)。
乳がん
内因性エストロゲンである17β-エストラジオールは、不可逆的に16α-ヒドロキシエストロン(16α-OHE1)または2-ヒドロキシエストロン(2-OHE1)へと代謝される。 2-OHE1と対照的に、 16α-OHE1は非常にエストロゲンと似ており、培養下でエストロゲンに影響されやすい乳がん細胞の増殖を強めることがわかっている(38,39)。17β-エストラジオールの代謝を2-OHE1に移行させ、同時に16α-OHE1から離すことが、乳がんのようなエストロゲンに影響されやすいがんのリスクを減らすのではないかという仮設があった(40)。小規模な臨床試験で、健康な閉経後の女性のアブラナ科野菜の摂取を4週間にわたって増やしたところ、尿中の2-OHE1対16α-OHE1の比率が増えた。このことは、アブラナ科野菜の摂取が多いとエストロゲンの代謝を変える可能性があることを示唆している。しかしながら、尿中の2-OHE1対16α-OHE1の比率と乳がんリスクの関係は明らかでない。数例の小規模な症例対照研究で、乳がんの女性は2-OHE1対16α-OHE1の比率が低いことがわかった(41~43)が、より大規模の症例対照研究および前向きコホート研究では、尿中の2-OHE1と16α-OHE1の比率と乳がんリスクとの間には特に関連がなかった(44~46)。アブラナ科野菜の摂取と乳がんリスクに関する疫学的研究の結果もまちまちである。米国、スウェーデン、および中国での数件の症例対照研究では、乳がんの女性のアブラナ科野菜の摂取は、がんでない対照群の女性と比べてかなり少なかった(47~49)。しかし7つの大規模前向きコホート研究の統合解析では、アブラナ科野菜の摂取は乳がんのリスクと関連がなかった(50)。285,526人の女性の前向き研究では、野菜全体の摂取は乳がんのリスクと関係がなかった。この研究では、キャベツ、根菜類、および葉物野菜といった野菜のタイプごとの分類と乳がんのリスクとは個別に関連づけられていない「51)。
前立腺がん
グルコシノレート加水分解物は、培養した前立腺がん細胞の成長を妨げ、そのプログラム死(アポトーシス)を促進することが知られている(52,53)が、アブラナ科野菜の摂取と前立腺がんのリスクに関する疫学的研究の結果は一貫していない。1990年以降に発表された8つの症例対照研究のうちの4つでは、前立腺がんの男性のアブラナ科野菜の摂取の程度は、がんでない対照群の男性とくらべてかなり低かった(54~57)。アブラナ科野菜の摂取と前立腺がんリスクの関連を調べた5つの前向きコホート研究では、統計的に意味のある逆相関は全体的には見られなかった(58~62)。しかしながら、その中で前立腺がんの症例が最多で最も長く追跡調査した研究では、前立腺特異抗原(PSA)検査を受けた男性に限って分析してみると、アブラナ科野菜の摂取と前立腺がんリスクには意義深い逆相関があった(58)。PSA検査で選別された男性は前立腺がんと診断される可能性がより高いため、このように分析を限定することは、検出バイアスを減らす一つの方法である(63)。加えて、直近の前向き研究で、アブラナ科野菜の摂取は前立腺以外に転移してしまっている転移性前立腺がん(すなわち、末期前立腺がん)と逆相関があることがわかった(62)。現在では、アブラナ科野菜の高摂取が前立腺がんのリスクを減らすという仮説は、疫学的研究で控えめにしか裏付けられていない(1)。
遺伝的影響
がんのリスクに対するアブラナ科野菜摂取の効果に、ヒトの遺伝的差異が影響している可能性があるというエビデンスが増えている(64)。イソチオシアネートはグルコシノレート加水分解物であり、アブラナ科野菜の摂取によるがん予防効果に役立っていると考えられている。グルタチオンS転移酵素(GST)は、イソチオシアネートを含む多様な化合物を体外への排出を促進するように代謝する酵素群である。GST酵素の活性に影響する遺伝的差異(多型性)がヒトで発見されている。GSTM1遺伝子とGSTT1遺伝子のヌル(null)型変異は遺伝子欠失が大きく、GSTM1遺伝子のヌル型またはGSTT1遺伝子のヌル型を2つ受け継いだ個人は、対応するGST酵素を作ることができない(65)。そのような個人においてGST酵素の活性が低いと、アブラナ科野菜の摂取後にイソチオシアネートの除去が遅くなり、それが長く体内に留まることになる(66)。この考えを支持するように、いくつかの疫学的研究でアブラナ科野菜からのイソチオシアネートの摂取と肺がん(16~19)または大腸がん(34~36)リスクとの逆相関が、GSTM1ヌル型および/またはGSTT1ヌル型の個人に顕著であるとわかった。これらの発見は、イソチオシアネートのような保護的働きを持つ可能性のある化合物をより遅く代謝する個人では、アブラナ科野菜の高摂取による身体保護的効果が強化されることを示唆している。あるいは、GST酵素は発がん性物質の解毒に主要な役割を果たし、ヌル型の遺伝子を持つ個人はがんになりやすいことが予期されるので、発がん性物質濃度が高い状態でアブラナ科野菜の保護的効果がますます重要であれば、そのような集団においてはアブラナ科野菜が重要な保護効果を示すのかもしれない(67)。
栄養素との相互作用
ヨウ素と甲状腺機能
キャベツやカブなどのアブラナ科野菜を非常に多く摂取すると、動物は甲状腺機能低下症(甲状腺ホルモン不足)を起こすことがわかっている(68)。数ヶ月にわたって推定で1.0~1.5kg/日の生のパクチョイを食べた88歳の女性が、重篤な甲状腺機能低下症を発症し昏睡状態になったという報告がある(69)。この結果には2つのメカニズムが働いていることがわかっている。アブラナ科野菜に見られるグルコシノレートの何種類か(例えばプロゴイトリン)の加水分解ではゴイトリンという化合物が作られ、これが甲状腺ホルモンの合成を阻害することがわかっている。インドールグルコシノレートという別種のグルコシノレートの加水分解ではチオシアネートイオンが放出され、甲状腺による吸収をヨウ素と競う。アブラナ科野菜の摂取あるいはもっと一般的な喫煙によるチオシアネートイオンに多くさらされても、ヨウ素欠乏でない限り甲状腺機能低下症のリスクが増えるようには見えない。ヒトでにおける1つの研究では、150g/日の加熱した芽キャベツを4週間にわたって食べても、甲状腺の機能には悪影響がなかった(70)。
推奨される摂取量
米国国立がん研究所を含む多くの機関で毎日様々な野菜や果物を食べること(分量は年齢、性別、および運動量で異なる。(71)) を勧めているが、アブラナ科野菜のみに関する推奨はない。アブラナ科野菜とがんの予防に関してもっと学ばなければいけないことが多いが、いくつかの疫学的研究の結果から、成人はアブラナ科野菜を週に少なくとも5回摂るように図るべきであることが示されている(14,58,71)。
| ビタミン | ミネラル | 植物性化学物質 |
|---|---|---|
| 葉酸塩 | カリウム | カロテノイド |
| ビタミンC | セレン | 葉緑素 |
| 食物繊維 | ||
| フラボノイド | ||
| インドール3カルビノール | ||
| イソチオシアネート | ||
| リグナン | ||
| 植物ステロール |
Authors and Reviewers
Originally written in 2005 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in December 2008 by:
Victoria J. Drake, Ph.D.
Linus Pauling Institute
Oregon State University
Reviewed in December 2008 by:
David E. Williams, Ph.D.
Principal Investigator, Linus Pauling Institute
Professor, Department of Environmental and Molecular Toxicology
Oregon State University
Copyright 2005-2024 Linus Pauling Institute
References
1. Kristal AR, Lampe JW. Brassica vegetables and prostate cancer risk: a review of the epidemiological evidence. Nutr Cancer. 2002;42(1):1-9. (PubMed)
2. Drewnowski A, Gomez-Carneros C. Bitter taste, phytonutrients, and the consumer: a review. Am J Clin Nutr. 2000;72(6):1424-1435. (PubMed)
3. Holst B, Williamson G. A critical review of the bioavailability of glucosinolates and related compounds. Nat Prod Rep. 2004;21(3):425-447. (PubMed)
4. Liu RH. Potential synergy of phytochemicals in cancer prevention: mechanism of action. J Nutr. 2004;134(12 Suppl):3479S-3485S. (PubMed)
5. McNaughton SA, Marks GC. Development of a food composition database for the estimation of dietary intakes of glucosinolates, the biologically active constituents of cruciferous vegetables. Br J Nutr. 2003;90(3):687-697. (PubMed)
6. van Poppel G, Verhoeven DT, Verhagen H, Goldbohm RA. Brassica vegetables and cancer prevention. Epidemiology and mechanisms. Adv Exp Med Biol. 1999;472:159-168. (PubMed)
7. Zhang Y. Cancer-preventive isothiocyanates: measurement of human exposure and mechanism of action. Mutat Res. 2004;555(1-2):173-190. (PubMed)
8. Auborn KJ, Fan S, Rosen EM, et al. Indole-3-carbinol is a negative regulator of estrogen. J Nutr. 2003;133(7 Suppl):2470S-2475S. (PubMed)
9. Verhoeven DT, Goldbohm RA, van Poppel G, Verhagen H, van den Brandt PA. Epidemiological studies on brassica vegetables and cancer risk. Cancer Epidemiol Biomarkers Prev. 1996;5(9):733-748. (PubMed)
10. Willett W. Nutritional Epidemiology. 2nd ed. New York: Oxford University Press; 1998.
11. Miller AB, Altenburg HP, Bueno-de-Mesquita B, et al. Fruits and vegetables and lung cancer: Findings from the European Prospective Investigation into Cancer and Nutrition. Int J Cancer. 2004;108(2):269-276. (PubMed)
12. Smith-Warner SA, Spiegelman D, Yaun SS, et al. Fruits, vegetables and lung cancer: a pooled analysis of cohort studies. Int J Cancer. 2003;107(6):1001-1011. (PubMed)
13. Voorrips LE, Goldbohm RA, Verhoeven DT, et al. Vegetable and fruit consumption and lung cancer risk in the Netherlands Cohort Study on diet and cancer. Cancer Causes Control. 2000;11(2):101-115. (PubMed)
14. Feskanich D, Ziegler RG, Michaud DS, et al. Prospective study of fruit and vegetable consumption and risk of lung cancer among men and women. J Natl Cancer Inst. 2000;92(22):1812-1823. (PubMed)
15. Neuhouser ML, Patterson RE, Thornquist MD, Omenn GS, King IB, Goodman GE. Fruits and vegetables are associated with lower lung cancer risk only in the placebo arm of the beta-carotene and retinol efficacy trial (CARET). Cancer Epidemiol Biomarkers Prev. 2003;12(4):350-358. (PubMed)
16. Lewis S, Brennan P, Nyberg F, et al. Re: Spitz, M. R., Duphorne, C. M., Detry, M. A., Pillow, P. C., Amos, C. I., Lei, L., de Andrade, M., Gu, X., Hong, W. K., and Wu, X. Dietary intake of isothiocyanates: evidence of a joint effect with glutathione S-transferase polymorphisms in lung cancer risk. Cancer Epidemiol. Biomark. Prev., 9: 2000; 10(10):1017-1020. (PubMed)
17. Spitz MR, Duphorne CM, Detry MA, et al. Dietary intake of isothiocyanates: evidence of a joint effect with glutathione S-transferase polymorphisms in lung cancer risk. Cancer Epidemiol Biomarkers Prev. 2000;9(10):1017-1020. (PubMed)
18. London SJ, Yuan JM, Chung FL, et al. Isothiocyanates, glutathione S-transferase M1 and T1 polymorphisms, and lung-cancer risk: a prospective study of men in Shanghai, China. Lancet. 2000;356(9231):724-729. (PubMed)
19. Zhao B, Seow A, Lee EJ, et al. Dietary isothiocyanates, glutathione S-transferase -M1, -T1 polymorphisms and lung cancer risk among Chinese women in Singapore. Cancer Epidemiol Biomarkers Prev. 2001;10(10):1063-1067. (PubMed)
20. Brennan P, Hsu CC, Moullan N, et al. Effect of cruciferous vegetables on lung cancer in patients stratified by genetic status: a Mendelian randomisation approach. Lancet. 2005;366(9496):1558-1560. (PubMed)
21. Wang LI, Giovannucci EL, Hunter D, Neuberg D, Su L, Christiani DC. Dietary intake of Cruciferous vegetables, Glutathione S-transferase (GST) polymorphisms and lung cancer risk in a Caucasian population. Cancer Causes Control. 2004;15(10):977-985. (PubMed)
22. Walters DG, Young PJ, Agus C, et al. Cruciferous vegetable consumption alters the metabolism of the dietary carcinogen 2-amino-1-methyl-6-phenylimidazo(4,5-b)pyridine (PhIP) in humans. Carcinogenesis. 2004;25(9):1659-1669. (PubMed)
23. Benito E, Obrador A, Stiggelbout A, et al. A population-based case-control study of colorectal cancer in Majorca. I. Dietary factors. Int J Cancer. 1990;45(1):69-76. (PubMed)
24. West DW, Slattery ML, Robison LM, et al. Dietary intake and colon cancer: sex- and anatomic site-specific associations. Am J Epidemiol. 1989;130(5):883-894. (PubMed)
25. Young TB, Wolf DA. Case-control study of proximal and distal colon cancer and diet in Wisconsin. Int J Cancer. 1988;42(2):167-175. (PubMed)
26. Graham S, Dayal H, Swanson M, Mittelman A, Wilkinson G. Diet in the epidemiology of cancer of the colon and rectum. J Natl Cancer Inst. 1978;61(3):709-714. (PubMed)
27. Kojima M, Wakai K, Tamakoshi K, et al. Diet and colorectal cancer mortality: results from the Japan Collaborative Cohort Study. Nutr Cancer. 2004;50(1):23-32. (PubMed)
28. McCullough ML, Robertson AS, Chao A, et al. A prospective study of whole grains, fruits, vegetables and colon cancer risk. Cancer Causes Control. 2003;14(10):959-970. (PubMed)
29. Michels KB, Edward G, Joshipura KJ, et al. Prospective study of fruit and vegetable consumption and incidence of colon and rectal cancers. J Natl Cancer Inst. 2000;92(21):1740-1752. (PubMed)
30. Steinmetz KA, Kushi LH, Bostick RM, Folsom AR, Potter JD. Vegetables, fruit, and colon cancer in the Iowa Women's Health Study. Am J Epidemiol. 1994;139(1):1-15. (PubMed)
31. Hsing AW, McLaughlin JK, Chow WH, et al. Risk factors for colorectal cancer in a prospective study among US white men. Int J Cancer. 1998;77(4):549-553. (PubMed)
32. Pietinen P, Malila N, Virtanen M, et al. Diet and risk of colorectal cancer in a cohort of Finnish men. Cancer Causes Control. 1999;10(5):387-396. (PubMed)
33. Voorrips LE, Goldbohm RA, van Poppel G, Sturmans F, Hermus RJ, van den Brandt PA. Vegetable and fruit consumption and risks of colon and rectal cancer in a prospective cohort study: The Netherlands Cohort Study on Diet and Cancer. Am J Epidemiol. 2000;152(11):1081-1092. (PubMed)
34. Turner F, Smith G, Sachse C, et al. Vegetable, fruit and meat consumption and potential risk modifying genes in relation to colorectal cancer. Int J Cancer. 2004;112(2):259-264. (PubMed)
35. Seow A, Yuan JM, Sun CL, Van Den Berg D, Lee HP, Yu MC. Dietary isothiocyanates, glutathione S-transferase polymorphisms and colorectal cancer risk in the Singapore Chinese Health Study. Carcinogenesis. 2002;23(12):2055-2061. (PubMed)
36. Slattery ML, Kampman E, Samowitz W, Caan BJ, Potter JD. Interplay between dietary inducers of GST and the GSTM-1 genotype in colon cancer. Int J Cancer. 2000;87(5):728-733. (PubMed)
37. Lin HJ, Probst-Hensch NM, Louie AD, et al. Glutathione transferase null genotype, broccoli, and lower prevalence of colorectal adenomas. Cancer Epidemiol Biomarkers Prev. 1998;7(8):647-652. (PubMed)
38. Telang NT, Suto A, Wong GY, Osborne MP, Bradlow HL. Induction by estrogen metabolite 16 alpha-hydroxyestrone of genotoxic damage and aberrant proliferation in mouse mammary epithelial cells. J Natl Cancer Inst. 1992;84(8):634-638. (PubMed)
39. Yuan F, Chen DZ, Liu K, Sepkovic DW, Bradlow HL, Auborn K. Anti-estrogenic activities of indole-3-carbinol in cervical cells: implication for prevention of cervical cancer. Anticancer Res. 1999;19(3A):1673-1680. (PubMed)
40. Bradlow HL, Telang NT, Sepkovic DW, Osborne MP. 2-hydroxyestrone: the 'good' estrogen. J Endocrinol. 1996;150 Suppl:S259-265. (PubMed)
41. Ho GH, Luo XW, Ji CY, Foo SC, Ng EH. Urinary 2/16 alpha-hydroxyestrone ratio: correlation with serum insulin-like growth factor binding protein-3 and a potential biomarker of breast cancer risk. Ann Acad Med Singapore. 1998;27(2):294-299. (PubMed)
42. Kabat GC, Chang CJ, Sparano JA, et al. Urinary estrogen metabolites and breast cancer: a case-control study. Cancer Epidemiol Biomarkers Prev. 1997;6(7):505-509. (PubMed)
43. Schneider J, Kinne D, Fracchia A, et al. Abnormal oxidative metabolism of estradiol in women with breast cancer. Proc Natl Acad Sci U S A. 1982;79(9):3047-3051. (PubMed)
44. Cauley JA, Zmuda JM, Danielson ME, et al. Estrogen metabolites and the risk of breast cancer in older women. Epidemiology. 2003;14(6):740-744. (PubMed)
45. Meilahn EN, De Stavola B, Allen DS, et al. Do urinary oestrogen metabolites predict breast cancer? Guernsey III cohort follow-up. Br J Cancer. 1998;78(9):1250-1255. (PubMed)
46. Ursin G, London S, Stanczyk FZ, et al. Urinary 2-hydroxyestrone/16alpha-hydroxyestrone ratio and risk of breast cancer in postmenopausal women. J Natl Cancer Inst. 1999;91(12):1067-1072. (PubMed)
47. Ambrosone CB, McCann SE, Freudenheim JL, Marshall JR, Zhang Y, Shields PG. Breast cancer risk in premenopausal women is inversely associated with consumption of broccoli, a source of isothiocyanates, but is not modified by GST genotype. J Nutr. 2004;134(5):1134-1138. (PubMed)
48. Fowke JH, Chung FL, Jin F, et al. Urinary isothiocyanate levels, brassica, and human breast cancer. Cancer Res. 2003;63(14):3980-3986. (PubMed)
49. Terry P, Wolk A, Persson I, Magnusson C. Brassica vegetables and breast cancer risk. JAMA. 2001;285(23):2975-2977. (PubMed)
50. Smith-Warner SA, Spiegelman D, Yaun SS, et al. Intake of fruits and vegetables and risk of breast cancer: a pooled analysis of cohort studies. JAMA. 2001;285(6):769-776. (PubMed)
51. van Gils CH, Peeters PH, Bueno-de-Mesquita HB, et al. Consumption of vegetables and fruits and risk of breast cancer. JAMA. 2005;293(2):183-193. (PubMed)
52. Singh AV, Xiao D, Lew KL, Dhir R, Singh SV. Sulforaphane induces caspase-mediated apoptosis in cultured PC-3 human prostate cancer cells and retards growth of PC-3 xenografts in vivo. Carcinogenesis. 2004;25(1):83-90. (PubMed)
53. Sarkar FH, Li Y. Indole-3-carbinol and prostate cancer. J Nutr. 2004;134(12 Suppl):3493S-3498S. (PubMed)
54. Cohen JH, Kristal AR, Stanford JL. Fruit and vegetable intakes and prostate cancer risk. J Natl Cancer Inst. 2000;92(1):61-68. (PubMed)
55. Jain MG, Hislop GT, Howe GR, Ghadirian P. Plant foods, antioxidants, and prostate cancer risk: findings from case-control studies in Canada. Nutr Cancer. 1999;34(2):173-184. (PubMed)
56. Joseph MA, Moysich KB, Freudenheim JL, et al. Cruciferous vegetables, genetic polymorphisms in glutathione s-transferases m1 and t1, and prostate cancer risk. Nutr Cancer. 2004;50(2):206-213. (PubMed)
57. Kolonel LN, Hankin JH, Whittemore AS, et al. Vegetables, fruits, legumes and prostate cancer: a multiethnic case-control study. Cancer Epidemiol Biomarkers Prev. 2000;9(8):795-804. (PubMed)
58. Giovannucci E, Rimm EB, Liu Y, Stampfer MJ, Willett WC. A prospective study of cruciferous vegetables and prostate cancer. Cancer Epidemiol Biomarkers Prev. 2003;12(12):1403-1409. (PubMed)
59. Hsing AW, McLaughlin JK, Schuman LM, et al. Diet, tobacco use, and fatal prostate cancer: results from the Lutheran Brotherhood Cohort Study. Cancer Res. 1990;50(21):6836-6840. (PubMed)
60. Key TJ, Allen N, Appleby P, et al. Fruits and vegetables and prostate cancer: no association among 1104 cases in a prospective study of 130544 men in the European Prospective Investigation into Cancer and Nutrition (EPIC). Int J Cancer. 2004;109(1):119-124. (PubMed)
61. Schuurman AG, Goldbohm RA, Dorant E, van den Brandt PA. Vegetable and fruit consumption and prostate cancer risk: a cohort study in The Netherlands. Cancer Epidemiol Biomarkers Prev. 1998;7(8):673-680. (PubMed)
62. Kirsh VA, Peters U, Mayne ST, et al. Prospective study of fruit and vegetable intake and risk of prostate cancer. J Natl Cancer Inst. 2007;99(15):1200-1209. (PubMed)
63. Kristal AR, Stanford JL. Cruciferous vegetables and prostate cancer risk: confounding by PSA screening. Cancer Epidemiol Biomarkers Prev. 2004;13(7):1265. (PubMed)
64. Lampe JW, Peterson S. Brassica, biotransformation and cancer risk: genetic polymorphisms alter the preventive effects of cruciferous vegetables. J Nutr. 2002;132(10):2991-2994. (PubMed)
65. Coles BF, Kadlubar FF. Detoxification of electrophilic compounds by glutathione S-transferase catalysis: determinants of individual response to chemical carcinogens and chemotherapeutic drugs? Biofactors. 2003;17(1-4):115-130. (PubMed)
66. Seow A, Shi CY, Chung FL, et al. Urinary total isothiocyanate (ITC) in a population-based sample of middle-aged and older Chinese in Singapore: relationship with dietary total ITC and glutathione S-transferase M1/T1/P1 genotypes. Cancer Epidemiol Biomarkers Prev. 1998;7(9):775-781. (PubMed)
67. Perera FP, Mooney LA, Stampfer M, et al. Associations between carcinogen-DNA damage, glutathione S-transferase genotypes, and risk of lung cancer in the prospective Physicians' Health Cohort Study. Carcinogenesis. 2002;23(10):1641-1646. (PubMed)
68. Fenwick GR, Heaney RK, Mullin WJ. Glucosinolates and their breakdown products in food and food plants. Crit Rev Food Sci Nutr. 1983;18(2):123-201. (PubMed)
69. Chu M, Seltzer TF. Myxedema coma induced by ingestion of raw bok choy. N Engl J Med. 2010;362(20):1945-1946.
70. McMillan M, Spinks EA, Fenwick GR. Preliminary observations on the effect of dietary brussels sprouts on thyroid function. Hum Toxicol. 1986;5(1):15-19. (PubMed)
71. National Cancer Institute. Eat a Variety of Fruits & Vegetables Every Day. http://www.fruitsandveggiesmatter.gov/. Accessed 9/22/08.
ニンニク
目次
ニンニクと有機硫黄化合物
要約
- ニンニク(Allium sativum L.)は有機硫黄化合物を豊富に含有しており、現在これら化合物の病気予防および治療の可能性について研究が行われている。(詳細な情報)
- ニンニクをつぶすもしくはみじん切りにすると、Allicinの形成を触媒するAlliinaseと呼ばれている酵素が放出される。Allicinは速やかに分解して様々な有機硫黄合成物を形成する。(詳細な情報)
- 加熱調理することでアリイナーゼを不活性することができるため、一部の科学者は加熱調理をする前に、ニンニクを細かく刻んだり、粉砕してから10分間放置することを勧めている。(詳細な情報)
- ニンニク製剤には、いくつかの種類が市販されており、各種製剤はニンニクがどのように処理されたかに応じて、異なる有機硫黄化合物の分析結果を提供している。(詳細な情報)
- 無作為比較試験の結果は、ニンニクの摂取が血小板凝集を阻害することを示唆しているが、ニンニク製剤が循環器疾患を防ぐことができるかどうかは不明である。(詳細な情報)
- いくつかの疫学的研究の結果、ニンニクや他のネギ属野菜(例えば、玉ねぎやネギ)の多量摂取は胃癌·大腸癌の予防に役立つことを示唆しているが、ニンニク由来の有機硫黄化合物が、ヒトの癌予防または治療に有効であるかどうかは不明である。(詳細な情報)
はじめに
ニンニク(Allium sativum L.)は、何世紀にもわたり多様な文化のなかで料理や薬用に用いられてきた (1)。ニンニクは有機硫黄化合物を特に豊富に含んでおり、これらはその味と香りだけでなく、健康上の潜在的利益にも関与していると考えられている(2)。ニンニクの健康上の利点に対する消費者の関心は、アメリカ国内でのハーブ系製剤の売上1位を獲得できるほど十分に高い(3)。科学者は、癌や循環器疾患などの慢性疾患を予防・治療するニンニク由来の有機硫黄化合物の可能性に興味を持っている(4)。
ニンニクの有機硫黄化合物
2種類の有機硫黄化合物がニンニクから発見されている。ひとつはGamma-glutamylcysteines、もうひとつはCysteine sulfoxidesである。Allylcysteine sulfoxide (alliin) は、ニンニクに含まれるCysteine sulfoxidesの約80%を占めている (1)。生のニンニク片がつぶされたりみじん切りにされる、または噛まれたとき、Alliinaseとして知られている酵素が放出される。Alliinaseは、Cysteine sulfoxidesからのスルフェン酸の形成を触媒する(Figure 1)。スルフェン酸は互いに自発的に反応してthiosulfinatesと呼ばれる不安定な化合物を形成する。Alliinの場合、Alliinaseによって生じたスルフェン酸が互いに反応しあってAllicinとして知られるthiosulfinateを形成する(つぶしたニンニクの場合、23℃における半減期は2.5日。)。Thiosulfinatesの形成は非常に迅速であり、粉砕したニンニクの場合、10〜60秒以内に完了することが見出されている。Allicinはin vitroでの分解で、diallyl trisulfide(DATS)、diallyl disulfide(DADS)、およびdiallyl sulfide(DAS)を含む多様な脂溶性有機硫黄化合物を形成するか (Figure 2)、油または有機溶媒存在下ではajoene やvinyldithiinsを形成する(2)。ニンニクを粉砕してもそのGamma-glutamylcysteine含量は変化しない。例えばS-allylcysteine等の水溶性有機硫黄化合物は、熟成ニンニク抽出液の製造など、水溶液中でつぶしたニンニクの長期保存中にgamma-glutamylcysteinesから形成される (下記出典を参照)。

生物学的利用能と代謝
Allicin由来の化合物
AllicinおよびAllicin由来の化合物の吸収と代謝は、部分的にしか明らかにされていない (5)。多くの生物活性は多様なAllicin由来の化合物に起因しているが、それらの化合物や代謝産物のどれが実際に標的組織に到達するかはまだ明確になっていない(1)。放射性標識化合物を用いた動物実験では、Allicinまたはその分解生成物が腸管吸収されることを示している (6,7)。しかしながら、AllicinとAllicin由来の化合物(diallylsufides、ajoene、vinyldithiins)は、新鮮なニンニク25 gまたはAllicin 60 mgの摂取後でもヒトの血液、尿、糞中に検出されない。これらの知見は、Allicin及びAllicin由来化合物は急速に代謝されることを示唆している。呼気中のアリルメチルスルフィド濃度は、Allicin及びAllicin由来化合物の生物学的利用能の指標として提案されている(5)。つぶしたニンニクとそれに相当する量のallicin、DATS、DADS、ajoene、アリルメチルスルフィドをヒトが消費したとき、呼気中のアリルメチルスルフィド濃度が同様に増加したことから、Allicin及びAllicin由来化合物は、呼気中の計測できる揮発性化合物であるアリルメチルスルフィドに代謝されることを示唆している。
Gamma-GlutamylcysteinesとS-Allylcysteine
Gamma-glutamylcysteinesはそのまま吸収されS-allylcysteineおよびS-1-propenylcysteineに加水分解されると考えられている。その理由として、これら化合物の代謝物がニンニク摂取後のヒト尿中で測定されているためである (8,9)。熟成ニンニク抽出物やS-allylcysteineを含有する市販のニンニク製剤を摂取したヒトでは、血漿中のS-allylcysteine濃度が増加することが見出された(10,11)。
生物活性
心血管疾患の予防に関連して
コレステロール合成の阻害
ニンニクおよびニンニク由来の有機硫黄化合物は、肝細胞によるコレステロール合成を減少させることが見出されている(12)。 S-allylcysteineとajoeneを含む、 いくつかのニンニク由来の有機硫黄化合物は、コレステロール生合成経路において重要な酵素である3-hydroxy-3-methyl-glutaryl-coenzyme A reductase (HMG-CoA reductase) を阻害することが見出されている(13,14)。またニンニク由来の化合物は4-alpha-methyl oxidaseを含むコレステロール生合成経路内の他の酵素を阻害する可能性がある(15)。
血小板凝集抑制
ニンニク由来の多様な有機硫黄化合物は血小板凝集を阻害することが試験管内で見出されている (16,17)。
抗炎症活性
炎症は、心臓血管疾患の病状に重要な役割を果たすと思われる(18)。ニンニク由来の有機硫黄化合物はin vitroでcyclooxygenaseおよびlipoxygenaseといった炎症性酵素の活性を阻害し[総説19]、炎症性白血球細胞(マクロファージ)中の誘導型一酸化窒素合成酵素(iNOS)の発現を減少させることが見出されている(20,21)。特に最近では、有機硫黄化合物は培養したマクロファージ内およびヒト全血中における炎症性シグナル分子の産生を減少させることが見出されている(22,23)。
動脈平滑筋増殖の阻害
正常に休止した動脈平滑筋細胞の増殖と遊走は、アテローム性動脈硬化症および冠動脈再狭窄を含む血管疾患の主要な特徴である。ヒトの心血管疾患におけるこれらの知見の重要性はまだ明らかではないが、限られた細胞培養の研究では、ニンニク由来の有機硫黄化合物は血管平滑筋細胞の増殖と遊走を阻害し得ることを示唆している(13,25,26)。
抗酸化活性
多数の有機硫黄化合物は、試験管内で抗酸化活性を有することが見出され、有機硫黄化合物は、重要な細胞内抗酸化物質であるグルタチオンの合成を促進することができるいくつかの証拠が存在している(27)。高血圧成人におけるニンニク油の摂取試験では、小規模非対照試験にてin vivo で脂質 (脂肪) 酸化のバイオマーカーを減少させることが報告されているが(28)、ニンニク由来の有機硫黄化合物が、in vivoで臨床的に重要な抗酸化効果を有するかどうかはまだ明らかではない。
硫化水素を介した血管拡張活性
正常な動脈機能の維持は心血管疾患の予防において重要な役割を果たしている。体内の細胞により産生されるガス状のシグナル伝達分子である硫化水素は、血管拡張剤 (血管を弛緩する) として作用し、従って心臓保護作用を有する可能性がある(29,30)。最近の研究においてニンニク由来の化合物は、in vitroで赤血球によって硫化水素に変換されることがわかった(31)。しかし、ヒトにおける生ニンニクの大量摂取は呼気中の硫化水素濃度を増加させないため、in vivoにおいてニンニク化合物らの硫化水素生成への代謝はあまり起こらないことを示唆している(32)。
癌に関連する生物活性
発癌性物質の代謝に及ぼす影響
フェーズI生体内変換酵素の阻害:いくつかの化学発癌性物質は、チトクロームP450(CYP)ファミリーに属するようなフェーズI生体内変換酵素によって代謝されるまで、活性を有する発癌性物質にならない。発癌性物質の活性化に関与する特異的CYP酵素の阻害は、いくつかの動物モデルにおける癌の進展を阻害する(33)。特に、DASとその代謝物は、in vitro (34)、および動物に高用量で経口投与した場合において、CYP2E1活性を阻害することが見出されている(35,36)。ヒトにおいてもガーリックオイルとDASの経口投与はCYP2E1活性を減少させる証拠を示す結果となった(37,38)。
フェーズII生体内変換酵素の誘導:フェーズII生体内酵素によって触媒される反応は、一般的に体内の薬物、毒素そして発癌性物質の除去を促進する。そのためglutathione S-transferaseおよびquinone reductaseなどのフェーズII酵素の活性増大は、発癌性物質となり得る物質の除去を促進し、癌を防ぐ手助けをする可能性がある(39)。動物実験においてニンニク製剤および有機硫黄化合物の経口投与は、様々な組織中のフェーズII酵素の活性を増加させる(40-42)。多数のフェーズII酵素の遺伝子は、抗酸化応答因子(ARE)と呼ばれるDNAの特異的配列を含んでいる。最近の研究では、allyl sulfides、特にDATSはNrf2として知られる転写因子の核への移行を促進し、核でNrf2がAREと結合してAREを含む遺伝子の転写を増大させることを示唆している(43,44)。非常に高用量の有機硫黄化合物が多くの動物実験で投与されたが、少なくとも一つの研究では、ヒトが摂取し得る量でDADSを投与したマウスの消化管でキノンレダクターゼ活性が増加していることがわかった(45)。
細胞内グルタチオン合成の促進:グルタチオンは重要な細胞内の抗酸化物質であり、いくつかのフェーズII生体内変換反応にも必要とされる。細胞培養および動物研究から、ニンニク由来の有機硫黄化合物が細胞内グルタチオン濃度を増加させるという証拠がある(43,46)。多くのフェーズII酵素の遺伝子と同様に、グルタチオン合成に重要な酵素の遺伝子にもまたAREが含まれている。このように、有機硫黄化合物は、核への移行とAREsを含む遺伝子へのNrf2転写因子の結合を促進することにより、細胞のグルタチオン合成を増加させることができる(上記のフェーズII酵素の誘導を参照)。
細胞周期停止の誘導
無秩序な細胞分裂はヒトの癌の顕著な特徴である(47)。正常細胞では、細胞周期は細胞分裂前における染色体の分離とDNA複製を忠実、且つ確実にするために厳密に調節されている。DNAが損傷すると、細胞周期はDNAの修復もしくは細胞死(アポトーシス)に至る経路の活性化のため一時的に停止することになる。細胞培養実験でDATS、DADS、ajoene、およびS-allylmercaptocysteine(SAMC)などの有機硫黄化合物を癌細胞に加えると、細胞周期の停止を誘導することが見出されている(48-50)。
アポトーシスの誘発
アポトーシスは、遺伝的に損傷もしくは不要になった細胞の自己破壊のための正常な生理的プロセスである。前癌性および癌性細胞はアポトーシス誘導シグナルに対して抵抗性を持つ(51)。Allicin、ajoene、DAS、DADS、DATSおよびSAMCなどのニンニク由来の有機硫黄化合物は、様々な培養癌細胞株に添加するとアポトーシスを誘導することが見出されている[総説 (48,51)]。ニンニクの水抽出物、S-allylcysteineの経口投与は、口腔癌の動物モデルでアポトーシスを促進することが報告されている(52,53)。
抗菌活性
ニンニク抽出物は、抗菌剤及び抗真菌特性を有することが見出された(54,55)。Thiosulfinate類、特にAllicinは、ニンニクの抗菌活性において重要な役割を果たすと考えられている(55-57)。DATSやajoeneなどのAllicin由来の化合物もある程度の抗菌活性をin vitroで示すが、その抗菌性はAllicinよりもかなり弱い(1)。これまで、無作為化比較試験では、経口ニンニク調製物がヒトで有意な抗菌活性を示すという確定的な証拠は得られていない(58-60)が、Allicinの豊富なニンニク製剤(生または加熱調理したニンニク)を使用した臨床試験は行われていない。小規模無作為比較試験では、1日2回の1%ajoeneクリームの皮膚への塗布が、足白癬(水虫)治療において、1%テルビナフィン(ラミシール)クリームと同等のの効果があることがわかった(61)。
病気の予防
心臓血管疾患
ニンニクとそれによる心血管疾患予防の可能性への関心は、地中海付近に住む人々の心血管疾患による死亡率が低いという観察から始まった(62)。ニンニクは地中海料理において一般的な食材であるが、 数多くの"地中海食"の特徴が、その心臓保護効果を説明するために提案されている。ニンニクの消費と心血管疾患リスクの関連を検討してきた疫学的研究の数は少ないが、心血管疾患の危険因子に対するニンニク補給効果に関する多数の介入試験で検討がされてきている。
血清脂質プロファイル
40以上の無作為化比較試験において、血清コレステロールレベルが正常もしくは高値のヒトの血清脂質プロファイルに対する多様なニンニク製剤の摂取による効果が検討された(63)。これらの試験の多くには方法論的な限界があったものの、いくつかのメタ分析の結果では、ニンニクの摂取により血清総コレステロール、LDLコレステロール、トリグリセリドにおいて若干(6から11パーセント)の減少がプラセボに対して認められた(63-65)。今日における最も網羅的なメタ分析では、摂取開始から3ヶ月後における血清コレステロールレベルのわずかな減少は、6ヶ月後にはもはや統計的に有意な差でないことが明らかになった(63)。最近のいくつかの臨床試験では、プラセボと比較した場合ニンニク製剤の使用は、血清脂質プロファイルにおいて臨床的または統計的に有意に改善される結果になることが明らかにされていない(66-74)。最新の大規模試験では、生ニンニクと高いアリシンの生物学的利用能を有するニンニクサプリメントがそれぞれ高用量で用いられた。しかしどちらの製剤も中程度の高コレステロール血症者において6ヶ月後の血清脂質に有意な効果はなかった(74)。従って、LDLコレステロールが非常に高値のヒトを除いて、ニンニクの摂取は血清脂質に対してほとんど影響を及ぼさないものと強く思われる。
血小板凝集
血小板凝集は、冠動脈または大脳動脈を閉塞する血栓(凝血塊)形成の第一段階の一つであり、それぞれ、心筋梗塞(心臓発作)または虚血性脳梗塞を引き起こす。ほとんどの無作為比較試験によって、ニンニクの投与により、ex vivo (生体外)での血小板凝集が有意に減少することが分かってきた。5件の試験のうち4件において、脱水ニンニクまたはニンニク油浸漬物を投与すると、プラセボ投与に比べて血小板の自然凝集が減少することが分かった(文献(63)にレビューされている)。さらに最近、2件の独立した試験において、熟成ニンニク抽出物の投与は、生理学的な活性化因子に起因する血小板凝集をex vivoで阻害した(11,75)。
血圧
多数の比較臨床試験からは、ニンニクの投与が正常あるいは高血圧の人々における収縮期あるいは拡張期の血圧を有意に低下させるという結果は得られていない(63,76)。システマティック・レビュー(63)に記載された23件の無作為化比較試験のうち3件のみにおいて、拡張期血圧の統計的に有意な低下が報告されており(77-79)、1件のみにおいて収縮期血圧の統計的に有意な低下が報告されている(77)。現時点では、ニンニクの投与を高血圧症の予防もしくは治療に用いることを支持する証拠は少ない。
ニンニクとアテローム性動脈硬化
ヒトのアテローム性動脈硬化の進行に及ぼすニンニクの投与効果を評価しようとした二つの研究が報告されている。一つはドイツで行われた研究で、900 mg/dayの脱水ニンニクの投与が頸動脈および大腿動脈におけるアテローム斑(動脈硬化性プラーク)の進行に及ぼす効果を超音波画像診断で評価したものである(80)。4年間の試験において、プラセボを投与した女性のプラークの増加はニンニク投与した女性のプラークよりも有意に大きかった。しかし、ニンニクまたは偽薬を投与した男性の場合有意差はなかった(81)。もう一つの小規模のパイロット研究では、研究者たちは電子ビーム断層撮影法を用いて冠動脈カルシウムを測定することで、HMG-CoAレダクターゼインヒビター(statins)を既に摂取している19名の大人のアテローム性動脈硬化の進行に及ぼす熟成ニンニク抽出物の投与効果を評価した(82)。1年間の試験において、プラセボを投与した場合に比べて熟成ニンニク抽出物を投与 (4 ml/day) した場合に冠動脈カルシウム値の増加が有意に低かった。冠動脈カルシウム値は冠動脈アテローム性動脈硬化の重症度と相関しているけれども、この技術による予測は依然として研究段階である(83)。いずれの研究もニンニクサプリメントを市販している企業により資金援助を受けて実施された。
要約:心臓血管疾患
要約すると、無作為化比較試験の結果は、3か月のニンニクの投与により血小板凝集が阻害され、血清の脂質プロファイルが穏やかながら改善されることを示唆している。ニンニクの投与によってアテローム性動脈硬化を弱めたり、心筋梗塞や脳卒中といった心臓血管の症状を防止したりできるかどうかは依然不明である。
癌
胃癌
胃癌による死亡率の低い中国のある地域では、男性の82%および女性の74%が1週間に3度以上ニンニクを摂取していることが報告されている。一方、中国でも胃癌による死亡率の高い地域では、1週間に3度以上ニンニクを摂取している男性および女性はわずか1%に過ぎなかった(84)。ヨーロッパとアジアで行われた4つの症例対照研究の内3つにおいて、胃癌と診断された人々の過去におけるニンニクの消費が、癌でない対照群に比べて有意に低かったことが示された(85-87)。症例対照研究の結果を統合評価したメタ解析の結果、ニンニクの摂取量が最高の人々の胃癌になるリスクは、ニンニク摂取量の低い人々よりも約50%低いことが示された(88)。一方、オランダで行われた前向きコホート研究の結果からは、ニンニクサプリメントの利用と胃癌になるリスクとの間に相関性は見られなかった(89)。しかし、ある研究によれば、ヨーロッパで市販されている様々なニンニクサプリメントの硫黄化合物の含量は12倍以上異なっており、このことは注目すべきである(90)。さらに最近になって中国で行われたランダム化二重盲検プラセボ対照介入試験によると、熟成ニンニク抽出物と蒸気蒸留ニンニク油を7.3年間投与しても、胃の前癌病変の罹患率や胃癌の発生率を減少させなかった(60)。おそらくサプリメントとして消費される場合のニンニク化合物の量は、食品として消費される場合の量よりも低い。そのため、ニンニクの抗癌作用を見出すには、日常的にニンニク食品を消費することが必要かもしれない。
Helicobacter pylori感染と胃癌:細菌H. pyloriのいくつかの株の感染が、胃癌になるリスクを顕著に増加させる。実験室内の研究によって、ニンニク製剤および有機硫黄化合物がH. pyloriの増殖を阻害することが示されている。しかし、ニンニクあるいはニンニクサプリメントの多量摂取によりヒトにおけるH. pylori感染を防止あるいは除去する可能性についてはあまり証拠がない(91,92)。中国あるいはトルコにおける研究で、ニンニクの多量摂取量とH. pylori感染率の有意な低下には相関が認められなかった(93,94)。さらに、ニンニクの鱗片(95)、熟成ニンニク抽出物(59)、水蒸気蒸留ニンニク油(59,96)、ニンニク油漬け(97)、またはニンニク粉(98)を用いた臨床試験の結果からも、ニンニクの投与がヒトにおけるH. pyloriの感染を除去する効果は認められていない。
結腸直腸癌
4つの症例対照研究の内3つにおいて、結腸直腸癌と診断された人々のニンニクの摂取量が、癌でない対照群に比べて有意に低かったことが示された(99-101)。一方、3つの前向きコホート研究の結果からは、ニンニクの消費と結腸直腸癌になるリスクとの間に相関性は認められなかった(102-104)。しかし、これらのコホートにおけるニンニクの消費は概して低く、1つの研究においてはニンニクサプリメントを用いて評価したものであった(102)。これらの症例対照研究ならびに前向きコホート研究の結果を用いたメタ解析の結果、ニンニクの摂取量が最も高い人々の結腸直腸癌になるリスクは、ニンニク摂取量の最も低い人々よりも約30%低いことが示された(88)。同様に、イタリアおよびスイスで行われた症例対照研究のデータを解析したところ、ニンニクの摂取量が最も高い人々のリスクは、摂取量が最も低い人々よりも約26%低いことが示された(105)。結腸直腸腺腫(ポリープ)は前癌病変である。大人に対してS状結腸鏡検査を行った1つの症例対照研究によると、結腸直腸腺腫の人々は、結腸直腸腺腫がない人々に比べて有意にニンニクの摂取量が少ないことがわかった(106)。37名の結腸直腸腺腫の患者における小規模の予備的介入試験において、熟成ニンニク抽出物の12か月間の投与が腺腫のサイズや再発に影響するか否かが調べられた。高用量の投与患者(2.4 ml/day)は少量を投与した患者(0.16 ml/day)に比べて、腺腫の数およびサイズ共に有意に減少した(107,108)。ニンニクまたはニンニク抽出物が実質的に腺腫の再発を減少させるかどうかを決定するには、より大規模なランダム化比較試験が必要である。
要約:癌
ヒトを母集団とした疫学研究の結果は、ニンニクおよび他のAllium属の野菜の高摂取によって胃癌および結腸直腸癌を防止する助けとなりうることを示唆しているが、ニンニクの高摂取がヒトの各種の癌のリスクを低減できる証拠は限定的で一貫性が得られていない(88,109)。ニンニクおよび有機硫黄化合物は、動物モデルにおいて化学的に誘導された口腔癌、食道癌、胃癌、大腸癌、子宮癌、乳癌、前立腺癌(110)、皮膚癌(51)の進行を阻止することが示されてきたが、ニンニク由来の有機硫黄化合物がヒトの癌の進行を防いだり遅らせたりするかどうかは分からない。
供給源
食品による供給
ニンニク、タマネギを含むAllium属の野菜は、ヒトの食事における有機硫黄化合物の最も豊富な供給源である(109)。今日まで、有機硫黄化合物の健康に及ぼす効果に関する主な科学的研究は、ニンニク由来の化合物に焦点が当てられてきた。生のニンニクの鱗片には2-6 mg/gのγ-glutamyl-S-allylcysteine (新鮮重量の0.2-0.6%)および6-14 mg/gのアリイン (新鮮重量の0.6-14%)が含まれる。ニンニクの鱗片を破砕すると新鮮重量 1 g当たり2,500-4,500 mcg (= μg)のアリシンが得られる。新鮮なニンニクの鱗片1片の重さは2-4 gである(1)。
調理の効果
酵素アリイナーゼは加熱により失活させることができる。ある研究では、皮を剥かず破砕していないニンニクを電子レンジで加熱調理することで完全にアリイナーゼの活性が消失した(111)。あるin vitroの研究によると、オーブンで長時間(6 分間あるいはそれ以上)加熱あるいは煮ることで、破砕していないあるいは破砕したニンニクの血小板凝集に対する阻害効果が抑制されが、破砕したニンニクは破砕していないニンニクに比べて高い抗凝集活性を維持していた(112)。生ニンニクをラットに投与したところ、化学発癌物質によって誘導されたDNA損傷の量が有意に低減したが、破砕していないニンニクの鱗片を投与に先立ち電子レンジで60秒間、もしくは対流式オーブンで45 分間加熱したところ、ニンニクによるその保護作用が失われた(113)。ニンニクのDNA損傷に対する防御作用は、電子レンジでの60秒間の加熱の前に破砕し10 分間静置した場合、あるいは対流式オーブンの加熱の前に、ニンニクの鱗片の上部を切除し10 分間静置した場合には部分的に残存した。アリイナーゼが触媒する反応に由来する有機硫黄化合物がニンニクの生物学的効果に何らかの役割を果たしていると考えられるので、何人かの科学者達は、破砕あるいは刻んだニンニクを加熱調理する前に最低10 分間「静置」することを推奨している(111)。
サプリメント
いくつかの異なるタイプのニンニク製品が市販されており、製造工程によってそれぞれタイプが異なる組成の有機硫黄化合物が含まれる (下表を参照)。全てのニンニク製品が規格化されているわけではなく、規格化されているブランドにおいても、それらが含んでいる有機硫黄化合物の量と生物学的利用能に関しては変動する可能性がある(1)。
粉末(脱水)ニンニク
粉末あるいは脱水ニンニクは、通常、スライスされ低温で乾燥させることでアリイナーゼの失活を防止したニンニクの鱗片から作られている(114)。この乾燥ニンニクは微粉砕され、しばしば錠剤にもされている。合衆国薬局方(USP)の規格に適合するために、粉末ニンニクサプリメントは、0.1%以上のγ-glutamyl-S-allylcysteineおよび0.3%以上のアリイン(いずれも乾燥重量)を含まなければならない(115)。粉末ニンニクサプリメントは実際にはアリシンを含んでいないが、製造業者はそのサプリメントの「アリシンポテンシャル」あるいは「アリシン産生量」をラベルに表示してもよい。これらの値はサプリメントから得られるアリシンの最大値を示している(116)。これは粉末ニンニクを水に溶解させ室温で30 分後のアリシン含量を測定することで決定される(115)。アリイナーゼは胃の酸性pHにより不活性化されるので、ほとんどの粉末ニンニクの錠剤は腸溶性錠剤となっており、腸の中性pHに到達する前に溶解するのを防いでいる。薬剤の遊離を評価するUSP法を用いて、胃および腸を模した条件下で腸溶性錠剤からの“アリシンの遊離”を測定するのがより適切であると議論されている(115)。この方法によるアリシンの遊離は真の生物学的利用能と類似することが示されている(116)。ほとんどの錠剤ブランドにおいて、これらの条件ではわずかのアリシンしか産生されないことが分かっている。これは主に低いアリイナーゼ活性と長期の粉末化時間によるものである(116,117)。多くの製造業者は彼らの粉末ニンニクサプリメントの「アリシンポテンシャル」についての情報を提供しているが、「アリシンの遊離」についての情報を提供している製造業者は少ない。いくつもの対照臨床試験によって、粉末あるいは脱水ニンニクサプリメントが心血管リスク因子に及ぼす効果が調べられている(上述の心血管疾患を参照)。最も一般的に使用される投与量は600-900 mg/dayの間であり、これに含まれるアリシンの潜在量は3,600-5,400 mcg/day (= μg/day)である(63)。
ニンニク抽出液(熟成ニンニク抽出物TM)
ニンニクの鱗片をエタノールの水溶液中で最大20か月間インキュベートすると、アリシンは主に硫化アリル化合物に変換され、これらは蒸発して消失するか他の化合物に変換される(114)。こうして得られた抽出物には主にSAC、SAMCなどの水溶性有機硫黄化合物が含まれる(118)。熟成ニンニク抽出物を含むニンニク抽出液はそのS-allylcysteine含量で規格化されている。対照臨床試験において、熟成ニンニク抽出物を2.4-7.2 g/day投与することで、ex vivo (生体外)での血小板凝集が短期的に減少することが示され(11)、血清コレステロールのレベルを最長12週間、減少することも示された(119)。
水蒸気蒸留ニンニク油
粉砕ニンニク鱗片を水蒸気蒸留すると、DATS、DADSそしてDASを含む硫化アリル化合物を主成分とする製品が得られる(114)。これらの脂溶性の水蒸気蒸留製品は通常植物油に溶解されている。
ニンニク油漬け
粉砕ニンニク鱗片を油に漬け込み室温でインキュベートすると、DADSおよびDATS(1)などの硫化アリル化合物に加えて、アリシンからビニルジチイン類(vinyldithiins)およびアホエン(ajoene)が生成される。エーテル抽出を行うとニンニク油漬けと同様の組成の成分が得られるが、より高濃度である(76)。
安全性
悪影響
ニンニクおよびニンニクサプリメントを摂取した場合の最も一般的な悪影響は、息と体の悪臭である(63,120)。また、胸やけ、腹痛、吐き気、嘔吐、腹部膨満、下痢などの胃腸の症状も報告されている(121)。ニンニクの経口投与による最も深刻な悪影響は、出血が止まらなくなることである。ニンニクの投与に伴う、手術後あるいは突然の出血の例がいくつか医学書に報告されている(122-125)。仕事でニンニクの粉や粉末に曝される人々のなかで、喘息患者を含む一部の人々においてアレルギー反応を引き起こす例がある(126)。肌へのニンニクの暴露により接触性皮膚炎を引き起こす例がいくつか報告されている(120,127)。6時間以上のニンニクの局所暴露により、水膨れや炎症を含むさらに深刻な皮膚の病変もおこることが報告されている。
妊娠と授乳
食事によりニンニクを摂取した際の妊娠に及ぼす悪影響の結果については報告されていない。妊娠第3期のイランの女性が脱水ニンニク錠剤(800 mg/day)を2か月間服用したが妊娠に悪影響は見られなかった(128)。けれども、妊娠におけるニンニクサプリメントの安全性は確立してはいない。ニンニクの摂取により、母乳の臭いおよびおそらくフレーバーに変化が起こる証拠がいくつかある。1例の対照交差試験では、1.5 gのニンニク抽出物を経口摂取した授乳女性の母乳の臭いが強く感じられることが示された(129)。母親がニンニク抽出物を摂取した後では、プラセボを摂取した場合に比べて乳児の授乳に要する時間が長くなったが、母乳の消費量と授乳の回数に有意差はなかった。また、妊娠または授乳期間におけるニンニクの局所的使用が安全かどうかは分かっていない。
薬物相互作用
抗凝血薬
ニンニクはワルファリンwarfarin (クマディンCoumadin)の抗凝血作用を増加させる可能性がある。ワルファリン投与量や他の習慣を変えないで、ニンニク錠剤またはニンニク油の摂取を開始した患者においてプロトロンビン時間(INR)が延長されたという報告が2例ある(130)。しかし、最近の研究によると、ワルファリン治療を受けている厳密に監視された患者では、出血の危険性はニンニク抽出液(熟成ニンニク抽出物)では増加しなかった(131)。ニンニクサプリメントは血小板の凝集を阻害することが分かっているため(63)、多量の魚油やビタミンEなど血小板凝集を阻害する他の薬剤やサプリメントと一緒にニンニクサプリメントを摂取すると、何らかの付加的影響が生じる可能性が考えられる。ニンニクサプリメントが抗凝血治療を行っている人々に安全かどうかを決定するためにさらなる研究が必要である。
HIVプロテアーゼ阻害剤
健常ボランティアにニンニクのカプセル型錠剤(カプレット)を1日2回(アリシン産生量:7,200 mcg/day(= μg/day))3週間投与した結果、プロテアーゼ阻害剤サキナビルsaquinavir (Fortovase)の生物学的利用能が50%減少した(133)。サキナビルはCYP3A4 (肝チトクロームP450 3A4)により代謝されるが、2週間のニンニク抽出物の摂取により健常ボランティアのCYP3A4活性は有意に変化しなかった(134)。ニンニク抽出物の投与(10 mg/day)を4日間続けても、プロテアーゼ阻害剤、リトナビルritonavir (Norvir)の一回投与における薬物動態を有意に変化させなかった。しかし、よく知られたニンニクサプリメントとリトナビルの間の定常状態での相互作用を明らかにするためにさらなる研究が必要である(135)。
Authors and Reviewers
Originally written in 2005 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in July 2008 by:
Victoria J. Drake, Ph.D.
Linus Pauling Institute
Oregon State University
Reviewed in July 2008 by:
Larry D. Lawson, Ph.D.
Research Director, Silliker, Inc.
Orem, Utah
Copyright 2005-2024 Linus Pauling Institute
References
1. Lawson LD. Garlic: a review of its medicinal effects and indicated active compounds. In: Lawson LD, Bauer R, eds. Phytomedicines of Europe: Chemistry and Biological Activity. Washington, D. C.: American Chemical Society; 1998:177-209.
2. Block E. The chemistry of garlic and onions. Sci Am. 1985;252(3):114-119. (PubMed)
3. Blumenthal M. Herb Sales Down 7.4 Percent in Mainstream Market. HerbalGram: American Botanical Council; 2005:63.
4. Tapiero H, Townsend DM, Tew KD. Organosulfur compounds from alliaceae in the prevention of human pathologies. Biomed Pharmacother. 2004;58(3):183-193. (PubMed)
5. Lawson LD, Wang ZJ. Allicin and allicin-derived garlic compounds increase breath acetone through allyl methyl sulfide: use in measuring allicin bioavailability. J Agric Food Chem. 2005;53(6):1974-1983. (PubMed)
6. Germain E, Auger J, Ginies C, Siess MH, Teyssier C. In vivo metabolism of diallyl disulphide in the rat: identification of two new metabolites. Xenobiotica. 2002;32(12):1127-1138. (PubMed)
7. Lachmann G, Lorenz D, Radeck W, Steiper M. [The pharmacokinetics of the S35 labeled labeled garlic constituents alliin, allicin and vinyldithiine]. Arzneimittelforschung. 1994;44(6):734-743. (PubMed)
8. de Rooij BM, Boogaard PJ, Rijksen DA, Commandeur JN, Vermeulen NP. Urinary excretion of N-acetyl-S-allyl-L-cysteine upon garlic consumption by human volunteers. Arch Toxicol. 1996;70(10):635-639. (PubMed)
9. Jandke J, Spiteller G. Unusual conjugates in biological profiles originating from consumption of onions and garlic. J Chromatogr. 1987;421(1):1-8. (PubMed)
10. Kodera Y, Suzuki A, Imada O, et al. Physical, chemical, and biological properties of s-allylcysteine, an amino acid derived from garlic. J Agric Food Chem. 2002;50(3):622-632. (PubMed)
11. Steiner M, Li W. Aged garlic extract, a modulator of cardiovascular risk factors: a dose-finding study on the effects of AGE on platelet functions. J Nutr. 2001;131(3s):980S-984S. (PubMed)
12. Gebhardt R, Beck H. Differential inhibitory effects of garlic-derived organosulfur compounds on cholesterol biosynthesis in primary rat hepatocyte cultures. Lipids. 1996;31(12):1269-1276. (PubMed)
13. Ferri N, Yokoyama K, Sadilek M, et al. Ajoene, a garlic compound, inhibits protein prenylation and arterial smooth muscle cell proliferation. Br J Pharmacol. 2003;138(5):811-818. (PubMed)
14. Liu L, Yeh YY. S-alk(en)yl cysteines of garlic inhibit cholesterol synthesis by deactivating HMG-CoA reductase in cultured rat hepatocytes. J Nutr. 2002;132(6):1129-1134. (PubMed)
15. Singh DK, Porter TD. Inhibition of sterol 4alpha-methyl oxidase is the principal mechanism by which garlic decreases cholesterol synthesis. J Nutr. 2006;136(3 Suppl):759S-764S. (PubMed)
16. Chan KC, Hsu CC, Yin MC. Protective effect of three diallyl sulphides against glucose-induced erythrocyte and platelet oxidation, and ADP-induced platelet aggregation. Thromb Res. 2002;108(5-6):317-322. (PubMed)
17. Lawson LD, Ransom DK, Hughes BG. Inhibition of whole blood platelet-aggregation by compounds in garlic clove extracts and commercial garlic products. Thromb Res. 1992;65(2):141-156. (PubMed)
18. Blake GJ, Ridker PM. C-reactive protein and other inflammatory risk markers in acute coronary syndromes. J Am Coll Cardiol. 2003;41(4 Suppl S):37S-42S. (PubMed)
19. Ali M, Thomson M, Afzal M. Garlic and onions: their effect on eicosanoid metabolism and its clinical relevance. Prostaglandins Leukot Essent Fatty Acids. 2000;62(2):55-73. (PubMed)
20. Dirsch VM, Kiemer AK, Wagner H, Vollmar AM. Effect of allicin and ajoene, two compounds of garlic, on inducible nitric oxide synthase. Atherosclerosis. 1998;139(2):333-339. (PubMed)
21. Kim KM, Chun SB, Koo MS, et al. Differential regulation of NO availability from macrophages and endothelial cells by the garlic component S-allyl cysteine. Free Radic Biol Med. 2001;30(7):747-756. (PubMed)
22. Chang HP, Huang SY, Chen YH. Modulation of cytokine secretion by garlic oil derivatives is associated with suppressed nitric oxide production in stimulated macrophages. J Agric Food Chem. 2005;53(7):2530-2534. (PubMed)
23. Keiss HP, Dirsch VM, Hartung T, et al. Garlic (Allium sativum L.) modulates cytokine expression in lipopolysaccharide-activated human blood thereby inhibiting NF-kappaB activity. J Nutr. 2003;133(7):2171-2175. (PubMed)
24. Hedin U, Roy J, Tran PK. Control of smooth muscle cell proliferation in vascular disease. Curr Opin Lipidol. 2004;15(5):559-565. (PubMed)
25. Campbell JH, Efendy JL, Smith NJ, Campbell GR. Molecular basis by which garlic suppresses atherosclerosis. J Nutr. 2001;131(3s):1006S-1009S. (PubMed)
26. Golovchenko I, Yang CH, Goalstone ML, Draznin B. Garlic extract methylallyl thiosulfinate blocks insulin potentiation of platelet-derived growth factor-stimulated migration of vascular smooth muscle cells. Metabolism. 2003;52(2):254-259. (PubMed)
27. Banerjee SK, Mukherjee PK, Maulik SK. Garlic as an antioxidant: the good, the bad and the ugly. Phytother Res. 2003;17(2):97-106. (PubMed)
28. Dhawan V, Jain S. Effect of garlic supplementation on oxidized low density lipoproteins and lipid peroxidation in patients of essential hypertension. Mol Cell Biochem. 2004;266(1-2):109-115. (PubMed)
29. Pryor WA, Houk KN, Foote CS, et al. Free radical biology and medicine: it's a gas, man! Am J Physiol Regul Integr Comp Physiol. 2006;291(3):R491-511. (PubMed)
30. Lefer DJ. A new gaseous signaling molecule emerges: cardioprotective role of hydrogen sulfide. Proc Natl Acad Sci U S A. 2007;104(46):17907-17908. (PubMed)
31. Benavides GA, Squadrito GL, Mills RW, et al. Hydrogen sulfide mediates the vasoactivity of garlic. Proc Natl Acad Sci U S A. 2007;104(46):17977-17982. (PubMed)
32. Suarez F, Springfield J, Furne J, Levitt M. Differentiation of mouth versus gut as site of origin of odoriferous breath gases after garlic ingestion. Am J Physiol. 1999;276(2 Pt 1):G425-430. (PubMed)
33. Yang CS, Chhabra SK, Hong JY, Smith TJ. Mechanisms of inhibition of chemical toxicity and carcinogenesis by diallyl sulfide (DAS) and related compounds from garlic. J Nutr. 2001;131(3s):1041S-1045S. (PubMed)
34. Brady JF, Ishizaki H, Fukuto JM, et al. Inhibition of cytochrome P-450 2E1 by diallyl sulfide and its metabolites. Chem Res Toxicol. 1991;4(6):642-647. (PubMed)
35. Jeong HG, Lee YW. Protective effects of diallyl sulfide on N-nitrosodimethylamine-induced immunosuppression in mice. Cancer Lett. 1998;134(1):73-79. (PubMed)
36. Park KA, Kweon S, Choi H. Anticarcinogenic effect and modification of cytochrome P450 2E1 by dietary garlic powder in diethylnitrosamine-initiated rat hepatocarcinogenesis. J Biochem Mol Biol. 2002;35(6):615-622. (PubMed)
37. Gurley BJ, Gardner SF, Hubbard MA, et al. Cytochrome P450 phenotypic ratios for predicting herb-drug interactions in humans. Clin Pharmacol Ther. 2002;72(3):276-287. (PubMed)
38. Loizou GD, Cocker J. The effects of alcohol and diallyl sulphide on CYP2E1 activity in humans: a phenotyping study using chlorzoxazone. Hum Exp Toxicol. 2001;20(7):321-327. (PubMed)
39. Munday R, Munday CM. Induction of phase II enzymes by aliphatic sulfides derived from garlic and onions: an overview. Methods Enzymol. 2004;382:449-456. (PubMed)
40. Andorfer JH, Tchaikovskaya T, Listowsky I. Selective expression of glutathione S-transferase genes in the murine gastrointestinal tract in response to dietary organosulfur compounds. Carcinogenesis. 2004;25(3):359-367. (PubMed)
41. Hatono S, Jimenez A, Wargovich MJ. Chemopreventive effect of S-allylcysteine and its relationship to the detoxification enzyme glutathione S-transferase. Carcinogenesis. 1996;17(5):1041-1044. (PubMed)
42. Munday R, Munday CM. Relative activities of organosulfur compounds derived from onions and garlic in increasing tissue activities of quinone reductase and glutathione transferase in rat tissues. Nutr Cancer. 2001;40(2):205-210. (PubMed)
43. Chen C, Pung D, Leong V, et al. Induction of detoxifying enzymes by garlic organosulfur compounds through transcription factor Nrf2: effect of chemical structure and stress signals. Free Radic Biol Med. 2004;37(10):1578-1590. (PubMed)
44. Fisher CD, Augustine LM, Maher JM, et al. Induction of drug-metabolizing enzymes by garlic and allyl sulfide compounds via activation of constitutive androstane receptor and nuclear factor E2-related factor 2. Drug Metab Dispos. 2007;35(6):995-1000. (PubMed)
45. Munday R, Munday CM. Low doses of diallyl disulfide, a compound derived from garlic, increase tissue activities of quinone reductase and glutathione transferase in the gastrointestinal tract of the rat. Nutr Cancer. 1999;34(1):42-48. (PubMed)
46. Kweon S, Park KA, Choi H. Chemopreventive effect of garlic powder diet in diethylnitrosamine-induced rat hepatocarcinogenesis. Life Sci. 2003;73(19):2515-2526. (PubMed)
47. Stewart ZA, Westfall MD, Pietenpol JA. Cell-cycle dysregulation and anticancer therapy. Trends Pharmacol Sci. 2003;24(3):139-145. (PubMed)
48. Herman-Antosiewicz A, Singh SV. Signal transduction pathways leading to cell cycle arrest and apoptosis induction in cancer cells by Allium vegetable-derived organosulfur compounds: a review. Mutat Res. 2004;555(1-2):121-131. (PubMed)
49. Knowles LM, Milner JA. Possible mechanism by which allyl sulfides suppress neoplastic cell proliferation. J Nutr. 2001;131(3s):1061S-1066S. (PubMed)
50. Arunkumar A, Vijayababu MR, Srinivasan N, Aruldhas MM, Arunakaran J. Garlic compound, diallyl disulfide induces cell cycle arrest in prostate cancer cell line PC-3. Mol Cell Biochem. 2006;288(1-2):107-113. (PubMed)
51. Wu X, Kassie F, Mersch-Sundermann V. Induction of apoptosis in tumor cells by naturally occurring sulfur-containing compounds. Mutat Res. 2005;589(2):81-102. (PubMed)
52. Balasenthil S, Rao KS, Nagini S. Apoptosis induction by S-allylcysteine, a garlic constituent, during 7,12-dimethylbenz[a]anthracene-induced hamster buccal pouch carcinogenesis. Cell Biochem Funct. 2002;20(3):263-268. (PubMed)
53. Balasenthil S, Rao KS, Nagini S. Garlic induces apoptosis during 7,12-dimethylbenz[a]anthracene-induced hamster buccal pouch carcinogenesis. Oral Oncol. 2002;38(5):431-436. (PubMed)
54. Fenwick GR, Hanley AB. The genus Allium--Part 3. Crit Rev Food Sci Nutr. 1985;23(1):1-73. (PubMed)
55. Harris JC, Cottrell SL, Plummer S, Lloyd D. Antimicrobial properties of Allium sativum (garlic). Appl Microbiol Biotechnol. 2001;57(3):282-286. (PubMed)
56. Ankri S, Mirelman D. Antimicrobial properties of allicin from garlic. Microbes Infect. 1999;1(2):125-129. (PubMed)
57. Cavallito CJ, Bailey JH. Allicin, the antibacterial principle of Allium sativum. I. Isolation, physical properties and antibacterial action. J Am Chem Soc. 1944;66(11):1950-1951.
58. Martin KW, Ernst E. Herbal medicines for treatment of bacterial infections: a review of controlled clinical trials. J Antimicrob Chemother. 2003;51(2):241-246. (PubMed)
59. Gail MH, Pfeiffer RM, Brown LM, et al. Garlic, vitamin, and antibiotic treatment for Helicobacter pylori: a randomized factorial controlled trial. Helicobacter. 2007;12(5):575-578. (PubMed)
60. You WC, Brown LM, Zhang L, et al. Randomized double-blind factorial trial of three treatments to reduce the prevalence of precancerous gastric lesions. J Natl Cancer Inst. 2006;98(14):974-983. (PubMed)
61. Ledezma E, Marcano K, Jorquera A, et al. Efficacy of ajoene in the treatment of tinea pedis: a double-blind and comparative study with terbinafine. J Am Acad Dermatol. 2000;43(5 Pt 1):829-832. (PubMed)
62. Keys A. Wine, garlic, and CHD in seven countries. Lancet. 1980;1(8160):145-146. (PubMed)
63. Ackermann RT, Mulrow CD, Ramirez G, Gardner CD, Morbidoni L, Lawrence VA. Garlic shows promise for improving some cardiovascular risk factors. Arch Intern Med. 2001;161(6):813-824. (PubMed)
64. Alder R, Lookinland S, Berry JA, Williams M. A systematic review of the effectiveness of garlic as an anti-hyperlipidemic agent. J Am Acad Nurse Pract. 2003;15(3):120-129. (PubMed)
65. Stevinson C, Pittler MH, Ernst E. Garlic for treating hypercholesterolemia. A meta-analysis of randomized clinical trials. Ann Intern Med. 2000;133(6):420-429. (PubMed)
66. Berthold HK, Sudhop T, von Bergmann K. Effect of a garlic oil preparation on serum lipoproteins and cholesterol metabolism: a randomized controlled trial. JAMA. 1998;279(23):1900-1902. (PubMed)
67. Gardner CD, Chatterjee LM, Carlson JJ. The effect of a garlic preparation on plasma lipid levels in moderately hypercholesterolemic adults. Atherosclerosis. 2001;154(1):213-220. (PubMed)
68. Kannar D, Wattanapenpaiboon N, Savige GS, Wahlqvist ML. Hypocholesterolemic effect of an enteric-coated garlic supplement. J Am Coll Nutr. 2001;20(3):225-231. (PubMed)
69. McCrindle BW, Helden E, Conner WT. Garlic extract therapy in children with hypercholesterolemia. Arch Pediatr Adolesc Med. 1998;152(11):1089-1094. (PubMed)
70. Neil HA, Silagy CA, Lancaster T, et al. Garlic powder in the treatment of moderate hyperlipidaemia: a controlled trial and meta-analysis. J R Coll Physicians Lond. 1996;30(4):329-334. (PubMed)
71. Turner B, Molgaard C, Marckmann P. Effect of garlic (Allium sativum) powder tablets on serum lipids, blood pressure and arterial stiffness in normo-lipidaemic volunteers: a randomised, double-blind, placebo-controlled trial. Br J Nutr. 2004;92(4):701-706. (PubMed)
72. Zhang L, Gail MH, Wang YQ, et al. A randomized factorial study of the effects of long-term garlic and micronutrient supplementation and of 2-wk antibiotic treatment for Helicobacter pylori infection on serum cholesterol and lipoproteins. Am J Clin Nutr. 2006;84(4):912-919. (PubMed)
73. van Doorn MB, Espirito Santo SM, Meijer P, et al. Effect of garlic powder on C-reactive protein and plasma lipids in overweight and smoking subjects. Am J Clin Nutr. 2006;84(6):1324-1329. (PubMed)
74. Gardner CD, Lawson LD, Block E, et al. Effect of raw garlic vs commercial garlic supplements on plasma lipid concentrations in adults with moderate hypercholesterolemia: a randomized clinical trial. Arch Intern Med. 2007;167(4):346-353. (PubMed)
75. Rahman K, Billington D. Dietary supplementation with aged garlic extract inhibits ADP-induced platelet aggregation in humans. J Nutr. 2000;130(11):2662-2665. (PubMed)
76. Brace LD. Cardiovascular benefits of garlic (Allium sativum L). J Cardiovasc Nurs. 2002;16(4):33-49. (PubMed)
77. Adler AJ, Holub BJ. Effect of garlic and fish-oil supplementation on serum lipid and lipoprotein concentrations in hypercholesterolemic men. Am J Clin Nutr. 1997;65(2):445-450. (PubMed)
78. Auer W, Eiber A, Hertkorn E, et al. Hypertension and hyperlipidaemia: garlic helps in mild cases. Br J Clin Pract Suppl. 1990;69:3-6. (PubMed)
79. Vorberg G, Schneider B. Therapy with garlic: results of a placebo-controlled, double-blind study. Br J Clin Pract Suppl. 1990;69:7-11. (PubMed)
80. Koscielny J, Klussendorf D, Latza R, et al. The antiatherosclerotic effect of Allium sativum. Atherosclerosis. 1999;144(1):237-249. (PubMed)
81. Siegel G, Klussendorf D. The anti-atheroslerotic effect of Allium sativum: statistics re-evaluated. Atherosclerosis. 2000;150(2):437-438. (PubMed)
82. Budoff MJ, Takasu J, Flores FR, et al. Inhibiting progression of coronary calcification using Aged Garlic Extract in patients receiving statin therapy: a preliminary study. Prev Med. 2004;39(5):985-991. (PubMed)
83. Vliegenthart R. Non-invasive assessment of coronary calcification. Eur J Epidemiol. 2004;19(12):1063-1072. (PubMed)
84. Takezaki T, Gao CM, Ding JH, Liu TK, Li MS, Tajima K. Comparative study of lifestyles of residents in high and low risk areas for gastric cancer in Jiangsu Province, China; with special reference to allium vegetables. J Epidemiol. 1999;9(5):297-305. (PubMed)
85. Buiatti E, Palli D, Decarli A, et al. A case-control study of gastric cancer and diet in Italy. Int J Cancer. 1989;44(4):611-616. (PubMed)
86. Kim HJ, Chang WK, Kim MK, Lee SS, Choi BY. Dietary factors and gastric cancer in Korea: a case-control study. Int J Cancer. 2002;97(4):531-535. (PubMed)
87. You WC, Blot WJ, Chang YS, et al. Allium vegetables and reduced risk of stomach cancer. J Natl Cancer Inst. 1989;81(2):162-164. (PubMed)
88. Fleischauer AT, Poole C, Arab L. Garlic consumption and cancer prevention: meta-analyses of colorectal and stomach cancers. Am J Clin Nutr. 2000;72(4):1047-1052. (PubMed)
89. Dorant E, van den Brandt PA, Goldbohm RA, Sturmans F. Consumption of onions and a reduced risk of stomach carcinoma. Gastroenterology. 1996;110(1):12-20. (PubMed)
90. Lawson LD, Wang ZJ, Hughes BG. Identification and HPLC quantitation of the sulfides and dialk(en)yl thiosulfinates in commercial garlic products. Planta Med. 1991;57(4):363-370. (PubMed)
91. Canizares P, Gracia I, Gomez LA, et al. Allyl-thiosulfinates, the bacteriostatic compounds of garlic against Helicobacter pylori. Biotechnol Prog. 2004;20(1):397-401. (PubMed)
92. O'Gara EA, Hill DJ, Maslin DJ. Activities of garlic oil, garlic powder, and their diallyl constituents against Helicobacter pylori. Appl Environ Microbiol. 2000;66(5):2269-2273. (PubMed)
93. Salih BA, Abasiyanik FM. Does regular garlic intake affect the prevalence of Helicobacter pylori in asymptomatic subjects? Saudi Med J. 2003;24(8):842-845. (PubMed)
94. You WC, Zhang L, Gail MH, et al. Helicobacter pylori infection, garlic intake and precancerous lesions in a Chinese population at low risk of gastric cancer. Int J Epidemiol. 1998;27(6):941-944. (PubMed)
95. Graham DY, Anderson SY, Lang T. Garlic or jalapeno peppers for treatment of Helicobacter pylori infection. Am J Gastroenterol. 1999;94(5):1200-1202. (PubMed)
96. McNulty CA, Wilson MP, Havinga W, Johnston B, O'Gara EA, Maslin DJ. A pilot study to determine the effectiveness of garlic oil capsules in the treatment of dyspeptic patients with Helicobacter pylori. Helicobacter. 2001;6(3):249-253. (PubMed)
97. Aydin A, Ersoz G, Tekesin O, Akcicek E, Tuncyurek M. Garlic oil and Helicobacter pylori infection. Am J Gastroenterol. 2000;95(2):563-564. (PubMed)
98. Ernst E. Is garlic an effective treatment for Helicobacter pylori infection? Arch Intern Med. 1999;159(20):2484-2485. (PubMed)
99. Hu JF, Liu YY, Yu YK, Zhao TZ, Liu SD, Wang QQ. Diet and cancer of the colon and rectum: a case-control study in China. Int J Epidemiol. 1991;20(2):362-367. (PubMed)
100. Iscovich JM, L'Abbe KA, Castelleto R, et al. Colon cancer in Argentina. I: Risk from intake of dietary items. Int J Cancer. 1992;51(6):851-857. (PubMed)
101. Levi F, Pasche C, La Vecchia C, Lucchini F, Franceschi S. Food groups and colorectal cancer risk. Br J Cancer. 1999;79(7-8):1283-1287. (PubMed)
102. Dorant E, van den Brandt PA, Goldbohm RA. A prospective cohort study on the relationship between onion and leek consumption, garlic supplement use and the risk of colorectal carcinoma in The Netherlands. Carcinogenesis. 1996;17(3):477-484. (PubMed)
103. Giovannucci E, Rimm EB, Stampfer MJ, Colditz GA, Ascherio A, Willett WC. Intake of fat, meat, and fiber in relation to risk of colon cancer in men. Cancer Res. 1994;54(9):2390-2397. (PubMed)
104. Steinmetz KA, Kushi LH, Bostick RM, Folsom AR, Potter JD. Vegetables, fruit, and colon cancer in the Iowa Women's Health Study. Am J Epidemiol. 1994;139(1):1-15. (PubMed)
105. Galeone C, Pelucchi C, Levi F, et al. Onion and garlic use and human cancer. Am J Clin Nutr. 2006;84(5):1027-1032. (PubMed)
106. Witte JS, Longnecker MP, Bird CL, Lee ER, Frankl HD, Haile RW. Relation of vegetable, fruit, and grain consumption to colorectal adenomatous polyps. Am J Epidemiol. 1996;144(11):1015-1025. (PubMed)
107. Tanaka S, Haruma K, Kunihiro M, et al. Effects of aged garlic extract (AGE) on colorectal adenomas: a double-blinded study. Hiroshima J Med Sci. 2004;53(3-4):39-45. (PubMed)
108. Tanaka S, Haruma K, Yoshihara M, et al. Aged garlic extract has potential suppressive effect on colorectal adenomas in humans. J Nutr. 2006;136(3 Suppl):821S-826S. (PubMed)
109. Bianchini F, Vainio H. Allium vegetables and organosulfur compounds: do they help prevent cancer? Environ Health Perspect. 2001;109(9):893-902. (PubMed)
110. Arunkumar A, Vijayababu MR, Venkataraman P, Senthilkumar K, Arunakaran J. Chemoprevention of rat prostate carcinogenesis by diallyl disulfide, an organosulfur compound of garlic. Biol Pharm Bull. 2006;29(2):375-379. (PubMed)
111. Song K, Milner JA. The influence of heating on the anticancer properties of garlic. J Nutr. 2001;131(3s):1054S-1057S. (PubMed)
112. Cavagnaro PF, Camargo A, Galmarini CR, Simon PW. Effect of cooking on garlic (Allium sativum L.) antiplatelet activity and thiosulfinates content. J Agric Food Chem. 2007;55(4):1280-1288. (PubMed)
113. Song K, Milner JA. Heating garlic inhibits its ability to suppress 7, 12-dimethylbenz(a)anthracene-induced DNA adduct formation in rat mammary tissue. J Nutr. 1999;129(3):657-661. (PubMed)
114. Staba EJ, Lash L, Staba JE. A commentary on the effects of garlic extraction and formulation on product composition. J Nutr. 2001;131(3s):1118S-1119S. (PubMed)
115. Dietary Supplements: Garlic. The United States Pharmacopeia. Vol 28. Rockville, MD: United States Pharmacopeial Convention, Inc.; 2005:2087-2092.
116. Lawson LD, Wang ZJ. Low allicin release from garlic supplements: a major problem due to the sensitivities of alliinase activity. J Agric Food Chem. 2001;49(5):2592-2599. (PubMed)
117. Lawson LD, Wang ZJ, Papadimitriou D. Allicin release under simulated gastrointestinal conditions from garlic powder tablets employed in clinical trials on serum cholesterol. Planta Med. 2001;67(1):13-18. (PubMed)
118. Amagase H, Petesch BL, Matsuura H, Kasuga S, Itakura Y. Intake of garlic and its bioactive components. J Nutr. 2001;131(3s):955S-962S. (PubMed)
119. Steiner M, Khan AH, Holbert D, Lin RI. A double-blind crossover study in moderately hypercholesterolemic men that compared the effect of aged garlic extract and placebo administration on blood lipids. Am J Clin Nutr. 1996;64(6):866-870. (PubMed)
120. Borrelli F, Capasso R, Izzo AA. Garlic (Allium sativum L.): adverse effects and drug interactions in humans. Mol Nutr Food Res. 2007;51(11):1386-1397. (PubMed)
121. Mulrow C, Lawrence V, Ackermann R, et al. Garlic: effects on cardiovascular risks and disease, protective effects against cancer, and clinical adverse effects: summary. Agency for Healthcare Research and Quality [Evidence Report/Technology Assessment No. 20]. October, 2000. Available at: http://www.ncbi.nlm.nih.gov/books/NBK11910/. Accessed 3/4/15.
122. Burnham BE. Garlic as a possible risk for postoperative bleeding. Plast Reconstr Surg. 1995;95(1):213. (PubMed)
123. Carden SM, Good WV, Carden PA, Good RM. Garlic and the strabismus surgeon. Clin Experiment Ophthalmol. 2002;30(4):303-304. (PubMed)
124. German K, Kumar U, Blackford HN. Garlic and the risk of TURP bleeding. Br J Urol. 1995;76(4):518. (PubMed)
125. Rose KD, Croissant PD, Parliament CF, Levin MB. Spontaneous spinal epidural hematoma with associated platelet dysfunction from excessive garlic ingestion: a case report. Neurosurgery. 1990;26(5):880-882. (PubMed)
126. Anibarro B, Fontela JL, De La Hoz F. Occupational asthma induced by garlic dust. J Allergy Clin Immunol. 1997;100(6 Pt 1):734-738. (PubMed)
127. Jappe U, Bonnekoh B, Hausen BM, Gollnick H. Garlic-related dermatoses: case report and review of the literature. Am J Contact Dermat. 1999;10(1):37-39. (PubMed)
128. Ziaei S, Hantoshzadeh S, Rezasoltani P, Lamyian M. The effect of garlic tablet on plasma lipids and platelet aggregation in nulliparous pregnants at high risk of preeclampsia. Eur J Obstet Gynecol Reprod Biol. 2001;99(2):201-206. (PubMed)
129. Mennella JA, Beauchamp GK. Maternal diet alters the sensory qualities of human milk and the nursling's behavior. Pediatrics. 1991;88(4):737-744. (PubMed)
130. Sunter WH. Warfarin and garlic. Pharm J. 1991;246:722.
131. Macan H, Uykimpang R, Alconcel M, et al. Aged garlic extract may be safe for patients on warfarin therapy. J Nutr. 2006;136(3 Suppl):793S-795S. (PubMed)
132. Izzo AA, Ernst E. Interactions between herbal medicines and prescribed drugs: a systematic review. Drugs. 2001;61(15):2163-2175. (PubMed)
133. Piscitelli SC, Burstein AH, Welden N, Gallicano KD, Falloon J. The effect of garlic supplements on the pharmacokinetics of saquinavir. Clin Infect Dis. 2002;34(2):234-238. (PubMed)
134. Markowitz JS, Devane CL, Chavin KD, Taylor RM, Ruan Y, Donovan JL. Effects of garlic (Allium sativum L.) supplementation on cytochrome P450 2D6 and 3A4 activity in healthy volunteers. Clin Pharmacol Ther. 2003;74(2):170-177. (PubMed)
135. Gallicano K, Foster B, Choudhri S. Effect of short-term administration of garlic supplements on single-dose ritonavir pharmacokinetics in healthy volunteers. Br J Clin Pharmacol. 2003;55(2):199-202. (PubMed)
全粒穀物
目次
要旨
- 穀物はイネ科に属する特定の草の食用種子であり、小麦、米、トウモロコシ、大麦、えん麦、ライ麦、ライ小麦、キビ、ブルグル、およびモロコシがこれに含まれる。キヌア(キノア)、アマランサス、およびソバは、本来の穀物と栄養的に似た擬似穀物である。(詳細はこちら)
- 全粒穀物は、そのままの穀物の種や、割ったり、潰したり、細かくした穀物の種である。その中には、そのままの穀粒に入っているのと同じ相対的割合で穀粒のすべての成分、つまり糠、胚乳、および胚芽が含まれている。(詳細はこちら)
- 精白(製粉)過程で失われる糠と胚芽は、ミネラル、ビタミン、植物性化学物質、および食物性繊維が豊富であり、全粒穀物の摂取に伴う健康効果に重要な役割を果たす。(詳細はこちら)
- 全粒穀物食品は何からできているか、ということに関して意見の一致はない。全粒穀物に関するFDAの健康強調表示に見合う製品は、重量で少なくとも51%の全粒穀物原材料を含んでいる。(詳細はこちら)
- 観察研究では、全粒穀物の豊富な食事は精白した穀物の多い食事よりも、2型糖尿病や心臓血管疾患のリスクが低いという関連が認められた。(詳細はこちら)
- 全粒穀物のがんに対する防護効果は心臓血管疾患や2型糖尿病ほどよくわかっていないが、いくつかの前向きコホート研究では、全粒穀物の摂取が食道がんや結直腸がんのリスク減少と関連があった。(詳細はこちら)
- 大規模前向きコホート研究で、全粒穀物の摂取は全死因および心臓血管疾患、がん、2型糖尿病、呼吸器疾患、および感染症を含むいくつかの病状による死因と逆相関があった。(詳細はこちら)
- 全粒穀物と食物繊維の豊富な食事は健康な個人の便秘を防ぎ、結腸の壁に曩(憩室)ができることを防ぐのに役立っている可能性がある。最近の前向きコホート研究で、食物性繊維、特に穀物や果物の穀物繊維の高摂取が憩室性疾患の有意なリスク低下と関連があった。(詳細はこちら)
- 2015-2020年版の米国人のための食事ガイドライン(指針)は、毎日全粒穀物製品を最低でも3サービング分(約90g)摂取することを勧めている。(詳細はこちら)
序説
穀物とは、イネ科(禾本科などとも呼ばれる)に属する植物の種である。食用の穀物の例として、小麦、米、トウモロコシ、大麦、えん麦、ライ麦、ライ小麦(小麦とライ麦の交配種)、キビ、ブルグル、およびモロコシなどがある(1)。イネ科ではないが、全粒穀物性の原材料にはキヌア、アマランサス、およびソバのような擬似穀物も含まれる。全粒穀物は外層に糠があり、炭水化物の豊富な胚乳と呼ばれる中間層と、内側の胚芽の層がある(図1参照)。全粒穀物食品は、穀粒をそのまま、あるいは割ったり潰したり粉状にしたりして種全体を含み、そのままの穀粒と同じ割合で糠、胚乳、胚芽が保持されている(1)。全粒穀物はビタミン、ミネラル、食物繊維、およびリグナンや植物ステロールなどの植物性化学物質を含む潜在的に有益な化合物が豊富である(2)。これらの化合物のほとんどは穀物の糠や胚芽に存在し、ともに精白(製粉)過程で失われて、でんぷん質の胚乳部分だけが残る(1)。精白した穀物の多い食事に比べて、全粒穀物の豊富な食事はいくつかの慢性疾患のリスク減少と関連がある。全粒穀物の健康効果は、それに含まれる個々の栄養素や植物性化学物質の有益性によって全部説明できるわけではない。全粒穀物は健康を増進し疾病を予防する、エネルギーと微量栄養素、および植物性化学物質の独特な集合体である(3)。
疾病予防
全粒穀物食品が何からできているかを定義する世界的に認められた定義がないため、全粒穀物の摂取が健康や疾患の結果を表すマーカーに与える影響を調べた研究を比較することは難しい。米国食品医薬品局(FDA)は、重量で51%以上の全粒穀物原材料を含む食品、または1回分の量である1オンス(約30g)につき8g以上の全粒穀物を含む食品に対して、全粒穀物の健康強調表示を認めた(4)。国際的な多領域にわたる専門家集団は、1オンスあたり8g以上の全粒穀物含有量のある食品を「全粒穀物」と表示するように最近提唱した(5)。しかしながら、現在までのところ全粒穀物食品を摂取することの健康効果を調べたほとんどの疫学的研究は、重量で25%以上の全粒穀物を含み、且つ糠を添加した食品を対象としている(6)。
2型糖尿病
385,868人の参加者による8つの大規模前向きコホート研究の最近のメタ解析で、総穀物および全粒穀物の高摂取は、低摂取に比べて2型糖尿病発症リスクの有意の低減と関連があることがわかった(7)。一方で、258,078人の被験者による6つの前向き研究のメタ解析では、精白した穀物の摂取と糖尿病との間には何の関係もなかった(7)。特に、毎日3サービング数の全粒穀物食品を摂ることは、糖尿病リスクの32%の低下と関連があった(下記の「全粒穀物の1サービングの例」の項参照)。さらなる解析で、全粒穀物を単独の食品(たとえば玄米や小麦ふすまなど)として、あるいは食品の原材料(たとえば全粒穀物のパンや全粒穀物のシリアルなど)として高摂取すると、低摂取の場合に比べて糖尿病リスクが大きく減ることがわかったが、白米や小麦胚乳などの精白した穀物ではそうではなかった(7)。また、米国での医療従事者追跡調査(HPFS)と2つの看護師健康調査(NHS I, NHS II)という3つの大規模前向きコホート研究の統合解析で、白米の摂取が最も多い上位5分の1(週に5サービング数以上)の参加者は、最も少ない下位5分の1(月に1サービング未満)の者に比べて2型糖尿病リスクが17%高く、玄米の摂取では週に2サービング数以上の者は月に1サービング未満の者に比べて11%リスクが低かった(8)。興味深いことに、50g/日(2/3サービング/日)の玄米またはその他の全粒穀物を同量の白米に置き換えると、糖尿病リスクの16%以上の低下が予想された(8)。
全粒穀物とブドウ糖制御
全粒穀物は、食後血糖を改善することで2型糖尿病リスクを減らすと仮定されてきた。食事の直後は血糖と脂質濃度が上昇し、膵臓からのインスリンの分泌が組織でのブドウ糖および脂質の貯蔵を促進する。食後の高血糖や高脂質が長引くことは、酸化ストレス、炎症、インスリン耐性、および内皮機能障害と関連し、そのすべてが2型糖尿病のような慢性疾患の発症に寄与する(9)。糠や胚芽を除去してしまう精白プロセスは、炭水化物の豊富な胚乳の消化を促進する。そのように精白した穀物由来の炭水化物は、全粒穀物に比べて血糖をより高く、またより速く上昇させ、インスリン需要を高める(10)。しかしながら、精白した穀物由来の食品に比べて、全粒穀物製品は血糖を上昇させる能力、つまり血糖指数(GI)が必ずしも低いわけではない(11)。GIの概念は、消化、吸収、および代謝されやすい炭水化物を含む食品はGIが高く(GI値が70以上)、食後の血糖反応が低下するゆっくり消化される炭水化物を含む食品はGIが低い(GI値が55以下)という考えに基づく(「血糖指数および血糖負荷」の項の記事参照)(12)。全粒穀物を含もうと含むまいと、パン、シリアル、米、および菓子製品はGIが高いものも低いものもある(11)ので、全粒穀物の含有量よりは食品のタイプが食後の血糖濃度に影響することが示唆される。
いくつかの観察研究では、全粒穀物の摂取が多いと、健康な個人ではインスリン抵抗が低くなり(13)、インスリン感受性が高くなる(14)という関連があった。11人の体重過多または肥満の成人による対照交差試験で、全粒穀物の豊富な食事を6週間摂取したら、精白した穀物の多い食事よりもインスリン抵抗に関するいくつかの臨床測定値が下がった(15)。しかしながら、メタボリック症候群の61人の成人による最近の無作為化対照試験で、いくつかの全粒穀物シリアル製品の食事を12週間しても、精白した穀物の食事に比べて、空腹時の血漿中のブドウ糖、インスリン、脂質の濃度、またはインスリン抵抗には何の影響もなかった。それでも、食後の血漿インスリンおよびトリグリセリド(中性脂肪)は、全粒穀物中心の食事では大きく下がったが、食後血糖値はそうではなかった(16)。食後のインスリン応答が下がったのは、組織のインスリン感受性が上がったことと関連しているのかもしれない(3)。20人の健康なボランティアによる別の介入試験では、標準的な朝食に全粒大麦パンを3日間摂取したら、精白した小麦のパンの同じ食事に比べて食後のインスリンの最高値が下がった。全粒大麦パンの摂取は、消化管に関わるホルモン(たとえばペプチドYYやグルカゴン様ペプチド)の血中濃度の上昇や、消化管での発酵活性の活発化とも関連があった。このことから、消化におけるホルモン制御の改善と、結腸における難消化性デンプン(難消化性食物繊維)の発酵の改善(17)が示唆され、おそらくそれが満腹感を起こさせ(18)、インスリン感受性を増大させた(19)のであろう。
全粒穀物の摂取は、食後の高血糖を和らげるというよりも、むしろインスリン感受性を良くしているのかもしれない。しかしながら、全粒穀物の摂取がどのように2型糖尿病の予防に役立つのかをより良く知るためには、よく考えられた、大規模な無作為化対照試験が必要である。
心(臓)血管疾患
1998-2010年に出版された10の大規模前向きコホート研究のメタ解析で、全粒穀物の摂取が最も多い(毎日、約3サービング)の場合は、全粒穀物の摂取が最低の場合に比べて、いくつかの心血管疾患(CVD)リスク要因に対して補正をした後での冠動脈性心疾患(CHD)、虚血性心疾患、心不全、および虚血性脳卒中を含むCVDリスクの21%の低下と関連があることがわかった(20)。さらに、エビデンスは今のところ限られているものの、全粒穀物の摂取は心血管疾患のリスク要因である高血圧のリスク低下と関連がある可能性がある(21,22)。
精白した穀物に比べて、全粒穀物は心血管疾患のリスク低下と関連する栄養素が豊富である。42,850人の男性による米国の医療従事者追跡調査(HPFS)で、全粒穀物の摂取が最も多い上位5分の1の者(49.6g/日)は、最少の下位5分の1の者(3.3g/日)に比べて、年齢、性別、およびCHDリスク要因について補正した後のCHDリスクの16%の低下と関連があった(23)。食物繊維、葉酸塩、マグネシウム、マンガン、ビタミンB6およびビタミンEのような全粒穀物に含まれる栄養素に対してさらに補正すると、統計的に意味が無いくらいの関連しかなかった。このことは、微量元素と食物繊維の含有量が全粒穀物摂取による心血管系への良効果を説明できることを示唆している。全粒穀物の高摂取および精白した穀物の低摂取に伴う心血管保護効果には、血中脂質プロファイルの向上や無症状の炎症を示すマーカー値の減少も含まれる。
全粒穀物と心血管代謝のマーカー
21の無作為化対照試験のメタ解析で、全粒穀物を4-16週間摂取するようにしたら、個人の空腹時ブドウ糖、インスリン、総コレステロールおよびLDLコレステロールの血中濃度が改善され、拡張期血圧(最低血圧)および収縮期血圧(最大高血圧)の低下が示された(20)。これと同様に、1988-2015年に出版された23の無作為化対照試験の最近更新されたメタ解析では、全粒穀物(28g/日-213g/日を2-16週間)、特に全粒えん麦入りのシリアルやその他の製品を2週間ほど摂取すると、精白した穀物の対照群の食事に比べて、中性脂肪、総コレステロールおよびLDLコレステロールの血中濃度が有意に低下したことが示された(24)。全粒穀物ミックスの製品(パン、ミューズリー、そのまま食べられるシリアル、パスタ、米、チップス、マフィン、クッキー)の介入試験でも、血中HDLコレステロールの濃度が改善した(24)。さらに、小麦の食物繊維が血清コレステロール濃度を下げるとは示されなかったが、多くの臨床研究で、えん麦の食物繊維や大麦の水溶性食物繊維の摂取を増やすと、総コレステロールおよびLDLコレステロール濃度が控えめに減少することが示された(25-27)。そのような発見に照らし合わせて、米国食品医薬品局(FDA)は全粒穀物とCHDリスク低減に関して、えん麦(オートブラン、オートミール、全粒えん麦粉)または全粒大麦の水溶性食物繊維であるβグルカンを少なくとも3g/日摂取できる低飽和脂肪および低コレステロールの食事に健康強調表示を認めた(28)。全粒穀物は、コレステロールの腸での吸収を妨げることで血清コレステロールを下げる化合物である植物性ステロール類の供給源でもある(2)。
全粒穀物と炎症マーカー
観察研究からのエビデンスで、全粒穀物の摂取と心血管疾患および代謝疾患を特徴づける軽度の慢性炎症との逆相関が示唆された(29)。しかしながら、介入試験の結果はまちまちである。全粒穀物をあまり摂取しない健康な消費者による最近の交差試験で、全粒穀物ミックスの摂取を6週間増加させた場合(平均で168g/日)の効果と、全粒穀物を16g/日未満摂取する場合とで比較を行った。全粒穀物の摂取を増加させても、血液中の免疫細胞(白血球、リンパ球、ナチュラルキラー細胞)の絶対数、これらの細胞の生体外での食作用活性、または血液中の炎症のマーカー(IL-10、TNF-α、C反応性タンパク質(CRP))などに何の効果もなかった(30)。健康な正常体重、体重過多、および肥満の被験者を対象に以前に行われた無作為化対照試験も、全粒穀物の摂取が炎症マーカーにもたらす効果を示すことはできなかった(31-35)。80人の体重過多または肥満の被験者による8週間の食事介入試験で、彼らの習慣的な食事に含まれていた精白穀物製品を全粒小麦製品に代えたら、精白小麦の摂取に比べて、炎症誘発性サイトカインTNF-αの大幅な減少、抗炎症性IL-10の一時的増加、およびCRPの無変化という結果になった(36)。別の無作為化交差介入試験では、体重過多/肥満の子供(8-15歳)に全粒穀物製品のリストを渡して、6週間の間、毎日穀物の半分を全粒穀物食品で摂取するようにする(全粒穀物群)か、これらの食品摂取をまったくしない(対照群)ように頼んだ。毎日平均98gの全粒穀物製品摂取(対照群は11g/日)で、CRP、sICAM-1(水溶性細胞間接着分子1)、急性期タンパク質SAA(血清アミロイドA)、およびレプチンの血清濃度が下がった(37)。低カロリー食をしているメタボリック症候群の肥満の成人に全粒穀物摂取を毎日約5サービング分増加させると(1サービング未満の場合に比べて)、CRPの血中濃度が下がったが、IL-10とTNF-αの濃度には何の影響もなかった(38)。研究によって結果が一貫しないのは、参加者の健康状態、介入期間、および/または選択された全粒穀物のタイプによるものであるかもしれない。特に、血糖指標(GI)の低い食品が心血管代謝および炎症のマーカー値を下げることができる(39)としたら、GIの高い全粒穀物で精白穀物の製品を代替することは、心臓疾患リスクに関して何の有益性も示さないかもしれない。
がん
様々なタイプのがんに対する全粒穀物の防護効果は、2型糖尿病や心血管疾患に対する効果に比べて確立されていないが、多くの症例対照研究で全粒穀物の摂取とがんリスクとの逆相関が見られている(40-42)。20種類の異なるがんを調べた40例の症例対照研究の初期のメタ解析で、全粒穀物の摂取が多い者は少ない者に比べて、がん全体のリスクが34%低いことがわかった(40)。全粒穀物の高摂取は、口腔、咽喉、食道、胃、結腸、および直腸のがんを含む消化管がんのリスク低減と最も一貫した関連が認められた。61,000人以上のスウェーデン人女性を15年間追跡した前向きコホート研究で、毎日4.5サービング以上の全粒穀物を摂取していた者は、毎日1.5サービング以下しか摂取しなかった者に比べて結腸がんのリスクが35%低いことがわかった(43)。米国国立衛生研究所(NIH)による291,988人の男性と197,623人の女性を対象とした全米退職者協会(AARP)の食事と健康に関する大規模な前向き研究で、上記のスウェーデンのコホート研究よりもずっと少ない平均全粒穀物摂取でも、結直腸がん、特に直腸がんのリスクとの逆相関が認められた(44)。特に、全粒穀物摂取が最上位の5分の1の者(2.6サービング/日)は、最下位の5分の1の者(0.4サービング/日)に比べて、直腸がん発症リスクの36%の低下と関連が認められた(44)。多機関が参加した欧州におけるがんと栄養に関する前向き研究(EPIC)の参加者を含むコホート内症例対照研究で、全粒小麦および全粒ライ麦の摂取の代用マーカーである血漿アルキルレゾルシノール濃度が高い上位4分の1の者は、それが低い下位4分の1の者に比べて、遠位結腸がん発症の52%の低下と関連することがわかった。直腸がん、結腸がん、および近位結腸がんの発症、または結直腸がん全体の発症との相関は報告されなかった(45)。腸がんに対して全粒穀物が防護的であるということを、すべてのコホート研究が示唆しているわけではない(46、47)。しかしながら、6つのコホート研究の結果に基づく用量反応解析で、毎日3サービング分(90g)の全粒穀物の摂取増加による17%の結直腸がんリスクの低下がわかった(48)。注目すべきは、EPIC研究の一部であり110,000人超の参加者がいるスカンジナビアでの3つのコホート研究を最近解析したところ、全粒穀物総摂取と食道がんリスクとの逆相関が示されたことだ。全粒小麦摂取が10g増えるごとに、食道がんリスクの50%低下と関連することがわかった。そのような関連は、全粒ライ麦や全粒えん麦では見られなかった(49)。
精白穀物製品と対照的に、全粒穀物は、がん、特に消化管のがんに対して防護的な可能性のある多くの化合物が豊富である(50)。全粒穀物は食物繊維の主な摂取源であり、食物繊維の摂取が多いと結腸の便通を速くして、潜在的に発がん性のある化合物が結腸の内面に並ぶ細胞と接触する時間を減らすと考えられている(51)。食物性の繊維は、食物繊維が結腸の微生物叢によって発酵する時に発生する短鎖脂肪酸を介して化学保護的効果も働かせる可能性がある(52)。全粒穀物は、フェノール酸、リグナン、フィトエストロゲン(植物エストロゲン)、フラボノイド、およびビタミンEなどの化合物を含み、それががんの発症を促進するシグナル伝達経路を変更したり、消化管で潜在的に有害な遊離金属イオンと結合したりするのかもしれない(53、54)。
死亡率
最近の大規模前向きコホート研究で、全粒穀物の摂取と全死因および死因ごとの死亡リスクとの関係が調べられた。367,442人の年配の成人を対象にしたNIHによるAARPの食事と健康に関する研究で、全粒穀物摂取が多い(約36g/日相当)と、少ない(約3.9g/日相当)場合に比べて、全死因の死亡リスクが17%低いという関連があった(55)。全粒穀物の高摂取は、心血管疾患(17%減)、がん(15%減)、2型糖尿病(48%減)、呼吸器疾患(11%減)、および感染症(23%減)による死亡リスクの低下とかなり関連があった。これらの関連は、穀類の食物繊維摂取について補正した後では大きく減っていたため、死亡に対する全粒穀物の防護効果において、食物繊維が主要な役割を果たしていることを示唆している(55)。74,341人の女性を対象にした看護師健康調査(NHS)と43,744人の男性を対象にした医療従事者追跡調査(HPFS)という米国の2つの前向きコホート研究の最近の解析で、全粒穀物摂取が最多の上位5分の1の者は、最少の下位5分の1の者より全死因の死亡リスクが9%低いと報告された(56)。全粒穀物の高摂取は心血管疾患に関する死亡リスクが15%低いという関連もあったが、がん関連の死亡との相関は見つからなかった。さらに、全粒穀物摂取と死亡率との関連は、110,000人超の参加者によるスカンジナビアHELGAコホート研究でも調べられた(57)。このコホート研究で、全粒穀物製品の摂取を倍増すること、または特定の全粒小麦、全粒ライ麦、または全粒えん麦の製品の摂取を倍増することが、全死因および死因別死亡リスクの減少と関連があった。
米国および北欧でのコホート研究のこれらの結果は、早期の死亡の予防に全粒穀物摂取が果たす役割を一貫して示唆している。
腸の健康
全粒穀物および食物繊維の豊富な食事は、便を軟化してかさを増やしたり、結腸での通過を早めたりして、便秘の症状を予防または改善したりする可能性がある(58,59)。そのような食事は、結腸での小さな曩(憩室)の形成が特徴的な憩室症という症状のリスク低下とも関連がある。憩室症のあるほとんどの人は何の症状もないが、約10-25%が憩室炎という痛みや炎症になる可能性がある(58)。先進国で小麦粉の製粉が始まる前には憩室炎は実質的になく、食物繊維の少ない食事が憩室性疾患の発症に果たす役割はよく理解されている(60)。もし食物繊維の多い食事が憩室性疾患リスクを減少させる(61,62)なら、食物繊維の摂取源(たとえば穀類、果物、野菜など)が重要なのかもしれない。興味深いことに、穀類からの食物繊維の摂取を5g増やすと、英国で690,075人の女性(平均年齢60歳)を6年間追跡したコホート研究で、憩室性疾患リスクが14%減り、果物と野菜の食物繊維摂取を5g増加させると、憩室性疾患リスクがそれぞれ15%と5%減った(62)。食物繊維の多い食事は、すでにできてしまった憩室を解消するというより、新しくできるのを防ぐために憩室症の患者に推奨されている(58)。憩室症の者は、食物繊維の多い食事をしない場合は特に、憩室に小さな種や殻が詰まって憩室炎になるのを防ぐためにそれらを食べないようにアドバイスされることがある(58)。しかしながら、種やポップコーンを食べることを避けることが憩室症の個人の憩室炎リスクを下げることを示す研究がないことに留意すべきである(60)。
体重の管理
前向きコホート研究は一貫して、全粒穀物摂取が肥満度指数(BMI)の低下、および体重増加や肥満のリスク低下と関連があると示唆してきた(6,20)。しかしながら、1988-2012年に出版された無作為化対照試験の最近のメタ解析で、全粒穀物の摂取(18.2g/日-150g/日を2-16週間)は、慢性的な健康上の症状がない2,060人の正常体重または体重過多/肥満の成人の体重(26研究)、体脂肪(7研究)、および腹囲(9研究)に何の大きな影響もないと報告された(63)。メタボリック症候群で体重過多/肥満の60人の個人による、最近の無作為化非盲検対照試験では、最初の6週間に体重維持食を摂り、その後6週間に低カロリー食を摂るという12週間の介入期間の間、全粒穀物の摂取(約6-12サービング/日)と、同量の精白穀物の摂取との比較を行った(64)。全粒穀物の摂取増加は、体重、BMI、体脂肪率、または腹囲に関しては、精白穀物の摂取でも見られた程度の減少以上にそれらを減らすことができなかった。注目すべきは、全粒穀物を摂取した個人は精白穀物を摂取した個人に比べて、空腹時血糖が改善を示したものの、その他の心血管代謝の変数は変化しなかったことである(64)。これらの結果は、精白した穀物に比べて全粒穀物が体脂肪率により良い影響をもたらすことを示すその他のエネルギー制限食事介入試験と対照的である(38,65)。全粒穀物摂取が体重調整に役立つか否かを明らかにするための、さらなる研究が必要である。
摂取推奨量
毎日3サービング分に近い全粒穀物の摂取は、全粒穀物摂取が比較的低い集団での慢性疾患リスクのかなりの低減に関連していた。米国保健福祉省および米国農務省が共同で発行している2015-2020年版の米国人のための食事ガイドラインでは、摂取する全穀物の少なくとも半分が全粒穀物であること、および精白穀物を全粒穀物に置き換えて全粒穀物の摂取を増やすことを推奨している(66)。2015-2020年版の米国人のための食事ガイドラインでの全粒穀物のサービング(分量)の計測単位は、オンス当量(oz-eq)である。全粒穀物の1サービング(分量)は、(1)すぐに食べられる100%全粒穀物の食品1オンス(約30g),(2)部分的に全粒穀物が入っている製品2オンス、または(3)16gの全粒穀物原材料を含む食品の量に相当する(67)。表1は、全粒穀物摂取に関する2015-2020年版の米国人のための食事ガイドラインのまとめである。
| ライフステージ | 年齢 | 1日の摂取量(オンス当量/日)*3 | 1日の摂取量(グラム/日)*4 |
|---|---|---|---|
| 幼児 | 2-3歳 | 1.5-2.5 | 24-40 |
| 子供 | 4-8歳 | 2-3 | 32-48 |
| 子供 | 9-13歳 | 2.5-4.5 | 40-72 |
| 青少年 | 14-18歳 | 3-5 | 48-80 |
| 成人 | 19歳以上 | 3-5 | 48-80 |
|
1食事ガイドラインは、食事摂取基準(DRI)の数値がない場合に適応される。 |
|||
2009-2010年にかけての米国国民健康栄養調査(NHANES)では、全粒穀物摂取の平均は子供や青少年で0.57オンス当量(約9g)/日で、成人では0.82オンス当量(約13g)/日であったと報告された(68)。約40%の米国人は全粒穀物をまったく摂取せず、子供や青少年の2.9%と成人の7.7%のみが3オンス当量(約48g)/日以上の全粒穀物を摂取している(68)。全粒穀物摂取を増やすことの潜在的健康効果に照らし合わせれば、全粒穀物食品を毎日3サービング分摂るというのは最低限の量であって、可能であればいつでも精白穀物の炭水化物を全粒穀物製品に代えるべきである。
全粒穀物1サービングの例
- 全粒穀物パン1切れ
- 全粒穀物のイングリッシュマフィン、ベーグル、またはバンズ(丸パン)1/2個
- そのまま食べられる全粒穀物のシリアル1オンス(約30g)分
- 調理したオートミール、玄米、または全粒小麦パスタ 1/2カップ(約120ml)
- 全粒穀物クラッカー5-6枚
- 直径15cmのトルティーヤ1枚
- 直径12.5cmのパンケーキ1枚
全粒穀物摂取を増加させる
全粒穀物食品を見つける
全粒穀物食品には、アマランサス、全粒大麦、玄米や古代米、ソバ(カーシャ)、キビ、えん麦、ポップコーン、キヌア、全粒ライ麦、ライ小麦、全粒小麦(小麦粒)に様々な種の小麦(普通小麦、エンマー小麦、スペルト小麦、およびコーラサン小麦)を混ぜたものを含むことがある(69)。残念ながら、製品ラベルを見てもその製品が全粒穀物または精白穀物から主に作られたのかどうかは常に明白ではない。全粒穀物食品を買う際に使える方法には、以下のようなものがある。
- 原材料の最初に全粒穀物が挙げられている製品を探す
- 全粒穀物食品は食物繊維がたいてい豊富なので、1サービンング当たり少なくとも2gの食物繊維を含む全粒穀物製品を探す。
- 次のような健康強調効果を表示している製品を探す。「全粒穀物食品およびその他の植物性食品が豊富で、総脂肪量、飽和脂肪量、およびコレステロールの少ない食事は、心疾患や特定のがんのリスク低下に役立つ可能性があります。」この健康強調効果を表示している製品は、重量で少なくとも51%、またはオンス当量あたり少なくとも8gの全粒穀物を含んでいなければならない(4)。
- 原材料の最初に全粒小麦粉が書かれている全粒小麦パスタを探す。大部分のパスタは精白したセモリナまたはデュラム小麦粉からできている。
- 「マルチグレイン(多穀)」、「石臼挽き」「100%小麦」「7種の穀物」「ひき割り小麦」または「糠」などの言葉を含むラベルのある食品は、通常100%全粒穀物の製品でないか、全粒穀物がまったく入っていないことすらあることを承知しておく(1)。
全粒穀物摂取を増やすための方法
- 小麦フレーク、シュレッデッド・フィート、ミューズリー(押し麦)、およびオートミールのような全粒穀物の朝食用シリアルを食べる。ブランシリアル(糠のシリアル)は実は全粒穀物シリアルではないが、食物繊維含有量が高いので、朝食に良い。
- 精白穀物のパン、ロールパン、トルティーヤ、およびクラッカーを全粒穀物でできたものに代える。
- 従来のパスタの代わりに、全粒小麦パスタや50%全粒小麦で50%精白小麦のパスタにする。
- 白米の代わりに玄米にする。
- 全粒大麦をスープやシチューに入れる。
- パンやケーキなどを作る際に、精白小麦または無漂白小麦を全粒小麦粉(100%全粒小麦粉、全粒白小麦粉、または全粒薄力粉)に代える。
全粒穀物の生理活性成分
全粒穀物は、多数の生物学的活性を持つ成分の摂取源である。そのいくつかを表2に示す。
| 主要栄養素 | ビタミン類 | ミネラル類 | 植物性化学物質 |
|---|---|---|---|
| 不飽和脂肪 | 葉酸塩 | マグネシウム | 食物繊維 |
| ビタミンE | カリウム | フラボノイド類 | |
| セレン | リグナン類 | ||
| 植物性ステロール類 |
Authors and Reviewers
Originally written in 2003 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in December 2005 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in May 2009 by:
Victoria J. Drake, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in January 2016 by:
Barbara Delage, Ph.D.
Linus Pauling Institute
Oregon State University
Reviewed in January 2016 by:
Simin Liu, M.D., M.S., M.P.H., Sc.D.
Professor of Epidemiology, Professor of Medicine
Brown University
Copyright 2003-2024 Linus Pauling Institute
References
1. US Department of Agriculture and US Department of Health and Human Services. Dietary Guidelines for Americans 2010; 2010.
2. Bartlomiej S, Justyna RK, Ewa N. Bioactive compounds in cereal grains - occurrence, structure, technological significance and nutritional benefits - a review. Food Sci Technol Int. 2012;18(6):559-568. (PubMed)
3. Seal CJ, Brownlee IA. Whole-grain foods and chronic disease: evidence from epidemiological and intervention studies. Proc Nutr Soc. 2015;74(3):313-319. (PubMed)
4. US Food and Drug Administration. Guidance for industry: a food labeling guide. Center for Food Safety and Applied Nutrition, Office of Food Labeling [Web page]. August 2015. http://www.fda.gov/Food/GuidanceRegulation/GuidanceDocumentsRegulatoryInformation/LabelingNutrition/ucm064919.htm. Accessed 11/25/15.
5. Ferruzzi MG, Jonnalagadda SS, Liu S, et al. Developing a standard definition of whole-grain foods for dietary recommendations: summary report of a multidisciplinary expert roundtable discussion. Adv Nutr. 2014;5(2):164-176. (PubMed)
6. Cho SS, Qi L, Fahey GC, Jr., Klurfeld DM. Consumption of cereal fiber, mixtures of whole grains and bran, and whole grains and risk reduction in type 2 diabetes, obesity, and cardiovascular disease. Am J Clin Nutr. 2013;98(2):594-619. (PubMed)
7. Aune D, Norat T, Romundstad P, Vatten LJ. Whole grain and refined grain consumption and the risk of type 2 diabetes: a systematic review and dose-response meta-analysis of cohort studies. Eur J Epidemiol. 2013;28(11):845-858. (PubMed)
8. Sun Q, Spiegelman D, van Dam RM, et al. White rice, brown rice, and risk of type 2 diabetes in US men and women. Arch Intern Med. 2010;170(11):961-969. (PubMed)
9. Blaak EE, Antoine JM, Benton D, et al. Impact of postprandial glycaemia on health and prevention of disease. Obes Rev. 2012;13(10):923-984. (PubMed)
10. Liu S. Intake of refined carbohydrates and whole grain foods in relation to risk of type 2 diabetes mellitus and coronary heart disease. J Am Coll Nutr. 2002;21(4):298-306. (PubMed)
11. Atkinson FS, Foster-Powell K, Brand-Miller JC. International tables of glycemic index and glycemic load values: 2008. Diabetes Care. 2008;31(12):2281-2283. (PubMed)
12. Augustin LS, Kendall CW, Jenkins DJ, et al. Glycemic index, glycemic load and glycemic response: An International Scientific Consensus Summit from the International Carbohydrate Quality Consortium (ICQC). Nutr Metab Cardiovasc Dis. 2015;25(9):795-815. (PubMed)
13. McKeown NM, Meigs JB, Liu S, Wilson PW, Jacques PF. Whole-grain intake is favorably associated with metabolic risk factors for type 2 diabetes and cardiovascular disease in the Framingham Offspring Study. Am J Clin Nutr. 2002;76(2):390-398. (PubMed)
14. Liese AD, Roach AK, Sparks KC, Marquart L, D'Agostino RB, Jr., Mayer-Davis EJ. Whole-grain intake and insulin sensitivity: the Insulin Resistance Atherosclerosis Study. Am J Clin Nutr. 2003;78(5):965-971. (PubMed)
15. Pereira MA, Jacobs DR, Jr., Pins JJ, et al. Effect of whole grains on insulin sensitivity in overweight hyperinsulinemic adults. Am J Clin Nutr. 2002;75(5):848-855. (PubMed)
16. Giacco R, Costabile G, Della Pepa G, et al. A whole-grain cereal-based diet lowers postprandial plasma insulin and triglyceride levels in individuals with metabolic syndrome. Nutr Metab Cardiovasc Dis. 2014;24(8):837-844. (PubMed)
17. Nilsson AC, Johansson-Boll EV, Bjorck IM. Increased gut hormones and insulin sensitivity index following a 3-d intervention with a barley kernel-based product: a randomised cross-over study in healthy middle-aged subjects. Br J Nutr. 2015;114(6):899-907. (PubMed)
18. Rosen LA, Ostman EM, Bjorck IM. Effects of cereal breakfasts on postprandial glucose, appetite regulation and voluntary energy intake at a subsequent standardized lunch; focusing on rye products. Nutr J. 2011;10:7. (PubMed)
19. Robertson MD, Bickerton AS, Dennis AL, Vidal H, Frayn KN. Insulin-sensitizing effects of dietary resistant starch and effects on skeletal muscle and adipose tissue metabolism. Am J Clin Nutr. 2005;82(3):559-567. (PubMed)
20. Ye EQ, Chacko SA, Chou EL, Kugizaki M, Liu S. Greater whole-grain intake is associated with lower risk of type 2 diabetes, cardiovascular disease, and weight gain. J Nutr. 2012;142(7):1304-1313. (PubMed)
21. Wang L, Gaziano JM, Liu S, Manson JE, Buring JE, Sesso HD. Whole- and refined-grain intakes and the risk of hypertension in women. Am J Clin Nutr. 2007;86(2):472-479. (PubMed)
22. Flint AJ, Hu FB, Glynn RJ, et al. Whole grains and incident hypertension in men. Am J Clin Nutr. 2009;90(3):493-498. (PubMed)
23. Jensen MK, Koh-Banerjee P, Hu FB, et al. Intakes of whole grains, bran, and germ and the risk of coronary heart disease in men. Am J Clin Nutr. 2004;80(6):1492-1499. (PubMed)
24. Hollaender PL, Ross AB, Kristensen M. Whole-grain and blood lipid changes in apparently healthy adults: a systematic review and meta-analysis of randomized controlled studies. Am J Clin Nutr. 2015;102(3):556-572. (PubMed)
25. Ames NP, Rhymer CR. Issues surrounding health claims for barley. J Nutr. 2008;138(6):1237S-1243S. (PubMed)
26. Behall KM, Scholfield DJ, Hallfrisch J. Diets containing barley significantly reduce lipids in mildly hypercholesterolemic men and women. Am J Clin Nutr. 2004;80(5):1185-1193. (PubMed)
27. Truswell AS. Cereal grains and coronary heart disease. Eur J Clin Nutr. 2002;56(1):1-14. (PubMed)
28. U.S. Food and Drug Administration. CFR - Code of Federal Regulations Title 21, Vol. 2. Part 101: food labeling. Subpart E: specific requirements for health claims.
29. Lefevre M, Jonnalagadda S. Effect of whole grains on markers of subclinical inflammation. Nutr Rev. 2012;70(7):387-396. (PubMed)
30. Ampatzoglou A, Williams CL, Atwal KK, et al. Effects of increased wholegrain consumption on immune and inflammatory markers in healthy low habitual wholegrain consumers. Eur J Nutr. 2015. Jan 25. [Epub ahead of print]. (PubMed)
31. Andersson A, Tengblad S, Karlstrom B, et al. Whole-grain foods do not affect insulin sensitivity or markers of lipid peroxidation and inflammation in healthy, moderately overweight subjects. J Nutr. 2007;137(6):1401-1407. (PubMed)
32. Brownlee IA, Moore C, Chatfield M, et al. Markers of cardiovascular risk are not changed by increased whole-grain intake: the WHOLEheart study, a randomised, controlled dietary intervention. Br J Nutr. 2010;104(1):125-134. (PubMed)
33. Giacco R, Clemente G, Cipriano D, et al. Effects of the regular consumption of wholemeal wheat foods on cardiovascular risk factors in healthy people. Nutr Metab Cardiovasc Dis. 2010;20(3):186-194. (PubMed)
34. Nelson K, Mathai ML, Ashton JF, et al. Effects of malted and non-malted whole-grain wheat on metabolic and inflammatory biomarkers in overweight/obese adults: A randomised crossover pilot study. Food Chem. 2016;194:495-502. (PubMed)
35. Tighe P, Duthie G, Vaughan N, et al. Effect of increased consumption of whole-grain foods on blood pressure and other cardiovascular risk markers in healthy middle-aged persons: a randomized controlled trial. Am J Clin Nutr. 2010;92(4):733-740. (PubMed)
36. Vitaglione P, Mennella I, Ferracane R, et al. Whole-grain wheat consumption reduces inflammation in a randomized controlled trial on overweight and obese subjects with unhealthy dietary and lifestyle behaviors: role of polyphenols bound to cereal dietary fiber. Am J Clin Nutr. 2015;101(2):251-261. (PubMed)
37. Hajihashemi P, Azadbakht L, Hashemipor M, Kelishadi R, Esmaillzadeh A. Whole-grain intake favorably affects markers of systemic inflammation in obese children: a randomized controlled crossover clinical trial. Mol Nutr Food Res. 2014;58(6):1301-1308. (PubMed)
38. Katcher HI, Legro RS, Kunselman AR, et al. The effects of a whole grain-enriched hypocaloric diet on cardiovascular disease risk factors in men and women with metabolic syndrome. Am J Clin Nutr. 2008;87(1):79-90. (PubMed)
39. Feliciano Pereira P, das Gracas de Almeida C, Alfenas Rde C. Glycemic index role on visceral obesity, subclinical inflammation and associated chronic diseases. Nutr Hosp. 2014;30(2):237-243. (PubMed)
40. Jacobs DR, Jr., Marquart L, Slavin J, Kushi LH. Whole-grain intake and cancer: an expanded review and meta-analysis. Nutr Cancer. 1998;30(2):85-96. (PubMed)
41. La Vecchia C, Chatenoud L, Negri E, Franceschi S. Session: Whole cereal grains, fibre and human cancer Wholegrain cereals and cancer in Italy. Proc Nutr Soc. 2003;62(1):45-49. (PubMed)
42. Chan JM, Wang F, Holly EA. Whole grains and risk of pancreatic cancer in a large population-based case-control study in the San Francisco Bay Area, California. Am J Epidemiol. 2007;166(10):1174-1185. (PubMed)
43. Larsson SC, Giovannucci E, Bergkvist L, Wolk A. Whole grain consumption and risk of colorectal cancer: a population-based cohort of 60,000 women. Br J Cancer. 2005;92(9):1803-1807. (PubMed)
44. Schatzkin A, Mouw T, Park Y, et al. Dietary fiber and whole-grain consumption in relation to colorectal cancer in the NIH-AARP Diet and Health Study. Am J Clin Nutr. 2007;85(5):1353-1360. (PubMed)
45. Kyro C, Olsen A, Landberg R, et al. Plasma alkylresorcinols, biomarkers of whole-grain wheat and rye intake, and incidence of colorectal cancer. J Natl Cancer Inst. 2014;106(1):djt352. (PubMed)
46. McCullough ML, Robertson AS, Chao A, et al. A prospective study of whole grains, fruits, vegetables and colon cancer risk. Cancer Causes Control. 2003;14(10):959-970. (PubMed)
47. Pietinen P, Malila N, Virtanen M, et al. Diet and risk of colorectal cancer in a cohort of Finnish men. Cancer Causes Control. 1999;10(5):387-396. (PubMed)
48. Aune D, Chan DS, Lau R, et al. Dietary fibre, whole grains, and risk of colorectal cancer: systematic review and dose-response meta-analysis of prospective studies. BMJ. 2011;343:d6617. (PubMed)
49. Skeie G, Braaten T, Olsen A, et al. Intake of whole grains and incidence of oesophageal cancer in the HELGA Cohort. Eur J Epidemiol. 2015. Jun 20. [Epub ahead of print]. (PubMed)
50. Slavin JL. Mechanisms for the impact of whole grain foods on cancer risk. J Am Coll Nutr. 2000;19(3 Suppl):300S-307S. (PubMed)
51. Lipkin M, Reddy B, Newmark H, Lamprecht SA. Dietary factors in human colorectal cancer. Annu Rev Nutr. 1999;19:545-586. (PubMed)
52. Scharlau D, Borowicki A, Habermann N, et al. Mechanisms of primary cancer prevention by butyrate and other products formed during gut flora-mediated fermentation of dietary fibre. Mutat Res. 2009;682(1):39-53. (PubMed)
53. Kuijsten A, Arts IC, Hollman PC, van't Veer P, Kampman E. Plasma enterolignans are associated with lower colorectal adenoma risk. Cancer Epidemiol Biomarkers Prev. 2006;15(6):1132-1136. (PubMed)
54. Van Hung P. Phenolic Compounds of Cereals and Their Antioxidant Capacity. Crit Rev Food Sci Nutr. 2016;56(1):25-35. (PubMed)
55. Huang T, Xu M, Lee A, Cho S, Qi L. Consumption of whole grains and cereal fiber and total and cause-specific mortality: prospective analysis of 367,442 individuals. BMC Med. 2015;13:59. (PubMed)
56. Wu H, Flint AJ, Qi Q, et al. Association between dietary whole grain intake and risk of mortality: two large prospective studies in US men and women. JAMA Intern Med. 2015;175(3):373-384. (PubMed)
57. Johnsen NF, Frederiksen K, Christensen J, et al. Whole-grain products and whole-grain types are associated with lower all-cause and cause-specific mortality in the Scandinavian HELGA cohort. Br J Nutr. 2015;114(4):608-623. (PubMed)
58. Slavin JL. Position of the American Dietetic Association: health implications of dietary fiber. J Am Diet Assoc. 2008;108(10):1716-1731. (PubMed)
59. Woo HI, Kwak SH, Lee Y, Choi JH, Cho YM, Om AS. A Controlled, Randomized, Double-blind Trial to Evaluate the Effect of Vegetables and Whole Grain Powder That Is Rich in Dietary Fibers on Bowel Functions and Defecation in Constipated Young Adults. J Cancer Prev. 2015;20(1):64-69. (PubMed)
60. Farrell RJ, Farrell JJ, Morrin MM. Diverticular disease in the elderly. Gastroenterol Clin North Am. 2001;30(2):475-496. (PubMed)
61. Crowe FL, Appleby PN, Allen NE, Key TJ. Diet and risk of diverticular disease in Oxford cohort of European Prospective Investigation into Cancer and Nutrition (EPIC): prospective study of British vegetarians and non-vegetarians. BMJ. 2011;343:d4131. (PubMed)
62. Crowe FL, Balkwill A, Cairns BJ, et al. Source of dietary fibre and diverticular disease incidence: a prospective study of UK women. Gut. 2014;63(9):1450-1456. (PubMed)
63. Pol K, Christensen R, Bartels EM, Raben A, Tetens I, Kristensen M. Whole grain and body weight changes in apparently healthy adults: a systematic review and meta-analysis of randomized controlled studies. Am J Clin Nutr. 2013;98(4):872-884. (PubMed)
64. Harris Jackson K, West SG, Vanden Heuvel JP, et al. Effects of whole and refined grains in a weight-loss diet on markers of metabolic syndrome in individuals with increased waist circumference: a randomized controlled-feeding trial. Am J Clin Nutr. 2014;100(2):577-586. (PubMed)
65. Kristensen M, Toubro S, Jensen MG, et al. Whole grain compared with refined wheat decreases the percentage of body fat following a 12-week, energy-restricted dietary intervention in postmenopausal women. J Nutr. 2012;142(4):710-716. (PubMed)
66. US Department of Health and Human Services and US Department of Agriculture. 2015 – 2020 Dietary Guidelines for Americans. 8th ed; 2015. Available at: http://health.gov/dietaryguidelines/2015/guidelines/.
67. Whole Grains Council. What is an Ounce Equivalent? Available at: http://wholegrainscouncil.org/whole-grains-101/what-is-an-ounce-equivalent. Accessed 11/27/15.
68. Reicks M, Jonnalagadda S, Albertson AM, Joshi N. Total dietary fiber intakes in the US population are related to whole grain consumption: results from the National Health and Nutrition Examination Survey 2009 to 2010. Nutr Res. 2014;34(3):226-234. (PubMed)
69. Willett WC. Eat, Drink, and be Healthy: The Harvard Medical School Guide to Healthy Eating. New York: Simon & Schuster; 2001.
コーヒー
目次
概要
- コーヒーは相当量のクロロゲン酸やカフェインが含まれている複合混合物である。(詳細はこちら)
- 無濾過のコーヒーにはCafestolやKahweol、ジテルペン類が含まれている。これら化合物はヒトにおいて血清中の総コレステロール及びLDLコレステロールの濃度を上昇させることが知られている。(詳細はこちら)
- 疫学調査の結果は、コーヒーの摂取が2型糖尿病、パーキンソン病、肝疾患のリスクを減少させることと関連があることを示唆している。しかしこのエビデンスに基づいて、これらの疾病予防のためにコーヒーの摂取を推奨することは早計である。(詳細はこちら)
- 現在のところ、コーヒーの摂取により癌のリスクが増加するという証拠はほとんどない。(詳細はこちら)
- コーヒー中のカフェインが血圧を上昇させることが臨床治験によって明らかになっているが、多くの前向きコホート研究において、適量のコーヒーの摂取が循環器疾患に罹患するリスクの増加に繋がる事がないことが明らかになっている。(詳細はこちら)
- 総合的に判断すると、適量のコーヒー(3-4杯/日、カフェイン量で換算すると300-400mg/日)の摂取は、大人において健康へのリスクがほとんどなく、健康への利点があるという結果がある。(詳細はこちら)
- しかし、人によりコーヒーに含まれるカフェインによる弊害を受けやすい者もいるかもしれない。
序章
ローストされたコーヒー豆の粉の煎じ液であるコーヒーは世界中で最も広く消費されている飲料である。カフェインは科学者の注目を最も集めているが、コーヒーは炭水化物や脂質(脂肪),アミノ酸,ビタミン類,無機質,アルカロイド,フェノール類などを含んだ化学物質の複雑な混合物である(1)。
コーヒーに含まれるいくつかの生理活性物質
クロロゲン酸
クロロゲン酸は実際にはキナ酸と桂皮酸として知られるフェノール性化合物類から形成される一群のエステル類である(2)。コーヒーに最も多く含まれているクロロゲン酸は5-O-カフェオイルキナ酸でキナ酸とコーヒー酸のエステル結合物質である(Figure 1)。コーヒーはクロロゲン酸の最も豊富な摂取源である。200ml (7-oz)カップ一杯のコーヒーに含まれるクロロゲン酸量は70mg~350mgであることが報告されている。この量はコーヒー酸を約35mg~175mg供給する量である。クロロゲン酸やコーヒー酸(caffeic acid)はin vitroにおいて抗酸化活性を示すが(3)、in vivoでどれほど抗酸化活性に寄与するかは不明である。なぜならばそれらの化合物は生体内で広範に代謝され、それらの代謝産物は親化合物より抗酸化活性が低いからである(4)。
カフェイン
カフェインはコーヒー豆の中に自然に生合成されるプリンアルカロイドの一種である(Figure 2)。コーヒーの飲食に伴う摂取レベルにおいて、カフェインはアデノシン受容体のサブタイプであるA1とA2の拮抗作用を通して大部分の生物学的効果を発揮すると考えられる(5)。アデノシンは神経伝達物質に対する神経の応答を調節する内因性化合物である。アデノシンは主に中枢神経系に対して抑制効果を持つため、カフェインによるアデノシンの拮抗作用は通常中枢神経系を刺激する。カフェインは胃と小腸で急速にほぼ完全に吸収され、脳を含む全ての組織に分布する。コーヒー飲料中のカフェイン濃度はそれぞれ全く異なる。標準的なカップ1杯のコーヒーは100mgのカフェインを供給するとしばしば考えられている。しかし、アメリカのコーヒーショップで購入した14のスペシャリティコーヒーのカフェイン量についての最近の分析結果から、8-oz (~240ml)のコーヒーで72mg~130mgのカフェインが含まれていることが明らかになった(6)。エスプレッソコーヒー1ショットに含まれるカフェイン量は58mg~76mgの範囲であった。アメリカ以外の国において、1杯のコーヒーはしばしば濃いが量が少なく、コーヒー1杯中のカフェイン量を100mg程度と見積もるのがリーズナブルである。
ジテルペン類
CafestolとKahweolは脂溶性化合物でジテルペン類として知られている(Figure 3)。これらの化合物はヒトの血清中の総コレステロール及びLDLコレステロールの濃度を上昇させる作用があることが明らかとなっている(7)。多少のCafestolとKahweolは挽いたコーヒー豆からコーヒーを淹れる際に抽出されるが、大部分はフィルター紙によって除去される。スカンジナビアンコーヒーやトルココーヒー、フレンチプレス(カフェティエール)コーヒーは相対的に高いレベルのCafestolとKahweolを含んでいる(6-12mg/杯)。一方、フィルターコーヒー、ダンク式コーヒー、インスタントコーヒーでは0.2-0.6mg/杯と含有量は低い(8,9)。ジテルペンの濃度はエスプレッソコーヒーで比較的高いが、一回に飲む量が少ないので、CafestolとKahweolの供給量としては中程度である(4mg/杯)。コーヒー豆中にはCafestolやKahweolが多く含まれているため、コーヒー豆そのものや焙煎し挽いたものを摂取すると、やはり血清中の総コレステロールとLDLコレステロールが上昇する。
疾病予防
2型糖尿病
いくつかのコホート研究から、コーヒーの摂取が多いほど、2型糖尿病を発症するリスクが有意に減少することが分かっている(10-18)。9報の前向きコホート研究の結果を総括すると、193,000人以上の男性及び女性を調査した結果、一日2杯未満しかコーヒーを摂取しない人の2型糖尿病を発症するリスクと比較すると、一日少なくとも6杯以上コーヒーを摂取する人ではそのリスクが35%減少し、一日4-6杯コーヒーを摂取する人では28%リスクが減少することが分かった(16)。アメリカでは男性医療従事者に対する疫学研究 (Health Professionals Follow-up Study; HPFS,対象人数 41,934人) 及び女性看護師の疫学研究(Nurses' Health Study; NHS,対象人数84,276人),女性看護師の疫学研究 Ⅱ (NHSⅡ,対象人数88,259人)の3種類の大規模な前向きコホート研究が行われ、カフェインを添加したコーヒーの摂取と2型糖尿病の関連性についての検討がなされた。その結果、男性のうち一日少なくとも6杯以上コーヒーを摂取する人は、コーヒーを全く摂取しない人よりも2型糖尿病を発症するリスクが54%減少することが分かった。また、女性では一日少なくとも6杯以上コーヒーを摂取する人は、コーヒーを全く摂取しない人よりも2型糖尿病を発症するリスクが29%減少することが分かった(13)。それとは別のコホート研究において一日4杯以上コーヒーを摂取する女性は2型糖尿病を発症するリスクが39%減少することが分かり、同様の結果が一日2-3杯のコーヒーを摂取する女性でも見られた(18)。またこれら3つのコホート研究から、カフェインの摂取量の多さに伴って2型糖尿病の発症リスクが有意に減少する事も分かった。通常、カフェインを除去したコーヒーを摂取した場合でも、2型糖尿病の発症リスクが多少減少するので、カフェイン以外の化合物がこのリスクの減少に寄与していることを示唆している。興味深いことに、28,812人の閉経後の女性を対象としたコホート研究においては、ある種類のデカフェコーヒー(カフェインを取り除く処理をしたコーヒー)で2型糖尿病の発症リスクが有意に減少していた(19)。前向きコホート研究の多くで観察された2型糖尿病の発症リスクを減少させる作用機序ついては不明であるが、それは短期間の臨床治験ではカフェインの投与により糖耐性が障害され、インスリン感受性が減少することが分かっているためである(20,21)。長期間におけるコーヒーの摂取と2型糖尿病のリスクとの関連性がより明らかになるまでは、2型糖尿病を予防する手段としてコーヒーの摂取を推奨するのは早計である(13,16)。
パーキンソン病
いくつかの大規模な前向きコホート研究において、コーヒーやカフェインを摂取するほど男性でのパーキンソン病に罹患するリスクが有意に減少することが分かった(22-24)。47,000人の男性を対象とした前向きコホート研究において、一日に少なくとも一杯のコーヒーを定期的に摂取する男性は、その後10年間でパーキンソン病を発症するリスクが全くコーヒーを飲まない男性よりも40%減少することが分かった(23)。コーヒー以外からカフェインを摂取した場合でも、その摂取量に依存してパーキンソン病の発症リスクが低下した。近年、29,335人のフィンランド人男女を対象とした前向きコホート研究が行われ、毎日一杯以上のコーヒーを飲むとパーキンソン病を発症するリスクが60%減少することが分かった(25)。この研究において、毎日3杯以上の茶を摂取することでもパーキンソン病の発症リスクが減少していたことから(25)、カフェインが保護的な成分である可能性が示唆される。パーキンソン病の動物モデルを用いた研究では、カフェインが脳のアデノシンA2A受容体に対し拮抗物質として作用することにより、ドパミン作動性ニューロンを保護している可能性が示唆されている(26)。しかし、男性における前向きコホート研究の結果とは対照的に、女性ではコーヒーまたはカフェイン摂取量とパーキンソン病を発症するリスクとの逆相関関係は見出せなかった(22,23)。これは恐らくエストロゲン補充療法の影響によるものだろう。77,000人の女性看護士を対象とした前向きコホート研究で更に解析を行ったところ、コーヒーを摂取し、かつ閉経後にエストロゲンを使用したことのない女性ではパーキンソン病の発症リスクが量依存的に減少する一方、毎日コーヒーを少なくとも6杯摂取し、かつ閉経後にエストロゲンを使用している女性では、逆にパーキンソン病の発症リスクが有意に増加することが明らかになった(27)。238,000人以上の女性を対象とした前向きコホート研究においても、閉経後にエストロゲンを使用していない女性ではコーヒーの摂取量とパーキンソン病による死亡率との間には有意な逆相関関係が見られたが、閉経後にエストロゲンを使用している女性には有意性が見られなかった(22)。パーキンソン病の発症リスクにおいて、どの様にエストロゲンがカフェインの効果に対して影響を与えているのかは分かっていない(28)。疫学的調査と動物実験の結果からはカフェインがパーキンソン病を発症するリスクを減少させる可能性があることが示唆されるものの、カフェイン摂取により、特にエストロゲンを利用している女性におけるパーキンソン病の発症を防ぐことが出来るかどうかは不明である。
大腸癌
いくつかの研究により、コーヒーの摂取は大腸癌の発生を抑制する働きがあることが分かっている。通常、症例対照研究ではコーヒーの摂取量と結腸癌のリスクは逆相関することが分かっているが、前向きコホート研究ではそのような関係性は見出されなかった(29,30)。12の症例対照研究と5つの前向きコホート研究を用いたメタ解析により、毎日コーヒーを4杯以上摂取する人は、コーヒーを摂取しない人と比べると大腸癌のリスクが24%減少することが明らかになった(30)。しかし、前向きコホート研究のみを併用したメタ解析ではコーヒーの摂取と大腸癌のリスクとの関連性は見出せなかった。これは、症例対照研究が一般に前向きコホート研究よりも多く癌のケースを取り扱っているが、症例対照研究では、コーヒー摂取に関する記憶想起バイアスと対照群に関する選択バイアスが生じたことによるものかもしれない。更に最近の疫学調査のレビューを見ると、症例対照研究においてコーヒーの摂取量と結腸癌のリスクが逆相関するという証拠が見出された一方、前向きコホート研究ではそのような証拠は見出せなかった(29)。このレビューではコーヒーと直腸がんの関連性は見出されなかった。それとは対照的に、コーヒーと大腸癌の関連性を検討するために行われた2つの大規模な前向きコホート研究では、毎日2杯以上のカフェインを除去したコーヒーを摂取するアメリカの男性及び女性は、コーヒーを全く摂取しない人と比べ直腸癌のリスクが48%減少することが明らかになった(31)。しかし、どちらの研究においても、カフェイン含有コーヒーやお茶の摂取あるいは全カフェイン摂取量は結腸あるいは直腸癌の発症リスクとの関連はないと報告されている。最近行われたスウェーデン(32)及び日本(33-35)における前向きコホート研究では、カフェインの含まれているコーヒーの摂取と結腸,直腸,または大腸癌との関連性は男女共に見出されなかった。しかし、2つのコホート研究から、女性についてはコーヒーの摂取量と結腸癌(33)及び浸潤性結腸癌(34)のリスクが相反することが明らかになった。症例対照研究では有望な知見が得られているものの、ヒトにおいてコーヒーの摂取が結腸または直腸癌のリスクの減少に繋がるかは不明瞭である。コーヒーの摂取が結腸または直腸癌のリスクを増加させるという知見は得られていない。
肝硬変及び肝臓癌
慢性的な炎症による肝臓への障害の結果、肝硬変が生じる。肝硬変になると、繊維性の瘢痕組織が形成され、肝機能が悪化すると共に肝癌(肝細胞癌)を含む他の合併症が進行する(36)。先進国で肝硬変となる主要な原因として、アルコール乱用とB型及びC型肝炎ウイルスの感染が挙げられる。いくつかの症例対照研究においてコーヒーの摂取と肝硬変のリスクは相反することが分かっており(37-39)、2つの前向きコホート研究ではコーヒーの摂取とアルコール性肝硬変による死亡率が相反することが分かっている(40,41)。アメリカにおいて120,000人以上の男女を対象とし8年間調査を行った結果、アルコール性肝硬変で死亡するリスクが、毎日カップ一杯のコーヒーを飲むことで22%減少することが明らかになった(42)。またノルウェーにおいて51,000人以上の男女を対象とし、17年間調査を行った結果、毎日少なくとも2杯以上のコーヒーを摂取する人は、コーヒーを全く摂取しない人と比較すると肝硬変で死亡するリスクが40%減少することが分かった(41)。最近アメリカで行われた125,580人の成人を対象とした前向きコホート研究では、アルコール性肝硬変についてはコーヒーの摂取が抑制的に働くが、非アルコール性肝硬変には作用しないことが分かった(43)。具体的には、アルコール性肝硬変の発症リスクは毎日コーヒーを1-3杯摂取する人で40%減少し、毎日4杯以上摂取する人では80%減少する(43)。ヨーロッパ(44-46)及び日本(47,48)におけるいくつかの症例対照研究では、コーヒーの摂取量と肝細胞癌のリスクは有意に逆相関することが明らかになった。この結果は、日本で行われた3つの前向きコホート研究(49-51)、及びフィンランドで行われた一つの前向きコホート研究(52)でも支持された知見である。このうち2つの前向きコホート研究では、肝疾患またはC型肝炎に罹患している日本人男女において、コーヒーの摂取が肝細胞癌のリスクを有意に減少させることが分かった(49,50)。元々肝細胞癌を発症するリスクが高い人において、毎日少なくとも1杯以上のコーヒーを摂取する人はコーヒーを全く摂取しない人と比較すると肝細胞癌の発症リスクが50%減少する。同様に、ある前向きコホート研究では、毎日コーヒーを少なくても1杯以上摂取すると肝細胞癌による死亡のリスクが50%減少するが、肝疾患の既往歴のない人では統計的な有意差が見られなかった(51)。更に、2つのメタ解析でもコーヒーの摂取量と肝癌とは逆相関にあることが明らかになった(53,54)。
死亡率
アメリカにおける男性医療従事者に対する疫学研究及び女性看護師の疫学研究での前向きコホート研究(対象人数 男性 41,736人,女性 86,214人)で、コーヒーの摂取と総死亡率,循環器疾患による死亡率または癌による死亡率との関連性について検討が行われた。その結果、男女共にカフェインの含まれているコーヒーの摂取量と総死亡率及び循環器疾患による死亡率とは逆相関する一方、癌による死亡率とは関連性が見られなかった(55)。他の小規模なコホート研究でも、カフェインの含まれているコーヒーを習慣的に摂取することにより総死亡率(56-59)及び循環器疾患による死亡率(57)が減少したが、男女間ではその減少率は全て一致するわけではなかった。しかし、他の研究ではコーヒーの摂取が総死亡率または特定原因による死亡率に関係しないか、あるいはそれらを増加させる可能性があることが分かっている(55 レビュー)。
コーヒーの摂取による健康へのリスク
心血管疾患
冠動脈心疾患
症例対照研究には選択バイアスと記憶想起バイアスが潜在するため限界があるが、多くの症例対照研究において、毎日コーヒーを5杯以上摂取する人は冠動脈心疾患(CHD)のリスクが増加する可能性があることが示唆されている(60,61)。その一方、多くの前向きコホート研究ではコーヒーの摂取と冠動脈心疾患のリスクとの有意な関連性は見出されなかった。しかし、ノルウェーで行われた前向きコホート研究は例外で、フィルターを通さない煮出しコーヒーの摂取量が多いと、フィルターを通したコーヒーを摂取するようにした人と比較して冠動脈心疾患で死亡するリスクが増加することが分かった(62)。10以上の前向きコホート研究の結果を用いて行われた2つのメタ解析では、コーヒーの摂取と冠動脈心疾患のリスクには関連性が見出されなかった(60,63)。このメタ解析以降に行われた、アメリカ(64-66)、スコットランド(67)、フィンランド(68)における大規模な前向きコホート研究でも同様に、コーヒーの摂取と冠動脈心疾患のリスクとに有意な関連性は見出されなかった。
高血圧
高血圧は循環器疾患に至る、一般に広く認識された危険因子である。カフェインを摂取すると急速に血圧が上昇し、特に高血圧の人では顕著である(5)。コーヒーを習慣的に摂取すると、カフェインによる血圧上昇効果に耐性が生じることが知られているものの、いくつかの臨床治験からはカフェインを日常的に摂取する人でも、必ずしも耐性が生じるわけではないことが示唆された(69-71)。コーヒーの摂取と一週間以上の血圧の変動における無作為化比較対照試験の結果を踏まえ、2つのメタ解析で検討がなされた。そのうち一つ目のメタ解析は、11の無作為化比較対照試験について行われ、コーヒーの継続摂取期間の中央値は56日、摂取量の中央値は一日5杯であったが、コーヒーの摂取により収縮期血圧では2.4mm/Hg、拡張期血圧では1.2mm/Hgそれぞれ有意に増加することが明らかになった(72)。更に近年、18の無作為化比較対照試験について行われたもうひとつのメタ解析では、コーヒーの継続摂取期間の中央値は43日、摂取量の中央値は一日725ml (~3杯/日)であったが、コーヒーの摂取により収縮期血圧が1.2mm/Hg有意に増加することが分かった(73)。収縮期血圧の増加は個々人の基準では瑣末な上昇に見えるかも知れないが、ある集団において収縮期血圧が平均2mm/Hg減少すると、卒中による死亡率は10%低下し、冠動脈心疾患による死亡率は7%減少するという推計がある(74)。最も新しいメタ解析では、錠剤でカフェインを摂取するほうがコーヒーでカフェインを摂取するよりも血圧を上昇させることが分かっており(73)、これはコーヒー中に含まれる他の化合物がカフェインの血圧上昇効果を抑制している可能性があることを示唆している。更に、最近行われた女性看護師の疫学研究及び女性看護師の疫学研究 Ⅱ(対象人数 140,544人)の前向きコホート研究では、カフェインの添加されたコーラを日常的に摂取し、コーヒーを飲む習慣がない人では高血圧のリスクが増加することが報告された(75)。しかし、短期間の無作為化比較対照試験で得られた結果からは、日常的にコーヒーやカフェインを摂取する人では収縮期血圧が多少上昇することから、カフェインやコーヒーを日常的に摂取する人では、特に高血圧の背景を持つ人で、脳卒中や冠動脈心疾患による死亡率が増加する可能性があることが示唆された。
LDLコレステロール
14の無作為化比較対照試験によるメタ解析では、無濾過の煮出しコーヒーの摂取により用量依存的に血清中の総コレステロールとLDLコレステロール量が増加する一方、フィルターを通したコーヒーではほとんど変化しないことが分かった(76)。具体的には、煮出しコーヒーを摂取した場合、血清中の総コレステロールは23mg/dl、LDLコレステロールは14mg/dlそれぞれ増加した一方、フィルターを通したコーヒーを摂取した場合では血清中の総コレステロールは3mg/dlしか増加せず、LDLコレステロールには影響を及ぼさなかった。煮出しコーヒーのコレステロール増加因子はジテルペン類であるCafestolとKahweolと分かっており、これらはコーヒーをフィルターに通した際に大部分が除去される(ジテルペンの項を参照)(7)。
ホモシステイン
血漿中の総ホモシステイン(tHcy)が増加すると冠動脈心疾患、脳卒中、末梢血管疾患といった循環器疾患のリスクも増加するが、その因果関係については不明である(77)。コーヒーの摂取量が多いと血漿中の総ホモシステイン濃度が増加することがヨーロッパ、北欧、アメリカで行われた横断研究により明らかになった(78-82)。対象臨床試験により、一日にコーヒーを4杯程度摂取するとホモシステインを増加させることが確認されている(83-85)。
不整脈
臨床治験において5-6杯/日に相当するコーヒーまたはカフェインの摂取により、健常者あるいは冠動脈心疾患に罹患している者で不整脈の頻度が増加したり、不整脈が重症化することはなかった(86,87)。アメリカにおいて128,000人を対象として7年間調査を行った大規模な前向きコホート研究では、コーヒーの摂取と心臓性突然死との因果関係は見出されなかった。また、近年北欧で行われた二つの前向きコホート研究では、コーヒーの摂取と一般的な上室性不整脈である心房細動の発生リスクには因果関係が見られなかった(88,89)。
癌
多くの疫学調査において、ヒトにおけるコーヒーやカフェインの摂取と発癌リスクとの関連性が検討された。一般に、コーヒーの摂取が癌のリスクを増大させるという根拠はほとんど見つからず、特に喫煙のファクターを加味した解析でも見出されなかった(90のレビュー)。
妊娠
流産
母親がコーヒーまたはカフェインの摂取することによる流産(自然流産)のリスクとの関連性を検討した疫学調査の結果を見るとその結果は矛盾していた。いくつかの研究では、特にコーヒー由来のカフェインの摂取量が多い事と自然流産のリスクには有意な関係性が認められた(91-95)一方、他の研究では有意な関係性は見られなかった(96-98)。多くの研究においてコーヒーまたはカフェインの摂取量の自己申告量と流産のリスクについて有意な関連性が見出されたのは、カフェインの摂取量が少なくとも300mg/日の場合であった(90)。また、カフェインの代謝産物であるパラキサンチンの血清中濃度を測定することによるカフェイン摂取の評価を行った研究では、カフェインを少なくとも一日600mg摂取した量に匹敵するパラキサンチン濃度の場合でのみ自然流産のリスクが増すことが示唆された(99)。カフェイン摂取量と自然流産のリスクとの関連性は悪心と胎児生育性との関連性によって説明できる(100)。吐き気は胎児が生育できない妊娠よりも生育可能な妊娠でより一般的に認められる。これは生育可能な妊婦が吐き気によってカフェインの摂取を避けたり、あるいは制限しているように見えることを示している。しかし、少なくともある研究ではカフェインの摂取量が300mg/日以上で妊娠による悪心の影響を受けていない女性では、自然流産のリスクが有意に増加する事が分かった(92)。更に別の二つの研究では妊娠中にコーヒーに対する悪心または嫌忌の経験がある女性において、カフェイン摂取が自然流産のリスクの増加に繋がることが明らかになった(91,94)。この話題はまだ議論の余地が残っているが、疫学的証拠からは、母親がカフェインを一日300mg以下摂取する場合、自然流産のリスクが増加する可能性は少ない。
胎児発育
母親のカフェイン及びコーヒーの摂取が胎児発育に影響するかを検討するため、平均出生体重、低出生体重児(2500g未満)の発生率、及び胎児発育遅延(在胎期間を基準とした出生時体重の10パーセンタイル未満)の評価による疫学調査が行われた。いくつかの研究において、母親が200-400mg/日のカフェインを摂取した場合、平均出生体重は約100g(3.5 oz)減少していた(101-103)。しかし、大規模な前向きコホート研究では、一日に摂取するカフェインの量が600mg未満の母親の場合、カフェインによる出生体重の減少は臨床的に重要であるとは考えられないという結果が出された(104)。母親のカフェイン摂取と低出生体重児及び胎児発育遅延との関連性を検討した疫学調査の結果は実に様々であった(90のレビュー)。また、いくつかの疫学調査では低出生体重児や胎児発育遅延の重要な危険因子、特に喫煙について不適切な調査上の処置がなされているという批判がある(100)。最近、妊娠後半期の女性にカフェインを除去したコーヒー(カフェイン摂取量の中央値 117mg/日)またはカフェインを含んだコーヒー(カフェイン摂取量の中央値 317mg/日)を摂取する二重盲検介入試験が行われた(105)。その結果、妊娠期間または乳児の出生体重は2群で差が見られなかった(105)。母親のカフェイン摂取量と胎児発育との関連性については更なる検討が必要だが、300mg/日未満のカフェイン摂取では非喫煙女性における胎児発育にはほとんど影響を及ぼさないものと考えられる。
先天性異常
今のところ、母親のカフェイン摂取量が300-1000mg/日の場合、ヒトにおける先天性異常のリスクが増加するという疫学的な根拠は得られていない(90,106,107のレビュー)。
授乳
アメリカ小児科学会は母親の薬物療法におけるカフェインを通常の母乳栄養に適合すると分類している(108)。しかし、母親のカフェイン摂取量が多い場合、易刺激性による乳児の睡眠が不十分になると言う報告があるが、母親が一日2-3杯程度のコーヒーに匹敵する量のカフェインを摂取した場合、乳児への副作用が生じるという報告例はない。
安全性
副作用
コーヒーに起因する副作用の多くはカフェインに関連するものである。カフェインの副作用には頻脈、動悸、不眠、焦燥感、神経過敏、振戦、頭痛、腹痛、悪心、嘔吐、下痢、利尿が挙げられる(109)。コーヒーを通常摂取するには問題がないが、カフェインを多量に摂取すると低カリウム血症を誘発する恐れがある(110)。また、長期間カフェインを摂取した後、急に摂取を止めるとカフェインの禁断症状が生じる場合がある(111)。一般的なカフェインの禁断症状として頭痛、疲労、眠気、易刺激性、集中しにくい、抑うつ感などがある。有意な禁断症状は一般にカフェインの摂取量が多いほど生じるが、100mg/日という比較的低い摂取量でも長期間摂取し続けると禁断症状が生じる。カフェインの摂取を徐々に止める事により急激に止めるよりも禁断症状が出にくくなる(112)。
薬との相互作用
カフェインを習慣的に摂取すると、肝臓のチトクロムP450(CYP)1A2の活性が増加し、これによりいくつかの薬物の代謝に影響が生じる(113)。加えて、カフェインの代謝と除去に関与しているCYP1A2の活性を抑制する薬物を使用すると、副作用のリスクが増加する(114)。
カフェイン代謝を変化させる薬物
下記に列挙した薬物療法によって肝臓におけるカフェインの代謝が障害され、カフェインの除去が減少し、カフェインに関わる副作用が生じる危険性がある:シメチジン、ジスルフィラム、エストロゲン、フルコナゾール、フルボキサミン、メキシレチン(Mexitil)、キノロン系抗生物質、テルビナフィン(113)。また、フェニトインや喫煙は肝臓におけるカフェインの代謝量が増加し、その結果血漿カフェイン濃度は減少していく(109)。
他の薬物へのカフェインの影響
カフェイン及び他のメチルキサンチンはエピネフリンやアルブテロールといったβ-アドレナリン作動薬の効果やリスクを増強する可能性がある(109,113)。また、カフェインは抗精神病薬であるクロザピンの肝臓での代謝を抑制するため、血清中のクロザピンレベルが上昇し、毒性のリスクが増加する。同様にカフェインの摂取により、テオフィリンの排出が減少することから、血清のテオフィリンレベルが増加する。カフェインはアセトアミノフェンの代謝を遅らせ、アスピリンの生物学的利用能を増加する作用がある事が分かっており、このことは鎮痛効果を増強するというカフェインの有効性の一部を説明するものである。この効果は重要であり、今日市場に出回っている多くの鎮痛剤はカフェインとアスピリンやアセトアミノフェンを併用している。更に、カフェインは血清中のリチウム除去能を増強するため、血清のリチウム濃度を低下させる。
栄養成分との相互作用
カルシウム及び骨粗鬆症
ヒトにおける対照試験から、コーヒー及びカフェインの摂取によってカルシウムの吸収効率が減少し、その結果コーヒー1杯あたり4-6mgのカルシウムを損失しているということが分かった(115,116)。多くの研究においてカフェインの摂取による骨密度の経時変化は見られなかった(117のレビュー)。しかし、ある研究ではカルシウム摂取量が744mg/日未満の女性でのみ、カフェインの摂取が骨密度の減少を促進するという結果が出た(118)ほか、他の研究ではカフェインを300mg/日以上摂取する高齢の女性において骨量減少が促進された(119)。少なくとも6つの前向きコホート研究で女性におけるカフェイン(主にコーヒー由来)またはコーヒー摂取と股関節骨折のリスクの関連性についての検討がなされた。このうちフィンランドと日本で行われた研究からは関連性は見出されなかった(120,121)。ノルウェーにおける研究では少なくとも1日9杯以上コーヒーを摂取する女性において股関節骨折のリスクが増加する傾向にあったが、その量のコーヒーを摂取する女性は全体の7%程度だった(122)。しかし、アメリカにおける3つの前向きコホート研究では女性におけるコーヒーまたはカフェイン摂取と股関節骨折のリスクには関連性があることが分かった(123-125)。アメリカのフラミンガム研究では、一日に2杯以上のコーヒーを摂取する女性はカフェインの入った飲み物を摂取しない女性に比べ、12年間での股関節骨折のリスクは69%高かった(123)。女性看護師の疫学研究では、一日コーヒーを4杯以上摂取する女性では、コーヒーを摂取しない女性と比較すると6年間での股関節骨折のリスクは3倍になった(124)。65歳以上の女性を対象とした前向きコホート研究において、コーヒー2杯分に匹敵する量のカフェイン(約200mg)を日常的に摂取している人では、骨粗鬆症による股関節骨折のリスクが増加する事が分かった(125)。最近行われたスウェーデンでの高齢女性31,527人を対象とした前向きコホート研究では、一日4杯以上のコーヒーを摂取する人では全ての骨粗鬆症性骨折のリスクが増加するものの、有意にリスクが増加するのはそのうちカルシウムの摂取量が少ない(<700mg/日)女性に限られていた(126)。骨粗鬆症の原因は様々であり、コーヒーまたはカフェインの摂取が骨粗鬆症のリスクとなるか否かは不明である。しかし、現在までの研究を総括すると、カルシウムとビタミンDの適切な量を摂取し、かつコーヒーの摂取が一日3杯以下である場合、とくに高齢者における骨粗鬆症や骨粗鬆症性骨折のリスクを軽減させる可能性がある。
非ヘム鉄
コーヒーに含まれるフェノール性化合物は非ヘム鉄と結合し、その腸管吸収を抑制する(127)。試験食と共に150-250mlのコーヒーを摂取したところ、鉄の吸収が24-73%抑制された(128,129)。食事や鉄分のサプリメントから十分に鉄を吸収するためには、コーヒーを一緒に摂取することは避けるべきである。
Authors and Reviewers
Originally written in 2005 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in September 2008 by:
Victoria J. Drake, Ph.D.
Linus Pauling Institute
Oregon State University
Reviewed in September 2008 by:
Professor Martijn B. Katan, Ph.D.
Institute of Health Sciences
VU University, Amsterdam
The Netherlands
Copyright 2005-2023 Linus Pauling Institute
References
1. Spiller MA. The Chemical Components of Coffee. In: Spiller GA, ed. Caffeine. Boca Raton: CRC Press; 1998:97-161.
2. Clifford MN. Chlorogenic acids and other cinnamates--nature occurrence and dietary burden. J Sci Food Agric. 1999;79:362-372.
3. Iwai K, Kishimoto N, Kakino Y, Mochida K, Fujita T. In vitro antioxidative effects and tyrosinase inhibitory activities of seven hydroxycinnamoyl derivatives in green coffee beans. J Agric Food Chem. 2004;52(15):4893-4898. (PubMed)
4. Olthof MR, Hollman PC, Buijsman MN, van Amelsvoort JM, Katan MB. Chlorogenic acid, quercetin-3-rutinoside and black tea phenols are extensively metabolized in humans. J Nutr. 2003;133(6):1806-1814. (PubMed)
5. James JE. Critical review of dietary caffeine and blood pressure: a relationship that should be taken more seriously. Psychosom Med. 2004;66(1):63-71. (PubMed)
6. McCusker RR, Goldberger BA, Cone EJ. Caffeine content of specialty coffees. J Anal Toxicol. 2003;27(7):520-522. (PubMed)
7. Urgert R, Katan MB. The cholesterol-raising factor from coffee beans. Annu Rev Nutr. 1997;17:305-324. (PubMed)
8. Gross G, Jaccaud E, Huggett AC. Analysis of the content of the diterpenes cafestol and kahweol in coffee brews. Food Chem Toxicol. 1997;35(6):547-554. (PubMed)
9. Urgert R, van der Weg G, Kosmeijer-Schuil TG, van de Bovenkamp P, Hovenier R, Katan MB. Levels of the cholesterol-elevating diterpenes cafestol and kahweol in various coffee brews. J Agric Food Chem. 1995;43(8):2167-2172.
10. Hu G, Jousilahti P, Peltonen M, Bidel S, Tuomilehto J. Joint association of coffee consumption and other factors to the risk of type 2 diabetes: a prospective study in Finland. Int J Obes (Lond). 2006;30(12):1742-1749. (PubMed)
11. Carlsson S, Hammar N, Grill V, Kaprio J. Coffee consumption and risk of type 2 diabetes in Finnish twins. Int J Epidemiol. 2004;33(3):616-617. (PubMed)
12. Rosengren A, Dotevall A, Wilhelmsen L, Thelle D, Johansson S. Coffee and incidence of diabetes in Swedish women: a prospective 18-year follow-up study. J Intern Med. 2004;255(1):89-95. (PubMed)
13. Salazar-Martinez E, Willett WC, Ascherio A, et al. Coffee consumption and risk for type 2 diabetes mellitus. Ann Intern Med. 2004;140(1):1-8. (PubMed)
14. Tuomilehto J, Hu G, Bidel S, Lindstrom J, Jousilahti P. Coffee consumption and risk of type 2 diabetes mellitus among middle-aged Finnish men and women. JAMA. 2004;291(10):1213-1219. (PubMed)
15. van Dam RM, Feskens EJ. Coffee consumption and risk of type 2 diabetes mellitus. Lancet. 2002;360(9344):1477-1478. (PubMed)
16. van Dam RM, Hu FB. Coffee consumption and risk of type 2 diabetes: a systematic review. JAMA. 2005;294(1):97-104. (PubMed)
17. Greenberg JA, Axen KV, Schnoll R, Boozer CN. Coffee, tea and diabetes: the role of weight loss and caffeine. Int J Obes Relat Metab Disord. 2005;29(9):1121-1129. (PubMed)
18. van Dam RM, Willett WC, Manson JE, Hu FB. Coffee, caffeine, and risk of type 2 diabetes: a prospective cohort study in younger and middle-aged U.S. women. Diabetes Care. 2006;29(2):398-403. (PubMed)
19. Pereira MA, Parker ED, Folsom AR. Coffee consumption and risk of type 2 diabetes mellitus: an 11-year prospective study of 28 812 postmenopausal women. Arch Intern Med. 2006;166(12):1311-1316. (PubMed)
20. Keijzers GB, De Galan BE, Tack CJ, Smits P. Caffeine can decrease insulin sensitivity in humans. Diabetes Care. 2002;25(2):364-369. (PubMed)
21. Petrie HJ, Chown SE, Belfie LM, et al. Caffeine ingestion increases the insulin response to an oral-glucose-tolerance test in obese men before and after weight loss. Am J Clin Nutr. 2004;80(1):22-28. (PubMed)
22. Ascherio A, Weisskopf MG, O'Reilly EJ, et al. Coffee consumption, gender, and Parkinson's disease mortality in the cancer prevention study II cohort: the modifying effects of estrogen. Am J Epidemiol. 2004;160(10):977-984. (PubMed)
23. Ascherio A, Zhang SM, Hernan MA, et al. Prospective study of caffeine consumption and risk of Parkinson's disease in men and women. Ann Neurol. 2001;50(1):56-63. (PubMed)
24. Ross GW, Abbott RD, Petrovitch H, et al. Association of coffee and caffeine intake with the risk of Parkinson disease. JAMA. 2000;283(20):2674-2679. (PubMed)
25. Hu G, Bidel S, Jousilahti P, Antikainen R, Tuomilehto J. Coffee and tea consumption and the risk of Parkinson's disease. Mov Disord. 2007;22(15):2242-2248. (PubMed)
26. Schwarzschild MA, Chen JF, Ascherio A. Caffeinated clues and the promise of adenosine A(2A) antagonists in PD. Neurology. 2002;58(8):1154-1160. (PubMed)
27. Ascherio A, Chen H, Schwarzschild MA, Zhang SM, Colditz GA, Speizer FE. Caffeine, postmenopausal estrogen, and risk of Parkinson's disease. Neurology. 2003;60(5):790-795. (PubMed)
28. Pollock BG, Wylie M, Stack JA, et al. Inhibition of caffeine metabolism by estrogen replacement therapy in postmenopausal women. J Clin Pharmacol. 1999;39(9):936-940. (PubMed)
29. Tavani A, La Vecchia C. Coffee, decaffeinated coffee, tea and cancer of the colon and rectum: a review of epidemiological studies, 1990-2003. Cancer Causes Control. 2004;15(8):743-757. (PubMed)
30. Giovannucci E. Meta-analysis of coffee consumption and risk of colorectal cancer. Am J Epidemiol. 1998;147(11):1043-1052. (PubMed)
31. Michels KB, Willett WC, Fuchs CS, Giovannucci E. Coffee, tea, and caffeine consumption and incidence of colon and rectal cancer. J Natl Cancer Inst. 2005;97(4):282-292. (PubMed)
32. Larsson SC, Bergkvist L, Giovannucci E, Wolk A. Coffee consumption and incidence of colorectal cancer in two prospective cohort studies of Swedish women and men. Am J Epidemiol. 2006;163(7):638-644. (PubMed)
33. Oba S, Shimizu N, Nagata C, et al. The relationship between the consumption of meat, fat, and coffee and the risk of colon cancer: a prospective study in Japan. Cancer Lett. 2006;244(2):260-267. (PubMed)
34. Lee KJ, Inoue M, Otani T, Iwasaki M, Sasazuki S, Tsugane S. Coffee consumption and risk of colorectal cancer in a population-based prospective cohort of Japanese men and women. Int J Cancer. 2007;121(6):1312-1318. (PubMed)
35. Naganuma T, Kuriyama S, Akhter M, et al. Coffee consumption and the risk of colorectal cancer: a prospective cohort study in Japan. Int J Cancer. 2007;120(7):1542-1547. (PubMed)
36. Friedman SL, Schiano TD. Cirrhosis and its sequelae. In: Goldman L, Ausiello D, eds. Cecil Textbook of Medicine. 22nd ed. St. Louis: W. B. Saunders; 2004:940-944.
37. Corrao G, Lepore AR, Torchio P, et al. The effect of drinking coffee and smoking cigarettes on the risk of cirrhosis associated with alcohol consumption. A case-control study. Provincial Group for the Study of Chronic Liver Disease. Eur J Epidemiol. 1994;10(6):657-664. (PubMed)
38. Corrao G, Zambon A, Bagnardi V, D'Amicis A, Klatsky A. Coffee, caffeine, and the risk of liver cirrhosis. Ann Epidemiol. 2001;11(7):458-465. (PubMed)
39. Gallus S, Tavani A, Negri E, La Vecchia C. Does coffee protect against liver cirrhosis? Ann Epidemiol. 2002;12(3):202-205. (PubMed)
40. Klatsky AL, Armstrong MA. Alcohol, smoking, coffee, and cirrhosis. Am J Epidemiol. 1992;136(10):1248-1257. (PubMed)
41. Tverdal A, Skurtveit S. Coffee intake and mortality from liver cirrhosis. Ann Epidemiol. 2003;13(6):419-423. (PubMed)
42. Klatsky AL, Armstrong MA, Friedman GD. Coffee, tea, and mortality. Ann Epidemiol. 1993;3(4):375-381. (PubMed)
43. Klatsky AL, Morton C, Udaltsova N, Friedman GD. Coffee, cirrhosis, and transaminase enzymes. Arch Intern Med. 2006;166(11):1190-1195. (PubMed)
44. Gallus S, Bertuzzi M, Tavani A, et al. Does coffee protect against hepatocellular carcinoma? Br J Cancer. 2002;87(9):956-959. (PubMed)
45. Gelatti U, Covolo L, Franceschini M, et al. Coffee consumption reduces the risk of hepatocellular carcinoma independently of its aetiology: a case-control study. J Hepatol. 2005;42(4):528-534. (PubMed)
46. Montella M, Polesel J, La Vecchia C, et al. Coffee and tea consumption and risk of hepatocellular carcinoma in Italy. Int J Cancer. 2007;120(7):1555-1559. (PubMed)
47. Tanaka K, Hara M, Sakamoto T, et al. Inverse association between coffee drinking and the risk of hepatocellular carcinoma: a case-control study in Japan. Cancer Sci. 2007;98(2):214-218. (PubMed)
48. Ohfuji S, Fukushima W, Tanaka T, et al. Coffee consumption and reduced risk of hepatocellular carcinoma among patients with chronic type C liver disease: A case-control study. Hepatol Res. 2006;36(3):201-208. (PubMed)
49. Shimazu T, Tsubono Y, Kuriyama S, et al. Coffee consumption and the risk of primary liver cancer: Pooled analysis of two prospective studies in Japan. Int J Cancer. 2005;116(1):150-154. (PubMed)
50. Inoue M, Yoshimi I, Sobue T, Tsugane S. Influence of coffee drinking on subsequent risk of hepatocellular carcinoma: a prospective study in Japan. J Natl Cancer Inst. 2005;97(4):293-300. (PubMed)
51. Kurozawa Y, Ogimoto I, Shibata A, et al. Coffee and risk of death from hepatocellular carcinoma in a large cohort study in Japan. Br J Cancer. 2005;93(5):607-610. (PubMed)
52. Hu G, Tuomilehto J, Pukkala E, et al. Joint effects of coffee consumption and serum gamma-glutamyltransferase on the risk of liver cancer. Hepatology. 2008;48(1):129-136. (PubMed)
53. Bravi F, Bosetti C, Tavani A, et al. Coffee drinking and hepatocellular carcinoma risk: a meta-analysis. Hepatology. 2007;46(2):430-435. (PubMed)
54. Larsson SC, Wolk A. Coffee consumption and risk of liver cancer: a meta-analysis. Gastroenterology. 2007;132(5):1740-1745. (PubMed)
55. Lopez-Garcia E, van Dam RM, Li TY, Rodriguez-Artalejo F, Hu FB. The relationship of coffee consumption with mortality. Ann Intern Med. 2008;148(12):904-914. (PubMed)
56. Iwai N, Ohshiro H, Kurozawa Y, et al. Relationship between coffee and green tea consumption and all-cause mortality in a cohort of a rural Japanese population. J Epidemiol. 2002;12(3):191-198. (PubMed)
57. Murray SS, Bjelke E, Gibson RW, Schuman LM. Coffee consumption and mortality from ischemic heart disease and other causes: results from the Lutheran Brotherhood study, 1966-1978. Am J Epidemiol. 1981;113(6):661-667. (PubMed)
58. Jazbec A, Simic D, Corovic N, Durakovic Z, Pavlovic M. Impact of coffee and other selected factors on general mortality and mortality due to cardiovascular disease in Croatia. J Health Popul Nutr. 2003;21(4):332-340. (PubMed)
59. Rosengren A, Wilhelmsen L. Coffee, coronary heart disease and mortality in middle-aged Swedish men: findings from the Primary Prevention Study. J Intern Med. 1991;230(1):67-71. (PubMed)
60. Kawachi I, Colditz GA, Stone CB. Does coffee drinking increase the risk of coronary heart disease? Results from a meta-analysis. Br Heart J. 1994;72(3):269-275. (PubMed)
61. Greenland S. A meta-analysis of coffee, myocardial infarction, and coronary death. Epidemiology. 1993;4(4):366-374. (PubMed)
62. Tverdal A, Stensvold I, Solvoll K, Foss OP, Lund-Larsen P, Bjartveit K. Coffee consumption and death from coronary heart disease in middle aged Norwegian men and women. BMJ. 1990;300(6724):566-569. (PubMed)
63. Myers MG, Basinski A. Coffee and coronary heart disease. Arch Intern Med. 1992;152(9):1767-1772. (PubMed)
64. Willett WC, Stampfer MJ, Manson JE, et al. Coffee consumption and coronary heart disease in women. A ten-year follow-up. JAMA. 1996;275(6):458-462. (PubMed)
65. Lopez-Garcia E, van Dam RM, Willett WC, et al. Coffee consumption and coronary heart disease in men and women: a prospective cohort study. Circulation. 2006;113(17):2045-2053. (PubMed)
66. Andersen LF, Jacobs DR, Jr., Carlsen MH, Blomhoff R. Consumption of coffee is associated with reduced risk of death attributed to inflammatory and cardiovascular diseases in the Iowa Women's Health Study. Am J Clin Nutr. 2006;83(5):1039-1046. (PubMed)
67. Woodward M, Tunstall-Pedoe H. Coffee and tea consumption in the Scottish Heart Health Study follow up: conflicting relations with coronary risk factors, coronary disease, and all cause mortality. J Epidemiol Community Health. 1999;53(8):481-487. (PubMed)
68. Bidel S, Hu G, Qiao Q, Jousilahti P, Antikainen R, Tuomilehto J. Coffee consumption and risk of total and cardiovascular mortality among patients with type 2 diabetes. Diabetologia. 2006;49(11):2618-2626. (PubMed)
69. Denaro CP, Brown CR, Jacob P, 3rd, Benowitz NL. Effects of caffeine with repeated dosing. Eur J Clin Pharmacol. 1991;40(3):273-278. (PubMed)
70. James JE. Chronic effects of habitual caffeine consumption on laboratory and ambulatory blood pressure levels. J Cardiovasc Risk. 1994;1(2):159-164. (PubMed)
71. Lovallo WR, Wilson MF, Vincent AS, Sung BH, McKey BS, Whitsett TL. Blood pressure response to caffeine shows incomplete tolerance after short-term regular consumption. Hypertension. 2004;43(4):760-765. (PubMed)
72. Jee SH, He J, Whelton PK, Suh I, Klag MJ. The effect of chronic coffee drinking on blood pressure: a meta-analysis of controlled clinical trials. Hypertension. 1999;33(2):647-652. (PubMed)
73. Noordzij M, Uiterwaal CS, Arends LR, Kok FJ, Grobbee DE, Geleijnse JM. Blood pressure response to chronic intake of coffee and caffeine: a meta-analysis of randomized controlled trials. J Hypertens. 2005;23(5):921-928. (PubMed)
74. Lewington S, Clarke R, Qizilbash N, Peto R, Collins R. Age-specific relevance of usual blood pressure to vascular mortality: a meta-analysis of individual data for one million adults in 61 prospective studies. Lancet. 2002;360(9349):1903-1913. (PubMed)
75. Winkelmayer WC, Stampfer MJ, Willett WC, Curhan GC. Habitual caffeine intake and the risk of hypertension in women. JAMA. 2005;294(18):2330-2335. (PubMed)
76. Jee SH, He J, Appel LJ, Whelton PK, Suh I, Klag MJ. Coffee consumption and serum lipids: a meta-analysis of randomized controlled clinical trials. Am J Epidemiol. 2001;153(4):353-362. (PubMed)
77. Splaver A, Lamas GA, Hennekens CH. Homocysteine and cardiovascular disease: biological mechanisms, observational epidemiology, and the need for randomized trials. Am Heart J. 2004;148(1):34-40. (PubMed)
78. Husemoen LL, Thomsen TF, Fenger M, Jorgensen T. Effect of lifestyle factors on plasma total homocysteine concentrations in relation to MTHFR(C677T) genotype. Eur J Clin Nutr. 2004;58(8):1142-1150. (PubMed)
79. Mennen LI, de Courcy GP, Guilland JC, et al. Homocysteine, cardiovascular disease risk factors, and habitual diet in the French Supplementation with Antioxidant Vitamins and Minerals Study. Am J Clin Nutr. 2002;76(6):1279-1289. (PubMed)
80. de Bree A, Verschuren WM, Blom HJ, Kromhout D. Lifestyle factors and plasma homocysteine concentrations in a general population sample. Am J Epidemiol. 2001;154(2):150-154. (PubMed)
81. Stolzenberg-Solomon RZ, Miller ER, 3rd, Maguire MG, Selhub J, Appel LJ. Association of dietary protein intake and coffee consumption with serum homocysteine concentrations in an older population. Am J Clin Nutr. 1999;69(3):467-475. (PubMed)
82. Nygard O, Refsum H, Ueland PM, et al. Coffee consumption and plasma total homocysteine: The Hordaland Homocysteine Study. Am J Clin Nutr. 1997;65(1):136-143. (PubMed)
83. Christensen B, Mosdol A, Retterstol L, Landaas S, Thelle DS. Abstention from filtered coffee reduces the concentrations of plasma homocysteine and serum cholesterol--a randomized controlled trial. Am J Clin Nutr. 2001;74(3):302-307. (PubMed)
84. Urgert R, van Vliet T, Zock PL, Katan MB. Heavy coffee consumption and plasma homocysteine: a randomized controlled trial in healthy volunteers. Am J Clin Nutr. 2000;72(5):1107-1110. (PubMed)
85. Grubben MJ, Boers GH, Blom HJ, et al. Unfiltered coffee increases plasma homocysteine concentrations in healthy volunteers: a randomized trial. Am J Clin Nutr. 2000;71(2):480-484. (PubMed)
86. Chelsky LB, Cutler JE, Griffith K, Kron J, McClelland JH, McAnulty JH. Caffeine and ventricular arrhythmias. An electrophysiological approach. JAMA. 1990;264(17):2236-2240. (PubMed)
87. Myers MG. Caffeine and cardiac arrhythmias. Ann Intern Med. 1991;114(2):147-150. (PubMed)
88. Frost L, Vestergaard P. Caffeine and risk of atrial fibrillation or flutter: the Danish Diet, Cancer, and Health Study. Am J Clin Nutr. 2005;81(3):578-582. (PubMed)
89. Wilhelmsen L, Rosengren A, Lappas G. Hospitalizations for atrial fibrillation in the general male population: morbidity and risk factors. J Intern Med. 2001;250(5):382-389. (PubMed)
90. Nawrot P, Jordan S, Eastwood J, Rotstein J, Hugenholtz A, Feeley M. Effects of caffeine on human health. Food Addit Contam. 2003;20(1):1-30. (PubMed)
91. Cnattingius S, Signorello LB, Anneren G, et al. Caffeine intake and the risk of first-trimester spontaneous abortion. N Engl J Med. 2000;343(25):1839-1845. (PubMed)
92. Giannelli M, Doyle P, Roman E, Pelerin M, Hermon C. The effect of caffeine consumption and nausea on the risk of miscarriage. Paediatr Perinat Epidemiol. 2003;17(4):316-323. (PubMed)
93. Rasch V. Cigarette, alcohol, and caffeine consumption: risk factors for spontaneous abortion. Acta Obstet Gynecol Scand. 2003;82(2):182-188. (PubMed)
94. Wen W, Shu XO, Jacobs DR, Jr., Brown JE. The associations of maternal caffeine consumption and nausea with spontaneous abortion. Epidemiology. 2001;12(1):38-42. (PubMed)
95. Weng X, Odouli R, Li DK. Maternal caffeine consumption during pregnancy and the risk of miscarriage: a prospective cohort study. Am J Obstet Gynecol. 2008;198(3):279 e271-278. (PubMed)
96. Fenster L, Hubbard AE, Swan SH, et al. Caffeinated beverages, decaffeinated coffee, and spontaneous abortion. Epidemiology. 1997;8(5):515-523. (PubMed)
97. Mills JL, Holmes LB, Aarons JH, et al. Moderate caffeine use and the risk of spontaneous abortion and intrauterine growth retardation. JAMA. 1993;269(5):593-597. (PubMed)
98. Savitz DA, Chan RL, Herring AH, Howards PP, Hartmann KE. Caffeine and miscarriage risk. Epidemiology. 2008;19(1):55-62. (PubMed)
99. Klebanoff MA, Levine RJ, DerSimonian R, Clemens JD, Wilkins DG. Maternal serum paraxanthine, a caffeine metabolite, and the risk of spontaneous abortion. N Engl J Med. 1999;341(22):1639-1644. (PubMed)
100. Leviton A, Cowan L. A review of the literature relating caffeine consumption by women to their risk of reproductive hazards. Food Chem Toxicol. 2002;40(9):1271-1310. (PubMed)
101. Bracken MB, Triche E, Grosso L, Hellenbrand K, Belanger K, Leaderer BP. Heterogeneity in assessing self-reports of caffeine exposure: implications for studies of health effects. Epidemiology. 2002;13(2):165-171. (PubMed)
102. Martin TR, Bracken MB. The association between low birth weight and caffeine consumption during pregnancy. Am J Epidemiol. 1987;126(5):813-821. (PubMed)
103. Peacock JL, Bland JM, Anderson HR. Effects on birthweight of alcohol and caffeine consumption in smoking women. J Epidemiol Community Health. 1991;45(2):159-163. (PubMed)
104. Bracken MB, Triche EW, Belanger K, Hellenbrand K, Leaderer BP. Association of maternal caffeine consumption with decrements in fetal growth. Am J Epidemiol. 2003;157(5):456-466. (PubMed)
105. Bech BH, Obel C, Henriksen TB, Olsen J. Effect of reducing caffeine intake on birth weight and length of gestation: randomised controlled trial. BMJ. 2007;334(7590):409. (PubMed)
106. Christian MS, Brent RL. Teratogen update: evaluation of the reproductive and developmental risks of caffeine. Teratology. 2001;64(1):51-78. (PubMed)
107. Browne ML. Maternal exposure to caffeine and risk of congenital anomalies: a systematic review. Epidemiology. 2006;17(3):324-331. (PubMed)
108. American Academy of Pediatrics Committee on Drugs. Transfer of drugs and other chemicals into human milk. Pediatrics. 2001;108(3):776-789. (PubMed)
109. Novak K, ed. Drug Facts and Comparisons. St. Louis: Wolters Kluwer Health; 2005.
110. Engebretsen KM, Harris CR. Caffeine and Related Nonprescription Sympathomimetics. In: Ford MD, Delaney KA, Ling LJ, Erickson T, eds. Clinical Toxicology. Philadelphia: W. B. Saunders; 2001:310-315.
111. Juliano LM, Griffiths RR. A critical review of caffeine withdrawal: empirical validation of symptoms and signs, incidence, severity, and associated features. Psychopharmacology (Berl). 2004;176(1):1-29. (PubMed)
112. Dews PB, Curtis GL, Hanford KJ, O'Brien CP. The frequency of caffeine withdrawal in a population-based survey and in a controlled, blinded pilot experiment. J Clin Pharmacol. 1999;39(12):1221-1232. (PubMed)
113. Carrillo JA, Benitez J. Clinically significant pharmacokinetic interactions between dietary caffeine and medications. Clin Pharmacokinet. 2000;39(2):127-153. (PubMed)
114. Faber MS, Fuhr U. Time response of cytochrome P450 1A2 activity on cessation of heavy smoking. Clin Pharmacol Ther. 2004;76(2):178-184. (PubMed)
115. Barger-Lux MJ, Heaney RP. Caffeine and the calcium economy revisited. Osteoporos Int. 1995;5(2):97-102. (PubMed)
116. Hasling C, Sondergaard K, Charles P, Mosekilde L. Calcium metabolism in postmenopausal osteoporotic women is determined by dietary calcium and coffee intake. J Nutr. 1992;122(5):1119-1126. (PubMed)
117. Heaney RP. Effects of caffeine on bone and the calcium economy. Food Chem Toxicol. 2002;40(9):1263-1270. (PubMed)
118. Harris SS, Dawson-Hughes B. Caffeine and bone loss in healthy postmenopausal women. Am J Clin Nutr. 1994;60(4):573-578. (PubMed)
119. Rapuri PB, Gallagher JC, Kinyamu HK, Ryschon KL. Caffeine intake increases the rate of bone loss in elderly women and interacts with vitamin D receptor genotypes. Am J Clin Nutr. 2001;74(5):694-700. (PubMed)
120. Fujiwara S, Kasagi F, Yamada M, Kodama K. Risk factors for hip fracture in a Japanese cohort. J Bone Miner Res. 1997;12(7):998-1004. (PubMed)
121. Huopio J, Kroger H, Honkanen R, Saarikoski S, Alhava E. Risk factors for perimenopausal fractures: a prospective study. Osteoporos Int. 2000;11(3):219-227. (PubMed)
122. Meyer HE, Pedersen JI, Loken EB, Tverdal A. Dietary factors and the incidence of hip fracture in middle-aged Norwegians. A prospective study. Am J Epidemiol. 1997;145(2):117-123. (PubMed)
123. Kiel DP, Felson DT, Hannan MT, Anderson JJ, Wilson PW. Caffeine and the risk of hip fracture: the Framingham Study. Am J Epidemiol. 1990;132(4):675-684. (PubMed)
124. Hernandez-Avila M, Colditz GA, Stampfer MJ, Rosner B, Speizer FE, Willett WC. Caffeine, moderate alcohol intake, and risk of fractures of the hip and forearm in middle-aged women. Am J Clin Nutr. 1991;54(1):157-163. (PubMed)
125. Cummings SR, Nevitt MC, Browner WS, et al. Risk factors for hip fracture in white women. Study of Osteoporotic Fractures Research Group. N Engl J Med. 1995;332(12):767-773. (PubMed)
126. Hallstrom H, Wolk A, Glynn A, Michaelsson K. Coffee, tea and caffeine consumption in relation to osteoporotic fracture risk in a cohort of Swedish women. Osteoporos Int. 2006;17(7):1055-1064. (PubMed)
127. Fairweather-Tait SJ. Iron nutrition in the UK: getting the balance right. Proc Nutr Soc. 2004;63(4):519-528. (PubMed)
128. Morck TA, Lynch SR, Cook JD. Inhibition of food iron absorption by coffee. Am J Clin Nutr. 1983;37(3):416-420. (PubMed)
129. Hallberg L, Rossander L. Effect of different drinks on the absorption of non-heme iron from composite meals. Hum Nutr Appl Nutr. 1982;36(2):116-123. (PubMed)
茶飲料
要約
- 茶飲料は、学名カメリア・シネンシスという植物の葉を煎じた液体で、いわゆる「ハーブ」茶と混同してはいけない。
- 茶飲料に含まれる生物活性化学物質は、フラボノイド、カフェイン、およびフッ化物である。(詳細はこちら)
- 全体的に、ヒトにおける観察研究では、少なくとも毎日3杯を飲用すると心筋梗塞のリスクをやや(11%)減少させる可能性がある。(詳細はこちら)
- 動物実験の結果が有望であるにもかかわらず、茶飲料の摂取を増やすとヒトのガン予防に役立つかは不明である。(詳細はこちら)
- 茶飲料の摂取が骨密度と正の相関があるとする研究もあるが、茶飲料の摂取が骨粗しょう症による骨折のリスクを減少させるかは不明である。(詳細はこちら)
- 茶飲料の摂取が虫歯を減少させ腎臓結石をわずかに減少させる可能性があるという限定的な研究もあるが、これらの結果を確認するにはさらなる研究が必要である。(詳細はこちら)
- 茶飲料や茶の抽出物が体重減少を促すかは現在では不明である。これにはエネルギー摂取とエネルギー消費を管理した大規模臨床試験が必要である。(詳細はこちら)
序論
茶飲料は学名カメリア・シネンシスという植物の葉を煎じた液体で、水以外では世界中で最も広く摂取されている飲料である(1)。ハーブ茶は、カメリア・シネンシス以外の植物やハーブを煎じたもので、ここでは論じない。茶飲料はカフェインやフッ化物などの生物活性のある化学物質をいくつか含んでいるが、茶飲料に含まれるフラボノイドとして知られる種類の化合物が持つ潜在的健康効果には特に関心が持たれている。多くの文化で、茶飲料は食事性フラボノイドの重要な摂取源である。
定義
茶飲料の種類
すべての茶飲料はカメリア・シネンシスの葉から作られるが、製造方法の違いで茶飲料の種類も異なる。新鮮な茶葉はカテキン(図1参照)というフラボノイドが豊富である。茶葉は、カテキンとは別に仕切られた部分にポリフェノール酸化酵素も含む。製造過程で故意に茶葉を破砕したり丸めたりすると、ポリフェノール酸化酵素との接触によってカテキンが結合し、テアフラビンおよびテアルビジンという二重体および重合体を作る(図2参照)。この酸化過程は、製茶業では(間違って)「発酵」として知られている。茶葉を蒸したり焙じたりするとポリフェノール酸化酵素が不活性化し、酸化を止める(2)。茶飲料には数千の種類があるが、製造過程での酸化の具合で3つのグループに分けられる。


白茶および緑茶
白茶は芽や若い葉から作られ、蒸したり焙じたりしてポリフェノール酸化酵素を不活性化し、その後乾燥させる。したがって、酸化の度合いが最低限であるので、新鮮な茶葉に含まれるカテキンを高濃度のまま保持している。緑茶は白茶より成熟した茶葉から作られ、茶葉を蒸したり焙じたりする前にしおれさせることもある。やはりカテキンが豊富ではあるが、緑茶は白茶とはカテキンの特性が異なっていることがあり、酸化物の濃度が少し高い(3)。
ウーロン茶
ウーロン茶に使用される茶葉は、茶葉に含まれるポリフェノール酸化酵素を一部出すために「傷つけ」られる。加熱され乾燥される前に、ウーロン茶は白茶や緑茶よりも酸化されるが、酸化の時間は紅茶よりは短い。したがって、ウーロン茶のカテキン、テアフラビン、およびテアルビジンの濃度は、緑茶/白茶と完全に酸化された紅茶の間にあることが一般的である(2)。
紅茶
紅茶を作る茶葉は十分に丸めるか破砕されるかして、カテキンとポリフェノール酸化酵素の相互作用を最大化する。乾燥の前に完全に酸化されているので、紅茶はテアフラビンとテアルビジンが豊富だが、EGCGなどの単量体カテキンは比較的少ないものがほとんどである(下の項目を参照)(4)。
カップの大きさ
一杯がどのくらいかは国や地域によって異なる。日本では緑茶一杯は典型的に100mlしかないこともある。伝統的なヨーロッパのティーカップは約125~150mlであり、マグカップでは235mlかそれ以上である。
茶飲料の生物活性物質
フラボノイド
フラバノールは全種の茶飲料で一番豊富に含まれる種類のフラボノイドである(上記の「茶飲料の種類」参照)。フラバノール単量体はカテキンとしても知られる。白茶および緑茶に含まれる主なカテキンは、エピカテキン(EC)、エピガロカテキン(EGC)、エピカテキンガレート(ECG)、およびエピガロカテキンガレート(EGCG)である(図1参照)(2)。ウーロン茶と紅茶では、テアフラビンおよびテアルビジンがより豊富である(図2参照)。茶飲料は、フラボノールと呼ばれる他種のフラボノイドを摂取するのによい。茶飲料のフラボノールは、ケンフェロール、ケルセチン、ミリセチンなどを含む(図3参照)。フラボノールの含有量は製造工程に最低限しか左右されないので、相当量のフラボノールが全種の茶飲料に含まれる。フラバノールと異なり、フラボノールは通常(糖分子に結合している)グリコシドとして茶飲料に含まれる。フラボノイドに関する詳細情報は、「食事性フラボノイド」の項を参照のこと。

カフェイン
すべての茶飲料は、製造工程で意図的にカフェインを取り除かない限りカフェインを含む。カフェイン含有量は茶飲料の種類によってかなり違うことがあり、煎じる時間、茶葉の量、煎じる水、および茶葉がティーバッグに入っているか否かといった要素に影響される。一般に、マグカップ1杯の茶飲料は、マグカップ1杯のコーヒーの約半分のカフェインを含む(4)。包装の説明書に従って淹れた20以上の緑茶および紅茶のカフェイン含有量を下の表に示す(5)。ウーロン茶のカフェイン含有量は緑茶のそれに匹敵する(6)。白茶はしばしば緑茶と同様に分類されるため、白茶のカフェイン含有量の情報はほとんどない。芽や若い葉は成長した葉よりもカフェイン含有量が多いことが知られており(7)、ある白茶のカフェイン含有量は緑茶よりも若干高い可能性がある(3)。
| 茶飲料の種類 | カフェイン(mg/l) | カフェイン(mg/235ml) |
|---|---|---|
| 緑茶 | 40-234 | 9-63 |
| 紅茶 | 177-333 | 42-79 |
| ドリップコーヒー | 306-553 | 72-130 |
フッ化物
茶の木は葉にフッ化物を蓄積する。一般に、葉が古いほど多くのフッ化物を含む(9)。最も高級な茶飲料は芽や初めの二葉または四つ葉、つまり一番若い葉から作られる。低品質のたん茶は最も古い葉から作られ、フッ化物含有量がとても高いことが多い。フッ化物の過剰摂取の症状(歯や骨のフッ素沈着症)は、チベットの子供やたん茶を大量に摂取する成人に見られる(10,11)。たん茶と異なり、緑茶、ウーロン茶、および紅茶のフッ化物濃度は、虫歯予防に推奨される濃度に一般的に匹敵する。したがって、緑茶、ウーロン茶、または紅茶を毎日最大1リットルまで飲んでも、口腔衛生のために推奨される量よりも多くフッ化物を摂取することにはなりにくい(12,13)。白茶は茶の木の最も若い葉や芽から作られるので、白茶のフッ化物含有量は他の茶飲料よりも少ないであろう。17のブランドの緑茶、ウーロン茶、紅茶のフッ化物含有量を下の表に示す(12)。これらの数字は、茶飲料を淹れるのに使った水に含まれるフッ化物の量は含まない。詳細については、フッ化物の項を参照のこと。
| 茶飲料の種類 | フッ化物(mg/l)* | フッ化物(mg/235ml) |
|---|---|---|
| 緑茶 | 1.2-1.7 | 0.3-0.4 |
| ウーロン茶 | 0.6-1.0 | 0.1-0.2 |
| 紅茶 | 1.0-1.9 | 0.2-0.5 |
| たん茶 | 2.2-7.3 | 0.5-1.7 |
| *5分から360分継続して抽出した重量/体積パーセント濃度1%の茶飲料に含まれるフッ化物 | ||
疾病予防
心血管疾患
疫学的研究
茶飲料の摂取と、心筋梗塞や脳卒中を含む心血管疾患の発現の関連について、多くの疫学的研究がなされてきた。10の前向きコホート研究と7の症例対照研究の結果をまとめたメタ解析では、毎日マグカップ3杯(約680ml)の茶飲料摂取を増やすと、心筋梗塞のリスクが11%減った(14)。しかしながら、これらの結果の解釈には注意が必要である。なぜならば、予防効果を示唆する研究結果発表への偏向が入っているからである。それ以来、その他の前向きコホート研究の結果はまちまちである。オランダ人男女を対象とした6年間の研究では、毎日少なくとも3杯(約370ml)以上を摂取した者は、まったく飲まない者に比べて心筋梗塞のリスクがぐっと減った(15)。米国の女性を対象にした7年間の研究では、重大な血管疾患(心筋梗塞、脳卒中、または心血管疾患による死亡)のリスクが、毎日少なくとも4杯の紅茶を飲む少数の女性にはかなり少なかった(16)。しかしながら、このグループの人数がとても限られていたため、この結果の重要性は不明である。米国人男性を対象とした15年間の研究では、茶飲料の摂取と心血管疾患のリスクに関連は見られなかったが、このグループでの茶飲料の摂取は平均で一日あたり1杯と比較的少ない(17)。全体的に、紅茶を毎日少なくとも3杯以上摂取すると、心筋梗塞のリスクがやや減る可能性があることが過去の研究で示唆されている。40,530人の日本人成人を対象にした最近の前向きコホート研究では、すべての死因や心血管にまつわる死亡率の減少と緑茶の摂取に関連があると報告されている(18)。特に、毎日1杯未満しか茶飲料を飲まない場合と比べて、毎日5杯以上の緑茶を飲むと、すべての死因による死亡率で16%、心血管疾患による死亡率で26%の減少が見られた。どちらも女性の方が男性よりもこの関連が強く、心血管疾患の中でも脳卒中による死亡率との負の相関性が一番強かった(18)。したがって、緑茶の摂取は心血管疾患の発症を防ぐ可能性があるが、確固たる結論を出すにはさらなる研究が必要である。
内皮機能(血管の拡張)
血管の内皮細胞は、動脈の弛緩(血管拡張)を促す化合物である一酸化窒素を生成することで、心臓血管の健康状態を維持するのに重要な役割を果たしている(19)。内皮での一酸化窒素生成による動脈の血管拡張は、内皮依存性血管拡張と呼ばれる。2つの対照臨床試験の結果から、4週間にわたって毎日4~5杯(900~1,250ml)の紅茶を摂取すると、同等のカフェインのみか白湯を摂取した場合に比べて、冠動脈疾患(20)や、血清コレステロール濃度(21)がやや高い患者の内皮依存性血管拡張が著しく改善した。この改善は、同量の白湯の場合と比べて顕著であった。これらの研究の中の1つでは、茶飲料と同等のカフェインは内皮依存性血管拡張には何らの短期的効果もなかった。したがって、茶飲料のカフェイン以外の成分が、報告された短期的血管拡張に有効である可能性がある。実際、茶飲料に含まれるフラボノイドはそのような効果を及ぼす可能性がある(22)。詳細はフラボノイドの項を参照されたい。緑茶またはその主要なカテキンであるEGCGが同様の血管拡張効果を持つ可能性があることを示すいくつかの小規模な研究もある(23-25)。茶飲料の摂取による血管内皮機能に対する薬効で、いくつかの疫学的研究に見られる心血管疾患リスクの穏やかな低下が説明しやすくなるのかもしれない。
がん
動物試験
緑茶や紅茶は、皮膚がん、肺がん、口腔がん、食道がん、胃がん、大腸がん、すい臓がん、膀胱がん、および前立腺がんを含む様々な動物モデルにおいてがん予防活性を持つことが知られている(26,27)。加えて、白茶と緑茶はマウスの腸ポリープを抑制することが示された。(「Tea Compliments Drugs in Fight Against Colon Cancer」を参照。)ほとんどの場合、茶飲料のがん予防効果にはフラボノイドが著しく貢献しているようである。しかし、皮膚がん(28)、肺がん(29)、および大腸がん(30)の動物モデルでカフェインもがん予防効果があることが知られている。茶飲料のフラボノイドの薬効は、しばしばその酸化防止活性によるものだとされてきた。しかし、ヒトの血漿および組織の酸化防止活性における茶飲料フラボノイドの全体的な貢献は、最近では比較的小さいと考えられている(31)。現在では、茶飲料のフラボノイドが健康な細胞からがん細胞への変化を促す細胞信号伝達経路を調整する可能性が注目されている(32,33)。フラボノイドの生物活性に関する詳細は、「食事性フラボノイド」の項を参照のこと。
疫学的研究
動物試験での有望な結果にもかかわらず、茶飲料の摂取を増やすとヒトのがん予防に役立つかは不明である。異なる種類のがんについての多数の疫学的研究の結果では、緑茶や紅茶の摂取ががんのリスクの大幅な低下と関連するという一貫した根拠はない(34)。40,530人の日本人成人が参加した大崎国民健康保険加入者コホート研究という最近の前向きコホート研究では、全体的ながんの死亡率、または胃がん、肺がん、結腸直腸がんによる死亡率と緑茶の摂取は関係がなかったと報告されている(18)。茶飲料は消化管と直接接触するので、茶飲料の摂取を増やすことが胃がんおよび大腸がんの予防になるのかに特に関心が集まった。緑茶を多く摂取すると胃がんのリスクが減るという症例対照研究もあったが、前向きコホート研究では日本人男性および女性における茶飲料の摂取と胃がんリスクの逆相関という結果は支持されていない(35-39)。大腸がんの動物モデルにおける有望な発見(40)にもかかわらず、大部分の疫学的研究は、茶飲料の摂取が結腸直腸がんのリスク低下に関連するという結果になっていない(41,42)。症例対照および前向き研究のメタ解析は、現在あるデータでは緑茶または紅茶が結腸直腸がんを予防するとは示されていないと結論づけている(43)。より新しくは、160万人以上の参加者による51の研究の再調査で、緑茶の摂取が様々ながんを予防するという説得力のある根拠はないと結論づけられた(84)。
がんの動物モデルからの発見とヒトでの疫学的研究とのずれには、いくつかの理由が考えられる。種の違いによる潜在的な理由は別として、血漿および組織での茶飲料のフラボノイド濃度が予防効果を実際に現すほど十分になるまで茶飲料を飲むのは難しい可能性がある。一般に、フラボノイドは急速に代謝され体内から排出されるが、これにはかなりの個人差がある(44)。カテコール-O-メチル基転移酵素(COMT)は、フラボノイドの代謝に関わる酵素の1つである。COMTの遺伝子には、低活性型と高活性型の2つの形態がある。症例対照研究では、緑茶の摂取が多いと、少なくとも1つの低活性型COMTの遺伝子を持つ女性のみに乳がんリスクが低下する相関が見られた。これは、緑茶のフラボノイドを除去するのがより非効率な者は、茶飲料の摂取が有益である可能性を示す(45)。茶飲料の摂取とがんのリスクとの関係は複雑であろうから、茶飲料の摂取とがん予防に関して特定の推奨がなされる前に、さらなる研究が必要である。詳細な議論は、ライナス・ポーリング研究所のニュースレターに掲載のRoderick H. Dashwoodの「Tea and Cancer」および「Tea Time」という2つの記事を参照されたい。
骨粗しょう症
骨粗しょう症の発症には、栄養、運動、および遺伝的要因を含む多くの要因が影響する。カフェイン、フッ化物、およびフラボノイドといった茶飲料の成分は、骨密度(BMD)に影響する可能性がある(46)。紅茶の摂取が米国人女性の骨密度を若干低下させたという横断研究が1つだけある(47)。しかし他の3つの横断研究では、習慣的に茶飲料を摂取することと、英国人女性(48)、カナダ人女性(49)、および台湾人男女(46)で骨密度がより高いこととが関連しているとわかった。164人の年配の女性による前向き研究では、茶飲料の摂取は加齢による大腿骨近位部骨密度の減少を鈍らせるとの結果になった(50)。股関節骨折は、骨粗しょう症の最も重篤な結果の一つである。地中海諸国の大規模な症例対照研究では、茶飲料の摂取が少ないと、男性(51)および女性(52)の股関節骨折リスクが高まるとわかった。しかしながら、米国人女性を4~6年にわたって追跡した2つの大規模前向きコホート研究では、茶飲料の摂取と股関節または手関節骨折には何の関係もなかった(53,54)。これらの2つの研究の最新結果では、茶飲料の摂取が多いと閉経後の女性の骨密度が若干上昇するとわかったが、この発見が股関節や手関節の骨折リスクにそのまま当てはまるわけではない(53)。茶飲料の摂取が骨粗しょう症の発症や骨粗しょう症による骨折に有意に影響しているのかを決定するには、さらなる研究が必要である。
虫歯
茶飲料のフッ化物濃度は、米国で虫歯を予防するための水道水供給に推奨されている濃度に匹敵する(55)。緑茶、紅茶、およびウーロン茶の抽出物は、試験管内で虫歯を作るバクテリアの成長や酸の生成を抑制することが知られていた(56-58)。動物モデルでは茶飲料の抽出物が虫歯を予防したり減らしたりすることが報告されているものの、ヒトの虫歯に対する茶飲料の摂取の効果を調べた研究報告はほとんどない。14歳の子供6,000人以上を対象にした英国での横断研究で、茶飲料を摂取する者はそうでない者よりかなり虫歯が少なかった。この結果は、茶飲料に砂糖を入れるかどうかには無関係であった(60)。虫歯についての詳細は、「フッ化物」の項を参照されたい。
腎臓結石
2つの大規模前向き研究では、腎臓結石の兆候の発現リスクは、毎日茶飲料をマグカップ1杯(235ml)飲むことで、女性で8%(61)、男性で14%(62)減少した。マウスを使った研究では、緑茶の抗酸化物質がシュウ酸カルシウムの沈殿析出とそれによる腎臓結石の形成を抑制している可能性があるとしている(63)。これらの発見が、シュウ酸カルシウム結石の病歴がある個人にどのような意味があるかは不明である。茶飲料を含む水分摂取を多くすることは、一般的に最も効果的で経済的な腎臓結石の予防方法であると考えられている(64)。しかしながら、茶飲料の摂取は健康な個人の尿中シュウ酸塩濃度を上げることわかっており(65)、シュウ酸カルシウム結石の病歴のある者は茶飲料の摂取を制限するべきであると勧め続けている専門家もいる(66)。
体重減少
体重減少は、長期的なエネルギー摂取の減少やエネルギー消費の増加によってなされるものである。いくつかの小規模な短期的試験では、ウーロン茶(67,68)または緑茶(69)の抽出物の摂取でエネルギー消費が3~4%とやや増加したとの報告がある。しかしながら、これらの研究のどれもが特に体重減少を評価しようと考えられたものではない。最近では、非常に低カロリーの食事を4週間守って体重を平均で7.5%減少させた過体重の男女による臨床試験で、(573mg/日のカテキンと104mg/日のカフェインを含む)緑茶抽出物カプセルはプラセボと比べてその後8週間の体重リバウンドを防ぐ効果は特になかった(70)。同じ研究者グループによる追跡調査では、習慣的なカフェイン摂取が少ない者(300mg/日未満)は体重減少後の体重リバウンドが緑茶抽出物のサプリメントで予防されたが、習慣的にカフェインを多く摂取している者(300mg/日より多い)はそうではなかったと報告している(71)。35人の過体重の男性による12週間にわたる最近の介入試験では、緑茶抽出物(690mg/日のカテキン)を豊富に含むウーロン茶を与えられた者は、ふつうのウーロン茶(33mg/日のカテキン)を与えられた者よりも、体重、肥満度指数(BMI)、腹囲、体脂肪量、および皮下脂肪面積の有意な減少がみられたと報告された(72)。茶飲料または茶抽出物がヒトの体重減少を促進したり体重維持をよくしたりするかを決定するには、エネルギー摂取と運動をコントロールした大規模介入試験が必要である。興味深いことに、動物モデルの研究では、緑茶、紅茶、またはカフェイン含有水溶液を飲ませたマウスの組織脂肪のレベルが低下したと示されている(28)。
安全性
悪影響
茶飲料
茶飲料は、大量に摂取しても一般に安全であると考えられている。しかしながら、年配者の低カリウム血症(血清カリウム濃度が異常に低い状態)が2件あり、これは紅茶やウーロン茶を過剰に(3~14リットル/日)摂取したことによるものである(73,74)。低カリウム血症は、カフェインの毒性に関連して命にかかわる危険性もある状態である。
茶抽出物
カフェイン添加した緑茶抽出物を用いた臨床試験では、6g/日を3~6回に分けて摂取したがん患者には、吐き気、嘔吐、腹痛、および下痢といった軽度または中度の胃腸への副作用があった(75,76)。激越(感情の昂ぶり)、不穏状態、不眠、振戦(ふるえ)、めまい、および錯乱といった中枢神経系の症状も報告されている。あるケースでは、錯乱状態がひどく入院が必要であった(75)。これらの副作用は、緑茶抽出物に含まれるカフェインに関連している可能性が高い(76)。健康な個人でカフェイン除去した緑茶抽出物(800mg/日のEGCG)の安全性を4週間調べた臨床試験では、軽度の吐き気、胃のむかつき、めまい、または筋肉痛を報告した参加者が少数いた(77)。
妊娠期および授乳期
妊娠中または母乳を授乳中の女性に対する茶抽出物またはそのサプリメントの安全性は確立していない。カフェイン摂取を300mg/日までに制限するように妊婦に勧める機関もある。これは、カフェイン摂取量が多いと流産や低出生体重になるリスクが高くなるという疫学的研究があるためである(78)。
薬物相互作用
緑茶
緑茶の過剰摂取は、抗凝固剤であるワルファリン(クマジン)の治療効果を下げる可能性がある。そのような効果は、1.9~3.8リットルの緑茶を毎日飲むようになったある患者について報告された(79)。ワルファリンで治療している者が緑茶を完全に避ける必要はないであろうが、大量の緑茶はその効果を下げる可能性がある(80)。
カフェイン
かなりの薬物はカフェインの代謝を損なう可能性があり、カフェインによる悪影響を増長させる危険性がある(81)。そのような薬物には、シメチジン(タガメット)、ジスルフィラム(アンタビュース)、エストロゲン、フルオロキノロン系抗生物質(シプロフロキサシン、エノキサシン、ノルフロキサシンなど)、フルコナゾール(ジフルカン)、フルボキサミン(ルボックス)、メキシレチン(メキシチール)、リルゾール(リルテック)、テルビナフィン(ラミシール)、およびベラパミル(カラン)などがある。カフェインの摂取が多いと、アルブテロール(アルーペント)、クロザピン(クロザリル)、エフェドリン、エピネフリン、モノアミン酸化酵素阻害薬、フェニルプロパノールアミン、およびテオフィリンなどの薬物の毒性を増長する可能性がある。リチウムを摂取している者は、急にカフェイン摂取をやめると血清リチウム濃度が増加することが知られており、リチウム毒性を高める可能性がある。
栄養素との相互作用
ノンヘム鉄
茶飲料のフラボノイドはノンヘム鉄と結合し、小腸でのノンヘム鉄の吸収を阻害する可能性がある。ノンヘム鉄は、植物性食品、乳製品、および鉄のサプリメントに含まれる鉄の主要な形態である。食事と一緒に1杯の茶飲料を摂取すると、その食事に含まれるノンヘム鉄の吸収を約70%減らすことがわかっている(82,83)。食事や鉄のサプリメントからの鉄の吸収を最大化するには、茶飲料を同時に摂取してはいけない。
Authors and Reviewers
Originally written by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in January 2005 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in January 2008 by:
Victoria J. Drake, Ph.D.
Linus Pauling Institute
Oregon State University
Reviewed in January 2008 by:
Roderick H. Dashwood, Ph.D.
Director, Cancer Chemoprotection Program, Linus Pauling Institute
Professor of Environmental & Molecular Toxicology
Oregon State University
Copyright 2002-2024 Linus Pauling Institute
References
1. Graham HN. Green tea composition, consumption, and polyphenol chemistry. Prev Med. 1992;21(3):334-350. (PubMed)
2. Balentine DA, Paetau-Robinson I. Tea as a source of dietary antioxidants with a potential role in prevention of chronic diseases. In: Mazza G, Oomah BD, eds. Herbs, Botanicals, & Teas. Lancaster: Technomic Publishing Co., Inc.; 2000:265-287.
3. Santana-Rios G, Orner GA, Amantana A, Provost C, Wu SY, Dashwood RH. Potent antimutagenic activity of white tea in comparison with green tea in the Salmonella assay. Mutat Res. 2001;495(1-2):61-74. (PubMed)
4. Lakenbrink C, Lapczynski S, Maiwald B, Engelhardt UH. Flavonoids and other polyphenols in consumer brews of tea and other caffeinated beverages. J Agric Food Chem. 2000;48(7):2848-2852. (PubMed)
5. Astill C, Birch MR, Dacombe C, Humphrey PG, Martin PT. Factors affecting the caffeine and polyphenol contents of black and green tea infusions. J Agric Food Chem. 2001;49(11):5340-5347. (PubMed)
6. Lin JK, Lin CL, Liang YC, Lin-Shiau SY, Juan IM. Survey of catechins, gallic acid, and methylxanthines in green, oolong, pu-erh, and black teas. J Agric Food Chem. 1998;46(9):3635-3642.
7. Lin YS, Tsai YJ, Tsay JS, Lin JK. Factors affecting the levels of tea polyphenols and caffeine in tea leaves. J Agric Food Chem. 2003;51(7):1864-1873. (PubMed)
8. McCusker RR, Goldberger BA, Cone EJ. Caffeine content of specialty coffees. J Anal Toxicol. 2003;27(7):520-522. (PubMed)
9. Wong MH, Fung KF, Carr HP. Aluminium and fluoride contents of tea, with emphasis on brick tea and their health implications. Toxicol Lett. 2003;137(1-2):111-120. (PubMed)
10. Cao J, Bai X, Zhao Y, et al. The relationship of fluorosis and brick tea drinking in Chinese Tibetans. Environ Health Perspect. 1996;104(12):1340-1343. (PubMed)
11. Cao J, Zhao Y, Liu J, et al. Brick tea fluoride as a main source of adult fluorosis. Food Chem Toxicol. 2003;41(4):535-542. (PubMed)
12. Fung KF, Zhang ZQ, Wong JWC, Wong MH. Fluoride contents in tea and soil from tea plantations and the release of fluoride into tea liquor during infusion. Environmental Pollution. 1999;104(2):197-205.
13. Cao J, Luo SF, Liu JW, Li YH. Safety evaluation on fluoride content in black tea. Food Chemistry. 2004;88(2):233-236.
14. Peters U, Poole C, Arab L. Does tea affect cardiovascular disease? A meta-analysis. Am J Epidemiol. 2001;154(6):495-503. (PubMed)
15. Geleijnse JM, Launer LJ, Van der Kuip DA, Hofman A, Witteman JC. Inverse association of tea and flavonoid intakes with incident myocardial infarction: the Rotterdam Study. Am J Clin Nutr. 2002;75(5):880-886. (PubMed)
16. Sesso HD, Gaziano JM, Liu S, Buring JE. Flavonoid intake and the risk of cardiovascular disease in women. Am J Clin Nutr. 2003;77(6):1400-1408. (PubMed)
17. Sesso HD, Paffenbarger RS, Jr., Oguma Y, Lee IM. Lack of association between tea and cardiovascular disease in college alumni. Int J Epidemiol. 2003;32(4):527-533. (PubMed)
18. Kuriyama S, Shimazu T, Ohmori K, et al. Green tea consumption and mortality due to cardiovascular disease, cancer, and all causes in Japan: the Ohsaki study. JAMA. 2006;296(10):1255-1265. (PubMed)
19. Vita JA. Tea consumption and cardiovascular disease: effects on endothelial function. J Nutr. 2003;133(10):3293S-3297S. (PubMed)
20. Duffy SJ, Keaney JF, Jr., Holbrook M, et al. Short- and long-term black tea consumption reverses endothelial dysfunction in patients with coronary artery disease. Circulation. 2001;104(2):151-156. (PubMed)
21. Hodgson JM, Puddey IB, Burke V, Watts GF, Beilin LJ. Regular ingestion of black tea improves brachial artery vasodilator function. Clin Sci (Lond). 2002;102(2):195-201. (PubMed)
22. Vita JA. Polyphenols and cardiovascular disease: effects on endothelial and platelet function. Am J Clin Nutr. 2005;81(1 Suppl):292S-297S. (PubMed)
23. Nagaya N, Yamamoto H, Uematsu M, et al. Green tea reverses endothelial dysfunction in healthy smokers. Heart. 2004;90(12):1485-1486. (PubMed)
24. Kim W, Jeong MH, Cho SH, et al. Effect of green tea consumption on endothelial function and circulating endothelial progenitor cells in chronic smokers. Circ J. 2006;70(8):1052-1057. (PubMed)
25. Widlansky ME, Hamburg NM, Anter E, et al. Acute EGCG supplementation reverses endothelial dysfunction in patients with coronary artery disease. J Am Coll Nutr. 2007;26(2):95-102. (PubMed)
26. Lambert JD, Yang CS. Mechanisms of cancer prevention by tea constituents. J Nutr. 2003;133(10):3262S-3267S. (PubMed)
27. Yang CS, Maliakal P, Meng X. Inhibition of carcinogenesis by tea. Annu Rev Pharmacol Toxicol. 2002;42:25-54. (PubMed)
28. Lu YP, Lou YR, Lin Y, et al. Inhibitory effects of orally administered green tea, black tea, and caffeine on skin carcinogenesis in mice previously treated with ultraviolet B light (high-risk mice): relationship to decreased tissue fat. Cancer Res. 2001;61(13):5002-5009. (PubMed)
29. Chung FL, Wang M, Rivenson A, et al. Inhibition of lung carcinogenesis by black tea in Fischer rats treated with a tobacco-specific carcinogen: caffeine as an important constituent. Cancer Res. 1998;58(18):4096-4101. (PubMed)
30. Carter O, Dashwood RH, Wang R, et al. Comparison of white tea, green tea, epigallocatechin-3-gallate, and caffeine as inhibitors of PhIP-induced colonic aberrant crypts. Nutr Cancer. 2007;58(1):60-65. (PubMed)
31. Williams RJ, Spencer JP, Rice-Evans C. Flavonoids: antioxidants or signalling molecules? Free Radic Biol Med. 2004;36(7):838-849. (PubMed)
32. Hou Z, Lambert JD, Chin KV, Yang CS. Effects of tea polyphenols on signal transduction pathways related to cancer chemoprevention. Mutat Res. 2004;555(1-2):3-19. (PubMed)
33. Khan N, Afaq F, Saleem M, Ahmad N, Mukhtar H. Targeting multiple signaling pathways by green tea polyphenol (-)-epigallocatechin-3-gallate. Cancer Res. 2006;66(5):2500-2505. (PubMed)
34. Higdon JV, Frei B. Tea catechins and polyphenols: health effects, metabolism, and antioxidant functions. Crit Rev Food Sci Nutr. 2003;43(1):89-143. (PubMed)
35. Hoshiyama Y, Kawaguchi T, Miura Y, et al. A nested case-control study of stomach cancer in relation to green tea consumption in Japan. Br J Cancer. 2004;90(1):135-138. (PubMed)
36. Koizumi Y, Tsubono Y, Nakaya N, et al. No association between green tea and the risk of gastric cancer: pooled analysis of two prospective studies in Japan. Cancer Epidemiol Biomarkers Prev. 2003;12(5):472-473. (PubMed)
37. Hoshiyama Y, Kawaguchi T, Miura Y, et al. A prospective study of stomach cancer death in relation to green tea consumption in Japan. Br J Cancer. 2002;87(3):309-313. (PubMed)
38. Tsubono Y, Nishino Y, Komatsu S, et al. Green tea and the risk of gastric cancer in Japan. N Engl J Med. 2001;344(9):632-636. (PubMed)
39. Hoshiyama Y, Kawaguchi T, Miura Y, et al. Green tea and stomach cancer--a short review of prospective studies. J Epidemiol. 2005;15 Suppl 2:S109-112. (PubMed)
40. Orner GA, Dashwood WM, Blum CA, Diaz GD, Li Q, Dashwood RH. Suppression of tumorigenesis in the Apc(min) mouse: down-regulation of beta-catenin signaling by a combination of tea plus sulindac. Carcinogenesis. 2003;24(2):263-267. (PubMed)
41. Arab L, Il'yasova D. The epidemiology of tea consumption and colorectal cancer incidence. J Nutr. 2003;133(10):3310S-3318S. (PubMed)
42. Tavani A, Vecchia CL. Coffee, decaffeinated coffee, tea and cancer of the colon and rectum: a review of epidemiological studies, 1990-2003. Cancer Causes Control. 2004;15(8):743-757. (PubMed)
43. Sun CL, Yuan JM, Koh WP, Yu MC. Green tea, black tea and colorectal cancer risk: a meta-analysis of epidemiologic studies. Carcinogenesis. 2006;27(7):1301-1309. (PubMed)
44. Manach C, Scalbert A, Morand C, Remesy C, Jimenez L. Polyphenols: food sources and bioavailability. Am J Clin Nutr. 2004;79(5):727-747. (PubMed)
45. Wu AH, Tseng CC, Van Den Berg D, Yu MC. Tea intake, COMT genotype, and breast cancer in Asian-American women. Cancer Res. 2003;63(21):7526-7529. (PubMed)
46. Wu CH, Yang YC, Yao WJ, Lu FH, Wu JS, Chang CJ. Epidemiological evidence of increased bone mineral density in habitual tea drinkers. Arch Intern Med. 2002;162(9):1001-1006. (PubMed)
47. Hernandez-Avila M, Stampfer MJ, Ravnikar VA, et al. Caffeine and other predictors of bone density among pre- and perimenopausal women. Epidemiology. 1993;4(2):128-134. (PubMed)
48. Hegarty VM, May HM, Khaw KT. Tea drinking and bone mineral density in older women. Am J Clin Nutr. 2000;71(4):1003-1007. (PubMed)
49. Hoover PA, Webber CE, Beaumont LF, Blake JM. Postmenopausal bone mineral density: relationship to calcium intake, calcium absorption, residual estrogen, body composition, and physical activity. Can J Physiol Pharmacol. 1996;74(8):911-917. (PubMed)
50. Devine A, Hodgson JM, Dick IM, Prince RL. Tea drinking is associated with benefits on bone density in older women. Am J Clin Nutr. 2007;86(4):1243-1247. (PubMed)
51. Kanis J, Johnell O, Gullberg B, et al. Risk factors for hip fracture in men from southern Europe: the MEDOS study. Mediterranean Osteoporosis Study. Osteoporos Int. 1999;9(1):45-54. (PubMed)
52. Johnell O, Gullberg B, Kanis JA, et al. Risk factors for hip fracture in European women: the MEDOS Study. Mediterranean Osteoporosis Study. J Bone Miner Res. 1995;10(11):1802-1815. (PubMed)
53. Chen Z, Pettinger MB, Ritenbaugh C, et al. Habitual tea consumption and risk of osteoporosis: a prospective study in the women's health initiative observational cohort. Am J Epidemiol. 2003;158(8):772-781. (PubMed)
54. Hernandez-Avila M, Colditz GA, Stampfer MJ, Rosner B, Speizer FE, Willett WC. Caffeine, moderate alcohol intake, and risk of fractures of the hip and forearm in middle-aged women. Am J Clin Nutr. 1991;54(1):157-163. (PubMed)
55. Trevisanato SI, Kim YI. Tea and health. Nutr Rev. 2000;58(1):1-10. (PubMed)
56. Rasheed A, Haider M. Antibacterial activity of Camellia sinensis extracts against dental caries. Arch Pharm Res. 1998;21(3):348-352. (PubMed)
57. Matsumoto M, Minami T, Sasaki H, Sobue S, Hamada S, Ooshima T. Inhibitory effects of oolong tea extract on caries-inducing properties of mutans streptococci. Caries Res. 1999;33(6):441-445. (PubMed)
58. Hirasawa M, Takada K, Otake S. Inhibition of acid production in dental plaque bacteria by green tea catechins. Caries Res. 2006;40(3):265-270. (PubMed)
59. Linke HA, LeGeros RZ. Black tea extract and dental caries formation in hamsters. Int J Food Sci Nutr. 2003;54(1):89-95. (PubMed)
60. Jones C, Woods K, Whittle G, Worthington H, Taylor G. Sugar, drinks, deprivation and dental caries in 14-year-old children in the north west of England in 1995. Community Dent Health. 1999;16(2):68-71. (PubMed)
61. Curhan GC, Willett WC, Speizer FE, Stampfer MJ. Beverage use and risk for kidney stones in women. Ann Intern Med. 1998;128(7):534-540. (PubMed)
62. Curhan GC, Willett WC, Rimm EB, Spiegelman D, Stampfer MJ. Prospective study of beverage use and the risk of kidney stones. Am J Epidemiol. 1996;143(3):240-247. (PubMed)
63. Itoh Y, Yasui T, Okada A, Tozawa K, Hayashi Y, Kohri K. Preventive effects of green tea on renal stone formation and the role of oxidative stress in nephrolithiasis. J Urol. 2005;173(1):271-275. (PubMed)
64. Borghi L, Meschi T, Schianchi T, et al. Urine volume: stone risk factor and preventive measure. Nephron. 1999;81 Suppl 1:31-37. (PubMed)
65. Massey LK, Roman-Smith H, Sutton RA. Effect of dietary oxalate and calcium on urinary oxalate and risk of formation of calcium oxalate kidney stones. J Am Diet Assoc. 1993;93(8):901-906. (PubMed)
66. Massey LK. Tea oxalate. Nutr Rev. 2000;58(3 Pt 1):88-89. (PubMed)
67. Komatsu T, Nakamori M, Komatsu K, et al. Oolong tea increases energy metabolism in Japanese females. J Med Invest. 2003;50(3-4):170-175. (PubMed)
68. Rumpler W, Seale J, Clevidence B, et al. Oolong tea increases metabolic rate and fat oxidation in men. J Nutr. 2001;131(11):2848-2852. (PubMed)
69. Dulloo AG, Duret C, Rohrer D, et al. Efficacy of a green tea extract rich in catechin polyphenols and caffeine in increasing 24-h energy expenditure and fat oxidation in humans. Am J Clin Nutr. 1999;70(6):1040-1045. (PubMed)
70. Kovacs EM, Lejeune MP, Nijs I, Westerterp-Plantenga MS. Effects of green tea on weight maintenance after body-weight loss. Br J Nutr. 2004;91(3):431-437. (PubMed)
71. Westerterp-Plantenga MS, Lejeune MP, Kovacs EM. Body weight loss and weight maintenance in relation to habitual caffeine intake and green tea supplementation. Obes Res. 2005;13(7):1195-1204. (PubMed)
72. Nagao T, Komine Y, Soga S, et al. Ingestion of a tea rich in catechins leads to a reduction in body fat and malondialdehyde-modified LDL in men. Am J Clin Nutr. 2005;81(1):122-129. (PubMed)
73. Aizaki T, Osaka M, Hara H, et al. Hypokalemia with syncope caused by habitual drinking of oolong tea. Intern Med. 1999;38(3):252-256. (PubMed)
74. Trewby PN, Rutter MD, Earl UM, Sattar MA. Teapot myositis. Lancet. 1998;351(9111):1248. (PubMed)
75. Jatoi A, Ellison N, Burch PA, et al. A phase II trial of green tea in the treatment of patients with androgen independent metastatic prostate carcinoma. Cancer. 2003;97(6):1442-1446. (PubMed)
76. Pisters KM, Newman RA, Coldman B, et al. Phase I trial of oral green tea extract in adult patients with solid tumors. J Clin Oncol. 2001;19(6):1830-1838. (PubMed)
77. Chow HH, Cai Y, Hakim IA, et al. Pharmacokinetics and safety of green tea polyphenols after multiple-dose administration of epigallocatechin gallate and polyphenon E in healthy individuals. Clin Cancer Res. 2003;9(9):3312-3319. (PubMed)
78. Caffeine. The National Toxicology Program Center for the Evaluation of Risks to Human Reproduction [Website]. December 21, 2005. Available at: http://cerhr.niehs.nih.gov/common/caffeine.html. Accessed December 21, 2007.
79. Taylor JR, Wilt VM. Probable antagonism of warfarin by green tea. Ann Pharmacother. 1999;33(4):426-428. (PubMed)
80. Heck AM, DeWitt BA, Lukes AL. Potential interactions between alternative therapies and warfarin. Am J Health Syst Pharm. 2000;57(13):1221-1227. (PubMed)
81. Carrillo JA, Benitez J. Clinically significant pharmacokinetic interactions between dietary caffeine and medications. Clin Pharmacokinet. 2000;39(2):127-153. (PubMed)
82. Hurrell RF, Reddy M, Cook JD. Inhibition of non-haem iron absorption in man by polyphenolic-containing beverages. Br J Nutr. 1999;81(4):289-295. (PubMed)
83. Zijp IM, Korver O, Tijburg LB. Effect of tea and other dietary factors on iron absorption. Crit Rev Food Sci Nutr. 2000;40(5):371-398. (PubMed)
84. Boehm K, Borrelli F, Ernst E, et al. Green tea (Camellia sinensis) for the prevention of cancer. Cochrane Database Syst Rev. 2009;(3):CD005004. (PubMed)
アルコール飲料
目次
要約
- 観察研究では適度のアルコール摂取(男性で2杯以内/日、女性で1杯以内/日)は、心血管疾患および全死因による死亡のリスク低下と一貫して関連があった。(詳細はこちら)
- 適度のアルコール摂取は、冠動脈性疾患(CHD)や虚血性脳卒中のリスク低下と関連があった。(詳細はこちら)
- 観察研究からのエビデンスで、適度のアルコール摂取は2型糖尿病、認知症、および胆石のリスク低下と骨密度の改善に関連があることが示唆された。(詳細はこちら)
- 適度のアルコール摂取でも、女性の乳がん、アルコールに関連する先天性異常、および一部の者のアルコール多飲への進行のリスクが上昇する可能性がある。(詳細はこちら)
- アルコールの多量摂取は、高血圧、脳卒中、不整脈、認知症、事故、ケガ、暴力、および心臓、肝臓、膵臓の損傷のリスク上昇と関連がある。(詳細はこちら)
- アルコールの多量摂取は、口腔がん、喉頭がん、咽頭がん、食道がん、肝臓がん、乳がん、結腸がん、および直腸がんを含む多くのがんのリスク上昇と関連がある。アルコール摂取に喫煙が加わると、口腔がんと食道がんのリスクが大きく上昇する。(詳細はこちら)
- 最少量より多くのアルコールを摂取する者は、400μgの葉酸を含むマルチビタミンを毎日服用して適度の葉酸塩も摂取するように心がけるべきである。(詳細はこちら)
- 適度のアルコール摂取による健康効果よりも健康へのリスクが大きい者がいるというコンセンサスがある。アルコール摂取をひかえるべき者(1,2)は以下のとおり。子供および青少年。妊婦、および妊娠の可能性のある女性。アルコール摂取を適切な量でやめることが困難な者、特にアルコール症から回復中の者やアルコール依存症またはアルコールで問題を起こした家族のいる者。慢性肝臓疾患またはアルコール関連の疾患や損傷のある者。
- 運転したり、重機を操縦したり、調整や技術を要するその他の危険性のある活動に従事する者は、アルコールを摂取すべきでない。
- 適度のアルコール摂取の健康効果や潜在的健康リスクに関する個人的アドバイスで恩恵を受けるのは以下の者である。アルコールとの相互作用で悪影響の可能性がある薬物(店頭で売られているものや処方されたもの)を摂取している者。乳がん、冠動脈性心疾患、または適度の飲酒に良い意味でまたは悪い意味で関連するその他の症状のある者や、家族(両親や兄弟姉妹など)にその履歴のある者。
序説
アルコールの摂取過多は多くの健康上または社会的な問題とつながりがあるものの、観察研究では適度のアルコール摂取がいくつかの重要な健康効果と関連があるとされてきた。アルコール摂取と死亡率との関係はしばしば、グラフの左側の禁酒から右側の深酒に向かってJ字形になるとされており、軽度から適度のアルコール摂取(2杯以下/日)は死亡率-たいていは心血管疾患の死亡率-が禁酒よりも低く、一方で深酒(1日に3-4杯より多い)は、多くの死因で死亡率が高くなる(3-5)。アルコール摂取は「両刃の剣」のようにも見えるため、アルコール摂取に関する個人の決定には、潜在的健康有益性とリスクに関する科学的根拠(エビデンス)と、個人的および家系的健康問題履歴や嗜癖を考慮するべきである。
アルコールと疾患の関係を示すデータは観察研究によるものだけで無作為化対照試験によるものではなく、観察によるデータは因果関係を示せないことに注意することが重要である。観察研究では、統計的技術を使用する際に紛らわしい変数は適切に調整されるべきである。たとえば非飲酒者は、調査対象である疾病の結果に影響するかもしれないような方法でアルコールを摂取する者とは異なることが示されている(6)。紛らわしい可能性のある多くの要素を照査しても、その他の紛らわしい要因がそれでも発生するかもしれない。
定義(7)
標準的アルコール飲料(8)
標準的アルコール飲料1杯は約14gのアルコールを含み、これは約350mlのビール(アルコール濃度約5%)、約250mlのモルトリカー(麦芽酒。アルコール濃度約9%)、約150gのワイン(アルコール濃度約12%)、約100gの強化ワイン(シェリー酒やポートワインなど)、または約45gの蒸留酒(アルコール濃度約40%)に相当する。
適度のアルコール摂取
- 男性:1日に標準的アルコール飲料2杯以内(9)
- 女性:1日に標準的アルコール飲料1杯以内*(9)
- 週全体でのアルコール摂取をほぼ毎日に均等に割り付けることが、最も健康的な飲み方のパターンであるというコンセンサスがある。
深酒(8)
- 男性:週に標準的アルコール飲料14杯超か、1日に標準的アルコール飲料4杯超
- 女性:週に標準的アルコール飲料7杯超か、1日に標準的アルコール飲料3杯超*
*概して体重が男性より少ないことに加えて、女性はアルコールを男性と別様に吸収および代謝する。一般的に、女性は同じような体重の男性よりも体の水分が少なく、男性と同量のアルコールを摂取した後での血中アルコール濃度が高くなる(10)。女性は男性よりも深酒による健康への悪影響を受けやすいようである。したがって、「適度の飲酒」や「深酒」という定義のほとんどで、女性の方がしきい値が低い。
適度のアルコール摂取による潜在的健康効果
死亡率
観察研究のデータは、軽度から適度のアルコール摂取(女性で1杯以下/日、男性で2杯以下/日)はすべての死因に対して防護的であることを示している(4,11-15)。先に述べたように、全死因の死亡率をアルコール摂取に対してグラフにする(横軸の左が禁酒、右が深酒)と、J字形の関係が明白である(4,16)。言い換えれば、適度に飲む者は禁酒の者や深酒をする者に比べてすべての死亡リスクが最も低く、深酒をする者は死亡リスクが最も高い。
適度のアルコール摂取と死亡率の減少の関連は、心血管疾患による死亡(14,16-18)、特に冠動脈性心疾患の死亡の減少によるところが大きい(下記の「心血管疾患」の項参照)。ところが、初期の観察研究では以前飲酒していた者を生涯禁酒の群(つまり基準群)に間違えて分類していることもあるという懸念が持ち上がった。しかしながら最近の研究のほとんどは、そのような「分類間違いによる仮定」を支持していない(15,16,19)。
心血管疾患
冠動脈性心疾患
過去40年にわたって、適度のアルコール摂取に関連する健康効果の最も一貫したエビデンスは、多数の疫学的研究で確認された発見である冠動脈性心疾患(CHD)の大幅なリスク減少であった。28の前向きコホート研究の結果をまとめてメタ解析したところ、平均で25g/日のアルコール摂取(標準的アルコール飲料2杯の量)を摂取する成人は、アルコールを摂取しない成人に比べてCHDリスクが20%低かった(20)。米国で行われた2つの大規模前向きコホート研究からのより新しいデータでは、適度のアルコール摂取によるCHDリスク低下の程度は30%近いであろうと示唆された。38,000人超の男性医療従事者を対象とした12年にわたる研究では、週に少なくとも3-4回アルコールを摂取する者は、週に1回以下しかアルコールを摂取しない者に比べて心筋梗塞(心臓発作)リスクが32%低かった(21)。同様に120,000人超の男女を対象にした20年にわたる研究で、毎日1-2杯のアルコールを摂取する者は、アルコールを飲まない者に比べてCHDによる死亡リスクが30%低かった(22)。29の研究の2011年のシステマティックレビュー(系統的レビュー)およびメタ解析で、アルコール摂取は禁酒に比べてCHDリスクが29%低く、2.5-60.0g/日のアルコール摂取はCHDリスクの低下と関連があった(16)。
アルコール摂取はどのようにCHDリスクを下げるのか?CHDの発症は、コレステロールが溜まったプラークが動脈にできた(アテローム性動脈硬化)り、血管の炎症、および血餅ができたりすることが特徴的である(23)。多数の小規模無作為化試験で、毎日のアルコール摂取がCHDリスクのマーカー値に及ぼす影響が調べられ、適度のアルコール摂取は「善玉コレステロール」である高密度リポタンパク質コレステロール、つまりHDLコレステロールの濃度をかなり上昇させるという一貫した結果がわかった(24,25)。HDLはコレステロールを動脈壁を含む組織から肝臓へと運び戻して、除去または再利用に回す。HDL濃度の上昇だけでなく、適度のアルコール摂取は血液循環中のHDLの主要成分であるアポリポタンパク質A1の濃度も上昇させていることが示された(25)。HDLコレステロールの濃度が高いことは、CHDのリスク低下と関連している(26)。
また、アルコールには抗血栓性もあるのかもしれない。血餅の生成は、凝固を促進する要素とそれを抑制したり血餅の溶解を促進したりする要素との複雑な相互作用の結果である。いくつかの無作為化試験で、適度のアルコール摂取が血餅の生成を促進するタンパク質であるフィブリノゲンの血清濃度を下げ(25)、血餅の溶解を助ける酵素(組織型プラスミノゲン活性化因子)の血清濃度を上げる(24)ことがわかった。
さらに、適度のアルコール摂取は抗炎症作用を持つのかもしれない。なぜなら、全身性炎症のマーカーでCHDリスクの鋭敏な予兆因子であるC反応性タンパク質(CRP)の血清濃度は、適度にアルコールを摂取する者のほうが飲酒しない者よりも低いからである(27-32)。適度なアルコール摂取は、アディポネクチン濃度(25)、インスリン感応性(下記の「2型糖尿病」の項参照)、腹部肥満(33)、および血管内皮機能(34)の改善にも関連がある。
摂取するアルコールの種類(ワイン、ビール、蒸留酒)はCHDリスクに影響するか?CHDリスクの大きな減少は、ワイン、ビール、および蒸留酒の適度な摂取と関連がある。しかしながら、比較的高濃度の食事性飽和脂肪と喫煙にもかかわらずフランスではCHDの死亡率が比較的低いという「フレンチパラドックス」から、赤ワインの日常的摂取がCHDに対してさらに防護的なのではないかという考えが導かれた(35,36)。赤ワインは、通常は変異が大きく低濃度ではあるが、レスベラトロールというフェノール化合物を含み(「レスベラトロール」の記事参照)、その他にもプロシアニジンのようなフラボノイドも含む。これらの化合物は、エタノールに関連する有益性以外の心血管への有益性をさらにもたらしている可能性がある。ビールも、心臓保護に寄与するかもしれないポリフェノール化合物を含む(37)。
いくつかの大規模前向きコホート研究で、ワインを飲む者はビールや蒸留酒を飲む者よりもCHDリスクが低いことがわかった(22,38-40)が、何の違いもなかった研究もあった(21,41,42)。また、チェコ(43)、ドイツ(44)、およびハワイに住む日本人男性(45)で主にビールを飲む集団では、心筋梗塞やCHDのリスク減少が見られるとする研究もある。前向きコホート研究および症例対照研究の2011年のメタ解析で、ワインまたはビールの適度な摂取が死に至らない血管性事象のリスク減少に関連していることがわかった(46)。この分析では蒸留酒の摂取を心血管的有益性と関連付けてはいないが、CHDリスクを上げることが知られている過飲が解析対象の研究のいくつかで明白であったと著者らは注意している(46)。
社会経済的地位とライフスタイルの特徴(たとえば喫煙、運動習慣など)がワイン、ビール、または蒸留酒を好む者たちの間で異なっていて、これがいくつかの研究で見られた飲み物のタイプによる追加的な有益性を部分的に説明するのかもしれない。たとえば初期の研究のいくつかで、ワインを好む者はその他のアルコール飲料を好む者よりも高収入で高学歴、喫煙が少なく、野菜や果物を多く食べて飽和脂肪の摂取が少ない傾向があるとわかった(47-49)。これらの紛らわしさの原因となりうるものは、観察データの解析において照査や調整がなされるべきである。
したがって、適度なアルコール摂取が一貫して20-30%のCHDリスク減少と関連があるといっても、特定のタイプのアルコール飲料を摂取することで心血管的有益性がさらに得られるかどうかは未だに明らかではない。
脳卒中
すべての脳卒中の87%を占める虚血性脳卒中は、脳の一領域への血流が不十分になって起こり、血餅によって脳への動脈が塞がれて起こる可能性がある(50)。出血性脳卒中は血管が破れて脳の中で出血することで起こる。それは虚血性脳卒中よりも発生が少ないが、出血性脳卒中は一般的により重症で、脳卒中全体の死亡率に占める割合が大きい(51)。多くの観察研究で、軽度または適度のアルコール摂取は虚血性脳卒中のリスク減少と関連付けられてきたが、出血性脳卒中とは関連がなかった(52-58)。アルコール摂取と脳卒中リスクに関する19の前向きコホート研究と16の症例対照研究の結果をまとめたメタ解析で、適度のアルコール摂取は虚血性脳卒中リスクのかなりの低下と関連があった(59)。全体的に、毎日1-2杯のアルコール飲料を摂取する者は、まったく飲まない者に比べて虚血性脳卒中リスクが28%低かった。より最近(1980-2009年)の研究の別のメタ解析でも、適度なアルコール摂取は男女とも虚血性脳卒中に対してのみ防護的であったことが確認された(60)。27の前向きコホート研究のさらに最近のメタ解析で、軽度から適度(毎日15g未満)のアルコールを摂取する女性は虚血性脳卒中のリスクが低い(相対リスクで0.72)いう関連があったが、出血性脳卒中ではそうではなかった。適度のアルコール摂取(15-30g/日)は、この解析では男性のどちらの脳卒中とも関連がなかった(61)。
したがって、おそらくはアルコールの抗血栓性によって、軽度から適度のアルコール摂取が虚血性脳卒中のリスクを低下させるようであるが、出血性脳卒中のリスクは低下しないようである。
末梢動脈疾患
心臓の筋肉に血液を送る動脈のアテローム性動脈硬化症が冠動脈性心疾患につながるように、四肢への動脈のアテローム性動脈硬化症は末梢動脈疾患(PAD)につながる。足への血流がなくなるくらいアテローム性動脈硬化症が重篤だと、歩くことですら間欠性跛行として知られる足や腰の痛みになってしまうかもしれない(62)。血管内皮機能の障害もこの疾病の特徴で、臨床症状に寄与しているかもしれない(63)。
心臓疾患や脳卒中のエビデンスのように一貫してはいないが、適度なアルコール摂取がPADのリスク低下に関連するという限定的なエビデンスもある。4つの前向きコホート研究で、適度なアルコール摂取がいくつかの異なるPAD指標の値をかなり減らすという関連があることがわかった(64-67)。これらの研究の中の1つでは、アルコール摂取とPADリスクの逆相関は非喫煙者では大きかったが、喫煙者ではそうではなかったことがわかった。このことから、PADリスクに対する喫煙の悪影響は、アルコール摂取による防護効果を上回るかもしれないことが示唆される(64)。
心不全
冠動脈性心疾患は、心不全の主な原因である。21,601人の男性コホートによる前向き研究と126,283人の男女のコホートによる前向き研究で、適度なアルコール摂取は心不全と、特にCHDに関係する心疾患と逆相関があることがわかった(68,69)。より最近では、4,490人の年配成人コホート(開始時に65歳以上)を20年超追跡した(1,380件の心不全)ところ、週に1杯以上のアルコール飲料を摂取すると、まったく飲まない者に比べて心不全リスクが26%低いという関連があった(70)。
心臓性突然死
重度のアルコール摂取が心臓性突然死(SCD)リスクを増加させるという研究もあった(下記参照)が、軽度から適度のアルコール摂取とSCDの関連はそれほど明らかではない。この関連に関する研究では結果がまちまちであるが、今日までで最大規模な2つの前向きコホート研究では、軽度から適度のアルコール摂取によるSCDのリスク低下がわかっている(71,72)。
2型糖尿病
3つのメタ解析で、アルコール摂取と2型糖尿病の発症率との間にU字形の関係があり、女性にはより防護的であることがわかった(73-75)。最も新しいメタ解析は20の前向きコホート研究を含み、適度のアルコール摂取(22-25g/日、つまり1.6-1.8杯/日)は、生涯飲酒しない者に比べて2型糖尿病リスクが女性で40%、男性で13%低いという関連があった(74)。アルコールの多飲(男性で62g/日、つまり4.4杯/日、女性で51g/日、つまり3.6杯/日)は、2型糖尿病リスクの上昇と関連があった(74)。
膵臓からのインスリン分泌の増加およびインスリン感応性の低下は、2型糖尿病の発症に至る重要な要因である。研究からは、適度なアルコール摂取が血清インスリン濃度を下げ、アディポネクチン(2型糖尿病と逆相関のある脂肪細胞ホルモン)濃度を増やし(25)、インスリン感応性を向上させる可能性がある(76-79)ことが示唆されている。一方で、深酒は肥満、特に腹部の肥満の原因となったり、炭水化物の代謝を阻害したり、膵臓や肝臓の機能を損なったりすることで、2型糖尿病リスクを上昇させるのかもしれない(80)。
骨粗しょう症
骨粗しょう症は年配者に多い症状で、骨密度(BMD)減少が進むことによって起こる。数件の観察研究で、年配者の軽度または適度のアルコール摂取は、飲まない者に比べてBMDが高いこととの関連があった(81-89)。いくつかの研究で、ワイン(89)またはビール(89,90)を飲む者は蒸留酒を飲む者に比べてこの防護効果が高いことがわかり、非アルコール成分(たとえばビールのシリコンなど)がこの関連を説明するのかもしれないことを示唆している。骨の健康にアルコールがもたらす効果は、年齢、性別、およびホルモン状態に依存するのかもしれない((92)の文献で概説)。
今あるデータは観察研究によるもので、観察された関連は混同されやすいかもしれないことに留意することが重要である。たとえば適度にアルコールを飲む者は、飲まない者や深酒の者に比べて全体的に健康なライフスタイルなのかもしれない。しかしながら、閉経期前後の女性を対象にした最近の研究で、適度なアルコール摂取はBMDの向上と関連があり、喫煙状態、果物や野菜の摂取、および運動の程度を含む様々なライフスタイル要因とは無関係であった(90)。
認知機能低下、認知症、およびアルツハイマー病
アルコール症や重度のアルコール摂取(1日に3-4杯より多い)は認知障害や認知症のリスクを上昇させるということが知られている(93-95)が、最近のメタ解析やレビューで、年配者の軽度から適度のアルコール摂取は、アルコールを飲まない者に比べて認知症やアルツハイマー病のリスクが低いことと関連があることが報告された(93,96,97)。いくつかのメタ解析では、血管性の認知症(96,98)や認知機能低下(93,96,98,99)に対する大幅なリスク低下は見つからなかった。ワインの摂取が認知症に対して特に防護的であると示唆している研究もあるが、結果はまちまちであり、多くの研究では様々な種類のアルコール飲料を特に指定していない。
少なくとも3つの疫学的研究で、健康な中年または年配者の脳における無症状な異常とアルコール摂取との関係を調べるために、磁気共鳴画像法(MRI)が使用された。そのうちの2つの研究で、軽度または適度のアルコールを摂取する者のほうがアルコールを飲まない者に比べて梗塞(死亡した組織の領域)の発生頻度が少なかった(100,101)。しかしながら、もう1つの研究ではアルコール摂取と梗塞の存在との関係は見られなかった(102)。アルツハイマー病とアルコール性認知症の特徴である脳の萎縮を測定した2つの研究では、アルコールを飲まない者のほうがアルコールを摂取する者よりも脳の萎縮が少なかったことがわかった(100,102)。残りのもう1つの研究では、軽度から適度のアルコール摂取者のほうが脳の萎縮が少なかったが、これはアルツハイマー病のリスクが高いアポリポタンパク質E(APOE)のε4対立遺伝子を持つ者にだけ当てはまった(101)。アルコールが脳に及ぼす複雑な影響のため、、認知機能や認知症に関するアルコール摂取のリスクや有益性を決定するさらなる研究が必要である。
胆石
前向きコホート研究(103-107)と症例対照研究(108,109)の大半で、適度なアルコール摂取をする男女は、胆石や胆のう手術(胆のう摘出術)のリスクがアルコールを飲まない者よりも低いことがわかった。適度なアルコール摂取と胆石発症率との一貫した逆相関の理由はすべて明らかなわけではないが、定期的なアルコール摂取によって胆汁が胆石に結晶化することが少なくなったり、胆のうが空になるよう刺激されているのかもしれない(106)。
適度のアルコール摂取の健康リスク
妊娠
胎児性アルコールスペクトラム障害(FASD)は、妊娠中にアルコールに晒されたことによる継続的な発育異常である。FASDは米国の1-2%もの子供に影響している可能性がある(110,111)。FASDの重篤な形態である胎児性アルコール症候群(FAS)とは、妊娠中のアルコール多飲に関連する一連の身体的および精神的先天性異常のことである。FASの特徴には、顔の異常、精神遅延、および成長障害などがある。妊娠中のより軽度のアルコール摂取(週に7-14杯)でも、より軽度だが認知および行動の発達に影響するという関連がある(112,113)。通常で適度の量を妊娠中に飲酒した母を持つ子供は、記憶、注意、学習、および行動に問題があることがわかっている(114)。全体的に、妊娠中の軽度から適度の飲酒と生まれた子供の精神的健康の関連を調べた研究は結果がまちまちである。((115)の文献で概説)。しかしながら、これらの研究は本来観察的なものであり、結果を紛らわしくする可能性のある要因(たとえば妊娠中に飲酒した女性と禁酒した女性とにおける子供の精神発達に影響するライフスタイルの差など)について適切に照査されていないかもしれないことに留意することが大切である(115)。
妊娠中はいかなる段階でも安全なアルコール摂取量が確立していないので、妊娠中の女性や妊娠を考えている女性は禁酒すべきである(116,117)。
乳がん
100を超える観察研究でアルコール摂取と女性の乳がんの関連が調べられ、たいていの研究でリスク上昇がわかった(118-121)。利用可能なデータが観察研究によるものであるとはいえ、この関連には因果関係があると多くの者が考えている。毎日1-2杯という程度の定期的アルコール摂取でも、控えめだが十分に意味のある乳がんリスクの上昇に関連する。しかしながら、実害を起こすしきい値を定義するのは難しい。それというのもヘビードリンカーがアルコール摂取を少なめに報告する可能性があり、その結果ヘビードリンカーが「適度なアルコール摂取者」に間違って分類されるかもしれないからだ(122)。
乳がんリスクとアルコール摂取の用量に比例した関係は、摂取したアルコール飲料の種類にかかわらず閉経前および閉経後の乳がんに関して観察されている。統合解析およびメタ解析で、毎日10g(1杯より若干少なめ)アルコール摂取が増えるごとに、女性の乳がんリスクが7-10%増えるという関連がわかった(123-125)。アルコール摂取と乳がんに限った死亡率に関する研究は結果がまちまちであり、25の前向きコホート研究の最近のメタ解析で、20g(1.4杯)/日を超えるアルコール摂取の場合のみリスク上昇が見られた(126)。適度なアルコール摂取は、全死因による死亡のリスク減少と一貫して関連している(上記の「死亡率」の項参照)。
アルコール摂取と乳がんの発生率との一貫した関連のメカニズムははっきりとわかっていないが、提唱されているメカニズムには、アセトアルデヒドの生成、CYP2E1による代謝の誘発と酸化ストレスの上昇、血液循環中のエストロゲンまたはアンドロゲンの濃度上昇、および乳がん細胞の侵襲性の強化などがある(119,127)。現在の推定では、米国の約8人に1人(12.4%)が人生のある時点で乳がんを発症する(128)。乳がんには多くのリスク要因があるが、アルコール摂取は数少ない変更可能なリスク要因の一つである。
葉酸塩と乳がん
アルコールは、DNAのメチル化や修復に必要な葉酸塩の吸収、輸送、および代謝を阻害する(「葉酸塩」の項の記事参照)。これらのプロセスの変化は、突然変異や遺伝子発現の変化となって、がんリスクを上昇させる可能性がある(118)。いくつかの研究(129-134)で、十分な葉酸塩の摂取がアルコール摂取と乳がんリスクの関連を変える可能性があることがわかったが、すべての研究でそうだったわけではない(135-139)。葉酸塩、アルコール、および乳がんリスクとの相互作用は解明されていないが、飲酒する女性が400μgの葉酸を含むマルチビタミンを毎日摂取するのは理にかなっている。
深酒または危険な飲酒への進行
アルコール症から回復中の者や、アルコール乱用や依存症の家族歴のある者などは、適度な飲酒習慣を維持することができないかもしれない。アルコール依存症のなりやすさは、遺伝的、心理社会的、および環境的要因に影響される。アルコール症の親の子供は、アルコール症でない親の子供よりもアルコール依存症になるリスクがかなり高いことがわかっている(140)。このリスク増加は、遺伝的要因と家族環境による要因の相互作用に関係しているようである。米国の国立アルコール乱用依存症研究所は、アルコール依存症の家族歴のある者、特に親がそうである者は、注意深く適度な飲酒になるように推奨している(141)。
薬物相互作用
肝臓では、アルコールは多くの薬物と同じ酵素で代謝される。したがって、アルコール摂取は多くの薬物の活性や分解に影響する可能性がある。アルコール摂取はまた、処方薬および店頭で売られている多くの薬物による鎮静さ、眠気、および低血圧を助長する可能性がある。アルコールと薬物の重篤な相互作用は多量のアルコール摂取時に多いが、敏感な者は適度のアルコール摂取でも悪影響のリスクが増大する可能性もある(142)。女性と年配者は特に、アルコールと薬物の相互作用に関してリスクが大きい(143,144)。
様々な種類の処方された薬物がアルコールと有害に相互作用するかもしれず、それには抗生物質、抗けいれん薬、抗凝血薬(クマジンなど)、抗うつ剤、抗糖尿病薬、降圧薬、血管拡張剤(硝酸塩やカルシウムチャネル拮抗薬など)、バルビツール酸塩、ベンゾジアゼピン(鎮静剤)、ヒスタミンH2受容体拮抗薬、筋肉弛緩剤、および催眠性または非催眠性の痛み止めなどがある。店頭で売られている薬剤や植物性生薬などもアルコールと相互作用する可能性があり、これにはアスピリン、アセトアミノフェン(タイレノール)イブプロフェン(アドヴィルやモトリン)、ナプロキセンナトリウム(アリーブ)などの痛み止め、ジフェンヒドラミン(ベナドリル)やクロルフェニラミンなどの風邪薬やアレルギー薬、シメチジン(タガメット)やラニチジン(ザンタック)などの胸焼けの薬、およびカモミールやカノコソウ、およびカヴァなどの植物性生薬を含む。
アルコールと薬物の潜在的に危険な相互作用を避けるのに役立つのは、自分の医療従事者にアルコール摂取について必ず知っていてもらうようにすることである。処方薬や店頭での薬物を摂取する前に、アルコール摂取が悪影響リスクを上昇させないかどうかを決めるために、製品の警告ラベルを読むか、薬剤師や医療従事者に相談しよう。一般的に、どのような薬物も飲酒と2-3時間あけて別に摂取することが得策である。アルコールと薬物との深刻な相互作用の可能性については、米国の国立アルコール乱用依存症研究所のウェブサイトを参照のこと。
深酒の健康効果
なし
深酒の健康リスク
妊娠
妊娠中のアルコールの多飲は、胎児性アルコール症候群(FAS)を引き起こす。上記を参照のこと。
心血管疾患
高血圧
深酒は、前向きコホート研究でも症例対照研究でも、高血圧のリスク上昇と一貫して関連している(145-147)。12の前向きコホート研究の2009年の系統的レビューおよびメタ解析で、50g(3.6杯)/日のアルコール摂取は、男性および女性でそれぞれ1.6倍と1.8倍の高血圧リスク上昇と関連があることがわかった。この量の2倍(100g(約7杯)/日)のアルコール摂取は、男性で2.5倍、女性で2.8倍の相対リスクと関連があった(148)。
多くの臨床試験の結果は、アルコール摂取を減らすと、高血圧および正常血圧の個人の血圧が下がることを示している。15の無作為化対照試験の結果をまとめたメタ解析で、アルコール摂取を減らすと、収縮期および拡張期血圧がかなり下がることがわかった(149)。
脳卒中
虚血性脳卒中は脳の一領域への血流が不十分になることが原因で、脳への動脈が血餅で塞がれて起こることがある。出血性脳卒中は、脳の中で血管が破れて出血して起こる。定期的な適度のアルコール摂取は虚血性脳卒中リスクの減少と関連しているという研究もあるが、深酒は虚血性脳卒中と出血性脳卒中どちらのリスク上昇とも関連がある。19の前向きコホート研究および16の症例対照研究の結果をまとめたメタ解析で、深酒は出血性脳卒中のリスクが2倍以上に、虚血性脳卒中のリスクが70%上昇することがわかった(59)。最近(1980-2009年)の研究のメタ解析で、深酒は男女とも虚血性脳卒中および出血性脳卒中のリスク上昇と関連していることが確認された(60)。深酒は、高血圧、心筋症(心臓の筋肉の損傷)、心拍の乱れ、および血液凝固異常や止血異常に寄与することによって、脳卒中リスクを上昇させているのかもしれない。
不整脈と心臓性突然死
昔から知られている深酒の酒宴と心拍の乱れ(不整脈)についての関連は、それが休日や週末に入院する者について初めて使われたことから、「休日症候群」と呼ばれる(150)。心房細動は、深酒と最も一般的に関連のある不整脈である(151,152)。2010年の系統的レビューとメタ解析で、毎日のアルコール摂取とこのタイプの不整脈リスクとの間に飲酒量に比例した関連があることがわかり、女性では24g/日(1.7杯/日)、男性では36g/日(2.6杯/日)より多い飲酒でリスクが高かった(153)。7つの前向き研究を2014年にメタ解析したところ、毎日2杯より多く飲酒すると男女とも心房細動のリスクが高くなり、毎日1杯追加するごとに8%リスクが上昇するとわかった(154,155)。さらに、深酒(1日に5杯より多い)は心臓性突然死(SCD)のリスクも上昇させることがわかった(156,157)。
アルコールが不整脈やSCDを引き起こすかもしれない経緯は、全部わかっているわけではない。アルコールは心筋細胞の収縮性を損ない、心筋細胞の形や構造を変え、電解質の不均衡に寄与し、酸化ストレスを誘発したりするのかもしれない(158)。
アルコール性心筋症
アルコール性心筋症とは、長期にわたる深酒によって引き起こされる心筋の疾患である(159)。この疾患はヘビードリンカーのうち少しの割合(10%未満)でしか起こらないようである(160)。アルコール性心筋症は2段階で起こる。(1)初期の無症状の段階では心筋の損傷は明確な症状を呈さないが、(2)症状の出る段階では心筋が弱くてポンプ機能を効果的に行うことができない。アルコール性心筋症に至る飲酒レベルは明確に確立されてないが、毎日少なくとも7杯のアルコール飲料を5年より長く摂取している者は、無症状のアルコール性心筋症の危険性があると考えられている。深酒を続ける者は、ついには心不全を発症する。女性は男性よりアルコールによる心筋への害を受けやすいことが、研究から示唆される(161,162)。
アルコール性肝臓疾患
慢性的にアルコールを過多に摂取することは、肝臓疾患やそれによる死の主な原因である(163)。アルコール性肝臓疾患は、脂肪肝、肝炎(致命的になる可能性もある肝臓の炎症)、線維症、および最も進んだアルコール性肝臓疾患である肝硬変を含む広範な肝臓損傷が特徴である。肝硬変では、線維症の傷のある組織ができて、それが進行性の肝機能の悪化に至る。進行した肝臓疾患の合併症には、食道の静脈が膨張してひどく出血したり(食道静脈瘤)、脳の損傷(肝性脳症)、腹部での体液の貯留(腹水症)、および腎不全などがある。
9つの研究の2004年のメタ解析で、摂取したアルコール量の増加に反応して肝硬変リスクが増加することがわかり、相対リスク(RR)は25g(1.8杯)/日で2.9、50g(3.6杯)/日で7.1、100g(7.1杯)/日で26.5であった。別のメタ解析では、肝硬変の相対リスクはアルコール量の増加で高くなることがわかったが、肝硬変による罹患率にはしきい値(女性では24g(1.7杯)/日を超えるアルコール摂取、男性では36g(2.6杯)/日を超えるアルコール摂取)があることも示唆された(165)。肝硬変による死亡リスクは、女性ではいかなるアルコール摂取量でも増加し、男性では12g(0.9杯)/日を超える摂取で増加していた。アルコール摂取は、すでに罹っているいかなる肝臓疾患も悪化させることが知られていることから、アルコール摂取と肝硬変による死亡率との関係が、アルコール摂取と肝硬変の罹患率との関係よりも強いことがうかがわれる(165)。
重い肝臓疾患は、60g(4.3杯)/日を超えるアルコール摂取をする者の約10%に発生することがわかっている。女性は男性よりも重いアルコール性肝臓疾患になりやすく(165,166)、C型肝炎の感染者はアルコール性肝臓疾患リスクが高くなる(167)。
がん
深酒は、多くの部位でのがんのリスクを増大させることがわかっている(168)。深酒は一貫して、またアルコール量に依存して 、口腔がん、喉頭がん、咽頭がん、食道がん、肝臓がん、結腸がん、直腸がん、および乳がんのリスク上昇と関連していることがわかっている(165)。しかも、喫煙とアルコール摂取の組み合わせは、がんリスクのもっと劇的な増大に至る(169)。長期に渡る深酒による肝臓がんリスクの増大は、アルコール性肝硬変またはウィルス性肝炎によるがんになりやすくなることと関係しているのかもしれない。
アルコールに関係する脳の障害
慢性的な多量のアルコール摂取やアルコール依存は、脳とその機能に、特に記憶と実行機能に有害な関連がある(170)。アルコール症は大脳萎縮(脳の組織の縮小)を被ることが観察され、これはアルコールに関連する認知症や認知障害に寄与しているようだ(94)。アルツハイマー病で見られる進行性の大脳萎縮とは対照的に、アルコール関係の大脳萎縮は禁酒期間を置くことで減少する可能性がある。アルコール関係の脳障害は、チアミン(171)やナイアシン(172)といった栄養素の欠乏に関連しているかもしれない。
膵炎
膵炎は、痛みの出る膵臓の炎症である。急性膵炎では上腹部の強い痛みが突然起こり、しばしば吐き気や嘔吐を伴う(173)。大部分の急性膵炎は支持療法しか必要としないが、ごく少数の者は重篤または命にかかわる合併症になる可能性がある。研究によると、19-32%の急性膵炎はアルコールが原因であると推定される((174)の文献で概説)。
慢性膵炎は膵臓の破壊を進行させ、その機能を失わせる(175)。推定で慢性膵炎の62-70%は、アルコールが原因である。慢性膵炎の発症リスクは、アルコール摂取の量と期間とともに上昇する。慢性膵炎のリスク上昇は、長期間にわたって毎日5杯以上のアルコール飲料を摂取した場合に見られる(174)。アルコール症の者のうち少数(10%未満)しか慢性膵炎を発症しないので、遺伝的および環境的要因も関わっていると考えられている。この疾病は女性よりも男性に、白人よりも黒人に、非喫煙者よりも喫煙者に多い(176,177)。
骨の健康
慢性的アルコール依存症は、骨密度の減少や骨折のリスク上昇など骨の健康に有害な影響をもたらす。大量(100-200g/日)のアルコール摂取は、骨を形成する細胞である骨芽細胞の活性を直に損う。骨の健康に対するネガティブな影響は、アルコール症患者の栄養不良によっても間接的に引き起こされている(92)。
事故、けが、および暴力
アルコール摂取は、自動車事故、転倒、および火事などを含む多くの状況で、けがのリスクを上昇させるという関連がある(178)。病院の緊急救命部門からのデータは、6時間前に1-2杯のアルコール飲料を摂取しただけで、けがのリスクが大きく上昇することを示している(179)。米国での交通事故死全体の31%は、アルコール絡みである(180)。米国の運転者に対する法的な血中アルコール濃度(BAC)は、血液1デシリットルあたり0.08gである。しかし大半の科学的研究では、BACが0.05でも運転関連の技能が大きく損なわれることがわかっている(181)。参考までに、0.05のBACとは、体重が約80kgの男性が1時間で3杯の標準的なアルコール飲料を飲むか、体重が約55kgの女性が1時間に2杯のアルコール飲料を飲むと到達する濃度である(182)。
過剰なアルコール摂取は、自殺、殺人、家庭内暴力、性的暴行、および集団暴行などのすべての形態の暴力に関連する。アルコールに関連する暴力の理由は複雑であるが、ある集団の暴力的行動のリスクをアルコール摂取が上昇させているようである(183)。
死亡率
アルコールの多飲は死亡率を上昇させる(4,16)。上記のように、アルコール摂取と死亡率の関係はJ字形で、アルコール摂取が多い者はアルコールを飲まない者よりも死亡リスクが高いことを意味する。8つの前向きコホート研究の2011年のメタ解析で、60g/日より多いアルコール摂取は、全死因による死亡率を30%上昇させるという関連があった(16)。
Authors and Reviewers
Originally written in 2004 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in December 2007 by:
Victoria J. Drake, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in August 2015 by:
Victoria J. Drake, Ph.D.
Linus Pauling Institute
Oregon State University
Reviewed in August 2015 by:
Arthur L. Klatsky, M.D.
Senior Consultant in Cardiology
Adjunct Investigator, Division of Research
Kaiser Permanente Medical Care Program
Oakland, CA
Copyright 2004-2024 Linus Pauling Institute
References
1. Ecker RR, Klatsky AL. Doctor, should I have a drink? An algorithm for health professionals. Ann N Y Acad Sci. 2002;957:317-320. (PubMed)
2. US Department of Health and Human Services, US Department of Agriculture. Nutrition and your health: Dietary Guidelines for Americans [Website]. Available at: http://www.health.gov/dietaryguidelines/dga2000/document/choose.htm#alcohol. Accessed 11/4/03.
3. Klatsky AL. Drink to your health? Sci Am. 2003;288(2):74-81. (PubMed)
4. Di Castelnuovo A, Costanzo S, Bagnardi V, Donati MB, Iacoviello L, de Gaetano G. Alcohol dosing and total mortality in men and women: an updated meta-analysis of 34 prospective studies. Arch Intern Med. 2006;166(22):2437-2445. (PubMed)
5. Krenz M, Korthuis RJ. Moderate ethanol ingestion and cardiovascular protection: from epidemiologic associations to cellular mechanisms. J Mol Cell Cardiol. 2012;52(1):93-104. (PubMed)
6. Naimi TS, Brown DW, Brewer RD, et al. Cardiovascular risk factors and confounders among nondrinking and moderate-drinking U.S. adults. Am J Prev Med. 2005;28(4):369-373. (PubMed)
7. National Institute on Alcohol Abuse and Alcoholism. Helping patients who drink too much: a clinician's guide [Web page]. January 2007. Available at: http://pubs.niaaa.nih.gov/publications/Practitioner/CliniciansGuide2005/clinicians_guide.htm. Accessed 10/3/07.
8. National Institute on Alcohol Abuse and Alcoholism. Helping patients who drink too much: a clinician's guide: NIH Publication No. 07-3769; 2005.
9. US Department of Agriculture and US Department of Health and Human Services. Dietary Guidelines for Americans, 2010. Washington, D.C.: US Government Printing Office, December 2010.
10. National Institute on Alcohol Abuse and Alcoholism. Women and alcohol. Available at: http://pubs.niaaa.nih.gov/publications/womensfact/womensfact.htm. Accessed 7/29/15.
11. Thun MJ, Peto R, Lopez AD, et al. Alcohol consumption and mortality among middle-aged and elderly U.S. adults. N Engl J Med. 1997;337(24):1705-1714. (PubMed)
12. Poikolainen K. Alcohol and mortality: a review. J Clin Epidemiol. 1995;48(4):455-465. (PubMed)
13. Lee SJ, Sudore RL, Williams BA, Lindquist K, Chen HL, Covinsky KE. Functional limitations, socioeconomic status, and all-cause mortality in moderate alcohol drinkers. J Am Geriatr Soc. 2009;57(6):955-962. (PubMed)
14. Djousse L, Lee IM, Buring JE, Gaziano JM. Alcohol consumption and risk of cardiovascular disease and death in women: potential mediating mechanisms. Circulation. 2009;120(3):237-244. (PubMed)
15. Fuller TD. Moderate alcohol consumption and the risk of mortality. Demography. 2011;48(3):1105-1125. (PubMed)
16. Ronksley PE, Brien SE, Turner BJ, Mukamal KJ, Ghali WA. Association of alcohol consumption with selected cardiovascular disease outcomes: a systematic review and meta-analysis. BMJ. 2011;342:d671. (PubMed)
17. Mukamal KJ, Chen CM, Rao SR, Breslow RA. Alcohol consumption and cardiovascular mortality among U.S. adults, 1987 to 2002. J Am Coll Cardiol. 2010;55(13):1328-1335. (PubMed)
18. Fuchs CS, Stampfer MJ, Colditz GA, et al. Alcohol consumption and mortality among women. N Engl J Med. 1995;332(19):1245-1250. (PubMed)
19. Roerecke M, Rehm J. The cardioprotective association of average alcohol consumption and ischaemic heart disease: a systematic review and meta-analysis. Addiction. 2012;107(7):1246-1260. (PubMed)
20. Corrao G, Rubbiati L, Bagnardi V, Zambon A, Poikolainen K. Alcohol and coronary heart disease: a meta-analysis. Addiction. 2000;95(10):1505-1523. (PubMed)
21. Mukamal KJ, Conigrave KM, Mittleman MA, et al. Roles of drinking pattern and type of alcohol consumed in coronary heart disease in men. N Engl J Med. 2003;348(2):109-118. (PubMed)
22. Klatsky AL, Friedman GD, Armstrong MA, Kipp H. Wine, liquor, beer, and mortality. Am J Epidemiol. 2003;158(6):585-595. (PubMed)
23. Ross R. Atherosclerosis--an inflammatory disease. N Engl J Med. 1999;340(2):115-126. (PubMed)
24. Rimm EB, Williams P, Fosher K, Criqui M, Stampfer MJ. Moderate alcohol intake and lower risk of coronary heart disease: meta-analysis of effects on lipids and haemostatic factors. BMJ. 1999;319(7224):1523-1528. (PubMed)
25. Brien SE, Ronksley PE, Turner BJ, Mukamal KJ, Ghali WA. Effect of alcohol consumption on biological markers associated with risk of coronary heart disease: systematic review and meta-analysis of interventional studies. BMJ. 2011;342:d636. (PubMed)
26. Rader DJ. Regulation of reverse cholesterol transport and clinical implications. Am J Cardiol. 2003;92(4A):42J-49J. (PubMed)
27. Albert MA, Glynn RJ, Ridker PM. Alcohol consumption and plasma concentration of C-reactive protein. Circulation. 2003;107(3):443-447. (PubMed)
28. Stewart SH, Mainous AG, 3rd, Gilbert G. Relation between alcohol consumption and C-reactive protein levels in the adult US population. J Am Board Fam Pract. 2002;15(6):437-442. (PubMed)
29. Imhof A, Froehlich M, Brenner H, Boeing H, Pepys MB, Koenig W. Effect of alcohol consumption on systemic markers of inflammation. Lancet. 2001;357(9258):763-767. (PubMed)
30. Sierksma A, van der Gaag MS, Kluft C, Hendriks HF. Moderate alcohol consumption reduces plasma C-reactive protein and fibrinogen levels; a randomized, diet-controlled intervention study. Eur J Clin Nutr. 2002;56(11):1130-1136. (PubMed)
31. Whitfield JB, Heath AC, Madden PA, Pergadia ML, Montgomery GW, Martin NG. Metabolic and biochemical effects of low-to-moderate alcohol consumption. Alcohol Clin Exp Res. 2013;37(4):575-586. (PubMed)
32. Wang JJ, Tung TH, Yin WH, et al. Effects of moderate alcohol consumption on inflammatory biomarkers. Acta Cardiol. 2008;63(1):65-72. (PubMed)
33. O'Keefe JH, Bybee KA, Lavie CJ. Alcohol and cardiovascular health: the razor-sharp double-edged sword. J Am Coll Cardiol. 2007;50(11):1009-1014. (PubMed)
34. Suzuki K, Elkind MS, Boden-Albala B, et al. Moderate alcohol consumption is associated with better endothelial function: a cross sectional study. BMC Cardiovasc Disord. 2009;9:8. (PubMed)
35. St Leger AS, Cochrane AL, Moore F. Factors associated with cardiac mortality in developed countries with particular reference to the consumption of wine. Lancet. 1979;1(8124):1017-1020. (PubMed)
36. Criqui MH, Ringel BL. Does diet or alcohol explain the French paradox? Lancet. 1994;344(8939-8940):1719-1723. (PubMed)
37. Arranz S, Chiva-Blanch G, Valderas-Martinez P, Medina-Remon A, Lamuela-Raventos RM, Estruch R. Wine, beer, alcohol and polyphenols on cardiovascular disease and cancer. Nutrients. 2012;4(7):759-781. (PubMed)
38. Renaud SC, Gueguen R, Siest G, Salamon R. Wine, beer, and mortality in middle-aged men from eastern France. Arch Intern Med. 1999;159(16):1865-1870. (PubMed)
39. Gronbaek M, Becker U, Johansen D, et al. Type of alcohol consumed and mortality from all causes, coronary heart disease, and cancer. Ann Intern Med. 2000;133(6):411-419. (PubMed)
40. Streppel MT, Ocke MC, Boshuizen HC, Kok FJ, Kromhout D. Long-term wine consumption is related to cardiovascular mortality and life expectancy independently of moderate alcohol intake: the Zutphen Study. J Epidemiol Community Health. 2009;63(7):534-540. (PubMed)
41. Rimm EB, Klatsky A, Grobbee D, Stampfer MJ. Review of moderate alcohol consumption and reduced risk of coronary heart disease: is the effect due to beer, wine, or spirits. BMJ. 1996;312(7033):731-736. (PubMed)
42. Wannamethee SG, Shaper AG. Type of alcoholic drink and risk of major coronary heart disease events and all-cause mortality. Am J Public Health. 1999;89(5):685-690. (PubMed)
43. Bobak M, Skodova Z, Marmot M. Effect of beer drinking on risk of myocardial infarction: population based case-control study. BMJ. 2000;320(7246):1378-1379. (PubMed)
44. Keil U, Chambless LE, Doring A, Filipiak B, Stieber J. The relation of alcohol intake to coronary heart disease and all-cause mortality in a beer-drinking population. Epidemiology. 1997;8(2):150-156. (PubMed)
45. Yano K, Rhoads GG, Kagan A. Coffee, alcohol and risk of coronary heart disease among Japanese men living in Hawaii. N Engl J Med. 1977;297(8):405-409. (PubMed)
46. Costanzo S, Di Castelnuovo A, Donati MB, Iacoviello L, de Gaetano G. Wine, beer or spirit drinking in relation to fatal and non-fatal cardiovascular events: a meta-analysis. Eur J Epidemiol. 2011;26(11):833-850. (PubMed)
47. Mortensen EL, Jensen HH, Sanders SA, Reinisch JM. Better psychological functioning and higher social status may largely explain the apparent health benefits of wine: a study of wine and beer drinking in young Danish adults. Arch Intern Med. 2001;161(15):1844-1848. (PubMed)
48. Barefoot JC, Gronbaek M, Feaganes JR, McPherson RS, Williams RB, Siegler IC. Alcoholic beverage preference, diet, and health habits in the UNC Alumni Heart Study. Am J Clin Nutr. 2002;76(2):466-472. (PubMed)
49. McCann SE, Sempos C, Freudenheim JL, et al. Alcoholic beverage preference and characteristics of drinkers and nondrinkers in western New York (United States). Nutr Metab Cardiovasc Dis. 2003;13(1):2-11. (PubMed)
50. American Stroke Association. Ischemic strokes (clots) [Web page]. Available at: http://www.strokeassociation.org/STROKEORG/AboutStroke/TypesofStroke/IschemicClots/Ischemic-Strokes-Clots_UCM_310939_Article.jsp. Accessed 9/24/14.
51. Grysiewicz RA, Thomas K, Pandey DK. Epidemiology of ischemic and hemorrhagic stroke: incidence, prevalence, mortality, and risk factors. Neurol Clin. 2008;26(4):871-895, vii. (PubMed)
52. Berger K, Ajani UA, Kase CS, et al. Light-to-moderate alcohol consumption and risk of stroke among U.S. male physicians. N Engl J Med. 1999;341(21):1557-1564. (PubMed)
53. Sacco RL, Elkind M, Boden-Albala B, et al. The protective effect of moderate alcohol consumption on ischemic stroke. JAMA. 1999;281(1):53-60. (PubMed)
54. Malarcher AM, Giles WH, Croft JB, et al. Alcohol intake, type of beverage, and the risk of cerebral infarction in young women. Stroke. 2001;32(1):77-83. (PubMed)
55. Mukamal KJ, Chung H, Jenny NS, et al. Alcohol use and risk of ischemic stroke among older adults: the cardiovascular health study. Stroke. 2005;36(9):1830-1834. (PubMed)
56. Jimenez M, Chiuve SE, Glynn RJ, et al. Alcohol consumption and risk of stroke in women. Stroke. 2012;43(4):939-945. (PubMed)
57. Zhang Y, Tuomilehto J, Jousilahti P, Wang Y, Antikainen R, Hu G. Lifestyle factors on the risks of ischemic and hemorrhagic stroke. Arch Intern Med. 2011;171(20):1811-1818. (PubMed)
58. Iso H, Baba S, Mannami T, et al. Alcohol consumption and risk of stroke among middle-aged men: the JPHC Study Cohort I. Stroke. 2004;35(5):1124-1129. (PubMed)
59. Reynolds K, Lewis B, Nolen JD, Kinney GL, Sathya B, He J. Alcohol consumption and risk of stroke: a meta-analysis. JAMA. 2003;289(5):579-588. (PubMed)
60. Patra J, Taylor B, Irving H, et al. Alcohol consumption and the risk of morbidity and mortality for different stroke types--a systematic review and meta-analysis. BMC Public Health. 2010;10:258. (PubMed)
61. Zhang C, Qin YY, Chen Q, et al. Alcohol intake and risk of stroke: a dose-response meta-analysis of prospective studies. Int J Cardiol. 2014;174(3):669-677. (PubMed)
62. Mills JL. Peripheral arterial disease. In: Rakel RE, Bope ET, eds. Rakel: Conn's Current Therapy 2002. New York: W.B. Saunders Company; 2002:340-343.
63. Kiani S, Aasen JG, Holbrook M, et al. Peripheral artery disease is associated with severe impairment of vascular function. Vasc Med. 2013;18(2):72-78. (PubMed)
64. Vliegenthart R, Geleijnse JM, Hofman A, et al. Alcohol consumption and risk of peripheral arterial disease: the Rotterdam study. Am J Epidemiol. 2002;155(4):332-338. (PubMed)
65. Camargo CA, Jr., Hennekens CH, Gaziano JM, Glynn RJ, Manson JE, Stampfer MJ. Prospective study of moderate alcohol consumption and mortality in US male physicians. Arch Intern Med. 1997;157(1):79-85. (PubMed)
66. Djousse L, Levy D, Murabito JM, Cupples LA, Ellison RC. Alcohol consumption and risk of intermittent claudication in the Framingham Heart Study. Circulation. 2000;102(25):3092-3097. (PubMed)
67. Mukamal KJ, Kennedy M, Cushman M, et al. Alcohol consumption and lower extremity arterial disease among older adults: the cardiovascular health study. Am J Epidemiol. 2008;167(1):34-41. (PubMed)
68. Klatsky AL, Chartier D, Udaltsova N, et al. Alcohol drinking and risk of hospitalization for heart failure with and without associated coronary artery disease. Am J Cardiol. 2005;96(3):346-351. (PubMed)
69. Djousse L, Gaziano JM. Alcohol consumption and risk of heart failure in the Physicians' Health Study I. Circulation. 2007;115(1):34-39. (PubMed)
70. Del Gobbo LC, Kalantarian S, Imamura F, et al. Contribution of major lifestyle risk Factors for incident heart failure in older adults: the Cardiovascular Health Study. JACC Heart Fail. 2015;3(7):520-528. (PubMed)
71. Albert CM, Manson JE, Cook NR, Ajani UA, Gaziano JM, Hennekens CH. Moderate alcohol consumption and the risk of sudden cardiac death among US male physicians. Circulation. 1999;100(9):944-950. (PubMed)
72. Chiuve SE, Rimm EB, Mukamal KJ, et al. Light-to-moderate alcohol consumption and risk of sudden cardiac death in women. Heart Rhythm. 2010;7(10):1374-1380. (PubMed)
73. Koppes LL, Dekker JM, Hendriks HF, Bouter LM, Heine RJ. Moderate alcohol consumption lowers the risk of type 2 diabetes: a meta-analysis of prospective observational studies. Diabetes Care. 2005;28(3):719-725. (PubMed)
74. Baliunas DO, Taylor BJ, Irving H, et al. Alcohol as a risk factor for type 2 diabetes: A systematic review and meta-analysis. Diabetes Care. 2009;32(11):2123-2132. (PubMed)
75. Carlsson S, Hammar N, Grill V. Alcohol consumption and type 2 diabetes Meta-analysis of epidemiological studies indicates a U-shaped relationship. Diabetologia. 2005;48(6):1051-1054. (PubMed)
76. Meyer KA, Conigrave KM, Chu NF, et al. Alcohol consumption patterns and HbA1c, C-peptide and insulin concentrations in men. J Am Coll Nutr. 2003;22(3):185-194. (PubMed)
77. Kenkre PV, Lindeman RD, Lillian Yau C, Baumgartner RN, Garry PJ. Serum insulin concentrations in daily drinkers compared with abstainers in the New Mexico elder health survey. J Gerontol A Biol Sci Med Sci. 2003;58(10):M960-963. (PubMed)
78. Greenfield JR, Samaras K, Jenkins AB, Kelly PJ, Spector TD, Campbell LV. Moderate alcohol consumption, estrogen replacement therapy, and physical activity are associated with increased insulin sensitivity: is abdominal adiposity the mediator? Diabetes Care. 2003;26(10):2734-2740. (PubMed)
79. Bantle AE, Thomas W, Bantle JP. Metabolic effects of alcohol in the form of wine in persons with type 2 diabetes mellitus. Metabolism. 2008;57(2):241-245. (PubMed)
80. Kao WH, Puddey IB, Boland LL, Watson RL, Brancati FL. Alcohol consumption and the risk of type 2 diabetes mellitus: atherosclerosis risk in communities study. Am J Epidemiol. 2001;154(8):748-757. (PubMed)
81. Laitinen K, Valimaki M, Keto P. Bone mineral density measured by dual-energy X-ray absorptiometry in healthy Finnish women. Calcif Tissue Int. 1991;48(4):224-231. (PubMed)
82. Holbrook TL, Barrett-Connor E. A prospective study of alcohol consumption and bone mineral density. BMJ. 1993;306(6891):1506-1509. (PubMed)
83. Felson DT, Zhang Y, Hannan MT, Kannel WB, Kiel DP. Alcohol intake and bone mineral density in elderly men and women. The Framingham Study. Am J Epidemiol. 1995;142(5):485-492. (PubMed)
84. New SA, Bolton-Smith C, Grubb DA, Reid DM. Nutritional influences on bone mineral density: a cross-sectional study in premenopausal women. Am J Clin Nutr. 1997;65(6):1831-1839. (PubMed)
85. Kroger H, Tuppurainen M, Honkanen R, Alhava E, Saarikoski S. Bone mineral density and risk factors for osteoporosis--a population-based study of 1600 perimenopausal women. Calcif Tissue Int. 1994;55(1):1-7. (PubMed)
86. Hansen MA, Overgaard K, Riis BJ, Christiansen C. Potential risk factors for development of postmenopausal osteoporosis--examined over a 12-year period. Osteoporos Int. 1991;1(2):95-102. (PubMed)
87. Rapuri PB, Gallagher JC, Balhorn KE, Ryschon KL. Alcohol intake and bone metabolism in elderly women. Am J Clin Nutr. 2000;72(5):1206-1213. (PubMed)
88. Ganry O, Baudoin C, Fardellone P. Effect of alcohol intake on bone mineral density in elderly women: The EPIDOS Study. Epidemiologie de l'Osteoporose. Am J Epidemiol. 2000;151(8):773-780. (PubMed)
89. Tucker KL, Jugdaohsingh R, Powell JJ, et al. Effects of beer, wine, and liquor intakes on bone mineral density in older men and women. Am J Clin Nutr. 2009;89(4):1188-1196. (PubMed)
90. McLernon DJ, Powell JJ, Jugdaohsingh R, Macdonald HM. Do lifestyle choices explain the effect of alcohol on bone mineral density in women around menopause? Am J Clin Nutr. 2012;95(5):1261-1269. (PubMed)
91. Wosje KS, Kalkwarf HJ. Bone density in relation to alcohol intake among men and women in the United States. Osteoporos Int. 2007;18(3):391-400. (PubMed)
92. Maurel DB, Boisseau N, Benhamou CL, Jaffre C. Alcohol and bone: review of dose effects and mechanisms. Osteoporos Int. 2012;23(1):1-16. (PubMed)
93. Neafsey EJ, Collins MA. Moderate alcohol consumption and cognitive risk. Neuropsychiatr Dis Treat. 2011;7:465-484. (PubMed)
94. Tyas SL. Alcohol use and the risk of developing Alzheimer's disease. Alcohol Res Health. 2001;25(4):299-306. (PubMed)
95. Stavro K, Pelletier J, Potvin S. Widespread and sustained cognitive deficits in alcoholism: a meta-analysis. Addict Biol. 2013;18(2):203-213. (PubMed)
96. Peters R, Peters J, Warner J, Beckett N, Bulpitt C. Alcohol, dementia and cognitive decline in the elderly: a systematic review. Age Ageing. 2008;37(5):505-512. (PubMed)
97. Panza F, Frisardi V, Seripa D, et al. Alcohol consumption in mild cognitive impairment and dementia: harmful or neuroprotective? Int J Geriatr Psychiatry. 2012;27(12):1218-1238. (PubMed)
98. Panza F, Capurso C, D'Introno A, et al. Alcohol drinking, cognitive functions in older age, predementia, and dementia syndromes. J Alzheimers Dis. 2009;17(1):7-31. (PubMed)
99. Anstey KJ, Mack HA, Cherbuin N. Alcohol consumption as a risk factor for dementia and cognitive decline: meta-analysis of prospective studies. Am J Geriatr Psychiatry. 2009;17(7):542-555. (PubMed)
100. Mukamal KJ, Longstreth WT, Jr., Mittleman MA, Crum RM, Siscovick DS. Alcohol consumption and subclinical findings on magnetic resonance imaging of the brain in older adults: the cardiovascular health study. Stroke. 2001;32(9):1939-1946. (PubMed)
101. den Heijer T, Vermeer SE, van Dijk EJ, et al. Alcohol intake in relation to brain magnetic resonance imaging findings in older persons without dementia. Am J Clin Nutr. 2004;80(4):992-997. (PubMed)
102. Ding J, Eigenbrodt ML, Mosley TH, Jr., et al. Alcohol intake and cerebral abnormalities on magnetic resonance imaging in a community-based population of middle-aged adults: the Atherosclerosis Risk in Communities (ARIC) study. Stroke. 2004;35(1):16-21. (PubMed)
103. Kato I, Nomura A, Stemmermann GN, Chyou PH. Prospective study of clinical gallbladder disease and its association with obesity, physical activity, and other factors. Dig Dis Sci. 1992;37(5):784-790. (PubMed)
104. Misciagna G, Leoci C, Guerra V, et al. Epidemiology of cholelithiasis in southern Italy. Part II: Risk factors. Eur J Gastroenterol Hepatol. 1996;8(6):585-593. (PubMed)
105. Leitzmann MF, Giovannucci EL, Stampfer MJ, et al. Prospective study of alcohol consumption patterns in relation to symptomatic gallstone disease in men. Alcohol Clin Exp Res. 1999;23(5):835-841. (PubMed)
106. Leitzmann MF, Tsai CJ, Stampfer MJ, et al. Alcohol consumption in relation to risk of cholecystectomy in women. Am J Clin Nutr. 2003;78(2):339-347. (PubMed)
107. Maclure KM, Hayes KC, Colditz GA, Stampfer MJ, Speizer FE, Willett WC. Weight, diet, and the risk of symptomatic gallstones in middle-aged women. N Engl J Med. 1989;321(9):563-569. (PubMed)
108. Tseng M, Everhart JE, Sandler RS. Dietary intake and gallbladder disease: a review. Public Health Nutr. 1999;2(2):161-172. (PubMed)
109. Scragg RK, McMichael AJ, Baghurst PA. Diet, alcohol, and relative weight in gall stone disease: a case-control study. Br Med J (Clin Res Ed). 1984;288(6424):1113-1119. (PubMed)
110. Riley EP, Infante MA, Warren KR. Fetal alcohol spectrum disorders: an overview. Neuropsychol Rev. 2011;21(2):73-80. (PubMed)
111. Waterman EH, Pruett D, Caughey AB. Reducing fetal alcohol exposure in the United States. Obstet Gynecol Surv. 2013;68(5):367-378. (PubMed)
112. Jacobson JL, Jacobson SW. Drinking moderately and pregnancy. Effects on child development. Alcohol Res Health. 1999;23(1):25-30. (PubMed)
113. Jacobson JL, Dodge NC, Burden MJ, Klorman R, Jacobson SW. Number processing in adolescents with prenatal alcohol exposure and ADHD: differences in the neurobehavioral phenotype. Alcohol Clin Exp Res. 2011;35(3):431-442. (PubMed)
114. Jacobson JL, Jacobson SW. Effects of prenatal alcohol exposure on child development. Alcohol Res Health. 2002;26(4):282-286. (PubMed)
115. Niclasen J. Drinking or not drinking in pregnancy: the multiplicity of confounding influences. Alcohol Alcohol. 2014;49(3):349-355. (PubMed)
116. Centers for Disease Control and Prevention. Fetal Alcohol Spectrum Disorders (FASDs). Alcohol use in pregnancy. April 2014. Available at: http://www.cdc.gov/ncbddd/fasd/alcohol-use.html. Accessed 8/6/15.
117. American Academy of Pediatrics. Committee on Substance Abuse and Committee on Children With Disabilities. Fetal alcohol syndrome and alcohol-related neurodevelopmental disorders. Pediatrics. 2000;106(2 Pt 1):358-361. (PubMed)
118. Singletary KW, Gapstur SM. Alcohol and breast cancer: review of epidemiologic and experimental evidence and potential mechanisms. JAMA. 2001;286(17):2143-2151. (PubMed)
119. Seitz HK, Pelucchi C, Bagnardi V, La Vecchia C. Epidemiology and pathophysiology of alcohol and breast cancer: Update 2012. Alcohol Alcohol. 2012;47(3):204-212. (PubMed)
120. International Agency for Research on Cancer WHO. IARC monographs on the evaluation of carcingenic risks to humans. Vol 96; 2010. Available at: http://monographs.iarc.fr/ENG/Monographs/vol96/index.php. Accessed 8/24/15.
121. Scoccianti C, Lauby-Secretan B, Bello PY, Chajes V, Romieu I. Female breast cancer and alcohol consumption: a review of the literature. Am J Prev Med. 2014;46(3 Suppl 1):S16-25. (PubMed)
122. Klatsky AL, Udaltsova N, Li Y, Baer D, Nicole Tran H, Friedman GD. Moderate alcohol intake and cancer: the role of underreporting. Cancer Causes Control. 2014;25(6):693-699. (PubMed)
123. Smith-Warner SA, Spiegelman D, Yaun SS, et al. Alcohol and breast cancer in women: a pooled analysis of cohort studies. JAMA. 1998;279(7):535-540. (PubMed)
124. Hamajima N, Hirose K, Tajima K, et al. Alcohol, tobacco and breast cancer--collaborative reanalysis of individual data from 53 epidemiological studies, including 58,515 women with breast cancer and 95,067 women without the disease. Br J Cancer. 2002;87(11):1234-1245. (PubMed)
125. Key J, Hodgson S, Omar RZ, et al. Meta-analysis of studies of alcohol and breast cancer with consideration of the methodological issues. Cancer Causes Control. 2006;17(6):759-770. (PubMed)
126. Gou YJ, Xie DX, Yang KH, et al. Alcohol consumption and breast cancer survival: a meta-analysis of cohort studies. Asian Pac J Cancer Prev. 2013;14(8):4785-4790. (PubMed)
127. Brooks PJ, Zakhari S. Moderate alcohol consumption and breast cancer in women: from epidemiology to mechanisms and interventions. Alcohol Clin Exp Res. 2013;37(1):23-30. (PubMed)
128. National Cancer Institute. Breast Cancer Risk in American Women. [Web page]. Available at: http://www.cancer.gov/types/breast/risk-fact-sheet. Accessed 12/15/15.
129. Baglietto L, English DR, Gertig DM, Hopper JL, Giles GG. Does dietary folate intake modify effect of alcohol consumption on breast cancer risk? Prospective cohort study. BMJ. 2005;331(7520):807. (PubMed)
130. Rohan TE, Jain MG, Howe GR, Miller AB. Dietary folate consumption and breast cancer risk. J Natl Cancer Inst. 2000;92(3):266-269. (PubMed)
131. Sellers TA, Kushi LH, Cerhan JR, et al. Dietary folate intake, alcohol, and risk of breast cancer in a prospective study of postmenopausal women. Epidemiology. 2001;12(4):420-428. (PubMed)
132. Zhang S, Hunter DJ, Hankinson SE, et al. A prospective study of folate intake and the risk of breast cancer. JAMA. 1999;281(17):1632-1637. (PubMed)
133. Zhang SM, Willett WC, Selhub J, et al. Plasma folate, vitamin B6, vitamin B12, homocysteine, and risk of breast cancer. J Natl Cancer Inst. 2003;95(5):373-380. (PubMed)
134. Sellers TA, Vierkant RA, Cerhan JR, et al. Interaction of dietary folate intake, alcohol, and risk of hormone receptor-defined breast cancer in a prospective study of postmenopausal women. Cancer Epidemiol Biomarkers Prev. 2002;11(10 Pt 1):1104-1107. (PubMed)
135. Feigelson HS, Jonas CR, Robertson AS, McCullough ML, Thun MJ, Calle EE. Alcohol, folate, methionine, and risk of incident breast cancer in the American Cancer Society Cancer Prevention Study II Nutrition Cohort. Cancer Epidemiol Biomarkers Prev. 2003;12(2):161-164. (PubMed)
136. Tjonneland A, Christensen J, Olsen A, et al. Folate intake, alcohol and risk of breast cancer among postmenopausal women in Denmark. Eur J Clin Nutr. 2006;60(2):280-286. (PubMed)
137. Duffy CM, Assaf A, Cyr M, et al. Alcohol and folate intake and breast cancer risk in the WHI Observational Study. Breast Cancer Res Treat. 2009;116(3):551-562. (PubMed)
138. Suzuki R, Iwasaki M, Inoue M, et al. Alcohol consumption-associated breast cancer incidence and potential effect modifiers: the Japan Public Health Center-based Prospective Study. Int J Cancer. 2010;127(3):685-695. (PubMed)
139. Larsson SC, Bergkvist L, Wolk A. Folate intake and risk of breast cancer by estrogen and progesterone receptor status in a Swedish cohort. Cancer Epidemiol Biomarkers Prev. 2008;17(12):3444-3449. (PubMed)
140. Lieberman DZ. Children of alcoholics: an update. Curr Opin Pediatr. 2000;12(4):336-340. (PubMed)
141. National Institute on Alcohol Abuse and Alcoholism. A family history of alcoholism: are you at risk? [Web page]. June 2012. Available at: http://pubs.niaaa.nih.gov/publications/FamilyHistory/famhist.htm. Accessed 9/9/14.
142. Weathermon R, Crabb DW. Alcohol and medication interactions. Alcohol Res Health. 1999;23(1):40-54. (PubMed)
143. National Institute on Alcohol Abuse and Alcoholism. Older adults and alcohol. Available at: http://pubs.niaaa.nih.gov/publications/olderAdults/olderAdults.htm#toc03. Accessed 9/9/14.
144. National Institute on Alcohol Abuse and Alcoholism. Alcohol: a women's health issue. 2008. Available at: http://pubs.niaaa.nih.gov/publications/brochurewomen/women.htm. Accessed 8/24/15.
145. Klatsky AL. Alcohol and cardiovascular disease--more than one paradox to consider. Alcohol and hypertension: does it matter? Yes. J Cardiovasc Risk. 2003;10(1):21-24. (PubMed)
146. Cushman WC. Alcohol consumption and hypertension. J Clin Hypertens (Greenwich). 2001;3(3):166-170. (PubMed)
147. Briasoulis A, Agarwal V, Messerli FH. Alcohol consumption and the risk of hypertension in men and women: a systematic review and meta-analysis. J Clin Hypertens (Greenwich). 2012;14(11):792-798. (PubMed)
148. Taylor B, Irving HM, Baliunas D, et al. Alcohol and hypertension: gender differences in dose-response relationships determined through systematic review and meta-analysis. Addiction. 2009;104(12):1981-1990. (PubMed)
149. Xin X, He J, Frontini MG, Ogden LG, Motsamai OI, Whelton PK. Effects of alcohol reduction on blood pressure: a meta-analysis of randomized controlled trials. Hypertension. 2001;38(5):1112-1117. (PubMed)
150. Klatsky AL. Alcohol and cardiovascular diseases: a historical overview. Novartis Found Symp. 1998;216:2-12; discussion 12-18, 152-158. (PubMed)
151. Koskinen P, Kupari M, Leinonen H. Role of alcohol in recurrences of atrial fibrillation in persons less than 65 years of age. Am J Cardiol. 1990;66(12):954-958. (PubMed)
152. Ruigomez A, Johansson S, Wallander MA, Rodriguez LA. Incidence of chronic atrial fibrillation in general practice and its treatment pattern. J Clin Epidemiol. 2002;55(4):358-363. (PubMed)
153. Samokhvalov AV, Irving HM, Rehm J. Alcohol consumption as a risk factor for atrial fibrillation: a systematic review and meta-analysis. Eur J Cardiovasc Prev Rehabil. 2010;17(6):706-712. (PubMed)
154. Larsson SC, Drca N, Wolk A. Alcohol consumption and risk of atrial fibrillation: a prospective study and dose-response meta-analysis. J Am Coll Cardiol. 2014;64(3):281-289. (PubMed)
155. Conen D, Albert CM. Alcohol consumption and risk of atrial fibrillation: how much is too much? J Am Coll Cardiol. 2014;64(3):290-292. (PubMed)
156. Wannamethee G, Shaper AG. Alcohol and sudden cardiac death. Br Heart J. 1992;68(5):443-448. (PubMed)
157. Dyer AR, Stamler J, Paul O, et al. Alcohol consumption, cardiovascular risk factors, and mortality in two Chicago epidemiologic studies. Circulation. 1977;56(6):1067-1074. (PubMed)
158. Balbao CE, de Paola AA, Fenelon G. Effects of alcohol on atrial fibrillation: myths and truths. Ther Adv Cardiovasc Dis. 2009;3(1):53-63. (PubMed)
159. Piano MR, Phillips SA. Alcoholic cardiomyopathy: pathophysiologic insights. Cardiovasc Toxicol. 2014;14(4):291-308. (PubMed)
160. Klatsky AL. Alcohol and cardiovascular diseases: where do we stand today? J Intern Med. 2015;278(3):238-250. (PubMed)
161. Fernandez-Sola J, Nicolas-Arfelis JM. Gender differences in alcoholic cardiomyopathy. J Gend Specif Med. 2002;5(1):41-47. (PubMed)
162. Urbano-Marquez A, Estruch R, Fernandez-Sola J, Nicolas JM, Pare JC, Rubin E. The greater risk of alcoholic cardiomyopathy and myopathy in women compared with men. JAMA. 1995;274(2):149-154. (PubMed)
163. Louvet A, Mathurin P. Alcoholic liver disease: mechanisms of injury and targeted treatment. Nat Rev Gastroenterol Hepatol. 2015;12(4):231-242. (PubMed)
164. Corrao G, Bagnardi V, Zambon A, La Vecchia C. A meta-analysis of alcohol consumption and the risk of 15 diseases. Prev Med. 2004;38(5):613-619. (PubMed)
165. Rehm J, Baliunas D, Borges GL, et al. The relation between different dimensions of alcohol consumption and burden of disease: an overview. Addiction. 2010;105(5):817-843. (PubMed)
166. Maher JJ. Alcoholic liver disease. In: Feldman M, Friedman LS, Sleisenger LH, eds. Sleisenger & Fordtran's Gastrointestinal and Liver Disease. 7th ed. St. Louis: W.B. Saunders; 2002:1375-1387.
167. Lieber CS. Alcohol and hepatitis C. Alcohol Res Health. 2001;25(4):245-254. (PubMed)
168. Bagnardi V, Blangiardo M, La Vecchia C, Corrao G. Alcohol consumption and the risk of cancer: a meta-analysis. Alcohol Res Health. 2001;25(4):263-270. (PubMed)
169. Doll R, Forman D, La Vecchia C, Woutersen R. Alcoholic beverages and cancers of the digestive tract and larynx. In: MacDonald I, ed. Health Issues Related to Alcohol Consumption. Oxford: Blackwell Science Ltd; 1999:351-394.
170. Bernardin F, Maheut-Bosser A, Paille F. Cognitive impairments in alcohol-dependent subjects. Front Psychiatry. 2014;5:78. (PubMed)
171. Thomson AD. Mechanisms of vitamin deficiency in chronic alcohol misusers and the development of the Wernicke-Korsakoff syndrome. Alcohol Alcohol Suppl. 2000;35(1):2-7. (PubMed)
172. Greenberg DM, Lee JW. Psychotic manifestations of alcoholism. Curr Psychiatry Rep. 2001;3(4):314-318. (PubMed)
173. DiMagno EP, Chari S. Acute Pancreatitis. In: Feldman M, Friedman LS, Sleisenger LH, eds. Sleisenger & Fordtran's Gastrointestinal and Liver Disease. St. Louis: W.B. Saunders; 2002:913-942.
174. Yadav D, Whitcomb DC. The role of alcohol and smoking in pancreatitis. Nat Rev Gastroenterol Hepatol. 2010;7(3):131-145. (PubMed)
175. Forsmark CE. Chronic Pancreatitis. In: Feldman M, Friedman LS, Sleisenger LH, eds. Sleisenger & Fordtran's Gastrointestinal and Liver Disease. St. Louis: W.B. Saunders; 2002.
176. Yadav D, Papachristou GI, Whitcomb DC. Alcohol-associated pancreatitis. Gastroenterol Clin North Am. 2007;36(2):219-238, vii. (PubMed)
177. Pandol SJ, Lugea A, Mareninova OA, et al. Investigating the pathobiology of alcoholic pancreatitis. Alcohol Clin Exp Res. 2011;35(5):830-837. (PubMed)
178. Health risks and benefits of alcohol consumption. Alcohol Res Health. 2000;24(1):5-11. (PubMed)
179. Vinson DC, Maclure M, Reidinger C, Smith GS. A population-based case-crossover and case-control study of alcohol and the risk of injury. J Stud Alcohol. 2003;64(3):358-366. (PubMed)
180. US National Highway Traffic Safety Admininstration's National Center for Statistics and Analysis. Traffic safety facts. 2013 data: Alcohol-impaired driving. December 2014. Available at: http://www-nrd.nhtsa.dot.gov/Pubs/812102.pdf. Accessed 8/6/15.
181. Moskowitz H, Fiorentino DA. Review of the literature on the effects of low doses of alcohol on driving-related skills. Washington D.C.: National Highway Traffic Safety Administration; 2000.
182. Fisher HR, Simpson RI, Kapur BM. Calculation of blood alcohol concentration (BAC) by sex, weight, number of drinks and time. Can J Public Health. 1987;78(5):300-304. (PubMed)
183. National Institute on Alcohol Abuse and Alcoholism. Alcohol alert: alcohol, violence, and aggression [Web page]. October 2000. Available at: http://pubs.niaaa.nih.gov/publications/aa38.htm. Accessed 10/3/07.
ナッツ
ナッツ
要約
●ナッツは食物繊維、植物ステロール、および不飽和脂肪の良好な摂取源である。(詳細はこちら)
●大部分の前向きコホート研究の結果では、習慣的にナッツを摂取(約28gを少なくとも週5回摂取することに相当)すると、心血管疾患のリスクが大きく減少するという関連があることが示唆される。(詳細はこちら)
●ある前向きコホート研究で、習慣的なナッツの摂取は2型糖尿病の発症リスクの大きな低下と関連があることがわかった。(詳細はこちら)
●大部分の前向き研究で、習慣的にナッツを摂取する者は滅多に摂取しない者より体重が少ないことが示されている。そうは言っても、大部分のナッツは約28gでほぼ160kcalのエネルギーがあるので、他のあまり健康でないお菓子をナッツに代えることは、ナッツの摂取を増やす際に体重増加を避けるよい方法である。(詳細はこちら)
序説
あまり遠くない昔には、ナッツは脂肪含有量が比較的高いので不健康だと考えられていた。対照的に、習慣的なナッツの摂取は健康的な食事の重要な一部であることが、最近の研究では示唆される(1)。ナッツの脂肪含有量は比較的高い(約28g中14~19g)が、ナッツの大部分の脂肪はより健康的な一価不飽和脂肪および多価不飽和脂肪である(表1参照)(2)。「ナッツ」という用語は、アーモンド、ブラジルナッツ、カシューナッツ、ヘーゼルナッツ、マカデミアナッツ、ピーカン、ピスタチオ、クルミ、およびピーナッツを含む。その名に反して、ピーナッツ(peanut)は実はえんどう豆(pea)やインゲン豆(bean)と同じ豆類である。しかしながら、ピーナッツは栄養的に木の実のナッツと似ていて、いくつかの同じような有益な特性がある。
疾病予防
心血管疾患
冠動脈性心疾患
大規模前向きコホート研究で、習慣的なナッツの摂取は冠動脈性心疾患(CHD)リスクの大きな低減に一貫して関連があった(3)。ナッツの摂取に予防効果があることを見つけた初期の研究の一つがアドベンティスト健康研究で、これは30,000人超のセブンスデー・アドベンティスト(キリスト教アドベンティスト派信者)を12年にわたって追跡したものである(4)。一般的に、セブンスデー・アドベンティストの食事や生活習慣は、平均的なアメリカ人のそれよりも心血管疾患予防に勧められるものに近い。アドベンティスト健康研究に参加した者はほとんどが喫煙せず、大部分の者が平均的なアメリカ人よりも飽和脂肪が少ない食事をしていた。この健康的な集団において、ナッツを週に少なくとも5回食べる者は、週に1回未満しか食べない者よりもCHDによる死亡リスクが48%、非致死性心筋梗塞(MI)のリスクが51%低かった(4)。83歳超のセブンスデー・アドベンティストにおいては、週に少なくとも5回ナッツを食べる者は、週に1回未満しか食べない者よりもCHDの死亡リスクが39%低かった(5)。3,000人超の黒人男女によるより小規模な前向き研究でも、同じような結果が報告された(6)。週に少なくとも5回ナッツを摂取する者は、週に1回未満しか食べない者よりもCHDの死亡リスクが44%低かった(5)。
ナッツの心臓保護効果は、セブンスデー・アドベンティストに限ったものではない。14年間に86,000人超の女性が参加した看護師健康調査で、週に約142g超のナッツを摂取する者は、月に約28g未満しか摂取しない者に比べてCHDのリスクが35%低かった(7)。同様の低下は、非致死性MIのリスクやCHDによる死亡リスクでも見られた。より最近の21,000人超の男性医師による17年間の研究で、週に少なくとも2回ナッツを摂取する者は、ナッツを滅多にまたはまったく食べない者に比べて心臓突然死のリスクが53%低かったことがわかったが、非致死性MIや急死でないCHDによる死亡のリスクにおいては大きな減少はなかった(8)。この男性医師の集団の追跡調査分析で、ナッツの摂取は心不全の発生と関連がないことがわかった(9)。閉経後の女性30,000人超を12年間追跡した米国のアイオワ女性健康調査は、ナッツ摂取とCHDの死亡率との間に大きな逆相関が見られないとした唯一の前向き研究論文であるが、ナッツを週に2回摂取する者は全死因による死亡率に若干ではあるが有意義な減少が見られた(10)。全体的に大部分の前向きコホート研究の結果は、習慣的なナッツの摂取はCHDに関連する死亡リスクの大きな減少に関連があることを示唆している。実際、上記した米国における疫学研究のうちの4つに対する最近の統合解析で、ナッツ摂取が最も多い(週に約5回)者はCHDリスクが35%低かったことがわかった(11)。対照臨床試験の結果からは、ナッツの心臓保護効果の少なくとも一部は、血清総コレステロール濃度およびLDLコレステロール濃度に対する有益な効果に由来することが示唆される(3)。少なくとも18の対照臨床試験で、飽和脂肪の少ない食事にナッツを加えると、血清コレステロールが正常または高い者に血清総コレステロール濃度およびLDLコレステロール濃度の大きな減少があったことがわかった。これらの効果は、アーモンド(12~15)、ヘーゼルナッツ(16)、マカデミアナッツ(17~19)、ピーナッツ(20,21)、ピーカン(22)、ピスタチオ(23,24)、およびクルミ(25~30)で見つかった。より最近のある横断研究では、ナッツや種子を頻繁に食べると、多民族集団で炎症性バイオマーカーの血清濃度が低くなることに関連があることがわかった(31)。エビデンスが状況的ではあるものの、これらの発見はナッツに含まれる化合物が炎症を減らすことで心血管疾患のリスクを低下させているかもしれないことを示唆している。
ナッツに含まれる心臓保護的化合物
食事の飽和脂肪をナッツに含まれるような多価不飽和脂肪や一価不飽和脂肪に代えると、血清総コレステロール濃度およびLDLコレステロール濃度を下げる可能性がある(3)。しかしいくつかの臨床試験では、ナッツ摂取によるコレステロール低減効果は、ナッツに含まれる多価不飽和脂肪や一価不飽和脂肪の含有量から予想されるよりも大きかった。このことは、ナッツにそれ以外の予防的要素があることを示唆している(32)。コレステロール低減効果に寄与するかもしれないナッツのその他の生物活性化合物には、食物繊維や植物ステロールがある(33)。特定のナッツの不飽和脂肪、食物繊維、および植物ステロール含有量については、表1を参照されたい。クルミはαリノレン酸というオメガ3脂肪酸が特に豊富で、心臓突然死につながるかもしれない心不整脈の予防などの多くの心臓保護効果がある。ナッツの心臓保護効果に寄与するかもしれないその他の栄養素には、葉酸塩、ビタミンE,およびカリウムがある(3,33~35)。米国食品医薬品局(FDA)は、ナッツに関する以下のような限定的健康強調表示を承認して、ナッツの摂取と心血管疾患リスクとの関係について最近出現しているエビデンスを認めている(36):「飽和脂肪とコレステロールが少ない食事の一部として、ほとんどの種類のナッツを1日に約42g食べることによって心疾患のリスクが減少する可能性があることが、科学的なエビデンスで証明されていないが示唆はされている。」ナッツの栄養素含有量に関する詳細は、米国農務省の国民栄養データベースを参照のこと。
2型糖尿病
看護師健康調査の最近の結果、ナッツとピーナッツバターの摂取が女性の2型糖尿病(DM)リスクと逆相関があるかもしれないことが示唆された(37)。16年間追跡対象となったこの86,000人超の女性集団では、週に少なくとも5回約28gのナッツを摂取する者は、めったにあるいはまったく摂取しない者に比べて2型糖尿病の発症リスクが27%低かった。同様に、ピーナッツバターを週に少なくとも5回摂取する者は、めったに摂取しないかまったく摂取しない者に比べて、2型糖尿病の発症リスクが21%低かった。これらの発見はその他の研究でも確認される必要があるが、これらはナッツが健康な食事の要素になりうることの追加的エビデンスとなる。観察された2型糖尿病の減少に寄与しているかもしれないナッツの化合物は、不飽和脂肪、食物繊維、およびマグネシウムである。
体重過多および肥満
主要な懸念は、ナッツの摂取を増やすと体重増加や肥満を起こすのではないかということだ。しかし、アドベンティスト健康研究(5)や看護師健康調査(7)を含む大規模コホート研究のいくつかの横断解析で、習慣的にナッツを摂取する者はめったに摂取しない者に比べて体重が低い傾向があることが示された。最近、スペインで実施された28ヶ月の前向き研究で、ナッツをより多く摂取した参加者はめったに摂取しなかった者に比べて、体重増加のリスクが低かったことがわかった(38)。同様の関連は、看護師健康調査IIでも観察された(39)。これらの疫学データは、自由に生活している被験者においては、ナッツをより多く摂取しても大きな体重増加は起こらず、むしろ食事にナッツを入れることで体重管理に有益であるかもしれないことを示している。ナッツのタンパク質や食物繊維の量がより多いことが、満腹感を起こして空腹感を抑えるのかもしれない。
安全性
ナッツアレルギー
ピーナッツや木の実のナッツ(アーモンド、カシューナッツ、ヘーゼルナッツ、ピーカン、ピスタチオ、およびクルミ)に対するアレルギーは、最も一般的な食物アレルギーの一種で、米国の人口の少なくとも1%に影響している(40)。すべての食物アレルギーは重篤な反応を引き起こす可能性があるが、ピーナッツや木の実のナッツは命にかかわるアレルギー反応であるアナフィラキシーに最も一般的に関連する食品の一つである(41)。重篤なピーナッツや木の実のナッツのアレルギーのある者は、ラベルをチェックしたりラベルの無いスナック、キャンディー、およびデザートを避けたりして、ピーナッツや木の実のナッツをうっかり口にすることがないように特別に用心する必要がある。意図せずにピーナッツや木の実のナッツを摂取することを避けるためのさらなるアドバイスについては、食物アレルギーおよびアナフィラキシーネットワークのウェブサイトを参照のこと。
悪影響
セレンの豊富な土壌のあるブラジルの地域で育ったブラジルナッツは、一粒のナッツに100μg超のセレンが含まれている可能性があるが、その一方でセレンのあまりない土壌で育ったものはその10分の1の含有量であるかもしれない(42)。セレンの毒性についての詳細は、「セレン」のタイトルの記事を参照のこと。
摂取の推奨量
約28gのナッツを週に5回といった習慣的なナッツの摂取は、疫学研究において冠動脈性心疾患(CHD)のリスクが一貫して大きく減るという関連がある。飽和脂肪の少ない食事の一部として毎日約28~57gのナッツを摂取すると、血清総コレステロールおよびLDLコレステロールを下げることが、多くの対照臨床試験でわかっている。約28gのナッツは少なくとも160kcalあるので、その他の食物を除かないで習慣的な食事に毎日28gのナッツを単純に追加すると、体重が増えるかもしれない。その他のより不健康なスナックやメインデッシュの肉の代わりに塩を付けていないナッツにすることは、ナッツを健康な食事の一部にするための方法である。表2はナッツに含まれるいくつかの有益性のありそうな化合物のリストである。
| 主要栄養素 | ビタミン | ミネラル | 植物性化学物質 |
|---|---|---|---|
| 不飽和脂肪 | 葉酸塩 | マグネシウム | 食物繊維 |
| ビタミンE | カリウム | 植物ステロール |
Authors and Reviewers
Originally written in 2003 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in December 2005 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in June 2009 by:
Victoria J. Drake, Ph.D.
Linus Pauling Institute
Oregon State University
Reviewed in June 2009 by:
Frank B. Hu, M.D., Ph.D.
Professor of Nutrition and Epidemiology
Harvard School of Public Health
Copyright 2003-2024 Linus Pauling Institute
References
1. Hu FB, Stampfer MJ. Nut consumption and risk of coronary heart disease: a review of epidemiologic evidence. Curr Atheroscler Rep. 1999;1(3):204-209. (PubMed)
2. Kris-Etherton PM, Yu-Poth S, Sabate J, Ratcliffe HE, Zhao G, Etherton TD. Nuts and their bioactive constituents: effects on serum lipids and other factors that affect disease risk. Am J Clin Nutr. 1999;70(3 Suppl):504S-511S. (PubMed)
3. Kris-Etherton PM, Zhao G, Binkoski AE, Coval SM, Etherton TD. The effects of nuts on coronary heart disease risk. Nutr Rev. 2001;59(4):103-111. (PubMed)
4. Fraser GE, Sabate J, Beeson WL, Strahan TM. A possible protective effect of nut consumption on risk of coronary heart disease. The Adventist Health Study. Arch Intern Med. 1992;152(7):1416-1424. (PubMed)
5. Fraser GE, Shavlik DJ. Risk factors for all-cause and coronary heart disease mortality in the oldest-old. The Adventist Health Study. Arch Intern Med. 1997;157(19):2249-2258. (PubMed)
6. Fraser GE, Sumbureru D, Pribis P, Neil RL, Frankson MA. Association among health habits, risk factors, and all-cause mortality in a black California population. Epidemiology. 1997;8(2):168-174. (PubMed)
7. Hu FB, Stampfer MJ, Manson JE, et al. Frequent nut consumption and risk of coronary heart disease in women: prospective cohort study. BMJ. 1998;317(7169):1341-1345. (PubMed)
8. Albert CM, Gaziano JM, Willett WC, Manson JE. Nut consumption and decreased risk of sudden cardiac death in the Physicians' Health Study. Arch Intern Med. 2002;162(12):1382-1387. (PubMed)
9. Djousse L, Rudich T, Gaziano JM. Nut consumption and risk of heart failure in the Physicians' Health Study I. Am J Clin Nutr. 2008;88(4):930-933. (PubMed)
10. Ellsworth JL, Kushi LH, Folsom AR. Frequent nut intake and risk of death from coronary heart disease and all causes in postmenopausal women: the Iowa Women's Health Study. Nutr Metab Cardiovasc Dis. 2001;11(6):372-377. (PubMed)
11. Kris-Etherton PM, Hu FB, Ros E, Sabate J. The role of tree nuts and peanuts in the prevention of coronary heart disease: multiple potential mechanisms. J Nutr. 2008;138(9):1746S-1751S. (PubMed)
12. Hyson DA, Schneeman BO, Davis PA. Almonds and almond oil have similar effects on plasma lipids and LDL oxidation in healthy men and women. J Nutr. 2002;132(4):703-707. (PubMed)
13. Jenkins DJ, Kendall CW, Marchie A, et al. Dose response of almonds on coronary heart disease risk factors: blood lipids, oxidized low-density lipoproteins, lipoprotein(a), homocysteine, and pulmonary nitric oxide: a randomized, controlled, crossover trial. Circulation. 2002;106(11):1327-1332. (PubMed)
14. Sabate J, Haddad E, Tanzman JS, Jambazian P, Rajaram S. Serum lipid response to the graduated enrichment of a Step I diet with almonds: a randomized feeding trial. Am J Clin Nutr. 2003;77(6):1379-1384. (PubMed)
15. Spiller GA, Jenkins DA, Bosello O, Gates JE, Cragen LN, Bruce B. Nuts and plasma lipids: an almond-based diet lowers LDL-C while preserving HDL-C. J Am Coll Nutr. 1998;17(3):285-290. (PubMed)
16. Durak I, Koksal I, Kacmaz M, Buyukkocak S, Cimen BM, Ozturk HS. Hazelnut supplementation enhances plasma antioxidant potential and lowers plasma cholesterol levels. Clin Chim Acta. 1999;284(1):113-115.
17. Curb JD, Wergowske G, Dobbs JC, Abbott RD, Huang B. Serum lipid effects of a high-monounsaturated fat diet based on macadamia nuts. Arch Intern Med. 2000;160(8):1154-1158. (PubMed)
18. Garg ML, Blake RJ, Wills RB. Macadamia nut consumption lowers plasma total and LDL cholesterol levels in hypercholesterolemic men. J Nutr. 2003;133(4):1060-1063. (PubMed)
19. Griel AE, Cao Y, Bagshaw DD, Cifelli AM, Holub B, Kris-Etherton PM. A macadamia nut-rich diet reduces total and LDL-cholesterol in mildly hypercholesterolemic men and women. J Nutr. 2008;138(4):761-767. (PubMed)
20. Kris-Etherton PM, Pearson TA, Wan Y, et al. High-monounsaturated fatty acid diets lower both plasma cholesterol and triacylglycerol concentrations. Am J Clin Nutr. 1999;70(6):1009-1015. (PubMed)
21. O'Byrne DJ, Knauft DA, Shireman RB. Low fat-monounsaturated rich diets containing high-oleic peanuts improve serum lipoprotein profiles. Lipids. 1997;32(7):687-695. (PubMed)
22. Morgan WA, Clayshulte BJ. Pecans lower low-density lipoprotein cholesterol in people with normal lipid levels. J Am Diet Assoc. 2000;100(3):312-318. (PubMed)
23. Edwards K, Kwaw I, Matud J, Kurtz I. Effect of pistachio nuts on serum lipid levels in patients with moderate hypercholesterolemia. J Am Coll Nutr. 1999;18(3):229-232. (PubMed)
24. Sheridan MJ, Cooper JN, Erario M, Cheifetz CE. Pistachio nut consumption and serum lipid levels. J Am Coll Nutr. 2007;26(2):141-148. (PubMed)
25. Abbey M, Noakes M, Belling GB, Nestel PJ. Partial replacement of saturated fatty acids with almonds or walnuts lowers total plasma cholesterol and low-density-lipoprotein cholesterol. Am J Clin Nutr. 1994;59(5):995-999. (PubMed)
26. Almario RU, Vonghavaravat V, Wong R, Kasim-Karakas SE. Effects of walnut consumption on plasma fatty acids and lipoproteins in combined hyperlipidemia. Am J Clin Nutr. 2001;74(1):72-79. (PubMed)
27. Chisholm A, Mann J, Skeaff M, et al. A diet rich in walnuts favourably influences plasma fatty acid profile in moderately hyperlipidaemic subjects. Eur J Clin Nutr. 1998;52(1):12-16. (PubMed)
28. Morgan JM, Horton K, Reese D, Carey C, Walker K, Capuzzi DM. Effects of walnut consumption as part of a low-fat, low-cholesterol diet on serum cardiovascular risk factors. Int J Vitam Nutr Res. 2002;72(5):341-347. (PubMed)
29. Sabate J, Fraser GE, Burke K, Knutsen SF, Bennett H, Lindsted KD. Effects of walnuts on serum lipid levels and blood pressure in normal men. N Engl J Med. 1993;328(9):603-607. (PubMed)
30. Zambon D, Sabate J, Munoz S, et al. Substituting walnuts for monounsaturated fat improves the serum lipid profile of hypercholesterolemic men and women. A randomized crossover trial. Ann Intern Med. 2000;132(7):538-546. (PubMed)
31. Jiang R, Jacobs DR, Jr., Mayer-Davis E, et al. Nut and Seed Consumption and Inflammatory Markers in the Multi-Ethnic Study of Atherosclerosis. Am J Epidemiol. 2005;163(3):222-31. (PubMed)
32. Coulston AM. Do Nuts Have a Place in a Healthful Diet? Nutr Today. 2003;38(3):95-99. (PubMed)
33. Segura R, Javierre C, Lizarraga MA, Ros E. Other relevant components of nuts: phytosterols, folate and minerals. Br J Nutr. 2006;96 Suppl 2:S36-44. (PubMed)
34. Willett WC. Eat, Drink, and be Healthy: The Harvard Medical School Guide to Healthy Eating. New York: Simon & Schuster; 2001.
35. Coates AM, Howe PR. Edible nuts and metabolic health. Curr Opin Lipidol. 2007;18(1):25-30. (PubMed)
36. US Food and Drug Administration, Center for Food Safety and Nutrition. Summary of Qualified Health Claims Subject to Enforcement Discretion. 2003. http://www.fda.gov/Food/IngredientsPackagingLabeling/LabelingNutrition/ucm073992.htm.
37. Jiang R, Manson JE, Stampfer MJ, Liu S, Willett WC, Hu FB. Nut and peanut butter consumption and risk of type 2 diabetes in women. JAMA. 2002;288(20):2554-2560. (PubMed)
38. Bes-Rastrollo M, Sabate J, Gomez-Gracia E, Alonso A, Martinez JA, Martinez-Gonzalez MA. Nut consumption and weight gain in a Mediterranean cohort: The SUN study. Obesity (Silver Spring). 2007;15(1):107-116. (PubMed)
39. Bes-Rastrollo M, Wedick NM, Martinez-Gonzalez MA, Li TY, Sampson L, Hu FB. Prospective study of nut consumption, long-term weight change, and obesity risk in women. Am J Clin Nutr. 2009;89(6):1913-1919. (PubMed)
40. Sicherer SH, Munoz-Furlong A, Burks AW, Sampson HA. Prevalence of peanut and tree nut allergy in the US determined by a random digit dial telephone survey. J Allergy Clin Immunol. 1999;103(4):559-562. (PubMed)
41. Al-Muhsen S, Clarke AE, Kagan RS. Peanut allergy: an overview. CMAJ. 2003;168(10):1279-1285. (PubMed)
42. Chang JC. Selenium content of Brazil nuts from two geographic locations in Brazil. Chemosphere. 1995;30:801-802. (PubMed)
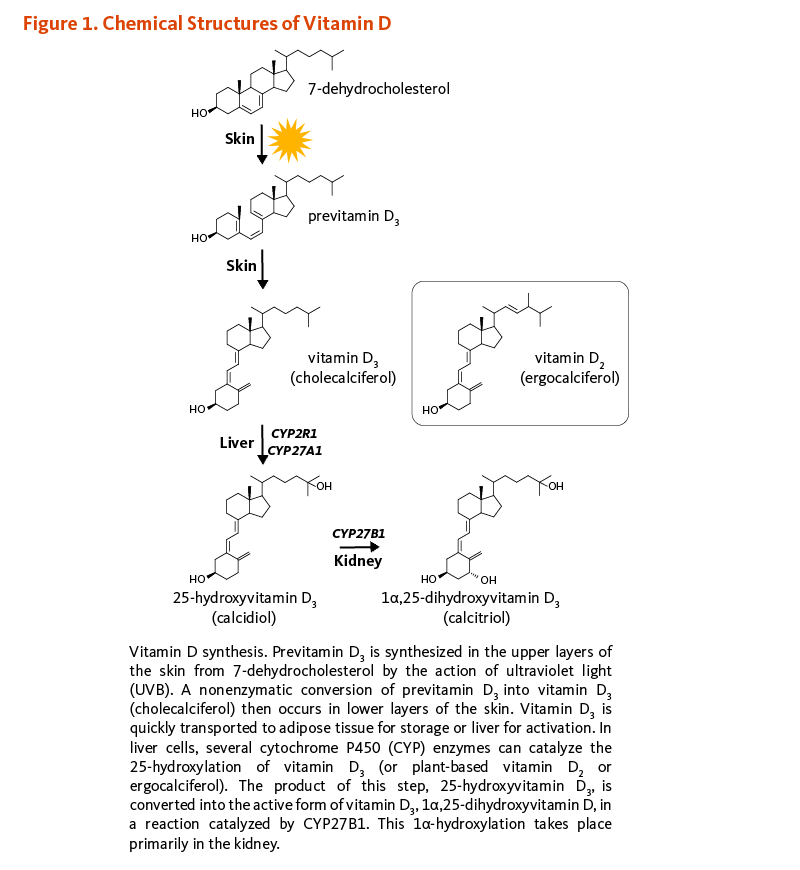
![Figure 2. Conversion to the Active Form of Vitamin D and VDR-mediated Gene Regulation. Mechanism of action. 25-hydroxyvitamin D (25(OH)D) is the main form of vitamin D in the circulation. Most 25(OH)D and 1α,25-dihydroxyvitamin D (1,25(OH)2D) molecules are transported bound to the vitamin D-binding protein and they enter cells via the megalin/tubulin complex. In kidney cells, 1α-hydroxylase (CYP27B1) catalyzes the conversion of 25(OH)D into 1,25(OH)2D. Parathyroid hormone (PTH), estradiol, and low phosphorus concentration ([P]) stimulate this reaction, whereas 1,25(OH)2D, fibroblast growth factor-23 (FGF-23), and high calcium concentration ([Ca]) inhibit it. 1,25(OH)2D enters the circulation and is transported to extra-renal target tissues where it can regulate gene expression. In the nucleus of target cells, 1,25(OH)2D binds to the vitamin D receptor (VDR), which heterodimerizes with the retinoid X receptor (RXR). VDR-RXR binds to vitamin D response elements (VDRE) in the promoter of vitamin D target genes. 25(OH)D, 25-hydroxyvitamin D; 1,25(OH)2D, 1α,25-dihydroxyvitamin D; [Ca], calcium concentration; CYP2R1, 1α-hydroxylase; DBP, vitamin D-binding protein; FGF-23, fibroblast growth factor-23; PTH, parathyroid hormone; [P], phosphorus concentration; RNA Pol II, RNA polymerase II; RXR, retinoid X receptor; VDR, vitamin D nuclear receptor; VDRE, vitamin D response element.](/sites/lpi.oregonstate.edu/files/vitamin-d-figure-2-800px.png)
![Figure 3. Regulation of Calcium and Phosphorus Homeostasis. Calcium and phosphorus homeostasis. A slight drop in blood calcium concentration ([Ca2+]) results in the secretion of parathyroid hormone (PTH) by the parathyroid glands. PTH simulates the activity of CYP27B1 (25-hydroxyvitamin D-1α-hydroxylase enzyme) that catalyzes the hydroxylation of 25-hydroxyvitamin D into 1α,25-dihydroxyvitamin D. This active form of vitamin D (i) increases the reabsorption of calcium filtered by the kidneys and stimulates phosphorus excretion, (ii) increases the intestinal absorption of both calcium and phosphorus, and (iii) mobilizes calcium (and phosphorus) from bone when dietary calcium intake is insufficient. PTH also stimulates bone resorption that releases calcium and phosphorus. 1α,25-dihydroxyvitamin D inhibits its own production, as well as PTH synthesis, via negative feedback loops. FGF-23 is secreted by bone-forming cells (osteoblasts) in response to an increase in phosphorus intake. FGF-23 inhibits the synthesis of 1α,25-dihydroxyvitamin D and promotes phosphorus excretion in the urine. [Ca2+], calcium concentration; FGF-23, fibroblast growth factor-23; PTH, parathyroid hormone.](/sites/lpi.oregonstate.edu/files/vitamin-d-figure-3-800px.png)