ビタミン
ビオチン
目次
要約
ビオチンはビタミンB複合体(ビタミンB群)に属する水溶性ビタミンの1種である。ビオチンがビタミンとして立証されるまでにはその発見以後40年近くを要した(1)。ビオチンは全ての生物に必要であるが、生合成できる生物種はバクテリアや酵母、カビ、藻類やいくつかの植物に限られている(2)。
機能
ビオチンは哺乳動物の5種類のカルボキシラーゼ(enzyme)の活性部位に結合する(3)。ビオチンがタンパク質など別の分子へ結合することを“ビオチニル化”という。ホロカルボキシラーゼ合成酵素(HCS)はアポカルボキシラーゼ(不活性型)のビオチニル化やヒストンのビオチニル化を触媒する(ヒストンのビオチニル化の項目を参照)。ビオチニダーゼはヒストンやカルボキシラーゼの分解産物(peptide)からビオチンを遊離する。
補酵素
各々のカルボキシラーゼは生命維持に必須の代謝反応を触媒する。
- アセチルCoAカルボキシラーゼⅠ及びⅡはアセチルCoAに重炭酸イオン(HCO3-)を結合させマロニルCoAを合成する反応を触媒する。マロニルCoAは脂肪酸合成に必須である。アセチルCoAカルボキシラーゼⅠは細胞質での脂肪酸の合成に極めて重要であり、アセチルCoAカルボキシラーゼⅡはミトコンドリアでの脂肪酸の酸化(β酸化)を調節する。
- ピルビン酸カルボキシラーゼは糖新生-糖質以外の物質(例えばアミノ酸)からグルコースを生成すること-において極めて重要な酵素である。
- メチルクロトニルCoAカルボキシラーゼは必須アミノ酸であるロイシンの異化で、不可欠なステップを触媒する。
- プロピオニルCoAカルボキシラーゼは特定のアミノ酸やコレステロール、奇数鎖脂肪酸(炭素数が奇数個の脂肪酸)の代謝で必須段階を触媒する(4)。
ヒストンのビオチニル化
ヒストンはDNAと結合しコンパクトな構造にパッケージングすることでヌクレオソーム(クロモソームに不可欠な構造的構成要素)を形成するタンパク質である。コンパクトにパッケージングされたDNAは、DNAの複製や転写の際に弛まなければならない。アセチル基やメチル基の結合によるヒストン修飾(アセチル化もしくはメチル化)はヒストン構造を変化させ、DNAの複製や転写に影響を与える。数多くの証拠から、ヒストンのビオチニル化は細胞増殖や他の細胞応答と同様にDNAの複製や転写を調節する役割を持つことが示されている(5-7)。
ビオチン欠乏症
明白なビオチン欠乏症は非常に稀であるが、ヒトにおける食事性ビオチンの必要量は異なる2つの状況での調査から明示されている。すなわち、ビオチン補給なしでの長期的経静脈栄養(非経口栄養)と長期間(数週間~数年間)にわたる生卵白の摂取である。アビジンは卵白中に存在する抗微生物タンパク質で、ビオチンと強固に結合し腸管からの吸収を阻害する。アビジンは加熱調理によって消化を受けやすくなる。その結果、アビジンは食事性ビオチンの吸収を阻害することができなくなる(8)。
以下の3つは、ビオチン栄養状態の指標としてその有効性が実証されている評価基準である:(1)ビオチン酵素であるメチルクロトニルCoAカルボキシラーゼ活性の低下を反映する有機酸(3-ヒドロキシイソ吉草酸)排泄の増加(2)尿中ビオチン排泄の減少(3)末梢血リンパ球のプロピオニルCoAカルボキシラーゼ活性の低下(4, 9-11)
兆候と症状
明白なビオチン欠乏症の兆候として、脱毛や眼、口、鼻、生殖器周辺での鱗屑性皮疹が挙げられる。成人での神経症状としては、精神抑うつ、無気力、幻覚、四肢のしびれや刺痛がある。ある研究者は異常な脂肪分布を伴う特徴的な顔面皮疹を「ビオチン欠乏顔貌」と称している(8)。ビオチン代謝に遺伝性疾患のあるヒトは機能的な面でビオチン欠乏症となる。そのため、しばしば免疫機能異常や細菌等への感染症の増加、ビオチン欠乏症に似た身体所見が認められる(12)。
素因的(欠乏しやすくなる)状態
ビオチン欠乏症はビオチニダーゼ欠損症など幾つかの遺伝性疾患で発症する。ビオチニダーゼは食事から摂取した結合型ビオチン(タンパク質に共有結合しているビオチン)を遊離する作用がある。そのため、ビオチニダーゼが欠損するとビオチンの腸管からの吸収は減少する。また、ビオチンはタンパク質へ結合することで再利用されるが、ビオチニダーゼに結合していないビオチンは腎臓で急速に排泄されるため、ビオチンの再利用は悪化し、尿中へのビオチン排泄が増加する(5,8)。ビオチニダーゼ欠損症は適度なビオチン補給で回復する。経口補給では5-10mg/dayのビオチンが必要となるケースもある。しかし、多くの場合はもっと少量のビオチンで十分である。ある種のホロカルボキシラーゼ合成酵素(HCS)欠損症の場合では、多量のビオチンが必要となる。HCSはビオチン酵素である4種のカルボキシラーゼとビオチンの結合を触媒する(機能の項目を参照)。HCS欠損症では、血中ビオチン濃度が正常範囲であってもホロ酵素化が低下する。そのため、多量(40-100mg/day)のビオチン補給が必要となる。先天異常であるビオチン輸送担体欠損症においても多量のビオチン補給が必要となる(13)。これら3つの疾患の予後診断は、ビオチン治療が早期(幼年期や幼児期)に開始され生涯継続された場合、概ね良好である(12)。
長期間の生卵白摂取やビオチン不含の経静脈栄養だけでなく、その他の状況においてもビオチン欠乏症の危険性は増加する。発育中の胎児では細胞は急速に分裂するが、これらの細胞ではヒストンのビオチニル化と必須カルボキシラーゼの合成にビオチンを必要とする。そのため、妊娠中にもビオチン必要量は増加する。研究者は、相当な数の女性が正常な妊娠にもかかわらずその期間に軽度もしくは潜在性のビオチン欠乏症を発症すると示唆する(6,14)。しかしながら、妊娠期におけるビオチンの推奨目安量は設定されていない(目安量の項目を参照)。加えて、ある種の肝臓病ではビオチニダーゼ活性は低下し、理論上ビオチン要求量の増加が推察される。62名の慢性肝臓病の小児と27名の健常児の研究では、肝硬変を原因とする重篤な肝機能障害のある患児において血清ビオチニダーゼ活性の著しい低下が示されている(15)。しかし、この研究ではビオチン欠乏症については全く触れていない。さらに、てんかん患児の発作予防に使用される抗痙攣剤による治療はビオチン欠乏症の危険性を増大させる(16,17)。ビオチンと抗痙攣剤に関する情報については「安全性の項目」を参照されたし。
目安量(AI: Adequate Intake)
1988年、米国医学研究所食品栄養委員会(Food and Nutrition Board of Institute of Medicine)は、ビオチンの推奨量(RDA)を算出するには科学的根拠が不足しているとの判断から、推奨量ではなく目安量(AI)を策定した。ビオチンの目安量は、栄養要求量に見合ったビオチンの平均摂取量(35-60µg/day)で設定されている(1)。
| ライフステージ | 年齢 (月齢) | 男性 (µg/day) | 女性 (µg/day) |
|---|---|---|---|
| 乳児期 | 0-6ヶ月 | 5 | 5 |
| 乳児期 | 7-12ヶ月 | 6 | 6 |
| 幼児期 | 1-3歳 | 8 | 8 |
| 幼児期・小児期 | 4-8歳 | 12 | 12 |
| 小児期 | 9-13歳 | 20 | 20 |
| 青年期 | 14-18歳 | 25 | 25 |
| 成人期 | 19歳以上 | 30 | 30 |
| 妊娠期 | 全年齢 | - | 30 |
| 授乳期 | 全年齢 | - | 35 |
疾病予防
先天性異常
ビオチンの分解速度は妊娠中に速まる。そのため、ビオチン栄養状態は妊娠経過中に低下することが指摘されている(6)。ある研究では、13名のうち6名の妊娠女性で妊娠後期におけるビオチン排泄量が正常範囲を下回っており、ビオチン栄養状態の異常な低下が示唆されている。妊娠女性の半数以上では、ビオチン酵素の活性低下を反映する代謝産物(3-ヒドロキシイソ吉草酸)の排泄量が著しく増加する。26名の妊娠女性の研究では、ビオチン補給よるこの代謝産物の排泄量の減少が示されており、軽度のビオチン欠乏症が妊娠女性において比較的共通の症状であることが示唆されている(14)。ある研究では、75%以上の妊娠女性でリンパ球のプロピオニルCoAカルボキシラーゼ活性(ビオチン欠乏症の指標)が低下した(18)。ビオチン欠乏の程度が診断兆候や症状を発症させるに至らないレベルであっても、潜在性ビオチン欠乏症が複数の動物種では先天性異常を誘発するといった報告もあるので、そのような所見には留意すべきである(16)。現在、少なくとも三分の一の女性は妊娠中に潜在性ビオチン欠乏症を発症すると推定されている(8)。確固たる証拠はないが、ヒトにおいても潜在性ビオチン欠乏症による先天性異常が示唆されている。結局のところ、ビオチン欠乏症を原因とした催奇形性(胚もしくは胎児の異常発達)の潜在的リスクが存在するのであれば、そうしたリスクを回避するためにも全ての妊娠期間で適切なビオチン摂取量を確保することが賢明である。妊娠女性は神経管欠損症の予防のために妊娠前と妊娠中にサプリメントで葉酸を摂取するようアドバイスされる(葉酸の項目を参照)。葉酸をマルチビタミン剤(葉酸を400μg以上含む)で摂取すれば、少なくとも30µg/dayのビオチンを容易に補給することができる。このレベルでのビオチンによる毒性は報告されていない(安全性の項目を参照)。
疾病治療
糖尿病
顕在的なビオチン欠乏ラットにおけるグルコース利用能の悪化は古くから知られている(19)。ヒトを対象とした研究では、43名の2型糖尿病患者の血中ビオチン濃度は健常者よりも有意に低下し、空腹時血糖値と血中ビオチン濃度の間に逆相関の関係が認められた。1ヶ月間のビオチン補給(9000µg/day)によって空腹時血糖値は平均45%減少した(20)。一方、10名の2型糖尿病患者と7名の健常者の研究では、28日間ビオチンを補給(15,000µg/day)しても空腹時血糖値には何ら変化が認められなかった(21)。最近発表された同一研究グループによる二重盲検 プラセボ比較試験では、同様のビオチン療法プロトコールで、糖尿病の有無にかかわらず高トリグリセリド血症患者の血漿中性脂肪レベルが低下した(22)。この研究では、ビオチンは糖尿病、非糖尿病患者の血糖値に何ら影響を与えなかった。さらに、二三の研究では、ビオチンとクロミウム・ピコリネートの併用補給が2型糖尿病の補助療法として有効であることが示された(23-26)。しかし、いつくかの研究では、クロミウム・ピコリネートは単独投与でも糖尿病患者の血糖コントロールを改善することが示されている(27)。クロミウムの項目を参照されたし。
1週間のビオチン内服(16,000µg/day)によって7名の1型糖尿病患者の血糖値が減少することが報告されている(28)。ビオチンによる血糖降下作用はいつくかの作用機序で説明することができる。ビオチンは、脂肪酸合成に必須の酵素(アセチルCoAカルボキシラーゼ)の補酵素として作用するため、脂肪酸合成でグルコースの利用を増加することが推察される。ビオチンは、肝臓においてグルコースの貯蔵型であるグリコーゲンの合成を亢進するグルコキナーゼを活性化する。また、ビオチンはラットのインスリン(血糖降下ホルモン)分泌を刺激することが確認されている(29)。グルコーストランスポーターに対するビオチンの効果については今も検討中である。現在までに、ヒトを対象とした血糖値に対するビオチンの効果に関する研究は数少ないため、更なる研究が必要である。
もろい爪
ビオチン補給は馬や豚の蹄の治療に効果がある。こうした事実から、ビオチン補給はヒトのもろい爪の強化にも有効と推測される。3つの非対照試験において、もろい爪の女性患者に対するビオチン補給(6か月間まで2.5mg/day)の効果が検討されている(29-31)。2つの試験では、治療期間の最後までフォローアップが可能であった参加者のうち69-91%で自覚的な臨床症状の改善が報告されている(29,30)。もうひとつの試験では、電子顕微鏡によるスキャンニングによって爪の厚みと縦裂を評価しており、ビオチン補給によって爪の厚みが25%増加し、縦裂が減少することを報告している(31)。これら3つ非対照試験では、ビオチン補給がもろい爪の補強に有用であることを示唆している。しかし、もろい爪の治療に対する高濃度のビオチン補給の有効性を評価するためには大規模なプラセボ対照試験が必要である。
脱毛
脱毛は重度なビオチン欠乏症の兆候(欠乏の項目を参照)であるが、ヒトの脱毛予防・治療に対する高濃度のビオチン補給の有効性について科学的に検証した研究報告はない。
供給源
食物供給源
ビオチンは多くの食品に含まれているが、他の水溶性ビタミンと比較するとその含量は概して少ない。卵黄、レバー、酵母はビオチンを豊富に含んだ優良供給源である。米国における大規模国民栄養調査では、食品中ビオチン含量のデータ不足からビオチンの摂取量を見積もることができなかった。極僅かな研究ではあるが、成人における平均ビオチン摂取量は40-60μg/dayと算出されている(1)。以下の表にビオチンの優良供給源とその含量を示す(32)。しかし、食品中のビオチン含量を化学的定量法で測定した近年の研究では、いくつかの同一食品においてその含量が全く異なることが報告されている(33)。(一般的にビオチンは微生物定量法で測定される〔訳者注〕)
| 食品 | 一回当たりの摂取目安量 | ビオチン量(µg) |
|---|---|---|
| 酵母 | 1袋(7g) | 1.4-14 |
| パン(全粒小麦) | 1枚 | 0.02-6 |
| 鶏卵(加熱調理) | 大1個 | 13-25 |
| チーズ(チェダー) | 1オンス | 0.4-2 |
| レバー(加熱調理) | 3オンス* | 27-35 |
| 豚肉(加熱調理) | 3オンス* | 2-4 |
| サケ(加熱調理) | 3オンス* | 4-5 |
| アボカド | 1個 | 2-6 |
| ラズベリー | 1カップ | 0.2-2 |
| カリフラワー(生) | 1カップ | 0.2-4 |
*3オンスの食肉の大きさは1組のトランプとほぼ同サイズである。
細菌による合成
小腸及び大腸に常在する細菌の多くはビオチンを合成する。ヒトにおけるビオチンの出納についてはよくわかっていない。しかし、ビオチン吸収のための特別なプロセスについては小腸及び大腸由来の培養細胞で確認されている(34)。これらは豚で実証された現象ではあるが、ヒトにおいても腸内細菌由来のビオチンを吸収することが可能であることを示唆している。
安全性
毒性
ビオチンの毒性は今のところ報告されていない。先天的ビオチン代謝疾患の患者では、経口ビオチン補給は200,000µg/dayまで良好な耐容性を示した(毒性を示さなかった)(1)。ビオチン代謝疾患のないヒトにおいても、2年間にわたり5,000µg/dayまでのビオチンを服用しても何ら副作用は認められなかった(35)。しかし、高齢女性が2ヶ月間10,000µg/dayのビオチンと300mg/dayのパントテン酸を併用摂取したところ、致命的な好酸球性胸膜心膜漏出が認められたとの報告が1件ある(36)。米国医学研究所は、1988年にビオチンの食事摂取基準が策定された際、ビオチンの副作用の報告がなかったことからビオチンの耐容上限量(UL)を設定しなかった(1)。Note: 1mg = 1,000µg
栄養素相互作用
パントテン酸(ビタミンB5)はビオチンと類似した構造のため、多量に摂取すると腸管からの吸収や細胞への取り込みでビオチンと競合する可能性がある(37)。さらに、ラットでは過剰量(薬理量)のリポ酸がビオチン依存性カルボキシラーゼの活性を低下させることが報告されている。しかし、ヒトではこれらの影響について確認されていない(4,38)。
薬物間相互作用
長期間にわたり抗痙攣薬(抗発作薬)の治療を受けた患者では、ビオチンの血中濃度の低下と有機酸の尿中排泄の増加(ビオチン酵素であるカルボキシラーゼの活性低下の指標)が報告されている(39)。抗痙攣薬であるプリミドンとカルバマゼピンは小腸でのビオチンの吸収を阻害する。フェノバルビタールやフェニトイン、カルバマゼピンによる長期治療では、3-ヒドロキシイソ吉草酸の尿中排泄が増加するようである。小児では、抗痙攣薬であるバルプロ酸の服用がビオチニダーゼ活性の低下と関連している(17)。サルファ剤や抗生物質による長期治療では、腸内細菌によるビオチン合成の低下が推察される。そのため、理論上、食事性ビオチンの必要量が増加することになる。
ライナス・ポーリング研究所の推奨量
ビオチンに関しては、最適な健康状態の維持・増進や慢性疾患の予防に必要とされる食事性ビオチン量の情報は全く報告されていない。ライナス・ポーリング研究所では、米国医学研究所食品栄養委員会が推奨するビオチンの目安量(成人30µg/day)を勧める。多様な食生活によって多くの人が十分量のビオチンを摂取できるものと考えられる。しかし、マルチビタミン・ミネラルのサプリメントを毎日摂取するというライナス・ポーリング研究所の推奨に従えば、少なくとも一日当たり30µgのビオチンを摂取することができる。
高齢者(50歳以上)
現在、高齢者においてビオチン必要量が増加するとの指摘はない。食事から摂取するビオチンだけでは不十分であれば、マルチビタミン-ミネラルサプリメントを毎日摂取することによって、少なくとも一日当たり30µg/dayのビオチンが摂取可能となる。
Authors and Reviewers
Originally written by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in June 2004 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in August 2008 by:
Victoria J. Drake, Ph.D.
Linus Pauling Institute
Oregon State University
Reviewed in August 2008 by:
Donald Mock, M.D., Ph.D.
Professor
Departments of Biochemistry and Molecular Biology and Pediatrics
University of Arkansas for Medical Sciences
Copyright 2000-2024 Linus Pauling Institute
References
1. Food and Nutrition Board, Institute of Medicine. Biotin. Dietary Reference Intakes: Thiamin, Riboflavin, Niacin, Vitamin B6, Vitamin B12, Pantothenic Acid, Biotin, and Choline. Washington, D.C.: National Academy Press; 1998:374-389. (National Academy Press)
2. Mock DM. Biotin. In: Shils ME, Olson JA, Shike M, Ross AC, eds. Modern Nutrition in Health and Disease. 9th ed. Baltimore: Lippincott Williams & Wilkins; 1999:459-466.
3. Chapman-Smith A, Cronan JE, Jr. Molecular biology of biotin attachment to proteins. J Nutr. 1999;129(2S Suppl):477S-484S. (PubMed)
4. Zempleni J, Mock DM. Biotin biochemistry and human requirements. 1999; volume 10: pages 128-138. J Nutr. Biochem. 1999;10:128-138. (PubMed)
5. Hymes J, Wolf B. Human biotinidase isn't just for recycling biotin. J Nutr. 1999;129(2S Suppl):485S-489S. (PubMed)
6. Zempleni J, Mock DM. Marginal biotin deficiency is teratogenic. Proc Soc Exp Biol Med. 2000;223(1):14-21. (PubMed)
7. Kothapalli N, Camporeale G, Kueh A, et al. Biological functions of biotinylated histones. J Nutr Biochem. 2005;16(7):446-448. (PubMed)
8. Mock DM. Biotin. In: Shils ME, Shike M, Ross AC, Caballero B, Cousins RJ, eds. Modern Nutrition in Health and Disease. 10th ed. Baltimore: Lippincott Williams & Wilkins; 2006:498-506.
9. Mock DM. Marginal biotin deficiency is teratogenic in mice and perhaps humans: a review of biotin deficiency during human pregnancy and effects of biotin deficiency on gene expression and enzyme activities in mouse dam and fetus. J Nutr Biochem. 2005;16(7):435-437. (PubMed)
10. Stratton SL, Bogusiewicz A, Mock MM, Mock NI, Wells AM, Mock DM. Lymphocyte propionyl-CoA carboxylase and its activation by biotin are sensitive indicators of marginal biotin deficiency in humans. Am J Clin Nutr. 2006;84(2):384-388. (PubMed)
11. Mock D, Henrich C, Carnell N, Mock N, Swift L. Lymphocyte propionyl-CoA carboxylase and accumulation of odd-chain fatty acid in plasma and erythrocytes are useful indicators of marginal biotin deficiency small star, filled. J Nutr Biochem. 2002;13(8):462. (PubMed)
12. Baumgartner ER, Suormala T. Inherited defects of biotin metabolism. Biofactors. 1999;10(2-3):287-290.
13. Mardach R, Zempleni J, Wolf B, et al. Biotin dependency due to a defect in biotin transport. J Clin Invest. 2002;109(12):1617-1623. (PubMed)
14. Mock DM, Quirk JG, Mock NI. Marginal biotin deficiency during normal pregnancy. Am J Clin Nutr. 2002;75(2):295-299. (PubMed)
15. Pabuccuoglu A, Aydogdu S, Bas M. Serum biotinidase activity in children with chronic liver disease and its clinical significance. J Pediatr Gastroenterol Nutr. 2002;34(1):59-62. (PubMed)
16. Mock DM. Biotin status: which are valid indicators and how do we know? J Nutr. 1999;129(2S Suppl):498S-503S. (PubMed)
17. Schulpis KH, Karikas GA, Tjamouranis J, Regoutas S, Tsakiris S. Low serum biotinidase activity in children with valproic acid monotherapy. Epilepsia. 2001;42(10):1359-1362. (PubMed)
18. Mock DM. Marginal biotin deficiency is common in normal human pregnancy and is highly teratogenic in mice. J Nutr. 2009; 139(1):154-157. (PubMed)
19. Zhang H, Osada K, Sone H, Furukawa Y. Biotin administration improves the impaired glucose tolerance of streptozotocin-induced diabetic Wistar rats. J Nutr Sci Vitaminol (Tokyo). 1997;43(3):271-280. (PubMed)
20. Maebashi M, Makino Y, Furukawa Y, Ohinata K, Kimura S, Sato T. Therapeutic evaluation of the effect of biotin on hyperglycemia in patients with non-insulin dependent diabetes mellitus. J Clin Biochem Nutr. 1993;14:211-218.
21. Baez-Saldana A, Zendejas-Ruiz I, Revilla-Monsalve C, et al. Effects of biotin on pyruvate carboxylase, acetyl-CoA carboxylase, propionyl-CoA carboxylase, and markers for glucose and lipid homeostasis in type 2 diabetic patients and nondiabetic subjects. Am J Clin Nutr. 2004;79(2):238-243. (PubMed)
22. Revilla-Monsalve C, Zendejas-Ruiz I, Islas-Andrade S, et al. Biotin supplementation reduces plasma triacylglycerol and VLDL in type 2 diabetic patients and in nondiabetic subjects with hypertriglyceridemia. Biomed Pharmacother. 2006;60(4):182-185. (PubMed)
23. Geohas J, Daly A, Juturu V, Finch M, Komorowski JR. Chromium picolinate and biotin combination reduces atherogenic index of plasma in patients with type 2 diabetes mellitus: a placebo-controlled, double-blinded, randomized clinical trial. Am J Med Sci. 2007;333(3):145-153. (PubMed)
24. Albarracin C, Fuqua B, Geohas J, Juturu V, Finch MR, Komorowski JR. Combination of chromium and biotin improves coronary risk factors in hypercholesterolemic type 2 diabetes mellitus: a placebo-controlled, double-blind randomized clinical trial. J Cardiometab Syndr. 2007;2(2):91-97. (PubMed)
25. Singer GM, Geohas J. The effect of chromium picolinate and biotin supplementation on glycemic control in poorly controlled patients with type 2 diabetes mellitus: a placebo-controlled, double-blinded, randomized trial. Diabetes Technol Ther. 2006;8(6):636-643. (PubMed)
26. Albarracin CA, Fuqua BC, Evans JL, Goldfine ID. Chromium picolinate and biotin combination improves glucose metabolism in treated, uncontrolled overweight to obese patients with type 2 diabetes. Diabetes Metab Res Rev. 2008;24(1):41-51. (PubMed)
27. Broadhurst CL, Domenico P. Clinical studies on chromium picolinate supplementation in diabetes mellitus--a review. Diabetes Technol Ther. 2006;8(6):677-687. (PubMed)
28. Coggeshall JC, Heggers JP, Robson MC, Baker H. Biotin status and plasma glucose levels in diabetics. Ann NY Acad Sci. 1985;447:389-392.
29. Romero-Navarro G, Cabrera-Valladares G, German MS, et al. Biotin regulation of pancreatic glucokinase and insulin in primary cultured rat islets and in biotin-deficient rats. Endocrinology. 1999;140(10):4595-4600. (PubMed)
30. Floersheim GL. [Treatment of brittle fingernails with biotin]. Z Hautkr. 1989;64(1):41-48. (PubMed)
31. Hochman LG, Scher RK, Meyerson MS. Brittle nails: response to daily biotin supplementation. Cutis. 1993;51(4):303-305. (PubMed)
32. Briggs DR, Wahlqvist ML. Food facts: the complete no-fads-plain-facts guide to healthy eating. Victoria, Australia: Penguin Books; 1988.
33. Staggs CG, Sealey WM, McCabe BJ, Teague AM, Mock DM. Determination of the biotin content of select foods using accurate and sensitive HPLC/avidin binding. J Food Compost Anal. 2004;17(6):767-776. (PubMed)
34. Said HM, Ortiz A, McCloud E, Dyer D, Moyer MP, Rubin S. Biotin uptake by human colonic epithelial NCM460 cells: a carrier-mediated process shared with pantothenic acid. Am J Physiol. 1998;275(5 Pt 1):C1365-1371. (PubMed)
35. Koutsikos D, Agroyannis B, Tzanatos-Exarchou H. Biotin for diabetic peripheral neuropathy. Biomed Pharmacother. 1990;44(10):511-514. (PubMed)
36. Debourdeau PM, Djezzar S, Estival JL, Zammit CM, Richard RC, Castot AC. Life-threatening eosinophilic pleuropericardial effusion related to vitamins B5 and H. Ann Pharmacother. 2001;35(4):424-426. (PubMed)
37. Zempleni J, Mock DM. Human peripheral blood mononuclear cells: ; Inhibition of biotin transport by reversible competition with pantothenic acid is quantitatively minor. J Nutr Biochem. 1999;10(7):427-432. (PubMed)
38. Flodin N. Pharmacology of micronutrients. New York: Alan R. Liss, Inc.; 1988.
39. Camporeale G, Zempleni J. Biotin. In: Bowman BA, Russell RM, eds. Present Knowledge in Nutrition. 9th ed. Volume 1. Washington, D.C.: ILSI Press; 2006:314-326.
葉酸塩
目次
要約
- 葉酸塩は、食品に含まれる天然の葉酸塩や、サプリメントや強化食品に使用される合成された葉酸の総称である。葉酸塩は核酸前駆物質やいくつかのアミノ酸の代謝およびメチル化反応に重要である。(詳細はこちら)
- 葉酸塩またはビタミンB12の重度の不足は巨赤芽球性貧血に至る可能性があり、疲労、虚弱、および息切れなどを起こす。ビタミンB12依存性巨赤芽球性貧血を不適切に高用量葉酸の補給で治療すると、ビタミンB12欠乏の診断の遅れを招く可能性があり、それによって不可逆性の脳損傷になるリスクに個人をさらすことになる。(詳細はこちら)
- 葉酸塩の状態は葉酸塩代謝の遺伝的変異の存在によって影響を受け、特に5,10メチレンテトラヒドロ葉酸塩還元酵素(MTHFR)遺伝子の遺伝的変異に影響される。(詳細はこちら)
- 妊娠初期の葉酸塩の状態が不適切であると、先天性異常のリスクが高くなる。米国で1998年に導入された精製した穀物の製品への強制的な葉酸の強化は、新生児の神経管欠損(NTD)の罹患率を減らした。それでも世界中で妊娠可能年齢の女性の大部分で葉酸塩の状態が不適切であると考えられている。しかも、妊娠中に葉酸塩欠乏症になりやすくなることで、遺伝的要因がNTDのリスクを変えるかもしれない。NTD以外の先天性異常の予防に葉酸の補給が果たす役割を調査するいくつかの研究が現在行われている。(詳細はこちら)
- 血液中で葉酸塩が欠乏したりホモシステインの濃度が高いと、心(臓)血管疾患(CVD)のリスク上昇と関連する。血液循環中のホモシステイン濃度を制御するのに葉酸補給が有効であるとわかっているが、CVDの発症におけるホモシステイン濃度低下の効果については未だに論争がある。(詳細はこちら)
- 葉酸塩が低い状態だと、がんのリスク上昇と結びつく。しかし高用量の葉酸の介入試験では、一般的にがんの発症に関して何の有益性もなかった。(詳細はこちら)
- 前向きコホート研究で、特に男性の葉酸塩の状態と結直腸がん(CRC)のリスクに逆相関が報告された。しかしながら、葉酸塩の状態とがんリスクの関係は複雑で、さらなる研究が必要である。(詳細はこちら)
- 葉酸塩は脳の発達と機能に不可欠である。葉酸塩が低い状態であること、および/またはホモシステイン濃度が高いことは、加齢による認知機能障害(軽度の障害から認知症まで)と関連する。葉酸を含むビタミンB群の補給が認知機能を良好に保つのに長期的な有益性があるのかどうかは不明である。(詳細はこちら)
- 葉塩酸の輸送と代謝に影響する常染色体劣性遺伝疾患のいくつかは、葉酸誘導体であるフォリン酸の高用量補給で治療可能である。(詳細はこちら)
葉酸塩は水溶性のビタミンB群の一つで、葉酸塩(folate)と葉酸(folic acid)という用語が、この水溶性のビタミンに対してしばしば互換性を持って使用され、また、ビタミンB9またはホラシンとしても知られている。天然起源の葉酸塩は多くの化学的形態で存在しており、食品に含まれるだけでなく、ヒトの体内で代謝的に活発な形態でも存在する。葉酸は、強化食品やビタミンサプリメントに含まれる主要な合成形態である。その他の合成形態には、フォリン酸(図1参照)やレボメフォリック酸がある。葉酸は葉酸塩に変換されないと、何ら生物学的活性を持たない(1)。以下の議論では、食品や体内に存在する形態を「葉酸塩」と呼び、サプリメントや強化食品に含まれる形態を「葉酸」と呼ぶ。
機能
一炭素代謝
体内での葉酸塩補酵素(folate coenzyme)の唯一の機能は、一炭素単位の輸送を仲介することのようである(2)。葉酸塩補酵素は、核酸およびアミノ酸の代謝に重要な種々の反応における一炭素単位の受容体および供与体として働く(図2参照)(3)。
核酸の代謝
葉酸塩補酵素は、2つの異なる経路でのDNA代謝に極めて重要な役割を果たす。(1)核酸の前駆物質(チミジンおよびプリン)からの核酸の合成は、葉酸塩補酵素に依存する。(2)葉酸塩補酵素はホモシステインからメチオニンを合成するのに必要であり、メチオニンはSアデノシルメチオニン(SAM)の合成に必要である。SAMは、DNA、RNA、タンパク質、およびリン脂質の多数の部位におけるメチル化を含むほとんどの生物学的メチル化反応に使用されるメチル基(一炭素単位)の供与体である。DNAのメチル化は遺伝子発現の制御に関与しており、細胞の分化に重要である。DNAメチル化の異常は、がんの発症と結びついている(「がん」の項参照)。
アミノ酸代謝
葉酸塩補酵素は、メチオニン、システイン、セリン、グリシン、およびヒスチジンといったいくつかの重要なアミノ酸の代謝に必要である。ホモシステインからのメチオニンの合成は、葉酸塩(5メチルテトラヒドロ葉酸塩のような)だけでなくビタミンB12を使う酵素であるメチオニンシンターゼ(合成酵素)が触媒作用をする。したがって、葉酸塩(および/またはビタミンB12)の欠乏はメチオニンの合成を減らし、ホモシステインの蓄積に至る可能性がある。ホモシステインの血中濃度が高くなると、心血管疾患および認知症を含むいくつかの慢性疾患のリスク要因になると長年考えられてきた(「疾病予防」の項参照)。
他の栄養素との相互作用
ビタミンB12とビタミンB6
含硫アミノ酸代謝の中間体であるホモシステインの代謝は、最適な生理機能および健康に必要な栄養素の間の相互関係の例である。健康な個人は、ホモシステインを代謝するのに2つの異なる経路を用いる(図3)。一つの経路(メチオニン合成)はホモシステインからメチオニンを合成し、補助因子としての葉酸塩やビタミンB12に依存する。もう一つの経路はホモシステインを別のアミノ酸であるシステインに変えるもので、2つのビタミンB6依存性酵素を必要とする。したがって血液中のホモシステイン濃度は、葉酸塩、ビタミンB12、ビタミンB6という3つのビタミンBによって調整されている(4)。人によっては、リボフラビン(ビタミンB2)もホモシステイン濃度の調整に関わっている。
リボフラビン
あまりよく知られていないが、葉酸塩はリボフラビンと重要な代謝相互作用をする。リボフラビンは葉酸塩の代謝酵素である5,10-メチレンテトラヒドロ葉酸塩還元酵素(MTHFR)の活性に必要な補酵素であるフラビンアデニンジヌクレオチド(FAD)の前駆体である。FAD依存性MTHFRは、5メチルテトラヒドロ葉酸塩を生成する反応の触媒作用を次々と行う(上の図2参照)。この葉酸塩の活性型は、ホモシステインからメチオニンを作るのに必要である。その他のビタミンBに加えて、リボフラビンの高摂取は血漿中のホモシステイン濃度の低下と関連する(5)。葉酸塩の代謝におけるリビフラビンの効果は、MTHFR遺伝子の一般的なc.677C>T多型を持つホモ接合(TT型)の人達で最も大きいようである(「葉酸塩必要量における遺伝的差異」の項参照)(6)。これらの人達(世界中の成人の約10%)は、葉酸塩が低い状態であり、ホモシステイン濃度が高いことが典型的で、特に葉酸塩および/またはリボフラビンの摂取が最適以下である場合にそうである。これらの人々における高いホモシステイン濃度はリボフラビン補給によって低下しやすく、リボフラビンとMTHFRの相互作用の重要性を裏付けている(7)。
ビタミンC
ビタミンCは天然の葉酸塩補酵素および補給された葉酸の胃内での分解を低減して、葉酸塩の生物学的利用性を向上させている可能性がある。健康な9人の男性による交差試験で、5メチルテトラヒドロ葉酸塩(343μg)およびビタミンC(289mgまたは974mg)を同時に経口投与したところ、血清葉酸塩濃度が 5メチルテトラヒドロ葉酸塩のみの場合に比べて高かったという関連があった(8)。さらに、葉酸塩の代謝に関するいくつかの遺伝的変異が葉酸塩の代謝に関するビタミンCの効果に影響している可能性が、最近の研究で示唆された(9)。
生物学的利用性
食事性の葉酸塩は主に(いくつかのグルタミン酸残基を含む)ポリグルタミル形で存在するのに対し、合成ビタミンの形態である葉酸は一つのグルタミン酸しか含まないモノグルタミン酸である。加えて、天然の葉酸塩は還元された分子であるのに対し、葉酸は完全に酸化されている。これらの化学的差異がビタミンの生物学的利用性に大きな関連があり、たとえば同等の摂取濃度でも葉酸は天然起源の食品の葉酸塩よりも生物学的利用性があると考えられている。
食事由来の葉酸塩の小腸での吸収は、葉酸塩ポリグルタミン酸がそれに対応するモノグルタミン酸誘導体に加水分解され、その後に腸の細胞内に輸送されるという2段階のプロセスになっている。小腸細胞内では葉酸は天然起源の葉酸塩、つまり5-メチルテトラヒドロ葉酸塩に変換され、これがヒトの体内で循環する葉酸塩の主要形態である(上の図1参照)。
天然起源の葉酸塩の生物学的利用性は遺伝的に限定され、かつ変動する。異なる食品基質からの葉酸塩の放出され易さには大きな変動が伴われ、そして小腸細胞により取り込まれる前にポリグルタミルの「尾部」が除去(脱抱合)される。その他の食事成分も、変わり易い葉酸塩の不安定さに消化の過程で影響する。その結果、天然起源の葉酸塩は、葉酸に比べて不十分な生物学的利用性を示す。対照的に、サプリメントとして消化されれば葉酸の生物学的利用性は100%と考えられ、強化食品の葉酸は、サプリメントの葉酸の約85%の生物学的利用性であると推定される。
留意したいのは、米国およびその他の特定の国での葉酸塩の推奨量は、現在では「食事性葉酸塩等量(DFE)」として表記されている点である。これは葉酸が天然起源の葉酸塩に比べて生物学的利用性がずっと高いことを考慮して工夫された計算となっている(「推奨量」の項参照)。
輸送
葉酸塩とその補酵素は、細胞膜を通過するのに輸送体が必要である。葉酸塩の輸送体には、還元型葉酸塩キャリアー(RFC)、プロトン共役葉酸トランスポーター(PCFT)、および葉酸塩受容体タンパク質であるFRαとFRβがある。葉酸塩の恒常性は葉酸塩の輸送体があらゆる所に分布していることに支えられているが、その存在量や重要性は組織によって異なる(10)。PCFTをコード化する遺伝子に影響する突然変異が遺伝性葉酸吸収不全を引き起こすことから、PCFTは腸での葉酸塩の輸送に主要な役割を担っていることがわかる。PCFTに欠陥があると、脳への葉酸塩輸送障害にもなる(「疾病治療」の項参照)。FRαとRFCも、それぞれ細胞外の葉酸塩濃度が低いまたは高い時に、血液脳関門を超えた葉酸塩の輸送に重要となる。葉酸塩は胚および胎児の正しい発育に不可欠である。胎盤は葉酸塩を胎児の体内の循環に集中させることが知られており、妊娠中の女性そのものに比べて胎児での葉酸塩濃度が高くなる。妊娠中には、胎盤を通しての葉酸塩の輸送に3種の受容体のすべてが関わる(11)。
欠乏症
原因
葉酸塩欠乏症(folate deficiency)は食事不足によって起きることが最も多いが、その他の多くの状況でも起こる。たとえば、(食事からの摂取が少ないことに加えて)慢性的または多量のアルコール摂取は葉酸塩の吸収減と関連していて、葉酸塩欠乏症になる可能性がある(12)。喫煙も、葉酸塩が低い状態であることと関連する。ある研究では、血液中の葉酸塩濃度は、喫煙者では非喫煙者に比べて約15%低かった(13)。加えて、妊娠中に喫煙するかアルコールを乱用した妊婦は、胎児への葉酸塩の輸送に障害があると報告されている(14, 15)。
胎児、胎盤、および母体の組織の急速な細胞複製および成長による要求を満たすために、妊娠中は葉酸塩の需要が大幅に増加する時である。がんや炎症といった症状も細胞分裂および代謝の速度を上げることになり、体の葉酸塩に対する需要を増やす(16)。さらに、葉酸塩欠乏症は炎症性腸疾患(クローン病や潰瘍性大腸炎)や小児脂肪便症(セリアック病)を含む吸収不全状態から起こることもある(17)。葉酸塩欠乏症にはいくつかの薬物が関係している可能性もある(「薬物相互作用」の項参照)。加えて、葉酸塩の吸収、輸送、または代謝に影響する多くの遺伝性疾患が葉酸塩欠乏症やその代謝機能の阻害を起こすことがある(「疾病治療」の項参照)。
症状
臨床的な葉酸塩欠乏症は巨赤芽球性貧血になるが、これは葉酸による治療で回復できる。DNAの合成や細胞分裂は葉酸塩補酵素に依存するため、骨髄由来の細胞のように急速に分裂する細胞は葉酸塩欠乏症の影響を最も受けやすい。急速に分裂している骨髄の細胞への葉酸塩の供給が不適切だと血液細胞の分裂が減り、大きいが数が少ない赤血球になってしまう。このタイプの貧血を巨赤芽球性貧血または大球性貧血と呼び、大きく未成熟な赤血球を意味する。好中球という白血球が過分葉していて、血液サンプルを顕微鏡で調べることで発見可能である。正常な赤血球は血液循環において約4ヶ月の寿命であるので、葉酸塩欠乏症の人達が特徴的な巨赤芽球性貧血を発症するには数ヶ月かかることもある。そのような貧血の進行は血液の酸素運搬能力が減って、ついには疲労、虚弱、および息切れといった症状になる(1)。葉酸塩欠乏症による巨赤芽球性貧血はビタミンB12欠乏による巨赤芽球性貧血と同じなので、巨赤芽球性貧血の真の原因を診断するにはさらなる臨床検査が必要であるということを指摘しておくことが大切である(「毒性」の項参照)。
葉酸塩欠乏症の初期段階にある人達は明確な症状を呈することがないかもしれないが、血液中のホモシステイン濃度は上昇している可能性がある(「疾病予防」の項参照)。しかし血液循環中のホモシステイン濃度は葉酸塩の状態を示す特別な指標ではなく、ホモシステインの濃度上昇は、ビタミンB12やその他のビタミンB欠乏、ライフスタイル要因、および腎不全の結果であることもある。無症状の欠乏状態は、概して血清/血漿中または赤血球中の葉酸塩濃度の測定で検出される。
推奨量(RDA)
RDAの決定
食事性の葉酸塩の必要量は、貧血のような症状を起こすくらい重い欠乏を防ぐのに必要な量としてかつては定義されていた。最も新しいRDA(1998年;表1)は、異なる葉酸塩摂取量における赤血球葉酸塩濃度の妥当性に主に基いており、その妥当性は異常な血液学的指標がないことで判断される。赤血球中の葉酸塩は肝臓での葉酸塩の貯蔵と相関があることが示されており、長期的な葉酸塩の状態を示す指標として使用される。血漿の葉酸塩濃度は最近の葉酸塩の摂取を反映しており、葉酸塩の状態を示す信頼性のあるバイオマーカーではない。一炭素代謝の指標である血中ホモシステイン濃度を正常に維持することは、適切な葉酸塩摂取の補助的な指標であると考えられてきた。
妊娠は葉酸塩補酵素を必要とする細胞分裂やその他の代謝プロセスの大幅な増進と関連しているため、妊娠中の女性のRDAは妊娠していない女性のそれよりもかなり高い(3)。しかしながら、妊娠中の女性に対するRDAを設定する際に、神経管欠損(NTD)の予防は考慮されなかった。むしろNTDのリスク減少は、妊娠可能な女性向けの別な推奨の中で考慮された(「疾病予防」の項参照)。なぜならば、神経管の発達における重要な事象は、多くの女性が妊娠に気づく前に起こるからである(18)。
食事性葉酸塩当量(DFE)
米国医学研究所の食品栄養委員会が葉酸塩に対する新しい食事性推奨量を設定する際に、食事性葉酸塩当量(DFE)という新しい単位を導入した(1)。DFEの使用は、サプリメントや強化食品に含まれる合成された葉酸の生物学的利用性が天然起源の食品からの葉酸塩よりも高いことを反映している(18)。
- 1マイクログラム(μg)の食品性葉酸塩は、1μgのDFEにあたる
- 食事と一緒に摂取された葉酸または強化食品として摂取された1μgの葉酸は、1.7μgのDFEにあたる
- 空腹時に(サプリメントから)摂取された1μgの葉酸は、2μgのDFEにあたる
たとえば、60μgの葉酸塩を含む食品1サービング(分)は、60μgのDFEを供給する。一方で、60μgの葉酸を強化したパスタ1サービングは、葉酸の生物学的利用性が高いことから、1.7×60=102μgのDFEを供給する。空腹時に摂取された400μgの葉酸サプリメントは、800μgのDFEを供給する。DFEは成人による研究で決定されており、乳児用調製粉乳における葉酸が母乳に含まれる葉酸塩よりも生物学的利用性が高いかどうかは研究されていないことに留意すべきである。乳幼児に対する葉酸塩の必要量を決定するのにDFEを使用することは望ましくない。
葉酸塩の必要量における遺伝的差異
5,10メチレンテトラヒドロ葉酸塩還元酵素(MTHFR)に対する遺伝子配列における一般的な多型または変異はMTHFR c.677C>Tとして知られ、熱不安定性酵素となって現れる(19)。MTHFR遺伝子のエクソン4においてヌクレオチド677がシトシン(C)からチミン(T)に置き換わると、酵素の触媒ドメイン(触媒領域)におけるアラニンからバリンへの転移が起こる。集団によるが、MTHFR遺伝子に関して、20~53%の人達がTの遺伝子を1つ(677C/T型)受け継ぎ、3~32%の人達が2つ(677T/T型)受け継いでいる可能性がある(20)。MTHFRは、5,10メチレンテトラヒドロ葉酸塩(5,10メチレンTHF)の5メチルテトラヒドロ葉酸塩(5MeTHF)への還元を触媒する。後者はホモシステインからメチオニンを作るのに必要な葉酸塩補酵素である(上記の図2参照)。677C/C遺伝子型の人達に比べて、ヘテロ接合体677C/Tおよびホモ接合体677T/Tの人達では、MTHFRの活性が大きく弱まる(それぞれ30%と65%減少)(21)。ホモ接合体の突然変異(677T/T)は、赤血球での葉酸塩濃度がより低く、ホモシステインの血中濃度がより高いことに関連する(22,23)。Tの対立遺伝子を持つ年配の女性の葉酸塩の栄養状態が改善したら、血漿ホモシステイン濃度が減少した(24)。葉酸塩に関してまだわかっていない重要な問題は、少なくとも一つのT対立遺伝子を持つ人達におけるMHTFR酵素の活性の低さを補償するのに現在のRDAが十分であるのか、それともそれらの人達はRDAよりも葉酸塩の必要量が高いのかということである(25)。
疾病予防
妊娠結果への悪影響
神経管欠損
胎児の成長や発達は、広範な細胞分裂が特徴である。適切な量の葉酸塩がDNAやRNAの合成に重要である。神経管欠損(NTD)は受胎後21~27日後の胎児の神経管閉鎖の障害に由来し、この時は多くの女性は妊娠に気づかないことすらあるかもしれない(26)。NTDは脳の病変(たとえば無脳症や脳瘤)または脊椎の障害(脊椎破裂)などの様々な奇形を含み、それらは破滅的で生死に関わる(27)。食品に葉酸を強化する前の米国におけるNTDの罹患率は、1,000人に1人であったと推定される(1)。無作為化試験の結果、女性が受胎前後(受胎の約1ヶ月前から少なくとも1ヶ月後まで)に様々な食事に加えて葉酸のサプリメントを摂取したら、NTDの症例が60~100%減ったことが論証された(28, 29).。これらおよびその他の研究結果から、NTDを防ぐために妊娠可能な女性はすべて400μgの葉酸を毎日摂取するように、米国公衆衛生局は推奨した。以前にNTDの影響があった妊娠を経験した女性も、NTDの再発を防ぐために4,000mgの葉酸を毎日摂るように勧められた(30)。これらの推奨は、妊娠可能な年齢のすべての女性に対して行われた。なぜならば適切な量の葉酸塩が妊娠のごく初期に利用可能になっていなければならないからであり、また米国での妊娠の多くが計画されたものではないからである(31)。
葉酸塩の状態を改善する上での葉酸サプリメントの有効性にもかかわらず、世界的には、たったの30%の妊娠可能な女性しか正しく推奨に従っていないようであり、少数民族出身や社会経済学的に低階層の若い女性は最も推奨に従い難いであろうとの心配がある(32-34)。NTDの発生を減らすため、米国食品医薬品局(USFDA)は1998年にすべての強化穀物製品に対して穀物1kgあたり1.4mgの葉酸を強化するように要求する法令を実施した(「摂取源」の項参照)。米国における葉酸強化に要求されている濃度は、当初は平均的な個人の食事に100μgの葉酸を追加的に供給すると推定されていたが、食品メーカーによる葉酸の過剰使用により、実際にはより以上の葉酸を供給しているであろう(25, 35)。全米出生時異常予防ネットワークは、葉酸の強化以前に比べて米国ではNTDの罹患率が約30%減少し、強化後のNTD罹患率は出産および死産1,000人に対して0.69人であると報告している(36)。
また、NTDの病因学において遺伝的要因があることは、NTDの家族歴の女性はリスクが高いことや、民族によってもリスクが異なることが証左となっている(37)。加えて、NTDの発生は特定の葉酸・遺伝子の相互作用によるものでありうる。MTHFR c.677C>T多型やその他の遺伝的変異が、葉酸塩の必要量を増やし、NTDを患う妊娠へのなりやすさを高めている可能性がある。強化が始まる前、ある症例対象研究で、野生型のC/C遺伝子型に比べてT/TやC/Tの変異のある妊婦は、赤血球および血清葉酸塩濃度が有意に低いことが示された(22)。このことは、母体が特定の遺伝子型の場合、葉酸塩代謝が不十分であることを示唆している。2,429人の症例群の母親と3,570人の対照群の母親を含む25の症例対照研究のメタ解析で、母体のMTHFR c.677C>T多型とNTDとの正の相関が示された(38)。別のMTHFR変異である塩基番号1298におけるAからCへの変化も、MTHFRの活性を低下させNTDリスクが高くなるという相関があった(39)。両方のMTHFR変異(677C/Tと1298A/Cの組み合わせ)のあるヘテロ接合の人達は、677C/Tと1298A/Aという組み合わせの遺伝子型の人達よりも、血漿葉酸塩濃度が低くホモシステイン濃度が高かった(40)。G/Gのホモ接合である遺伝子型に還元型葉酸塩キャリアー(RFC-1)という輸送体の多型(c.80A>G)が組み合わさると、NTDの発生にさらに寄与することになるかもしれない(41)。NTDのリスクの程度は、MTHFRのその他の多型(c.116C>T, c.1793G>A)(42)や、メチオニンシンターゼ(MTR c.2756A>G)(43)、メチオニンシンターゼ還元酵素(MTRR c.66A>G)(44)、およびメチレンテトラヒドロ葉酸脱水素酵素(MTHFD1 c.1958G>A)(45)を含む一炭素代謝のその他の酵素に影響する突然変異に関連していた。母体の遺伝子型が妊娠の結果に影響することはあるが、母体と胎児との間の遺伝子の相互作用がもっと影響するようである。NTDのリスクは、母体のMTHFR c.677C>Tと胎児のMTHFR c.677C>T、および母体のMTRR c.66A>Gと胎児のMTHFR c.677C>Tの相互作用を含む特定の遺伝子の組み合わせによって増加する(43, 44, 46)。さらに、一炭素代謝における特定の多型がある場合に、ビタミンB12の状態がNTDリスクの変化と関連する(47)。
心(臓)血管の奇形
心臓の先天的異常は乳児の死亡の主な原因であるが、成人してからも死をもたらす(48)。欧州先天異常監視機構(EUROCAT)のデータベースからのデータを用いた596の症例と2,359の対照群による症例対照研究で、妊娠前後期(受胎1ヶ月前から胎児の心臓の発達の時期にあたる 受胎後8週間まで)に少なくとも400μg/日の葉酸を摂取すると、先天性心臓欠陥リスクが18%減少するという関連があった(49)。20~25の症例対照研究および家族に基づく研究の最近のメタ解析で、母方、胎児、または父方のMTHFR c.677C>T変異と先天性心臓欠陥の発生との間の正の相関がわかった(50, 51)。先天性心臓欠陥のリスクにおける遺伝子と栄養素の相互作用の影響を明らかにするにはさらなる研究が必要であるが、現在までにわかっている研究は適切な葉酸塩摂取が重要な役割を果たしているであろうことを示している。
口唇口蓋裂 (口腔顔面裂)
妊娠時の母体の葉酸塩の状態は、口蓋裂を伴うまたは伴わない口唇裂(CL/P)である口唇口蓋裂と呼ばれる先天性異常のリスクに影響する可能性がある(52)。ノルウェーでの集団に基づく症例対照研究で、CL/Pのある377人の新生児、196人の口蓋裂(CPO)のみの新生児、および763人の対照群それぞれの母親への葉酸補給の影響が調べられた(52)。母親自らによる(妊娠初期の3ヶ月間の)食事からまたはサプリメントからの摂取がCL/Pのリスクを大きく変えることはなかったが、食事からの葉酸塩の他にマルチビタミンや葉酸(日に400μg以上)のサプリメントを摂取した女性はリスクが64%低かったと報告された。同じ集団で、シスタチオニンβシンターゼ(CBS)遺伝子の多型(c.699C>T)またはMTHFR遺伝子(葉酸塩の摂取が400μg/日よりも少ない場合のc677C>T)の多型が異常の予防に役立つようであり、葉酸塩/一炭素代謝におけるその他の遺伝子変異はCL/Pと関係がないのかもしれない(54, 55)。しかしながら、18の研究の最近のメタ解析で、母体が677T/Tホモ接合であるとCL/Pリスクが上昇することが示された(56)。遺伝的多型と葉酸塩摂取パラメータの両方を統合してCL/Pのリスクを評価する追加的研究が必要である。CPOリスクにおける葉酸塩の役割を支持する疫学的エビデンスは不足している。
その他の妊娠結果への悪影響
低体重出生は生後1年間の死亡率が高くなるリスクと関連があり、成人してからの健康にも影響するかもしれない(57)。8つの無作為化対照試験の最近の系統的レビューおよびメタ解析で、葉酸の補給と出生時体重との正の相関がわかったが、妊娠期間と体重との関連は見られなかった(58)。さらに、306人の少女の妊婦の前向きコホート研究で、妊娠後期の低葉酸塩摂取と母体の葉酸塩の状態が、胎内発育遅延での出生(出生時体重が10パーセンタイルより少ないもの)と関連していた(59)。しかも、母体のMTHFR c677C>T遺伝子型と機能的な葉酸塩欠乏症の指標であると考えられるホモシステイン濃度の上昇が、出生時の低体重と関連していた(60)。
血中ホモシステイン濃度の上昇は、流産および子癇前症や胎盤早期剥離を含むその他の妊娠合併症の発生の増加と関連している(61)。大規模な後ろ向き研究で、ノルウェー人女性の血漿ホモシステイン濃度が、過去の妊娠における子癇前症、早産、および極低出生体重児を含む妊娠結果や合併症への悪影響と強く関係していたことが示された(62)。51の前向きコホート研究の最近のメタ解析では、MTHFR c677C>T変異が白人および東アジアの人々の子癇前症リスク上昇と関連づけられ、葉酸塩代謝がその症状に関わっているのではないかという考えが強化された(63)。妊娠中ずっと5.1mgまでの葉酸を毎日補給することが、リスクの高い女性の子癇前症やその他の有害事象(母体の死、胎盤剥離、早期分娩など)を予防するかどうかを評価するために、葉酸臨床試験(FACT)という大規模な多機関による無作為化対照試験が始まった(64)。妊娠中の適切な葉酸塩の摂取は、巨赤芽球性貧血から体を護る(65)。最近の症例対照研究で、母親と子供がMTHFR c677C>T遺伝子型である時に、毎日600μg以上の葉酸を妊娠前と妊娠中に摂取すると、自閉症スペクトラム障害のリスクが減ることがわかった(66)。
したがって、神経管閉鎖の後も妊娠中ずっと葉酸補給をすることは、妊娠中のその他の問題のリスクを減らすために理にかなっている。さらに、観察研究の最近の系統的レビューでは、妊娠中に葉酸を摂ることと、出生児の健康への悪影響、特に小児喘息やアレルギーなどとの関連のエビデンスはなかった(67, 68)。
心(臓)血管疾患
モシステインと心(臓)血管疾患
80超の研究の結果、血液中のホモシステイン濃度の少しの上昇でも心(臓)血管疾患(CVD)のリスクが高まることが示された(4)。血管障害になりやすい体質は、ある集団ではホモシステイン代謝における遺伝子欠損とも関連付けられてきた(69)。ホモシステインが血管疾患のリスクを高めるかもしれないメカニズムは幾多の研究の主題となってきたが、それにはホモシステインが血液凝固、血管拡張、および動脈壁の肥厚に及ぼす悪影響が関連しているのかもしれない(70)。血液中のホモシステイン濃度の上昇は一貫してCVDリスクの上昇と関連してきたが、循環血液中のホモシステイン濃度を下げることがCVDリスクを下げることになるのか不明である(「葉酸塩とホモシステイン」の項参照)。研究では、3マイクロモル/リットルという血清ホモシステイン濃度の長期の減少がCVDリスクを最大25%減らし、リスクの高い個人の合理的な治療目標であると、はじめは予想されていた(71,72)。しかし、最近のビタミンB補給の臨床試験の解析で、ホモシステイン濃度を下げても、すでにCVDを患っている患者の第二の心血管障害の予防には、ならなかったことが示された(73,74)。その結果、たとえば個人的または家族歴に早発性の心血管疾患がある者、栄養不良または吸収不良症候群の者、甲状腺機能低下症の者、腎不全の者、狼瘡のある者、または特定の薬剤(ニコチン酸、テオフィリン、胆汁酸-結合樹脂(胆汁酸吸着レジン)、メトトレキサート、およびL-ドーパ)を飲んでいる者などのハイリスクな個人のみが、総ホモシステイン濃度が高くないか検診することを米国心臓協会は推奨している。
葉酸塩とホモシステイン
葉酸塩の豊富な食事は、冠状動脈疾患、心筋梗塞(心臓発作)、および脳卒中を含むCVDリスクの減少と関連がある。1,980人のフィンランド人男性を10年間追跡した研究で、食事からの葉酸塩の摂取が最も多い場合は、最も少ない場合に比べて急性の冠動脈性事故のリスクが55%低いことがわかった(75)。ホモシステイン濃度を調整している3種のビタミンBのうち、ビタミンB12やB6が同時に欠乏していない場合には、葉酸は血液中のホモシステインの基礎濃度を下げるのに最大の効果があることが示されている(「栄養素の相互作用」の項参照)(76)。葉酸塩の豊富な食事やサプリメントで葉酸塩の摂取を増やすことは、ホモシステイン濃度を下げることがわかっている(77)。加えて、米国でFDAが穀物に葉酸を強化するよう命じてから、血中ホモシステイン濃度は減少した(25)。ほぼ3,000人の被験者を含む25の無作為化対照試験のメタ解析で、800μg/日以上の葉酸補給によって血漿ホモシステイン濃度が最大25%下がることがわかった。このメタ解析では、毎日200μgおよび400μgの用量の葉酸が、それぞれ13%と20%の血漿ホモシステイン濃度の減少と関連があった(78)。もしも、はじめに試した葉酸塩の豊富な食事(「摂取源」の項参照)が、ホモシステイン濃度を適度に下げるのにうまくいかなかった場合、400μgの葉酸、2mgのビタミンB6、および6μgのビタミンB12による補給養生法を米国心臓協会が提唱している(79)。
葉酸塩/一炭素代謝におけるいくつかの多型が血中ホモシステイン濃度を変える(80)。特に、MTHFR c.677C>T変異の効果は、世界中で葉酸強化政策との関係で調べられてきた。CVDの病歴のない59,995人の被験者を含む無作為化試験の分析で、T/TおよびC/C遺伝子型でのホモシステイン濃度の差は、強化食品政策を取っている地域に比べて葉酸塩の摂取の少ない地域(3.12マイクロモル/リットル対0.13マイクロモル/リットル)で大きかったことがわかった (81)。葉酸の補給は効果的にホモシステイン濃度を下げているが、それがCVDのリスクも下げているかどうかは不明である。心血管または腎臓の持病のある47,921人の被験者を対象にした19の無作為化臨床試験の最近のメタ解析で、葉酸やその他のビタミンB補給によるホモシステイン濃度の低下は、血漿ホモシステイン濃度が大幅に下がってもCVDの発生を減らすことにはならなかったことがわかった(74)。その他のメタ解析では、脳卒中リスク(83,84)を含むCVDリスク(80-82)とホモシステイン濃度の低下に因果関係がないことが確認された。したがって、全米心臓協会はハイリスクの女性に対して心血管疾患予防での葉酸の使用を推奨することを取り下げた(85)。今日までの予防試験の大多数は、進行したCVDの患者に対して行われてきたことには留意すべきである。葉酸塩とそれに関連するビタミンB類の有益さを支持するエビデンスは、脳卒中の一次的予防に関して最も強いようである(86)。強制的な葉酸強化の導入は北米で脳卒中に絡んだ死亡の減少と関連があり、脳卒中の予防に葉酸塩の状態を強化すること、および/またはホモシステイン濃度を下げることの潜在的有益性をさらに支持するものである(87)。
CVD予防におけるホモシステイン濃度の低下の役割に関する論争にかかわらず、血管障害のリスク要因として知られるアテローム性動脈硬化症の発症に対する葉酸補給の効果を調べたいくつかの研究がある。頸動脈内膜中膜複合体厚(CIMT)の測定値は、初期のアテローム性動脈硬化症の代替エンドポイントであり、心血管イベント(心血管事象)の予測因子である(88)。葉酸補給の効果をテストした10の無作為化試験のメタ解析で、慢性的腎疾患やCVDのリスクのある被験者のCIMTが大きく減ったが、健康な参加者ではそうではなかった(89)。内皮機能障害は、アテローム性動脈硬化症や血管疾患に共通の特徴である。高用量(400~10,000μg/日)の葉酸は、健康な被験者でもCVDの被験者でも血管の健康の改善に関わっていた(90)。最近の研究では葉酸補給による心血管保護の論証はできなかったが、葉酸塩の低摂取は血管疾患のリスク要因として知られており、血管の健康を維持するための葉酸塩の役割を調べるさらなる研究が必要である(91)。
がん
がんは、進行中のDNAの修復過剰および/または重要な遺伝子の不適切な発現によるDNA損傷から起こると考えられている。DNAおよびRNAの合成やメチル化に葉酸塩が重要な役割を果たしていることから、不十分な葉酸塩の摂取が、がんの発症をしばしば特徴づけるゲノムの不安定さや染色体切断に寄与している可能性がある。特に、DNAの複製と修復はゲノムの維持に重要であり、葉酸塩欠乏によるヌクレオチド不足が、ゲノムの不安定さやDNAの突然変異に至るのかもしれない。5,10-メチレンTHFの減少は、チミジル酸合成酵素(TS)によるデオキシウリジン一リン酸(dUMP)のデオキシチミジン一リン酸(dTMP)への変換を損なう可能性があり、ウラシルの蓄積とチミンの枯渇を引き起こす。するとこれがDNAの複製や修復の際にウラシルをDNAに誤って取り込み、点突然変異や鎖切断を含むDNA損傷を起こすことになりかねない(92)。5,10-メチレンTHFはMTHFR酵素の基質でもあるので、c.677C>T多型に伴うMTHFR活性の減少がチミジル酸合成のための5,10-メチレンTHFの使用増加をおこし、DNA損傷を防いでいることは妥当であろう。しかしながら、この仮説は葉酸塩欠乏症の状態でのみ正しいかもしれない(93)。逆に、葉酸補給がDNA合成を促進し腫瘍の成長を促すのではないかという議論もあった。これは、TSが腫瘍促進物質(発がん遺伝子)のように機能することができて、一方ではTS活性の減少ががんリスクの低下と関連しているという観察によって裏付けられる(94,95)。さらに、チミジル酸合成経路を阻害する葉酸(代謝)拮抗薬分子は、がんの治療にうまく使用されている(96)。葉酸塩は、ホモシステイン/メチオニン代謝サイクルと、メチル化反応のメチル供与体であるS-アデノシルメチオニン(SAM)の貯蔵も制御している。したがって、葉酸塩欠乏症はDNAとタンパク質のメチル化を損い、DNA修復、増殖、および細胞死に関係する遺伝子の発現を変える可能性がある。がんの典型的な特徴である全体的な低メチル化は、ゲノムの不安定さや染色体切断を引き起こす((97)の文献で総括)。
毎日少なくとも5サービング分の果物や野菜を摂取することは、がんの発症が減ることと常に関連してきた(98)。果物や野菜は葉酸塩の優れた摂取源で、抗発がん性効果に役立っているのかもしれない。観察研究では、葉酸塩の減少した状態が、部位特異的ながんに関連があるとわかっている。米国では食品への強化は義務である(1998年以降。「摂取源」の項参照)が、葉酸の高摂取がもたらす健康への影響の懸念がその他のいくつかの国での実施を遅らせている(99)。しかしながら、最も新しい葉酸介入試験(サプリメントの用量が500~5,000μg/日で少なくとも1年間)のメタ解析では、がん全体の発症および部位特異的ながんの発症でも、何ら特別な有益さも害も示されなかった(100,101)。
結直腸がん
全部で725,134人を7~20年間追跡した13の前向きコホート研究の統合解析で、食事からの葉酸塩および葉酸塩全体(食品やサプリメントからのもの)の摂取量と結腸がんリスクとの控えめな逆相関がわかった。特に、総葉酸塩摂取が100μg/日増えるごとに、結腸がんリスクが2%減少すると推定された(102)。1995~2006年に50~71歳の525,488人の被験者を追跡した米国の大規模前向き研究では、食事からの葉酸塩、サプリメントの葉酸、および総葉酸塩の摂取が結直腸がん(CRC)リスクの減少と関連があった(103)。しかしながら、性によって分けると、女性には食事からの葉酸塩の摂取とCRCリスクとの関連はなかった(103,104)。CRCリスクと食事からの葉酸塩摂取、サプリメントの葉酸摂取、および総葉酸塩摂取との関連がないことは、米国で葉酸強化が始まる前後の11年間にわたり、90,000人の閉経後の女性を追跡した別の前向き研究でも報告された(105)。これらのデータは、葉酸塩によるCRCリスクの違いに性別が影響している可能性を示唆する。後者の研究では、葉酸強化の義務化後に一時的ではあるが、かなりのリスク上昇も観察された。しかしながら、これが葉酸の強化義務による葉酸塩摂取増加によって引き起こされたものではないだろうという主張もある(106)。また、18の症例対照研究のメタ解析で、食品からの葉酸塩でCRCリスクがわずかに減少することがわかった(107)。しかし、その症例対照研究はとても不均質で、食物繊維、ビタミン、およびアルコール摂取が研究結果を混同させていると著者らが述べていることに留意することが大切である。しかも、葉酸塩摂取の最高分位の下限は270~1,367μg/日とかなりの幅があった(107)。
たいていの疫学的研究が結直腸がん発症に対する葉酸塩による防護効果を示している一方で、高用量の葉酸サプリメントが実際にはがん患者の腫瘍の成長を加速しているかもしれないという示唆もある(108)。正常な食事の範囲で葉酸塩が高めの状態なことはがんに対して防護的であると広く考えられているが、過剰な葉酸の高摂取によって既存の新生物(腫瘍)の成長が助長されるのではないかと懸念している研究者もいる(108)。結直腸腺腫の病歴のある患者への葉酸補給の効果を扱ったいくつかの臨床試験があり、葉酸補給によるリスク低下があったものもあれば、まったく効果がなかったものもあった(109-112)。リスクの高い被験者による3つの大規模無作為化対照試験の最近のメタ解析では、葉酸を24~42ヶ月の間500または1,000μg/日の用量で補給した被験者の結直腸腺腫の再発は、プラセボに比べて何も増加しなかった(113)。
前に示唆したように、葉酸塩が少ない状態ではMTHFR 677T/T遺伝子型がウラシルの誤取込を防ぎ、DNAの統合性と安定性を護るのかもしれない。62の症例対照研究と2つのコホート研究のメタ解析で、C/TおよびC/C遺伝子型に比べてT/T変異がCRCリスクを12%下げる一方で、遺伝子型にかかわらず全葉酸塩摂取量が高い(348~1,583μg/日)と、低い(264~450μg/日)場合に比べてリスクが30%減ったことがわかった(114)。メチオニンシンターゼをコード化するMTR遺伝子の一般的多型(c.2756A>G)でも、結直腸の腺腫やがんのリスクとの関係が調べられた。メチオニンシンターゼは、ホモシステインと5メチレンTHFをそれぞれ同時にメチオニンとTHFに変換する反応の触媒作用をする。27の症例対照研究の最近のメタ解析では、MTRの変異とがんリスクとの関連は示されなかった(115)。
アルコール摂取は葉酸塩の吸収と代謝を妨げる(16)が、1つの症例対照研究と5つの前向きコホート研究で、アルコールを飲まない者は飲む者に比べてCRCリスクが低下するか無関連であることが報告された(107)。しかしながら、28,000人以上の男性医療従事者を22年間追跡した大規模前向き研究では、毎日2杯より多いアルコール飲料(30グラム超のアルコール)の摂取で、葉酸強化前の期間ではCRCリスクが42%増えた。CRCリスクは強化後の期間には増大しなかったので、高アルコール摂取と低葉酸塩摂取の組み合わせがCRCリスクを増加させるのではないかと示唆している。69,000人の女性看護師を28年間追跡した別の前向き研究では、葉酸の強化が義務化される以前でも以後でも、アルコール摂取とCRCリスクの上昇との関係は報告されなかった(116)。いくつかの研究では、MTHFR c.677C>T多型がホモ接合(T/T)の人達は、葉酸塩の摂取が適切である場合には結腸がんリスクが減ることがわかった。しかしながら、葉酸塩の摂取が少なく(および/または)アルコール摂取が高いと、T/T遺伝子型の人達は結直腸がんのリスクが上昇していた(117,118)。
乳がん
葉酸塩の摂取が乳がんリスクに影響するかを調べたいくつかの前向きコホート研究および症例対照研究は、結果がまちまちである(119)。15の前向き研究および1つのコホート内症例対照研究では、食事からの葉酸塩の摂取とは無関係であった(120)。女性は適度のアルコール摂取でも、乳がんリスク上昇と関連する(121)。3つの前向き研究の結果から、葉酸塩の摂取を増やすと、アルコールを定期的に摂取している女性の乳がんリスクが減る可能性があることが示唆された(122-124)。したがって、葉酸塩の高摂取は、アルコール摂取によって乳がんリスクが高くなっている女性にのみリスク低下と関連しているのかもしれない。88,000人超の看護師を対象にした大規模前向き研究で、1日に1杯未満のアルコール飲料しか摂取しない女性の乳がんと葉酸の摂取は関連がなかったと報告された。しかしながら、1日に少なくとも1杯のアルコール飲料を摂取する女性では、毎日少なくとも600μgの葉酸摂取で、毎日300μg未満の葉酸しか摂取しない女性に比べて乳がんリスクが約半分になった(124)。それでも、アルコール摂取が乳がんリスクを上げているのかどうかや、どのように上げているのかは未だに議論のあるところである(125,126)。また、がんリスクに対する一炭素代謝における多型の影響を評価する最近のメタ解析で、チミジル酸合成酵素をコード化する遺伝子の特定の変異が、特定の民族集団の乳がんリスクを上げることがわかった(127,128)。
小児がん
子供におけるウィルムス腫瘍(腎臓がん)と特定の悪性脳腫瘍(神経芽細胞腫、神経節芽細胞腫、および上衣腫)の発症は、米国での1998年の穀物製品への葉酸強化の義務化以来少なくなっている(129)。しかしながら、小児の主な悪性腫瘍である白血病に関しては、強化の前後で発症率に変化がなかった。妊娠中の母体への葉酸補給と小児白血病のリスク減少を関連付けた初期の研究にもかかわらず、最近の研究では葉酸の予防効果を支持するエビデンスはほとんどない(130)。いくつかのメタ解析でも、MTHFR多型の防護効果はほとんど、または、全くないことがわかっている。しかしながら、22の症例対照研究の最も新しいメタ解析で、c.677C>T変異のある白人やアジア人の急性リンパ芽球性白血病(ALL)のリスク低下がわかった(131)。
アルツハイマー病および認知障害
アルツハイマー病(AD)は米国で最も一般的な認知症の形態で、65歳以上の500万人以上がこの病にかかっている(132)。AD患者の脳でのβ-アミロイド斑の沈着、タウタンパク質形成のもつれ、および細胞死の増加が、認知機能低下や記憶の喪失と関連している。ある研究では、葉酸塩の豊富な食品源である果物や野菜の摂取増加と、女性の認知症やADの発症リスクの低下には関連があった(133)。核酸の合成およびメチル化の際のメチル供与体という役割から、妊娠中および出生後だけでなくその後の人生においても、葉酸塩は正常な脳の発達と機能に重要である(134)。年配女性の1つの横断研究では、AD患者は健康な者に比べてホモシステイン濃度が有意に高く、赤血球の葉酸塩濃度が低かった。しかしながら、血清葉酸塩濃度には両群間で違いはなかった。このことから、最近の葉酸塩摂取ではなく長期的な葉酸塩の状態がADリスクと関連しているかもしれないということがわかる(135)。
数人の研究者が、年配者ではホモシステイン濃度が高いことと認知障害との関連があると記載している(136)。しかし前向きコホート研究では、葉酸塩の高摂取と認知機能の向上との関連があるとはわかっていない(137,138)。高めのホモシステイン濃度は、健康な被験者に比べてADや血管性認知症を含む認知症の人達に見うけられる(139,140)。葉酸塩、ビタミンB12、およびビタミンB6の欠乏がホモシステイン濃度を上昇させる可能性はあるが、AD患者の血清ビタミン濃度が健康な個人に比べて低いことは、ビタミン摂取の減少によるものでないかもしれない(141)。現在では、血清のホモシステインが認知症発症のリスク要因であるのか、それとも単に認知機能の低下に関連するのかはっきりしない。ここ10年間で、ホモシステイン濃度を低下させ認知機能低下を予防あるいは遅延するために、いくつかの臨床試験でビタミンB群がテストされた。45歳以上の健康な人達を対象に葉酸〔0.2~15mg/日を約6ヶ月間(中央値)にわたって〕補給した9例の無作為化プラセボ対照試験のメタ解析で、記憶、速度、言語、および実行機能を含む認知機能への短期的効果はなかったことがわかった(142)。より最近では、ビタミンB補給の無作為化プラセボ対照試験19例のメタ解析で、補給によってホモシステイン濃度は効果的に下がったものの、補給した群とプラセボ群との間に認知機能パラメーターの差がなかった(143)。試験ごとに一貫しない結果になったのは、試験の計画や方法の差によるものであるかもしれない((144)の文献で概説)。
それでもなお、軽い認知障害のある168人の年配の被験者による2年間の無作為化プラセボ対照試験で、800μgの葉酸、500μgのビタミンB12,および20mgのビタミンB6の組み合わせを毎日摂取することの有益性が最近報告された(145,146)。ADによる影響を受けた脳の特定領域の萎縮は両群で見られ、この萎縮は認知機能の低下と関連していた。しかしながら、ビタミンBで治療した群はプラセボ群に比べて、灰白質の損失が小さかった(0.5%対3.7%)。試験開始時にホモシステイン濃度が高かった被験者で、より有効であったことから、認知機能低下や認知症の予防に血液中のホモシステイン濃度を下げることが重要であることを示唆している。有望ではあるが、ビタミンB補給の効果については、ADの発症のような長期的結果を評価できる、より大規模な試験でさらに研究される必要がある。
疾病治療
代謝性疾患
テトラヒドロ葉酸誘導体であるフォリン酸(上記の図1参照)は、葉酸塩の輸送または代謝に影響するまれな先天性異常の臨床管理に使用されている((147)の文献で概説)。そのような容態は常染色体劣性遺伝であり、突然変異した遺伝子を2つ(両方の親から1つずつ)受け継いだ人達のみがその病気を発症することになる。
遺伝性葉酸吸収不全症
遺伝性葉酸吸収不全症は、葉酸塩輸送体であるPCFTをコード化するSLC46A1遺伝子の突然変異によって引き起こされ、概して胃腸での葉酸塩の吸収と脳への葉酸塩の輸送に影響する(148)。患者は血清および脳脊髄液の葉酸塩濃度が低いか、または検出不能な濃度であったり、汎血球減少(全血球の数が少ないこと)になったり、感染にかかりやすくなる免疫応答障害が出たりして、一般的に丈夫でない(149)。てんかん発作を含む神経症状も見られる(150)。非経口的フォリン酸の補給による臨床的な改善が報告されている(151)。
脳性葉酸(塩)欠乏(CFD)症候群
CFDは、血液中の葉酸塩濃度が正常であるにもかかわらず脳脊髄液中の葉酸塩補酵素濃度が低いことが特徴である。血液脳関門を通過する葉酸塩の輸送がCFDの患者では損なわれており、これは葉酸塩受容体のFRαを阻害する抗体があることや、FRαをコード化するFOLR1遺伝子の突然変異と関連がある(152,153)。視覚聴覚障害を伴う神経学的異常がCFDの子供に報告されている。自閉症スペクトラム障害(ASD)があるケースもある。フォリン酸(ロイコボリンとも言う)は脳に入り込んで葉酸塩補酵素の濃度を正常にし、葉酸塩濃度を正常にして、ASDの子供の気分、行動、および言葉でのコミュニケーションを含むCFDの様々な社会的相互作用を向上させることが示されている(152,154,155)。
ジヒドロ葉酸還元酵素(DHFR)欠乏症
DHFRはNADPH依存性酵素で、ジヒドロ葉酸(DHF)をテトラヒドロ葉酸(THF)に還元する反応の触媒作用をする。DHFRは葉酸をDHFに変換するのにも必要である。DHFR欠乏症は巨赤芽球性貧血や脳性葉酸(塩)欠乏症が特徴で、難治性の発作や精神的な欠陥を起こす。フォリン酸による治療がDHFR欠乏症の症状を軽減するとはいえ、不可逆的な脳損傷を予防し治療結果を向上させるのに初期段階での診断が欠かせない(156,157)。
摂取源
食品源
緑色の葉物野菜(葉)は葉酸塩の豊富な食品源で、その名前の由来となっている。柑橘のジュース、豆類、および強化食品も優れた葉酸塩摂取源である(1)。強化されたシリアルの葉酸塩含有量は大きく幅がある。いくつかの葉酸塩が豊富な食品を、マイクログラム(μg)表記の葉酸塩含有量とともに表2に示す。特定の食品の栄養素含有量の詳細は、米国農務省(USDA)の 食品成分データベースを検索のこと。
| 食品 | サービング数(分量) | 葉酸塩 (μg DFEs) |
|---|---|---|
| レンズ豆(成熟したものを加熱調理) | ½カップ | 179 |
| ひよこ豆(加熱調理) | ½カップ | 141 |
| アスパラガス(加熱調理) | ½カップ(約6本) | 134 |
| ホウレンソウ(加熱調理) | ½カップ | 131 |
| アオイマメ(大きな成熟したものを加熱調理) | ½カップ | 78 |
| オレンジジュース(生) | 約180ml | 56 |
| スパゲッティ(強化食品を加熱) | 1カップ | 167* |
| 白米(強化食品を加熱) | 1カップ | 153* |
| パン(強化したもの) | 1切れ | 84* |
| *神経管欠損の予防に役立てるため、すでにナイアシン、チアミン、リボフラビン、および鉄を強化した精白した穀物の製品に穀物1kgあたり1.4mgの葉酸を強化するよう、米国のFDAは1998年1月1日以降要求している。栄養素の欠乏予防や処理過程で失われる栄養素を戻すために食品に栄養素を加えることを強化という。FDAはもともと、このレベルの強化で1日あたり平均100μgの摂取増加になるであろうと推定していた(26)。しかし、観察研究に基づく、さらなる評価で、摂取量はFDAの予想した量の2倍に増加していることが示唆されている(35)。血清および赤血球中の低葉酸塩濃度の人達の米国総人口に対する割合は、葉酸強化以前にはそれぞれ24%と3.5%であったが、現在では1%以下である (158)。 | ||
サプリメント
サプリメントの葉酸塩の主要形態は葉酸である。単一成分としても、ビタミンB複合体サプリメントやマルチビタミンのような他の成分との組み合わせとしても入手可能である。1mg以上の用量は処方箋が必要である(159)。さらに、テトラヒドロ葉酸誘導体であるフォリン酸は特定の代謝性疾患の治療に使用される(「疾病治療」の項参照)。また、米国FDAは経口避妊薬に葉酸塩を入れることを承認している。レボメフォラート・カルシウム(levomefolate calciumはMeTHFのカルシウム塩。451μg/錠)を経口避妊薬に添加するのは、妊娠可能年齢の女性の葉酸塩の状態を向上させる意図がある(160)。全米調査によると、15~44歳の妊娠していない女性の24%しか400μg/日という現在の葉酸推奨量を満たしていない(161)。
安全性
毒性
食品から葉酸塩を過剰摂取しても、関連する悪影響はない。安全性に関する懸念は、合成された葉酸の摂取についてのみである。しばしば診断されないこともあるが、ビタミンB12の欠乏はかなり多くの人、特に年配の成人(「ビタミンB12」の項の記事参照)に影響しているのかもしれない。ビタミンB12欠乏症の一つの症状は巨赤芽球性貧血で、葉酸塩欠乏症によるものと区別がつかない(「欠乏症」の項参照)。ビタミンB12欠乏と診断されていない人が高用量の葉酸を使用すると、隠れているビタミンB12欠乏を治すことなく巨赤芽球性貧血を治すことになり、不可逆的な神経性損傷を起こしてしまうリスクにさらされることになる。ビタミンB12欠乏症における神経性疾患の進行のそのようなケースは、大部分が5,000μg(5mg)以上の用量の葉酸で見られる。ビタミンB12欠乏症の人達の不可逆的神経性損傷を確実に予防するため、米国医学研究所の食品栄養委員会は、すべての成人は(サプリメントおよび強化食品からの)葉酸摂取を毎日1,000μg(1mg)に限るようにアドバイスしている(表3)。委員会はまた、ビタミンB12欠乏症は妊娠可能年齢の女性には非常にまれであるので、1,000μg/日以上の葉酸を摂取しても問題はないであろうとしている(1)。しかしながら、大量投与の効果に関するデータは限られている。
| 年齢層 | UL (μg/日) |
|---|---|
| 乳児 0~12ヶ月 | 確定不能* |
| 幼児 1~3歳 | 300 |
| 子供 4~8歳 | 400 |
| 子供 9~13歳 | 600 |
| 青少年 14~18歳 | 800 |
| 成人 19歳以上 | 1,000 |
| *摂取は食品および調整粉乳からのみ | |
葉酸の経口補給によるDHFR代謝能力の飽和は、血中における未代謝葉酸の出現と関連があるとされている(162)。血液学的な異常や認知機能が低下することは、年配(60歳以上)のビタミンB12欠乏症の成人における未代謝葉酸の存在と関連がある(163,164)。閉経後の女性による小規模な研究で、未代謝の葉酸が免疫機能におよぼす影響について懸念が提示されている(165)。マルチビタミンのサプリメントを30週間毎日摂取した生殖可能年齢の38人の女性による小規模な無作為化オープンラベル試験(無作為化非盲検試験)では、1日に1.1mgまたは5mgの葉酸補給によって、最初の12週間に血中に未代謝の葉酸が過渡的に現れた(166)。しかし、研究の終了時には未代謝の葉酸塩濃度は研究開始時の濃度にまで戻ったため、適応機構によって最終的には葉酸が葉酸塩の還元された形態に変換されたことを示唆している。それにもかかわらず、レボメフォラート(5MeTHF)をサプリメントとして使用することは、年配の成人において未変換の葉酸のネガティブな作用の可能性を予防する選択肢となるかもしれない。
薬物相互作用
アスピリンまたはイブプロフェンのような非ステロイド系抗炎症剤(NSAID)を非常に高い治療薬量(すなわち重篤な関節炎治療用)で服用した場合、それが葉酸塩の代謝を阻害する可能性がある。対照的に、NSAIDの日常的な使用が葉酸塩の状態に悪影響を及ぼすということはわかっていない。抗けいれん薬のフェニトインは葉酸塩の腸での吸収を抑制することが示されており、フェニトイン、フェノバルビタール、およびプリミドンといった抗けいれん薬の長期使用が葉酸塩の状態を低下させると関連づけた研究もいくつかある(167)。しかしながら、抗けいれん薬の使用者と非使用者との間で、食事性葉酸塩摂取の差を考慮した研究はほとんどない。また、コレスチラミンやコレスチポールというコレステロール低下薬といっしょに葉酸を摂取すると、葉酸塩の吸収を減らす可能性がある(159)。メトトレキサートは、がん、リューマチ性関節炎、および乾癬を含む多くの疾患の治療に使われる葉酸拮抗薬である。メトトレキサートの副作用は重篤な葉酸塩欠乏症の副作用と似ており、葉酸またはフォリン酸といっしょに服用して葉酸拮抗薬の毒性を減らすのに使用される。がんの治療に現在使われるその他の葉酸拮抗薬(の分子)は、アミノプテリン、ペメトレキセド、プララトレキサート、およびラルチトレキセドを含む(96)。さらに、多くの他の薬物が葉酸拮抗薬活性を持つことが示されており、トリメトプリム(抗生物質)、ピリメタミン(抗マラリア薬)、トリアムテレン(血圧の薬)、およびスルファサラジン(潰瘍性大腸炎の治療薬)などが挙げられる。高用量のエストロゲンを含む初期の経口避妊薬の研究で、葉酸塩の状態への悪影響が示されたが、この発見は低容量経口避妊薬を使用し、かつ食事からの葉酸塩を管理した最近の研究では支持されていない(168)。
ライナス・ポーリング研究所の推奨
利用可能な科学的エビデンスは、適切な葉酸塩摂取が神経管欠損やその他の不具合な妊娠結果を予防し、ある種のがん、特に遺伝的にそれにかかりやすい人達のがんのリスク低減に役立ち、そして、心血管疾患のリスクまで下げる可能性があることを示している。ライナス・ポーリング研究所は、一日摂取量(Daily Value=DV)である400μgの葉酸を含むマルチビタミン/マルチミネラルサプリメントを成人が毎日摂取することを推奨する。強化食品から平均より多い葉酸を摂取したとしても、各個人の毎日の葉酸摂取が米国医学研究所によって設定された許容上限摂取量である1,000μg/日をいつも超えるということはないであろう(「安全性」の項参照)。
年配の成人(51歳以上)
葉酸塩の豊富な食事に加えて、マルチビタミン/マルチミネラルサプリメントの成分として400μg/日の葉酸を毎日摂取することを推奨することは、血中ホモシステイン濃度が年齢とともに増加しやすい年配の成人には特に重要である(「疾病予防」の項参照)。
Authors and Reviewers
Originally written in 2000 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in April 2002 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in September 2007 by:
Victoria J. Drake, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in June 2014 by:
Barbara Delage, Ph.D.
Linus Pauling Institute
Oregon State University
Reviewed in December 2014 by:
Helene McNulty, Ph.D., R.D.
Professor of Human Nutrition and Dietetics
Northern Ireland Centre for Food and Health (NICHE)
University of Ulster
Coleraine, United Kingdom
The 2014 update of this article was underwritten, in part, by a grant from Bayer Consumer Care AG, Basel, Switzerland.
Copyright 2000-2024 Linus Pauling Institute
References
1. Food and Nutrition Board, Institute of Medicine. Folate. Dietary Reference Intakes: Thiamin, Riboflavin, Niacin, Vitamin B6, Folate, Vitamin B12, Pantothenic Acid, Biotin, and Choline. Washington, D.C.: National Academy Press; 1998:196-305. (National Academy Press)
2. Choi SW, Mason JB. Folate and carcinogenesis: an integrated scheme. J Nutr. 2000;130(2):129-132. (PubMed)
3. Bailey LB, Gregory JF, 3rd. Folate metabolism and requirements. J Nutr. 1999;129(4):779-782. (PubMed)
4. Gerhard GT, Duell PB. Homocysteine and atherosclerosis. Curr Opin Lipidol. 1999;10(5):417-428. (PubMed)
5. Jacques PF, Bostom AG, Wilson PW, Rich S, Rosenberg IH, Selhub J. Determinants of plasma total homocysteine concentration in the Framingham Offspring cohort. Am J Clin Nutr. 2001;73(3):613-621. (PubMed)
6. Jacques PF, Kalmbach R, Bagley PJ, et al. The relationship between riboflavin and plasma total homocysteine in the Framingham Offspring cohort is influenced by folate status and the C677T transition in the methylenetetrahydrofolate reductase gene. J Nutr. 2002;132(2):283-288. (PubMed)
7. McNulty H, Dowey le RC, Strain JJ, et al. Riboflavin lowers homocysteine in individuals homozygous for the MTHFR 677C->T polymorphism. Circulation. 2006;113(1):74-80. (PubMed)
8. Verlinde PH, Oey I, Hendrickx ME, Van Loey AM, Temme EH. L-ascorbic acid improves the serum folate response to an oral dose of [6S]-5-methyltetrahydrofolic acid in healthy men. Eur J Clin Nutr. 2008;62(10):1224-1230. (PubMed)
9. Lucock M, Yates Z, Boyd L, et al. Vitamin C-related nutrient-nutrient and nutrient-gene interactions that modify folate status. Eur J Nutr. 2013;52(2):569-582. (PubMed)
10. Desmoulin SK, Hou Z, Gangjee A, Matherly LH. The human proton-coupled folate transporter: Biology and therapeutic applications to cancer. Cancer Biol Ther. 2012;13(14):1355-1373. (PubMed)
11. Solanky N, Requena Jimenez A, D'Souza SW, Sibley CP, Glazier JD. Expression of folate transporters in human placenta and implications for homocysteine metabolism. Placenta. 2010;31(2):134-143. (PubMed)
12. Halsted CH, Villanueva JA, Devlin AM, Chandler CJ. Metabolic interactions of alcohol and folate. J Nutr. 2002;132(8 Suppl):2367S-2372S. (PubMed)
13. Pfeiffer CM, Sternberg MR, Schleicher RL, Rybak ME. Dietary supplement use and smoking are important correlates of biomarkers of water-soluble vitamin status after adjusting for sociodemographic and lifestyle variables in a representative sample of US adults. J Nutr. 2013;143(6):957S-965S. (PubMed)
14. Stark KD, Pawlosky RJ, Sokol RJ, Hannigan JH, Salem N, Jr. Maternal smoking is associated with decreased 5-methyltetrahydrofolate in cord plasma. Am J Clin Nutr. 2007;85(3):796-802. (PubMed)
15. Hutson JR, Stade B, Lehotay DC, Collier CP, Kapur BM. Folic acid transport to the human fetus is decreased in pregnancies with chronic alcohol exposure. PLoS One. 2012;7(5):e38057. (PubMed)
16. Herbert V. Folic acid. In: Shils M, Olson JA, Shike M, Ross AC, eds. Modern Nutrition in Health and Disease. 9th ed. Baltimore: Lippincott Williams & Wilkins; 1999:433-446.
17. Stabler SP. Clinical folate deficiency. In: Bailey LB, ed. Folate in Health and Disease. 2nd edition ed. Boca Raton, FL: CRC press, Taylor & Francis Group; 2010:409-428.
18. Bailey LB. Dietary reference intakes for folate: the debut of dietary folate equivalents. Nutr Rev. 1998;56(10):294-299. (PubMed)
19. Bailey LB, Gregory JF, 3rd. Polymorphisms of methylenetetrahydrofolate reductase and other enzymes: metabolic significance, risks and impact on folate requirement. J Nutr. 1999;129(5):919-922. (PubMed)
20. Wilcken B, Bamforth F, Li Z, et al. Geographical and ethnic variation of the 677C>T allele of 5,10 methylenetetrahydrofolate reductase (MTHFR): findings from over 7000 newborns from 16 areas world wide. J Med Genet. 2003;40(8):619-625. (PubMed)
21. Guenther BD, Sheppard CA, Tran P, Rozen R, Matthews RG, Ludwig ML. The structure and properties of methylenetetrahydrofolate reductase from Escherichia coli suggest how folate ameliorates human hyperhomocysteinemia. Nat Struct Biol. 1999;6(4):359-365. (PubMed)
22. Molloy AM, Daly S, Mills JL, et al. Thermolabile variant of 5,10-methylenetetrahydrofolate reductase associated with low red-cell folates: implications for folate intake recommendations. Lancet. 1997;349(9065):1591-1593. (PubMed)
23. Rozen R. Genetic predisposition to hyperhomocysteinemia: deficiency of methylenetetrahydrofolate reductase (MTHFR). Thromb Haemost. 1997;78(1):523-526. (PubMed)
24. Kauwell GP, Wilsky CE, Cerda JJ, et al. Methylenetetrahydrofolate reductase mutation (677C-->T) negatively influences plasma homocysteine response to marginal folate intake in elderly women. Metabolism. 2000;49(11):1440-1443. (PubMed)
25. Shane B. Folic acid, vitamin B-12, and vitamin B-6. In: Stipanuk M, ed. Biochemical and Physiological Aspects of Human Nutrition. Philadelphia: W.B. Saunders Co.; 2000:483-518.
26. Eskes TK. Open or closed? A world of difference: a history of homocysteine research. Nutr Rev. 1998;56(8):236-244. (PubMed)
27. Czeizel AE, Dudas I, Vereczkey A, Banhidy F. Folate deficiency and folic acid supplementation: the prevention of neural-tube defects and congenital heart defects. Nutrients. 2013;5(11):4760-4775. (PubMed)
28. MRC Vitamin Study Research Group. Prevention of neural tube defects: results of the Medical Research Council Vitamin Study. Lancet. 1991;338(8760):131-137. (PubMed)
29. Czeizel AE, Dudas I. Prevention of the first occurrence of neural-tube defects by periconceptional vitamin supplementation. N Engl J Med. 1992;327(26):1832-1835. (PubMed)
30. Talaulikar VS, Arulkumaran S. Folic acid in obstetric practice: a review. Obstet Gynecol Surv. 2011;66(4):240-247. (PubMed)
31. American College of Obstetricians and Gynecologists (ACOG). Neural tube defects. Washington, DC. 2003. Available at: http://www.guideline.gov/content.aspx?id=3994. Accessed 12/19/14.
32. McNulty B, Pentieva K, Marshall B, et al. Women's compliance with current folic acid recommendations and achievement of optimal vitamin status for preventing neural tube defects. Hum Reprod. 2011;26(6):1530-1536. (PubMed)
33. Nilsen RM, Vollset SE, Gjessing HK, et al. Patterns and predictors of folic acid supplement use among pregnant women: the Norwegian Mother and Child Cohort Study. Am J Clin Nutr. 2006;84(5):1134-1141. (PubMed)
34. Ray JG, Singh G, Burrows RF. Evidence for suboptimal use of periconceptional folic acid supplements globally. BJOG. 2004;111(5):399-408. (PubMed)
35. Quinlivan EP, Gregory JF, 3rd. Effect of food fortification on folic acid intake in the United States. Am J Clin Nutr. 2003;77(1):221-225. (PubMed)
36. National Birth Defects Prevention Network. Neural Tube Defect Ascertainment Project. Available at: http://www.nbdpn.org/ntd_folic_acid_information.php. Accessed 12/16/14.
37. Copp AJ, Stanier P, Greene ND. Neural tube defects: recent advances, unsolved questions, and controversies. Lancet Neurol. 2013;12(8):799-810. (PubMed)
38. Yan L, Zhao L, Long Y, et al. Association of the maternal MTHFR C677T polymorphism with susceptibility to neural tube defects in offsprings: evidence from 25 case-control studies. PLoS One. 2012;7(10):e41689. (PubMed)
39. De Marco P, Calevo MG, Moroni A, et al. Study of MTHFR and MS polymorphisms as risk factors for NTD in the Italian population. J Hum Genet. 2002;47(6):319-324. (PubMed)
40. van der Put NM, Gabreels F, Stevens EM, et al. A second common mutation in the methylenetetrahydrofolate reductase gene: an additional risk factor for neural-tube defects? Am J Hum Genet. 1998;62(5):1044-1051. (PubMed)
41. De Marco P, Calevo MG, Moroni A, et al. Reduced folate carrier polymorphism (80A-->G) and neural tube defects. Eur J Hum Genet. 2003;11(3):245-252. (PubMed)
42. O'Leary VB, Mills JL, Parle-McDermott A, et al. Screening for new MTHFR polymorphisms and NTD risk. Am J Med Genet A. 2005;138A(2):99-106. (PubMed)
43. Christensen B, Arbour L, Tran P, et al. Genetic polymorphisms in methylenetetrahydrofolate reductase and methionine synthase, folate levels in red blood cells, and risk of neural tube defects. Am J Med Genet. 1999;84(2):151-157. (PubMed)
44. Relton CL, Wilding CS, Pearce MS, et al. Gene-gene interaction in folate-related genes and risk of neural tube defects in a UK population. J Med Genet. 2004;41(4):256-260. (PubMed)
45. Brody LC, Conley M, Cox C, et al. A polymorphism, R653Q, in the trifunctional enzyme methylenetetrahydrofolate dehydrogenase/methenyltetrahydrofolate cyclohydrolase/formyltetrahydrofolate synthetase is a maternal genetic risk factor for neural tube defects: report of the Birth Defects Research Group. Am J Hum Genet. 2002;71(5):1207-1215. (PubMed)
46. van der Put NM, van den Heuvel LP, Steegers-Theunissen RP, et al. Decreased methylene tetrahydrofolate reductase activity due to the 677C-->T mutation in families with spina bifida offspring. J Mol Med (Berl). 1996;74(11):691-694. (PubMed)
47. Wilson A, Platt R, Wu Q, et al. A common variant in methionine synthase reductase combined with low cobalamin (vitamin B12) increases risk for spina bifida. Mol Genet Metab. 1999;67(4):317-323. (PubMed)
48. Gilboa SM, Salemi JL, Nembhard WN, Fixler DE, Correa A. Mortality resulting from congenital heart disease among children and adults in the United States, 1999 to 2006. Circulation. 2010;122(22):2254-2263. (PubMed)
49. van Beynum IM, Kapusta L, Bakker MK, den Heijer M, Blom HJ, de Walle HE. Protective effect of periconceptional folic acid supplements on the risk of congenital heart defects: a registry-based case-control study in the northern Netherlands. Eur Heart J. 2010;31(4):464-471. (PubMed)
50. Yin M, Dong L, Zheng J, Zhang H, Liu J, Xu Z. Meta analysis of the association between MTHFR C677T polymorphism and the risk of congenital heart defects. Ann Hum Genet. 2012;76(1):9-16. (PubMed)
51. Wang W, Wang Y, Gong F, Zhu W, Fu S. MTHFR C677T polymorphism and risk of congenital heart defects: evidence from 29 case-control and TDT studies. PLoS One. 2013;8(3):e58041. (PubMed)
52. Badovinac RL, Werler MM, Williams PL, Kelsey KT, Hayes C. Folic acid-containing supplement consumption during pregnancy and risk for oral clefts: a meta-analysis. Birth Defects Res A Clin Mol Teratol. 2007;79(1):8-15. (PubMed)
53. Wilcox AJ, Lie RT, Solvoll K, et al. Folic acid supplements and risk of facial clefts: national population based case-control study. BMJ. 2007;334(7591):464. (PubMed)
54. Boyles AL, Wilcox AJ, Taylor JA, et al. Folate and one-carbon metabolism gene polymorphisms and their associations with oral facial clefts. Am J Med Genet A. 2008;146A(4):440-449. (PubMed)
55. Boyles AL, Wilcox AJ, Taylor JA, et al. Oral facial clefts and gene polymorphisms in metabolism of folate/one-carbon and vitamin A: a pathway-wide association study. Genet Epidemiol. 2009;33(3):247-255. (PubMed)
56. Luo YL, Cheng YL, Ye P, Wang W, Gao XH, Chen Q. Association between MTHFR polymorphisms and orofacial clefts risk: a meta-analysis. Birth Defects Res A Clin Mol Teratol. 2012;94(4):237-244. (PubMed)
57. Wilcox AJ. On the importance--and the unimportance--of birthweight. Int J Epidemiol. 2001;30(6):1233-1241. (PubMed)
58. Fekete K, Berti C, Trovato M, et al. Effect of folate intake on health outcomes in pregnancy: a systematic review and meta-analysis on birth weight, placental weight and length of gestation. Nutr J. 2012;11:75. (PubMed)
59. Baker PN, Wheeler SJ, Sanders TA, et al. A prospective study of micronutrient status in adolescent pregnancy. Am J Clin Nutr. 2009;89(4):1114-1124. (PubMed)
60. Lee HA, Park EA, Cho SJ, et al. Mendelian randomization analysis of the effect of maternal homocysteine during pregnancy, as represented by maternal MTHFR C677T genotype, on birth weight. J Epidemiol. 2013;23(5):371-375. (PubMed)
61. Scholl TO, Johnson WG. Folic acid: influence on the outcome of pregnancy. Am J Clin Nutr. 2000;71(5 Suppl):1295S-1303S. (PubMed)
62. Vollset SE, Refsum H, Irgens LM, et al. Plasma total homocysteine, pregnancy complications, and adverse pregnancy outcomes: the Hordaland Homocysteine study. Am J Clin Nutr. 2000;71(4):962-968. (PubMed)
63. Wang XM, Wu HY, Qiu XJ. Methylenetetrahydrofolate reductase (MTHFR) gene C677T polymorphism and risk of preeclampsia: an updated meta-analysis based on 51 studies. Arch Med Res. 2013;44(3):159-168. (PubMed)
64. Wen SW, Champagne J, Rennicks White R, et al. Effect of folic acid supplementation in pregnancy on preeclampsia: the folic acid clinical trial study. J Pregnancy. 2013;2013:294312. (PubMed)
65. Lassi ZS, Salam RA, Haider BA, Bhutta ZA. Folic acid supplementation during pregnancy for maternal health and pregnancy outcomes. Cochrane Database Syst Rev. 2013;3:CD006896. (PubMed)
66. Schmidt RJ, Tancredi DJ, Ozonoff S, et al. Maternal periconceptional folic acid intake and risk of autism spectrum disorders and developmental delay in the CHARGE (CHildhood Autism Risks from Genetics and Environment) case-control study. Am J Clin Nutr. 2012;96(1):80-89. (PubMed)
67. Crider KS, Cordero AM, Qi YP, Mulinare J, Dowling NF, Berry RJ. Prenatal folic acid and risk of asthma in children: a systematic review and meta-analysis. Am J Clin Nutr. 2013;98(5):1272-1281. (PubMed)
68. Brown SB, Reeves KW, Bertone-Johnson ER. Maternal folate exposure in pregnancy and childhood asthma and allergy: a systematic review. Nutr Rev. 2014;72(1):55-64. (PubMed)
69. Ding R, Lin S, Chen D. The association of cystathionine β synthase (CBS) T833C polymorphism and the risk of stroke: a meta-analysis. J Neurol Sci. 2012;312(1-2):26-30. (PubMed)
70. Seshadri N, Robinson K. Homocysteine, B vitamins, and coronary artery disease. Med Clin North Am. 2000;84(1):215-237. (PubMed)
71. Wald DS, Law M, Morris JK. Homocysteine and cardiovascular disease: evidence on causality from a meta-analysis. BMJ. 2002;325(7374):1202. (PubMed)
72. Homocysteine Studies Collaboration. Homocysteine and risk of ischemic heart disease and stroke: a meta-analysis. JAMA. 2002;288(16):2015-2022. (PubMed)
73. Clarke R, Halsey J, Bennett D, Lewington S. Homocysteine and vascular disease: review of published results of the homocysteine-lowering trials. J Inherit Metab Dis. 2011;34(1):83-91. (PubMed)
74. Huang T, Chen Y, Yang B, Yang J, Wahlqvist ML, Li D. Meta-analysis of B vitamin supplementation on plasma homocysteine, cardiovascular and all-cause mortality. Clin Nutr. 2012;31(4):448-454. (PubMed)
75. Voutilainen S, Rissanen TH, Virtanen J, Lakka TA, Salonen JT. Low dietary folate intake is associated with an excess incidence of acute coronary events: The Kuopio Ischemic Heart Disease Risk Factor Study. Circulation. 2001;103(22):2674-2680. (PubMed)
76. Brattstrom L. Vitamins as homocysteine-lowering agents. J Nutr. 1996;126(4 Suppl):1276S-1280S. (PubMed)
77. Rader JI. Folic acid fortification, folate status and plasma homocysteine. J Nutr. 2002;132(8 Suppl):2466S-2470S. (PubMed)
78. Homocysteine Lowering Trialists' Collaboration. Dose-dependent effects of folic acid on blood concentrations of homocysteine: a meta-analysis of the randomized trials. Am J Clin Nutr. 2005;82(4):806-812. (PubMed)
79. Malinow MR, Bostom AG, Krauss RM. Homocyst(e)ine, diet, and cardiovascular diseases: a statement for healthcare professionals from the Nutrition Committee, American Heart Association. Circulation. 1999;99(1):178-182. (PubMed)
80. van Meurs JB, Pare G, Schwartz SM, et al. Common genetic loci influencing plasma homocysteine concentrations and their effect on risk of coronary artery disease. Am J Clin Nutr. 2013;98(3):668-676. (PubMed)
81. Holmes MV, Newcombe P, Hubacek JA, et al. Effect modification by population dietary folate on the association between MTHFR genotype, homocysteine, and stroke risk: a meta-analysis of genetic studies and randomised trials. Lancet. 2011;378(9791):584-594. (PubMed)
82. Clarke R, Bennett DA, Parish S, et al. Homocysteine and coronary heart disease: meta-analysis of MTHFR case-control studies, avoiding publication bias. PLoS Med. 2012;9(2):e1001177. (PubMed)
83. Ji Y, Tan S, Xu Y, et al. Vitamin B supplementation, homocysteine levels, and the risk of cerebrovascular disease: A meta-analysis. Neurology. 2013;81(15):1298-1307. (PubMed)
84. Zhang C, Chi FL, Xie TH, Zhou YH. Effect of B-vitamin supplementation on stroke: a meta-analysis of randomized controlled trials. PLoS One. 2013;8(11):e81577. (PubMed)
85. Mosca L, Benjamin EJ, Berra K, et al. Effectiveness-based guidelines for the prevention of cardiovascular disease in women--2011 update: a guideline from the American Heart Association. J Am Coll Cardiol. 2011;57(12):1404-1423. (PubMed)
86. Wang X, Qin X, Demirtas H, et al. Efficacy of folic acid supplementation in stroke prevention: a meta-analysis. Lancet. 2007;369(9576):1876-1882. (PubMed)
87. Yang Q, Botto LD, Erickson JD, et al. Improvement in stroke mortality in Canada and the United States, 1990 to 2002. Circulation. 2006;113(10):1335-1343. (PubMed)
88. Lorenz MW, Markus HS, Bots ML, Rosvall M, Sitzer M. Prediction of clinical cardiovascular events with carotid intima-media thickness: a systematic review and meta-analysis. Circulation. 2007;115(4):459-467. (PubMed)
89. Qin X, Xu M, Zhang Y, et al. Effect of folic acid supplementation on the progression of carotid intima-media thickness: a meta-analysis of randomized controlled trials. Atherosclerosis. 2012;222(2):307-313. (PubMed)
90. de Bree A, van Mierlo LA, Draijer R. Folic acid improves vascular reactivity in humans: a meta-analysis of randomized controlled trials. Am J Clin Nutr. 2007;86(3):610-617. (PubMed)
91. McNeil CJ, Beattie JH, Gordon MJ, Pirie LP, Duthie SJ. Nutritional B vitamin deficiency disrupts lipid metabolism causing accumulation of proatherogenic lipoproteins in the aorta adventitia of ApoE null mice. Mol Nutr Food Res. 2012;56(7):1122-1130. (PubMed)
92. Blount BC, Mack MM, Wehr CM, et al. Folate deficiency causes uracil misincorporation into human DNA and chromosome breakage: implications for cancer and neuronal damage. Proc Natl Acad Sci U S A. 1997;94(7):3290-3295. (PubMed)
93. Narayanan S, McConnell J, Little J, et al. Associations between two common variants C677T and A1298C in the methylenetetrahydrofolate reductase gene and measures of folate metabolism and DNA stability (strand breaks, misincorporated uracil, and DNA methylation status) in human lymphocytes in vivo. Cancer Epidemiol Biomarkers Prev. 2004;13(9):1436-1443. (PubMed)
94. Rahman L, Voeller D, Rahman M, et al. Thymidylate synthase as an oncogene: a novel role for an essential DNA synthesis enzyme. Cancer Cell. 2004;5(4):341-351. (PubMed)
95. Hubner RA, Liu JF, Sellick GS, Logan RF, Houlston RS, Muir KR. Thymidylate synthase polymorphisms, folate and B-vitamin intake, and risk of colorectal adenoma. Br J Cancer. 2007;97(10):1449-1456. (PubMed)
96. Desmoulin SK, Wang L, Polin L, et al. Functional loss of the reduced folate carrier enhances the antitumor activities of novel antifolates with selective uptake by the proton-coupled folate transporter. Mol Pharmacol. 2012;82(4):591-600. (PubMed)
97. Crider KS, Yang TP, Berry RJ, Bailey LB. Folate and DNA methylation: a review of molecular mechanisms and the evidence for folate's role. Adv Nutr. 2012;3(1):21-38. (PubMed)
98. Butrum RR, Clifford CK, Lanza E. NCI dietary guidelines: rationale. Am J Clin Nutr. 1988;48(3 Suppl):888-895. (PubMed)
99. Crider KS, Bailey LB, Berry RJ. Folic acid food fortification-its history, effect, concerns, and future directions. Nutrients. 2011;3(3):370-384. (PubMed)
100. Qin X, Cui Y, Shen L, et al. Folic acid supplementation and cancer risk: A meta-analysis of randomized controlled trials. Int J Cancer. 2013;133(5):1033-1041. (PubMed)
101. Vollset SE, Clarke R, Lewington S, et al. Effects of folic acid supplementation on overall and site-specific cancer incidence during the randomised trials: meta-analyses of data on 50,000 individuals. Lancet. 2013;381(9871):1029-1036. (PubMed)
102. Kim DH, Smith-Warner SA, Spiegelman D, et al. Pooled analyses of 13 prospective cohort studies on folate intake and colon cancer. Cancer Causes Control. 2010;21(11):1919-1930. (PubMed)
103. Gibson TM, Weinstein SJ, Pfeiffer RM, et al. Pre- and postfortification intake of folate and risk of colorectal cancer in a large prospective cohort study in the United States. Am J Clin Nutr. 2011;94(4):1053-1062. (PubMed)
104. Stevens VL, McCullough ML, Sun J, Jacobs EJ, Campbell PT, Gapstur SM. High levels of folate from supplements and fortification are not associated with increased risk of colorectal cancer. Gastroenterology. 2011;141(1):98-105, 105 e101. (PubMed)
105. Zschabitz S, Cheng TY, Neuhouser ML, et al. B vitamin intakes and incidence of colorectal cancer: results from the Women's Health Initiative Observational Study cohort. Am J Clin Nutr. 2013;97(2):332-343. (PubMed)
106. Keum N, Giovannucci EL. Folic acid fortification and colorectal cancer risk. Am J Prev Med. 2014;46(3 Suppl 1):S65-72. (PubMed)
107. Kennedy DA, Stern SJ, Moretti M, et al. Folate intake and the risk of colorectal cancer: a systematic review and meta-analysis. Cancer Epidemiol. 2011;35(1):2-10. (PubMed)
108. Kim YI. Folate: a magic bullet or a double edged sword for colorectal cancer prevention? Gut. 2006;55(10):1387-1389. (PubMed)
109. Paspatis GA, Kalafatis E, Oros L, Xourgias V, Koutsioumpa P, Karamanolis DG. Folate status and adenomatous colonic polyps. A colonoscopically controlled study. Dis Colon Rectum. 1995;38(1):64-67; discussion 67-68. (PubMed)
110. Jaszewski R, Misra S, Tobi M, et al. Folic acid supplementation inhibits recurrence of colorectal adenomas: a randomized chemoprevention trial. World J Gastroenterol. 2008;14(28):4492-4498. (PubMed)
111. Wu K, Platz EA, Willett WC, et al. A randomized trial on folic acid supplementation and risk of recurrent colorectal adenoma. Am J Clin Nutr. 2009;90(6):1623-1631. (PubMed)
112. Logan RF, Grainge MJ, Shepherd VC, Armitage NC, Muir KR. Aspirin and folic acid for the prevention of recurrent colorectal adenomas. Gastroenterology. 2008;134(1):29-38. (PubMed)
113. Figueiredo JC, Mott LA, Giovannucci E, et al. Folic acid and prevention of colorectal adenomas: a combined analysis of randomized clinical trials. Int J Cancer. 2011;129(1):192-203. (PubMed)
114. Kennedy DA, Stern SJ, Matok I, et al. Folate intake, MTHFR polymorphisms, and the risk of colorectal cancer: a systematic review and meta-analysis. J Cancer Epidemiol. 2012;2012:952508. (PubMed)
115. Ding W, Zhou DL, Jiang X, Lu LS. Methionine synthase A2756G polymorphism and risk of colorectal adenoma and cancer: evidence based on 27 studies. PLoS One. 2013;8(4):e60508. (PubMed)
116. Nan H, Lee JE, Rimm EB, Fuchs CS, Giovannucci EL, Cho E. Prospective study of alcohol consumption and the risk of colorectal cancer before and after folic acid fortification in the United States. Ann Epidemiol. 2013;23(9):558-563. (PubMed)
117. Slattery ML, Potter JD, Samowitz W, Schaffer D, Leppert M. Methylenetetrahydrofolate reductase, diet, and risk of colon cancer. Cancer Epidemiol Biomarkers Prev. 1999;8(6):513-518. (PubMed)
118. Ma J, Stampfer MJ, Giovannucci E, et al. Methylenetetrahydrofolate reductase polymorphism, dietary interactions, and risk of colorectal cancer. Cancer Res. 1997;57(6):1098-1102. (PubMed)
119. Larsson SC, Giovannucci E, Wolk A. Folate and risk of breast cancer: a meta-analysis. J Natl Cancer Inst. 2007;99(1):64-76. (PubMed)
120. Liu M, Cui LH, Ma AG, Li N, Piao JM. Lack of effects of dietary folate intake on risk of breast cancer: an updated meta-analysis of prospective studies. Asian Pac J Cancer Prev. 2014;15(5):2323-2328. (PubMed)
121. Brooks PJ, Zakhari S. Moderate alcohol consumption and breast cancer in women: from epidemiology to mechanisms and interventions. Alcohol Clin Exp Res. 2013;37(1):23-30. (PubMed)
122. Rohan TE, Jain MG, Howe GR, Miller AB. Dietary folate consumption and breast cancer risk. J Natl Cancer Inst. 2000;92(3):266-269. (PubMed)
123. Sellers TA, Kushi LH, Cerhan JR, et al. Dietary folate intake, alcohol, and risk of breast cancer in a prospective study of postmenopausal women. Epidemiology. 2001;12(4):420-428. (PubMed)
124. Zhang S, Hunter DJ, Hankinson SE, et al. A prospective study of folate intake and the risk of breast cancer. JAMA. 1999;281(17):1632-1637. (PubMed)
125. Tjonneland A, Christensen J, Olsen A, et al. Alcohol intake and breast cancer risk: the European Prospective Investigation into Cancer and Nutrition (EPIC). Cancer Causes Control. 2007;18(4):361-373. (PubMed)
126. Bassett JK, Baglietto L, Hodge AM, et al. Dietary intake of B vitamins and methionine and breast cancer risk. Cancer Causes Control. 2013;24(8):1555-1563. (PubMed)
127. Wang J, Wang B, Bi J, Di J. The association between two polymorphisms in the TYMS gene and breast cancer risk: a meta-analysis. Breast Cancer Res Treat. 2011;128(1):203-209. (PubMed)
128. Weiner AS, Boyarskikh UA, Voronina EN, et al. Polymorphisms in the folate-metabolizing genes MTR, MTRR, and CBS and breast cancer risk. Cancer Epidemiol. 2012;36(2):e95-e100. (PubMed)
129. Linabery AM, Johnson KJ, Ross JA. Childhood cancer incidence trends in association with US folic acid fortification (1986-2008). Pediatrics. 2012;129(6):1125-1133. (PubMed)
130. Milne E, Royle JA, Miller M, et al. Maternal folate and other vitamin supplementation during pregnancy and risk of acute lymphoblastic leukemia in the offspring. Int J Cancer. 2010;126(11):2690-2699. (PubMed)
131. Yan J, Yin M, Dreyer ZE, et al. A meta-analysis of MTHFR C677T and A1298C polymorphisms and risk of acute lymphoblastic leukemia in children. Pediatr Blood Cancer. 2012;58(4):513-518. (PubMed)
132. Alzheimer's Association. 2013 Alzheimer's Disease Fact and Figures. Alzheimer's & Dementia. 9(2). http://www.alz.org/downloads/facts_figures_2013.pdf. Accessed 9/9/13.
133. Hughes TF, Andel R, Small BJ, et al. Midlife fruit and vegetable consumption and risk of dementia in later life in Swedish twins. Am J Geriatr Psychiatry. 2010;18(5):413-420. (PubMed)
134. Weir DG, Scott JM. Brain function in the elderly: role of vitamin B12 and folate. Br Med Bull. 1999;55(3):669-682. (PubMed)
135. Faux NG, Ellis KA, Porter L, et al. Homocysteine, vitamin B12, and folic acid levels in Alzheimer's disease, mild cognitive impairment, and healthy elderly: baseline characteristics in subjects of the Australian Imaging Biomarker Lifestyle study. J Alzheimers Dis. 2011;27(4):909-922. (PubMed)
136. Van Dam F, Van Gool WA. Hyperhomocysteinemia and Alzheimer's disease: A systematic review. Arch Gerontol Geriatr. 2009;48(3):425-430. (PubMed)
137. Morris MC, Evans DA, Bienias JL, et al. Dietary folate and vitamin B12 intake and cognitive decline among community-dwelling older persons. Arch Neurol. 2005;62(4):641-645. (PubMed)
138. Morris MC, Evans DA, Schneider JA, Tangney CC, Bienias JL, Aggarwal NT. Dietary folate and vitamins B-12 and B-6 not associated with incident Alzheimer's disease. J Alzheimers Dis. 2006;9(4):435-443. (PubMed)
139. Wald DS, Kasturiratne A, Simmonds M. Serum homocysteine and dementia: meta-analysis of eight cohort studies including 8669 participants. Alzheimers Dement. 2011;7(4):412-417. (PubMed)
140. Ho RC, Cheung MW, Fu E, et al. Is high homocysteine level a risk factor for cognitive decline in elderly? A systematic review, meta-analysis, and meta-regression. Am J Geriatr Psychiatry. 2011;19(7):607-617. (PubMed)
141. Nilforooshan R, Broadbent D, Weaving G, et al. Homocysteine in Alzheimer's disease: role of dietary folate, vitamin B6 and B12. Int J Geriatr Psychiatry. 2011;26(8):876-877. (PubMed)
142. Wald DS, Kasturiratne A, Simmonds M. Effect of folic acid, with or without other B vitamins, on cognitive decline: meta-analysis of randomized trials. Am J Med. 2010;123(6):522-527 e522. (PubMed)
143. Ford AH, Almeida OP. Effect of homocysteine lowering treatment on cognitive function: a systematic review and meta-analysis of randomized controlled trials. J Alzheimers Dis. 2012;29(1):133-149. (PubMed)
144. Nachum-Biala Y, Troen AM. B-vitamins for neuroprotection: narrowing the evidence gap. Biofactors. 2012;38(2):145-150. (PubMed)
145. Smith AD, Smith SM, de Jager CA, et al. Homocysteine-lowering by B vitamins slows the rate of accelerated brain atrophy in mild cognitive impairment: a randomized controlled trial. PLoS One. 2010;5(9):e12244. (PubMed)
146. Douaud G, Refsum H, de Jager CA, et al. Preventing Alzheimer's disease-related gray matter atrophy by B-vitamin treatment. Proc Natl Acad Sci U S A. 2013;110(23):9523-9528. (PubMed)
147. Watkins D, Rosenblatt DS. Update and new concepts in vitamin responsive disorders of folate transport and metabolism. J Inherit Metab Dis. 2012;35(4):665-670. (PubMed)
148. Zhao R, Min SH, Qiu A, et al. The spectrum of mutations in the PCFT gene, coding for an intestinal folate transporter, that are the basis for hereditary folate malabsorption. Blood. 2007;110(4):1147-1152. (PubMed)
149. Borzutzky A, Crompton B, Bergmann AK, et al. Reversible severe combined immunodeficiency phenotype secondary to a mutation of the proton-coupled folate transporter. Clin Immunol. 2009;133(3):287-294. (PubMed)
150. Sofer Y, Harel L, Sharkia M, Amir J, Schoenfeld T, Straussberg R. Neurological manifestations of folate transport defect: case report and review of the literature. J Child Neurol. 2007;22(6):783-786. (PubMed)
151. Diop-Bove N, Kronn D, Goldman ID. Hereditary folate malabsorption. In: Pagon RA, Adam MP, Bird TD, Dolan CR, Fong CT, Stephens K, eds. GeneReviews™ [Internet]. Seattle, WA: University of Washington, Seattle; 2008. (PubMed)
152. Frye RE, Sequeira JM, Quadros EV, James SJ, Rossignol DA. Cerebral folate receptor autoantibodies in autism spectrum disorder. Mol Psychiatry. 2013;18(3):369-381. (PubMed)
153. Grapp M, Just IA, Linnankivi T, et al. Molecular characterization of folate receptor 1 mutations delineates cerebral folate transport deficiency. Brain. 2012;135(Pt 7):2022-2031. (PubMed)
154. Ramaekers VT, Blau N, Sequeira JM, Nassogne MC, Quadros EV. Folate receptor autoimmunity and cerebral folate deficiency in low-functioning autism with neurological deficits. Neuropediatrics. 2007;38(6):276-281. (PubMed)
155. Ramaekers VT, Hausler M, Opladen T, Heimann G, Blau N. Psychomotor retardation, spastic paraplegia, cerebellar ataxia and dyskinesia associated with low 5-methyltetrahydrofolate in cerebrospinal fluid: a novel neurometabolic condition responding to folinic acid substitution. Neuropediatrics. 2002;33(6):301-308. (PubMed)
156. Banka S, Blom HJ, Walter J, et al. Identification and characterization of an inborn error of metabolism caused by dihydrofolate reductase deficiency. Am J Hum Genet. 2011;88(2):216-225. (PubMed)
157. Cario H, Smith DE, Blom H, et al. Dihydrofolate reductase deficiency due to a homozygous DHFR mutation causes megaloblastic anemia and cerebral folate deficiency leading to severe neurologic disease. Am J Hum Genet. 2011;88(2):226-231. (PubMed)
158. Pfeiffer CM, Hughes JP, Lacher DA, et al. Estimation of trends in serum and RBC folate in the US population from pre- to postfortification using assay-adjusted data from the NHANES 1988-2010. J Nutr. 2012;142(5):886-893. (PubMed)
159. Folate. In: Hendler SS, Rorvik, D.R., ed. PDR for Nutritional Supplements. 2nd ed. Montvale: Physicians' Desk Reference Inc.; 2008.
160. Wiesinger H, Eydeler U, Richard F, et al. Bioequivalence evaluation of a folate-supplemented oral contraceptive containing ethinylestradiol/drospirenone/levomefolate calcium versus ethinylestradiol/drospirenone and levomefolate calcium alone. Clin Drug Investig. 2012;32(10):673-684. (PubMed)
161. Tinker SC, Cogswell ME, Devine O, Berry RJ. Folic acid intake among US women aged 15-44 years, National Health and Nutrition Examination Survey, 2003-2006. Am J Prev Med. 2010;38(5):534-542. (PubMed)
162. Kelly P, McPartlin J, Goggins M, Weir DG, Scott JM. Unmetabolized folic acid in serum: acute studies in subjects consuming fortified food and supplements. Am J Clin Nutr. 1997;65(6):1790-1795. (PubMed)
163. Morris MS, Jacques PF, Rosenberg IH, Selhub J. Folate and vitamin B-12 status in relation to anemia, macrocytosis, and cognitive impairment in older Americans in the age of folic acid fortification. Am J Clin Nutr. 2007;85(1):193-200. (PubMed)
164. Morris MS, Jacques PF, Rosenberg IH, Selhub J. Circulating unmetabolized folic acid and 5-methyltetrahydrofolate in relation to anemia, macrocytosis, and cognitive test performance in American seniors. Am J Clin Nutr. 2010;91(6):1733-1744. (PubMed)
165. Troen AM, Mitchell B, Sorensen B, et al. Unmetabolized folic acid in plasma is associated with reduced natural killer cell cytotoxicity among postmenopausal women. J Nutr. 2006;136(1):189-194. (PubMed)
166. Tam C, O'Connor D, Koren G. Circulating unmetabolized folic acid: relationship to folate status and effect of supplementation. Obstet Gynecol Int. 2012;2012:485179. (PubMed)
167. Apeland T, Mansoor MA, Strandjord RE. Antiepileptic drugs as independent predictors of plasma total homocysteine levels. Epilepsy Res. 2001;47(1-2):27-35. (PubMed)
168. Wilson SM, Bivins BN, Russell KA, Bailey LB. Oral contraceptive use: impact on folate, vitamin B(6), and vitamin B(1)(2) status. Nutr Rev. 2011;69(10):572-583. (PubMed)
ビタミンD
目次
要約
-
ビタミンDは日光を浴びることによって皮膚で合成可能で、肝臓と腎臓で代謝されて1α,25-ジヒドロキシビタミンDと呼ばれる代謝的に活性のある形態になる。ビタミンD受容体(VDR)と結合することで、1α,25-ジヒドロキシビタミンDは骨格やその他の生体機能に関わる数百の遺伝子の発現を調整することができる。(詳細はこちら)
-
カルシウムとリンの恒常性の調整による骨の石灰化の維持にビタミンDは不可欠である。ビタミンDは、骨格以外にも特に免疫、内分泌、および心血管系に対して多くの効果を発揮する。(詳細はこちら)
-
ビタミンDは、正常な骨の発達と維持に重要である。重篤なビタミンD欠乏症は、子供のくる病や成人の骨軟化症を引き起こす。(詳細はこちら)
-
ビタミンDの不足による二次性副甲状腺機能亢進症は、骨の分解を進めて骨粗しょう症を促進する可能性がある。無作為化臨床試験では、ビタミンDを少なくとも800 IU/日補給することによって、年配者の転倒や骨折リスクを減らせるかもしれないことが示されている。(詳細はこちら)
-
大部分の体細胞にあるビタミンD受容体と結合することによって、ビタミンDは細胞の分化と成長を調整することができる。日光にあたることが少ないことやビタミンDの栄養状態が良くないことと、結腸直腸がんや乳がんの発症リスクの上昇との間に関連があることが観察研究で報告されている。がん予防にビタミンD補給が有益であるかを評価する無作為化対照試験が必要である。(詳細はこちら)
-
様々な観察研究で、1型糖尿病、多発性硬化症、関節リウマチ、および全身性エリテマトーデスなどの自己免疫疾患のなりやすさや重篤度とビタミンDの状態との逆相関が報告されている。(詳細はこちら)
-
観察研究による現在のエビデンス(=科学的根拠)で、血液中のビタミンD濃度と2型糖尿病リスクとの逆相関が示唆されている。耐糖能障害の者のビタミンD欠乏症を治すことで2型糖尿病への進行リスクを減らすことができるかどうかはまだわかっていない。(詳細はこちら)
-
神経変性疾患を持つ被験者の認知機能低下や疾患の進行をビタミンD補給によって制限できるかどうかについて、無作為化臨床試験で現在調査中である。(詳細はこちら)
-
妊婦のビタミンD不足は、母親と新生児へのいくつかの悪影響と関連している可能性がある。妊娠中のビタミンD補給の安全性と有益性は、臨床試験で評価されねばならない。(詳細はこちら)
-
新型コロナウィルス感染症であるCOVID-19の発症率や重症度の上昇はビタミンD欠乏症と相関があることが、観察研究で報告されている。(詳細はこちら)
-
ビタミンD補給でアトピー性皮膚炎(湿疹)やクローン病の治療に改善の見込みがあるかもしれないことが、予備調査で示されている。(詳細はこちら)
ビタミンDはカルシウムの恒常性を調整し、骨の健康に不可欠な脂溶性ビタミンである(1)。食事やサプリメントでも摂取できるが、日光の紫外線B波(UVB)にさらされると、7-デヒドロコレステロールからビタミンD3(コレカルシフェロール)が皮膚内で合成される。ビタミンD2(エルゴカルシフェロール)は、植物、キノコ類、および酵母によって光合成されるビタミンDの類似体である。ビタミンD2はしばしば、食品のビタミンD強化にも使用される(2)。UVBにあたることが不十分で皮膚のビタミンD3が不適切な状態だと、ビタミンD需要を満たすためにビタミンDの経口摂取が必要である。
機能
ビタミンDの代謝
コレカルシフェロールとエルゴカルシフェロールは生物学的に不活性なビタミンD前駆体で、肝臓や腎臓で生物活性のある形態に変換されねばならない(図1)。実際、食事から摂取したりUVBにあたって表皮で合成されたりした後では、どちらの形態のビタミンDも血液中に入ってビタミンD結合タンパク質によって(および程度は低いがアルブミンによっても)肝臓まで輸送される。肝実質細胞(肝細胞)では、ビタミンDは25-ヒドロキシビタミンD(カルシジオール;カルシフェジオール)にヒドロキシル化(=水酸化)される。日光を浴びることや食事からビタミンDを摂取することで、25-ヒドロキシビタミンDの血清濃度が上がる。25-ヒドロキシビタミンDは血液中のビタミンDの主要な形態であり、25-ヒドロキシビタミンD2と25-ヒドロキシビタミンD3の血清濃度の合計は、ビタミンDの栄養状態の指標として使用される(3)。腎臓の25-ヒドロキシビタミンD-1α-ヒドロキシラーゼ酵素(CYP27B1としても知られる)は最終的に、25-ヒドロキシビタミンDを1α,25-ジヒドロキシビタミンD(カルシトリオール)に変換する第二のヒドロキシル化の触媒作用をする。腎臓での1α,25-ジヒドロキシビタミンDの生成は、血清中のリン、カルシウム、副甲状腺ホルモン(PTH)、線維芽細胞増殖因子-23(FGF-23)、および1α,25-ジヒドロキシビタミンDそのものなどのいくつかの要因によって調整されている。腎臓は1α-ヒドロキシラーゼ(=水酸化酵素)が活動する主要な部位であるが、皮膚、副甲状腺、乳房、結腸、前立腺、および免疫細胞や骨細胞などの様々な組織でも1α,25-ジヒドロキシビタミンDの腎臓外での生成が行われる(2)。体内でのビタミンDのほとんどの生理的効果は、1α,25-ジヒドロキシビタミンDの活性に関連している(4)。ビタミンDの様々な形態を図1に示す。
作用メカニズム
すべてではないがほとんどのビタミンDの作用は、ビタミンD受容体(VDR)として知られる核転写因子によって媒介される(図2)(5)。細胞の核に入ると、1α,25-ジヒドロキシビタミンDはVDRと結合し、レチノイドX受容体(RXR)という別の核受容体を動員する。1α,25-ジヒドロキシビタミンDがあると、VDR/RXR複合体はビタミンD応答配列(VDRE)というDNAの小配列と結合し、特定の遺伝子の転写を調整する一連の分子相互作用を開始させる。数千のVDREがゲノム中で識別されており、1α,25-ジヒドロキシビタミンDによるVDRの活性化は、直接および/または間接的に100~1,250の遺伝子を調整すると考えられている(6)。
カルシウムのバランス
血清カルシウム濃度を狭い範囲に維持することは、神経系の正常な機能や骨の成長および骨密度の維持に極めて重要である。体がカルシウムを効率的に利用するために、ビタミンDは不可欠である(1)。副甲状腺が血清カルシウム濃度を感知し、それが正常値より少ないと副甲状腺ホルモン(PTH)を分泌する(図3参照)。PTHの上昇が腎臓での25-ヒドロキシビタミンD3-1α-ヒドロキシラーゼ酵素の活性を刺激し、その結果1α,25-ジヒドロキシビタミンDの生成が増える。ビタミンDの活性型である1α,25-ジヒドロキシビタミンDは血液中に放出され、標的組織に運ばれる。標的細胞の中で1α,25-ジヒドロキシビタミンDはVDRと結合してそれを活性化し、血清カルシウム濃度を正常化する遺伝子の発現を変化させる。この遺伝子は(1)食事性カルシウムの腸における吸収を増やし、(2)腎臓でろ過されたカルシウムの再吸収を増やし、(3)正常な血清カルシウム濃度を維持するのに必要な食事性のカルシウムが不足している場合には骨からカルシウムを移動させる(7)。
リンのバランス
カルシウムとリンの恒常性の調整は密接に関連しており、カルシウム調整ホルモンであるPTHと1α,25-ジヒドロキシビタミンDは、血清リン濃度も調整可能である。特に、1α,25-ジヒドロキシビタミンDは小腸でのナトリウム・リン酸共輸送体の発現を刺激することで、腸でのリンの吸収を増やす。PTHは腎臓でのリンの再吸収を減らして尿へのリンの排出を増やすが、1α,25-ジヒドロキシビタミンDが直接的に腎臓でのリンの輸送を調整することができるのかどうかは不明である。リン利尿ホルモンであり、骨芽細胞(骨を造る細胞)で分泌される線維芽細胞増殖因子-23(FGF-23)は、25-ヒドロキシビタミンD-1α-ヒドロキシラーゼ酵素を抑制することで、1α,25-ジヒドロキシビタミンDの生成を制限する(図3)((8)の文献でレビュー)。
細胞分化
急速に分裂している細胞は増殖していると言う。分化の結果、細胞が特定の機能に特化する。一般的に、細胞分化は増殖の低下につながる。細胞増殖は成長や傷の治癒には不可欠であるが、特定の突然変異を持つ細胞の制御不能な増殖は、がんになる可能性がある。活性のあるビタミンD形態である1α,25-ジヒドロキシビタミンDは増殖を抑制し、VDRと結合することで細胞分化を刺激する(1)。
免疫
VDRを介して作用する1α,25-ジヒドロキシビタミンDは、免疫系の強力な調整役である。VDRは、樹状細胞やマクロファージといった制御性T細胞や抗原提示細胞などの免疫系のほとんどの細胞で発現する(9)。特定の状況では、単球、マクロファージ、およびT細胞は25-ヒドロキシビタミンD3-1α-ヒドロキシラーゼ酵素を発現させて1α,25-ジヒドロキシビタミンDを生成し、局所的に免疫反応の調整作用をする(10,11)。1α,25-ジヒドロキシビタミンDが免疫系の機能に様々な効果をもたらし、これが生来の免疫を強化したり自己免疫の発生を抑制しているのかもしれないという少なからぬ科学的エビデンスがある(12)。逆に、ビタミンDの欠乏は免疫系の整合性を損なって、不適切な免疫反応を起こすことになるのかもしれない(「自己免疫疾患」の項参照)。
インスリンの分泌
VDRは膵臓のインスリン分泌細胞によって発現し、動物研究の結果では、1α,25-ジヒドロキシビタミンDはインスリン需要が増えた状況でのインスリンの分泌に関与することが示唆されている(13,14)。横断研究および前向き研究で、ビタミンDの栄養状態が不充分だと、インスリンの分泌および2型糖尿病(非インスリン依存性糖尿病)の耐糖能に悪影響を及ぼすかもしれないことが示唆されている((15)の文献でレビュー)。
血圧の調整
レニン・アンジオテンシン系は、血圧の調整に重要な役割を果たす(16)。レニンは肝臓で造られる大きいタンパク質(アンジオテンシノーゲン)から小さいペプチド(アンジオテンシンI)が開裂(分割)される際の触媒作用をする酵素である。アンジオテンシン変換酵素(ACE)は、アンジオテンシンIが開裂してアンジオテンシンIIを生成する際の触媒作用をし、アンジオテンシンIIは小動脈の圧縮を促しナトリウムと水分をより多く保持することで血圧を上昇させることができるペプチドである。アンジオテンシンIIの合成率は、レニンに依存する(17)。VDRをコード化する遺伝子がないマウスの研究では、1α,25-ジヒドロキシビタミンDはレニンをコード化する遺伝子の発現をVDRとの相互作用で減らすことが示されている(18)。レニン・アンジオテンシン系の不適切な活性化は高血圧に寄与する可能性があるので、適切なビタミンDの栄養状態になることが高血圧のリスク低下に重要であるかもしれない(「高血圧」の項参照)。
欠乏症
ビタミンD欠乏症では、体のカルシウム需要を満たすのに十分なまでにカルシウムの吸収を増やすことができない(4)。したがって、副甲状腺によるPTHの生成が増えて、正常な血清カルシウム濃度を維持するために骨格からカルシウムが移動する。これは二次性副甲状腺機能亢進症として知られている。重篤なビタミンD欠乏症が骨の健康に深刻な結果を引き起こすことは長らく知られているが、それほど明白でないビタミンD欠乏症状態が一般的で、骨粗しょう症やその他の様々な健康上の問題のリスクを上昇させることが研究から示唆される(「疾病予防」の項参照)。
重篤なビタミンD欠乏症
くる病
幼児や子供では、重篤なビタミンD欠乏症は骨の石灰化不全を起こす。骨芽細胞によるリン酸カルシウム結晶の生成を起こす石灰化のプロセスは、骨の硬さや強さを決定する。ビタミンD欠乏症は、急速に成長する骨に深刻に影響する。骨の成長板は大きくなり続けるが、適切な石灰化ができないと、体重を支える四肢(腕と脚)が曲がる。幼児では、頭蓋骨の泉門(柔らかい部分)の閉鎖が遅れることになるかもしれず、また横隔膜に引っ張られて胸郭が変形する可能性がある。重篤なケースでは、血清カルシウム濃度が低い(低カルシウム血症)ことで痙攣が起きる可能性がある。ビタミンD欠乏症に関しては食品の強化で満足のいく結果になっているが、世界中では栄養不足のくる病はいまだに報告されている(19,20)。
骨軟化症
成人の骨はもはや成長はしないが、常に代謝回転、つまり「再形成」の状態にある。重篤なビタミンD欠乏症の成人では、コラーゲン性骨基質は保持されているものの骨塩の喪失が進行して骨が柔らかくなったり(骨軟化症)、骨の痛みがあったり、骨粗しょう症のリスクが上がったりする(21)。
筋力低下と筋肉痛
ビタミンD欠乏症は、子供や成人に筋力低下や筋肉痛を引き起こす。デンマークに住むアラブ人およびデンマーク人のイスラム教徒女性の研究で、筋肉痛や筋力低下はビタミンD欠乏症の顕著な症状であった(22)。持続する非特異性の筋骨格痛を診てもらうためににミネソタ州の診療所を訪れた150人の連続症例の横断研究では、93%が血清中の25-ヒドロキシビタミンD濃度が20ng/mL以下で平均で12.1ng/mLであり、これはビタミンD不足を呈している(23)。筋力がなくなると転倒や骨折のリスクが大幅に高くなり、年配者では特にそうである(24)。加えて、長期にわたるビタミンDの不足は年配者の骨粗しょう症の要因であるかもしれない(「骨粗しょう症」の項参照)。
ビタミンD欠乏症のリスク要因
環境要因および文化的慣習が、ビタミンDの状態の差異となって現れる。
●環境的条件:緯度や高度などの地理的位置や大気の状態(大気汚染や雲の有無など)は、地面に到達するUVBの強度に大きく影響する。季節的な変化もUVBの質や量に影響し、それによる皮膚でのビタミンD生成にも影響する(25~27)。
●肌を隠す服装:宗教的または文化的理由で頭にスカーフをしたり肌を全部隠す中東の女性2,032人の研究で、96%が血清中の25-ヒドロキシビタミンD濃度が20ng/mL未満で、60%がビタミンD濃度が12ng/mLより低かった(28)。子供や女性が屋外ではいつでも肌の大部分または全部を覆う中東や北アフリカでは、くる病や骨軟化症は珍しいことではない(29)。
●日光への安全策:日光に当たることを制限する、保護的な服や帽子を身に付ける、および日焼け止めを塗るなどの日光への防護対策は日光が肌に当たることを邪魔するので、適切な経口摂取がないとビタミンD3生成が減ったり、血液中のビタミンD代謝物が減ったりすることになる。留意したいのは、日焼け防止指数(SPF)が10の日焼け止め(2mg/cm2)を塗ると、UVBが90%減ることである(30)。
●母乳のみで育つ乳児:母乳のみで育ってビタミンDの補給を受けない乳児はビタミンD欠乏症のリスクが高く、肌の色が濃いおよび/または日光にほとんど当たらない場合は特にそうである(19)。母乳は一般に1リットル(L)に10~80 IUのビタミンDを含むが、これは一日の平均母乳摂取を0.75リットルとすると、0.2~1.5g/日(8~60 IU/日)に相当する(31)。米国小児科学会は、母乳のみおよび一部母乳で育つ乳児は400 IU/日の経口ビタミンD補給を受けるべきであると推奨している(19)。授乳期間中の母親のビタミンD補給も母乳で育つ乳児のビタミンDの状態を改善するのに役立つ可能性があり、ビタミンD欠乏症の有病率が高い集団では特にそうである(32)。ビタミンDを強化していない代用乳(大豆でできた人工乳など)や離乳食のみで育てられて成長した乳児や幼児は、ビタミンD欠乏症のリスクにさらされている(33)。
ビタミンDの合成、吸収、および代謝の効率も様々な生物学的要因に依存する。
●肌の色:肌の色が暗い人々は、日光に当たってもビタミンDの合成が肌の色が明るい人々よりも少ない(34)。米国の国家的な調査では、血清中の25-ヒドロキシビタミンD濃度の平均は、20歳以上の白人、メキシコ系アメリカ人、およびアフリカ系アメリカ人でそれぞれ28.1ng/mL、21.6ng/mL、16.9ng/mLであったと報告されている(25)。
●遺伝的変異:SUNLIGHTコンソーシアム([Study of Underlying Genetic Determinants of Vitamin D and Highly Related Traits]=根底にあるビタミンDの遺伝的決定因子および関連性の高い体質の研究)として知られる30,000人のヨーロッパ系参加者による15のコホート(=同齢などの共通因子を持つ集団)の国際的多機関ゲノム全体関連研究(GWAS)で、ビタミンDの栄養状態に影響するコレステロール合成、ヒドロキシル化、およびビタミンD輸送に関わる遺伝子における共通の変異(遺伝子多型)がわかった(35)。ヨーロッパ系(36,37)やアジア系(38,39)の集団での低ビタミンD状態の遺伝的決定因子はわかりつつあるが、アフリカ系の集団でのゲノム全体の関連研究が必要である。
●高齢:年配者はUVBに当っても皮膚でビタミンDを合成する能力が低下しているうえに、屋内にいたり日焼け止めを使ったりしやすく、これはビタミンD合成を妨げる。カナダ、米国、およびヨーロッパでは、ビタミンD欠乏症の罹患率は自活をしている年配者で10~20%である(40)。さらに、施設に入っていてビタミンD補給をされていない成人は、ビタミンD欠乏症のリスクが極端に高い(41,42)。
●慢性腎臓疾患(CKD):腎臓の機能が損なわれた患者のビタミンD欠乏症は、1α,25-ジヒドロキシビタミンDの合成が減り尿中へ25-ヒドロキシビタミンDの排出が増えることによるものである(43)。
●脂肪吸収不全症:ビタミンD欠乏症は、嚢胞性線維症や、胆汁うっ滞性および非胆汁うっ滞性の肝臓疾患の患者によく見られる。これは、食事からのビタミンDの吸収が減ったり、ビタミンDから25-ヒドロキシビタミンDへの変換が損なわれたりすることによるものである((44)の文献でレビュー)。
●炎症性腸疾患:クローン病のような炎症性腸疾患のある者はビタミンD欠乏症のリスクが高くなるようであり、小腸を切除した者は特にそうである(45)。
●肥満:肥満(肥満度指数BMIが30kg/m2以上)はビタミンD欠乏症のリスクを高くする(46)。ビタミンDが摂取されたり皮膚で合成されたりすると体脂肪の中に蓄えられ、体脂肪量の多い者には生物学的に利用しにくくなってしまう。さらに、正常体重(BMIが25kg/m2未満)の参加者と同量の経口用量を服用しても、肥満の者は血清の25-ヒドロキシビタミンD濃度がずっと低くなることがビタミンD補給試験で示された(47)。
●マグネシウム欠乏症:最近の発見で、マグネシウムの摂取が多いとビタミンD不足のリスクを減らせるかもしれないことが示唆されている。マグネシウムはビタミンDの代謝に重要な酵素の活性を調整するので、それによってマグネシウム欠乏症がどのようにビタミンDの状態にネガティブに影響するのかを説明できるであろう(48)。
ビタミンDの栄養状態の評価
ビタミンDの不足がくる病や骨軟化症以上の重篤な健康問題を起こすことを広く知らしめるため、ビタミンDの栄養状態を正確に評価する必要性が強調される。現在では、血清25-ヒドロキシビタミンDの全体濃度(1ng/mLが2.5nmol/Lに相当)の測定が、ビタミンDの状態を示す最善の指標であると合意されている。しかしながら、現在のカットオフ値(=しきい値)がビタミンD不足や欠乏症の状態を定義するのに最適であることを確実にする質の高いエビデンスがいまだに必要である(40)。さらに、大部分が標準化されていない研究データを用いての指針が開発できるように、商業的および研究室で開発される25-ヒドロキシビタミンDアッセイ(=測定法)の標準化への努力がやっと最近になってなされている(49)。ビタミンDの充足濃度を示す試験室での基準値はもともと、健康な者のコホートにおける血清中の25-ヒドロキシビタミンD濃度に基づいている。しかし、二次性副甲状腺機能亢進症や骨量減少を防ぐための健康に基づくカットオフ値は、それよりかなり高くなくてはいけないことが追加的な研究で示唆されている。実際、血清の25-ヒドロキシビタミンD濃度が8~10ng/mL(20~25-nmol/L)未満だと、くる病や骨軟化症を伴う重篤な欠乏症を示すと考えられているが、いくつかの研究でPTH濃度(50,51)やカルシウム吸収(52)は、血清の25-ヒドロキシビタミンD濃度が32ng/mL(80nmol/L)未満では最適化されなかったことが観察された。
今のところ、より最近の研究でもPTHの抑制と最適なカルシウム吸収に関する血清の25-ヒドロキシビタミンD濃度のしきい値を見つけることはできなかった。一方で312,962の臨床試料の横断的分析では、血清中のPTHおよび25-ヒドロキシビタミンD濃度の測定値のペアが逆相関を示すよく理論に合うグラフにおいて、25-ヒドロキシビタミンD濃度が70ng/mL(175nmol/L)超でもPTH抑制のしきい値のエビデンスはわからなかった(53)。これは、40ng/mL(100nmol/L)以上の25-ヒドロキシビタミンD濃度に対するPTHの最大抑制値を推測した米国全国健康栄養調査(NHANES2003-2006)の解析と矛盾する(54)。さらに、どちらの研究も血清25-ヒドロキシビタミンD濃度が優に20ng/mL(50nmol/L)を超える者に軽度の副甲状腺機能亢進症(血清PTHが65pg/mL超)のエビデンスを見つけており、血清PTHをビタミンD欠乏症の感度の良い指標として使用することに疑問を呈している(53,54)。一方で、ビタミンD不足(血清中の25-ヒドロキシビタミンD濃度が20ng/mL未満)の閉経後の女性に400~4,800 IUのビタミンD3を毎日補給した無作為化プラセボ対照試験では、20~66ng/mLという正常な25-ヒドロキシビタミンD濃度の範囲にわたって、カルシウムの吸収にわずかな変化(6%)しか見られなかった(55)。
米国医学研究所(IOM)によって提唱されている現在のカットオフ値は以下のようである:血清25-ヒドロキシビタミンD濃度が12ng/mL(30nmol/L)未満で欠乏症、12~19ng/mL(30~49nmol/L)で不足、20~50ng/mL(50~125nmol/L)で充足である(56)。米国医学研究所で設定した食事摂取基準(EAR, RDA)は、骨の健康と最適なカルシウム吸収を維持するのに適切である血液中の25-ヒドロキシビタミンD濃度を達成することを意図している(57)。
しかし、多くの慢性疾患による負荷がかかる状態での30ng/mL未満の血中濃度がもたらす潜在的役割を考慮(6)して、米国内分泌学会はカットオフ値を以下のように定義することを提案している:血清25-ヒドロキシビタミンD濃度が20ng/mL(50nmol/L)以下で欠乏症、21~29ng/mL(51~74nmol/L)で不足、30~100ng/mL(75~250nmol/L)で充足である(40)。この代替範囲はいくつかの観察研究で支持されているが、無作為化対照試験によるデータに基づくものではない(47)(「疾病予防」の項参照)。これらの後者のカットオフ値を使用すると、低ビタミンD症が広く蔓延していて、子供もどの年齢の大人も等しく不足症や欠乏症のリスクがあることが世界中の研究から推定される(58)。補給による研究のデータで、温帯にあたる緯度に住む成人が少なくとも30ng/mL(75nmol/L)の血清25-ヒドロキシビタミンD濃度を達成するには、少なくとも800~1,000 IU/日のビタミンD摂取が必要であることが示された(40)。
なお、血清25-ヒドロキシビタミンDの全体濃度が必ずしもビタミンDの生物学的利用能を適切に反映するものではなく(35)、異なる民族の集団におけるビタミンDの状態をよりよく決定するためにさらなるエビデンスが必要である。
推奨量 (RDA)
米国医学研究所の食品栄養委員会(FNB)は、骨の健康に必要なビタミンDの量に基づく推奨量(RDA)を2010年に設定した。RDAは1997年に設定された目安量(AI)よりも増やされたが、一般の人々の副甲状腺機能亢進症を最小限にして骨の健康を最善にする最適な推奨摂取量や血清25-ヒドロキシビタミンD濃度についてはいまだに議論のあるところである(40)。年齢層別および性別ごとのビタミンDのRDAを表1に示す。
疾病予防
死亡率
15,099人(うち77%が白人)が参加した第三回米国全国健康栄養調査(NHANES III)の9年間に及ぶ追跡分析で、ビタミンD標準化プログラム(VDSP)によって開発された方法論により標準化された血清25-ヒドロキシビタミンD濃度と死亡率との関係が調べられた。その分析からは、血清25-ヒドロキシビタミンD濃度が16ng/mL未満に減少すると総死亡率が上昇することが示唆された(60)。対照的に、ベースライン(=調査開始時)血清25-ヒドロキシビタミンD濃度が16~40ng/mLの範囲だと、総死亡率リスクにはほとんど変化がなかった(60)。標準化された25-ヒドロキシビタミンD濃度と死亡率の関係を考慮した平均で10.5年間の8つの前向きコホート研究のメタ解析でも、似たような結果が得られた。25-ヒドロキシビタミンD濃度が30~39.99ng/mLの場合の死亡リスクに比べて、濃度が12~15.99ng/mLだと死亡リスクが19%高く、12ng/mL未満だと56%高かったことがわかった(61)。800,000人超が参加した73の前向きコホート研究のメタ解析で、血清25-ヒドロキシビタミンD濃度が最低位の三分位群は最高位の三分位群に比べて、総死亡率(+35%)、心血管疾患による死亡率(+35%)、およびがんによる死亡率(+14%)のすべてでリスクが高いことがわかった(62)。しかしデンマークの95,766人の成人による3つの大規模コホートのデータを、交絡因子因果および逆因果によるバイアスを限定するメンデルランダム化解析(63)で分析すると、遺伝的な血漿25-ヒドロキシビタミンD低濃度は総死亡率とがん関連の死亡率には有意な相関があったが、心血管疾患関連の死亡率とは相関がないことがわかった(64)。なお、無作為化対照試験の2つのメタ解析で、ビタミンDとカルシウムを補給した年配者の総死亡率がやや低下したものの、ビタミンD単独ではそうではなかったことが示唆された(62,65)。ビタミンD単独またはカルシウムとの組み合わせでの補給が食事が充分に足りている者の早期死亡を防ぐことに役立つのかどうかを、さらなるプラセボ対照試験で調べる必要がある。
骨粗しょう症
ビタミンDの栄養状態、骨粗鬆症、および骨折リスク
骨粗しょう症の原因には多くの因子があるが、年配の成人にはビタミンDの不足が重要な病因学的要素となりうる。骨粗しょう症は、60~70歳の女性の3分の1に、80歳以上の女性の3分の2に影響している(66)。骨粗しょう症を患う2,600人超の閉経後の女性による多国間(北緯64度から南緯38度までの18ヶ国)調査で、31%の被験者の25-ヒドロキシビタミンD濃度が20ng/mL(50nmol/L)よりも低かったことが明らかになった(67)。さらに、111人の大腿骨頚部骨折患者と73人の対照群(中央値が83歳)を含む症例対照研究で、患者の血清中の25-ヒドロキシビタミンD濃度およびビタミンK1濃度がともに低いと、大腿骨頚部骨折のリスクが対照群よりも高まるという関連があることがわかった(68)。日光にあたったり食事から摂取したりしてビタミンDを充分にしておかないと、腸でのカルシウムの吸収が大きく減りうる。これが副甲状腺によるPTH分泌を増やし、PTHが高いままだと骨からのカルシウムの再吸収を増やすことになり、結果的に骨粗しょう症による骨折のリスクを上昇させることになるかもしれない(69)。
ビタミンD補給と骨密度
骨密度(BMD)が進行的に減って骨減少症(骨粗しょう症の前兆)や骨粗しょう症になるのは、年配者、特に老齢者によく見られる。4,000人超(平均年齢59歳)が参加した23の無作為化対照試験をメタ解析した結果、腰椎、大腿骨頚部、転子、前腕、および全身といった調査対象の5箇所の骨格部位のどこにおいても、ビタミンDの補給がBMDに及ぼす効果のエビデンスはほとんど見られなかった。BMDのかなりの上昇が報告されたのは、大腿骨頚部のみであった(70)。しかしながら、それはこの年齢層の者のカルシウム摂取が適切で、それによって正常な骨の新陳代謝が行われているため、骨量の増加にビタミンD補給の効果がないことを示唆しているのかもしれない(71)。逆に年配の個人では、ビタミンD補給は適切な血清25-ヒドロキシビタミンD濃度を達成したり維持したりして、二次的な副甲状腺機能亢進症や骨密度減少を防ぐのに不可欠である(72)。
ビタミンD補給と骨折リスク
米国で18年にわたって72,000人超の閉経後の女性を追跡した前向きコホート研究で、少なくとも600 IU/日のビタミンDを食事やサプリメントから摂取していた者は、140 IU/日未満のビタミンDしか摂取しなかった女性よりも、骨粗しょう症での大腿骨頚部骨折リスクが37%低かったことがわかった(73)。しかしながら、36,282人の閉経後の女性によるWomen's Health Initiative trial(=女性の健康イニシアティブ研究)では、1,000mgのカルシウムとともに400 IUのビタミンD3を毎日補給しても、大腿骨頚部骨折リスクはプラセボに比べて大きく減ることがなく(74)、骨折リスクの減少が見られるのに必要なビタミンD摂取のしきい値があるかもしれないことが示唆される。この試験データの遺伝子解析結果では、骨折リスクに対するビタミンDとカルシウム補給の有益な効果は、低骨密度になる遺伝子リスクが最も少ない女性に限られているかもしれないことが示唆された(75)。それでも、アドヒアランス(=服薬遵守)が悪いことや結果を交絡させかねない追加のビタミンDやカルシウムのサプリメント摂取が認められていたことなどから、この研究には疑問が呈されてきた。さらに、閉経後の女性の集団における主要な交絡要因であるにもかかわらず、この集団の骨格の健康状態に対するビタミンDやカルシウムの効果の研究において、ホルモン補充療法の適用が考慮されていなかった(57,76)。
カルシウムまたはビタミンDの無作為化評価研究(RECORD)という別の研究では、ビタミンD3単独(800 IU/日)またはカルシウム(1,000mg/日)との組み合わせでの経口補給は、軽度の骨粗しょう症性骨折の外傷をすでにしたことのある年配の成人の骨粗しょう症性骨折の発生を予防することはできなかったことが報告された(77)。後者の研究でも、アドヒアランスが悪いことおよび/またはビタミンD補給によって血清25-ヒドロキシビタミンD濃度が骨折を防ぐであろうほどには上昇しなかったことなどを含むいくつかの制限が、効果がなかったことの原因であるかもしれない(78)。治療へのアドヒアランスが高かったにも関わらず、3年間のビタミンD評価試験(ViDA)では、ビタミンD3補給(初期に200,000 IU/月で、その後100,000 IU/月)をしてもプラセボ補給をしても、閉経後の女性の非椎体骨折の発生率は同じようなものだった(79)。
それでも、米国予防医学専門委員会が52,915人の年配者(そのうち69%は閉経後の女性)を含む11の無作為化プラセボ対照試験をメタ解析し、最大7年間ビタミンD(300~1,000 IU/日)およびカルシウム(500~1,200mg/日)を補給したら、新しく骨折するリスクが12%減ったことを発見した(80)。65歳以上の31,022人(91%が女性)に対するビタミンD補給の効果に関する11の無作為化二重盲検プラセボ対照試験の別のメタ解析では、ビタミンD摂取が最大(792~2,000 IU/日)の者は大腿骨頚部骨折のリスクが30%、その他の脊髄以外の骨折のリスクが14%低かったことが示された(81)。なお、ビタミンDとカルシウムの組み合わせが年配の男性や閉経後の女性の骨折を予防する効果を調べた試験の第三のメタ解析でも、大腿骨頚部骨折を含む新たな骨折のリスクは、補給した者のほうが対照群に比べてかなり下がったとの結論になった(82)。興味深いことにこれらの3つのメタ解析では、ビタミンDとカルシウムの補給によって骨折が予防されるのは、施設に入っている年配者に限られた。実際、地域社会で生活をしている年配者の骨折リスクは大きく下がることはなかった(80~82)。
ビタミンD補給と姿勢バランス、筋力、および転倒リスク
840人の転倒経験者と1,330人の非転倒経験者を調べた7つの観察研究のメタ解析で、転倒経験者は非経験者に比べて血清25-ヒドロキシビタミンD濃度がかなり低いことがわかった(83)。さらに、3つの観察研究からの4つのコホートのメタ解析で、ビタミンDの栄養状態と転倒リスクの間に控えめながらも有意な逆相関があることが報告された(83)。いくつかの無作為化対照試験で年配の被験者の筋力、姿勢バランス、または転倒リスクに対するビタミンD補給の影響が調べられた。これらの試験のメタ解析で、筋力および運動性についてそれぞれ1種類の検査を基にしたビタミンD補給効果の限定的なエビデンスが見られた。しかしながら、ビタミンDの栄養状態が最適ではない(平均血清25-ヒドロキシビタミンD濃度が20ng/mL未満)160人の閉経後の女性(50~65歳)による最近の無作為化二重盲検プラセボ対照試験で、1,000 IU/日のビタミンD3補給により、ビタミンDの栄養状態だけでなく上肢および下肢の筋力および姿勢バランスのパラメータが大きく改善した(84,85)。転倒および転倒の繰り返しのリスクは、ビタミンD3補給をした群よりも対照群の方が2~3倍高いことがわかった(85)。対照的に、200人の年配者(そのうち58%はベースライン血清25-ヒドロキシビタミンD濃度が20ng/mL未満)による12ヶ月の別の無作為化対照研究では、2,000 IU/日(10μgのカルシジオール補給も有りもしくは無し)の補給をした者には、800 IU/日の補給をした者と比べて下肢の機能または転倒の可能性に関して何の利点も示されなかった(86)。最近発表されたViDA試験の事後解析で、平均で3.4年間ビタミンD補給(100,000 IU/月、すなわち約3,350 IU/日)またはプラセボを摂取するように無作為化されても、5,108人の地域在住参加者(50~84歳)の転倒の可能性や報告数に何の違いもなかったことがわかった(79)。ViDAの参加者のほとんどは血清25-ヒドロキシビタミンD濃度が20ng/mL以上で、少なくともこれがビタミンDが転倒におよぼす影響がなかったことの説明になっているかもしれない(87)。
全体的に、800~1,000 IU/日のビタミンD3補給が年配者の転倒や骨折率を減らすのに役立つのではないかということが、現在のエビデンスから示唆される。ビタミンD補給が骨の健康を維持するのに有効であるためには、食事からの適切なカルシウム摂取(1,000~1,200mg/日)をすべきである(「カルシウム」の項目の別記事を参照)(88)。
がん
生態学的研究で、北緯とビタミンD欠乏症とがんの発生率との関連が最初に示唆された(89)。1980年代からのいくつかの前向きコホート研究で、ビタミンD摂取またはビタミンDの栄養状態と様々な種類のがんとの関連が調べられてきた。137,567人を対象とした16の前向き研究の2013年のシステマティックレビュー(=系統的総括)とメタ解析で、血液中の25-ヒドロキシビタミンD濃度が20ng/mL(50nmol/L)増加するごとにがん全体の発生率が11%減少し、がんの死亡率も17%低下することが報告された。しかし、8つの研究の性別によるサブグループ(=下位群)の解析で、女性では血液中のビタミンD濃度とがんの死亡率には逆相関があったものの、男性ではそれがなかった(90)。さらに、ビタミンD受容体(VDR)をコード化する遺伝子のいくつかの変異が個人のビタミンDの状態に影響し、それによって部位ごとのがんのなりやすさに変化があったり(91)、がんからの回復に影響したりしている(92)かもしれないことが、増大するエビデンスによって示唆されている。なお、乳がん、肺がん、皮膚がん(メラノーマ)、結腸がん、および骨がんを含む多くの悪性腫瘍がVDRを発現させることがわかっており(93)、これらがビタミンDの作用によって影響されやすいかもしれないことが示唆される。多数の実験的研究で、1α,25-ジヒドロキシビタミンDやその類似体などの生物学的に活性のある形態のビタミンDは、多種のがん状態の細胞の分裂抑制および/または細胞分化や細胞死(アポトーシス)の誘発によって、VDRと結合する際に細胞の運命を制御しうることが実証された(94)。
結腸直腸がん
結腸がんの死亡率の地理的分布は、かつてのくる病の地理的分布と似ている(95)。このことは、日光にあたることが減りビタミンDの栄養状態が悪化することが結腸がんのリスク上昇に関係するのではないかという状況的な証拠を提示している。観察研究からのエビデンスは概ねこの仮設を支持している。4つの前向きコホート研究、4つの横断研究、および7つの症例対照研究の最近のメタ解析で、血液中のビタミンD濃度と悪性に変わる可能性のある良性腫瘍である結腸直腸腺腫の発生率に逆相関があることがわかった(96)。この解析で、血清25-ヒドロキシビタミンD濃度が最高位の四分位群は最低位の四分位群に比べて32%のリスク減少があることがわかった(96)。さらに、ビタミンD摂取が多いことと血清中の25-ヒドロキシビタミンD濃度が高いことが結腸直腸がんのリスク減少に関連があることを示唆する前向きコホート研究のメタ解析からの強力なエビデンスがある(97~99)。4つの前向きコホート研究、17のコホート内症例対照研究、および3つの症例対照研究の最新のメタ解析で、血清25-ヒドロキシビタミンD濃度が最高位の四分位群は、最低位の四分位群に比べて結腸直腸がんのリスクが38%低いことがわかった(100)。 5つのコホート内症例内対照研究に基づく初期の用量反応解析では、33ng/mL以上の血清25-ヒドロキシビタミンD濃度だと、(12ng/mL以下と比較して)結腸直腸がんリスクが50%低下するという関連があると推測された(101)。
しかしながら、女性の健康イニシアティブ研究に参加した36,282人の閉経後の女性による7年間の無作為化二重盲検プラセボ対照試験では、ビタミンD3(400 IU/日)にカルシウム(1,000mg/日)を組み合わせて補給しても、結腸直腸がんの発生率は低下しなかった(102)。カルシウム補給(1,200mg/日)が有りまたは無しでビタミンD3補給(1,000 IU/日)をした別の無作為化対照試験では、参加者の結腸直腸腺腫をまず除去した後の3~5年間に腺腫が再発するリスクに、プラセボと比べて何の低下も見られなかった(103)。これらのビタミンDの一日用量では、がんの発生に対する効果を検出するには低すぎるのかどうかはよくわかっていない(101,104)。結腸直腸がんの予防にビタミンD補給が役立つのかどうかを評価するさらなる無作為化臨床試験が必要である。また、ビタミンDの代謝や機能に関わる遺伝子配列の遺伝的変異(多型)が、ビタミンDの状態と結腸直腸腺腫またはがんのリスクの関係に影響する可能性があるのかはっきりしな(105~107)。
積み上がっていくエビデンスからは、適切なビタミンDの状態が結腸直腸がんの患者の生存によいという関連があるのではないかと示唆される。5つの前向き研究のメタ解析で、血清25-ヒドロキシビタミンD濃度が高いがん患者の結腸直腸部位のがん死亡リスクが35%低いことがわかった。用量反応解析では、25-ヒドロキシビタミンD濃度が8ng/mL増えるごとに、結腸直腸がんの死亡率が10%下がるという関連が推定された(108)。
乳がん
緯度が高くなって日光にあたることが減ると乳がんの死亡率が増えることが生態学的エビデンスから示唆されるが、ビタミンDの栄養状態と乳がんリスクの関連を裏付ける最新の観察研究データはほとんどない(86)。第一回米国国民健康栄養調査(NHANES I)に参加した女性による初期の前向き研究では、適切な日光浴と食事からのビタミンD摂取をした白人女性は、20年後に乳がんのリスクがかなり減ったことがわかった(110)。しかしながら、この研究と9つのより直近の前向き研究をともにメタ解析したところ、ビタミンD摂取の程度の高低による乳がんの発生リスクには何の有意な違いもなかった(111)。さらに、血液中のビタミンD濃度と乳がんリスクの間に関連があるのかもはっきりしない。14の観察研究(9,110人の症例群と16,244人の対照群)のメタ解析で、血清25-ヒドロキシビタミンD濃度が最高位の四分位群を最低位の四分位群と比べると、全体で16%のリスク低下があったと報告された。この逆相関は閉経後の女性で統計的に有意であったが、閉経前の女性ではそうではなかった(112)。しかし、同じような群を含む14の前向き研究(そのうち2つの研究では異なる)の別のメタ解析では、全体的に何の関連も見られなかった(111)。初期の乳がん患者に対する研究の1つのメタ解析では、ビタミンDの状態が不適切であることと、再発および死亡のリスク上昇に関連があることがわかった(113)。無作為化対照試験からのエビデンスは現在、ビタミンD補給が乳がん発生を減らす可能性について結論付けるにはあまりに限定的すぎる((114)の文献でレビュー)。
しかしながら、3つのメタ解析で血液中のビタミンD濃度と乳がん関連死の間の逆相関がわかった(111,115,116)。1つの後ろ向きコホート研究と5つの前向きコホート研究のメタ解析で、血清ビタミンD濃度が高い者は低い者よりも死亡率が33%低いという関連があり、用量反応解析では血清ビタミンD濃度が8ng/mL上昇するごとに12%低下していたことがわかった(115)。
なお、現在のエビデンスではVDRのコード化における特定の遺伝子変異が乳がんリスクに影響しているかもしれないとは示されていない(117,118)。
その他のがん
ビタミンDの状態とその他のがんとを関連づけるエビデンスは、現在のところ限られている。前立腺がんの発生が日照と逆相関があるように思われるが、前向きコホート研究では血清25-ヒドロキシビタミンD濃度とそれによる前立腺がんの発症リスクとの有意な関係は一般的に示されていない(119,120)。実際、血液中のビタミンD濃度が高いと前立腺がんのリスクが高いと示唆する研究もある。たとえばスカンジナビアの男性(622人の症例と1,451人の対照群)によるコホート内症例対照研究では、血清25-ヒドロキシビタミンD濃度と前立腺がんリスクとの間にU字形の関係があったことがわかった。その研究では、血清25-ヒドロキシビタミンD濃度が7.6ng/mL以下か32ng/mL以上だと、前立腺がんリスクが高いという関連があった(121)。17のコホート内症例対照研究、3つの前向きコホート研究、および1つの後ろ向きコホート研究のメタ解析では、血液中の25-ヒドロキシビタミンD濃度が高い者は、低い者に比べて前立腺がんのリスクが17%高かったことがわかった(122)。血中ビタミンD濃度が高い男性の前立腺がんの症例が少し多く発見されることは、交絡因子の可能性によって説明できるかもしれないことが、最近の発表で強調されている(123)。
なお、観察研究の最近のメタ解析で、ビタミンDの状態と肺がんリスク(124,125)および膀胱がんリスク(126,127)の逆相関がわかった。しかし、現在までに発表されたしばしば異種な内容の研究では、血清25-ヒドロキシビタミンD濃度は、非ホジキンリンパ腫(128)、卵巣がん(129)、胃がん(130)、または皮膚がん(131)などの他のがんと関連づけられなかった。
自己免疫疾患
インスリン依存性糖尿病(1型糖尿病)、多発性硬化症(MS)、関節リウマチ(RA)、および全身性エリテマトーデス(SLE)は自己免疫疾患の例である。自己免疫疾患は、体が外来の病原体ではなく自分自身の組織に対して免疫反応を起こして発生する。1型糖尿病では、インスリン産生をする膵臓のβ細胞が不適切な免疫反応の標的になる。MSでは、中枢神経系のミエリン産生細胞が標的であり、RAでは関節のコラーゲン産生細胞が標的である(132)。SLEは複数の組織を損傷する可能性のある広範な自己抗体があることが特徴である(133)。自己免疫反応は、T細胞と呼ばれる免疫細胞によって媒介されている。生物学的に活性のあるビタミンDの形態である1α,25-ジヒドロキシビタミンDは、自己免疫反応が消えるようにT細胞の反応を調整することがわかっている。自己免疫疾患(特にMS(134))の罹患率は緯度が高くなるに連れて増えることが生態学的研究からわかっており、UVBに当たらないで皮膚でのビタミンD合成が減ると、これらの疾病の病理に影響があるかもしれないことを示唆している。いくつかの前向きコホート研究の結果も、異なる年齢層(胎児、幼児、および青少年期を含む)における適切なビタミンDの状態が、自己免疫疾患リスクを減少させるかもしれないことを示唆している。
1型糖尿病
新たに1型糖尿病と診断される患者は、同じ年齢層や性別の糖尿病でない被験者に比べて、血液中のビタミンD濃度が低いことが報告されている(135,136)。複数の膵島関連自己抗体(インスリンを分泌する膵臓の細胞に対する抗体)を持つ前糖尿病性の子供は、自己抗体を持たない子供に比べてビタミンDの不足や欠乏症が蔓延していることも観察されている。しかし前糖尿病性の子供のコホートを追跡した前向き研究では、不足、欠乏、または充足で定義されるビタミンDの状態は、5または10年間の追跡後に1型糖尿病に進行する率とは関連がなかったことがわかった(137)。1966年にフィンランドに生まれた子供を30年間追跡した初期の前向きコホート研究では、生後1年間ビタミンD補給をされた子供は、補給を受けなかった子供に比べて1型糖尿病を発症するリスクが88%低かったことがわかった。しかも、生後1年間にくる病(重篤なビタミンD欠乏症)の疑いのあった子供は、1型糖尿病の発症率が有意に高かった(138)。したがって、ビタミンD補給は1型糖尿病の発症から体を保護するようであり、乳幼児期に最適以下のビタミンDの状態だと、その後の人生で免疫反応に長期的影響があるかもしれない。
妊娠中の母親のビタミンD不足が子供の1型糖尿病リスクに影響するかもしれないと示唆する限定的なデータもある。最近の症例対照研究で、母親の妊娠後期での血清25-ヒドロキシビタミンD濃度が21.6ng/mL(54nmol/L)未満だと、濃度が35.6ng/mL(89nmol/L)超の母親から生まれた子供に比べて、子供の1型糖尿病の発症リスクが2倍よりも高かった(139)。その他の症例対照研究でも、妊娠中のビタミンD補給で子供の糖尿病関連の自己抗体の発生リスクが低いという関連がわかった(140,141)。しかしながら、糖尿病のリスクが遺伝的に高い子供の母親に対する大規模な研究では、子供の生後1年間の膵島関連自己抗体および/または糖尿病の発生と母親の妊娠中のビタミンD摂取との間に関連はなかったと報告された(142)。別の症例対照研究では、妊娠初期の血清25-ヒドロキシビタミンDと子供の1型糖尿病の発症との間に関係が見られなかった(143)。妊娠中の母親のビタミンDの状態が子供の1型糖尿病リスクに影響するのかどうかを確定する大規模前向き研究が必要である。
また、ビタミンD代謝に関係する遺伝子の多型と1型糖尿病との関係が現在研究されている。たとえば、CYP27B1(25-ヒドロキシビタミンD3-1α-ヒドロキシラーゼをコード化する)やVDRの遺伝子における特定の多型がビタミンDの作用に機能的に関係があり、それにより1型糖尿病のなりやすさに影響しているのかもしれないということが提唱されている。1型糖尿病の8,517人の子供および青少年と7,320人の対照群に対する研究では、コレステロールの合成とビタミンDのヒドロキシル化に関わる遺伝子の多型が、血液中のビタミンD濃度と糖尿病の状態に関連していた(26)。
多発性硬化症
日光にあたることが少ないことやビタミンDの欠乏症は、多発性硬化症(MS)の発症に関連しているようである。ビタミンDの状態が悪いと、様々な免疫反応の調整に重要な特定の免疫細胞の働きを損ない、MSの自己免疫を引き起こすことに寄与してしまうかもしれない(144)。Multiple Sclerosis Genetics Consortium(=多発性硬化症遺伝学コンソーシアム)のデータのメンデルランダム化解析において、ビタミンDの低栄養状態の遺伝的決定因子は最近、成人発症性のMSになりやすくなることと関連付けられた(145)。これはビタミンDが充分であることがMSのリスク低下に関連していることを示唆しているいくつかの観察研究の結果と呼応していた。オーストラリアで行われた紫外線の量とMSの症例の後ろ向き研究で、子供のMSの発生は、妊娠初期の母親が紫外線に当たることと逆相関があったことがわかった(146)。1,660人のMS患者と3,050人の対照群を含む最近の症例対照研究でも、日光にあたることはビタミンD摂取の代替マーカーとして使用された。屋外での活動がたまにしかなく幼児期や青少年期に日焼け止めを使用していると、後にMSを発症するリスクが高くなるという関連があることを著者らは発見した(147)。横断研究では、子供の時に日光に当たってタラの肝油(ビタミンDが豊富)を摂取することが、再発性MSを患う退役軍人の後の症状の発現に関連していた(148)。さらに、MSと診断された257人の症例を含む米国軍人の症例対照研究では、血清25-ヒドロキシビタミンD濃度が最高五分位(39.6ng/mL超)の白人被験者は、最低五分位(25.3ng/mL未満)の者に比べてMSの発症リスクが62%低かったことがわかった(149)。また、187,000人超の米国人女性の2つの大規模コホートを少なくとも10年間追跡したところ、ビタミンDのサプリメント(400 IU/日以上)を使用していると、MSの発症リスクが41%低いという関連があった(150)。別の前向き非対照研究では、156人の再発寛解型MS患者に第一線の免疫調節療法に加えてビタミンD補給(100,000 IU/月を6~42ヶ月、平均で31ヶ月)をする前と後で、症状の再発生をビタミンDの状態との関係でモニターしたら(151)、血清25-ヒドロキシビタミンD濃度が4ng/mL上がるごとに再発生が14.9%減るという関連があった(151)。新たに臨床分離症候群(CIS)と診断されインターフェロン(IFN)-βで治療を受けている患者に対して行われた多機関の研究で、ビタミンDの状態がMSの活動性や進行の予兆となっていた。CISの診断から最初の1年間の血清25-ヒドロキシビタミンD濃度が高い(20ng/mLすなわち50nmol/L以上)と、その後4年間の追跡でMSと診断されるまでの時間が長くなり、新規の病変の数が減り、病変の変化も脳の体積の変化も少ないことが予見された(152)。しかしながらある後ろ向き研究では、再発寛解型MS患者のビタミンDの状態は、身体障害の悪化が特徴的である二次性進行型MSへの転換までの時間に関しての予測値にはならないと示唆された(153)。
MS患者の再発率や身体障害に関連した症状について、単独またはIFN-βによる治療と組み合わせてビタミンD補給をしても、臨床試験では何の利点も実証されなかった(154,155)。別の臨床試験でも、ビタミンD3補給は免疫調節作用を示さなかった(156~159)。53人のIFN-β治療を受けている再発寛解型MS患者に対する最近の無作為化プラセボ対照試験で、ビタミンD3補給(7,000 IU/日を4週間、その後14,000 IU/日を第48週まで)は48週間の研究期間にわたって、ある種の制御性T細胞とB細胞の比率にほとんど影響しなかった。ビタミンD3は抗炎症のCD4+T細胞の割合の維持にのみ役立つようであったが、これはプラセボを与えられた患者では減少していたものの、ガラス容器内で1,25-ジヒドロキシビタミンDで刺激してもこの細胞の反応性が良くなることはなかった(157)。別の試験では、再発寛解型MS患者にビタミンD3(10,400 IU/日を3ヶ月間)補給をすると、炎症促進性のIL-17産生CD4+T細胞の割合が減ったことがわかり、これはMSの発症に中心的な役割を果たしていると考えられている(160)。
関節リウマチ
エビデンスが主に動物研究によるものであるとはいえ、ビタミンDの欠乏は関節リウマチ(RA)の病因および/または進行にも関係があるかもしれない。ビタミンD受容体(VDR)がない遺伝子組み換えのマウスは、炎症の程度がひどく自己免疫になりやすくなるという関連がある(161)。自然に炎症性の関節炎を起こす遺伝子導入マウスにVDRが欠乏していると、より侵襲性の慢性関節炎を起こす(162)。また、VDR遺伝子が特定の多型だと、ある集団でRAになりやくなるという関連があるが、これらの遺伝子的変異がどのようにビタミンDの機能に作用するのかは充分にわかっていない(163~165)。しかしながら、RAを含む多くの慢性疾患の根本的な炎症プロセスの調整におけるビタミンDの役割が、現在のデータで示されている。中度から重度の炎症のある個人を対象にしたいくつかの横断研究では、血液中の25-ヒドロキシビタミンD濃度と炎症マーカーとの間には、何の関係もないか逆相関があることが報告された。それでもなお、重度炎症のある被験者の炎症を制限し疾病(RAを含む)のリスクを減らすことがビタミンD補給によってできるかどうかを示す介入試験が不足してい(166)。
今のところ、RAの発症にビタミンD欠乏症の有病率が関連しているかどうかは不明のままである。30,000人近い米国の閉経後の女性を対象にした大規模コホート研究では、ビタミンD摂取が最多レベル(467.7 IU/日以上)の被験者は最少レベル(221.4 IU/日未満)の者に比べて、11年間の追跡調査後にRAの発症リスクが33%低かった(167)。しかし、200,000人近くの米国人女性の2つの大規模コホートを数十年間にわたって追跡したより最近の解析では、青少年期や成人期におけるビタミンDの食事からの摂取の報告(食品摂取頻度調査票を使用した)とその後のRAの発症との関連は見られなかった(168,169)。さらに、RA患者の血液中のビタミンDと疾患活動性との関係を探ったいくつかの研究で、関連の有無どちらの結果も報告されている((170)の文献でレビュー)。しかし、観察研究の最近の2つのメタ解析で、疾患活動性指標28(DAS28)を使用して評価されたRA患者の疾患活動性とビタミンDの栄養状態の間に逆相関があることがわかった(171,172)。なお、関節炎の患者の疾患活動性に対するビタミンD補給の効果を探る研究は不足している。22人のRA患者による小規模な無作為化二重盲検プラセボ対照試験では、カルシウム(1,500mg/日)と高用量ビタミンD2(エルゴカルシフェロール;平均4,500 IU/日超)を1年間補給された被験者は、プラセボと比べても疾患活動性や炎症の程度に改善が見られなかった(173)。初期のRAである41人の女性を対象にした3ヶ月間の別の無作為化対照試験では、T-ヘルパーリンパ球の数え上げ、サイトカイン産生、または疾患活動性を含む臨床的パラメータに関して、ビタミンD3補給(300,000 IUの急速投与を1回)は標準的療法(メソトレキサートおよびグルココルチコイド)に対して何の追加的利点もなかったことがわかった(174)。また、ビタミンD補給は2つの小規模な無作為化対照試験に登録したRA患者の再発率を減らすことができなかった(175,176)。サンプル数が少ないことも含めてこれらの研究にはいくつかの限界があり、追加的な研究がなされるべきである。
全身性エリテマトーデス
非白人(ヒスパニック、アフリカ系、およびアジア系)により多く見られより重症である(177)全身性エリテマトーデス(SLE)は、臨床的に様々な症状を示す自己免疫疾患である。この病気は、皮膚(皮膚発疹や光過敏性)、腎臓(腎炎)および関節(関節炎)を含むたいていの組織や臓器に影響する可能性がある。動物モデルでは、SLEの予防にビタミンDが役立つというエビデンスがある(178)。興味深いことに、11の症例対照研究の最近のメタ解析で、特定のVDRの多型がアジア人のSLEに特に関連しているとわかった(179)。しかし、そのような遺伝子変異の機能的関連性はわかっていない(180)。200,000人近い米国人女性に対する2つの大規模前向きコホート研究の解析では、青少年期や成人期におけるビタミンDの食事からの摂取(食品摂取頻度調査票を使用した)と、その後のSLEの発症との関連は見られなかった(168,169)。
今のところ、ビタミンDの状態がSLEの被験者では最適以下なことが一般的で、これは日光に当たることが少ないことによって一部説明可能で、それが疾病の症状を悪化させる傾向がある(181,182)。血清中の25-ヒドロキシビタミンD濃度は、378人のSLE患者のコホートで疾患活動性の測定値と逆相関があった(183)。20人のSLEの被験者に高用量ビタミンD3補給(100,000 IU/週を1ヶ月間、その後100,000 IU/月を6ヶ月間)でビタミンD不足を治してもらったら、免疫の不均衡の徴候やSLEで典型的に検出される自己抗体の濃度が下がったという関連があり、これは疾病の治療におけるビタミンDの効果を示唆している(184)。皮膚エリテマトーデス(皮膚病だけのループス(=狼瘡)の一種)でビタミンD欠乏症でもある52人の患者に対する別の前向き研究で、ビタミンD3(初めは1,400 IU/日で、後に800 IU/日)とカルシウムを1年間補給した群は、何もしなかった群に比べて疾病の重症度が下がったことが報告された(185)。267人のSLE患者に対する無作為化プラセボ対照試験でも、ビタミンD3補給(200 IU/日を1年間)をしたら、炎症サイトカインの濃度を下げることができた(186)。別の無作為化プラセボ対照試験では、ビタミンD3補給(50,000 IU/週を6ヶ月間)によってSLE疾患活動性指標(SLEDAI)、欧州コンセンサスループス活動性測定(ECLAM)のスコア、および若年発症型SLEの若者のいくつかの疲労測定値が改善した(187)。しかしながら最近の2つの別な研究では、ビタミンD3補給(約800~7,000 IU/日に相当する1週または1月あたりの急速投与量で6~24ヶ月補給)でSLE患者のビタミンDの状態が改善したものの、疾患活動性に関して何の利点も示されなかった(188,189)。SLE患者へのビタミンDの経口投与は耐容性がよいものの、その効能には疑問が残るままであり、さらなる臨床試験での調査がなされるべきである。
要旨
したがって、自己免疫疾患の予防や治療にビタミンD補給が有効であると結論づけられないものの、ビタミンD不足を解消し充分な濃度を維持することが疾患のリスクを下げることに役立つ可能性があることを、ヒトでの疫学的研究のエビデンスは示している(190)。
心血管疾患
高血圧
高血圧は心血管疾患(CVD)のリスク要因としてよく知られている(191)。観察研究および臨床研究の結果は、血圧を下げるのにビタミンDが役立つことを示唆しており、これは一部には1α,25-ジヒドロキシビタミンDがレニンの合成を抑制するということで説明できるかもしれない(「機能」の項参照)。したがって、ビタミンD欠乏症とそれによるレニン・アンジオテンシン系の上方制御が高血圧やCVDリスクに寄与するのかもしれない。PTH濃度が高いと、高血圧やCVDのリスクを高めるのではないかとも示唆されてきた(6)。3,002人(ベースライン時に平均59歳)に対する最近の前向きコホート研究で、9年間の追跡期間に41%の参加者が高血圧を患ったが、この発症は血清25-ヒドロキシビタミンD濃度が20ng/mL未満の者には多くなく、PTH濃度が高いことにわずかに関連があった(192)。それにもかかわらず、全部で48,633人が参加し5,000人近くが高血圧を発症した7つの前向き研究のメタ解析で、血清25-ヒドロキシビタミンD濃度が上部三分位の者は、下部三分位の者より30%高血圧リスクが低かったことがわかった。用量反応解析では、血清25-ヒドロキシビタミンD濃度が10ng/mL上がるごとに、高血圧リスクが12%下がるという関連が推定された(193)。4つの前向き研究と14の横断研究のメタ解析でも、血液中の25-ヒドロキシビタミンD濃度と高血圧の逆相関が報告された(194)。
血管内皮障害
血管内皮障害は心血管疾患(CDV)のリスク上昇に寄与し、慢性腎疾患(CKD)の患者に一般的に見られる(195)。CKDの患者では、上腕動脈の血流依存性血管拡張反応(FMD)という血管の健康状態を示す代理マーカーの値が低いことが、異常な血管内皮機能と関連している。軽度から中度のCKDの被験者に対する最近の研究で、血清25-ヒドロキシビタミンD濃度はFMDの値と正の相関があり、これはビタミンDの状態が最適より悪いことが血管内皮障害と関連があることを示唆している(196)。ある予備的な介入研究では、ビタミンDが不足(平均で17.2ng/mL)している26人の中度のCKD患者に300,000 IUのビタミンD3を2回補給(1週目と8週目)し、全体で16週間追跡した。ビタミンD補給によって血清25-ヒドロキシビタミンD濃度がほぼ倍になり、PTH濃度は68.5%減った。ビタミンDの状態の改善は、FMDの数値の上昇と血管内皮障害のマーカーの低下とともに起こった(197)。CVDリスクが高い患者に対する12の小規模無作為化対照試験の最近のメタ解析で、ビタミンD補給(1日用量で2,500~5,000 IU、1週用量で50,000 IU、1月用量で60,000 IU、1回の急速投与量で100,000~200,000 IU)を8週間から6ヶ月したところ、FMDが有意に上昇したことがわかった(198)。
観察研究と臨床試験での心血管イベント(=事象)
今日までビタミンDとCVDの転帰(=結果)との関係を調べた多くの疫学的研究は、まちまちの結果を生んできた((199)の文献でレビュー)。最近のメンデルランダム化研究では、冠動脈性心疾患、虚血性心疾患、または心筋梗塞のリスクと遺伝的低血清25-ヒドロキシビタミンD濃度との間には何の関連も見られなかった(200,201)。このことは、観察研究で報告された関連が交絡因子や因果関係の逆転によるものである可能性を示唆している。5,292人の年配者によるRECORD試験(「骨粗しょう症」の項参照)では、800 IU/日のビタミンD3補給(カルシウム有りまたは無し)によって、カルシウム単独またはプラセボを摂取した場合に比べて最初の心不全リスクが減ったものの、心筋梗塞および脳卒中のリスクには何の効果もなかった(202)。心血管イベントに対するビタミンD補給の効果に関するデータは、13,033人の参加者(60歳以上)による21の無作為化対照研究(RECORD試験も含む)から集められ、メタ解析に組み込まれた(202)。1~6.2年間の追跡期間にわたって、心不全、心筋梗塞、および脳卒中といった主要な心血管イベントに関してビタミンD補給(ビタミンD類似体を含む)の効果は見られなかった(202)。しかしながら、これらの結果を解釈する際には注意をした方がよい。それというのもこれらの試験はもともと骨の健康に対するビタミンDの効果を評価するように考えられたものであって、心血管に関する結果は主要エンドポイント(=評価項目)ではないからである。CVDリスクに対するビタミンD補給の効果を探るいくつかの無作為化対照試験が現在進行中であり(203)、それらには米国のビタミンDとオメガ3試験(VITAL)(204)やオーストラリアのD健康試験(D-Health trial)(205)という2つの大規模試験も含まれる。ニュージーランドの無作為化対照試験であるビタミンD評価試験(ViDA)の結果が最近発表された。追跡期間中の全CVDイベント数や最初のCVDイベントまでの時間は、中央値で3.3年にわたってビタミンD3補給(最初の月の用量が200,000 IUでその後100,000 IUの1月用量)をした者とプラセボを摂取した者とでは違いはなかった(206)。
2型糖尿病
メタボリック症候群の人々は、2型糖尿病(非インスリン依存性糖尿病)や心血管疾患(CVD)のリスクが高い。メタボリック症候群とは、脂質異常症、高血圧、インスリン抵抗性、および肥満を含むいくつかの代謝障害をいう。最近の研究で、1,801人のメタボリック症候群の患者における2型糖尿病の罹患率は、血清25-ヒドロキシビタミンD濃度が低い(30ng/mL未満)ことと関連していることがわかった。8年間の追跡期間で、血清25-ヒドロキシビタミンD濃度が30ng/mL(75nmol/L)超の者は、10ng/mL(25nmol/L)未満の者に比べて全死因による死亡リスクが72%低く、CVDによる死亡のリスクも64%低いことが報告された(207)。
健康な者には、ビタミンDが充分であることはインスリン感受性や膵臓β細胞の適切な機能と正の相関がある。逆に、ビタミンD欠乏症はグルコース恒常性に影響し、耐糖能異常やインスリン抵抗性を引き起こすかもしれない(208)。前糖尿病状態(2型糖尿病の発症リスクが高い状態)にある4,057人を含む12,719人の成人に対する横断研究で、前糖尿病の罹患率は血清25-ヒドロキシビタミンD濃度が低いこと(32.4ng/mL以下)と関連があった。血清25-ヒドロキシビタミンD濃度が最低レベル(17.7ng/mL以下)の被験者は、現在喫煙中で肥満で高血圧であることが多かった(209)。リスクの高い個人のビタミンD不足は、はっきりとした糖尿病への進行を加速させるかもしれない。2,378人の中年男性および女性を8~10年間追跡した前向き研究で、前糖尿病から2型糖尿病への進行リスクは、血液中のビタミンD濃度が最も高い(28.4ng/mL超)四分位群では、最も低い(18.5ng/mL未満)四分位群より女性で62%、男性で60%低かった。用量反応解析では、2型糖尿病への進行リスクは、血清25-ヒドロキシビタミンD濃度が4ng/mL(10nmol/L)上がるごとに、平均で23%低くなった(210)。210,000人超の参加者を中央値で10年間追跡した18の前向きコホート研究の最近のレビューとメタ解析で、ビタミンD濃度(血液中の濃度または食事からの摂取による)が上位3分の1の者は、2型糖尿病リスクやメタボリック症候群リスクが下位の3分の1に比べてそれぞれ19%と14%低かった(211)。28,258人の年配者(平均年齢67.7歳)に対する9つの前向き研究の別のメタ解析で、中央値で7.3年間の追跡期間にわたって、ベースライン血中ビタミンD濃度が低い者は高い者より2型糖尿病になるリスクが17%高いという関連があったことがわかった(212)。現在、ビタミンD補給は耐糖能障害や顕性2型糖尿病の者のインスリン感受性を向上させるかもしれないということが、限定的なエビデンスで示唆されている(213~216)。適切なビタミンD濃度を維持することが健康またはリスクの高い個人の代謝に関する結果の悪化を防ぐのかどうかを調べるように良く計画された臨床試験が必要である。
神経変性疾患
認知障害およびアルツハイマー病
アルツハイマー病(AD)は最も一般的な認知症の形態で、脳内に神経外のβアミロイド斑や神経内のTタンパク質凝集物(神経原線維変化として知られる)が存在することが特徴である。動物研究で現在調べられているメカニズムのモデルは、大脳皮質や海馬の領域でのビタミンD欠乏またはビタミンD代謝の異常および/またはビタミンDとVDRの経路の分断が、神経細胞の変性や認知機能の喪失に関わっているかもしれないことを示唆している(217)。中枢神経系のカルシウムチャネルの調整、神経細胞保護、および免疫調整におけるビタミンDの役割を裏付ける実験的エビデンスでも、低ビタミンD状態が加齢に伴う認知機能障害の前兆となったり寄与をしたりすることが暗示されている(218)。
食事性のビタミンD摂取と血清25-ヒドロキシビタミンD濃度との関連で、年配者の認知機能低下と脳の変性疾患が多くの観察研究で調べられてきた。閉経後の女性の骨粗しょう症と大腿骨頚部骨折に関するフランスでの大規模コホート研究では、ファイファーの簡易携帯型知的状態質問票(SPMSQ)というテストで評価された全体的な認知能力の損傷は、5,596人の年配の女性(平均年齢80.5歳)で食事からのビタミンD摂取が少ない(1,400 IU/週未満)ことと関連があった(219)。498人のサブグループの女性を7年間追跡した研究では、ベースライン時に食事性ビタミンD摂取が最高五分位の者は、最低五分位の者に比べて(その他の認知症ではなく)アルツハイマー病のリスクが77%低かったことが示された(220)。全部ではないがいくつかの観察研究で、血清25-ヒドロキシビタミンD濃度が低いことと年配者の軽度認知障害に関連があることがわかった(219,221,222)。65歳以上の1,604人の男性(223)と6,257人の女性(224)に対する2つの前向き研究の横断的および縦断的解析で、女性はビタミンD欠乏症(血液中の25-ヒドロキシビタミンD濃度が10ng/mL未満)だと30ng/mL以上の場合よりもベースライン時で認知障害の可能性が60%高く、4年間の追跡期間の間では認知障害のリスクが58%上昇したが、男性ではそうではなかったことが報告された。2,273人(平均年齢70.4歳)を対象とした多民族のコホート内症例対照研究であるSingapore Kidney Eye Study(=シンガポール腎臓眼研究)では、簡略型認知機能テスト(AMT)で評価された逆行性エピソード記憶、意味記憶、および時間の見当識に影響する認知障害と、血清25-ヒドロキシビタミンD濃度が逆相関していた(225)。
しかし観察研究の系統的総括やメタ解析は、認知能力やADとビタミンDの状態との関連についてまちまちな結果となっている(226-230)。さらに、1,182人の男性を18年間追跡した成人男性ウプサラ縦断研究(ULSAM)の最近のデータ解析では、ビタミンD合成の遺伝的決定因子、ビタミンD摂取、および血漿25-ヒドロキシビタミンD濃度と、認知機能障害、AD,血管性認知症、または全原因による認知症のリスクとの間の相関は見られなかった(231)。対照的に別のメンデルランダム化研究では、国際アルツハイマー病ゲノムプロジェクト(International Genomics of Alzheimer's Project)のデータ(17,008人のAD患者と37,154人の健常者)で、ビタミンDの状態が悪いことの遺伝的決定因子とADリスクの上昇が関連付けられた(232)。
そうは言っても、年配の成人の70~90%にビタミンDの不足/欠乏が蔓延しており、血清25-ヒドロキシビタミンD濃度が低い状態を治すことが、認知プロセス、特に実行機能の向上に役立つかもしれない(233)。外来診療所での小規模非無作為化対照研究において、800 IU/日(または100,000 IU/月)のビタミンD補給をした20人の患者と24人の対照群被験者で、ベースライン時と16ヶ月後に認知機能全体の評価が行われた。補給されなかった群に比べて、外来患者へのビタミンD補給によってビタミンD濃度が低い状態は改善され(血清25-ヒドロキシビタミンD濃度の平均はベースライン時で16.8ng/mL、16ヶ月後では30ng/mL)、認知テストの成績が大きく改善するという関連があった(234)。鼻からのインスリン投与を受けている32人の軽度から中度のAD患者による小規模無作為化プラセボ対照臨床試験では、高用量(最大で36,000 IU/日)のビタミンD2を8週間補給しても、低用量(1,000 IU/日)の場合に比べて大きく認知能力が改善することはなかった(235)。年配者におけるビタミンDの再充足と認知能力への長期的な有益性の因果関係を調べるさらなる試験が必要である。また、認知障害の被験者のビタミンD欠乏を治すことが抗認知症治療の影響を強めることができるかどうかを評価することは非常に重要である(236)。
パーキンソン病
パーキンソン病(PD)は、患者の間でビタミンD不足が広く見られるという関連があり、体を動かすことに問題がある者については特にそうである(237)。平均年齢65歳の296人の外来患者による症例対照研究では、血清25-ヒドロキシビタミンD濃度が20ng/mL以下の者はPD被験者の23%にあたり、AD患者や健康な者ではそれぞれ16%と10%だった(238)。ベースライン時にPDでなかった50~79歳の男女3,173人による前向きコホート研究では、血清25-ヒドロキシビタミンD濃度が最高四分位(女性では20ng/mL以上、男性では22.8ng/mL以上)にある者は、最低四分位(女性で10ng/mL以下、男性で11.2ng/mL以下)にある者に比べてPDのリスクが67%低かった(239)。観察研究からメタ解析用にプールされたデータはすべて、健康な対照群にくらべてPD患者にはビタミンDの状態の不適切さが報告されやすいことを示していた(240~242)。
ある無作為化二重盲検プラセボ対照試験では、標準的なPD治療を受けている112人のPD患者(平均年齢72歳)が1,200 IU/日のビタミンDまたはプラセボ補給を12ヶ月受けた。ビタミンD補給によって、補給を受けた被験者の血清25-ヒドロキシビタミンD濃度が倍近くになった(平均22.5ng/mLから41.7ng/mLへ)だけでなく、PDの進行も限定的になった。これは、補給を受けた群の大部分の患者で、症状の悪化(ホーン・ヤールの重症度分類[Hoehn and Yahr stage]やパーキンソン病統一スケールのパートII[United Parkinson Disease Rating Scale part II]で評価)がプラセボ群に比べてまったくなかったことによって示されている(243)。この疾患の病因にビタミンD不足が関わっているかは不明だが、ビタミンDを充足させてやることで、PDの予防および/または治療以上の健康への利点があるかもしれない。たとえば、ビタミンD欠乏はPDや多発性硬化症を含む神経障害のある者の骨粗しょう症や骨折のリスクを悪化させるかもしれない(244~246)。興味深いことに、324人のPDの年配者に対する前向き研究で、日光に当たることはビタミンDの状態の改善、第二中手骨の骨密度の増加、および大腿骨頚部骨折の発生率の低下と関連があることがわかった(247)。
妊娠への悪影響
母親のビタミンDの状態と妊娠の転帰に関する31の観察研究の系統的総括とメタ解析で、ビタミンD不足は妊娠中の女性の妊娠糖尿病、妊娠高血圧腎症 、および細菌性膣炎と関連しているかもしれないことが示された。妊娠中に母親の血清ビタミンD濃度が低いと不当軽量児や低出生体重児のリスクが上昇することとも関連しているが、帝王切開とは関連がない(248)。しかし、妊娠中にビタミンD補給をすることが上記のような妊娠への悪影響の発生を減らす可能性があるのかについて結論を出すには、介入試験の数が現在ではあまりにも限られすぎている(249)。
妊娠糖尿病
膵臓のβ細胞機能障害による異常な高血糖症は、2型糖尿病でない妊婦における妊娠糖尿病(GDM)の徴候の特徴である。この症状は、妊娠高血圧腎症、帝王切開分娩のリスク上昇、およびメタボリック症候群や2型糖尿病の生涯を通じてのリスク上昇を含む深刻な母体への悪影響と関連している。GDMは、生まれた子供の胎児性巨大児(過剰出生体重)、新生児低血糖症、新生児呼吸窮迫症候群、および生涯を通じての肥満、耐糖能異常、2型糖尿病、および心血管疾患のリスク上昇を含むリスクの上昇に寄与しているかもしれない((250)の文献でレビュー)。
655人の妊婦に対する最近の前向き研究で、GDMを発症した54人の女性はそれ以外の者に比べて、妊娠第一期に平均血清25-ヒドロキシビタミンD濃度がかなり低かった(23ng/mL対25.4ng/mL)ことがわかった。ビタミンDの状態とGDMのリスク(体重過多/肥満および2型糖尿病やGDMの前病歴を含む)の交絡因子に対する複数の補正を行った後、妊娠初期に血清25-ヒドロキシビタミンD濃度が7.5ng/mL減少するごとに、GDM発症リスクが48%高くなるという関連があることがこの研究でわかった(251)。118人のGDMの妊婦と219人の同等な対照群の被験者によるコホート内症例対照研究で、妊娠第二期に血清25-ヒドロキシビタミンD濃度が低い(29.4ng/mL未満)ことはGDMの発症と関連があった(252)。中等~上質の観察研究を含む5つのメタ解析(248, 253~256)でも、異なる血清25-ヒドロキシビタミンD濃度測定方法が使用されていたり、異なる妊娠期に濃度測定されていたり、GDMの評価の基準が異なるなどの研究の偏りのエビデンスはあったものの、妊娠中の母体の血清ビタミンD濃度はGDMの発症リスクと逆相関していたと報告された((257)の文献でレビュー)。
さらに、妊娠中のグルコース(=ブドウ糖)調整におけるビタミンDの役割のエビデンスが、GDMと診断された54人の妊婦に対する小規模無作為化二重盲検プラセボ対照試験で報告された。6週間に2回(第1日目と第21日目)50,000 IUのビタミンD3を補給したら、プラセボに比べて空腹時血糖値および血清インスリン濃度が有意に低くなり、インスリン抵抗性が減り、インスリン感受性が改善した(258)。これは、ビタミンD欠乏が妊娠中の耐糖能に悪影響を及ぼし、GMDの発症に寄与するかもしれないことを示唆している。今のところ、耐糖能異常やGDMの予防におけるビタミンD補給の潜在的有益性は評価されていない。GDMのリスクのある妊婦(妊娠前BMIが29kg/m2以上)の代謝の状態に対して、ビタミンD補給とライフスタイルのへ介入(健康な食事や運動)の効果を評価する多機関の無作為化対照試験(DALI)がヨーロッパで進行中である(259)。健康な食事と運動が標準治療に比べて妊娠性の体重増加を抑えるのに役立つことが予備的な結果では示唆されているが、これらの生活様式変化は肥満の妊婦のGDMリスクを低くすることはなさそうである(260)。DALI研究でのビタミンD補給の効果に関する結果はまだ発表されていない。
生まれた子供の健康
妊娠中に腸でのカルシウム吸収や骨格からのカルシウム代謝が増えることによって、胎児の骨格へのカルシウムの付加が可能になる。しかし、母親のビタミンDの状態と胎児の骨成長の測定値の関係を調べた観察研究は、一貫した結果になっていない(261,262)。さらに、母親のビタミンD骨粗しょう症研究(MAVIDOS)からの最近のデータでは、妊娠17週未満から出産までの間毎日ビタミンD3(1,000 IU)またはプラセボを無作為化されて補給した母親から生まれた新生児の全身の骨塩量(BMC)には、差がなかったことが示唆された(263)。また、母親が妊娠中にビタミンD強化によって余分にビタミンDを摂取していてもいなくても、10~18歳のデンマークの子供の骨折リスクは同じようなものであった(264)。妊娠中のビタミンD補給は、出産時に新生児のビタミンD欠乏症リスクを効果的に防ぐ(265)ものの、新生児のビタミンD状態がその後の幼児期に骨折リスクに影響するというエビデンスはほとんどない(266)。
いくつかの観察研究で、妊娠中の母親のビタミンDが充分であることと子供の呼吸器症状やアレルギーの発生との関係を支持するやや弱いエビデンスが示された(267)。無作為化対照試験では、妊娠第三期(妊娠第27週から出産まで)の108人の妊婦にビタミンD3を800 IU/日または200,000 IUの急速投与で補給しても、3歳時点でその子供の喘鳴、アレルギー性鼻炎、食物アレルギーの診断、下気道感染症、または湿疹のリスクはプラセボ(N=50)に比べて減らなかったことがわかった(268)。より最近の二重盲検無作為化対照試験で、295人のデンマーク人妊婦に妊娠第22~26週から出産まで2,800 IU/日(70μg/日)のビタミンD3補給をしたら、400 IU/日(10μg/日)のビタミンD3補給(これはデンマークの現在の推奨量である)をした場合(N=286)に比べて、子供が3歳になるまでの間に肺の症状で問題になるエピソードのリスクが17%減ったことがわかった(269)。しかしながら持続性喘鳴、喘息、アレルギーの感作、気道感染症、または湿疹のリスクに関して、治療群と対照群とでは何の差も報告されなかった(269)。喘息、アレルギー性鼻炎、または湿疹の病歴(または配偶者にその病歴)のある777人の米国人妊婦に対するビタミンD出生前喘息低減試験(Vitamin D Antenatal Asthma Reduction Trial)という同様の無作為化二重盲検対照試験で、2,400 IU/日(60μg/日)または400 IU/日(10μg/日)の補給をしても、その子供が3歳時点で喘息や再発性喘鳴を発症するリスクには何の差もなかった(270)。個々の研究で有意性がなかったにも関わらず、これら3つの研究の統合解析では、妊娠中に高用量のビタミンD補給をした母親の子供は低用量の補給をした母親の子供よりも、再発性喘鳴のリスクが19%低いことがわかった(271)。378の母子ペアのコホートでは、妊娠第34週で測定された血清25-ヒドロキシビタミンD濃度が高いと、子供が2歳までに食物アレルギーになるリスクが上昇するという関連があり、妊娠中のビタミンD補給の安全性に関して注意深い評価が必要となっている(272)。
ビタミンDが不十分なことが自己免疫に関連する(「自己免疫疾患」の項参照)ため、妊娠中に母親のビタミンDの状態が良くないことがその子供の自己免疫性糖尿病(インスリン依存性1型糖尿病)のリスク上昇に寄与しているかもしれない。しかし1型糖尿病リスクが遺伝的に高い3,723人の子供を平均で4.3年間追跡した研究の結果、妊娠第三期の母親のビタミンD摂取(食物および/または補給による摂取を食品摂取頻度質問票で評価)は、進行したβ細胞自己免疫や臨床的糖尿病とは関連がなかった(142)。あるコホート内症例対照研究では、1型糖尿病の子供の母親343人と対照群の母親343人の妊娠第三期における血清25-ヒドロキシビタミンDの平均濃度には何の差もなかった(143)。追跡研究では、母親のビタミンDの状態よりもむしろ特定のVDR多型が、子供が1型糖尿病を発症しやすくなることに関連しているかもしれないことが示唆された(273)。別のコホート内症例対照研究(1型糖尿病の子供の母親119人と129人の対照群の母親)では、25-ヒドロキシビタミンD濃度ではなく妊娠第三期のビタミンD結合タンパク質濃度と子供の1型糖尿病リスクとの間に逆相関があることがわかった(274)。現在のところ、妊娠中の母親のビタミンDの状態と子供の自己免疫疾患との間の因果関係は確定していない。
急性呼吸器感染症
200超のウィルスが上気道(URT)によくある感染、つまり風邪を引き起こし、鼻づまりや鼻水、咳、喉の痛み、およびくしゃみといった症状が現れる(275)。第三回米国国民健康栄養調査(NHANES III)への18,883人の参加者(12歳以上)による横断的データの解析で、血清25-ヒドロキシビタミンD濃度と最近の(自己申告による)URT感染(URTI)との間に逆相関が報告された。血液中のビタミンD濃度が30ng/mL以上の場合に比べて、10~29ng/mLの者では24%、10ng/mL未満の者だと36%URTIのリスクが高かった(276)。サブグループの解析で、喘息や慢性閉塞性肺疾患(COPD)の被験者が低い血清25-ヒドロキシビタミンD濃度だと、肺疾患のない者に比べてずっとURTIにかかりやすいと関連付けられた。
322人の健康な成人(18歳以上)に対して行われた無作為化二重盲検プラセボ対照試験では、月々のビタミンD3の服用(初めの2ヶ月は200,000 IUで、その後16ヶ月は100,000 IU)によって、プラセボに比べて介入群では平均の血清25-ヒドロキシビタミンD濃度が大きく上昇(29ng/mLから48ng/mLに変化)したが、URTIの発生が減ることはなかった(277)。また、結腸直腸腺腫の病歴のある2,259人の被験者(45~75歳)によるより大規模な多機関4群臨床試験では、ベースライン時に血清25-ヒドロキシビタミンD濃度が最低レベルの参加者でも、毎日1,000 IUのビタミンD3補給をしても冬またはその他の季節のURTIの症例の数や期間が減ることはなかった(278)。さらに、644人(60~84歳)による無作為化プラセボ対照試験の事後解析では、最長1年間1ヶ月に30,000または60,000 IUのビタミンD3を補給しても、細菌性気道感染に対する抗生物質の処方の割合は大きくは減らなかった。しかし月に60,000 IUの用量では、70歳以上の参加者への抗生物質使用のリスクが47%減ったことが層別解析でわかった(279)。また、妊婦にビタミンD3補給(2,000 IU/日)を出産までの3ヶ月とその後に子供への補給(800 IU/日)を生後6ヶ月まで行ったところ、介入期間後に6~18ヶ月齢の子供の急性呼吸器感染症の数がプラセボに比べて大幅に減った(280)。興味深いことにこれらのデータと追加的な21の試験のデータの統合解析では、試験の不均一性が大きいにもかかわらず、急速投与(毎週、毎月、または3ヶ月ごと)、毎日投与、または急速投与と毎日投与の組み合わせでビタミンD3を摂取すると、URTIの発症が全体で12%減少したことが示唆された(281)。サブグループの解析では、ベースライン血清25-ヒドロキシビタミンD濃度が10ng/mL未満の被験者ではビタミンD3補給によってURTIリスクが42%減ったが、濃度が10ng/mL以上の者には何の予防効果もなかったことがわかった。また急速投与を除いたサブグループの解析で、ベースラインのビタミンDの状態に関わらず毎日および毎週のビタミンD3投与計画がURTIに対して予防的であるようで、急速大量投与(30,000 IU以上)は毎日または毎週の投与に比べて効果がないことがわかった。またURTIに対するビタミンD3補給の効果は、年齢、BMI、喘息やCOPDの持病があること、およびインフルエンザワクチンの状態によっては変化しないようであった(281)。
ニュージーランドでの大規模臨床試験であるビタミンD状態評価研究(ViDA)の結果で、急性呼吸器感染症リスクの低下にビタミンDの急速大量投与は無効であることが確認された(282)。5,110人の年配者(ベースライン時で50~84歳)を対象としたこの二重盲検プラセボ対照試験で、中間値で3.3年間ビタミンD3を初めに200,000 IU/月、その後100,000 IU/月補給しても、急性呼吸器感染症の発症(自己申告による)に関して何の効果(HR, 1.01; 95% CI, 0.94-1.07)もなかった。ビタミンDの状態によるデータの層別化でも、血中ビタミンD濃度が20ng/mL(50nmol/L)以下の参加者には効果無し(HR, 1.08; 95% CI, 0.95-1.23)という同様の結果が見られた(282)。
最近終了したビタミンDとオメガ-3試験(VITAL試験)で、感染症の予防は試験の二次的な結果であるものの、年配者の気道感染症リスクに関する毎日のビタミンD服用(2,000 IU/日)効果に対する追加的なエビデンスが提供されるかもしれない(204,283,284)。
就学前の子供による試験では、2,000 IU/日のビタミンDを少なくとも4ヶ月間補給しても、400 IU/日を少なくとも4ヶ月間補給した場合と比べて、冬季間のURTIの発生率(285)または重症度(286)は低下しなかった。2,000 IU/日の補給で400 IU/日の場合より血清25-ヒドロキシビタミンDの平均濃度は有意に上昇した(48.7ng/mLに対して36.8ng/mL)が、これらの幼児のURTI予防には400 IUの用量で充分であったかもしれない(285)。ベトナムの農村における1,300人の健康な子供と青少年(対照群も介入群もベースライン25-ヒドロキシビタミンD濃度は26ng/mL)を対象にしたプラセボ対照試験で、8ヶ月間ビタミンDを14,000 IU/週補給したところ、インフルエンザでないウィルス性の呼吸器感染症が24%という有意な減少を示したが、インフルエンザAまたはBの発症は減少しなかった(287)。
新型コロナウィルス感染症、COVID-19
新型コロナウィルス感染症のCOVID-19は、重症急性呼吸器症候群コロナウィルス-2(SARS-CoV-2)に感染することによって引き起こされる。このウィルスは2019年後半に中国の武漢において発生し、急速に世界中に広まって全世界的なパンデミックを引き起こしている。咳、発熱、倦怠感、および呼吸困難といったインフルエンザに似た症状だけでなく、その他の多様な症状がCOVID-19の特徴である(CDCやWHOのウェブサイトを参照のこと)。この疾患の影響は広範囲に及び、最も重篤な場合には肺炎や呼吸困難、および死亡といった結果になる。しかしSARS-CoV-2に感染しても無症状のままで、他者をウィルス感染させてしまう可能性のある者もいる(288)。さらに、SARS-CoV-2に感染した者は症状が現れる前にこの疾病を拡散してしまう(発症前感染)可能性があり(289)、手洗い、マスク着用、ソーシャルディスタンスの確保、および検査や接触者追跡といった公衆衛生対策がこのパンデミックを抑えていくために重要である。
いくつかの観察研究でビタミンDの栄養状態とCOVID-19発生との相関が調べられ、全部(290-292)ではないがその大部分で、ビタミンDの欠乏または不足がSARS-CoV-2の感染リスク上昇と関連しているとわかった。2020年春の3ヶ月間にSARS-CoV-2検査を受けた191,000人超の米国在住者を調べた後ろ向きコホート研究で、ウィルス検査以前の12ヶ月以内のある一時点で測定された血清25-ヒドロキシビタミンD濃度が低めであることが、SARS-CoV-2検査での陽性結果と強く相関していた(293)。この研究では、血清25-ヒドロキシビタミンD濃度が1ng/mL上がるごとにSARS-CoV-2の陽性リスクが1.6%下がるという関連があり、血清濃度が55ng/mL以上でリスクが最も低くなっていた(293)。イスラエルにおける782人のSARS-CoV-2陽性者を含む7,807人の集団ベース後ろ向き研究で、血漿25-ヒドロキシビタミンD濃度が30ng/mL未満だと、それ以上のビタミンD濃度の場合に比べてSARS-CoV-2感染のリスクが50%高いという関連があった(294)。この研究ではビタミンDの状態評価がウィルス検査の前に行われたが、その時間枠に関する詳細情報は不足している。ビタミンDの栄養状態測定値とCOVID診断検査の時間的な関係は英国バイオバンク(UK Biobank)の大規模データ分析でも懸念であり、この分析ではSARS-CoV-2感染とビタミンDの状態には関連がないとなっている。この研究においては、COVID-19診断検査の10~14年前に行われたビタミンDの状態評価が使用された(291)。小規模後ろ向きコホート研究(295)と5つの症例対照研究(296-300)では、ビタミンDの状態とSARS-CoV-2感染との逆相関が報告されており、これは現在までのほとんどの研究結果と一致している。361,934人が参加した10の観察研究の2021年のメタ解析では、ビタミンD不足または欠乏とCOVID-19リスクの上昇との関連(OR, 1.43; 95% CI: 1.00-2.05)が報告されたが、それぞれの研究ごとの異種性が高い(301)。また英国バイオバンクのデータの解析では、ビタミンDのサプリメントを定期的に服用していると、服用していない者に比べてSARS-CoV-2感染リスクが34%低いという関連が見られた(292)。
さらに、入院の必要性や集中治療室への入室(302)」、肺炎のステージ(男性のみで女性はない;(303))、非侵襲的換気の必要性(304)、侵襲的機械的換気の必要性(305)、またはこれらやその他の指標の組み合わせ(297)によって測定されたCOVID-19の重篤リスクの上昇とビタミンD欠乏症との関連がわかり、ビタミンDの栄養状態が悪いこととCOVID-19の重篤度の関連が観察研究の大部分で示唆された。別の研究では、血漿25-ヒドロキシビタミンD濃度が30ng/mL未満と定義されるビタミンD不足とCOVID関連の入院可能性の上昇との相関がわかったが、50歳超の者のサブ解析(OR, 2.71; 95% CI 1.55-4.78; p<0.001)以外ではこの相関は統計的に有意になっていない(p=0.061)(294)。今日までの大部分のエビデンスと対照的に、ある症例対照研究ではビタミンD欠乏症はCOVID-19の重篤度と関連がないとわかった(298)。また、いくつかの研究でビタミンDの状態とCOVID-19の死亡率の関係が調べられ、そのうちの3つでビタミンD欠乏症が死亡リスクの上昇と関連しているとわかった(303, 305, 306)。残りの2つでは何の関連も見つからなかった(304, 307)が、そのうちの1つはCOVID-19診断検査の10年以上も前のビタミンDの測定値を使用していた(307)。
高齢、肥満、および2型糖尿病や心血管疾患の持病など、COVID-19重篤化リスク要因はいくつか知られている(308)ため、観察研究では潜在的交絡因子をコントロールすることが重要である。2つの準実験的研究では、SARS-CoV-2感染の前または間にビタミンD3を大量補給(50,000 IU/月、または80,000~100,000 IUを2~3ヶ月ごと)することによって、脆弱な年配のCOVID-19患者の重症度低下や生存率向上に関連があったと報告されている(309, 310)。COVID-19予防や治療にビタミンD補給をする無作為化対照試験がいくつか進行中であり、これらの結果でこの関連の因果関係に関する情報が得られるであろう。とはいえ現在のデータは、ビタミンDの状態を補給で改善することによってCOVID-19リスク要因を変えられることを示している。
疾病治療
アトピー性皮膚炎
アトピー性皮膚炎やアトピー性湿疹は先進国で特に広がっており、10~20%の子供および1~3%の成人が罹っている。アトピー性皮膚炎は、罹患すると皮膚が乾いて痒みのあることが特徴的な慢性炎症性皮膚疾患である。局所的な皮膚の炎症や免疫機能不全は、罹患者の表皮バリアを損なって皮膚感染やアトピー性反応を起こしやすくする可能性がある。この疾患はしばしば、食物アレルギー、喘息、およびアレルギー性鼻炎などのその他のアトピー性疾患を伴う(311)。
この疾病の病因は充分によくわかっていないが、ビタミンD欠乏がこの疾病の発症および/または重篤度に寄与しているかもしれないことが示唆されている(312)。英国バイオバンクの資料、(313)、SUNLIGHTコンソーシアム(35)、GABRIEL asthmaコンソーシアム(314)、EAGLE eczemaコンソーシアム(315)などのヨーロッパ系白人の大規模データを用いて、遺伝的に血清25-ヒドロキシビタミンD濃度が低いこととアトピー性皮膚炎、喘息、または血清イムノグロブリン(Ig)-E濃度が高いこととの間に何の関連もないことが最近のメンデルランダム化研究でわかった(316)。
もしかしたら局所的な炎症反応を調整し皮膚の抗菌作用を刺激することで、ビタミンDはこの疾病の治療に有効な付加的手段になるかもしれないのではないかと、いくつかの無作為化対照研究で調べられた。さらに、アトピー性皮膚炎の特定のケースに見られる光療法の有効性にも、ビタミンDの作用が部分的に介在しているかもしれない(311)。アトピー性皮膚炎でビタミンD濃度が低い45人の患者(被験者の70%が血清25-ヒドロキシビタミンD濃度が20ng/mL未満)による小規模無作為化二重盲検プラセボ対照試験で、600 IUのビタミンEと一緒もしくは単体で1,600 IUのビタミンD3を60日間毎日経口投与したら、SCORAD(SCORing Atopic Dermatitis=アトピー性皮膚炎のスコア)によって評価された湿疹の広がりやひどさが有意に低減した(317)。別の小規模無作為化試験でも、ビタミンD3(1,600 IU/日を60日間)はアトピー性皮膚炎の53人の患者のビタミンDの栄養状態を改善し、疾病の重篤度を下げた(318)。より最近では、湿疹面積と重症度指数(EASI)および包括的重症度評価(IGA)のスコア変化で示されたモンゴル人の子供の冬季性アトピー性皮膚炎の重症度が、ビタミンD3(1,000 IU/日を1ヶ月)によって改善した(319)。4つの小規模試験(上記のものを含む)のメタ解析で、ビタミンD補給は罹患者の測定可能な臨床的改善につながる可能性があると結論づけられた(320)。これらの予備的結果を支持し最も適切で効果的な補給計画を決定するための大規模試験が必要である。注記したいのは、ビタミンD類似体による乾癬の局所的治療が米国食品医薬品局(FDA)によって承認され、これはその他の皮膚病の治療でも有効であるかもしれないことだ(321)。
炎症性腸疾患
いくつかの原因不明の環境および遺伝的要因は、潰瘍性大腸炎(UC)およびクローン病(CD)を引き起こす腸内細菌叢に対する不適切な免疫反応が起こることに寄与すると考えられている。特定のVDR多型が、UCやCDを発症しやすくなることに関連しているかもしれない(322)。一方で、72,719人の女性の大規模コホートでは、ビタミンD摂取が多く血液中の濃度が高いと考えられると、UCやCDの発生が減るという関連がわかった(323)。6つの観察研究のメタ解析で、ビタミンDの状態とCDの重症度の逆相関がわかった(324)。3つの研究で、おそらく腸の炎症を抑えることでビタミンD3がCDの患者に有益となるかどうかを調べた。多機関による1つの二重盲検プラセボ対照研究で、1年間の治療後に寛解状態にあるCD患者の再発率は、毎日1,200 IUのビタミンD3と1,200mgのカルシウムを補給した者の方が、カルシウムのみを補給した者に比べて有意に低かった(13%対29%)(325)。もう一つの予備的研究では、18人のCD患者に1,000から5,000 IUまで用量を増やしながら24週間毎日ビタミンD3を投与して、血液中の25-ヒドロキシビタミンD濃度が40ng/mL超になるようにした。患者の半分は40ng/mLには至らなかったが、平均25-ヒドロキシビタミンD濃度は(ベースラインの平均16ng/mLから)45ng/mLまで上がり、ビタミンDの状態が全体的に改善したことで、クローン病活動指数(CDAI)のスコアで評価されるこの疾病の重篤度が有意に下がるという関連があった(326)。寛解中の27人の患者に対する3ヶ月の無作為化二重盲検プラセボ対照試験で、ビタミンD3を毎日補給(2,000 IU)したらビタミンDの状態はよくなったが、腸管透過性(腸管壁浸漏)または炎症や疾患活動度の測定値には何の有意な効果もなかった(327)。それでもその研究で、血清25-ヒドロキシビタミンD濃度が30 ng/mL以上になることが腸の炎症を減らして患者の生活の質を上げることに役立つかもしれないことが示唆された。炎症性腸疾患におけるビタミンDの治療的有効性を確定するさらなる研究が必要である。
心血管疾患
Intermountain Heart Collaborative study(=インターマウンテン心臓共同研究)における41,504の電子医療記録の前向き解析で、患者の3分の1しか適切な血清25-ヒドロキシビタミンD濃度(30ng/mL超)になっていなかったことがわかった。ビタミンD不足(血清25-ヒドロキシビタミンD濃度が30ng/mL以下)は、高血圧、冠動脈疾患、心不全、および脳卒中などの多くの心血管的病状の発生や蔓延に関連していた(328)。最適以下のビタミンD状態は、高血圧の発生や心血管的な有害事象の強力な決定因子である動脈壁硬化や血管内皮障害に関連付けられてきた(329)。
高血圧
いくつかの介入試験で、血圧に対するビタミンD補給の効果が評価されてきた。オランダに住み軽度の高血圧だが治療を受けていない18名の男女による初期の対照臨床試験で、冬に6週間毎週3回紫外線B波に当たると、血清25-ヒドロキシビタミンD濃度が162%上昇し、PTH濃度が15%下がり、24時間自由行動下の収縮期(=最高)および拡張期(=最低)血圧値が平均で6mmHg下がったことがわかった(330)。健康または心臓代謝の既存症状(高血圧を含む)のある1,879人の参加者による16の無作為化対照試験の最近のメタ解析で、ビタミンD補給(800~8,571 IU/日を5週間から1年間)をしても最高および最低血圧値が大きく下がることはなかった。しかし、6つの試験のサブグループ解析で、既存症状のある者の最低血圧値が有意に1.31mmHg下がったことがわかった。ビタミンD不足/欠乏の場合には血圧の改善が期待できても、参加者の最適以下のビタミンD濃度は心臓代謝の症状のある者にのみ観察されるのではないことに、著者らは留意している(331)。対照的に、Styrian vitamin D hypertension trial(=スティリアのビタミンD高血圧試験)(332)およびDAYLIGHT(=高血圧リスクの高い者へのビタミンD療法試験)(333)という最近の2つの介入試験で、(前)高血圧症の被験者にビタミンD3補給(400~4,000 IU/日を2~6ヶ月)しても、ベースラインのビタミンDの状態(IOMの現在のカットオフ値で不足または適切)に関わらず血圧低下のエビデンスは示されなかった。
皮膚の色が濃い、温帯気候の緯度に住んでいる、および加齢などの皮膚でのビタミンD合成を減らす条件は高血圧の罹患率の上昇と関連があり(334)、このことはビタミンDが特定の集団の血圧を下げるかもしれないことを示唆している。上記のメタ解析で、ある4群二重盲検プラセボ対照試験が283人のアフリカ系アメリカ人に対して行われ、彼らは無作為に分けられて日に1,000 IU、2,000 IU、または4,000 IUのビタミンD3補給を3ヶ月間受けた。ベースライン値に比べて最高血圧は1,000 IU/日、2,000 IU/日、および4,000 IU/日の群でそれぞれ0.66mmHg、3.4mmHg、および4mmHg下がったのに対して、プラセボ群では1.7mmHg上がった。25-ヒドロキシビタミンD濃度が1ng/mL上がるごとに、最高血圧値が有意に0.2mmHg下がることが発見された。しかし、ビタミンD3とプラセボとでは3ヶ月の血圧変化に何の統計的な差もなかった(335)。150人の年配者(平均年齢77歳)を対象にした別の無作為化プラセボ対照試験では、3ヶ月ごとに100,000 IUのビタミンD3補給を1年間しても、プラセボに比べて血圧は大きく下がらなかった(336)。
ビタミンD補給が高血圧の予防や管理に役立つのかどうかを決定するさらなる研究が必要である。
うっ血性心不全
うっ血性心不全(心機能不全)は、脈拍が上がりその後に左心室肥大になることが特徴である。心不全は、心エコー検査(=心臓超音波検査)で評価される左室駆出率(LVEF)の減少を伴う。心不全の患者には現在、アンジオテンシン変換酵素(ACE)阻害薬(「血圧調整」の項参照)が第一選択治療薬として使用される。冠動脈造影を受けた健康な患者に対する横断研究で、血清25-ヒドロキシビタミンD濃度が30ng/mL未満だと、冠血流量率が悪いという関連があった(337)。ビタミンD濃度が最適以下だと、心不全の患者の予後がよくないこととも関連があった(338)。過去数年間のいくつかの介入研究で、心不全の者へのビタミンD補給の効果が調べられた。12週間の無作為化二重盲検プラセボ対照研究では、慢性うっ血性心不全の子供に毎日1,200 IUのビタミンD3を補給したら、ビタミンDの状態が大幅に良くなり、心筋の働きも改善(LVEFが高くなる)し、PTHや炎症性サイトカインの濃度も低くなった(339)。心不全を患う64人の年配の患者による別の無作為化二重盲検プラセボ対照試験では、800mg/日のカルシウムと50,000 IU/週のビタミンD3を摂取した参加者は、カルシウムだけ補給した者と比べても、体力成績(有酸素能力や骨格筋強度の評価の代替指標として使用される)が大幅に良いということはなかった(340)。心不全の573人の被験者に対する7つの小規模無作為化プラセボ対照試験の最近のメタ解析で、ビタミンD補給(1,000 IU/日~50,000 IU/週)を6週間~9ヶ月したら血清中のPTH、腫瘍壊死因子-α(TNF-α)、およびC-反応性タンパク質(CRP)の濃度が下がった。しかしビタミンDで治療をした患者とプラセボを摂取した患者とでは、LVEF、血中インターロイキン-10(IL-10)濃度およびレニン濃度に有意な差はなかった(341)。また、末期心不全でビタミンD濃度が不適切(ベースライン血清25-ヒドロキシビタミンD濃度が8.6~19.7ng/mL)な患者に対するEVITA(=総死亡率に対するビタミンDの効果)試験で、4,000 IU/日のビタミンD補給を3年間しても、プラセボに比べて死亡リスクは下がらなかった(342)。
摂取源
日光
日光に含まれる紫外線B波(UVB;波長290~315ナノメートル)は、皮膚の表皮でのビタミンD3の生成を刺激する(343)。日光にあたることで、大部分の人のビタミンD必要量全部がまかなえる。屋外で週に2~3回短時間すごす子供や若い成人は一般的に、ビタミンD欠乏症を防ぐのに必要なすべてのビタミンDを合成することになる。ある研究で、模擬太陽光に最小紅斑量(肌が若干赤くなるのに必要な量)だけ全身を当てた後の血清ビタミンD濃度は、ビタミンDを約10,000~25,000 IU摂取した時と同じであった(344)。肌の色が濃い者は肌の色が明るい者に比べて、日光に当たってもビタミンD合成が顕著に少ない(34)。さらに、年配者は日光に当ってもビタミンDを合成する能力が下がっている上に、皮膚がんや肌の損傷を防ぐために頻繁に日焼け止めを使ったり肌を覆ったりする。SPF値が10の日焼け止めを塗ると、ビタミンD合成が90%も減る(30)。北緯および南緯40度くらい(マサチューセッツ州ボストンは北緯42度)では、11月から3月初旬までビタミンD合成に必要なUVB量が不十分である。さらに10度北または南(たとえばカナダのエドモントン)では、「ビタミンD不足の冬」は10月中旬から3月中旬まで延びる。緯度が25度(フロリダ州マイアミ)では年間を通して、緯度42度(ボストン)では春、夏、および秋に、12時ころに手、腕、および顔に日光を毎日15分まで浴びると、肌の色が明るい者はビタミンDが1,000 IU生成されるかもしれない(345)。
食品の摂取源
ビタミンDは天然にはいくつかの食品にしか入っておらず、それには油ののった魚(サバ、サケ、イワシ)、肝油、およびビタミンDを餌に混ぜて育てられた鶏の卵、および日光または紫外線にさらされたきのこなどがある。米国では牛乳と粉ミルクがビタミンD強化されており、1リットル弱に400 IU(10μg)入っている。しかし、チーズやヨーグルトなどのその他の乳製品は、常にビタミンD強化されているとは限らない。シリアル、パン、およびフルーツジュースもビタミンD強化されている可能性がある。強化食品のビタミンD含有量の変異が大きいので、ビタミンDの食事からの平均摂取量を正確に推定するのは難しい(346)。下の表2にビタミンDが豊富ないくつかの食品のビタミンD含有量(ビタミンD2とビタミンD3の合計)を国際単位(IU)とマイクログラム(μg)で示す。特定の食品の栄養素含有量についての詳細は、USDA(=米国農務省)のFoodData Centralを検索のこと。25-ヒドロキシビタミンD代謝物も低濃度で特定の食物に含まれ、それらには肉、乳製品、および卵などがある(347,348)。
| 食品 | 分量 | ビタミンD(IU) | ビタミンD(μg) |
|---|---|---|---|
| 缶詰のカラフトマス(ピンクサーモン) | 85g | 465 | 11.6 |
| 詰のサバ(骨なし) | 85g | 248 | 6.2 |
| 缶詰のイワシ | 85g | 164 | 4.1 |
| 低脂肪(1%)ビタミンD強化牛乳 | 1カップ強 | 108 | 2.7 |
| ビタミンD強化オレンジジュース | 1カップ強 | 100 | 2.5 |
| 強化シリアル |
1食分(通常1カップ強) |
40~50 | 1.0~1.3 |
| 卵黄 | 大1 | 37 | 0.9 |
サプリメント
処方箋なしで入手可能な大部分のビタミンDサプリメントは、コレカルシフェロール(ビタミンD3)を含んでいる。マルチビタミンのサプリメントは一般的に、400 IU~1,000 IU(10μg~25μg)のビタミンD2またはD3を含む。ビタミンD単一成分サプリメントは400~50,000 IUのビタミンD3を含むかもしれないが、400 IUが最も一般的な用量である(66)。多くのカルシウムサプリメントもビタミンDを含んでいることがある。ビタミンD2(エルゴカルシフェロール)の急速投与量では血清25-ヒドロキシビタミンD濃度を上げるのにビタミンD3ほど常に有効ではないかもしれないことが無作為化対照試験のメタ解析で示唆されたが、毎日補給の効能にはビタミンD2とビタミンD3の差は見られなかった(349)。ただしある25週間の無作為化二重盲検プラセボ対照試験では、夏の終わりに毎日1,000 IUのビタミンD3補給を開始すると、夏の時点の25-ヒドロキシビタミンD濃度を秋や冬も維持する効能がビタミンD2よりも高かったことがわかった(350)。
コレカルシフェロールのヒドロキシ化された形態である25-ヒドロキシビタミンD3(カルシジオール;カルシフェジオール)をサプリメントとして使用することに関心が高まっている。このビタミンD代謝物は皮膚で生成されたり食事で摂取されたりしたコレカルシフェロールからヒトや動物の肝臓で合成され、いくつかの食物(肉、牛乳、卵など)にも低濃度で含まれている(347,348)。一般的にカルシフェジオールの方が、同量のコレカルシフェロールを補給するよりも血中25-ヒドロキシビタミンD濃度の上昇に2~5倍効能があることが、臨床研究でわかっている(351~359)。したがってカルシフェジオール補給はコレカルシフェロールよりも低用量でビタミンDの状態を急速かつ一貫して改善するための手段である可能性があり、コレカルシフェロールの腸での吸収が減るような症状の者には有益であるかもしれない(359)。しかしながら25-ヒドロキシビタミンD3の形態は、現在米国では店頭で購入可能なサプリメントではない。
安全性
毒性
ビタミンDの毒性(ビタミンD過剰症)で、日光にあたることによって発生したものは観察されていない。これは、過剰な日光浴が7-デヒドロコレステロールやコレカルシフェロールから生物学的に不活性ないくつかの光反応生成物を発生させるからである(3)。ビタミンDの毒性で異常に高い血清カルシウム濃度(高カルシウム血症)になることがあり、これは長期間治療しないでいると骨量減少、腎臓結石、および心臓や腎臓といった臓器の石灰化に至る可能性がある。高カルシウム血症は、日に50,000 IU超のビタミンDを摂取した後に見られる(360)。全体的に、10,000 IU/日未満の摂取量なら、ビタミンDによる毒性は健康な者ではとても少ないことが研究で示唆されている(361~363)。しかし、米国医学研究所の食品栄養委員会は許容上限摂取量(UL)をすべての成人に対して4,000 IU/日(100μg/日)に設定した(表3参照)。原発性副甲状腺機能亢進症、サルコイドーシス、結核、およびリンパ腫などの特定の病状は、ビタミンDに反応して高カルシウム血症のリスクを高めることがある(361)。これらの病状の者はビタミンDのいかなる増加にも反応して高カルシウム血症になるかもしれず、ビタミンD摂取の増加に関して有識の医療従事者に相談すべきである。
| 年齢 | μg/日 | IU/日 |
|---|---|---|
| 乳児 0-6ヶ月 | 25 | 1,000 |
| 乳児 6-12ヶ月 | 37.5 | 1,500 |
| 幼児 1-3歳 | 62.5 | 2,500 |
| 子供 4-8歳 | 75 | 3,000 |
| 子供 9-13歳 | 100 | 4,000 |
| 青少年 14-18歳 | 100 | 4,000 |
| 成人 19歳以上 | 100 | 4,000 |
薬物相互作用
以下の薬物は腸でのビタミンDの吸収を減らす可能性があるので、ビタミンDと同時に摂取すべきでない:コレスチラミン(クエストラン)、コレスチポール(コレスチッド)、オルリスタット(ゼニカル)、および鉱物油(364,365)。以下の薬物はビタミンDの代謝を上げて血清25-ヒドロキシビタミンD濃度を減らすかもしれない:フェニトイン(ジランチン)、フォスフェニトイン(セレビクス)、フェノバルビタール(ルミナール)、カルバマゼピン(テグレトール)、およびリファンピン(リマクタン)(6)。胃酸の分泌を抑えるH2ブロッカーであるシメチジンは、肝臓でのビタミンDのヒドロキシル化を阻害する(366)。呑酸、胃食道逆流疾患(GERD)、または胃潰瘍をプロトンポンプ阻害薬(オメプラゾール、ランソプラゾール)で治療することは、カルシウムの吸収に支障をきたして骨折リスクを高めるかもしれないので、患者にはカルシウムとビタミンDのサプリメントの摂取が勧められる(367)。経口抗真菌薬のケトコナゾールは25-ヒドロキシビタミンD3-1α-ヒドロキシラーゼ酵素を抑制し、健康な男性の血清1α,25-ジヒドロキシビタミンD濃度を減らすことがわかっている(368)。米国内分泌学会は、糖質コルチコイドやHIVの治療薬を服用している患者のビタミンD状態を監視することも勧めている。これらの薬物は25-ヒドロキシビタミンDの異化を増進させるからである(40)。細胞増殖抑制剤の中には、化学療法中のがん患者の25-ヒドロキシビタミンDおよび1α,25-ジヒドロキシビタミンDの分解を増進するものがある(6)。ビタミンDを有害なレベルまで服用して高カルシウム血症になると、ジゴキシン(ラノキシン)を服用している患者の不整脈を促進するかもしれない(366)。高カルシウム血症はまた、心房細動におけるベラパミル(カラン)およびジルチアゼム(カルディゼム)の効果を低減させる可能性がある(366)。
ライナス・ポーリング研究所の推奨
ライナス・ポーリング研究所は、概して健康な成人が毎日2,000 IU(50μg)のビタミンD補給をすることを推奨する。大部分のマルチビタミン剤は400 IU(10μg)のビタミンDを含んでおり、ビタミンD単一成分のサプリメントも追加的に利用できる。日光浴、食事、肌の色、および肥満度指数(BMI)が、体のビタミンD濃度に変動的かつ実質的に影響する。個人差を調整し適切なビタミンDの状態を確保するために、ライナス・ポーリング研究所は血清25-ヒドロキシビタミンD濃度として少なくとも30ng/mL(75nmol/L)を目標にすることを推奨する。血清25-ヒドロキシビタミンビタミンD濃度が30ng/mL~60ng/mLだと、がんや自己免疫疾患などの健康への悪影響のリスクが低いという関連が観察研究で示唆されている。
米国小児科学会は現在、すべての幼児、子供、および青少年が毎日400 IUのビタミンD補給を受けることを提唱している(19)。米国内分泌学会の推奨(40)と同様に、乳児は400~1,000 IU(10~25μg)のビタミンDを、子どもや青少年では600~1,000 IU(15~25μg)のビタミンDを毎日摂取することをライナス・ポーリング研究所は推奨する。母乳、粉ミルク、および子供や青少年の食事の平均的ビタミンD含有量であれば、これらの推奨値を達成するのにビタミンD補給が必要かもしれない。
年配者(50歳超)
年配者には毎日2,000 IU(50μg)のビタミンD補給が特に重要で、これは加齢によって日光に当たっても皮膚でビタミンDを合成する能力が下がるという関連があるからである。
Authors and Reviewers
Originally written in 2000 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in March 2003 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in March 2004 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in January 2008 by:
Victoria J. Drake, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in July 2014 by:
Barbara Delage, Ph.D.
Linus Pauling Institute
Oregon State University
The 2014 update of this article was supported by a grant from Bayer Consumer Care AG, Basel, Switzerland.
Updated in July 2017 by:
Barbara Delage, Ph.D.
Linus Pauling Institute
Oregon State University
Reviewed in October 2017 by:
Adrian F. Gombart, Ph.D.
Principal Investigator, Linus Pauling Institute
Associate Professor, Department of Biochemistry and Biophysics
Oregon State University
The 2017 update of this article was supported by a grant from Pfizer Inc.
Last updated 2/11/21 Copyright 2000-2024 Linus Pauling Institute
References
1. Holick MF. Vitamin D: importance in the prevention of cancers, type 1 diabetes, heart disease, and osteoporosis. Am J Clin Nutr. 2004;79(3):362-371. (PubMed)
2. Bikle DD. Vitamin D metabolism, mechanism of action, and clinical applications. Chem Biol. 2014;21(3):319-329. (PubMed)
3. Volmer DA, Mendes LR, Stokes CS. Analysis of vitamin D metabolic markers by mass spectrometry: Current techniques, limitations of the "gold standard" method, and anticipated future directions. Mass Spectrom Rev. 2015;34(1):2-23. (PubMed)
4. Holick MF. Vitamin D: A millenium perspective. J Cell Biochem. 2003;88(2):296-307. (PubMed)
5. Sutton AL, MacDonald PN. Vitamin D: more than a "bone-a-fide" hormone. Mol Endocrinol. 2003;17(5):777-791. (PubMed)
6. Grober U, Spitz J, Reichrath J, Kisters K, Holick MF. Vitamin D: Update 2013: From rickets prophylaxis to general preventive healthcare. Dermatoendocrinol. 2013;5(3):331-347. (PubMed)
7. Lieben L, Carmeliet G. The delicate balance between vitamin D, calcium and bone homeostasis: lessons learned from intestinal- and osteocyte-specific VDR null mice. J Steroid Biochem Mol Biol. 2013;136:102-106. (PubMed)
8. Fukumoto S. Phosphate metabolism and vitamin D. Bonekey Rep. 2014;3:497. (PubMed)
9. Lin R, White JH. The pleiotropic actions of vitamin D. Bioessays. 2004;26(1):21-28. (PubMed)
10. Edfeldt K, Liu PT, Chun R, et al. T-cell cytokines differentially control human monocyte antimicrobial responses by regulating vitamin D metabolism. Proc Natl Acad Sci U S A. 2010;107(52):22593-22598. (PubMed)
11. Smolders J, Thewissen M, Damoiseaux J. Control of T cell activation by vitamin D. Nat Immunol. 2011;12(1):3; author reply 3-4. (PubMed)
12. Aranow C. Vitamin D and the immune system. J Investig Med. 2011;59(6):881-886. (PubMed)
13. Zeitz U, Weber K, Soegiarto DW, Wolf E, Balling R, Erben RG. Impaired insulin secretory capacity in mice lacking a functional vitamin D receptor. Faseb J. 2003;17(3):509-511. (PubMed)
14. Bourlon PM, Billaudel B, Faure-Dussert A. Influence of vitamin D3 deficiency and 1,25 dihydroxyvitamin D3 on de novo insulin biosynthesis in the islets of the rat endocrine pancreas. J Endocrinol. 1999;160(1):87-95. (PubMed)
15. Heer M, Egert S. Nutrients other than carbohydrates: their effects on glucose homeostasis in humans. Diabetes Metab Res Rev. 2015;31(1):14-35. (PubMed)
16. Sheng H-W. Sodium, chloride, and potassium. In: Stipanuk M, ed. Biochemical and Physiological Aspects of Human Nutrition. Philadelphia: W.B. Saunders Company; 2000:686-710.
17. Sigmund CD. Regulation of renin expression and blood pressure by vitamin D(3). J Clin Invest. 2002;110(2):155-156. (PubMed)
18. Li YC, Kong J, Wei M, Chen ZF, Liu SQ, Cao LP. 1,25-Dihydroxyvitamin D(3) is a negative endocrine regulator of the renin-angiotensin system. J Clin Invest. 2002;110(2):229-238. (PubMed)
19. Wagner CL, Greer FR, American Academy of Pediatrics Section on B, American Academy of Pediatrics Committee on N. Prevention of rickets and vitamin D deficiency in infants, children, and adolescents. Pediatrics. 2008;122(5):1142-1152. (PubMed)
20. Goldacre M, Hall N, Yeates DG. Hospitalisation for children with rickets in England: a historical perspective. Lancet. 2014;383(9917):597-598. (PubMed)
21. Jones AN, Hansen KE. Recognizing the musculoskeletal manifestations of vitamin D deficiency. J Musculoskelet Med. 2009;26(10):389-396. (PubMed)
22. Bringhurst FR, Demay MB, Kronenberg HM. Mineral Metabolism. In: Larson PR, Kronenberg HM, Melmed S, Polonsky KS, eds. Williams Textbook of Endocrinology. 10th ed. Philadelphia: Saunders Book Company; 2003:1317-1320.
23. Plotnikoff GA, Quigley JM. Prevalence of severe hypovitaminosis D in patients with persistent, nonspecific musculoskeletal pain. Mayo Clin Proc. 2003;78(12):1463-1470. (PubMed)
24. Deandrea S, Lucenteforte E, Bravi F, Foschi R, La Vecchia C, Negri E. Risk factors for falls in community-dwelling older people: a systematic review and meta-analysis. Epidemiology. 2010;21(5):658-668. (PubMed)
25. Al-Khalidi B, Kimball SM, Rotondi MA, Ardern CI. Standardized serum 25-hydroxyvitamin D concentrations are inversely associated with cardiometabolic disease in US adults: a cross-sectional analysis of NHANES, 2001-2010. Nutr J. 2017;16(1):16. (PubMed)
26. Cooper JD, Smyth DJ, Walker NM, et al. Inherited variation in vitamin D genes is associated with predisposition to autoimmune disease type 1 diabetes. Diabetes. 2011;60(5):1624-1631. (PubMed)
27. Webb AR, Kline L, Holick MF. Influence of season and latitude on the cutaneous synthesis of vitamin D3: exposure to winter sunlight in Boston and Edmonton will not promote vitamin D3 synthesis in human skin. J Clin Endocrinol Metab. 1988;67(2):373-378. (PubMed)
28. Nichols EK, Khatib IM, Aburto NJ, et al. Vitamin D status and determinants of deficiency among non-pregnant Jordanian women of reproductive age. Eur J Clin Nutr. 2012;66(6):751-756. (PubMed)
29. Bassil D, Rahme M, Hoteit M, Fuleihan Gel H. Hypovitaminosis D in the Middle East and North Africa: prevalence, risk factors and impact on outcomes. Dermatoendocrinol. 2013;5(2):274-298. (PubMed)
30. Balk SJ, Council on Environmental H, Section on D. Ultraviolet radiation: a hazard to children and adolescents. Pediatrics. 2011;127(3):e791-817. (PubMed)
31. Dawodu A, Tsang RC. Maternal vitamin D status: effect on milk vitamin D content and vitamin D status of breastfeeding infants. Adv Nutr. 2012;3(3):353-361. (PubMed)
32. Thiele DK, Senti JL, Anderson CM. Maternal vitamin D supplementation to meet the needs of the breastfed infant: a systematic review. J Hum Lact. 2013;29(2):163-170. (PubMed)
33. Wharton B, Bishop N. Rickets. Lancet. 2003;362(9393):1389-1400. (PubMed)
34. Chen TC, Chimeh F, Lu Z, et al. Factors that influence the cutaneous synthesis and dietary sources of vitamin D. Arch Biochem Biophys. 2007;460(2):213-217. (PubMed)
35. Wang TJ, Zhang F, Richards JB, et al. Common genetic determinants of vitamin D insufficiency: a genome-wide association study. Lancet. 2010;376(9736):180-188. (PubMed)
36. Ahn J, Yu K, Stolzenberg-Solomon R, et al. Genome-wide association study of circulating vitamin D levels. Hum Mol Genet. 2010;19(13):2739-2745. (PubMed)
37. Wang W, Ingles SA, Torres-Mejia G, et al. Genetic variants and non-genetic factors predict circulating vitamin D levels in Hispanic and non-Hispanic White women: the Breast Cancer Health Disparities Study. Int J Mol Epidemiol Genet. 2014;5(1):31-46. (PubMed)
38. Elkum N, Alkayal F, Noronha F, et al. Vitamin D insufficiency in Arabs and South Asians positively associates with polymorphisms in GC and CYP2R1 genes. PLoS One. 2014;9(11):e113102. (PubMed)
39. Zhang Y, Yang S, Liu Y, Ren L. Relationship between polymorphisms in vitamin D metabolism-related genes and the risk of rickets in Han Chinese children. BMC Med Genet. 2013;14:101. (PubMed)
40. Holick MF, Binkley NC, Bischoff-Ferrari HA, et al. Evaluation, treatment, and prevention of vitamin D deficiency: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab. 2011;96(7):1911-1930. (PubMed)
41. Harris SS, Soteriades E, Coolidge JA, Mudgal S, Dawson-Hughes B. Vitamin D insufficiency and hyperparathyroidism in a low income, multiracial, elderly population. J Clin Endocrinol Metab. 2000;85(11):4125-4130. (PubMed)
42. Allain TJ, Dhesi J. Hypovitaminosis D in older adults. Gerontology. 2003;49(5):273-278. (PubMed)
43. Doorenbos CR, van den Born J, Navis G, de Borst MH. Possible renoprotection by vitamin D in chronic renal disease: beyond mineral metabolism. Nat Rev Nephrol. 2009;5(12):691-700. (PubMed)
44. Pappa HM, Bern E, Kamin D, Grand RJ. Vitamin D status in gastrointestinal and liver disease. Curr Opin Gastroenterol. 2008;24(2):176-183. (PubMed)
45. Jahnsen J, Falch JA, Mowinckel P, Aadland E. Vitamin D status, parathyroid hormone and bone mineral density in patients with inflammatory bowel disease. Scand J Gastroenterol. 2002;37(2):192-199. (PubMed)
46. Arunabh S, Pollack S, Yeh J, Aloia JF. Body fat content and 25-hydroxyvitamin D levels in healthy women. J Clin Endocrinol Metab. 2003;88(1):157-161. (PubMed)
47. Gallagher JC, Yalamanchili V, Smith LM. The effect of vitamin D supplementation on serum 25(OH)D in thin and obese women. J Steroid Biochem Mol Biol. 2013;136:195-200. (PubMed)
48. Deng X, Song Y, Manson JE, et al. Magnesium, vitamin D status and mortality: results from US National Health and Nutrition Examination Survey (NHANES) 2001 to 2006 and NHANES III. BMC Med. 2013;11:187. (PubMed)
49. Sempos CT, Durazo-Arvizu RA, Binkley N, Jones J, Merkel JM, Carter GD. Developing vitamin D dietary guidelines and the lack of 25-hydroxyvitamin D assay standardization: The ever-present past. J Steroid Biochem Mol Biol. 2016;164:115-119. (PubMed)
50. Chapuy MC, Preziosi P, Maamer M, et al. Prevalence of vitamin D insufficiency in an adult normal population. Osteoporos Int. 1997;7(5):439-443. (PubMed)
51. Thomas MK, Lloyd-Jones DM, Thadhani RI, et al. Hypovitaminosis D in medical inpatients. N Engl J Med. 1998;338(12):777-783. (PubMed)
52. Heaney RP, Dowell MS, Hale CA, Bendich A. Calcium absorption varies within the reference range for serum 25-hydroxyvitamin D. J Am Coll Nutr. 2003;22(2):142-146. (PubMed)
53. Valcour A, Blocki F, Hawkins DM, Rao SD. Effects of age and serum 25-OH-vitamin D on serum parathyroid hormone levels. J Clin Endocrinol Metab. 2012;97(11):3989-3995. (PubMed)
54. Ginde AA, Wolfe P, Camargo CA, Jr., Schwartz RS. Defining vitamin D status by secondary hyperparathyroidism in the US population. J Endocrinol Invest. 2012;35(1):42-48. (PubMed)
55. Gallagher JC, Yalamanchili V, Smith LM. The effect of vitamin D on calcium absorption in older women. J Clin Endocrinol Metab. 2012;97(10):3550-3556. (PubMed)
56. Looker AC, Johnson CL, Lacher DA, Pfeiffer CM, Schleicher RL, Sempos CT. Vitamin D status: United States, 2001-2006. NCHS Data Brief. 2011(59):1-8. (PubMed)
57. Food and Nutrition Board, Institute of Medicine. Dietary Reference Intakes for Calcium and Vitamin D. Washington, D.C.: The National Academies Press; 2011. (The National Academies Press)
58. Mithal A, Wahl DA, Bonjour JP, et al. Global vitamin D status and determinants of hypovitaminosis D. Osteoporos Int. 2009;20(11):1807-1820. (PubMed)
59. Powe CE, Evans MK, Wenger J, et al. Vitamin D-binding protein and vitamin D status of black Americans and white Americans. N Engl J Med. 2013;369(21):1991-2000. (PubMed)
60. Durazo-Arvizu RA, Dawson-Hughes B, Kramer H, et al. The reverse J-shaped association between serum total 25-hydroxyvitamin D concentration and all-cause mortality: the impact of assay standardization. Am J Epidemiol. 2017;185(8):720-726. (PubMed)
61. Gaksch M, Jorde R, Grimnes G, et al. Vitamin D and mortality: Individual participant data meta-analysis of standardized 25-hydroxyvitamin D in 26916 individuals from a European consortium. PLoS One. 2017;12(2):e0170791. (PubMed)
62. Chowdhury R, Kunutsor S, Vitezova A, et al. Vitamin D and risk of cause specific death: systematic review and meta-analysis of observational cohort and randomised intervention studies. BMJ. 2014;348:g1903. (PubMed)
63. Gupta V, Walia GK, Sachdeva MP. 'Mendelian randomization': an approach for exploring causal relations in epidemiology. Public Health. 2017;145:113-119. (PubMed)
64. Afzal S, Brondum-Jacobsen P, Bojesen SE, Nordestgaard BG. Genetically low vitamin D concentrations and increased mortality: Mendelian randomisation analysis in three large cohorts. BMJ. 2014;349:g6330. (PubMed)
65. Bjelakovic G, Gluud LL, Nikolova D, et al. Vitamin D supplementation for prevention of mortality in adults. Cochrane Database Syst Rev. 2014(1):Cd007470. (PubMed)
66. Wacker M, Holick MF. Vitamin D - effects on skeletal and extraskeletal health and the need for supplementation. Nutrients. 2013;5(1):111-148. (PubMed)
67. Lips P, Hosking D, Lippuner K, et al. The prevalence of vitamin D inadequacy amongst women with osteoporosis: an international epidemiological investigation. J Intern Med. 2006;260(3):245-254. (PubMed)
68. Torbergsen AC, Watne LO, Wyller TB, et al. Vitamin K1 and 25(OH)D are independently and synergistically associated with a risk for hip fracture in an elderly population: A case control study. Clin Nutr. 2015;34(1):101-106. (PubMed)
69. Lips P, van Schoor NM. The effect of vitamin D on bone and osteoporosis. Best Pract Res Clin Endocrinol Metab. 2011;25(4):585-591. (PubMed)
70. Reid IR, Bolland MJ, Grey A. Effects of vitamin D supplements on bone mineral density: a systematic review and meta-analysis. Lancet. 2014;383(9912):146-155. (PubMed)
71. Rosen CJ. Vitamin D supplementation: bones of contention. Lancet. 2014;383(9912):108-110. (PubMed)
72. Mocanu V, Vieth R. Three-year follow-up of serum 25-hydroxyvitamin D, parathyroid hormone, and bone mineral density in nursing home residents who had received 12 months of daily bread fortification with 125 mug of vitamin D3. Nutr J. 2013;12:137. (PubMed)
73. Feskanich D, Willett WC, Colditz GA. Calcium, vitamin D, milk consumption, and hip fractures: a prospective study among postmenopausal women. Am J Clin Nutr. 2003;77(2):504-511. (PubMed)
74. Jackson RD, LaCroix AZ, Gass M, et al. Calcium plus vitamin D supplementation and the risk of fractures. N Engl J Med. 2006;354(7):669-683. (PubMed)
75. Wang Y, Wactawski-Wende J, Sucheston-Campbell LE, et al. The influence of genetic susceptibility and calcium plus vitamin D supplementation on fracture risk. Am J Clin Nutr. 2017;105(4):970-979. (PubMed)
76. Gurney EP, Nachtigall MJ, Nachtigall LE, Naftolin F. The Women's Health Initiative trial and related studies: 10 years later: a clinician's view. J Steroid Biochem Mol Biol. 2014;142:4-11. (PubMed)
77. Grant AM, Avenell A, Campbell MK, et al. Oral vitamin D3 and calcium for secondary prevention of low-trauma fractures in elderly people (Randomised Evaluation of Calcium Or vitamin D, RECORD): a randomised placebo-controlled trial. Lancet. 2005;365(9471):1621-1628. (PubMed)
78. Bischoff-Ferrari HA, Giovannucci E, Willett WC, Dietrich T, Dawson-Hughes B. Estimation of optimal serum concentrations of 25-hydroxyvitamin D for multiple health outcomes. Am J Clin Nutr. 2006;84(1):18-28. (PubMed)
79. Khaw KT, Stewart AW, Waayer D, et al. Effect of monthly high-dose vitamin D supplementation on falls and non-vertebral fractures: secondary and post-hoc outcomes from the randomised, double-blind, placebo-controlled ViDA trial. Lancet Diabetes Endocrinol. 2017;5(6):438-447. (PubMed)
80. Chung M, Lee J, Terasawa T, Lau J, Trikalinos TA. Vitamin D with or without calcium supplementation for prevention of cancer and fractures: an updated meta-analysis for the US Preventive Services Task Force. Ann Intern Med. 2011;155(12):827-838. (PubMed)
81. Bischoff-Ferrari HA, Willett WC, Orav EJ, et al. A pooled analysis of vitamin D dose requirements for fracture prevention. N Engl J Med. 2012;367(1):40-49. (PubMed)
82. Avenell A, Mak JC, O'Connell D. Vitamin D and vitamin D analogues for preventing fractures in post-menopausal women and older men. Cochrane Database Syst Rev. 2014;4:CD000227. (PubMed)
83. Annweiler C, Beauchet O. Questioning vitamin D status of elderly fallers and nonfallers: a meta-analysis to address a 'forgotten step'. J Intern Med. 2015;277(1):16-44. (PubMed)
84. Cangussu LM, Nahas-Neto J, Orsatti CL, Bueloni-Dias FN, Nahas EA. Effect of vitamin D supplementation alone on muscle function in postmenopausal women: a randomized, double-blind, placebo-controlled clinical trial. Osteoporos Int. 2015;26(10):2413-2421. (PubMed)
85. Cangussu LM, Nahas-Neto J, Orsatti CL, et al. Effect of isolated vitamin D supplementation on the rate of falls and postural balance in postmenopausal women fallers: a randomized, double-blind, placebo-controlled trial. Menopause. 2016;23(3):267-274. (PubMed)
86. Bischoff-Ferrari HA, Dawson-Hughes B, Orav EJ, et al. Monthly high-dose vitamin D treatment for the prevention of functional decline: a randomized clinical trial. JAMA Intern Med. 2016;176(2):175-183. (PubMed)
87. Murad MH, Elamin KB, Abu Elnour NO, et al. Clinical review: The effect of vitamin D on falls: a systematic review and meta-analysis. J Clin Endocrinol Metab. 2011;96(10):2997-3006. (PubMed)
88. Boonen S, Lips P, Bouillon R, Bischoff-Ferrari HA, Vanderschueren D, Haentjens P. Need for additional calcium to reduce the risk of hip fracture with vitamin d supplementation: evidence from a comparative metaanalysis of randomized controlled trials. J Clin Endocrinol Metab. 2007;92(4):1415-1423. (PubMed)
89. Grant WB. Update on evidence that support a role of solar ultraviolet-B irradiance in reducing cancer risk. Anticancer Agents Med Chem. 2013;13(1):140-146. (PubMed)
90. Yin L, Ordonez-Mena JM, Chen T, Schottker B, Arndt V, Brenner H. Circulating 25-hydroxyvitamin D serum concentration and total cancer incidence and mortality: a systematic review and meta-analysis. Prev Med. 2013;57(6):753-764. (PubMed)
91. Gandini S, Gnagnarella P, Serrano D, Pasquali E, Raimondi S. Vitamin D receptor polymorphisms and cancer. Adv Exp Med Biol. 2014;810:69-105. (PubMed)
92. Vaughan-Shaw PG, O'Sullivan F, Farrington SM, et al. The impact of vitamin D pathway genetic variation and circulating 25-hydroxyvitamin D on cancer outcome: systematic review and meta-analysis. Br J Cancer. 2017;116(8):1092-1110. (PubMed)
93. Gombart AF, Luong QT, Koeffler HP. Vitamin D compounds: activity against microbes and cancer. Anticancer Res. 2006;26(4A):2531-2542. (PubMed)
94. Thorne J, Campbell MJ. The vitamin D receptor in cancer. Proc Nutr Soc. 2008;67(2):115-127. (PubMed)
95. Garland CF, Garland FC, Gorham ED. Calcium and vitamin D. Their potential roles in colon and breast cancer prevention. Ann N Y Acad Sci. 1999;889:107-119. (PubMed)
96. Choi YJ, Kim YH, Cho CH, Kim SH, Lee JE. Circulating levels of vitamin D and colorectal adenoma: A case-control study and a meta-analysis. World J Gastroenterol. 2015;21(29):8868-8877. (PubMed)
97. Gandini S, Boniol M, Haukka J, et al. Meta-analysis of observational studies of serum 25-hydroxyvitamin D levels and colorectal, breast and prostate cancer and colorectal adenoma. Int J Cancer. 2011;128(6):1414-1424. (PubMed)
98. Ma Y, Zhang P, Wang F, Yang J, Liu Z, Qin H. Association between vitamin D and risk of colorectal cancer: a systematic review of prospective studies. J Clin Oncol. 2011;29(28):3775-3782. (PubMed)
99. Touvier M, Chan DS, Lau R, et al. Meta-analyses of vitamin D intake, 25-hydroxyvitamin D status, vitamin D receptor polymorphisms, and colorectal cancer risk. Cancer Epidemiol Biomarkers Prev. 2011;20(5):1003-1016. (PubMed)
100. Ekmekcioglu C, Haluza D, Kundi M. 25-Hydroxyvitamin D status and risk for colorectal cancer and type 2 diabetes mellitus: a systematic review and meta-analysis of epidemiological studies. Int J Environ Res Public Health. 2017;14(2). (PubMed)
101. Gorham ED, Garland CF, Garland FC, et al. Optimal vitamin D status for colorectal cancer prevention: a quantitative meta analysis. Am J Prev Med. 2007;32(3):210-216. (PubMed)
102. Cauley JA, Chlebowski RT, Wactawski-Wende J, et al. Calcium plus vitamin D supplementation and health outcomes five years after active intervention ended: the Women's Health Initiative. J Womens Health (Larchmt). 2013;22(11):915-929. (PubMed)
103. Baron JA, Barry EL, Mott LA, et al. A trial of calcium and vitamin D for the prevention of colorectal adenomas. N Engl J Med. 2015;373(16):1519-1530. (PubMed)
104. Holick MF. Calcium plus vitamin D and the risk of colorectal cancer. N Engl J Med. 2006;354(21):2287-2288; author reply 2287-2288. (PubMed)
105. Barry EL, Peacock JL, Rees JR, et al. Vitamin D receptor genotype, vitamin D3 supplementation, and risk of colorectal adenomas: a randomized clinical trial. JAMA Oncol. 2017;3(5):628-635. (PubMed)
106. Hiraki LT, Joshi AD, Ng K, et al. Joint effects of colorectal cancer susceptibility loci, circulating 25-hydroxyvitamin D and risk of colorectal cancer. PLoS One. 2014;9(3):e92212. (PubMed)
107. Vidigal VM, Silva TD, de Oliveira J, Pimenta CAM, Felipe AV, Forones NM. Genetic polymorphisms of vitamin D receptor (VDR), CYP27B1 and CYP24A1 genes and the risk of colorectal cancer. Int J Biol Markers. 2017;32(2):e224-e230. (PubMed)
108. Maalmi H, Ordonez-Mena JM, Schottker B, Brenner H. Serum 25-hydroxyvitamin D levels and survival in colorectal and breast cancer patients: Systematic review and meta-analysis of prospective cohort studies. 2014;50(8):1510-1521. (PubMed)
109. Mohr SB, Garland CF, Gorham ED, Grant WB, Garland FC. Relationship between low ultraviolet B irradiance and higher breast cancer risk in 107 countries. Breast J. 2008;14(3):255-260. (PubMed)
110. John EM, Schwartz GG, Dreon DM, Koo J. Vitamin D and breast cancer risk: the NHANES I Epidemiologic follow-up study, 1971-1975 to 1992. National Health and Nutrition Examination Survey. Cancer Epidemiol Biomarkers Prev. 1999;8(5):399-406. (PubMed)
111. Kim Y, Je Y. Vitamin D intake, blood 25(OH)D levels, and breast cancer risk or mortality: a meta-analysis. Br J Cancer. 2014;110(11):2772-2784. (PubMed)
112. Wang D, Velez de-la-Paz OI, Zhai JX, Liu DW. Serum 25-hydroxyvitamin D and breast cancer risk: a meta-analysis of prospective studies. Tumour Biol. 2013;34(6):3509-3517. (PubMed)
113. Rose AA, Elser C, Ennis M, Goodwin PJ. Blood levels of vitamin D and early stage breast cancer prognosis: a systematic review and meta-analysis. Breast Cancer Res Treat. 2013;141(3):331-339. (PubMed)
114. Sperati F, Vici P, Maugeri-Sacca M, et al. Vitamin D supplementation and breast cancer prevention: a systematic review and meta-analysis of randomized clinical trials. PLoS One. 2013;8(7):e69269. (PubMed)
115. Hu K, Callen DF, Li J, Zheng H. Circulating vitamin D and overall survival in breast cancer patients: a dose-response meta-analysis of cohort studies. Integr Cancer Ther. 2017:1534735417712007. (PubMed)
116. Mohr SB, Gorham ED, Kim J, Hofflich H, Garland CF. Meta-analysis of vitamin D sufficiency for improving survival of patients with breast cancer. Anticancer Res. 2014;34(3):1163-1166. (PubMed)
117. Lu D, Jing L, Zhang S. Vitamin D receptor polymorphism and breast cancer risk: a meta-analysis. Medicine (Baltimore). 2016;95(18):e3535. (PubMed)
118. Mun MJ, Kim TH, Hwang JY, Jang WC. Vitamin D receptor gene polymorphisms and the risk for female reproductive cancers: A meta-analysis. Maturitas. 2015;81(2):256-265. (PubMed)
119. Gilbert R, Martin RM, Beynon R, et al. Associations of circulating and dietary vitamin D with prostate cancer risk: a systematic review and dose-response meta-analysis. Cancer Causes Control. 2011;22(3):319-340. (PubMed)
120. van der Rhee H, Coebergh JW, de Vries E. Is prevention of cancer by sun exposure more than just the effect of vitamin D? A systematic review of epidemiological studies. Eur J Cancer. 2013;49(6):1422-1436. (PubMed)
121. Tuohimaa P, Tenkanen L, Ahonen M, et al. Both high and low levels of blood vitamin D are associated with a higher prostate cancer risk: a longitudinal, nested case-control study in the Nordic countries. Int J Cancer. 2004;108(1):104-108. (PubMed)
122. Xu Y, Shao X, Yao Y, et al. Positive association between circulating 25-hydroxyvitamin D levels and prostate cancer risk: new findings from an updated meta-analysis. J Cancer Res Clin Oncol. 2014;140(9):1465-1477. (PubMed)
123. Grant WB, Karras SN, Bischoff-Ferrari HA, et al. Do studies reporting 'U'-shaped serum 25-hydroxyvitamin D-health outcome relationships reflect adverse effects? Dermatoendocrinol. 2016;8(1):e1187349. (PubMed)
124. Wu X, Cheng J, Yang K. Vitamin D-related gene polymorphisms, plasma 25-hydroxy-vitamin D, cigarette smoke and non-small cell lung cancer (NSCLC) Risk. Int J Mol Sci. 2016;17(10). (PubMed)
125. Zhang L, Wang S, Che X, Li X. Vitamin D and lung cancer risk: a comprehensive review and meta-analysis. Cell Physiol Biochem. 2015;36(1):299-305. (PubMed)
126. Liao Y, Huang JL, Qiu MX, Ma ZW. Impact of serum vitamin D level on risk of bladder cancer: a systemic review and meta-analysis. Tumour Biol. 2015;36(3):1567-1572. (PubMed)
127. Zhang H, Zhang H, Wen X, Zhang Y, Wei X, Liu T. Vitamin D deficiency and increased risk of bladder carcinoma: a meta-analysis. Cell Physiol Biochem. 2015;37(5):1686-1692. (PubMed)
128. Lu D, Chen J, Jin J. Vitamin D status and risk of non-Hodgkin lymphoma: a meta-analysis. Cancer Causes Control. 2014;25(11):1553-1563. (PubMed)
129. Prescott J, Bertrand KA, Poole EM, Rosner BA, Tworoger SS. Surrogates of long-term vitamin d exposure and ovarian cancer risk in two prospective cohort studies. Cancers (Basel). 2013;5(4):1577-1600. (PubMed)
130. Khayatzadeh S, Feizi A, Saneei P, Esmaillzadeh A. Vitamin D intake, serum Vitamin D levels, and risk of gastric cancer: A systematic review and meta-analysis. J Res Med Sci. 2015;20(8):790-796. (PubMed)
131. Gandini S, Raimondi S, Gnagnarella P, Dore JF, Maisonneuve P, Testori A. Vitamin D and skin cancer: a meta-analysis. Eur J Cancer. 2009;45(4):634-641. (PubMed)
132. Deluca HF, Cantorna MT. Vitamin D: its role and uses in immunology. Faseb J. 2001;15(14):2579-2585. (PubMed)
133. Agmon-Levin N, Mosca M, Petri M, Shoenfeld Y. Systemic lupus erythematosus one disease or many? Autoimmun Rev. 2012;11(8):593-595. (PubMed)
134. Goodin DS. The epidemiology of multiple sclerosis: insights to disease pathogenesis. Handb Clin Neurol. 2014;122:231-266. (PubMed)
135. Littorin B, Blom P, Scholin A, et al. Lower levels of plasma 25-hydroxyvitamin D among young adults at diagnosis of autoimmune type 1 diabetes compared with control subjects: results from the nationwide Diabetes Incidence Study in Sweden (DISS). Diabetologia. 2006;49(12):2847-2852. (PubMed)
136. Pozzilli P, Manfrini S, Crino A, et al. Low levels of 25-hydroxyvitamin D3 and 1,25-dihydroxyvitamin D3 in patients with newly diagnosed type 1 diabetes. Horm Metab Res. 2005;37(11):680-683. (PubMed)
137. Raab J, Giannopoulou EZ, Schneider S, et al. Prevalence of vitamin D deficiency in pre-type 1 diabetes and its association with disease progression. Diabetologia. 2014;57(5):902-908. (PubMed)
138. Hypponen E, Laara E, Reunanen A, Jarvelin MR, Virtanen SM. Intake of vitamin D and risk of type 1 diabetes: a birth-cohort study. Lancet. 2001;358(9292):1500-1503. (PubMed)
139. Sorensen IM, Joner G, Jenum PA, Eskild A, Torjesen PA, Stene LC. Maternal serum levels of 25-hydroxy-vitamin D during pregnancy and risk of type 1 diabetes in the offspring. Diabetes. 2012;61(1):175-178. (PubMed)
140. Brekke HK, Ludvigsson J. Vitamin D supplementation and diabetes-related autoimmunity in the ABIS study. Pediatr Diabetes. 2007;8(1):11-14. (PubMed)
141. Fronczak CM, Baron AE, Chase HP, et al. In utero dietary exposures and risk of islet autoimmunity in children. Diabetes Care. 2003;26(12):3237-3242. (PubMed)
142. Marjamaki L, Niinisto S, Kenward MG, et al. Maternal intake of vitamin D during pregnancy and risk of advanced beta cell autoimmunity and type 1 diabetes in offspring. Diabetologia. 2010;53(8):1599-1607. (PubMed)
143. Miettinen ME, Reinert L, Kinnunen L, et al. Serum 25-hydroxyvitamin D level during early pregnancy and type 1 diabetes risk in the offspring. Diabetologia. 2012;55(5):1291-1294. (PubMed)
144. Smolders J, Thewissen M, Peelen E, et al. Vitamin D status is positively correlated with regulatory T cell function in patients with multiple sclerosis. PLoS One. 2009;4(8):e6635. (PubMed)
145. Mokry LE, Ross S, Ahmad OS, et al. Vitamin D and risk of multiple sclerosis: a Mendelian randomization study. PLoS Med. 2015;12(8):e1001866. (PubMed)
146. Staples J, Ponsonby AL, Lim L. Low maternal exposure to ultraviolet radiation in pregnancy, month of birth, and risk of multiple sclerosis in offspring: longitudinal analysis. BMJ. 2010;340:c1640. (PubMed)
147. Bjornevik K, Riise T, Casetta I, et al. Sun exposure and multiple sclerosis risk in Norway and Italy: The EnvIMS study. Mult Scler. 2014; 20(8):1042-1049. (PubMed)
148. McDowell TY, Amr S, Culpepper WJ, et al. Sun exposure, vitamin D and age at disease onset in relapsing multiple sclerosis. Neuroepidemiology. 2011;36(1):39-45. (PubMed)
149. Munger KL, Levin LI, Hollis BW, Howard NS, Ascherio A. Serum 25-hydroxyvitamin D levels and risk of multiple sclerosis. JAMA. 2006;296(23):2832-2838. (PubMed)
150. Munger KL, Zhang SM, O'Reilly E, et al. Vitamin D intake and incidence of multiple sclerosis. Neurology. 2004;62(1):60-65. (PubMed)
151. Pierrot-Deseilligny C, Rivaud-Pechoux S, Clerson P, de Paz R, Souberbielle JC. Relationship between 25-OH-D serum level and relapse rate in multiple sclerosis patients before and after vitamin D supplementation. Ther Adv Neurol Disord. 2012;5(4):187-198. (PubMed)
152. Ascherio A, Munger KL, White R, et al. Vitamin d as an early predictor of multiple sclerosis activity and progression. JAMA Neurol. 2014;71(3):306-314. (PubMed)
153. Muris AH, Smolders J, Rolf L, et al. Vitamin D status does not affect disability progression of patients with multiple sclerosis over three year follow-up. PLoS One. 2016;11(6):e0156122. (PubMed)
154. Kampman MT, Steffensen LH, Mellgren SI, Jorgensen L. Effect of vitamin D3 supplementation on relapses, disease progression, and measures of function in persons with multiple sclerosis: exploratory outcomes from a double-blind randomised controlled trial. Mult Scler. 2012;18(8):1144-1151. (PubMed)
155. Soilu-Hanninen M, Aivo J, Lindstrom BM, et al. A randomised, double blind, placebo controlled trial with vitamin D3 as an add on treatment to interferon beta-1b in patients with multiple sclerosis. J Neurol Neurosurg Psychiatry. 2012;83(5):565-571. (PubMed)
156. Mrad MF, El Ayoubi NK, Esmerian MO, Kazan JM, Khoury SJ. Effect of vitamin D replacement on immunological biomarkers in patients with multiple sclerosis. Clin Immunol. 2017;181:9-15. (PubMed)
157. Muris AH, Smolders J, Rolf L, Thewissen M, Hupperts R, Damoiseaux J. Immune regulatory effects of high dose vitamin D3 supplementation in a randomized controlled trial in relapsing remitting multiple sclerosis patients receiving IFNbeta; the SOLARIUM study. J Neuroimmunol. 2016;300:47-56. (PubMed)
158. O'Connell K, Sulaimani J, Basdeo SA, et al. Effects of vitamin D3 in clinically isolated syndrome and healthy control participants: A double-blind randomised controlled trial. Mult Scler J Exp Transl Clin. 2017;3(3):2055217317727296. (PubMed)
159. Rosjo E, Steffensen LH, Jorgensen L, et al. Vitamin D supplementation and systemic inflammation in relapsing-remitting multiple sclerosis. J Neurol. 2015;262(12):2713-2721. (PubMed)
160. Sotirchos ES, Bhargava P, Eckstein C, et al. Safety and immunologic effects of high- vs low-dose cholecalciferol in multiple sclerosis. Neurology. 2016;86(4):382-390. (PubMed)
161. Bruce D, Whitcomb JP, August A, McDowell MA, Cantorna MT. Elevated non-specific immunity and normal Listeria clearance in young and old vitamin D receptor knockout mice. Int Immunol. 2009;21(2):113-122. (PubMed)
162. Zwerina K, Baum W, Axmann R, et al. Vitamin D receptor regulates TNF-mediated arthritis. Ann Rheum Dis. 2011;70(6):1122-1129. (PubMed)
163. Hitchon CA, Sun Y, Robinson DB, et al. Vitamin D receptor polymorphism rs2228570 (Fok1) is associated with rheumatoid arthritis in North American natives. J Rheumatol. 2012;39(9):1792-1797. (PubMed)
164. Lee YH, Bae SC, Choi SJ, Ji JD, Song GG. Associations between vitamin D receptor polymorphisms and susceptibility to rheumatoid arthritis and systemic lupus erythematosus: a meta-analysis. Mol Biol Rep. 2011;38(6):3643-3651. (PubMed)
165. Mosaad YM, Hammad EM, Fawzy Z, et al. Vitamin D receptor gene polymorphism as possible risk factor in rheumatoid arthritis and rheumatoid related osteoporosis. Hum Immunol. 2014;75(5):452-461. (PubMed)
166. Zanetti M, Harris SS, Dawson-Hughes B. Ability of vitamin D to reduce inflammation in adults without acute illness. Nutr Rev. 2014;72(2):95-98. (PubMed)
167. Merlino LA, Curtis J, Mikuls TR, Cerhan JR, Criswell LA, Saag KG. Vitamin D intake is inversely associated with rheumatoid arthritis: results from the Iowa Women's Health Study. Arthritis Rheum. 2004;50(1):72-77. (PubMed)
168. Costenbader KH, Feskanich D, Holmes M, Karlson EW, Benito-Garcia E. Vitamin D intake and risks of systemic lupus erythematosus and rheumatoid arthritis in women. Ann Rheum Dis. 2008;67(4):530-535. (PubMed)
169. Hiraki LT, Munger KL, Costenbader KH, Karlson EW. Dietary intake of vitamin D during adolescence and risk of adult-onset systemic lupus erythematosus and rheumatoid arthritis. Arthritis Care Res (Hoboken). 2012;64(12):1829-1836. (PubMed)
170. Sen D, Ranganathan P. Vitamin D in rheumatoid arthritis: panacea or placebo? Discov Med. 2012;14(78):311-319. (PubMed)
171. Lee YH, Bae SC. Vitamin D level in rheumatoid arthritis and its correlation with the disease activity: a meta-analysis. Clin Exp Rheumatol. 2016;34(5):827-833. (PubMed)
172. Lin J, Liu J, Davies ML, Chen W. Serum vitamin D level and rheumatoid arthritis disease activity: review and meta-analysis. PLoS One. 2016;11(1):e0146351. (PubMed)
173. Hansen KE, Bartels CM, Gangnon RE, Jones AN, Gogineni J. An evaluation of high-dose vitamin D for rheumatoid arthritis. J Clin Rheumatol. 2014;20(2):112-114. (PubMed)
174. Buondonno I, Rovera G, Sassi F, et al. Vitamin D and immunomodulation in early rheumatoid arthritis: A randomized double-blind placebo-controlled study. PLoS One. 2017;12(6):e0178463. (PubMed)
175. Dehghan A, Rahimpour S, Soleymani-Salehabadi H, Owlia MB. Role of vitamin D in flare ups of rheumatoid arthritis. Z Rheumatol. 2014;73(5):461-464. (PubMed)
176. Yang J, Liu L, Zhang Q, Li M, Wang J. Effect of vitamin D on the recurrence rate of rheumatoid arthritis. Exp Ther Med. 2015;10(5):1812-1816. (PubMed)
177. Gonzalez LA, Toloza SM, McGwin G, Jr., Alarcon GS. Ethnicity in systemic lupus erythematosus (SLE): its influence on susceptibility and outcomes. Lupus. 2013;22(12):1214-1224. (PubMed)
178. Hsieh CC, Lin BF. Dietary factors regulate cytokines in murine models of systemic lupus erythematosus. Autoimmun Rev. 2011;11(1):22-27. (PubMed)
179. Mao S, Huang S. Association between vitamin D receptor gene BsmI, FokI, ApaI and TaqI polymorphisms and the risk of systemic lupus erythematosus: a meta-analysis. Rheumatol Int. 2014;34(3):381-388. (PubMed)
180. Monticielo OA, Teixeira Tde M, Chies JA, Brenol JC, Xavier RM. Vitamin D and polymorphisms of VDR gene in patients with systemic lupus erythematosus. Clin Rheumatol. 2012;31(10):1411-1421. (PubMed)
181. Ruiz-Irastorza G, Egurbide MV, Olivares N, Martinez-Berriotxoa A, Aguirre C. Vitamin D deficiency in systemic lupus erythematosus: prevalence, predictors and clinical consequences. Rheumatology (Oxford). 2008;47(6):920-923. (PubMed)
182. Toloza SM, Cole DE, Gladman DD, Ibanez D, Urowitz MB. Vitamin D insufficiency in a large female SLE cohort. Lupus. 2010;19(1):13-19. (PubMed)
183. Amital H, Szekanecz Z, Szucs G, et al. Serum concentrations of 25-OH vitamin D in patients with systemic lupus erythematosus (SLE) are inversely related to disease activity: is it time to routinely supplement patients with SLE with vitamin D? Ann Rheum Dis. 2010;69(6):1155-1157. (PubMed)
184. Terrier B, Derian N, Schoindre Y, et al. Restoration of regulatory and effector T cell balance and B cell homeostasis in systemic lupus erythematosus patients through vitamin D supplementation. Arthritis Res Ther. 2012;14(5):R221. (PubMed)
185. Cutillas-Marco E, Marquina-Vila A, Grant W, Vilata-Corell J, Morales-Suarez-Varela M. Vitamin D and cutaneous lupus erythematosus: effect of vitamin D replacement on disease severity. Lupus. 2014;23(7):615-623. (PubMed)
186. Abou-Raya A, Abou-Raya S, Helmii M. The effect of vitamin D supplementation on inflammatory and hemostatic markers and disease activity in patients with systemic lupus erythematosus: a randomized placebo-controlled trial. J Rheumatol. 2013;40(3):265-272. (PubMed)
187. Lima GL, Paupitz J, Aikawa NE, Takayama L, Bonfa E, Pereira RM. Vitamin D supplementation in adolescents and young adults With juvenile systemic lupus erythematosus for improvement in disease activity and fatigue scores: a randomized, double-blind, placebo-controlled trial. Arthritis Care Res (Hoboken). 2016;68(1):91-98. (PubMed)
188. Andreoli L, Dall'Ara F, Piantoni S, et al. A 24-month prospective study on the efficacy and safety of two different monthly regimens of vitamin D supplementation in pre-menopausal women with systemic lupus erythematosus. Lupus. 2015;24(4-5):499-506. (PubMed)
189. Karimzadeh H, Shirzadi M, Karimifar M. The effect of Vitamin D supplementation in disease activity of systemic lupus erythematosus patients with Vitamin D deficiency: A randomized clinical trial. J Res Med Sci. 2017;22:4. (PubMed)
190. Antico A, Tampoia M, Tozzoli R, Bizzaro N. Can supplementation with vitamin D reduce the risk or modify the course of autoimmune diseases? A systematic review of the literature. Autoimmun Rev. 2012;12(2):127-136. (PubMed)
191. Wang TJ, Pencina MJ, Booth SL, et al. Vitamin D deficiency and risk of cardiovascular disease. Circulation. 2008;117(4):503-511. (PubMed)
192. van Ballegooijen AJ, Kestenbaum B, Sachs MC, et al. Association of 25-Hydroxyvitamin D and parathyroid hormone with incident hypertension: MESA (Multi-Ethnic Study of Atherosclerosis). J Am Coll Cardiol. 2014;63(12):1214-1222. (PubMed)
193. Kunutsor SK, Apekey TA, Steur M. Vitamin D and risk of future hypertension: meta-analysis of 283,537 participants. Eur J Epidemiol. 2013;28(3):205-221. (PubMed)
194. Burgaz A, Orsini N, Larsson SC, Wolk A. Blood 25-hydroxyvitamin D concentration and hypertension: a meta-analysis. J Hypertens. 2011;29(4):636-645. (PubMed)
195. Moody WE, Edwards NC, Madhani M, et al. Endothelial dysfunction and cardiovascular disease in early-stage chronic kidney disease: cause or association? Atherosclerosis. 2012;223(1):86-94. (PubMed)
196. Chitalia N, Recio-Mayoral A, Kaski JC, Banerjee D. Vitamin D deficiency and endothelial dysfunction in non-dialysis chronic kidney disease patients. Atherosclerosis. 2012;220(1):265-268. (PubMed)
197. Chitalia N, Ismail T, Tooth L, et al. Impact of vitamin d supplementation on arterial vasomotion, stiffness and endothelial biomarkers in chronic kidney disease patients. PLoS One. 2014;9(3):e91363. (PubMed)
198. Mazidi M, Karimi E, Rezaie P, Vatanparast H. The impact of vitamin D supplement intake on vascular endothelial function; a systematic review and meta-analysis of randomized controlled trials. Food Nutr Res. 2017;61(1):1273574. (PubMed)
199. Messa P, Curreri M, Regalia A, Alfieri CM. Vitamin D and the cardiovascular system: an overview of the recent literature. Am J Cardiovasc Drugs. 2014;14(1):1-14. (PubMed)
200. Brondum-Jacobsen P, Benn M, Afzal S, Nordestgaard BG. No evidence that genetically reduced 25-hydroxyvitamin D is associated with increased risk of ischaemic heart disease or myocardial infarction: a Mendelian randomization study. Int J Epidemiol. 2015;44(2):651-661. (PubMed)
201. Manousaki D, Mokry LE, Ross S, Goltzman D, Richards JB. Mendelian randomization studies do not support a role for vitamin D in coronary artery disease. Circ Cardiovasc Genet. 2016;9(4):349-356. (PubMed)
202. Ford JA, MacLennan GS, Avenell A, Bolland M, Grey A, Witham M. Cardiovascular disease and vitamin D supplementation: trial analysis, systematic review, and meta-analysis. Am J Clin Nutr. 2014;100(3):746-755. (PubMed)
203. Chin K, Appel LJ, Michos ED. Vitamin D, calcium, and cardiovascular disease: a"D"vantageous or "D"etrimental? An era of uncertainty. Curr Atheroscler Rep. 2017;19(1):5. (PubMed)
204. Pradhan AD, Manson JE. Update on the Vitamin D and OmegA-3 trial (VITAL). J Steroid Biochem Mol Biol. 2016;155(Pt B):252-256. (PubMed)
205. Neale RE, Armstrong BK, Baxter C, et al. The D-Health Trial: A randomized trial of vitamin D for prevention of mortality and cancer. Contemp Clin Trials. 2016;48:83-90. (PubMed)
206. Scragg R, Stewart AW, Waayer D, et al. Effect of monthly high-dose vitamin D supplementation on cardiovascular disease in the vitamin D assessment study: a randomized clinical trial. JAMA Cardiol. 2017;2(6):608-616. (PubMed)
207. Thomas GN, o Hartaigh B, Bosch JA, et al. Vitamin D levels predict all-cause and cardiovascular disease mortality in subjects with the metabolic syndrome: the Ludwigshafen Risk and Cardiovascular Health (LURIC) Study. Diabetes Care. 2012;35(5):1158-1164. (PubMed)
208. Chiu KC, Chu A, Go VL, Saad MF. Hypovitaminosis D is associated with insulin resistance and beta cell dysfunction. Am J Clin Nutr. 2004;79(5):820-825. (PubMed)
209. Shankar A, Sabanayagam C, Kalidindi S. Serum 25-hydroxyvitamin D levels and prediabetes among subjects free of diabetes. Diabetes Care. 2011;34(5):1114-1119. (PubMed)
210. Deleskog A, Hilding A, Brismar K, Hamsten A, Efendic S, Ostenson CG. Low serum 25-hydroxyvitamin D level predicts progression to type 2 diabetes in individuals with prediabetes but not with normal glucose tolerance. Diabetologia. 2012;55(6):1668-1678. (PubMed)
211. Khan H, Kunutsor S, Franco OH, Chowdhury R. Vitamin D, type 2 diabetes and other metabolic outcomes: a systematic review and meta-analysis of prospective studies. Proc Nutr Soc. 2013;72(1):89-97. (PubMed)
212. Lucato P, Solmi M, Maggi S, et al. Low vitamin D levels increase the risk of type 2 diabetes in older adults: A systematic review and meta-analysis. Maturitas. 2017;100:8-15. (PubMed)
213. George PS, Pearson ER, Witham MD. Effect of vitamin D supplementation on glycaemic control and insulin resistance: a systematic review and meta-analysis. Diabet Med. 2012;29(8):e142-150. (PubMed)
214. Gulseth HL, Wium C, Angel K, Eriksen EF, Birkeland KI. Effects of vitamin D supplementation on insulin sensitivity and insulin secretion in subjects with type 2 diabetes and vitamin D deficiency: a randomized controlled trial. Diabetes Care. 2017;40(7):872-878. (PubMed)
215. Lee CJ, Iyer G, Liu Y, et al. The effect of vitamin D supplementation on glucose metabolism in type 2 diabetes mellitus: A systematic review and meta-analysis of intervention studies. J Diabetes Complications. 2017;31(7):1115-1126. (PubMed)
216. Talaei A, Mohamadi M, Adgi Z. The effect of vitamin D on insulin resistance in patients with type 2 diabetes. Diabetol Metab Syndr. 2013;5(1):8. (PubMed)
217. Gezen-Ak D, Yilmazer S, Dursun E. Why vitamin d in Alzheimer's disease? The hypothesis. J Alzheimers Dis. 2014;40(2):257-269. (PubMed)
218. Landel V, Annweiler C, Millet P, Morello M, Feron F. Vitamin D, cognition and Alzheimer's disease: the therapeutic benefit is in the D-tails. J Alzheimers Dis. 2016;53(2):419-444. (PubMed)
219. Annweiler C, Schott AM, Rolland Y, Blain H, Herrmann FR, Beauchet O. Dietary intake of vitamin D and cognition in older women: a large population-based study. Neurology. 2010;75(20):1810-1816. (PubMed)
220. Annweiler C, Rolland Y, Schott AM, et al. Higher vitamin D dietary intake is associated with lower risk of Alzheimer's disease: a 7-year follow-up. J Gerontol A Biol Sci Med Sci. 2012;67(11):1205-1211. (PubMed)
221. Annweiler C, Fantino B, Schott AM, Krolak-Salmon P, Allali G, Beauchet O. Vitamin D insufficiency and mild cognitive impairment: cross-sectional association. Eur J Neurol. 2012;19(7):1023-1029. (PubMed)
222. Hooshmand B, Lokk J, Solomon A, et al. Vitamin D in relation to cognitive impairment, cerebrospinal fluid biomarkers, and brain volumes. J Gerontol A Biol Sci Med Sci. 2014;69(9):1132-1138. (PubMed)
223. Slinin Y, Paudel ML, Taylor BC, et al. 25-Hydroxyvitamin D levels and cognitive performance and decline in elderly men. Neurology. 2010;74(1):33-41. (PubMed)
224. Slinin Y, Paudel M, Taylor BC, et al. Association between serum 25(OH) vitamin D and the risk of cognitive decline in older women. J Gerontol A Biol Sci Med Sci. 2012;67(10):1092-1098. (PubMed)
225. Annweiler C, Milea D, Whitson HE, et al. Vitamin D insufficiency and cognitive impairment in Asians: a multi-ethnic population-based study and meta-analysis. J Intern Med. 2016;280(3):300-311. (PubMed)
226. Annweiler C, Llewellyn DJ, Beauchet O. Low serum vitamin D concentrations in Alzheimer's disease: a systematic review and meta-analysis. J Alzheimers Dis. 2013;33(3):659-674. (PubMed)
227. Balion C, Griffith LE, Strifler L, et al. Vitamin D, cognition, and dementia: a systematic review and meta-analysis. Neurology. 2012;79(13):1397-1405. (PubMed)
228. Lopes da Silva S, Vellas B, Elemans S, et al. Plasma nutrient status of patients with Alzheimer's disease: Systematic review and meta-analysis. Alzheimers Dement. 2014;10(4):485-502. (PubMed)
229. Shen L, Ji HF. Vitamin D deficiency is associated with increased risk of Alzheimer's disease and dementia: evidence from meta-analysis. Nutr J. 2015;14:76. (PubMed)
230. Sommer I, Griebler U, Kien C, et al. Vitamin D deficiency as a risk factor for dementia: a systematic review and meta-analysis. BMC Geriatr. 2017;17(1):16. (PubMed)
231. Olsson E, Byberg L, Karlstrom B, et al. Vitamin D is not associated with incident dementia or cognitive impairment: an 18-y follow-up study in community-living old men. Am J Clin Nutr. 2017;105(4):936-943. (PubMed)
232. Mokry LE, Ross S, Morris JA, Manousaki D, Forgetta V, Richards JB. Genetically decreased vitamin D and risk of Alzheimer disease. Neurology. 2016;87(24):2567-2574. (PubMed)
233. Annweiler C, Montero-Odasso M, Llewellyn DJ, Richard-Devantoy S, Duque G, Beauchet O. Meta-analysis of memory and executive dysfunctions in relation to vitamin D. J Alzheimers Dis. 2013;37(1):147-171. (PubMed)
234. Annweiler C, Fantino B, Gautier J, Beaudenon M, Thiery S, Beauchet O. Cognitive effects of vitamin D supplementation in older outpatients visiting a memory clinic: a pre-post study. J Am Geriatr Soc. 2012;60(4):793-795. (PubMed)
235. Stein MS, Scherer SC, Ladd KS, Harrison LC. A randomized controlled trial of high-dose vitamin D2 followed by intranasal insulin in Alzheimer's disease. J Alzheimers Dis. 2011;26(3):477-484. (PubMed)
236. Annweiler C, Karras SN, Anagnostis P, Beauchet O. Vitamin D supplements: a novel therapeutic approach for Alzheimer patients. Front Pharmacol. 2014;5:6. (PubMed)
237. Sato Y, Kikuyama M, Oizumi K. High prevalence of vitamin D deficiency and reduced bone mass in Parkinson's disease. Neurology. 1997;49(5):1273-1278. (PubMed)
238. Evatt ML, Delong MR, Khazai N, Rosen A, Triche S, Tangpricha V. Prevalence of vitamin D insufficiency in patients with Parkinson disease and Alzheimer disease. Arch Neurol. 2008;65(10):1348-1352. (PubMed)
239. Knekt P, Kilkkinen A, Rissanen H, Marniemi J, Saaksjarvi K, Heliovaara M. Serum vitamin D and the risk of Parkinson disease. Arch Neurol. 2010;67(7):808-811. (PubMed)
240. Lv Z, Qi H, Wang L, et al. Vitamin D status and Parkinson's disease: a systematic review and meta-analysis. Neurol Sci. 2014;35(11):1723-1730. (PubMed)
241. Shen L, Ji HF. Associations between vitamin D status, supplementation, outdoor work and risk of Parkinson's disease: a meta-analysis assessment. Nutrients. 2015;7(6):4817-4827. (PubMed)
242. Zhao Y, Sun Y, Ji HF, Shen L. Vitamin D levels in Alzheimer's and Parkinson's diseases: a meta-analysis. Nutrition. 2013;29(6):828-832. (PubMed)
243. Suzuki M, Yoshioka M, Hashimoto M, et al. Randomized, double-blind, placebo-controlled trial of vitamin D supplementation in Parkinson disease. Am J Clin Nutr. 2013;97(5):1004-1013. (PubMed)
244. Dobson R, Yarnall A, Noyce AJ, Giovannoni G. Bone health in chronic neurological diseases: a focus on multiple sclerosis and parkinsonian syndromes. Pract Neurol. 2013;13(2):70-79. (PubMed)
245. Torsney KM, Noyce AJ, Doherty KM, Bestwick JP, Dobson R, Lees AJ. Bone health in Parkinson's disease: a systematic review and meta-analysis. J Neurol Neurosurg Psychiatry. 2014;85(10):1159-66. (PubMed)
246. van den Bos F, Speelman AD, Samson M, Munneke M, Bloem BR, Verhaar HJ. Parkinson's disease and osteoporosis. Age Ageing. 2013;42(2):156-162. (PubMed)
247. Sato Y, Iwamoto J, Honda Y. Amelioration of osteoporosis and hypovitaminosis D by sunlight exposure in Parkinson's disease. Parkinsonism Relat Disord. 2011;17(1):22-26. (PubMed)
248. Aghajafari F, Nagulesapillai T, Ronksley PE, Tough SC, O'Beirne M, Rabi DM. Association between maternal serum 25-hydroxyvitamin D level and pregnancy and neonatal outcomes: systematic review and meta-analysis of observational studies. BMJ. 2013;346:f1169. (PubMed)
249. Perez-Lopez FR, Pasupuleti V, Mezones-Holguin E, et al. Effect of vitamin D supplementation during pregnancy on maternal and neonatal outcomes: a systematic review and meta-analysis of randomized controlled trials. Fertil Steril. 2015;103(5):1278-1288.e1274. (PubMed)
250. Alzaim M, Wood RJ. Vitamin D and gestational diabetes mellitus. Nutr Rev. 2013;71(3):158-167. (PubMed)
251. Lacroix M, Battista MC, Doyon M, et al. Lower vitamin D levels at first trimester are associated with higher risk of developing gestational diabetes mellitus. Acta Diabetol. 2014;51(4):609-616. (PubMed)
252. Parlea L, Bromberg IL, Feig DS, Vieth R, Merman E, Lipscombe LL. Association between serum 25-hydroxyvitamin D in early pregnancy and risk of gestational diabetes mellitus. Diabet Med. 2012;29(7):e25-32. (PubMed)
253. Lu M, Xu Y, Lv L, Zhang M. Association between vitamin D status and the risk of gestational diabetes mellitus: a meta-analysis. Arch Gynecol Obstet. 2016;293(5):959-966. (PubMed)
254. Poel YH, Hummel P, Lips P, Stam F, van der Ploeg T, Simsek S. Vitamin D and gestational diabetes: a systematic review and meta-analysis. Eur J Intern Med. 2012;23(5):465-469. (PubMed)
255. Wei SQ, Qi HP, Luo ZC, Fraser WD. Maternal vitamin D status and adverse pregnancy outcomes: a systematic review and meta-analysis. J Matern Fetal Neonatal Med. 2013;26(9):889-899. (PubMed)
256. Zhang MX, Pan GT, Guo JF, Li BY, Qin LQ, Zhang ZL. Vitamin D deficiency increases the risk of gestational diabetes mellitus: a meta-analysis of observational studies. Nutrients. 2015;7(10):8366-8375. (PubMed)
257. Triunfo S, Lanzone A, Lindqvist PG. Low maternal circulating levels of vitamin D as potential determinant in the development of gestational diabetes mellitus. J Endocrinol Invest. 2017;40(10):1049-1059. (PubMed)
258. Asemi Z, Hashemi T, Karamali M, Samimi M, Esmaillzadeh A. Effects of vitamin D supplementation on glucose metabolism, lipid concentrations, inflammation, and oxidative stress in gestational diabetes: a double-blind randomized controlled clinical trial. Am J Clin Nutr. 2013;98(6):1425-1432. (PubMed)
259. Jelsma JG, van Poppel MN, Galjaard S, et al. DALI: Vitamin D and lifestyle intervention for gestational diabetes mellitus (GDM) prevention: an European multicentre, randomised trial - study protocol. BMC Pregnancy Childbirth. 2013;13:142. (PubMed)
260. Simmons D, Devlieger R, van Assche A, et al. Effect of Physical Activity and/or Healthy Eating on GDM Risk: The DALI Lifestyle Study. J Clin Endocrinol Metab. 2017;102(3):903-913. (PubMed)
261. Galthen-Sorensen M, Andersen LB, Sperling L, Christesen HT. Maternal 25-hydroxyvitamin D level and fetal bone growth assessed by ultrasound: a systematic review. Ultrasound Obstet Gynecol. 2014;44(6):633-640. (PubMed)
262. Shor DB, Barzel J, Tauber E, Amital H. The effects of maternal vitamin D on neonatal growth parameters. Eur J Pediatr. 2015;174(9):1169-1174. (PubMed)
263. Cooper C, Harvey NC, Bishop NJ, et al. Maternal gestational vitamin D supplementation and offspring bone health (MAVIDOS): a multicentre, double-blind, randomised placebo-controlled trial. Lancet Diabetes Endocrinol. 2016;4(5):393-402. (PubMed)
264. Handel MN, Frederiksen P, Osmond C, Cooper C, Abrahamsen B, Heitmann BL. Prenatal exposure to vitamin D from fortified margarine and risk of fractures in late childhood: period and cohort results from 222 000 subjects in the D-tect observational study. Br J Nutr. 2017;117(6):872-881. (PubMed)
265. Rodda CP, Benson JE, Vincent AJ, Whitehead CL, Polykov A, Vollenhoven B. Maternal vitamin D supplementation during pregnancy prevents vitamin D deficiency in the newborn: an open-label randomized controlled trial. Clin Endocrinol (Oxf). 2015;83(3):363-368. (PubMed)
266. Handel MN, Frederiksen P, Cohen A, Cooper C, Heitmann BL, Abrahamsen B. Neonatal vitamin D status from archived dried blood spots and future risk of fractures in childhood: results from the D-tect study, a population-based case-cohort study. Am J Clin Nutr. 2017;106(1):155-161. (PubMed)
267. Bountouvi E, Douros K, Papadopoulou A. Can getting enough vitamin D during pregnancy reduce the risk of getting asthma in childhood? Front Pediatr. 2017;5:87. (PubMed)
268. Goldring ST, Griffiths CJ, Martineau AR, et al. Prenatal vitamin D supplementation and child respiratory health: a randomised controlled trial. PLoS One. 2013;8(6):e66627. (PubMed)
269. Chawes BL, Bonnelykke K, Stokholm J, et al. Effect of vitamin D3 supplementation during pregnancy on rsk of persistent wheeze in the offspring: a randomized clinical trial. JAMA. 2016;315(4):353-361. (PubMed)
270. Litonjua AA, Carey VJ, Laranjo N, et al. Effect of prenatal supplementation with vitamin D on asthma or eecurrent wheezing in offspring by age 3 years: the VDAART randomized clinical trial. JAMA. 2016;315(4):362-370. (PubMed)
271. Vahdaninia M, Mackenzie H, Helps S, Dean T. Prenatal intake of vitamins and allergic outcomes in the offspring: a systematic review and meta-analysis. J Allergy Clin Immunol Pract. 2017;5(3):771-778.e775. (PubMed)
272. Weisse K, Winkler S, Hirche F, et al. Maternal and newborn vitamin D status and its impact on food allergy development in the German LINA cohort study. Allergy. 2013;68(2):220-228. (PubMed)
273. Miettinen ME, Smart MC, Kinnunen L, et al. Maternal VDR variants rather than 25-hydroxyvitamin D concentration during early pregnancy are associated with type 1 diabetes in the offspring. Diabetologia. 2015;58(10):2278-2283. (PubMed)
274. Sorensen IM, Joner G, Jenum PA, et al. Vitamin D-binding protein and 25-hydroxyvitamin D during pregnancy in mothers whose children later developed type 1 diabetes. Diabetes Metab Res Rev. 2016;32(8):883-890. (PubMed)
275. Makela MJ, Puhakka T, Ruuskanen O, et al. Viruses and bacteria in the etiology of the common cold. J Clin Microbiol. 1998;36(2):539-542. (PubMed)
276. Ginde AA, Mansbach JM, Camargo CA, Jr. Association between serum 25-hydroxyvitamin D level and upper respiratory tract infection in the Third National Health and Nutrition Examination Survey. Arch Intern Med. 2009;169(4):384-390. (PubMed)
277. Murdoch DR, Slow S, Chambers ST, et al. Effect of vitamin D3 supplementation on upper respiratory tract infections in healthy adults: the VIDARIS randomized controlled trial. JAMA. 2012;308(13):1333-1339. (PubMed)
278. Rees JR, Hendricks K, Barry EL, et al. Vitamin D3 supplementation and upper respiratory tract infections in a randomized, controlled trial. Clin Infect Dis. 2013;57(10):1384-1392. (PubMed)
279. Tran B, Armstrong BK, Ebeling PR, et al. Effect of vitamin D supplementation on antibiotic use: a randomized controlled trial. Am J Clin Nutr. 2014;99(1):156-161. (PubMed)
280. Grant CC, Kaur S, Waymouth E, et al. Reduced primary care respiratory infection visits following pregnancy and infancy vitamin D supplementation: a randomised controlled trial. Acta Paediatr. 2015;104(4):396-404. (PubMed)
281. Martineau AR, Jolliffe DA, Hooper RL, et al. Vitamin D supplementation to prevent acute respiratory tract infections: systematic review and meta-analysis of individual participant data. BMJ. 2017;356:i6583. (PubMed)
282. Scragg R, Waayer D, Stewart AW, et al. The Vitamin D Assessment (ViDA) study: design of a randomized controlled trial of vitamin D supplementation for the prevention of cardiovascular disease, acute respiratory infection, falls and non-vertebral fractures. J Steroid Biochem Mol Biol. 2016;164:318-325. (PubMed)
283. Manson JE, Bassuk SS, Buring JE, Group VR. Principal results of the VITamin D and OmegA-3 TriaL (VITAL) and updated meta-analyses of relevant vitamin D trials. J Steroid Biochem Mol Biol. 2020;198:105522. (PubMed)
284. Gold DR, Litonjua AA, Carey VJ, et al. Lung VITAL: Rationale, design, and baseline characteristics of an ancillary study evaluating the effects of vitamin D and/or marine omega-3 fatty acid supplements on acute exacerbations of chronic respiratory disease, asthma control, pneumonia and lung function in adults. Contemp Clin Trials. 2016;47:185-195. (PubMed)
285. Aglipay M, Birken CS, Parkin PC, et al. Effect of high-dose vs standard-dose wintertime vitamin D supplementation on viral upper respiratory tract infections in young healthy children. JAMA. 2017;318(3):245-254. (PubMed)
286. Hueniken K, Aglipay M, Birken CS, et al. Effect of high-dose vitamin D supplementation on upper respiratory tract infection symptom severity in healthy children. Pediatr Infect Dis J. 2019;38(6):564-568. (PubMed)
287. Loeb M, Dang AD, Thiem VD, et al. Effect of Vitamin D supplementation to reduce respiratory infections in children and adolescents in Vietnam: A randomized controlled trial. Influenza Other Respir Viruses. 2019;13(2):176-183. (PubMed)
288. Kronbichler A, Kresse D, Yoon S, Lee KH, Effenberger M, Shin JI. Asymptomatic patients as a source of COVID-19 infections: A systematic review and meta-analysis. Int J Infect Dis. 2020;98:180-186. (PubMed)
289. Wiersinga WJ, Rhodes A, Cheng AC, Peacock SJ, Prescott HC. Pathophysiology, transmission, diagnosis, and treatment of coronavirus disease 2019 (COVID-19): a review. JAMA. 2020;324(8):782-793. (PubMed)
290. Ferrari D, Locatelli M. No significant association between vitamin D and COVID-19. A retrospective study from a northern Italian hospital. Int J Vitam Nutr Res. 2020:1-4. (PubMed)
291. Hastie CE, Mackay DF, Ho F, et al. Vitamin D concentrations and COVID-19 infection in UK Biobank. Diabetes Metab Syndr. 2020;14(4):561-565. (PubMed)
292. Ma H, Zhou T, Heianza Y, Qi L. Habitual use of vitamin D supplements and risk of coronavirus disease 2019 (COVID-19) infection: a prospective study in UK Biobank. Am J Clin Nutr. 2021;113(5):1275-1281. (PubMed)
293. Kaufman HW, Niles JK, Kroll MH, Bi C, Holick MF. SARS-CoV-2 positivity rates associated with circulating 25-hydroxyvitamin D levels. PLoS One. 2020;15(9):e0239252. (PubMed)
294. Merzon E, Tworowski D, Gorohovski A, et al. Low plasma 25(OH) vitamin D level is associated with increased risk of COVID-19 infection: an Israeli population-based study. FEBS J. 2020;287(17):3693-3702. (PubMed)
295. Meltzer DO, Best TJ, Zhang H, Vokes T, Arora V, Solway J. Association of vitamin D status and other clinical characteristics with COVID-19 test results. JAMA Netw Open. 2020;3(9):e2019722. (PubMed)
296. D'Avolio A, Avataneo V, Manca A, et al. 25-Hydroxyvitamin D concentrations are lower in patients with positive PCR for SARS-CoV-2. Nutrients. 2020;12(5):1359. (PubMed)
297. Ye K, Tang F, Liao X, et al. Does serum vitamin D level affect COVID-19 infection and its severity?-a case-control study. J Am Coll Nutr. 2020:1-8. (PubMed)
298. Hernandez JL, Nan D, Fernandez-Ayala M, et al. Vitamin D status in hospitalized patients with SARS-CoV-2 infection. J Clin Endocrinol Metab. 2020;106(3):e1343-e1353. (PubMed)
299. Im JH, Je YS, Baek J, Chung MH, Kwon HY, Lee JS. Nutritional status of patients with COVID-19. Int J Infect Dis. 2020;100:390-393. (PubMed)
300. Abdollahi A, Kamali Sarvestani H, Rafat Z, et al. The association between the level of serum 25(OH) vitamin D, obesity, and underlying diseases with the risk of developing COVID-19 infection: A case-control study of hospitalized patients in Tehran, Iran. J Med Virol. 2020;93(4):2359-2364. (PubMed)
301. Liu N, Sun J, Wang X, Zhang T, Zhao M, Li H. Low vitamin D status is associated with coronavirus disease 2019 outcomes: a systematic review and meta-analysis. Int J Infect Dis. 2021;104:58-64. (PubMed)
302. Panagiotou G, Tee SA, Ihsan Y, et al. Low serum 25-hydroxyvitamin D (25[OH]D) levels in patients hospitalized with COVID-19 are associated with greater disease severity. Clin Endocrinol (Oxf). 2020;93(4):508-511. (PubMed)
303. De Smet D, De Smet K, Herroelen P, Gryspeerdt S, Martens GA. Serum 25(OH)D level on hospital admission associated with COVID-19 stage and mortality. Am J Clin Pathol. 2020;155(3):381-388. (PubMed)
304. Baktash V, Hosack T, Patel N, et al. Vitamin D status and outcomes for hospitalised older patients with COVID-19. Postgrad Med J. 2020. [Epub ahead of print] (PubMed)
305. Radujkovic A, Hippchen T, Tiwari-Heckler S, Dreher S, Boxberger M, Merle U. Vitamin D deficiency and outcome of COVID-19 patients. Nutrients. 2020;12(9): 2757. (PubMed)
306. Carpagnano GE, Di Lecce V, Quaranta VN, et al. Vitamin D deficiency as a predictor of poor prognosis in patients with acute respiratory failure due to COVID-19. J Endocrinol Invest. 2020;(4):765-771. (PubMed)
307. Hastie CE, Pell JP, Sattar N. Vitamin D and COVID-19 infection and mortality in UK Biobank. Eur J Nutr. 2020;60(1):545-548. (PubMed)
308. Centers for Disease Control and Prevention. Assessing Risk Factors for Severe COVID-19 Illness. Available at: https://www.cdc.gov/coronavirus/2019-ncov/covid-data/investigations-discovery/assessing-risk-factors.html. Accessed 1/22/21.
309. Annweiler G, Corvaisier M, Gautier J, et al. Vitamin D supplementation associated to better survival in hospitalized frail elderly COVID-19 patients: the GERIA-COVID quasi-experimental study. Nutrients. 2020;12(11):3377. (PubMed)
310. Annweiler C, Hanotte B, Grandin de l'Eprevier C, Sabatier JM, Lafaie L, Celarier T. Vitamin D and survival in COVID-19 patients: A quasi-experimental study. J Steroid Biochem Mol Biol. 2020;204:105771. (PubMed)
311. Mesquita Kde C, Igreja AC, Costa IM. Atopic dermatitis and vitamin D: facts and controversies. An Bras Dermatol. 2013;88(6):945-953. (PubMed)
312. Lee SA, Hong S, Kim HJ, Lee SH, Yum HY. Correlation between serum vitamin D level and the severity of atopic dermatitis associated with food sensitization. Allergy Asthma Immunol Res. 2013;5(4):207-210. (PubMed)
313. Sudlow C, Gallacher J, Allen N, et al. UK biobank: an open access resource for identifying the causes of a wide range of complex diseases of middle and old age. PLoS Med. 2015;12(3):e1001779. (PubMed)
314. Moffatt MF, Gut IG, Demenais F, et al. A large-scale, consortium-based genomewide association study of asthma. N Engl J Med. 2010;363(13):1211-1221. (PubMed)
315. Paternoster L, Zhurov AI, Toma AM, et al. Genome-wide association study of three-dimensional facial morphology identifies a variant in PAX3 associated with nasion position. Am J Hum Genet. 2012;90(3):478-485. (PubMed)
316. Manousaki D, Paternoster L, Standl M, et al. Vitamin D levels and susceptibility to asthma, elevated immunoglobulin E levels, and atopic dermatitis: A Mendelian randomization study. PLoS Med. 2017;14(5):e1002294. (PubMed)
317. Javanbakht MH, Keshavarz SA, Djalali M, et al. Randomized controlled trial using vitamins E and D supplementation in atopic dermatitis. J Dermatolog Treat. 2011;22(3):144-150. (PubMed)
318. Amestejani M, Salehi BS, Vasigh M, et al. Vitamin D supplementation in the treatment of atopic dermatitis: a clinical trial study. J Drugs Dermatol. 2012;11(3):327-330. (PubMed)
319. Camargo CA, Jr., Ganmaa D, Sidbury R, Erdenedelger K, Radnaakhand N, Khandsuren B. Randomized trial of vitamin D supplementation for winter-related atopic dermatitis in children. J Allergy Clin Immunol. 2014;134(4):831-835.e831. (PubMed)
320. Kim G, Bae JH. Vitamin D and atopic dermatitis: A systematic review and meta-analysis. Nutrition. 2016;32(9):913-920. (PubMed)
321. Wat H, Dytoc M. Off-label uses of topical vitamin d in dermatology: a systematic review. J Cutan Med Surg. 2014;18(2):91-108. (PubMed)
322. Xue LN, Xu KQ, Zhang W, Wang Q, Wu J, Wang XY. Associations between vitamin D receptor polymorphisms and susceptibility to ulcerative colitis and Crohn's disease: a meta-analysis. Inflamm Bowel Dis. 2013;19(1):54-60. (PubMed)
323. Ananthakrishnan AN, Khalili H, Higuchi LM, et al. Higher predicted vitamin D status is associated with reduced risk of Crohn's disease. Gastroenterology. 2012;142(3):482-489. (PubMed)
324. Sadeghian M, Saneei P, Siassi F, Esmaillzadeh A. Vitamin D status in relation to Crohn's disease: meta-analysis of observational studies. Nutrition. 2016;32(5):505-514. (PubMed)
325. Jorgensen SP, Agnholt J, Glerup H, et al. Clinical trial: vitamin D3 treatment in Crohn's disease - a randomized double-blind placebo-controlled study. Aliment Pharmacol Ther. 2010;32(3):377-383. (PubMed)
326. Yang L, Weaver V, Smith JP, Bingaman S, Hartman TJ, Cantorna MT. Therapeutic effect of vitamin d supplementation in a pilot study of Crohn's patients. Clin Transl Gastroenterol. 2013;4:e33. (PubMed)
327. Raftery T, Martineau AR, Greiller CL, et al. Effects of vitamin D supplementation on intestinal permeability, cathelicidin and disease markers in Crohn's disease: Results from a randomised double-blind placebo-controlled study. United European Gastroenterol J. 2015;3(3):294-302. (PubMed)
328. Anderson JL, May HT, Horne BD, et al. Relation of vitamin D deficiency to cardiovascular risk factors, disease status, and incident events in a general healthcare population. Am J Cardiol. 2010;106(7):963-968. (PubMed)
329. Al Mheid I, Patel R, Murrow J, et al. Vitamin D status is associated with arterial stiffness and vascular dysfunction in healthy humans. J Am Coll Cardiol. 2011;58(2):186-192. (PubMed)
330. Krause R, Buhring M, Hopfenmuller W, Holick MF, Sharma AM. Ultraviolet B and blood pressure. Lancet. 1998;352(9129):709-710. (PubMed)
331. Kunutsor SK, Burgess S, Munroe PB, Khan H. Vitamin D and high blood pressure: causal association or epiphenomenon? Eur J Epidemiol. 2014;29(1):1-14. (PubMed)
332. Pilz S, Gaksch M, Kienreich K, et al. Effects of vitamin D on blood pressure and cardiovascular risk factors: a randomized controlled trial. Hypertension. 2015;65(6):1195-1201. (PubMed)
333. Arora P, Song Y, Dusek J, et al. Vitamin D therapy in individuals with prehypertension or hypertension: the DAYLIGHT trial. Circulation. 2015;131(3):254-262. (PubMed)
334. Rostand SG. Ultraviolet light may contribute to geographic and racial blood pressure differences. Hypertension. 1997;30(2 Pt 1):150-156. (PubMed)
335. Forman JP, Scott JB, Ng K, et al. Effect of vitamin D supplementation on blood pressure in blacks. Hypertension. 2013;61(4):779-785. (PubMed)
336. Witham MD, Price RJ, Struthers AD, et al. Cholecalciferol treatment to reduce blood pressure in older patients with isolated systolic hypertension: the VitDISH randomized controlled trial. JAMA Intern Med. 2013;173(18):1672-1679. (PubMed)
337. Oz F, Cizgici AY, Oflaz H, et al. Impact of vitamin D insufficiency on the epicardial coronary flow velocity and endothelial function. Coron Artery Dis. 2013;24(5):392-397. (PubMed)
338. Liu LC, Voors AA, van Veldhuisen DJ, et al. Vitamin D status and outcomes in heart failure patients. Eur J Heart Fail. 2011;13(6):619-625. (PubMed)
339. Shedeed SA. Vitamin D supplementation in infants with chronic congestive heart failure. Pediatr Cardiol. 2012;33(5):713-719. (PubMed)
340. Boxer RS, Kenny AM, Schmotzer BJ, Vest M, Fiutem JJ, Pina IL. A randomized controlled trial of high dose vitamin D3 in patients with heart failure. JACC Heart Fail. 2013;1(1):84-90. (PubMed)
341. Jiang WL, Gu HB, Zhang YF, Xia QQ, Qi J, Chen JC. Vitamin D supplementation in the treatment of chronic heart failure: a meta-analysis of randomized controlled trials. Clin Cardiol. 2016;39(1):56-61. (PubMed)
342. Zittermann A, Ernst JB, Prokop S, et al. Effect of vitamin D on all-cause mortality in heart failure (EVITA): a 3-year randomized clinical trial with 4000 IU vitamin D daily. Eur Heart J. 2017;38(29):2279-2286. (PubMed)
343. Norman AW, Henry HH. Vitamin D. In: Bowman BA, Russell RM, eds. Present Knowledge in Nutrition. 9th ed. Washington, D.C.: ILSI Press; 2006:198-210.
344. Holick MF. Vitamin D: the underappreciated D-lightful hormone that is important for skeletal and cellular health. Curr Opin Endocrinol Diabetes. 2002;9:87-98.
345. Terushkin V, Bender A, Psaty EL, Engelsen O, Wang SQ, Halpern AC. Estimated equivalency of vitamin D production from natural sun exposure versus oral vitamin D supplementation across seasons at two US latitudes. J Am Acad Dermatol. 2010;62(6):929 e921-929. (PubMed)
346. Food and Nutrition Board, Institute of Medicine. Vitamin D. Dietary Reference Intakes for Calcium, Phosphorus, Magnesium, Vitamin D, and Fluoride. Washington, D.C.: National Academies Press; 1999:250-287. (National Academy Press)
347. Ovesen L, Brot C, Jakobsen J. Food contents and biological activity of 25-hydroxyvitamin D: a vitamin D metabolite to be reckoned with? Ann Nutr Metab. 2003;47(3-4):107-113. (PubMed)
348. Jakobsen J, Christensen T. Natural vitamin D in food: to what degree does 25-hydroxyvitaminn D contribute to the vitamin D activity in food? JMBR Plus. 2020: doi: 10.1002/jbm1004.10453.
349. Tripkovic L, Lambert H, Hart K, et al. Comparison of vitamin D2 and vitamin D3 supplementation in raising serum 25-hydroxyvitamin D status: a systematic review and meta-analysis. Am J Clin Nutr. 2012;95(6):1357-1364. (PubMed)
350. Logan VF, Gray AR, Peddie MC, Harper MJ, Houghton LA. Long-term vitamin D3 supplementation is more effective than vitamin D2 in maintaining serum 25-hydroxyvitamin D status over the winter months. Br J Nutr. 2013;109(6):1082-1088. (PubMed)
351. Barger-Lux MJ, Heaney RP, Dowell S, Chen TC, Holick MF. Vitamin D and its major metabolites: serum levels after graded oral dosing in healthy men. Osteoporos Int. 1998;8(3):222-230. (PubMed)
352. Cashman KD, Seamans KM, Lucey AJ, et al. Relative effectiveness of oral 25-hydroxyvitamin D3 and vitamin D3 in raising wintertime serum 25-hydroxyvitamin D in older adults. Am J Clin Nutr. 2012;95(6):1350-1356. (PubMed)
353. Bischoff-Ferrari HA, Dawson-Hughes B, Stocklin E, et al. Oral supplementation with 25(OH)D3 versus vitamin D3: effects on 25(OH)D levels, lower extremity function, blood pressure, and markers of innate immunity. J Bone Miner Res. 2012;27(1):160-169. (PubMed)
354. Jetter A, Egli A, Dawson-Hughes B, et al. Pharmacokinetics of oral vitamin D(3) and calcifediol. Bone. 2014;59:14-19. (PubMed)
355. Navarro-Valverde C, Sosa-Henriquez M, Alhambra-Exposito MR, Quesada-Gomez JM. Vitamin D3 and calcidiol are not equipotent. J Steroid Biochem Mol Biol. 2016;164:205-208. (PubMed)
356. Shieh A, Ma C, Chun RF, et al. Effects of cholecalciferol vs calcifediol on total and free 25-hydroxyvitamin D and parathyroid hormone. J Clin Endocrinol Metab. 2017;102(4):1133-1140. (PubMed)
357. Vaes AMM, Tieland M, de Regt MF, Wittwer J, van Loon LJC, de Groot L. Dose-response effects of supplementation with calcifediol on serum 25-hydroxyvitamin D status and its metabolites: A randomized controlled trial in older adults. Clin Nutr. 2018;37(3):808-814. (PubMed)
358. Graeff-Armas LA, Bendik I, Kunz I, Schoop R, Hull S, Beck M. Supplemental 25-hydroxycholecalciferol is more effective than cholecalciferol in raising serum 25-hydroxyvitamin D concentrations in older adults. J Nutr. 2020;150(1):73-81. (PubMed)
359. Quesada-Gomez JM, Bouillon R. Is calcifediol better than cholecalciferol for vitamin D supplementation? Osteoporos Int. 2018;29(8):1697-1711. (PubMed)
360. Holick MF. Vitamin D deficiency. N Engl J Med. 2007;357(3):266-281. (PubMed)
361. Vieth R. Vitamin D supplementation, 25-hydroxyvitamin D concentrations, and safety. Am J Clin Nutr. 1999;69(5):842-856. (PubMed)
362. Heaney RP, Davies KM, Chen TC, Holick MF, Barger-Lux MJ. Human serum 25-hydroxycholecalciferol response to extended oral dosing with cholecalciferol. Am J Clin Nutr. 2003;77(1):204-210. (PubMed)
363. Vieth R, Chan PC, MacFarlane GD. Efficacy and safety of vitamin D3 intake exceeding the lowest observed adverse effect level. Am J Clin Nutr. 2001;73(2):288-294. (PubMed)
364. Knodel LC, Talbert RL. Adverse effects of hypolipidaemic drugs. Med Toxicol. 1987;2(1):10-32. (PubMed)
365. McDuffie JR, Calis KA, Booth SL, Uwaifo GI, Yanovski JA. Effects of orlistat on fat-soluble vitamins in obese adolescents. Pharmacotherapy. 2002;22(7):814-822. (PubMed)
366. Natural Medicines. Vitamin D. Professional handout/Drug interactions. Available at: https://naturalmedicines.therapeuticresearch.com. Accessed 6/11/17.
367. Panday K, Gona A, Humphrey MB. Medication-induced osteoporosis: screening and treatment strategies. Ther Adv Musculoskelet Dis. 2014;6(5):185-202. (PubMed)
368. Glass AR, Eil C. Ketoconazole-induced reduction in serum 1,25-dihydroxyvitamin D. J Clin Endocrinol Metab. 1986;63(3):766-769. (PubMed)
ビタミンE
目次
ビタミンEは4種(α、β、γ、δ)のトコフェロールと4種のトコトリエノールの合計8種の抗酸化物質で構成されている。人体において積極的に保持されるのはビタミンEの中でもα-トコフェロールのみであるため、血液や組織に最も多く存在するビタミンEはα-トコフェロールである(1)。ビタミンEの中で栄養学的に最も重要な同族体はα-トコフェロールであることから、以下の解説ではα-トコフェロールが話題の中心となる。最新の摂取推奨量(栄養所要量)においても、ビタミンEの1日当たりの推奨摂取量(RDA)はα-トコフェロールの量で表される。
機能
α-トコフェロール
α-トコフェロールはヒトにおいて抗酸化物質として主に機能する。フリーラジカルは正常な代謝の過程で、さらには喫煙や汚染物質のような環境因子にさらされる過程で主に生成する。細胞膜を構成する脂質はフリーラジカルによって酸化されやすい。脂溶性ビタミンであるα-トコフェロールはフリーラジカルの捕捉に適しており、脂質過酸化の連鎖反応を阻止する。生体における細胞膜の機能維持に加えて、α-トコフェロールは低密度リポタンパク質(LDL)中の脂質を酸化から保護する。リポタンパク質は脂質とタンパク質から構成される粒子で、血流を介して脂質を輸送する。LDLは肝臓から体の各組織へコレステロールを特異的に輸送する。酸化LDLは心疾患の進行に関与することがわかっている(疾病予防を参照)。α-トコフェロールがフリーラジカルを中和するとその抗酸化能が失われるが、ビタミンCのような抗酸化物質はα-トコフェロールの抗酸化活性を再生することができる(2, 3)。
α-トコフェロールのその他の機能としては、抗酸化以外の働きがあることが示されている。例えば、α-トコフェロールは重要な細胞情報伝達分子であるプロテインキナーゼCの活性を阻害することが知られている。α-トコフェロールは免疫細胞や炎症細胞において分子や酵素の発現・活性にも影響を与えているようである。さらに、α-トコフェロールは血小板凝集を阻害し血管拡張を促進することも示されている(4,5)。
食品に含まれるα-トコフェロールの異性体はRRR-α-トコフェロール(天然型またはd-α-トコフェロールとも言われる)である。合成したα-トコフェロールはall-rac-α-トコフェロールまたはdl-α-トコフェロールと表記され、生理活性の強さはRRR-α-トコフェロールの半分しかない(サプリメントを参照)。多くの場合、ビタミンE強化食品には合成したα-トコフェロールが含まれており、その量は一日の摂取量である30 IUの百分率で示される。本文では、α-トコフェロールの量を国際単位(IU)とmgで表記する。
γ-トコフェロール
γ-トコフェロールのヒトでの機能は現在不明である。アメリカ人の食事にはビタミンE異性体の中でγ-トコフェロールが最も多く含まれているが(食料源を参照)、一般的にγ-トコフェロールの血中濃度はα-トコフェロールの10分の1である。この現象には2つの機構が関与すると考えられている。1) α-トコフェロールは肝臓のα-トコフェロール輸送タンパク質(α-TTP)によって生体内に保持される。α-TTPは血中のリポタンパク質にα-トコフェロールを選択的に取り込んで(1)、最終的に各組織へα-トコフェロールを運搬する(6)。α-TTPとビタミンEの充足性についての情報がさらに必要な場合はライナスポーリング研究所のニュースレターを参照すること。2) α-トコフェロール以外のビタミンE同族体は速やかに代謝される(6)。γ-トコフェロールはα-トコフェロールと同様の機構で吸収されるため、微量のγ-トコフェロールが血中や組織から検出される。トコフェロール類の代謝物は尿から検出できる。α-トコフェロールよりもγ-トコフェロールの代謝物が尿に多く排出されることから、生体における必要量はγ-トコフェロールの方が少ないと示唆される(7)。γ-トコフェロールとその代謝物にはフリーラジカルの消去能があると試験管内での実験や動物試験で示されているが(8,9)、ヒトにおける有効性はまだ証明されていない。前向き研究では、血漿のγ-トコフェロール濃度の増加に伴った有意な前立腺癌のリスク低下が認められた。この研究では、血漿α-トコフェロール濃度と足の爪に蓄積したセレニウム濃度が高く、且つγ-トコフェロール濃度が高い場合には前立腺癌の予防につながることが明らかになった(10)。α-トコフェロールの摂取が血中γ-トコフェロール濃度を低下させるという事実に加えて、上記の知見はγ-トコフェロールの健康に対する効果に更なる研究が必要であることを示している(11)。血漿γ-トコフェロール濃度が比較的高いと、野菜や植物油の摂取が多いことを示している可能性があることも重要である。
欠乏症
ビタミンE欠乏は重篤な低栄養状態、α-トコフェロール輸送タンパク質の遺伝子異常、脂肪吸収不全症の患者に認められている。例えば、嚢胞性線維症や胆汁鬱滞性肝疾患の子供(食事由来の脂質の吸収不良のため脂溶性ビタミンの吸収も阻害される)は、ビタミンE欠乏の症状を示すだろう。深刻なビタミンE欠乏は平衡感覚や協調運動の障害(運動失調)、感覚神経の損傷(末梢神経障害)、筋力低下(筋疾患)、網膜の損傷(網膜色素変性)などの神経症状を呈する。このため、末梢神経障害、運動失調、網膜色素変性の患者にはビタミンE欠乏の検査をすべきである(2)。発達中の神経系はビタミンE欠乏により特に影響を受けやすい。例えば、生まれつき重篤なビタミンE欠乏症の子供はビタミンE投与が行われていない場合には神経症状が急速に進行する。一方、成人期にビタミンEの吸収不全に罹った患者は、10~20年間は神経症状を示さないだろう。ビタミンEの摂取量が少ない健常人がビタミンE欠乏症を呈するという症例は過去に無いことを強調しておく(2,12)。
ビタミンE欠乏症は実際には稀であるが、アメリカではビタミンE摂取がほとんど無い状態が日常的に生じている。1988~1994年の国民健康栄養調査III(NHANES III)で、18歳以上の16,295人の成人におけるα-トコフェロールの一日の摂取量と血中濃度を調査した。白人の27%、アフリカ系アメリカ人の41%、メキシコ系アメリカ人の28%、その他の人種の32%が20μM以下の血中α-トコフェロール濃度であることがわかった。心疾患のリスクが20μMの濃度以下の場合に上昇するという報告を基に、この濃度をカットオフ値として選んでいる(13)。より最近の2003~2006年のNHANESのデータによると、2歳以上のアメリカ人における食品(強化食品も含む)から摂取するα-トコフェロールの平均値は一日6.9 mgである(14)。この摂取量は一日の推奨量である15 mgをはるかに下回っている(RDAを参照)。実際にこの摂取量であれば、90%以上のアメリカ人が一日のビタミンE推奨量を満たしていないことになる(14)。
推奨摂取量(RDA)
以前、ビタミンEの推奨摂取量(RDA)は女性で一日8 mg、男性で10 mgであった。医学研究所の食品栄養委員会によって2000年に推奨摂取量が改定された(4)。この推奨量は、1950年代に行われたビタミンE欠乏食を摂取した男性の研究成果を基にしている。血液を試験管に取り、過酸化水素を加え、赤血球の崩壊(溶血反応)をビタミンE欠乏の指標とした。重篤なビタミンE欠乏の子供に溶血反応が認められているため、この分析はビタミンEの状態に関する臨床的に意義のある試験と考えられてきている。このことは、最新のビタミンE推奨摂取量においても、これまで通り、欠乏症の発症予防に基づいており、健康の増進や慢性疾患の予防ではないことを強調しておきたい。
疾病予防
心疾患
少なくとも5つの大規模観察研究の成果によって、ビタミンE摂取の増加に伴って心筋梗塞(心臓発作)や心臓病による死亡のリスクが男女ともに低下することが示されている。これらの試験は、健常者のビタミンE摂取量を調べ、心臓病と診断された人数もしくはそれが原因で死亡した人数を長年にわたって追跡調査した前向き研究である。それらのうちの2つの研究で、一日3~5 mg以下のα-トコフェロールを摂取していたヒトと比べて一日7 mg以上のα-トコフェロールを食事から摂取したヒトが心臓病で死亡する率はその35%であることがわかった(15,16)。その他の2つの研究で、毎日100 IU以上のRRR-α-トコフェロール(67 mgに相当)を摂取している男女は心臓病のリスクが有意に低減することが報告された(17,18)。近年、アテローム性頸動脈硬化症とその重症度(超音波検査による検出)が血漿や赤血球のα-トコフェロール濃度と逆相関することが見出されている(19-22)。Women’s Health Studyに参加した女性39,876名の無作為化プラセボ対照介入試験では、10年間にわたって一日おきに600 IUのRRR-α-トコフェロール(400 mgに相当)を摂取しても心疾患(心筋梗塞と脳卒中)の発症率に影響しないが、ビタミンEは心疾患による死亡率を24%低減することがわかった(23)。本研究はビタミンEが静脈血栓塞栓症のリスクを21%低下させることも示している(24)。しかし、健康な中年男性に実施した大規模無作為化臨床試験(試験名称:PHS II)では8年間一日おきに400 IUの合成α-トコフェロールを摂取しても心疾患のリスクに影響ないことがわかった(25)。心疾患の予防に関するビタミンE摂取の有益性については近年の総説で議論されている(26)。心臓病や腎臓病患者の介入試験では、ビタミンE摂取が心臓発作や死亡の予防に効果がないことを示している(疾病の治療を参照)。
白内障
白内障は眼球の水晶体でタンパク質が酸化されることで生じ、その酸化はα-トコフェロールのような抗酸化物質によって抑制される可能性がある。ビタミンE摂取量と白内障の発症率・重症度との関連性を検証した観察研究が行われている。研究成果は相反しており、ビタミンE摂取が白内障の進行を防ぐという報告もあれば、関連性がないという報告もある(27)。500 mgのビタミンC、400 IUの合成ビタミンE(dl-α-トコフェロール酢酸エステル:180 mgのRRR-α-トコフェロールに相当)15 mgのβ-カロテンを含む抗酸化物質を7年にわたって毎日サプリメントとして摂取しても加齢に伴う白内障の進行に効果がないことが4,629人の男女に対するプラセボ対照介入試験で明らかになった(28)。5年間の介入試験でも同様に、抗酸化物質の摂取(500 mgのビタミンC、400IU [268 mg]のRRR-α-トコフェロール、15 mgのβ-カロテン)は白内障の進行に影響しなかった(29)。4年間の無作為化プラセボ対照試験では、一日あたり500 IUの天然型のビタミンE(335 mgのRRR-α-トコフェロール)を摂取しても高齢者の白内障の発症や進行を低減化しないことが報告された(30)。50 mgの合成α-トコフェロール(25 mgのRRR-α-トコフェロールに相当)サプリメントを毎日摂っても男性喫煙者の白内障手術の実施率に影響しないことが介入試験により見出された(31)。いくつかの観察研究ではビタミンEによる白内障の進行抑制効果を示唆する結果が得られているものの、臨床試験の結果からは予防効果が認められていない。
免疫機能
α-トコフェロールが加齢に伴って衰える特定の免疫応答を高めることが知られている。例えば、一日200 mgの合成α-トコフェロール(100 mgのRRR-α-トコフェロールまたは150 IUのRRR-α-トコフェロールに相当)を数か月間摂取した高齢者は、B型肝炎{がた かんえん}ワクチンと破傷風ワクチンに応答して抗体産生が増大することがわかった(32)。しかし、α-トコフェロールによる高齢者の免疫機能の賦活はインフルエンザ(インフルエンザウィルス)のような感染症にも抵抗性を示すかどうかはわからない(33)。老人ホームに入居している高齢者に対する無作為化プラセボ対照試験で、200 IUの合成α-トコフェロール(90mgのRRR-α-トコフェロールに相当)を一年にわたって毎日摂取すると風邪のような上気道感染症の罹患率が有意に低下するが、下気道(肺)の感染症には効果がないと報告された(34)。ビタミンE摂取が高齢者において風邪などの感染症の予防につながるかについてはさらなる研究が必要である。
癌
多くの癌はフリーラジカルによるDNAの酸化損傷に起因すると考えられている。癌予防の研究の多くはα-トコフェロールによるフリーラジカルの消去能に焦点を当てている。しかし、α-トコフェロール摂取と肺癌・乳癌の発症率に有意な相関が認められないことがいくつかの大規模前向き研究で明らかになった(4)。77,126人の男女を対象としたコホート研究で、10年間にわたるビタミンEサプリメントの使用は常習喫煙者の肺癌リスクを増大させることが示された(35)。これまでに、ビタミンE摂取が癌のリスクに影響しないことがほとんどの臨床試験で明らかになっている。Women’s Health Studyに参加した女性39,876名の無作為化プラセボ対照試験(RCT)によって、10年間にわたって一日おきに600 IUのRRR-α-トコフェロール(400 mgに相当)を摂取しても癌の発症率と癌による死亡率に影響しないことがわかった(23)。ビタミンE摂取は乳癌、肺癌、大腸癌のような特定組織における癌の発症率にも効果がなかった。さらに、最近の12のRCTをまとめたメタ分析でもビタミンE摂取は癌の発症率、癌による死亡率、総死亡率に影響がないと結論されたことが近年報告された(36)。
RCTにおけるα-トコフェロールの前立腺癌に対する効果が注目を集めている。α-トコフェロールの肺癌に与える影響を調べたプラセボ対照介入試験(試験名称:ATBC)で、毎日50 mgの合成α-トコフェロール(25 mgのRRR-α-トコフェロールに相当)を喫煙者が摂取すると前立腺癌の発症率が34%低下することがわかった(37)。この試験と他の3つのRCTを統合したメタ分析によって、ビタミンEサプリメントが前立腺癌のリスクを15%低減させるという結果が得られた(35)。しかし、その後に行われた2つの大規模無作為化プラセボ対照介入試験では、ビタミンEを摂取している健康な男性において前立腺癌に対する有益性も有害性もないことがわかった。Physicians’ Healthy Study II(PHS II)では、8年間一日おきに400 IUの合成ビタミンE(180 mgのRRR-α-トコフェロールに相当)を摂取した50歳以上の14,641人の健康な男性に対して追跡調査をした(38)。これらの男性においてビタミンE摂取は前立腺癌と全ての部位の癌に対して効果がなかった。50歳以上の35,533人の健康な男性に対して前立腺癌の予防効果がないことが実証されたため、α-トコフェロールとセレニウムの同時摂取とそれぞれの単独摂取による大規模無作為化プラセボ対照介入試験(試験名称:SELECT)は近年中止となった(39,40)。この試験の5.5年後の追跡調査では、ビタミンE(一日400 IUのall-rac-α-トコフェロール)を単独摂取した被験者は統計学的に有意ではないが前立腺癌のリスクが上昇した(41)。試験中止後の解析(7年の追跡調査の中央値)によって、ビタミンE摂取群はプラセボ群と比較して前立腺癌のリスクが17%高いことが示された(42)。
病気の治療法
心疾患
観察研究によって、α-トコフェロール摂取は心疾患の治療に対して有益であることが示唆されている。例えば、冠動脈バイパス手術を受けた前歴のある男性を対象とした小規模観察研究で、一日100 IU(67 mgに相当)以下のα-トコフェロール摂取群に比べて、それ以上のα-トコフェロールを摂取した群では冠動脈アテローム性動脈硬化の進行が抑えられることが血管造影法でによる判定で判明した(43)。イギリスの無作為化プラセボ対照介入試験(CHAOS試験)では、平均18か月間400 IUまたは800 IUの合成α-トコフェロール(それぞれ180 mgと360 mgのRRR-α-トコフェロールに相当)を摂取した心臓病患者において致命的ではない心臓発作の発生が77%に低減した。しかし、α-トコフェロール摂取による心臓病の死亡率の有意な低下は認められなかった(44)。慢性腎臓透析(人工透析)患者は健常者よりも心臓病で死亡するリスクが極めて高く、酸化ストレスに曝されていることも実証されている。平均1.4年間800 IUの天然型α-トコフェロール(536 mgのRRR-α-トコフェロールに相当)を摂取した人工透析患者はプラセボ群と比較して有意に心臓病のリスクが低下した(45)。一方、その他の3つの介入試験ではα-トコフェロールによるリスク低下は認められなかった。主として癌の予防効果を調べるために実施されたATBC試験では、毎日50 mgの合成α-トコフェロール(25 mgのRRR-α-トコフェロールに相当)の摂取は過去に心臓発作を経験した患者において致命的でない心臓発作を11%低下させたが、この低下に統計的有意差はなかった(46)。同様に、心臓病患者(過去に心臓発作、脳卒中、血管障害を経験)を対象としたその他の2つの大規模試験では、400 IUの天然型α-トコフェロール(268 mgの RRR-α-トコフェロールに相当)を毎日摂取した場合(試験名称:HOPE)または300 mgの合成α-トコフェロール(150 mgのRRR-α-トコフェロールに相当)を毎日摂取した場合(試験名称:GISSI)のいずれも心臓発作や脳卒中のリスクに有意差はなかった(47,48)。血管障害または糖尿病患者による試験では、平均7年間毎日400 IUの天然型α-トコフェロールを摂取しても心血管系疾患(心筋梗塞や脳卒中)と死亡率に影響がないことが示された。注目すべきは、この試験はビタミンEを摂取する被験者において心不全のリスクをわずかに上昇させることである(49)。したがって、心臓病の治療のためにビタミンEを用いた臨床試験の大部分は有益な効果が得られていない。
臨床試験の計画を特徴づける目的で、心血管系疾患に対して高いリスクを有する患者を対象としてα-トコフェロールの用量反応試験を行った(50)。高コレステロール血症と血漿F2-イソプラスタン濃度が高値(酸化ストレスが誘導されていることを示す)の35人の男女(平均42歳)に、プラセボもしくは100、200、400、800、1,600、3,200 IUの天然型α-トコフェロール(RRR-α-トコフェロール)を16週間毎日投与した。1,600 IU以上の摂取によって有意に血漿F2-イソプラスタン濃度が低減した。被験者の酸化ストレスを軽減した一日1,600 IUの摂取はビタミンEの許容上限量(一日1,500 IU)を上回っていることに注意しなければならない(安全性を参照)。
糖尿病
糖尿病では酸化ストレスが増加しており、心血管系の合併症(心臓発作と脳卒中)が糖尿病の主な死因であるため、糖尿病患者のα‐トコフェロール摂取が提案されている。酸化ストレスのバイオマーカー(F2-イソプロスタンの尿中排泄量)が上昇している糖尿病患者に600 mgの合成α-トコフェロール(300mgのRRR-α-トコフェロールに相当)を14日間投与すると、そのバイオマーカーレベルが減少することが報告された(50)。α-トコフェロールの血中グルコース制御に及ぼす影響の研究結果は相反している。ある研究では、ビタミンEを補給すると2型糖尿病(51)と非糖尿病(52,53)患者においてインスリンの働きと糖代謝を改善することを示しているが、他の研究では2型糖尿病の糖代謝において軽度の改善または全く改善を示さないことが報告されている(54,55)。1型糖尿病(インスリン依存性)で酸化ストレスの増加も報告されている(51)。1型糖尿病患者が一日100 IUの合成型α-トコフェロール(45 mgのRRR-α-トコフェロールに相当)を一ヶ月補給することで糖化ヘモグロビンとトリグリセリドの値が大幅に改善したことが報告されている(56)。また、この研究ではα-トコフェロール摂取によって血糖値の有意な改善は認められなかったとも述べられている(57)。α-トコフェロール摂取は1型糖尿病と2型糖尿病の治療に役立つかもしれないが、十分に管理された臨床試験による証拠が不足しているのが現状である。
認知症(認知機能の障害)
脳は、アルツハイマー病のような神経変性疾患の病態に影響を与える酸化ストレスに特に脆弱である(56)。アルツハイマー患者の脳脊髄液のビタミンEレベルは低いという研究報告がある(58)。大規模プラセボ対照介入試験で、2年間毎日2,000 IUの合成α-トコフェロール(900 mg/日のRRR-α-トコフェロールに相当)を中程度の神経障害患者に投与することでアルツハイマー病による認知症の進行が有意に遅れることを発見した(59)。一方で、軽度認知症患者における3年間のプラセボ対照試験では、同様のビタミンEの投与量ではアルツハイマー病の進行に影響ないことが報告されている(60)。アルツハイマー病後の血管性認知症(脳卒中の結果として生じる認知症)はアメリカにおいて、最も一般的な認知症のタイプである。ある症例対照研究では血管性認知症の危害因子を調査し、日系アメリカ人の高齢者男性において、ビタミンEとビタミンCの摂取は血管性認知症とその他の認知症のリスクを有意に減少させたが、アルツハイマー病とは関連がないことを発見した(61)。認知症でない高齢者男性では、ビタミンEの摂取が認識力テストの高スコアと相関が認められた。これらの知見は有望ではあるが、アルツハイマー病とその他の認知症に対するα-トコフェロール補給の役割を特定するために、さらなる研究が必要である。
癌
癌細胞は急速に増殖し、アポトーシス(プログラムされた細胞死)に耐性を示す。培養細胞を用いた研究で、エステル型のビタミンEであるα-トコフェロールコハク酸エステルは様々な癌細胞に対して増殖阻害とアポトーシス誘導を示す(62,63)α-トコフェロールではなく、エステル型のα-トコフェロールコハク酸エステルが、効率的なガン細胞の増殖阻害と細胞死の誘導に必要とされる(64)。α-トコフェロールコハク酸エステルのガン細胞に及ぼす影響のメカニズムはまだ明らかでないが、エステル型は抗酸化活性を持たないという事実は抗酸化とは異なるメカニズムが寄与していることを示唆している(65)。癌の動物モデルに限ったデータで、α-トコフェロールコハク酸エステルの注射による投与で腫瘍の成長を阻害できることが示されている(66-69)が、α-トコフェロールコハク酸エステルがヒトの癌治療の有用な補助となるかどうかを決めるためには、さらに多くの研究が必要だろう。経口摂取したα-トコフェロールコハク酸エステルは腸管内でα-トコフェロールへと変換されるため、注射による投与が確実に手助けとなるだろう(70)。今のところ、ヒトにおいて経口摂取したα-トコフェロールコハク酸エステルが組織へ運ばれている証拠はない。
供給源
食料源
アメリカの食事では植物油(オリーブ油、ひまわり油、紅花油)、ナッツ類、全粒粉及び緑葉野菜に含まれているα-トコフェロールが主な供給源である。全部で8種類のビタミンE(α、β、γ、δ-トコフェロール及びトコトリエノール)は食品中で天然に存在するが、含量は異なる。食品の栄養分含量の詳細情報は、USDA食品データベースを検索すること。
サプリメント
α-トコフェロール
アメリカでは、2歳以上の人で食品(濃縮や栄養強化したものを含む)からのα-トコフェロールの平均摂取量は一日6.9 mgである(14)。これはRRR-α-トコフェロールの推奨摂取量である15 mg/日を遥かに下回っている(4)。
多くの科学者は、脂肪摂取を増やさずに、食品のみから一日に15 mg以上のα-トコフェロールを推奨量以上摂取するのは難しいと考えている。食品に含まれるすべてのα-トコフェロールはRRR-α-トコフェロール異性体の構造をとっている。ただ、サプリメントが全てそうとは限らない。ビタミンEのサプリメントは一般的に100 IUから1000 IUのα-トコフェロールを含んでいる。天然物から作られるサプリメントはRRR-α-トコフェロール(d-α-トコフェロールとも表記される)のみを含んでいる。RRR-α-トコフェロールは生体内で好んで利用される異性体であり、α-トコフェロールの中で最も生物が利用しやすい構造である。栄養強化食品と栄養補助食品でよく見られる合成α-トコフェロールは、大抵all-rac-α-トコフェロールまたはdl-α-トコフェロールと表記され、それはα-トコフェロールの異性体、全8種の混合物であることを意味している。all-rac-α-トコフェロールに存在するα-トコフェロールの異性体の半分は体では利用できないため、合成型α-トコフェロールは生物学的利用が劣っており、半分の効力しかない。サプリメント中に存在する生物学的に利用可能なα-トコフェロールのmg数を算出するには、次式を使用する。
-
RRR-α-トコフェロール(天然型またはd-α-トコフェロール):
IU × 0.67 = mg RRR-α-トコフェロール
例 100 IU = 67mg
(天然型ビタミンE 100 IUからRRR-α-トコフェロール67 mgが摂れる) -
all-rac-α-トコフェロール(合成型またはdl-α-トコフェロール):
IU × 0.45 = mg RRR-α-トコフェロール
例 100 IU = 45mg
(合成ビタミンE 100 IUからRRR-α-トコフェロール45 mgが摂れる)
α-トコフェロールコハク酸エステルとα-トコフェロール酢酸エステル(エステル型α-トコフェロール)
α-トコフェロールのサプリメントで利用可能なエステル型はα-トコフェロールコハク酸エステルとα-トコフェロール酢酸エステルである。トコフェロールエステルは保管している間、非エステル型トコフェロールよりも酸化抵抗性がある。経口摂取した時、腸内ではコハク酸または酢酸部分がトコフェロールから外れる。α-トコフェロールコハク酸エステルとα-トコフェロール酢酸エステルから生じるα-トコフェロールの生物学的利用率は遊離型のα-トコフェロールと同等である。エステル型のα-トコフェロールの国際単位(IU)は分子量から算出されるため、α-トコフェロールコハク酸エステルとα-トコフェロール酢酸エステルから生じて、体内に吸収利用されるα-トコフェロール量を換算するための係数はα-トコフェロールの係数と同じである(式を参照)(4)。α-トコフェロールではなく、エステル型のα-トコフェロールコハク酸が培養癌細胞を増殖阻害と細胞死へ効果的に誘導するのに必要とされる(病気の治療:癌を参照)。しかし、現在、ヒトが経口摂取したα-トコフェロールコハク酸エステルがα-トコフェロールコハク酸エステルとして組織に運ばれる証拠はない。
α-トコフェロールリン酸(Ester-E)
α-トコフェロールを含むサプリメントよりも、α-トコフェロールリン酸を含んでいるサプリメントの方がよりヒトにおいて効率よく吸収され、生物学的利用率が優れているという証拠はまだ発表されてない。
γ-トコフェロール
γ-トコフェロールのサプリメントやトコフェロール異性体を混合したサプリメントが市販されている(71)。トコフェロール異性体を混合したサプリメントにおけるα-トコフェロールとγ-トコフェロールの含量はそれぞれ異なるため、サプリメントのラベルを読み、トコフェロールの個々の含量を判断することが大切である。
安全性
毒性
一日2000 mg以下のα-トコフェロール(RRR-またはall-rac-α-トコフェロール)サプリメントを摂っている成人について、ごく僅かな副作用が知られている。しかし、α-トコフェロール摂取による毒性や副作用の研究のほとんどはほんの数週から数ヶ月間にわたるもので、長期的なα-トコフェロール摂取の結果として生じる副作用は十分に研究されていない。最も気になる可能性は血液凝固能の低下で、それにより人によっては出血の可能性が増加する。医学研究所の食品栄養委員会は出血の予防を根拠に、α-トコフェロールサプリメントの許容上限量(UL)を設定した(下記の表を参照)。委員会は、一日1000 mgのα-トコフェロール(1500 IU/日のRRR-α-トコフェロールまたは1100 IU/日のall-rac-α-トコフェロールに相当)は、ほぼすべての成人で出血が起こらない上限量だと考えた(4)。α-トコフェロールのある種の異性体のみが血中を循環するが、全ての異性体は吸収され、肝臓で代謝される。そのため、どのような型のα-トコフェロール(天然型でも合成品)でも吸収され、潜在的に有毒になり得る可能性があるという理論的解釈が、全てのα-トコフェロール異性体に関する許容上限摂取量(UL)策定の根拠になっている。
一部の内科医は出血のリスクを低下させるために待機手術の1ヶ月前に、高用量のビタミンE摂取の中止を勧めている。未熟児はα-トコフェロールの副作用に対して特に弱いと考えられるので、小児科医の管理の下で使用すべきである(71)。一日400 IUのビタミンE補給によって、ビタミンE欠乏症と関わりのない網膜色素変性症が進行することがわかっている(72)。
| 年齢層 | mg/日 | IU/日 d-α-トコフェロール |
|---|---|---|
| 幼児 0~12ヶ月 | 確立されていない✽ | |
| 小児 1~3歳 | 200 | 300 |
| 小児 4~8歳 | 300 | 450 |
| 小児 9~13歳 | 600 | 900 |
| 青年 14~18歳 | 800 | 1,200 |
| 成人 19歳以上 | 1,000 | 1,500 |
| ✽摂取源は食品または粉ミルクだけ | ||
ビタミンE摂取と死亡率
心臓病、末期腎不全、アルツハイマーを含む様々な病気とビタミンE摂取に関する19の臨床試験の結果をまとめたメタ解析では、成人で一日400 IU又はそれ以上のビタミンEサプリメントを摂取した人はサプリメントを摂らなかった人に比べ、死亡する可能性が6%高いことが報告されている(73)。しかしながら、ビタミンE摂取と他のビタミン・ミネラル摂取の組み合わせによって、更にリスクを分析した結果、統計学的に有意に死のリスクが増加したのは成人のULよりも高い一日2000 IUを摂取した時だけであることが分かった。その上、心血管疾患の予防や治療に対するビタミンE補給の有効性を評価するための無作為化比較試験の結果を統合した他の3例のメタ分析では、一日800 IU以下のビタミンE補給によって心血管疾患の死亡率または全死亡率が有意に増加または減少した証拠は見つかってない(74-76)。その上、最近の57の無作為化比較試験によってビタミンEの摂取量が5500 IU/日以下であれば、総死亡率に影響がないことがわかった(77)。さらに、68の無作為試験のメタ解析で、ビタミンEを単独、または他の抗酸化サプリメントと併用しても死亡のリスクに有意な変化がないことが明らかになった(78)。現時点では一日800 IU以下のビタミンE摂取であれば、心血管疾患などによって死亡する危険性が増加するという確かな証拠はない。
薬物との相互作用
抗凝血剤であるワーファリン(クマジン)、抗血小板薬であるクロピドグレル(プラビックス)やジピリダモール(ペルサチン)、非ステロイド性抗炎症薬(NSAIDs)であるアスピリンやイブロフェンなどを摂取している人は、ビタミンEサプリメントを使用すると出血のリスクが増加する可能性がある。また、抗凝血療法(抗凝血剤)を受けている人またはビタミンK欠乏の人は出血のリスクが増加するため、医師の指導なしにはα-トコフェロールサプリメントを摂取してはいけない(4)。コレスチラミン、コレスチポール、イソニアジド、ミネラルオイル、オルリスタット、スクラルファートや合成脂肪であるオレストラなどの薬物はビタミンEの吸収を低下させる可能性がある。フェノバビタール、フェニトイン、またはカルバマゼピンのような抗痙攣薬もビタミンEの血漿濃度を減少させる(4,71)。
抗酸化物質とHMG-CoAレダクターゼ阻害(スタチン)
160名の冠動脈心疾患(CHD)と低HDL値患者による3年間の無作為化比較試験によって、シンバスタチン(ゾコール)とナイアシンの組み合わせでHDL2が増加し、冠動脈狭搾症(狭小化)の進行を抑制し、心筋梗塞や脳卒中のような心血管系疾患の頻度が減少することが分かった(79)。驚いたことに、抗酸化物質(毎日1000 mgのビタミンC、800 IUのα-トコフェロール、100 mgのセレンと25 mgのβ-カロテンを摂取)と、シンバスチン-ナイアシンの組み合わせを服用した際に予防効果が減少した。しかし、20,000人以上の冠動脈狭窄症または糖尿病の男女において、シンバスチンと抗酸化物質(毎日600 mgのビタミンE、250 mgのビタミンCと20 mgのβ-カロテンを摂取)を組み合わせた大規模無作為化比較試験において、抗酸化物質の組み合わせはシンバスタチン治療の心臓保護作用に対して5年間悪影響を及ぼすことはなかった(80)。これらの相反する知見は、抗酸化物質とHMG-CoAレダクターゼ阻害剤(スタチン)のようなコレステロール降下薬間の相互作用の可能性についてさらなる研究が必要であることを示す。
ライナスポーリング研究所の推奨
成人男女におけるビタミンEの推奨摂取量(RDA)は1日15 mg(22.5 IU)である。特に、アメリカにおいて年齢2歳以上の人の90%以上が、食事だけでは一日の必要量のビタミンEを満たしていないが、高用量のビタミンE摂取が慢性疾患のリスクを減少させる決定的な証拠はない。したがって、LPIは一般的に健康な成人(19歳以上)にはマルチビタミン/ミネラルのサプリメント(30 IUの合成型ビタミンEもしくはRDAの90%のビタミンEを含む)を推奨する。 高用量のビタミンE摂取が慢性疾患のリスクを低下させるという確かな証拠はなく、また、一部の人達にはむしろ悪影響を与えるという研究報告も存在している。
高齢者(50歳以上)
ライナスポーリング研究所では、ビタミンEを含むマルチビタミン/ミネラル(MVM)サプリメントを毎日摂取することを高齢者にも推奨する。MVMは30 IUの合成型ビタミンEまたはRDAの90%を含む典型的なものとする。
Authors and Reviewers
Originally written in 2000 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in November 2004 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in June 2008 by:
Victoria J. Drake, Ph.D.
Linus Pauling Institute
Oregon State University
Reviewed in June 2008 by:
Maret G. Traber, Ph.D.
Professor of Nutrition and Exercise Sciences
Principal Investigator, Linus Pauling Institute
Oregon State University
Last updated 11/17/11 Copyright 2000-2024 Linus Pauling Institute
References
1. Traber MG. Utilization of vitamin E. Biofactors. 1999;10(2-3):115-120. (PubMed)
2. Traber MG. Vitamin E. In: Shils ME, Shike M, Ross AC, Caballero B, Cousins RJ, eds. Modern Nutrition in Health and Disease. Philadelphia: Lippincott Williams & Wilkiins; 2006:396-411.
3. Bruno RS, Leonard SW, Atkinson J, et al. Faster plasma vitamin E disappearance in smokers is normalized by vitamin C supplementation. Free Radic Biol Med. 2006;40(4):689-697. (PubMed)
4. Food and Nutrition Board, Institute of Medicine. Vitamin E. Dietary reference intakes for vitamin C, vitamin E, selenium, and carotenoids. Washington D.C.: National Academy Press; 2000:186-283. (National Academy Press)
5. Traber MG. Does vitamin E decrease heart attack risk? summary and implications with respect to dietary recommendations. J Nutr. 2001;131(2):395S-397S. (PubMed)
6. Traber MG. Vitamin E regulatory mechanisms. Annu Rev Nutr. 2007;27:347-362. (PubMed)
7. Traber MG, Elsner A, Brigelius-Flohe R. Synthetic as compared with natural vitamin E is preferentially excreted as α-CEHC in human urine: studies using deuterated α-tocopheryl acetates. FEBS Lett. 1998;437(1-2):145-148. (PubMed)
8. Christen S, Woodall AA, Shigenaga MK, Southwell-Keely PT, Duncan MW, Ames BN. γ-Tocopherol traps mutagenic electrophiles such as NO(X) and complements α-tocopherol: physiological implications. Proc Natl Acad Sci U S A. 1997;94(7):3217-3222. (PubMed)
9. Li D, Saldeen T, Mehta JL. γ-Tocopherol decreases ox-LDL-mediated activation of nuclear factor-kappaB and apoptosis in human coronary artery endothelial cells. Biochem Biophys Res Commun. 1999;259(1):157-161. (PubMed)
10. Helzlsouer KJ, Huang HY, Alberg AJ, et al. Association between alpha-tocopherol, gamma-tocopherol, selenium, and subsequent prostate cancer. J Natl Cancer Inst. 2000;92(24):2018-2023. (PubMed)
11. Jiang Q, Christen S, Shigenaga MK, Ames BN. Gamma-tocopherol, the major form of vitamin E in the US diet, deserves more attention. Am J Clin Nutr. 2001;74(6):714-722. (PubMed)
12. Traber MG. Vitamin E. In: Bowman BA, Russell RM, eds. Present Knowledge in Nutrition. 9th ed. Volume 1. Washington, D.C.: ILSI Press; 2006:211-219.
13. Ford ES, Sowell A. Serum α-tocopherol status in the United States population: findings from the Third National Health and Nutrition Examination Survey. Am J Epidemiol. 1999;150(3):290-300. (PubMed)
14. Fulgoni VL 3rd, Keast DR, Bailey, Dwyer J. Foods, fortificants, and supplements: where do Americans get their nutrients? J Nutr. 2011;141(10):18-47-1854. (PubMed)
15. Knekt P, Reunanen A, Jarvinen R, Seppanen R, Heliovaara M, Aromaa A. Antioxidant vitamin intake and coronary mortality in a longitudinal population study. Am J Epidemiol. 1994;139(12):1180-1189. (PubMed)
16. Kushi LH, Folsom AR, Prineas RJ, Mink PJ, Wu Y, Bostick RM. Dietary antioxidant vitamins and death from coronary heart disease in postmenopausal women. N Engl J Med. 1996;334(18):1156-1162. (PubMed)
17. Rimm EB, Stampfer MJ, Ascherio A, Giovannucci E, Colditz GA, Willett WC. Vitamin E consumption and the risk of coronary heart disease in men. N Engl J Med. 1993;328(20):1450-1456. (PubMed)
18. Stampfer MJ, Hennekens CH, Manson JE, Colditz GA, Rosner B, Willett WC. Vitamin E consumption and the risk of coronary disease in women. N Engl J Med. 1993;328(20):1444-1449. (PubMed)
19. Cherubini A, Zuliani G, Costantini F, et al. High vitamin E plasma levels and low low-density lipoprotein oxidation are associated with the absence of atherosclerosis in octogenarians. J Am Geriatr Soc. 2001;49(5):651-654. (PubMed)
20. Gale CR, Ashurst HE, Powers HJ, Martyn CN. Antioxidant vitamin status and carotid atherosclerosis in the elderly. Am J Clin Nutr. 2001;74(3):402-408. (PubMed)
21. McQuillan BM, Hung J, Beilby JP, Nidorf M, Thompson PL. Antioxidant vitamins and the risk of carotid atherosclerosis. The Perth Carotid Ultrasound Disease Assessment study (CUDAS). J Am Coll Cardiol. 2001;38(7):1788-1794. (PubMed)
22. Simon E, Gariepy J, Cogny A, Moatti N, Simon A, Paul JL. Erythrocyte, but not plasma, vitamin E concentration is associated with carotid intima-media thickening in asymptomatic men at risk for cardiovascular disease. Atherosclerosis. 2001;159(1):193-200. (PubMed)
23. Lee IM, Cook NR, Gaziano JM, et al. Vitamin E in the primary prevention of cardiovascular disease and cancer: the Women's Health Study: a randomized controlled trial. JAMA. 2005;294(1):56-65. (PubMed)
24. Glynn RJ, Ridker PM, Goldhaber SZ, Zee RY, Buring JE. Effects of random allocation to vitamin E supplementation on the occurrence of venous thromboembolism: report from the Women's Health Study. Circulation. 2007;116(13):1497-1503. (PubMed)
25. Sesso HD, Buring JE, Christen WG, et al. Vitamins E and C in the prevention of cardiovascular disease in men: the Physicians' Health Study II randomized controlled trial. JAMA. 2008;300(18):2123-2133. (PubMed)
26. Traber MG, Frei B, Beckman JS. Vitamin E revisited: do new data validate benefits for chronic disease prevention? Curr Opin Lipidol. 2008;19(1):30-38. (PubMed)
27. West AL, Oren GA, Moroi SE. Evidence for the use of nutritional supplements and herbal medicines in common eye diseases. Am J Ophthalmol. 2006;141(1):157-166. (PubMed)
28. A randomized, placebo-controlled, clinical trial of high-dose supplementation with vitamins C and E and β carotene for age-related cataract and vision loss: AREDS report no. 9. Arch Ophthalmol. 2001;119(10):1439-1452. (PubMed)
29. Gritz DC, Srinivasan M, Smith SD, et al. The Antioxidants in Prevention of Cataracts Study: effects of antioxidant supplements on cataract progression in South India. Br J Ophthalmol. 2006;90(7):847-851. (PubMed)
30. McNeil JJ, Robman L, Tikellis G, Sinclair MI, McCarty CA, Taylor HR. Vitamin E supplementation and cataract: randomized controlled trial. Ophthalmology. 2004;111(1):75-84. (PubMed)
31. Teikari JM, Rautalahti M, Haukka J, et al. Incidence of cataract operations in Finnish male smokers unaffected by α tocopherol or β carotene supplements. J Epidemiol Community Health. 1998;52(7):468-472. (PubMed)
32. Meydani SN, Meydani M, Blumberg JB, et al. Vitamin E supplementation and in vivo immune response in healthy elderly subjects. A randomized controlled trial. JAMA. 1997;277(17):1380-1386. (PubMed)
33. Han SN, Meydani SN. Vitamin E and infectious diseases in the aged. Proc Nutr Soc. 1999;58(3):697-705. (PubMed)
34. Meydani SN, Leka LS, Fine BC, et al. Vitamin E and respiratory tract infections in elderly nursing home residents: a randomized controlled trial. JAMA. 2004;292(7):828-836. (PubMed)
35. Slatore CG, Littman AJ, Au DH, Satia JA, White E. Long-term use of supplemental multivitamins, vitamin C, vitamin E, and folate does not reduce the risk of lung cancer. Am J Respir Crit Care Med. 2008;177(5):524-530. (PubMed)
36. Alkhenizan A, Hafez K. The role of vitamin E in the prevention of cancer: a meta-analysis of randomized controlled trials. Ann Saudi Med. 2007;27(6):409-414. (PubMed)
37. Heinonen OP, Albanes D, Virtamo J, et al. Prostate cancer and supplementation with α-tocopherol and β-carotene: incidence and mortality in a controlled trial. J Natl Cancer Inst. 1998;90(6):440-446. (PubMed)
38. Gaziano JM, Glynn RJ, Christen WG, et al. Vitamins E and C in the prevention of prostate and total cancer in men: the Physicians' Health Study II randomized controlled trial. JAMA. 2009;301(1):52-62. (PubMed)
39. Klein EA, Thompson IM, Lippman SM, et al. SELECT: the next prostate cancer prevention trial. Selenum and Vitamin E Cancer Prevention Trial. J Urol. 2001;166(4):1311-1315. (PubMed)
40. National Cancer Institute. Review of Prostate Cancer Prevention Study Shows No Benefit for Use of Selenium and Vitamin E Supplements. [Web page]. http://www.cancer.gov/newscenter/pressreleases/SELECTresults2008. Accessed 10/28/08.
41. Lippman SM, Klein EA, Goodman PJ, et al. Effect of selenium and vitamin E on risk of prostate cancer and other cancers: the Selenium and Vitamin E Cancer Prevention Trial (SELECT). JAMA. 2009;301(1):39-51. (PubMed)
42. Klein EA, Thompson IM, Jr., Tangen CM, et al. Vitamin E and the risk of prostate cancer: the Selenium and Vitamin E Cancer Prevention Trial (SELECT). JAMA. 306(14):1549-1556. (PubMed)
43. Azen SP, Qian D, Mack WJ, et al. Effect of supplementary antioxidant vitamin intake on carotid arterial wall intima-media thickness in a controlled clinical trial of cholesterol lowering. Circulation. 1996;94(10):2369-2372. (PubMed)
44. Stephens NG, Parsons A, Schofield PM, Kelly F, Cheeseman K, Mitchinson MJ. Randomised controlled trial of vitamin E in patients with coronary disease: Cambridge Heart Antioxidant Study (CHAOS). Lancet. 1996;347(9004):781-786. (PubMed)
45. Boaz M, Smetana S, Weinstein T, et al. Secondary prevention with antioxidants of cardiovascular disease in endstage renal disease (SPACE): randomised placebo-controlled trial. Lancet. 2000;356(9237):1213-1218. (PubMed)
46. Rapola JM, Virtamo J, Ripatti S, et al. Randomised trial of α-tocopherol and β-carotene supplements on incidence of major coronary events in men with previous myocardial infarction. Lancet. 1997;349(9067):1715-1720. (PubMed)
47. Yusuf S, Dagenais G, Pogue J, Bosch J, Sleight P. Vitamin E supplementation and cardiovascular events in high-risk patients. The Heart Outcomes Prevention Evaluation Study Investigators. N Engl J Med. 2000;342(3):154-160. (PubMed)
48. Gruppo Italiano per lo Studio della Sopravvivenza nell'Infarto miocardico. Dietary supplementation with n-3 polyunsaturated fatty acids and vitamin E after myocardial infarction: results of the GISSI-Prevenzione trial. Gruppo Italiano per lo Studio della Sopravvivenza nell'Infarto miocardico. Lancet. 1999;354(9177):447-455. (PubMed)
49. Lonn E, Bosch J, Yusuf S, et al. Effects of long-term vitamin E supplementation on cardiovascular events and cancer: a randomized controlled trial. JAMA. 2005;293(11):1338-1347. (PubMed)
50. Roberts LJ 2nd, Oats JA, Linton MF, et al. The relationship between dose of vitamin E and suppression of oxidative stress in humans. Free Radic Biol Med. 2007;43(10):1388-1393. (PubMed)
51. Davi G, Ciabattoni G, Consoli A, et al. In vivo formation of 8-iso-prostaglandin f2α and platelet activation in diabetes mellitus: effects of improved metabolic control and vitamin E supplementation. Circulation. 1999;99(2):224-229. (PubMed)
52. Paolisso G, D'Amore A, Giugliano D, Ceriello A, Varricchio M, D'Onofrio F. Pharmacologic doses of vitamin E improve insulin action in healthy subjects and non-insulin-dependent diabetic patients. Am J Clin Nutr. 1993;57(5):650-656. (PubMed)
53. Paolisso G, Di Maro G, Galzerano D, et al. Pharmacological doses of vitamin E and insulin action in elderly subjects. Am J Clin Nutr. 1994;59(6):1291-1296. (PubMed)
54. Paolisso G, D'Amore A, Galzerano D, et al. Daily vitamin E supplements improve metabolic control but not insulin secretion in elderly type II diabetic patients. Diabetes Care. 1993;16(11):1433-1437. (PubMed)
55. Reaven PD, Herold DA, Barnett J, Edelman S. Effects of Vitamin E on susceptibility of low-density lipoprotein and low-density lipoprotein subfractions to oxidation and on protein glycation in NIDDM. Diabetes Care. 1995;18(6):807-816. (PubMed)
56. Jain SK, McVie R, Jaramillo JJ, Palmer M, Smith T. Effect of modest vitamin E supplementation on blood glycated hemoglobin and triglyceride levels and red cell indices in type I diabetic patients. J Am Coll Nutr. 1996;15(5):458-461. (PubMed)
57. Meydani M. Antioxidants and cognitive function. Nutr Rev. 2001;59(8 Pt 2):S75-80; discussion S80-72.
58. Kontush K, Schekatolina S. Vitamin E in neurodegenerative disorders: Alzheimer's disease. Ann N Y Acad Sci. 2004;1031:249-262. (PubMed)
59. Sano M, Ernesto C, Thomas RG, et al. A controlled trial of selegiline, α-tocopherol, or both as treatment for Alzheimer's disease. The Alzheimer's Disease Cooperative Study. N Engl J Med. 1997;336(17):1216-1222. (PubMed)
60. Petersen RC, Thomas RG, Grundman M, et al. Vitamin E and donepezil for the treatment of mild cognitive impairment. N Engl J Med. 2005;352(23):2379-2388. (PubMed)
61. Masaki KH, Losonczy KG, Izmirlian G, et al. Association of vitamin E and C supplement use with cognitive function and dementia in elderly men. Neurology. 2000;54(6):1265-1272. (PubMed)
62. Yu W, Sanders BG, Kline K. RRR-α-tocopheryl succinate-induced apoptosis of human breast cancer cells involves Bax translocation to mitochondria. Cancer Res. 2003;63(10):2483-2491. (PubMed)
63. You H, Yu W, Munoz-Medellin D, Brown PH, Sanders BG, Kline K. Role of extracellular signal-regulated kinase pathway in RRR-α-tocopheryl succinate-induced differentiation of human MDA-MB-435 breast cancer cells. Mol Carcinog. 2002;33(4):228-236. (PubMed)
64. Neuzil J, Weber T, Schroder A, et al. Induction of cancer cell apoptosis by α-tocopheryl succinate: molecular pathways and structural requirements. FASEB J. 2001;15(2):403-415. (PubMed)
65. Brigelius-Flohe R, Kelly FJ, Salonen JT, Neuzil J, Zingg JM, Azzi A. The European perspective on vitamin E: current knowledge and future research. Am J Clin Nutr. 2002;76(4):703-716. (PubMed)
66. Weber T, Lu M, Andera L, et al. Vitamin E succinate is a potent novel antineoplastic agent with high selectivity and cooperativity with tumor necrosis factor-related apoptosis-inducing ligand (Apo2 ligand) in vivo. Clin Cancer Res. 2002;8(3):863-869. (PubMed)
67. Malafa MP, Fokum FD, Mowlavi A, Abusief M, King M. Vitamin E inhibits melanoma growth in mice. Surgery. 2002;131(1):85-91. (PubMed)
68. Malafa MP, Neitzel LT. Vitamin E succinate promotes breast cancer tumor dormancy. J Surg Res. 2000;93(1):163-170. (PubMed)
69. Quin J, Engle D, Litwiller A, et al. Vitamin E succinate decreases lung cancer tumor growth in mice. J Surg Res. 2005;127(2):139-143. (PubMed)
70. Cheeseman KH, Holley AE, Kelly FJ, Wasil M, Hughes L, Burton G. Biokinetics in humans of RRR-α-tocopherol: the free phenol, acetate ester, and succinate ester forms of vitamin E. Free Radic Biol Med. 1995;19(5):591-598. (PubMed)
71. Hendler SS, Rorvik DR, eds. PDR for Nutritional Supplements. Montvale: Medical Economics Company, Inc; 2001.
72. Berson EL, Rosner B, Sandberg MA, et al. A randomized trial of vitamin A and vitamin E supplementation for retinitis pigmentosa. Arch Ophthalmol. 1993;111(6):761-772. (PubMed)
73. Miller ER, Pastor-Barriuso R, Dalal D, Riemersma RA, Appel LJ, Guallar E. Meta-analysis: high-dosage vitamin E supplementation may increase all-cause mortality. Ann Intern Med. 2005;142(1):37-46. (PubMed)
74. Shekelle PG, Morton SC, Jungvig LK, et al. Effect of supplemental vitamin E for the prevention and treatment of cardiovascular disease. J Gen Intern Med. 2004;19(4):380-389. (PubMed)
75. Eidelman RS, Hollar D, Hebert PR, Lamas GA, Hennekens CH. Randomized trials of vitamin E in the treatment and prevention of cardiovascular disease. Arch Intern Med. 2004;164(14):1552-1556. (PubMed)
76. Abner EL, Schmitt FA, Mendiondo MS, Marcum JL, Kryscio RJ. Vitamin E and all-cause mortality: a meta-analysis. Curr Aging Sci. 2011; 4(2):158-170 (PubMed)
77. Vivekananthan DP, Penn MS, Sapp SK, Hsu A, Topol EJ. Use of antioxidant vitamins for the prevention of cardiovascular disease: meta-analysis of randomised trials. Lancet. 2003;361(9374):2017-2023. (PubMed)
78. Bjelakovic G, Nikolova D, Gluud LL, Simonetti RG, Gluud C. Mortality in randomized trials of antioxidant supplements for primary and secondary prevention: systematic review and meta-analysis. JAMA. 2007;297(8):842-857. (PubMed)
79. Brown BG, Zhao XQ, Chait A, et al. Simvastatin and niacin, antioxidant vitamins, or the combination for the prevention of coronary disease. N Engl J Med. 2001;345(22):1583-1592. (PubMed)
80. Collins R, Peto R, Armitage J. The MRC/BHF Heart Protection Study: preliminary results. Int J Clin Pract. 2002;56(1):53-56. (PubMed)
チアミン
目次
要約
-
チアミンの活性化形態であるチアミンピロリン酸(TPP)は、炭水化物、分岐鎖アミノ酸、および脂肪酸の代謝に関連するいくつかの酵素機能に関わっている。(詳細はこちら)
-
重篤なチアミン欠乏症は、中枢および末梢神経系を含む多数の器官系に影響する疾患である脚気を起こす。(詳細はこちら)
-
ウェルニッケ脳症は、チアミン欠乏症に次いで起こる急性神経障害である。ウェルニッケ・コルサコフ症候群は脳症に関連した症状とともに、記憶の形成が永続的に変質してしまう。(詳細はこちら)
-
チアミン欠乏症は貧弱な食事性摂取、不適切な非経口栄養の提供、胃腸での吸収低下、代謝需要の増加、またはチアミンの喪失過剰によって起こることがある。先進国では、慢性的アルコール摂取がチアミン欠乏症の第一の原因である。(詳細はこちら)
-
糖尿病患者ではブドウ糖代謝の変化が血漿チアミン濃度の低下と関連付けられてきた。チアミン欠乏症を治すことは、糖尿病患者の血管合併症リスクを下げるかもしれない。(詳細はこちら)
-
チアミン欠乏症とチアミン依存性酵素の活性低下は、アルツハイマー病と関連がある。チアミン欠乏症の動物モデルはチアミン補給によって顕著に認知障害が回復したが、アルツハイマー病患者へのチアミン補給の効果は未だにわかっていない。(詳細はこちら)
-
利尿剤に誘発されたチアミンの排泄は、うっ血性心不全患者のチアミン欠乏症リスクや疾患の重篤度を上げるかもしれない。この疾患の管理にチアミン補給を取り入れる評価をするさらなる研究が必要である。(詳細はこちら)
チアミンは別名がビタミンB1またはアノイリンという水溶性ビタミンBである(1)。1930年代に単離され特性が明らかにされたチアミンは、ビタミンとして認知された初期の有機化合物の一つである(2)。人体ではチアミンは遊離チアミンとして、また様々なリン酸化された形態で存在する。それらはチアミン一リン酸(TMP)、チアミン三リン酸(TTP)、およびチアミンピロリン酸(TPP)、別名チアミン二リン酸である。
機能
補酵素機能
遊離チアミンからTPPを合成するには、マグネシウム、アデノシン三リン酸(ATP)、およびチアミンピロホスホキナーゼという酵素が必要である。TPPは、炭水化物や分岐鎖アミノ酸の代謝に関連する4つの多成分酵素複合体の補酵素として必要である。
ピルビン酸脱水素酵素、αケトグルタル酸脱水素酵素、および分岐鎖αケト酸脱水素酵素(BCKDH)は、ミトコンドリアと呼ばれる細胞小器官内に見られるそれぞれ異なる酵素複合体を構成する。それらはピルビン酸、αケトグルタル酸、および分岐鎖アミノ酸の脱炭酸反応を触媒し、それぞれアセチル補酵素A(アセチルCoA)、スクシニルCoA、および分岐鎖アミノ酸誘導体を生成する。これらのすべては、クエン酸回路(クレブス回路)への関わりで食物からエネルギーを生成することに決定的な役割をしている(2)。ロイシン、イソロイシン、およびバリンを含む分岐鎖アミノ酸(BCAA)は最終的にアセチルCoAとスクシニルCoAに分解され、クエン酸回路を促進する。これら3つのBCAAの異化作用はコレステロールの生成にも関わり、神経伝達物質であるグルタミン酸とガンマアミノ酪酸(GABA)の合成のための窒素を提供する(3)。各々の脱水素酵素複合体はチアミン補酵素(TPP)に加えて、ナイアシン含有補酵素(NAD)、リボフラビン含有補酵素(FAD)、およびリポ酸を必要とする。
トランスケトラーゼは、サイトゾル(細胞基質)で起こるペントースリン酸経路(五炭糖リン酸回路)として知られる別の代謝回路の重要な反応を触媒する。この経路における最も重要な中間体の一つは、ATPやグアノシン三リン酸(GTP)などの高エネルギーリボヌクレオチドの合成に必要な五炭糖リン酸であるリボース-5-リン酸である。ヌクレオチドは、核酸、DNA、およびRNAの構成要素である。ペントースリン酸経路はまた、脂肪酸合成を含む様々な同化経路にナイアシン含有補酵素のNADPHを供給し、これは多くの生合成反応に必須である(1, 4)。トランスケトラーゼはチアミン欠乏症の初期に減少し、ほとんどのチアミン依存性酵素と違って赤血球に存在するので、赤血球におけるその活性の測定がチアミンの栄養状態の評価に使用されている(2)。
欠乏症
重篤なチアミン欠乏症から起こる脚気は、紀元前2600年もの早期に中国の文献に記載された。チアミン欠乏症は、心血管系、神経系、筋肉系、消化器系、および中枢抹消神経系に影響する(2)。重篤なチアミン欠乏症で影響を受ける系によって、脚気は乾性脚気、湿性脚気、脳性脚気、または胃腸の脚気にさらに分けられる(1, 5)。
乾性脚気
乾性脚気(麻痺性または神経性脚気)の主な特徴は、神経障害である。神経障害の初期には、「灼熱足症候群」が起こるかもしれない。その他の症状には、異常な(不自然な)反射や感覚の衰え、および足や腕の脱力感などがある。筋肉痛や圧痛、およびしゃがんだ体勢からの起立困難も観察されている(6)。
湿性脚気
神経性の症状に加えて、湿性脚気(心臓性の脚気)はチアミン欠乏症の心血管性兆候が特徴的であり、これには頻脈、心臓肥大、ひどい腫れ(浮腫)、呼吸困難、および究極的にはうっ血性心不全などを含む。日本の文献では、急性の劇症性湿性脚気を「衝心」と記載している(7)。
脳性脚気
脳性脚気はウェルニッケ脳症やコルサコフ精神病に至るかもしれず、アルコールを乱用する者は特にそうである。ウェルニッケ脳症の診断は「三徴候」に基づき、これは異常な眼球運動、姿勢や歩行の運動失調、および認知障害を含む。未治療のままだと、不可逆性の神経性ダメージがコルサコフ精神病として知られるさらなる臨床的兆候を引き起こすことがある。この症候群はコルサコフ認知症、コルサコフ記憶喪失、または健忘作話症候群とも呼ばれるが、混乱したり無関心な状態や、重篤な記憶喪失や最近の記憶および作業記憶の喪失を伴う深刻な記憶障害を含む。
中枢神経系に影響するチアミン欠乏症は、記憶喪失状態がない場合はウェルニッケ病と、記憶喪失症状があり眼球運動や歩行障害がある場合はウェルニッケ・コルサコフ症候群(WKS)と呼ばれる。より稀な神経性兆候には、痙攣発作も含まれることがある(8)。WKS患者のほとんどはアルコール中毒者であるが、胃がんやAIDSを含むその他の全体的栄養失調障害でも観察されている。WKS患者にチアミンの静脈投与をすると一般的に眼球の症状が迅速に改善するが、症状がどれほど長く続いたかによって、運動協調や記憶の面での改善はそれより軽いかもしれない。脳内で選択的に損傷を受けた領域での免疫細胞の活性が高まりフリーラジカルの生成が増えるというエビデンス(科学的根拠)から、チアミン欠乏症の神経性病理には酸化ストレスが重要な役割を果たしていることが示唆される(9)。
胃腸の脚気
TPPは解糖系およびクエン酸回路でブドウ糖を利用する代謝反応に決定的に重要である(図1参照)。チアミン依存性酵素の活性低下はピルビン酸からアセチルCoAへの変換とクエン酸回路の利用を制限し、ピルビン酸と乳酸の蓄積につながる。乳酸の蓄積から起こる乳酸アシドーシスはしばしば、胃腸の脚気として記載される症候群の吐き気、嘔吐、および重い腹痛に関連している(5)。
チアミン欠乏症の原因
チアミン欠乏症は、不適切なチアミン摂取、チアミン必要量の増加、体からのチアミンの喪失過剰、食物中の抗チアミン因子の摂取、またはこれらの要因の組み合わせで起こるかもしれない。
不適切な摂取
発展途上国では、不適切なチアミン摂取がチアミン欠乏症の主要な原因である(2)。チアミン欠乏症は、食事に炭水化物が多くチアミンが少ない(たとえば精米や白米など)低収入の集団で一般的である。チアミン欠乏症の母に母乳で育てられた乳児は、乳児脚気を発症しやすい。先進国では、その他の栄養素とともにチアミンの低摂取に関連するアルコール中毒が、チアミン欠乏症の第一の原因である。WKSに伴う非アルコール性症状には、食欲不振、肥満外科手術(減量手術)、胃腸の悪性腫瘍、および吸収不全症候群などがある(10~13)。ウェルニッケ脳症の症例は、ビタミン補給を欠いた非経口栄養法とも関連付けられてきた(14, 15)。
必要量の増加
チアミンの必要量増加を起こす状態には、激しい身体運動、発熱、妊娠、授乳、および思春期の成長などがある。そのような状態は、チアミン摂取がぎりぎりの者をチアミン欠乏症の症状発症のリスクにさらす。東南アジアのマラリア患者は、感染していない者に比べてチアミン欠乏症である頻度が高いことがわかっている(16, 17)。マラリア感染は、ブドウ糖の代謝的必要量を大きく増加させる。チアミンはブドウ糖代謝に関わる酵素に必要であるので、すでになりやすくなっている者のチアミン欠乏症が、マラリア感染で起こるストレスによって悪化するかもしれない。AIDSを発症してもしていなくても、HIV感染者はチアミン欠乏症リスクが高いことがわかっている(18)。さらに、慢性的アルコール乱用はチアミンの腸での吸収と利用を損なう(1)。したがって、アルコール中毒者はチアミン必要量が高くなる。チアミン欠乏症は、再栄養症候群の合併症としても見られる。すなわち、重症な飢餓の者に炭水化物を与えると、解糖系においておよびチアミン欠乏症を促進するクエン酸回路において、チアミンの必要量が増えることになる(19)。
喪失過剰
チアミンの喪失過剰は、チアミン欠乏症を促進するかもしれない。尿流を増やすことで、利尿剤は腎臓でのチアミン再吸収を妨げて尿中への排泄を増やすかもしれない(20, 21)。チアミン摂取がぎりぎりの状態で利尿剤治療を受けている患者(22)と、長期間の利尿治療を受けている者(23)のチアミン欠乏症リスクは上昇する。血液透析を必要とする腎不全の者はチアミンを高い割合で喪失し、チアミン欠乏症リスクがある(24)。液体の高摂取と高尿流率を維持しているアルコール中毒者も、チアミン喪失が増えて低チアミン摂取による作用を悪化させるかもしれない(25)。
抗チアミン因子(ATF)
食物中の抗チアミン因子(ATF)の存在も、チアミン欠乏症リスクに寄与する。ある種の植物はATFを含むが、これはチアミンと反応し、酸化された不活性の生成物を作る。紅茶やコーヒー(カフェイン抜きも含む)の大量摂取、および茶葉やビンロウジュを噛んだりすることは、それに含まれるATFが原因でヒトのチアミン枯渇と関連づけられてきた(26, 27)。ATFにはマイコトキシン(カビ毒)や、食物のチアミンを分解するチアミナーゼも含まれる。習慣的に特定の生の淡水魚、生の貝や甲殻類、およびシダを摂取する者は、チアミン欠乏症リスクが高い。なぜならこれらの食物は、通常は調理の熱で不活性化されるチアミナーゼを含むからである(1)。ナイジェリアでは、一部のナイジェリア人にとって伝統的高タンパク質食物であるアフリカカイコに含まれるチアミナーゼで促進された急性の神経性症候群(季節性運動失調)が、チアミン欠乏症と関連付けられてきた(28)。
推奨量 (RDA)
1998年に米国医学研究所の食品栄養委員会によって改訂されたチアミンのRDAは、全般的に健康な者の欠乏症を予防することに基づいている(表1)(29)。
疾病予防
白内障
49歳以上のオーストラリア人男女2,900人による横断研究で、チアミン摂取が最も多い五分位の者は最も少ない五分位の者に比べて、核性白内障に40%なりにくいことがわかった(30)。また408人の米国人女性による最近の研究で、チアミンの食事性摂取がより多いことは水晶体の混濁形成における5年間の変化と逆相関があったことがわかった(31)。しかしこれらの横断的関連は、因果関係の研究でまだ明らかになっていない。
糖尿病と血管合併症
健康な者にくらべてチアミンの血漿濃度が低く腎クリアランスが高いことが、糖尿病患者において観察される(32)。このことから1型または2型の糖尿病の者は、チアミン欠乏症リスクが高いことが示唆される。2つのチアミン輸送体であるチアミン輸送体-1(THTR-1)とチアミン輸送体-2(THTR-2)は、小腸の腸細胞によるチアミンの取り込みと腎臓の近位尿細管における再取り込みに関わっている。糖尿病患者の高血糖状態は、腎臓でのチアミン輸送体の発現を減らすことでチアミンの再取り込みに影響するのではないかと、最近の研究で示唆された(33)。逆にチアミン欠乏症は膵臓の正常な内分泌機能を損ない、高血糖を悪化させるようである。初期の研究では、チアミン欠乏症ラットの膵臓内分泌細胞におけるインスリン合成や分泌が変化していることが示された(34, 35)。ヒトでは、THTR-1を符号化する遺伝子の劣性突然変異によるチアミン欠乏症によって、チアミン反応性巨赤芽球性貧血症候群における糖尿病に至る(「代謝疾患」の項参照)。
無作為化二重盲検予備研究で、高用量チアミンのサプリメント(300 mg/日)が高血糖の者(耐糖能障害または新規に2型糖尿病と診断された者)に6週間与えられた。チアミン補給はプラセボ治療に比べて空腹時血糖やインスリン濃度がさらに上がることを防いだが、高血糖を減らせなかった(36)。しかしある研究では、チアミン補給が2型糖尿病の初期段階(すなわち糖尿病前症または初期糖尿病)における空腹時血糖濃度を改善させるかもしれないことが示された(37)。
糖尿病の者の慢性的高血糖は、微小血管疾患の病因となる。糖尿病に関係した血管損傷は、心臓(心筋症)、腎臓(腎症)、網膜(網膜症)、および末梢神経系(神経症)に影響を与えうる。糖尿病患者では、血管の成長に非常に重要な骨髄由来の内皮前駆細胞(EPC)の機能を高血糖が変えてしまう(38)。興味深いことに2型糖尿病の88人の者において、食事からの毎日のチアミン摂取が多いと体内循環のEPCが多くなり、血管内皮の健康状態が良いという相関があった(39)。糖尿病患者の血漿チアミン濃度と、血管の機能障害のマーカーである可溶性血管細胞接着分子-1(sVCAM-1)の存在の逆相関も見つかっている(32, 40)。糖尿病性腎症の初期のマーカーは尿中の血清アルブミンの存在で、微量アルブミン尿症として知られている。チアミンまたはベンフォチアミン(チアミンの誘導体)の投与によって、化学的誘発性糖尿病のラットが腎臓の合併症を発症することが防がれた(41)。微量アルブミン尿症のある40人の2型糖尿病患者による無作為化二重盲検研究で、高用量のチアミン補給(300 mg/日)によって、3ヶ月間に渡って尿中へのアルブミン排泄がプラセボに比べて減ったことがわかった(40)。培養細胞や動物モデルではチアミンによる治療が有望な結果を示している(42~44)ため、血管性の合併症に対するチアミンとその誘導体の効果が糖尿病患者で調べられるべきである。
疾病治療
アルツハイマー病
年配者の中には不適切な食事性摂取、胃腸での吸収の減少、および様々な医学的症状によって、無症状性のチアミン欠乏症を発症するリスクが高い者もいる(45, 46)。チアミン欠乏症は認知症(ウェルニッケ・コルサコフ症候群)という形態に至ることもあるので、アルツハイマー病(AD)やその他の形態の認知症との関係が調べられてきた。ADは年配者の認知機能低下が特徴的で、βアミロイド斑の沈着やリン酸化されたタウタンパク質で形成された線維のもつれ(神経原線維変化)を含む病理学的特徴を伴う(47)。陽電子放射断層撮影法(PET)によるスキャンの使用で、AD患者の脳内でブドウ糖代謝が低下していることが観察された(48)。放射標識されたブドウ糖の類似体であるフッ素18-フルオロデオキシグルコース(FDG)を使用した大規模多機関PET研究で、AD患者のFDG取り込み(ブドウ糖代謝の代替マーカー)の減少と認知障害の程度とが相関付けられた。認知的に正常な者(229人)、軽度認知障害のある者(405人)、または軽度のAD(188人)である55歳超の822人の被験者を含むこの研究で、軽度認知障害からADへの進行を脳のブドウ糖利用から予想できるのではないかということが示された(49)。興味深いことに、年配者(55歳超)における糖尿病とAD発症リスクの上昇が、9年間の縦断的研究で関連付けられた(50)。
脳内でのチアミン依存性プロセスの低下が、AD患者のブドウ糖代謝の変化と関係があるかもしれない(51)。38人の年配女性の症例対照研究で、血中チアミン、TPP、およびTMP濃度が、アルツハイマー型認知症(DAT)の者は対照群の者に比べて低かったことがわかった(52)。さらに、ADで亡くなった患者の脳内でTPP依存性酵素であるαケトグルタル酸脱水素酵素とトランスケトラーゼの活性が低下していたというエビデンスを、数人の研究者が発見した(53)。遊離チアミンとTMP濃度が正常であるのに脳内のTPP濃度が低いという発見は、チアミンの生物学的利用性が悪いというよりもTPP合成に変化があることを示唆していた。しかし、AD患者はTPP代謝酵素(チアミンピロホスホキナーゼを含む)の活性が変化しているのかどうかは明らかでない(54, 55)。ADのマウスモデルでは、チアミン誘導体であるベンフォチアミンの慢性的投与によって、脳内のTMPやTPP濃度を上げることなく認知的変化が和らいでβアミロイド斑の数が減った。このことは、脳でのベンフォチアミンの有益な効果はTPPに依存しない経路の刺激によって仲介されているであろうことを示唆していた(56)。
チアミン欠乏症は、培養神経細胞内のβアミロイド生産の増加と、動物モデルでのプラーク形成に関連付けられてきた(57, 58)。これらのADの病理学的特徴はチアミン補給で元に戻せる可能性があり、このことはチアミンがADを防ぐ可能性を示唆している。さらに、ミトコンドリアの機能障害や慢性的酸化ストレスを含むその他の障害は、チアミン欠乏症とADの病因および進行に関連付けられてきた(9, 59)。現在のところチアミン補給がADに有益であるというエビデンスはわずかで、一貫性がない。15人の患者(10人が研究を最後まで受けた)による二重盲検プラセボ対照研究で、12ヶ月にわたって3グラム/日のチアミン補給をしても、認知機能低下に何の有益な効果もなかったと報告された(60)。別の研究の予備報告でDATに対する3~8グラム/日のチアミン補給の緩やかな効果が主張されたが、この研究からの追加的データは利用可能となっていない(61)。AD患者に対する緩やかに有益な効果が、100 mg/日のチアミン誘導体(チアミンテトラヒドロフルフリルジスルフィド)による12週間の治療後に報告されたが、この研究はプラセボ対照研究ではなかった(62)。DAT患者へのチアミン使用による無作為化二重盲検プラセボ対照試験のシステマティックレビュー(総括)で、アルツハイマー病の症状に対してチアミンが有益な治療法であるとするエビデンスは見つからなかった(63)。
うっ血性心不全 (CHF)
重篤なチアミン欠乏症(湿性脚気)は心臓機能障害に至り、究極的にはうっ血性心不全(CHF)になる。先進国では脚気の症状が心臓に現れることは稀であるが、その他の原因によるCHFは一般的であり、特に年配者においてそうである。CHF治療に使用される利尿剤、とりわけフロセミドはチアミン排泄を増やすことがわかっており、チアミン欠乏症ぎりぎりになる可能性がある(64)。多くの研究でCHF患者のチアミンの栄養状態が調べられ、トランスケトラーゼ活性アッセイ(測定法)で測定された結果から、そのほとんどでチアミン欠乏症の発生率がかなり高いとわかった。一般的な集団と同様に、年配のCHF患者は若い者よりチアミン欠乏症リスクが高い(65)。CHFにおける心臓機能の重要な測定は左室駆出率(LVEF)で、これは心臓超音波検査(心エコー)で評価できる。25人の患者によるある研究で、フロセミドを80 mg/日以上の用量で使用することと98%というチアミン欠乏症罹患率との関連があったことがわかった(23)。フロセミド(80 mg/日)を少なくとも3ヶ月間服用した30人のCHF患者による無作為化二重盲検研究で、静脈投与によるチアミン治療(200 mg/日)を7日間行ったところ、静脈へのプラセボ投与に比べてLVEFが改善した(66)。その研究の30人のCHF患者全員が続けて経口チアミン治療(200 mg/日)を6週間受けたところ、平均LVEFが22%改善した。LVEFの改善はCHF患者の生存率上昇と関連があることから、この発見は関連しているかもしれない(67)。しかし、研究のサンプル数の少なさ、いくつかの研究における無作為性の欠如、およびチアミンの栄養状態のより精密な測定の必要性から、今日までに出版された研究の結論は限定的である。目下のところ、CHF患者の心臓機能の維持におけるチアミン補給の必要性は、今だに議論のあるところである。
がん
急速に成長する腫瘍のあるがん患者の中には、チアミン欠乏症が見られることがある。培養細胞や動物モデルによる研究では、急速に分裂しているがん細胞はチアミンの必要量が多いことが示されている(68)。急速に分裂するすべての細胞は高率で核酸を必要とし、がん細胞の中には核酸合成に必要なリボース-5-リン酸を提供するTPP依存性酵素のトランスケトラーゼに大きく依存しているように見えるものもある。最近の研究でTHTR-1、トランスケトラーゼ、およびミトコンドリアのTPP輸送体の濃度がヒトの乳がん組織標本で正常な組織に比べて高いことがわかり、これはがんの代謝を支えるチアミンの恒常性における適応を示唆している(69)。がん患者のチアミン補給はチアミン欠乏症を防ぐために一般的であるが、ボロスらは過剰なチアミンは実際のところいくつかの悪性腫瘍の成長を促すかもしれないと注意している(70)。このことは、実際にチアミン欠乏症のがん患者へのチアミン補給は控えめであるべきだと示唆している。現在はこの理論を裏付けたり論駁したりするヒトでの研究からのエビデンスはない。しかし、チアミン補給を考えているがん患者は、彼らのがん治療を管理する医師と話し合うことが賢明であろう。
代謝疾患
チアミン補給は、炭水化物や分岐鎖アミノ酸(BCAA)の代謝に影響する遺伝子疾患の臨床管理に含められている。
チアミン反応性ピルビン酸脱水素酵素複合体(PDHC)欠損症
PDHCにおける突然変異は、それを患う者の効率的な炭水化物酸化を妨げる。PDHC欠損症は、乳酸アシドーシス、神経変性および神経筋変性、および幼児期の死亡が一般的な特徴である。チアミン治療(数mg/日から1,000 mg/日の用量まで)に反応する患者は、PDHCのTPPに対する親和性が低下していることからPDHC欠損症を呈する(71, 72)。ビタミン補給で乳酸の蓄積を減らしてチアミン反応性患者の臨床的症状を改善できるが、それは治癒ではない(73)。
メープルシロップ尿症
BCAA代謝の先天異常は、チアミン反応性分岐鎖ケト酸尿症、別名メープルシロップ尿症を起こす。BCAAの異化経路の変化は、BCAAとその誘導体である分岐鎖ケト酸(BCKA)の蓄積によって起こる神経機能障害に至る。治療方法にはBCAA含有量を減らした合成食があり、BCKDH複合体のE2サブユニットに突然変異がある患者にはチアミン(10~1,000 mg/日)が補給される(74)。チアミン反応性の者には、BCAA制限食に頼らずともその表現型を治すためにチアミン補給が有効であることが証明されている。
チアミン反応性巨赤芽球性貧血
腸でのチアミンの取り込みを損ないチアミン欠乏症を起こすTHTR-1の変異が、チアミン反応性巨赤芽球性貧血の患者で見つかっている。この症候群は巨赤芽球性貧血、糖尿病、および聴覚喪失が特徴的である。30の症例のレビューで、追加的な神経性、視覚性、および心臓性の障害が報告された(75)。経口用量のチアミン(最大300 mg/日)で、思春期前の子供の健康を維持し高血糖を治せる。しかし思春期後では膵臓機能の低下によって、高血糖を制御するためにインスリンとともにチアミンも必要となる。ある研究では、生後4ヶ月の女児を100 mg/日のチアミンで治療しても、生後20ヶ月の段階で聴覚喪失を防げなかったことも報告された(76)。
ビオチン反応性大脳基底核疾患
ビオチン反応性大脳基底核疾患、別名チアミン代謝機能不全症候群2は、THTR-2を符号化する遺伝子の突然変異によって起こる。臨床的兆候は3~4歳ごろから現れ、亜急性脳症(混乱、眠気、意識レベルの変化)、運動失調、および痙攣発作を含む。サウジアラビアの同じ家族または部族出身の18人の患者による後ろ向き研究が、最近行われた。そのデータから、ビオチン単独療法(5~10 mg/kg/日)でその疾患の臨床的兆候が効率的に消失したが、3分の1の患者が急性発作の再発を患った。結果がうまくいかないこともしばしばであるが、チアミン補給では開始時(300~400 mg/日)も5年間の追跡期間後も、急性発作は見られなかった。早期の診断とビオチンおよびチアミンでの早急な治療が良い結果を生む(77)。
摂取源
ヒトは食事性の摂取源から、および結腸の正常な細菌叢からチアミンを得ているが、体のチアミン必要量に対する後者の寄与はよくわからない(78)。
食物の摂取源
様々な食事によって、ほとんどの者は欠乏症を予防できるだけの適切なチアミンを得られる。米国では若い成人男性の平均食事性チアミン摂取量は約2 mg/日で、若い成人女性では1.2 mg/日であった。60歳超の者の調査では、平均食事性チアミン摂取量は男性で1.4 mg/日、女性で1.1 mg/日であることがわかった(29)。しかし施設に入所することや貧困で、年配者のチアミン摂取が不適切になりやすい(79)。全粒穀物、豆類(インゲン豆やレンズ豆など)、ナッツ、赤身の豚肉、およびイーストはチアミンの豊富な摂取源である(1)。チアミンのほとんどは精白小麦粉や精白米の精製で失われてしまうので、多くの西洋諸国では小麦粉から作られた食品(パンやパスタなど)や白米はチアミンが強化されている。チアミンの豊富な食物を、ミリグラム(mg)で表記したチアミン含有量とともに表2に示す。食物の栄養素含有量についての詳細は、USDA(米国農務省)の食品成分データベースを検索のこと(80)。
サプリメント
チアミンは栄養サプリメントに含まれており、また塩酸チアミンや硝酸チアミンとして強化に利用される(81)。
安全性
毒性
食品栄養委員会はチアミンの許容上限摂取量(UL)を設定しなかった。これは、食物に含まれるチアミンまたは長期の経口補給(最大で200 mg/日)のチアミンの過剰摂取によるよく知られた中毒作用がないからである。チアミンの大用量静脈投与で、命に関わるアナフィラキシー反応が少数見られた(29)。
薬物相互作用
血中チアミン濃度が下がることが、発作性疾患(てんかん)で長期間抗けいれん薬であるフェニトインを摂取した者について報告された(82)。がんの治療で使用される薬物である5-フルオロウラシルは、チアミンからTPPへのリン酸化を阻害する(83)。利尿剤、特にフロセミドは、チアミン摂取がぎりぎりである者がチアミン欠乏症になるリスクを、チアミンの尿中排泄が増えることによって上げるかもしれない(21)。また慢性的なアルコール乱用は、食事性摂取が少ないことや、吸収や利用が損なわれることや、ビタミンの排泄が増えることによって、チアミン欠乏症と関連がある(1)。ラットに慢性的にアルコールを与えると、腸管上皮におけるチアミンの膜輸送体THTR-1の阻害に関連するチアミンの積極的吸収が減ることが示された(84)。ラットのアルコール摂取は腎臓上皮細胞におけるTHTR-1とTHTR-2の濃度を減らし、それによって腎臓のチアミン再取り込みが制限されてしまう(85)。
ライナス・ポーリング研究所の推奨
ライナス・ポーリング研究所は、男性で1,2 mg/日、女性で1.1 mg/日という食品栄養委員会の推奨を支持する。ほとんどの者に十分なチアミンが、様々な食事によって得られるはずである。一日所要量(DV)の100%を含むマルチビタミン/ミネラルのサプリメントを毎日摂取するというライナス・ポーリング研究所の推奨に従えば、少なくとも1.5 mg/日のチアミンが確実に摂取できるであろう。
年配者(50歳超)
現在、年配者のチアミン必要量が増えるというエビデンスはないが、不適切な食事性摂取やチアミンの不足が年配者の集団でより一般的であることがいくつかの研究でわかっている(79)。したがって、年配者はマルチビタミン/ミネラルのサプリメントを摂取することが賢明であり、それによって一般的に少なくとも1.5 mg/日のチアミンが得られる。
Authors and Reviewers
Originally written in 2000 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in September 2002 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in June 2007 by:
Victoria J. Drake, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in June 2013 by:
Barbara Delage, Ph.D.
Linus Pauling Institute
Oregon State University
Reviewed in July 2013 by:
Christopher Bates, D.Phil.
Honorary Senior Scientist
Formerly Head of Micronutrient Status Research
MRC Human Nutrition Research
Elsie Widdowson Laboratory
Cambridge, UK
Copyright 2000-2024 Linus Pauling Institute
References
1. Tanphaichitr V. Thiamin. In: Shils M, Olson JA, Shike M, Ross AC, eds. Modern Nutrition in Health and Disease. 9th ed. Baltimore: Williams & Wilkins; 1999:381-389.
2. Rindi G. Thiamin. In: Ziegler EE, Filer LJ, eds. Present Knowledge in Nutrition. 7th ed. Washington D.C.: ILSI Press; 1996:160-166.
3. Hutson SM, Sweatt AJ, Lanoue KF. Branched-chain [corrected] amino acid metabolism: implications for establishing safe intakes. J Nutr. 2005;135(6 Suppl):1557S-1564S. (PubMed)
4. Brody T. Nutritional Biochemistry. 2nd ed. San Diego: Academic Press; 1999.
5. Donnino M. Gastrointestinal beriberi: a previously unrecognized syndrome. Ann Intern Med. 2004;141(11):898-899. (PubMed)
6. McDowell L. Thiamin. In: Vitamins in Animal and Human Nutrition. 2nd ed. Ames: Iowa State University Press; 2000:265-310. Available at: http://www.ucv.ve/fileadmin/user_upload/facultad_agronomia/Producion_Animal/Vitamins_in_Animal_and_Human_Nutrition.pdf
7. Yamasaki H, Tada H, Kawano S, Aonuma K. Reversible pulmonary hypertension, lactic acidosis, and rapidly evolving multiple organ failure as manifestations of shoshin beriberi. Circ J. 2010;74(9):1983-1985. (PubMed)
8. Doss A, Mahad D, Romanowski CA. Wernicke encephalopathy: unusual findings in nonalcoholic patients. J Comput Assist Tomogr. 2003;27(2):235-240. (PubMed)
9. Hazell AS, Faim S, Wertheimer G, Silva VR, Marques CS. The impact of oxidative stress in thiamine deficiency: a multifactorial targeting issue. Neurochem Int. 2013;62(5):796-802. (PubMed)
10. Saad L, Silva LF, Banzato CE, Dantas CR, Garcia C, Jr. Anorexia nervosa and Wernicke-Korsakoff syndrome: a case report. J Med Case Rep. 2010;4:217. (PubMed)
11. Becker DA, Balcer LJ, Galetta SL. The Neurological Complications of Nutritional Deficiency following Bariatric Surgery. J Obes. 2012;2012:608534. (PubMed)
12. Jung ES, Kwon O, Lee SH, et al. Wernicke's encephalopathy in advanced gastric cancer. Cancer Res Treat. 2010;42(2):77-81. (PubMed)
13. Greenspon J, Perrone EE, Alaish SM. Shoshin beriberi mimicking central line sepsis in a child with short bowel syndrome. World journal of pediatrics : World J Pediatr. 2010;6(4):366-368. (PubMed)
14. Sequeira Lopes da Silva JT, Almaraz Velarde R, Olgado Ferrero F, et al. Wernicke's encephalopathy induced by total parental nutrition. Nutr Hosp. 2010;25(6):1034-1036. (PubMed)
15. Francini-Pesenti F, Brocadello F, Manara R, Santelli L, Laroni A, Caregaro L. Wernicke's syndrome during parenteral feeding: not an unusual complication. Nutrition. 2009;25(2):142-146. (PubMed)
16. Krishna S, Taylor AM, Supanaranond W, et al. Thiamine deficiency and malaria in adults from southeast Asia. Lancet. 1999;353(9152):546-549. (PubMed)
17. Mayxay M, Taylor AM, Khanthavong M, et al. Thiamin deficiency and uncomplicated falciparum malaria in Laos. Trop Med Int Health. 2007;12(3):363-369. (PubMed)
18. Muri RM, Von Overbeck J, Furrer J, Ballmer PE. Thiamin deficiency in HIV-positive patients: evaluation by erythrocyte transketolase activity and thiamin pyrophosphate effect. Clin Nutr. 1999;18(6):375-378. (PubMed)
19. Stanga Z, Brunner A, Leuenberger M, et al. Nutrition in clinical practice-the refeeding syndrome: illustrative cases and guidelines for prevention and treatment. Eur J Clin Nutr. 2008;62(6):687-694. (PubMed)
20. Suter PM, Haller J, Hany A, Vetter W. Diuretic use: a risk for subclinical thiamine deficiency in elderly patients. J Nutr Health Aging. 2000;4(2):69-71. (PubMed)
21. Rieck J, Halkin H, Almog S, et al. Urinary loss of thiamine is increased by low doses of furosemide in healthy volunteers. J Lab Clin Med. 1999;134(3):238-243. (PubMed)
22. Sica DA. Loop diuretic therapy, thiamine balance, and heart failure. Congestive heart failure 2007;13(4):244-247. (PubMed)
23. Zenuk C, Healey J, Donnelly J, Vaillancourt R, Almalki Y, Smith S. Thiamine deficiency in congestive heart failure patients receiving long term furosemide therapy. Can J Clin Pharmacol. 2003;10(4):184-8. (PubMed)
24. Hung SC, Hung SH, Tarng DC, Yang WC, Chen TW, Huang TP. Thiamine deficiency and unexplained encephalopathy in hemodialysis and peritoneal dialysis patients. Am J Kidney Dis. 2001;38(5):941-947. (PubMed)
25. Wilcox CS. Do diuretics cause thiamine deficiency? J Lab Clin Med. 1999;134(3):192-193.
26. Vimokesant SL, Hilker DM, Nakornchai S, Rungruangsak K, Dhanamitta S. Effects of betel nut and fermented fish on the thiamin status of northeastern Thais. Am J Clin Nutr. 1975;28(12):1458-1463. (PubMed)
27. Ventura A, Mafe MC, Bourguet M, Tornero C. Wernicke's encephalopathy secondary to hyperthyroidism and ingestion of thiaminase-rich products. Neurologia. 2013;28(4):257-259. (PubMed)
28. Nishimune T, Watanabe Y, Okazaki H, Akai H. Thiamin is decomposed due to Anaphe spp. entomophagy in seasonal ataxia patients in Nigeria. J Nutr. 2000;130(6):1625-1628. (PubMed)
29. Food and Nutrition Board, Institute of Medicine. Thiamin. Dietary Reference Intakes: Thiamin, Riboflavin, Niacin, Vitamin B6, Vitamin B12, Pantothenic Acid, Biotin, and Choline. Washington D.C.: National Academy Press; 1998:58-86. (National Academy Press)
30. Cumming RG, Mitchell P, Smith W. Diet and cataract: the Blue Mountains Eye Study. Ophthalmology. 2000;107(3):450-456. (PubMed)
31. Jacques PF, Taylor A, Moeller S, et al. Long-term nutrient intake and 5-year change in nuclear lens opacities. Arch Ophthalmol. 2005;123(4):517-526. (PubMed)
32. Thornalley PJ, Babaei-Jadidi R, Al Ali H, et al. High prevalence of low plasma thiamine concentration in diabetes linked to a marker of vascular disease. Diabetologia. 2007;50(10):2164-2170. (PubMed)
33. Larkin JR, Zhang F, Godfrey L, et al. Glucose-induced down regulation of thiamine transporters in the kidney proximal tubular epithelium produces thiamine insufficiency in diabetes. PLoS One. 2012;7:e53175. (PubMed)
34. Rathanaswami P, Sundaresan R. Effects of thiamine deficiency on the biosynthesis of insulin in rats. Biochem Int. 1991;24(6):1057-1062. (PubMed)
35. Rathanaswami P, Pourany A, Sundaresan R. Effects of thiamine deficiency on the secretion of insulin and the metabolism of glucose in isolated rat pancreatic islets. Biochem Int. 1991;25(3):577-583. (PubMed)
36. Alaei Shahmiri F, Soares MJ, Zhao Y, Sherriff J. High-dose thiamine supplementation improves glucose tolerance in hyperglycemic individuals: a randomized, double-blind cross-over trial. Eur J Clin Nutr. 2013. May 29 [Epub ahead of print] (PubMed)
37. Gonzalez-Ortiz M, Martinez-Abundis E, Robles-Cervantes JA, Ramirez-Ramirez V, Ramos-Zavala MG. Effect of thiamine administration on metabolic profile, cytokines and inflammatory markers in drug-naive patients with type 2 diabetes. Eur J Clin Nutr. 2011;50(2):145-149. (PubMed)
38. Tepper OM, Galiano RD, Capla JM, et al. Human endothelial progenitor cells from type II diabetics exhibit impaired proliferation, adhesion, and incorporation into vascular structures. Circulation. 2002;106(22):2781-2786. (PubMed)
39. Wong CY, Qiuwaxi J, Chen H, et al. Daily intake of thiamine correlates with the circulating level of endothelial progenitor cells and the endothelial function in patients with type II diabetes. Mol Nutr Food Res. 2008;52(12):1421-1427. (PubMed)
40. Rabbani N, Alam SS, Riaz S, et al. High-dose thiamine therapy for patients with type 2 diabetes and microalbuminuria: a randomised, double-blind placebo-controlled pilot study. Diabetologia. 2009;52(2):208-212. (PubMed)
41. Babaei-Jadidi R, Karachalias N, Ahmed N, Battah S, Thornalley PJ. Prevention of incipient diabetic nephropathy by high-dose thiamine and benfotiamine. Diabetes. 2003;52(8):2110-2120. (PubMed)
42. Hammes HP, Du X, Edelstein D, et al. Benfotiamine blocks three major pathways of hyperglycemic damage and prevents experimental diabetic retinopathy. Nature Med. 2003;9(3):294-299. (PubMed)
43. Varkonyi T, Kempler P. Diabetic neuropathy: new strategies for treatment. Diabetes Obes Metab. 2008;10(2):99-108. (PubMed)
44. Kohda Y, Shirakawa H, Yamane K, et al. Prevention of incipient diabetic cardiomyopathy by high-dose thiamine. J Toxicol Sci. 2008;33(4):459-472. (PubMed)
45. Lee DC, Chu J, Satz W, Silbergleit R. Low plasma thiamine levels in elder patients admitted through the emergency department. Acad Emerg Med. 2000;7(10):1156-1159. (PubMed)
46. Ito Y, Yamanaka K, Susaki H, Igata A. A cross-investigation between thiamin deficiency and the physical condition of elderly people who require nursing care. J Nutr Sci Vitaminol. 2012;58(3):210-216. (PubMed)
47. Prvulovic D, Hampel H. Amyloid β (A-β) and phospho-τ (p-τ) as diagnostic biomarkers in Alzheimer's disease. Clin Chem Lab Med. 2011;49:367-374. (PubMed)
48. Kish SJ. Brain energy metabolizing enzymes in Alzheimer's disease: α-ketoglutarate dehydrogenase complex and cytochrome oxidase. Ann N Y Acad Sci. 1997;826:218-228. (PubMed)
49. Langbaum JB, Chen K, Lee W, et al. Categorical and correlational analyses of baseline fluorodeoxyglucose positron emission tomography images from the Alzheimer's Disease Neuroimaging Initiative (ADNI). NeuroImage. 2009;45(4):1107-1116. (PubMed)
50. Arvanitakis Z, Wilson RS, Bienias JL, Evans DA, Bennett DA. Diabetes mellitus and risk of Alzheimer disease and decline in cognitive function. Arch Neurol. 2004;61(5):661-666. (PubMed)
51. Gibson GE, Hirsch JA, Cirio RT, Jordan BD, Fonzetti P, Elder J. Abnormal thiamine-dependent processes in Alzheimer's Disease. Lessons from diabetes. Mol Cell Neurosci. 2013;55:17-25. (PubMed)
52. Glaso M, Nordbo G, Diep L, Bohmer T. Reduced concentrations of several vitamins in normal weight patients with late-onset dementia of the Alzheimer type without vascular disease. J Nutr Health Aging. 2004;8(5):407-413. (PubMed)
53. Bender DA. Optimum nutrition: thiamin, biotin and pantothenate. Proc Nutr Soc. 1999;58(2):427-433. (PubMed)
54. Mastrogiacoma F, Bettendorff L, Grisar T, Kish SJ. Brain thiamine, its phosphate esters, and its metabolizing enzymes in Alzheimer's disease. Ann Neurol. 1996;39(5):585-591. (PubMed)
55. Heroux M, Raghavendra Rao VL, Lavoie J, Richardson JS, Butterworth RF. Alterations of thiamine phosphorylation and of thiamine-dependent enzymes in Alzheimer's disease. Metab Brain Dis. 1996;11(1):81-88. (PubMed)
56. Pan X, Gong N, Zhao J, et al. Powerful beneficial effects of benfotiamine on cognitive impairment and beta-amyloid deposition in amyloid precursor protein/presenilin-1 transgenic mice. Brain. 2010;133(Pt 5):1342-1351. (PubMed)
57. Karuppagounder SS, Xu H, Shi Q, et al. Thiamine deficiency induces oxidative stress and exacerbates the plaque pathology in Alzheimer's mouse model. Neurobiol Aging. 2009;30(10):1587-1600. (PubMed)
58. Zhang Q, Yang G, Li W, et al. Thiamine deficiency increases beta-secretase activity and accumulation of beta-amyloid peptides. Neurobiol Aging. 2011;32(1):42-53. (PubMed)
59. Dumont M, Beal MF. Neuroprotective strategies involving ROS in Alzheimer disease. Free Rad Res Med. 2011;51(5):1014-1026. (PubMed)
60. Nolan KA, Black RS, Sheu KF, Langberg J, Blass JP. A trial of thiamine in Alzheimer's disease. Arch Neurology. 1991;48(1):81-83. (PubMed)
61. Meador K, Loring D, Nichols M, et al. Preliminary findings of high-dose thiamine in dementia of Alzheimer's type. J Geriatr Psychiatry Neurol. 1993;6(4):222-229. (PubMed)
62. Mimori Y, Katsuoka H, Nakamura S. Thiamine therapy in Alzheimer's disease. Metab Brain Dis. 1996;11(1):89-94. (PubMed)
63. Rodriguez-Martin JL, Qizilbash N, Lopez-Arrieta JM. Thiamine for Alzheimer's disease (Cochrane Review). Cochrane Database Syst Rev. 2001;2:CD001498. (PubMed)
64. Hanninen SA, Darling PB, Sole MJ, Barr A, Keith ME. The prevalence of thiamin deficiency in hospitalized patients with congestive heart failure. J Am Coll Cardiol. 2006;47(2):354-361. (PubMed)
65. Wilkinson TJ, Hanger HC, George PM, Sainsbury R. Is thiamine deficiency in elderly people related to age or co-morbidity? Age Ageing. 2000;29(2):111-116. (PubMed)
66. Shimon I, Almog S, Vered Z, et al. Improved left ventricular function after thiamine supplementation in patients with congestive heart failure receiving long-term furosemide therapy. Am J Med. 1995;98(5):485-490. (PubMed)
67. Leslie D, Gheorghiade M. Is there a role for thiamine supplementation in the management of heart failure? Am Heart J. 1996;131(6):1248-1250.
68. Comin-Anduix B, Boren J, Martinez S, et al. The effect of thiamine supplementation on tumour proliferation. A metabolic control analysis study. Eur J Biochem. 2001;268(15):4177-4182. (PubMed)
69. Zastre JA, Hanberry BS, Sweet RL, et al. Up-regulation of vitamin B1 homeostasis genes in breast cancer. J Nutr Biochem. 2013. May 1 [Epub ahead of print] (PubMed)
70. Boros LG, Brandes JL, Lee WN, et al. Thiamine supplementation to cancer patients: a double edged sword. Anticancer Res. 1998;18(1B):595-602. (PubMed)
71. Naito E, Ito M, Yokota I, Saijo T, Ogawa Y, Kuroda Y. Diagnosis and molecular analysis of three male patients with thiamine-responsive pyruvate dehydrogenase complex deficiency. J Neurological Sci. 2002;201(1-2):33-37. (PubMed)
72. Patel KP, O'Brien TW, Subramony SH, Shuster J, Stacpoole PW. The spectrum of pyruvate dehydrogenase complex deficiency: clinical, biochemical and genetic features in 371 patients. Mol Genet Metab. 2012;106(3):385-394. (PubMed)
73. Lee EH, Ahn MS, Hwang JS, Ryu KH, Kim SJ, Kim SH. A Korean female patient with thiamine-responsive pyruvate dehydrogenase complex deficiency due to a novel point mutation (Y161C)in the PDHA1 gene. J Korean Med Sci. 2006;21(5):800-804. (PubMed)
74. Chuang DT, Chuang JL, Wynn RM. Lessons from genetic disorders of branched-chain amino acid metabolism. J Nutr. 2006;136(1 Suppl):243S-249S. (PubMed)
75. Shaw-Smith C, Flanagan SE, Patch AM, et al. Recessive SLC19A2 mutations are a cause of neonatal diabetes mellitus in thiamine-responsive megaloblastic anaemia. Pediatr Diabetes. 2012;13(4):314-321. (PubMed)
76. Akin L, Kurtoglu S, Kendirci M, Akin MA, Karakukcu M. Does early treatment prevent deafness in thiamine-responsive megaloblastic anaemia syndrome? J Clin Res Pediatr Endocrinol. 2011;3(1):36-39. (PubMed)
77. Alfadhel M, Almuntashri M, Jadah RH, et al. Biotin-responsive basal ganglia disease should be renamed biotin-thiamine-responsive basal ganglia disease: a retrospective review of the clinical, radiological and molecular findings of 18 new cases. Orphanet J Rare Dis. 2013;8:83. (PubMed)
78. LeBlanc JG, Milani C, de Giori GS, Sesma F, van Sinderen D, Ventura M. Bacteria as vitamin suppliers to their host: a gut microbiota perspective. Curr Opin Biotechnol. 2013;24(2):160-168. (PubMed)
79. Russell RM, Suter PM. Vitamin requirements of elderly people: an update. Am J Clin Nutr. 1993;58(1):4-14. (PubMed)
80. US Department of Agriculture, Agricultural Research Service. USDA National Nutrient Database for Standard Reference, Release 25. 2012. Available at: http://ndb.nal.usda.gov. Accessed 6/21/13.
81. Thiamin (vitamin B1). In: Hendler S, Rorvik D, eds. PDR for Nutritional Supplements. 2nd ed. Montvale: Physicians' Desk Reference Inc.; 2008:609-615.
82. Flodin N. Pharmacology of micronutrients. New York: Alan R. Liss, Inc.; 1988.
83. Schumann K. Interactions between drugs and vitamins at advanced age. Int J Vitam Nutr Res. 1999;69(3):173-178. (PubMed)
84. Subramanya SB, Subramanian VS, Said HM. Chronic alcohol consumption and intestinal thiamin absorption: effects on physiological and molecular parameters of the uptake process. Am J Physiol Gastrointest Liver Physiol. 2010;299(1):G23-G31. (PubMed)
85. Subramanian VS, Subramanya SB, Tsukamoto H, Said HM. Effect of chronic alcohol feeding on physiological and molecular parameters of renal thiamin transport. Am J Physiol Renal Physiol. 2010;299(1):F28-F34. (PubMed)
パントテン酸
目次
要約
-
ビタミンB5としても知られるパントテン酸は水溶性ビタミンで、補酵素Aの合成における前駆体である。補酵素Aは、生命を支える多くの生化学的反応に必須である。また、補酵素Aのホスホパンテテイニル基部分は、脂肪酸の合成に関わるアシルキャリアタンパク質を含むいくつかのタンパク質の生物学的活性に必要である。 (詳細はこちら)
-
パントテン酸は、すべての形態の生物に必須である。それは植物および動物由来の食物にあまねく含まれ、食事による欠乏症は非常に稀である。 (詳細はこちら)
-
米国医学研究所の食品栄養委員会は、パントテン酸の推定1日平均摂取量に基づいて、5mg/日という成人の目安量(AI)を設定した。 (詳細はこちら)
-
限定的な介入研究によるエビデンスから、パントテン酸および/またはパントテノール(アルコール類似体)が皮膚の創傷治癒過程を改善させるかもしれないことが示唆される。今なお追加的なより大規模の研究が認められている。 (詳細はこちら)
-
パントテン酸の誘導体であるパンテチンによる高用量の治療で、血清コレステロールや脂質濃度が下がることが示されてきた。パンテチンによる治療は耐用性が高いようであるが、医学的監督が欠かせない。 (詳細はこちら)
-
パントテン酸の豊富な食品は、動物の臓器(肝臓や腎臓)、魚、貝、牛乳製品、卵、アボカド、豆類、マッシュルーム、およびサツマイモなどである。 (詳細はこちら)
-
食事性およびサプリメントからのパントテン酸は毒性とほとんど何の関連もないので、許容上限摂取量(UL)が設定されていないほどである。 (詳細はこちら)
ビタミンB5としても知られるパントテン酸は、すべての形態の生命に必須である(1)。パントテン酸は、多数の化学反応に非常に重要な補酵素である補酵素Aの形態で生物の全部門に見られる(2)。
機能
パントテン酸補助因子の合成
補酵素A
パントテン酸は、生命を支える多様な生化学反応に必須の補酵素である補酵素A(CoA、図1参照)の生合成における前駆体である(下記参照)。パントテン酸キナーゼII(PanK2)は、パントテン酸から4'-ホスホパントテン酸へのリン酸化の初期段階を触媒作用する。補酵素Aとその誘導体は4'-ホスホパントテン酸の合成を阻害するが、脂肪酸のミトコンドリアへの輸送に必要なカルニチンによってこの阻害は保留可能である(3)。この生合成経路におけるその後の反応には、中間体である4'-ホスホパンテテインの合成や、補酵素Aから4'-ホスホパンテテインへの再利用などがある(図1参照)。
4'-ホスホパンテテイン
補酵素Aの4'-ホスホパンテテイニル基部分は、生物学的活性のために4'-ホスホパンテテインが必須の補助因子である酵素類へと移送可能である(4'-ホスホパンテテイニル化の項参照)。
補助因子および補助基質機能
補酵素A
補酵素Aはアシル基と反応し、アセチルCoA、スクシニルCoA、マロニルCoA、および3-ヒドロキシ-3-メチルグルタリル(HMG)-CoAなどのチオエステル誘導体を生じる。補酵素Aとそのアシル誘導体は、食事性の脂肪、炭水化物、およびタンパク質の分解によってエネルギーを作り出す反応に必要である。また、アセチルCoAとスクシニルCoAの形態の補酵素Aはクエン酸回路や、必須脂肪、コレステロール、ステロイドホルモン、ビタミンAとD、および神経伝達物質のアセチルコリンの合成、さらに脂肪酸β酸化経路に関わっている。補酵素Aの誘導体はまた、メラトニンというホルモンの合成、およびヘムと呼ばれるヘモグロビン成分に必要である。加えて、肝臓での多数の薬剤や毒素の代謝に補酵素Aが必要である(4)。
補酵素Aは、そのアセチル化反応における役割から命名された。体内のアセチル化されたタンパク質の大部分は、補酵素Aのチオエステル誘導体であるアセチルCoAによって提供されたアセテート基を加えることによって修飾される。タンパク質のアセチル化はタンパク質の全体的な電荷を変化させ、その三次元的構造を変え、その機能まで変える可能性がある。たとえば、アセチル化は脳下垂体が生成するものも含めたペプチドホルモンの活性を調整するメカニズムである(5)。またタンパク質のアセチル化は、その他の翻訳後修飾と同様に、多くのシグナル(信号)分子、転写因子、および酵素の細胞内局在化、機能、半減期を調整することが示されている。特にヒストンのアセチル化は転写(すなわちmRNAの合成)を促進することで遺伝子発現の調整に役割を果たすが、脱アセチル化されたヒストンは通常、クロマチン凝縮や遺伝子発現抑制に関連がある。ヒストンのアセチル化はクロマチンの構造変化につながることがわかっており、これはDNAとタンパク質、およびタンパク質とタンパク質同士の相互作用に影響する。ヒストンのアセチル化標識とその他の転写後修飾のクロストーク(相互干渉)はまた、その後転写される遺伝子のプロモーターへの転写調整因子の補充も促す((6)の文献でレビュー)。
最後に、多くのシグナル分子は補酵素Aによって提供された長鎖脂肪酸の付加によって修飾される。これらの修飾はタンパク質のアシル化として知られ、細胞シグナル伝達経路に中心的役割を果たす(4)。
4'-ホスホパンテテイニル化
特定の多酵素複合体は、秩序だったやり方でいくつかの反応を実施する必要があるが、4'-ホスホパンテテインアームの「キャリア」領域(またはタンパク質)への共有結合を必要とするかもしれない。このキャリア領域は、様々な酵素反応の進行中に基質または反応中間体を保持する。哺乳類では、補酵素Aから特定のキャリア領域の保存セリン残基への4'-ホスホパンテテイニル基部分の輸送は、唯一ホスホパンテテイニル転移酵素によって触媒作用がなされる(7)。4'-ホスホパンテテイニル化は、アポ酵素を十分に活性のあるホロ酵素に変換するために必要である(下記参照)。
アシルキャリアタンパク質
脂質は正常な生理学的機能に必須の脂肪分子で、あまたある中にスフィンゴ脂質(神経伝達を強化するミエリン鞘の必須成分)、リン脂質(細胞膜の重要な構造成分)、および脂肪酸を含む。脂肪酸合成酵素(FAS)は、脂肪酸の合成を触媒する多酵素複合体である。FAS複合体の中でも、アシルキャリアタンパク質(ACP)はキャリアタンパク質としての活性のために4'-ホスホパンテテインの形態でパントテン酸を必要とする(3)。ACPにとっての4'-ホスホパンテテイニル基部分のような基は、補欠分子族と呼ばれる。補欠分子族はアミノ酸を含まず、いくつかのタンパク質の生物学的活性に必要な強固に結合した補助因子である(図2参照)。アセチルCoA、マロニルCoA、およびACPはどれも、サイトゾルにおける脂肪酸の合成に必要である。脂肪酸の合成中に、アセチルCoAとマロニルCoAのアシル基は、ACPの4'-ホスホパンテテイニル基部分のスルフヒドリル基(-SH)に輸送される。補欠分子族は、増殖中の脂肪酸鎖をI型FAS複合体の酵素的中心部のそれぞれに輸送するためのフレキシブル(可撓性)アームとして使用される。ミトコンドリアでは、4'-ホスホパンテテインはミトコンドリアのII型FAS複合体にあるACP相同体に対する補欠分子族としても作用する(8)。
10-ホルミルテトラヒドロ葉酸脱水素酵素
10-ホルミルテトラヒドロ葉酸脱水素酵素(FDH)は、10-ホルミルテトラヒドロ葉酸が核酸およびアミノ酸の代謝に不可欠の補助因子であるテトラヒドロ葉酸へと変換する際に触媒作用をする(図3参照)。ACPと同様に、FDHは自身の生物学的活性のために4'-ホスホパンテテイン補欠分子族を必要とする。補欠分子族は、FDHの2つの触媒領域の活性を結びつけるスイング(揺動)アームとして働く(9,10)。ミトコンドリアのFDHの相同体も、生物学的に活性を持つために4'-ホスホパンテテイニル化を必要とする(11)。
アミノアジピン酸セミアルデヒド合成酵素
4'-ホスホパンテテイニル化は、アポ酵素であるα-アミノアジピン酸セミアルデヒド合成酵素(AASS)の生物学的活性に必要である。AASSは、ヒトにとっての必須アミノ酸であるリジンをミトコンドリアで分解する経路における初期反応を触媒する。AASSは2つの触媒領域でできている。リジンケトグルタル酸還元酵素領域がまずリジンからサッカロピンへの変換を触媒する。サッカロピンはさらに、サッカロピン脱水素酵素領域によって触媒される反応においてα-アミノアジピン酸セミアルデヒドに変換される(図4参照)。
欠乏症
ヒトでの自然発生的なパントテン酸欠乏症は非常に稀で、重篤な栄養不良の場合にのみ観察されてきた。フィリピン、ミャンマー、および日本での第二次世界大戦捕虜は、足のしびれや苦痛を伴った灼熱感や刺痛を経験した。これらの症状は、特にパントテン酸補給で緩和された(4)。ヒトのパントテン酸欠乏症は、実験的にパントテン酸キナーゼ阻害薬(オメガ>メチルパントテン酸、上記の図1参照)とパントテン酸欠乏の食事を同時投与することで誘発されてきた。この実験の参加者は、頭痛、疲労、不眠、腸の不調、および手足のしびれやひりひり感を訴えた(12)。別の研究では、パントテン酸を含まない食事のみを与えられた参加者は欠乏症の臨床的兆候を示さなかったが、何人かはだるそうで疲労を訴えた(13)。
ホモパントテン酸カルシウム(ホパンテン酸カルシウム)は、コリン作動性効果(神経伝達物質のアセチルコリンの効果に似たもの)があるパントテン酸拮抗薬である。この化合物は日本で、特にアルツハイマー病の精神機能の強化に使用されている。これの稀な副作用は、肝臓が毒素を除去することができずに起こる異常な脳機能状態である肝性脳症の発症であった。肝性脳症はパントテン酸補給によって回復し、このことから肝性脳症はホモパントテン酸で誘発されたパントテン酸欠乏症であったことが示唆される(14)。留意したいのは、パントテン酸キナーゼII(上記の図1参照)を符号化するヒトの遺伝子であるPanK2の突然変異は、4'-ホスホパンテテインおよび補酵素Aの合成障害を起こすということである(「機能」の項参照)。パントテン酸キナーゼ関連神経変性症と呼ばれるこの障害は、視覚および知的障害、ジストニア(筋緊張異常)、言語異常、行動困難、および人格障害によって特徴付けられる(15)。
しかし、パントテン酸は自然に広く分布しておりヒトでの欠乏症は非常に稀であることから、欠乏症の結果に関するほとんどの情報は動物での実験研究から集められてきた((3)の文献でレビュー)。パントテン酸欠乏症のラットは副腎に損傷が起こり、サルはヘモグロビンの成分であるヘムの合成不足から貧血になった。パントテン酸欠乏症のイヌは低血糖、呼吸促迫や頻脈、および痙攣を起こした。ニワトリは皮膚刺激、羽毛の異常、およびミエリン鞘の変性に関連した脊髄神経損傷を発症した。パントテン酸が欠乏したマウスは運動耐性が下がり、筋肉や肝臓でのブドウ糖貯蔵(グリコーゲンの形態)が減るという症状を示した。マウスはまた、皮膚刺激や毛の白髪化も起こり、これはパントテン酸の投与で元に戻った。
症状が多様なことは、パントテン酸には補酵素の形態で多数の機能があることを強く示すものである。
目安量(AI)
ヒトでのパントテン酸の必要量に関する情報がほとんどないため、米国医学研究所の食品栄養委員会は健康な集団で観察された食事性摂取量に基づいて目安量(AI)を設定した(表1)(16)。
| 年齢層 | 年齢 | 男性(mg/日) | 女性(mg/日) |
|---|---|---|---|
| 乳児 | 0~6ヶ月 | 1.7 | 1.7 |
| 乳児 | 7~12ヶ月 | 1.8 | 1.8 |
| 子供 | 1~3歳 | 2 | 2 |
| 子供 | 4~8歳 | 3 | 3 |
| 子供 | 9~13歳 | 4 | 4 |
| 青少年 | 14~18歳 | 5 | 5 |
| 成人 | 19歳以上 | 5 | 5 |
| 妊娠期 | 全年齢 | - | 6 |
| 授乳期 | 全年齢 | - | 7 |
疾病治療
創傷治癒
D-パントテン酸カルシウムおよび/またはパントテノール(図5参照)を人工的に傷つけた皮膚線維芽細胞培養物の培地に添加すると細胞増殖や細胞移動が高まり、そのためin vitro(ガラス容器内)での創傷治癒が早くなることがわかった(17,18)。同様に、ガラス容器内でパントテン酸欠乏症状態を作ると、細胞増殖中の皮膚線維芽細胞の分化マーカーの発現を誘発し、ヒトのケラチノサイト(角化細胞)の増殖を阻害した(19)。D-パンテノールまたはデクスパンテノールとしても知られるD-パントテン酸カルシウムまたはパントテノールのどちらかを含む軟膏を皮膚に塗ると、動物の皮膚の創傷閉鎖を早め、瘢痕組織の強度が増すことが示されている(3)。
創傷治癒におけるデクスパンテノールの効果はよくわかっていない。12人の健康なボランティアを含むプラセボ対照研究で、デクスパンテノールを含む軟膏を皮膚の創傷治癒モデルに塗った(12時間ごとに1~6日間)ら、細胞増殖、炎症、および組織修復のマーカーの発現が強化されるという関連があった(20)。しかしこの研究では、デクスパンテノールの局所適用に反応したこれらの変化がプラセボに比べて傷の修復プロセスを向上させたのかどうかを報告していない(20)。何の効果も示されなかった研究もある。タトゥー消去の手術を受けた患者による初期の無作為化対照試験で、1または3グラムのビタミンCと200mgまたは900mgのパントテン酸を21日間毎日併用補給しても、創傷治癒プロセスはあまり向上しなかったことがわかった(21,22)。しかし最近の無作為化二重盲検プラセボ対照研究で、デクスパンテノールのトローチ(300mg/日を最長で術後14日間)の使用によって、扁桃摘出術を受けた子供の粘膜治癒が早くなったことがわかった(23)。
高コレステロール
初期の研究で、パンテノン酸の誘導体であるパンテチンを薬理学的用量で使用すると、コレステロール低減効果があるかもしれないことが示唆された(24,25)。パンテチンは2つのパンテチン分子がジスルフィド結合(2つの硫黄分子間の化学結合)によって結合してできている(図5参照)。パンテチンは補酵素Aに構造的に関連があり、アシルキャリアタンパク質であるホルミルテトラヒドロ葉酸脱水素酵素の生物学的機能に必要な補欠分子族と、α-アミノアジピン酸セミアルデヒド合成酵素に見られる(「機能」の項参照)。16週間の無作為化二重盲検プラセボ対照研究で、毎日のパンテチン補給(600mg/日を8週間、その後900mg/日を8週間)によって、心血管疾患(CVD)リスクが低~中の120人の脂質パラメータプロフィールが大きく向上した。ベースライン(試験開始時)への調整の後で、低密度リポタンパク質コレステロール(LDL-C)およびアポリポタンパク質B(apoB)濃度を低下させること、およびトリグリセリド(中性脂肪)と高密度リポタンパク質コレステロールの比率(TG:HDL-C)を下げることにおいて、パンテチンはプラセボよりもかなり効果的であったことがわかった(26)。パンテチンは耐容性がよくコレステロール代謝を向上させるのにも有益な可能性があるようだが、パンテチンはビタミンではない。薬理学的用量のパンテチンを高い血中コレステロールやトリグリセリドの治療に使用するという決定は、適切な追跡をすることができる有資格医療提供者が合意した場合のみなされねばならない。
白髪化
パントテン酸欠乏のマウスは皮膚刺激や毛が白くなる症状を起こしたが、これはパントテン酸の投与で元に戻った。ヒトでは、パントテン酸をサプリメントとして摂取したりパントテン酸入りのシャンプーを使用したりすることが髪の色を保ったり復元したりすることができるというエビデンスはない。
摂取源
食品の摂取源
パントテン酸は、通常は補酵素A(CoA)や4'-ホスホパンテテインの成分として様々な食物に含まれる(上記の図1参照)。消化の際には、食事性の補酵素Aとホスホパンテテインは腸での吸収の前にパントテン酸に加水分解される(3)。動物の肝臓や腎臓、魚、貝、豚肉、鶏肉、卵黄、牛乳、ヨーグルト、豆類、マッシュルーム、アボカド、ブロッコリー、およびサツマイモは、パントテン酸の良好な摂取源である。穀物もパントテン酸の良好な摂取源であるが、加工や精製することで35~70%が喪失しかねない。冷凍や缶詰も同様の喪失が起こる(16)。大規模な国家的栄養調査では、パントテン酸摂取量の推定ができなかった。これは主に食物のパントテン酸含有量データが不足していたからである(16)。小規模研究では、パントテン酸の毎日の平均摂取量は成人で4~7mgと推定された。表2はパントテン酸の豊富な食物とその含有量をミリグラムで表示したものである。食物の栄養素含有量の詳細情報は、USDAの食品成分データベースを検索のこと。
腸内細菌
結腸(大腸)に通常棲み着いている細菌は、パントテン酸を合成可能である。ビオチンとパントテン酸の摂取のための特別な輸送体が結腸内壁の培養細胞において同定されたことから、ヒトは腸内細菌によって生成されたパントテン酸とビオチンを吸収できるのではないかと示唆された(27)。しかし、細菌による合成がヒトのパントテン酸摂取にどの程度貢献しているかは不明である(28)。
サプリメント
パントテノールおよびパントテン酸塩
サプリメントは一般的にパントテン酸の安定したアルコール類似体であるパントテノール(パンテノール)を含み、これはヒトでは急速にパントテン酸に変換される。パントテン酸のカルシウムおよびナトリウム塩であるD-パントテン酸カルシウムおよびナトリウムも、サプリメントとして市販されている。
パンテチン
パンテチンは日本でコレステロール低減薬として使用されており、米国では栄養補助食品として市販されている(29)。
安全性
毒性
パントテン酸はヒトに有毒であるとはされていない。注目された唯一の有害作用は、D-パントテン酸カルシウムを10~20g/日という非常に高用量で摂取した結果としての下痢である(30)。しかし、10mg/日のビオチンと300mg/日のパントテン酸を2ヶ月間併用した年配女性が、命に関わる好酸球性胸膜心膜滲出(好酸球性胸水)を起こした報告が1つある(31)。パントテン酸の食事摂取基準量(DRI)が1998年に確定された際には有害作用の報告がなかったため、米国医学研究所の食品栄養委員会はパントテン酸の許容上限摂取量(UL)を設定しなかった(16)。パンテチンは最大1,200mg/日まで一般的によく耐用性がある。しかし、吐き気や胸焼けなどの胃腸系の副作用が報告されている(29)。また、デクスパンテノール(D-パンテノール)を最大5%まで含む局所製剤は、最長1ヶ月まで安全に使用されてきた。それでもデクスパンテノール含有の軟膏の使用による皮膚刺激、接触性皮膚炎、および湿疹の報告がいくつかある(32,33)。
栄養素相互作用
大用量のパントテン酸は、ヒトのナトリウム依存性マルチビタミン輸送体(hSMVT)による腸および細胞での取り込みにおいて、ビオチンと競合する可能性がある(27,34)。
薬物相互作用
エストロゲンやプロゲスチンを含む経口避妊薬は、パントテン酸の需要を増やすかもしれない(30)。スタチン(HMG-CoA還元酵素阻害薬)と呼ばれるコレステロール低減薬またはニコチン酸 とパンテチンを併用すると、血中脂質に相加効果をもたらすかもしれない(29)。
ライナス・ポーリング研究所の推奨
健康を最大限促進し慢性疾患を防ぐために必要な食事性パントテン酸の量を決めるためのさらなるデータが必要である。ライナス・ポーリング研究所は、食品栄養委員会が設定した成人に対する5mg/日というパントテン酸の推奨量を支持する。様々な食事によって、十分なパントテン酸がほとんどの人には提供されているはずである。パントテン酸の一日摂取量(DV)を100%含むマルチビタミン/ミネラルのサプリメントを毎日摂取するというライナス・ポーリング研究所の推奨に従えば、少なくとも5mg/日の摂取が確実であろう。
年配者(50歳超)
パントテン酸の摂取または必要量が年配者では異なるというエビデンスは、現在ほとんどない。たいていのマルチビタミン/ミネラルのサプリメントで、少なくとも5mg/日のパントテン酸が摂れる。
Authors and Reviewers
Written in May 2004 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in April 2008 by:
Victoria J. Drake, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in April 2015 by:
Barbara Delage, Ph.D.
Linus Pauling Institute
Oregon State University
Reviewed in July 2015 by:
Robert B. Rucker, Ph.D.
Distinguished Professor Emeritus
Department of Nutrition and School of Medicine
University of California, Davis
Copyright 2000-2023 Linus Pauling Institute
References
1. Trumbo PR. Pantothenic acid. In: Ross AC, Caballero B, Cousins RJ, Tucker KL, Ziegler TR, eds. Modern Nutrition in Health and Disease. 11th ed. Baltimore: Lippincott Williams & Wilkins; 2014:351-357.
2. Martinez DL, Tsuchiya Y, Gout I. Coenzyme A biosynthetic machinery in mammalian cells. Biochem Soc Trans. 2014;42(4):1112-1117. (PubMed)
3. Miller JW, Rucker RB. Pantothenic acid. In: Erdman JWJ, Macdonald IA, Zeisel SH, eds. Present Knowledge in Nutrition. 10th ed. Ames: Wiley-Blackwell; 2012:375-390.
4. Bauerly K, Rucker RB. Pantothenic acid. In: Zempleni J, Rucker RB, McCormick DB, Suttie JW, eds. Handbook of vitamins. 4th ed. Boca Raton: CRC Press; 2007:289-314.
5. Takahashi A, Mizusawa K. Posttranslational modifications of proopiomelanocortin in vertebrates and their biological significance. Front Endocrinol (Lausanne). 2013;4:143. (PubMed)
6. Choudhary C, Weinert BT, Nishida Y, Verdin E, Mann M. The growing landscape of lysine acetylation links metabolism and cell signalling. Nat Rev Mol Cell Biol. 2014;15(8):536-550. (PubMed)
7. Beld J, Sonnenschein EC, Vickery CR, Noel JP, Burkart MD. The phosphopantetheinyl transferases: catalysis of a post-translational modification crucial for life. Nat Prod Rep. 2014;31(1):61-108. (PubMed)
8. Bunkoczi G, Pasta S, Joshi A, et al. Mechanism and substrate recognition of human holo ACP synthase. Chem Biol. 2007;14(11):1243-1253. (PubMed)
9. Donato H, Krupenko NI, Tsybovsky Y, Krupenko SA. 10-formyltetrahydrofolate dehydrogenase requires a 4'-phosphopantetheine prosthetic group for catalysis. J Biol Chem. 2007;282(47):34159-34166. (PubMed)
10. Strickland KC, Hoeferlin LA, Oleinik NV, Krupenko NI, Krupenko SA. Acyl carrier protein-specific 4'-phosphopantetheinyl transferase activates 10-formyltetrahydrofolate dehydrogenase. J Biol Chem. 2010;285(3):1627-1633. (PubMed)
11. Strickland KC, Krupenko NI, Dubard ME, Hu CJ, Tsybovsky Y, Krupenko SA. Enzymatic properties of ALDH1L2, a mitochondrial 10-formyltetrahydrofolate dehydrogenase. Chem Biol Interact. 2011;191(1-3):129-136. (PubMed)
12. Hodges RE, Ohlson MA, Bean WB. Pantothenic acid deficiency in man. J Clin Invest. 1958;37(11):1642-1657. (PubMed)
13. Fry PC, Fox HM, Tao HG. Metabolic response to a pantothenic acid deficient diet in humans. J Nutr Sci Vitaminol (Tokyo). 1976;22(4):339-346. (PubMed)
14. Bender DA. Optimum nutrition: thiamin, biotin and pantothenate. Proc Nutr Soc. 1999;58(2):427-433. (PubMed)
15. Kurian MA, Hayflick SJ. Pantothenate kinase-associated neurodegeneration (PKAN) and PLA2G6-associated neurodegeneration (PLAN): review of two major neurodegeneration with brain iron accumulation (NBIA) phenotypes. Int Rev Neurobiol. 2013;110:49-71. (PubMed)
16. Food and Nutrition Board, Institute of Medicine. Pantothenic acid. Dietary Reference Intakes: Thiamin, Riboflavin, Niacin, Vitamin B6, Vitamin B12, Pantothenic Acid, Biotin, and Choline. Washington, D.C.: National Academy Press; 1998:357-373. (National Academy Press)
17. Weimann BI, Hermann D. Studies on wound healing: effects of calcium D-pantothenate on the migration, proliferation and protein synthesis of human dermal fibroblasts in culture. Int J Vitam Nutr Res. 1999;69(2):113-119. (PubMed)
18. Wiederholt T, Heise R, Skazik C, et al. Calcium pantothenate modulates gene expression in proliferating human dermal fibroblasts. Exp Dermatol. 2009;18(11):969-978. (PubMed)
19. Kobayashi D, Kusama M, Onda M, Nakahata N. The effect of pantothenic acid deficiency on keratinocyte proliferation and the synthesis of keratinocyte growth factor and collagen in fibroblasts. J Pharmacol Sci. 2011;115(2):230-234. (PubMed)
20. Heise R, Skazik C, Marquardt Y, et al. Dexpanthenol modulates gene expression in skin wound healing in vivo. Skin Pharmacol Physiol. 2012;25(5):241-248. (PubMed)
21. Vaxman F, Olender S, Lambert A, et al. Effect of pantothenic acid and ascorbic acid supplementation on human skin wound healing process. A double-blind, prospective and randomized trial. Eur Surg Res. 1995;27(3):158-166. (PubMed)
22. Vaxman F, Olender S, Lambert A, Nisand G, Grenier JF. Can the wound healing process be improved by vitamin supplementation? Experimental study on humans. Eur Surg Res. 1996;28(4):306-314. (PubMed)
23. Celebi S, Tepe C, Yelken K, Celik O. Efficacy of dexpanthenol for pediatric post-tonsillectomy pain and wound healing. Ann Otol Rhinol Laryngol. 2013;122(7):464-467. (PubMed)
24. Coronel F, Tornero F, Torrente J, et al. Treatment of hyperlipemia in diabetic patients on dialysis with a physiological substance. Am J Nephrol. 1991;11(1):32-36. (PubMed)
25. Gaddi A, Descovich GC, Noseda G, et al. Controlled evaluation of pantethine, a natural hypolipidemic compound, in patients with different forms of hyperlipoproteinemia. Atherosclerosis. 1984;50(1):73-83. (PubMed)
26. Rumberger JA, Napolitano J, Azumano I, Kamiya T, Evans M. Pantethine, a derivative of vitamin B(5) used as a nutritional supplement, favorably alters low-density lipoprotein cholesterol metabolism in low- to moderate-cardiovascular risk North American subjects: a triple-blinded placebo and diet-controlled investigation. Nutr Res. 2011;31(8):608-615. (PubMed)
27. Said HM, Ortiz A, McCloud E, Dyer D, Moyer MP, Rubin S. Biotin uptake by human colonic epithelial NCM460 cells: a carrier-mediated process shared with pantothenic acid. Am J Physiol. 1998;275(5 Pt 1):C1365-1371. (PubMed)
28. Said HM. Intestinal absorption of water-soluble vitamins in health and disease. Biochem J. 2011;437(3):357-372. (PubMed)
29. Hendler SS, Rorvik DR, eds. PDR for Nutritional Supplements. 2nd ed. Montvale: Thomson Reuters; 2008.
30. Flodin N. Pharmacology of micronutrients. New York: Alan R. Liss, Inc.; 1988.
31. Debourdeau PM, Djezzar S, Estival JL, Zammit CM, Richard RC, Castot AC. Life-threatening eosinophilic pleuropericardial effusion related to vitamins B5 and H. Ann Pharmacother. 2001;35(4):424-426. (PubMed)
32. Herbst RA, Uter W, Pirker C, Geier J, Frosch PJ. Allergic and non-allergic periorbital dermatitis: patch test results of the Information Network of the Departments of Dermatology during a 5-year period. Contact Dermatitis. 2004;51(1):13-19. (PubMed)
33. Schmuth M, Wimmer MA, Hofer S, et al. Topical corticosteroid therapy for acute radiation dermatitis: a prospective, randomized, double-blind study. Br J Dermatol. 2002;146(6):983-991. (PubMed)
34. Chirapu SR, Rotter CJ, Miller EL, Varma MV, Dow RL, Finn MG. High specificity in response of the sodium-dependent multivitamin transporter to derivatives of pantothenic acid. Curr Top Med Chem. 2013;13(7):837-842. (PubMed)
ビタミンA
要約
- ビタミンAは、多数の関連する化合物群の一般名称であり、果物や植物においてプロビタミンAあるいは既成ビタミンA(レチノール)として含まれる脂溶性化合物である。(詳細はこちら)
- ビタミンAは、人体内の実質的にすべての細胞の成長と特殊化(分化)を制御することに関与している。ビタミンAは、胚発生、胎児発育中の臓器形成、正常な免疫機能、および眼の発達および視覚において重要な役割を果たしている。(詳細はこちら)
- 世界中の予防可能な失明において、ビタミンA欠乏症はその主要因とされている。子供や妊娠中の女性においてしばしば認められる。ビタミンA欠乏症は、甲状腺および皮膚疾患だけでなく感染症に対する感受性の増加と関連している。(詳細はこちら)
- 推奨されている摂取量(RDA)は、レチノール活性当量(RAE)で1日当たり700μg/日、男性については900μgRAE/日である。(詳細はこちら)
- レチノイン酸および類縁体は、急性前骨髄球性白血病および種々の皮膚疾患において、薬理学的用量で治療に用いられている。(詳細はこちら)
- 既成ビタミンAが豊富な動物性食品には、乳製品、強化シリアル、肝臓、および魚油がある。プロビタミンAカロテノイドは、サツマイモやほうれん草などのオレンジとグリーンの野菜に豊富に含まれている。(詳細はこちら)
- 既成ビタミンAの過剰摂取においては強い毒性が認められ、妊娠前および妊娠中は特に禁忌とされている。これは、重度の先天性欠損をもたらす可能性があるためである。成人のビタミンAの許容上限摂取量(UL)は、1日当たり3000μgRAEに設定されている。 ULは、カロチノイド由来のビタミンAには適用されない。(詳細はこちら)
ビタミンAは、多くの関連化合物を包含する総称である(Figure 1)。レチノール(アルコール)及びレチナール(アルデヒド)が、しばしば既成ビタミンA(preformed Vitamin A)のことをさしている。レチナールは、体内で遺伝子転写に影響するといわれるビタミンAの形態であるレチノイン酸(レチノール酸)へ変換される。レチノール、レチナール、レチノイン酸及び類縁化合物は、レチノイドといわれる。生体内でレチノールに変換されるβ-カロテンなどのカロテノイド類は、プロビタミンAカロテノイドと呼ばれる。数100種類のカロテノイド類が植物によって合成されるが、そのうちの約10%だけがプロビタミンAカロテノイドである (1)。以下の記述は、主に既成ビタミンA及びレチノイン酸に焦点をあてた内容である。
機能
ビタミンA化合物は、レチニルエステル(例えばレチニルパルミテート)の形で主に肝臓に貯蔵される必須の脂溶性分子である。通常は、レチニルエステルは加水分解されて全トランス - レチノールを生成し、これは血流中に放出する前にレチノール結合タンパク質(RBP)に結合する。全トランス-レチノール/ RBP複合体は、全トランス-レチノールを末梢組織へ送るタンパク質であるトランスサイレチンに結合して循環する (2)。カイロミクロン中のレチニルエステルとしてのビタミンAは、特に早期にビタミンAを肝外組織に送る際に重要な役割を果たすことも知られている (3,4) 。
視覚
網膜(retina)は、目の裏側に位置している。光が水晶体を通過すると、網膜によって感知され、脳が認識するための神経インパルスへ変換される。レチノールは、循環系から網膜へ輸送され、網膜色素上皮細胞に蓄積する。ここで、レチノールがエステル化されレチノールエステルが生成され、貯蔵される。必要時に、レチノールエステルが分解(加水分解)し異性化され、11-cis-レチノールを生成し、それがさらに酸化され、11-cis-レチナールを生成する。11-cis-レチナールが、光受容体間マトリックスを通過し桿状体細胞へ到達し、その細胞内でオプシンと呼ばれるタンパク質と結合し視覚色素のロドプシン(視紅とも呼ばれる)を生成する。ロドプシンを伴った桿状体細胞は、極めて微量の光を検知でき、暗視能力にとって重要なものとなる。光の光子吸収が、11-cis-レチナールをall-trans-レチナールへの異性化を触媒し、結果としてそれらを放出する。この異性化が一連のイベントの引き金となり、視神経への電気信号を発生する。視神経により放出される神経インパルスが、脳へ伝達され視覚として認識される。all-trans-レチナールは放出されるとすぐにtrans-レチノールへ変換され、光受容体間マトリックスを通り網膜上皮細胞へ運ばれ、その結果視覚サイクルが完結する (2)。網膜で利用できるレチノールが不足すると、暗順応障害を起こし、いわゆる「夜盲症」になる。
遺伝子発現の制御
レチノイン酸(RA)異性体は、遺伝子発現に影響するホルモンとして働き、多くの生理プロセスに影響を及ぼす。all-trans-RA及び9-cis-RAは、細胞質内のレチノイン酸結合タンパク質(CRABP)のある細胞核へ輸送される。細胞核内で、RAはレチノイン酸受容体タンパク質と結合する。特異的に、all-trans-RAはレチノイン酸受容体(RAR)と結合し、9-cis-RAはレチノイドX受容体(RXR)と結合する。RARとRXRはRAR/RXRヘテロ二量体を形成する。これらへテロ二量体が、レチノイン酸応答エレメント(RARE)と呼ばれる染色体の制御領域と結合する。二量体は2つのタンパク分子の複合体である。ヘテロ二量体は2つの異なるタンパクの複合体で、ホモ二量体は同じタンパクの複合体である。all-trans-RA及び9-cis-RAとRAR及びRXRとの結合は、それぞれ複合体の遺伝子転写を可能とするため、特定タンパク質の合成に影響を及ぼす。RXRは、甲状腺ホルモン受容体(THR)やビタミンD受容体(VDR)ともヘテロ二量体を形成する。このように、ビタミンA、 甲状腺ホルモン及びビタミンDは、相互作用し遺伝子転写に影響する (3)。特定遺伝子の転写に対する促進と抑制によって、レチノイン酸は、高度に特殊な生理的役割である細胞の特殊化、すなわち細胞分化に大きな役割を持つ。ビタミンAに関係する多くの生理作用は、細胞分化における役割から起こると考えられる。
免疫
ビタミンAは、免疫系の正常な機能に必要なため、一般に抗感染性ビタミンといわれる (4)。皮膚と粘膜細胞(気道、消化器官及び尿路を覆う細胞)は、バリアーとして働き、感染に対する生体内の最初の防御ラインを形成する。レチノールとその代謝物は、これらの細胞の完全性と機能性の維持に必要である (5)。ビタミンA及びレチノイン酸(RA)は、免疫反応に重要な役割を持つリンパ球などの白血球細胞の発生や分化に中心的役割を果たす。免疫系の主な制御細胞であるT-リンパ球の活性化が、RARのall-trans-RA結合に必要と考えられる (3)。
成長と発達
ビタミンAの過剰と欠乏は、両方とも先天性異常を起こすことが知られている。レチノール及びレチノイン酸(RA)は、胎児の発育に必須である (4)。胎児の発育中に、RAは、手足の発達及び心臓、眼及び耳の形成に機能を果たす (6)。さらに、RAは、成長ホルモンに対する遺伝子発現を制御することが認められている。
赤血球の産生
全ての血液細胞と同様、赤血球細胞は、幹細胞と呼ばれる前駆細胞から生成する。幹細胞は、正常な赤血球細胞への分化に関して、レチノイドに左右される。さらに、ビタミンAは、赤血球細胞中の酸素運搬体であるヘモグロビンへ導入するために、鉄を貯蔵部位から発達中の赤血球へ移動させることを助長する (2,7)。
栄養成分との相互作用
亜鉛
亜鉛欠乏は、いくつかの点でビタミンA代謝を阻害すると考えられる。(1) 亜鉛欠乏は、循環により組織(網膜など)へレチノールを輸送し、またレチノールの潜在毒性から器官を保護する、レチノール結合タンパク質(RBP)の合成を低下させる。(2) 亜鉛欠乏は、肝臓における貯蔵型であるパルミチン酸レチニルからレチノールを遊離する酵素の活性を低下させる。(3) 亜鉛は、レチノールをレチナールに変換する酵素に必要である (8,9)。現在のところ、人におけるビタミンA栄養状態に及ぼす亜鉛欠乏の健康影響は不明である (10)。
鉄
ビタミンA欠乏は、鉄欠乏性貧血を悪化させる可能性がある。ビタミンA補給は、鉄欠乏性貧血に有効であり、子供や妊婦における鉄の栄養状態を改善する。ビタミンAと鉄の補給の組み合わせは、それぞれの単独補給より、貧血抑制に有効と思われる (11)。さらに、ラットの実験から、鉄欠乏がビタミンAの血漿中レベルと肝臓中レベルを変化させることが報告されている (12,13)。
欠乏症
ビタミンA欠乏と視力
開発途上国の子供の間でのビタミンA欠乏は、主要な予防可能である視力喪失の原因である (14)。ビタミンA欠乏の初期の形跡は、暗所順応障害や夜盲症である。軽度のビタミンA欠乏は、「ビトー斑点」と呼ばれる結膜(眼の隅)中の変化を引き起こす。重度または継続的なビタミンA欠乏は、眼球乾燥症(ドライアイ)と呼ばれる症状を起こし、それは角膜(眼の透明膜)細胞の変化で特徴付けられ、最終的に角膜潰瘍、角膜瘢痕及び失明を起こす (4,9)。
ビタミンA欠乏と感染症
ビタミンA欠乏は、栄養的な後天性免疫不全疾患とみなすことができる (15)。ごく軽度のビタミンA不足の子供でさえ、ビタミンA供給が十分な子供と比較して、感染症による高い死亡率のみならず、呼吸器疾患や下痢などの高い罹患率を示す (16)。ビタミンA補給は、ビタミンA欠乏が日常的な途上国における下痢やはしかに関連する重症度や死亡率を減少させることが認められている (17)。感染が発症すると極めて速やかに血中のレチノール濃度が低下する。この現象は、一般に、肝臓によるレチノール結合タンパク質(RBP)の合成低下に関係するといわれている。このように、ビタミンAの不十分な栄養状態が、感染症からの重症度や死亡確率を高めることと関係するため、感染が悪循環を亢進する。一方で、最近の4つの研究レビューから、ビタミンA補給は、母親から子へのHIV伝染の抑制には効果がないと結論付けられた (19)。ある研究では、ビタミンAが欠乏しているHIV感染女性が、乳児へ3~4倍HIVを伝染させやすいことが認められた (20)。
推奨栄養所要量(RDA)
ビタミンAに対するRDAは、2001年に、米国医学研究所の食品栄養委員会(FNB)により改訂された。最新のRDAは、正常な生殖機能、免疫機能、遺伝子発現及び視力を維持するために、体内中で適切なビタミンA蓄積に必要な量(4ヵ月)に基づいている (21)。下の表に、レチノール当量(RAE)(μg)及び国際単位(IU)の両方のRDA値を示した。これらの単位の詳細情報はRAE章を参照。
疾病予防
がん
培養細胞や実験動物における研究から、天然及び合成のレチノイドが、皮膚、乳、肝臓、結腸、前立腺その他の部位において、有意に発がんを抑制する能力があると報告されている (2)。しかしながら、既成ビタミンAの摂取とがんとの因果関係を試験したヒトの研究結果は、あまり明確ではない。
肺がん
少なくとも10の前向き研究により、後に肺がんを発症した人と発症しなかった人の間で、血中レチノールレベルが比較された。それらの中で、一つの研究だけから、血清中レチノールと肺がんリスクとの間に統計的有意な逆相関が認められた (22)。β-カロテン・レチノール有効性試験(CARET)の結果から、高用量のビタミンAとβ-カロテンが、肺がんの高リスク者では避けるべきであることが示唆された (23)。約9、000人(喫煙者とアスベスト曝露者)が、レチノール25、000 IUとβ-カロテン30 mgを1日当たりの処方量として投与され、一方で同数の人にプラセボが投与された。追跡4年後、肺がんの発症率は、対照群と比較し、補給群で28%高くなった。このような結果について考えられる説明は、タバコやアスベスト曝露により生成された肺の酸化的環境が、発がんに関与する異常な量のカロテノイド分解産物を生成させるのではないかということである。現在のところ、レチノールの効果は、喫煙者と非喫煙者で異なっているのかもしれないが、レチノール摂取の増量が、肺がんリスクを減少させることはなさそうである (22)。
乳がん
レチノール及びその代謝物は、in vitroで乳がん細胞の生育を抑制することが認められているが、ヒトにおける食事からのレチノール摂取量の観察研究では、in vivoでこのことは確認されていない (24)。大部分の疫学研究からは、女性におけるレチノール摂取量と乳がんリスクとの間に有意な相関は認められていない (25-28) が、一つの大規模な前向き研究から、総ビタミンA摂取量が、乳がんの家族歴をもつ閉経前女性における乳がんリスクと逆相関が認められた (29)。レチノールの血中レベルは、既成ビタミンAとβ-カロテンのようなプロビタミンAカロテノイドの両方の摂取量を反映している。症例-対照研究からは、血清中レチノールレベルと血清中抗酸化物質レベルが、乳がんリスクと逆相関することが認められ (30)、2つの前向き研究からは、血中レチノール濃度と進行性乳がんのその後のリスクとの間に有意な相関は認められなかった (31,32)。現在のところ、既成ビタミンAまたはレチノールの摂取量増加が、人において乳がんリスクを減少させるという証拠はほとんどない。
疾病治療
レチノイドの薬理学的用量(上限レベルも参照)
レチノイドは、網膜色素変性、急性前骨髄球性白血病及び様々な皮膚疾患などのいくつかの症状を治療するために薬理学的用量で使用される。天然または合成のレチノイドの高用量処置が、体自体の制御メカニズムを無効としないように注意することが重要である。従って、レチノイド治療は、潜在的な副作用と毒性を伴う。さらに、全てのレチノイド化合物は、先天性異常を起こすことが認められている。そこで、妊娠する可能性のある女性は、これらの薬物治療を避けるべきである。レチノイドは、作用期間が長い傾向にある。副作用や先天性異常は、レチノイド治療を止めた数ヵ月後に起こることが報告されている (2)。以下に議論するレチノイドは処方薬のことであり、医師の管理下で用いるべきである。
網膜色素変性(Retinitis pigmentosa)
網膜色素変性とは、目網膜中の光受容体細胞(桿状体と錘状体)に進行性の消失を起こす広い範囲での遺伝性障害のことをいう (33)。網膜色素変性の初期症状は、暗所順応の損傷と夜盲症であり、その後時間の経過とともに周辺視覚と中心視覚が徐々に低下していく。一般的な網膜色素変性の症状を持つ600人以上被験者による無作為化比較対照試験(randomized controlled trial)の結果から、既成ビタミンA(レチノール)を4、500 μg(15、000 IU)/日で補給することにより、4~6年の期間で有意に網膜機能の低下を遅らせることが示唆された (34)。対照的に、ビタミンEの400 IU/日補給は、程度は低いが有意に網膜機能の低下を強め、一般的な網膜色素変性患者の治療に、長期間のビタミンA補給は有効であるが、代表的なマルチビタミンにみられるような高いレベルでのビタミンE補給は避けるべきであることを示唆していた。これらの患者の12年までの追跡調査からは、過剰なビタミンA摂取から起こる肝毒性のいかなる徴候も認められなかった (35)。網膜色素変性の過程を遅らせるための高用量ビタミンA補給は、医師の指示を必要とし、妊娠の可能性がある場合は服用を中止しなければならない(「安全性」参照)。
急性前骨髄球性白血病(Acute promyelocytic leukemia)
骨髄における正常な骨髄幹細胞の分化は、血小板、赤血球細胞及び免疫反応に重要な白血球細胞を誘導する。それらの幹細胞の分化異常は、未成熟の白血病細胞の増殖をもたらし、白血病を引き起こす。レチノイン酸受容体(RAR)の突然変異が、急性前骨髄球性白血病(APL)と呼ばれる特異的な白血病患者で発見された。all-trans-レチノイン酸またはall-trans-パルミチン酸レチニルにより処置で、正常な分化状態を回復し、数名のAPL患者における症状改善になる (2,18)。
皮膚の疾患
天然と合成のレチノイドは、両方とも皮膚障害治療の医薬品として使用されている。エトレチネートとアシトレチンは、乾癬(白い鱗屑に覆われた赤い班を特徴とする慢性皮膚疾患)の治療に有効なレチノイドであり、トレチノイン(レチン-A)とイソトレチノイン(アキュテイン)は、重度のニキビ(痤瘡)治療に有効である。レチノイドは、皮膚の成長因子やそれらの受容体の転写にほとんど影響を及ぼさないとされる (2)。妊娠女性によるレチノイドの薬物服用は、先天性異常を起こす(「妊娠中の安全性」参照)。
摂取源
レチノール活性当量(RAE)
各種の食事からのビタミンA摂取源は異なる利用能を持つ。例えば、β-カロテンは、レチノールよりは吸収が容易ではなく、体内でレチナールやレチノールに変換される必要がある。最も新しいビタミンA単位に対する国際基準はレチノール活性当量(RAE)で、ビタミンA活性をレチノールとして表現する。サプリメントとして供給される油脂中のβ-カロテンの2 μgは、体内でレチノール1 μgに変換され、RAE比は2:1になる。一方、体内でレチノール1 μgを供給するために、食品からのβ-カロテン12 μgが必要で、食事からのβ-カロテンのRAEは12:1である。他の食品中のプロビタミンAカロテノイドは、β-カロテンほど容易に吸収されないため、RAE比は24:1になる。β-カロテンと他のプロビタミンAカロテノイドのRAE比を下表に示す (21)。今なお一般的に使用される古い国際標準は、国際単位(IU)である。1 IUはレチノール0.3 μgに相当する。
食事摂取源
遊離のレチノールは食品中には一般には存在しない。レチノールの前駆体及び貯蔵形態であるパルミチン酸レチニルが、動物由来食品に認められる。植物は、ビタミンA前駆体であるいくつかのカロテノイドを含む(α-カロテン、β-カロテン及びβ-クリプトキサンチン等)。黄色や橙色の野菜は有意な量のカロテノイド類を含有する。緑色野菜もカロテノイドを含むが、色素がクロロフィルの緑色に隠されている (1)。多くの良質なビタミンAの食品源を、レチノール当量(μg RAE)としてのビタミンA含量とともに下表に示した。レチノール活性が、主としてプロビタミンAカロテノイドに由来する食品について、カロテノイド含量とレチノール活性当量を示した。リコペン、ルテイン及びゼアキサンチンなど数種異なるカロテノイド含量を確認するために、USDA食品成分データベースを用いることが可能である。しかしながら、USDAデータベース中のビタミンA のIUは、様々なカロテノイドの生物学的利用能を考慮していない。カロテノイドを含む食品中のビタミンAについてのより正確なIU値を得るためには、RAEに3.33を乗ずる。
サプリメント
サプリメント中の既成ビタミンA(レチノール)の基本的な形態は、パルミチン酸レチニルと酢酸レチニルである。β-カロテンもサプリメント中の一般的なビタミンA供給源で、多くのサプリメントはレチノールとβ-カロテンを組み合わせて供給される (36)。サプリメント中の総ビタミンA含量の割合がβ-カロテンに由来する場合、この情報がビタミンAのサプリメント表示ラベルに加えられる(「サプリメント表示ラベル」参照:注)別文書)。米国で入手できるほとんどのマルチビタミン補助食品は、ビタミンAを1、500 μg(5、000 IU)供給しているため、ビタミンAに対する現在のRDAより多くなる。このことは、サプリメント表示についてFDAが用いる一日摂取量(DV)が、最新のRDAよりもむしろ1968年に設定されたRDAに基づいているためで、マルチビタミンサプリメントは、一般的にほとんどの栄養成分ついてのDVの100%を供給している。レチノールの5、000 IU/日摂取量は、高齢者における骨粗鬆症のリスク増加と関係しているため(「安全性」参照)、会社によっては、マルチビタミンサプリメント中のレチノール含量を750 μg(2、500 IU)まで下げているところもある。
安全性
毒性
ビタミンA毒性により起こる症状は、「ビタミンA過剰症」と呼ばれる。これは、カロテノイドではなく既成ビタミンAの過剰摂取により起こされる。既成ビタミンAは速やかに吸収され、体内からの排泄は遅い。したがって、既成ビタミンAによる毒性は、実際には、短期間の高用量曝露またはかなり低い摂取量による慢性曝露から起こる (2)。急性のビタミンA毒性は比較的まれで、症状には、吐き気、頭痛、倦怠感、食欲不振、めまい、皮膚乾燥(乾燥肌)、落屑(外側皮膚の喪失)及び脳水腫などである。慢性毒性の徴候は、かゆみを伴う皮膚乾燥、落屑、食欲不振、頭痛、脳水腫及び骨・間接の痛みなどである。また、乳児におけるビタミンAの毒性症状は、泉門(胎児・乳児の頭蓋骨にある膜でおおわれた間隙)の隆起である。ビタミンA過剰症が重度の場合、肝障害、出血及び昏睡を起こす可能性がある。概して、毒性の徴候は、RDAの10倍(8、000~10、000 μg/日、または25、000~33、000 IU)以上のビタミンAの長期摂取に関係している。しかしながら、潜在性(無症状性)のビタミンA毒性が特定集団に懸念があるかどうか判断するためには、さらに研究が必要である (37)。高齢者、慢性アルコール摂取者及び高コレステロールに対する遺伝的素因をもつ人々など、いくつかの集団が、比較的低用量で毒性を受けやすい可能性があるとの証拠がある (8)。2001年1月に、米国医学研究所の食品・栄養委員会(FNB)は、成人に対するビタミンAの耐容上限摂取量(UL)を、既成ビタミンAとして3、000 μg(10、000 IU)/日に設定した (21)。
妊娠中の安全性
正常な胎児発育には十分なビタミンA摂取量が必要であるが、妊娠中の過剰な既成ビタミンA(レチノール)摂取は、先天性異常を誘発するといわれている。3、000 μg/日(10、000 IU/日)未満の用量でのサプリメントからの既成ビタミンAでは、ビタミンAに関係する先天性異常のリスク増加は認められていない (21)。米国における多数の商品に既成ビタミンAが添加されているため、妊娠女性は、1、500 μg(5、000 IU)以上のビタミンAを含むマルチビタミンまたは出産前サプリメントを避けるべきである。β-カロテン由来のビタミンAが、先天性異常のリスクを高めることは知られていない。レチノールの合成誘導体であるエトレチネートやイソトレチノイン(アキュテイン)は、重い先天異常を誘発することが知られ、妊娠時または妊娠する可能性がある場合、摂取してはいけない (38)。もう一つのレチノール誘導体のトレチノイン(レチン-A)は、皮膚に塗布する局所剤として処方されている。局所からのトレチノインが全身吸収される可能性があるため、妊娠中での使用は推奨されない。
ビタミンAの高摂取は骨粗鬆症リスクを高めるか?
いくつかの研究結果から、ビタミンA摂取量が、骨ミネラル密度(BMD)や骨折リスクの及ぼす有害影響と関係しないことが示されている (39-41)。しかしながら、いくつかの前向き研究の結果からは、1、500 μg/日(5、000 IU/日)を超える既成ビタミンAの長期間摂取が、高齢の男女において、骨粗鬆症性骨折及びBMD低下のリスク増加と関係することが示唆されている (42-44)。この摂取レベルはRDAの700~900 μg/日(2、300~3、000 IU/日)より高いが、実質的にはULの3、000 μg/日(10、000 IU/日)よりは低い。β-カロテンではなく既成ビタミンA(レチノール)の過剰摂取だけが、骨の健康への悪性影響と関係があった。これらの観察研究からは、過剰のレチノール摂取と骨粗鬆症との間の関係に関する根拠を得ることはできないが、限られた実験データでは、過剰のレチノールが、骨吸収を亢進する可能性 (45)、あるいはカルシウムバランスを維持するビタミンDの作用を阻害する可能性 (46) が示唆されている。米国において、5、000 IU/日を超えるレチノール摂取量は、定期的にマルチビタミンサプリメントやいくつかの朝食シリアルなどの強化食品を摂取する人々では容易に到達することができる。影響範囲のもう一方では、有意な数の年配者はビタミンA摂取量が不足しており、それもまたBMD低下と関係がある。ある高齢男女の研究では、BMDが、RDAに近いビタミンA摂取量が最適であることが認められた (43)。サプリメントや強化食品が現在のビタミンAに対するRDAを反映するように改良されるまで、ビタミンAを2、500 IU含むマルチビタミンサプリメント、または最低50%がβ-カロテンに由来するビタミンAを5、000 IU含むマルチビタミンサプリメントを求めることは有意義ではある。
薬物との相互作用
慢性のアルコール摂取は、ビタミンAの肝臓蓄積を枯渇させ、アルコール誘発性の肝障害の原因になる (47)。一方で、既成ビタミン(レチノール)の肝毒性は、慢性アルコール摂取により亢進されるため、アルコール依存症におけるビタミンA補給のための治療幅を狭めることになる (48)。エストロゲンやプロゲスチンを含む経口避妊薬は、肝臓によるレチノール結合タンパク質(RBP)合成を増進させ、血中におけるRBP-レチノール複合体の排出を増加させる。これがビタミンAの食事からの必要量を増加させるかどうか不明であるが、レチノイドやアシトレチン、all-trans-レチノイン酸、ベキサロテン、エトレチネート及びイソトレチノイン(アキュテイン)などのレチノイド同族体は、ビタミンA毒性のリスクを高めるため、ビタミンAサプリメントといっしょに使うべきではない (36)。
ライナス・ポーリング研究所の推奨
ビタミンAに対するRDA (女性2、300 IU/日、男性3、000 IU/日)は、正常な遺伝子発現、免疫機能及び視覚を維持するために十分な量である。しかしながら、ライナスポーリング研究所の推奨に従って毎日マルチビタミン/ミネラルのサプリメントを摂取することは、高齢者における骨の健康に及ぼす悪性影響と関係する量である、レチノールとして5、000 IU/日のビタミンAを供給することになる。このため、我々は、2、500 IU(750 μg)くらいの既成ビタミン(通常、ビタミンA酢酸塩またはビタミンAパルミチン酸塩と表示される)、及びβ-カロテンとして2、500 IU程度の追加のビタミンAを供給するマルチビタミン/マルチミネラルのサプリメントをとることを推奨した。作用の強いビタミンAサプリメントは、毒性リスクがあるため、医師の指導なく使用すべきではない。
高齢者(65歳以上)
現在、高齢者におけるビタミンA必要量が、若い成人の必要量と異なるという証拠はほとんどない。さらに、ビタミンAの毒性は、高齢者では、若い成人より低い用量で発生する可能性がある。ライナスポーリング研究所の推奨に従って毎日マルチビタミン/ミネラルのサプリメントを摂取することは、高齢者における骨の健康の悪影響と関係する量である、レチノールとして5、000 IU/日供給することになる。このため、我々は、2、500 IU(750 μg)くらいの既成ビタミンA(通常、ビタミンA酢酸塩またはビタミンAパルミチン酸塩と表示される)、及びβ-カロテンとして2、500 IU程度の追加のビタミンAを供給するマルチビタミン/マルチミネラルのサプリメントをとることを推奨した。作用の強いビタミンAサプリメントは、毒性リスクがあるため、医師の指導なく使用すべきではない。
Authors and Reviewers
Originally written in 2000 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in December 2003 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in November 2007 by:
Victoria J. Drake, Ph.D.
Linus Pauling Institute
Oregon State University
Copyright 2000-2024 Linus Pauling Institute
References
1. Groff JL. Advanced Nutrition and Human Metabolism. 2nd ed. St Paul: West Publishing; 1995.
2. Ross AC. Vitamin A and retinoids. In: Shils M、 Olson JA、 Shike M、 Ross AC. ed. Modern Nutrition in Health and Disease. 9th ed. Baltimore: Lippincott Williams & Wilkins; 1999:305-327.
3. Semba RD. The role of vitamin A and related retinoids in immune function. Nutr Rev. 1998;56(1 Pt 2):S38-48.
4. Semba RD. Impact of vitamin A on immunity and infection in developing countries. In: Bendich A、 Decklebaum RJ、 eds. Preventive Nutrition: The Comprehensive Guide for Health Professionals. 2nd ed. Totowa: Humana Press Inc; 2001:329-346.
5. McCullough、 F. et al. The effect of vitamin A on epithelial integrity. Nutr Soc. 1999; volume 58: pages 289-293. (PubMed)
6. Solomons NW. Vitamin A and carotenoids. In: Bowman BA、 Russell RM、 eds. Present Knowledge in Nutrition. 8th ed. Washington、 D.C.: ILSI Press; 2001:127-145.
7. Lynch SR. Interaction of iron with other nutrients. Nutr Rev. 1997;55(4):102-110. (PubMed)
8. Russell RM. The vitamin A spectrum: from deficiency to toxicity. Am J Clin Nutr. 2000;71(4):878-884. (PubMed)
9. Brody T. Nutritional Biochemistry. 2nd ed. San Diego: Academic Press; 1999.
10. Christian P、 West KP、 Jr. Interactions between zinc and vitamin A: an update. Am J Clin Nutr. 1998;68(2 Suppl):435S-441S. (PubMed)
11. Suharno D、 West CE、 Muhilal、 Karyadi D、 Hautvast JG. Supplementation with vitamin A and iron for nutritional anaemia in pregnant women in West Java、 Indonesia. Lancet. 1993;342(8883):1325-1328. (PubMed)
12. Jang JT、 Green JB、 Beard JL、 Green MH. Kinetic analysis shows that iron deficiency decreases liver vitamin A mobilization in rats. J Nutr. 2000;130(5):1291-1296. (PubMed)
13. Rosales FJ、 Jang JT、 Pinero DJ、 Erikson KM、 Beard JL、 Ross AC. Iron deficiency in young rats alters the distribution of vitamin A between plasma and liver and between hepatic retinol and retinyl esters. J Nutr. 1999;129(6):1223-1228. (PubMed)
14. Underwood BA、 Arthur P. The contribution of vitamin A to public health. FASEB J. 1996;10(9):1040-1048. (PubMed)
15. Semba RD. Vitamin A and human immunodeficiency virus infection. Nutr Soc. 1997;56(1B):459-469.
16. Field CJ、 Johnson IR、 Schley PD. Nutrients and their role in host resistance to infection. J Leukoc Biol. 2002;71(1):16-32. (PubMed)
17. West CE. Vitamin A and measles. Nutr Rev. 2000;58(2 Pt 2):S46-54.
18. Thurnham DI、 Northrop-Clewes CA. Optimal nutrition: vitamin A and the carotenoids. Nutr Soc. 1999;58(2):449-457. (PubMed)
19. Wiysonge CS、 Shey MS、 Sterne JA、 Brocklehurst P. Vitamin A supplementation for reducing the risk of mother-to-child transmission of HIV infection. Cochrane Database Syst Rev. 2005;(4):CD003648. (PubMed)
20. Ramasethu J. Semba RD、 et al.、 Maternal vitamin A deficiency and mother-to-child transmission of HIV-1. Lancet 1994;343:1593-7. Pediatr AIDS HIV Infect. 1995;6(5):303-304.
21. Food and Nutrition Board、 Institute of Medicine. Vitamin A. Dietary Reference Intakes for Vitamin A、 Vitamin K、 Arsenic、 Boron、 Chromium、 Copper、 Iodine、 Iron、 Manganese、 Molybdenum、 Nickel、 Silicon、 Vanadium、 and Zinc. Washington、 D.C.: National Academy Press; 2001:82-161. (National Academy Press)
22. Comstock GW、 Helzlsouer KJ. Preventive nutrition and lung cancer. In: Bendich A、 Decklebaum RJ、 eds. Preventive Nutrition: The Comprehensive Guide for Health Professionals. 2nd ed. Totowa: Humana Press Inc; 2001:97-129.
23. Omenn GS、 Goodman GE、 Thornquist MD、 et al. Effects of a combination of beta carotene and vitamin A on lung cancer and cardiovascular disease. N Engl J Med. 1996;334(18):1150-1155. (PubMed)
24. Prakash P、 Krinsky NI、 Russell RM. Retinoids、 carotenoids、 and human breast cancer cell cultures: a review of differential effects. Nutr Rev. 2000;58(6):170-176. (PubMed)
25. Bohlke K、 Spiegelman D、 Trichopoulou A、 Katsouyanni K、 Trichopoulos D. Vitamins A、 C and E and the risk of breast cancer: results from a case-control study in Greece. Br J Cancer. 1999;79(1):23-29. (PubMed)
26. Franceschi S. Micronutrients and breast cancer. Eur J Cancer Prev. 1997;6(6):535-539. (PubMed)
27. Longnecker MP、 Newcomb PA、 Mittendorf R、 Greenberg ER、 Willett WC. Intake of carrots、 spinach、 and supplements containing vitamin A in relation to risk of breast cancer. Cancer Epidemiol Biomarkers Prev. 1997;6(11):887-892. (PubMed)
28. Michels KB、 Holmberg L、 Bergkvist L、 Ljung H、 Bruce A、 Wolk A. Dietary antioxidant vitamins、 retinol、 and breast cancer incidence in a cohort of Swedish women. Int J Cancer. 2001;91(4):563-567. (PubMed)
29. Zhang S、 Hunter DJ、 Forman MR、 et al. Dietary carotenoids and vitamins A、 C、 and E and risk of breast cancer. J Natl Cancer Inst. 1999;91(6):547-556. (PubMed)
30. Ching S、 Ingram D、 Hahnel R、 Beilby J、 Rossi E. Serum levels of micronutrients、 antioxidants and total antioxidant status predict risk of breast cancer in a case control study. J Nutr. 2002;132(2):303-306. (PubMed)
31. Hulten K、 Van Kappel AL、 Winkvist A、 et al. Carotenoids、 alpha-tocopherols、 and retinol in plasma and breast cancer risk in northern Sweden. Cancer Causes Control. 2001;12(6):529-537. (PubMed)
32. Dorgan JF、 Sowell A、 Swanson CA、 et al. Relationships of serum carotenoids、 retinol、 alpha-tocopherol、 and selenium with breast cancer risk: results from a prospective study in Columbia、 Missouri (United States). Cancer Causes Control. 1998;9(1):89-97. (PubMed)
33. van Soest S、 Westerveld A、 de Jong PT、 Bleeker-Wagemakers EM、 Bergen AA. Retinitis pigmentosa: defined from a molecular point of view. Surv Ophthalmol. 1999;43(4):321-334. (PubMed)
34. Berson EL、 Rosner B、 Sandberg MA、 et al. A randomized trial of vitamin A and vitamin E supplementation for retinitis pigmentosa. Arch Ophthalmol. 1993;111(6):761-772. (PubMed)
35. Sibulesky L、 Hayes KC、 Pronczuk A、 Weigel-DiFranco C、 Rosner B、 Berson EL. Safety of <7500 RE (<25000 IU) vitamin A daily in adults with retinitis pigmentosa. Am J Clin Nutr. 1999;69(4):656-663. (PubMed)
36. Hendler SS、 Rorvik DR、 eds. PDR for Nutritional Supplements. Montvale: Medical Economics Company、 Inc; 2001.
37. Penniston KL、 Tanumihardjo SA. The acute and chronic toxic effects of vitamin A. Am J Clin Nutr. 2006;83(2):191-201. (PubMed)
38. Chan A、 Hanna M、 Abbott M、 Keane RJ. Oral retinoids and pregnancy. Med J Aust. 1996;165(3):164-167. (PubMed)
39. Rejnmark L、 Vestergaard P、 Charles P、 et al. No effect of vitamin A intake on bone mineral density and fracture risk in perimenopausal women. Osteoporos Int. 2004;15(11):872-880. (PubMed)
40. Sowers MF、 Wallace RB. Retinol、 supplemental vitamin A and bone status. J Clin Epidemiol. 1990;43(7):693-699. (PubMed)
41. Ballew C、 Galuska D、 Gillespie C. High serum retinyl esters are not associated with reduced bone mineral density in the Third National Health And Nutrition Examination Survey、 1988-1994. J Bone Miner Res. 2001;16(12):2306-2312. (PubMed)
42. Michaelsson K、 Lithell H、 Vessby B、 Melhus H. Serum retinol levels and the risk of fracture. N Engl J Med. 2003;348(4):287-294. (PubMed)
43. Promislow JH、 Goodman-Gruen D、 Slymen DJ、 Barrett-Connor E. Retinol intake and bone mineral density in the elderly: the Rancho Bernardo Study. J Bone Miner Res. 2002;17(8):1349-1358. (PubMed)
44. Feskanich D、 Singh V、 Willett WC、 Colditz GA. Vitamin A intake and hip fractures among postmenopausal women. JAMA. 2002;287(1):47-54. (PubMed)
45. Rohde CM、 DeLuca H. Bone resorption activity of all-trans retinoic acid is independent of vitamin D in rats. J Nutr. 2003;133(3):777-783. (PubMed)
46. Johansson S、 Melhus H. Vitamin A antagonizes calcium response to vitamin D in man. J Bone Miner Res. 2001;16(10):1899-1905. (PubMed)
47. Wang XD. Chronic alcohol intake interferes with retinoid metabolism and signaling. Nutr Rev. 1999;57(2):51-59. (PubMed)
48. Leo MA、 Lieber CS. Alcohol、 vitamin A、 and beta-carotene: adverse interactions、 including hepatotoxicity and carcinogenicity. Am J Clin Nutr. 1999;69(6):1071-1085. (PubMed)
ビタミンB12
目次
要旨
- ビタミンB12、別名コバラミンは葉酸塩の代謝、およびクエン酸回路の中間体であるスクシニルCoAの合成に必須の役割を果たす。(詳細はこちら)
- ビタミンB12欠乏症は慢性的な胃の炎症と一般的に関連があり、これは悪性貧血と呼ばれる自己免疫性のビタミンB12吸収不全症および食品タンパク質結合ビタミンB12吸収不全症に寄与しているかもしれない。ビタミンB12の吸収が損なわれると、欠乏症の者に巨赤芽球性貧血や神経性の障害を起こすことがある。(詳細はこちら)
- 60歳超の個人では、食品に結合したビタミンB12の吸収に必要な消化器系の正常な機能が一般的に損なわれており、それがビタミンB12欠乏症のリスクをもたらす。(詳細はこちら)
- ビタミンB12と葉酸塩はホモシステイン代謝に重要である。血中ホモシステイン濃度が高いことは、心血管疾患(CVD)のリスク要因である。ビタミンB補給がホモシステイン濃度の制御に有効であることは証明されているが、介入試験による現在のデータでは、ホモシステイン濃度を下げることがCVDリスクを減少させるとは示されていない。(詳細はこちら)
- DNAの完全性は、葉酸塩とビタミンB12の利用性によって保持される。ビタミンB12の栄養状態が悪いことは、いくつかの観察研究で乳がんリスクの上昇と関連があったが、すべての研究でそうだったわけではない。葉酸とともにビタミンB12補給をすることで乳がんの発症が減るのかどうかを評価する必要がある。(詳細はこちら)
- 母体のビタミンB12の状態が悪いことは、神経管欠損(NTD)のリスク上昇と関連があるが、ビタミンB12補給がNTDリスクの減少に役立つのかどうかは不明である。(詳細はこちら)
- ビタミンB12は、神経細胞の周りのミエリン鞘の保持と神経伝達物質の合成に不可欠である。高ホモシステイン血症は認知機能の損傷リスクを高めるかもしれないが、ビタミンB12欠乏症が年配者の認知症リスクに寄与するのかどうかは不明である。ビタミンB補給は年配の被験者のホモシステイン濃度を下げるが、長期間の有益性についてはわからない。(詳細はこちら)
- うつ病と骨粗鬆症のどちらも、ビタミンB12の栄養状態が悪くなることや高ホモシステイン濃度と関連がある。(詳細はこちら)
- 動物性食品はビタミンB12の主要な摂取源となっている。ビタミンB12の必要量を満たすために、年配者と完全菜食主義者(ヴィーガン)にはビタミンB12が強化された食品やサプリメントの使用が推奨される。(詳細はこちら)
- 胃酸分泌阻害薬のような特定の薬剤の長期使用は、ビタミンB12の吸収に悪影響を与えることがある。(詳細はこちら)
ビタミンB12は全てのビタミンの中で最大で最も複雑な化学構造をしている。金属イオンであるコバルトを含むということで、ビタミンの中でビタミンB12は独特である。そのため、コバラミンという用語がビタミンB12の活動をする化合物を指し示すのに使用される。メチルコバラミンおよび5-デオキシアデノシルコバラミンは、ヒトの体内で使用されるビタミンB12の形態である(1)。ほとんどの栄養補助食品や栄養強化食品で使用されるコバラミンの形態であるシアノコバラミンは、体内ですぐに5-デオキシアデノシルコバラミンやメチルコバラミンに変換される。哺乳類では、コバラミンはメチオニン合成酵素およびLメチルマロニルCoAムターゼという2つの酵素のみの補助因子である(2)。
機能
メチオニン合成酵素の補助因子
メチルコバラミンは、葉酸依存性酵素であるメチオニン合成酵素の機能に必要である。この酵素は、ホモシステインからアミノ酸であるメチオニンを合成するために必要である。次にメチオニンはSアデノシルメチオニンの合成に必要であり、これはDNA、RNA、およびタンパク質内での多部位のメチル化を含むたくさんの生物学的メチル化反応で使用されるメチル基供与体である(3)。DNAやタンパク質のメチル化異常はクロマチン構造や遺伝子発現の変化を引き起こすが、これはがん細胞に一般的な特徴である。メチオニン合成酵素の機能が不適切だとホモシステインの蓄積につながることがあり、これは心血管疾患のリスク上昇と関連がある(図1参照)。
L-メチルマロニルCoA ムターゼの補助因子
5-デオキシアデノシルコバラミンは、L-メチルマロニルCoAからスクシニル補酵素A(スクシニルCoA)への変換の触媒作用をする酵素に必要であり、この物質はその後クエン酸回路に入る(図2参照)。スクシニルCoAは脂質やタンパク質からのエネルギー生成に重要な働きをしており、赤血球の酸素運搬色素であるヘモグロビンの合成にも必要である(3)。
欠乏症
健康な個人では、ビタミンB12欠乏症は稀である。これは主に、体全体の貯蔵が2,500μgを超えること、日々の代謝回転がゆっくりなこと、および適切なビタミンB12の状態を維持するのにわずか2.4μg/日の食事からの摂取で十分なこと(「RDA」の項参照)などが理由である(4)。年配者ではビタミンB12欠乏症はより一般的で、これは腸管吸収が損なわれることが原因であり、この集団のビタミンB12欠乏症ぎみひいては重篤な欠乏症に至ることがある。
ビタミンB12欠乏症の原因
ビタミンB12欠乏症のほとんどの症例は、食事からの不適切な摂取ではなく腸での吸収不全で説明できる(5)。食物からビタミンB12を吸収するには、胃、膵臓、および小腸の機能が正常でなければならない。胃酸と酵素が食物からビタミンB12を遊離し、唾液や胃液にあるRタンパク質(トランスコバラミン-1またはハプトコリンともいう)と結合できるようにする。小腸のアルカリ性環境中で、Rタンパク質は膵酵素によって分解され、これによりビタミンB12が胃の特殊な細胞から分泌されるタンパク質である内因子(IF)と結合できるように遊離される。回腸(小腸の最終部)の表面にある受容体が、膵臓によって供給されるカルシウムがある場合にのみIF-B12複合体を吸収する(5)。ビタミンB12は受動拡散によっても吸収されうるが、このプロセスは非常に非効率的である。ビタミンB12の用量のうち、わずか約1%だけが受動的に吸収される(2)。ビタミンB12欠乏症の一般的な原因は(1)悪性貧血として知られる自己免疫性の容態、および(2)食品タンパク質結合ビタミンB12吸収不全である。どちらも萎縮性胃炎という胃の慢性炎症性疾患に関連する。
萎縮性胃炎
60歳を超えた者の10~30%が萎縮性胃炎を発症していると考えられている(6)。この症状は、胃の細胞に直接作用する自己抗体があること(「悪性貧血」の項参照)、および/またはヘリコバクター・ピロリ菌(H.ピロリ菌)による感染としばしば関連している(7)。H.ピロリ菌感染は胃の慢性炎症を引き起こし、これが消化性潰瘍、萎縮性胃炎、および/または胃がんへと進行する者もいる。萎縮性胃炎にかかった個人の胃機能の衰退によって小腸での細菌の異常増殖へと至り、食品タンパク質結合ビタミンB12吸収不全を起こすことがある。H.ピロリ菌に感染した個人は、血清、血漿、および胃液中のビタミンB12濃度がかなり低くなり、除菌によって血清ビタミンB12濃度が大きく向上することが示されている(8)。
悪性貧血
悪性貧血は60歳を超えた者の約2%に見られると推定されている(9)。貧血はしばしばその症状となるが、この症状は実は自己免疫性萎縮性胃炎として知られる胃の自己免疫性炎症の末期症状であり、自分自身の抗体(自己抗体)によって胃の細胞が破壊されることになる。胃の内側を覆う細胞の進行的な破壊によって、食物に結合したビタミンB12の遊離に必要な酸や酵素の分泌が減ってしまう。内因子(IF)の抗体はIFと結合しIF-B12複合体の生成を妨げ、さらにビタミンB12の吸収を阻害する。悪性貧血患者の親戚の約20%も同じ症状があり、遺伝的素因が示唆される。ある集団では、H.ピロリ菌感染が自己免疫反応を引き起こすことに関わっているとも思われる(10)。また、自己免疫性萎縮性胃炎とその他の自己免疫症状、特に自己免疫性甲状腺炎や1型糖尿病の同時発生も報告されている(11, 12)。
悪性貧血の治療には、腸での吸収をバイパスするためにビタミンB12の注射が一般的に必要である。高用量経口補給も別の治療選択肢である。なぜなら1,000μg(1mg)/日のビタミンB12を経口摂取することは、受動拡散によって約10μg/日(用量の1%)を吸収することになるからである。実際、高用量経口治療は筋肉内注射と同様に有効であると考えられている(4)。
食品タンパク質結合ビタミンB12吸収不全
食品タンパク質結合ビタミンB12吸収不全は、食物つまりタンパク質に結合したビタミンB12を吸収する能力が損なわれることと定義される。この疾患の個人は、遊離型を全部吸収することができる(13)。この疾患は年配者の集団におけるビタミンB12の栄養不良の主な原因であるが、それは萎縮性胃炎と通常関連している。萎縮性胃炎は胃の内膜の慢性的炎症で、究極的には胃腺を消失(萎縮)し胃酸の分泌を減少させることになる(「萎縮性胃炎」の項参照)。胃酸は食物に含まれるタンパク質からビタミンB12を遊離するのに必要であるので、ビタミンB12の吸収が減ってしまう。胃酸生成が減ると、胃の中で嫌気性細菌の異常増殖につながる環境も作り出されてしまい、ビタミンB12吸収にさらに支障をきたす(3)。サプリメントのビタミンB12はタンパク質と結合しておらず、内因子(IF)は今だに利用可能であることから、サプリメントのビタミンB12の吸収は悪性貧血の場合ほど減らない。したがって食品タンパク質結合ビタミンB12吸収不全の個人は、ビタミンB12の要求量が増えない。ただ単に強化食品や栄養補助サプリメントに含まれる結晶型の形態のビタミンB12を必要とする。
ビタミンB12欠乏症のその他の原因
ビタミンB12欠乏症のその他の原因には、IF-B12複合体の受容体がある胃や小腸の一部を外科的に切除することが含まれる。吸収不全症候群(セリアック病や熱帯性スプルー)などの小腸に影響する疾患でも、ビタミンB12欠乏症になるかもしれない。膵臓は重要な酵素とビタミンB12の吸収に必要なカルシウムとを提供するので、膵機能不全もビタミンB12欠乏症に寄与する可能性がある。ビタミンB12は動物性の食物にしか含まれないので、厳密な菜食主義者(ヴィーガン)の食事はビタミンB12欠乏症を起こしてきた。またアルコール依存症の者は、腸でのビタミンB12の吸収が減ることがあるかもしれない(2)。さらに、後天性免疫不全症候群(AIDS)の個人は、おそらくIF-B12複合体を受けるIF-B12受容体の不全症に関係して欠乏症のリスクが高いようである(3)。そのほか、胃酸抑制剤の長期使用もビタミンB12欠乏症に関わっている(「薬物相互作用」の項参照)。
ビタミンB12吸収の遺伝性疾患
ビタミンB12代謝の先天性異常の稀な症例が文献で報告されている((5)でレビュー)。イメルスルンド-グレスベック症候群は遺伝性のビタミンB12吸収不全症候群で、これを患う個人に巨赤芽球性貧血や様々な重篤度の神経障害を引き起こす。遺伝性のIF欠乏症(先天性悪性貧血とも呼ばれる)の個人にも同様の臨床症状が見られ、この個人ではIFの欠如がビタミンB12吸収の欠陥となってしまう。さらに、体内でのビタミンB12輸送に影響する突然変異も確認されている(14)。
ビタミンB12欠乏症の症状
ビタミンB12欠乏症は、ビタミンB12を必要とする酵素の活動の障害となる。メチオニン合成酵素の活動に障害があるとホモシステインの濃度上昇が起こり、L-メチルマロニルCoAムターゼの活動に障害があれば、メチルマロニル酸(MMA)というメチルマロニルCoAの代謝物の濃度上昇に至る。軽度のビタミンB12欠乏症の個人は症状を感じないかもしれないが、血中のホモシステインおよび/またはMMA濃度は上昇しているかもしれない(15)。
巨赤芽球性貧血
ビタミンB12欠乏症でメチオニン合成酵素の活動が減ると、テトラヒドロ葉酸(THF)の再生が阻害され、体内で使用できない形態に葉酸を閉じ込めてしまい(図3参照)、葉酸塩濃度が適切でも葉酸欠乏症の症状になってしまう。したがって、葉酸欠乏症でもビタミンB12欠乏症でも、葉酸塩がDNA合成の際に利用できない。このDNA合成障害は、急速に細胞分裂する骨髄の細胞にその他の細胞より先に影響し、大きく未熟でヘモグロビンの少ない赤血球ができてしまう。その結果としての貧血は巨赤芽球性貧血として知られ、これはそのために悪性貧血と命名された疾患の症状である(3)。葉酸を補給すれば、正常な赤血球の生成を回復するのに十分な葉酸塩が提供される。しかし、もしビタミンB12欠乏症がその原因であれば、貧血が治ってもその症状が長引く。そのため、巨赤芽球性貧血はその原因がわかるまで葉酸での治療をすべきではない(16)。
神経性の症状
ビタミンB12欠乏症の神経性症状には、手およびそれより一般的な足の痺れや刺痛、歩行困難、記憶喪失、見当識障害、および気分変動を伴うまたは伴わない認知症などがある。神経学的合併症の進行は一般的にゆっくりであるものの、そのような症状はビタミンB12欠乏症の治療でも治らないかもしれず、長期にわたる場合は特にそうである。神経学的合併症は常に巨赤芽球性貧血に関連するとは限らず、約25%の症例ではビタミンB12欠乏症の唯一の臨床的症状である(17)。ビタミンB12欠乏症は脳神経、脊髄神経、および末梢神経を覆うミエリン鞘を損傷することが知られているが、ビタミンB12欠乏症における神経的損傷が起こる生化学的プロセスは今だに十分に理解されていない(18)。
胃腸症状
舌の痛み、食欲喪失、および便秘も、ビタミンB12欠乏症と関連がある。これらの症状の起源は不明であるが、ビタミンB12欠乏症のいくつかの症例の根底にある胃の炎症や胃の内膜の進行的破壊に関係しているのかもしれない(17)。
推奨量(RDA)
ビタミンB12の推奨量は、米国医学研究所の食品栄養委員会(FNB)によって1998年に改訂された(表1)。年配者の食品タンパク質結合ビタミンB12吸収不全症のリスクが高くなることから、FNBは50歳を超える成人はRDAの大部分を強化食品やビタミンB12含有サプリメントから摂取することを推奨した(17)。
疾病予防
心血管疾患
上記のように、慢性萎縮性胃炎やH.ピロリ菌感染は吸収不全によってビタミンB12欠乏症を引き起こすことがある(「ビタミンB12欠乏症の原因」の項参照)。けれどもH.ピロリ菌感染や慢性萎縮性胃炎が発生しても、50歳超の10,000人近い男女による大規模コホート研究における心血管性の発作(脳卒中や心臓発作)の5年発症率や死亡率に変わりはなかった(19)。しかし年配者のビタミンB12欠乏症の有病率が高いにもかかわらず、ビタミンB12の栄養状態はこの研究で評価がなされなかった。
ホモシステインと心血管疾患
血中ホモシステイン濃度が軽く高いくらいでも心血管疾患(CVD)リスクが高くなることを疫学的研究は示している(20)が、ホモシステインがCVDリスクを上昇させるかもしれないメカニズムは多くの研究の主題のままである(21)。血中のホモシステイン量は少なくとも3つのビタミンで調整されている。それらは葉酸塩、ビタミンB6、およびビタミンB12である(上記の図1参照)。12の無作為化対照試験結果の初期の解析で、葉酸補給(0.5~5mg/日)が血中ホモシステイン濃度低下に最も効果的(25%の減少)であり、葉酸とともにビタミンB12(500μg/日)を補給することで、血中ホモシステイン濃度がさらに7%減少(32%低下)したことが示された(22)。53人の男女による順次補給試験の結果、葉酸補給の後ではビタミンB12が血漿ホモシステイン濃度の主要な決定因子になることが示された(23)。ホモシステイン濃度の上昇は、60歳超の個人におけるビタミンB12欠乏症が一因なのではないかと考えられる。2つの研究で、ホモシステイン濃度が高い年配者の60%超では、血中メチルマロニル酸(MMA)濃度が高いことがわかった。腎臓機能が損なわれていない場合、高MMA濃度でもあり高ホモシステイン濃度でもあることは、ビタミンB12の欠乏症またはビタミンB12と葉酸塩の両方の欠乏症のどちらかが示唆される(24)。したがって、ホモシステイン濃度低下療法を開始する前に、高ホモシステイン濃度の年配者はビタミンB12の栄養状態と腎臓機能の評価をされることが重要なようである。ホモシステインとCVDの関係のさらなる情報については、「葉酸塩」のタイトルの記事を参照のこと。
介入研究
葉酸およびビタミンB12摂取を増やすことはホモシステイン濃度を下げるのに有効であるが、これらのビタミンBを併用した介入ではCVDリスクが下がらなかった。実際、葉酸、ビタミンB12、およびビタミンB6補給によるホモシステイン濃度低下がCVDの発症を減らすのかどうかを決めるいくつかの無作為化プラセボ対照試験が行われた。CVDリスクのある45,000人近い参加者を含む11の試験データに対する最近のメタ解析で、心筋梗塞(心臓発作)または脳卒中リスクにビタミンB補給はさっぱり効果がなく、全死因のリスクにも変化がなかった(25)。慢性的な腎臓病患者を含むその他のメタ解析でも、心筋梗塞や死亡のリスクに対するホモシステイン濃度低下の効果はないことが確認された。しかし、脳卒中リスクはビタミンB補給によって7~12%とかなり低下した(26, 27)。ホモシステイン濃度低下による血流依存性血管拡張反応(FMD;血管の健康状態の代替マーカー)を測定した12の臨床試験の別なメタ解析で、ビタミンB補給によって短期間(8週間未満)ではFMDの向上が見られるが、既存の血管疾患のある被験者による長期間の研究ではそうではなかった(28)。しかし、これらのメタ解析に含まれた研究のいくつかではビタミンB12が使用されておらず、血管機能や脳卒中リスクに対する葉酸塩投与単独での保護的な役割はすでに示されている(29)。さらに、年配者では吸収不全障害やビタミンB12欠乏症の罹患率が高いことから、これらの試験で使用された用量よりも高い用量のビタミンB12の使用が是認されるかもしれない(30)。吸収不全の症例では、高用量の経口治療や筋肉内注射のみでビタミンB12欠乏症が克服できる(4)。
がん
葉酸塩はDNA合成に必要であり、葉酸塩の利用性が低下すると、より影響を受けやすいDNA鎖が損傷を受けるというエビデンス(科学的根拠)がある。ビタミンB12欠乏症は、葉酸塩を体がDNA合成に利用できない形態に閉じ込めてしまう。ビタミンB12欠乏症でも葉酸欠乏症でも、メチル化反応(上記の図3参照)の能力低下に至る。したがって、ビタミンB12欠乏症だとDNA損傷の割合が高くなったり、DNAのメチル化に変化が起きたりするが、そのどちらもががんの重要なリスク要因である。若い成人と年配の男性による一連の研究で、血中のホモシステイン濃度が高いこととビタミンB12濃度が低いことは、白血球における染色体切断のバイオマーカーと関連があった((31)の文献でレビュー)。ある二重盲検プラセボ対照試験では、2ヶ月間毎日シリアルで700μgの葉酸と7μgのビタミンB12を補給した若い成人は、同じ染色体切断マーカーが最小限になった(32)。
乳がん
ある症例対照研究で、後に乳がんと診断された195人の女性とそれに同齢のがんでない195人の女性で、診断前の血清葉酸塩、ビタミンB6、およびビタミンB12の濃度が比べられた。閉経後の女性では、血中ビタミンB12濃度と乳がんの関連はしきい値効果を示唆していた。血清ビタミンB12濃度が最も低い五分位の女性はそれより高い五分位の女性に比べて、乳がんリスクが2倍以上であった(33)。しかし、この研究に3つの症例対照研究を加えたメタ解析では、血清ビタミンB12濃度が高いことが低いことに比べて保護効果があるという関連が見つからなかった(34)。メキシコ人女性(475の症例群と1,391の対照群)による症例対照研究では、ビタミンB12摂取が最も高い(7.3~7.7μg/日)四分位の女性は、最も低い四分位(2.6μg/日)の女性に比べて乳がんリスクが68%低かったことが報告された。そのデータの層別化で、食事性ビタミンB12摂取と乳がんリスクの逆相関は、閉経後の女性の方が閉経前の女性に比べて強かったことがわかり、どちらの関連も統計学的に有意義であった。また閉経後の女性では、葉酸塩による明らかな保護効果はビタミンB12摂取が最も高い四分位の女性のみで見られた(35)。しかし、より最近の症例対照研究や前向きコホート研究では、ヒスパニック、アフリカ系アメリカ人、およびヨーロッパ系アメリカ人の女性といった異なる集団において、ビタミンB12摂取に関連するリスク低下は弱いかまったくなかったと報告された(36, 37)。7つの症例対照研究および7つの前向きコホート研究のメタ解析で、ビタミンB12摂取の高低によって乳がんリスクが変わることはないと結論づけられた(34)。葉酸塩およびビタミンB12両方の摂取と乳がんリスクとの関連もない。目下、ビタミンB12の栄養状態と乳がんとの関係を示唆するエビデンスもほとんどない。さらに観察研究の結果では、食事性葉酸塩摂取が高いことと乳がんリスク低下との関連は一貫した支持がなされていない(「葉酸塩」のタイトルの記事参照)。閉経期の状態、民族性、およびアルコール摂取などの乳がんリスクを変える様々な要因を考慮して、よく対照された無作為化臨床試験で葉酸塩とビタミンB12補給の効果を評価する必要がある。
神経管欠損
神経管欠損(NTD)は無脳症または脊髄披裂にいたる可能性があり、それらはほとんど致命的な中枢神経系の先天性奇形である。この欠陥は胎児の神経管が閉じないことによって起こり、多くの女性が妊娠に気づかない時期である受胎後21~28日の間に起こる(38)。無作為化対照試験では、女性が受胎の前後1ヶ月ずつの間に様々な食事に加えて葉酸のサプリメントを摂取すると、NTDの症例が60~100%減ることが明示された。増大するエビデンスによれば、葉酸のホモシステイン濃度低下効果がNTDリスクの減少に重大な役割を果たしていることが示されている(39)。メチオニン合成酵素が有効的に機能するための葉酸および/またはビタミンB12が不十分だと、血液中にホモシステインが溜まるかもしれない。NTDのリスクが高い妊婦の血中および羊水では、ビタミンB12濃度の低下とホモシステイン濃度の上昇が見られる(40)。現在または過去にNTDの影響を受けた567人の母親と影響がなかった1,566人の母親を含む12の症例対照研究に対する最近のメタ解析で、母体のビタミンB12の栄養状態が悪いこととNTDリスクが高いことに関連があったことが示された(41)。しかし、ビタミンB12補給がNTD予防に有益かどうかは、今まで評価されていない(42)。
認知機能低下、認知症、およびアルツハイマー病
ビタミンB12欠乏症の発症は年配者の集団によくあり、しばしばアルツハイマー病と関連付けられてきた((43)の文献でレビュー)。アルツハイマー病患者の脳脊髄液におけるビタミンB12濃度は、その他のタイプの認知症の患者よりも低いことが研究でわかったが、血中ビタミンB12濃度には差がなかった(44)。ビタミンB12の栄養状態が悪いこととアルツハイマー病との関連の原因ははっきりしない。葉酸塩の欠乏症と同様に、ビタミンB12欠乏症もメチオニンおよびS-アデノシルメチオニン(SAM)の合成が減ることになり、それによってメチル化反応に悪い影響があるのかもしれない。メチル化反応は、神経細胞におけるミエリン鞘の成分の代謝と神経伝達物質の合成に不可欠である(18)。ビタミンB12欠乏症のその他の代謝上の関わりにはホモシステインとメチルマロニル酸の蓄積があり、それは認知症の神経病理学的特徴に寄与しているかもしれない(43)。
観察研究
横断的研究および前向きコホート研究の大部分では、ホモシステイン濃度が高いことが、認知機能測定値のスコアが悪いことやアルツハイマー病を含む認知症のリスクが高いことと関連づけられてきた((45)の文献でレビュー)。アルツハイマー型の認知症患者164人によるある症例対照研究には、死後に脳細胞の検査でアルツハイマー病の診断が確定した76人の症例が含まれていた。認知症のエビデンスのない108人の対照群の被験者に比べて、アルツハイマー型の認知症である被験者およびアルツハイマー病と確定された被験者は血中ホモシステイン濃度が高く、葉酸塩とビタミンB12の血中濃度が低かった。全般的な栄養状態の測定値からは、ホモシステイン濃度が高いことやビタミンB12の栄養状態が低いこととアルツハイマー病との関連は、認知症に関係する栄養不良によるものではないことが示された(46)。認知症のない1,092人の男女のサンプル集団を平均で10年間追跡したら、ベースライン時(開始時)の血漿ホモシステイン濃度が高い者はアルツハイマー病およびその他の認知症の発症リスクが相当に高かった。具体的には、血漿ホモシステイン濃度が14μmol/Lより高い者は、アルツハイマー病発症リスクが2倍近かった(47)。650人の年配の男女によるある研究で、血漿ホモシステイン濃度が高くなるリスクは、認知機能スコアが低い者のほうが有意義に高かったことが報告された(48)。816人の年配の男女によるある前向き研究では、高ホモシステイン血症(ホモシステイン濃度が15μmol/L超)の者はアルツハイマー病または認知症の発症リスクがかなり高かったことが報告されている。ホモシステイン濃度が高いことは、ビタミンB12の栄養状態が悪いことが一因であるかもしれないが、この研究では後者はアルツハイマー病または認知症のリスクと関係がなかった(49)。
ベースライン時に認知症があるまたはない年配者のビタミンB12の状態と認知機能低下の関連を評価する35の前向きコホート研究に対する最近のシステマティックレビューで、血清ビタミンB12濃度と認知機能低下、認知症、またはアルツハイマー病との関係は支持されなかった(50)。それにもかかわらず、ホロトランスコバラミン(holo-TC、ビタミンB12担体)およびメチルマロニル酸の測定値を含むビタミンB12のより鋭敏なバイオマーカーを利用した研究では、ビタミンB12の栄養状態が悪いことと認知機能悪化が速いこと、およびアルツハイマー病リスクとの関連に対するより一貫した結果と傾向が示された(51~55)。さらに、ホモシステイン濃度が高いことや葉酸塩の栄養状態が悪いことなどの潜在的交絡因子が同時にあることが、ビタミンB12の栄養状態が認知機能に果たす真の寄与を軽くしているかもしれないことを却下するわけにはいかない(45)。
介入研究
認知機能の障害のあるまたはない年配者の高ホモシステイン血症の治療に、高用量ビタミンB補給は有効であることが証明されてきた。しかしこうした集団の認知機能悪化予防に関して、ホモシステイン低減試験は相反する結果を生み出してきた。ビタミンB補給の効果を調べる18の無作為化プラセボ対照試験のシステマティックレビューおよびメタ解析では、ホモシステイン濃度の低下が年配の被験者の認知機能低下を予防または遅延させるということにはならなかった(56)。認知機能障害のリスクの高い900人の年配者によるより最近の無作為化二重盲検プラセボ対照臨床試験で、毎日400μgの葉酸と100μgのビタミンB12を2年間補給したら、即時記憶や遅延記憶の測定値が有意義に向上したり、血漿ホモシステイン濃度上昇が遅くなったことがわかった(57)。しかし、補給を受けた被験者はベースライン時に比べてホモシステイン濃度の低下がなく、プラセボに比べて処理速度テストで成績がよいこともなかった。年配の成人による別の2年間の無作為化プラセボ対照研究では、毎日800μgの葉酸、500μgのビタミンB12、および20mgのビタミンB6摂取というレジメン(治療計画)で、プラセボ治療に比べて脳萎縮の速度がかなり遅くなったことが報告された(0.5%対3.7%)。興味深いことに、ベースライン時のホモシステイン濃度が高い者の方が低い者よりも大きな効果が見られ、脳萎縮および認知機能低下の予防にホモシステイン濃度低下が重要であることを示唆している(58, 59)。著者らはホモシステイン濃度の変化を主にビタミンB12によるものだとしている(59)。最後に、脳卒中を患った2,500人超の者による最新の無作為化二重盲検プラセボ対照試験で、ビタミンB補給(2mgの葉酸、500μgのビタミンB12、および25mgのビタミンB6)によってホモシステイン濃度が正常化しても、プラセボに比べて認知行動能力は向上せず、認知機能低下の発生も減ることがなかったことが示された(60)。目下のところ、アルツハイマー病の発症のような長期的結果に関するビタミンB補給の効果を評価するより大規模な試験が必要である。
うつ病
うつ病で入院した患者の30%もがビタミンB12欠乏症であるということが、観察研究でわかった(61)。65歳超の700人の地域生活を送る身体障害者女性による横断研究で、ビタミンB12欠乏症の女性はそうでない女性に比べて重いうつ病に2倍もなりやすいことがわかった(62)。うつ病的障害のある3,884人の年配の男女による集団ベースの研究で、ビタミンB12欠乏症の者はビタミンB12の状態が正常な者に比べてほぼ70%もうつ病になりやすいことがわかった(63)。ビタミンB12欠乏症とうつ病の関係の原因ははっきりしないが、S-アデノシルメチオニン(SAM)の不足が関わっているかもしれない。SAMは脳内での多くのメチル化反応におけるメチル基供与体で、不足することがうつ病に関わる神経伝達物質の代謝もこの反応に含まれる(64)。マウスモデルでの重篤なビタミンB12欠乏症では、脳内でのDNAメチル化の程度に劇的な変化が示され、これが神経学的障害へとつながっているのかもしれない(65)。この仮説は、SAMの補給でうつ病的症状が改善することを示すいくつかの研究によって裏付けされている(66~69)。
ホモシステイン濃度が高いことは、年配者におけるうつ病的症状に関連するビタミンB12欠乏症のもう一つの非特異性バイオマーカーである(70)。しかし、1,677人の年配者に対して行われた最近の横断的研究で、血漿ビタミンB12濃度が高いことはうつ病的症状の出現が少ないことと相関があったが、ホモシステイン濃度の変化はそれとの相関がなかった(71)。ビタミンB12の状態とホモシステイン濃度、および経年的なうつ病の発症との関係を調べた研究はとても少ない。心理的苦痛がある900人超の年配の参加者による無作為化プラセボ対照介入研究で、2年間毎日葉酸(400μg)とビタミンB12(100μg)を補給しても、プラセボに比べて血中の葉酸塩、ビタミンB12、およびホモシステインの濃度がかなりよくなったにもかかわらず、うつ病症状の発生が減ることはなかった(72)。しかし、うつ病リスクの高い脳血管性発作に苦しむ者による長期の無作為化二重盲検プラセボ対照研究で、毎日の2mgの葉酸、25mgのビタミンB6、および500μgのビタミンB12補給で、7年間の追跡期間における主要なうつ病的エピソードのリスクがプラセボに比べて大きく下がった(73)。うつ病にビタミンB12欠乏症が原因的な役割を果たしているかどうかはまだわからないが、うつ病の医学的評価の一部として年配者のビタミンB12欠乏症を検査することは有益であるかもしれない。
骨粗鬆症
ホモシステイン濃度が高いと骨吸収(破壊)を増やし、骨形成を減らし、骨の血流を減らして骨リモデリング(再形成)に影響するかもしれない。提唱されている別のメカニズムでは、骨のコラーゲンマトリックスへのホモシステインの結合が関わっており、これがコラーゲンの特性を変えて骨の強度を下げるのかもしれない((74)の文献でレビュー)。骨の生化学的特性の変化は、骨粗鬆症に寄与して年配者の骨折リスクを上げることがある。ビタミンB12はホモシステイン代謝の決定因子であるので、年配の被験者の骨粗鬆症的骨折リスクがビタミンB12欠乏症によって高くなるのではないかと示唆された。全部で7,475人の年配者を3~16年追跡した4つの観察研究のメタ解析で、血中ビタミンB12濃度が50pmol/L上がると骨折リスクが減るという弱い関連が見つかった(75)。血清葉酸塩およびビタミンB12濃度が低く骨折リスクの高い559人の年配者による無作為化プラセボ対照試験で、非常に高用量の葉酸(5mg/日)およびビタミンB12(1.5mg/日)の併用補給が評価された。2年間の研究で、プラセボに比べて補給によりビタミンBの栄養状態が良くなって、ホモシステイン濃度が減少し、全体の骨折リスクが下がったことがわかった(76)。しかし、心血管疾患または糖尿病のある5,485人の被験者による多機関の研究では、毎日葉酸(2.5mg)、ビタミンB12(1mg)、およびビタミンB6(50mg)を補給することでホモシステイン濃度は下がったが、プラセボに比べて骨折リスクへの効果は何もなかったことが示された(77)。ビタミンDの栄養状態が悪い93人による別の小規模無作為化二重盲検試験では、ビタミンB補給(50mg/日のビタミンB6、0.5mg/日の葉酸、および0.5mg/日のビタミンB12)をしても、ビタミンDとカルシウム補給に関連する以上の骨の健康マーカーへの追加的な効果は1年間に見られなかった。それでもこの研究が短期間であるので、ビタミンB補給によってホモシステイン濃度を下げることが骨強度や骨折リスクに長期的な有益性をもたらすかどうかを結論付けることはできなかった(78)。既存の症状のない年配者に対して、骨の健康マーカーや骨折の発生に対するビタミンB補給の効果を評価する大規模介入研究が現在進行中である。年配者の集団における骨の健康に対してビタミンBに保護的効果があるのかどうかが、この試験で明らかになるかもしれない(79)。
摂取源
食物の摂取源
細菌だけがビタミンB12を合成できる(80)。ビタミンB12は、肉、家禽類の肉、魚(貝や甲殻類を含む)などの動物性食品に含まれ、それよりは少ないが乳製品や卵にも含まれる(1)。新鮮な殺菌された牛乳は1カップ(約240ml)あたり0.9μgを含み、一部の菜食主義者にとって重要なビタミンB12摂取源になっている(17)。動物性食品をいっさい食べない厳密な菜食主義者(ヴィーガン)は、その必要量を満たすためにビタミンB12補給をしなければならない。最近の解析で、ある種の植物起源の食物、たとえば特定の発酵豆類や発酵野菜、および食用藻類やキノコなどは、生理活性のあるビタミンB12を相当量含んでいることがわかった(81)。ビタミンB強化食品やサプリメントと一緒に摂取することで、これらの食物が菜食主義の食事をする者のビタミンB12欠乏症予防に控えめではあるが貢献するかもしれない。また、50歳超の個人はビタミンB12をサプリメントや強化食品(強化シリアルなど)で摂取すべきである。なぜなら加齢によって食品タンパク質結合ビタミンB12吸収不全になりやすくなるからである。
たいていの人々は、食物に含まれるビタミンB12を2.4μg/日というRDAどおりに摂取することに何の問題もない。米国での全国的調査によると、食事性の平均ビタミンB12摂取は成人男性で5.4μg/日、女性で3.4μg/日である。60歳を超えた成人は、平均で4.8μg/日を食事で摂取している(42)。しかし、どのようなタイプであっても菜食主義の食事をすると、全ての年齢層の者におけるビタミンB12欠乏症の罹患率が上がる(82)。ビタミンB12の量が多いいくつかの食物を、その含有量をマイクログラム(μg)で表したものとともに表2に記載する。特定の食物の栄養素含有量についてのさらなる情報は、USDAの食品成分データベースを検索のこと。
サプリメント
シアノコバラミンは経口サプリメントに使用されるビタミンB12の主要形態であるが、メチルコバラミンもサプリメントとして入手可能である。シアノコバラミンは、悪性貧血の治療用に注射剤および点鼻用ゲルとして処方箋で入手できる。シアノコバラミンを含む店頭用製剤には、マルチビタミン、ビタミンB複合体サプリメント、およびビタミンB12単一成分サプリメントがある(83)。
安全性
毒性
健康な個人では、食物またはサプリメントからのビタミンB12の多量摂取に関連する毒性や有害作用はない。経口で毎日2mg(2,000μg)または筋肉内注射(IM)で1mgを毎月といった高用量でも、目立った副作用もなく悪性貧血の治療に使用されている(84)。高用量のビタミンB12を経口で投与されてもわずかな割合しか吸収されず、それが毒性の低さの所以かもしれない(4)。ビタミンB12が低毒性なので、米国の食品栄養委員会は許容上限摂取量(UL)を設定していない(17)。
薬物相互作用
いくつかの薬剤はビタミンB12の吸収を低くする。ゾリンジャー・エリソン症候群や胃食道逆流疾患(GERD)の治療に使用されるプロトンポンプ阻害薬(オメプラゾールやランソプラゾールなど)は、サプリメントではなく食物からビタミンB12を遊離するのに必要な胃酸の分泌を顕著に減らす。プロトンポンプ阻害薬の長期使用は、血中ビタミンB12濃度を下げることがわかっている。しかし、ビタミンB12欠乏症は少なくとも3年間の継続治療の後までは一般的に発症しない(85, 86)。ヒスタミン2(H2)受容体拮抗薬(シメチジン、ファモチジン、およびラニチジンなど)として知られる胃酸分泌抑制剤の別種は消化性潰瘍疾患の治療によく使用されるが、これも食物からのビタミンB12吸収を減らすことがわかっている。H2受容体拮抗薬の長期使用が明白なビタミンB12欠乏症を引き起こすのかどうかは明らかでない(87, 88)。胃酸分泌を抑制する薬剤を使用している個人は、吸収に胃酸を必要としないサプリメントの形態でビタミンB12を摂取することを考慮すべきである。食物からのビタミンB12吸収を阻害することがわかっているその他の薬剤には、コレスチラミン(高コレステロール治療に使われる胆汁酸結合レジン)、クロラムフェニコールとネオマイシン(抗生物質)、およびコルヒチン(痛風の治療薬)がある。2型糖尿病の者への治療薬であるメトホルミンは、IF-B12複合体の吸収に必要な遊離カルシウムと結合することで、ビタミンB12の吸収を減らすことがわかっている(89)。しかし、このことの臨床的意味はわかっていない(90)。カルシウム補給でビタミンB12吸収不全を治せるのかどうかはわからない。したがって現在では、メトホルミン誘発性のビタミンB12欠乏症の予防や治療にカルシウム補給は処方されていない(91)。大容量のビタミンCはビタミンB12を壊すという以前の報告は裏付けられなかった(92)。これはビタミンB12濃度測定に使用されるアッセイ(試験)のアーティファクト(人為的結果)であるかもしれない(17)。
よく使用される麻酔薬である亜酸化窒素は、ビタミンB12を酸化し不活性化する。したがってビタミンB12依存性酵素を2つとも阻害して、巨赤芽球性貧血やまたは神経障害などのビタミンB12欠乏症の臨床的症状を多く発生させる可能性がある。亜酸化窒素は年配者の手術で一般的に使用されるので、その使用の前にビタミンB12欠乏症を除外しておくべきだと感じる専門家もいる(6, 15)。
診断されていないビタミンB12欠乏症の個人に大容量の葉酸を与えると、根底にあるビタミンB12欠乏症が治らないまま巨赤芽球性貧血が治るものの、不可逆性の神経学的障害を発症するリスクを残したままになるかもしれない(17)。そのため米国医学研究所の食品栄養委員会は、全ての成人の(サプリメントや強化食品由来の)葉酸摂取は一日に1,000μg(1mg)を限度とするように勧めている。
ライナス・ポーリング研究所の推奨
様々な食事によって、50歳以下のほとんどの者の欠乏症を予防するのに十分なビタミンB12が得られる。厳密な菜食主義者や妊娠を計画中の女性は、毎日マルチビタミンサプリメントを摂取したり強化シリアルを食べたりするべきで、それによって吸収しやすい形態のビタミンB12を毎日6~30μg摂取することが確実であろう。より高用量のビタミンB12サプリメントは、ビタミンB12の吸収を妨げる薬剤を使用している患者に推奨される(「薬物相互作用」の項参照)。
年配者(50歳超)
年配者ではビタミンB12吸収不全や欠乏症がより一般的であるので、ライナス・ポーリング研究所は50歳超の成人が100~400μg/日のビタミンB12補給をすることを推奨する。
Authors and Reviewers
Originally written in 2000 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in March 2003 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in August 2007 by:
Victoria J. Drake, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in January 2014 by:
Barbara Delage, Ph.D.
Linus Pauling Institute
Oregon State University
Reviewed in April 2014 by:
Joshua W. Miller, Ph.D.
Professor and Chair, Department of Nutritional Sciences
Rutgers, The State University of New Jersey
Last updated 6/4/15 Copyright 2000-2023 Linus Pauling Institute
References
1. Brody T. Nutritional Biochemistry. 2nd ed. San Diego: Academic Press; 1999.
2. Carmel R. Cobalamin (Vitamin B-12). In: Shils ME, Shike M, Ross AC, Caballero B, Cousins RJ, eds. Modern Nutrition in Health and Disease. Philadelphia: Lippincott Williams & Wilkins; 2006:482-497.
3. Shane B. Folic acid, vitamin B-12, and vitamin B-6. In: Stipanuk M, ed. Biochemical and Physiological Aspects of Human Nutrition. Philadelphia: W.B. Saunders Co.; 2000:483-518.
4. Carmel R. How I treat cobalamin (vitamin B12) deficiency. Blood. 2008;112(6):2214-2221. (PubMed)
5. Kozyraki R, Cases O. Vitamin B12 absorption: mammalian physiology and acquired and inherited disorders. Biochimie. 2013;95(5):1002-1007. (PubMed)
6. Baik HW, Russell RM. Vitamin B12 deficiency in the elderly. Annu Rev Nutr. 1999;19:357-377. (PubMed)
7. Neumann WL, Coss E, Rugge M, Genta RM. Autoimmune atrophic gastritis--pathogenesis, pathology and management. Nat Rev Gastroenterol Hepatol. 2013;10(9):529-541. (PubMed)
8. Lahner E, Persechino S, Annibale B. Micronutrients (Other than iron) and Helicobacter pylori infection: a systematic review. Helicobacter. 2012;17(1):1-15. (PubMed)
9. Carmel R. Megaloblastic anemias. Curr Opin Hematol. 1994;1(2):107-112. (PubMed)
10. Banka S, Ryan K, Thomson W, Newman WG. Pernicious anemia - genetic insights. Autoimmun Rev. 2011;10(8):455-459. (PubMed)
11. Lam-Tse WK, Batstra MR, Koeleman BP, et al. The association between autoimmune thyroiditis, autoimmune gastritis and type 1 diabetes. Pediatr Endocrinol Rev. 2003;1(1):22-37. (PubMed)
12. Checchi S, Montanaro A, Ciuoli C, et al. Prevalence of parietal cell antibodies in a large cohort of patients with autoimmune thyroiditis. Thyroid. 2010;20(12):1385-1389. (PubMed)
13. Ho C, Kauwell GP, Bailey LB. Practitioners' guide to meeting the vitamin B-12 recommended dietary allowance for people aged 51 years and older. J Am Diet Assoc. 1999;99(6):725-727. (PubMed)
14. Watkins D, Rosenblatt DS. Lessons in biology from patients with inborn errors of vitamin B12 metabolism. Biochimie. 2013;95(5):1019-1022. (PubMed)
15. Weir DG, Scott JM. Vitamin B12 "Cobalamin." In: Shils M, ed. Nutrition in Health and Disease. 9th ed. Baltimore: Williams & Wilkins; 1999:447-458.
16. Herbert V. Vitamin B-12. In: Ziegler EE, Filer LJ, eds. Present Knowledge in Nutrition. 7th ed. Washington D.C.: ILSI Press; 1996:191-205.
17. Food and Nutrition Board, Institute of Medicine. Vitamin B12. Dietary Reference Intakes for Thiamin, Riboflavin, Niacin, Vitamin B6, Vitamin B12, Pantothenic Acid, Biotin, and Choline. Washington, D.C.: National Academy Press; 1998:306-356. (National Academy Press)
18. Scalabrino G. The multi-faceted basis of vitamin B12 (cobalamin) neurotrophism in adult central nervous system: Lessons learned from its deficiency. Prog Neurobiol. 2009;88(3):203-220. (PubMed)
19. Schottker B, Adamu MA, Weck MN, Muller H, Brenner H. Helicobacter pylori infection, chronic atrophic gastritis and major cardiovascular events: a population-based cohort study. Atherosclerosis. 2012;220(2):569-574. (PubMed)
20. Gerhard GT, Duell PB. Homocysteine and atherosclerosis. Curr Opin Lipidol. 1999;10(5):417-428. (PubMed)
21. Homocysteine Lowering Trialists' Collaboration. Lowering blood homocysteine with folic acid based supplements: meta-analysis of randomised trials. Homocysteine Lowering Trialists' Collaboration. BMJ. 1998;316(7135):894-898. (PubMed)
22. Lowering blood homocysteine with folic acid based supplements: meta-analysis of randomised trials. Homocysteine Lowering Trialists' Collaboration. Bmj. 1998;316(7135):894-898. (PubMed)
23. Quinlivan EP, McPartlin J, McNulty H, et al. Importance of both folic acid and vitamin B12 in reduction of risk of vascular disease. Lancet. 2002;359(9302):227-228. (PubMed)
24. Stabler SP, Lindenbaum J, Allen RH. Vitamin B-12 deficiency in the elderly: current dilemmas. Am J Clin Nutr. 1997;66(4):741-749. (PubMed)
25. Marti-Carvajal AJ, Sola I, Lathyris D, Karakitsiou DE, Simancas-Racines D. Homocysteine-lowering interventions for preventing cardiovascular events. Cochrane Database Syst Rev. 2013;1:CD006612. (PubMed)
26. Huang T, Chen Y, Yang B, Yang J, Wahlqvist ML, Li D. Meta-analysis of B vitamin supplementation on plasma homocysteine, cardiovascular and all-cause mortality. Clin Nutr. 2012;31(4):448-454. (PubMed)
27. Ji Y, Tan S, Xu Y, et al. Vitamin B supplementation, homocysteine levels, and the risk of cerebrovascular disease: A meta-analysis. Neurology. 2013;81(15):1298-1307. (PubMed)
28. Potter K, Hankey GJ, Green DJ, Eikelboom J, Jamrozik K, Arnolda LF. The effect of long-term homocysteine-lowering on carotid intima-media thickness and flow-mediated vasodilation in stroke patients: a randomized controlled trial and meta-analysis. BMC Cardiovasc Disord. 2008;8:24. (PubMed)
29. Qin X, Xu M, Zhang Y, et al. Effect of folic acid supplementation on the progression of carotid intima-media thickness: a meta-analysis of randomized controlled trials. Atherosclerosis. 2012;222(2):307-313. (PubMed)
30. Spence JD. B vitamin therapy for homocysteine: renal function and vitamin B12 determine cardiovascular outcomes. Clin Chem Lab Med. 2013;51(3):633-637. (PubMed)
31. Fenech M. Folate (vitamin B9) and vitamin B12 and their function in the maintenance of nuclear and mitochondrial genome integrity. Mutat Res. 2012;733(1-2):21-33. (PubMed)
32. Fenech M. Micronucleus frequency in human lymphocytes is related to plasma vitamin B12 and homocysteine. Mutat Res. 1999;428(1-2):299-304. (PubMed)
33. Wu K, Helzlsouer KJ, Comstock GW, Hoffman SC, Nadeau MR, Selhub J. A prospective study on folate, B12, and pyridoxal 5'-phosphate (B6) and breast cancer. Cancer Epidemiol Biomarkers Prev. 1999;8(3):209-217. (PubMed)
34. Wu W, Kang S, Zhang D. Association of vitamin B6, vitamin B12 and methionine with risk of breast cancer: a dose-response meta-analysis. Br J Cancer. 2013;109(7):1926-1944. (PubMed)
35. Lajous M, Lazcano-Ponce E, Hernandez-Avila M, Willett W, Romieu I. Folate, vitamin B(6), and vitamin B(12) intake and the risk of breast cancer among Mexican women. Cancer Epidemiol Biomarkers Prev. 2006;15(3):443-448. (PubMed)
36. Yang D, Baumgartner RN, Slattery ML, et al. Dietary intake of folate, B-vitamins and methionine and breast cancer risk among Hispanic and non-Hispanic white women. PLoS One. 2013;8(2):e54495. (PubMed)
37. Bassett JK, Baglietto L, Hodge AM, et al. Dietary intake of B vitamins and methionine and breast cancer risk. Cancer Causes Control. 2013;24(8):1555-1563. (PubMed)
38. Eskes TK. Open or closed? A world of difference: a history of homocysteine research. Nutr Rev. 1998;56(8):236-244. (PubMed)
39. Mills JL, Scott JM, Kirke PN, et al. Homocysteine and neural tube defects. J Nutr. 1996;126(3):756S-760S. (PubMed)
40. Imbard A, Benoist JF, Blom HJ. Neural tube defects, folic acid and methylation. Int J Environ Res Public Health. 2013;10(9):4352-4389. (PubMed)
41. Wang ZP, Shang XX, Zhao ZT. Low maternal vitamin B(12) is a risk factor for neural tube defects: a meta-analysis. J Matern Fetal Neonatal Med. 2012;25(4):389-394. (PubMed)
42. Dror DK, Allen LH. Interventions with vitamins B6, B12 and C in pregnancy. Paediatr Perinat Epidemiol. 2012;26 Suppl 1:55-74. (PubMed)
43. McCaddon A. Vitamin B12 in neurology and ageing; clinical and genetic aspects. Biochimie. 2013;95(5):1066-1076. (PubMed)
44. Nourhashemi F, Gillette-Guyonnet S, Andrieu S, et al. Alzheimer disease: protective factors. Am J Clin Nutr. 2000;71(2):643S-649S. (PubMed)
45. Smith AD. The worldwide challenge of the dementias: a role for B vitamins and homocysteine? Food Nutr Bull. 2008;29(2 Suppl):S143-172. (PubMed)
46. Clarke R, Smith AD, Jobst KA, Refsum H, Sutton L, Ueland PM. Folate, vitamin B12, and serum total homocysteine levels in confirmed Alzheimer disease. Arch Neurol. 1998;55(11):1449-1455. (PubMed)
47. Seshadri S, Beiser A, Selhub J, et al. Plasma homocysteine as a risk factor for dementia and Alzheimer's disease. N Engl J Med. 2002;346(7):476-483. (PubMed)
48. Ravaglia G, Forti P, Maioli F, et al. Homocysteine and cognitive function in healthy elderly community dwellers in Italy. Am J Clin Nutr. 2003;77(3):668-673. (PubMed)
49. Ravaglia G, Forti P, Maioli F, et al. Homocysteine and folate as risk factors for dementia and Alzheimer disease. Am J Clin Nutr. 2005;82(3):636-643. (PubMed)
50. O'Leary F, Allman-Farinelli M, Samman S. Vitamin B(1)(2) status, cognitive decline and dementia: a systematic review of prospective cohort studies. Br J Nutr. 2012;108(11):1948-1961. (PubMed)
51. Clarke R, Birks J, Nexo E, et al. Low vitamin B-12 status and risk of cognitive decline in older adults. Am J Clin Nutr. 2007;86(5):1384-1391. (PubMed)
52. Tangney CC, Tang Y, Evans DA, Morris MC. Biochemical indicators of vitamin B12 and folate insufficiency and cognitive decline. Neurology. 2009;72(4):361-367. (PubMed)
53. Kivipelto M, Annerbo S, Hultdin J, et al. Homocysteine and holo-transcobalamin and the risk of dementia and Alzheimers disease: a prospective study. Eur J Neurol. 2009;16(7):808-813. (PubMed)
54. Hooshmand B, Solomon A, Kareholt I, et al. Homocysteine and holotranscobalamin and the risk of Alzheimer disease: a longitudinal study. Neurology. 2010;75(16):1408-1414. (PubMed)
55. Hooshmand B, Solomon A, Kareholt I, et al. Associations between serum homocysteine, holotranscobalamin, folate and cognition in the elderly: a longitudinal study. J Intern Med. 2012;271(2):204-212. (PubMed)
56. Ford AH, Almeida OP. Effect of homocysteine lowering treatment on cognitive function: a systematic review and meta-analysis of randomized controlled trials. J Alzheimers Dis. 2012;29(1):133-149. (PubMed)
57. Walker JG, Batterham PJ, Mackinnon AJ, et al. Oral folic acid and vitamin B-12 supplementation to prevent cognitive decline in community-dwelling older adults with depressive symptoms--the Beyond Ageing Project: a randomized controlled trial. Am J Clin Nutr. 2012;95(1):194-203. (PubMed)
58. Smith AD, Smith SM, de Jager CA, et al. Homocysteine-lowering by B vitamins slows the rate of accelerated brain atrophy in mild cognitive impairment: a randomized controlled trial. PLoS One. 2010;5(9):e12244. (PubMed)
59. Douaud G, Refsum H, de Jager CA, et al. Preventing Alzheimer's disease-related gray matter atrophy by B-vitamin treatment. Proc Natl Acad Sci U S A. 2013;110(23):9523-9528. (PubMed)
60. Hankey GJ, Ford AH, Yi Q, et al. Effect of B vitamins and lowering homocysteine on cognitive impairment in patients with previous stroke or transient ischemic attack: a prespecified secondary analysis of a randomized, placebo-controlled trial and meta-analysis. Stroke. 2013;44(8):2232-2239. (PubMed)
61. Hutto BR. Folate and cobalamin in psychiatric illness. Compr Psychiatry. 1997;38(6):305-314. (PubMed)
62. Penninx BW, Guralnik JM, Ferrucci L, Fried LP, Allen RH, Stabler SP. Vitamin B(12) deficiency and depression in physically disabled older women: epidemiologic evidence from the Women's Health and Aging Study. Am J Psychiatry. 2000;157(5):715-721. (PubMed)
63. Tiemeier H, van Tuijl HR, Hofman A, Meijer J, Kiliaan AJ, Breteler MM. Vitamin B12, folate, and homocysteine in depression: the Rotterdam Study. Am J Psychiatry. 2002;159(12):2099-2101. (PubMed)
64. Mischoulon D, Fava M. Role of S-adenosyl-L-methionine in the treatment of depression: a review of the evidence. Am J Clin Nutr. 2002;76(5):1158S-1161S. (PubMed)
65. Fernandez-Roig S, Lai SC, Murphy MM, Fernandez-Ballart J, Quadros EV. Vitamin B12 deficiency in the brain leads to DNA hypomethylation in the TCblR/CD320 knockout mouse. Nutr Metab (Lond). 2012;9:41. (PubMed)
66. Bressa GM. S-adenosyl-l-methionine (SAMe) as antidepressant: meta-analysis of clinical studies. Acta Neurol Scand Suppl. 1994;154:7-14. (PubMed)
67. Bell KM, Plon L, Bunney WE, Jr., Potkin SG. S-adenosylmethionine treatment of depression: a controlled clinical trial. Am J Psychiatry. 1988;145(9):1110-1114. (PubMed)
68. Delle Chiaie R, Pancheri P, Scapicchio P. Efficacy and tolerability of oral and intramuscular S-adenosyl-L-methionine 1,4-butanedisulfonate (SAMe) in the treatment of major depression: comparison with imipramine in 2 multicenter studies. Am J Clin Nutr. 2002;76(5):1172S-1176S. (PubMed)
69. Williams AL, Girard C, Jui D, Sabina A, Katz DL. S-adenosylmethionine (SAMe) as treatment for depression: a systematic review. Clin Invest Med. 2005;28(3):132-139. (PubMed)
70. Almeida OP, McCaul K, Hankey GJ, Norman P, Jamrozik K, Flicker L. Homocysteine and depression in later life. Arch Gen Psychiatry. 2008;65(11):1286-1294. (PubMed)
71. Moorthy D, Peter I, Scott TM, et al. Status of vitamins B-12 and B-6 but not of folate, homocysteine, and the methylenetetrahydrofolate reductase C677T polymorphism are associated with impaired cognition and depression in adults. J Nutr. 2012;142(8):1554-1560. (PubMed)
72. Walker JG, Mackinnon AJ, Batterham P, et al. Mental health literacy, folic acid and vitamin B12, and physical activity for the prevention of depression in older adults: randomised controlled trial. Br J Psychiatry. 2010;197(1):45-54. (PubMed)
73. Almeida OP, Marsh K, Alfonso H, Flicker L, Davis TM, Hankey GJ. B-vitamins reduce the long-term risk of depression after stroke: The VITATOPS-DEP trial. Ann Neurol. 2010;68(4):503-510. (PubMed)
74. Vacek TP, Kalani A, Voor MJ, Tyagi SC, Tyagi N. The role of homocysteine in bone remodeling. Clin Chem Lab Med. 2013;51(3):579-590. (PubMed)
75. van Wijngaarden JP, Doets EL, Szczecinska A, et al. Vitamin B12, folate, homocysteine, and bone health in adults and elderly people: a systematic review with meta-analyses. J Nutr Metab. 2013;2013:486186. (PubMed)
76. Sato Y, Honda Y, Iwamoto J, Kanoko T, Satoh K. Effect of folate and mecobalamin on hip fractures in patients with stroke: a randomized controlled trial. JAMA. 2005;293(9):1082-1088. (PubMed)
77. Sawka AM, Ray JG, Yi Q, Josse RG, Lonn E. Randomized clinical trial of homocysteine level lowering therapy and fractures. Arch Intern Med. 2007;167(19):2136-2139. (PubMed)
78. Herrmann W, Kirsch SH, Kruse V, et al. One year B and D vitamins supplementation improves metabolic bone markers. Clin Chem Lab Med. 2013;51(3):639-647. (PubMed)
79. van Wijngaarden JP, Dhonukshe-Rutten RA, van Schoor NM, et al. Rationale and design of the B-PROOF study, a randomized controlled trial on the effect of supplemental intake of vitamin B12 and folic acid on fracture incidence. BMC Geriatr. 2011;11:80. (PubMed)
80. LeBlanc JG, Milani C, de Giori GS, Sesma F, van Sinderen D, Ventura M. Bacteria as vitamin suppliers to their host: a gut microbiota perspective. Curr Opin Biotechnol. 2013;24(2):160-168. (PubMed)
81. Watanabe F, Yabuta Y, Tanioka Y, Bito T. Biologically active vitamin B12 compounds in foods for preventing deficiency among vegetarians and elderly subjects. J Agric Food Chem. 2013;61(28):6769-6775. (PubMed)
82. Pawlak R, Parrott SJ, Raj S, Cullum-Dugan D, Lucus D. How prevalent is vitamin B(12) deficiency among vegetarians? Nutr Rev. 2013;71(2):110-117. (PubMed)
83. Hendler SS, Rorvik DR, eds. PDR for Nutritional Supplements. Montvale: Medical Economics Company, Inc; 2001.
84. Kuzminski AM, Del Giacco EJ, Allen RH, Stabler SP, Lindenbaum J. Effective treatment of cobalamin deficiency with oral cobalamin. Blood. 1998;92(4):1191-1198. (PubMed)
85. Dharmarajan TS, Kanagala MR, Murakonda P, Lebelt AS, Norkus EP. Do acid-lowering agents affect vitamin B12 status in older adults? J Am Med Dir Assoc. 2008;9(3):162-167. (PubMed)
86. Wilhelm SM, Rjater RG, Kale-Pradhan PB. Perils and pitfalls of long-term effects of proton pump inhibitors. Expert Rev Clin Pharmacol. 2013;6(4):443-451. (PubMed)
87. Valuck RJ, Ruscin JM. A case-control study on adverse effects: H2 blocker or proton pump inhibitor use and risk of vitamin B12 deficiency in older adults. J Clin Epidemiol. 2004;57(4):422-428. (PubMed)
88. Termanini B, Gibril F, Sutliff VE, Yu F, Venzon DJ, Jensen RT. Effect of long-term gastric acid suppressive therapy on serum vitamin B12 levels in patients with Zollinger-Ellison syndrome. Am J Med. 1998;104(5):422-430. (PubMed)
89. Bauman WA, Shaw S, Jayatilleke E, Spungen AM, Herbert V. Increased intake of calcium reverses vitamin B12 malabsorption induced by metformin. Diabetes Care. 2000;23(9):1227-1231. (PubMed)
90. Obeid R. Metformin causing vitamin B12 deficiency: a guilty verdict without sufficient evidence. Diabetes Care. 2014;37(2):e22-23. (PubMed)
91. Mazokopakis EE, Starakis IK. Recommendations for diagnosis and management of metformin-induced vitamin B12 (Cbl) deficiency. Diabetes Res Clin Pract. 2012;97(3):359-367. (PubMed)
92. Simon JA, Hudes ES. Relation of serum ascorbic acid to serum vitamin B12, serum ferritin, and kidney stones in US adults. Arch Intern Med. 1999;159(6):619-624. (PubMed)
ビタミンB6
目次
要旨
-
ビタミンB6とその誘導体であるピリドキサール5'-リン酸(PLP)は、主にタンパク質の代謝に関わる100超の酵素にとって不可欠である。(詳細はこちら)
-
体内循環しているホモシステインの濃度が高いと、心血管疾患のリスクが上がるという関連がある。無作為化対照試験では、ビタミンB6を含むビタミンBの補給がホモシステイン濃度を効果的に下げる可能性があることが明示された。しかしながら、ビタミンBによるホモシステイン濃度の低下は、高リスクの個人における心血管的な有害事象のリスクを減らすことができなかった。(詳細はこちら)
-
実験的および臨床的研究に基づき増大するエビデンスは、ほとんどの慢性病に潜む全身性炎症がビタミンB6の代謝を損なうかもしれないことを示している。(詳細はこちら)
-
ビタミンB6およびその他のビタミンBの補給は年配者の認知行動能力の向上または認知低下の遅延に関連がないものの、最近の研究ではビタミンB6が晩年のうつ病のリスクを下げるのに役立つかもしれないことが示唆されている。(詳細はこちら)
-
薬理学的用量のビタミンB6は、まれな先天性ビタミンB6代謝異常でおこるてんかん発作の治療で使われる。また、無作為化対照試験の結果は妊婦のつわりの治療におけるビタミンB6の使用を支持しており、月経前症候群や手根管症候群の管理に有益である可能性を暗示している。(詳細はこちら)
-
ビタミンB6は、魚、家禽類、ナッツ、豆類、ジャガイモ、およびバナナなど様々な食品に含まれる。(詳細はこちら)
-
抗結核薬、抗パーキンソン病薬、非ステロイド性抗炎症薬、および経口避妊薬を含むいくつかの薬剤は、ビタミンB6の代謝に支障をきたす可能性がある。(詳細はこちら)
ビタミンB6は1930年代に初めて単離された水溶性ビタミンである。ビタミンB6という用語は6つの一般的形態を指し、それらはピリドキサール、ピリドキシン(ピリドキソール)、ピリドキサミン、およびそれらのリン酸化された形態を意味する。リン酸エステルの形態の誘導体であるピリドキサール5'-リン酸(PLP)は、全酵素反応の4%超に関わる生理活性補酵素の形態である(図1)(1~3)。

機能
ヒトの体内で合成できないので、ビタミンB6は食事から摂取されねばならない。PLPは、ヒトの体内で不可欠な化学反応の触媒作用をする100超の酵素の機能に決定的な役割を果たす(4)。PLP依存性酵素は、Fold Type I~Vという5つの構造グループに分けられる(5)。
- Fold Type I アスパラギン酸アミノ基転移酵素ファミリー
(アスパラギン酸アミノトランスフェラーゼファミリー)
- Fold Type II トリプトファン合成酵素ファミリー
(トリプトファンシンターゼファミリー)
- Fold Type III アラニンラセマーゼファミリー
- Fold Type IV D-アミノ酸アミノ基転移酵素ファミリー
(D-アミノ酸アミノトランスフェラーゼファミリー)
- Fold Type V グリコーゲンホスホリラーゼファミリー
PLP依存性酵素が触媒作用をする多くの生化学的反応は、ヘモグロビンやアミノ酸の生合成や脂肪酸代謝などの生物学的に必須のプロセスに関わる。PLPは、貯蔵されたグリコーゲンからブドウ糖を遊離する反応の触媒作用をする酵素であるグリコーゲンホスホリラーゼの補酵素としても働く。ヒトの体内でのPLPの多くは、グリコーゲンホスホリラーゼに結合した筋肉に見られる。PLPはまた、アミノ酸からブドウ糖を生成する反応の補酵素でもあり、このプロセスは糖新生として知られる(6)。
神経系の機能
脳内では、PLP依存性酵素である芳香族L-アミノ酸脱炭酸酵素(芳香族L-アミノ酸デカルボキシラーゼ)が2つの主要な神経伝達物質の合成の触媒作用をする。それらはアミノ酸であるトリプトファンからのセロトニンの合成と、L-3,4-ジヒドロキシフェニルアラニン(L-Dopa)からのドーパミンの合成である。グリシン、D-セリン、グルタミン酸、ヒスタミン、およびγアミノ酪酸(GABA)などのその他の神経伝達物質も、PLP依存性酵素が触媒作用をする反応において合成される(7)。
ヘモグロビンの合成と機能
PLPは5-アミノレブリン酸合成酵素(5-アミノレブリン酸シンターゼ)の補酵素として働き、これはヘモグロビンの鉄含有成分であるヘムの合成に関わる。ヘモグロビンは赤血球で見られ、体内にあまねく酸素を運ぶ赤血球の能力に不可欠である。ピリドキサールとPLPはともにヘモグロビンの分子に結合可能で、ヘモグロビンが酸素を授受する能力に影響を与える。しかし、このことが組織への正常な酸素運搬に与える影響については不明である(6,8)。ビタミンB6欠乏症はヘモグロビン合成を損ない、小球性貧血に至るのかもしれない(3)。
トリプトファンの代謝
別のビタミンBであるナイアシンの欠乏症は、適切な食事摂取によって簡単に予防できる。ナイアシンとその補酵素であるニコチンアミドアデニンジヌクレオチド(NAD)の食事からの必要量も、かなり限らられた程度までではあるもののトリプトファン代謝のキヌレニン経路における必須アミノ酸であるトリプトファンの異化作用によって摂取可能である(図2)。この経路の重要な反応はPLPに依存する。特にPLPはキヌレニナーゼ酵素の補助因子であり、キヌレニナーゼは3-ヒドロキシキヌレニンから3-ヒドロキシアントラニル酸への変換の触媒作用をする。PLPの利用性が減ると主にキヌレニナーゼの活動に影響し、NADの生成を制限し、血中および尿中でのキヌレニン、3-ヒドロキシキヌレニン、およびキサンツレン酸の濃度が高くなることにつながるようである(図2)(9)。したがって、食事性のビタミンB6を制限するとトリプトファンからのNADの合成が損なわれる一方で、適切なPLP濃度はトリプトファンからのNADの生成を維持するのに役立つ(10)。免疫の活性化と炎症に関してビタミンB6の量が不適切であることの影響は、トリプトファン代謝のキヌレニン経路におけるPLPの役割に一部関係しているのかもしれない(「疾病予防」の項参照)。
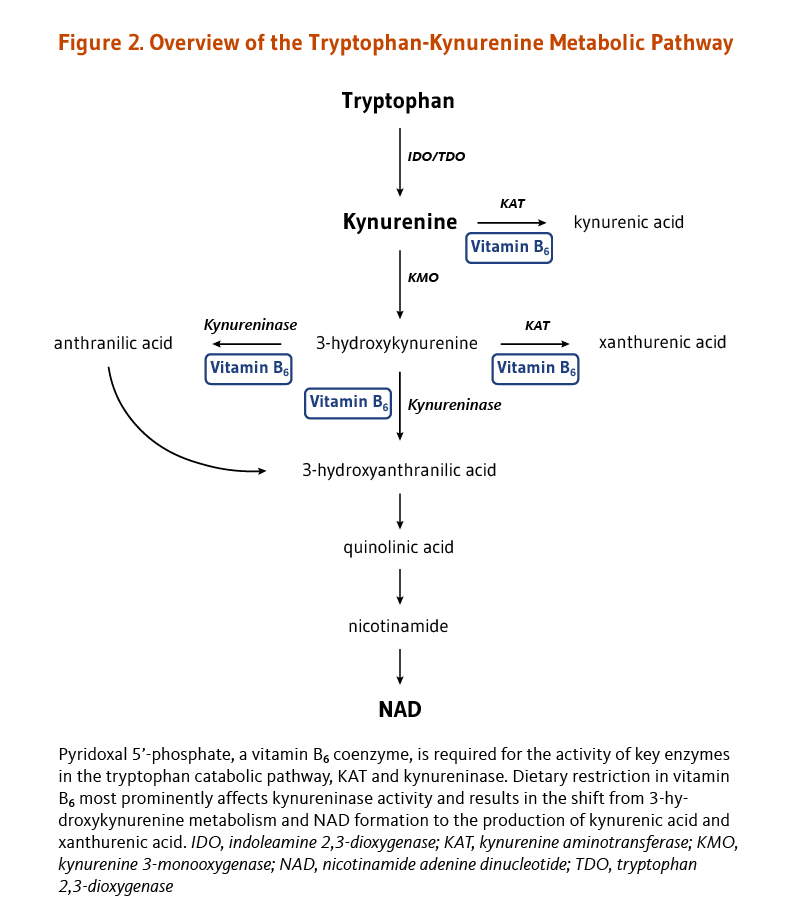
ホルモンの機能
エストロゲンやテストステロンなどのステロイドホルモンは、体内で標的細胞の核にあるステロイドホルモン受容体と結合することでその効果を表す。核の受容体そのものはDNAの特定の制御配列と結合し、標的遺伝子の転写を変える。PLPがステロイド受容体の活動に影響し、遺伝子発現へのそれらの効果を減少させるかもしれないメカニズムが、実験的な研究で明らかになった。生殖生物学における役割が知られている核内受容体の抑制因子であるRIP140/NRIP1とPLPが相互作用するのではないかということがわかった(11)。しかし、この相互作用がステロイド受容体介在性の遺伝子発現におけるRIP140/NRIP1の抑制活動を強めることを確認するさらなる研究が必要である。エストロゲン、プロゲステロン、テストステロン、またはその他のステロイドホルモンの受容体の活動がPLPによって阻害されるのであれば、乳がんや前立腺がんのようにステロイドホルモンによって促される疾病の発症リスクにビタミンB6の栄養状態が影響を与えることが可能かもしれない(6)。
核酸の合成
前駆体であるチミジンおよびプリン体からの核酸の合成は、葉酸補酵素に依存する。de novoチミジル酸(dTMP)生合成経路には、3つの酵素が関わる。それらはジヒドロ葉酸還元酵素(DHFR)、セリンヒドロキシメチルトランスフェラーゼ(SHMT)、およびチミジル酸合成酵素(TYMS)である(図3)。PLPはSHMTの補酵素として働き、これはセリンからグリシンへの変換とテトラヒドロ葉酸(THF)から5,10-メチレンTHFへの同時変換の触媒作用をする。後者の分子は、TYMSによるデオキシウリジン一リン酸(dUMP)からのdTMPの生成における一炭素供与体である。
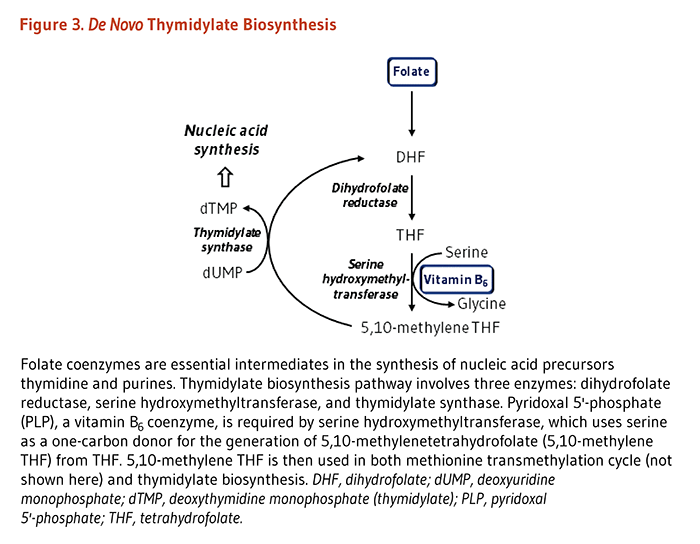
欠乏症
ビタミンB6の重篤な欠乏症は一般的でない。アルコール依存症患者は、食事性のビタミン摂取が少なくビタミン代謝も損なわれているので、ビタミンB6欠乏症のリスクが最も高いと考えられている。1950年代初期には、粉ミルク製造上の過失による重篤なビタミンB6欠乏症の結果として、乳児に発作が起きた(7)。ビタミンB6欠乏症の成人でも異常な脳波(EEG)パターンが報告されている。重篤なビタミンB6欠乏症で見られるその他の神経性症状には、易怒性、うつ、および錯乱があり、その他の症状には舌の炎症、口内炎や口内痛、および口角の皮膚の潰瘍などがある(12)。
推奨量(RDA)
ビタミンB6は代謝の多くの態様、特にアミノ酸の代謝経路に関わっているので、個人のタンパク質摂取量がビタミンB6の必要量に影響しているであろう(13)。米国医学研究所の食品栄養委員会(FNB)が発した以前の推奨量と違って、これらの関係はRDAを設定するのに考慮されてはいるものの、最新のビタミンB6のRDAはタンパク質摂取の見地からは表されてれていない(14)。現在のRDAは1998年にFNBによって改訂されており、表1にそれを示す。
疾病予防
免疫機能不全
トリプトファン代謝のキヌレニン経路のいくつかの酵素反応は、ビタミンB6補酵素であるピリドキサール5'-リン酸(PLP、上記の図2参照)に依存する(「トリプトファン代謝」の項参照)。この経路は炎症促進性の免疫反応において活性化され、妊娠期間中の胎児の免疫寛容に重要な役割を果たすことが知られている(15)。トリプトファン代謝のキヌレニン経路の重要な中間体が、免疫反応の調整に関わっている。トリプトファン誘導体のいくつかは、リンパ球(特に1型ヘルパーT細胞)のようなある種の免疫細胞の細胞死(アポトーシス)または細胞分裂阻止を引き起こすことがわかっている。それらはまた、炎症促進性サイトカインの生成を阻害することがある((15)の文献でレビュー)。最適な免疫機能、特に年配者のそれでは、ビタミンB6の適切な摂取が重要であることを示唆するエビデンス(根拠)がある(16,17)。しかし、トリプトファン分解の誘因となり多くの疾病(心血管疾患やがんなど)の根底にある慢性的炎症は、PLPの喪失を早めてビタミンB6の必要量を増やすかもしれない。現在のRDAより多いビタミンB6摂取が免疫系の障害を予防および/または反転できるのかを評価するさらなる研究が必要である(「ビタミンB6と炎症」の項参照)。
心血管疾患
米国看護師健康調査に参加した80,082人の女性集団による大規模前向き研究で、マルチビタミン(ビタミンB6を含む)サプリメントの使用は、偶発的な冠動脈疾患(CAD)リスクの24%の低下と関連があった(18)。食物摂取頻度調査票を使って、著者らは食物およびサプリメントからのビタミンB6摂取が最も高い五分位(中央値で4.6mg/日)の女性は、最も低い五分位(中央値で1.1mg/日)の女性に比べて、CADのリスクが34%低いことを見つけた。CADは冠状動脈の異常な狭窄(狭くなること)が特徴(一般的にはアテローム性動脈硬化症が原因)で、致命的な心筋梗塞(心臓発作)に至ることもある。最近では40,000人超の中年の日本人集団を11年半追跡した前向き研究で、サプリメントを使用しない者の中でビタミンB6摂取が最も高い五分位(平均で1.6mg/日)は、最も低い五分位(平均で1.3mg/日)に比べて心筋梗塞のリスクが48%低かったことが報告された(19)。
初期の観察研究でも、最適に満たない血漿ピリドキサール5'-リン酸(PLP)濃度、高い血中ホモシステイン濃度、および心血管疾患のリスク上昇には関連があることが示された(20~22)。より最近の研究で、血漿PLPが低い状態はCADのリスク要因であることが確定された。CADの184人の参加者と516人の健康な対照群によるある症例対照研究で、血漿PLP濃度が低いこと(30ナノモル/リットル未満)は、高いこと(30ナノモル/リットル以上)に比べてCADのリスクが倍近くになるという関連があった(23)。144の心筋梗塞症例(うち21人は死亡)を含む看護師健康調査の集団に基づくコホート内症例対照研究では、血中PLP濃度が最も高い四分位(70ナノモル/リットル以上)の女性は最も低い四分位(27.9ナノモル/リットル未満)の者に比べて心筋梗塞のリスクが79%低かった(24)。
ビタミンB6とホモシステイン
血中のホモシステイン濃度が少し高いだけでも、心不全、CAD、心筋梗塞、および脳血管性の発作(脳卒中)を含む心血管疾患(CVD)のリスク上昇と関連がある(25)。タンパク質の消化の際に、メチオニンを含むアミノ酸が放出される。メチオニンは必須アミノ酸であり、DNA、RNA、タンパク質、およびリン脂質のメチル化を含むほとんどのメチル化反応における普遍的なメチル基供与体であるSアデノシルメチオニン(SAM)の前駆体である(図4)。ホモシステインは、メチオニンの代謝における中間体である。健康な個人は、メチオニンの再メチル化サイクルにおいてホモシステインからメチオニンを再生するために2つの異なる経路を使用する(図5)。ホモシステインをメチオニンへと変換して戻すために、一方の経路はビタミンB12依存性メチオニン合成酵素とメチル基供与体である5-メチルテトラヒドロ葉酸(葉酸塩の誘導体)に依存する。他方の反応はベタイン-ホモシステインメチル基転移酵素によって触媒作用され、これはホモシステインからメチオニンを生成するのにベタインをメチル基の供給源として使用する。さらに、ホモシステイントランススルフレーション経路においてホモシステインをアミノ酸に変換するには、シスタチオニンβ合成酵素とシスタチオニンγリアーゼという2つのPLP依存性酵素が必要である(図5参照)。したがって血中のホモシステイン量は、葉酸塩、ビタミンB12、およびビタミンB6という少なくとも3つのビタミンBの栄養状態によって影響されるかもしれない。
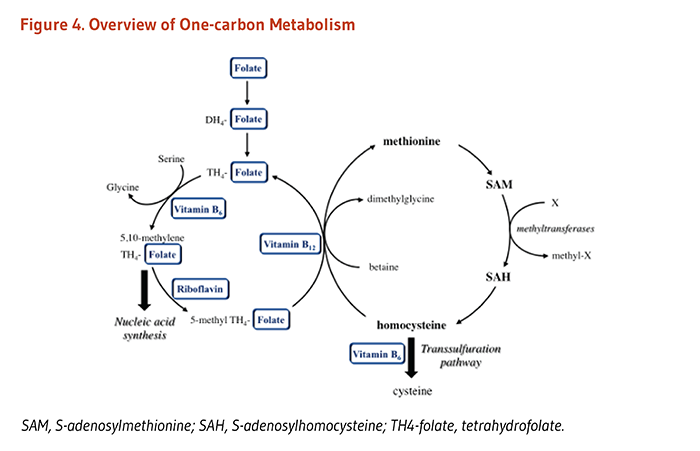
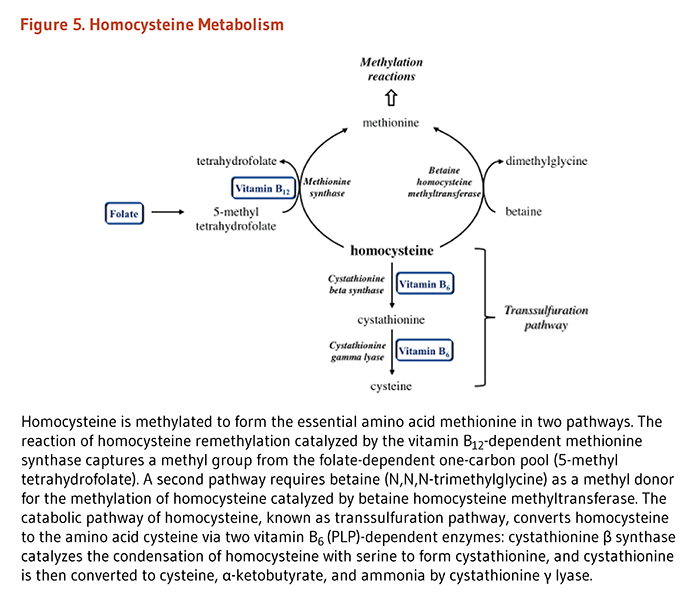
これらのビタミンBの1つもしくは全ての欠乏症は、再メチル化およびトランススルフレーションプロセスの両方に影響して異常なホモシステイン高濃度に至る可能性がある。初期の研究で、経口用量のメチオニンを与えた(メチオニン負荷試験)後でのビタミンB6の補給は血中ホモシステイン濃度を下げるかもしれないということがわかったが(26)、空腹時ホモシステイン濃度を下げることにおいてはビタミンB6補給は有効ではないかもしれない。9人の若い健康なボランティアによる最近の研究で、食後のホモシステイン濃度上昇は、ビタミンB6欠乏症ぎりぎり(平均血漿PLP濃度が19ナノモル/リットル)だとビタミンB6が十分(平均PLP濃度が49ナノモル/リットル)な場合に比べて大きいことがわかった(27)。著者らはビタミンB6制限に伴うシスタチオニン合成の速度上昇を報告し、このことはPLPの利用性がわずかに減少することに反応してトランススルフレーションにおけるホモシステインの異化作用が維持または強化されるのかもしれないことを示している。しかし、9人の参加者のうち6人において、メチオニンサイクルとトランススルフレーション経路の流出比は、トランススルフレーションよりも再メチル化によるホモシステインのクリアランス(排除)を支持しているようであった(27)。
高ホモシステイン血症や血管性障害のある被験者による多くの無作為化対照試験は、葉酸を単体もしくはビタミンB6やビタミンB12と一緒に補給すると、空腹時血漿ホモシステイン濃度を効果的に下げることができるかもしれないことを明示した。あるメタ解析に最近含まれた19の介入研究では、ビタミンB補給の後の血中ホモシステイン濃度は、ベースライン濃度(治験前の濃度)に比べて7.6%~51.7%の範囲で低下した(28)。対照的に、個人にビタミンB6のみを補給した研究では、通常は空腹時ホモシステイン濃度に効果を示さなかった(29,30)。補給された3種類のビタミンBのうち、ビタミンB12またはビタミンB6の欠乏症がない場合は、葉酸が空腹時ホモシステイン濃度の調整の主要な決定因子であるようだ(31)。しかし、CVDリスク低下におけるホモシステイン濃度低下の効果には議論の余地がある。9つの無作為化対照試験の最近のメタ解析では、ビタミンB補給で脳卒中の事象が10%減ったと報告され、これは高リスクの被験者(たとえば腎臓疾患の者など)にとってより有益であった(32)。それでも、今日までのビタミンB介入研究のシステマティックレビュー(概説)やメタ解析の大部分で、空腹時ホモシステイン濃度の低下と心血管事象の予防との間に因果関係が見られないことが示されている(28,33~35)。さらに、高リスク被験者へのビタミンB補給試験では、アテローム性動脈硬化症の進行を評価するのに使用される2つの血管健康状態マーカーである頸動脈内膜中膜肥厚(CIMT)や上腕動脈の血流依存性血管拡張反応(FMD)に大きな変化は見られなかった(36)。最後に、CADの疑いのある87人の被験者による無作為化二重盲検プラセボ対照試験である西ノルウェービタミンB介入試験(WENBIT)では、中央値で10ヶ月間ビタミンB6補給(40mg/日のピリドキシン)をしても、定量的血管造影検査によって評価された冠状動脈狭窄の進行には何の効果もなかった(37)。
CVDの一次予防で使用される抗血小板療法が、CVDリスクに関してビタミンBでホモシステイン濃度を低下させる効果に支障をきたしてしているかもしれないと示唆されてきた(38)。この点に関して、多機関共同無作為化二重盲検プラセボ対照試験であるVITATOPS(39)の部分集団事後解析で、抗血小板薬で治療を受けている患者はビタミンBによるホモシステイン濃度低下のささやかな有効性が帳消しにされているのかもしれないと提唱された(40)。しかし、一次予防(つまり、抗血小板薬の非使用者)におけるビタミンB補給の有益性は、未だに確立されていない。
ビタミンB6と炎症
ビタミンB6の栄養状態が悪いと、ホモシステイン濃度低下とは関係ないメカニズムによって心血管疾患のリスクが高くなるかもしれないことが、増大中のエビデンスで目下のところ示唆されている(41~43)。冠動脈疾患(CAD)の個人では、免疫活性と炎症のマーカーが高ホモシステイン血症(15マイクロモル/リットル超のホモシステイン濃度)と関連があった(44)。実際、動脈壁内のプラーク(アテロームとして知られる)に脂質が蓄積するアテローム性動脈硬化症の初期の段階には炎症が関わっており、CADリスクを上昇させる(45)。267人のCAD患者と475人の健康な対照群を含むある症例対照研究で、血漿PLP濃度は全身の炎症を示す2つのマーカーであるC反応性タンパク質(CRP)とフィブリノゲンの濃度と逆相関をしていた(46)。しかしその研究では、炎症マーカーへの補正をしてもCADリスクが変わらなかった(補正なしのオッズ比(OR)が1.71で、多変量補正後のORが1.73)ことから、最適未満のPLP濃度(36.3ナノモル/リットル未満)は炎症とは無関係にCADリスク増大に寄与するかもしれないことが示唆された。さらに、米国における2003~2004年全国健康栄養調査(NHANES)への参加者2,686人に対する炎症マーカーの解析で、血清CRP濃度がビタミンB6の全摂取量(食品およびサプリメントから)に逆相関することが示された。特に、血清CRP濃度が10mg/L超(高炎症活性に相当)になるリスクは、ビタミンB6摂取が2mg/日に満たない個人では摂取が5mg/日以上の者に比べて57%高かった(41)。さらに、ビタミンB6摂取が5mg/日に満たないでビタミンB6の栄養状態が不適切(血漿PLP濃度が20ナノモル/リットル未満)な者の割合は、血清CRP濃度が高い(10mg/L超)者の方が低い(3mg/L以下)者に対して体系的に高く、このことは炎症がビタミンB6の代謝を損なう可能性があることを示唆している。これらの観察はその他の同齢集団(フラミンガム次世代研究)の研究でも確認されており、この中ではビタミンB6の状態が13の炎症マーカー(CRP、フィブリノゲン、腫瘍壊死因子-α、およびインターロイキン-6を含む)の濃度に基づく全体的な炎症スコアと関連していた(42)。特に、炎症スコアが最も高い三分位の者は、最も低い三分位の者に比べて血漿PLP濃度が24%低かった。また、PLP濃度と炎症スコアとの逆相関はビタミンB6摂取の量にかかわらず大きいままだったことから、この関係性の本質がまたしても疑問視される。興味深いことに、WENBIT研究で集められたデータの最近の解析で、全身性の炎症がピリドキサール(PL)から4-ピリドキシン酸(PA)への分解が増えることと関連があることが明示され、これはビタミンB6の状態および全身性炎症という双方のマーカーとしてPAとPL+PLPとの比率を使用することを支持している(47)。最後に、炎症はビタミンB6の状態が悪いことに寄与するかもしれないが、現在のエビデンスは、心血管疾患の患者の炎症の制御におけるビタミンB6の役割を支持するものではない(48,49)。
認知機能低下とアルツハイマー病
いくつかの観察研究では、年配者の認知機能低下やアルツハイマー病(AD)と、葉酸塩、ビタミンB12、およびビタミンB6の栄養状態が不適切なこととを関連付けてきた(50)。しかし、年配者の間で高ホモシステイン血症の有病率が高いことや全身性炎症の徴候があることの両方のために、ビタミンBと加齢における認知機能の健全性との関係は複雑である(51)。一方では炎症がビタミンB6代謝を損なうかもしれないことから、血清PLP濃度が低いことは栄養不良というよりは加齢に関わる過程によって引き起こされているのかもしれない。他方では、まだ議論中ではあるものの、血清ホモシステイン濃度が高いことが年配者の認知機能低下リスク要因である可能性がある。特に、ビタミンB補給に関する19の無作為化プラセボ対照試験のメタ解析で、治療によってホモシステイン濃度が効果的に下がったにもかかわらず、治療を受けた群とプラセボを投与された群でのいくつかの認知機能測定値に差が報告されなかった(52)。認知障害のあるまたはない2,695人の脳卒中経験者による最近の無作為化二重盲検プラセボ対照研究で、2mgの葉酸、0.5mgのビタミンB12、および25mgのビタミンB6を毎日3.4年間補給したら、プラセボに比べて平均ホモシステイン濃度が大きく下がった(認知障害のない患者で28%、認知障害のある患者で43%)。しかしビタミンBによる介入は、新規に認知障害と診断される症例の発生率や認知行動能力の測定値に関して、プラセボに比べて何の効果もなかった(53)。対照的に最近の別のプラセボ対照試験で、高リスクの年配者のホモシステイン濃度を大きく低下させた毎日のビタミンBレジメン(治療計画)は、ADの過程に関連する脳の灰白質での進行性萎縮を制限するかもしれないことがわかった(54)。しかし、著者らはホモシステイン濃度の変化は主にビタミンB12によるものであるとしている。結果が混在しているので、ビタミンB補給が年配者の認知機能低下を鈍らせるかどうかは今のところ明らかでない。年配者には比較的一般的である若干のビタミンB欠乏が加齢に関連した認知機能の低下に寄与するのか、それとも両方とも加齢および/または疾患に関連するプロセスの結果なのかどうかを決定するエビデンスが必要である。
うつ病
晩年のうつ病は、股関節骨折や脳卒中などの急性の病気の後で時々起こる一般的な疾患である(55,56)。うつ病の症状とビタミンB6の低栄養状態(血漿PLP濃度が20ナノモル/リットル以下)の共存が、いくつかの横断的研究で報告されている(57,58)。シカゴ健康加齢プロジェクトに参加した自由生活を送る3,503人の65歳以上の人々の前向き研究で、ビタミンB6の全摂取量(食事性の摂取だけではない)は、平均7.2年の追跡期間のうつ病的症状の発生と逆相関があった(59)。最近脳卒中を経験した563人による無作為化二重盲検プラセボ対照試験で、毎日2mgの葉酸、0.5mgのビタミンB12、および25mgのビタミンB6を補給すると、平均7.1年間の追跡期間中に主なうつ病エピソードの発症リスクが半分になった(60)。このリスク低下は、対照群に比べて補給群の患者の血漿ホモシステイン濃度が25%低いことと関連していた。うつ病リスクが高い年配者の日常的な管理にビタミンBも含めるかどうかを評価するさらなるエビデンスが必要である。
がん
ほとんどのがんの根底にある慢性的炎症は、ビタミンB6の分解を促進するかもしれない(「ビタミンB6と炎症」の項参照)。さらに、メチオニンサイクル、ホモシステイン異化作用、およびチミジル酸合成におけるPLPの必要性から、ビタミンB6の低栄養状態は腫瘍の発生および/または進行に寄与するかもしれない。9つの前向き研究のシステマティックレビューで、ビタミンB6摂取と直腸結腸がん(CRC)リスクとの間の負または正のどちらの相関も見つかった(61)。ビタミンB6摂取と乳がんの関連における一貫しないエビデンスも、あるメタ解析で最近報告された(62)。しかし、500,000人近い年配の成人を9年間追跡した前向き研究で、ビタミンB6の全摂取量が最も高い五分位の参加者(中央値で2.7mg/日)は、最も低い参加者(中央値で1.4mg/日)に比べて食道がんおよび胃がんのリスクが低いことが観察された(63)。さらに、4つのコホート内症例対照研究のメタ解析で、血中PLP濃度が最も高い四分位の者は最も低い者に比べてCRCリスクが48%低いことが報告された(61)。5つのコホート内症例対照研究の別のメタ解析で、血清PLP濃度が高いと濃度が低い場合より閉経後の女性の乳がんリスクが29%低いという関連がわかったが、閉経前の女性ではそうではなかった(62)。
ビタミンBとがんリスクの関連の本質を調べる無作為化プラセボ対照試験でビタミンB6に焦点を当てたものは非常に少ない。冠動脈疾患の被験者で行われた初期の2つの研究では、ビタミンB6補給(40mg/日)をしてもCRCリスクや死亡率に何の有益性も見られなかった((64)の文献でレビュー)。心血管リスクの高い1,470人の女性に行われた最近の無作為化二重盲検プラセボ対照研究で、毎日2.5mgの葉酸、1mgのビタミンB12、および50mgのビタミンB6を平均して7.3年間補給しても、プラセボに比べて直腸結腸腺腫の発症リスクに何の効果もなかったことが示された(65)。
腎結石
ある大規模前向き研究で、女性のビタミンB6摂取と症候性腎結石の発生の関係が調べられた。腎結石の病歴のない85,000人超の女性群が14年超にわたって追跡され、毎日40mg以上のビタミンB6を摂取した者は、3mg以下しか摂取しなかった者に比べて腎結石を発症するリスクが3分の2しかなかった(66)。しかしながら、45.000人超の男性群を14年間追跡したら、ビタミンB6摂取と腎結石の発症には何の関連も見つからなかった(67)。高用量のピリドキサミン補給は、シュウ酸カルシウムの腎結石の生成を減らし、シュウ酸カルシウムの腎結石生成の重要な決定因子である尿中シュウ酸塩濃度を下げるのに役立つかもしれないことが、限定的な実験データから示唆される(68,69)。現在のところ、ビタミンB6摂取と腎結石発症リスクの関係については、何らかの推奨がなされる前にさらなる研究が必要である。
疾病治療
薬理学的用量(欠乏症を予防するのに必要な量よりずっと高用量)のビタミンB6サプリメントは、広範な症状の治療の試みで使用されてきており、以下でそのいくつかについて検討する。
代謝疾患
ピリドキシン依存性てんかん(PDE)やピリドキシン/ピリドキサミン5'-リン酸オキシダーゼ(PNPO)欠乏症などの稀な先天性代謝障害のいくつかは、薬理学的用量のビタミンB6によく反応することがわかっている早発性てんかん性脳症の原因である。PDEやPNPO欠乏症の個人では、PLPの生物学的利用性が限定されており、ピリドキシンおよび/またはPLPでの治療がこれらの病状の特徴であるてんかん発作を軽減または消失させるために使用されてきた(70,71)。食事性のタンパク質制限とともにピリドキシンで治療することも、PLP依存性酵素であるシスタチオニンβ合成酵素の欠乏でおこりビタミンB6によく反応するホモシスチン尿症の管理に使用される(72)。
つわり
つわりとよく言われる妊娠中の吐き気と嘔吐(NVP)は、妊娠初期の85%の女性に影響し、通常は12~16週間続く(73)。妊娠中の吐き気治療にビタミンB6が1940年代から使用されてきた。ビタミンB6はもともとベンデクチンという薬剤に含まれ、これはNVP治療に処方され、後に先天性欠損のリスクが高くなるのではないかという未証明の懸念によって市場から回収された。ビタミンB6自体は妊娠中でも安全であると考えられており、致命的な害のエビデンスも無く妊婦に使用されている(74)。25mgのピリドキシンを8時間ごとに3日間使った妊婦(75)や10mgのピリドキシンを8時間ごとに5日間使った妊婦(76)を含む401人の妊婦による2つの二重盲検プラセボ対照試験の結果では、ビタミンB6は吐き気を抑えるのに有益であるかもしれないということが示唆された。妊娠初期のNVP症状に関する無作為化対照試験の最近のシステマティックレビューで、ビタミンB6補給は多少の効果があるとわかった(77)。NVPは通常は何の治療もしないで解決するので、よく対照された試験を行うことが難しいことに留意すべきである。より最近では、NVPに悩まされる256人の妊婦(妊娠7~14週)に対して行われた無作為化二重盲検プラセボ対照研究において、妊娠特有嘔吐定量化(PUQE)スコアを用いてNVPの症状が評価された(78)。プラセボに比べてPUQEスコアが低かったため、ピリドキシンおよびドキシラミンという薬剤の補給は、NVPの症状を大きく改善したと評価された。また、ピリドキシンとドキシラミンを補給した女性は、プラセボで処置された女性よりも15日間の試験の終わりにその治療を継続したいと希望した者が多かった(48.9%対32.8%)。アメリカおよびカナダの産婦人科学会は、NVPの第一選択療法としてビタミンB6(塩酸ピリドキシン10mg)とコハク酸ドキシラミン(10mg)の使用を勧めている(73)。
月経前症候群
月経前症候群(PMS)とは、疲労、易怒性、むら気/うつ、体液貯留、および乳房圧痛などを含む症状群を言うが、これだけには限定されず、排卵(中間期)後の頃に始まり月経(生理)の始まりとともに和らぐ。9つの無作為化プラセボ対照試験のシステマティックレビューおよびメタ解析で、最大100mg/日までのビタミンB6補給が気分的な症状を含むPMSの治療に有益かもしれないと示唆された。しかし、ほとんどの研究の品質がよくないため、限定的な結論しか出せないかもしれない(79)。13の無作為化対照試験の最近の別のレビューでも、推奨を出せるくらいの決定的なエビデンスの必要性が強調された(80)。
うつ
いくつかの神経伝達物質(「神経系の機能」の項参照)の合成におけるPLP依存性酵素の重要性から、研究者はビタミンB6欠乏症がうつ病症状の発症に寄与しているのではないかと考えるようになった(「疾病予防」の項参照)。ビタミンB6補給がうつ病の管理に治療的効能があるかもしれないと示唆するエビデンスは限定的である。急性の疾病で入院した225人の年配の患者に対して行われたある無作為化プラセボ対照試験では、毎日6ヶ月間マルチビタミン/ミネラル補給をする介入でビタミンBの栄養状態が改善し、プラセボに比べてうつ症状の回数や重篤度が低下した(81)。さらに、サプリメントの摂取によってプラセボに比べて効果的に血漿ホモシステイン濃度が減り、ホモシステイン濃度が最も低い四分位の被験者(10マイクロモル/リットル以下)は最も高い四分位(16.1マイクロモル/リットル以上)に比べて試験終了時のうつ病的症状に対する補給の効果が大きかった(82)。しかし、晩期発症型うつ病の病因はよくわからず、ビタミンB(ビタミンB6を含む)補給がうつ病的症状を和らげるのかどうかということを示唆するエビデンスが現在不足している。
手根管症候群
手根管症候群(CTS)は、手首の正中神経の圧迫により手や指に痺れ、痛み、および脱力感を引き起こす。それは手首に繰り返し与えられた圧力損傷や軟組織の腫脹によるものであるかもしれず、時として妊娠や甲状腺機能低下症とともに起こる。同じ研究者による初期の研究で100~200mg/日のビタミンB6を数ヶ月補給すると、ビタミンB6の栄養状態が悪い個人のCTSの症状を改善するかもしれないことが示唆された(83,84)。さらに、ビタミンのサプリメントを摂取していない137人の男性による横断的研究で、低い血中PLP濃度がCTSの症状である痛み、うずき、および中途覚醒の増加と関連していることがわかった(85)。しかし、正中神経の伝導の電気生理学的測定を使用した大部分の研究では、ビタミンB6欠乏症とCTSの関連は見つけられなかった(86)。ビタミンB6補給によるいくらかの症状の軽減に言及した研究もあったが、二重盲検プラセボ対照試験は一般的にビタミンB6がCTS治療に効果的だとはしていない(86)。しかし、有効性に関する賛否両論があるにもかかわらず、手の手術を避けるための試みとしての補完療法にビタミンB6補給が時々使用される。高用量のビタミンB6を摂取している患者は、医師に助言を受けビタミンB6関連の毒性の症状に関してチェックされねばならない(「毒性」の項参照)(87)。
摂取源
食品の摂取源
2003~2004年に行われた米国のNHANESで集められたデータの解析で、ビタミンB6の食品のみからの摂取は平均で1.9mg/日であったことが示された(88)。現在のRDAを大きく上回る数字であるにもかかわらず、2mg/日未満というビタミンB6の全摂取量(食品およびサプリメントを合わせたもの)は、全年齢層でビタミンB6の栄養状態が低い人の割合が比較的高いことと関連しているように見える(「サプリメント」の項参照)。多くの植物性食品はピリドキシングルコシドという独特な形態のビタミンB6を含有しており、この形態のビタミンB6はその他の食品源やサプリメント由来のビタミンB6に比べて約半分の生物学的利用性しかないようである(7)。混合食に含まれるビタミンB6は約75%の生物学的利用性があることがわかっている(14)。たいていの場合ビタミンB6の豊富な食品を食事に含めることで、現在のRDAを満たすのに十分なビタミンB6が供給されるはずである。しかし、非常に制限された菜食主義の食事を守る者は、ビタミンB6が強化された食品を食べたりサプリメントを摂ったりして、ビタミンB6摂取を増やす必要があるかもしれない。ビタミンB6が比較的豊富な食品とその含有量をミリグラム(mg)で示したものを、表2に記載する。特定の食品の栄養素含有量についてのさらなる情報は、USDAの食品成分データベースを検索のこと。
サプリメント
ビタミンB6はマルチビタミン、ビタミンB複合体、およびビタミンB6のサプリメント中の塩酸ピリドキシンとして入手可能である(89)。2003~2004年のNHANESでは、ビタミンB6の栄養状態が悪い(血漿PLP濃度が20ナノモル/リットル未満)ケースがサプリメントの不使用者で24%、サプリメント使用者で11%報告された。さらに、2mg/日より少ないビタミンB6全摂取量(食品およびサプリメント由来)が、血漿PLP濃度の低い者の割合が高いことと関連があった。これは13~54歳の男性の16%、月経のある女性の24%、および65歳以上の者の26%にあたる。最後に、ビタミンB6摂取が2mg/日未満の者の方がそれより摂取が多い者に比べて低PLP濃度の割合が高かった。たとえば、65歳以上の男女ではビタミンB6の全摂取量が2~2.9mg/日の者はその14%が低PLP濃度だったのに対し、2mg/日未満の者では26%が低PLP濃度であった(88)。
安全性
毒性
有害作用はビタミンB6サプリメントに関しての記録しかなく、食品源からの記録がないため、ビタミンB6(ピリドキシン)のサプリメントのみに関しての安全性を議論する。ビタミンB6は水溶性ビタミンで尿中に排泄されるものの、非常に高用量のピリドキシンの長期補給は感覚性ニューロパチーとして知られる痛みを伴う神経症状に至る可能性がある。症状には四肢の痛みや痺れなどがあるが、重篤な場合は歩行困難になる。感覚性ニューロパチーは、1日に1,000mgを超える用量のピリドキシンで一般的に発症する。しかし、数ヶ月間の毎日500mg未満の用量でも感覚性ニューロパチーを発症した個人のいくつかの症例報告がある。客観的な神経学的検査が行われた研究で、毎日200mg未満のピリドキシン摂取で感覚神経損傷のエビデンスが報告されたものはない(90)。実質的にすべての者の感覚性ニューロパチーを防ぐために、米国医学研究所の食品栄養委員会は成人に対するピリドキシンの許容上限摂取量(UL)を100mg/日と設定した(表3)(14)。プラセボ対照研究で高用量ピリドキシンの治療効果が一般的に示されなかったため、100mg/日というULを超えることにはほとんど意味がない。
| 年齢層 | UL(mg/日) |
|---|---|
| 乳児 0~12ヶ月 | 設定不可能* |
| 幼児 1~3歳 | 30 |
| 子供4~8歳 | 40 |
| 子供9~13歳 | 60 |
| 青少年 14~18歳 | 80 |
| 成人 19歳以上 | 100 |
| *摂取源は食品および粉ミルクのみ。 | |
薬物相互作用
特定の薬物はビタミンB6代謝に支障をきたす。したがってビタミンB6補給をしないとビタミンB6欠乏症になりやすいかもしれない個人もいる。2003~2004年のNHANESの解析で、月経期の女性で現在および過去に経口避妊薬(OC)を使用したことのある者は、使用したことのない女性に比べて血漿PLP濃度が低い者がかなり多かった。このことはOCに含まれるエストロゲンがビタミンB6代謝に支障をきたす可能性を示唆する(「経口避妊薬の副作用」の項参照)(88)。抗結核薬(たとえばイソニアジドやシクロセリンなど)、金属キレートペニシラミン、およびLドーパのような抗パーキンソン病薬はすべてビタミンB6と複合体を形成することが可能で、ビタミンB6の生物学的利用性を限定してしまい、機能性欠乏症を引きおこしてしまう。PLPの生物学的利用性も、特定の呼吸状態の治療に使用されるテオフィリンなどのメチルキサンチンによって低下する可能性がある(7)。長期間の非ステロイド性抗炎症薬(NSAID、たとえばセレコキシブやナプロキセン)の使用も、ビタミンB6代謝を損なう可能性がある(91)。逆に、高用量のビタミンB6はフェノバルビタールとフェニトインという2つの抗痙攣薬、およびLドーパの効能を下げることがわかっている(6,90)。
経口避妊薬の副作用
ビタミンB6はアミノ酸であるトリプトファンの代謝に必要であるので、トリプトファン負荷試験(トリプトファンの経口投与後のトリプトファン代謝物の測定)がビタミンB6の状態の機能評価として使用されてきた。1960~1970年代に高用量の経口避妊薬(OC)を摂取した女性の異常なトリプトファン負荷試験の結果はこれらの女性がビタミンB6欠乏であると示唆し、OCを摂取する女性への高用量ビタミンB6(100~150mg/日)処方につながった。しかし、高用量OCを摂取した女性のビタミンB6状態に関するその他のほとんどの指標は正常であり、OCに含まれるエストロゲンの方がトリプトファン代謝の異常の原因であるようだった(88)。しかしながら、最近になってより低用量の製剤の使用も、ビタミンB6の不適切さと関連していた(88,92)。OCが実際にビタミンB6代謝を損なうのかPLPの組織分布に影響しているだけなのか不明であるが、OCの使用は女性がOCを止めて妊娠した際にビタミンB6欠乏症になるリスクを高くするのかもしれない(93)。ホモシステイン濃度が正常でもOCの使用者は心血管疾患のリスクが高いのかどうかも確定されねばならない。最後に、高用量ビタミンB6(ピリドキシン)はOCの副作用リスクの予防に何の効果もないと実証されてきた(94)が、現在および過去のOC使用者にはビタミンB6サプリメントの使用が是認されてもよいかもしれない。
ライナス・ポーリング研究所の推奨
ライナス・ポーリング研究所はビタミンB6のRDAを支持する。LPIはすべての成人が毎日マルチビタミン/ミネラルのサプリメントを摂取することを推奨し、これには通常少なくとも2mgのビタミンB6が含まれる。この量はRDAより若干多いが、食品栄養委員会によって設定された許容上限摂取量(UL)よりも50倍も低い(「安全性」の項参照)。
年配の成人(50歳超)
初期の代謝研究は、年配者のビタミンB6必要量は毎日約2mgであると示してきた(95)。しかし、2003~2004年の米国の集団調査(NHANES)の分析で、65歳以上の人々における適切なビタミンB6の状態と低ホモシステイン濃度は3mg/日以上のビタミンB6全摂取量と関連があることが示された(88)。ライナス・ポーリング研究所は、年配者が少なくとも2.0mgのビタミンB6を毎日摂れるマルチビタミン/ミネラルサプリメントを摂取することを推奨する。
Authors and Reviewers
Originally written in 2000 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in February 2002 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in November 2007 by:
Victoria J. Drake, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in May 2014 by:
Barbara Delage, Ph.D.
Linus Pauling Institute
Oregon State University
Reviewed in June 2014 by:
Jesse F. Gregory, Ph.D.
Professor, Food Science and Human Nutrition
University of Florida
The 2014 update of this article was underwritten, in part, by a grant from Bayer Consumer Care AG, Basel, Switzerland.
Copyright 2000-2024 Linus Pauling Institute
References
1. Dakshinamurti S, Dakshinamurti K. Vitamin B6. In: Zempleni J, Rucker RB, McCormick DB, Suttie JW, eds. Handbook of Vitamins. 4th ed. New York: CRC Press (Taylor & Fracis Group); 2007:315-359.
2. Galluzzi L, Vacchelli E, Michels J, et al. Effects of vitamin B6 metabolism on oncogenesis, tumor progression and therapeutic responses. Oncogene. 2013;32(42):4995-5004. (PubMed)
3. McCormick DB. Vitamin B6. In: Bowman BA, Russell RM, eds. Present Knowledge in Nutrition. Vol. I. Washington, D.C.: International Life Sciences Institute; 2006:269-277.
4. Da Silva VR, Russell KA, Gregory JF 3rd. Vitamin B6. In: Erdman JW Jr., Macdonald IA, Zeisel SH. Present Knowldege in Nutrition. 10th ed: Wiley-Blackwell; 2012:307-320.
5. Eliot AC, Kirsch JF. Pyridoxal phosphate enzymes: mechanistic, structural, and evolutionary considerations. Annu Rev Biochem. 2004;73:383-415. (PubMed)
6. Leklem JE. Vitamin B-6. In: Shils M, Olson JA, Shike M, Ross AC, eds. Modern Nutrition in Health and Disease. 9th ed. Baltimore: Williams & Wilkins; 1999:413-422.
7. Clayton PT. B6-responsive disorders: a model of vitamin dependency. J Inherit Metab Dis. 2006;29(2-3):317-326. (PubMed)
8. Schnackerz KD, Benesch RE, Kwong S, Benesch R, Helmreich EJ. Specific receptor sites for pyridoxal 5'-phosphate and pyridoxal 5'-deoxymethylenephosphonate at the α and β NH2-terminal regions of hemoglobin. J Biol Chem. 1983;258(2):872-875. (PubMed)
9. Rios-Avila L, Nijhout HF, Reed MC, Sitren HS, Gregory JF, 3rd. A mathematical model of tryptophan metabolism via the kynurenine pathway provides insights into the effects of vitamin B-6 deficiency, tryptophan loading, and induction of tryptophan 2,3-dioxygenase on tryptophan metabolites. J Nutr. 2013;143(9):1509-1519. (PubMed)
10. Oxenkrug G. Insulin resistance and dysregulation of tryptophan-kynurenine and kynurenine-nicotinamide adenine dinucleotide metabolic pathways. Mol Neurobiol. 2013;48(2):294-301. (PubMed)
11. Huq MD, Tsai NP, Lin YP, Higgins L, Wei LN. Vitamin B6 conjugation to nuclear corepressor RIP140 and its role in gene regulation. Nat Chem Biol. 2007;3(3):161-165. (PubMed)
12. Leklem JE. Vitamin B6. In: Machlin L, ed. Handbook of Vitamins. New York: Marcel Decker Inc; 1991:341-378.
13. Hansen CM, Shultz TD, Kwak HK, Memon HS, Leklem JE. Assessment of vitamin B-6 status in young women consuming a controlled diet containing four levels of vitamin B-6 provides an estimated average requirement and recommended dietary allowance. J Nutr. 2001;131(6):1777-1786. (PubMed)
14. Food and Nutrition Board, Institute of Medicine. Vitamin B6. Dietary Reference Intakes: Thiamin, Riboflavin, Niacin, Vitamin B6, Vitamin B12, Pantothenic Acid, Biotin, and Choline. Washington D.C.: National Academies Press; 1998:150-195. (National Academies Press)
15. Paul L, Ueland PM, Selhub J. Mechanistic perspective on the relationship between pyridoxal 5'-phosphate and inflammation. Nutr Rev. 2013;71(4):239-244. (PubMed)
16. Meydani SN, Ribaya-Mercado JD, Russell RM, Sahyoun N, Morrow FD, Gershoff SN. Vitamin B-6 deficiency impairs interleukin 2 production and lymphocyte proliferation in elderly adults. Am J Clin Nutr. 1991;53(5):1275-1280. (PubMed)
17. Talbott MC, Miller LT, Kerkvliet NI. Pyridoxine supplementation: effect on lymphocyte responses in elderly persons. Am J Clin Nutr. 1987;46(4):659-664. (PubMed)
18. Rimm EB, Willett WC, Hu FB, et al. Folate and vitamin B6 from diet and supplements in relation to risk of coronary heart disease among women. JAMA. 1998;279(5):359-364. (PubMed)
19. Ishihara J, Iso H, Inoue M, et al. Intake of folate, vitamin B6 and vitamin B12 and the risk of CHD: the Japan Public Health Center-Based Prospective Study Cohort I. J Am Coll Nutr. 2008;27(1):127-136. (PubMed)
20. Folsom AR, Nieto FJ, McGovern PG, et al. Prospective study of coronary heart disease incidence in relation to fasting total homocysteine, related genetic polymorphisms, and B vitamins: the Atherosclerosis Risk in Communities (ARIC) study. Circulation. 1998;98(3):204-210. (PubMed)
21. Robinson K, Arheart K, Refsum H, et al. Low circulating folate and vitamin B6 concentrations: risk factors for stroke, peripheral vascular disease, and coronary artery disease. European COMAC Group.Circulation. 1998;97(5):437-443. (PubMed)
22. Robinson K, Mayer EL, Miller DP, et al. Hyperhomocysteinemia and low pyridoxal phosphate. Common and independent reversible risk factors for coronary artery disease. Circulation. 1995;92(10):2825-2830. (PubMed)
23. Lin PT, Cheng CH, Liaw YP, Lee BJ, Lee TW, Huang YC. Low pyridoxal 5'-phosphate is associated with increased risk of coronary artery disease. Nutrition. 2006;22(11-12):1146-1151. (PubMed)
24. Page JH, Ma J, Chiuve SE, et al. Plasma vitamin B(6) and risk of myocardial infarction in women. Circulation. 2009;120(8):649-655. (PubMed)
25. Gerhard GT, Duell PB. Homocysteine and atherosclerosis. Curr Opin Lipidol. 1999;10(5):417-428. (PubMed)
26. Ubbink JB, Vermaak WJ, van der Merwe A, Becker PJ, Delport R, Potgieter HC. Vitamin requirements for the treatment of hyperhomocysteinemia in humans. J Nutr. 1994;124(10):1927-1933. (PubMed)
27. Lamers Y, Coats B, Ralat M, Quinlivan EP, Stacpoole PW, Gregory JF, 3rd. Moderate vitamin B-6 restriction does not alter postprandial methionine cycle rates of remethylation, transmethylation, and total transsulfuration but increases the fractional synthesis rate of cystathionine in healthy young men and women. J Nutr. 2011;141(5):835-842. (PubMed)
28. Huang T, Chen Y, Yang B, Yang J, Wahlqvist ML, Li D. Meta-analysis of B vitamin supplementation on plasma homocysteine, cardiovascular and all-cause mortality. Clin Nutr. 2012;31(4):448-454. (PubMed)
29. Bosy-Westphal A, Holzapfel A, Czech N, Muller MJ. Plasma folate but not vitamin B(12) or homocysteine concentrations are reduced after short-term vitamin B(6) supplementation. Ann Nutr Metab. 2001;45(6):255-258. (PubMed)
30. Lee BJ, Huang MC, Chung LJ, et al. Folic acid and vitamin B12 are more effective than vitamin B6 in lowering fasting plasma homocysteine concentration in patients with coronary artery disease. Eur J Clin Nutr. 2004;58(3):481-487. (PubMed)
31. Bostom AG, Carpenter MA, Kusek JW, et al. Homocysteine-lowering and cardiovascular disease outcomes in kidney transplant recipients: primary results from the Folic Acid for Vascular Outcome Reduction in Transplantation trial. Circulation. 2011;123(16):1763-1770. (PubMed)
32. Qin X, Huo Y, Xie D, Hou F, Xu X, Wang X. Homocysteine-lowering therapy with folic acid is effective in cardiovascular disease prevention in patients with kidney disease: a meta-analysis of randomized controlled trials. Clin Nutr. 2013;32(5):722-727. (PubMed)
33. Clarke R, Halsey J, Bennett D, Lewington S. Homocysteine and vascular disease: review of published results of the homocysteine-lowering trials. J Inherit Metab Dis. 2011;34(1):83-91. (PubMed)
34. Marti-Carvajal AJ, Sola I, Lathyris D, Karakitsiou DE, Simancas-Racines D. Homocysteine-lowering interventions for preventing cardiovascular events. Cochrane Database Syst Rev. 2013;1:CD006612. (PubMed)
35. Zhang C, Chi FL, Xie TH, Zhou YH. Effect of B-vitamin supplementation on stroke: a meta-analysis of randomized controlled trials. PLoS One. 2013;8(11):e81577. (PubMed)
36. Potter K, Hankey GJ, Green DJ, Eikelboom J, Jamrozik K, Arnolda LF. The effect of long-term homocysteine-lowering on carotid intima-media thickness and flow-mediated vasodilation in stroke patients: a randomized controlled trial and meta-analysis. BMC Cardiovasc Disord. 2008;8:24. (PubMed)
37. Loland KH, Bleie O, Blix AJ, et al. Effect of homocysteine-lowering B vitamin treatment on angiographic progression of coronary artery disease: a Western Norway B Vitamin Intervention Trial (WENBIT) substudy. Am J Cardiol. 2010;105(11):1577-1584. (PubMed)
38. Wang X, Qin X, Demirtas H, et al. Efficacy of folic acid supplementation in stroke prevention: a meta-analysis. Lancet. 2007;369(9576):1876-1882. (PubMed)
39. Vitatops Trial Study Group. B vitamins in patients with recent transient ischaemic attack or stroke in the VITAmins TO Prevent Stroke (VITATOPS) trial: a randomised, double-blind, parallel, placebo-controlled trial. Lancet Neurol. 2010;9(9):855-865. (PubMed)
40. Hankey GJ, Eikelboom JW, Yi Q, et al. Antiplatelet therapy and the effects of B vitamins in patients with previous stroke or transient ischaemic attack: a post-hoc subanalysis of VITATOPS, a randomised, placebo-controlled trial. Lancet Neurol. 2012;11(6):512-520. (PubMed)
41. Morris MS, Sakakeeny L, Jacques PF, Picciano MF, Selhub J. Vitamin B-6 intake is inversely related to, and the requirement is affected by, inflammation status. J Nutr. 2010;140(1):103-110. (PubMed)
42. Sakakeeny L, Roubenoff R, Obin M, et al. Plasma pyridoxal-5-phosphate is inversely associated with systemic markers of inflammation in a population of US adults. J Nutr. 2012;142(7):1280-1285. (PubMed)
43. Shen J, Lai CQ, Mattei J, Ordovas JM, Tucker KL. Association of vitamin B-6 status with inflammation, oxidative stress, and chronic inflammatory conditions: the Boston Puerto Rican Health Study. Am J Clin Nutr. 2010;91(2):337-342. (PubMed)
44. Schroecksnadel K, Grammer TB, Boehm BO, Marz W, Fuchs D. Total homocysteine in patients with angiographic coronary artery disease correlates with inflammation markers. Thromb Haemost. 2010;103(5):926-935. (PubMed)
45. Hartman J, Frishman WH. Inflammation and atherosclerosis: a review of the role of interleukin-6 in the development of atherosclerosis and the potential for targeted drug therapy. Cardiol Rev. 2014;22(3):147-151. (PubMed)
46. Friso S, Girelli D, Martinelli N, et al. Low plasma vitamin B-6 concentrations and modulation of coronary artery disease risk. Am J Clin Nutr. 2004;79(6):992-998. (PubMed)
47. Ulvik A, Midttun O, Pedersen ER, Eussen SJ, Nygard O, Ueland PM. Evidence for increased catabolism of vitamin B-6 during systemic inflammation. Am J Clin Nutr. 2014;100(1):250-255. (Epub ahead of print) (PubMed)
48. Bleie O, Semb AG, Grundt H, et al. Homocysteine-lowering therapy does not affect inflammatory markers of atherosclerosis in patients with stable coronary artery disease. J Intern Med. 2007;262(2):244-253. (PubMed)
49. Potter K, Lenzo N, Eikelboom JW, Arnolda LF, Beer C, Hankey GJ. Effect of long-term homocysteine reduction with B vitamins on arterial wall inflammation assessed by fluorodeoxyglucose positron emission tomography: a randomised double-blind, placebo-controlled trial. Cerebrovasc Dis. 2009;27(3):259-265. (PubMed)
50. Selhub J, Bagley LC, Miller J, Rosenberg IH. B vitamins, homocysteine, and neurocognitive function in the elderly. Am J Clin Nutr. 2000;71(2):614S-620S. (PubMed)
51. Pawelec G, Goldeck D, Derhovanessian E. Inflammation, ageing and chronic disease. Curr Opin Immunol. 2014;29C:23-28. (PubMed)
52. Ford AH, Almeida OP. Effect of homocysteine lowering treatment on cognitive function: a systematic review and meta-analysis of randomized controlled trials. J Alzheimers Dis. 2012;29(1):133-149. (PubMed)
53. Hankey GJ, Ford AH, Yi Q, et al. Effect of B vitamins and lowering homocysteine on cognitive impairment in patients with previous stroke or transient ischemic attack: a prespecified secondary analysis of a randomized, placebo-controlled trial and meta-analysis. Stroke. 2013;44(8):2232-2239. (PubMed)
54. Douaud G, Refsum H, de Jager CA, et al. Preventing Alzheimer's disease-related gray matter atrophy by B-vitamin treatment. Proc Natl Acad Sci U S A. 2013;110(23):9523-9528. (PubMed)
55. Hackett ML, Yapa C, Parag V, Anderson CS. Frequency of depression after stroke: a systematic review of observational studies. Stroke. 2005;36(6):1330-1340. (PubMed)
56. Lenze EJ, Munin MC, Skidmore ER, et al. Onset of depression in elderly persons after hip fracture: implications for prevention and early intervention of late-life depression. J Am Geriatr Soc. 2007;55(1):81-86. (PubMed)
57. Merete C, Falcon LM, Tucker KL. Vitamin B6 is associated with depressive symptomatology in Massachusetts elders. J Am Coll Nutr. 2008;27(3):421-427. (PubMed)
58. Pan WH, Chang YP, Yeh WT, et al. Co-occurrence of anemia, marginal vitamin B6, and folate status and depressive symptoms in older adults. J Geriatr Psychiatry Neurol. 2012;25(3):170-178. (PubMed)
59. Skarupski KA, Tangney C, Li H, Ouyang B, Evans DA, Morris MC. Longitudinal association of vitamin B-6, folate, and vitamin B-12 with depressive symptoms among older adults over time. Am J Clin Nutr. 2010;92(2):330-335. (PubMed)
60. Almeida OP, Marsh K, Alfonso H, Flicker L, Davis TM, Hankey GJ. B-vitamins reduce the long-term risk of depression after stroke: The VITATOPS-DEP trial. Ann Neurol. 2010;68(4):503-510. (PubMed)
61. Larsson SC, Orsini N, Wolk A. Vitamin B6 and risk of colorectal cancer: a meta-analysis of prospective studies. JAMA. 2010;303(11):1077-1083. (PubMed)
62. Wu W, Kang S, Zhang D. Association of vitamin B6, vitamin B12 and methionine with risk of breast cancer: a dose-response meta-analysis. Br J Cancer. 2013;109(7):1926-1944. (PubMed)
63. Xiao Q, Freedman ND, Ren J, Hollenbeck AR, Abnet CC, Park Y. Intakes of folate, methionine, vitamin B6, and vitamin B12 with risk of esophageal and gastric cancer in a large cohort study. Br J Cancer. 2014;110(5):1328-1333. (PubMed)
64. Zhang XH, Ma J, Smith-Warner SA, Lee JE, Giovannucci E. Vitamin B6 and colorectal cancer: current evidence and future directions. World J Gastroenterol. 2013;19(7):1005-1010. (PubMed)
65. Song Y, Manson JE, Lee IM, et al. Effect of combined folic acid, vitamin B(6), and vitamin B(12) on colorectal adenoma. J Natl Cancer Inst. 2012;104(20):1562-1575. (PubMed)
66. Curhan GC, Willett WC, Speizer FE, Stampfer MJ. Intake of vitamins B6 and C and the risk of kidney stones in women. J Am Soc Nephrol. 1999;10(4):840-845. (PubMed)
67. Taylor EN, Stampfer MJ, Curhan GC. Dietary factors and the risk of incident kidney stones in men: new insights after 14 years of follow-up. J Am Soc Nephrol. 2004;15(12):3225-3232. (PubMed)
68. Chetyrkin SV, Kim D, Belmont JM, Scheinman JI, Hudson BG, Voziyan PA. Pyridoxamine lowers kidney crystals in experimental hyperoxaluria: a potential therapy for primary hyperoxaluria. Kidney Int. 2005;67(1):53-60. (PubMed)
69. Scheinman JI, Voziyan PA, Belmont JM, Chetyrkin SV, Kim D, Hudson BG. Pyridoxamine lowers oxalate excretion and kidney crystals in experimental hyperoxaluria: a potential therapy for primary hyperoxaluria. Urol Res. 2005;33(5):368-371. (PubMed)
70. Pearl PL, Gospe SM, Jr. Pyridoxine or pyridoxal-5'-phosphate for neonatal epilepsy: The distinction just got murkier. Neurology. 2014;82(16):1392-1394. (PubMed)
71. Stockler S, Plecko B, Gospe SM, Jr., et al. Pyridoxine dependent epilepsy and antiquitin deficiency: clinical and molecular characteristics and recommendations for diagnosis, treatment and follow-up. Mol Genet Metab. 2011;104(1-2):48-60. (PubMed)
72. Picker JD, Levy HL. Homocystinuria caused by cystathionine β-synthase deficiency. In: Pagon RA, Adam MP, Ardinger HH, et al., eds. GeneReviews®. Seattle, Washington: University of Washington, Seattle 1993-2014. (PubMed)
73. Maltepe C, Koren G. The management of nausea and vomiting of pregnancy and hyperemesis gravidarum--a 2013 update. J Popul Ther Clin Pharmacol. 2013;20(2):e184-192. (PubMed)
74. Magee LA, Mazzotta P, Koren G. Evidence-based view of safety and effectiveness of pharmacologic therapy for nausea and vomiting of pregnancy (NVP). Am J Obstet Gynecol. 2002;186(5 Suppl Understanding):S256-261. (PubMed)
75. Sahakian V, Rouse D, Sipes S, Rose N, Niebyl J. Vitamin B6 is effective therapy for nausea and vomiting of pregnancy: a randomized, double-blind placebo-controlled study. Obstet Gynecol. 1991;78(1):33-36. (PubMed)
76. Vutyavanich T, Wongtra-ngan S, Ruangsri R. Pyridoxine for nausea and vomiting of pregnancy: a randomized, double-blind, placebo-controlled trial. Am J Obstet Gynecol. 1995;173(3 Pt 1):881-884. (PubMed)
77. Matthews A, Haas DM, O'Mathuna DP, Dowswell T, Doyle M. Interventions for nausea and vomiting in early pregnancy. Cochrane Database Syst Rev. 2014;3:CD007575. (PubMed)
78. Koren G, Clark S, Hankins GD, et al. Effectiveness of delayed-release doxylamine and pyridoxine for nausea and vomiting of pregnancy: a randomized placebo controlled trial. Am J Obstet Gynecol. 2010;203(6):571 e571-577. (PubMed)
79. Wyatt KM, Dimmock PW, Jones PW, Shaughn O'Brien PM. Efficacy of vitamin B-6 in the treatment of premenstrual syndrome: systematic review. BMJ. 1999;318(7195):1375-1381. (PubMed)
80. Whelan AM, Jurgens TM, Naylor H. Herbs, vitamins and minerals in the treatment of premenstrual syndrome: a systematic review. Can J Clin Pharmacol. 2009;16(3):e407-429. (PubMed)
81. Gariballa S, Forster S. Effects of dietary supplements on depressive symptoms in older patients: a randomised double-blind placebo-controlled trial. Clin Nutr. 2007;26(5):545-551. (PubMed)
82. Gariballa S. Testing homocysteine-induced neurotransmitter deficiency, and depression of mood hypothesis in clinical practice. Age Ageing. 2011;40(6):702-705. (PubMed)
83. Ellis J, Folkers K, Watanabe T, et al. Clinical results of a cross-over treatment with pyridoxine and placebo of the carpal tunnel syndrome. Am J Clin Nutr. 1979;32(10):2040-2046. (PubMed)
84. Ellis JM, Kishi T, Azuma J, Folkers K. Vitamin B6 deficiency in patients with a clinical syndrome including the carpal tunnel defect. Biochemical and clinical response to therapy with pyridoxine. Res Commun Chem Pathol Pharmacol. 1976;13(4):743-757. (PubMed)
85. Keniston RC, Nathan PA, Leklem JE, Lockwood RS. Vitamin B6, vitamin C, and carpal tunnel syndrome. A cross-sectional study of 441 adults. J Occup Environ Med. 1997;39(10):949-959. (PubMed)
86. Aufiero E, Stitik TP, Foye PM, Chen B. Pyridoxine hydrochloride treatment of carpal tunnel syndrome: a review. Nutr Rev. 2004;62(3):96-104. (PubMed)
87. Ryan-Harshman M, Aldoori W. Carpal tunnel syndrome and vitamin B6. Can Fam Physician. 2007;53(7):1161-1162. (PubMed)
88. Morris MS, Picciano MF, Jacques PF, Selhub J. Plasma pyridoxal 5'-phosphate in the US population: the National Health and Nutrition Examination Survey, 2003-2004. Am J Clin Nutr. 2008;87(5):1446-1454. (PubMed)
89. Hendler SS, Rorvik DR, eds. PDR for Nutritional Supplements. Montvale: Medical Economics Company, Inc; 2001.
90. Bender DA. Non-nutritional uses of vitamin B6. Br J Nutr. 1999;81(1):7-20 (PubMed)
91. Chang HY, Tang FY, Chen DY, et al. Clinical use of cyclooxygenase inhibitors impairs vitamin B-6 metabolism. Am J Clin Nutr. 2013;98(6):1440-1449. (PubMed)
92. Lussana F, Zighetti ML, Bucciarelli P, Cugno M, Cattaneo M. Blood levels of homocysteine, folate, vitamin B6 and B12 in women using oral contraceptives compared to non-users. Thromb Res. 2003;112(1-2):37-41. (PubMed)
93. Wilson SM, Bivins BN, Russell KA, Bailey LB. Oral contraceptive use: impact on folate, vitamin B(6), and vitamin B(1)(2) status. Nutr Rev. 2011;69(10):572-583. (PubMed)
94. Villegas-Salas E, Ponce de Leon R, Juarez-Perez MA, Grubb GS. Effect of vitamin B6 on the side effects of a low-dose combined oral contraceptive. Contraception. 1997;55(4):245-248. (PubMed)
95. Ribaya-Mercado JD, Russell RM, Sahyoun N, Morrow FD, Gershoff SN. Vitamin B-6 requirements of elderly men and women. J Nutr. 1991;121(7):1062-1074. (PubMed)
ビタミンK
目次
要旨
- 天然起源形態のビタミンKは、フィロキノン(ビタミンK1)およびメナキノン(MKまたはビタミンK2)と呼ばれる分子ファミリーを含む。(詳細はこちら)
- ビタミンKの貯蔵能力が限られているので、ビタミンKを何回も再使用できるように体はビタミンK酸化還元サイクルでビタミンKを再利用する。 (詳細はこちら)
- ビタミンKは、多くのビタミンK依存性タンパク質(VKDP)のグルタミン酸残基のカルボキシル化に必須の補助因子であり、VKDPは血液凝固、骨代謝、血管の石灰化予防、および様々な細胞機能の調整に関わる。(詳細はこちら)
- ビタミンK欠乏症だと、出血過多(大量出血)のリスクが上がる。命に関わる頭蓋骨内の出血から全ての新生児を守るため、ビタミンK注射が推奨される。(詳細はこちら)
- ビタミンKの目安量(AI)は、女性で90μg/日、男性で120μg/日に設定されている。(詳細はこちら)
- ビタミンK欠乏症は、VKDPの活動を損なって骨粗鬆症や骨折のリスクを増大させるかもしれない。しかし、観察研究ではビタミンK摂取を全般的な健康食から切り出すことができなかった。したがってビタミンK摂取と骨の健康マーカーとの正の相関の解釈には注意が必要である。全体として、カルシウムやビタミンDが足りている成人のさらなる骨量減少の縮小に対するビタミンK補給の役割に関して、介入試験では結論が出ていない。(詳細はこちら)
- 血管の異常な石灰化は加齢とともに増え、心血管疾患の主要なリスク要因である。ビタミンKの量が不適切だと、血管内でカルシウム沈殿物の生成を抑制するいくつかのVKDPを不活性化してしまうかもしれない。血管の石灰化および心血管イベントの予防におけるビタミンK補給の効果については、無作為化対照試験で尚も評価する必要がある。(詳細はこちら)
- フィロキノンは緑色葉物野菜や特定の植物油に高濃度で存在するが、ほとんどのメナキノンはたいてい動物の肝臓や発酵食品に見られる。(詳細はこちら)
- ビタミンK拮抗薬(ワルファリンなど)を含むいくつかの薬剤は、ビタミンKの吸収と代謝に支障をきたすことが知られている。(詳細はこちら)
ビタミンKは脂溶性ビタミンである。血餅の生成過程における役割からもともと同定されたように(「K」はドイツ語で凝固を意味する「koagulation」に由来する)、ビタミンKは血液凝固(凝血)の調整などをする生理学的プロセスに関わるいくつかのタンパク質の機能に不可欠である(1)。天然起源のビタミンKには、ビタミンK1およびビタミンK2として知られるいくつかのビタマー(ビタミン誘導体)がある(図1参照)。ビタミンK1別名フィロキノンは植物によって合成され、食事に含まれるものの主な形態である。ビタミンK2はメナキノンと総称される範疇のビタミンKの形態を含む。ほとんどのメナキノンはヒトの腸内細菌叢で合成され、発酵食品や動物性食品に見られる。メナキノンは、分子の側鎖における5炭素単位の繰り返しの長さが1~14まで異なる。これらの形態のビタミンKは、メナキノン-n(MK-n)と示され、nは5炭素単位の数を表す(MK-2からMK-14まで)(2, 3)。畜産で広く使用されメナジオン(ビタミンK3)として知られる合成化合物はビタミン前駆体で、活性を持つためにはメナキノン-4(MK-4)に変換されねばならない(4)。
機能
ビタミンKはγ-グルタミルカルボキシラーゼ(GGCX)という酵素の補助因子として機能し、この酵素はアミノ酸であるグルタミン酸(Glu)をγ-カルボキシグルタミン酸(Gla)にカルボキシル化する反応の触媒作用をする。同定されたビタミンK依存性タンパク質(VKDP)中の特定のグルタミン酸残基においてのみ発生するビタミンK依存性γカルボキシル化によって、残基がカルシウムと結合する能力が決定的になる(5)。
ビタミンK酸化還元サイクル
ビタミンKは脂溶性ビタミンであるが、体には非常に少量しか貯蔵されておらず、定期的な食事からの摂取がないと急速に枯渇してしまう。おそらくビタミンKを蓄える能力がこのように限られていることから、体はビタミンKエポキシドサイクルと呼ばれるプロセスによってビタミンKを再利用している(図2参照)。ビタミンKサイクルによって、少量のビタミンKがタンパク質のカルボキシル化に何回も再利用できることになり、それによって食事からの必要量が減る。手短に言えば、ビタミンKヒドロキノン(還元された形態)がビタミンKエポキシド(酸化された形態)に酸化される。この反応で、γグルタミルカルボキシラーゼはビタミンK依存性タンパク質における選択的なグルタミン酸残基をカルボキシル化することができる。ビタミンKエポキシド(酸化型)からヒドロキノン(還元型)への再利用は、ビタミンKエポキシド(KO)をビタミンKキノンに還元し、その後ビタミンKヒドロキノン(KH2:図2参照)に還元するという2つの反応で行われる。また、ビタミンKオキシドレダクターゼ(VKOR)という酵素は、KOからビタミンKキノンへの還元を触媒する。VKORは、未だに定義されていない別の還元酵素とともに、ビタミンKキノンからKH2を生成することにも関わっているかもしれない(6, 7)。抗凝固薬のワルファリンはVKORの活動を阻害することでビタミンK拮抗薬として作用し、ビタミンKの再利用を妨げる(「血液凝固」の項参照)。
血液凝固 (凝血)
凝固カスケードにおけるいくつかのビタミンK依存性凝固因子、つまりタンパク質の活性化には、カルシウムイオン(Ca2+)と結合する能力が必要である。凝固カスケードという用語は、血餅を生成することで出血を止める一連の事象のことであり、各事象はたがいに依存しあっている。それらのタンパク質中の特定のグルタミン酸残基のビタミンK依存性γカルボキシル化によって、それらはカルシウムと結合可能になる。第II因子(プロトロンビン)、第VII因子、第IX因子、および第X因子が凝固カスケードの中心となる。プロテインZは、細胞膜のリン脂質との会合を促進することでトロンビン(プロトロンビンの活性化された形態)の作用を強化するようである。プロテインCとプロテインSは抗凝固タンパク質で、凝固カスケードを制御均衡する。プロテインZも抗凝固機能を持つ。無制御な凝血は無制御な出血と同様に命に関わるかもしれないので、凝固カスケードの制御メカニズムが存在する。ビタミンK依存性凝固因子は肝臓で合成される。したがって、重篤な肝臓疾患だとビタミンK依存性凝固因子の血中濃度が低くなり、無制御な出血のリスク上昇に至る(8)。
ビタミンK拮抗薬による経口抗凝固治療
血餅生成のリスクが高い者もおり、これは心臓、脳、または肺の動脈の血流をブロックし、それぞれ心筋梗塞(心臓発作)、脳卒中、または肺塞栓症に至ることがある。異常な血液凝固は過剰なビタミンK摂取と関係がなく、ビタミンK1またはK2に関連する毒性も知られていない(「毒性」の項参照)。ワルファリン(クマジン、Jantoven)などの経口抗凝固薬は、ビタミンKの作用に拮抗することで凝血を阻害する。ワルファリンはVKORの活動を阻止することでビタミンKの再利用を妨げるので、その結果として機能性ビタミンK欠乏症を起こす(上記の図2参照)。ビタミンK依存性凝固タンパク質の不適切なγカルボキシル化は凝固カスケードに支障をきたし、これが血餅の生成を妨げる。大量の食事性または補給用のビタミンK摂取でビタミンK拮抗薬の抗凝固効果を弱らせるので、これらの薬剤を服用している患者は非常に大量または変量のビタミンK摂取に対して注意をすべきである(「薬物相互作用」の項参照)。ワルファリンのようなビタミンK拮抗薬を服用している患者に対して、今や専門家は現在の食事からの推奨量(90~120μg/日)を満たす適度な一定の食事性ビタミンK摂取を勧めている(9)。最後に、患者によってビタミンK拮抗薬への反応が大きく変化するので、毎日低用量フィロキノンを補給することで抗凝固治療が安定するかもしれないと提唱されている。しかしいくつかのメタ解析で、ワルファリンを服用している者に対するこの選択を支持する十分なエビデンスがないことが最近強調された(10~12)。
骨格形成と軟組織の石灰化予防
ビタミンK依存性γカルボキシル化は、オステオカルシン(OC)、抗凝固因子プロテインS、マトリックスγ-カルボキシグルタミン酸(Gla)タンパク質(MGP:マトリックスGlaタンパク質)、Glaリッチタンパク質(GRP)、およびペリオスチン(元々はosteoblast-specific factor-2:骨芽細胞特異因子2と呼ばれた)などのいくつかの骨に関係するタンパク質に必須である。オステオカルシン(bone Gla protein:骨Glaタンパク質としても知られる)は骨芽細胞(骨を造る細胞)によって合成され、オステオカルシンの合成はビタミンDの活性化形態である1,25-ジヒドロキシビタミンD(カルシトリオール)によって調整されている。オステオカルシンがカルシウムと結合するためには、3つのグルタミン酸残基のビタミンK依存性γカルボキシル化反応が必要である。骨石灰化における機能は十分にわかっていないが、オステオカルシンはカルシウムヒドロキシアパタイト結晶の成長と成熟に必要である(「骨粗鬆症」の項参照)(13)。
プロテインSは、破骨細胞が介する骨の分解に関わっているようである。遺伝性のプロテインS欠乏症の者は、血液凝固が高じることに関連する合併症と、骨壊死を患う(14, 15)。プロテインSは、食作用に関わるTAMファミリーの受容体と結合し活性化させることができる。TAM受容体の突然変異は、視力障害、精子形成の欠陥、自己免疫異常、および血小板異常を起こすことがある(16)。
MGPは軟骨、骨、および血管壁を含む軟組織に見られ、血管壁では血管平滑筋細胞によってMGPが合成され分泌される。MGPは軟骨、血管壁、皮膚の弾性繊維、またはヒトの目の線維柱帯網などの様々な部位の石灰化予防に関わっている(「血管石灰化」の項参照)(17)。さらに、MGPを含むいくつかのVKDPは、弾性線維性仮性黄色腫およびβサラセミアなどの特定の遺伝性疾患における動脈、皮膚、腎臓、および目の石灰化に関連がある(18, 19)。
ビタミンK依存性タンパク質であるGRPとペリオスチンも骨の組織で合成されるが、骨の代謝におけるそれらの役割は未だにはっきりしない(20, 21)。GRPは正常なヒトの皮膚や血管組織で発現し、石灰化した動脈や石灰化した皮膚の病巣における細胞外基質の異常なミネラル沈着物と共存している(22)。
ペリオスチンは皮膚や骨を含むほとんどの結合組織で発現し、初めは細胞接着や細胞移動と関連付けられた。このVKDPも、心臓弁の変質や腫瘍成長の際の血管新生(新しい血管の生成)を促進するようである(23, 24)。
GGCXの活性低下および/またはビタミンKの生物学的利用能の低下がVKDPの活動を損ない、骨石灰化の欠陥や異常な軟組織の石灰化に寄与するかもしれないことが、現在の研究から示唆される(「疾病予防」の項参照)(25)。
細胞機能の調整
Gas6(growth arrest-specific gene 6 protein:増殖停止特異的タンパク質6)は1993年に同定されたビタミンK依存性タンパク質である。これは神経系にくまなく見られ、心臓、肺、胃、腎臓、および軟骨にも見られる。膜貫通型チロシンキナーゼ受容体のTAMファミリーのリガンドとして同定されたGas6は、細胞シグナル伝達活動をする細胞増殖調整因子のようである。Gas6は多様な細胞機能に関わっており、それらには食作用、細胞接着、細胞増殖、および細胞死予防などがある(5)。それは発育中および老化中の神経系でも重要な役割を果たしているかもしれない((26)の文献でレビュー)。さらに、Gas6は血小板のシグナル伝達と血管の恒常性も調整しているようである(27)。ほとんどの組織で発現し多くの細胞機能に関わっているGas6は、血餅形成(血栓形成)、アテローム性動脈硬化、慢性炎症、およびがんの増殖を含むいくつかの病態と関連がある(28~30)。
欠乏症
明白なビタミンK欠乏症は血液凝固が損なわれることになり、たいていは凝固時間を測る臨床検査で実証される。症状としては簡単に青あざや出血が起こりやすくなり、これは鼻血、歯茎の出血、血尿、血便、タール便、または極端にひどい月経として現れるかもしれない。乳児では、ビタミンK欠乏症は命に関わる頭蓋骨内部の出血(頭蓋内出血)を起こすかもしれない(8)。
成人
ビタミンK欠乏症は、健康な成人ではいくつかの理由によって珍しい。それらは(1)ビタミンKは食物に広く含まれている(「食物の摂取源」の項参照);(2)ビタミンKサイクルによってビタミンKが保たれる(「ビタミンK酸化還元サイクル」の項参照);および(3)相当な量が吸収されたり利用されたりするのかは不明であるが、通常は大腸に存在する細菌がメナキノン(ビタミンK2)を合成する(「食物の摂取源」の項参照)からである。ビタミンK欠乏症のリスクのある成人は、ビタミンK拮抗薬を服用している者や、相当な肝臓障害や疾患のある者である(8)。さらに、炎症性腸疾患や嚢胞性繊維症などを含む脂肪吸収不全障害のある個人は、ビタミンK欠乏症のリスクが高いかもしれない(31~33)。
乳児
母乳のみで育つ新生児は、ビタミンK欠乏症リスクが高い。なぜなら母乳は粉ミルクに比べて比較的ビタミンKが少ないからである。一般的に新生児は次のような理由でビタミンKの栄養状態が悪い。それらは(1)胎盤関門を通るビタミンKの輸送が限られている;(2)肝臓のビタミンK貯蔵がとても少ない;(3)新生児、特に未熟児ではビタミンKサイクルが十分に機能していないかもしれない;および(4)母乳のビタミンK含有量が少ない(5)ということである。母親がてんかん発作予防に抗けいれん薬を服用している乳幼児も、ビタミンK欠乏症リスクがある。新生児のビタミンK欠乏症は、新生児乳児のビタミンK欠乏性出血症(VKDB)とよばれる出血障害に至ることがある((34)の文献でレビュー)。VKDBは命に関わるが簡単に予防できるため、米国小児科学会や多くの同様の国際機関は、全ての新生児に筋肉内注射用量のフィロキノン(ビタミンK1)を投与することを勧めている(35)。
新生児へのビタミンK投与をめぐる論争
ビタミンKと小児白血病:1990年代初期に2つの後ろ向き研究で、新生児へのフィロキノン注射と小児白血病およびその他の小児がんの発症に関連があるのではないかという提唱が発表された。しかし米国およびスウェーデンでの2つの大規模後ろ向き研究で、それぞれ54,000人および130万人の子供の医療記録を調べ直したところ、小児がんと誕生時のフィロキノン注射との関係を示すエビデンスは何もなかったと判明した(36, 37)。さらに、小児がんと診断された2,431人の子供と6,338人のがんでない子供を含む6つの症例対照研究の統合解析で、新生児へのフィロキノン注射が小児白血病のリスクを上げるというエビデンスは見つからなかった(38)。米国小児学会はその方針声明で、ビタミンKによる新生児への通例的な予防を続けるように推奨した。VKDBは命にかかわり、がんのリスクが証明されていないうえにおそらくないからである(35)。親側による新生児へのビタミンK予防の省略や拒否が増加傾向にあることから、過去数年において医師は遅発性のVKDB症例の増加を報告している(39)。
未熟児への低用量ビタミンK1:未熟児のビタミンK濃度に関する2つの研究結果から、正期産児への標準的フィロキノン(ビタミンK1)初回量(1.0mg)は、未熟児には高すぎるかもしれないことが示唆された(40, 41)。これらの発見から、1,000g未満の出生体重の乳児にはフィロキノン初回量を0.3mg/kgにし、0.5mgというフィロキノン初回量が新生児の出血性疾患を予防するであろうと提唱する専門家もいる(40)。
目安量 (AI)
2001年1月に米国医学研究所の食品栄養委員会(FNB)は、健康な個人の摂取レベルに基づくビタミンKの目安量レベルを設定した(表1)。乳児のAIは、母乳からのビタミンK摂取の推定に基づいていた(42)。
疾病予防
骨粗鬆症
骨にあるビタミンK依存性タンパク質の発見が、骨の健康を維持する際のビタミンKの役割に関する研究につながった。
ビタミンKと骨の健康:観察研究
ビタミンK1:フィロキノン(ビタミンK1)と加齢による骨量減少(骨粗鬆症)との関係が、観察研究でわかった。看護師健康研究では、72,000人超の女性を10年間追跡した。このコホート(集団)の解析で、フィロキノンの摂取が109μg/日より少ない女性は、それ以上の摂取の女性に比べて30%も股関節骨折のリスクが高かった(43)。7年間800人超の年配の男女を追跡したフラミンガム心臓研究という別の前向き研究で、食事性ビタミンK 摂取が最も高い四分位(中央値で254μg/日)の参加者は、摂取が最も低い(中央値で56μg/日)者より股関節骨折リスクが65%低かった(44)。骨粗鬆症的な骨折はしばしば骨石灰化の減退と関連している。しかし研究者たちは、フラミンガム研究の被験者における食事性フィロキノン摂取と骨密度(BMD)との間に何の関連も見出さなかった(44)。他の研究で食事性フィロキノン摂取と骨強度、BMD、または骨折の発生との関連を観察できないでいた(45, 46)が、3,199人の中年女性コホートのクロスオーバー研究(横断研究:交差研究)で、食事性フィロキノン摂取が最も高い四分位の被験者(162μg/日)は、最も低い四分位の者(59μg/日)よりも股関節部および腰椎部のBMDがかなり高いことがわかった(47)。さらに、最近のクロスオーバー研究や症例対照研究で、フィロキノン摂取が多い方が股関節骨折の発生が少ないという関連が報告された(48, 49)。
しかしながら、緑色葉物野菜がフィロキノンの主要な食事性摂取源であり、それらは通常バランスのとれた食事の一部であることから、フィロキノンの高摂取は単に健康な食習慣の現れであり、フィロキノン自体ではなくこのことが観察研究で報告された関連の全部または一部を説明しているのかもしれない(50)。血漿フィロキノン濃度を測定した数少ない研究では、一般的に循環濃度がより高いと骨折リスクがより低いという関連が見られた(17, 51)。たとえば、30~88歳の379人の日本人女性による4年間の前向き研究で、椎体骨折の発生は腰部BMDや血漿フィロキノン濃度と逆相関があった(51)。しかし観察研究は因果関係の推論をするように考えられておらず、無作為化対照試験でのみフィロキノンが骨の健康に有益なのかどうかを評価することができる(「ビタミンK補給研究と骨粗鬆症」の項参照)。
ビタミンK2:メナキノン(ビタミンK2)と骨の健康との関連についての研究はほとんどない。それはおそらく西洋式の食事に含まれるビタミンK2の主な形態であるメナキノン-4(MK-4)の食事性摂取源が限られているからである。加熱した大豆を納豆菌で発酵させた日本の食品である納豆は、MK-7が豊富である。944人の日本人女性(20~79歳)を追跡した前向き研究で、ベースライン時(開始時)の全体的な股関節BMDは、閉経後の女性で納豆の摂取量と正の相関があった(52)。納豆を食べる女性(200μg/日超のMK-7)は食べない女性に比べて、大腿骨頚部のBMD減少率が3年間の追跡期間でかなり低かった。閉経前の女性では、納豆摂取量とBMDの関連は見られなかった(52)。
全体的な股関節および大腿骨頚部のBMDも、2,000人近い65歳以上の日本人男性のうち、定期的に1日に少なくとも1パックの納豆(350μg/日以上のMK-7)を食べる者の方が、週に1パック未満(50μg/日未満のMK-7)しか食べない者に比べて高かったと報告された(53)。しかし納豆の消費を増やすと、骨格の健康に潜在的有益性のあるその他の食事性化合物(大豆イソフラボンなど)の摂取も最大化される。したがって、ビタミンKの栄養状態の信頼できる測定値が必要である。今の所、観察研究は循環メナキノン(MK-7およびMK-4)濃度と骨折リスクとの関連を明確に裏付けていない(17, 54)。
ビタミンKの栄養状態のバイオマーカーと骨の健康
骨のタンパク質であるオステオカルシンの総循環濃度は、骨生成の鋭敏なマーカーであることが示されてきた。ビタミンKではなくビタミンDなどのいくつかのホルモンや成長因子が、骨芽細胞によるオステオカルシンの合成を調整する。しかしビタミンKは、オステオカルシンに含まれる3つのグルタミン酸残基のγ-カルボキシル化に不可欠な補助因子である。ヒトの骨や血清でのオステオカルシンの低カルボキシル化は、ビタミンKの栄養状態が悪いことと関連づけられてきた。オステオカルシンのγ-カルボキシル化の程度はビタミンKの栄養介入療法に反応するので、ビタミンKの栄養状態の相対的指標として使用される(13)。
低カルボキシル化オステオカルシン(ucOC)の循環濃度は閉経後の女性の方が閉経前の女性より高く、70歳超の女性では顕著に高いことがわかった。また、総OC濃度に対するucOCの割合(ucOC/OC)が高いことは、年配の女性の股関節骨折リスクの予測となるようである(55, 56)。ビタミンK欠乏症が血中ucOC/OC比率が高いことの一番の原因であるようだが、ビタミンDの栄養状態の生化学的測定値とucOC濃度の間の逆相関と、ビタミンD補給によるucOC/OC比率の相当な低下を述べている研究者もいる(57)。循環ucOC/OC比率の上昇は、ビタミンDの不足を含む全体的な栄養状態の悪さを反映していると提唱されており、これが上記の観察を説明するのかもしれない(58)。しかし若い女性(58, 59)や閉経後の女性(60)に対するいくつかの無作為化プラセボ対照介入研究で、ビタミンD補給がucOC/OC比率を低下させたり、ビタミンK補給によるucOC/OC比率の低下に追加的な効果を示したりすることはなかった。
ビタミンK補給研究と骨粗鬆症
ビタミンK1補給:12~36ヶ月にわたる200~5,000μg/日の用量でのフィロキノン(ビタミンK1)補給が股関節部のBMDに与える効果を評価する5つの無作為化臨床試験のシステマティックレビュー(総括)で、骨の健康に対する有望な利点はほとんど見られなかった(17)。5つの研究すべてでフィロキノン補給によってucOC濃度は低下したが、1つの研究でのみBMDに対するフィロキノン補給の効果が報告されただけだった(61)。この研究では、150人の閉経後の女性にプラセボか、ミネラル(500mg/日のカルシウム、130mg/日のマグネシウム、および10mg/日の亜鉛)にビタミンD(320 IU/日)か、またはミネラル、ビタミンD、およびフィロキノン(1,000mg/日)かを無作為に与えた。腰椎ではなく大腿骨頚部におけるBMD減少の割合が、フィロキノン補給をした被験者では他の2群に比べてかなり低かった。したがって、年配の成人の骨の健康に対するフィロキノンの推定的な効果のエビデンスは弱いと考えられる。これらの研究は、骨粗鬆症に関連する骨折に対するフィロキノンの効果を評価するように考えられていなかった。フィロキノン補給がビタミンKが不足してリスクが高い被験者(吸収不全症候群や嚢胞性線維症の者など)の骨格の健康を向上させるのかどうかを、さらなる研究によって評価するようになるかもしれない。
ビタミンK2補給:薬理学的用量のメナキノン-4(MK-4、商標名はメナテトレノン)は、現在日本で骨粗鬆症の治療に使用されている。したがって、骨量減少に対する高用量MK-4の効果を調べるほとんどの介入試験が、日本の閉経後の女性に対して行われている。7つの無作為化対照試験の2006年のメタ解析で、MK-4補給はBMD増加や骨折発生の減少と相関付けられた(62)。7つの研究のうち1つ以外のすべてで、毎日45mgのMK-4が使用され、残りの1つでは15mg/日であった(62)。このメタ解析で、6ヶ月超のMK-4補給によって椎体骨折で60%、股関節骨折で77%、非椎体骨折で81%の大幅なリスク低下が報告された。しかし、含まれる研究の規模が小さいことと、その中のいくつかがプラセボ対照ではなく併用または非盲検療法(カルシウムとビタミンDなど)であったという事実から、このメタ解析結果は後に控えめに扱われた。さらにこの解析は、骨折リスクに対するMK-4の効果がないと報告していたことからこのメタ解析の結果を変えたであろうサンプル数のより多い未発表のデータを含んでいなかった(63)。
より最近の非プラセボ対照研究で、4,000人超の閉経後の日本人女性が3年間カルシウムを単独でまたはMK-4(45mg/日)と併用して無作為化されて摂取した。追加的なもう1年間の追跡期間(全体で4年間)の終わりには、椎体骨折の発生に関してグループごとの差はなく、カルシウム単独治療に比べて併用治療を受けた者に新規の臨床的な骨折の発生がわずかに減った(4.4%対3.4%)が、これも骨折リスクが高い女性のみにおいてであった(64)。欧州および米国で行われた追加的試験では、曖昧な結果が報告されている。325人の健康な閉経後の女性による3年間のプラセボ対照介入試験では、3年間のMK-4補給(45mg/日)によってプラセボに比べて骨強度の測定値が向上した(65)。留意したいのは、引用された研究のほとんどで使用されたこのMK-4用量は、ビタミンKの目安量の約500倍であるということだ。365人の健康だがビタミンKの状態が不適切な(低カルボキシル化オステオカルシンが4%以上)閉経後のアメリカ人女性による別の1年間の無作為化二重盲検プラセボ対照試験では、高用量のフィロキノン(1,000μg/日)補給もMK-4(45mg/日)補給も、プラセボに比べて骨代謝回転またはBMD(腰椎および股関節)の血清マーカーに対する効果はなかった(65)。この研究では、すべての被験者は毎日非盲検でカルシウム(630mg)とビタミンD3(400 IU)も摂取した。
いくつかの観察研究で納豆(MK-7が豊富)の摂取と骨の健康との関連が示唆されている。しかし334人の健康な閉経後の女性(閉経後1~5年)による最近の無作為化二重盲検プラセボ対照研究では、360μg/日のMK-7(納豆カプセルの形態)はベースライン時に比べて1年後の様々な部位におけるBMDに何の効果も見られなかった(67)。244人の閉経期の女性による別の比較可能なプラセボ対照試験では、180μg/日のMK-7を3年間補給したら、大腿骨頚部における骨量減少がかなり少なくなったが、その他の部位ではそうではなかった(68)。現在のところ、骨の健康に対するメナキノン補給の潜在的役割は、大規模無作為化のよく対照された試験で確立される必要がある。
ビタミンK拮抗薬と骨の健康
ワルファリンなどの特定の経口抗凝固薬は、ビタミンK拮抗薬であることが知られている(「血液凝固」の項参照)。年配の女性の慢性的ワルファリン使用と骨折リスクとの関連を調べた研究はほとんどない。ある研究では長期間のワルファリンによる治療と骨折リスクの関連は何もないと報告された(69)が、別の研究ではワルファリン使用者は非使用者に比べて肋骨および椎体骨折のリスクがかなり高いことがわかった(70)。さらに、心房細動のある年配の患者によるある研究では、長期間のワルファリンによる治療は男性の骨粗鬆症的骨折リスクがかなり高くなることと関連があったが、女性ではそうではなかったと報告された(71)。11の発表済み研究結果をメタ解析したところ、経口抗凝固治療は手首のBMDのささやかな低下と関連があったが、股関節や脊椎のBMDは変化しなかったことがわかった(72)。ビタミンKの再利用を阻止しない新しい抗凝固薬の開発によって、ビタミンK拮抗薬の使用に替わる安心な代替物が提供されるかもしれない(73)。
心血管疾患
ビタミンK摂取と死亡率との逆相関は、3,401人が参加した米国の全国的調査(NHANES III)で報告された(74)。ビタミンK摂取が適切な者は不適切な者(性別ごとのAIに基づく:女性で90μg/日、男性で120μg/日)よりも、心血管疾患関連の死亡リスクが22%、全死因による死亡リスクが15%低いという関連があった。報告ではまた、慢性腎臓疾患の者の3分の2超はAIよりもビタミンK摂取が少ないのだが、適切な摂取の者はそれ以下の者に比べてCVDによる死亡率が41%低かったことが示された(74)。しかし、CVD発症リスクのある7,216人の年配の成人を追跡した前向き研究で、ビタミンK摂取が多い方がCVDによる死亡率が低いという関連はなかった(75)。この研究では、メナキノンではなくフィロキノンの摂取が多い方が、全死因による死亡率が低いという関連があった。
35,476人の健康なオランダ人男女を平均で12.1年間追跡した最近の別の前向き研究で、脳卒中発症のリスクはフィロキノンやメナキノン摂取とさして関連がなかった(76)。初期の観察研究はフィロキノン摂取とCVDリスクとの逆相関を限定的に裏付けていたが、高摂取は低い心血管リスクに関連する健康な食事習慣の指標と時には見なされていた((77)の文献でレビュー)。16,057人のオランダ人女性(49~70歳)を平均8.1年間追跡した前向きコホート研究で、メナキノン摂取が10μg/日増えるごとに冠動脈心疾患(CHD)リスクが9%減ることがわかった(78)。55歳以上の健康な4,807人の男女を調べたオランダでの初期の別の研究で、メナキノン摂取が最も高い三分位(32.7μg超/日)の参加者は、最も低い三分位(21.6μg未満/日)の者よりもCHD発症リスクが41%、全死因による死亡リスクが26%低かった(79)。さらに、メナキノン摂取はCVDの主要なリスク要因である大動脈石灰化と逆相関があることがわかった(79)。
血管石灰化
心血管疾患の顕著な特徴の一つは、動脈壁の動脈硬化巣の存在である。血餅の生成(血栓形成)を起こすプラーク破裂は、心筋梗塞(心臓発作)または脳卒中の通常の原因である。プラークの石灰化はアテローム性動脈硬化症の進行で起こるが、石灰化がプラークの不安定性さを高めて破裂や血栓形成になるリスクを予測するのかどうかは不明である(80)。しかし、石灰化は将来の心血管疾患性イベントの予測的なものであるかもしれない。全部で218,080人の参加者による30の前向きコホート研究のメタ解析で、血管石灰化が見られると、全体的に3~4倍の心血管イベントや死亡率の上昇リスクがあることがわかった(81)。閉経後の女性(60~79歳)による初期の集団ベースの研究で、大動脈石灰化のある年齢が低い方の女性(60~69歳)は石灰化がない女性に比べてビタミンK摂取が少なかったが、年齢が高いほうの女性(70~79歳)ではそうではなかったことが観察された(82)。39~45歳の男女807人による前向きコホート研究で、食事からのフィロキノン摂取とコンピュータ断層撮影(CT)によって非侵襲的に測定された冠状動脈の石灰化との間には、何の相関もないことがわかった(83)。さらに、49~70歳の1,689人の女性のクロスオーバー研究で、フィロキノンまたはメナキノン摂取は胸部の動脈の石灰化と関連がなかった(84)。しかし別のクロスオーバー研究で、メナキノン(MK-4~MK-10)の摂取が最高の四分位(摂取の中央値が48.5μg/日)と最低の四分位(18μg/日)では、564人の閉経後の女性の冠状動脈石灰化罹患率が20%低いという関連が見つかった(85)。
最近の研究で、ビタミンKが骨の石灰化を促進する一方で血管の石灰化を妨げるかもしれないメカニズムの可能性が明らかになった。その可能性のあるメカニズムはまだ十分に理解されていないが、マトリックスGlaタンパク質(MGP)と新規に記述されたGlaリッチタンパク質(GRP)とを含むビタミンK依存性タンパク質に関係している。動脈血管壁にある血管平滑筋細胞(VSMC)などの様々なタイプの細胞から分泌されるMGPは、軟骨、脈管、皮膚、および目の線維柱帯網細胞などの軟組織の石灰化予防に重要なようである(17, 86)。MGPノックアウトマウスでは、VSMCから骨状の細胞への転換や過剰な血管の石灰化によって、大血管破裂や早期死亡へと至った。ヒトのMGP遺伝子の欠陥は、異常な軟骨の石灰化や肺動脈の狭窄がとりわけ特徴的な稀な遺伝性病態であるコイテル症候群と関連付けられてきた。MGPによる石灰化予防には、カルシウム結晶との結合や異所性化骨の生成を促進することが知られているタンパク質(骨形成タンパク質、BMP)の阻害などのいくつかのメカニズムが関わっていた((87)の文献でレビュー)。
MGPのカルシウムとの結合活性は、2種類の修飾(タンパク質合成の後に起こるので翻訳後修飾として知られる)によって調整されている。それらは最大5つのGlu残基のビタミンK依存性カルボキシル化と、セリン残基のリン酸化である。タンパク質の5つのGlaドメインの1つにおけるトレオニンからアラニンへの変移を起こすMGPの遺伝子配列の変異(多型)は、カルボキシル化を妨げてMGPがカルシウムと結合する能力に変化を引き起こすのかもしれない。MGPThr83Alaとして知られるこの多型は、605人の中年男女を追跡した地域ベースの前向き研究において、平均で10.6年にわたる冠状動脈の石灰化の進行に関連があった(88)。この関連はベースライン時に検出可能な石灰化が見られなかった参加者にのみ見られ、ベースライン時に石灰化していた者では見られなかった(88)。興味深いことに、MGPThr83Alaはその遺伝子型保因者の心筋梗塞および大腿動脈石灰化のリスクが高いことと関連していた(89)。
さらに、低カルボキシル化のMGP(ucMGP)は健康な被験者の頸動脈の最も内側を構成する膜にはないが、アテローム性動脈硬化症患者の頸動脈の内膜におけるほとんどのMGPは低カルボキシル化のものだったことが、ある小規模な研究で最初にわかった(90)。577人の年配の男女を平均で5.6年間追跡した別の研究で循環MGPと心血管性イベントの発症の関連を調べたら、脱リン酸化-低カルボキシル化MGP(dp-ucMGP)の血漿濃度が最高の三分位は最低の三分位に比べて、心血管疾患(すなわち冠状動脈疾患、末梢動脈疾患、および脳血管疾患)のリスクが3~4倍も大きかった(91)。別の前向き研究の結果では、循環dp-ucMGP濃度は明白な血管疾患の被験者における死亡リスクの予測となるかもしれないことが示唆された(92)。実際、冠状動脈疾患または脳卒中の被験者でdp-ucMGP濃度が最大の四分位の者は、最低の四分位の者に比べて心血管関連および全死因の死亡リスクが2倍近いことがわかった(92)。
ビタミンKの栄養状態が最適以下だとカルボキシル化が制限され、その結果生物学的に不活性のucMGPになってしまうかもしれないため、ビタミンK補給が血管の石灰化を防ぐかもしれないと推測されてきた。3年間の二重盲検対照試験で、ベースライン時にCVDがない401人の地域社会生活を送る年配者(60~80歳)の冠状動脈石灰化の進行に対するビタミンKの潜在的効果が調べられた(93)。参加者は毎日マルチビタミンに加えてカルシウムとビタミンDを500mgのフィロキノン有りまたは無しで摂取するように無作為に分けられた。ベースライン時および追跡時の冠状動脈石灰化の測定値を使用して、フィロキノン補給は対照群に比べて血管石灰化の進行を限定し、血漿dp-ucMGPを減らすことができたとわかった(93, 94)。循環dp-ucMGPはビタミンKの栄養状態の様々なマーカーと相関があったが、冠状動脈石灰化の測定値との関連は見つからなかった(94)。
ヒトの動脈硬化巣の石灰化におけるその他のビタミンK依存性タンパク質(GRP、ペリオスチン、Gas6など)の役割を調べ、血管石灰化の進行とCVDリスクに対するビタミンK補給の効果を評価するさらなる研究が必要である。
ビタミンK拮抗薬と血管石灰化
いくつかのクロスオーバー研究で、ビタミンK拮抗薬の慢性的使用者は非使用者に比べて血管の石灰化スコア(血管石灰化を定量化する手段)が上がることが報告された((95)の文献でレビュー)。CVDの被験者で血管石灰化を調べた最近の前向き研究においても、ワルファリン療法は循環dp-ucMGP濃度がより高いことと関連づけられた(92)。VKDPの活動に支障をきたさないで凝固因子を直接阻害する新規開発薬剤は、特に血管石灰化に関してビタミンK拮抗薬よりも適切かもしれない(95)。
摂取源
食物の摂取源
欧州および米国での栄養調査で、食事性ビタミンK(全形態)の平均摂取量は、60~200μg/日と個人や集団で大きく異なることが示された(96)。
ビタミンK1
フィロキノン(ビタミンK1)は、ほとんどの食事におけるビタミンKの主要形態である。緑色葉物野菜やいくつかの植物油(大豆油、キャノーラ油、オリーブ油、および綿実油)は、食事性ビタミンKの主な摂取源である。しかし緑色野菜由来のフィロキノンの生物学的利用性は、油やサプリメントのものの利用性より低い。また、緑色野菜のフィロキノン含有量は葉緑素(緑色の色素)の含有量に依存するので、外側の葉の方が内側の葉よりもフィロキノンが多い。フィロキノンの腸での吸収効率は摂取源の植物によって異なり、食事に脂肪源を加えると増加する。最後に、植物油の水素添加は食事性フィロキノンの吸収や生物学的効果を低下させるかもしれない((2, 9)の文献でレビュー)。食品中のフィロキノンを含む栄養素含有量を調べたいならば、USDAの食品成分データベースを検索のこと。フィロキノンが豊富な食品のいくつかを、そのフィロキノン含有量をマイクログラム(μg)で示して表2に記載する。
ビタミンK2
メナキノン(ビタミンK2)は主として微生物起源であるので、チーズ、凝乳、および納豆(発酵させた大豆)などの発酵性食品に一般的に見られる。長鎖のメナキノン(MK-7~MK-13)のその他の摂取源は、動物の肝臓である(9)。メナキノンの食品成分表が入手しにくいので、ビタミンK摂取全体におけるその割合は推定しづらく、異なる食物摂取習慣の集団ごとに違っているであろう(2)。大腸(結腸)に通常住み着いている細菌は、メナキノンを合成できる。ヒトのビタミンK必要量の最大50%は、細菌による合成で賄われるのではないかと初めは考えられていた。しかしすべての形態のビタミンKが胆汁酸塩を必要とするメカニズムを介して小腸で吸収される一方で、大部分のメナキノン生成は胆汁酸塩がない結腸で行われている。現在の研究では、正確な割合は不明なままであるものの、細菌による合成の割合は以前考えられていたよりもずっと少ないことが示唆される(97)。メナキノンの中で、MK-4は動物用飼料に含まれるメナジオン(合成ビタミンKの形態)から作られるか、食事性フィロキノンから組織特異的な方法で変換される。したがって、それは細菌によって製造されない唯一のメナキノンである(4)。長鎖のメナキノンは、限られた発酵食品に含まれる。大豆を素にした日本の発酵食品である納豆はMK-7が豊富(998μg/100g)で、MK-8(84μg/100g)も含む。いくつかの種類のチーズには、MK-8およびMK-9が含まれる(2)。
サプリメント
米国では、一般的に一錠に25~100μgの用量のマルチビタミンおよびその他の栄養補助食品として、フィロキノンもメナキノンも処方箋無しで入手可能である(98)。メナキノン-4(MK-4)は日本では骨粗鬆症治療用に市販されているが、米国食品医薬品局(FDA)は現在、いかなる形態のビタミンKも骨粗鬆症予防または治療への使用を許可していない。
安全性
毒性
アレルギー反応の可能性はあるものの、ビタミンKのフィロキノン(ビタミンK1)またはメナキノン(ビタミンK2)形態での高用量(食事性または補給用)摂取に関連する毒性は知られていない(42)。合成メナジオン(ビタミンK3)とその誘導体はそうではない。メナジオンは体が持つ天然抗酸化剤の一つであるグルタチオンの機能を妨げる可能性があり、結果として細胞膜の酸化ダメージを起こす。注射によるメナジオンは、乳児に肝毒性、黄疸、および溶血性貧血(赤血球の破裂による)を誘発してきた。したがって、メナジオンはビタミンK欠乏症の治療にはもはや用いられていない(5)。ビタミンKの許容上限摂取量(UL)は設定されていない(42)。
栄養素相互作用
大容量のビタミンAとEは、ビタミンKと拮抗することがわかっている(8)。過剰なビタミンAはビタミンKの吸収に支障をきたすようであり、ビタミンEはビタミンK依存性カルボキシラーゼの活動を抑制し、凝固カスケードに支障をきたすのかもしれない(99)。正常な凝血状態の成人によるある研究で、1,000 IU/日のビタミンEを12週間補給したら、ビタミンK依存性タンパク質であるプロトロンビンのγカルボキシル化が低減したことがわかった(100)。ワルファリンのような抗凝固薬を服用している個人やビタミンK欠乏症の者は、大量出血(過剰な出血)のリスクが増大するので、厳しい医学的管理無しにビタミンEサプリメントを摂取すべきでない(101)。
薬物相互作用
ビタミンK拮抗薬(ワルファリンなど)の抗凝固効果は、非常に高用量の食事性または補給用のビタミンK摂取によって損なわれるかもしれない。さらに、毎日最大100μgのフィロキノンサプリメントはワルファリン服用患者にとって安全であると考えられているが、治療上の抗凝固薬の安定性は毎日10~20μgといった低用量のMK-7によって弱まるかもしれない(102)。一般的に、ワルファリン服用者はビタミンKの目安量(90~120μg/日)を摂取するようにして、抗凝固薬の用量調整に支障をきたすかもしれないようなビタミンK摂取量の大きな変動を避けることが推奨される(9)。妊婦や授乳婦への抗ビタミンK性の抗凝固薬、抗けいれん薬(フェニトインなど)、および抗結核薬(リファンピンやイソニアジドなど)の処方は、新生児にビタミンK欠乏症のリスク上昇をもたらすかもしれない(103)。
セファロスポリンやサリチル酸塩などの薬効範囲の広い抗生物質の長期使用は、腸内細菌によるビタミンK合成に支障をきたしビタミンK吸収を減らす可能性がある。心房細動を含む特定の不整脈(不規則な脈)の管理に使用されるアミオダロンという薬剤は、ワルファリンの抗凝固効果を強めて出血リスクを上昇させるかもしれない(104, 105)。さらに、コレステロール低下薬(コレスチラミンやコレスチポールなど)の使用は、オルリスタット、鉱物油、および脂肪吸収を妨げる脂肪代替物のオレストラの使用とともに、ビタミンKを含む脂溶性ビタミンの吸収に影響するかもしれない(106)。
ライナス・ポーリング研究所の推奨
骨でのビタミンK依存性タンパク質(「骨粗鬆症」の項参照)のγカルボキシル化を最適化するのに、ビタミンKの目安量で十分であるかどうかは不明である。フラミンガム心臓研究における股関節骨折リスクの低下に関連した量のビタミンK(約250μg/日)を摂取するには、刻んだブロッコリーを120mlより少し多いくらいか、大量のミックス緑色野菜サラダを毎日食べる必要がある。すべてのビタミンK依存性タンパク質の最適な機能に必要な食事性ビタミンKの摂取量はわからないが、ライナス・ポーリング研究所はマルチビタミン/ミネラルのサプリメントを服用し、毎日少なくとも240mlの濃い緑色の葉物野菜を食べることを推奨する。バターやチーズのような食事性の飽和脂肪をオリーブ油やキャノーラ油に含まれる一不飽和脂肪に替えると、食事性ビタミンK摂取を増やし、心血管疾患リスクを減少させるかもしれない。
年配の成人 (50歳超)
年配者は骨粗鬆症や股関節骨折のリスクが高いため、マルチビタミン/ミネラルのサプリメントおよび毎日少なくとも240mlの濃い緑色葉物野菜を摂るという上記の推奨は、特に年配者に関連があるものである。
Authors and Reviewers
Originally written in 2000 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in May 2004 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in May 2008 by:
Victoria J. Drake, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in July 2014 by:
Barbara Delage, Ph.D.
Linus Pauling Institute
Oregon State University
Reviewed in August 2014 by:
Sarah L. Booth, Ph.D.
Director, Vitamin K Research Program
Jean Mayer USDA Human Nutrition Research Center on Aging
Tufts University
Copyright 2000-2024 Linus Pauling Institute
References
1. Brody T. Nutritional Biochemistry. 2nd ed. San Diego: Academic Press; 1999.
2. Booth SL. Vitamin K: food composition and dietary intakes. Food Nutr Res. 2012;56. (PubMed)
3. Kidd PM. Vitamins D and K as pleiotropic nutrients: clinical importance to the skeletal and cardiovascular systems and preliminary evidence for synergy. Altern Med Rev. 2010;15(3):199-222. (PubMed)
4. Nakagawa K, Hirota Y, Sawada N, et al. Identification of UBIAD1 as a novel human menaquinone-4 biosynthetic enzyme. Nature. 2010;468(7320):117-121. (PubMed)
5. Ferland G. Vitamin K. In: Erdman Jr. JW, Macdonald IA, Zeisel SH, eds. Present Knowledge in Nutrition. 10th ed. Ames: Wiley-Blackwell; 2012:230-247.
6. Rishavy MA, Hallgren KW, Wilson LA, Usubalieva A, Runge KW, Berkner KL. The vitamin K oxidoreductase is a multimer that efficiently reduces vitamin K epoxide to hydroquinone to allow vitamin K-dependent protein carboxylation. J Biol Chem. 2013;288(44):31556-31566. (PubMed)
7. Tie JK, Jin DY, Straight DL, Stafford DW. Functional study of the vitamin K cycle in mammalian cells. Blood. 2011;117(10):2967-2974. (PubMed)
8. Olson RE. Vitamin K. In: Shils M, Olson JA, Shike M, Ross AC, eds. Modern Nutrition in Health and Disease. 9th ed. Baltimore: Lippincott Williams & Wilkins; 1999:363-380.
9. Holmes MV, Hunt BJ, Shearer MJ. The role of dietary vitamin K in the management of oral vitamin K antagonists. Blood Rev. 2012;26(1):1-14. (PubMed)
10. Kramps M, Flanagan A, Smaldone A. The use of vitamin K supplementation to achieve INR stability: a systematic review and meta-analysis. J Am Assoc Nurse Pract. 2013;25(10):535-544. (PubMed)
11. Lam J, Schulman S, Witt DM, Vandvik PO, Qayyum F, Holbrook AM. Anticoagulation control with daily low-dose vitamin k to reduce clinically adverse outcomes and international normalized ratio variability: a systematic review and meta-analysis. Pharmacotherapy. 2013;33(11):1184-1190. (PubMed)
12. Mahtani KR, Heneghan CJ, Nunan D, Roberts NW. Vitamin K for improved anticoagulation control in patients receiving warfarin. Cochrane Database Syst Rev. 2014;5:CD009917. (PubMed)
13. Gundberg CM, Lian JB, Booth SL. Vitamin K-dependent carboxylation of osteocalcin: friend or foe? Adv Nutr. 2012;3(2):149-157. (PubMed)
14. Pierre-Jacques H, Glueck CJ, Mont MA, Hungerford DS. Familial heterozygous protein-S deficiency in a patient who had multifocal osteonecrosis. A case report. J Bone Joint Surg Am. 1997;79(7):1079-1084. (PubMed)
15. Rawat RS, Mehta Y, Arora D, Trehan N. Asymptomatic type B right atrial thrombus in a case with protein S deficiency. Ann Card Anaesth. 2014;17(3):237-239. (PubMed)
16. van der Meer JH, van der Poll T, van 't Veer C. TAM receptors, Gas6, and protein S: roles in inflammation and hemostasis. Blood. 2014;123(16):2460-2469. (PubMed)
17. Booth SL. Roles for vitamin K beyond coagulation. Annu Rev Nutr. 2009;29:89-110. (PubMed)
18. Boraldi F, Annovi G, Guerra D, et al. Fibroblast protein profile analysis highlights the role of oxidative stress and vitamin K recycling in the pathogenesis of pseudoxanthoma elasticum. Proteomics Clin Appl. 2009;3(9):1084-1098. (PubMed)
19. Boraldi F, Garcia-Fernandez M, Paolinelli-Devincenzi C, et al. Ectopic calcification in β-thalassemia patients is associated with increased oxidative stress and lower MGP carboxylation. Biochim Biophys Acta. 2013;1832(12):2077-2084. (PubMed)
20. Coutu DL, Wu JH, Monette A, Rivard GE, Blostein MD, Galipeau J. Periostin, a member of a novel family of vitamin K-dependent proteins, is expressed by mesenchymal stromal cells. J Biol Chem. 2008;283(26):17991-18001. (PubMed)
21. Viegas CS, Simes DC, Laize V, Williamson MK, Price PA, Cancela ML. Gla-rich protein (GRP), a new vitamin K-dependent protein identified from sturgeon cartilage and highly conserved in vertebrates. J Biol Chem. 2008;283(52):36655-36664. (PubMed)
22. Viegas CS, Cavaco S, Neves PL, et al. Gla-rich protein is a novel vitamin K-dependent protein present in serum that accumulates at sites of pathological calcifications. Am J Pathol. 2009;175(6):2288-2298. (PubMed)
23. Hakuno D, Kimura N, Yoshioka M, et al. Periostin advances atherosclerotic and rheumatic cardiac valve degeneration by inducing angiogenesis and MMP production in humans and rodents. J Clin Invest. 2010;120(7):2292-2306. (PubMed)
24. Kudo Y, Siriwardena BS, Hatano H, Ogawa I, Takata T. Periostin: novel diagnostic and therapeutic target for cancer. Histol Histopathol. 2007;22(10):1167-1174. (PubMed)
25. Vanakker OM, Martin L, Schurgers LJ, et al. Low serum vitamin K in PXE results in defective carboxylation of mineralization inhibitors similar to the GGCX mutations in the PXE-like syndrome. Lab Invest. 2010;90(6):895-905. (PubMed)
26. Ferland G. Vitamin K and the nervous system: an overview of its actions. Adv Nutr. 2012;3(2):204-212. (PubMed)
27. Laurance S, Lemarie CA, Blostein MD. Growth arrest-specific gene 6 (gas6) and vascular hemostasis. Adv Nutr. 2012;3(2):196-203. (PubMed)
28. Robins RS, Lemarie CA, Laurance S, Aghourian MN, Wu J, Blostein MD. Vascular Gas6 contributes to thrombogenesis and promotes tissue factor up-regulation after vessel injury in mice. Blood. 2013;121(4):692-699. (PubMed)
29. Rothlin CV, Leighton JA, Ghosh S. Tyro3, Axl, and Mertk Receptor Signaling in Inflammatory Bowel Disease and Colitis-associated Cancer. Inflamm Bowel Dis. 2014;20(8):1472-1480. (PubMed)
30. Tjwa M, Moons L, Lutgens E. Pleiotropic role of growth arrest-specific gene 6 in atherosclerosis. Curr Opin Lipidol. 2009;20(5):386-392. (PubMed)
31. Jagannath VA, Fedorowicz Z, Thaker V, Chang AB. Vitamin K supplementation for cystic fibrosis. Cochrane Database Syst Rev. 2013;4:CD008482. (PubMed)
32. Nakajima S, Iijima H, Egawa S, et al. Association of vitamin K deficiency with bone metabolism and clinical disease activity in inflammatory bowel disease. Nutrition. 2011;27(10):1023-1028. (PubMed)
33. Nowak JK, Grzybowska-Chlebowczyk U, Landowski P, et al. Prevalence and correlates of vitamin K deficiency in children with inflammatory bowel disease. Sci Rep. 2014;4:4768. (PubMed)
34. Shearer MJ. Vitamin K deficiency bleeding (VKDB) in early infancy. Blood Rev. 2009;23(2):49-59. (PubMed)
35. American Academy of Pediatrics Committee on Fetus and Newborn. Controversies concerning vitamin K and the newborn. Pediatrics. 2003;112(1 Pt 1):191-192. (PubMed)
36. Klebanoff MA, Read JS, Mills JL, Shiono PH. The risk of childhood cancer after neonatal exposure to vitamin K. N Engl J Med. 1993;329(13):905-908. (PubMed)
37. Ekelund H, Finnstrom O, Gunnarskog J, Kallen B, Larsson Y. Administration of vitamin K to newborn infants and childhood cancer. BMJ. 1993;307(6896):89-91. (PubMed)
38. Roman E, Fear NT, Ansell P, et al. Vitamin K and childhood cancer: analysis of individual patient data from six case-control studies. Br J Cancer. 2002;86(1):63-69. (PubMed)
39. Schulte R, Jordan LC, Morad A, Naftel RP, Wellons JC, 3rd, Sidonio R. Rise in late onset vitamin K deficiency bleeding in young infants because of omission or refusal of prophylaxis at birth. Pediatr Neurol. 2014;50(6):564-568. (PubMed)
40. Costakos DT, Greer FR, Love LA, Dahlen LR, Suttie JW. Vitamin K prophylaxis for premature infants: 1 mg versus 0.5 mg. Am J Perinatol. 2003;20(8):485-490. (PubMed)
41. Kumar D, Greer FR, Super DM, Suttie JW, Moore JJ. Vitamin K status of premature infants: implications for current recommendations. Pediatrics. 2001;108(5):1117-1122. (PubMed)
42. Food and Nutrition Board, Institute of Medicine. Vitamin K. Dietary Reference Intakes for Vitamin A, Vitamin K, Arsenic, Boron, Chromium, Copper, Iodine, Iron, Manganese, Molybdenum, Nickel, Silicon, Vanadium, and Zinc. Washington, D.C.: National Academy Press; 2001:162-196. (National Academy Press)
43. Feskanich D, Weber P, Willett WC, Rockett H, Booth SL, Colditz GA. Vitamin K intake and hip fractures in women: a prospective study. Am J Clin Nutr. 1999;69(1):74-79. (PubMed)
44. Booth SL, Tucker KL, Chen H, et al. Dietary vitamin K intakes are associated with hip fracture but not with bone mineral density in elderly men and women. Am J Clin Nutr. 2000;71(5):1201-1208. (PubMed)
45. Rejnmark L, Vestergaard P, Charles P, et al. No effect of vitamin K1 intake on bone mineral density and fracture risk in perimenopausal women. Osteoporos Int. 2006;17(8):1122-1132. (PubMed)
46. McLean RR, Booth SL, Kiel DP, et al. Association of dietary and biochemical measures of vitamin K with quantitative ultrasound of the heel in men and women. Osteoporos Int. 2006;17(4):600-607. (PubMed)
47. Macdonald HM, μguigan FE, Lanham-New SA, Fraser WD, Ralston SH, Reid DM. Vitamin K1 intake is associated with higher bone mineral density and reduced bone resorption in early postmenopausal Scottish women: no evidence of gene-nutrient interaction with apolipoprotein E polymorphisms. Am J Clin Nutr. 2008;87(5):1513-1520. (PubMed)
48. Apalset EM, Gjesdal CG, Eide GE, Tell GS. Intake of vitamin K1 and K2 and risk of hip fractures: The Hordaland Health Study. Bone. 2011;49(5):990-995. (PubMed)
49. Torbergsen AC, Watne LO, Wyller TB, et al. Vitamin K1 and 25(OH)D are independently and synergistically associated with a risk for hip fracture in an elderly population: A case control study. Clin Nutr. 2015;34(1):101-106. (PubMed)
50. Booth SL, Mayer J. Warfarin use and fracture risk. Nutr Rev. 2000;58(1):20-22. (PubMed)
51. Tsugawa N, Shiraki M, Suhara Y, et al. Low plasma phylloquinone concentration is associated with high incidence of vertebral fracture in Japanese women. J Bone Miner Metab. 2008;26(1):79-85. (PubMed)
52. Ikeda Y, Iki M, Morita A, et al. Intake of fermented soybeans, natto, is associated with reduced bone loss in postmenopausal women: Japanese Population-Based Osteoporosis (JPOS) Study. J Nutr. 2006;136(5):1323-1328. (PubMed)
53. Fujita Y, Iki M, Tamaki J, et al. Association between vitamin K intake from fermented soybeans, natto, and bone mineral density in elderly Japanese men: the Fujiwara-kyo Osteoporosis Risk in Men (FORMEN) study. Osteoporos Int. 2012;23(2):705-714. (PubMed)
54. Kaneki M, Hodges SJ, Hosoi T, et al. Japanese fermented soybean food as the major determinant of the large geographic difference in circulating levels of vitamin K2: possible implications for hip-fracture risk. Nutrition. 2001;17(4):315-321. (PubMed)
55. Szulc P, Chapuy MC, Meunier PJ, Delmas PD. Serum undercarboxylated osteocalcin is a marker of the risk of hip fracture in elderly women. J Clin Invest. 1993;91(4):1769-1774. (PubMed)
56. Vergnaud P, Garnero P, Meunier PJ, Breart G, Kamihagi K, Delmas PD. Undercarboxylated osteocalcin measured with a specific immunoassay predicts hip fracture in elderly women: the EPIDOS Study. J Clin Endocrinol Metab. 1997;82(3):719-724. (PubMed)
57. Shearer MJ. The roles of vitamins D and K in bone health and osteoporosis prevention. Proc Nutr Soc. 1997;56(3):915-937. (PubMed)
58. O'Connor E, Molgaard C, Michaelsen KF, Jakobsen J, Cashman KD. Vitamin D-vitamin K interaction: effect of vitamin D supplementation on serum percentage undercarboxylated osteocalcin, a sensitive measure of vitamin K status, in Danish girls. Br J Nutr. 2010;104(8):1091-1095. (PubMed)
59. Kanellakis S, Moschonis G, Tenta R, et al. Changes in parameters of bone metabolism in postmenopausal women following a 12-month intervention period using dairy products enriched with calcium, vitamin D, and phylloquinone (vitamin K(1)) or menaquinone-7 (vitamin K (2)): the Postmenopausal Health Study II. Calcif Tissue Int. 2012;90(4):251-262. (PubMed)
60. Bolton-Smith C, McMurdo ME, Paterson CR, et al. Two-year randomized controlled trial of vitamin K1 (phylloquinone) and vitamin D3 plus calcium on the bone health of older women. J Bone Miner Res. 2007;22(4):509-519. (PubMed)
61. Braam LA, Knapen MH, Geusens P, et al. Vitamin K1 supplementation retards bone loss in postmenopausal women between 50 and 60 years of age. Calcif Tissue Int. 2003;73(1):21-26. (PubMed)
62. Cockayne S, Adamson J, Lanham-New S, Shearer MJ, Gilbody S, Torgerson DJ. Vitamin K and the prevention of fractures: systematic review and meta-analysis of randomized controlled trials. Arch Intern Med. 2006;166(12):1256-1261. (PubMed)
63. Tamura T, Morgan SL, Takimoto H. Vitamin K and the prevention of fractures. Arch Intern Med. 2007;167(1):94; author reply 94-95. (PubMed)
64. Inoue T, Fujita T, Kishimoto H, et al. Randomized controlled study on the prevention of osteoporotic fractures (OF study): a phase IV clinical study of 15-mg menatetrenone capsules. J Bone Miner Metab. 2009;27(1):66-75. (PubMed)
65. Knapen MH, Schurgers LJ, Vermeer C. Vitamin K2 supplementation improves hip bone geometry and bone strength indices in postmenopausal women. Osteoporos Int. 2007;18(7):963-972. (PubMed)
66. Binkley N, Harke J, Krueger D, et al. Vitamin K treatment reduces undercarboxylated osteocalcin but does not alter bone turnover, density, or geometry in healthy postmenopausal North American women. J Bone Miner Res. 2009;24(6):983-991. (PubMed)
67. Emaus N, Gjesdal CG, Almas B, et al. Vitamin K2 supplementation does not influence bone loss in early menopausal women: a randomised double-blind placebo-controlled trial. Osteoporos Int. 2010;21(10):1731-1740. (PubMed)
68. Knapen MH, Drummen NE, Smit E, Vermeer C, Theuwissen E. Three-year low-dose menaquinone-7 supplementation helps decrease bone loss in healthy postmenopausal women. Osteoporos Int. 2013;24(9):2499-2507. (PubMed)
69. Jamal SA, Browner WS, Bauer DC, Cummings SR. Warfarin use and risk for osteoporosis in elderly women. Study of Osteoporotic Fractures Research Group. Ann Intern Med. 1998;128(10):829-832. (PubMed)
70. Caraballo PJ, Heit JA, Atkinson EJ, et al. Long-term use of oral anticoagulants and the risk of fracture. Arch Intern Med. 1999;159(15):1750-1756. (PubMed)
71. Gage BF, Birman-Deych E, Radford MJ, Nilasena DS, Binder EF. Risk of osteoporotic fracture in elderly patients taking warfarin: results from the National Registry of Atrial Fibrillation 2. Arch Intern Med. 2006;166(2):241-246. (PubMed)
72. Caraballo PJ, Gabriel SE, Castro MR, Atkinson EJ, Melton LJ, 3rd. Changes in bone density after exposure to oral anticoagulants: a meta-analysis. Osteoporos Int. 1999;9(5):441-448. (PubMed)
73. Fusaro M, Crepaldi G, Maggi S, et al. Bleeding, vertebral fractures and vascular calcifications in patients treated with warfarin: hope for lower risks with alternative therapies. Curr Vasc Pharmacol. 2011;9(6):763-769. (PubMed)
74. Cheung CL, Sahni S, Cheung BM, Sing CW, Wong IC. Vitamin K intake and mortality in people with chronic kidney disease from NHANES III. Clin Nutr. 2014; pii: S0261-5614(14)00086-7. doi: 10.1016/j.clnu.2014.03.011. (Epub ahead of print) (PubMed)
75. Juanola-Falgarona M, Salas-Salvado J, Martinez-Gonzalez MA, et al. Dietary intake of vitamin K is inversely associated with mortality risk. J Nutr. 2014;144(5):743-750. (PubMed)
76. Vissers LE, Dalmeijer GW, Boer JM, Monique Verschuren WM, van der Schouw YT, Beulens JW. Intake of dietary phylloquinone and menaquinones and risk of stroke. J Am Heart Assoc. 2013;2(6):e000455. (PubMed)
77. Rees K, Guraewal S, Wong YL, et al. Is vitamin K consumption associated with cardio-metabolic disorders? A systematic review. Maturitas. 2010;67(2):121-128. (PubMed)
78. Gast GC, de Roos NM, Sluijs I, et al. A high menaquinone intake reduces the incidence of coronary heart disease. Nutr Metab Cardiovasc Dis. 2009;19(7):504-510. (PubMed)
79. Geleijnse JM, Vermeer C, Grobbee DE, et al. Dietary intake of menaquinone is associated with a reduced risk of coronary heart disease: the Rotterdam Study. J Nutr. 2004;134(11):3100-3105. (PubMed)
80. Otsuka F, Sakakura K, Yahagi K, Joner M, Virmani R. Has our understanding of calcification in human coronary atherosclerosis progressed? Arterioscler Thromb Vasc Biol. 2014;34(4):724-736. (PubMed)
81. Rennenberg RJ, Kessels AG, Schurgers LJ, van Engelshoven JM, de Leeuw PW, Kroon AA. Vascular calcifications as a marker of increased cardiovascular risk: a meta-analysis. Vasc Health Risk Manag. 2009;5(1):185-197. (PubMed)
82. Jie KS, Bots ML, Vermeer C, Witteman JC, Grobbee DE. Vitamin K intake and osteocalcin levels in women with and without aortic atherosclerosis: a population-based study. Atherosclerosis. 1995;116(1):117-123. (PubMed)
83. Villines TC, Hatzigeorgiou C, Feuerstein IM, O'Malley PG, Taylor AJ. Vitamin K1 intake and coronary calcification. Coron Artery Dis. 2005;16(3):199-203. (PubMed)
84. Maas AH, van der Schouw YT, Beijerinck D, et al. Vitamin K intake and calcifications in breast arteries. Maturitas. 2007;56(3):273-279. (PubMed)
85. Beulens JW, Bots ML, Atsma F, et al. High dietary menaquinone intake is associated with reduced coronary calcification. Atherosclerosis. 2009;203(2):489-493. (PubMed)
86. Borras T, Comes N. Evidence for a calcification process in the trabecular meshwork. Exp Eye Res. 2009;88(4):738-746. (PubMed)
87. Schurgers LJ, Uitto J, Reutelingsperger CP. Vitamin K-dependent carboxylation of matrix Gla-protein: a crucial switch to control ectopic mineralization. Trends Mol Med. 2013;19(4):217-226. (PubMed)
88. Cassidy-Bushrow AE, Bielak LF, Levin AM, et al. Matrix gla protein gene polymorphism is associated with increased coronary artery calcification progression. Arterioscler Thromb Vasc Biol. 2013;33(3):645-651. (PubMed)
89. Herrmann SM, Whatling C, Brand E, et al. Polymorphisms of the human matrix gla protein (MGP) gene, vascular calcification, and myocardial infarction. Arterioscler Thromb Vasc Biol. 2000;20(11):2386-2393. (PubMed)
90. Schurgers LJ, Teunissen KJ, Knapen MH, et al. Novel conformation-specific antibodies against matrix γ-carboxyglutamic acid (Gla) protein: undercarboxylated matrix Gla protein as marker for vascular calcification. Arterioscler Thromb Vasc Biol. 2005;25(8):1629-1633. (PubMed)
91. van den Heuvel EG, van Schoor NM, Lips P, et al. Circulating uncarboxylated matrix Gla protein, a marker of vitamin K status, as a risk factor of cardiovascular disease. Maturitas. 2014;77(2):137-141. (PubMed)
92. Mayer O, Jr., Seidlerova J, Bruthans J, et al. Desphospho-uncarboxylated matrix Gla-protein is associated with mortality risk in patients with chronic stable vascular disease. Atherosclerosis. 2014;235(1):162-168. (PubMed)
93. Shea MK, O'Donnell CJ, Hoffmann U, et al. Vitamin K supplementation and progression of coronary artery calcium in older men and women. Am J Clin Nutr. 2009;89(6):1799-1807. (PubMed)
94. Shea MK, O'Donnell CJ, Vermeer C, et al. Circulating uncarboxylated matrix gla protein is associated with vitamin K nutritional status, but not coronary artery calcium, in older adults. J Nutr. 2011;141(8):1529-1534. (PubMed)
95. Chatrou ML, Winckers K, Hackeng TM, Reutelingsperger CP, Schurgers LJ. Vascular calcification: the price to pay for anticoagulation therapy with vitamin K-antagonists. Blood Rev. 2012;26(4):155-166. (PubMed)
96. Booth SL, Suttie JW. Dietary intake and adequacy of vitamin K. J Nutr. 1998;128(5):785-788. (PubMed)
97. Beulens JW, Booth SL, van den Heuvel EG, Stoecklin E, Baka A, Vermeer C. The role of menaquinones (vitamin K(2)) in human health. Br J Nutr. 2013;110(8):1357-1368. (PubMed)
98. Hendler SS, Rorvik DR. Vitamin K. PDR for Nutritional Supplements. 2nd ed. Montvale: Physicians' Desk Reference Inc.; 2008:708-7123.
99. Traber MG. Vitamin E and K interactions--a 50-year-old problem. Nutr Rev. 2008;66(11):624-629. (PubMed)
100. Booth SL, Golly I, Sacheck JM, et al. Effect of vitamin E supplementation on vitamin K status in adults with normal coagulation status. Am J Clin Nutr. 2004;80(1):143-148. (PubMed)
101. Pastori D, Carnevale R, Cangemi R, et al. Vitamin E serum levels and bleeding risk in patients receiving oral anticoagulant therapy: a retrospective cohort study. J Am Heart Assoc. 2013;2(6):e000364. (PubMed)
102. Shearer MJ, Newman P. Recent trends in the metabolism and cell biology of vitamin K with special reference to vitamin K cycling and MK-4 biosynthesis. J Lipid Res. 2014;55(3):345-362. (PubMed)
103. Thorp JA, Gaston L, Caspers DR, Pal ML. Current concepts and controversies in the use of vitamin K. Drugs. 1995;49(3):376-387. (PubMed)
104. Reiffel JA. An important indirect drug interaction between dronedarone and warfarin that may be extrapolated to other drugs that can alter gastrointestinal function. Am Heart J. 2011;161(2):e5; author reply e7. (PubMed)
105. Shirolkar SC, Fiuzat M, Becker RC. Dronedarone and vitamin K antagonists: a review of drug-drug interactions. Am Heart J. 2010;160(4):577-582. (PubMed)
106. Hendler SS, Rorvik DR, eds. PDR for Nutritional Supplements. Montvale: Medical Economics Company, Inc.; 2001.
リボフラビン
目次
要約
-
リボフラビンはフラビンアデニンジヌクレオチド(FAD)とフラビンモノヌクレオチド(FMN)という補酵素の前駆体である。それらはエネルギー生産や多数の代謝経路に関わるたくさんの酸化還元反応における電子伝達体として働く。(詳細はこちら)
-
リボフラビン欠乏症は、ビタミンB6、葉酸塩、ナイアシン、および鉄の代謝における複数の経路に影響することがある。(詳細はこちら)
-
リボフラビン欠乏症は、妊婦の子癇前症と関連づけられてきた。この症状は子癇へと進行し、重度の出血や死を引き起こすかもしれない。子癇前症のリスクは最近、メチレンテトラヒドロ葉酸還元酵素(MTHFR)遺伝子における遺伝子変異(C677T)の存在との関わりがわかった。この遺伝子はMTHFR酵素を符号化し、これはFAD依存性である。(詳細はこちら)
-
酸化ストレスは眼の水晶体を混濁化させ、年配者の白内障へと至らせることがある。いくつかの観察研究の結果は有望であるものの、白内障の予防におけるリボフラビンの利点の可能性を評価する介入研究が必要である。(詳細はこちら)
-
リボフラビン(FADの形態)は、葉酸塩を代謝する主要な酵素であるMTHFRの補助因子として必要である。リボフラビンの状態が悪いと葉酸塩の代謝に支障をきたす可能性があり、MTHFRC677T遺伝子変異がホモ接合である者は特にそうである。これらの者は心血管疾患(CVD)のリスクがより高い。介入試験から導かれるエビデンスでは、MTHFRC677TT遺伝子型の者の高血圧に対するリボフラビンの予防的役割が裏付けられている。(詳細はこちら)
-
リボフラビンは偏頭痛に悩む子供や成人による研究で予防薬として評価されてきた。リボフラビン補給は成人の頭痛発作の頻度や重篤度を下げることが示されたが、子供ではそうではなかった。(詳細はこちら)
-
リボフラビン代謝の常染色体劣性遺伝疾患のある患者にはリボフラビン補給が有益であるかもしれないことが症例報告で示されている。(詳細はこちら)
-
リボフラビンはがんおよびある種の眼科疾患の補助療法としての可能性が評価されてきた。(詳細はこちら)
リボフラビンはビタミンB2としても知られる水溶性ビタミンBである。リボフラビンは体内において、補酵素であるフラビンアデニンジヌクレオチド(FAD)およびフラビンモノヌクレオチド(FMN)に不可欠な成分として主に存在する(1)。リボフラビン由来の補酵素はフラビン補酵素と命名され、フラビン補酵素を使用する酵素はフラビンタンパク質と呼ばれる(2)。
機能
酸化還元反応
生物はそのエネルギーのほとんどを酸化還元反応から得ており、これは電子の移送を伴うプロセスである。フラビン補酵素は、多数の代謝経路において酸化還元反応に関わっている(3)。それらは炭水化物、脂質、およびタンパク質の代謝に非常に重要である。FADは電子伝達(呼吸)鎖の一部であり、これはエネルギー生産の中心である。シトクロムP-450とともに、フラビン補酵素は薬剤や毒素の代謝にも関わる(4)。
抗酸化機能
グルタチオン還元酵素は、グルタチオンの酸化還元サイクルに関わるFAD依存性酵素である。グルタチオン酸化還元サイクルは、ヒドロペルオキシドのような活性酸素種から生物を守ることに主要な役割を果たす。グルタチオン還元酵素(GR)は、酸化されたグルタチオンから還元されたグルタチオン2分子を再生するためにFADを必要とする。リボフラビン欠乏症は、酸化ストレス上昇と関連付けられてきた(4)。リボフラビンの栄養状態を評価するために、赤血球のGR活性測定値が一般的に使用される(5)。赤血球グルタチオン還元酵素の活性係数(EGRac)アッセイ(試験法)は、in vitro(ガラス容器内)での補欠分子族FADによる再活性化の前後でGRの活性を測定することで、リボフラビンの状態を評価する。EGRacはFADに刺激された酵素活性と刺激されなかったものの比率として計算され、組織がリボフラビンで飽和された程度を示すものである。EGRacはしたがってリボフラビンの状態の機能性測定値であり、重篤な欠乏症から正常な状態までのバイオマーカーの状態を反映する有効性が示されている(6)。
セレン含有酵素であるグルタチオンペルオキシダーゼ(GPx)は、還元されたグルタチオン2分子をヒドロペルオキシドの分解に必要とする。GPxはグルタチオン酸化還元サイクルに関わっている(図1参照)。
別のFAD依存性酵素であるキサンチン酸化酵素は、ヒポキサンチンやキサンチンを尿酸へと酸化する反応を触媒する。尿酸は、血液中で最も効果的な水溶性抗酸化物質の一つである。リボフラビン欠乏症はキサンチン酸化酵素の活性を下げ、血中尿酸濃度を低下させることになるかもしれない(7)。
栄養素相互作用
ビタミンB群
フラビンタンパク質は、その他のいくつかのビタミン(すなわちビタミンB6、ナイアシン、および葉酸塩)の代謝に関わっている。したがって、重篤なリボフラビン欠乏症は多くの酵素系に影響する可能性がある。ほとんどの天然由来のビタミンB6をその補酵素形態であるピリドキサール5'-リン酸(PLP)に変換するには、FMN依存性酵素であるピリドキシン5'-リン酸酸化酵素(PPO)が必要である(8)。年配者対象の少なくとも2つの研究で、ビタミンB6の指標とリボフラビンの栄養状態との間に有意な相互作用があることが記載された(9,10)。アミノ酸のトリプトファンからナイアシン含有補酵素のNADとNADPを合成するには、FAD依存性酵素のキヌレニン(3-)モノオキシゲナーゼを必要とする。重篤なリボフラビン欠乏症はトリプトファンからのNADやNADPの合成を減らし、ナイアシン欠乏症のリスクを上げる可能性がある(3)。5,10-メチレンテトラヒドロ葉酸還元酵素(MTHFR)は、ホモシステインからメチオニンを作るために必要な特定の葉酸酵素を維持することに重要な役割を果たすFAD依存性酵素である(図2参照)。その他のビタミンB群と同様に、リボフラビンの高摂取は血漿ホモシステイン濃度の低下と関連付けられてきた(11)。主にMTHFR遺伝子のC677T多型がホモ接合である者や葉酸塩の摂取が少ない者では、血漿リボフラビン濃度の上昇が血漿ホモシステイン濃度の減少とも関連付けられる(12)。そのような結果は、遺伝性および食事性の要因の複雑な相互作用によって慢性疾患リスクが影響を受けることを示している(「心血管疾患」および「がん」の項参照)。
鉄
リボフラビン欠乏症は鉄の代謝を変える。そのメカニズムはよくわかっていないが、動物による研究ではリボフラビン欠乏症が鉄の吸収を損ない、腸での鉄の損失を増やし、および/またはヘモグロビン(Hb)合成のための鉄の利用を損なうかもしれないことが示されている(13)。ヒトでは、リボフラビンの栄養状態を向上させることが体内循環のHb濃度を上げることがわかっている(14)。リボフラビンも鉄も欠乏症の者のリボフラビン欠乏症を治すと、鉄欠乏性貧血の鉄による治療への反応が改善する(15)。全世界的な公衆衛生問題である妊娠中の貧血は、かなりの出生時罹患や死亡の原因である(16,17)。母親の貧血の管理には単独または葉酸と併用での鉄補給があり(18)、リボフラビン補給が鉄葉酸補給を強化するのではないかと考えられてきた。東南アジアの貧血の妊婦に対する無作為化二重盲検介入試験で、葉酸、鉄、ビタミンA、およびリボフラビンの組み合わせは鉄と葉酸だけの補給に比べてHb濃度を好転させ、貧血の罹患率を低減させたことが示された(19,20)。
欠乏症
ビタミンB2欠乏症は、臨床的リボフラビン欠乏症の医学用語である。リボフラビン欠乏症は、単独で見つかることは稀である。それはしばしばその他の水溶性ビタミン欠乏症とともに起こる。リボフラビン欠乏症の症状は、咽頭痛、口内や喉の赤み(発赤)や腫れ(腫脹)、唇表面のひび割れや痛み(口唇症)、および口の端の割れ目や痛み(口角炎)、舌の炎症や発赤(赤色舌炎)、およびじくじくして剥がれ落ちる皮膚の炎症(脂漏性皮膚炎)などがある。その他の症状では、眼の透明膜における血管の生成(角膜の血管新生)や、現存の赤血球は正常なヘモグロビン濃度と大きさであるのに赤血球数が減ること(正色素性正球性貧血)もあるかもしれない(1,3)。重篤なリボフラビン欠乏症は、ビタミンB6からその補酵素の形態(PLP)への変換の低減や、トリプトファンからナイアシンへの変換の減少に至るかもしれない(「栄養素相互作用」の項参照)。
子癇前症は、妊娠中の血圧上昇、尿中タンパク質、および浮腫(ひどい腫れ)が起こることと定義される。子癇前症の妊婦の約5%が、母体および胎児の死亡の重大原因である子癇へと進行する。子癇は痙攣が特徴で、高血圧や出血(大量出血)リスクの上昇も伴う(21)。子癇前症のリスクが高い154人の妊婦による研究で、リボフラビン欠乏症の者はリボフラビンの栄養状態が適切である者に比べて子癇前症に4.7倍なりやすかったことがわかった(22)。子癇前症と子癇の原因はわかっていない。フラビン補酵素の細胞内濃度の低下がミトコンドリアの機能不全を起こして酸化ストレスを増大させ、一酸化窒素の放出に支障をきたして、そのために血管拡張が妨げられる。これらすべての変化が子癇前症と関連がある(22)。
51の研究の最近のメタ解析で、メチレンテトラヒドロ葉酸還元酵素(MTHFR)遺伝子のC677T多型が白人および東アジアの集団における子癇前症と関連があることがわかった(23)。しかし初期のメタ解析では、MTHFR677TTの遺伝子型はアジア人女性のみにおいて子癇前症のリスクがかなり高い一方で、白人女性ではリスク上昇はそれほどでもなかったことが報告された(24)。研究ごとのそのような違いは、MTHFR677TT遺伝子型の効果が、集団ごとにかなり異なるかもしれないリボフラビンやその他の関連する食事要因によって調整されているのかもしれないことを示唆している。C677T遺伝子変異体を持つ被験者に見られるフラビンタンパク質のMTHFR活性の低下は、血漿ホモシステイン濃度がやや上昇することになり、ホモシステイン濃度の上昇は子癇前症と関連付けられてきた(25)。子癇前症のリスクの高い450人の妊婦による1つの小規模無作為化プラセボ対照二重盲検試験で、毎日15 mgのリボフラビン補給では症状を予防できなかったことがわかった(26)。しかし、周産期の合併症、特にC677T遺伝子型の女性の子癇前症を減らすためのリボフラビン補給の潜在的有益性を評価する研究が必要である。
リボフラビン欠乏症のリスク要因
アルコール中毒者は、リボフラビンの摂取が不足したり、吸収が悪かったり、利用が損なわれたりしてリボフラビン欠乏症リスクが高い。興味深いことに、リボフラビン欠乏に伴うホモシステイン濃度上昇は、アルコールを控える間は急速に下がる(27)。また、拒食症の者が適切にリボフラビンを摂取することは稀であり、ラクトース不耐性の者は、リボフラビンの良好な摂取源である牛乳やその他の乳製品を摂取しないかもしれない。リボフラビンからFADやFMNへの変換は、甲状腺機能低下症や副腎機能不全によって損なわれる(3,4)。さらに、身体的に非常に活動的な者(アスリートや肉体労働者)はリボフラビン必要量が少し高いかもしれない。しかし一般的には、リボフラビン補給で運動耐性または運動能力が上がるとはされていない(28)。
臨床的リボフラビン欠乏症(すなわち口角炎、口唇症、および舌炎などの兆候を含む)は先進国では稀であるが、リボフラビンの状態(機能的バイオマーカーのEGRacで決定されるもの)が適切でないことは、それ以外は健康な先進国の多くの集団に影響する広汎な問題であるかもしれないと示唆するエビデンス(科学的根拠)がある。たとえば英国成人のかなりの割合は、EGRacを使用した国家的調査データから決定されたように、リボフラビンの状態が良くないと報告された(29)。しかし摂取が少ない若い女性を除けば、食事性摂取量は一般的に推奨量に程よく匹敵することがわかった。食事性摂取量が適切であるように見えるのにEGRacの数値が異常な英国人の割合が高いことは、さらなる調査が必要である。
推奨量(RDA)
1998年に改定されたリボフラビンのRDAは、欠乏症予防に基づいている(表1)。ヒトの欠乏症の臨床的兆候は0.5~0.6ミリグラム(mg)/日よりも少ない摂取量で現れ、約1 mg/日の摂取量でリボフラビンの尿中への排泄が見られる(1)。
疾病予防
白内障
加齢性白内障は、米国およびその他の先進国における視覚障害の主因である。研究では、栄養学的な抗酸化物質に焦点が当てられてきたが、これは水晶体のタンパク質の光誘発性酸化ダメージから加齢性白内障の発症に至るのではないかとするエビデンスに拠るものである。症例対照研究で、食事性リボフラビン摂取が最も高い五分位(中央値で1.6~2.2 mg/日)の男女は、最も低い五分位(男女とも中央値で0.08 mg/日)の者に比べて加齢性白内障リスクがかなり低い(33%対55%)ことがわかった(30)。別の症例対照研究では、赤血球グルタチオン還元酵素活性で測定されたリボフラビンの栄養状態が最も高い五分位の者は、最も低い五分位の者に比べて加齢性白内障の発生が約半分であったことが報告されたが、その結果は統計学的にそれほど有意義ではなかった(31)。49歳以上のオーストラリアの男女2,900人による横断研究で、リボフラビン摂取が最多の五分位の者は、最少の者に比べて白内障に50%なりにくいことがわかった(32)。50,000人超の女性による前向き研究においては、リボフラビン摂取が最も多い五分位(中央値で1.5 mg/日)の女性と最も少ない五分位(中央値で1.2 mg/日)の女性の間で、白内障摘出手術の割合に差は見られなかった(33)。しかし最多と最少の範囲が小さく、どちらの五分位も摂取の中央値が現在のリボフラビンのRDAより上であった。408人の女性による研究では、リボフラビン摂取が多いと5年間の水晶体混濁形成の変化と逆相関があることがわかった(34)。これらの観察は白内障予防におけるリボフラビンの役割をいくらか裏付けるものであるが、この関係を確認するために反応のバイオマーカー(EGRacなど)を含む無作為化プラセボ対照介入試験が必要である。
心血管疾患
何年も血漿ホモシステイン濃度が高いことは心血管疾患(CVD)のリスク要因であると考えられてきたが、最近これにはいささか議論がある(35)。血漿ホモシステインは葉酸塩や、リボフラビンを含む代謝的に関連のあるビタミンB群での介入による低減効果に反応する。リボフラビンはMTHFRの補助因子として働くので、ホモシステインからメチオニンへの再メチル化に必要な5-メチルテトラヒドロ葉酸を生成するために必要である(上記の図2参照)。これらのビタミンB群はしかしながら、ホモシステインに対するそれらの効果とは別にCVD予防における役割があるかもしれない。
遺伝学的研究で、ビタミンBの栄養状態が不適切なこととCVDリスクに関連があることを裏付ける確信的なエビデンスが提供されている。そのような研究のメタ解析で、MTHFRC677T遺伝子変異がホモ接合の者は、この多型を持っていない者に比べてCVDリスクがかなり高い(14~21%)ことが示された。しかしCVDリスクの増加には大きな地理的差異があり(36)、食事性の要因でこの遺伝子要因に関連した疾病リスクを調整できるのではないかということが強く示唆される。
蓄積されたエビデンスから、この一般的な葉酸代謝遺伝子多型とCVD、特に脳卒中の主要なリスク要因である高血圧(血圧が140/90 mmHg以上と定義)とが関連付けられている。この多型がホモ接合の患者の血圧が低用量のリボフラビンにとてもよく反応する(「疾病治療」の項参照)という最近のエビデンスから、リボフラビンの状態を改善することが高血圧予防に重要な役割を持つであろう可能性が出てくる。これは、関連する遺伝子型の者にとって特に脳卒中リスクを低減できるかもしれないことになる。注目すべきことに、報告されているMTHFR677TT遺伝子型の出現頻度は全世界では10%だが、ヨーロッパで4~26%、中国北部で20%、そしてメキシコでは32%にもなる(37)。
がん
フラビンタンパク質であるメチレンテトラヒドロ葉酸還元酵素(MTHFR)は、葉酸介在のホモシステイン代謝に中心的な役割をする。MTHFRは5,10-メチレンテトラヒドロ葉酸を5-メチルテトラヒドロ葉酸に変換し、これはホモシステインからメチオニンへの再メチル化に必要である(上記の図2参照)。ホモシステインからメチオニンへの変換はホモシステインの解毒と、DNAおよびヒストンのメチル化の際のメチル基供与体であるS-アデノシルメチオニン(SAM)の生成に重要である。葉酸塩欠乏症とホモシステイン濃度上昇は、がんリスクを上昇させるかもしれない(「葉酸塩」のタイトルの記事参照)。異常なメチル化の変化は、がんの進行中にDNAとヒストンの構造や機能を変化させることが知られている(38)。MTHFRはホモシステインの解毒とSAM合成のためのメチル基供給を制御しているため、その活性の低下はホモシステイン代謝に影響して細胞でのメチル化プロセスを乱す可能性がある。MTHFR遺伝子の位置677におけるシトシンからチミンへの置換(c.677C>T)はFADの結合に影響する多型であり、MTHFRがフラビン補酵素を喪失する傾向を強めることになる(39)。この変異がホモ接合の者(すなわちMTHFR677TT遺伝子型)はMTHFR活性の低下を示し、そうした者は様々な部位でのがんリスクが高くなるというエビデンスがある(40~42)。しかし、この一般的な多型とがんリスクの関連の本質は今もはっきりしていない。
上記のように(「ビタミンB群」の項参照)、リボフラビン摂取はホモシステイン濃度の決定要因である。このことはリボフラビンの状態がMTHFR活性と葉酸代謝に影響し、それによってがんリスクに影響する可能性があることを示唆している(42)。ある無作為化二重盲検プラセボ対照研究で、大腸ポリープのある93人の被験者と86人の健康な被験者に45日間にわたってプラセボか、葉酸(400または1,200 mcg/日)か、葉酸(400 mcg/日)とリボフラビン(5 mg/日)を与えた。これらの介入によって、ビタミン補給された者の葉酸塩とリボフラビンの状態はプラセボを摂取した者よりかなり改善した。興味深いことに、特にC677T遺伝子変異のあるポリープ患者では、体内循環の5-メチルテトラヒドロ葉酸(5-MeTh4)に対する400 mcgの葉酸の効果をリボフラビンが強化していた(43)。このことは、MTHFR活性が下がっている者への葉酸補給に対する反応を、リボフラビンが向上させるかもしれないことを示唆している。また、閉経後の88,045人の女性による前向きコホート研究で、リボフラビンの全摂取量(食事性およびサプリメント性)について毎日の摂取量が最多の四分位(3.97 mg超)の者と最少の四分位(1.80 mg未満)の者とで比べた場合に、全摂取量は結腸直腸がん(大腸がん)リスクと逆相関があることがわかった(44)。参照群における摂取量はRDAを大きく上回る1.1 mg/日であった。この研究の被験者はC677T遺伝子型を持つ者を事前に選別しておらず、C677T多型と大腸がんの関連ははっきりしないが、T対立遺伝子があるとリスクが低下することを示唆する報告がある(45)。
リボフラビン摂取とがんリスクの関連は、その他のタイプのがんでも評価されている。ある7年間の介入研究は、中国で食道がんのリスクが高い22,093人の者へのリボフラビン強化塩の使用について評価した。対照群に比べて、介入群ではリボフラビンの状態と食道に関する病理学的数値(正常、形成異常、およびがん組織のパーセント)が向上したが、介入群における食道がんの発生率が低いことは、統計学的に有意義ではなかった(46)。さらに、41,514人の男女を15年間追跡したメルボルン共同コホート研究では、リボフラビン摂取と肺がん(47)および乳がん(48)に弱い逆相関が見られたが、前立腺がんでは何の相関もなかった(49)。胃がんリスクが高い患者の介入試験の10年にわたる追跡では、リボフラビン(3.2 mg/日)とナイアシン(40 mg/日)を含むミネラルとビタミンの食事性補給を5年間しても、胃がんの発生率や死亡率を下げることはできなかったことがわかった(50)。
疾病治療
偏頭痛
脳内でのミトコンドリアの酸素代謝が損なわれることが偏頭痛の病理に関わっているのではないかと示すエビデンスがある。リボフラビンは、ミトコンドリアの電子伝達系のフラビンタンパク質が必要とする2つのフラビン補酵素(FADおよびFMN)の前駆体であるので、リボフラビン補給は偏頭痛の治療法として調べられてきた。ある無作為化プラセボ対照試験で、偏頭痛の再発の履歴がある54人の男女における片頭痛予防に関して、3ヶ月間400 mg/日のリボフラビンを摂取する効果が調べられた(51)。リボフラビンはプラセボに比べて発作頻度と頭痛のある日を減らすことにおいてかなり良好であったが、有益な効果は治療の3ヶ月目に最も顕著であった。同じ研究者による別の研究で、βブロッカー(遮断薬)と呼ばれる薬物または高用量リボフラビン(400 mg/日)で4ヶ月間治療したところ臨床的に改善があったが、どちらの治療法も別個の病理学的メカニズムに作用するようだとわかった。すなわちβブロッカーは皮質の異常な情報処理に、リボフラビンは脳のミトコンドリアのエネルギー産生低下に働くようであった(52)。23人の患者による小規模研究で、毎日400 mgのリボフラビンを3ヶ月間補給したら偏頭痛発作頻度の中央値が下がったと報告された(53)。しかし、偏頭痛に悩む者にリボフラビン(400 mg/日)、マグネシウム、およびナツシロギクを併用投与した3ヶ月間の無作為化二重盲検プラセボ対照研究では、25 mg/日のリボフラビンを含むプラセボを摂取した場合以上の治療効果は何もなかったと報告された(54)。この試験でのベースライン時(治療開始時)の測定に比べて、プラセボ群も治療群も偏頭痛の平均回数、日数、または指標に関していくらかの有益性があった(54)。これらの発見はまだ先行的なものであるが、今日までのほとんどの研究からのデータは、成人へのリボフラビン補給が片頭痛予防の薬理学的治療法に対する有益な補助療法であるかもしれないことを示唆している。
2つの無作為化二重盲検プラセボ対照試験で、偏頭痛のある子供の発作の頻度や重篤度に関してリボフラビン補給の効果が調べられた。第一の研究では、5~15歳の48人の子供に200 mg/日のリボフラビンを12週間与えた効果を評価した(55)。第二の研究は、6~13歳の42人の子供による横断研究であった。そのうち半分は50 mg/日のリボフラビンを16週間摂取してから4週間の休薬期間を経てプラセボ(100 mg/日のカロテン)を16週間摂取し、残りの半分はまずプラセボを摂取してからリボフラビンを摂取した(56)。どちらの研究でも治療による偏頭痛の頻度、持続時間、または強さに何の差も示されなかった。偏頭痛の子供へのリボフラビン補給の有効性はまだ確率されておらず、将来の研究ではこの集団に対する最適な用量をまず決定すべきである。
代謝障害
FAD依存性酵素の欠陥による常染色体劣性遺伝疾患の患者はリボフラビン補給で恩恵を受けるかもしれないことが、増大するエビデンスで示唆されている。
多種アシルCoA脱水素酵素欠損症(MADD)
II型グルタル酸尿症(または血症)としても知られるMADDは、様々な組織における短鎖、中鎖、および長鎖のアシルカルニチンの蓄積が特徴的な脂肪酸代謝異常症である。MADDの新生児期および遅発性の発症形態は、突発性の脳症、周期性嘔吐、肝障害、および横紋筋融解症を含む様々な症状を広範な臨床的重篤度で呈する(57)。MADDは、ミトコンドリア内でアシル補酵素A(アシルCoA)からコエンザイムQ10/ユビキノンへの電子輸送に関わる酵素の活性を損なう遺伝子の突然変異によって起こる(図3参照)。ETFA、ETFB、およびETFDHはそれぞれ、電子伝達系フラビンタンパク質(ETF-AおよびETF-B)の2つのサブユニットおよびETF脱水素酵素/ユビキノン酸化還元酵素(ETFDH/ETFQO)を符号化する。
これらの酵素(ETFまたはETFDH)の欠損は酸化されたFADの減少につながり、ミトコンドリア内で起こる主要な脂肪酸異化作用であるβ酸化の第一段階を含むFAD依存性脱水素反応において、酸化されたFADが利用不能になってしまう。脂肪酸β酸化の欠陥は骨格筋での脂質蓄積を引き起こし、筋肉痛や筋力低下、および運動不耐性が特徴的な脂質蓄積性ミオパシーにつながる。低脂肪で炭水化物が多い食事と一緒にリボフラビン補給をすると、ETFDH突然変異を持つ患者にかなりの臨床的改善が起こる。FTE/ETFDHにおける特定のタイプの突然変異は、発症年齢、重篤度、およびリボフラビンによる治療への反応性に関わる(58)。さらに、リボフラビン反応性MADDの20歳の男性に関する最近の報告ではETFやETFDH遺伝子に突然変異が見つからなかったことから、その他の部位の突然変異も排除すべきではないことが示唆された(57)。最後に、呼吸鎖での二次性欠損がMADDで観察され、これはリボフラビン治療にうまく反応するようである(58,59)。
アシルCoA脱水素酵素9欠損症(ACAD9)
FAD依存性のアシルCoA脱水素酵素を符号化するACAD9遺伝子の劣性突然変異が、呼吸鎖疾患であるミトコンドリア複合体I欠損症患者で見つかった(60)。ACAD9欠損は脂肪酸のβ酸化の欠陥とは関連がないため、複合体I構造におけるACAD9の役割が示唆される(61)。複合体Iは電子伝達系でNADHからコエンザイムQ10へ電子を運ぶ。複合体I欠損による酸化的リン酸化(呼吸鎖によるATP合成)の欠陥は、新生児死亡から遅発性神経変性疾患まで広範な臨床症状と関連付けられてきた。ACAD9の突然変異による複合体I欠損の症状には、筋力低下、運動不耐性、乳酸アシドーシス、脳症、および心筋症などがある。リボフラビン補給(100~300 mg/日)によって、幼少期発症性臨床形態のACAD9欠損を持つ患者の複合体I活性が高まった。筋力や運動耐性の向上も、リボフラビン補給と関連があった(62~64)。
リボフラビン輸送の欠陥に関連する疾患
SLC52A1、SLC52A3、およびSLC52A2遺伝子はそれぞれヒトのリボフラビン輸送体であるhRTF1、hRTF2、およびhRTF3を符号化する。これらの遺伝子の突然変異は、様々な発症年齢が特徴的である稀な神経変性疾患のブラウン-ビアレット-ヴァン・ラール(BVVL)症候群と関連付けられてきた。その症状には、筋緊張低下や顔面脱力を伴う球麻痺、感音性難聴、および呼吸不全などがある。BVVL症候群の臨床的記載で聴覚喪失がないものは、ファチオ・ロンド(FL)症候群として知られている。MADDの一過性の臨床的および生化学的特徴が、リボフラビン欠乏症の母親から生まれた新生児に関して記述された。hRTF1遺伝子の突然変異によって起こるこの軽症の欠乏症は、リボフラビン補給によって迅速に治療された(65,66)。BVVL/FL症候群に罹った74人の患者の報告を分析した文献の最近のレビューで、リボフラビン補給(平均用量で10 mg/kg/日)を受けた13人のうち8人が臨床的な改善を示し、治療を受けた者は生存率が100%だったことがわかった(67)。異常なプロフィールを示す患者でも、リボフラビンはフラビンとアシルカルニチン濃度を正常に回復させた。
リボフラビン反応性トリメチルアミン尿症
原発性トリメチルアミン尿症は、フラビン含有モノオキシゲナーゼ3(FMO3)と呼ばれる肝臓のフラビンタンパク質によるトリメチルアミン酸化の欠陥で起こる。FMO3欠損の者は、尿、汗、および息のトリメチルアミン濃度が高い(68)。この社会的に苦悩を与える症状は魚臭症候群として知られ、これはトリメチルアミンの持つ魚のような匂いと揮発性によるものである。FMO3遺伝子の突然変異は通常、軽度または間欠性トリメチルアミン尿症と関連がある。症状は時として、女性の月経周期の頃またはトリメチルアミンが豊富な食品の摂取の際に限られる。この症状の臨床的管理としてトリメチルアミンとその前駆体の食事制限があり、コリンの豊富な食物や海産物、およびトリメチルアミン前駆体とFMO3拮抗物質の両方を含むアブラナ科の野菜などを制限する(69)。ピリドキシン非反応性ホモシスチン尿症を患う17歳の女性患者へのリボフラビンサプリメントの使用が最近報告された(70)。この疾患は最初はベタイン(コリン誘導体)で治療されていたが、FMO3欠損症に次ぐ体臭が発生した。リボフラビン補給(200 mg/日)は、トリメチルアミンの排出とベタイン治療関連の体臭を減らした。このデータから、リボフラビンは原発性トリメチルアミン尿症患者のFMO3酵素の残存活性を最大化することに役立つかもしれないことが示唆される。
高血圧
高血圧の病因ははっきりしないが、メチレンテトラヒドロ葉酸還元酵素(MTHFR)遺伝子のC677T多型はホモシステイン濃度の主要な決定因子であり、血圧が高くなること(高血圧のマーカー)(71)や、冠動脈心疾患および血管性発作のリスク上昇(72~74)と関連付けられてきた。この遺伝子変異はMTHFRの活性低下に至るため、677TT遺伝子型の者はリボフラビン補給で恩恵を受けるかもしれない。MTHFR遺伝子型で事前選別された77人の健康な被験者による初期の無作為化二重盲検プラセボ対照試験で、リボフラビン補給(1.6 mg/日を12週間)によってMTHFR677TT遺伝子型の群ではホモシステイン濃度が下がったが、ベースライン時に正常な血漿ホモシステイン濃度だった同齢の677CCおよび677CT群はそうならなかった(75)。早発性心血管疾患(CVD)患者(事前にMTHFR677C→T多型について選別)によるその後の2つの無作為化二重盲検プラセボ対照試験で、リボフラビンで高血圧を調節する可能性が調べられた(76,77)。その結果、リボフラビン補給(1.6 mg/日を16週間)をした677TT遺伝子型の患者においてのみプラセボに比べてかなりの血圧低下が示され、これは元の試験(69)でも、同じ高リスクCVD患者のコホート(集団)を元の試験から4年後に再調査した際でもそうであった(70)。別の研究で、MTHFR677TT遺伝子型の88人の高血圧患者(ただし、明白なCVD症状はない)に対するリボフラビンの効果が調べられ、そのうちの大半は降圧療法で治療中であった。ベースライン時には、3~4種類の降圧薬を使用中でも参加者の60%は目標の血圧レベル(140/90 mm Hg以下)に到達していなかった。これらの患者へのリボフラビン補給(1.6 mg/日を16週間)に伴う血圧降下は、この遺伝子変異に関連した高血圧リスク過多がリボフラビンの状態を最適化することで克服できるかもしれないことを示した(78)。
がん
抗がん剤はしばしば、患者に用量を制限したり治療をやめさせたりするように強いるかもしれない様々な副作用を呈する。タモキシフェンで90日間治療を受けた78人の閉経後の乳がん患者にリボフラビン(10 mg/日)、ナイアシン(50 mg/日)、およびコエンザイムQ10(100 mg/日)を同時投与しての抗酸化効果が評価された。この補給によって、タモキシフェン治療に伴う酸化ストレスが効果的に防がれた(79)。リボフラビンは光増感剤としても作用することができ、この特性ががんの光線力学的療法には価値のあることかもしれない。最も効果的な抗がん剤であるシスプラチンとリボフラビンを併用する効果を評価するために、マウスのモデルが使用された。光に当てると、肝臓や腎臓でシスプラチンに誘発されたDNA損傷がリボフラビン投与によって減った(80)。これらの結果は有望であるが、リボフラビンが化学療法に対する有効的な補助療法であるのかを調べるヒトでの研究が必要である。
角膜の障害
角膜拡張は、視覚に影響する角膜の形状の歪みが特徴的な目の症状である。角膜の損傷が進行するのを制限するために専門家によって行われる新しい方法である角膜の架橋結合は、紫外線照射とともにリボフラビンの使用を伴う。架橋結合は角膜の特性を変更し、その構造を強化する(81)。
摂取源
食物の摂取源
たいていの植物性および動物性食物は、少なくとも少量のリボフラビンを含む。米国では、1943年から小麦粉とパンにリボフラビン(およびチアミン、ナイアシン、鉄)が強化されてきた。大規模な食事調査からのデータでは、平均的リボフラビン摂取量は男性で約2 mg/日、女性で約1.5 mg/日であることが示され、どちらもRDAを優に上回っている。摂取量は年配の男女の集団でも同様であった(1)。リボフラビンは光に当たると簡単に破壊される。たとえば、透明なガラス瓶の牛乳に含まれるリボフラビンの最大50%は、眩しい日光に2時間当たると破壊されることがある(7)。リボフラビン含有量が多い食物とその含有量をミリグラム(mg)で表2に示す。食物の栄養素含有量についてのより詳細な情報は、USDAの食品成分データベースを検索のこと。
サプリメント
サプリメントとして入手可能な最も一般的な形態のリボフラビンは、リボフラビンおよび5'-一リン酸リボフラビンである。リボフラビンは、マルチビタミンおよびビタミンB複合体製剤に最も一般的に見られる(82)。
安全性
毒性
ヒトでのリボフラビン高摂取による毒性または有害作用は知られていない。培養細胞による研究で、発がん物質として知られているクロム(六価)があるとDNA鎖切断のリスクがリボフラビンの過剰によって高まるかもしれないことが示されている(83)。これはクロムにさらされる労働者には懸念であるかもしれないが、ヒトでのデータはない。高用量のリボフラビン療法は尿の色を明るい黄色に強める(フラビニュリア)ことがわかっているが、これは無害の副作用である。食品栄養委員会は1998年にRDAが改定された際に、許容上限摂取量(UL)を設定しなかった(1)。
薬物相互作用
高用量の経口避妊薬(OC)を摂取している女性はリボフラビンの栄養状態が低下していると初期のいくつかの報告があった。しかし研究者が食事性リボフラビン摂取に関して調整をした際には、OC使用者と非使用者に何の差も見つからなかった(1)。向精神薬のクロルプロマジンや三環系抗うつ薬のようなフェノチアジン誘導体は、抗マラリア薬のキナクリンやがんの化学療法薬であるアドリアマイシンと同様に、FADやFMNへのリボフラビンの取り込みを阻害する(4)。抗けいれん薬のフェノバルビタールの長期使用は、肝臓の酵素によるリボフラビンの破壊を増加して欠乏症リスクを上昇させるかもしれない(3)。また、慢性的アルコール摂取はリボフラビン欠乏症と関連付けられてきた。慢性的にアルコールを与えられたラットでは、リボフラビン輸送体の阻害によってビタミンの腸での吸収と腎臓での再吸収が損なわれた(84)。
ライナス・ポーリング研究所の推奨
ほとんどの者の欠乏症を予防するはずであるリボフラビンのRDA(男性で1.3 mg/日、女性で1.1 mg/日)は、様々な食事をすることで簡単に達成できる。様々な食事をすることで、一日に1.5 mgから2 mgのリボフラビンが摂取できる。一日摂取量(DV)を100%含むマルチビタミン/ミネラルのサプリメントを摂取するというライナス・ポーリング研究所の推奨に従えば、少なくとも1.7 mg/日のリボフラビン摂取が確実になる。
年配者(50歳超)
栄養と加齢の専門家の中には、RDA(男性で1.3 mg/日、女性で1.1 mg/日)は50歳超の者にとって余裕がほとんどないと感じる者もいる(85,86)。65~90歳で独立して生活する者の研究で、ほぼ25%の者がリボフラビンの推奨摂取量未満しか摂取せず、10%は欠乏症の生化学的証拠を示していたことがわかった(87)。白内障有病率の疫学的研究で、1.6~2.2 mg/日のリボフラビン摂取で加齢による白内障の発症リスクが下がるかもしれないことが示された。また、急性虚血性脳卒中を患う年配者はリボフラビンが不足していることがわかり(88)、リボフラビン欠乏症はMTHFR677T変異を持つ閉経後の女性の骨折リスクが高いことと関連付けられている(89)。食事に適切なリボフラビンが含まれていない者、特に50歳超の者は、マルチビタミン/ミネラルのサプリメント摂取を考慮すべきで、これによって少なくとも1.7 mg /日のリボフラビンが一般的に摂れる。
Authors and Reviewers
Originally written in 2000 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in September 2002 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in June 2007 by:
Victoria J. Drake, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in July 2013 by:
Barbara Delage, Ph.D.
Linus Pauling Institute
Oregon State University
Reviewed in December 2013 by:
Helene McNulty, Ph.D., R.D.
Professor of Human Nutrition and Dietetics
Northern Ireland Centre for Food and Health (NICHE)
University of Ulster
Coleraine, United Kingdom
Reviewed in December 2013 by:
Adrian McCann, Ph.D.
Research Associate
Northern Ireland Centre for Food and Health (NICHE)
University of Ulster
Coleraine, United Kingdom
Copyright 2000-2023 Linus Pauling Institute
References
1. Food and Nutrition Board, Institute of Medicine. Riboflavin. Dietary Reference Intakes: Thiamin, Riboflavin, Niacin, Vitamin B6, Vitamin B12, Pantothenic Acid, Biotin, and Choline. Washington D.C.: National Academy Press; 1998:87-122. (National Academy Press)
2. Brody T. Nutritional Biochemistry. 2nd ed. San Diego: Academic Press; 1999.
3. McCormick DB. Riboflavin. In: Shils M, Olson JA, Shike M, Ross AC, eds. Modern Nutrition in Health and Disease. 9th ed. Baltimore: Williams & Wilkins; 1999:391-399.
4. Powers HJ. Current knowledge concerning optimum nutritional status of riboflavin, niacin and pyridoxine. Proc Nutr Soc. 1999;58(2):435-440. (PubMed)
5. Rivlin RS. Riboflavin. In: Ziegler EE, Filer LJ, eds. Present Knowledge in Nutrition. 7th ed. Washington D.C.: ILSI Press; 1996:167-173.
6. Hoey L, McNulty H, Strain JJ. Studies of biomarker responses to intervention with riboflavin: a systematic review. Am J Clin Nutr. 2009;89(6):1960S-1980S. (PubMed)
7. Bohles H. Antioxidative vitamins in prematurely and maturely born infants. Int J Vitam Nutr Res. 1997;67(5):321-328. (PubMed)
8. McCormick DB. Two interconnected B vitamins: riboflavin and pyridoxine. Physiol Rev. 1989;69(4):1170-1198. (PubMed)
9. Madigan SM, Tracey F, McNulty H, et al. Riboflavin and vitamin B-6 intakes and status and biochemical response to riboflavin supplementation in free-living elderly people. Am J Clin Nutr. 1998;68(2):389-395. (PubMed)
10. Lowik MR, van den Berg H, Kistemaker C, Brants HA, Brussaard JH. Interrelationships between riboflavin and vitamin B6 among elderly people (Dutch Nutrition Surveillance System). Int J Vitam Nutr Res. 1994;64(3):198-203. (PubMed)
11. Jacques PF, Bostom AG, Wilson PW, Rich S, Rosenberg IH, Selhub J. Determinants of plasma total homocysteine concentration in the Framingham Offspring cohort. Am J Clin Nutr. 2001;73(3):613-621. (PubMed)
12. Jacques PF, Kalmbach R, Bagley PJ, et al. The relationship between riboflavin and plasma total homocysteine in the Framingham Offspring cohort is influenced by folate status and the C677T transition in the methylenetetrahydrofolate reductase gene. J Nutr. 2002;132(2):283-288. (PubMed)
13. Powers HJ, Weaver LT, Austin S, Beresford JK. A proposed intestinal mechanism for the effect of riboflavin deficiency on iron loss in the rat. Br J Nutr. 1993;69(2):553-561. (PubMed)
14. Powers HJ, Hill MH, Mushtaq S, Dainty JR, Majsak-Newman G, Williams EA. Correcting a marginal riboflavin deficiency improves hematologic status in young women in the United Kingdom (RIBOFEM). Am J Clin Nutr. 2011;93(6):1274-1284. (PubMed)
15. Powers HJ. Riboflavin-iron interactions with particular emphasis on the gastrointestinal tract. Proc Nutr Soc. 1995;54(2):509-517. (PubMed)
16. Kalaivani K. Prevalence & consequences of anaemia in pregnancy. Indian J Med Res. 2009;130(5):627-633. (PubMed)
17. Worldwide prevalence of anaemia 1993-2005: WHO global database on anaemia. de Benoist B, McLean E, Egli I, Cogswell M, eds. 2008; World Health Organization Press. Available at: http://www.who.int/nutrition/publications/
micronutrients/anaemia_iron_deficiency/9789241596657/en/. Accessed 7/22/13.
18. Pena-Rosas JP, Viteri FE. Effects of routine oral iron supplementation with or without folic acid for women during pregnancy. Cochrane Database Syst Rev. 2006(3):CD004736. (PubMed)
19. Suprapto B, Widardo, Suhanantyo. Effect of low-dosage vitamin A and riboflavin on iron-folate supplementation in anaemic pregnant women. Asia Pac J Clin Nutr. 2002;11(4):263-267. (PubMed)
20. Ma AG, Schouten EG, Zhang FZ, et al. Retinol and riboflavin supplementation decreases the prevalence of anemia in Chinese pregnant women taking iron and folic Acid supplements. J Nutr. 2008;138(10):1946-1950. (PubMed)
21. Crombleholme WR. Obstetrics. In: Tierney LM, McPhee SJ, Papadakis MA, eds. Current Medical Treatment and Diagnosis. 37th ed. Stamford: Appleton and Lange; 1998:731-734.
22. Wacker J, Fruhauf J, Schulz M, Chiwora FM, Volz J, Becker K. Riboflavin deficiency and preeclampsia. Obstet Gynecol. 2000;96(1):38-44. (PubMed)
23. Wang XM, Wu HY, Qiu XJ. Methylenetetrahydrofolate reductase (MTHFR) gene C677T polymorphism and risk of preeclampsia: an updated meta-analysis based on 51 studies. Arch Med Res. 2013;44(3):159-168. (PubMed)
24. Xia XP, Chang WW, Cao YX. Meta-analysis of the methylenetetrahydrofolate reductase C677T polymorphism and susceptibility to pre-eclampsia. Hypertens Res. 2012;35(12):1129-1134. (PubMed)
25. Braekke K, Ueland PM, Harsem NK, Karlsen A, Blomhoff R, Staff AC. Homocysteine, cysteine, and related metabolites in maternal and fetal plasma in preeclampsia. Pediatr Res. 2007;62(3):319-324. (PubMed)
26. Neugebauer J, Zanre Y, Wacker J. Riboflavin supplementation and preeclampsia. Int J Gynaecol Obstet. 2006;93(2):136-137. (PubMed)
27. Heese P, Linnebank M, Semmler A, et al. Alterations of homocysteine serum levels during alcohol withdrawal are influenced by folate and riboflavin: results from the German Investigation on Neurobiology in Alcoholism (GINA). Alcohol Alcohol. 2012;47(5):497-500. (PubMed)
28. Soares MJ, Satyanarayana K, Bamji MS, Jacob CM, Ramana YV, Rao SS. The effect of exercise on the riboflavin status of adult men. Br J Nutr. 1993;69(2):541-551. (PubMed)
29. Ruston D, Hoare J, Henderson L, et al. The National Diet & Nutrition Survey: adults aged 19 to 64 years: Nutritional status (anthropometry and blood analytes), blood pressure and physical activity. Volume 4. London: The Stationary Office; 2004.
30. Mares-Perlman JA, Brady WE, Klein BE, et al. Diet and nuclear lens opacities. Am J Epidemiol. 1995;141(4):322-334. (PubMed)
31. Leske MC, Wu SY, Hyman L, et al. Biochemical factors in the lens opacities. Case-control study. The Lens Opacities Case-Control Study Group. Arch Ophthalmol. 1995;113(9):1113-1119. (PubMed)
32. Cumming RG, Mitchell P, Smith W. Diet and cataract: the Blue Mountains Eye Study. Ophthalmology. 2000;107(3):450-456. (PubMed)
33. Hankinson SE, Stampfer MJ, Seddon JM, et al. Nutrient intake and cataract extraction in women: a prospective study. BMJ. 1992;305(6849):335-339. (PubMed)
34. Jacques PF, Taylor A, Moeller S, et al. Long-term nutrient intake and 5-year change in nuclear lens opacities. Arch Ophthalmol. 2005;123(4):517-526. (PubMed)
35. McNulty H, Strain JJ, Pentieva K, Ward M. C(1) metabolism and CVD outcomes in older adults. Proc Nutr Soc. 2012;71(2):213-221. (PubMed)
36. Holmes MV, Newcombe P, Hubacek JA, et al. Effect modification by population dietary folate on the association between MTHFR genotype, homocysteine, and stroke risk: a meta-analysis of genetic studies and randomised trials. Lancet. 2011;378(9791):584-594. (PubMed)
37. Wilcken B, Bamforth F, Li Z, et al. Geographical and ethnic variation of the 677C>T allele of 5,10 methylenetetrahydrofolate reductase (MTHFR): findings from over 7000 newborns from 16 areas world wide. J Med Genet. 2003;40(8):619-625. (PubMed)
38. McGlynn AP, Wasson GR, O'Reilly SL, et al. Low colonocyte folate is associated with uracil misincorporation and global DNA hypomethylation in human colorectum. J Nutr. 2013;143(1):27-33. (PubMed)
39. Guenther BD, Sheppard CA, Tran P, Rozen R, Matthews RG, Ludwig ML. The structure and properties of methylenetetrahydrofolate reductase from Escherichia coli suggest how folate ameliorates human hyperhomocysteinemia. Nat Struct Biol. 1999;6(4):359-365. (PubMed)
40. Yin G, Ming H, Zheng X, Xuan Y, Liang J, Jin X. Methylenetetrahydrofolate reductase C677T gene polymorphism and colorectal cancer risk: A case-control study. Oncol Lett. 2012;4(2):365-369. (PubMed)
41. Gao S, Ding LH, Wang JW, Li CB, Wang ZY. Diet folate, DNA methylation and polymorphisms in methylenetetrahydrofolate reductase in association with the susceptibility to gastric cancer. Asian Pac J Cancer Prev. 2013;14(1):299-302. (PubMed)
42. Wen YY, Yang SJ, Zhang JX, Chen XY. Methylenetetrahydrofolate reductase genetic polymorphisms and esophageal squamous cell carcinoma susceptibility: a meta-analysis of case-control studies. Asian Pac J Cancer Prev. 2013;14(1):21-25. (PubMed)
43. Powers HJ, Hill MH, Welfare M, et al. Responses of biomarkers of folate and riboflavin status to folate and riboflavin supplementation in healthy and colorectal polyp patients (the FAB2 Study). Cancer Epidemiol Biomarkers Prev. 2007;16(10):2128-2135. (PubMed)
44. Zschabitz S, Cheng TY, Neuhouser ML, et al. B vitamin intakes and incidence of colorectal cancer: results from the Women's Health Initiative Observational Study cohort. Am J Clin Nutr. 2013;97(2):332-343. (PubMed)
45. Kennedy DA, Stern SJ, Matok I, et al. Folate Intake, MTHFR Polymorphisms, and the Risk of Colorectal Cancer: A Systematic Review and Meta-Analysis. J Cancer Epidemiol. 2012:952508. doi: 10.1155/2012/952508. (PubMed)
46. He Y, Ye L, Shan B, Song G, Meng F, Wang S. Effect of riboflavin-fortified salt nutrition intervention on esophageal squamous cell carcinoma in a high incidence area, China. Asian Pac J Cancer Prev. 2009;10(4):619-622. (PubMed)
47. Bassett JK, Hodge AM, English DR, et al. Dietary intake of B vitamins and methionine and risk of lung cancer. Eur J Clin Nutr. 2012;66(2):182-187. (PubMed)
48. Bassett JK, Baglietto L, Hodge AM, et al. Dietary intake of B vitamins and methionine and breast cancer risk. Cancer Causes Control. 2013;24(8):1555-1563. (PubMed)
49. Bassett JK, Severi G, Hodge AM, et al. Dietary intake of B vitamins and methionine and prostate cancer incidence and mortality. Cancer Causes Control. 2012;23(6):855-863. (PubMed)
50. Qiao YL, Dawsey SM, Kamangar F, et al. Total and cancer mortality after supplementation with vitamins and minerals: follow-up of the Linxian General Population Nutrition Intervention Trial. J Natl Cancer Inst. 2009;101(7):507-518. (PubMed)
51. Schoenen J, Jacquy J, Lenaerts M. Effectiveness of high-dose riboflavin in migraine prophylaxis. A randomized controlled trial. Neurology. 1998;50(2):466-470. (PubMed)
52. Sandor PS, Afra J, Ambrosini A, Schoenen J. Prophylactic treatment of migraine with β-blockers and riboflavin: differential effects on the intensity dependence of auditory evoked cortical potentials. Headache. 2000;40(1):30-35. (PubMed)
53. Boehnke C, Reuter U, Flach U, Schuh-Hofer S, Einhaupl KM, Arnold G. High-dose riboflavin treatment is efficacious in migraine prophylaxis: an open study in a tertiary care centre. Eur J Neurol. 2004;11(7):475-477. (PubMed)
54. Maizels M, Blumenfeld A, Burchette R. A combination of riboflavin, magnesium, and feverfew for migraine prophylaxis: a randomized trial. Headache. 2004;44(9):885-890. (PubMed)
55. MacLennan SC, Wade FM, Forrest KM, Ratanayake PD, Fagan E, Antony J. High-dose riboflavin for migraine prophylaxis in children: a double-blind, randomized, placebo-controlled trial. J Child Neurol. 2008;23(11):1300-1304. (PubMed)
56. Bruijn J, Duivenvoorden H, Passchier J, Locher H, Dijkstra N, Arts WF. Medium-dose riboflavin as a prophylactic agent in children with migraine: a preliminary placebo-controlled, randomised, double-blind, cross-over trial. Cephalalgia. 2010;30(12):1426-1434. (PubMed)
57. Cotelli MS, Vielmi V, Rimoldi M, et al. Riboflavin-responsive multiple acyl-CoA dehydrogenase deficiency with unknown genetic defect. Neurol Sci. 2012;33(6):1383-1387. (PubMed)
58. Olsen RK, Olpin SE, Andresen BS, et al. ETFDH mutations as a major cause of riboflavin-responsive multiple acyl-CoA dehydrogenation deficiency. Brain. 2007;130(Pt 8):2045-2054. (PubMed)
59. Liang WC, Ohkuma A, Hayashi YK, et al. ETFDH mutations, CoQ10 levels, and respiratory chain activities in patients with riboflavin-responsive multiple acyl-CoA dehydrogenase deficiency. Neuromuscul Disord. 2009;19(3):212-216. (PubMed)
60. Haack TB, Danhauser K, Haberberger B, et al. Exome sequencing identifies ACAD9 mutations as a cause of complex I deficiency. Nat Genet. 2010;42(12):1131-1134. (PubMed)
61. Nouws J, Nijtmans L, Houten SM, et al. Acyl-CoA dehydrogenase 9 is required for the biogenesis of oxidative phosphorylation complex I. Cell Metab. 2010;12(3):283-294. (PubMed)
62. Scholte HR, Busch HF, Bakker HD, Bogaard JM, Luyt-Houwen IE, Kuyt LP. Riboflavin-responsive complex I deficiency. Biochim Biophys Acta. 1995;1271(1):75-83. (PubMed)
63. Gerards M, van den Bosch BJ, Danhauser K, et al. Riboflavin-responsive oxidative phosphorylation complex I deficiency caused by defective ACAD9: new function for an old gene. Brain. 2011;134(Pt 1):210-219. (PubMed)
64. Garone C, Donati MA, Sacchini M, et al. Mitochondrial Encephalomyopathy Due to a Novel Mutation in ACAD9. JAMA Neurol. 2013:1-3. (PubMed)
65. Chiong MA, Sim KG, Carpenter K, et al. Transient multiple acyl-CoA dehydrogenation deficiency in a newborn female caused by maternal riboflavin deficiency. Mol Genet Metab. 2007;92(1-2):109-114. (PubMed)
66. Ho G, Yonezawa A, Masuda S, et al. Maternal riboflavin deficiency, resulting in transient neonatal-onset glutaric aciduria Type 2, is caused by a microdeletion in the riboflavin transporter gene GPR172B. Hum Mutat. 2011;32(1):E1976-1984. (PubMed)
67. Bosch AM, Stroek K, Abeling NG, Waterham HR, Ijlst L, Wanders RJ. The Brown-Vialetto-Van Laere and Fazio Londe syndrome revisited: natural history, genetics, treatment and future perspectives. Orphanet J Rare Dis. 2012;7:83. doi: 10.1186/1750-1172-7-83. (PubMed)
68. Mackay RJ, McEntyre CJ, Henderson C, Lever M, George PM. Trimethylaminuria: causes and diagnosis of a socially distressing condition. Clin Biochem Rev. 2011;32(1):33-43. (PubMed)
69. Phillips IR, Shephard EA. Trimethylaminuria. 2007 Oct 8 (Updated 2011 Apr 19). In: Pagon RA, Adam MP, Bird TD, et al., editors. GeneReviews™ (Internet). Seattle: University of Washington, Seattle; 1993-2013. Available at: http://www.ncbi.nlm.nih.gov/books/NBK1103/.
70. Manning NJ, Allen EK, Kirk RJ, Sharrard MJ, Smith EJ. Riboflavin-responsive trimethylaminuria in a patient with homocystinuria on betaine therapy. JIMD Rep. 2012;5:71-75. (PubMed)
71. Niu WQ, You YG, Qi Y. Strong association of methylenetetrahydrofolate reductase gene C677T polymorphism with hypertension and hypertension-in-pregnancy in Chinese: a meta-analysis. J Hum Hypertens. 2012;26(4):259-267. (PubMed)
72. Almawi WY, Khan A, Al-Othman SS, Bakhiet M. Case-control Study of methylenetetrahydrofolate reductase mutations and hyperhomocysteinemia and risk of stroke. J Stroke Cerebrovasc Dis. 2009;18(5):407-408. (PubMed)
73. Heux S, Morin F, Lea RA, Ovcaric M, Tajouri L, Griffiths LR. The methylentetrahydrofolate reductase gene variant (C677T) as a risk factor for essential hypertension in Caucasians. Hypertens Res. 2004;27(9):663-667. (PubMed)
74. Klerk M, Verhoef P, Clarke R, et al. MTHFR 677C→T polymorphism and risk of coronary heart disease: a meta-analysis. JAMA. 2002;288(16):2023-2031. (PubMed)
75. McNulty H, Dowey le RC, Strain JJ, et al. Riboflavin lowers homocysteine in individuals homozygous for the MTHFR 677C→T polymorphism. Circulation. 2006;113(1):74-80. (PubMed)
76. Horigan G, McNulty H, Ward M, Strain JJ, Purvis J, Scott JM. Riboflavin lowers blood pressure in cardiovascular disease patients homozygous for the 677C→T polymorphism in MTHFR. J Hypertens. 2010;28(3):478-486. (PubMed)
77. Wilson CP, Ward M, McNulty H, et al. Riboflavin offers a targeted strategy for managing hypertension in patients with the MTHFR 677TT genotype: a 4-y follow-up. Am J Clin Nutr. 2012;95(3):766-772. (PubMed)
78. Wilson CP, McNulty H, Ward M, et al. Blood pressure in treated hypertensive individuals with the MTHFR 677TT genotype is responsive to intervention with riboflavin: findings of a targeted randomized trial. Hypertension. 2013;61(6):1302-1308. (PubMed)
79. Yuvaraj S, Premkumar VG, Vijayasarathy K, Gangadaran SG, Sachdanandam P. Augmented antioxidant status in Tamoxifen treated postmenopausal women with breast cancer on co-administration with Coenzyme Q10, Niacin and Riboflavin. Cancer Chemother Pharmacol. 2008;61(6):933-941. (PubMed)
80. Hassan I, Chibber S, Khan AA, Naseem I. Riboflavin ameliorates cisplatin induced toxicities under photoillumination. PLoS One. 2012;7(5):e36273. (PubMed)
81. Raiskup F, Spoerl E. Corneal crosslinking with riboflavin and ultraviolet A. I. Principles. Ocul Surf. 2013;11(2):65-74. (PubMed)
82. Hendler SS, Rorvik DR, eds. PDR for Nutritional Supplements. Montvale: Medical Economics Company, Inc; 2001.
83. Sugiyama M. Role of physiological antioxidants in chromium(VI)-induced cellular injury. Free Radic Biol Med. 1992;12(5):397-407. (PubMed)
84. Subramanian VS, Subramanya SB, Ghosal A, Said HM. Chronic alcohol feeding inhibits physiological and molecular parameters of intestinal and renal riboflavin transport. Am J Physiol Cell Physiol. 2013; 305(5):C539-C546. (PubMed)
85. Russell RM, Suter PM. Vitamin requirements of elderly people: an update. Am J Clin Nutr. 1993;58(1):4-14. (PubMed)
86. Blumberg J. Nutritional needs of seniors. J Am Coll Nutr. 1997;16(6):517-523. (PubMed)
87. Lopez-Sobaler AM, Ortega RM, Quintas ME, et al. The influence of vitamin B2 intake on the activation coefficient of erythrocyte glutation reductase in the elderly. J Nutr Health Aging. 2002;6(1):60-62. (PubMed)
88. Gariballa S, Ullegaddi R. Riboflavin status in acute ischaemic stroke. Eur J Clin Nutr. 2007;61(10):1237-1240. (PubMed)
89. Yazdanpanah N, Uitterlinden AG, Zillikens MC, et al. Low dietary riboflavin but not folate predicts increased fracture risk in postmenopausal women homozygous for the MTHFR 677 T allele. J Bone Miner Res. 2008;23(1):86-94. (PubMed)
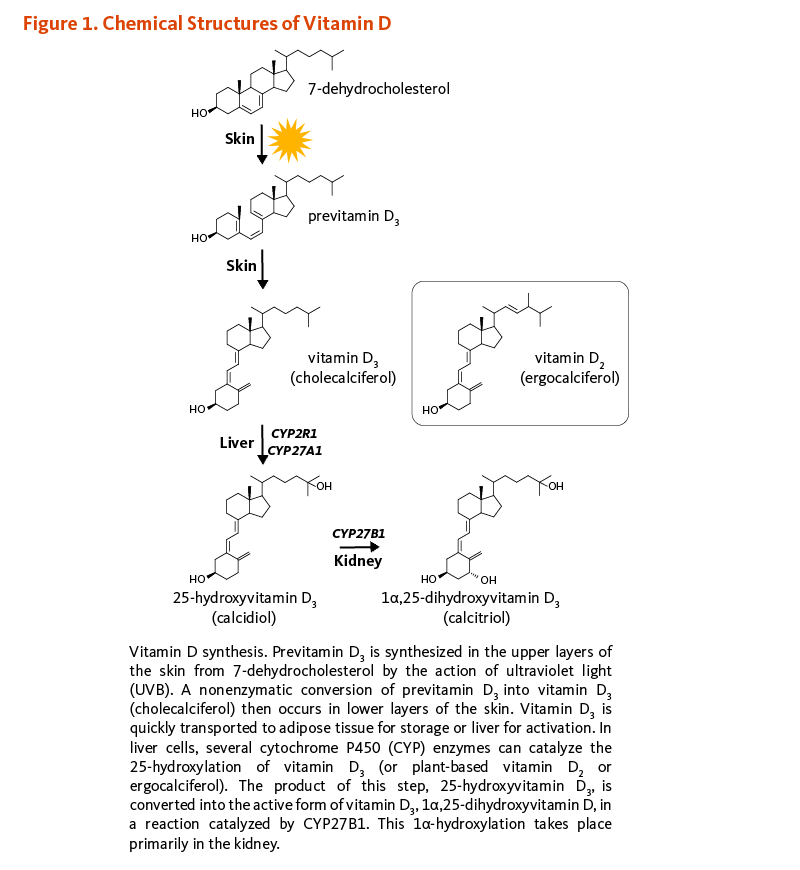
![Figure 2. Conversion to the Active Form of Vitamin D and VDR-mediated Gene Regulation. Mechanism of action. 25-hydroxyvitamin D (25(OH)D) is the main form of vitamin D in the circulation. Most 25(OH)D and 1α,25-dihydroxyvitamin D (1,25(OH)2D) molecules are transported bound to the vitamin D-binding protein and they enter cells via the megalin/tubulin complex. In kidney cells, 1α-hydroxylase (CYP27B1) catalyzes the conversion of 25(OH)D into 1,25(OH)2D. Parathyroid hormone (PTH), estradiol, and low phosphorus concentration ([P]) stimulate this reaction, whereas 1,25(OH)2D, fibroblast growth factor-23 (FGF-23), and high calcium concentration ([Ca]) inhibit it. 1,25(OH)2D enters the circulation and is transported to extra-renal target tissues where it can regulate gene expression. In the nucleus of target cells, 1,25(OH)2D binds to the vitamin D receptor (VDR), which heterodimerizes with the retinoid X receptor (RXR). VDR-RXR binds to vitamin D response elements (VDRE) in the promoter of vitamin D target genes. 25(OH)D, 25-hydroxyvitamin D; 1,25(OH)2D, 1α,25-dihydroxyvitamin D; [Ca], calcium concentration; CYP2R1, 1α-hydroxylase; DBP, vitamin D-binding protein; FGF-23, fibroblast growth factor-23; PTH, parathyroid hormone; [P], phosphorus concentration; RNA Pol II, RNA polymerase II; RXR, retinoid X receptor; VDR, vitamin D nuclear receptor; VDRE, vitamin D response element.](/sites/lpi.oregonstate.edu/files/vitamin-d-figure-2-800px.png)
![Figure 3. Regulation of Calcium and Phosphorus Homeostasis. Calcium and phosphorus homeostasis. A slight drop in blood calcium concentration ([Ca2+]) results in the secretion of parathyroid hormone (PTH) by the parathyroid glands. PTH simulates the activity of CYP27B1 (25-hydroxyvitamin D-1α-hydroxylase enzyme) that catalyzes the hydroxylation of 25-hydroxyvitamin D into 1α,25-dihydroxyvitamin D. This active form of vitamin D (i) increases the reabsorption of calcium filtered by the kidneys and stimulates phosphorus excretion, (ii) increases the intestinal absorption of both calcium and phosphorus, and (iii) mobilizes calcium (and phosphorus) from bone when dietary calcium intake is insufficient. PTH also stimulates bone resorption that releases calcium and phosphorus. 1α,25-dihydroxyvitamin D inhibits its own production, as well as PTH synthesis, via negative feedback loops. FGF-23 is secreted by bone-forming cells (osteoblasts) in response to an increase in phosphorus intake. FGF-23 inhibits the synthesis of 1α,25-dihydroxyvitamin D and promotes phosphorus excretion in the urine. [Ca2+], calcium concentration; FGF-23, fibroblast growth factor-23; PTH, parathyroid hormone.](/sites/lpi.oregonstate.edu/files/vitamin-d-figure-3-800px.png)