セレン
目次
セレンは少量で必須の微量元素であるが,全ての必須元素と同様に,高レベルでは毒性を示す。人や動物は,セレノタンパク質とも呼ばれる多数のセレン依存性酵素の機能のためにセレンを必要とする。セレンタンパク質合成時に,セレノシステインは,機能性タンパク質を生成するために,アミノ酸配列中の極めて特異的な位置に導入される。動物と異なり,植物は生存にセレンを必要としないと考えられる。しかしながら,セレンが土壌中に存在すると,植物はセレンを非特異的にイオウ含有化合物へ取り込む (1)。
機能
セレノタンパク質
少なくとも25種のセレノタンパク質が同定されているが,代謝機能が確認されているのは,それらの半分程度である (2)。
以下のセレノタンパク質について,機能が確認されている。
グルタチオンペルオキシダーゼ
5種のセレン含有グルタチオンペルオキシダーゼ(GPx)が確認されている。細胞質型または古典型GPx,血漿型または細胞外型GPx,リン脂質ヒドロペルオキシド型GPx,消化器型GPx,嗅覚器型GPxの5種である (2)。各々のGPxは異なるセレノタンパク質であるが,それらは全て,グルタチオンの酸化と自身の還元と連動して,過酸化水素や脂質過酸化物のような活性酸素種(ROS)を分解し,水やアルコールに無害化し減少させる能力がある抗酸化酵素である(図参照)。酸化的損傷から発育精子を保護し,後に成熟精子に必要な構造タンパク質を形成する抗酸化酵素である精子ミトコンドリア鞘中のセレノタンパク質は,かつては別のセレノタンパク質と考えられていたが,現在ではリン脂質ヒドロペルオキシド型GPxと考えられている (3)。
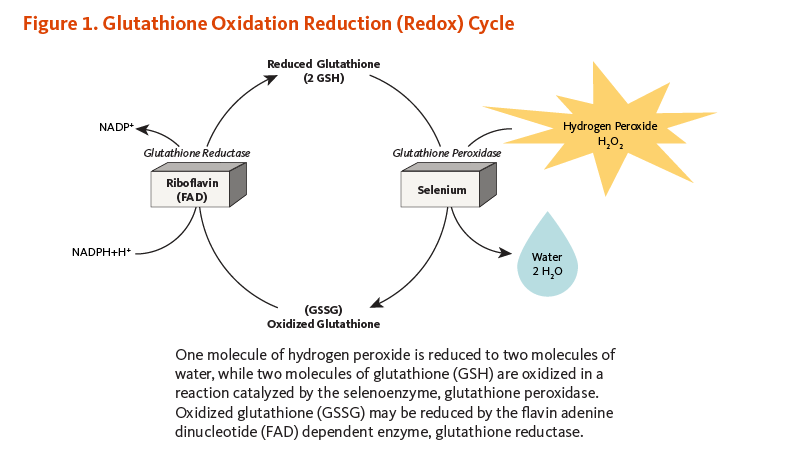
過酸化水素1分子が2分子の水へ還元され,グルタチオン(GSH)2分子が,セレノ酵素であるグルタチオンペルオキシダーゼによる触媒反応で酸化される。酸化型グルタチオンは,フラビンアデニンジヌクレオチド(FAD)依存性酵素のグルタチオン還元酵素により還元される。
チオレドキシン還元酵素
化合物チオレドキシンと協同し,チオレドキシン還元酵素は,おそらくビタミンCを含む数種の抗酸化物質の再生に関与する。チオレドキシン還元酵素により還元型チオレドキシンを維持することが,細胞の生育と生存力の制御に重要である (2,4)。
ヨードチロニン脱ヨウ素酵素(甲状腺ホルモン脱ヨウ素酵素)
甲状腺は,極少量の生物学的に活性のある甲状腺ホルモン(トリヨードチロニンまたはT3),及び多量の不活性型甲状腺ホルモン(チロキシンまたはT4)を循環器系に放出する。循環器系及び細胞内に存在する生理活性型のT3の大部分は,セレン依存性のヨードチロニン脱ヨウ素酵素による触媒反応でT4からヨウ素1原子を除去することによって生成する。3種のセレン依存性ヨードチロニン脱ヨウ素酵素(タイプI,II及びIII)は,T3,T4または他の甲状腺ホルモン代謝物に作用し,甲状腺ホルモンを活性型と不活性型の両方にすることができる。従って,セレンは,甲状腺ホルモン制御の役割があるため,正常な発生,発育及び代謝に必須の元素である (2,5)。
セレノタンパクP
セレノタンパクPは血漿中に存在し,血管内皮細胞(血管内壁に位置する細胞)とも関係している。セレノタンパク質Pの主要な機能は,セレンを輸送することと考えられる (6)。このタンパクは,活性窒素種(RNS)である過酸化亜硝酸のような化合物による損傷から内皮細胞を保護する抗酸化剤としても働く (7)。
セレノタンパクW
セレノタンパクWは筋肉中に存在する。その機能は今のところ不明であるが,筋肉の代謝に役割を持つと考えられている (8)。6種の異なる動物由来のセレノタンパクWは約80%の相同性がある (9)。セレノタンパクWの追加情報は,
セレノリン酸合成酵素
セレノシステインのセレノタンパクへの組み込みは,遺伝子コードにより指示され,セレノリン酸合成酵素を必要とする。セレノタンパク自体もセレノリン酸合成酵素で,セレノタンパク合成に必要なセレノシステイン前駆体であるリン酸一セリンの合成を触媒する (2)。
メチオニン-R-スルホキシド還元酵素
メチオニン-R-スルホキシド還元酵素は,2つの別々の試験室によってセレノタンパクR及びセレノタンパクXとして最初に同定された。しかしながら,その後の研究で,このタンパク質が,還元剤としてチオレドキシンを利用する反応において,酸化型のメチオニン残基の立体特異的な還元反応を触媒することが明らかにされた。この特異的なセレノタンパクには2つの型が存在する (2)。
15κDAセレノタンパク(Sep 15)
Sep 15は,細胞の小胞体に位置する哺乳類のタンパク質である。ここで,Sep 15は,タンパク質の折畳みを感知する酵素であるUGGT(UDP-グルコース:糖タンパク質/グルコシルトランスフェラーゼ)と結合する。Sep 15は酸化還元機能を持ち,がん予防とも関連している (2)。
セレノタンパクV
セレノタンパクVは精巣だけに発現し,精子形成に働くと考えられている (2)。
セレノタンパクS
セレノタンパクSは,小胞体から細胞基質(サイトゾル)へのタンパク質の誤った折畳みを復帰転写することに関与している。このタンパク質は,炎症反応や免疫応答にも関与している (2)。
栄養成分との相互作用
抗酸化性の栄養成分
グルタチオンペルオキシダーゼとチオレドキシン還元酵素の必須部分として,セレンは細胞の酸化還元状態に関係する栄養成分と相互作用する(すなわち,酸化促進剤/抗酸化剤バランス)。抗酸化性酵素の重要成分である他のミネラル類は,銅(スーパーオキシド・ジスムターゼとして),亜鉛(スーパーオキシド・ジスムターゼとして)及び鉄(カタラーゼとして)である。グルタチオンペルオキシダーゼとしてのセレンは,脂質酸化を抑制するビタミンE(α-トコフェロール)の活性も助けると思われる。動物実験から,セレンとビタミンEが互いを補い,セレンが酸化ストレスにおいてビタミンE欠乏から起こる障害をいくつか抑制すること示唆されている (10)。さらに,チオレドキシン還元酵素は,酸化型ビタミンCのデヒドロアスコルビン酸からのビタミンC再生を触媒し,ビタミンCの抗酸化作用を維持する (6)。
ヨウ素
セレン欠乏は,ヨウ素欠乏の影響を悪化させる。ヨウ素は甲状腺ホルモンの合成に必須であるが,ヨードチロニン脱ヨウ素酵素と呼ばれるセレノ酵素も,チロキシン(T4)から生理活性のある甲状腺ホルモンのトリヨードチロシン(T3)への変換に必要とされる。少数の高齢者におけるセレン補給が血液中のT4を減少させ,脱ヨウ素活性が高くなってT4からT3への変換率が高くなることが示唆された (1)。
欠乏症
セレンの摂取不足は,数種のチオレドキシン還元酵素や甲状腺脱ヨウ素酵素だけでなく,グルタチオンペルオキシダーゼの活性低下を引き起こす。重度の場合でも,セレン欠乏だけでは,通常は明らかな臨床症状は起こさない。しかしながら,セレン欠乏者は,さらに生理的ストレスに対する感受性が増すと考えられる (11)。
セレン欠乏症のリスクが高い人
臨床的なセレン欠乏症は,継続的にセレン添加のない完全非経口栄養(TPN)を受けている慢性疾病患者に認められている。これらの患者において,筋力低下,筋消耗,心筋症(心筋の炎症と損傷)が観察されている。TPN液は,現在そのような問題を防止するためセレンが添加されている。小腸の大部分を外科除去された人やクローン病のような重度の胃腸障害の人もまた,吸収障害によるセレン欠乏リスクがある。フェニルケトン尿症(PKU)のような代謝障害の治療に用いられる特別な医療食は,しばしばセレン含量が低い。長期間にわたりそればかりが使用される特定用途食は,セレン補給が必要かどうか判断するためにセレン含量を調査すべきである (11)。
克山病(ケシャン病,セレン欠乏による心筋症)
ケシャン病は,中国のセレン欠乏地域の若い女性と子供がかかる心筋症である。この疾病の急性症状は,心不全の突然の発症により特徴付けられ,慢性型は,中度~重度の心臓肥大を引き起こし,心不全の程度によってその症状が異なる。ケシャン病の発生率は,食事からのセレン摂取量が極めて低いことと乏しいセレンの栄養状態と密接に相関している。セレンの補給はケシャン病を発症している人の予防になるが,一度発症した心筋損傷を元に戻すことはできない (11,12)。セレン欠乏がケシャン病の病因の中の基本的因子であるとの強い証拠はあるが,その発生の季節変動や年度変動から,セレン欠乏に加えて感染病原体が関与していることが示唆される。コクサッキーウィルスは,ケシャン病患者から単離されたウィルスの一種で,セレン欠乏マウスにおける研究において,このウィルスが,心筋炎と呼ばれる心臓の炎症を起こすことが認められている。マウスの研究においても,セレン欠乏により誘発される酸化ストレスが,ウィルスゲノムの変化を起こす。そのようなゲノム変化が,比較的毒性の低いウィルス株を心筋炎誘発性の株へ変換する (13,14)。ケシャン病と診断されなくても,セレン欠乏症は,心筋に侵入し障害を起こす作用を持つさらに毒性の強いウィルス株を発生させる可能性がある。セレンとウィルス感染に関する追加情報は「疾病の予防」参照。
カシンベック病
カシンベック病は,関節間の軟骨の退化により特徴づけられ(骨関節炎),中国北部,北朝鮮及びシベリア東部の各地域における乏しいセレン状態と関係している。この疾病は,5~13歳の子供がかかる。重度の疾病症状は,関節の奇形と矮小化を起こす。ケシャン病と異なり,セレンの栄養状態を改善することがカシンベック病の予防になるとの証拠はほとんどない。そのため,カシンベック病の病因におけるセレン欠乏の役割はあまり確実ではない。穀類中のカビ毒,ヨウ素欠乏及び汚染した飲料水など,多くの他の要因がカシンベック病について提案されている (11,12)。
推奨栄養所要量(RDA)
RDAは,医薬品協会の食品栄養委員会(FNB)により2000年に改訂された。最新のRDAは,血漿中の抗酸化酵素グルタチオンペルオキシダーゼの活性を最大化するために必要な食事からのセレン量に基づいている (15)。
疾病の予防
免疫機能
セレンの欠乏は,免疫系の機能損傷と関係している (16)。さらに,明らかにセレンが欠乏していない人でのセレン補給は,免疫反応を刺激すると考えられる。2つの小規模研究において,セレンを亜セレン酸ナトリウムとして200 μg/日を8週間補給された健常者 (17,18) と免疫抑制のある人 (19) が,対照群と比較し,生体外抗原に対する免疫細胞の応答を増感することが認められた。かなり多くの基礎研究から,セレンが,免疫反応を組織化するサイトカインと呼ばれる細胞のシグナル伝達物質の発現を制御する役割を担うことが示されている (20)。
ウィルス感染
セレン欠乏は,ある種のウィルス感染症の毒性や進行を増強すると考えられる。セレン欠乏に起因する酸化ストレスの増加は,いくつかのウィルス遺伝子の突然変異や発現の変化を誘発する可能性がある。セレン欠乏マウスに,比較的無害なコクサッキーウィルス株を接種したとき,ウィルスをさらに有害化させるウィルスゲノムの突然変異を発生させ,心筋炎といわれる心筋の炎症を誘発した。一度変異すると,このウィルスは,毒性の増強が,宿主の免疫系に及ぼすセレン欠乏の効果というよりも,むしろウィルスの変化によることが確認されたことから,セレン欠乏でないマウスにも心筋炎を誘発する。細胞質型(古典型)グルタチオンペルオキシダーゼ酵素を欠損したマウス(GPx-1ノックアウトマウス)の研究から,細胞質型グルタチオンペルオキシダーゼが,以前は良性であったウィルスのゲノムにおける突然変異に起因する心筋炎に対して,保護作用を持つことが確認された。セレン欠乏症は,グルタチオンペルオキシダーゼ活性を低下させ,ウィルスゲノムの酸化的損傷と突然変異率を増加させる。数名のケシャン病患者の血液から単離されたコクサッキーウィルスは,人におけるセレン欠乏に関係する心筋症発症の補助因子であることが示唆されている (21)。
がん
動物実験
高レベルでのセレン補給が,実験動物でがん発生頻度を低減することを示す多数の証拠がある。20種の動物モデルにおける自然発生,ウィルス性及び化学物質が誘発するがんについて報告された100以上の研究のうちの2/3以上から,セレン補給が腫瘍の発生頻度を有意に低減することが認められている (22)。セレンのメチル化体が,腫瘍に対する活性化学種で,メチル化セレン化合物が,過剰のセレン摂取で多量に産生することが示されている (23)。セレン摂取量と人におけるがんとの関係,及びセレン状態と動物における腫瘍発生頻度との関係が,要約されている (24)。
疫学研究
地域的な研究では,一貫して土壌中のセレン濃度が低く,食事からのセレン摂取量が比較的低い集団において,がんによる死亡率が高いことが認められている。セレン摂取量の変動が少ない集団におけるがん発生率についての疫学研究結果はあまり一致性がないが,そのような研究からも,セレンレベル(血液及び爪)の低い人が数種のがんの発生率も高い傾向が認められている。一方,この傾向は女性ではさほど顕著ではない。例えば,米国における60,000人以上の看護婦による前向き研究で,足指爪のセレン含量と全体のがんリスクとの間に相関が認められなかった (25)。
ウィルス性肝炎と喫煙は,様々ながんリスクを増加させることが知られており,低い食事からのセレン摂取がさらにがんリスクを高めるかもしれない。ウィルス性のB型肝炎やC型肝炎の慢性的感染は,有意に肝臓癌リスクを高くする。慢性のウィルス性B型またはC型肝炎である台湾男性の研究において,低い血漿中のセレン濃度が,肝臓癌のさらに高いリスクと相関がみられ,喫煙者と血漿中のビタミンAや他のカロテノイドレベルが低い人において,セレンレベルと肝臓癌との間の逆相関が強くなった (26)。9,000人以上のフィンランド男女における前向き研究内の症例-対照研究において,後に肺癌と診断された95人の血清中セレンレベルが,対照群190人と比較された (27)。低い血清中セレンレベルは,肺癌のリスク増加と相関が認められ,その相関関係は喫煙者でより顕著であった。このフィンランド人の集団において,セレンレベルは,他の西洋諸国で通常みられるレベルのわずか約60%であった。最近の16例の研究についてのメタアナリシスから,セレンが肺癌に対する保護作用を持つことが示唆されている。この解析において,足指爪のセレン含量によってセレン曝露を評価した研究を結合させた場合,肺癌の有意なリスク減少(54%減少率)が,セレン状態と相関していた。血清中のセレンレベルによりセレン状態を評価した研究を選択的に解析したところ,有意性はないながらも肺癌リスクの低下(20%減少率)が認められた (28)。
低い食事からのセレン摂取が,前立腺癌のリスク増加と相関を示すことを報告した研究もいくつかある。米国における50,000人以上の男性医療従事者による前向き研究内の症例-対照研究において,足指爪のセレン含量と前立腺癌リスクとの間に有意な逆相関が認められた。この研究では,進行性前立腺癌と診断された181人男性と181人の対照が参加していた (29)。この研究において,足指爪のセレン含量が平均の食事セレン摂取量159 μg/日に相当する人は,足指爪のセレン含量が平均摂取量86 μg/日に相当する人と比較して,進行性の前立腺癌リスクが65%低かった。9,000人以上の日系アメリカ人男性の前向き研究の範囲内で,249人の前立腺癌症例と249人対照を試験した症例-対照研究から,血清中セレンレベル最大四分位の男性が,最小四分位の人と比べ前立腺癌発症リスクが50%低いことが認められた (30)。ある症例-対照研究では,診断前血漿中セレンレベルの最小四分位の男性が,最大四分位の男性より,前立腺癌を4~5倍高い確率で発症することが認められた (31)。724人の前立腺癌症例と対照879人を比較した症例-対照研究において,血清中のセレンレベルは前立腺癌と相関が認められなかった (32)。対照的に,現在まで最も大規模な症例-対照研究の一つから,足指爪のセレンと結腸癌リスクとの間に有意な逆相関が認められたが,足指爪のセレンと乳癌や前立腺癌のリスクの間には,相関関係が認められなかった (33)。20例の疫学研究(主に症例-対照研究)のメタアナリシスでは,血清中や足指爪中のセレン濃度が,前立腺癌の人では有意に低かった (34)。一方で,295,000人男性コホートにおける最近の前向き研究で,高頻度のマルチビタミン使用(>週7回)とセレンサプリメント使用が,ともに進行性及び致死的な前立腺癌の有意な増加と相関がみられた (35)。セレン状態が前立腺癌と関係するかどうか解明するために,明らかに,さらに多くの前向き研究と臨床試験が必要である。
人における介入試験
栄養不良の集団:セレン補給による介入試験が,ウィルス性B型肝炎と肝臓癌の高リスク地域である 中国の啓東市の5地域に住む130,471人の一般集団で実施された。この試験では,1地区の集団(20,847人)に亜セレン酸ナトリウムを添加した食卓塩を供給し,4地区の人を対照とした。8年の追跡期間中に,肝臓癌の平均発症率がセレン強化群で35%まで低下し,対照群では減少が認められなかった。同じ地域での臨床試験において,慢性のB型肝炎感染者226人に,セレン強化酵母錠剤としてセレン200 μgまたはプラセボ酵母錠剤のいずれかを毎日供給された。4年間の追跡で,対照群113人中の7人が原発性の肝臓癌を発症し,セレンを補給された113被験者の誰も肝臓癌の発症がなかった (36)。
栄養が満たされた集団:米国において,非黒色腫性(非メラノーマ性)皮膚癌病歴のある1,300人以上の高齢者による二重盲検プラセボ対照試験で,平均7.4年間セレン強化酵母を200μg/日補給したとき,男性における前立腺癌発生率の49%の減少と相関がみられた (37)。セレン補給による予防効果は,初発時の血漿中セレンと前立腺特異性抗原(PSA)のレベルが低い男性で最も高かった。驚いたことに,この研究の最新結果では,セレン補給が皮膚癌の一種(扁平上皮がん)のリスクを25%まで増加させ (38),肺癌リスクを有意に低下させない (39) ことが示唆されている。セレンの補給は前立腺癌予防に有望であることは認められているが,他のタイプのがんリスクについての効果は不明である。これらの知見を確認する必要性に対応して,セレンの前立腺癌予防における役割をさらに調査することを意図した大規模なプラセボ対照研究がいくつか,現在行われている (24,40,41)。しかしながら,前立腺癌予防における効果証拠がないことから,セレンとビタミンEの補給による大規模な無作為プラセボ対照介入研究(すなわちSELECT研究)は,現在停止している (42)。SELECT研究で5.5年追跡された後,セレン補給(200 μg/日)だけ,またはビタミンEとの共補給は,前立腺癌,肺癌または大腸癌のリスクに影響がなかった (67)。
予想されるメカニズム
セレンのがん予防作用について,数種のメカニズムが提案されている。1) 抗酸化性セレノ酵素の活性を亢進させ抗酸化状態を改善する,2) 免疫系機能を改善する,3) 発がん物質の代謝に影響を与える,4) 腫瘍細胞の生育を阻害するセレン代謝物の濃度を高める,5) アポトーシスにおけるセレン影響,6) DNA修復におけるセレンの影響,及び7) 血管新生抑制剤としてのセレン。セレンの異なる用量で異なる抗がん作用を明らかにするための2段階モデルが提案されている。栄養的または生理学的用量(成人において40~100 μg/日)において,セレンは,抗酸化性セレノ酵素の活性を最大化し,おそらくは免疫系機能を亢進し,発がん物質の代謝に影響を与える可能性がある。栄養的に過多状態または薬理的レベル(成人で200~300 μg/日)において,セレン代謝物,特にセレンメチル化物の生成も,抗発がん作用を示すかもしれない (22,23)。
心血管系疾患
理論的には,セレン酵素の活性を最適化することは,脂質過酸化を抑制しプロスタグランジンのような細胞シグナル伝達物質の代謝に影響を及ぼすことによって,心血管系疾患リスクを低下できる。しかしながら,人における前向き研究では,セレンの心血管保護作用を強く支持するものは確認されていない。ある研究で,血清中のセレンレベル45 μg/L未満の人が45 μg/L以上の人と比較して心血管系疾患による病気や死亡が有意に増加することが認められているが,同じ血清中セレンのカットオフ値を用いた別の研究では,脳卒中による死亡だけに有意差が認められた (44)。中高齢のデンマーク人男性における研究で,血清中のセレンレベル79 μg/L未満の男性で心血管系疾患リスクの増加が認められたが (45),いくつかの研究から,セレンの栄養状態と心血管系疾患リスクとの間に,明確な逆相関は認められていない (46)。ヨーロッパにおける多機関研究において,足指の爪中セレンレベルと心筋梗塞(心臓マヒ)が,セレンのレベルが最小の機関だけ相関が認められた (47)。疫学研究の中には,低レベルのセレン(米国の一般人以下)が心血管系疾患リスクを高めることを示唆するものもあるが,心血管系疾患予防におけるセレンの役割に関する決定的証拠を得るためには,管理された臨床試験が必要である。
2型糖尿病
セレン状態が2型糖尿病のリスクに影響を及ぼすかどうかを調査した研究は少ししかないが,結果は様々である。ある研究では,2型糖尿病の男性の足指の爪中セレンレベルが,糖尿病でない男性より低いことが認められた (48)。対照的に別の研究では,2型糖尿病患者における高い血清中セレンレベルが報告された (49)。栄養によるがん予防研究(Nutritional Prevention of Cancer)の試験において1,202人男女が参加した最近の無作為二重盲検プラセボ対照試験では,セレン補給(200 μg/日;平均7.7年の追跡)が,2型糖尿病の罹患率の増加と関連することが認められた (50)。セレンとビタミンEによるがん予防研究(SELECT)において,セレン補給(200 μg/日;5.5年追跡)は,2型糖尿病のリスク増加と統計的に有意ではないが相関を示した (67)。
疾病の治療
HIV/AIDS
セレンと後天性免疫不全症候群(AIDS)を起こす人の免疫不全ウィルス(HIV)との間に,特異的な相互作用があると考えられている。HIV感染者のセレンレベル低下は,栄養不良が一つの要因になるとしても,疾病の進行と重度についての感度の良いマーカーである。低レベルの血漿中セレンも,HIVによる死亡リスクの有意な増加と相関がみられている。適切なセレンの栄養状態は,T細胞と呼ばれる重要な免疫系細胞の機能亢進とサイトカインと呼ばれる細胞内メッセンジャーの産生を変化させることによって,HIV感染への抵抗性を高めるかもしれない (20,51)。HIV感染において,酸化ストレスの増加は,おそらく特異的な転写経路を活性化することによって,ウィルスの複製をしやすくすると思われる。グルタチオンペルオキシダーゼとチオレドキシン還元酵素の必須成分として,セレンは,HIV感染細胞における酸化ストレス低下に重要な役割を持ち,おそらくHIVの複製率を抑制するものと考えられる (51)。最近の研究からは,HIVが,宿主のセレンをグルタチオンペルオキシダーゼ活性のあるウィルスのセレノタンパク質へ取り込むことができることが示唆されている。これらの知見の有意性はさらに解明する必要があるが,人の免疫系とウィルスの活性が,セレンの栄養状態に影響されることを示唆している (51-53)。
HIV感染者におけるセレン補給試験は数件だけ報告がある。2つの管理されていないセレンの補給試験(一つは,セレン強化酵母400 μg/日,もう一つは亜セレン酸ナトリウム80 μg/日+ビタミンC 25 mg/日を用いている)において,自覚的な改善は報告されたが,AIDS進行に関連する生物学的パラメータにはいかなる改善も認められなかった (54)。亜セレン酸ナトリウム100 μg/日を投与された15人のHIV感染患者と無投与群22人を1年間追跡した別の試験において,酸化ストレス抑制及び免疫活性化とAIDS進行の生物学的マーカーの有意な減少に関するエビデンスが得られた。しかしながら,補給群と無補給群の患者間で,CD4 T細胞数(HIV感染進行の重要な生物学的マーカー)や死亡率に有意差はみられなかった (55,56)。186人のHIV陽性男女における無作為対照試験から,セレンを200 μg/日で2年間補給したとき,入院率が有意に減少した (57)。最近の174人のHIV-1-陽性者における無作為二重盲検プラセボ対照試験で,9ヵ月間のセレン補給(セレン強化酵母200 μg/日)が,血清中のセレン濃度増加,CD4 T細胞数の増加及びHIV-1ウィルス量の進行停止と相関が認められた (58)。
摂取源
食品からの摂取源
セレンの最も豊富な食品摂取源は肉臓と水産食品であり,ついで肉類である。一般に,植物はセレンを必要としないと考えられているため,植物や穀類のセレン含量は広く変動している。従って,セレンの植物タンパク質への取り込みは,土壌からのセレン含量だけに依存する。ブラジルのセレンが多い土壌で生育したブラジルナッツは,ナッツ一粒で100 μg以上のセレンを供給し,セレンが少ない土壌で生育したナッツ類はセレンが10倍少ない (59)。米国において,穀類は良質のセレン摂取源であるが,果実や野菜は,セレン摂取源としては相対的によくない。概して,北米では飲料水は重要なセレン摂取源ではない。米国成人における平均の食事摂取量は,約80~110 μg/日の範囲である。米国における食品流通の傾向から,土壌中のセレンが低い地域に居住する米国人は,土壌中のセレンが比較的多い地域で生産される食品を食べているため,欠乏症を免れている (11,15)。数種のセレン摂取源となる食品とそのセレン含有量(μg)を下表に示した。特定食品についての追加の栄養成分情報は,USDA food composition databaseで検索できる。
サプリメント
セレンのサプリメントは数種の形態で市販されている。亜セレン酸ナトリウムとセレン酸ナトリウムは無機態のセレンである。セレン酸塩はほぼ完全に吸収されるが,タンパク質へ取り込まれる前にかなりの量が尿中に排泄される。亜セレン酸塩は,約50%しか吸収されないが,いったん吸収されるとセレン酸塩より保持されやすい。天然に食品中に存在する有機態セレンであるセレノメチオニンは,約90%吸収される (15)。セレノメチオニンと主としてセレノメチオニンを供給するためのセレン強化酵母も,サプリメントとして市販されている。消費者は,市場に出ているセレン酵母の形態が,酵母に主に無機態セレンをプラスしているものが含まれていることを知っておく必要がある。無機態と有機態の両方のセレンが,体内でセレノシステインへ代謝されセレノ酵素に取り込まれる (60)。
セレンを強化された野菜
セレンを強化されたニンニク,ブロッコリー,タマネギ及びランプ(細長い球根と白っぽい花を持つ北米の多年生植物)は,ラットにおいて化学物質が誘発する腫瘍を抑制することが認められている (24,61,62)。セレン強化野菜は,それらが産生するある種のセレン形態(メチル化セレンなど)が,既存のサプリメント形態より腫瘍生成の阻害作用が強いため,科学者の関心が寄せられている。
安全性
毒性
セレンは,他の栄養成分と同様健康に必要であるが,高用量のセレンは毒性を示す。急性及び致死性の毒性は,グラム量のセレンを偶発的または自殺のために摂取したことにより起こされている。臨床的に重要なセレン毒性は,製造上のミスによって錠剤あたり27.3 mg(27,300 μg)のセレンを含むサプリメントを摂取した13人で報告されている。慢性のセレン毒性(セレン中毒症)は,比較的少量のセレンを長期間摂取したときに起こる可能性がある。最も多く報告されているセレン中毒の症状は,髪と爪の脆弱化と消失である。その他の症状には,胃腸障害,皮膚発疹,ニンニク口臭,倦怠感,いらいら及び神経系異常がある。セレン中毒の罹患率が高い中国のある地域において,血液中のセレン濃度が摂取量850 μg/日に相当するレベルに達する頻度が高くなると毒性影響が発生していた。医薬品協会の食品栄養委員会(FNB)は,最近,髪や爪の脆弱化と消失の予防と初期の慢性的なセレン毒性に基づいて,セレンの耐容上限摂取レベル(UL)を成人で400 μg/日と設定した (15)。成人についてのUL 400 μg/日(下表参照)は,食品に由来するセレンも含まれ,食品からのセレンは,サプリメントからのセレンと合わせ,米国成人で平均約100 μg/日である。最新のRDAとULの設定に用いられたデータについての詳細情報について,
| 年齢群 | UL (μg/日) |
|---|---|
| 乳児:0~6ヵ月 | 45 |
| 乳児;6~12ヵ月 | 60 |
| 子供;1~3歳 | 90 |
| 子供;4~8歳 | 150 |
| 子供:9~13歳 | 280 |
| 青少年;14~18歳 | 400 |
| 成人;19歳以上 | 400 |
薬物との相互作用
現在,セレンと医薬品との間の相互作用はあまりわかっていない (63)。抗てんかん治療薬のバルプロ酸が,血清中のセレンレベルを減少させることが認められている。動物実験では,亜セレン酸ナトリウムの補給が,抗菌剤のニトロフラントインと除草剤パラコートの毒性を弱めることが認められている (64)。
抗酸化性サプリメントとHMG-CoA還元酵素阻害剤(スタチン系薬剤)
冠動脈心疾患(CHD)の病歴がありHDLレベルが低い160人の患者における3年間の無作為対照試験において,シンバスタチン(Zocor)とナイアシンの併用がHDL2レベルを増加させ,冠状動脈狭窄(狭小化)の進行を抑制し,心筋梗塞(心臓マヒ)や脳卒中などの心血管系症例の発生頻度を減少させることが認められた (65)。驚くべきことに,抗酸化剤混合剤(ビタミンC 1,000 mg,α-トコフェロール 800 IU,セレン100 μg及びβ-カロテン 25 mgを毎日)をシバスタチン-ナイアシン混合剤とともに服用すると,予防効果がなくなった。セレンのこの効果への個別寄与は判断できないが,これらの結果は,抗酸化サプリメントとHMG-CoA還元酵素阻害剤(スタチン類)などのコレステロール降下薬との間の潜在的な相互作用について,追加研究が必要であることを強調している。
ライナスポーリング研究所の推奨
平均的な米国人食事は,現行RDA(55 μg/日)を十分超える量である約100 μg/日のセレンを供給していると推定され,血漿中および細胞内のグルタチオンペルオキシダーゼ活性を最大化するために十分と考えられる。マルチビタミン/マルチミネラル・サプリメント中のセレン量はかなり様々であるが,まれに,一日栄養所要量(DV)の70 μg以上を供給するマルチビタミン/マルチミネラル・サプリメントもある。様々な食事を摂り,毎日マルチビタミン・サプリメントを摂取することが,米国の大部分の人々にとって十分なセレンを供給することになる。
男性
栄養状態の良好な集団におけるセレン補給ががんリスクに及ぼす効果を試験した,管理された研究から,200 μg/日のセレン補給が,男性における前立腺癌のリスクを49%まで有意に低減させることが認められている (37)。一方,皮膚癌の一種のリスクは25%まで増加した (38)。前立腺癌による死亡率は,皮膚の扁平上皮癌による死亡率よりかなり高いが,これらの知見から,セレン補給ががんリスクに及ぼす全体的な影響は,いまだセレンサプリメントの追加補給の一般的推奨を支持するには十分クリアではない。より最近の,かなり大規模な無作為プラセボ対照介入試験,SELECT研究において,200 μg/日のセレンは,前立腺癌リスクに変化を与えなかった (67)。前立腺癌リスク低減のためにセレンを補給する男性は,200 μg/日を超過しないようすべきであり,扁平上皮癌リスクを低減するために,日焼け止めや長い間の日光曝露を避けるなどの注意を払う必要がある。
女性
セレン補給が,セレン欠乏症ではない女性でのがんリスクを低減するというエビデンスはないため,女性が余分にセレンサプリメントを摂る理由はない。しかしながら,動物実験からは,乳房腫瘍がセレンによって有意に低減されることが示唆され (66),現在進行中の2つの人による試験が,女性におけるこの相関関係についてのより決定的な情報を提供するはずである (24)。
高齢者(65歳以上)
加齢はセレンの必要量における有意な変化とは相関がないため,Linus Pauling Instituteのセレンに関する推奨は,高齢の男女でも同じである。
Authors and Reviewers
Written in October 2003 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in November 2007 by:
Victoria J. Drake, Ph.D.
Linus Pauling Institute
Oregon State University
Reviewed in November 2007 by:
Philip D. Whanger, Ph.D.
Professor, Emeritus Dept. of Environmental and Molecular Toxicology
Oregon State University
Last updated 1/22/09 Copyright 2001-2024 Linus Pauling Institute
References
1. Rayman MP. The importance of selenium to human health. Lancet. 2000;356(9225):233-241. (PubMed)
2. Gladyshev VN. Selenoproteins and selenoproteomes. In: Hatfield DL, Berry MJ, Gladyshev VN, eds. Selenium: Its molecular biology and role in human health. 2nd ed. New York: Springer; 2006:99-114.
3. Ursini F, Heim S, Kiess M, et al. Dual function of the selenoprotein PHGPx during sperm maturation. Science. 1999;285(5432):1393-1396. (PubMed)
4. Mustacich D, Powis G. Thioredoxin reductase. Biochem J. 2000;346 Pt 1:1-8. (PubMed)
5. Bianco AC, Larsen PR. Selenium, deiodinases and endocrine function. In: Hatfield DL, Berry MJ, Gladyshev VN, eds. Selenium: Its Molecular Biology and Role in Human Health. 2nd ed. New York: Springer; 2006:207-219.
6. Burk RF, Olson GE, Hill KE. Deletion of selenoprotein P gene in the mouse. In: Hatfield DL, Berry MJ, Gladyshev VN, eds. Selenium: Its Molecular Biology and Role in Human Health. 2nd ed. New York: Springer; 2006:111-122.
8. Kioussi C, Whanger PD. Selenoprotein W in development and oxidative stress. In: Hatfield DL, Berry MJ, Gladyshev VN, eds. Selenium: Its Molecular Biology and Role in Human Health. 2nd ed. New York: Springer; 2006:135-140.
9. Gu QP, Beilstein MA, Vendeland SC, Lugade A, Ream W, Whanger PD. Conserved features of selenocysteine insertion sequence (SECIS) elements in selenoprotein W cDNAs from five species. Gene. 1997;193(2):187-196.
12. Foster LH, Sumar S. Selenium in health and disease: a review. Crit Rev Food Sci Nutr. 1997;37(3):211-228. (PubMed)
13. Levander OA. Coxsackievirus as a model of viral evolution driven by dietary oxidative stress. Nutr Rev. 2000;58(2 Pt 2):S17-24.
14. Beck MA, Esworthy RS, Ho YS, Chu FF. Glutathione peroxidase protects mice from viral-induced myocarditis. Faseb J. 1998;12(12):1143-1149. (PubMed)
15. Food and Nutrition Board, Institute of Medicine. Selenium. Dietary reference intakes for vitamin C, vitamin E, selenium, and carotenoids. Washington D.C.: National Academy Press; 2000:284-324. (National Academy Press)
16. McKenzie RC, Beckett GJ, Arthur JR. Effects of selenium on immunity and aging. In: Hatfield DL, Berry MJ, Gladyshev VN, eds. Selenium: Its Molecular Biology and Role in Human Health. 2nd ed. New York: Springer; 2006:311-323.
17. Roy M, Kiremidjian-Schumacher L, Wishe HI, Cohen MW, Stotzky G. Supplementation with selenium and human immune cell functions. I. Effect on lymphocyte proliferation and interleukin 2 receptor expression. Biol Trace Elem Res. 1994;41(1-2):103-114. (PubMed)
18. Kiremidjian-Schumacher L, Roy M, Wishe HI, Cohen MW, Stotzky G. Supplementation with selenium and human immune cell functions. II. Effect on cytotoxic lymphocytes and natural killer cells. Biol Trace Elem Res. 1994;41(1-2):115-127. (PubMed)
19. Kiremidjian-Schumacher L, Roy M, Glickman R, et al. Selenium and immunocompetence in patients with head and neck cancer. Biol Trace Elem Res. 2000;73(2):97-111. (PubMed)
20. Baum MK, Miguez-Burbano MJ, Campa A, Shor-Posner G. Selenium and interleukins in persons infected with human immunodeficiency virus type 1. J Infect Dis. 2000;182 Suppl 1:S69-73. (PubMed)
21. Beck MA. Selenium and viral infections. In: Hatfield DL, Berry MJ, Gladyshev VN, eds. Selenium: Its Molecular Biology and Role in Human Health. 2nd ed. New York: Springer; 2006:287-298.
22. Combs GF, Jr., Gray WP. Chemopreventive agents: selenium. Pharmacol Ther. 1998;79(3):179-192. (PubMed)
23. Ip C. Lessons from basic research in selenium and cancer prevention. J Nutr. 1998;128(11):1845-1854. (PubMed)
24. Whanger PD. Selenium and its relationship to cancer: an update. Br J Nutr. 2004;91(1):11-28. (PubMed)
26. Yu MW, Horng IS, Hsu KH, Chiang YC, Liaw YF, Chen CJ. Plasma selenium levels and risk of hepatocellular carcinoma among men with chronic hepatitis virus infection. Am J Epidemiol. 1999;150(4):367-374. (PubMed)
27. Knekt P, Marniemi J, Teppo L, Heliovaara M, Aromaa A. Is low selenium status a risk factor for lung cancer? Am J Epidemiol. 1998;148(10):975-982. (PubMed)
28. Zhuo H, Smith AH, Steinmaus C. Selenium and lung cancer: a quantitative analysis of heterogeneity in the current epidemiological literature. Cancer Epidemiol Biomarkers Prev. 2004;13(5):771-778. (PubMed)
29. Yoshizawa K, Willett WC, Morris SJ, et al. Study of prediagnostic selenium level in toenails and the risk of advanced prostate cancer. J Natl Cancer Inst. 1998;90(16):1219-1224. (PubMed)
30. Nomura AM, Lee J, Stemmermann GN, Combs GF, Jr. Serum selenium and subsequent risk of prostate cancer. Cancer Epidemiol Biomarkers Prev. 2000;9(9):883-887. (PubMed)
31. Brooks JD, Metter EJ, Chan DW, et al. Plasma selenium level before diagnosis and the risk of prostate cancer development. J Urol. 2001;166(6):2034-2038. (PubMed)
32. Peters U, Foster CB, Chatterjee N, et al. Serum selenium and risk of prostate cancer-a nested case-control study. Am J Clin Nutr. 2007;85(1):209-217. (PubMed)
33. Ghadirian P, Maisonneuve P, Perret C, et al. A case-control study of toenail selenium and cancer of the breast, colon, and prostate. Cancer Detect Prev. 2000;24(4):305-313. (PubMed)
34. Brinkman M, Reulen RC, Kellen E, Buntinx F, Zeegers MP. Are men with low selenium levels at increased risk of prostate cancer? Eur J Cancer. 2006;42(15):2463-2471. (PubMed)
35. Lawson KA, Wright ME, Subar A, et al. Multivitamin use and risk of prostate cancer in the National Institutes of Health-AARP Diet and Health Study. J Natl Cancer Inst. 2007;99(10):754-764. (PubMed)
36. Yu SY, Zhu YJ, Li WG. Protective role of selenium against hepatitis B virus and primary liver cancer in Qidong. Biol Trace Elem Res. 1997;56(1):117-124. (PubMed)
37. Duffield-Lillico AJ, Dalkin BL, Reid ME, et al. Selenium supplementation, baseline plasma selenium status and incidence of prostate cancer: an analysis of the complete treatment period of the Nutritional Prevention of Cancer Trial. BJU Int. 2003;91(7):608-612. (PubMed)
38. Duffield-Lillico AJ, Slate EH, Reid ME, et al. Selenium supplementation and secondary prevention of nonmelanoma skin cancer in a randomized trial. J Natl Cancer Inst. 2003;95(19):1477-1481. (PubMed)
39. Reid ME, Duffield-Lillico AJ, Garland L, Turnbull BW, Clark LC, Marshall JR. Selenium supplementation and lung cancer incidence: an update of the nutritional prevention of cancer trial. Cancer Epidemiol Biomarkers Prev. 2002;11(11):1285-1291. (PubMed)
40. Klein EA, Thompson IM, Lippman SM, et al. SELECT: the Selenium and Vitamin E Cancer Prevention Trial: rationale and design. Prostate Cancer Prostatic Dis. 2000;3(3):145-151. (PubMed)
41. Clark LC, Marshall JR. Randomized, controlled chemoprevention trials in populations at very high risk for prostate cancer: Elevated prostate-specific antigen and high-grade prostatic intraepithelial neoplasia. Urology. 2001;57(4 Suppl 1):185-187. (PubMed)
42. National Cancer Institute. Review of Prostate Cancer Prevention Study Shows No Benefit for Use of Selenium and Vitamin E Supplements. [Web page]. http://www.cancer.gov/newscenter/pressreleases/SELECTresults2008. Accessed 10/28/08.
43. Salonen JT, Alfthan G, Huttunen JK, Pikkarainen J, Puska P. Association between cardiovascular death and myocardial infarction and serum selenium in a matched-pair longitudinal study. Lancet. 1982;2(8291):175-179. (PubMed)
44. Virtamo J, Valkeila E, Alfthan G, Punsar S, Huttunen JK, Karvonen MJ. Serum selenium and the risk of coronary heart disease and stroke. Am J Epidemiol. 1985;122(2):276-282. (PubMed)
45. Suadicani P, Hein HO, Gyntelberg F. Serum selenium concentration and risk of ischaemic heart disease in a prospective cohort study of 3000 males. Atherosclerosis. 1992;96(1):33-42. (PubMed)
46. Salvini S, Hennekens CH, Morris JS, Willett WC, Stampfer MJ. Plasma levels of the antioxidant selenium and risk of myocardial infarction among U.S. physicians. Am J Cardiol. 1995;76(17):1218-1221. (PubMed)
47. Kardinaal AF, Kok FJ, Kohlmeier L, et al. Association between toenail selenium and risk of acute myocardial infarction in European men. The EURAMIC Study. European Antioxidant Myocardial Infarction and Breast Cancer. Am J Epidemiol. 1997;145(4):373-379. (PubMed)
48. Rajpathak S, Rimm E, Morris JS, Hu F. Toenail selenium and cardiovascular disease in men with diabetes. J Am Coll Nutr. 2005;24(4):250-256. (PubMed)
49. Bleys J, Navas-Acien A, Guallar E. Serum selenium and diabetes in U.S. adults. Diabetes Care. 2007;30(4):829-834. (PubMed)
50. Stranges S, Marshall JR, Natarajan R, et al. Effects of Long-Term Selenium Supplementation on the Incidence of Type 2 Diabetes: A Randomized Trial. Ann Intern Med. 2007;147(4):217-223. (PubMed)
51. Baum MK, Campa A. Role of selenium in HIV/AIDS. In: Hatfield DL, Berry MJ, Gladyshev VN, eds. Selenium: Its Molecular Biology and Role in Human Health. 2nd ed. New York: Springer; 2006:299-310.
52. Zhao L, Cox AG, Ruzicka JA, Bhat AA, Zhang W, Taylor EW. Molecular modeling and in vitro activity of an HIV-1-encoded glutathione peroxidase. Proc Natl Acad Sci U S A. 2000;97(12):6356-6361. (PubMed)
53. Zhang W, Ramanathan CS, Nadimpalli RG, Bhat AA, Cox AG, Taylor EW. Selenium-dependent glutathione peroxidase modules encoded by RNA viruses. Biol Trace Elem Res. 1999;70(2):97-116. (PubMed)
54. Constans J, Conri C, Sergeant C. Selenium and HIV infection. Nutrition. 1999;15(9):719-720.
55. Delmas-Beauvieux MC, Peuchant E, Couchouron A, et al. The enzymatic antioxidant system in blood and glutathione status in human immunodeficiency virus (HIV)-infected patients: effects of supplementation with selenium or beta-carotene. Am J Clin Nutr. 1996;64(1):101-107. (PubMed)
56. Constans J, Delmas-Beauvieux MC, Sergeant C, et al. One-year antioxidant supplementation with beta-carotene or selenium for patients infected with human immunodeficiency virus: a pilot study. Clin Infect Dis. 1996;23(3):654-656.
57. Burbano X, Miguez-Burbano MJ, McCollister K, et al. Impact of a selenium chemoprevention clinical trial on hospital admissions of HIV-infected participants. HIV Clin Trials. 2002;3(6):483-491. (PubMed)
58. Hurwitz BE, Klaus JR, Llabre MM, et al. Suppression of human immunodeficiency virus type 1 viral load with selenium supplementation: a randomized controlled trial. Arch Intern Med. 2007;167(2):148-154. (PubMed)
59. Chang JC. Selenium content of brazil nuts from two geographic locations in Brazil. Chemosphere. 1995;30:801-802.
60. Schrauzer GN. Selenomethionine: a review of its nutritional significance, metabolism and toxicity. J Nutr. 2000;130(7):1653-1656. (PubMed)
61. Whanger PD, Ip C, Polan CE, Uden PC, Welbaum G. Tumorigenesis, metabolism, speciation, bioavailability, and tissue deposition of selenium in selenium-enriched ramps (Allium tricoccum). J Agric Food Chem. 2000;48(11):5723-5730. (PubMed)
62. Ip C, Birringer M, Block E, et al. Chemical speciation influences comparative activity of selenium-enriched garlic and yeast in mammary cancer prevention. J Agric Food Chem. 2000;48(6):2062-2070. (PubMed)
63. Azrak RG, Cao S, Pendyala L, et al. Efficacy of increasing the therapeutic index of irinotecan, plasma and tissue selenium concentrations is methylselenocysteine dose dependent. Biochem Pharmacol. 2007;73(9):1280-1287. (PubMed)
65. Brown BG, Zhao XQ, Chait A, et al. Simvastatin and niacin, antioxidant vitamins, or the combination for the prevention of coronary disease. N Engl J Med. 2001;345(22):1583-1592. (PubMed)
66. Ip C, Ganther HE. Novel stategies in selenium cancer chemoprevention research. In: Burk RF, ed. Selenium in biology and human health. New York: Springer-Verlag; 1994:169-180.
67. Lippman SM, Klein EA, Goodman PJ, et al. Effect of selenium and vitamin E on risk of prostate cancer and other cancers: the Selenium and Vitamin E Cancer Prevention Trial (SELECT). JAMA. 2009;301(1):39-51. (PubMed)