コエンザイムQ10
要約
- コエンザイムQ10は主に体内で合成される脂溶性の化合物で、食事からも摂取される。
- コエンザイムQ10はミトコンドリアでのATP合成に必要で、細胞膜やリポタンパク質で抗酸化物質として機能する。(詳細はこちら)
- 健康な個人では欠乏症を予防するのに充分なコエンザイムQ10が体内合成と食事からの摂取で供給されるようであるが、組織でのコエンザイムQ10濃度は加齢とともに減少する。(詳細はこちら)
- 血漿、リポタンパク質、および血管内のコエンザイムQ10濃度はコエンザイムQ10の経口補給で上昇するが、組織での濃度が上がるのかどうかは不明であり、健康な個人では特にそうである。(詳細はこちら)
- コエンザイムQ10の補給で、遺伝性のミトコンドリア性障害のある何人かの患者に臨床的および代謝的改善があった。(詳細はこちら)
- コエンザイムQ10の補給は、うっ血性心不全に対する従来の医学的療法への有益な補足療法であるかもしれないが、さらなる研究が必要である。(詳細はこちら)
- 心血管疾患、神経変性疾患、がん、および糖尿病にコエンザイムQ10の補給が果たす役割について、さらに研究が必要である。(詳細はこちら)
- コエンザイムQ10補給は、運動能力を向上させるわけではないようである。(詳細はこちら)
- コエンザイムQ10のサプリメントは比較的安全であるが、ワルファリンの抗凝固剤としての効能を低減させるかもしれない。(詳細はこちら)
- HMG-CoA還元酵素阻害剤として知られるコレステロール低下剤(スタチン)の使用は血液循環中のコエンザイムQ10濃度を下げるが、これらの薬物を服用している患者にコエンザイムQ10補給が健康上の利益をもたらすかどうかは不明である。(詳細はこちら)
序説
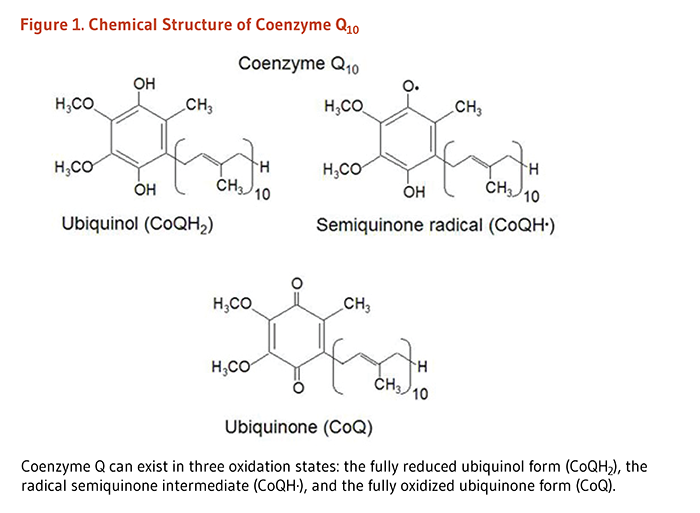
コエンザイムQ10はユビキノン族の化合物の1つである。ヒトを含むすべての動物は、ユビキノンを合成することができる。したがって、コエンザイムQ10はビタミンとは考えられていない(1)。ユビキノンという名称は、これらの化合物が生物に偏在し(ユビキタス)、その化学構造にベンゾキノンとして知られる官能基を含むことに由来する。ユビキノンは、1~12までのイソプレン(炭素5個)単位を持つ脂溶性分子である。ヒトに見られるユビキノンであるユビデカレノン、別名コエンザイムQ10は、ベンゾキノンの「頭部」に10のイソプレン単位(全部で炭素原子50個)から成る「尾部」が付いている(図1参照)(2)。
生物活性
コエンザイムQ10は脂質(脂肪)に溶け、実質的にすべての細胞膜とリポタンパク質に見られる(2)。コエンザイムQ10のベンゾキノン頭部基が持つ電子を受け入れたり渡したりする性質は、その生化学的機能における重要な特性である。コエンザイムQ10は3つの酸化状態で存在する(上記の図1参照)。それらは(1)完全に還元されたユビキノールの形態(CoQ10H2)、(2)セミキノンラジカル中間体(CoQ10H・)、および(3)完全に酸化されたユビキノンの形態(CoQ10)である。
ミトコンドリアでのATP合成
細胞で使用されるエネルギー形態であるアデノシン三リン酸(ATP)への炭水化物や脂肪からのエネルギー変換では、ミトコンドリア内膜にコエンザイムQが必要である。ミトコンドリアでの電子伝達系の一部として、コエンザイムQは脂肪酸およびブドウ糖の代謝で発生する還元当量の電子を受け取り、それらを電子受容体に渡す。同時にコエンザイムQはミトコンドリア内膜の外にあるプロトン(陽子)を輸送し、膜をはさんでプロトン濃度勾配を発生させる。プロトンがミトコンドリア内部に流れ戻る際に放出されるエネルギーが、ATPを生成するのに使用される(2)。
リソソームでの機能
リソソームは、細胞残屑の消化に特化した細胞小器官である。リソソーム内の消化酵素は、酸性のpHで最適に機能する。このことは、酵素がプロトンの供給を永続的に受ける必要があることを意味する。これらの消化酵素と細胞の残りの部分を隔てるリソソーム膜は、コエンザイムQ10濃度が比較的高い。最適なpHを維持するために、コエンザイムQ10がリソソーム膜を挟んでのプロトンの伝達に重要な役割を果たしていることが、研究から示唆される(2,3)。
抗酸化機能
還元された形態であるCoQ10H2は、効果的な脂溶性抗酸化物質である。細胞膜にかなりの量のCoQ10H2があって、酸化されたCoQ10をCoQ10H2に還元できる酵素がともにあることから、CoQ10H2が細胞の重要な抗酸化物質であるという考えが裏付けられる(2)。細胞膜と低密度リポタンパク質(LDL)が体外(ex vivo)で酸化条件にさらされると、CoQ10H2は脂質の過酸化を抑制することがわかっている。LDLが体外で酸化されると、CoQ10H2は真っ先に消費される抗酸化物質である。また、CoQ10H2があると、酸化された脂質の生成やαトコフェロール(α-TOH。生物学的に最も活性のあるビタミンEの形態)の消費が抑えられる(4)。独立したミトコンドリアでは、脂質の過酸化に伴う酸化ダメージからコエンザイムQ10が膜のタンパク質とDNAを守ることができる(1)。フリーラジカルを直接中和できることに加えて、CoQ10H2はα-TOHの一電子酸化体であるαトコフェロキシルラジカル(α-TO・)からα-TOHを生成することができる。
栄養素との相互作用
ビタミンE
αトコフェロール(ビタミンE)とコエンザイムQ10は、細胞膜とリポタンパク質における主要な脂溶性抗酸化物質である。α-TOHが脂質ペルオキシルラジカル(LOO・)などのフリーラジカルを中和する際に、それ自体が酸化されてα-TO・を生成し、これは試験管中では特定の条件下でリポタンパク質の脂質の酸化を促進できる。コエンザイムQ10の還元された形態(CoQ10H2)がα-TO・と反応すると、α-TOHが再生成され、セミキノンラジカル(CoQ10H・)が作られる。CoQ10H・は酸素(O2)と反応してスーパーオキシドアニオンラジカル(O2・-)を生成することができ、これはLOO・よりもずっと酸化力の弱いラジカルである。しかし、CoQ10H・はα-TO・をα-TOHに還元することもでき、その結果完全に酸化されたコエンザイムQ10(CoQ10)が生成され、これは酸素(O2)と反応してO2・-を作ることはない(図2参照)(4,5)。

欠乏症
コエンザイムQ10欠乏症の症状は一般に報告されていない。したがって健康な個人には充分なコエンザイムQ10が正常な生合成や多様な食事で供給されていると一般的に考えられている(6)。食事からの摂取は血漿のコエンザイムQ10の約25%を占めると推定されるが、コエンザイムQ10の食事からの摂取量の推奨は、米国医学研究所やその他の機関から現在特になされていない(7)。食事からの摂取が組織でのコエンザイムQ10の濃度にどの程度寄与しているかは明らかでない。
原発性(先天性)のコエンザイムQ10欠乏症は、コエンザイムQ10の生合成における遺伝子的欠陥によっておきるまれな常染色体劣性疾患である。結果としてコエンザイムQ10が組織で低濃度になることが、神経および筋肉の機能をひどく損なう。経口でのコエンザイムQ10補給は、原発性コエンザイムQ10欠乏症患者の神経症状および筋肉の症状を改善させることもあることが示されてきた(8)。いくつかの異なる組織で加齢によって次第にコエンザイムQ10の濃度が減ることがわかっているが(1,9)、この加齢に伴う低下が欠乏症をおこすのかどうかは不明である(「疾病予防」の項参照)。血漿でのコエンザイムQ10の濃度低下は、糖尿病、がん、およびうっ血性心不全の者にも見られる(「疾病治療」の項参照)。コレステロールとコエンザイムQ10の生合成にともに重要な酵素であるHMG-CoA還元酵素の活性を抑制する脂質低下剤は血漿でのコエンザイムQ10濃度を低下させる(「薬物相互作用」の項のHMG-CoA還元酵素抑制剤(スタチン)の箇所を参照)が、これが臨床的または症状的な意味があるのかどうかは不明なままである。
疾病予防
老化
老化のミトコンドリア・フリーラジカル説によれば、老化に伴う機能低下に活性酸素種(ROS)による細胞構造への酸化ダメージが重要な役割を果たしている(10)。ROSはミトコンドリアでATP生成の際の副産物として作られる。抗酸化物質で中和されないと、ROSは時間がたつにつれてミトコンドリアを損ない、それらの機能を非効率的にしたり、尽きることのないサイクルでより損傷性の強いROSを生成したりする可能性がある。コエンザイムQ10はミトコンドリアでのATPの合成に重要な役割を果たし、ミトコンドリア膜で抗酸化物質として機能する。さらに、コエンザイムQ10の組織での濃度は老化とともに減少することが報告されている(9)。老化の顕著な特徴の一つは多くの組織でのエネルギー代謝の減少であり、肝臓、心臓、および骨格筋では特にそうである。組織でのコエンザイムQ10濃度が老化で減少することが、この代謝減少に関わっているのではないかと提唱されている(11)。最近の研究では、生涯に渡って食べ物からコエンザイムQ10を補給するとコエンザイムQ10の組織での濃度が増えたが、ネズミの寿命が延びることはなかった(12,13)。しかしながら、ある研究ではコエンザイムQ10補給で加齢によるDNA損傷の増え方がゆるくなった(14)。現在では、コエンザイムQ10補給がヒトの寿命を延ばしたり老化による機能低下を防いだりするという科学的根拠はない。
心血管疾患
動脈壁での低密度リポタンパク質(LDL)の酸化修飾は、アテローム性動脈硬化症の発症に至る初期の事象を表すと考えられている。還元された形態のコエンザイムQ10(CoQ10H2)は、試験管内(in vitro)でLDLの酸化を抑制し、α-TO・をα-TOHに還元してα-TOHとともにLDLの酸化を阻害する。CoQ10H2(またはビタミンC)のような共に働く酸化防止剤がないと、α-TOHは特定の条件下では試験管内でLDLの酸化を促進することがある(4)。コエンザイムQ10を補給すると、ヒトのLDL中でのCoQ10H2の濃度が高まる(15)。アテローム性動脈硬化症の動物モデルであるアポリポタンパク質E欠乏症のマウスの研究で、薬理学的用量を超える量のコエンザイムQ10補給をしたら、アテローム性動脈硬化症の病変の発生が大きく抑制されたことがわかった(16)。興味深いことに、これらのマウスにα-TOHとコエンザイムQ10を同時に補給すると、α-TOHまたはコエンザイムQ10単独での補給よりもアテローム性動脈硬化症の抑制にさらに効果的であった(17)。アテローム性動脈硬化症発症の別の重要なステップは、血管壁に単球という免疫細胞が集まることである。これは細胞接着分子(インテグリン)の単球での発現に一部依存する。10人の健康な男女に200mg/日のコエンザイムQ10を10週間補給したら、インテグリンの単球での発現が大きく減った。このことは、コエンザイムQ10によるアテローム性動脈硬化症の抑制に別のメカニズムがある可能性を示唆する(18)。コエンザイムQ10の補給がLDLの酸化やアテローム性動脈硬化症の抑制剤として有望であるようだが、コエンザイムQ10補給がヒトのアテローム性動脈硬化症の発症や進行を抑制することができるかどうかを決定するさらなる研究が必要である。
疾病治療
ミトコンドリア脳筋症
ミトコンドリア脳筋症は、ミトコンドリアの電子伝達系の機能における多くの遺伝的異常による多様な遺伝性疾患群である。コエンザイムQ10補給は、様々なタイプのミトコンドリア脳筋症の何人かの患者に臨床的および代謝的改善をもたらした(19)。神経筋や広範な組織でのコエンザイムQ10の欠乏症は、ミトコンドリア脳筋症の人々のうちの非常に小さな集団に見られる(20,21)。コエンザイムQ10の生合成に遺伝的欠陥のあるこれらの稀な集団には、コエンザイムQ10の補給によって実質的な改善がもたらされた(22,23)。コエンザイムQ10補給がその他のミトコンドリア疾患のある患者に治療上の有益性があるのかどうかは不明である。この問題を調べる第Ⅲ相の臨床試験が現在進行中である(23)。
心血管疾患
うっ血性心不全
体全体の需要に合う十分な血液を送り出す心臓の能力に障害がある状態は、うっ血性心不全として知られる。冠動脈疾患では、冠動脈にアテローム性動脈硬化症のプラークが溜まると、心筋の一部が適切な血液供給を受けることができず、心臓障害や血液供給能力障害となる可能性がある。心筋梗塞(MI)も心筋を痛め、心不全に至るかもしれない。運動をすると弱った心臓に負担がかかるため、心不全の重篤度のモニターに運動負荷試験の測定値が頻繁に用いられる。心臓超音波検査も、心臓のポンプ機能の客観的測定値である左室駆出率を決定するのに用いられる(25)。心筋のコエンザイムQ10濃度は、より重篤な心不全の患者では軽度の患者よりも低いという発見から、心不全患者へのコエンザイムQ10補給の臨床試験がいくつか行われた(26)。従来の医学的治療と同時にサプリメントでのコエンザイムQ10(100~300mg/日を1~3ヶ月)をうっ血性心不全患者に投与する何件かの小規模介入試験では、いくつかの心機能の測定値の改善が実証された(27-29)。しかしながら、従来の医学的治療とともに食事に100~200mg/日のコエンザイムQ10を足しても、心不全患者の左室駆出率または運動負荷試験結果が大きく改善することはなかったとする研究者もいる(30,31)。10の無作為化対照試験の2006年のメタ解析で、心不全患者にコエンザイムQ10補給(99~200mg/日を1~6ヶ月)をしたら、3.7%という大きな左室駆出率の改善があったことがわかった。この効果はアンジオテンシン変換酵素阻害剤を服用していない患者でより強かった(32)。コエンザイムQ10補給で心拍出量の少々の増加(0.28L/分)も見られたが、この解析には2つの試験(60mg/日を1ヶ月または200mg/日を3ヶ月)しか含まれていない(32)。236人の心不全患者の最近の研究で、血漿のコエンザイムQ10濃度が低いことと死亡率が高くなることとの関連があった(33)。しかし、1,191人の心不全患者によるより大規模な研究で、血漿のコエンザイムQ10濃度は進行した心疾患のバイオマーカーであって、心不全患者の臨床的症状を独立して予見するものではないことがわかった(34)。コエンザイムQ10補給が有益であるかもしれないというエビデンス(科学的根拠)もあるものの、コエンザイムQ10補給がうっ血性心不全の治療において従来からの医学的治療法を補足する価値があるのかどうかを決定するよく考案された大規模介入研究が必要である。そのような研究の一つが現在進行中である。
心筋梗塞と心臓手術
心筋梗塞(MI)の結果として、または心臓手術の間に、心筋が酸素欠乏(局所貧血)になるかもしれない。心筋への酸素供給が回復(再灌流)した際のROSの生成増加が、虚血再灌流の間に起こる心筋障害に大きく寄与していると考えられている。動物をコエンザイムQ10で前処置しておくと、虚血再灌流による心筋障害を減らすことがわかっている(35)。虚血再灌流障害の別の原因となりうるのは、冠動脈バイパス手術(CABG)のようなある種の心臓手術中の大動脈遮断である。4つのプラセボ対照試験のうちの3つで、コエンザイムQ10補給による前処置(100~300mg/日を手術前の7~14日間)をしておくと、CABG手術後の短期的な結果測定にいくらかの利点があった(36,37)。コエンザイムQ10の手術前補給が有益ではなかったとしたプラセボ対照試験では、患者は手術の12時間前に600mgのコエンザイムQ10を与えられていた(38)。このことから、手術前のコエンザイムQ10補給が有益であるためには、CABG手術の少なくとも1週間前からの補給が必要であるかもしれないことが示唆される。結果は有望ではあるが、これらの試験は比較的少人数で行われており、またCABG手術のすぐ後の結果しか調べていない。
狭心症
心筋虚血症は、狭心症として知られる胸の痛みを起こす可能性がある。狭心症の人々はしばしば、たとえば運動中に酸素の需要が心筋に酸素を送る冠動脈循環の能力を超える際に狭心症の症状を起こす。5つの小規模プラセボ対照試験で、慢性安定狭心症の患者に従来の医学的治療法に加えて経口コエンザイムQ10補給(60~600mg/日)をした効果を調べた(28)。研究の大部分で、プラセボに比べてコエンザイムQ10補給は運動負荷試験の結果を向上させ、心筋虚血症による心電図変化が減ったり遅れたりした。しかし、その中の2つの研究のみでコエンザイムQ10補給によって症状の頻度やニトログリセリンの使用がかなり減ったりしただけであった。現在では、コエンザイムQ10補給が従来の狭心症治療に役立つ補足的な治療であると示唆するエビデンスは限られている。
高血圧
ヒトでのいくつかの小規模な非対照試験の結果で、コエンザイムQ10補給が高血圧の治療に有益であるかもしれないということが示唆された(37)。最近では2つの短期間プラセボ対照試験で、コエンザイムQ10補給で高血圧の個人の血圧がやや低下したことがわかった。高血圧と冠動脈疾患のある患者に従来の医学的治療に加えて120mg/日のコエンザイムQ10を8週間補給したら、ビタミンB複合体を含むプラセボに比べて収縮期血圧が平均12mmHg、拡張期血圧が平均6mmHg下がった(39)。孤立性収縮期高血圧症の患者にコエンザイムQ10(120mg/日)とビタミンE(300 IU/日)を一緒に12週間補給したら、300 IU/日のビタミンEのみの場合と比べて収縮期血圧が平均で17mmHg下がった(40)。362人の高血圧患者を含む12の臨床試験の2007年のメタ解析で、コエンザイムQ10補給によって収縮期血圧が11~17mmHg、拡張期血圧が8~10mmHg下がったことがわかった(41)。このメタ解析に含まれた4つの無作為化対照試験では、100~120mg/日の用量のコエンザイムQ10を使用していた。
血管内皮機能(血管の拡張)
血管内皮として知られる血管の内面の正常な機能は、心血管疾患の予防に重要な役割を果たす(42)。アテローム性動脈硬化症は血管内皮機能の障害に関連しており、血管が緩んで正常な血流を通す能力がそれによって危うくなる。血清コレステロール濃度の高い個人や冠動脈疾患や糖尿病の患者においては、内皮依存性血管弛緩(血管拡張)がうまくいかない。あるプラセボ対照試験で、コエンザイムQ10補給(200mg/日)を12週間したら、血清脂質プロフィールに異常のある糖尿病患者の内皮依存性血管拡張が改善したとわかったが、非糖尿病の個人に見られるような程度まで回復したわけではなかった(43)。スタチン(HMG-CoA還元酵素阻害剤)を服用している23人の2型糖尿病患者による別のプラセボ対照試験で、200mg/日のコエンザイムQ10を12週間服用したら、上腕動脈の血流依存性血管拡張反応が改善したが、硝酸塩による血管拡張反応(ニトログリセリン誘発性血管拡張反応)は改善しなかったことがわかった(44)。しかし、80人の2型糖尿病患者によるプラセボ対照試験で、この補給の手順では内皮機能が向上しなかったことがわかった(45)。
血清コレステロール濃度が高く内皮障害があるがそれ以外は健康な12人の研究で、150mg/日のコエンザイムQ10補給は内皮依存性血管拡張に影響がなかった(46)。内皮障害のある25人の男性による前向き無作為化交差試験で、コエンザイムQ10補給(150mg/日)によって脂質低下剤と同じように内皮機能がかなり向上したことがわかった(47)。しかしこの研究はプラセボ対照試験ではなく、大切なことには著者らが被験者の血流依存性血管拡張の調査開始時平均が0未満だったと報告していることに言及しておくことが重要である。冠動脈疾患のある22人の患者による一つの無作為化二重盲検プラセボ対照試験で、300mg/日のコエンザイムQ10を1ヶ月補給したら、内皮依存性血管拡張反応が改善した(48)。虚血性の左心室収縮機能障害のある56人の患者による別の無作為化二重盲検プラセボ対照試験で、300mg/日のコエンザイムQ10を8週間補給したら、内皮機能障害の測定値が大きく向上したと報告された(49)。194人の被験者を含む5つの無作為化対照試験の結果を調べた2011年のメタ解析で、コエンザイムQ10補給(150~300mg/日を4~12週間)によって、血流依存性の内皮性血管拡張が臨床的に意義のある1.7%増加になったことがわかった(50)。内皮機能障害におけるコエンザイムQ10の治療的役割をさらに明らかにする大規模研究が必要である。
糖尿病
糖尿病は、酸化ストレスが増えエネルギー代謝に障害がある状態である。血漿コレステロール濃度を正規化した場合に、還元型コエンザイムQ10(CoQ10H2)の血漿濃度が糖尿病患者では健康な対照者よりも低いことがわかっている(51,52)。しかし、100mg/日のコエンザイムQ10を3ヶ月補給しても、プラセボに比べて1型糖尿病(インスリン依存性)患者の血糖コントロールが改善したりインスリン需要が減ったりはしなかった(53)。同様に、200mg/日のコエンザイムQ10を12週間または6ヶ月補給しても、2型(非インスリン依存性)糖尿病患者の血糖コントロールや血清脂質プロフィールは改善しなかった(45,54)。コエンザイムQ10補給はどちらの研究でも血糖コントロールに影響しなかったため、両研究の著者らはコエンザイムQ10補給が糖尿病患者の心血管疾患の補足的療法として安全に使用できると結論づけた。
ミトコンドリア遺伝子変異糖尿病(MIDD)は、母からのみ遺伝するミトコンドリアDNAの突然変異の結果として起こる。ミトコンドリア糖尿病は糖尿病全体の1%未満であるが、長期間のコエンザイムQ10補給(150mg/日)がこれらの患者のインスリン分泌を改善し、聴覚喪失の進行を予防するかもしれないというエビデンスがある(55,56)。
神経変性疾患
パーキンソン病
パーキンソン病は体の震え、筋肉のこわばり、および動作緩慢が特徴的な神経変性疾患である。65歳以上のアメリカ人の約1%が罹患していると推定される。パーキンソン病の原因は全部わかっているわけではないが、ミトコンドリアにおける電子伝達系の複合体Iの活性低下と、黒質と呼ばれる脳の一部での酸化ストレス増加が関わっていると考えられている。コエンザイムQ10は複合体Iの電子受容体であり抗酸化物質でもあり、またパーキンソン病の個々人の血小板では、還元型コエンザイムQ10の酸化型に対する比率の低下が見られる(57,58)。ある研究においては、パーキンソン病を治療していない患者の脳脊髄液では、健康な対照者に比べて酸化型コエンザイムQ10濃度が高いこともわかった(59)。さらに、パーキンソン病患者の死後のコエンザイムQ10濃度の研究で、同年の対照者に比べて脳の皮質領域でのコエンザイムQ10全体の濃度が低いことがわかったが、線条体、黒質、および小脳を含むその他の脳領域では差がなかった(60)。ある16ヶ月の無作為化プラセボ対照試験で、初期のパーキンソン病である80人の患者に300、600、または1,200mg/日のコエンザイムQ10補給をした安全性と効能を評価した(61)。コエンザイムQ10補給は全部の用量で忍容性が良好であり、プラセボに比べてパーキンソン病患者の機能低下が遅くなったという関連があった。しかし、その差は1,200mg/日の用量の群でのみ統計的に有意義であった。より小規模なプラセボ対照試験で360mg/日のコエンザイムQ10を4週間経口投与したら、パーキンソン病患者にやや有益であったことが示された(62)。より最近では、中等症のパーキンソン病患者106人による無作為化二重盲検プラセボ対照試験で、300mg/日のコエンザイムQ10ナノ粒子を3ヶ月補給しても、何の治療効果もなかったことが報告された(63)。別の試験で2,400mg/日のコエンザイムQ10を12ヶ月補給しても、初期のパーキンソン病には有効ではなかったことがわかった(64)。パーキンソン病患者に対するコエンザイムQ10(1,200~2,400mg/日)とビタミンE(1,200 IU/日)補給の第Ⅲ相臨床試験は、そのような治療がパーキンソン病治療に有効ではないであろうということから、最近終了となった(65)。
ハンチントン病
ハンチントン病は、線条体の中型有棘ニューロンとして知られる神経細胞が選択的に変性することが特徴的な遺伝性神経変性障害である。運動障害や認知機能低下などの症状は40代で発症することが典型的で、時とともに悪化する。ミトコンドリアの機能障害とグルタミン酸媒介の神経毒性がハンチントン病の病理にかかわっているかもしれないことを、動物モデルが示している。コエンザイムQ10補給は、ハンチントン病の動物モデルで脳の病変範囲を減らし、ハンチントン病患者の脳の乳酸濃度を下げることがわかっている(66,67)。ハンチントン病のタンパク質を発現する遺伝子改変マウス(HD-N171-82Qマウス)にコエンザイムQ10(餌の0.2%)とレマセミド(餌の0.007%)の組み合わせを与えると、運動能力および/または生存率が向上した(68,69)。レマセミドはグルタミン酸塩で活性化される神経受容体の拮抗薬である。
ハンチントン病のR6/2マウスモデルは、ヒトの症状と同じような行動および神経症状の進行的悪化を示す(70)。したがって、R6/2マウスはハンチントン病の治療可能性を探るのに理想的なモデルであるかもしれない。これらのマウスを使って行われた全部ではないがいくつかの研究で、コエンザイムQ10を食事に混ぜて補給(餌の0.2%)すると運動能力と全体の生存率が向上し、体重減少の予防に役立ったことが示された。コエンザイムQ10補給は、脳の萎縮、脳室拡張、および線条体ニューロンの萎縮などのハンチントン病の様々な特徴の低減にも関連していた(68,71)。興味深いことに、コエンザイムQ10をレマセミド、抗生物質のミノサイクリン、またはクレアチンと同時投与すると、測定されたパラメータの大部分でさらに大きく改善が示された(68,71,72)。
今日までのところわずか1つだけの臨床試験において、コエンザイムQ10がハンチントン病の患者に効能があるかどうかが調べられた。コエンザイムQ10,レマセミド、またはその両方を347人の初期のハンチントン病患者に投与する30ヶ月の無作為化プラセボ対照試験で、コエンザイムQ10もレマセミドも機能全体の能力低下を大きく変化させることはなかったが、コエンザイムQ10補給(レマセミド有りまたは無しで)では、有意とはいえない13%の低下となった(73)。8人の健康な被験者とハンチントン病の20人の患者でコエンザイムQ10補給の用量を増やす(1,200mg/日、2,400mg/日および3,600mg/日)安全性と忍容性を調べる20週間の最近のパイロット試験で、22人の被験者が試験を終了した(74)。すべての用量は全体的に忍容性がよく、胃腸の症状が最も多く報告された悪影響であった。研究の終了時のコエンザイムQ10の血中濃度は、中用量の摂取結果の濃度より高くはなかった。このことから、2,400mg/日という用量は効果的にコエンザイムQ10の血中濃度を最大化し、それ以上の用量による副作用を避けることができるのではないかということが示唆される(74)。2,400mg/日のコエンザイムQ10またはプラセボを5年間投与する第Ⅲ相の臨床試験は、現在ハンチントン病の参加者を募集中である(75)。今のところ、ハンチントン病の患者にコエンザイムQ10を勧めるエビデンスは不十分である。
フリードライヒ運動失調症
フリードライヒ運動失調症(FRDA)は、主にミトコンドリアにあってその機能が不明なタンパク質であるフラタキシンを符号化する遺伝子の突然変異によっておこる常染色体劣性遺伝子性の神経変性疾患である。フラタキシンの発現が減少するとミトコンドリアに鉄の蓄積がおこり、それによって酸化ストレスが増加し、ミトコンドリアのアコニターゼを含む鉄硫黄含有タンパク質の不均衡がおこり、ミトコンドリアの呼吸鎖の活性が低下する(76)。臨床的には、FRDAは手足の運動失調および感覚神経の変性による中枢神経系の異常が特徴的な進行性疾患である(77,78)。さらに、FRDAの患者は肥大型心筋症や糖尿病の症状になる(79)。10人のFRDA患者にコエンザイムQ10(200mg/日)とビタミンE(2,100 IU/日)を投与したパイロット研究で、心筋および骨格筋のエネルギー代謝がわずか3ヶ月の治療で向上したことがわかった(80)。47ヶ月での追跡評価で、心筋および骨格筋の改善が維持されFRDA患者の心臓機能の測定値である左室内径短縮率が大きく増加したことが示された。また、この治療は神経機能の進行的低下を防ぐのにも有効であった(81)。最近の研究で、FRDA患者にはコエンザイムQ10とビタミンE両方の欠乏症がいたって一般的で、コエンザイムQ10を30mg/日、ビタミンEを4 IU/日といった低用量でこれらの化合物を同時補給しても、この疾患の症状を改善するかもしれないことがわかった(82)。コエンザイムQ10をビタミンEと同時に投与することがFRDAの治療に有益であるかどうかを決定する大規模無作為化臨床試験が必要である。
がん
がんの治療薬としてのコエンザイムQ10の可能性に対する関心は、胚、膵臓、そして特に乳がんの患者は健康な対照者よりも血漿コエンザイムQ10濃度が低くなりがちだという観察研究によって喚起された(83)。いくつかの症例報告や非対照試験で、コエンザイムQ10補給が従来の乳がん治療の補足として有益であるかもしれないことが示唆されている(84)。しかし対照臨床試験が不足しているため、コエンザイムQ10をがん患者に補給することに効果があるのかを決定することは不可能である。
パフォーマンス
運動能力
コエンザイムQ10補給によって運動負荷試験の結果が向上するミトコンドリア脳筋症の個々人もいる(「欠乏症」の項参照)が(19)、それが健康な個人の運動能力を向上させるというエビデンスはほとんどない。少なくとも7つのプラセボ対照試験で、トレーニングをしている男性とそうでない男性に100~150mg/日のコエンザイムQ10補給を3~8週間して、運動能力への効果を調べた。大部分の試験では、最大酸素摂取量(VO2 max)や疲労困憊に至るまでの運動時間などの有酸素運動能力測定値に関して、コエンザイムQ10を摂取した群とプラセボを摂取した群で何の有意義な差も見られなかった(85-89)。ある研究で8週間のコエンザイムQ10補給によって自転車こぎの最大運動量がプラセボに比べてわずかに(4%)増加したことがわかったが、有酸素パワーの測定値は増加しなかった(90)。実は2つの研究では、無酸素(86)および有酸素(85)運動能力の測定でプラセボ補給の方がコエンザイムQ10よりも測定値に有意義な改善があったことがわかった。女性の運動能力に対する補給効果の研究は不足しているが、コエンザイムQ10補給に対する反応に性差があると疑う理由はほとんどない。
摂取源
生合成
コエンザイムQ10はヒトのほとんどの組織で合成される。コエンザイムQ10の生合成には3つの主要ステップがある。(1)チロシンもしくはフェニルアラニンという2つのアミノ酸からベンゾキノン構造を合成する;(2)アセチルコエンザイムA(CoA)からメバロン酸経路でイソプレン側鎖を合成する;そして(3)これらの構造を結合または縮合する。ヒドロキシメチルグルタリル(HMG)CoA還元酵素という酵素が、コエンザイムQ10合成およびコレステロール合成の統制に重大な役割を果たす(1,6)。
ベンゾキノンの生合成(チロシンから4ヒドロキシフェニルピルビン酸への変換)の第一ステップでは、ピリドキサール5'リン酸の形態のビタミンB6が必要である。したがってコエンザイムQ10の生合成には、ビタミンB6の栄養状態が適切であることが不可欠である。29人の患者と健康なボランティアによるパイロット研究で、コエンザイムQ10の血中濃度とビタミンB6の栄養状態の測定値の間に有意義な正の相関があったことがわかった(91)。しかしながら、この関連の臨床的重要性を決定するさらなる研究が必要である。
食品の摂取源
食品摂取頻度の研究に基いて、デンマークではコエンザイムQ10の食事からの平均的摂取量が3~5mg/日と推定された(6,7)。大部分の人はおそらく10mg/日未満の食事性コエンザイムQ10を摂取している。食事性コエンザイムQ10の豊富な摂取源は主に、肉、鳥肉、および魚である。コエンザイムQ10が比較的豊富なその他の食品は、大豆油やキャノーラ油、およびナッツ類である。果物、野菜、卵、および乳製品にはコエンザイムQ10が程よく含まれている。野菜や卵を油で炒める際に約14~32%のコエンザイムQ10が失われるが、これらの食品のコエンザイムQ10の含有量は茹でても変わらない。コエンザイムQ10の比較的豊富な食品源とその含有量をミリグラム(mg)単位で表1に示す(92-94)。
サプリメント
コエンザイムQ10は、米国では処方箋なしで栄養補助食品として市販されている。成人に対する補給用量は30~100mg/日の範囲で、通常の食事性コエンザイムQ10摂取よりもかなり高い。成人に対する治療用の用量は一般的に100~300mg/日であるが、初期のパーキンソン病の治療に医師の監督下で3,000mg/日といった高用量で用いられたことがあった(95)。サプリメントの用量が高くなるにつれてコエンザイムQ10の吸収が減り、ヒトでは腸でのコエンザイムQ10の吸収は10%未満であろう。コエンザイムQ10は脂溶性なので、食事の脂肪と一緒に摂取すると一番吸収がよい。100mg/日より高い用量は、一般的に1日に2~3回に分けられる(7,96)。
経口コエンザイムQ10補給で組織での濃度が上がるか?
コエンザイムQ10の経口補給は、ヒトの血中およびリポタンパク質中のコエンザイムQ10濃度を上げることが知られている(2,12,15)。しかしながら、内因性コエンザイムQ10生合成が正常な個人において、経口補給でその他の組織でのコエンザイムQ10濃度が上がるかどうか不明である。若い健康な動物にコエンザイムQ10の経口補給をしても、肝臓、脾臓、および血管以外の組織での濃度は一般的に上昇しない(97,98)。健康な男性に120mg/日を3週間補給しても、骨格筋でのコエンザイムQ10濃度は上昇しなかった(99)。しかし、コエンザイムQ10欠乏になっている組織でのコエンザイムQ10濃度は、補給によって上がるかもしれない。たとえば、年取ったラットの脳のコエンザイムQ10濃度は経口補給で上昇した(100)。また、心臓手術の少なくとも7日前から300mg/日のコエンザイムQ10またはプラセボを補給した24人の年配者の研究では、コエンザイムQ10を摂取した者では心房組織でのコエンザイムQ10濃度が大きく上昇し、特に70歳以上の者ではそうであった(36)。さらに、左心室機能不全の患者の研究で、心臓手術前に150mg/日のコエンザイムQ10を4週間補給したら、心臓でのコエンザイムQ10濃度が上がったが骨格筋ではそうではなかった(101)。これは明らかにさらなる研究を要する分野である。
安全性
毒性
1,200mg/日の用量のコエンザイムQ10を最大16ヶ月まで経口補給しても(61)、600mg/日を最大30ヶ月まで補給しても(73)、大きな副作用の報告はない。実際、1,200mg/日という用量が最近、コエンザイムQ10の実質安全量(OSL)として提唱された(102)。吐き気、下痢、食欲不振、胸焼け、および腹部不快感などの胃腸症状が出る者もいる。これらの悪影響は、1日に100mg超の用量を2~3回に分けて摂取すると最小化されるかもしれない。妊婦や授乳婦への安全性の対照研究がないので、妊婦や授乳婦がコエンザイムQ10のサプリメントを摂取することは避けるべきである(96,103)。
薬物相互作用
ワルファリン
ワルファリン(クマジンまたはコーマディン)とコエンザイムQ10サプリメントの併用は、少なくとも4件のケースでワルファリンの抗凝固作用を低減させたことが報告されている(104)。ワルファリンを服用する個人は、抗凝固治療を管理している医療提供者に相談することなしにコエンザイムQ10のサプリメント摂取を始めるべきではない。ワルファリンとコエンザイムQ10を併用することになるならば、凝固時間(プロトロンビン時間:PT-INR)を評価する血液検査が頻繁にチェックされるべきであり、最初の2週間は特にそうである。
HMG-CoA還元酵素阻害剤(スタチン)
今ではコレステロールやコエンザイムQ10の生合成における他の律速段階もあることが認識されているものの、HMG-CoA還元酵素はコレステロール合成およびコエンザイムQ10合成の統制に重大な役割を果たす酵素である。スタチンとしても知られるHMG-CoA還元酵素阻害剤は広く使用されているコレステロール低下薬であり、コエンザイムQ10の内因性合成も低減するかもしれない。シンバスタチン(ゾコー)、プラバスタチン(プラバコール)、ロバスタチン(メバコール、アルトコール、アルトプレブ)、ロスバスタチン(クレストール)、およびアトルバスタチン(リピトール)などのスタチンを治療目的に使用すると、血漿または血清中のコエンザイムQ10濃度が下がることが示されている(105-114)。しかしながら、血中コエンザイムQ10濃度は全脂質または全コレステロール濃度に対して正規化されたもののみを報告すべきである。なぜならば、コエンザイムQ10はリポタンパク質とともに循環し、コエンザイムQ10濃度は血液循環中の脂質の濃度に高く依存するからである(115,116)。スタチンの脂質低減効果を考えると、これらの薬物が血液循環中の脂質の減少に関係なくコエンザイムQ10濃度を実際に下げるのかどうかは明らかでない。また、標的とする臓器でのコエンザイムQ10濃度を調べた研究はほとんどなく、スタチンの治療が体の組織でのコエンザイムQ10濃度に影響するのかどうか不明である(111,113,117)。今のところ、コエンザイムQ10補給がHMG-CoA還元酵素阻害剤を服用している者に有益であるかどうかを決定するさらなる研究が必要である。
Authors and Reviewers
Originally written in 2003 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in February 2007 by:
Victoria J. Drake, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in March 2012 by:
Victoria J. Drake, Ph.D.
Linus Pauling Institute
Oregon State University
Reviewed in March 2012 by:
Roland Stocker, Ph.D.
Centre for Vascular Research
School of Medical Sciences (Pathology) and
Bosch Institute
Sydney Medical School
The University of Sydney
Sydney, New South Wales, Australia
Copyright 2003-2024 Linus Pauling Institute
References
1. Ernster L, Dallner G. Biochemical, physiological and medical aspects of ubiquinone function. Biochim Biophys Acta. 1995;1271(1):195-204. (PubMed)
2. Crane FL. Biochemical functions of coenzyme Q10. J Am Coll Nutr. 2001;20(6):591-598. (PubMed)
3. Nohl H, Gille L. The role of coenzyme Q in lysosomes. In: Kagan VEQ, P. J. (ed). Coenzyme Q: Molecular Mechanisms in Health and Disease. Boca Raton: CRC Press; 2001:99-106.
4. Thomas SR, Stocker R. Mechanisms of antioxidant action of ubiquinol-10 for low-density lipoprotein. In: Kagan VE, Quinn PJ,eds. Coenzyme Q: Molecular Mechanisms in Health and Disease. Boca Raton: CRC Press; 2001:131-150.
5. Kagan VE, Fabisak JP, Tyurina YY. Independent and concerted antioxidant functions of coenzyme Q. In: Kagan VE, Quinn PJ, eds. Coenzyme Q: Molecular Mechanisms in Health and Disease. Boca Raton: CRC Press; 2001:119-130.
6. Overvad K, Diamant B, Holm L, Holmer G, Mortensen SA, Stender S. Coenzyme Q10 in health and disease. Eur J Clin Nutr. 1999;53(10):764-770. (PubMed)
7. Weber C. Dietary intake and absorption of coenzyme Q. In: Kagan VE, Quinn PJ,eds. Coenzyme Q: Molecular Mechanisms in Health and Disease. Boca Raton: CRC Press; 2001:209-215.
8. Rustin P, Munnich A, Rotig A. Mitochondrial respiratory chain dysfunction caused by coenzyme Q deficiency. Methods Enzymol. 2004;382:81-88. (PubMed)
9. Kalen A, Appelkvist EL, Dallner G. Age-related changes in the lipid compositions of rat and human tissues. Lipids. 1989;24(7):579-584. (PubMed)
10. Beckman KB, Ames BN. Mitochondrial aging: open questions. Ann N Y Acad Sci. 1998;854:118-127. (PubMed)
11. Alho H, Lonnrot K. Coenzyme Q supplementation and longevity. In: Kagan VE, Quinn PJ,eds. Coenzyme Q: Molecular Mechanisms in Health and Disease. Boca Raton: CRC Press; 2001:371-380.
12. Singh RB, Niaz MA, Kumar A, Sindberg CD, Moesgaard S, Littarru GP. Effect on absorption and oxidative stress of different oral Coenzyme Q10 dosages and intake strategy in healthy men. Biofactors. 2005;25(1-4):219-224. (PubMed)
13. Sohal RS, Kamzalov S, Sumien N, et al. Effect of coenzyme Q10 intake on endogenous coenzyme Q content, mitochondrial electron transport chain, antioxidative defenses, and life span of mice. Free Radic Biol Med. 2006;40(3):480-487. (PubMed)
14. Quiles JL, Ochoa JJ, Battino M, et al. Life-long supplementation with a low dosage of coenzyme Q10 in the rat: effects on antioxidant status and DNA damage. Biofactors. 2005;25(1-4):73-86. (PubMed)
15. Mohr D, Bowry VW, Stocker R. Dietary supplementation with coenzyme Q10 results in increased levels of ubiquinol-10 within circulating lipoproteins and increased resistance of human low-density lipoprotein to the initiation of lipid peroxidation. Biochim Biophys Acta. 1992;1126(3):247-254. (PubMed)
16. Witting PK, Pettersson K, Letters J, Stocker R. Anti-atherogenic effect of coenzyme Q10 in apolipoprotein E gene knockout mice. Free Radic Biol Med. 2000;29(3-4):295-305. (PubMed)
17. Thomas SR, Leichtweis SB, Pettersson K, et al. Dietary cosupplementation with vitamin E and coenzyme Q(10) inhibits atherosclerosis in apolipoprotein E gene knockout mice. Arterioscler Thromb Vasc Biol. 2001;21(4):585-593. (PubMed)
18. Turunen M, Wehlin L, Sjoberg M, et al. beta2-Integrin and lipid modifications indicate a non-antioxidant mechanism for the anti-atherogenic effect of dietary coenzyme Q10. Biochem Biophys Res Commun. 2002;296(2):255-260. (PubMed)
19. Shoffner JM. Oxidative phosphorylation diseases. In: Scriver CR, Beaudet AL, Sly WS, Valle D,eds. The metabolic and molecular bases of inherited disease. 8th ed. Volume 2. New York: McGraw-Hill; 2001:2367-2392.
20. Rotig A, Appelkvist EL, Geromel V, et al. Quinone-responsive multiple respiratory-chain dysfunction due to widespread coenzyme Q10 deficiency. Lancet. 2000;356(9227):391-395. (PubMed)
21. Boitier E, Degoul F, Desguerre I, et al. A case of mitochondrial encephalomyopathy associated with a muscle coenzyme Q10 deficiency. J Neurol Sci. 1998;156(1):41-46. (PubMed)
22. Munnich A, Rotig A, Cormier-Daire V, Rustin P. Clinical presentation of respiratory chain deficiency. In: Scriver CR, Beaudet AL, Sly WS, Valle D,eds. The metabolic and molecular bases of inherited disease. 8th ed. Volume 2. New York: McGraw-Hill; 2001:2261-2274.
23. Horvath R, Gorman G, Chinnery PF. How can we treat mitochondrial encephalomyopathies? Approaches to therapy. Neurotherapeutics. 2008;5:558-568. (PubMed)
24. National Institutes of Health. Phase III Trial of Coenzyme Q10 in Mitochondrial Disease. ClinicalTrials.gov [Web page]. Available at: http://www.clinicaltrials.gov/ct2/show/NCT00432744?term=coenzyme+Q10+AND+mitochondrial&rank=1. Accessed 2/23/12.
25. Trupp RJ, Abraham WT. Congestive heart failure. In: Rakel RE, Bope ET,eds. Rakel: Conn's Current Therapy 2002. 54th ed. New York: W. B. Saunders Company; 2002:306-313.
26. Folkers K, Vadhanavikit S, Mortensen SA. Biochemical rationale and myocardial tissue data on the effective therapy of cardiomyopathy with coenzyme Q10. Proc Natl Acad Sci U S A. 1985;82(3):901-904. (PubMed)
27. Belardinelli R, Mucaj A, Lacalaprice F, et al. Coenzyme Q10 and exercise training in chronic heart failure. Eur Heart J. 2006; 27(22):2675-2681. (PubMed)
28. Tran MT, Mitchell TM, Kennedy DT, Giles JT. Role of coenzyme Q10 in chronic heart failure, angina, and hypertension. Pharmacotherapy. 2001;21(7):797-806. (PubMed)
29. Belardinelli R, Mucaj A, Lacalaprice F, et al. Coenzyme Q10 improves contractility of dysfunctional myocardium in chronic heart failure. Biofactors. 2005;25(1-4):137-145. (PubMed)
30. Khatta M, Alexander BS, Krichten CM, et al. The effect of coenzyme Q10 in patients with congestive heart failure. Ann Intern Med. 2000;132(8):636-640. (PubMed)
31. Watson PS, Scalia GM, Galbraith A, Burstow DJ, Bett N, Aroney CN. Lack of effect of coenzyme Q on left ventricular function in patients with congestive heart failure. J Am Coll Cardiol. 1999;33(6):1549-1552. (PubMed)
32. Sander S, Coleman CI, Patel AA, Kluger J, White CM. The impact of coenzyme Q10 on systolic function in patients with chronic heart failure. J Card Fail. 2006;12:464-472. (PubMed)
33. Molyneux SL, Florkowski CM, George PM, et al. Coenzyme Q10: an independent predictor of mortality in chronic heart failure. J Am Coll Cardiol. 2008;52:1435-1441. (PubMed)
34. McMurray JJ, Dunselman P, Wedel H, et al. Coenzyme Q10, rosuvastatin, and clinical outcomes in heart failure: a pre-specified substudy of CORONA (controlled rosuvastatin multinational study in heart failure). J Am Coll Cardiol. 2010;56:1196-1204. (PubMed)
35. Lonnrot K, Tolvanen JP, Porsti I, Ahola T, Hervonen A, Alho H. Coenzyme Q10 supplementation and recovery from ischemia in senescent rat myocardium. Life Sci. 1999;64(5):315-323. (PubMed)
36. Rosenfeldt FL, Pepe S, Linnane A, et al. The effects of ageing on the response to cardiac surgery: protective strategies for the ageing myocardium. Biogerontology. 2002;3(1-2):37-40. (PubMed)
37. Langsjoen PH, Langsjoen AM. Overview of the use of CoQ10 in cardiovascular disease. Biofactors. 1999;9(2-4):273-284. (PubMed)
38. Taggart DP, Jenkins M, Hooper J, et al. Effects of short-term supplementation with coenzyme Q10 on myocardial protection during cardiac operations. Ann Thorac Surg. 1996;61(3):829-833. (PubMed)
39. Singh RB, Niaz MA, Rastogi SS, Shukla PK, Thakur AS. Effect of hydrosoluble coenzyme Q10 on blood pressures and insulin resistance in hypertensive patients with coronary artery disease. J Hum Hypertens. 1999;13(3):203-208. (PubMed)
40. Burke BE, Neuenschwander R, Olson RD. Randomized, double-blind, placebo-controlled trial of coenzyme Q10 in isolated systolic hypertension. South Med J. 2001;94(11):1112-1117. (PubMed)
41. Rosenfeldt FL, Haas SJ, Krum H, et al. Coenzyme Q10 in the treatment of hypertension: a meta-analysis of the clinical trials. J Hum Hypertens. 2007;21:297-306. (PubMed)
42. Ross R. Atherosclerosis--an inflammatory disease. N Engl J Med. 1999;340(2):115-126. (PubMed)
43. Watts GF, Playford DA, Croft KD, Ward NC, Mori TA, Burke V. Coenzyme Q(10) improves endothelial dysfunction of the brachial artery in Type II diabetes mellitus. Diabetologia. 2002;45(3):420-426. (PubMed)
44. Hamilton SJ, Chew GT, Watts GF. Coenzyme Q10 improves endothelial dysfunction in statin-treated type 2 diabetic patients. Diabetes Care. 2009;32:810-812. (PubMed)
45. Lim SC, Lekshminarayanan R, Goh SK, et al. The effect of coenzyme Q10 on microcirculatory endothelial function of subjects with type 2 diabetes mellitus. Atherosclerosis. 2008;196:966-969. (PubMed)
46. Raitakari OT, McCredie RJ, Witting P, et al. Coenzyme Q improves LDL resistance to ex vivo oxidation but does not enhance endothelial function in hypercholesterolemic young adults. Free Radic Biol Med. 2000;28(7):1100-1105. (PubMed)
47. Kuettner A, Pieper A, Koch J, Enzmann F, Schroeder S. Influence of coenzyme Q(10) and cerivastatin on the flow-mediated vasodilation of the brachial artery: results of the ENDOTACT study. Int J Cardiol. 2005;98(3):413-419. (PubMed)
48. Tiano L, Belardinelli R, Carnevali P, Principi F, Seddaiu G, Littarru GP. Effect of coenzyme Q10 administration on endothelial function and extracellular superoxide dismutase in patients with ischaemic heart disease: a double-blind, randomized controlled study. Eur Heart J. 2007;28:2249-2255. (PubMed)
49. Dai YL, Luk TH, Yiu KH, et al. Reversal of mitochondrial dysfunction by coenzyme Q10 supplement improves endothelial function in patients with ischaemic left ventricular systolic dysfunction: a randomized controlled trial. Atherosclerosis. 2011;216:395-401. (PubMed)
50. Gao L, Mao Q, Cao J, Wang Y, Zhou X, Fan L. Effects of coenzyme Q10 on vascular endothelial function in humans: A meta-analysis of randomized controlled trials. Atherosclerosis. 2011;221(2):311-316. (PubMed)
51. McDonnell MG, Archbold GP. Plasma ubiquinol/cholesterol ratios in patients with hyperlipidaemia, those with diabetes mellitus and in patients requiring dialysis. Clin Chim Acta. 1996;253(1-2):117-126. (PubMed)
52. Lim SC, Tan HH, Goh SK, et al. Oxidative burden in prediabetic and diabetic individuals: evidence from plasma coenzyme Q(10). Diabet Med. 2006;23:1344-1349. (PubMed)
53. Henriksen JE, Andersen CB, Hother-Nielsen O, Vaag A, Mortensen SA, Beck-Nielsen H. Impact of ubiquinone (coenzyme Q10) treatment on glycaemic control, insulin requirement and well-being in patients with Type 1 diabetes mellitus. Diabet Med. 1999;16(4):312-318. (PubMed)
54. Eriksson JG, Forsen TJ, Mortensen SA, Rohde M. The effect of coenzyme Q10 administration on metabolic control in patients with type 2 diabetes mellitus. Biofactors. 1999;9(2-4):315-318. (PubMed)
55. Alcolado JC, Laji K, Gill-Randall R. Maternal transmission of diabetes. Diabet Med. 2002;19(2):89-98. (PubMed)
56. Suzuki S, Hinokio Y, Ohtomo M, et al. The effects of coenzyme Q10 treatment on maternally inherited diabetes mellitus and deafness, and mitochondrial DNA 3243 (A to G) mutation. Diabetologia. 1998;41(5):584-588. (PubMed)
57. Gotz ME, Gerstner A, Harth R, et al. Altered redox state of platelet coenzyme Q10 in Parkinson's disease. J Neural Transm. 2000;107(1):41-48. (PubMed)
58. Shults CW, Haas RH, Passov D, Beal MF. Coenzyme Q10 levels correlate with the activities of complexes I and II/III in mitochondria from parkinsonian and nonparkinsonian subjects. Ann Neurol. 1997;42(2):261-264. (PubMed)
59. Isobe C, Abe T, Terayama Y. Levels of reduced and oxidized coenzyme Q-10 and 8-hydroxy-2'-deoxyguanosine in the cerebrospinal fluid of patients with living Parkinson's disease demonstrate that mitochondrial oxidative damage and/or oxidative DNA damage contributes to the neurodegenerative process. Neurosci Lett. 2010;469:159-63. (PubMed)
60. Hargreaves IP, Lane A, Sleiman PM. The coenzyme Q10 status of the brain regions of Parkinson's disease patients. Neurosci Lett. 2008;447:17-19. (PubMed)
61. Shults CW, Oakes D, Kieburtz K, et al. Effects of coenzyme Q10 in early Parkinson disease: evidence of slowing of the functional decline. Arch Neurol. 2002;59(10):1541-1550. (PubMed)
62. Muller T, Buttner T, Gholipour AF, Kuhn W. Coenzyme Q10 supplementation provides mild symptomatic benefit in patients with Parkinson's disease. Neurosci Lett. 2003;341(3):201-204. (PubMed)
63. Storch A, Jost WH, Vieregge P, et al. Randomized, double-blind, placebo-controlled trial on symptomatic effects of coenzyme Q(10) in Parkinson disease. Arch Neurol. 2007;64:938-44. (PubMed)
64. A randomized clinical trial of coenzyme Q10 and GPI-1485 in early Parkinson disease. Neurology. 2007;68:20-28. (PubMed)
65. National Institutes of Health. Effects of Coenzyme Q10 (CoQ) in Parkinson Disease (QE3). ClinicalTrials.gov [Web page]. Available at: http://www.clinicaltrials.gov/ct2/show/NCT00740714?term=coenzyme+Q&rank=2. Accessed 2/15/12.
66. Koroshetz WJ, Jenkins BG, Rosen BR, Beal MF. Energy metabolism defects in Huntington's disease and effects of coenzyme Q10. Ann Neurol. 1997;41(2):160-165. (PubMed)
67. Beal MF. Coenzyme Q10 as a possible treatment for neurodegenerative diseases. Free Radic Res. 2002;36(4):455-460. (PubMed)
68. Ferrante RJ, Andreassen OA, Dedeoglu A, et al. Therapeutic effects of coenzyme Q10 and remacemide in transgenic mouse models of Huntington's disease. J Neurosci. 2002;22(5):1592-1599. (PubMed)
69. Schilling G, Coonfield ML, Ross CA, Borchelt DR. Coenzyme Q10 and remacemide hydrochloride ameliorate motor deficits in a Huntington's disease transgenic mouse model. Neurosci Lett. 2001;315(3):149-153. (PubMed)
70. Stack EC, Kubilus JK, Smith K, et al. Chronology of behavioral symptoms and neuropathological sequela in R6/2 Huntington's disease transgenic mice. J Comp Neurol. 2005;490(4):354-370. (PubMed)
71. Stack EC, Smith KM, Ryu H, et al. Combination therapy using minocycline and coenzyme Q10 in R6/2 transgenic Huntington's disease mice. Biochim Biophys Acta. 2006;1762(3):373-380. (PubMed)
72. Yang L, Calingasan NY, Wille EJ, et al. Combination therapy with coenzyme Q10 and creatine produces additive neuroprotective effects in models of Parkinson's and Huntington's diseases. Journal Neurochem. 2009;109:1427-1439. (PubMed)
73. A randomized, placebo-controlled trial of coenzyme Q10 and remacemide in Huntington's disease. Neurology. 2001;57(3):397-404. (PubMed)
74. Hyson HC, Kieburtz K, Shoulson I, et al. Safety and tolerability of high-dosage coenzyme Q10 in Huntington's disease and healthy subjects. Mov Disord. 2010;25:1924-1928. (PubMed)
75. National Institutes of Health. Coenzyme Q10 in Huntington's Disease (HD) (2CARE). ClinicalTrials.gov [Web page]. Available at: http://www.clinicaltrials.gov/ct2/show/NCT00608881?term=coenzyme+Q10+and+huntington&rank=1. Accessed 3/15/12.
76. Gatchel JR, Zoghbi HY. Diseases of unstable repeat expansion: mechanisms and common principles. Nat Rev Genet. 2005;6(10):743-755. (PubMed)
77. Cooper JM, Schapira AH. Friedreich's Ataxia: disease mechanisms, antioxidant and Coenzyme Q10 therapy. Biofactors. 2003;18(1-4):163-171. (PubMed)
78. Taroni F, DiDonato S. Pathways to motor incoordination: the inherited ataxias. Nat Rev Neurosci. 2004;5(8):641-655. (PubMed)
79. Lodi R, Tonon C, Calabrese V, Schapira AH. Friedreich's ataxia: from disease mechanisms to therapeutic interventions. Antioxid Redox Signal. 2006;8(3-4):438-443. (PubMed)
80. Lodi R, Hart PE, Rajagopalan B, et al. Antioxidant treatment improves in vivo cardiac and skeletal muscle bioenergetics in patients with Friedreich's ataxia. Ann Neurol. 2001;49(5):590-596. (PubMed)
81. Hart PE, Lodi R, Rajagopalan B, et al. Antioxidant treatment of patients with Friedreich ataxia: four-year follow-up. Arch Neurol. 2005;62(4):621-626. (PubMed)
82. Cooper JM, Korlipara LV, Hart PE, Bradley JL, Schapira AH. Coenzyme Q10 and vitamin E deficiency in Friedreich's ataxia: predictor of efficacy of vitamin E and coenzyme Q10 therapy. Eur J Neurol. 2008;15:1371-1379. (PubMed)
83. Folkers K, Osterborg A, Nylander M, Morita M, Mellstedt H. Activities of vitamin Q10 in animal models and a serious deficiency in patients with cancer. Biochem Biophys Res Commun. 1997;234(2):296-299. (PubMed)
84. Hodges S, Hertz N, Lockwood K, Lister R. CoQ10: could it have a role in cancer management? Biofactors. 1999;9(2-4):365-370. (PubMed)
85. Laaksonen R, Fogelholm M, Himberg JJ, Laakso J, Salorinne Y. Ubiquinone supplementation and exercise capacity in trained young and older men. Eur J Appl Physiol Occup Physiol. 1995;72(1-2):95-100. (PubMed)
86. Malm C, Svensson M, Ekblom B, Sjodin B. Effects of ubiquinone-10 supplementation and high intensity training on physical performance in humans. Acta Physiol Scand. 1997;161(3):379-384. (PubMed)
87. Weston SB, Zhou S, Weatherby RP, Robson SJ. Does exogenous coenzyme Q10 affect aerobic capacity in endurance athletes? Int J Sport Nutr. 1997;7(3):197-206. (PubMed)
88. Porter DA, Costill DL, Zachwieja JJ, et al. The effect of oral coenzyme Q10 on the exercise tolerance of middle-aged, untrained men. Int J Sports Med. 1995;16(7):421-427. (PubMed)
89. Braun B, Clarkson PM, Freedson PS, Kohl RL. Effects of coenzyme Q10 supplementation on exercise performance, VO2max, and lipid peroxidation in trained cyclists. Int J Sport Nutr. 1991;1(4):353-365. (PubMed)
90. Bonetti A, Solito F, Carmosino G, Bargossi AM, Fiorella PL. Effect of ubidecarenone oral treatment on aerobic power in middle-aged trained subjects. J Sports Med Phys Fitness. 2000;40(1):51-57. (PubMed)
91. Willis R, Anthony M, Sun L, Honse Y, Qiao G. Clinical implications of the correlation between coenzyme Q10 and vitamin B6 status. Biofactors. 1999;9(2-4):359-363. (PubMed)
92. Mattila P, Kumpulainen J. Coenzymes Q9 and Q10: Contents in foods and dietary intake. J Food Comp Anal. 2001;14(4):409-417.
93. Kamei M, Fujita T, Kanbe T, et al. The distribution and content of ubiquinone in foods. Int J Vitam Nutr Res. 1986;56(1):57-63. (PubMed)
94. Weber C, Bysted A, Holmer G. Coenzyme Q10 in the diet--daily intake and relative bioavailability. Mol Aspects Med. 1997;18 Suppl:S251-254. (PubMed)
95. Shults CW, Flint Beal M, Song D, Fontaine D. Pilot trial of high dosages of coenzyme Q10 in patients with Parkinson's disease. Exp Neurol. 2004;188(2):491-494. (PubMed)
96. Hendler SS, Rorvik DR (eds). PDR for Nutritional Supplements. Montvale: Medical Economics Company, Inc; 2001.
97. Lonnrot K, Holm P, Lagerstedt A, Huhtala H, Alho H. The effects of lifelong ubiquinone Q10 supplementation on the Q9 and Q10 tissue concentrations and life span of male rats and mice. Biochem Mol Biol Int. 1998;44(4):727-737. (PubMed)
98. Zhang Y, Aberg F, Appelkvist EL, Dallner G, Ernster L. Uptake of dietary coenzyme Q supplement is limited in rats. J Nutr. 1995;125(3):446-453. (PubMed)
99. Svensson M, Malm C, Tonkonogi M, Ekblom B, Sjodin B, Sahlin K. Effect of Q10 supplementation on tissue Q10 levels and adenine nucleotide catabolism during high-intensity exercise. Int J Sport Nutr. 1999;9(2):166-180. (PubMed)
100. Matthews RT, Yang L, Browne S, Baik M, Beal MF. Coenzyme Q10 administration increases brain mitochondrial concentrations and exerts neuroprotective effects. Proc Natl Acad Sci U S A. 1998;95(15):8892-8897. (PubMed)
101. Keith M, Mazer CD, Mikhail P, Jeejeebhoy F, Briet F, Errett L. Coenzyme Q10 in patients undergoing CABG: Effect of statins and nutritional supplementation. Nutr Metab Cardiovasc Dis. (PubMed)
102. Hathcock JN, Shao A. Risk assessment for coenzyme Q10 (Ubiquinone). Regul Toxicol Pharmacol. 2006;45(3):282-288. (PubMed)
103. Natural Medicines Comprehensive Database. Therapeutic Research Faculty [Web site]. 11/07/02. Available at: http://www.naturaldatabase.com. Accessed 11/07/02, 2002.
104. Heck AM, DeWitt BA, Lukes AL. Potential interactions between alternative therapies and warfarin. Am J Health Syst Pharm. 2000;57(13):1221-1227; quiz 1228-1230. (PubMed)
105. Folkers K, Langsjoen P, Willis R, et al. Lovastatin decreases coenzyme Q levels in humans. Proc Natl Acad Sci U S A. 1990;87(22):8931-8934. (PubMed)
106. Colquhoun DM, Jackson R, Walters M, et al. Effects of simvastatin on blood lipids, vitamin E, coenzyme Q10 levels and left ventricular function in humans. Eur J Clin Invest. 2005;35(4):251-258. (PubMed)
107. Mabuchi H, Higashikata T, Kawashiri M, et al. Reduction of serum ubiquinol-10 and ubiquinone-10 levels by atorvastatin in hypercholesterolemic patients. J Atheroscler Thromb. 2005;12(2):111-119. (PubMed)
108. Bargossi AM, Battino M, Gaddi A, et al. Exogenous CoQ10 preserves plasma ubiquinone levels in patients treated with 3-hydroxy-3-methylglutaryl coenzyme A reductase inhibitors. Int J Clin Lab Res. 1994;24(3):171-176. (PubMed)
109. Watts GF, Castelluccio C, Rice-Evans C, Taub NA, Baum H, Quinn PJ. Plasma coenzyme Q (ubiquinone) concentrations in patients treated with simvastatin. J Clin Pathol. 1993;46(11):1055-1057. (PubMed)
110. Ghirlanda G, Oradei A, Manto A, et al. Evidence of plasma CoQ10-lowering effect by HMG-CoA reductase inhibitors: a double-blind, placebo-controlled study. J Clin Pharmacol. 1993;33(3):226-229. (PubMed)
111. Laaksonen R, Jokelainen K, Laakso J, et al. The effect of simvastatin treatment on natural antioxidants in low-density lipoproteins and high-energy phosphates and ubiquinone in skeletal muscle. Am J Cardiol. 1996;77(10):851-854. (PubMed)
112. Laaksonen R, Ojala JP, Tikkanen MJ, Himberg JJ. Serum ubiquinone concentrations after short- and long-term treatment with HMG-CoA reductase inhibitors. Eur J Clin Pharmacol. 1994;46(4):313-317. (PubMed)
113. Elmberger PG, Kalen A, Lund E, et al. Effects of pravastatin and cholestyramine on products of the mevalonate pathway in familial hypercholesterolemia. J Lipid Res. 1991;32(6):935-940. (PubMed)
114. Ashton E, Windebank E, Skiba M, et al. Why did high-dose rosuvastatin not improve cardiac remodeling in chronic heart failure? Mechanistic insights from the UNIVERSE study. Int J Cardiol. 2011;146:404-407. (PubMed)
115. Hughes K, Lee BL, Feng X, Lee J, Ong CN. Coenzyme Q10 and differences in coronary heart disease risk in Asian Indians and Chinese. Free Radic Biol Med. 2002;32(2):132-138. (PubMed)
116. Hargreaves IP, Duncan AJ, Heales SJ, Land JM. The effect of HMG-CoA reductase inhibitors on coenzyme Q10: possible biochemical/clinical implications. Drug Saf. 2005;28(8):659-676. (PubMed)
117. Laaksonen R, Jokelainen K, Sahi T, Tikkanen MJ, Himberg JJ. Decreases in serum ubiquinone concentrations do not result in reduced levels in muscle tissue during short-term simvastatin treatment in humans. Clin Pharmacol Ther. 1995;57(1):62-66. (PubMed)