リポ酸
目次
要約
- チオクト酸としても知られるリポ酸(しばしばα-リポ酸と呼ばれる)は、ヒトでも合成される天然由来の化学物質である。(詳細はこちら)
- 内因的に合成されたリポ酸はタンパク質と結合し、ミトコンドリアのいくつかの重要な多酵素複合体に対する補助因子として機能する。(詳細はこちら)
- リポ酸補給をすると、非結合リポ酸の血漿および細胞での濃度が過渡的に上昇する。(詳細はこちら)
- リポ酸は直接的な抗酸化物質であるが、生体内におけるラジカル除去活性の上昇は過渡的であろう。リポ酸はまた抗酸化防御を引き起こし、細胞のブドウ糖取り込みを強化し、様々な細胞シグナル分子や転写因子の活性を調整するのかもしれない。(詳細はこちら)
- 小規模無作為化対照研究からのエビデンスで、高用量のリポ酸は代謝障害のある者のブドウ糖利用の測定値を改善させるかもしれないことが示唆されている。(詳細はこちら)
- 経静脈または経口でのリポ酸治療は糖尿病性末梢神経障害の症状を軽減することに役立つかもしれないことが、公開されたエビデンスから示唆される。糖尿病性神経障害の治療へのリポ酸の効能をを調べる研究の多くはあるドイツの研究グループによって行われ、ドイツのリポ酸製造業者によって資金提供されていることに留意することが重要である。(詳細はこちら)
- 多発性硬化症のマウスモデルに投与すると、リポ酸が疾患の進行を遅くすることがわかった。進行性多発性硬化症の患者の運動性喪失や脳体積変化に対するリポ酸の効果を評価するように考案された2年間の臨床試験が進行中である。(詳細はこちら)
- アルツハイマー病患者にリポ酸補給が有益であるかどうかを示唆するエビデンスは、現在あまりに限定的である。(詳細はこちら)
- 肥満指数が高い者の体重管理に、リポ酸補給が何らかの有益性を示すかもしれない。(詳細はこちら)
- リポ酸は天然にはタンパク質と共役結合して食物中に存在するが、サプリメントは非結合の(遊離)リポ酸を含む。サプリメントを使用するなら、ライナス・ポーリング研究所は全般的に健康な者に対して200~400 mg/日という毎日の用量を推奨する。
序説
チオクト酸としても知られるリポ酸(しばしばα-リポ酸と呼ばれる)は、植物やヒトを含む動物によって合成される天然由来の有機硫黄化合物である(1,2)。リポ酸は特定のタンパク質に共役結合しており、それらはミトコンドリアのエネルギーおよびアミノ酸代謝に関わる必須多酵素複合体の一部として機能する(「生物活性」の項参照)。タンパク質に結合したリポ酸の生理学的機能に加えて、薬理学的用量の遊離(非結合性)リポ酸を治療に使用する可能性に科学的および医学的関心が高まっている(3)。リポ酸は2つのチオール(硫黄)基を含み、これらは酸化もしくは還元されうる。ジヒドロリポ酸は、リポ酸の還元型である(図1参照)(4)。リポ酸はまた非対称性の炭素も含み、これはリポ酸が鏡像異性体とも呼ばれる2つの光学異性体のうちの一つとして存在しうることを意味する。これらの鏡像異性体は、R-リポ酸とS-リポ酸という互いを鏡に写した像になっている(図1参照)。R型の鏡像異性体のみが内因的に合成され、タンパク質と共役結合する。R-リポ酸は食物中に天然に存在する(「食物の摂取源」の項参照)。遊離(非結合性)リポ酸のサプリメントはR-リポ酸であるか、もしくはR-リポ酸とS-リポ酸が半々(ラセミ)の混合物であるかもしれない(「サプリメント」の項参照)。
代謝と生物学的利用性
内因性生合成
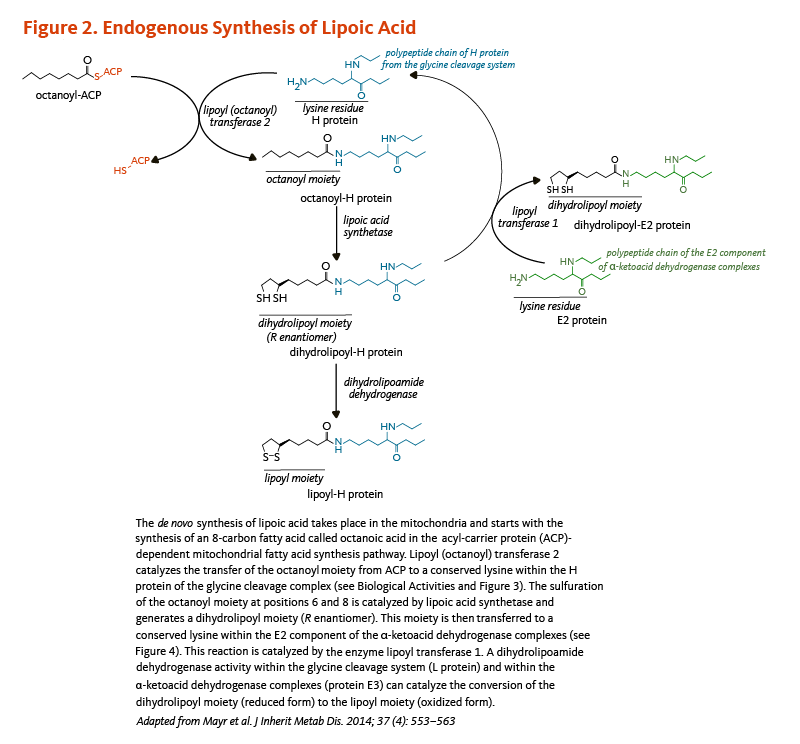
リポ酸の合成は、Saccharomyces cerevisiaeという酵母について特徴が詳細に明らかにされてきたが、この過程に関わる全ての遺伝子がヒトで同定されたわけではない(5)。リポ酸は、脂肪酸の合成過程においてアシルキャリアタンパク質(ACP;「パントテン酸」のタイトルの記事参照)に結合した8炭素(C8:0)脂肪酸であるオクタン酸から、ミトコンドリア内で新規に合成される(図2参照)。リポイルトランスフェラーゼ2(オクタノイルトランスフェラーゼ2)と呼ばれる酵素が、オクタノイル-ACPからグリシン開裂系におけるHタンパク質の保存リシンへのオクタノイル部分の移動を触媒する(「生物活性」の項参照)。次の反応はHタンパク質に結合したオクタノイル部分の6位および8位に2つの硫黄原子を挿入することで、それによってジヒドロリポイル部分が生成される。この段階は、この反応において硫黄供与体として働く鉄-硫黄クラスターを含むリポ酸合成酵素(リポイルシンターゼともいう)によって触媒される(5)。最後に、グリシン開裂系のHタンパク質から多酵素複合体であるα-ケト酸脱水素酵素のE2成分にある保存リシン残基へのジヒドロリポイル部分の移動を、リポイルトランスフェラーゼ1酵素が触媒する(5)。ジヒドロリポイル部分の酸化は、ジヒドロリポアミド脱水素酵素によって触媒される(図2参照)。
食事性およびサプリメントのリポ酸
食物からリポ酸を摂取することで、ヒトの血漿や細胞で遊離リポ酸が検出可能なまでに増加することになるという発見はまだない(3,6)。対照的に、経口で高用量遊離リポ酸(50 mg以上)を摂取すると、血漿や細胞での遊離リポ酸濃度が過渡的にだが相当に増加する。ヒトでの薬理動態学的研究で、経口用量のR-リポ酸とS-リポ酸のラセミ混合物の約30~40%が吸収されることがわかった(6,7)。経口リポ酸サプリメントは、空腹時の方が食物と一緒に摂るよりもよく吸収された。食物と一緒にリポ酸を摂取すると、(食物なしの場合より)血漿リポ酸のピーク濃度が約30%、全体的な血漿リポ酸濃度が約20%減少した(8)。R-リポ酸の液体製剤はさらに吸収がよく、血漿でより安定であることがわかった。このことから糖尿病性神経障害のような症状の管理には、そちらの方が固体製剤よりも効能があるかもしれないことが示唆される(9,10)。
リポ酸の2つの異性体には、生物学的利用性の差もあるかもしれない。RとS-リポ酸(ラセミ混合物)の経口用量1回分の摂取後、R-リポ酸のピーク血漿濃度はS-リポ酸よりも40~50%高かったことがわかり、これはR鏡像異性体の方が選ばれて差異的に吸収されることを示唆している(6,8,11)。しかしながら、経口摂取後はどちらの鏡像異性体も急速に代謝され排泄される。血漿リポ酸濃度は一般的に1時間以内にピークとなり、急速に低下する(6,7,11,12)。細胞ではリポ酸は迅速にジヒドロリポ酸に還元され、in vitro(ガラス容器内)の研究ではジヒドロリポ酸はその後速やかに細胞から排出されることが示されている(3)。さらに、19人の健康な成人による予備研究では、RとS-リポ酸の生物学的利用性とR-リポ酸のそれは、年齢や性別によって異なるかもしれないことが示唆された(13)。
最後に、ヒトでは外因性リポ酸がATP(アデノシン三リン酸)やGTP(グアノシン三リン酸)で「活性化」されて、リポイルトランスフェラーゼによってリポ酸依存性酵素に組み込まれるというエビデンスはない(14)。結果として、内因性のリポ酸合成における欠陥(「欠乏症」の項参照)によって起こされるリポ酸依存性酵素活性が喪失しても、リポ酸の外因的供給では治せない(5)。
生物活性
タンパク質結合のリポ酸
酵素の補助因子
R-リポ酸は、アミノ酸の異化作用(分解)やエネルギー生産に関係する非常に重要な反応を触媒するいくつかのミトコンドリア多酵素複合体に必須の補助因子である(15)。R-リポ酸は各多酵素複合体の少なくとも1つのタンパク質における特定のリシン残基に共役結合している。そのような非タンパク質補助因子は、「補欠分子族」として知られる。
R-リポ酸は、次の多酵素複合体の生物活性の補欠分子族として機能する。
●グリシンの脱炭酸反応を触媒し、メチレン基(-CH2)のテトラヒドロ葉酸への付加と相まって核酸合成における重要な補助因子である5,10-メチレンテトラヒドロ葉酸を作るグリシン開裂系(図3参照)。グリシン開裂系内では、R-リポ酸はHタンパク質の保存リシンに共役結合している(図2、3参照)。
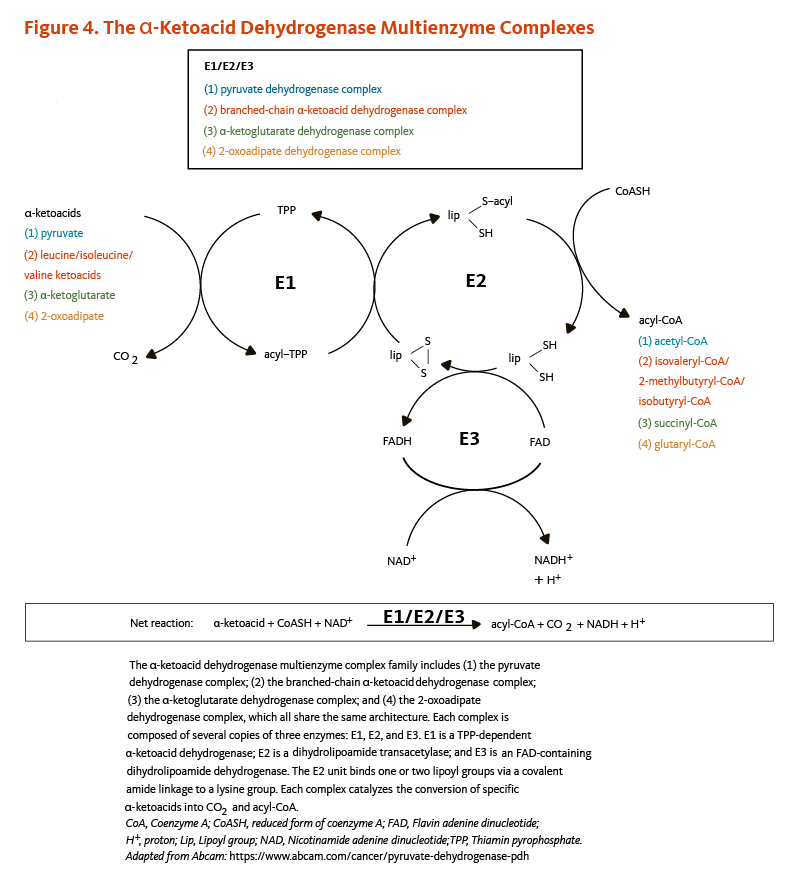
●以下の4つのα-ケト酸脱水素酵素複合体(図4参照)
(i)クエン酸回路を経してのエネルギー生産に重要な基質であるアセチル補酵素A(CoA)へとピルビン酸を変換する反応の触媒作用をするピルビン酸脱水素酵素複合体;
(ii)クエン酸回路の別の重要な中間体であるスクシニルCoAへとα-ケトグルタル酸を変換する反応を触媒するα-ケトグルタル酸脱水素酵素複合体;
(iii)ロイシン、イソロイシン、バリンという分岐鎖アミノ酸の異化経路におけるケト酸の脱炭酸反応に関わる分岐鎖α-ケト酸脱水素酵素複合体;
(iv)リシン、ヒドロキシリシン、およびトリプトファンの異化経路において2-オキソアジピン酸からグルタリルCoAへの脱炭酸反応を触媒する2-オキソアジピン酸脱水素酵素複合体。
これら4つのα-ケト酸脱水素酵素複合体は、E1、E2、E3という3つの酵素の活性がある。E1は、チアミンピロリン酸(TPP)依存性のα-ケト酸脱水素酵素である。R-リポ酸は、E2のアシルトランスフェラーゼの活性に不可欠な補欠分子族として機能する。E3は、フラビンアデニンジヌクレオチド(FAD)依存性ジヒドロリポアミド脱水素酵素である(図4参照)。R-リポ酸はまた、ピルビン酸脱水素酵素複合体のE3結合タンパク質(Xタンパク質成分)にも見られる(5)。
非結合のリポ酸
サプリメントの(非結合の)リポ酸の生物活性を考慮する際には、血漿および組織でのリポ酸増加が限定的および過渡的であるという本質を心に留めておくことが重要である(「代謝と生物学的利用性」の項参照)(3)。
抗酸化作用
活性酸素種および活性窒素種の除去:活性酸素種(ROS)および活性窒素種(RNS)は、DNA、タンパク質、および細胞膜の脂質に損傷を与える可能性のある非常に反応性の高い化合物である。リポ酸もジヒドロリポ酸も、生理学的に関連のあるROSやRNSを試験管内では直接的に除去(中和)できる((3)の文献でレビュー)。しかし直接的な除去反応が、in vivoで(生体内で)起こるのかどうかはわかっていない。経口補給で達成できるであろう遊離リポ酸の組織での最大濃度は、ビタミンCやグルタチオンのようなその他の細胞内抗酸化物質のそれの10分の1未満である。また遊離リポ酸は急速に細胞から取り除かれるため、直接的なラジカル除去作用の増加は持続しないであろう。
その他の抗酸化物質の再生:抗酸化物質がフリーラジカルを除去する際にはそれ自体が酸化され、それが還元されるまではさらにROSやRNSを除去することができない。試験管内では、ジヒドロリポ酸はコエンザイムQ10、ビタミンC、およびグルタチオンを含むいくつかの重要な抗酸化物質の酸化型を還元する能力を持つ強力な還元剤である(図5参照)(16,17)。ジヒドロリポ酸はまた、酸化されたビタミンC(「ビタミンE」のタイトルの記事参照)(18)または酸化されたコエンザイムQ10(「コエンザイムQ10」のタイトルの記事参照)(19)の再生によって、酸化されたα-トコフェロール(ビタミンE)を直接または間接的に還元するのかもしれない。ジヒドロリポ酸が生理学的な状況で効果的に抗酸化物質を再生するのかどうかは不明である(3)。
金属のキレート化:遊離鉄や遊離銅のような酸化還元活性のある金属イオンは、非常に反応性の高いフリーラジカルを生成する反応の触媒をすることによって、酸化ダメージを誘発することがある(20)。遊離金属イオンをフリーラジカルの生成を防ぐようなやり方でキレート化する化合物は、金属誘発性の酸化ダメージが病原として関わっているかもしれない神経変性疾患やその他の慢性疾患の治療に有望である(21)。リポ酸もジヒドロリポ酸も、試験管内では銅および鉄を介した酸化ダメージを阻害し、動物モデルでは過剰な鉄および銅の蓄積を阻害することがわかっている(24,25)。リポ酸はまた、重金属毒性に対する補助療法として役立つかもしれない。水銀の毒性に対してリポ酸をキレート剤として使用することを調べた臨床試験はないが、それはいくつかの哺乳動物では有効であると証明されている(26,27)。
抗酸化シグナル伝達経路の活性化:グルタチオンも、発がん性や毒素があるかもしれない物質の解毒や除去に関わる重要な細胞内抗酸化物質である。老いた動物における(若い動物に比べての)グルタチオンの合成低下や組織での濃度低下から、酸化ストレスや毒素にさらされた際の反応が低下する可能性が示唆される(28)。培養細胞や、リポ酸を与えられた老齢の動物において、リポ酸はグルタチオン濃度を上昇させることがわかっている(29,30)。リポ酸は、グルタチオン合成の律速酵素であるγグルタミルシステインリガーゼ(γ-GCL)の発現を上方制御すること(31)で、またグルタチオン合成に必要なアミノ酸であるシステインの細胞への取り込みを増やすこと(32)で、老いたラットにおけるグルタチオン合成を増やすことができるかもしれない。核内因子E2関連因子2(Nrf2)依存性経路の活性化を通して、リポ酸はγ-GCLやその他の抗酸化酵素の発現を上方制御することがわかっている(31,33)。
手短に言えば、Nrf2はサイトゾル(細胞基質)内のケルヒ様ECH関連タンパク質1(Keap1)に結合した転写因子である。Keap1は、Nrf2を放出することで酸化ストレスシグナルに反応する。放出の際には、抗酸化酵素や捕捉剤を符号化する遺伝子のプロモーター領域にある抗酸化剤応答配列(ARE)と結合可能な核にNrf2が移動する。リポ酸-ただしジヒドロリポ酸ではない-はKeap1の特定のスルフヒドリル残基と反応可能で、Nrf2の放出を起こす(34)。Nrf2/ARE標的遺伝子は、γ-GCL、NAD(P)Hキノン酸化還元酵素1(NQO-1)、ヘムオキシゲナーゼ1(HO-1)、カタラーゼ、およびスーパーオキシドディスムターゼ(SOD)を含むいくつかの抗酸化反応仲介物質を符号化する。たとえば、培養肝細胞や肥満もしくは糖尿病のラットの肝臓では、リポ酸でNrf2経路を上方制御すると、脂質過剰で誘発される脂肪肝や細胞死が防がれた(36)。Nrf2経路やその他の抗炎症性経路の活性化を通して、リポ酸はまたメトトレキサートで治療したラットの酸化ストレス誘発性肝臓障害から肝臓を保護した(37)。治療前および治療後にリポ酸を与えると、Nrf2を介したHO-1の上方制御によって、ラットのリポ多糖(LPS)誘発性病理組織学的肺変質がそれぞれ予防および回復した(38)。
ニコチンアミドアデニンジヌクレオチドリン酸(NADPH)酸化酵素(NOX)の阻害:NOXは酸素とNADPHからのスーパーオキシド生成を触媒する細胞膜結合酵素複合体であり、微生物に対する自然免疫防御に関わる(39)。リポ酸は、インスリン-ホスファチジルイノシトール3キナーゼ(PI3K)-プロテインキナーゼB(PKB/Akt)シグナル伝達経路を上方制御することで、脳虚血のラットモデルでNOX誘発性のスーパーオキシド生成を防ぎ、梗塞体積と神経学的欠損を制限した(40)。胃がん細胞をリポ酸で治療すると、NOXで発生するROSの生成と、ヘリコバクター・ピロリ菌(H.pylori)感染に誘発されたがん細胞増殖を低下させた(41)。
細胞のブドウ糖取り込みの調整
インスリンがインスリン受容体と結合するとタンパク質のリン酸化カスケードを刺激し、グルコース輸送体(GLUT4)の細胞膜への移動や細胞のブドウ糖取り込みの増加につながる(3,42)。リポ酸は培養細胞でインスリンシグナル伝達カスケードを活性化し(3,42,43)、GLUT4の細胞膜への移動を増やし、培養された動物性脂肪細胞および筋肉細胞でのブドウ糖取り込みを増やす(44,45)ことがわかっている。コンピュータモデルによる研究で、リポ酸はインスリン受容体の細胞内チロシンキナーゼ領域と結合し、この酵素の活性型を安定化させているかもしれないことが示唆された(43)。
その他のシグナル伝達経路の調整
Nrf2やインスリンシグナル伝達経路に加えて、リポ酸はその他の細胞シグナル伝達分子を標的にし、それによって代謝、ストレス反応、分裂、および生存といった様々な細胞プロセスに影響することがわかった。たとえば培養された内皮細胞では、酸化還元感受性で炎症促進性の転写因子である核内因子カッパB(NFKB)のサイトゾルから核への移動を促進する酵素であるIKK-βを、リポ酸が阻害することがわかっている(46)。リポ酸はまた、内皮一酸化窒素(NO)合成酵素(eNOS)のPKB/Akt依存性リン酸化とeNOSに触媒されたNO生成を増やすことで、年老いたラットのNO依存性血管拡張を高めることが示されている(47)。さらに、年老いたマウスの骨格筋においてAMPに活性化されたプロテインキナーゼ(AMKP)誘発性の転写因子PGC-1αの活性化を起こすことで、リポ酸はミトコンドリアでの生合成を増やした(48)。様々なモデルや異なる実験条件下でリポ酸の標的の可能性のある経路について、いくつかの文献レビューで述べられている(49~52)。
欠乏症
リポ酸欠乏症は、リポ酸生合成経路における遺伝性突然変異の稀な症例として述べられてきた。リポ酸代謝に欠陥のある患者で見つかっている突然変異は、鉄-硫黄クラスターの合成に関わる遺伝子や、リポ酸合成酵素(LIAS)、リポイルトランスフェラーゼ1(LIPT1)、およびジヒドロリポアミド脱水素酵素(DLD;α-ケト酸脱水素酵素複合体のE3成分)を符号化する遺伝子に影響する(5,53,54)。
疾病治療
糖尿病
慢性的に高い血中ブドウ糖濃度は、糖尿病の特徴である。1型糖尿病は膵臓のインスリン生成β細胞の自己免疫破壊によって起こり、インスリン生成が不十分になる。正常な血中ブドウ糖濃度(すなわち、空腹時血糖が100 mg/dL未満)を維持するために、インスリンを外部から補給することが必要である。対照的に、インスリンに反応しての組織でのブドウ糖取り込み障害(インスリン抵抗性と呼ばれる現象)が、2型糖尿病の発症に重要な役割をする(55)。2型糖尿病患者は最終的にインスリンが必要になるかもしれないが、インスリン感受性を強める介入が正常な血中ブドウ糖濃度を維持するために行われるかもしれない。「前糖尿病」という用語は、2型糖尿病発症リスクが高くなる初期の代謝異常を表すために時折使われる。留意したいのは、これらの患者は心血管疾患リスクも高いことだ。米国糖尿病学会によると、前糖尿病は空腹時血糖濃度が100 mg/dL~125 mg/dLの間であるということが特徴的な空腹時血糖異常の状態であること、および/または経口ブドウ糖負荷試験の後の2時間血糖濃度が140 mg/dL以上であることが特徴的な耐糖能障害の状態であることとして定義される(56)。
ブドウ糖の利用
ブドウ糖の利用に対する高用量リポ酸の効果は、初めに2型糖尿病の者について調べられた。13人の2型糖尿病患者による初期の臨床試験で、1,000 mgのリポ酸の単回静脈内注入によって、インスリン刺激性ブドウ糖処理(すなわちインスリン感受性)がプラセボ注入に比べて50%向上したことがわかった(57)。72人の2型糖尿病患者によるプラセボ対照研究で、600 mg/日、1,200 mg/日、または1,800 mg/日のリポ酸の経口投与で、治療後4週間のインスリン感受性が25%向上したことがわかった(58)。これら3種類のリポ酸用量における有意な差はなく、このことから600 mg/日が最大有効用量であるかもしれないことが示唆される(55)。しかし102人の被験者による最近の無作為化プラセボ対照研究で、16週間毎日600 mgのリポ酸(さらに800 mgのビタミンE(α-トコフェロール)を追加もしくは追加無しで)補給をしても、空腹時血糖、空腹時インスリン、または恒常性モデル評価によるインスリン抵抗性指標(HOMA-IR)と呼ばれるインスリン抵抗性測定値に何の効果もなかった(59)。2018年のシステマティックレビュー(概説)やメタ解析で、代謝障害(2型糖尿病に限らない)のある1,245人の被験者におけるブドウ糖利用のマーカーに対するリポ酸補給の効果を調べた20の無作為化対照試験(2007~2017年に発表)が確認された(60)。他の栄養素と一緒もしくは単独でリポ酸投与(200~1,800 mg/日を2週間~1年)をすると、空腹時血糖およびインスリン濃度、インスリン抵抗性、および過去数ヶ月間の血糖コントロールのマーカーである血中HbA1c濃度が下がったことがわかった(60)。
内皮機能
血管内皮として知られる血管の内皮は、心臓や血管の健康維持に重要な役割をする。特に、血管拡張と呼ばれる現象である動脈を含む全てのタイプの血管の弛緩を促進することで、一酸化窒素(NO)は血管の緊張と血流を調整する。NOが仲介する内皮依存性血管拡張の変化は、広汎な血管収縮や凝結異常に至り、アテローム性動脈硬化症発症の初期段階であると考えられている。慢性的な高血糖、インスリン抵抗性、酸化ストレス、および炎症促進性メカニズムの存在が、糖尿病患者の内皮機能障害に寄与する(61)。
上腕の血流依存性血管拡張反応(FMD)の測定値は、内皮機能の代替マーカーとしてしばしば使用される。内皮依存性血管拡張を測定するために、2つの技法が使用されている。一つは、アセチルコリンを注入した間の静脈閉塞プレチスモグラフィーによって前腕の血流を測定する。この侵襲性技法の使用によって、リポ酸の動脈内注入で2型糖尿病の39人の被験者で内皮依存性血管拡張が向上したが、11人の健康な対照群ではそうではなかったことがわかった(62)。2型糖尿病の30人の患者による最近の無作為化二重盲検プラセボ対照研究で、内皮依存性血管拡張剤であるアセチルコリンへの反応が600 mgのリポ酸の静脈内注入によって向上したが、内皮非依存性血管拡張剤である三硝酸グリセリンに対する反応は向上しなかったことがわかった(63)。血流仲介性血管拡張を測定する超音波を使用した非侵襲性である別の技法は、Xiang et al.によって行われた2つの追加的研究で使用された(64,65)。これらの無作為化プラセボ対照研究の結果から、静脈内リポ酸注入が空腹時血糖異常(64)や耐糖能異常(65)の患者の内皮機能を向上させるかもしれないことが示された。
ブドウ糖および脂質の代謝異常が特徴的症状であるメタボリック症候群と診断された58人の患者への経口リポ酸補給の効果を評価した一つの無作為化プラセボ対照試験では、300 mg/日のリポ酸を4週間補給したところ、血流仲介性血管拡張が44%向上したことが示された(66)。
糖尿病性神経障害
末梢神経障害:糖尿病患者の最大50%がとりわけ下肢の痛み、感覚の喪失、および脱力を起こすかもしれない神経障害の一種である末梢神経障害を発症する(67)。末梢神経障害は、糖尿病患者の下肢切断の主因でもある(68)。慢性的高血糖誘発性神経障害を説明するいくつかのメカニズムが提唱されており、ソルビトールの細胞内蓄積、糖化反応、および酸化ストレスやニトロソ化ストレスなどがある((69)の文献でレビュー)。いくつかの大規模無作為化対照試験の結果から、血糖を正常に近い濃度に維持することが糖尿病性神経障害や下肢切断のリスクを制限する最も重要なステップであることが示された(70~72)。しかし神経障害の予防における糖血症のコントロール強化の効能は、1型糖尿病患者の方が2型糖尿病患者よりも高い(73)。さらに、この血糖コントロール介入は低血糖発作のリスクを上げる(73)。
神経障害症状の管理における静脈内または経口での投与によるリポ酸の効能が、糖尿病患者で調べられてきた。無作為化対照試験のメタ解析では、300~600 mg/日のリポ酸注入を2~4週間することで、糖尿病性神経障害の症状が臨床的に有意義な程度まで大きく軽減したことが示唆された(55,74)。経口リポ酸補給の効能について、24人の2型糖尿病患者による初期の短期間研究で、600 mgのリポ酸を1日に3回3週間補給した者は、プラセボを摂取した者に比べて末梢神経障害の症状がよくなったことがわかった(75)。より大規模な臨床試験では、500人超の2型糖尿病患者および症候性末梢神経障害患者に次の治療のうちの一つを無作為にあてがった。それらは(i)600 mg/日のリポ酸静脈注入を3週間やり、1,800 mg/日の経口リポ酸補給を6ヶ月間、(ii)600 mg/日のリポ酸静脈注入を3週間やり、経口プラセボ補給を6ヶ月間、または(iii)プラセボの静脈注入を3週間やり、経口プラセボ補給を6ヶ月間のいずれかである(76)。医師によって評価された感覚および運動面における欠陥の改善エビデンスは3週間のリポ酸静脈注入による治療で観察されたかもしれないが、6ヶ月間の経口リポ酸治療の終わりには見られなかった。しかし糖尿病性神経障害のある181人の患者による別の無作為化二重盲検プラセボ対照試験で、5週間の600 mg/日、1,200 mg/日、または1,800 mg/日のいずれかの経口リポ酸補給によって、神経障害の症状が大きく改善したことがわかった(77)。この研究では、600 mg/日の用量でもそれより高い用量と同じ効果があった。最後に、遠位対称性感覚運動性多発神経障害のある421人の糖尿病患者による4年間の多機関臨床試験で、下肢および神経伝導の神経性障害を評価する総合点である主要エンドポイントにおいて、600 mg/日の経口リポ酸投与とプラセボとでは何の差も見られなかったことがわかった(78)。しかし、特定の神経性障害の測定値(二次的結果)は、リポ酸補給で改善した(78)。事後解析においては、正常な肥満指数(BMI)と血圧であるが心血管疾患、糖尿病、および神経障害が重い被験者ではとりわけ、経口リポ酸補給で神経障害的症状が軽減するかもしれないことが示唆された(79)。
自律神経障害:糖尿病の別の神経性合併症は心臓自律神経障害(CAN)であり、これは25%もの糖尿病患者に発生する(55)。CANは心臓および血管の神経支配をする神経線維の損傷が特徴的であり、心拍変動(心臓鼓動の間隔時間の変動性)の低下や死亡リスク上昇に至る(80)。2型糖尿病および心拍変動低下のある72人の患者による無作為化対照試験で、4ヶ月間800 mg/日の経口リポ酸補給をしたら、プラセボに比べて心拍変動の4つの測定値のうちの2つがかなり改善した(81)。
要約:全体的に、静脈注入または経口でのリポ酸による治療は糖尿病性末梢神経障害の症状を軽減するのに役立つかもしれないことが、公表されている研究では示唆されている。糖尿病性神経障害の治療にリポ酸を使用することは、現在ドイツで承認されている(4)。糖尿病性神経障害の治療におけるリポ酸の効能を調べた多くの研究は、主にドイツのある研究グループによって行われ、ドイツのリポ酸製造会社によって資金提供されていることに留意することが重要である(82)。
糖尿病性網膜症
慢性的な高血糖は網膜の血管を損ない、糖尿病性網膜症と呼ばれる視覚を脅かす可能性のある状態を起こすことがある(83)。あるプラセボ対照研究で、12人の1型糖尿病の者、48人の2型糖尿病の者、および20人の糖尿病のない者という80人の参加者の視覚能力に対するリポ酸の効果が調べられた。その結果、毎日300 mgのリポ酸の3ヶ月間経口投与によって、プラセボに比べて糖尿病患者のコントラスト感度の悪化が防がれ、健康な者ではそれが向上したことが示された(84)。
多発性硬化症
多発性硬化症は病因が未知の自己免疫疾患で、中枢神経系のミエリンと神経線維の進行的破壊が特徴的であり、これを患う者に神経性症状を引き起こす(85)。多発性硬化症には病気の進み方によって定義された4つの主要なタイプがある。それらは(i)臨床的に単独性の症状、(ii)再発寛解型多発性硬化症、(iii)二次性進行型多発性硬化症、および(iv)一次性進行型多発性硬化症である(詳細については米国多発性硬化症協会のウェブサイトを参照のこと)(86)。多発性硬化症のモデルである実験的自己免疫性脳脊髄膜炎(EAE)のマウスに経口(87)で、腹腔内(88)に、または皮下(89)にリポ酸を投与すると、疾患の進行を効果的に遅らせることがわかった。動物およびin vitroの研究では、自然免疫機能の中心的調整物質である環状アデノシン一リン酸(cAMP)の生成を促進するメカニズムを介してリポ酸が免疫調整特性を示し、おそらくは細胞接着分子の内皮での発現を減らしたり、マトリクスメタロプロテアーゼ(細胞外基質分解酵素、MMP)などの酵素の発現を阻害したり、および/または血液脳関門の浸透性を下げたり(87,89,93,94)して、脳や脊髄への免疫細胞の移動を阻害する(92)ことがわかった。
ヒトへのリポ酸補給について調べた研究は少ない。再発型または進行型多発性硬化症の30人の者へのリポ酸投与の安全性を評価するために考案された小規模予備研究で、2週間1,200~2,400 mg/日の経口リポ酸で治療したところ、全般的によい耐容性があったことがわかった(「安全性」の項参照)(95)。この研究では、血清リポ酸濃度が高いことと炎症マーカーであるMMP-9の最低血清濃度との関連があった(95)。別の研究では、多発性硬化症の被験者に1,200 mgの経口用量のリポ酸を投与すると、マウスで治療効果があるとわかっている血清リポ酸濃度と同様の濃度になることに役立つかもしれないことが示唆された(96)。再発寛解型多発性硬化症の52人の被験者(平均年齢30歳)による無作為化プラセボ対照研究で、リポ酸補給(1,200 mg/日を12週間)によって血中の全抗酸化能力が高まったが、特定の抗酸化酵素(スーパーオキシドジスムターゼおよびグルタチオンペルオキシダーゼ)の活性は高まらなかったことがわかった(97)。リポ酸補給はまた、いくつかのマーカー(IFN-γ、ICAM-1、TGF-γ、IL-4)の血清濃度、サイトカイン、およびその他の炎症を低減させたが、すべてのマーカーがそうだったわけではない(TNF-γ、IL-6、MMP-9)(98)。さらに、リポ酸補給は総合障害度評価尺度(EDSS)スコアで評価された多発性硬化症の症状の重篤度を下げたわけではない(98,99)。
進行型多発性硬化症患者の運動性喪失や脳体積変化に対するリポ酸(1,200 mg/日)の効果を評価するように考案された2年間の臨床試験が、現在進行中である(85)。
認知機能障害と認知症
加齢および神経変性疾患の動物モデルによる研究で、リポ酸投与によって空間記憶、学習能力、および/または運動機能の測定値が改善するかもしれないことが示された((100)の文献でレビュー)。
経口リポ酸補給によって、ヒトの加齢に関連した認知機能低下または病理的症状を遅くできるのかどうかはわからない。アセチルコリンエステラーゼ阻害薬も服用しているアルツハイマー病であろう患者および関連する認知症の患者9人による非対照オープンラベル試験で、600 mg/日の経口リポ酸補給で1年間にわたって認知機能が安定化したようだと報告された(101)。43人の患者を最長4年間追跡したその後の研究で、アセチルコリンエステラーゼ阻害薬とともにリポ酸(600 mg/日)を摂取した軽度認知症または初期の中度認知症の者は、文献で報告されたようなアルツハイマー病患者の典型的な認知機能低下に比べて、認知機能低下がゆっくりだったことがわかった(102)。しかしこれらの発見の重要性を、比較のための対照群なしで評価することは難しい。ある無作為化対照試験で、1,200 mg/日の経口リポ酸補給を10週間しても、HIVに関連した認知機能障害に何の有益性もなかったことがわかった(103)。アルツハイマー病の39人の患者による別の無作為化試験の結果では、魚油濃縮物(オメガ3脂肪酸が豊富)をリポ酸有り(600 mg/日)または無しで1年間補給したら、手段的日常生活動作(IADL)スコアで評価された認知的および機能的障害の進行が、プラセボに比べて遅くなったことが示唆された(104)。興味深いことに、魚油濃縮物をリポ酸と一緒に摂取した患者は、魚油濃縮物のみまたはプラセボを摂取した者に比べて、12ヶ月にわたって全体的認知機能(ミニメンタルステート検査(MMSE)で評価)が何も悪化しなかった(104)。これらの予備的発見を確認し、神経変性疾患の予防および/または管理におけるリポ酸補給の有益性をさらに評価する大規模試験が必要である。
体重管理
無作為化プラセボ対照試験の2018年のメタ解析で、肥満指数(BMI)が高い者へのリポ酸補給によって、カロリー制限なし(1つの研究を除く)であっても体重(9つの研究)およびBMI(11の研究)が穏やかながら有意義に減ったことがわかった(105)。サブグループ(部分集団)解析によって、体重過多の者は肥満の者より、不健康な者は健康な者より体重減少が大きく、さらに毎日の用量が600 mg以上で、また介入期間が10週間より短い場合に体重減少が大きかったことがわかった。リポ酸補給をしても、腹囲の減少はなかった(5つの研究)(105)。体重過多または肥満の被験者へのリポ酸補給で体重やBMIが実質的に減ることは、以前のメタ解析でも報告されていた(106)。
摂取源
内因性生合成
R-リポ酸はヒトによって内因的に合成される(「代謝と生物学的利用性」の項参照)。
食物の摂取源
R-リポ酸は、食物中でタンパク質中のリシン(リポイルリシン、図1参照)と共役結合して天然発生する。リポ酸は植物から動物まで幅広い食物源中で見られるが、リポ酸の量に関する情報または食物中のリポイルリシン含有量の情報は限られている。すなわち、公的なデータベースがない。リポイルリシン含有量の多い(約1~3μg/乾燥重量g)動物組織には腎臓、心臓、および肝臓があり、リポイルリシンの豊富な植物にはホウレンソウやブロッコリーがある(107)。それよりやや低いリポイルリシン(約0.5μg/乾燥重量g)は、トマト、豆、および芽キャベツに見られる。
サプリメント
食物中のリポ酸と異なり、サプリメント中のリポ酸はタンパク質と結合していない。さらに、栄養補助食品で摂取可能なリポ酸の量(50~600 mg)は、食事から得られるであろう量の1,000倍にもなるであろう。ドイツではリポ酸は糖尿病性神経障害の治療用に承認され、処方箋で入手可能である(108)。米国では、リポ酸は処方箋なしで栄養補助食品として市販されている。ほとんどのリポ酸サプリメントは、R-リポ酸とS-リポ酸(時としてd,l-リポ酸と注記される)のラセミ混合物を含む。R-リポ酸のみを含むとしているサプリメントは通常はより高価で、その純度についての情報は一般利用ができない(109)。食事と一緒にリポ酸を摂取するとその生物学的利用性が下がるので、リポ酸は一般的に食事の30分前に摂取するよう推奨される(「代謝と生物学的利用性」の項も参照)(8)。
ラセミ混合物とR-リポ酸のみの比較
R-リポ酸は植物や動物によって合成される異性体で、タンパク質と結合した形態でミトコンドリア酵素の補助因子として機能する(「生物活性」の項参照)。経口ラセミ混合物とR-リポ酸のサプリメントの生物学的利用性の直接的比較は公表されていない。R、S-リポ酸の摂取後、R-リポ酸のピーク血漿濃度はS-リポ酸のそれより40~50%高いことがわかり、このことからR-リポ酸の方が吸収が良いことが示唆される。そうではあるものの、どちらの異性体も急速に代謝され除去される(6,8,11)。ラットでは、R-リポ酸はS-リポ酸より骨格筋でのインスリン刺激性グルコース輸送と代謝の強化により効果的(110)であり、R-リポ酸は白内障の予防にR、S-リポ酸やS-リポ酸よりも効果的であった(111)。しかし、今まで公表されたヒトによる研究の全てでは、R、S-リポ酸(ラセミ混合物)を使用している。ラセミ混合物に含まれるS-リポ酸がR-リポ酸の重合を制限し、その生物学的利用性を高めているのかもしれないと示唆されている(52)。現在のところ、サプリメントのどの形態が臨床試験での使用に一番良いのかは未知なままである。
安全性
有害作用
一般的に、高用量リポ酸投与は深刻な副作用がほとんどないことがわかっている。糖尿病性末梢神経障害の治療に600 mg/日の用量で3週間(112)静脈投与しても、1,800 mg/日という高用量で6ヶ月間(113)、または1,200 mg/日で2年間(76)経口摂取しても、深刻な有害作用は起こらなかった。糖尿病性神経障害で600 mg/日のリポ酸を4年間摂取した患者とプラセボ群との間に、有害事象や深刻な有害事象の発生の大きな差はなかった(78)。多発性硬化症の参加者を含む予備研究でも、経口で2,400 mg/日を2週間摂取しても安全であったことがわかった(95)。静脈注入によるリポ酸投与後に、2例の軽度アナフィラキシー反応と、咽頭痙攣を含む1例の重篤なアナフィラキシー反応の報告があった(55)。経口リポ酸補給で最もよく報告される副作用は皮膚に影響するアレルギー反応で、発疹、じんましん、および痒みを含む。腹痛、吐き気、嘔吐、およびめまいも報告され、ある試験では吐き気、嘔吐、およびめまいの発生は用量に依存することがわかった(77)。さらに、経口で1,200 mg/日のリポ酸を摂取した者に尿の悪臭があった(95)。
妊娠と授乳
ある後ろ向き観察研究で、妊娠10~30週から37週の終わりの期間中に中断なく600 mgのリポ酸(ラセミ混合物)を毎日経口補給しても、母親やその新生児に何の有害作用もなかったことが報告された(114)。さらなるエビデンスがないため、妊娠中のリポ酸補給は厳密な医学的監督の元で考慮されるべきである。授乳中の女性へのリポ酸補給の安全性は確立されておらず、したがって思いとどまるべきである(115)。
子供
生後20ヶ月の乳児(体重10.5 kg)が誤って600 mgのリポ酸錠剤を4つ飲み込んでしまった後で、中毒症になった症例が報告された(116)。その乳児は痙攣、アシドーシス(酸性血症)、および意識不明で入院した。症状管理と急速なリポ酸除去で、5日間で後遺症なく完全に回復できた。ある思春期の少女は非常に高用量のリポ酸を非偶発的に摂取したことで多臓器不全になり、その後死亡した(117)。
薬物相互作用
理論的にはリポ酸補給はインスリン媒介性のブドウ糖利用を改善するかもしれない(「糖尿病」の項参照)ため、インスリンまたは経口の抗糖尿病薬を使用している糖尿病患者が低血糖になる潜在的リスクがある(118)。したがって、糖尿病の治療計画にリポ酸補給が加えられる場合は、血中ブドウ糖濃度を綿密に監視すべきである。しかし24人の健康なボランティアによる1つの研究で、単回の経口用量リポ酸(600 mg)とグリブリド(グリベンクラミドとも呼ばれる)またはアカルボース(プレコース/Prandase(プランダース)/グルコバイ)という経口抗糖尿病薬を同時に投与しても、何の重要な薬物相互作用も起きなかったことが報告された(119)。
栄養素相互作用
ビオチン
ビオチンの化学構造はリポ酸と似ているため、リポ酸が高濃度だと細胞膜を通した輸送でビオチンと競合するかもしれないというエビデンスがある(120,121)。ラットに高用量リポ酸を注射して投与すると、2つのビオチン依存性酵素の活性が30~35%下がった(122)が、経口または静脈でのリポ酸補給がヒトでのビオチン必要量を実際に増やすかどうかはわかっていない(123)。
Authors and Reviewers
Originally written in 2002 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in July 2003 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in April 2006 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in January 2012 by:
Victoria J. Drake, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in October 2018 by:
Barbara Delage, Ph.D.
Linus Pauling Institute
Oregon State University
Reviewed in January 2019 by:
Tory M. Hagen, Ph.D.
Principal Investigator, Linus Pauling Institute
Professor, Dept. of Biochemistry and Biophysics
Helen P. Rumbel Professor for Healthy Aging Research
Oregon State University
Copyright 2002-2024 Linus Pauling Institute
References
1. Reed LJ. A trail of research from lipoic acid to alpha-keto acid dehydrogenase complexes. J Biol Chem. 2001;276(42):38329-38336. (PubMed)
2. Carreau JP. Biosynthesis of lipoic acid via unsaturated fatty acids. Methods Enzymol. 1979;62:152-158. (PubMed)
3. Smith AR, Shenvi SV, Widlansky M, Suh JH, Hagen TM. Lipoic acid as a potential therapy for chronic diseases associated with oxidative stress. Curr Med Chem. 2004;11(9):1135-1146. (PubMed)
4. Kramer K, Packer L. R-alpha-lipoic acid. In: Kramer K, Hoppe P, Packer L, eds. Nutraceuticals in Health and Disease Prevention. New York: Marcel Dekker, Inc.; 2001:129-164.
5. Mayr JA, Feichtinger RG, Tort F, Ribes A, Sperl W. Lipoic acid biosynthesis defects. J Inherit Metab Dis. 2014;37(4):553-563. (PubMed)
6. Hermann R, Niebch G, Borbe H, et al. Enantioselective pharmacokinetics and bioavailability of different racemic alpha-lipoic acid formulations in healthy volunteers. Eur J Pharm Sci. 1996;4(3):167-174.
7. Teichert J, Hermann R, Ruus P, Preiss R. Plasma kinetics, metabolism, and urinary excretion of alpha-lipoic acid following oral administration in healthy volunteers. J Clin Pharmacol. 2003;43(11):1257-1267. (PubMed)
8. Gleiter CH, Schug BS, Hermann R, Elze M, Blume HH, Gundert-Remy U. Influence of food intake on the bioavailability of thioctic acid enantiomers. Eur J Clin Pharmacol. 1996;50(6):513-514. (PubMed)
9. Brufani M, Figliola R. (R)-alpha-lipoic acid oral liquid formulation: pharmacokinetic parameters and therapeutic efficacy. Acta Biomed. 2014;85(2):108-115. (PubMed)
10. Maglione E, Marrese C, Migliaro E, et al. Increasing bioavailability of (R)-alpha-lipoic acid to boost antioxidant activity in the treatment of neuropathic pain. Acta Biomed. 2015;86(3):226-233. (PubMed)
11. Breithaupt-Grogler K, Niebch G, Schneider E, et al. Dose-proportionality of oral thioctic acid--coincidence of assessments via pooled plasma and individual data. Eur J Pharm Sci. 1999;8(1):57-65. (PubMed)
12. Evans JL, Heymann CJ, Goldfine ID, Gavin LA. Pharmacokinetics, tolerability, and fructosamine-lowering effect of a novel, controlled-release formulation of alpha-lipoic acid. Endocr Pract. 2002;8(1):29-35. (PubMed)
13. Keith DJ, Butler JA, Bemer B, et al. Age and gender dependent bioavailability of R- and R,S-alpha-lipoic acid: a pilot study. Pharmacol Res. 2012;66(3):199-206. (PubMed)
14. Hiltunen JK, Autio KJ, Schonauer MS, Kursu VA, Dieckmann CL, Kastaniotis AJ. Mitochondrial fatty acid synthesis and respiration. Biochim Biophys Acta. 2010;1797(6-7):1195-1202. (PubMed)
15. Bustamante J, Lodge JK, Marcocci L, Tritschler HJ, Packer L, Rihn BH. Alpha-lipoic acid in liver metabolism and disease. Free Radic Biol Med. 1998;24(6):1023-1039. (PubMed)
16. Jones W, Li X, Qu ZC, Perriott L, Whitesell RR, May JM. Uptake, recycling, and antioxidant actions of alpha-lipoic acid in endothelial cells. Free Radic Biol Med. 2002;33(1):83-93. (PubMed)
17. Kozlov AV, Gille L, Staniek K, Nohl H. Dihydrolipoic acid maintains ubiquinone in the antioxidant active form by two-electron reduction of ubiquinone and one-electron reduction of ubisemiquinone. Arch Biochem Biophys. 1999;363(1):148-154. (PubMed)
18. May JM, Qu ZC, Mendiratta S. Protection and recycling of alpha-tocopherol in human erythrocytes by intracellular ascorbic acid. Arch Biochem Biophys. 1998;349(2):281-289. (PubMed)
19. Upston JM, Terentis AC, Stocker R. Tocopherol-mediated peroxidation of lipoproteins: implications for vitamin E as a potential antiatherogenic supplement. Faseb J. 1999;13(9):977-994. (PubMed)
20. Valko M, Morris H, Cronin MT. Metals, toxicity and oxidative stress. Curr Med Chem. 2005;12(10):1161-1208. (PubMed)
21. Doraiswamy PM, Finefrock AE. Metals in our minds: therapeutic implications for neurodegenerative disorders. Lancet Neurol. 2004;3(7):431-434. (PubMed)
22. Ou P, Tritschler HJ, Wolff SP. Thioctic (lipoic) acid: a therapeutic metal-chelating antioxidant? Biochem Pharmacol. 1995;50(1):123-126. (PubMed)
23. Suh JH, Zhu BZ, deSzoeke E, Frei B, Hagen TM. Dihydrolipoic acid lowers the redox activity of transition metal ions but does not remove them from the active site of enzymes. Redox Rep. 2004;9(1):57-61. (PubMed)
24. Suh JH, Moreau R, Heath SH, Hagen TM. Dietary supplementation with (R)-alpha-lipoic acid reverses the age-related accumulation of iron and depletion of antioxidants in the rat cerebral cortex. Redox Rep. 2005;10(1):52-60. (PubMed)
25. Yamamoto H, Watanabe T, Mizuno H, et al. The antioxidant effect of DL-alpha-lipoic acid on copper-induced acute hepatitis in Long-Evans Cinnamon (LEC) rats. Free Radic Res. 2001;34(1):69-80. (PubMed)
26. Patrick L. Mercury toxicity and antioxidants: Part 1: role of glutathione and alpha-lipoic acid in the treatment of mercury toxicity. Altern Med Rev. 2002;7(6):456-471. (PubMed)
27. Rooney JP. The role of thiols, dithiols, nutritional factors and interacting ligands in the toxicology of mercury. Toxicology. 2007;234(3):145-156. (PubMed)
28. Hagen TM, Vinarsky V, Wehr CM, Ames BN. (R)-alpha-lipoic acid reverses the age-associated increase in susceptibility of hepatocytes to tert-butylhydroperoxide both in vitro and in vivo. Antioxid Redox Signal. 2000;2(3):473-483. (PubMed)
29. Busse E, Zimmer G, Schopohl B, Kornhuber B. Influence of alpha-lipoic acid on intracellular glutathione in vitro and in vivo. Arzneimittelforschung. 1992;42(6):829-831. (PubMed)
30. Monette JS, Gomez LA, Moreau RF, et al. (R)-alpha-Lipoic acid treatment restores ceramide balance in aging rat cardiac mitochondria. Pharmacol Res. 2011;63(1):23-29. (PubMed)
31. Suh JH, Shenvi SV, Dixon BM, et al. Decline in transcriptional activity of Nrf2 causes age-related loss of glutathione synthesis, which is reversible with lipoic acid. Proc Natl Acad Sci U S A. 2004;101(10):3381-3386. (PubMed)
32. Suh JH, Wang H, Liu RM, Liu J, Hagen TM. (R)-alpha-lipoic acid reverses the age-related loss in GSH redox status in post-mitotic tissues: evidence for increased cysteine requirement for GSH synthesis. Arch Biochem Biophys. 2004;423(1):126-135. (PubMed)
33. Zhang J, Zhou X, Wu W, Wang J, Xie H, Wu Z. Regeneration of glutathione by alpha-lipoic acid via Nrf2/ARE signaling pathway alleviates cadmium-induced HepG2 cell toxicity. Environ Toxicol Pharmacol. 2017;51:30-37. (PubMed)
34. Fratantonio D, Speciale A, Molonia MS, et al. Alpha-lipoic acid, but not di-hydrolipoic acid, activates Nrf2 response in primary human umbilical-vein endothelial cells and protects against TNF-alpha induced endothelium dysfunction. Arch Biochem Biophys. 2018;655:18-25. (PubMed)
35. Sena CM, Cipriano MA, Botelho MF, Seica RM. Lipoic acid prevents high-fat diet-induced hepatic steatosis in Goto Kakizaki rats by reducing oxidative stress through Nrf2 activation. Int J Mol Sci. 2018;19(9). (PubMed)
36. Pilar Valdecantos M, Prieto-Hontoria PL, Pardo V, et al. Essential role of Nrf2 in the protective effect of lipoic acid against lipoapoptosis in hepatocytes. Free Radic Biol Med. 2015;84:263-278. (PubMed)
37. Fayez AM, Zakaria S, Moustafa D. Alpha lipoic acid exerts antioxidant effect via Nrf2/HO-1 pathway activation and suppresses hepatic stellate cells activation induced by methotrexate in rats. Biomed Pharmacother. 2018;105:428-433. (PubMed)
38. Lin YC, Lai YS, Chou TC. The protective effect of alpha-lipoic Acid in lipopolysaccharide-induced acute lung injury is mediated by heme oxygenase-1. Evid Based Complement Alternat Med. 2013;2013:590363. (PubMed)
39. Segal AW. The function of the NADPH oxidase of phagocytes and its relationship to other NOXs in plants, invertebrates, and mammals. Int J Biochem Cell Biol. 2008;40(4):604-618. (PubMed)
40. Dong Y, Wang H, Chen Z. Alpha-lipoic acid attenuates cerebral ischemia and reperfusion injury via insulin receptor and PI3K/Akt-dependent inhibition of NADPH oxidase. Int J Endocrinol. 2015;2015:903186. (PubMed)
41. Byun E, Lim JW, Kim JM, Kim H. alpha-Lipoic acid inhibits Helicobacter pylori-induced oncogene expression and hyperproliferation by suppressing the activation of NADPH oxidase in gastric epithelial cells. Mediators Inflamm. 2014;2014:380830. (PubMed)
42. Konrad D. Utilization of the insulin-signaling network in the metabolic actions of alpha-lipoic acid-reduction or oxidation? Antioxid Redox Signal. 2005;7(7-8):1032-1039. (PubMed)
43. Diesel B, Kulhanek-Heinze S, Holtje M, et al. Alpha-lipoic acid as a directly binding activator of the insulin receptor: protection from hepatocyte apoptosis. Biochemistry. 2007;46(8):2146-2155. (PubMed)
44. Estrada DE, Ewart HS, Tsakiridis T, et al. Stimulation of glucose uptake by the natural coenzyme alpha-lipoic acid/thioctic acid: participation of elements of the insulin signaling pathway. Diabetes. 1996;45(12):1798-1804. (PubMed)
45. Yaworsky K, Somwar R, Ramlal T, Tritschler HJ, Klip A. Engagement of the insulin-sensitive pathway in the stimulation of glucose transport by alpha-lipoic acid in 3T3-L1 adipocytes. Diabetologia. 2000;43(3):294-303. (PubMed)
46. Ying Z, Kampfrath T, Sun Q, Parthasarathy S, Rajagopalan S. Evidence that alpha-lipoic acid inhibits NF-kappaB activation independent of its antioxidant function. Inflamm Res. 2011;60(3):219-225. (PubMed)
47. Smith AR, Hagen TM. Vascular endothelial dysfunction in aging: loss of Akt-dependent endothelial nitric oxide synthase phosphorylation and partial restoration by (R)-alpha-lipoic acid. Biochem Soc Trans. 2003;31(Pt 6):1447-1449. (PubMed)
48. Wang Y, Li X, Guo Y, Chan L, Guan X. alpha-Lipoic acid increases energy expenditure by enhancing adenosine monophosphate-activated protein kinase-peroxisome proliferator-activated receptor-gamma coactivator-1alpha signaling in the skeletal muscle of aged mice. Metabolism. 2010;59(7):967-976. (PubMed)
49. Moura FA, de Andrade KQ, dos Santos JC, Goulart MO. Lipoic acid: its antioxidant and anti-inflammatory role and clinical applications. Curr Top Med Chem. 2015;15(5):458-483. (PubMed)
50. Packer L, Cadenas E. Lipoic acid: energy metabolism and redox regulation of transcription and cell signaling. J Clin Biochem Nutr. 2011;48(1):26-32. (PubMed)
51. Rochette L, Ghibu S, Richard C, Zeller M, Cottin Y, Vergely C. Direct and indirect antioxidant properties of alpha-lipoic acid and therapeutic potential. Mol Nutr Food Res. 2013;57(1):114-125. (PubMed)
52. Shay KP, Moreau RF, Smith EJ, Smith AR, Hagen TM. Alpha-lipoic acid as a dietary supplement: molecular mechanisms and therapeutic potential. Biochim Biophys Acta. 2009;1790(10):1149-1160. (PubMed)
53. Mayr JA, Zimmermann FA, Fauth C, et al. Lipoic acid synthetase deficiency causes neonatal-onset epilepsy, defective mitochondrial energy metabolism, and glycine elevation. Am J Hum Genet. 2011;89(6):792-797. (PubMed)
54. Tort F, Ferrer-Cortes X, Thio M, et al. Mutations in the lipoyltransferase LIPT1 gene cause a fatal disease associated with a specific lipoylation defect of the 2-ketoacid dehydrogenase complexes. Hum Mol Genet. 2014;23(7):1907-1915. (PubMed)
55. Ziegler D. Thioctic acid for patients with symptomatic diabetic polyneuropathy: a critical review. Treat Endocrinol. 2004;3(3):173-189. (PubMed)
56. Nathan DM, Davidson MB, DeFronzo RA, et al. Impaired fasting glucose and impaired glucose tolerance: implications for care. Diabetes Care. 2007;30(3):753-759. (PubMed)
57. Jacob S, Henriksen EJ, Schiemann AL, et al. Enhancement of glucose disposal in patients with type 2 diabetes by alpha-lipoic acid. Arzneimittelforschung. 1995;45(8):872-874. (PubMed)
58. Jacob S, Rett K, Henriksen EJ, Haring HU. Thioctic acid--effects on insulin sensitivity and glucose-metabolism. Biofactors. 1999;10(2-3):169-174. (PubMed)
59. de Oliveira AM, Rondo PH, Luzia LA, D'Abronzo FH, Illison VK. The effects of lipoic acid and alpha-tocopherol supplementation on the lipid profile and insulin sensitivity of patients with type 2 diabetes mellitus: a randomized, double-blind, placebo-controlled trial. Diabetes Res Clin Pract. 2011;92(2):253-260. (PubMed)
60. Akbari M, Ostadmohammadi V, Lankarani KB, et al. The effects of alpha-lipoic acid supplementation on glucose control and lipid profiles among patients with metabolic diseases: A systematic review and meta-analysis of randomized controlled trials. Metabolism. 2018;87:56-69. (PubMed)
61. Roberts AC, Porter KE. Cellular and molecular mechanisms of endothelial dysfunction in diabetes. Diab Vasc Dis Res. 2013;10(6):472-482. (PubMed)
62. Heitzer T, Finckh B, Albers S, Krohn K, Kohlschutter A, Meinertz T. Beneficial effects of alpha-lipoic acid and ascorbic acid on endothelium-dependent, nitric oxide-mediated vasodilation in diabetic patients: relation to parameters of oxidative stress. Free Radic Biol Med. 2001;31(1):53-61. (PubMed)
63. Heinisch BB, Francesconi M, Mittermayer F, et al. Alpha-lipoic acid improves vascular endothelial function in patients with type 2 diabetes: a placebo-controlled randomized trial. Eur J Clin Invest. 2010;40(2):148-154. (PubMed)
64. Xiang G, Pu J, Yue L, Hou J, Sun H. alpha-lipoic acid can improve endothelial dysfunction in subjects with impaired fasting glucose. Metabolism. 2011;60(4):480-485. (PubMed)
65. Xiang GD, Sun HL, Zhao LS, Hou J, Yue L, Xu L. The antioxidant alpha-lipoic acid improves endothelial dysfunction induced by acute hyperglycaemia during OGTT in impaired glucose tolerance. Clin Endocrinol (Oxf). 2008;68(5):716-723. (PubMed)
66. Sola S, Mir MQ, Cheema FA, et al. Irbesartan and lipoic acid improve endothelial function and reduce markers of inflammation in the metabolic syndrome: results of the Irbesartan and Lipoic Acid in Endothelial Dysfunction (ISLAND) study. Circulation. 2005;111(3):343-348. (PubMed)
67. National Institute of Diabetes and Digestive and Kidney Diseases. Diabetic Neuropathy. Available at: https://www.niddk.nih.gov/health-information/diabetes/overview/preventing-problems/nerve-damage-diabetic-neuropathies. Accessed 9/23/18.
68. Malik RA, Tesfaye S, Ziegler D. Medical strategies to reduce amputation in patients with type 2 diabetes. Diabet Med. 2013;30(8):893-900. (PubMed)
69. Obrosova IG. Diabetes and the peripheral nerve. Biochim Biophys Acta. 2009;1792(10):931-940. (PubMed)
70. Dy SM, Bennett WL, Sharma R, et al. AHRQ Comparative Effectiveness Reviews. Preventing complications and treating symptoms of diabetic peripheral neuropathy. Rockville (MD): Agency for Healthcare Research and Quality (US); 2017. (PubMed)
71. The Diabetes Control and Complications Trial Research Group. The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. The Diabetes Control and Complications Trial Research Group. N Engl J Med. 1993;329(14):977-986. (PubMed)
72. UK Prospective Diabetes Study (UKPDS) Group. Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33). Lancet. 1998;352(9131):837-853. (PubMed)
73. Callaghan BC, Little AA, Feldman EL, Hughes RA. Enhanced glucose control for preventing and treating diabetic neuropathy. Cochrane Database Syst Rev. 2012(6):Cd007543. (PubMed)
74. Han T, Bai J, Liu W, Hu Y. A systematic review and meta-analysis of alpha-lipoic acid in the treatment of diabetic peripheral neuropathy. Eur J Endocrinol. 2012;167(4):465-471. (PubMed)
75. Ruhnau KJ, Meissner HP, Finn JR, et al. Effects of 3-week oral treatment with the antioxidant thioctic acid (alpha-lipoic acid) in symptomatic diabetic polyneuropathy. Diabet Med. 1999;16(12):1040-1043. (PubMed)
76. Ziegler D, Hanefeld M, Ruhnau KJ, et al. Treatment of symptomatic diabetic polyneuropathy with the antioxidant alpha-lipoic acid: a 7-month multicenter randomized controlled trial (ALADIN III Study). ALADIN III Study Group. Alpha-lipoic acid in diabetic neuropathy. Diabetes Care. 1999;22(8):1296-1301. (PubMed)
77. Ziegler D, Ametov A, Barinov A, et al. Oral treatment with alpha-lipoic acid improves symptomatic diabetic polyneuropathy: the SYDNEY 2 trial. Diabetes Care. 2006;29(11):2365-2370. (PubMed)
78. Ziegler D, Low PA, Litchy WJ, et al. Efficacy and safety of antioxidant treatment with alpha-lipoic acid over 4 years in diabetic polyneuropathy: the NATHAN 1 trial. Diabetes Care. 2011;34(9):2054-2060. (PubMed)
79. Ziegler D, Low PA, Freeman R, Tritschler H, Vinik AI. Predictors of improvement and progression of diabetic polyneuropathy following treatment with alpha-lipoic acid for 4 years in the NATHAN 1 trial. J Diabetes Complications. 2016;30(2):350-356. (PubMed)
80. Balcioglu AS, Muderrisoglu H. Diabetes and cardiac autonomic neuropathy: Clinical manifestations, cardiovascular consequences, diagnosis and treatment. World J Diabetes. 2015;6(1):80-91. (PubMed)
81. Ziegler D, Schatz H, Conrad F, Gries FA, Ulrich H, Reichel G. Effects of treatment with the antioxidant alpha-lipoic acid on cardiac autonomic neuropathy in NIDDM patients. A 4-month randomized controlled multicenter trial (DEKAN Study). Deutsche Kardiale Autonome Neuropathie. Diabetes Care. 1997;20(3):369-373. (PubMed)
82. Nguyen N, Takemoto JK. A case for alpha-lipoic acid as an alternative treatment for diabetic polyneuropathy. J Pharm Pharm Sci. 2018;21(1s):177s-191s. (PubMed)
83. National Institute of Diabetes and Digestive and Kidney Diseases. Diabetic Eye Disease. Available at: https://www.niddk.nih.gov/health-information/diabetes/overview/preventing-problems/diabetic-eye-disease. Accessed 9/24/18.
84. Gebka A, Serkies-Minuth E, Raczynska D. Effect of the administration of alpha-lipoic acid on contrast sensitivity in patients with type 1 and type 2 diabetes. Mediators Inflamm. 2014;2014:131538. (PubMed)
85. National Multiple Sclerosis Society. Definition of Multiple Sclerosis (MS). Available at: https://www.nationalmssociety.org/What-is-MS/Definition-of-MS. Accessed 9/28/18.
86. National Multiple Sclerosis Society. Types of Multiple Sclerosis (MS). Available at: https://www.nationalmssociety.org/What-is-MS/Types-of-MS. Accessed 9/28/18.
87. Marracci GH, Jones RE, McKeon GP, Bourdette DN. Alpha lipoic acid inhibits T cell migration into the spinal cord and suppresses and treats experimental autoimmune encephalomyelitis. J Neuroimmunol. 2002;131(1-2):104-114. (PubMed)
88. Morini M, Roccatagliata L, Dell'Eva R, et al. Alpha-lipoic acid is effective in prevention and treatment of experimental autoimmune encephalomyelitis. J Neuroimmunol. 2004;148(1-2):146-153. (PubMed)
89. Schreibelt G, Musters RJ, Reijerkerk A, et al. Lipoic acid affects cellular migration into the central nervous system and stabilizes blood-brain barrier integrity. J Immunol. 2006;177(4):2630-2637. (PubMed)
90. Salinthone S, Schillace RV, Marracci GH, Bourdette DN, Carr DW. Lipoic acid stimulates cAMP production via the EP2 and EP4 prostanoid receptors and inhibits IFN gamma synthesis and cellular cytotoxicity in NK cells. J Neuroimmunol. 2008;199(1-2):46-55. (PubMed)
91. Schillace RV, Pisenti N, Pattamanuch N, et al. Lipoic acid stimulates cAMP production in T lymphocytes and NK cells. Biochem Biophys Res Commun. 2007;354(1):259-264. (PubMed)
92. George JD, Kim E, Spain R, Bourdette D, Salinthone S. Effects of lipoic acid on migration of human B cells and monocyte-enriched peripheral blood mononuclear cells in relapsing remitting multiple sclerosis. J Neuroimmunol. 2018;315:24-27. (PubMed)
93. Chaudhary P, Marracci GH, Bourdette DN. Lipoic acid inhibits expression of ICAM-1 and VCAM-1 by CNS endothelial cells and T cell migration into the spinal cord in experimental autoimmune encephalomyelitis. J Neuroimmunol. 2006;175(1-2):87-96. (PubMed)
94. Marracci GH, McKeon GP, Marquardt WE, Winter RW, Riscoe MK, Bourdette DN. Alpha lipoic acid inhibits human T-cell migration: implications for multiple sclerosis. J Neurosci Res. 2004;78(3):362-370. (PubMed)
95. Yadav V, Marracci G, Lovera J, et al. Lipoic acid in multiple sclerosis: a pilot study. Mult Scler. 2005;11(2):159-165. (PubMed)
96. Yadav V, Marracci GH, Munar MY, et al. Pharmacokinetic study of lipoic acid in multiple sclerosis: comparing mice and human pharmacokinetic parameters. Mult Scler. 2010;16(4):387-397. (PubMed)
97. Khalili M, Eghtesadi S, Mirshafiey A, et al. Effect of lipoic acid consumption on oxidative stress among multiple sclerosis patients: a randomized controlled clinical trial. Nutr Neurosci. 2014;17(1):16-20. (PubMed)
98. Khalili M, Azimi A, Izadi V, et al. Does lipoic acid consumption affect the cytokine profile in multiple sclerosis patients: a double-blind, placebo-controlled, randomized clinical trial. Neuroimmunomodulation. 2014;21(6):291-296. (PubMed)
99. Khalili M, Soltani M, Moghadam SA, Dehghan P, Azimi A, Abbaszadeh O. Effect of alpha-lipoic acid on asymmetric dimethylarginine and disability in multiple sclerosis patients: A randomized clinical trial. Electron Physician. 2017;9(7):4899-4905. (PubMed)
100. Molz P, Schroder N. Potential therapeutic effects of lipoic acid on memory deficits related to aging and neurodegeneration. Front Pharmacol. 2017;8:849. (PubMed)
101. Hager K, Marahrens A, Kenklies M, Riederer P, Munch G. Alpha-lipoic acid as a new treatment option for Azheimer type dementia. Arch Gerontol Geriatr. 2001;32(3):275-282. (PubMed)
102. Hager K, Kenklies M, McAfoose J, Engel J, Munch G. Alpha-lipoic acid as a new treatment option for Alzheimer's disease--a 48 months follow-up analysis. J Neural Transm Suppl. 2007(72):189-193. (PubMed)
103. Dana Consortium on the Therapy of HIV Dementia and Related Cognitive Disorders. A randomized, double-blind, placebo-controlled trial of deprenyl and thioctic acid in human immunodeficiency virus-associated cognitive impairment. Neurology. 1998;50(3):645-651. (PubMed)
104. Shinto L, Quinn J, Montine T, et al. A randomized placebo-controlled pilot trial of omega-3 fatty acids and alpha lipoic acid in Alzheimer's disease. J Alzheimers Dis. 2014;38(1):111-120. (PubMed)
105. Namazi N, Larijani B, Azadbakht L. Alpha-lipoic acid supplement in obesity treatment: A systematic review and meta-analysis of clinical trials. Clin Nutr. 2018;37(2):419-428. (PubMed)
106. Kucukgoncu S, Zhou E, Lucas KB, Tek C. Alpha-lipoic acid (ALA) as a supplementation for weight loss: results from a meta-analysis of randomized controlled trials. Obes Rev. 2017;18(5):594-601. (PubMed)
107. Lodge JK, Youn HD, Handelman GJ, et al. Natural sources of lipic acid: determination of lipoyllysine released from protease-digested tissues by high performance liquid chromatography incorporating electrochemical detection. J Appl Nutr. 1997;49(1 & 2):3-11.
108. Biewenga GP, Haenen GR, Bast A. The pharmacology of the antioxidant lipoic acid. Gen Pharmacol. 1997;29(3):315-331. (PubMed)
109. ConsumerLab.com. Alpha-Lipoic Acid Supplements Review July 2017. Available at: https://www.consumerlab.com/reviews/Alpha-Lipoic_Acid_Supplements/alphalipoic/. Accessed 9/27/18.
110. Streeper RS, Henriksen EJ, Jacob S, Hokama JY, Fogt DL, Tritschler HJ. Differential effects of lipoic acid stereoisomers on glucose metabolism in insulin-resistant skeletal muscle. Am J Physiol. 1997;273(1 Pt 1):E185-191. (PubMed)
111. Maitra I, Serbinova E, Tritschler HJ, Packer L. Stereospecific effects of R-lipoic acid on buthionine sulfoximine-induced cataract formation in newborn rats. Biochem Biophys Res Commun. 1996;221(2):422-429. (PubMed)
112. Ziegler D, Nowak H, Kempler P, Vargha P, Low PA. Treatment of symptomatic diabetic polyneuropathy with the antioxidant alpha-lipoic acid: a meta-analysis. Diabet Med. 2004;21(2):114-121. (PubMed)
113. Reljanovic M, Reichel G, Rett K, et al. Treatment of diabetic polyneuropathy with the antioxidant thioctic acid (alpha-lipoic acid): a two year multicenter randomized double-blind placebo-controlled trial (ALADIN II). Alpha Lipoic Acid in Diabetic Neuropathy. Free Radic Res. 1999;31(3):171-179. (PubMed)
114. Parente E, Colannino G, Picconi O, Monastra G. Safety of oral alpha-lipoic acid treatment in pregnant women: a retrospective observational study. Eur Rev Med Pharmacol Sci. 2017;21(18):4219-4227. (PubMed)
115. Natural Medicines. Alpha-Lipoic Acid/Safety - Professional Handout. Available at: https://naturalmedicines.therapeuticresearch.com. Accessed 9/26/18.
116. Karaarslan U, Isguder R, Bag O, Kisla M, Agin H, Unal N. Alpha lipoic acid intoxication, treatment and outcome. Clin Toxicol (Phila). 2013;51(6):522. (PubMed)
117. Hadzik B, Grass H, Mayatepek E, Daldrup T, Hoehn T. Fatal non-accidental alpha-lipoic acid intoxication in an adolescent girl. Klin Padiatr. 2014;226(5):292-294. (PubMed)
118. Natural Medicines. Alpha-Lipoic acid/Interactions with Drugs - Professional handout. Available at: https://naturalmedicines.therapeuticresearch.com. Accessed 9/25/18.
119. Gleiter CH, Schreeb KH, Freudenthaler S, et al. Lack of interaction between thioctic acid, glibenclamide and acarbose. Br J Clin Pharmacol. 1999;48(6):819-825. (PubMed)
120. Prasad PD, Wang H, Huang W, et al. Molecular and functional characterization of the intestinal Na+-dependent multivitamin transporter. Arch Biochem Biophys. 1999;366(1):95-106. (PubMed)
121. Balamurugan K, Vaziri ND, Said HM. Biotin uptake by human proximal tubular epithelial cells: cellular and molecular aspects. Am J Physiol Renal Physiol. 2005;288(4):F823-831. (PubMed)
122. Zempleni J, Trusty TA, Mock DM. Lipoic acid reduces the activities of biotin-dependent carboxylases in rat liver. J Nutr. 1997;127(9):1776-1781. (PubMed)
123. Zempleni J, Mock DM. Biotin biochemistry and human requirements. J Nutr Biochem. 1999;10(3):128-138. (PubMed)