Vitamina K
Contenido
Resumen
- Las formas de la vitamina K que se originan de manera natural incluyen la filoquinona (vitamina K1) y una familia de moléculas llamadas menaquinonas (MKs o vitamina K2). (Más información)
- Con una capacidad de almacenaje limitada de vitamina K, el cuerpo recicla la vitamina K en el ciclo de oxidación y reducción de la vitamina K a fin de que sea reutilizada varias veces. (Más información)
- La vitamina K es un cofactor esencial para la carboxilación de residuos de ácido glutámico en muchas proteínas dependientes de la vitamina K que están involucradas en la coagulación sanguínea, el metabolismo óseo, la prevención de la mineralización de vasos, y la regulación de varias funciones celulares. (Más información)
- La deficiencia de vitamina K incrementa el riesgo de sangrado excesivo (hemorragia). Una inyección de vitamina K es recomendada para proteger a todos los recién nacidos de sangrados dentro del cráneo potencialmente mortales. (Más información)
- El nivel de ingesta adecuada (IA) para la vitamina K está establecido en 90 μg/día para mujeres y 120 μg/día para hombres. (Más información)
- La deficiencia de vitamina K puede perjudicar la actividad de las proteínas dependientes de vitamina K e incrementar el riesgo de osteoporosis y fracturas. A pesar de todo, estudios basados en la observación han fallado en aislar las ingesta de vitamina K de dietas generalmente saludables, lo cual justifica una interpretación cautelosa de asociaciones positivas entre la ingesta de vitamina K y marcadores de la salud ósea. En general, ensayos de intervención han sido inconclusos con respecto al papel de la vitamina K suplementaria en la fomentación de la reducción de la perdida de hueso en adultos de otro modo repletos de calcio y vitamina D. (Más información).
- La mineralización anormal de los vasos sanguíneos incrementa con la edad y es un factor de riesgo principal para las enfermedades cardiovasculares. La insuficiencia de vitamina K puede inactivar varias proteínas dependientes de la vitamina K que inhiben la formación de precipitados de calcio en los vasos. El efecto de la vitamina K suplementaria en la prevención de la calcificación de vasos y eventos cardiovasculares aún necesita ser evaluado en ensayos controlados aleatorios. (Más información)
- La filoquinona se encuentra en altas concentraciones en vegetales de hojas verdes, y ciertos aceites vegetales, mientras que la mayoría de menaquinonas se encuentran en hígados animales y alimentos fermentados. (Más información)
- Varias drogas/fármacos, incluyendo antagonistas de la vitamina K (p. ej., la warfarina), son conocidos por interferir con la absorción y el metabolismo de la vitamina K. (Más información)
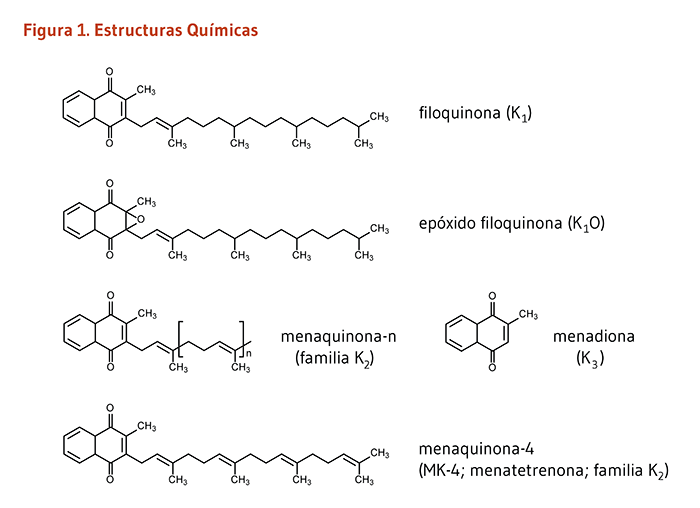
La vitamina K es un vitamina liposoluble. Originalmente identificada por su papel en el proceso de la formación de coágulos sanguíneos (la "K" se deriva de la palabra alemana "koagulation"), la vitamina K es esencial para el funcionamiento de varias proteínas involucrada en los procesos fisiológicos que abarca, pero no se limitan a la regulación de coágulos sanguíneos (coagulación) (1). Las formas de la vitamina K que se originan de forma natural incluyen un cierto número de vitámeros conocidos como vitamina K1 y vitamina K2 (Figura 1). La vitamina K1 o filoquinona es sintetizada por plantas y es la forma predominante en la dieta. La vitamina K2 incluye un rango de formas de la vitamina K colectivamente referidas como menaquinonas. La mayoría de las menaquinonas son sintetizadas por la microbiota intestinal humana y se encuentran en alimentos fermentados y productos de origen animal. Las menaquinonas difieren en la longitud de 1 a 14 repeticiones de unidades de 5 carbonos en la cadena lateral de las moléculas. Estas formas de la vitamina K son designadas como menaquinona-n (MK-n), donde la n representa el número de unidades de 5 carbonos (MK-2 a MK-14) (2, 3). Ampliamente usado en la cría de animales, el compuesto sintético conocido como menadiona (vitamina K3) es una provitamina que necesita ser convertida a menaquinona-4 (MK-4) para ser activa (4).
Función
Las funciones de la vitamina K como un cofactor para la enzima, γ-glutamil carboxilasa (GGCX), la cual cataliza la carboxilación del aminoácido ácido glutámico (Glu), a ácido γ-carboxiglutámico (Gla). La γ-carboxilación dependiente de vitamina K que ocurre solo en residuos específicos de ácido glutámico en proteínas dependientes de vitamina K (VKDP) identificadas es fundamental por su habilidad de unir al calcio (5).
Ciclo de oxidación-reducción de la vitamina K
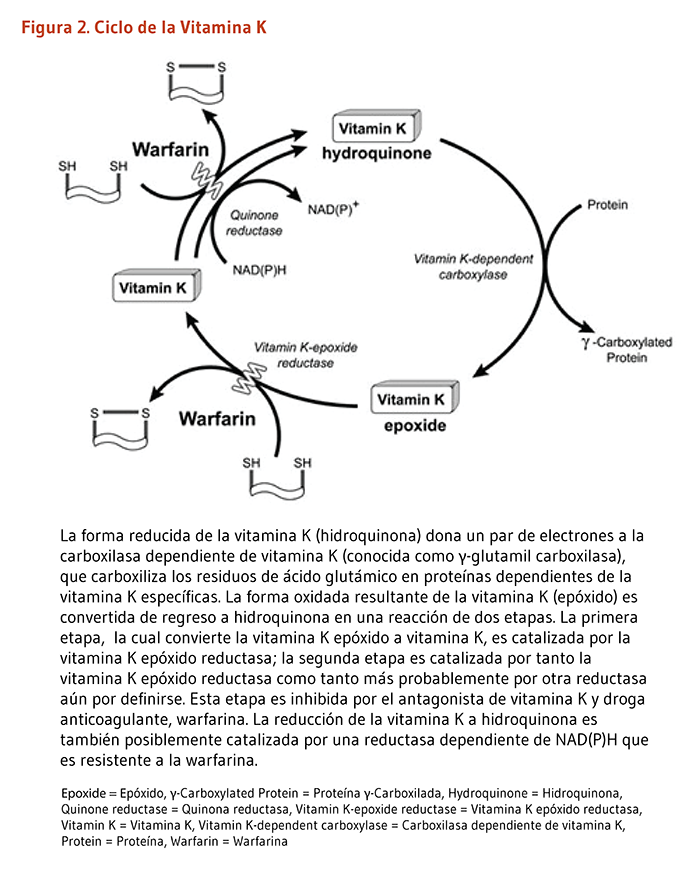
Aunque la vitamina K es una vitamina liposoluble, el cuerpo almacena cantidades muy pequeñas que son rápidamente agotadas sin una ingesta dietaría regular. Talvez debido a su limitada habilidad de almacenar vitamina K, el cuerpo la recicla a través de un proceso llamado ciclo de la vitamina K-epóxido (Figura 2). El ciclo de la vitamina K permite que una pequeña cantidad de vitamina K sea reusada muchas veces en la carboxilación de proteínas disminuyendo así el requerimiento dietario. Brevemente, la vitamina K hidroquinona (una forma reducida) es oxidada a vitamina K epóxido (una forma oxidada). La reacción permite a la γ-glutamil carboxilasa carboxilizar residuos de ácido glutámico selectivos en las proteínas dependientes de la vitamina K. El reciclado de la vitamina K epóxido (forma oxidada) a hidroquinona (forma reducida) es llevada a cabo por dos reacciones que reducen la vitamina K epóxido (KO) a vitamina K quinona y después a vitamina K hidroquinona (KH2; Figura 2). Además, la enzima vitamina K oxidorreductasa (VKOR) cataliza la reducción de la KO a vitamina K quinona y puede estar involucrada — así como otra aun-por-definirse reductasa — en la producción de KH2 proveniente de la vitamina K quinona (6, 7). La droga anticoagulante warfarina actúa con un antagonista de la vitamina K al inhibir la actividad de la VKOR, previniendo por lo tanto el reciclaje de la vitamina K (véase Coagulación).
Coagulación
La habilidad para unir iones de calcio (Ca2+) es requerida para la activación de varios factores de la coagulación dependientes de la vitamina K, o proteínas, en la cascada de la coagulación. El termino, cascada de coagulación, se refiere a una serie de eventos, cada uno dependiente del otro, que detienen el sangrado a través de la formación de coágulos. La γ-carboxilación dependiente de vitamina K de residuos específicos de ácido glutámico en tales proteínas hace posible que puedan unir al calcio. Los factores II (protrombina), VII, IX, y X conforman el núcleo de la cascada de la coagulación. La proteína Z parece aumentar la acción de la trombina (forma activada de la protrombina) al promover su asociación con fosfolípidos en las membranas celulares. La proteína C y la proteína S son proteínas anticoagulantes que proveen control y balance en la cascada de la coagulación; la proteína Z también posee una función anticoagulante. Los mecanismos de control de la cascada de la coagulación existen, ya que la coagulación descontrolada puede poner en riesgo la vida como el sangrado descontrolado. Los factores de la coagulación dependientes de vitamina K son sintetizados en el hígado. Como consecuencia, las enfermedades hepáticas graves resultan en bajos niveles sanguíneos de los factores de la coagulación dependientes de la vitamina K y en un riesgo incrementado de sangrado descontrolado (hemorragia) (8).
Terapia oral anticoagulante con antagonistas de la vitamina K
Algunas personas están en un riesgo incrementado de formar coágulos, los cuales podrían bloquear el flujo de la sangre en las arterias del corazón, cerebro o pulmones, resultando en un infarto al miocardio (ataque al corazón), accidentes cerebrovasculares o embolia pulmonar respectivamente. La coagulación anormal no está relacionada con la ingesta excesiva de vitamina K, y no se conoce de alguna toxicidad asociada con la vitamina K1 o la vitamina K2 (véase Toxicidad). Algunos anticoagulantes orales, como la warfarina (Coumadin, Jantoven), inhiben la coagulación a través del antagonismo de la acción de la vitamina K. La warfarina previene el reciclaje de la vitamina K al bloquear la actividad de la VKOR, creando así una deficiencia funcional de vitamina K (véase Figura 2 arriba). La γ-carboxilación inadecuada de proteínas de la coagulación dependientes de la vitamina K interfiere con la cascada de coagulación, lo que inhibe la formación de coágulos. Grandes cantidades de vitamina K dietaría o suplementaria podrían superar el efecto anticoagulante de los antagonistas de la vitamina K, por lo que aquellos pacientes que toman estos medicamentos se les advierte que no consuman cantidades muy grandes o altamente variables de vitamina K (véase Interacción con drogas). Los expertos recomiendan ahora a los pacientes en tratamiento con antagonistas de vitamina K como la warfarina, una ingesta dietaría razonablemente constante que satisfaga las recomendaciones dietarías actuales (90-120 μg/día) (9). Finalmente, debido a la alta variabilidad en la respuesta de pacientes a los antagonistas de la vitamina K, se ha sugerido que la suplementación diaria de dosis bajas de filoquinona puede mejorar la estabilidad de la terapia de anticoagulación. A pesar de todo, varios meta-análisis recientemente destacaron la falta de evidencia suficiente que apoye esta opción para aquellos que toman warfarina (10-12).
Formación esquelética y prevención de calcificación de tejido blando
La γ-carboxilación dependiente de la vitamina K es esencial en varias proteínas relacionadas con los huesos, incluyendo la osteocalcina, el factor de anticoagulación de la proteína S, la proteína glutamato γ-carboxilada (Gla) de la matriz (MGP), la proteína rica en Gla (GRP), y la periostina (originalmente llamada factor osteoblástico específico 2). La osteocalcina (también llamada proteína Gla ósea) es sintetizada por los osteoblastos (células formadoras de hueso); la síntesis de la osteocalcina es regulada por la forma activa de la vitamina D, 1,25-dihidroxivitamina D (calcitriol). La capacidad de unión del calcio de la osteocalcina requiere la γ-carboxilación dependiente de vitamina K de tres residuos de ácido glutámico. Aunque su función en la mineralización ósea no es comprendida del todo, la osteocalcina es requerida para el crecimiento y maduración de los cristales de hidroxiapatita de calcio (véase Osteoporosis) (13).
La proteína S parece desempeñar un papel en la degradación ósea mediada por los osteoclastos. Individuos con una deficiencia hereditaria de la proteína S padecen de complicaciones relacionadas al incremento de coagulación sanguínea, como también de osteonecrosis (14, 15). La proteína S puede unirse y activar los receptores de la familia TAM que están involucrados en fagocitosis. Mutaciones en los receptores TAM pueden resultar en discapacidad visual, espermatogénesis defectuosa, trastornos autoinmunes, y trastornos plaquetarios (16).
La MGP ha sido encontrada en cartílagos, tejido óseo y blando, incluyendo las paredes de vasos sanguinos, donde es secretada por células del músculo liso vascular. La MPG se ha involucrado en la prevención de la calcificación en varios sitios, incluyendo cartílagos, paredes de vasos sanguíneos, fibras elásticas de la piel, o en la malla trabecular en el ojo humano (véase Calcificación vascular) (17). Además, varias VKDP, incluyendo la MGP, han sido asociadas con sitios de calcificación en las arterias, piel, riñones, y ojos en ciertas enfermedades hereditarias, como el pseudoxantoma elástico y la β-talasemia (18, 19).
Las proteínas dependientes de la vitamina K, la GRP y la periostina, son también sintetizadas en el tejido óseo, pero sus papeles en el metabolismo óseo no son claros aun (20, 21). Expresada en la piel humana normal y los tejidos vasculares, la GRP ha sido colocalizada con depósitos minerales anormales en la matriz extracelular en arterias calcificadas y lesiones de la piel calcificadas (22).
Expresada en la mayoría de tejidos conectivos, incluyendo piel y huesos, la periostina fue inicialmente asociada con adhesión y migración celular. Esta VKDP también parece promover la angiogénesis (formación de nuevos vasos sanguíneos) durante la degeneración de la válvula cardiaca y el crecimiento tumoral (23, 24).
Investigación actual sugiere que la actividad reducida de la GGCX y/o la baja biodisponibilidad de la vitamina K puede perjudicar la actividad de las VKPD y contribuir a defectos de la mineralización ósea y a la calcificación anormal del tejido blando (véase Prevención de Enfermedades) (25).
Regulación de funciones celulares
La proteína específica del gen 6 de la detención de crecimiento (Gas6) es un proteína dependiente de la vitamina K identificada en 1993. Ha sido encontrada a lo largo del sistema nervioso, así como en el corazón, pulmones, estómago, riñones, y cartílago. Identificada como un ligando de la familia TAM de receptores de la tirosina quinasa de transmembrana, la Gas6 parece ser un factor de la regulación del crecimiento celular con actividades de señalización celular. La Gas6 ha sido involucrada en funciones celulares diversas, incluyendo fagocitosis, adhesión celular, proliferación celular, y protección contra apoptosis (5). Puede también desempeñar papeles importantes en el desarrollo y envejecimiento del sistema nervioso (revisado en 26). Además, la Gas6 parece regular la señalización plaquetaria y la hemostasia vascular (27). Expresada en la mayoría de tejidos e involucrada en muchas funciones celulares, la Gas6 ha sido también ligada a varias afecciones patológicas, incluyendo la formación de coágulos (trombogénesis), aterosclerosis, inflamación crónica, y crecimiento del cáncer (28-30).
Deficiencia
La deficiencia evidente de vitamina K resulta en una coagulación sanguínea deteriorada, usualmente demostrada por pruebas de laboratorio que miden el tiempo de coagulación. Los síntomas incluyen moretones y sangrado con facilidad que podrían manifestarse como hemorragias nasales, encías sangrantes, sangre en la orina, sangre en las deposiciones, deposiciones negras, o sangramiento menstrual extremadamente profuso. En infantes, la deficiencia de vitamina K puede resultar en hemorragias potencialmente letales dentro del cráneo (hemorragia intracraneal) (8).
Adultos
La deficiencia de vitamina K es poco común en adultos saludables por un cierto número de razones: (1) la vitamina K es ampliamente distribuida en los alimentos (véase Fuentes alimenticias); (2) el ciclo de la vitamina K conserva la vitamina K (véase Ciclo de oxidación-reducción de la vitamina K); y (3) las bacterias que normalmente habitan el intestino grueso sintetizan menaquinonas (vitamina K2), aunque no está claro si cantidades significativas son absorbidas o utilizadas (véase Fuentes alimenticias). Los adultos en riesgo de una deficiencia de vitamina K incluye a aquellos que consumen antagonistas de vitamina K e individuos con enfermedades o daño hepático severo (8). Además, las personas con desordenes de malabsorción de grasas incluyendo enfermedad intestinal inflamatoria y fibrosis quística podrían encontrarse en un mayor riesgo de deficiencia de vitamina K (31-33).
Infantes
Los bebes recién nacidos que son exclusivamente amamantados con leche materna se encuentran en un riesgo incrementado de deficiencia de vitamina K, debido a que la leche humana es relativamente baja en vitamina K en comparación con la leche formulada. En general, los recién nacidos tienen un bajo estatus de vitamina K por las siguientes razones: (1) el transporte de la vitamina K a través de la barrera placentaria es limitada; (2) el almacenamiento de la vitamina K en el hígado es bastante bajo; (3) el ciclo de la vitamina K puede aún no ser totalmente funcional en recién nacidos, especialmente en infantes prematuros; y (4) el contenido de vitamina K de la leche materna es bajo (5). Infantes cuyas madres consumen medicamentos anticonvulsivos para prevenir convulsiones están también en riesgo de una deficiencia de vitamina K. La deficiencia de vitamina K en recién nacidos puede resultar en un trastorno hemorrágico llamado sangrado por deficiencia de vitamina K (SDVK) del recién nacido (revisado en 34). Debido a que el SDVK pone en riesgo la vida y es fácilmente evitado, la Academia Americana de Pediatras y un cierto número de organizaciones internacionales similares recomiendan que una dosis intramuscular de filoquinona (vitamina K1) sea administrada a todos los recién nacidos (35).
Controversias acerca de la administración de vitamina K a recién nacidos
La vitamina K y leucemia infantil: A principios de 1990, se publicaron dos estudios retrospectivos que sugerían una posible asociación entre las inyecciones de filoquinona en recién nacidos y el desarrollo de leucemia infantil y otras formas de cáncer infantil. Sin embargo, dos grandes estudios retrospectivos en los EE.UU. y Suecia los cuales revisaron los registros médicos de 54,000 y 1.3 millones de niños, respectivamente, no encontraron evidencia de una relación entre cánceres infantiles e inyecciones de filoquinona al momento de nacer (36, 37). Además, un análisis agrupado de seis estudios de caso y control, incluyendo a 2,431 niños diagnosticados con cáncer infantil y 6,338 niños libres de cáncer, no encontró evidencia de que las inyecciones de filoquinona en recién nacidos incrementaran el riesgo de leucemia infantil (38). En una declaración de política, la Academia Americana de Pediatría recomendó que se debe continuar la profilaxis de rutina con vitamina K en recién nacidos debido a que la SDVK es potencialmente mortal y los riesgos de cáncer son improbables y no han sido demostrados (35). En los últimos años, doctores han reportado un incremento en casos de aparición tardía de SDVK debido a un una tendencia creciente de omisión o negativa parental del recién nacido a la profilaxis con vitamina K (39).
Dosis menores de vitamina K1 en infantes prematuros: Los resultados de dos estudios de los niveles de vitamina K en infantes prematuros sugiere que la dosis estándar inicial de filoquinona (vitamina K1) para infantes de termino (1.0 mg) podría ser demasiado elevada para infantes prematuros (40, 41). Estos hallazgos han llevado a algunos expertos a sugerir el uso de una dosis inicial de vitamina K1 de 0.3 mg/kg para infantes con pesos al nacer menores a 1,000 g (2 lbs, 3 oz), y una dosis inicial de 0.5 mg de filoquinona probablemente prevendría enfermedades hemorrágicas en recién nacidos (40).
La Ingesta Adecuada (IA)
En enero del 2001, la Junta de Nutrición y Alimentos (JNA) del Instituto de Medicina de los EE.UU. estableció el nivel de ingesta adecuada (IA) de la vitamina K en base a los niveles de consumo de individuos saludables (Tabla 1). La IA para infantes se basó en la ingesta estimada de vitamina K proveniente de la leche materna (42).
Prevención de Enfermedades
Osteoporosis
El descubrimiento de las proteínas dependientes de la vitamina K en el hueso llevo a la investigación del papel de la vitamina K en el mantenimiento de la salud ósea.
La vitamina K y la salud ósea: estudios basados en la observación
Vitamina K1: Estudios basados en la observación han encontrado una relación entre la filoquinona (vitamina K1) y la pérdida ósea relacionada con la edad (osteoporosis). El Estudio de Salud de las Enfermeras (Nurses' Health Study) dio seguimiento a más de 72,000 mujeres por diez años. En un análisis de esta cohorte, las mujeres cuyas ingestas de filoquinona fueron menores a 109 microgramos/día (μg/día) tuvieron un riesgo 30% más alto de fractura de cadera en comparación a aquellas mujeres con ingestas iguales o por encima de los 109 μg/día (43). Otro estudio prospectivo en más de 800 hombres y mujeres de la tercera edad, con un seguimiento en el Estudio del Corazón de Framingham (Framingham Heart Study) por siete años, encontró que los participantes con ingestas de vitamina K dietaría en el cuartil más alto (mediana, 254 μg/día) tuvieron un riesgo 65% más bajo de fractura de cadera que aquellos con ingestas en el cuartil más bajo (mediana, 56 μg/día) (44). Las fracturas osteoporóticas son frecuentemente ligadas a una reducción en la mineralización ósea. A pesar de todo, los investigadores no encontraron alguna asociación entre la ingesta dietaría de filoquinona y la densidad mineral ósea (DMO) en los sujetos del estudio de Framingham (44). Mientras que otros estudios fallaron en observar asociaciones entre la ingesta de filoquinona dietaría y mediciones de la resistencia ósea, DMO, o la incidencia de fractura (45, 46), el estudio de corte trasversal de una cohorte de 3,199 mujeres de edad media encontró que los sujetos en el cuartil más alto de la ingesta de filoquinona dietaría tuvieron una DMO de la cadera y columna lumbar significantemente mayor que aquellos en el cuartil más bajo (162 μg/día vs. 59 μg/día) (47). Además, estudios de corte transversal y de caso y control recientes han reportado asociaciones entre las ingestas altas de filoquinona y la baja incidencia de fractura de cadera (48, 49).
Sin embargo, debido a que vegetales de hoja verde son la fuente dietaría principal de filoquinona y debido a que son usualmente parte de una dieta balanceada, el consumo alto de filoquinona puede ser solo un indicador de hábitos alimenticios saludables que pudiesen, en lugar de la filoquinona en sí, dar cuenta de la totalidad o parte de la asociación descrita en los estudios basados en la observación (50). Los pocos estudios que midieron la filoquinona del plasma generalmente encontraron que los niveles altos circulantes estuvieron asociados con un riesgo menor de fractura (17, 51). Por ejemplo, la incidencia de fracturas vertebrales fue inversamente correlacionada con la DMO y la filoquinona en el plasma en un estudio prospectivo de cuatro años que incluyo 379 mujeres japonesas de edades de entre 30-88 años de edad (51). A pesar de todo, estudios basados en la observación no están diseñados para hacer inferencias de causalidad, y solo ensayos controlados aleatorios pueden evaluar si la filoquinona podría tener efectos benéficos en la salud ósea (véase Estudios de la suplementación con vitamina K y osteoporosis).
Vitamina K2: Existen algunos pocos estudios sobre las asociaciones entre las menaquinonas (vitamina K2) y la salud ósea, talvez debido al número limitado de fuentes dietarías de la menaquinona-4 (MK-4), la forma principal de la vitamina K2 presente en dietas occidentales. La comida japonesa natto, hecha de frijoles de soya cocidos fermentados por la bacteria Bacillus subtilis natto, es rica en MK-7. En un estudio prospectivo que dio seguimiento a 944 mujeres japonesas (edades 20-79 años), la DMO al inicio del estudio fue asociada positivamente con la ingesta de natto en mujeres postmenopáusicas (52). Durante el periodo de seguimiento de tres años, la tasa de perdida de la DMO en el cuello femoral fue significantemente menor en mujeres que consumieron natto (>200 μg/día de MK-7) en comparación con las que no lo consumieron. Ninguna asociación fue encontrada entre la ingesta de natto y la DMO en mujeres postmenopáusicas (52).
La DMO total de la cadera y cuello femoral según los reportes fue también más alta en aproximadamente 2,000 hombres japoneses de 65 años y mayores que regularmente consumieron por lo menos un paquete por día de natto (≥350 μg/día de MK-7) en comparación con aquellos que consumieron menos de un paquete por semana (<50 μg/día de MK-7) (53). A pesar de que incrementar el consumo de natto también maximiza la ingesta de otros compuestos dietarios (p. ej. isoflavonas de soya) que tienen beneficios potenciales para la salud del esqueleto; aún existe la necesidad de encontrar mediciones fiables del estatus de la vitamina K. Hasta la fecha, estudios basados en la observación han fallado inequívocamente en confirmar una asociación entre los niveles de menaquinona circulante (MK-7 y MK-4) y el riesgo de fractura (17, 54).
Biomarcador del estatus de la vitamina K y la salud ósea
Los niveles totales circulantes de la proteína ósea, osteocalcina, han mostrado ser marcadores sensibles de la formación ósea. Varias hormonas y factores de crecimiento, incluyendo la vitamina D pero no la vitamina K, regulan la síntesis de la osteocalcina por los osteoblastos. Sin embargo, la vitamina K es un cofactor esencial para la γ-carboxilación de los tres residuos de ácido glutámico en la osteocalcina. La subcarboxilación de la osteocalcina en el hueso humano y suero ha sido ligada a el estatus pobre de la vitamina K. El grado de γ-carboxilación de la osteocalcina es sensible a intervenciones nutricionales de la vitamina K, y de este modo es usado como un indicador relativo del estatus de la vitamina K (13).
Se encontró que los niveles circulantes de la osteocalcina subcarboxilada (OCsc) eran más altos en mujeres postmenopáusicas que en mujeres premenopáusicas, y marcadamente más altos en mujeres sobre los 70 años. También altas proporciones de OCsc a OC total (OCsc/OC) parecen predecir el riesgo de fractura de cadera en mujeres de edad avanzada (55, 56). Aunque la deficiencia de vitamina K parecería la causa más probable de la proporción de OCsc sanguínea elevada, algunos investigadores también han documentado una relación inversa entre las medidas bioquímicas del estado nutricional de la vitamina D y los niveles de OCsc, así como una disminución significativa de la proporción OCsc/OC a través de la suplementación con vitamina D (57). Se ha sugerido que el incremento de la proporción de OCsc/OC circulante podría reflejar un estatus nutricional pobre en general que incluiría la insuficiencia de vitamina D, la cual explicaría la observaciones anteriormente mencionadas (58). Sin embargo, en varios estudios de intervención aleatorios, controlados con placebo conducidos en niñas jóvenes (58, 59) y mujeres postmenopáusicas (60), la suplementación con vitamina D fallo en disminuir las proporciones de OCsc/OC o mostrar algún efectos adicional en la disminución de OCsc/OC a través de la vitamina K suplementaria.
Estudios de la suplementación con vitamina K y osteoporosis
Suplementación con vitamina K: La revisión sistemática de cinco ensayos clínicos aleatorios que evaluaron el efecto de la suplementación con filoquinona (vitamina K1) en la DMO de la cadera usando dosis de entre 200 μg/día a 5,000 μg/día con duraciones de 12 a 36 meses encontró un beneficio poco prometedor para la salud ósea (17). Aunque la suplementación con filoquinona disminuyo los niveles de OCsc en los cinco estudios, solo un estudio reporto un efecto de la filoquinona suplementaria en la DMO (61). En este estudio, 150 mujeres postmenopáusicas fueron asignadas aleatoriamente para recibir un placebo, minerales (500 mg/día de calcio, 130 mg/día de magnesio, y 10 mg/día de zinc) más vitamina D (320 UI/día), o minerales, vitamina D y filoquinona (1,000 mg/día). El ritmo de la pérdida de DMO en el cuello femoral, pero no en la columna lumbar, fue significativamente menor en sujetos con filoquinona suplementaria en comparación a los otros dos grupos. De esta manera, evidencia de un supuesto beneficio de la filoquinona en la salud ósea en adultos mayores es considerada débil. Ninguno de los estudios fue diseñado para evaluar el efecto de la filoquinona en fracturas relacionadas con la osteoporosis. Investigación adicional podría buscar evaluar si la suplementación con filoquinona podría mejorar la salud del esqueleto en sujetos en alto riesgo de una insuficiencia de vitamina K (es decir, individuos con trastornos de malabsorción, o fibrosis cística).
Suplementación con vitamina K2: Las dosis farmacológicas de manaquinona-4 (MK-4; nombre comercial, menatetrenona) son usadas actualmente en Japón en el tratamiento de la osteoporosis. De acuerdo con la mayoría de los ensayos de intervención la investigación del efecto de una dosis alta de MK-4 en la perdida ósea ha sido conducida en mujeres postmenopáusicas japonesas. Un meta-análisis del 2006 de siete ensayos controlados aleatorios asoció el incremento de la DMO y la incidencia reducida de fractura (62). Todos con la excepción de uno de los siete ensayos individuales emplearon 45 mg de MK-4 diariamente; el otro ensayo uso 15 mg/día (62). Este meta-análisis reporto que la suplementación con MK-4 por más de seis meses significantemente disminuyo el riesgo de fracturas vertebrales en un 60%, fracturas de cadera en un 77%, y fracturas no vertebrales en un 81%. Sin embargo, los resultados de este meta-análisis fueron posteriormente restados de importancia debido al pequeño tamaño de los estudios incluidos y al hecho de que algunos de ellos no fueron controlados con placebo pero en su lugar se usó un tratamiento abierto actual (p. ej., con calcio y vitamina D). Adicionalmente, el análisis no incluyo datos de un estudio no publicado con un tamaño de muestra más amplio que reporto ningún efecto de la MK-4 en el riesgo de fractura y habría alterado la conclusión del meta-análisis (63).
Un estudio controlado sin placebo más reciente asigno aleatoriamente a más de 4,000 mujeres postmenopáusicas japonesas para recibir calcio solo o en combinación con MK-4 (45 mg/día) por tres años. Al final de un seguimiento adicional de un año (cuatro años en total), no hubo diferencias entre los grupos con respecto a la incidencia de fracturas vertebrales, y solo una pequeña reducción fue apreciada en la incidencia de nuevas fracturas clínicas en aquellas que tomaron el tratamiento combinado en comparación con el calcio solo (4.4% vs 3.4%) pero solo en mujeres en alto riesgo de fracturas (64). Resultados dudosos han sido reportados en ensayos adicionales conducidos en Europa y en los EE.UU. Un ensayo de intervención controlado con placebo de tres años en 325 mujeres postmenopáusicas saludables encontró que la MK-4 suplementaria (45 mg/día) por tres años mejoro las medidas de la resistencia ósea en comparación con el placebo (65). Debe notarse, esta dosis de MK-4 usada en la mayoría de los estudios citados es 500 veces más alta que la IA para la vitamina K. Otro ensayo aleatorio, doble ciego, controlado con placebo de un año en 365 mujeres postmenopáusicas americanas con una insuficiencia de vitamina K (osteocalcina subcarboxilada ≥4%) encontró que ni la alta dosis de filoquinona suplementaria (1,000 μg/día) ni la de MK-4 (45 mg/día) tuvieron efecto en los marcadores del suero del recambio óseo o en la DMO (columna lumbar y cadera) cuando se comparó con el placebo (66). En este estudio, todos los sujetos también recibieron diariamente, calcio de etiqueta abierta (630 mg) y vitamina D3 (400 UI).
Aunque unos pocos estudios basados en la observación han sugerido un vínculo entre el consumo de natto (rico en MK-7) y la salud ósea, un reciente estudio aleatorio, doble ciego, controlado con placebo en 334 mujeres postmenopáusicas saludables (1 a 5 años de postmenopausia) no encontró efecto alguno de 360 μg/día de MK-7 (en la forma de capsulas de natto) en la DMO en varios sitios después de un año en comparación con el inicio del estudio (67). Otro ensayo controlado con placebo comparable en 244 mujeres menopaúsicas encontró que la suplementación con 180 μg/día de MK-7 por tres años significantemente limito la perdida ósea en el cuello femoral pero no en otros sitios (68). Actualmente, el papel potencial de las menaquinonas suplementarios sobre la salud ósea aún necesita ser establecido en ensayos de mayor magnitud, aleatorios, y bien controlados.
Antagonistas de la vitamina K en la salud ósea
Ciertos anticoagulantes orales, como la warfarina, son conocidos por ser antagonistas de la vitamina K (véase Coagulación). Pocos estudios han examinado el uso crónico de la warfarina y el riesgo de fractura en mujeres mayores. Un estudio reporto no asociación alguna entre el tratamiento a largo plazo con warfarina y el riesgo de fracturas (69), mientras tanto otro encontró un riesgo significativamente mayor de fracturas vertebrales y de las costillas en los usuarios de warfarina en comparación con los que no la usan (70). Además, un estudio en pacientes de la tercera edad con fibrilación auricular reporto que el tratamiento a largo plazo con warfarina estuvo asociado con un riesgo significativamente mayor de fracturas osteoporóticas en hombres pero no en mujeres (71). Un meta-análisis de resultados de 11 estudios publicados encontró que la terapia oral de anticoagulación estuvo asociada con una reducción muy modesta de la DMO en la muñeca y no cambio alguno en la DMO en la cadera o espina (72). El desarrollo de nuevos anticoagulantes que no bloquean el reciclaje de la vitamina K podrían ofrecer una alternativa más segura para el uso de antagonistas de la vitamina K (73).
Enfermedades cardiovasculares
Una relación inversa entre la ingesta de vitamina K y la mortalidad fue reportada en una encuesta nacional de los EE.UU. (NHANES III) de 3,401 participantes (74). Ingestas de vitamina K adecuadas vs. ingestas inadecuadas (basadas en específico en el sexo de la IA: 90 μg/día para las mujeres y 120 μg/día para los hombres) fueron asociadas con un riesgo 22% menor de mortalidad relacionada a enfermedades cardiovasculares (ECV) y un riesgo 15% menor de mortalidad por todos las causas. El reporte también indio que, mientras más de dos tercios de los individuos con enfermedad renal crónica tuvieron ingestas de vitamina K por debajo de la IA, el riesgo de mortalidad por ECV fue un 41% menor en aquellos con ingestas adecuadas en comparación con ingestas subóptimas (74). Sin embargo, ingestas más altas de vitamina K no fueron asociadas con una mortalidad menor por ECV en un estudio prospectivo que dio seguimiento a 7,216 adultos mayores en riesgo de desarrollar ECV (75). Este estudio asoció altas ingestas de filoquinona, pero no de menaquinonas, con un riesgo menor de mortalidad por todas las causas.
En otro estudio prospectivo reciente, que dio seguimiento a 35,476 hombres y mujeres holandeses saludables durante un periodo medio de 12.1 años, el riesgo de un incidente de un accidente cerebrovascular no fue significativamente asociado con ingestas de filoquinona o menaquinonas (76). Estudios basados en la observación tempranos ofrecen evidencia limitada para una relación inversa entre la ingesta de filoquinona y el riesgo de ECV, a pesar de que a las altas ingestas a veces se les atribuyen como un marcador de hábitos dietarios saludables con un riesgo cardiovascular bajo (revisado en 77). Un cohorte prospectivo de 16,057 mujeres holandesas (edades 49-70 años) con un seguimiento medio de 8.1 años encontró una reducción del 9% del riesgo de enfermedad coronaria cardiaca (ECC) por cada aumento gradual de 10 μg/día en la ingesta de menaquinona (78). En otro estudio holandés temprano que examino 4,807 hombres y mujeres saludables de 55 años y mayores, los participantes en el tercil más alto de la ingesta de menaquinona (>32.7 μg/día) tuvieron un riesgo 41% menor de ECC incidente y un riesgo 26% menor del riesgo de mortalidad por todas la causas que aquellos en el tercil más bajo (<21.6 μg/día) (79). Además, se encontró que la ingesta de menaquinona esta inversamente asociada con la calcificación aortica, un mayor factor de riesgo de ECV (79).
Calcificación vascular
Uno de los sellos distintivos de la enfermedad cardiovascular es la formación de placas ateroscleróticas en las paredes arteriales. La ruptura de placas que causa la formación de coágulos (trombogénesis), es la causa habitual de un infarto al miocardio (ataque al corazón) o de un accidente cerebrovascular. Mientras que la calcificación de las placas ocurre al mismo tiempo que la aterosclerosis progresa, no está claro si la calcificación incrementa la inestabilidad de las placas y podría predecir el riesgo de ruptura y trombogénesis (80). Sin embargo, la calcificación puede ser predictiva de eventos cardiovasculares futuros. Un meta-análisis de 30 estudios de cohorte prospectivos, incluyendo un total de 218,080 participantes, encontró que la presencia de calcificación vascular se asoció con un triple a cuádruple incremento general del riesgo de eventos cardiovasculares y mortalidad (81). Un estudio temprano basado en la población en mujeres postmenopáusicas (edades 60-79 años) observo que las mujeres de menor edad (60-69 años) con calcificaciones aorticas tuvieron menores ingestas de vitamina K que aquellas sin calcificaciones aórticas, sin embargo esto no fue cierto en mujeres de mayor edad (70-79 años) (82). Un estudio de cohorte prospectivo en 807 hombres y mujeres, 39-45 años de edad, no encontró correlación alguna entre la ingesta de filoquinona y la calcificación de arterias coronarias, al medirse de manera no invasiva mediante una tomografía computarizada (83). Además, ni las ingestas de filoquinona o las de menaquinona se asociaron con la calcificación de arterias de los senos en un estudio de corte transversal en 1,689 mujeres de edades de entre 49-70 años (84). Sin embargo, en otro estudio de corte transversal se encontró que el cuartil más elevado frente al más bajo de la ingesta (ingestas medias, 48.5 μg/día vs. 18 μg/día) de menaquinona (MK-4 a MK-10) estaba asociado con una reducción del 20% de la prevalencia de la calcificación arterial coronaria en 564 mujeres postmenopáusicas (85).
Reciente investigación ha descubierto posibles mecanismos por los cuales la vitamina K puede inhibir la mineralización (calcificación) de vasos sanguíneos mientras que promueve la mineralización ósea. Los mecanismos potenciales, aunque no son completamente comprehendidos, implican las proteínas dependientes de la vitamina K, incluyendo la proteína Gla de la matriz (MGP) y la recientemente descrita proteína rica en Gla (GRP). Secretada por varios tipos de células, como las células del musculo liso vascular (CMLV) en las paredes de los vasos arteriales, la MGP parece ser importante para la prevención de la calcificación de tejidos suaves, incluyendo cartílagos, vasculatura, piel, y células de la red trabecular en el ojo (17, 86). En ratones knockout de la MGP, la conversión de CMLV a células similares a las óseas y una calcificación de vasos extensa resulta en una gran ruptura de vasos y muerte prematura. En los seres humanos, el gen defectuoso de la MGP ha sido ligado al síndrome de Keutel, una rara condición hereditaria caracterizada en particular por la calcificación anormal del cartílago y estenosis de la arteria pulmonar (estrechamiento). La prevención de la calcificación por la MGP involucro varios mecanismos, incluyendo la unión a cristales de calcio y la inhibición de las proteínas (proteínas morfogenéticas óseas; PMO) conocidas por promover la formación de hueso ectópico (revisado en 87).
La actividad de la unión del calcio de la MGP es regulada por dos tipos de modificaciones (conocidas como modificaciones postraduccionales ya que toman lugar después de la síntesis de proteínas): la carboxilación dependiente de la vitamina K de hasta 5 residuos de Glu y la fosforilación de residuos de serina. Una variación en la secuencia (polimorfismo) del gene de la MGP que conduce a una transición de treonina a alanina en uno de los cinco dominios de la proteína Gla puede posiblemente prevenir la carboxilación y provocar un cambio en la habilidad de la MGP para unirse al calcio. Este polimorfismo, conocido como MGPThr83Ala ha sido asociado con la progresión de la calcificación de las arterias coronarias durante un periodo medio de 10.6 años en un estudio prospectivo basado en la comunidad que dio seguimiento a 605 mujeres y hombres de edad media (88). Esta asociación fue únicamente observada entre participantes sin una calcificación detectable al inicio del estudio y no en aquellos que tuvieron una calcificación al inicio del estudio (88). Curiosamente, el MGPThr83Ala fue asociado con un alto riesgo de infarto al miocardio y calcificación de la arteria femoral en portadores del genotipo (89).
Además, un estudio menor inicialmente encontró que, mientras la subcarboxilación de la MGP (MGPsc) estuvo ausente en el revestimiento más interno de las arterias carótidas en sujetos saludables, la mayoría de MGP en el revestimiento de la arteria carótida de los pacientes con aterosclerosis estaba subcarboxilada (90). En otro estudio que examino la asociación entre la MGP circulante y eventos cardiovasculares incidentes en 577 hombres y mujeres mayores con un seguimiento medio de 5.6 años, el riesgo de una enfermedad cardiovascular (es decir, enfermedad coronaria cardiaca, enfermedad arterial periférica, y enfermedad cerebrovascular) fue de dos a tres veces mayor en sujetos en el tercil más elevado frente al tercil más bajo de la MGP desfosforilada subcarboxilada (MGPdf-sc) del plasma (91). Los resultados de otro estudio prospectivo sugirieron que la MGPdf-sc circulante podría predecir el riesgo de mortalidad en sujetos con una enfermedad cardiovascular evidente (92). En efecto se encontró que el riesgo de mortalidad por todas las causas y relacionada a lo cardiovascular casi fue duplicado en sujetos con enfermedad coronaria cardiaca o accidentes cerebrovasculares en el cuartil más elevado frente al cuartil más bajo de las concentraciones de la MGPdf-sc (92).
Debido a que el estatus nutricional subóptimo de la vitamina K puede limitar la carboxilación y resultar en MGPsc biológicamente inactiva, se ha especulado que la suplementación con vitamina K podría proteger contra la calcificación vascular. Un ensayo controlado, doble ciego de tres años investigo el efecto potencial de la vitamina K en la progresión de la calcificación coronaria en 401 adultos mayores residentes de la comunidad (edades 60-80 años) sin ECV al inicio del estudio (93). Los participantes fueron aleatoriamente asignados para recibir un multivitamínico diario más calcio y vitamina D con o sin 500 mg de filoquinona. Usando mediciones de la calcificación de la arteria coronaria al inicio del estudio y del seguimiento, se encontró que la suplementación con filoquinona fue capaz de limitar la progresión de la calcificación vascular y reducir la MGPdf-sc del plasma en comparación con el control (93, 94). Aunque la MGPdf-sc circulante fue correlacionada con varios marcadores del estatus de la vitamina K, ninguna asociación con las medidas de la calcificación de la arteria coronaria fueron encontradas (94).
Investigaciones adicionales son necesarias para examinar el papel de otras proteínas dependientes de la vitamina K (p. ej., GRP, periostina, Gas6) en la calcificación de la placa aterosclerótica humana y para evaluar el efecto de la vitamina K en la progresión de la calcificación vascular y el riesgo de ECV.
Antagonistas de la vitamina K y la calcificación vascular
Varios estudios de corte transversal han reportado puntuaciones incrementadas de calcio vascular (una manera de cuantificar la calcificación vascular) en usuarios crónicos de antagonistas de la vitamina K en comparación con aquellos que no los usan (revisado en 95). La terapia con warfarina ha sido también asociada con altas concentraciones circulantes de MGPdf-sc en un estudio prospectivo reciente que examino la calcificación vascular en sujetos con ECV (92). Inhibidores directos recientemente desarrollados de los factores de coagulación que no interfieren con la actividad de las VKDP pueden ser más adecuados que los antagonistas de la vitamina K, especialmente con respecto a la calcificación vascular (95).
Fuentes
Fuentes alimenticias
Encuestas sobre la nutrición en Europa y los EE.UU han mostrado que las ingestas dietarías promedio de vitamina K (todas las formas) varias ampliamente entre individuos y poblaciones, con valores oscilando entre 60 a 200 μg/día (96).
Vitamina K1
La filoquinona (vitamina K1) es la es la principal forma dietaría de la vitamina K en la mayoría de las dietas. Los vegetales de hoja verde y algunos aceites vegetales (de soya, semilla de algodón, canola, y oliva) son los principales contribuyentes de la vitamina K dietaría. Sin embargo, la biodisponibilidad de la filoquinona proveniente de los vegetales de hoja verde es menor que aquella en aceites y suplementos. También, el contenido de filoquinona de los vegetales de hoja verde depende de su contenido de clorofila (pigmento verde), de modo que las hojas exteriores tienen más filoquinona que las hojas interiores. La eficiencia de la absorción intestinal de la filoquinona varía entre las fuentes vegetales y aumenta con la adición de una fuente de grasa a una comida. Finalmente, la hidrogenación de aceites vegetales podría disminuir la absorción y el efecto biológico de la vitamina K dietaría (revisada en 2, 9). Si desea revisar el contenido nutricional de los alimentos, incluyendo el de la filoquinona, busque en la base de datos de composición de los alimentos de la USDA. Una serie de alimentos ricos en filoquinona se muestran en la Tabla 2, junto a su contenido de filoquinona en microgramos (μg).
Vitamina K2
Las menaquinonas (vitamina K2) son principalmente de origen microbiano, y así comúnmente encontrada en alimentos fermentados, como el queso, la cuajada, y el natto (frijoles de soya fermentados). Otra fuente de menaquinonas de cadena larga (MK-7 a MK-13) es los hígados de animales (9). Debido a la disponibilidad limitada de tablas de composición de alimentos para las menaquinonas, su contribución al total de las ingestas de vitamina K es difícil de estimar y tiende a variar entre poblaciones con diferentes prácticas de consumo de alimentos (2). Las bacterias que normalmente colonizan el intestino grueso (colon) pueden sintetizar menaquinonas. Inicialmente se pensó que hasta un 50% del requerimiento podría ser satisfecho por la síntesis bacteriana. Sin embargo, todas las formas de vitamina K son absorbidas en el intestino delgado a través de un mecanismo que requiere de sales biliares, mientras que la mayoría de la producción de menaquinona toma lugar en el colon donde se carece de sales biliares. Investigación actual sugiere que la contribución de la síntesis bacteriana es mucho menos que lo que se pensó previamente, aunque la contribución exacta permanece sin ser clara (97). Entre las menaquinonas, la MK-4 está formada de menadiona (la forma sintética de la vitamina K) encontrada en alimentos para ganado o es convertida en una forma de tejido especifico de la filoquinona dietaría; por lo tanto, es la única menaquinona que no es producida por bacterias (4). Las menaquinonas de cadena más larga son encontradas en productos alimenticios fermentados limitados. El basado de frijoles soja fermentada japonés, el natto, es rico en MK-7 (998 μg/100 g) y también contienen MK-8 (84 μg/100 g). Algunos quesos contienen MK-8 y MK-9 (2).
Suplementos
En los EE.UU., tanto la filoquinona como las menaquinonas están disponible sin prescripción en multivitamínicos y otros suplementos dietarios en dosis que generalmente oscilan entre 25-100 μg por tableta (98). Mientras que la menaquinona-4 (MK-4) es comercializada para el tratamiento de la osteoporosis en Japón, la Administración de Alimentos y Drogas de los Estados Unidos (FDA) actualmente no permite a ninguna de las formas de vitamina K ser usada en la prevención o tratamiento de la osteoporosis.
Seguridad
Toxicidad
Aunque una reacción alérgica es posible, no existe toxicidad conocida asociada con altas dosis (dietaría y suplementaria) de la filoquinona (vitamina K1) o de las formas de menaquinona (vitamina K2) de la vitamina K (42). Lo mismo no es cierto para la menadiona sintética (vitamina K3) y sus derivados. La menadiona puede interferir con la función del glutatión, uno de los antioxidantes naturales del cuerpo, resultando en daño oxidativo a las membranas celulares. La menadiona administrada por inyección ha inducido toxicidad hepática, ictericia, y anemia hemolítica (debido a la ruptura de glóbulos rojos) en infantes; por ello, la menadiona ya no es usada para el tratamiento de la deficiencia de vitamina K (5). Un nivel máximo de ingesta tolerable (NM) para la vitamina K aún no ha sido establecido (42).
Interacción con nutrientes
Se ha encontrado que grandes dosis de vitamina A y vitamina E antagonizan a la vitamina K (8). El exceso de vitamina A parece interferir con la absorción de vitamina K, mientras que la vitamina E podría inhibir la actividad de enzimas carboxilasas dependientes de vitamina K e interferir con la cascada de coagulación (99). Un estudio en adultos con estados de coagulación normales encontró que la suplementación con 1,000 UI de vitamina E por 12 semanas disminuyó la γ-carboxilación de protrombina, una proteína dependiente de vitamina K (100). Individuos que toman drogas anticoagulantes como la warfarina y aquellos que son deficientes de vitamina K no deberían tomar suplementos de vitamina E sin una supervisión médica minuciosa debido al riesgo incrementado de hemorragia (sangrado excesivo) (101).
Interacción con drogas/fármacos
El efecto anticoagulante de los antagonistas de la vitamina K (p. ej., warfarina) podría verse involucrada por una muy alta ingesta recomendada o suplementaria de vitamina K. Por otra parte, los suplementos diarios de filoquinona de hasta 100 μg son considerados seguros para los sujetos que toman warfarina, pero la estabilidad anticoagulante terapéutica puede ser socavada por dosis de MK-7 tan bajas como de 10-20 μg (102). Generalmente se recomienda que los individuos que usan warfarina intenten consumir la IA de vitamina K (90-120 μg), y evitar grandes fluctuaciones en la ingesta de vitamina K que podrían interferir con el ajuste de su dosis de anticoagulante (9). La prescripción de anticoagulantes anti-vitamina K, anticonvulsivos (p. ej. fenitoína), y drogas contra la tuberculosis (p. ej. rifampicina e isoniazida) para mujeres embarazadas o que lactan pueden poner en un riesgo incrementado de deficiencia de vitamina K al recién nacido (103).
El uso prolongado de un amplio espectro de antibióticos, como cefalosporinas y salicilatos, puede interferir con la síntesis de vitamina K por bacterias intestinales y disminuir la absorción de vitamina K. El fármaco amiodarona, usado en el manejo de ciertas arritmias cardiacas (ritmo cardiaco irregular), incluyendo la fibrilación auricular, puede aumentar el efecto anticoagulante de la warfarina y así incrementar el riesgo de hemorragia (104, 105). Además, el uso de medicamentos que disminuyen el colesterol (como la colestiramina y el colestipol), como también el orlistat, el aceite mineral, y el sustituto de las grasas, olestra, que interfiere con la absorción de grasas, puede afectar la absorción de vitaminas liposolubles, incluyendo la vitamina K (106).
Recomendación del Instituto Linus Pauling
No es claro si la IA para la vitamina K es suficiente para optimizar la γ-carboxilación de las proteínas dependientes de vitamina K en el hueso (véase Osteoporosis). Para consumir la cantidad suficiente de vitamina K asociada con un riesgo disminuido de fractura de cadera en el Estudio del Corazón de Framingham (aproximadamente 250 μg/día) (44), un individuo necesitaría comer un poco más de una ½ taza de brócoli picado o una ensalada grande de verduras mixtas cada día. Aunque la ingesta recomendada de vitamina K necesaria para el funcionamiento óptimo de todas las proteínas dependientes de vitamina K aún se desconoce, el Instituto Linus Pauling recomienda tomar diariamente un suplemento multivitamínico-mineral y comer al menos una taza de vegetales de hoja verde. Reemplazar las grasas saturadas de la dieta como la mantequilla y el queso con grasas monosaturadas que se encuentran en el aceite de oliva y de canola, incrementara la ingesta de vitamina K dietética y podría disminuir el riesgo de enfermedades cardiovasculares.
Adultos mayores (>50 años)
Ya que los adultos mayores están un riesgo incrementado de osteoporosis y fractura de cadera, la recomendación anterior de un suplemento multivitamínico/mineral y al menos una taza de vegetales de hoja verde a diario es especialmente relevante.
Autores y Críticos
Originalmente escrito en 2000 por:
Jane Higdon, Ph.D.
Instituto Linus Pauling
Universidad Estatal de Oregon
Actualizado en Mayo de 2004 por:
Jane Higdon, Ph.D.
Instituto Linus Pauling
Universidad Estatal de Oregon
Actualizado en Mayo de 2008 por:
Victoria J. Drake, Ph.D.
Instituto Linus Pauling
Universidad Estatal de Oregon
Actualizado en Julio de 2014 por:
Barbara Delage, Ph.D.
Instituto Linus Pauling
Universidad Estatal de Oregon
Revisado en Agosto de 2014 por:
Sarah L. Booth, Ph.D.
Directora, Programa de Investigación de la Vitamina K
Jean Mayer USDA Centro de Investigación de Nutrición Humana en el Envejecimiento
Universidad de Tufts
Traducido al Español en 2016 por:
Silvia Vazquez Lima
Instituto Linus Pauling
Universidad Estatal de Oregon
Originalmente traducido al español en 2012 por Guillermo Sandoval y editado por Andrew Quest (Ph.D.) y Lisette Leyton (Ph.D.), todos provenientes de la Universidad de Chile. Estos esfuerzos fueron patrocinados por el projecto Anillo #ACT1111, CONICYT-Chile, programa PIA.
Derechos de autoría 2000-2024 Instituto Linus Pauling
Referencias
1. Brody T. Nutritional Biochemistry. 2nd ed. San Diego: Academic Press; 1999.
2. Booth SL. Vitamin K: food composition and dietary intakes. Food Nutr Res. 2012;56. (PubMed)
3. Kidd PM. Vitamins D and K as pleiotropic nutrients: clinical importance to the skeletal and cardiovascular systems and preliminary evidence for synergy. Altern Med Rev. 2010;15(3):199-222. (PubMed)
4. Nakagawa K, Hirota Y, Sawada N, et al. Identification of UBIAD1 as a novel human menaquinone-4 biosynthetic enzyme. Nature. 2010;468(7320):117-121. (PubMed)
5. Ferland G. Vitamin K. In: Erdman Jr. JW, Macdonald IA, Zeisel SH, eds. Present Knowledge in Nutrition. 10th ed. Ames: Wiley-Blackwell; 2012:230-247.
6. Rishavy MA, Hallgren KW, Wilson LA, Usubalieva A, Runge KW, Berkner KL. The vitamin K oxidoreductase is a multimer that efficiently reduces vitamin K epoxide to hydroquinone to allow vitamin K-dependent protein carboxylation. J Biol Chem. 2013;288(44):31556-31566. (PubMed)
7. Tie JK, Jin DY, Straight DL, Stafford DW. Functional study of the vitamin K cycle in mammalian cells. Blood. 2011;117(10):2967-2974. (PubMed)
8. Olson RE. Vitamin K. In: Shils M, Olson JA, Shike M, Ross AC, eds. Modern Nutrition in Health and Disease. 9th ed. Baltimore: Lippincott Williams & Wilkins; 1999:363-380.
9. Holmes MV, Hunt BJ, Shearer MJ. The role of dietary vitamin K in the management of oral vitamin K antagonists. Blood Rev. 2012;26(1):1-14. (PubMed)
10. Kramps M, Flanagan A, Smaldone A. The use of vitamin K supplementation to achieve INR stability: a systematic review and meta-analysis. J Am Assoc Nurse Pract. 2013;25(10):535-544. (PubMed)
11. Lam J, Schulman S, Witt DM, Vandvik PO, Qayyum F, Holbrook AM. Anticoagulation control with daily low-dose vitamin k to reduce clinically adverse outcomes and international normalized ratio variability: a systematic review and meta-analysis. Pharmacotherapy. 2013;33(11):1184-1190. (PubMed)
12. Mahtani KR, Heneghan CJ, Nunan D, Roberts NW. Vitamin K for improved anticoagulation control in patients receiving warfarin. Cochrane Database Syst Rev. 2014;5:CD009917. (PubMed)
13. Gundberg CM, Lian JB, Booth SL. Vitamin K-dependent carboxylation of osteocalcin: friend or foe? Adv Nutr. 2012;3(2):149-157. (PubMed)
14. Pierre-Jacques H, Glueck CJ, Mont MA, Hungerford DS. Familial heterozygous protein-S deficiency in a patient who had multifocal osteonecrosis. A case report. J Bone Joint Surg Am. 1997;79(7):1079-1084. (PubMed)
15. Rawat RS, Mehta Y, Arora D, Trehan N. Asymptomatic type B right atrial thrombus in a case with protein S deficiency. Ann Card Anaesth. 2014;17(3):237-239. (PubMed)
16. van der Meer JH, van der Poll T, van 't Veer C. TAM receptors, Gas6, and protein S: roles in inflammation and hemostasis. Blood. 2014;123(16):2460-2469. (PubMed)
17. Booth SL. Roles for vitamin K beyond coagulation. Annu Rev Nutr. 2009;29:89-110. (PubMed)
18. Boraldi F, Annovi G, Guerra D, et al. Fibroblast protein profile analysis highlights the role of oxidative stress and vitamin K recycling in the pathogenesis of pseudoxanthoma elasticum. Proteomics Clin Appl. 2009;3(9):1084-1098. (PubMed)
19. Boraldi F, Garcia-Fernandez M, Paolinelli-Devincenzi C, et al. Ectopic calcification in β-thalassemia patients is associated with increased oxidative stress and lower MGP carboxylation. Biochim Biophys Acta. 2013;1832(12):2077-2084. (PubMed)
20. Coutu DL, Wu JH, Monette A, Rivard GE, Blostein MD, Galipeau J. Periostin, a member of a novel family of vitamin K-dependent proteins, is expressed by mesenchymal stromal cells. J Biol Chem. 2008;283(26):17991-18001. (PubMed)
21. Viegas CS, Simes DC, Laize V, Williamson MK, Price PA, Cancela ML. Gla-rich protein (GRP), a new vitamin K-dependent protein identified from sturgeon cartilage and highly conserved in vertebrates. J Biol Chem. 2008;283(52):36655-36664. (PubMed)
22. Viegas CS, Cavaco S, Neves PL, et al. Gla-rich protein is a novel vitamin K-dependent protein present in serum that accumulates at sites of pathological calcifications. Am J Pathol. 2009;175(6):2288-2298. (PubMed)
23. Hakuno D, Kimura N, Yoshioka M, et al. Periostin advances atherosclerotic and rheumatic cardiac valve degeneration by inducing angiogenesis and MMP production in humans and rodents. J Clin Invest. 2010;120(7):2292-2306. (PubMed)
24. Kudo Y, Siriwardena BS, Hatano H, Ogawa I, Takata T. Periostin: novel diagnostic and therapeutic target for cancer. Histol Histopathol. 2007;22(10):1167-1174. (PubMed)
25. Vanakker OM, Martin L, Schurgers LJ, et al. Low serum vitamin K in PXE results in defective carboxylation of mineralization inhibitors similar to the GGCX mutations in the PXE-like syndrome. Lab Invest. 2010;90(6):895-905. (PubMed)
26. Ferland G. Vitamin K and the nervous system: an overview of its actions. Adv Nutr. 2012;3(2):204-212. (PubMed)
27. Laurance S, Lemarie CA, Blostein MD. Growth arrest-specific gene 6 (gas6) and vascular hemostasis. Adv Nutr. 2012;3(2):196-203. (PubMed)
28. Robins RS, Lemarie CA, Laurance S, Aghourian MN, Wu J, Blostein MD. Vascular Gas6 contributes to thrombogenesis and promotes tissue factor up-regulation after vessel injury in mice. Blood. 2013;121(4):692-699. (PubMed)
29. Rothlin CV, Leighton JA, Ghosh S. Tyro3, Axl, and Mertk Receptor Signaling in Inflammatory Bowel Disease and Colitis-associated Cancer. Inflamm Bowel Dis. 2014;20(8):1472-1480. (PubMed)
30. Tjwa M, Moons L, Lutgens E. Pleiotropic role of growth arrest-specific gene 6 in atherosclerosis. Curr Opin Lipidol. 2009;20(5):386-392. (PubMed)
31. Jagannath VA, Fedorowicz Z, Thaker V, Chang AB. Vitamin K supplementation for cystic fibrosis. Cochrane Database Syst Rev. 2013;4:CD008482. (PubMed)
32. Nakajima S, Iijima H, Egawa S, et al. Association of vitamin K deficiency with bone metabolism and clinical disease activity in inflammatory bowel disease. Nutrition. 2011;27(10):1023-1028. (PubMed)
33. Nowak JK, Grzybowska-Chlebowczyk U, Landowski P, et al. Prevalence and correlates of vitamin K deficiency in children with inflammatory bowel disease. Sci Rep. 2014;4:4768. (PubMed)
34. Shearer MJ. Vitamin K deficiency bleeding (VKDB) in early infancy. Blood Rev. 2009;23(2):49-59. (PubMed)
35. American Academy of Pediatrics Committee on Fetus and Newborn. Controversies concerning vitamin K and the newborn. Pediatrics. 2003;112(1 Pt 1):191-192. (PubMed)
36. Klebanoff MA, Read JS, Mills JL, Shiono PH. The risk of childhood cancer after neonatal exposure to vitamin K. N Engl J Med. 1993;329(13):905-908. (PubMed)
37. Ekelund H, Finnstrom O, Gunnarskog J, Kallen B, Larsson Y. Administration of vitamin K to newborn infants and childhood cancer. BMJ. 1993;307(6896):89-91. (PubMed)
38. Roman E, Fear NT, Ansell P, et al. Vitamin K and childhood cancer: analysis of individual patient data from six case-control studies. Br J Cancer. 2002;86(1):63-69. (PubMed)
39. Schulte R, Jordan LC, Morad A, Naftel RP, Wellons JC, 3rd, Sidonio R. Rise in late onset vitamin K deficiency bleeding in young infants because of omission or refusal of prophylaxis at birth. Pediatr Neurol. 2014;50(6):564-568. (PubMed)
40. Costakos DT, Greer FR, Love LA, Dahlen LR, Suttie JW. Vitamin K prophylaxis for premature infants: 1 mg versus 0.5 mg. Am J Perinatol. 2003;20(8):485-490. (PubMed)
41. Kumar D, Greer FR, Super DM, Suttie JW, Moore JJ. Vitamin K status of premature infants: implications for current recommendations. Pediatrics. 2001;108(5):1117-1122. (PubMed)
42. Food and Nutrition Board, Institute of Medicine. Vitamin K. Dietary Reference Intakes for Vitamin A, Vitamin K, Arsenic, Boron, Chromium, Copper, Iodine, Iron, Manganese, Molybdenum, Nickel, Silicon, Vanadium, and Zinc. Washington, D.C.: National Academy Press; 2001:162-196. (National Academy Press)
43. Feskanich D, Weber P, Willett WC, Rockett H, Booth SL, Colditz GA. Vitamin K intake and hip fractures in women: a prospective study. Am J Clin Nutr. 1999;69(1):74-79. (PubMed)
44. Booth SL, Tucker KL, Chen H, et al. Dietary vitamin K intakes are associated with hip fracture but not with bone mineral density in elderly men and women. Am J Clin Nutr. 2000;71(5):1201-1208. (PubMed)
45. Rejnmark L, Vestergaard P, Charles P, et al. No effect of vitamin K1 intake on bone mineral density and fracture risk in perimenopausal women. Osteoporos Int. 2006;17(8):1122-1132. (PubMed)
46. McLean RR, Booth SL, Kiel DP, et al. Association of dietary and biochemical measures of vitamin K with quantitative ultrasound of the heel in men and women. Osteoporos Int. 2006;17(4):600-607. (PubMed)
47. Macdonald HM, μguigan FE, Lanham-New SA, Fraser WD, Ralston SH, Reid DM. Vitamin K1 intake is associated with higher bone mineral density and reduced bone resorption in early postmenopausal Scottish women: no evidence of gene-nutrient interaction with apolipoprotein E polymorphisms. Am J Clin Nutr. 2008;87(5):1513-1520. (PubMed)
48. Apalset EM, Gjesdal CG, Eide GE, Tell GS. Intake of vitamin K1 and K2 and risk of hip fractures: The Hordaland Health Study. Bone. 2011;49(5):990-995. (PubMed)
49. Torbergsen AC, Watne LO, Wyller TB, et al. Vitamin K1 and 25(OH)D are independently and synergistically associated with a risk for hip fracture in an elderly population: A case control study. Clin Nutr. 2015;34(1):101-106. (PubMed)
50. Booth SL, Mayer J. Warfarin use and fracture risk. Nutr Rev. 2000;58(1):20-22. (PubMed)
51. Tsugawa N, Shiraki M, Suhara Y, et al. Low plasma phylloquinone concentration is associated with high incidence of vertebral fracture in Japanese women. J Bone Miner Metab. 2008;26(1):79-85. (PubMed)
52. Ikeda Y, Iki M, Morita A, et al. Intake of fermented soybeans, natto, is associated with reduced bone loss in postmenopausal women: Japanese Population-Based Osteoporosis (JPOS) Study. J Nutr. 2006;136(5):1323-1328. (PubMed)
53. Fujita Y, Iki M, Tamaki J, et al. Association between vitamin K intake from fermented soybeans, natto, and bone mineral density in elderly Japanese men: the Fujiwara-kyo Osteoporosis Risk in Men (FORMEN) study. Osteoporos Int. 2012;23(2):705-714. (PubMed)
54. Kaneki M, Hodges SJ, Hosoi T, et al. Japanese fermented soybean food as the major determinant of the large geographic difference in circulating levels of vitamin K2: possible implications for hip-fracture risk. Nutrition. 2001;17(4):315-321. (PubMed)
55. Szulc P, Chapuy MC, Meunier PJ, Delmas PD. Serum undercarboxylated osteocalcin is a marker of the risk of hip fracture in elderly women. J Clin Invest. 1993;91(4):1769-1774. (PubMed)
56. Vergnaud P, Garnero P, Meunier PJ, Breart G, Kamihagi K, Delmas PD. Undercarboxylated osteocalcin measured with a specific immunoassay predicts hip fracture in elderly women: the EPIDOS Study. J Clin Endocrinol Metab. 1997;82(3):719-724. (PubMed)
57. Shearer MJ. The roles of vitamins D and K in bone health and osteoporosis prevention. Proc Nutr Soc. 1997;56(3):915-937. (PubMed)
58. O'Connor E, Molgaard C, Michaelsen KF, Jakobsen J, Cashman KD. Vitamin D-vitamin K interaction: effect of vitamin D supplementation on serum percentage undercarboxylated osteocalcin, a sensitive measure of vitamin K status, in Danish girls. Br J Nutr. 2010;104(8):1091-1095. (PubMed)
59. Kanellakis S, Moschonis G, Tenta R, et al. Changes in parameters of bone metabolism in postmenopausal women following a 12-month intervention period using dairy products enriched with calcium, vitamin D, and phylloquinone (vitamin K(1)) or menaquinone-7 (vitamin K (2)): the Postmenopausal Health Study II. Calcif Tissue Int. 2012;90(4):251-262. (PubMed)
60. Bolton-Smith C, McMurdo ME, Paterson CR, et al. Two-year randomized controlled trial of vitamin K1 (phylloquinone) and vitamin D3 plus calcium on the bone health of older women. J Bone Miner Res. 2007;22(4):509-519. (PubMed)
61. Braam LA, Knapen MH, Geusens P, et al. Vitamin K1 supplementation retards bone loss in postmenopausal women between 50 and 60 years of age. Calcif Tissue Int. 2003;73(1):21-26. (PubMed)
62. Cockayne S, Adamson J, Lanham-New S, Shearer MJ, Gilbody S, Torgerson DJ. Vitamin K and the prevention of fractures: systematic review and meta-analysis of randomized controlled trials. Arch Intern Med. 2006;166(12):1256-1261. (PubMed)
63. Tamura T, Morgan SL, Takimoto H. Vitamin K and the prevention of fractures. Arch Intern Med. 2007;167(1):94; author reply 94-95. (PubMed)
64. Inoue T, Fujita T, Kishimoto H, et al. Randomized controlled study on the prevention of osteoporotic fractures (OF study): a phase IV clinical study of 15-mg menatetrenone capsules. J Bone Miner Metab. 2009;27(1):66-75. (PubMed)
65. Knapen MH, Schurgers LJ, Vermeer C. Vitamin K2 supplementation improves hip bone geometry and bone strength indices in postmenopausal women. Osteoporos Int. 2007;18(7):963-972. (PubMed)
66. Binkley N, Harke J, Krueger D, et al. Vitamin K treatment reduces undercarboxylated osteocalcin but does not alter bone turnover, density, or geometry in healthy postmenopausal North American women. J Bone Miner Res. 2009;24(6):983-991. (PubMed)
67. Emaus N, Gjesdal CG, Almas B, et al. Vitamin K2 supplementation does not influence bone loss in early menopausal women: a randomised double-blind placebo-controlled trial. Osteoporos Int. 2010;21(10):1731-1740. (PubMed)
68. Knapen MH, Drummen NE, Smit E, Vermeer C, Theuwissen E. Three-year low-dose menaquinone-7 supplementation helps decrease bone loss in healthy postmenopausal women. Osteoporos Int. 2013;24(9):2499-2507. (PubMed)
69. Jamal SA, Browner WS, Bauer DC, Cummings SR. Warfarin use and risk for osteoporosis in elderly women. Study of Osteoporotic Fractures Research Group. Ann Intern Med. 1998;128(10):829-832. (PubMed)
70. Caraballo PJ, Heit JA, Atkinson EJ, et al. Long-term use of oral anticoagulants and the risk of fracture. Arch Intern Med. 1999;159(15):1750-1756. (PubMed)
71. Gage BF, Birman-Deych E, Radford MJ, Nilasena DS, Binder EF. Risk of osteoporotic fracture in elderly patients taking warfarin: results from the National Registry of Atrial Fibrillation 2. Arch Intern Med. 2006;166(2):241-246. (PubMed)
72. Caraballo PJ, Gabriel SE, Castro MR, Atkinson EJ, Melton LJ, 3rd. Changes in bone density after exposure to oral anticoagulants: a meta-analysis. Osteoporos Int. 1999;9(5):441-448. (PubMed)
73. Fusaro M, Crepaldi G, Maggi S, et al. Bleeding, vertebral fractures and vascular calcifications in patients treated with warfarin: hope for lower risks with alternative therapies. Curr Vasc Pharmacol. 2011;9(6):763-769. (PubMed)
74. Cheung CL, Sahni S, Cheung BM, Sing CW, Wong IC. Vitamin K intake and mortality in people with chronic kidney disease from NHANES III. Clin Nutr. 2014; pii: S0261-5614(14)00086-7. doi: 10.1016/j.clnu.2014.03.011. [Epub ahead of print] (PubMed)
75. Juanola-Falgarona M, Salas-Salvado J, Martinez-Gonzalez MA, et al. Dietary intake of vitamin K is inversely associated with mortality risk. J Nutr. 2014;144(5):743-750. (PubMed)
76. Vissers LE, Dalmeijer GW, Boer JM, Monique Verschuren WM, van der Schouw YT, Beulens JW. Intake of dietary phylloquinone and menaquinones and risk of stroke. J Am Heart Assoc. 2013;2(6):e000455. (PubMed)
77. Rees K, Guraewal S, Wong YL, et al. Is vitamin K consumption associated with cardio-metabolic disorders? A systematic review. Maturitas. 2010;67(2):121-128. (PubMed)
78. Gast GC, de Roos NM, Sluijs I, et al. A high menaquinone intake reduces the incidence of coronary heart disease. Nutr Metab Cardiovasc Dis. 2009;19(7):504-510. (PubMed)
79. Geleijnse JM, Vermeer C, Grobbee DE, et al. Dietary intake of menaquinone is associated with a reduced risk of coronary heart disease: the Rotterdam Study. J Nutr. 2004;134(11):3100-3105. (PubMed)
80. Otsuka F, Sakakura K, Yahagi K, Joner M, Virmani R. Has our understanding of calcification in human coronary atherosclerosis progressed? Arterioscler Thromb Vasc Biol. 2014;34(4):724-736. (PubMed)
81. Rennenberg RJ, Kessels AG, Schurgers LJ, van Engelshoven JM, de Leeuw PW, Kroon AA. Vascular calcifications as a marker of increased cardiovascular risk: a meta-analysis. Vasc Health Risk Manag. 2009;5(1):185-197. (PubMed)
82. Jie KS, Bots ML, Vermeer C, Witteman JC, Grobbee DE. Vitamin K intake and osteocalcin levels in women with and without aortic atherosclerosis: a population-based study. Atherosclerosis. 1995;116(1):117-123. (PubMed)
83. Villines TC, Hatzigeorgiou C, Feuerstein IM, O'Malley PG, Taylor AJ. Vitamin K1 intake and coronary calcification. Coron Artery Dis. 2005;16(3):199-203. (PubMed)
84. Maas AH, van der Schouw YT, Beijerinck D, et al. Vitamin K intake and calcifications in breast arteries. Maturitas. 2007;56(3):273-279. (PubMed)
85. Beulens JW, Bots ML, Atsma F, et al. High dietary menaquinone intake is associated with reduced coronary calcification. Atherosclerosis. 2009;203(2):489-493. (PubMed)
86. Borras T, Comes N. Evidence for a calcification process in the trabecular meshwork. Exp Eye Res. 2009;88(4):738-746. (PubMed)
87. Schurgers LJ, Uitto J, Reutelingsperger CP. Vitamin K-dependent carboxylation of matrix Gla-protein: a crucial switch to control ectopic mineralization. Trends Mol Med. 2013;19(4):217-226. (PubMed)
88. Cassidy-Bushrow AE, Bielak LF, Levin AM, et al. Matrix gla protein gene polymorphism is associated with increased coronary artery calcification progression. Arterioscler Thromb Vasc Biol. 2013;33(3):645-651. (PubMed)
89. Herrmann SM, Whatling C, Brand E, et al. Polymorphisms of the human matrix gla protein (MGP) gene, vascular calcification, and myocardial infarction. Arterioscler Thromb Vasc Biol. 2000;20(11):2386-2393. (PubMed)
90. Schurgers LJ, Teunissen KJ, Knapen MH, et al. Novel conformation-specific antibodies against matrix γ-carboxyglutamic acid (Gla) protein: undercarboxylated matrix Gla protein as marker for vascular calcification. Arterioscler Thromb Vasc Biol. 2005;25(8):1629-1633. (PubMed)
91. van den Heuvel EG, van Schoor NM, Lips P, et al. Circulating uncarboxylated matrix Gla protein, a marker of vitamin K status, as a risk factor of cardiovascular disease. Maturitas. 2014;77(2):137-141. (PubMed)
92. Mayer O, Jr., Seidlerova J, Bruthans J, et al. Desphospho-uncarboxylated matrix Gla-protein is associated with mortality risk in patients with chronic stable vascular disease. Atherosclerosis. 2014;235(1):162-168. (PubMed)
93. Shea MK, O'Donnell CJ, Hoffmann U, et al. Vitamin K supplementation and progression of coronary artery calcium in older men and women. Am J Clin Nutr. 2009;89(6):1799-1807. (PubMed)
94. Shea MK, O'Donnell CJ, Vermeer C, et al. Circulating uncarboxylated matrix gla protein is associated with vitamin K nutritional status, but not coronary artery calcium, in older adults. J Nutr. 2011;141(8):1529-1534. (PubMed)
95. Chatrou ML, Winckers K, Hackeng TM, Reutelingsperger CP, Schurgers LJ. Vascular calcification: the price to pay for anticoagulation therapy with vitamin K-antagonists. Blood Rev. 2012;26(4):155-166. (PubMed)
96. Booth SL, Suttie JW. Dietary intake and adequacy of vitamin K. J Nutr. 1998;128(5):785-788. (PubMed)
97. Beulens JW, Booth SL, van den Heuvel EG, Stoecklin E, Baka A, Vermeer C. The role of menaquinones (vitamin K(2)) in human health. Br J Nutr. 2013;110(8):1357-1368. (PubMed)
98. Hendler SS, Rorvik DR. Vitamin K. PDR for Nutritional Supplements. 2nd ed. Montvale: Physicians' Desk Reference Inc.; 2008:708-7123.
99. Traber MG. Vitamin E and K interactions--a 50-year-old problem. Nutr Rev. 2008;66(11):624-629. (PubMed)
100. Booth SL, Golly I, Sacheck JM, et al. Effect of vitamin E supplementation on vitamin K status in adults with normal coagulation status. Am J Clin Nutr. 2004;80(1):143-148. (PubMed)
101. Pastori D, Carnevale R, Cangemi R, et al. Vitamin E serum levels and bleeding risk in patients receiving oral anticoagulant therapy: a retrospective cohort study. J Am Heart Assoc. 2013;2(6):e000364. (PubMed)
102. Shearer MJ, Newman P. Recent trends in the metabolism and cell biology of vitamin K with special reference to vitamin K cycling and MK-4 biosynthesis. J Lipid Res. 2014;55(3):345-362. (PubMed)
103. Thorp JA, Gaston L, Caspers DR, Pal ML. Current concepts and controversies in the use of vitamin K. Drugs. 1995;49(3):376-387. (PubMed)
104. Reiffel JA. An important indirect drug interaction between dronedarone and warfarin that may be extrapolated to other drugs that can alter gastrointestinal function. Am Heart J. 2011;161(2):e5; author reply e7. (PubMed)
105. Shirolkar SC, Fiuzat M, Becker RC. Dronedarone and vitamin K antagonists: a review of drug-drug interactions. Am Heart J. 2010;160(4):577-582. (PubMed)
106. Hendler SS, Rorvik DR, eds. PDR for Nutritional Supplements. Montvale: Medical Economics Company, Inc.; 2001.