English
免疫システムの概要
免疫系は感染や病気から体を守っている。それは細胞、組織、器官による複雑かつ統合されたシステムであり、異物や細菌、ウイルス、真菌を含む病原微生物に対する防御に特化した役割を担っている。また、免疫システムは癌の発生防止にも機能する。これらの活動のために、免疫系は外部からの侵略者だけでなく、異常な細胞を認識し、それを自己と区別しなければならない(1)。しかし、免疫系は両刃の剣であり、病原体と戦い、それを破壊する過程で宿主の(自らの)組織を傷害することがある。免疫応答の主要な構成要素は炎症で、宿主組織への損傷を引き起こす可能性があるが、多くの場合ダメージは深刻ではない(2)。炎症については、別の記事で説明することとし、この記事は、栄養と免疫に焦点を当てる。
免疫系の細胞は骨髄から発生し、血液とリンパ液によって末梢組織まで循環する。胸腺、脾臓、リンパ節が免疫系の器官である(3)。Tリンパ球は胸腺内で成熟する。胸腺は胸部にあり、心臓の上に乗っている。上腹部にある脾臓は、抗体の血液中への分泌を調節する機能に加え、古くなったり破損した赤血球を循環系から取り除く(4)。リンパ節は、全身の組織をそれぞれの場所で監視する交番のような組織で、抗原と病原菌を捕らえて、組織化された免疫細胞の活性化を促進する。
免疫システムは、大雑把に2つの主要な構成要素に分割される。 自然免疫と適応免疫である。 自然免疫は異物である侵略者への素早い非特異的な応答に係る。一方で適応免疫はより長い時間をかけて、複雑で特異的な応答を行う(1)。
自然免疫
自然免疫は、異物と病原微生物に対する最初の防衛線である。自然免疫には病原体に対する免疫記憶はなく、応答の速い非特異的な防御である。特異性が低いために、自然免疫の応答は時として身体の組織を損傷することがある(5)。免疫記憶がないということは、それぞれの抗原がたびたび侵入したとしても、応答は同じであることを意味する(6).
自然免疫系は感染症への様々な解剖学的障壁で構成され、物理的な障壁(例えば、皮膚)、化学的障壁(例えば、胃酸の酸性度)、および生物学的障壁(例えば、胃腸の正常細菌叢)を含んでいる(1)。解剖学的な障壁に加えて、自然免疫系は可溶性因子および病原体に対する防御の最前線を担う食細胞から構成されている。可溶性因子には、補体系、急性期(反応)タンパク質、およびサイトカイン(6)と呼ばれる情報タンパク質などが含まれる。補体系(血漿中および細胞表面の30を超えるタンパク質の生化学的なネットワーク)は、自然免疫の主要な構成要素である。補体系は、直接的な細胞溶解(細胞破壊)によって、あるいは貪食の促進によって侵入した病原体を殺傷する反応を誘導する。さらに補体蛋白質は炎症反応の制御も行う。それは自然免疫の重要な部分である(7-9)。急性期タンパク質は一群の血漿蛋白質であり、炎症において重要である。炎症の初期段階で、免疫細胞によって分泌されるサイトカインが肝臓での急性期タンパク質の合成を促進する(10)。サイトカインは、免疫応答の調節に重要な役割を持っている化学伝達物質であり、いくつかのサイトカインは、直接病原体と戦う。例えば、インターフェロンには抗ウイルス活性がある(6)。これらの可溶性因子は、感染局所に食細胞を呼び寄せる上で重要である。単球、マクロファージ、および好中球は、貪食と呼ばれるプロセスで侵入した微生物を取り込み消化する重要な免疫細胞である。これらの細胞は病原体関連分子パターン(PAMP)を識別するパターン認識受容体を発現しており、これを使って病原微生物に固有でありながら一群の病原体の間で保存されている分子を識別する(図1)(2, 11)。自然免疫応答の詳細については、炎症に関する記事を参照していただきたい。
適応免疫
適応免疫(後天的免疫とも呼ばれる)は、病原体に対する第二段の防御であり、完全に機能するまでに、数日から数週間がかかる。しかし適応免疫は自然免疫に比べ、抗原に特異的な反応と免疫学的な「記憶」を含むので、はるかに複雑である。病原体が侵入し、それが持つ特異的な抗原に曝露されると、その病原体の破壊に特化した免疫細胞の生産が刺激される(1)。免疫学的な抗原の「記憶」とは、抗原を覚えていることにより、同じ病原体への二回目の曝露では免疫応答がより速くより強いことを意味している。適応免疫応答の主要な調節者は、Bリンパ球(B細胞)とTリンパ球(T細胞)である。 B細胞は抗体を生産する。抗体は、異物であるタンパク質や病原体を認識して結合する特殊化された蛋白で、毒素を中和したり、マクロファージが破壊する時の目印として働く。抗体が介在する反応は、液性免疫と呼ばれている。これとは対照的に、細胞性免疫は胸腺で成熟するリンパ球であるT細胞が担っている。T細胞にはいくつかのサブグループがあり、適応免疫の中で異なった役割を持っている。たとえば、細胞傷害性T細胞(キラーT細胞)は感染細胞を直接攻撃して殺し、ヘルパーT細胞は他のリンパ球の応答を促進し、その結果としてそれらの機能を補助している(5, 6)。制御性T細胞(抑制T細胞とも呼ばれる)は、免疫応答を抑制する(12)。補体系は自然免疫でのその不可欠な役割に加えて、適応免疫の反応を調節しており、これは自然免疫と適応免疫での相互作用の一例である(7, 13)。自然免疫と適応免疫の構成要素は相互に作用し、協同して体を感染と病気から守っている。
栄養の役割
概要
栄養の状態によって、免疫系の働きが変化することがある。したがって、栄養学と免疫学は密接に結ばれている。事実、栄養失調は免疫不全の原因として、世界的に最も一般的である(14)。そして慢性的な栄養失調は、世界での疾病と死亡に関わる主要な危険因子となっている(15)。8億人以上の人々が栄養不良であると推定され、その大多数は発展途上国に暮らしている(16)。しかし、低栄養は先進工業国の問題でもあり、特に入院している患者と高齢者では問題である(17)。
全般的な栄養不足は、適当な免疫機能を保つのに必要とされる特定の微量元素が欠乏するだけでなく、エネルギーと主要栄養素が摂取不足となる。
このような栄養不足は、免疫抑制と免疫応答の調節不全を招く。特に、特定の栄養素の欠乏は、自然免疫での食細胞の機能を弱めることがあり、また、サイトカインの生産や抗体と細胞が媒介する免疫を含む適応免疫のいくつかの面で悪影響を与えることがある(18, 19)。過剰栄養は、栄養素、特に主要栄養素を栄養必要量以上に過剰摂取することによる栄養不良のひとつの型であり、免疫系機能に悪影響を与える(下の「過剰栄養と肥満」を参照のこと)。
栄養不良が誘発する免疫応答の障害は、人々の感染症と疾病への感受性を増大する。それに引き続いて、感染症と疾病は栄養不良の状態を悪化させる。たとえば、食欲不振によって栄養素の摂取が低下したり、栄養の吸収が悪化したり、より多くの栄養素が喪失したり、栄養をより多く必要とする代謝への変化などがある(19)。このように、栄養不良と感染症による状態の悪化は、互いに促進し合い、危険な悪循環につながることになる(14)。
主要栄養素
タンパク質・エネルギー栄養障害(PEM)
タンパク質・エネルギー栄養障害(PEM; タンパク質・カロリー栄養障害とも時々呼ばれる)は、主に幼児や高齢者に影響を与える一般的な栄養の問題である(20)。重度PEMの臨床症状は、マラスムス、クワシオルコル、またはこれら2つの症候群が混成したものと呼ばれている。マラスムスは、脂肪蓄積の消耗および筋肉消耗が特徴の消耗病である。これは、蛋白質とカロリー(すなわち、すべての栄養素)の両方の欠乏に起因する。マラスムスに悩まされている人達は異常なほどに痩せ衰えて見え、ひどい低体重で、浮腫は無い(21)。これとは対照的に、クワシオルコルの特徴は浮腫の存在である。全体的なカロリー摂取量は正常であっても、クワシオルコルは主に食物中のタンパク質の欠乏によって引き起こされる(21, 22)。どちらの障害も、発展途上国においてより一般的であるが、特定のタイプのPEMは、先進国でも様々なサブグループ、たとえば入院している高齢者などに見ることができる(17)。先進国では、PEMは、より一般的に、炎症性腸疾患、慢性腎不全、あるいは癌などの栄養素代謝に悪影響する慢性疾患に続発して発症する(22)。
特定の原因に関係なく、自然免疫と適応免疫の両方に悪影響を与えることによって、PEMは感染への感受性を増大する(15)。自然免疫に関しては、PEMは特定のサイトカインといくつかの補体タンパク質の生産の減少や、食細胞の機能低下にも関連している(20, 23, 24)。そのような栄養障害では、粘膜バリアによる防御にも障害を与え、呼吸器、胃腸、尿路での感染症に対する防御が弱くなる(21)。適応免疫に関しては、PEMは液性免疫の構成要素としてではなく、主に細胞性免疫に影響を及す。特に、PEMは胸腺(T細胞を生産する器官)の萎縮を引き起こす。そして、それは循環するT細胞の数を減らして、抗原に対する記憶応答の有効性を弱める(21, 24)。PEMはまた、脾臓とリンパ節を含む他のリンパ組織の機能をも低下させる(20)。液性免疫への影響が小さい場合には、PEMでは抗体の親和性と反応性が低下することが多い(24)。PEMは通常、必須微量栄養素、特にビタミンA、ビタミンB6、葉酸、ビタミンE、亜鉛、鉄、銅とセレンの欠乏と合併して起こる点に注意を払うことが重要である(21)。
食物中の脂質
実験的研究によれば、いくつかの種類の食物脂質(脂肪酸)には免疫応答を調節する作用がある(25)。この作用がある脂肪酸には、オメガ-3とオメガ-6の長鎖高度不飽和脂肪酸(PUFAs)が含まれる。PUFAは、炭素間二重結合を複数持つ脂肪酸である。すべてのオメガ-3脂肪酸(n-3)では、脂肪酸のメチル末端から数えて3番目と4番目の炭素原子の間に、最初の二重結合がある。同様に、すべてのオメガ-6脂肪酸(n-6)では、脂肪酸のメチル末端から数えて6番目と7番目の炭素原子の間に、最初の二重結合がある(26)。ヒトは、脂肪酸のn-3またはn-6位置に二重結合をつくる能力を持っていない。したがって、両方のクラスの脂肪酸は、必須な栄養素と考えられて、食品から摂取しなければならない(26)。詳細な情報は、必須脂肪酸についての記事で説明する。アルファ-リノレン酸(ALA)は栄養的に必須なn-3脂肪酸であり、そして、リノール酸(LA)は栄養的に必須なn-6脂肪酸である。食事からの摂取が推奨される必須脂肪酸は、ALAとLAである。n-3とn-6クラスに属する他の脂肪酸は、ALAまたはLAから、体内で合成することができる。たとえば、長鎖n-6 PUFA(アラキドン酸)はLAから合成することができ、長鎖n-3 PUFAs(エイコサペンタエン酸(EPA)とドコサヘキサエン酸(DHA)) はALAから合成することができる(26)。しかし妊娠中や授乳期間のような特定の状況では、EPA、特にDHAの合成が不十分になることがある(27, 28)。EPAとDHAは、他のPUFAと同様に、免疫応答や炎症応答を含む細胞機能を調節する(29)。
長鎖PUFAは免疫細胞の膜リン脂質に取り込まれ、貪食やT細胞シグナリングのような免疫と炎症応答の細胞シグナル伝達を調節する。長鎖PUFAは、エイコサノイドと他の脂質性のメディエイターの生産も調節している(29, 30)。エイコサノイドは、炭素数20のPUFA誘導体で、炎症と免疫の反応で鍵となる役割を担っている。炎症反応の間、免疫細胞の細胞膜中の長鎖PUFA(例えば、n-6シリーズのアラキドン酸[AA]とn-3シリーズのEPA)は酵素によって代謝され、炎症に様々な影響を及ぼすエイコサノイド(例えば、プロスタグランジン、ロイコトリエンとトロンボキサン)が形成される(29)。AAに由来するエイコサノイドは、Bリンパ球とTリンパ球の機能も調節する。レゾルビンはEPAとDHAに由来する脂質メディエイターで、抗炎症作用を有するらしい(30)。これらの脂質メディエイターの相対的な生産量は、脂質の食事やサプリメントの摂取によって、ある程度まで変えることができる。典型的な欧米型の食事をしている人々では、免疫細胞の細胞膜のAA量はEPA量を大きく上まわり、その結果として、EPAからよりもAAからのエイコサノイドの形成が大きく上回っている。しかしn-3脂肪酸の摂取量を増すことで、用量依存的に免疫細胞膜のEPA含量を増やすことができる。結果として、EPAに由来するエイコサノイドがより多く生産され、AAに由来するエイコサノイドが減少することになり、全般的な抗炎症性の影響が現れるであろう(30, 31)。EPAに由来するエイコサノイドの生理活性は、AAから派生したものより弱いものの(32)、EPAと他のn-3 PUFAを補給することは、さまざまな炎症性疾患の治療に有用である可能性がある。これは現在、活発に研究されている領域である。n-3 PUFAを補給することは、炎症性疾患あるいは自己免疫性疾患の人達には有用であるかもしれないが、多量のn-3 PUFA摂取は生体防御機構を損なう可能性があり、感染症に対する感受性を増大させる恐れがある(詳細は、必須脂肪酸に関する記事を参照のこと)(25, 33)。
PUFAsに加え、共役リノール酸(CLA)と呼ばれているLAの異性体が免疫機能を調節することが、主に動物と試験管内の研究において示された(34)。CLAは、自然界では反芻動物動物の肉とミルクに含まれるが、cis-9, trans-11 CLA、とtrans-10, cis-12 CLAの2つの異性体を含むサプリメントとしても摂取可能である。28人の男女によって行われた研究では、CLAの補給(2つの主なCLA異性体の50:50の混合物:1日当たり3gを摂取)は、IgAとIgM(抗体の2つのクラス)の血漿中濃度の上昇と関連していた(35)。CLAの補給は、2種の炎症性サイトカインの濃度の減少と抗炎症性サイトカインの濃度の上昇にも関連していた(35)。いくつかの動物実験でも免疫応答に対する類似した影響が認められている(36, 37)が、免疫の状態と機能をさまざまな方法で計測したヒトを対象にした少数の他の研究では、CLAの有益な影響を見つけることはできなかった(38-40)。CLAがヒトの免疫応答に与える影響を理解するためには、より多くの研究が必要である。
さらに、脂質は一般に、エイコサノイドやそれに類似した免疫調節物質の前駆体である以外に、免疫において他の多くの役割を果たしている。たとえば、脂質は免疫細胞によって代謝されるエネルギー源であり、細胞膜の重要な構造的、機能的な構成要素でもある。これに加えて、脂質は膜内のレセプタを刺激したり、転写因子の活性を調節することを通して遺伝子発現を調節することができる。さらに、脂質はタンパク質を共有結合により修飾することができ、それによってタンパク質の機能に影響を及ぼす(30)。
微量栄養素
特定の微量栄養素(ビタミンと栄養的に必須なミネラル)の欠乏は、自然免疫と適応免疫の両者に悪影響を与える可能性がある。その結果として、感染と病気への感受性を増大させる。微量元素の欠乏は一般的な米国人できわめて一般的であるが、貧しい人々、高齢者と肥満の人では特によく見られる(過剰栄養と肥満の項を参照のこと)(41, 42)。米国全国健康栄養検査調査(NHANES)からのデータによると、米国で推定平均必要量(the estimated average requirement, EAR)を満たしていない人口は、ビタミンEで93%、マグネシウムで56%、ビタミンAで44%、ビタミンCで31%、ビタミンB6で14%、亜鉛で12%である(43)。さらに、ビタミンDの欠乏は、米国だけでなく他の国でも大きな問題であり、世界の10億人がビタミンDの欠乏もしくは不十分な状態にあると見積もられている(44)。微量栄養素が免疫応答の発達と発現に重要な役割を演じているので、特定の微量栄養素の欠乏は免疫の抑制と、その結果としての感染と病気への感受性の増大を引き起こすことになる。いくつかの微量栄養素の免疫機能における役割について如何に述べる。
ビタミンA
ビタミンAとその代謝物質は、自然免疫と適応免疫で重要な役割を演じている。自然免疫において、皮膚細胞と、目や呼吸器、消化管、尿生殖器の粘膜細胞は、感染症に対する障壁として機能している。ビタミンAは、これらの粘膜細胞が構造的かつ機能的な健全さを維持するのに貢献している。ビタミンAは、ナチュラルキラー(NK)細胞、マクロファージ、好中球などの自然免疫に重要な細胞が本来の機能を発揮することにも重要である。さらに、T細胞やB細胞のような適応免疫を調節する細胞の適切な機能に、ビタミンAは必要とされる。このように、ビタミンAは特異抗原に対する抗体の産生のために必要である(45)。
ビタミンAの免疫への影響の大部分は、ビタミンA誘導体、すなわちレチノイン酸の異性体が担っている。レチノイン酸の異性体はステロイド・ホルモンであり、レチノイン酸受容体(RARs)とレチノイドXレセプター(RXRs)という2つの異なるクラスのレチノイド受容体と結合する。古典的な経路では、RARはまずRXRとヘテロダイマーを形成し、その後、レチノイン酸応答配列(RAREs)と呼ばれる小さなDNA配列に結合する。その結果、特定の遺伝子の転写を調節する分子間相互作用のカスケードが開始される(46)。500以上の遺伝子が、レチノイン酸によって直接または間接的に調節されている(47)。これらの遺伝子のいくつかは、細胞の増殖と分化を制御する。よって、ビタミンAの免疫における重要性は明らかである。
世界的には、特に発展途上国では、プリフォームド・ビタミンA (レチノール及びそのエステル)を含む食品の入手が限定的であるため、ビタミンA欠乏症は公衆衛生における大きな問題である。(ビタミンAを含む食品に関する情報は、ビタミンAに関する別の記事を参照)。動物モデルの実験でも疫学的研究でも、ビタミンAの欠乏が免疫不全につながり、感染症に対するリスクを増大させることが示されている(45)。実際、この微量元素の欠乏が、発展途上国の幼児、子供および女性の罹病率と死亡率が高いことの主要な原因となっている。ビタミンAが欠乏している人達は、はしか、マラリアや下痢症などの感染症にかかりやすい(45)。無症状であってもビタミンAが欠乏すると、感染症のリスクが増大するかも知れない(48)。その一方で、感染症が様々な経緯でビタミンAの欠乏に結びつく可能性がある。たとえば食物摂取の減少、ビタミン吸収の低下、ビタミン排出の増大、ビタミン利用の阻害、ビタミンAの代謝的な必要量の増加などである(49)。
ビタミンAの欠乏が免疫系に及ぼす特異的な影響の多くは、動物モデルを使って明らかにされてきた。ビタミンAの欠乏は、自然免疫の構成要素を損傷する。上で述べたように、ビタミンAは自然免疫系の粘膜バリアを維持するのに不可欠である。このように、ビタミンAの欠乏は生体防御の最前線を脆弱にし、それによって眼科系、呼吸器系、消化器系、尿生殖器系の感染症に罹りやすくさせる(50-56)。ビタミンAの欠乏はNK細胞の数と細胞傷害活性の低下をもたらすだけでなく、好中球やマクロファージのように、病原体を貪食で殺滅する細胞の機能をも低下させる。影響を受けると考えられる機能は、走化性や貪食、および侵入した病原体を殺すオキシダントを産生する免疫細胞機能である(45)。これに加えて、ビタミンAの欠乏でサイトカインによるシグナリングは変化する可能性があり、それにより、自然免疫の炎症応答に影響を及ぼすであろう。
その上、ビタミンA欠乏は体液性、細胞性免疫を含む適応免疫をさまざまな面から損なう。特に、ビタミンAの欠乏は、レチノールとその代謝物質に依存するB細胞の成長と分化に悪影響を及ぼす(57,58)。ビタミンA欠乏はB細胞機能にも影響を及ぼす。例を挙げれば、ビタミンAの欠乏が抗体反応を損なうことが動物実験から分かっている(59-61)。レチノールはT細胞(62)の活性化に重要であり、ビタミンA欠乏は次の変化を通じて細胞性免疫に影響を持つ。T細胞数の減少、T細胞の分布の変化、サイトカイン生産の変調、T細胞のシグナリングを調節する細胞表面レセプターの発現の減少(45)。
ビタミンAを補充することにより、免疫が強化され、ビタミンA欠乏と関連した感染症関連の罹患率と死亡率が低下することが示された。12例の対照試験のメタアナリシスによって、子供たちにビタミンAを補充することにより、あらゆる原因による死亡のリスクを30%減少させることが明らかになった。それに加えて、はしかで入院している児童にビタミンAを補充することで、死亡リスクが61%減少することも判明した(63)。いくつかの研究では、ビタミンAの補充が下痢症の症状を軽減させる(64)ことを示しただけでなく、はしかやマラリア、HIVなど他の感染症の発生率には変化を与えないものの、症状を軽くすることも示した(45)。さらに、ビタミンAの補充は、上に述べたような、抗体生産の低下や炎症応答の悪化のような免疫機能に対する有害な作用の多くを改善、もしくは好転させることができる(65)。しかし、ビタミンAの補充は、肺炎のような下気道感染症では有益で無いばかりか、症状を悪化させる可能性がある(45, 66, 67)。ビタミンAをサプリメントとして摂取することには潜在的な副作用があるので、栄養不良もしくは明らかなビタミンA欠乏症の場合にのみ摂取されるべきである(64)。ビタミンAの毒性に関する情報については、ビタミンAに関する記事を参照されたい。
ビタミンD
ビタミンDの活性型(1, 25-ジヒドロキシビタミンD3)は、ビタミンAのように、標的遺伝子の発現を制御するステロイド・ホルモンとして機能する。1, 25-ジヒドロキシビタミンD3の生物学的効果の多くは、ビタミンD 受容体(VDR)として知られている核転写因子により仲介されている (68)。細胞の核に入る時には、1, 25-ジヒドロキシビタミンD3はVDRに結合して、そのレチノイドXレセプター(RXR)への結合を促進する。1, 25-ジヒドロキシビタミンD3の存在下で、VDR/RXR複合体はビタミンD応答要素(VDREs)として知られているDNAの小さな配列に結合し、特定の遺伝子の転写を調節する数多くの分子間相互作用のカスケードを開始させる。生体内組織の200を超える遺伝子が1, 25-ジヒドロキシビタミンD3によって、直接的もしくは間接的に制御されることが知られている (44)。
ミネラルのホメオスタシスと骨代謝に対するその影響に加えて、1, 25-ジヒドロキシビタミンD3は、免疫系における強力な調節因子であると認められている。VDRは単球、マクロファージ、樹状細胞、活性化したT細胞を含む数種類の免疫細胞で発現している (69-72)。マクロファージも25-ヒドロキシビタミンD3-1-ヒドロキシラーゼという酵素を生産し、局所的にビタミンDを活性型に転換できる (73)。1,25-ジヒドロキシビタミンD3は自然免疫の応答も適応免疫の応答も調節することが研究で示されている。
抗菌性ペプチド(AMPs)とその他のタンパク質は病原体(特に細菌)を直接殺して免疫を促進するので、自然免疫系の重要な構成要素となっている(74)。AMPsは細胞シグナリング効果を通して免疫機能の調節も行っている(75)。ビタミンDの活性型は、カテリシジンと呼ばれている重要な抗菌性タンパク質を制御している(76-78)。免疫細胞の増殖とサイトカインの生産を含む自然免疫の他の要因が、ビタミンDによる刺激を受けていることも示されている(79)。これらの役割を通して、ビタミンDは、病原体に起因する感染症から身体を防護することに貢献している。
ビタミンDの適応免疫への影響は主に抑制なものである。特に1, 25-ジヒドロキシビタミンD3はB細胞による抗体生産を抑えるだけでなく、試験管内でのT細胞の増殖を妨げる(80-82)。さらに、1、25-ジヒドロキシビタミンD3はヘルパーT細胞ならびに樹状細胞の機能的な表現型を調節することが示された(75)。細胞表面タンパク質であるCD4を持っているT細胞は、生産する特有のサイトカインにより2つのサブセットに分けられる: ヘルパーT (Th)1細胞は主にマクロファージの活性化と炎症応答に関わっている。そして、Th2細胞は主にB細胞による抗体生産を刺激することに関わっている(12)。いくつかの研究が示すところでは、1、25-ジヒドロキシビタミンD3はTh1細胞の発生と機能を抑制する(83, 84)が、Th2細胞(85, 86)と調節性T細胞(87, 88)の発生と機能は促進する。これらの後2者のタイプの細胞は、自己免疫疾患と移植拒絶反応で重要な調節を行っており、ビタミンDはそのような病態の予防や治療に有用であると考えられている(89)。様々な動物モデルを使用した研究からは、1, 25-ジヒドロキシビタミンD3の自己免疫疾患と移植に対する有用性が報告されている(84の総説を参照)。
実際にビタミンDの欠乏はいくつかの自己免疫疾患の発症に関連している。例えば、インスリン依存性(真性)糖尿病(IDDM;タイプ1真性糖尿病)、多発性硬化症(MS)と慢性関節リウマチ(RA)である。身体が外来の病原体の代わりに自分自身の組織に対して免疫応答を開始すると、自己免疫疾患が発症する。免疫応答が間違って標的にするのは、IDDMでは膵臓のインスリンを生産するベータ細胞であり、MSでは中枢神経系のミエリン生産細胞、そしてRAでは関節のコラーゲン生産細胞である(90)。緯度が高い地方ほど、様々な自己免疫病の罹患率が上昇することが、いくつかの疫学研究で明らかになっている(91)。このことは、紫外線B (皮膚でのビタミンD合成を誘導するために必要なタイプの紫外線) を浴びる量が低下すること、およびそれに伴う内在性ビタミンD合成の減少が自己免疾患の病状に一定の役割を果たしている可能性を示唆する。加えて、ビタミンDの摂取量が多いか、または血清レベルが高いと、IDDM (92)、MS (93-96)とRA (97)の発生率、進行または症状の低減化と関連することを、いくつかの症例対照研究と前向きコホート研究の結果が示している。詳細は、ビタミンDに関する別の記事を参照のこと。ビタミンDの補充が自己免疫疾患のリスクを減らすかどうかは、まだわかっていない。面白いことに、最近の系統的レビューと観察研究のメタ解析によれば、幼年期のビタミンDサプリメントがIDDMになるリスクを29%低くすることがわかっている(98)。様々な自己免疫病的状態でのビタミンDの役割を明らかにするためには、更なる研究が必要である。
ビタミンC
免疫細胞は、病原体を殺すために活性酸素種(ROS)を生成する。ROSから細胞を保護するのに、ビタミンCは非常に効果的な抗酸化物質である。主にこの役割によって、このビタミンは自然免疫と適応免疫のいくつかの構成要素に影響を及ぼしている。ビタミンCは白血球、特に好中球およびリンパ球、貪食細胞の生産(99-103)と機能(104, 105)を刺激することが明らかにされている。ビタミンCによって刺激される機能には、細胞の運動性(104)、走化性(104, 105)と貪食作用(105)が含まれている。体外から侵入した細菌とウイルスを攻撃する好中球がビタミンCによって刺激される主要な細胞種であるようだが、リンパ球や他の食細胞もビタミンCの影響を受けている(106)。さらに、モルモットではビタミンCの補足により、血清中の抗体(107, 108)と補体タンパク質Cq1(109-111)のレベルが上昇する。ヒトと同様にモルモットはビタミンCを合成することができない動物であり、それゆえに食物からのビタミンCに依存している。しかし、いくつかの調査では、ビタミンCの投与(112-115)によって白血球の生産や機能に有益な変化はなかった。ビタミンCは免疫細胞が健全であることを助けるのかもしれない。好中球や単核貪食細胞、リンパ球は高濃度のビタミンCを蓄えている。こういった細胞種は高濃度のビタミンCによって酸化傷害から保護されている(103, 116, 117)。微生物の侵入に反応して、食作用性の白血球は、スーパーオキシドラジカル、次亜塩素酸(いわゆるブリーチ)、およびペルオキシ亜硝酸のような非特異的な毒素を放出し、これらのROSが病原体を殺すが、その過程で貪食細胞自身にも損傷を与えてしまう(118)。ビタミンCはその抗酸化機能によって白血球をそのような自己酸化の害から守っていることが示されている(119)。食作用性の白血球はROSだけでなく、抗ウイルス作用をもったインターフェロンなどのサイトカインも生産し放出する(120)。ビタミンCが試験管内でインターフェロン濃度を上昇させることが示されている(121)。さらに、ビタミンCは酸化型ビタミンEを還元型(抗酸化型)ビタミンEに再生する作用も持っている(122)。
ビタミンCが免疫系の機能を高めて、それによってウイルス感染やおそらくは他の病気からも我々を守っている、そのような考えが広く一般に受け入れられている。その一方で、ビタミンCが免疫増強剤であることの生物学的妥当性がいくつかの研究によって示唆されているが、これまでに発表されたヒト試験では意見が一致していない。ビタミンCの補給が免疫系を高めるかどうかを確定するには、適切な統計的解析の下で対照臨床試験を行うことが必要であろう。
ビタミンE
ビタミンEは、フリーラジカルに起因する損傷から細胞膜の健全性を保護する脂溶性の抗酸化物質である(123)。特に、α-トコフェロール型のビタミンEは多価不飽和脂肪酸の過酸化を防止する。この過酸化は細胞傷害を引き起こす可能性があり、それに続いて誤った免疫応答が起こりえる(124)。B細胞とT細胞の機能を含む、体液性及び細胞性両面の適応免疫が、ビタミンEの欠乏によって損われることを、動物モデルだけでなくヒトを対象にしたいくつかの研究が示している(124に総説を掲載する)。さらに、現在推奨されている摂取量を上回ってビタミンEを摂ることが免疫を強化し、ある種の感染症への感受性を低下させることが、特に高齢者において示されている。
エイジングは免疫の老化と関連している(125)。たとえば、T細胞機能は年齢とともに衰える。その衰えの現れは、T細胞増殖の低下とT細胞によるサイトカイン(インターロイキン-2)の生産減少である(126)。マウスでの研究は、これら2つの加齢による免疫への影響をビタミンEが改善することを明らかにしてきた(127, 128)。同様の影響はいくつかのヒトを対象とした試験でも観察されてきた(129)。高齢の被験者にα-トコフェロールを投与すると免疫が改善することを2,3の臨床試験が実証している。例えば、数か月の間200mg/日の合成α-トコフェロール(100mgのRRRα-トコフェロール、あるいは150IU のRRRトコフェロールに相当する。RRRα-トコフェロールは「自然な」あるいはd-α-トコフェロールと言われている)を与えられた高齢者は、B型肝炎ワクチンおよび破傷風ワクチンに対する抗体の生産が増加した(130)。しかしながら、この高齢者での免疫応答の増強が、実際にインフルエンザのような感染症(インフルエンザウイルス)に対する抵抗力の増強と解釈していいかどうかは分かっていない(131)。老人ホーム入居者を対象とした無作為化プラセボ対照試験によれば、1年間200IU/日の合成α-トコフェロール(90mgのRRRα-トコフェロールと等価)を投与することで、上気道感染症(特に風邪)にかかるリスクは有意に低下したが、下気道(肺)感染症には効果がなかった(132)。それにも関わらず、高齢者の呼吸器感染症に対してビタミンEの摂取が総じて有益な効果を持つことを示した他の報告はない(133-136)。ビタミンEの摂取が風邪あるいは他の伝染病から高齢者を守るかどうかを判断するためには、さらなる研究が必要である。
ビタミンB6
サイトカインや抗体のようなタンパク質の構成単位であるアミノ酸を体内で代謝したり合成するには、ビタミンB6は必須である。動物とヒトでの研究では、ビタミンB6の欠乏が適応免疫の体液性、細胞性の両者を害することが実証された。具体的には、この微量栄養素の欠乏がサイトカインおよび抗体産生だけでなく、リンパ球の増殖および分化と成熟にも影響することが明らかになった(137-139)。このビタミンの欠乏症が改善されれば、影響を受けた免疫機能は回復する(139)。
葉酸
ビタミンBの一種である葉酸は、1炭素単位の転移を触媒する時の補酵素として必要である。補酵素である葉酸は、核酸(DNAとRNA)およびアミノ酸の体内での合成および代謝に必須な様々な反応で1炭素単位を受け取ったり受け渡したりして働く(140,141)。したがって、葉酸が免疫に重要であることは明白である。葉酸欠乏症はおもに細胞性免疫に影響し、不適当な免疫応答を招く。しかしながら、抗体による体液性免疫の応答も葉酸欠乏症で損なわれるかもしれない(142)。
ビタミンB12
ヒトでは、ビタミンB12は2つの酵素反応で補酵素として機能する。ビタミンB12に依存する酵素のひとつはアミノ酸の合成、ホモシステインからメチオニンの合成に関与している。メチオニンはS-アデノシルメチオニンの合成に必要とされる。S-アデノシルメチオニンは、DNA、RNA内部の多数の部位のメチル化を含む多くの生物学的メチル化反応でメチル基供与体として働いている。もうひとつのビタミンB12に依存的する酵素であるL-メチルマロニルCoAムターゼは、L-メチルマロニルCoAをサクシニルCoAに転換する。サクシニルCoAは、ヘモグロビン(酸素を運搬する赤血球内の色素)の合成にも、脂肪とタンパク質からエネルギーを生産するときにも重要な化合物である(143)。ビタミンB12欠乏症と診断された患者では、ナチュラルキラー細胞の活動が抑制され、循環するリンパ球数が減少していることが報告されている(144,145)。これらの免疫調節への影響は、ビタミン欠乏症を治療することによって改善されるという報告もある(144)。
亜鉛
自然免疫でも適応免疫でも、免疫を調節する細胞の正常な発生と機能のために亜鉛は必須である(146)。亜鉛の細胞での機能は、3つのカテゴリーに分けることができる: 1) 触媒、2)構造的、そして、3)調節である(亜鉛に関する別の記事を参照のこと) (147)。亜鉛は体内に保存されないので、それを食事から規則的に摂取することが免疫系の健全性を維持するのに重要である。よって摂取不足は、亜鉛欠乏症と免疫応答の低下につながる可能性がある(148)。自然免疫に関しては、亜鉛欠乏は補体系、ナチュラルキラー細胞の細胞傷害性、好中球とマクロファージの貪食活性、そして、免疫細胞の侵入病原体を殺すオキシダントの生産能力をそれぞれ弱める(149-151)。亜鉛欠乏は適応免疫の機能面でも、リンパ球数の数を減らし、その機能を低下させる(152)。亜鉛がわずかに欠乏した場合(重度の亜鉛欠乏よりもより一般的である)にも、免疫を抑制する可能性がある(148)。亜鉛が不足していると、さまざまな病原体に対する感受性が増大することが知られている(亜鉛に関する別の記事を参照)。
セレン
セレンタンパク質として知られる、いくつかのセレン依存性酵素が機能を発揮するためにはセレンが必要であるため、適切な免疫応答を行うのにセレンの十分な摂取は不可欠である(セレンに関する別の記事を参照)。たとえば、グルタチオンペルオキシダーゼ(GPx)はセレン含有タンパク質であり、重要な酸化還元反応の調節因子として、また細胞の抗酸化物質として機能する。抗酸化物質は、自らの還元とグルタチオンの酸化を共役させることによって、潜在的に有害な過酸化水素や脂質ヒドロペルオキシドのような活性酸素種を水やアルコールのような無害な生成物に還元する(セレンに関する記事中の図を参照) (153)。このような役割は、免疫機能やがんの予防との関連を想像させる。
セレンの欠乏は自然免疫だけでなく、適応免疫をも損ない(154,155)、液性免疫(すなわち、抗体生産)と細胞性免疫に悪影響を与える(156)。セレン欠乏は、いくつかのウイルス感染の病毒性や進行を増大するように見える。さらに、セレン欠乏症であるとは断定できない人達がセレンを摂取すると、免疫応答が促進されるように見える。2つの小規模な研究で、200マイクログラム(μg)/日のセレンを亜セレン酸ナトリウムとして、健康な人達(157,158)と免疫不全の人達(159)に8週間投与したところ、プラセボ(偽薬)を投与されてた人達と比較して、外来の抗原に対する免疫細胞の応答が強化された。かなりの数の基礎研究が示すところでは、セレンは免疫応答を組織化するサイトカインの発現を調節する役割を担っている(160)。
鉄
鉄は何百ものタンパク質と酵素の必須な構成要素となっていて、酸素の輸送と貯蔵、電子伝達とエネルギー生成、抗酸化作用と有益な酸化促進機能、DNA合成に関与している(161-163)。鉄は病原体の侵入に対して効果的な免疫応答を開始するために必要であり、鉄の欠乏は免疫応答に悪影響を与える(164)。Tリンパ球の分化・増殖と病原体を殺す活性酸素種(ROS)の生成といったいくつかの免疫機能に、十分量の鉄はきわめて重大である。しかしながら、大部分の病原体にとっても鉄はそれらの複製や生存に不可欠である。急性の炎症が起こると、血清中のフェリチン(鉄の貯蔵タンパク質)のレベルが増加する一方で、鉄の濃度は低下する。これは、病原体に鉄を与えないことが感染に対処する宿主の重要な応答であることを示唆している(162,165)。さらに、鉄の過剰状態(例えば、遺伝性ホモクロマトーシス)は免疫機能に悪影響を与える。例えば、貪食機能、サイトカインの産生、補体系の活性化、Tリンパ球とBリンパ球の機能への障害である(164)。
さらに、全米調査である第1回の米国全国健康・栄養調査(NHANES)のデータによれば、鉄濃度の上昇は、特に男性でのガンと死亡のリスク要因となりうることを示している(167)。男女のデータを足し合わせたものでも、30%未満のトランスフェリン飽和と40%以上の飽和を比較して、トランスフェリン飽和が上昇するとガンと死亡率のリスクが増加するという有意な傾向があった(167)。
免疫系での鉄の極めて重要な機能にもかかわらず、鉄欠乏症と感染に対する感受性の関係、特にマラリアに関しては、結論が出ていない。熱帯地方の子供に高用量の鉄を投与することは、臨床的マラリア以外にも肺炎のような感染症のリスクの増大と関連している。
マラリア原虫や結核菌は、その生活環の一部を宿主細胞の中で送る。鉄を投与する治療が、このような病原体が宿主体内で生き残ることを助けている可能性が、細胞培養と動物での研究で示唆されている。マラリアが常在している地域における、鉄補充の適切な用法を決定するための対照臨床研究が必要である。HIVや結核、腸チフスのような感染症の場合も同様である(168)。
銅
銅酵素(銅に関する別の記事を参照)と呼ばれる多くの必須な酵素にとって、銅は必須な機能性構成要素である。このミネラル(銅)は免疫系機能の進行と維持において重要な役割を演じているが、どのようなメカニズムによるのかは正確にはわかっていない。銅の欠乏は、好中球の数が異常に低下する好中球減少症(169)を招き、感染への感受性を増大するかもしれない。銅の欠乏による免疫への悪影響は、おもに幼児で現れる。ひどい銅欠乏を伴う遺伝疾患であるメンケス病の幼児は、頻繁で重度の感染症を患う(170,171)。銅の欠乏が明らかな11人の栄養失調の幼児に1ヵ月間、銅を投与したところ、病原体を貪食する白血球の能力が有意に増加した(172)。
食物からの銅摂取量が低い成人でも、免疫への影響が観察されている。ある研究では、銅の食餌摂取量が低い(始めの24日間は銅0.66mg/日、続く40日間には0.38mg/日) 11人の男性から単核球と呼ばれる白血球を分離し、その増殖を細胞培養系で免疫的に刺激したところ、増殖応答は弱かった(173)。重度の銅欠乏には免疫機能に対して有害な効果があることが知られているが、軽度の銅の欠乏がヒトにどのような影響を与えるかはまだ明らかではない(174)。しかし、長期にわたる高い銅の摂取は、免疫機能に悪影響を与えることがありえる(175)。
プロバイオティクス
プロバイオティクスの通常の定義は、十分な量が投与された時に宿主の総体的な健康に役立つ、生きている微生物である(176)。一般的な例は、乳酸(桿)菌とビフィドバクテリアに属する細菌で、これらの生菌はヨーグルトやその他の発酵食品として摂取される。摂取されても、消化されずに生き残ったプロバイオティクスは、下部消化管に一時的に棲息することができる(177)。これらの細菌は腸内で、腸の上皮細胞の表面や腸に分布する樹枝細胞、M-細胞を含む免疫細胞の表面にある様々な受容体と相互作用することによって免疫機能を調節するのであろう(178)。プロバイオティクスが腸のミクロフローラを永久に変えるという観察はないので、免疫を調節するには定期的な摂取を必要とする(179)。プロバイオティクスは宿主の自然免疫と適応免疫の両者の応答を改善することが示されている(180)。たとえば、プロバイオティクスによって腸管上皮のバリアを強化することができる。バリアは重要な自然免疫による防衛であり、アポトーシスを妨げて腸管上皮細胞の生存を高めるなど様々なやり方によって行われる(181)。プロバイオティクスは、適応免疫の応答に極めて重要な抗体の生産とTリンパ球の生成を刺激することもできる(180)。プロバイオティクスのいくつかの免疫効果は、サイトカインやその他のタンパク質の発現に影響を与える細胞シグナル伝達カスケードの変化を介してもたらされる(181)。しかし免疫系に対するプロバイオティクスの多様な効果は、特定の菌であることだけに依存するのではなく、摂取量、摂取経路、摂取頻度などにも依存している(182)。プロバイオティクスは炎症性腸疾患、下痢性疾患、アレルギー疾患、胃腸感染症やその他の感染症、そして、ある種のガンの予防において、有用であるかもしれない。しかしながら、プロバイオティクスの健康への効果を明らかにするには、さらなる臨床研究が必要である(180)。
過剰栄養と肥満
過剰栄養は栄養失調のひとつの型で、栄養が身体の必要量を越えて供給される状態である。過剰栄養ではエネルギー摂取とエネルギー支出の間のバランス崩れ、エネルギー貯蔵が過度となり肥満へと導かれる(15)。肥満は世界中、特に先進工業国で主要な国民的健康問題である。太りすぎの人は多数の慢性疾患に罹患するリスクが高く、それらには高血圧、心臓血管疾患、2型糖尿病、肝臓と胆嚢の疾患、骨関節症、睡眠時無呼吸といくつかの種類のガンが含まれる(183)。肥満は死亡率を高めるリスクにも関連している(184)。
過剰栄養と肥満は、免疫の能力を変えることが示されている。肥満は、脂肪組織へのマクロファージの浸潤を伴う。脂肪組織でのマクロファージの蓄積は、肥満の程度に直接的に比例している(185)。遺伝的に肥満であるマウス、もしくは高脂肪食によって誘導された肥満マウスでのモデル研究では、炎症の発現と白色脂肪組織におけるマクロファージに特異的な遺伝子の発現が際立って上昇することが明らかにされた(186)。実際、肥満は慢性的な軽度の炎症によって特徴づけられる。そして、炎症はインスリン抵抗性(肥満と強く関連する病態)の重要な病因であると考えられている。脂肪組織は脂肪酸やその他の分子を分泌するが、それには炎症の引き金となる様々なホルモン類とサイトカイン(アディポサイトカインまたはアディポカインと呼ばれる)が含まれる(185)。
レプチンはそのようなホルモンやアディポカインの一種で、食物摂取、体重、そしてエネルギー恒常性の調節で重要な役割を演じている(187, 188)。レプチンは脂肪組織から分泌されて、脂肪の貯蔵量に比例して循環する。通常、高レベルのレプチン循環は食欲を抑制して、食物摂取の減少につながる(189)。これ以外にも、レプチンは炎症反応の調節や適応免疫系での体液性、および細胞性免疫の調節などの様々な機能を持っている(187, 190)。動物実験と試験管内の研究で明らかになったレプチン固有の効果には以下のものがある;免疫細胞の貪食機能の昂進、炎症性サイトカイン産生の刺激、そして好中球やナチュラルキラー(NK)細胞、樹枝細胞の機能調節 (190の総説を参照)。レプチンは細胞性免疫にも影響を及ぼし、ヘルパーT (Th) 1細胞の免疫応答を促進する。従って、レプチンは自己免疫病の発症に関連しているかもしれない(191)。Th1細胞は、おもにマクロファージの活性化と炎症反応の昂進に関連している(12)。太りすぎの人では、やせた人と比較して血漿レプチン濃度が高いことが報告されている。しかし肥満の人では、レプチン濃度が高くても食物摂取の低下にもエネルギー消費の上昇にも結びついていない。これは、肥満がレプチン抵抗性の状態を伴うことを示唆する。レプチン抵抗性はマウスの肥満モデルで研究されているが、ヒトの肥満でのレプチン抵抗性を理解するには、より多くの研究が必要である(189)。
肥満の人達は、様々な感染症により高い感受性を示すかもしれない。いくつかの疫学調査によれば、正常な体重の患者と比較して肥満の患者では、術後感染でも他の院内感染でも高い発病率が認められる(192, 193の論文、194の総説を参照)。肥満は創傷治癒の遅延と皮膚感染の増加に関連がある(195-197)。ボディーマスインデックス(BMI)が高いと、呼吸器や胃腸、肝臓、胆道での感染症への感受性も高まる可能性がある(194の総説を参照)。
肥満の人が特定の感染症に対して脆弱であったり、症状が厳しかったり、合併症を引き起こし易いといったことが、微量栄養素の不足などいくつもの要因と関連している場合がある。たとえば、幼年期と青年期の肥満についての研究では、亜鉛と鉄の欠乏が細胞性免疫に悪影響を与えることを示した(198)。ビタミンB群、ビタミンA、C、D、Eなどを含む微量栄養素の欠乏や摂取不足は、肥満とも関係している(41)。全体として、免疫応答は肥満によって低下するように見えるが、感染症に関連した病気の発症やそれによる死亡と肥満との関係をはっきりさせるためには、より多くの研究が必要である。
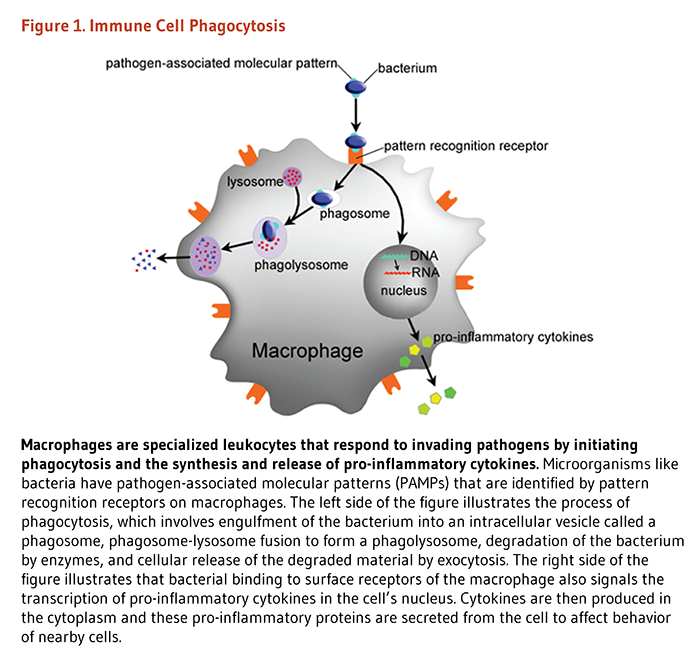
マクロファージは白血球の一種であり、食菌作用と炎症性サイトカインの合成と放出を始めることによって侵入してきた病原体に反応することを専門としている。細菌のような微生物は病原体関連分子パターン(PAMPs)を持ち、これがマクロファージ表面のパターン認識レセプターによって認識される。図の左側は貪食のプロセスを示している。貪食は以下の4つの段階から成り立っている。食胞と呼ばれる細胞内小胞中へ細菌を抱き込み、食物胞とリソソームの融合によってファゴリソソームを形成し、酵素によりバクテリアを消化し、エキソサイトーシスにより分解物を細胞から放出する。図の右側は、マクロファージ表面のレセプターへの細菌の結合を示している。この細菌の結合も細胞の核での炎症性サイトカインの転写を誘導する。それに続いてサイトカインは細胞質中で生産され、これらの炎症誘発性タンパク質は細胞から分泌され、近傍の細胞の行動に影響を及ぼす。
Authors and Reviewers
Written in August 2010 by:
Victoria J. Drake, Ph.D.
Linus Pauling Institute
Oregon State University
Reviewed in August 2010 by:
Adrian F. Gombart, Ph.D.
Associate Professor
Department of Biochemistry and Biophysics
Principal Investigator, Linus Pauling Institute
Oregon State University
Reviewed in August 2010 by:
Malcolm B. Lowry, Ph.D.
Assistant Professor
Department of Microbiology
Oregon State University
This article was underwritten, in part, by a grant from Bayer Consumer Care AG, Basel, Switzerland.
Copyright 2010-2024 Linus Pauling Institute
References
1. Nye KE. The basics of immunology for the non-immunologist. In: Hughes DA, Darlington LG, Bendich A, eds. Diet and Human Immune Function. Totowa, New Jersey: Humana Press; 2004:3-15.
2. Devereux G. The immune system: an overview. In: Calder PC, Field CJ, Gill HS, eds. Nutrition and Immune Function. New York: CABI Publishing; 2002:1-20.
3. The immune system. In: Alberts B, Bray D, Lewis J, Raff M, Roberts K, Watson JD, eds. Molecular Biology of the Cell. 3rd ed. New York: Garland Publishing, Inc.; 1994:1195-1254.
4. Parham P. Elements of the immune system and their roles in defense. The immune system. 2nd ed. New York: Garland Science Publishing; 2005:1-3
5. Parkin J, Cohen B. An overview of the immune system. Lancet. 2001;357(9270):1777-1789. (PubMed)
6. Delves PJ, Roitt IM. The immune system. First of two parts. N Engl J Med. 2000;343(1):37-49. (PubMed)
7. Dunkelberger JR, Song WC. Complement and its role in innate and adaptive immune responses. Cell Res. 20(1):34-50. (PubMed)
8. Walport MJ. Complement. Second of two parts. N Engl J Med. 2001;344(15):1140-1144. (PubMed)
9. Walport MJ. Complement. First of two parts. N Engl J Med. 2001;344(14):1058-1066. (PubMed)
10. Mak TW, Saunders ME. Innate immunity. The immune response: basic and clinical principles. Amsterdam: Elsevier Academic Press; 2004:70-92.
11. Iwasaki A, Medzhitov R. Regulation of adaptive immunity by the innate immune system. Science. 327(5963):291-295. (PubMed)
12. Parham P. T cell-mediated immunity. The immune system. 2nd ed. New York: Garland Science Publishing; 2005:145-178.
13. Kohl J. Self, non-self, and danger: a complementary view. Adv Exp Med Biol. 2006;586:71-94. (PubMed)
14. Katona P, Katona-Apte J. The interaction between nutrition and infection. Clin Infect Dis. 2008;46(10):1582-1588. (PubMed)
15. Schaible UE, Kaufmann SH. Malnutrition and infection: complex mechanisms and global impacts. PLoS Med. 2007;4(5):e115. (PubMed)
16. Food and Agriculture Organization of the United Nations. The state of food insecurity in the world 2006: eradicating world hunger--taking stock ten years after the World Food Summit. Available at: http://www.fao.org/docrep/009/a0750e/a0750e00.htm. Accessed 4/1/2010.
17. Chapman IM. Nutritional disorders in the elderly. Med Clin North Am. 2006;90(5):887-907. (PubMed)
18. Powell J, Borchers AT, Yoshida S, Gershwin ME. Evaluation of the immune system in the nutritionally at-risk host. In: Gershwin ME, German JB, Keen CL, eds. Nutrition and Immunology: Principles and Practice. Totowa, New Jersey: Humana Press; 2000:21-31.
19. Thurnham DI, Northrop-Clewes CA. Effects of infection on nutritional and immune status. In: Hughes DA, Darlington LG, Bendich A, eds. Diet and Human Immune Function. Totowa, New Jersey: Humana Press; 2004:35-64.
20. Jolly CA, Fernandes G. Protein-energy malnutrition and infectious disease. In: Gershwin ME, German JB, Keen CL, eds. Nutrition and Immunology: Principles and Practice. Totowa, New Jersey: Humana Press; 2000:195-202.
21. Cunningham-Rundles S, McNeeley DF, Moon A. Mechanisms of nutrient modulation of the immune response. J Allergy Clin Immunol. 2005;115(6):1119-1128; quiz 1129. (PubMed)
22. Grover Z, Ee LC. Protein energy malnutrition. Pediatr Clin North Am. 2009;56(5):1055-1068. (PubMed)
23. Chandra RK. Effect of post-natal protein malnutrition and intrauterine growth retardation on immunity and risk of infection. In: Calder PC, Field CJ, Gill HS, eds. Nutrition and immune function. New York: CABI Publishing; 2002:41-56.
24. Chandra RK. Protein-energy malnutrition and immunological responses. J Nutr. 1992;122(3 Suppl):597-600. (PubMed)
25. de Pablo MA, Puertollano MA, de Cienfuegos GA. Immune cell functions, lipids and host natural resistance. FEMS Immunol Med Microbiol. 2000;29:323-328. (PubMed)
26. Institute of Medicine. Dietary fats: total fats and fatty acids. Dietary Reference Intakes for Energy, Carbohydrate, Fiber, Fat, Fatty Acids, Cholesterol, Protein, and Amino acids. Washington, D.C: The National Academies Press; 2002:422-541. (The National Academies Press)
27. Cunnane SC. Problems with essential fatty acids: time for a new paradigm? Prog Lipid Res. 2003;42(6):544-568. (PubMed)
28. Muskiet FA, Fokkema MR, Schaafsma A, Boersma ER, Crawford MA. Is docosahexaenoic acid (DHA) essential? Lessons from DHA status regulation, our ancient diet, epidemiology and randomized controlled trials. J Nutr. 2004;134(1):183-186. (PubMed)
29. Galli C, Calder PC. Effects of fat and fatty acid intake on inflammatory and immune responses: a critical review. Ann Nutr Metab. 2009;55(1-3):123-139. (PubMed)
30. Calder PC. The relationship between the fatty acid composition of immune cells and their function. Prostaglandins Leukot Essent Fatty Acids. 2008;79(3-5):101-108. (PubMed)
31. Calder PC. Polyunsaturated fatty acids and inflammation. Prostaglandins Leukot Essent Fatty Acids. 2006;75(3):197-202. (PubMed)
32. Calder PC. Dietary modification of inflammation with lipids. Proc Nutr Soc. 2002;61(3):345-358. (PubMed)
33. Harbige LS. Fatty acids, the immune response, and autoimmunity: a question of n-6 essentiality and the balance between n-6 and n-3. Lipids. 2003;38(4):323-341. (PubMed)
34. O'Shea M, Bassaganya-Riera J, Mohede IC. Immunomodulatory properties of conjugated linoleic acid. Am J Clin Nutr. 2004;79(6 Suppl):1199S-1206S. (PubMed)
35. Song HJ, Grant I, Rotondo D, et al. Effect of CLA supplementation on immune function in young healthy volunteers. Eur J Clin Nutr. 2005;59(4):508-517. (PubMed)
36. Akahoshi A, Goto Y, Murao K, et al. Conjugated linoleic acid reduces body fats and cytokine levels of mice. Biosci Biotechnol Biochem. 2002;66(4):916-920. (PubMed)
37. Sugano M, Tsujita A, Yamasaki M, Noguchi M, Yamada K. Conjugated linoleic acid modulates tissue levels of chemical mediators and immunoglobulins in rats. Lipids. 1998;33(5):521-527. (PubMed)
38. Albers R, van der Wielen RP, Brink EJ, Hendriks HF, Dorovska-Taran VN, Mohede IC. Effects of cis-9, trans-11 and trans-10, cis-12 conjugated linoleic acid (CLA) isomers on immune function in healthy men. Eur J Clin Nutr. 2003;57(4):595-603. (PubMed)
39. Kelley DS, Simon VA, Taylor PC, et al. Dietary supplementation with conjugated linoleic acid increased its concentration in human peripheral blood mononuclear cells, but did not alter their function. Lipids. 2001;36(7):669-674. (PubMed)
40. Kelley DS, Taylor PC, Rudolph IL, et al. Dietary conjugated linoleic acid did not alter immune status in young healthy women. Lipids. 2000;35(10):1065-1071. (PubMed)
41. Garcia OP, Long KZ, Rosado JL. Impact of micronutrient deficiencies on obesity. Nutr Rev. 2009;67(10):559-572. (PubMed)
42. Ames BN. Low micronutrient intake may accelerate the degenerative diseases of aging through allocation of scarce micronutrients by triage. Proc Natl Acad Sci U S A. 2006;103(47):17589-17594. (PubMed)
43. Moshfegh A, Goldman J, Cleveland L. 2005. What We Eat in America, NHANES 2001-2002: Usual nutrient intakes from food compared to dietary reference intakes. U.S. Department of Agriculture, Agricultural Research Service.
44. Holick MF. Vitamin D deficiency. N Engl J Med. 2007;357(3):266-281. (PubMed)
45. Semba RD. Vitamin A. In: Hughes DA, Darlington LG, Bendich A, eds. Diet and Human Immune Function. Totowa, New Jersey: Humana Press Inc.; 2004:105-131.
46. Chambon P. A decade of molecular biology of retinoic acid receptors. FASEB J. 1996;10(9):940-954. (PubMed)
47. Balmer JE, Blomhoff R. Gene expression regulation by retinoic acid. J Lipid Res. 2002;43(11):1773-1808. (PubMed)
48. Bhaskaram P. Immunobiology of mild micronutrient deficiencies. Br J Nutr. 2001;85 Suppl 2:S75-80. (PubMed)
49. Stephensen CB. Vitamin A, infection, and immune function. Annu Rev Nutr. 2001;21:167-192. (PubMed)
50. McDowell EM, Keenan KP, Huang M. Effects of vitamin A-deprivation on hamster tracheal epithelium. A quantitative morphologic study. Virchows Arch B Cell Pathol Incl Mol Pathol. 1984;45(2):197-219. (PubMed)
51. Hatchell DL, Sommer A. Detection of ocular surface abnormalities in experimental vitamin A deficiency. Arch Ophthalmol. 1984;102(9):1389-1393. (PubMed)
52. Barreto ML, Santos LM, Assis AM, et al. Effect of vitamin A supplementation on diarrhoea and acute lower-respiratory-tract infections in young children in Brazil. Lancet. 1994;344(8917):228-231. (PubMed)
53. Brown KH, Gaffar A, Alamgir SM. Xerophthalmia, protein-calorie malnutrition, and infections in children. J Pediatr. 1979;95(4):651-656. (PubMed)
54. Twining SS, Zhou X, Schulte DP, Wilson PM, Fish B, Moulder J. Effect of vitamin A deficiency on the early response to experimental Pseudomonas keratitis. Invest Ophthalmol Vis Sci. 1996;37(4):511-522. (PubMed)
55. Sommer A, Katz J, Tarwotjo I. Increased risk of respiratory disease and diarrhea in children with preexisting mild vitamin A deficiency. Am J Clin Nutr. 1984;40(5):1090-1095. (PubMed)
56. Rojanapo W, Lamb AJ, Olson JA. The prevalence, metabolism and migration of goblet cells in rat intestine following the induction of rapid, synchronous vitamin A deficiency. J Nutr. 1980;110(1):178-188. (PubMed)
57. Buck J, Derguini F, Levi E, Nakanishi K, Hammerling U. Intracellular signaling by 14-hydroxy-4,14-retro-retinol. Science. 1991;254(5038):1654-1656. (PubMed)
58. Blomhoff HK, Smeland EB, Erikstein B, et al. Vitamin A is a key regulator for cell growth, cytokine production, and differentiation in normal B cells. J Biol Chem. 1992;267(33):23988-23992. (PubMed)
59. Pasatiempo AM, Bowman TA, Taylor CE, Ross AC. Vitamin A depletion and repletion: effects on antibody response to the capsular polysaccharide of Streptococcus pneumoniae, type III (SSS-III). Am J Clin Nutr. 1989;49(3):501-510. (PubMed)
60. Wiedermann U, Hanson LA, Kahu H, Dahlgren UI. Aberrant T-cell function in vitro and impaired T-cell dependent antibody response in vivo in vitamin A-deficient rats. Immunology. 1993;80(4):581-586. (PubMed)
61. Smith SM, Hayes CE. Contrasting impairments in IgM and IgG responses of vitamin A-deficient mice. Proc Natl Acad Sci U S A. 1987;84(16):5878-5882. (PubMed)
62. Garbe A, Buck J, Hammerling U. Retinoids are important cofactors in T cell activation. J Exp Med. 1992;176(1):109-117. (PubMed)
63. Fawzi WW, Chalmers TC, Herrera MG, Mosteller F. Vitamin A supplementation and child mortality. A meta-analysis. JAMA. 1993;269(7):898-903. (PubMed)
64. Villamor E, Fawzi WW. Vitamin A supplementation: implications for morbidity and mortality in children. J Infect Dis. 2000;182 Suppl 1:S122-133. (PubMed)
65. Aukrust P, Muller F, Ueland T, Svardal AM, Berge RK, Froland SS. Decreased vitamin A levels in common variable immunodeficiency: vitamin A supplementation in vivo enhances immunoglobulin production and downregulates inflammatory responses. Eur J Clin Invest. 2000;30(3):252-259. (PubMed)
66. Stephensen CB, Franchi LM, Hernandez H, Campos M, Gilman RH, Alvarez JO. Adverse effects of high-dose vitamin A supplements in children hospitalized with pneumonia. Pediatrics. 1998;101(5):E3. (PubMed)
67. Potential interventions for the prevention of childhood pneumonia in developing countries: a meta-analysis of data from field trials to assess the impact of vitamin A supplementation on pneumonia morbidity and mortality. The Vitamin A and Pneumonia Working Group. Bull World Health Organ. 1995;73(5):609-619. (PubMed)
68. Sutton AL, MacDonald PN. Vitamin D: more than a "bone-a-fide" hormone. Mol Endocrinol. 2003;17(5):777-791. (PubMed)
69. Brennan A, Katz DR, Nunn JD, et al. Dendritic cells from human tissues express receptors for the immunoregulatory vitamin D3 metabolite, dihydroxycholecalciferol. Immunology. 1987;61(4):457-461. (PubMed)
70. Provvedini DM, Tsoukas CD, Deftos LJ, Manolagas SC. 1,25-dihydroxyvitamin D3 receptors in human leukocytes. Science. 1983;221(4616):1181-1183. (PubMed)
71. Veldman CM, Cantorna MT, DeLuca HF. Expression of 1,25-dihydroxyvitamin D(3) receptor in the immune system. Arch Biochem Biophys. 2000;374(2):334-338. (PubMed)
72. Bhalla AK, Amento EP, Clemens TL, Holick MF, Krane SM. Specific high-affinity receptors for 1,25-dihydroxyvitamin D3 in human peripheral blood mononuclear cells: presence in monocytes and induction in T lymphocytes following activation. J Clin Endocrinol Metab. 1983;57(6):1308-1310. (PubMed)
73. Hewison M, Zehnder D, Chakraverty R, Adams JS. Vitamin D and barrier function: a novel role for extra-renal 1 alpha-hydroxylase. Mol Cell Endocrinol. 2004;215(1-2):31-38. (PubMed)
74. Zasloff M. Fighting infections with vitamin D. Nat Med. 2006;12(4):388-390. (PubMed)
75. Gombart AF. The vitamin D-antimicrobial peptide pathway and its role in protection against infection. Future Microbiol. 2009;4:1151-1165. (PubMed)
76. Weber G, Heilborn JD, Chamorro Jimenez CI, Hammarsjo A, Torma H, Stahle M. Vitamin D induces the antimicrobial protein hCAP18 in human skin. J Invest Dermatol. 2005;124(5):1080-1082. (PubMed)
77. Gombart AF, Borregaard N, Koeffler HP. Human cathelicidin antimicrobial peptide (CAMP) gene is a direct target of the vitamin D receptor and is strongly up-regulated in myeloid cells by 1,25-dihydroxyvitamin D3. FASEB J. 2005;19(9):1067-10. (PubMed)
78. Liu PT, Stenger S, Li H, et al. Toll-like receptor triggering of a vitamin D-mediated human antimicrobial response. Science. 2006;311(5768):1770-1773. (PubMed)
79. Mora JR, Iwata M, von Andrian UH. Vitamin effects on the immune system: vitamins A and D take centre stage. Nat Rev Immunol. 2008;8(9):685-698. (PubMed)
80. Chen WC, Vayuvegula B, Gupta S. 1,25-Dihydroxyvitamin D3-mediated inhibition of human B cell differentiation. Clin Exp Immunol. 1987;69(3):639-646. (PubMed)
81. Muller K, Heilmann C, Poulsen LK, Barington T, Bendtzen K. The role of monocytes and T cells in 1,25-dihydroxyvitamin D3 mediated inhibition of B cell function in vitro. Immunopharmacology. 1991;21(2):121-128. (PubMed)
82. Muller K, Odum N, Bendtzen K. 1,25-dihydroxyvitamin D3 selectively reduces interleukin-2 levels and proliferation of human T cell lines in vitro. Immunol Lett. 1993;35(2):177-182. (PubMed)
83. Lemire JM, Archer DC, Beck L, Spiegelberg HL. Immunosuppressive actions of 1,25-dihydroxyvitamin D3: preferential inhibition of Th1 functions. J Nutr. 1995;125(6 Suppl):1704S-1708S. (PubMed)
84. Mathieu C, Adorini L. The coming of age of 1,25-dihydroxyvitamin D(3) analogs as immunomodulatory agents. Trends Mol Med. 2002;8(4):174-179. (PubMed)
85. Boonstra A, Barrat FJ, Crain C, Heath VL, Savelkoul HF, O'Garra A. 1alpha,25-Dihydroxyvitamin d3 has a direct effect on naive CD4(+) T cells to enhance the development of Th2 cells. J Immunol. 2001;167(9):4974-4980. (PubMed)
86. Cantorna MT, Woodward WD, Hayes CE, DeLuca HF. 1,25-dihydroxyvitamin D3 is a positive regulator for the two anti-encephalitogenic cytokines TGF-beta 1 and IL-4. J Immunol. 1998;160(11):5314-5319. (PubMed)
87. Gregori S, Giarratana N, Smiroldo S, Uskokovic M, Adorini L. A 1alpha,25-dihydroxyvitamin D(3) analog enhances regulatory T-cells and arrests autoimmune diabetes in NOD mice. Diabetes. 2002;51(5):1367-1374. (PubMed)
88. Barrat FJ, Cua DJ, Boonstra A, et al. In vitro generation of interleukin 10-producing regulatory CD4(+) T cells is induced by immunosuppressive drugs and inhibited by T helper type 1 (Th1)- and Th2-inducing cytokines. J Exp Med. 2002;195(5):603-616. (PubMed)
89. Baeke F, Etten EV, Overbergh L, Mathieu C. Vitamin D3 and the immune system: maintaining the balance in health and disease. Nutr Res Rev. 2007;20(1):106-118. (PubMed)
90. Deluca HF, Cantorna MT. Vitamin D: its role and uses in immunology. FASEB J. 2001;15(14):2579-2585. (PubMed)
91. Cantorna MT, Mahon BD. Mounting evidence for vitamin D as an environmental factor affecting autoimmune disease prevalence. Exp Biol Med (Maywood). 2004;229(11):1136-1142. (PubMed)
92. Hypponen E, Laara E, Reunanen A, Jarvelin MR, Virtanen SM. Intake of vitamin D and risk of type 1 diabetes: a birth-cohort study. Lancet. 2001;358(9292):1500-1503. (PubMed)
93. Munger KL, Levin LI, Hollis BW, Howard NS, Ascherio A. Serum 25-hydroxyvitamin D levels and risk of multiple sclerosis. JAMA. 2006;296(23):2832-2838. (PubMed)
94. Munger KL, Zhang SM, O'Reilly E, et al. Vitamin D intake and incidence of multiple sclerosis. Neurology. 2004;62(1):60-65. (PubMed)
95. Ozgocmen S, Bulut S, Ilhan N, Gulkesen A, Ardicoglu O, Ozkan Y. Vitamin D deficiency and reduced bone mineral density in multiple sclerosis: effect of ambulatory status and functional capacity. J Bone Miner Metab. 2005;23(4):309-313. (PubMed)
96. van der Mei IA, Ponsonby AL, Dwyer T, et al. Vitamin D levels in people with multiple sclerosis and community controls in Tasmania, Australia. J Neurol. 2007;254(5):581-590. (PubMed)
97. Merlino LA, Curtis J, Mikuls TR, Cerhan JR, Criswell LA, Saag KG. Vitamin D intake is inversely associated with rheumatoid arthritis: results from the Iowa Women's Health Study. Arthritis Rheum. 2004;50(1):72-77. (PubMed)
98. Zipitis CS, Akobeng AK. Vitamin D supplementation in early childhood and risk of type 1 diabetes: a systematic review and meta-analysis. Arch Dis Child. 2008;93(6):512-517. (PubMed)
99. Prinz W, Bortz R, Bregin B, Hersch M. The effect of ascorbic acid supplementation on some parameters of the human immunological defence system. Int J Vitam Nutr Res. 1977;47(3):248-257. (PubMed)
100. Vallance S. Relationships between ascorbic acid and serum proteins of the immune system. Br Med J. 1977;2(6084):437-438. (PubMed)
101. Kennes B, Dumont I, Brohee D, Hubert C, Neve P. Effect of vitamin C supplements on cell-mediated immunity in old people. Gerontology. 1983;29(5):305-310. (PubMed)
102. Panush RS, Delafuente JC, Katz P, Johnson J. Modulation of certain immunologic responses by vitamin C. III. Potentiation of in vitro and in vivo lymphocyte responses. Int J Vitam Nutr Res Suppl. 1982;23:35-47. (PubMed)
103. Jariwalla RJ, Harakeh S. Antiviral and immunomodulatory activities of ascorbic acid. In: Harris JR (ed). Subcellular biochemistry. Ascorbic acid: biochemistry and biomedical cell biology. Volume 25. New York: Plenum Press; 1996:215-231.
104. Anderson R, Oosthuizen R, Maritz R, Theron A, Van Rensburg AJ. The effects of increasing weekly doses of ascorbate on certain cellular and humoral immune functions in normal volunteers. Am J Clin Nutr. 1980;33(1):71-76. (PubMed)
105. Levy R, Shriker O, Porath A, Riesenberg K, Schlaeffer F. Vitamin C for the treatment of recurrent furunculosis in patients with imparied neutrophil functions. J Infect Dis. 1996;173(6):1502-1505. (PubMed)
106. Anderson R. The immunostimulatory, antiinflammatory and anti-allergic properties of ascorbate. Adv Nutr Res. 1984;6:19-45. (PubMed)
107. Feigen GA, Smith BH, Dix CE, et al. Enhancement of antibody production and protection against systemic anaphylaxis by large doses of vitamin C. Res Commun Chem Pathol Pharmacol. 1982;38(2):313-333. (PubMed)
108. Prinz W, Bloch J, Gilich G, Mitchell G. A systematic study of the effect of vitamin C supplementation on the humoral immune response in ascorbate-dependent mammals. I. The antibody response to sheep red blood cells (a T-dependent antigen) in guinea pigs. Int J Vitam Nutr Res. 1980;50(3):294-300. (PubMed)
109. Haskell BE, Johnston CS. Complement component C1q activity and ascorbic acid nutriture in guinea pigs. Am J Clin Nutr. 1991;54(6 Suppl):1228S-1230S. (PubMed)
110. Johnston CS, Cartee GD, Haskell BE. Effect of ascorbic acid nutriture on protein-bound hydroxyproline in guinea pig plasma. J Nutr. 1985;115(8):1089-1093. (PubMed)
111. Johnston CS, Kolb WP, Haskell BE. The effect of vitamin C nutriture on complement component C1q concentrations in guinea pig plasma. J Nutr. 1987;117(4):764-768. (PubMed)
112. Shilotri PG, Bhat KS. Effect of mega doses of vitamin C on bactericidal ativity of leukocytes. Am J Clin Nutr. 1977;30(7):1077-1081. (PubMed)
113. Vogel RI, Lamster IB, Wechsler SA, Macedo B, Hartley LJ, Macedo JA. The effects of megadoses of ascorbic acid on PMN chemotaxis and experimental gingivitis. J Periodontol. 1986;57(8):472-479. (PubMed)
114. Ludvigsson J, Hansson LO, Stendahl O. The effect of large doses of vitamin C on leukocyte function and some laboratory parameters. Int J Vitam Nutr Res. 1979;49(2):160-165. (PubMed)
115. Delafuente JC, Prendergast JM, Modigh A. Immunologic modulation by vitamin C in the elderly. Int J Immunopharmacol. 1986;8(2):205-211. (PubMed)
116. Bergsten P, Amitai G, Kehrl J, Dhariwal KR, Klein HG, Levine M. Millimolar concentrations of ascorbic acid in purified human mononuclear leukocytes. Depletion and reaccumulation. J Biol Chem. 1990;265(5):2584-2587. (PubMed)
117. Evans RM, Currie L, Campbell A. The distribution of ascorbic acid between various cellular components of blood, in normal individuals, and its relation to the plasma concentration. Br J Nutr. 1982;47(3):473-482. (PubMed)
118. Differentiated cells and the maintenance of tissues. In: Alberts B BD, Lewis J, Raff M, Roberts K, Watson JD (ed). Molecular biology of the cell. 3rd ed. New York: Garland Publishing, Inc.; 1994:1139-1193.
119. Jariwalla RJ, Harakeh S. Mechanisms underlying the action of vitamin C in viral and immunodeficiency disease. In: L. P, J. F, eds. Vitamin C in Health and Disease. New York: Macel Dekker, Inc.; 1997:309-322.
120. Pauling L. The immune system. How to live longer and feel better. 20th anniversary ed. Corvallis: Oregon State University Press; 2006:105-111.
121. Dahl H, Degre M. The effect of ascorbic acid on production of human interferon and the antiviral activity in vitro. Acta Pathol Microbiol Scand B. 1976;84B(5):280-284. (PubMed)
122. Carr AC, Frei B. Toward a new recommended dietary allowance for vitamin C based on antioxidant and health effects in humans. Am J Clin Nutr. 1999;69(6):1086-1107. (PubMed)
123. Traber MG, Atkinson J. Vitamin E, antioxidant and nothing more. Free Radic Biol Med. 2007;43(1):4-15. (PubMed)
124. Moriguchi S, Muraga M. Vitamin E and immunity. Vitam Horm. 2000;59:305-336. (PubMed)
125. Gruver AL, Hudson LL, Sempowski GD. Immunosenescence of ageing. J Pathol. 2007;211(2):144-156. (PubMed)
126. Miller RA. The aging immune system: primer and prospectus. Science. 1996;273(5271):70-74. (PubMed)
127. Wang Y, Huang DS, Watson RR. Dietary vitamin E modulation of cytokine production by splenocytes and thymocytes from alcohol-fed mice. Alcohol Clin Exp Res. 1994;18(2):355-362. (PubMed)
128. Wang Y, Watson RR. Vitamin E supplementation at various levels alters cytokine production by thymocytes during retrovirus infection causing murine AIDS. Thymus. 1994;22(3):153-165. (PubMed)
129. Serafini M. Dietary vitamin E and T cell-mediated function in the elderly: effectiveness and mechanism of action. Int J Dev Neurosci. 2000;18(4-5):401-410. (PubMed)
130. Meydani SN, Meydani M, Blumberg JB, et al. Vitamin E supplementation and in vivo immune response in healthy elderly subjects. A randomized controlled trial. JAMA. 1997;277(17):1380-1386. (PubMed)
131. Han SN, Meydani SN. Vitamin E and infectious diseases in the aged. Proc Nutr Soc. 1999;58(3):697-705. (PubMed)
132. Meydani SN, Leka LS, Fine BC, et al. Vitamin E and respiratory tract infections in elderly nursing home residents: a randomized controlled trial. JAMA. 2004;292(7):828-836. (PubMed)
133. Harman D, Miller RA. Effect of vitamin E on the immune response to influenza virus vaccine and the incidence of infectious disease in man. Age. 1986;9:21-23.
134. Pallast EG, Schouten EG, de Waart FG, et al. Effect of 50- and 100-mg vitamin E supplements on cellular immune function in noninstitutionalized elderly persons. Am J Clin Nutr. 1999;69(6):1273-1281. (PubMed)
135. Graat JM, Schouten EG, Kok FJ. Effect of daily vitamin E and multivitamin-mineral supplementation on acute respiratory tract infections in elderly persons: a randomized controlled trial. JAMA. 2002;288(6):715-721. (PubMed)
136. Hemila H, Virtamo J, Albanes D, Kaprio J. The effect of vitamin E on common cold incidence is modified by age, smoking and residential neighborhood. J Am Coll Nutr. 2006;25(4):332-339. (PubMed)
137. Chandra RK, Sudhakaran L. Regulation of immune responses by vitamin B6. Ann N Y Acad Sci. 1990;585:404-423. (PubMed)
138. Trakatellis A, Dimitriadou A, Trakatelli M. Pyridoxine deficiency: new approaches in immunosuppression and chemotherapy. Postgrad Med J. 1997;73(864):617-622. (PubMed)
139. Rall LC, Meydani SN. Vitamin B6 and immune competence. Nutr Rev. 1993;51(8):217-225. (PubMed)
140. Bailey LB, Gregory JF, 3rd. Folate. In: Bowman BA, Russell RM, eds. Present Knowledge in Nutrition. 9th ed. Volume I. Washington, D.C.: ILSI Press; 2006:278-301.
141. Bailey LB, Gregory JF, 3rd. Folate metabolism and requirements. J Nutr. 1999;129(4):779-782. (PubMed)
142. Dhur A, Galan P, Hercberg S. Folate status and the immune system. Prog Food Nutr Sci. 1991;15(1-2):43-60. (PubMed)
143. Shane B. Folic acid, vitamin B-12, and vitamin B-6. In: Stipanuk M (ed). Biochemical and physiological aspects of human nutrition. 2nd ed. Philadelphia: Saunders Elsevier; 2006:693-732.
144. Erkurt MA, Aydogdu I, Dikilitas M, et al. Effects of cyanocobalamin on immunity in patients with pernicious anemia. Med Princ Pract. 2008;17(2):131-135. (PubMed)
145. Tamura J, Kubota K, Murakami H, et al. Immunomodulation by vitamin B12: augmentation of CD8+ T lymphocytes and natural killer (NK) cell activity in vitamin B12-deficient patients by methyl-B12 treatment. Clin Exp Immunol. 1999;116(1):28-32. (PubMed)
146. Prasad AS. Zinc in human health: effect of zinc on immune cells. Mol Med. 2008;14(5-6):353-357. (PubMed)
147. Cousins RJ. Zinc. In: Bowman BA, Russell RM, eds. Present Knowledge in Nutrition. Volume 1. Washington, D.C.: ILSI Press; 2006:445-457.
148. Ibs K-H, Rink L. Zinc. In: Hughes DA, Darlington LG, Bendich A, eds. Diet and Human Immune Function. Totowa, New Jersey: Human Press Inc.; 2004:241-259.
149. Kruse-Jarres JD. The significance of zinc for humoral and cellular immunity. J Trace Elem Electrolytes Health Dis. 1989;3(1):1-8. (PubMed)
150. Allen JI, Perri RT, McClain CJ, Kay NE. Alterations in human natural killer cell activity and monocyte cytotoxicity induced by zinc deficiency. J Lab Clin Med. 1983;102(4):577-589. (PubMed)
151. Ibs KH, Rink L. Zinc-altered immune function. J Nutr. 2003;133(5 Suppl 1):1452S-1456S. (PubMed)
152. Shankar AH, Prasad AS. Zinc and immune function: the biological basis of altered resistance to infection. Am J Clin Nutr. 1998;68(2 Suppl):447S-463S. (PubMed)
153. Gladyshev VN. Selenoproteins and selenoproteomes. In: Hatfield DL, Berry MJ, Gladyshev VN, eds. Selenium: Its Molecular Biology and Role in Human Health. 2nd ed. New York: Springer; 2006:99-114.
154. Arthur JR, McKenzie RC, Beckett GJ. Selenium in the immune system. J Nutr. 2003;133(5 Suppl 1):1457S-1459S. (PubMed)
155. McKenzie RC, Beckett GJ, Arthur JR. Effects of selenium on immunity and aging. In: Hatfield DL, Berry MJ, Gladyshev VN, eds. Selenium: Its Molecular Biology and Role in Human Health. 2nd ed. New York: Springer; 2006:311-323.
156. Spallholz JE, Boylan LM, Larsen HS. Advances in understanding selenium's role in the immune system. Ann N Y Acad Sci. 1990;587:123-139. (PubMed)
157. Kiremidjian-Schumacher L, Roy M, Wishe HI, Cohen MW, Stotzky G. Supplementation with selenium and human immune cell functions. II. Effect on cytotoxic lymphocytes and natural killer cells. Biol Trace Elem Res. 1994;41(1-2):115-127. (PubMed)
158. Roy M, Kiremidjian-Schumacher L, Wishe HI, Cohen MW, Stotzky G. Supplementation with selenium and human immune cell functions. I. Effect on lymphocyte proliferation and interleukin 2 receptor expression. Biol Trace Elem Res. 1994;41(1-2):103-114. (PubMed)
159. Kiremidjian-Schumacher L, Roy M, Glickman R, et al. Selenium and immunocompetence in patients with head and neck cancer. Biol Trace Elem Res. 2000;73(2):97-111. (PubMed)
160. Baum MK, Miguez-Burbano MJ, Campa A, Shor-Posner G. Selenium and interleukins in persons infected with human immunodeficiency virus type 1. J Infect Dis. 2000;182 Suppl 1:S69-73. (PubMed)
161. Brody T. Nutritional Biochemistry. 2nd ed. San Diego: Academic Press; 1999.
162. Beard J. Iron. In: Bowman BA, Russell RM, eds. Present Knowledge in Nutrition. 9th ed. Washington, D.C.: ILSI Press; 2006:430-444.
163. Wood RJ, Ronnenberg AG. Iron. In: Shils ME, Shike M, Ross AC, Caballero B, Cousins RJ, eds. Modern Nutrition in Health and Disease. 10th ed. Philadelphia: Lippincott Williams & Wilkins; 2006:248-270.
164. Doherty CP. Host-pathogen interactions: the role of iron. J Nutr. 2007;137(5):1341-1344. (PubMed)
165. Beard JL. Iron biology in immune function, muscle metabolism and neuronal functioning. J Nutr. 2001;131(2S-2):568S-579S; discussion 580S. (PubMed)
166. Walker EM, Jr., Walker SM. Effects of iron overload on the immune system. Ann Clin Lab Sci. 2000;30(4):354-365. (PubMed)
167. Stevens RG, Graubard BI, Micozzi MS, Neriishi K, Blumberg BS. Moderate elevation of body iron level and increased risk of cancer occurrence and death. Int J Cancer. 1994;56(3):364-369. (PubMed)
168. Oppenheimer SJ. Iron and its relation to immunity and infectious disease. J Nutr. 2001;131(2S-2):616S-633S; discussion 633S-635S. (PubMed)
169. Williams DM. Copper deficiency in humans. Semin Hematol. 1983;20(2):118-128. (PubMed)
170. Percival SS. Copper and immunity. Am J Clin Nutr. 1998;67(5 Suppl):1064S-1068S. (PubMed)
171. Failla ML, Hopkins RG. Is low copper status immunosuppressive? Nutr Rev. 1998;56(1 Pt 2):S59-64. (PubMed)
172. Heresi G, Castillo-Duran C, Munoz C, Arevalo M, Schlesinger L. Phagocytosis and immunoglobulin levels in hypocupremic children. Nutr Res 1985;5:1327-1334.
173. Kelley DS, Daudu PA, Taylor PC, Mackey BE, Turnlund JR. Effects of low-copper diets on human immune response. Am J Clin Nutr. 1995;62(2):412-416. (PubMed)
174. Bonham M, O'Connor JM, Hannigan BM, Strain JJ. The immune system as a physiological indicator of marginal copper status? Br J Nutr. 2002;87(5):393-403. (PubMed)
175. Turnlund JR, Jacob RA, Keen CL, et al. Long-term high copper intake: effects on indexes of copper status, antioxidant status, and immune function in young men. Am J Clin Nutr. 2004;79(6):1037-1044. (PubMed)
176. Borchers AT, Selmi C, Meyers FJ, Keen CL, Gershwin ME. Probiotics and immunity. J Gastroenterol. 2009;44(1):26-46. (PubMed)
177. Roberfroid MB. Prebiotics and probiotics: are they functional foods? Am J Clin Nutr. 2000;71(6 Suppl):1682S-1687S; discussion 1688S-1690S. (PubMed)
178. West NP, Pyne DB, Peake JM, Cripps AW. Probiotics, immunity and exercise: a review. Exerc Immunol Rev. 2009;15:107-126. (PubMed)
179. de Vrese M, Schrezenmeir J. Probiotics, prebiotics, and synbiotics. Adv Biochem Eng Biotechnol. 2008;111:1-66. (PubMed)
180. Ruemmele FM, Bier D, Marteau P, et al. Clinical evidence for immunomodulatory effects of probiotic bacteria. J Pediatr Gastroenterol Nutr. 2009;48(2):126-141. (PubMed)
181. Oelschlaeger TA. Mechanisms of probiotic actions - A review. Int J Med Microbiol. 2010;300(1):57-62. (PubMed)
182. Sherman PM, Ossa JC, Johnson-Henry K. Unraveling mechanisms of action of probiotics. Nutr Clin Pract. 2009;24(1):10-14. (PubMed)
183. National Institutes of Health NOEI. Clinical guidelines on the identification, evaluation, and treatment of overweight and obesity in adults. September 1998. Available online at: http://www.nhlbi.nih.gov/guidelines/obesity/ob_gdlns.pdf.
184. Calle EE, Thun MJ, Petrelli JM, Rodriguez C, Heath CW, Jr. Body-mass index and mortality in a prospective cohort of U.S. adults. N Engl J Med. 1999;341(15):1097-1105. (PubMed)
185. Olefsky JM, Glass CK. Macrophages, inflammation, and insulin resistance. Annu Rev Physiol. 72:219-246. (PubMed)
186. Xu H, Barnes GT, Yang Q, et al. Chronic inflammation in fat plays a crucial role in the development of obesity-related insulin resistance. J Clin Invest. 2003;112(12):1821-1830. (PubMed)
187. Matarese G, Moschos S, Mantzoros CS. Leptin in immunology. J Immunol. 2005;174(6):3137-3142. (PubMed)
188. Oswal A, Yeo G. Leptin and the control of body weight: a review of its diverse central targets, signaling mechanisms, and role in the pathogenesis of obesity. Obesity (Silver Spring). 18(2):221-229. (PubMed)
189. Enriori PJ, Evans AE, Sinnayah P, Cowley MA. Leptin resistance and obesity. Obesity (Silver Spring). 2006;14 Suppl 5:254S-258S. (PubMed)
190. Lago R, Gomez R, Lago F, Gomez-Reino J, Gualillo O. Leptin beyond body weight regulation--current concepts concerning its role in immune function and inflammation. Cell Immunol. 2008;252(1-2):139-145. (PubMed)
191. Matarese G, Leiter EH, La Cava A. Leptin in autoimmunity: many questions, some answers. Tissue Antigens. 2007;70(2):87-95. (PubMed)
192. Espejo B, Torres A, Valentin M, et al. Obesity favors surgical and infectious complications after renal transplantation. Transplant Proc. 2003;35(5):1762-1763. (PubMed)
193. Canturk Z, Canturk NZ, Cetinarslan B, Utkan NZ, Tarkun I. Nosocomial infections and obesity in surgical patients. Obes Res. 2003;11(6):769-775. (PubMed)
194. Falagas ME, Kompoti M. Obesity and infection. Lancet Infect Dis. 2006;6(7):438-446. (PubMed)
195. Wilson JA, Clark JJ. Obesity: impediment to postsurgical wound healing. Adv Skin Wound Care. 2004;17(8):426-435. (PubMed)
196. Scheinfeld NS. Obesity and dermatology. Clin Dermatol. 2004;22(4):303-309. (PubMed)
197. Janniger CK, Schwartz RA, Szepietowski JC, Reich A. Intertrigo and common secondary skin infections. Am Fam Physician. 2005;72(5):833-838. (PubMed)
198. Chandra RK, Kutty KM. Immunocompetence in obesity. Acta Paediatr Scand. 1980;69(1):25-30. (PubMed)





