Contenido
La biotina es una vitamina hidrosoluble que es generalmente clasificada como una vitamina del complejo B. Después de su descubrimiento inicial en 1927, se necesitaron cerca de 40 años de investigación para inequívocamente establecer a la biotina como una vitamina (1). La biotina es requerida por todos los organismos pero puede ser sintetizada por algunas cepas de bacterias, levaduras, hongos, algas, y algunas especies de plantas (2).
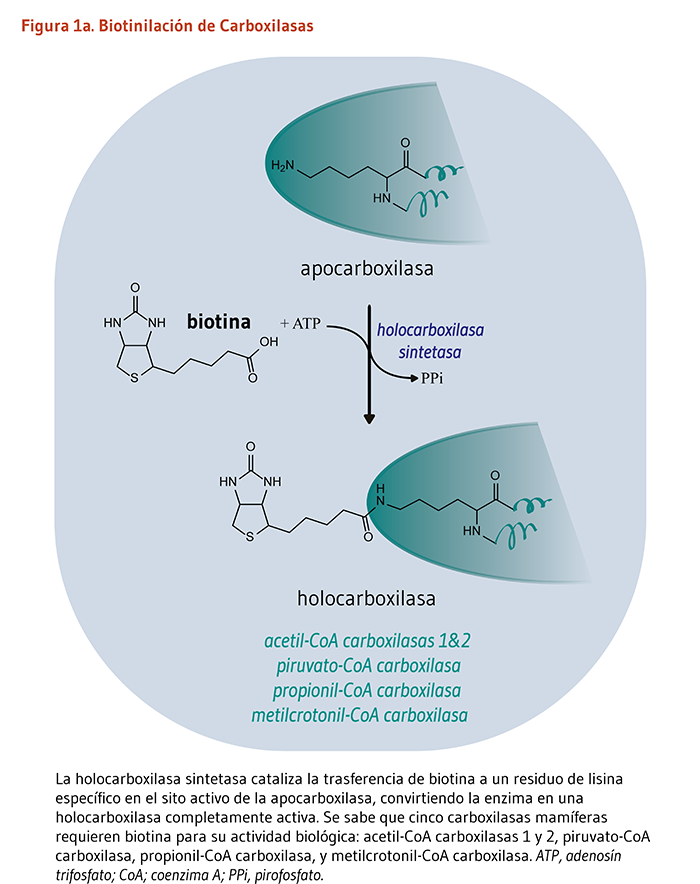
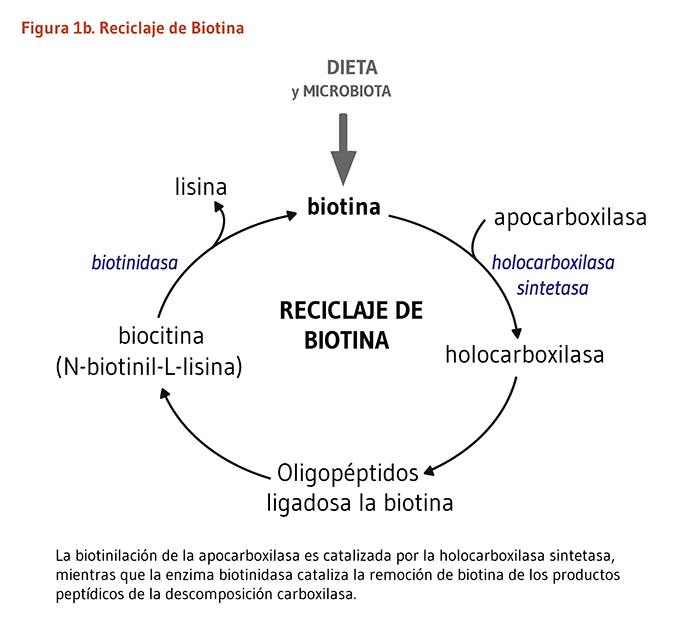
La biotina funciona como un cofactor unido covalentemente requerido para la actividad biológica de las cinco enzimas carboxilasas dependientes de la biotina conocidas de los mamíferos (véase abajo). Tal cofactor no-proteico es conocido como un “grupo prostético.” El enlace covalente de la biotina a la apocarboxilasa (es decir, una carboxilasa catalíticamente inactiva) es catalizado por la enzima, holocarboxilasa sintetasa (HCS). El término “biotinilación” se refiere a la adición covalente de biotina a cualquier molécula, incluyendo apocarboxilasas e histonas. La HCS cataliza la biotinilación postraduccional del grupo épsilon amino de un residuo de lisina en el sitio activo de cada apocarboxilasa, convirtiendo a la apocarboxilasa inactiva en una holocarboxilasa completamente activa (Figura 1a). Particularmente los residuos de lisina dentro del extremo N-terminal de histonas específicas, los cuales ayudan a empaquetar el ADN en el núcleo eucariótico, pueden también ser biotinilados (3). La biotinidasa es la enzima que cataliza la liberación de la biotina proveniente de las histonas biotiniladas y de los productos de péptidos de la degradación de la holocarboxilasa (Figura 1b).
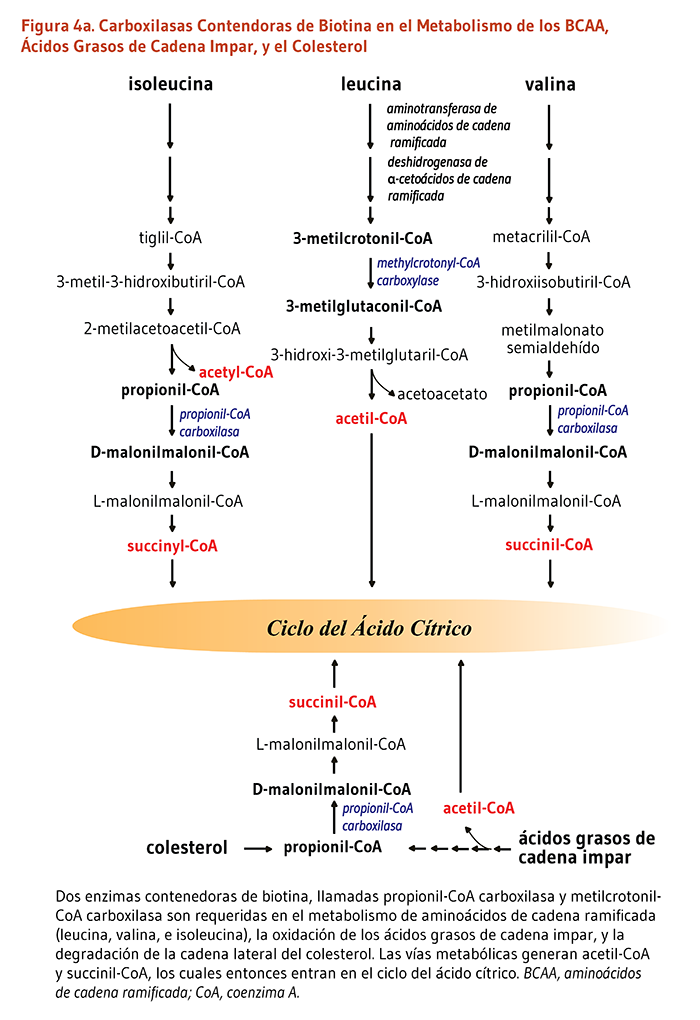
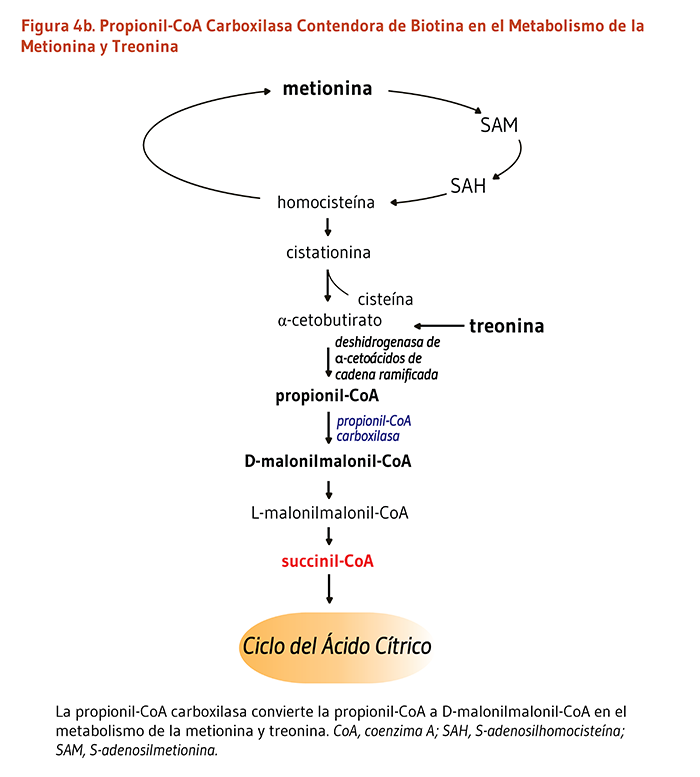
Cinco carboxilasas mamíferas que catalizan reacciones metabólicas esenciales:
En los núcleos eucariotas, el ADN es empaquetado en estructuras compactas para formar los nucleosomas — unidades fundamentales de la cromatina. Cada nucleosoma está compuesto de 147 pares de bases de ADN envueltos alrededor de ocho histonas (emparejamiento de histonas: H2A, H2B, H3, y H4). Otra histona, llamada H1 ligador, está localizada en la en la superficie exterior de cada nucleosoma y sirve como un ancla para fijar el ADN alrededor del núcleo de la histona. El embalaje compacto de la cromatina debe estar relajado de vez en cuando para permitir procesos biológicos, tales como la replicación y la transcripción del ADN. Modificaciones químicas del ADN y las histonas afectan el plegamiento de la cromatina, incrementando o reduciendo la accesibilidad del ADN a factores involucrados en los procesos previamente mencionados. Juntos con la metilación del ADN, un cierto número de modificaciones químicas dentro la dentro del extremo N-terminal de las histonas del núcleo modifica sus cargas eléctricas y estructuras, de este modo cambiando la conformación de la cromatina y la actividad transcripcional de los genes.
Las diversas modificaciones de las colas de las histonas, incluyendo la acetilación, metilación, fosforilación, ubiquitinación, SUMOilación, ADP-ribosilación, carbonilación, deiminación, hidroxilación, y la biotinilación, tiene diferentes funciones regulatorias. Varios sitios de biotinilación han sido identificados en las histonas H2A, H3, y H4 (5). Entre ellas, la biotinilación de la histona H4 en la lisina (K) 12 (señalado H4K12bio) parece ser enriquecida en la heterocromatina, una cromatina estrechamente condensada asociada con regiones de repetición en los (peri)centrómeros y telómeros, y con elementos transponibles conocidos como repeticiones terminales largas (3). Además, las marcas de biotinilación se co-localizan con marcas de la represión de genes bien conocidas como la lisina 9 metilada en la histona H3 (H3K9me) en la cromatina transcripcionalmente competente (6). Por ejemplo, H4K12bio se puede encontrar en el promotor del gen SLC5A6 que codifica para el transportador de la mediación de la asimilación de biotina en las células, el transportador multivitamínico dependiente del sodio humano (hSMVT). Cuando la biotina es abundante, la HCS puede biotinilar las histonas H4 en el promotor del SLC5A6, el cual detiene la síntesis del hSMVT y reduce la asimilación de biotina. Inversamente, en las células deficientes de biotina, las marcas de biotinilación en el promotor del LC5A6 son removidas de tal manera que se puede producir la expresión de genes, permitiendo la síntesis del hSMVT e incrementando posteriormente la asimilación de biotina (7).
Aunque la deficiencia de biotina evidente es bastante rara, el requerimiento humano de biotina dietaría ha sido demostrado en tres situaciones diferentes: alimentación intravenosa (parenteral) prolongada sin suplementación de biotina, infantes alimentados con una formula elemental carente de biotina, y el consumo de clara de huevo cruda por un período prolongado (de varias semanas a varios años) (8). La clara de huevo cruda contiene una proteína antimicrobiana conocida como avidina que puede unirse a la biotina y prevenir su absorción. El cocinar la clara de huevo desnaturaliza la avidina, haciéndola susceptible a la digestión y por lo tanto, incapaz de impedir la absorción de la biotina dietaría (5).
Los signos de la deficiencia evidente de biotina incluyen la caída de cabello (alopecia) y una erupción escamosa rojiza alrededor de los ojos, nariz, boca, y área genital. Síntomas neurológicos en adultos han incluido depresión, letargo, alucinaciones, y entumecimiento y cosquilleo de las extremidades, ataxia, y convulsiones. Las erupciones faciales características, junto con la distribución inusual de la grasa facial, han sido llamados "rasgos carentes de biotina" por algunos investigadores (1). Los individuos con desordenes hereditarios del metabolismo de la biotina (véase Trastornos metabólicos congénitos) que resultan en la deficiencia de biotina funcional, a menudo tienen hallazgos físicos similares, así como también convulsiones y evidencia de una función alterada del sistema inmune y una susceptibilidad aumentada a infecciones bacterianas y fúngicas (9, 10).
Aparte del consumo prolongado de la clara de huevo cruda o el soporte nutricional intravenoso total carente de biotina, otras condiciones pueden incrementar el riesgo de depleción de biotina. El fumar ha sido asociado con un incremento del catabolismo de la biotina (11). Las células que se dividen rápidamente del feto en desarrollo requieren biotina para la síntesis de carboxilasas esenciales y para la biotinilación de las histonas; por consiguiente, el requerimiento de biotina es propenso a incrementar durante el embarazo. Investigación sugiere que un número substancial de mujeres desarrollan una deficiencia marginal o subclínica durante el embarazo normal (véase también Prevención de Enfermedades) (8, 12, 13). Además, ciertos tipos de enfermedades hepáticas pueden disminuir la actividad de la biotinidasa y en teoría incrementar el requerimiento de biotina. Un estudio de 62 niños con enfermedad crónica del hígado y 27 controles sanos encontró que la actividad de la biotinidasa del suero se encontraba anormalmente baja en aquellos con una función severamente deteriorada debido a la cirrosis (14). Sin embargo, este estudio no aporto evidencia de la deficiencia de biotina. Además, los medicamentos anticonvulsivos, usados para prevenir convulsiones en individuos con epilepsia, incrementaron el riesgo de una depleción de biotina (para más información acerca de la biotina y los anticonvulsivos, véase Interacción con drogas/fármacos).
Existen varias maneras en que el desorden hereditario, la deficiencia de biotinidasa, conduce a una deficiencia secundaria de biotina. La absorción intestinal es disminuida porque una escases de biotinidasa previene la liberación de biotina proveniente de las proteínas dietarías (15). El reciclaje de nuestra propia biotina unida a las carboxilasas e histonas es también alterado, y la perdida urinaria de biocitina (N-biotinil-lisina) y biotina es incrementada (véase Figura 1 arriba) (5). La deficiencia de biotinidasa uniformemente responde a la biotina suplementaria. La suplementación oral con hasta 5 a 10 miligramos (mg) de biotina diariamente es a veces requerida, aunque dosis más pequeñas son frecuentemente suficientes (revisado en 16).
Algunas formas de la deficiencia de HCS responden a la suplementación con dosis farmacológicas de biotina. La deficiencia de HCS resulta en la disminución de la formación de todas las holocarboxilasas a concentraciones sanguíneas fisiológicas de la biotina; así, la suplementación de biotina de alta dosis (10-80 mg de biotina diaria es requerida (10).
La prognosis de estos dos desordenes es usualmente buena si la terapia con biotina es introducida tempranamente (infancia o niñez) y se continua de por vida (10).
Ha habido un reporte de caso de un niño con deficiencia del transporte de biotina que respondió a una suplementación de altas dosis de biotina (17). Debe notarse que la presencia de un transportador multivitamínico dependiente del sodio humano (hSMVT) defectuoso fue descartado como la causa de la deficiencia del transporte de biotina.
Las concentraciones anormalmente elevadas del aminoacido, fenilalanina, en la sangre de individuos afectados con FCU puede inhibir la actividad de la biotinidasa. Schulpis et al. especuló que la dermatitis seborreica asociada con la actividad baja de la biotinidasa en estos pacientes se resolvería a partir del cumplimiento con una dieta especial baja en proteína pero no con la suplementación de biotina (18).
Cuatro medidas de la deficiencia de biotina marginal han sido validados como indicadores del estatus de la biotina: (1) la excreción urinaria reducida de la biotina y algunos de sus catabolitos; (2) la alta excreción urinaria de un ácido orgánico, ácido 3-hidroxiisovalérico, y su derivado, ácido carnitil-3-hidroxiisovalérico, ambos de los cuales se refleja la actividad disminuida de la metilcrotonil-CoA carboxilasa dependiente de la biotina; (3) la actividad reducida de la propionil-CoA carboxilasa en los linfocitos sanguíneos periféricos (5); y (4) los niveles reducidos de holo-metilcrotonil-CoA carboxilasa y holo-propionil-CoA carboxilasa en los linfocitos — los indicadores más fiables del estatus de biotina (19). Estos marcadores han sido solo validados en hombres y mujeres no embarazadas, y podrían no reflejar precisamente el estatus de la biotina en mujeres embarazadas y mujeres que lactan (12).
La suficiente evidencia científica es escaza para estimar el requerimiento dietario para la biotina; por lo tanto no se ha establecido una Ingesta Diaria Recomendada (IDR) para la biotina. En su lugar, la Junta de Nutrición y Alimentos (JNA) del Instituto de Medicina (IOM) estableció recomendaciones para una Ingesta Adecuada (IA; Tabla 1). La IA para los adultos (30 microgramos [μg]/día) se extrapolo de la IA para infantes exclusivamente alimentados con leche humana y se espera que sobreestime el requerimiento dietario para la biotina en los adultos. Las ingestas dietarías de adultos generalmente saludables se han estimado son de entre 40-60 μg/día de biotina (1). El requerimiento para la biotina en el embarazo puede ser incrementada (20).
| Etapa de la Vida | Edad | Machos (μg/día) | Hembras (μg/día) |
|---|---|---|---|
| Infantes | 0-6 meses | 5 | 5 |
| Infantes | 7-12 meses | 6 | 6 |
| Niños | 1-3 años | 8 | 8 |
| Niños | 4-8 años | 12 | 12 |
| Niños | 9-13 años | 20 | 20 |
| Adolescentes | 14-18 años | 25 | 25 |
| Adultos | 19 años y más | 30 | 30 |
| Embarazo | Todas las edades | - | 30 |
| Período de lactancia | Todas las edades | - | 35 |
Investigación actual indica que por lo menos un tercio de las mujeres desarrollan deficiencia de biotina marginal durante el embarazo (8), pero no se sabe si esto podría incrementar el riesgo de anomalías congénitas. Estudios basados en la observación pequeños en mujeres embarazadas han reportado una excreción urinaria anormalmente alta de ácido 3-hidroxiisovalérico tanto temprano como tarde en el embarazo, sugiriendo una actividad disminuida de metilcrotonil-CoA carboxilasa dependiente de la biotina (21, 22). En un estudio de intervención, aleatorio, simple ciego en 26 mujeres embarazadas, la suplementación con 300 μg/día de biotina por dos semanas limitó la excreción de ácido 3-hidroxiisovalérico en comparación al placebo, confirmando que la excreción incrementada de ácido 3-hidroxiisovalérico en efecto reflejó la deficiencia de biotina marginal en el embarazo (23). Un estudio de corte transversal pequeño en 22 mujeres embarazadas reportó una incidencia de actividad baja de propionil-CoA carboxilasa linfocitaria (otro marcador de la deficiencia de biotina) mayor al 80% (13). Aunque el nivel de deficiencia de biotina no está asociado con signos manifestados de deficiencia en mujeres embarazadas, tales observaciones son fuentes de preocupación porque se ha demostrado que la deficiencia subclínica de biotina causa paladar hendido e hipoplasia de extremidades en varias especies de animales (revisado en 13). Además, se ha encontrado que la depleción de biotina suprime la expresión de carboxilasas dependientes de la biotina, remueve las marcas de biotina de las histonas, y disminuye la proliferación en células mesenquimales palatales embrionarias humanas en cultivo (24). La actividad alterada de las carboxilasas puede resultar en alteraciones en el metabolismo de los lípidos, el cual ha sido ligado al paladar hendido y anormalidades del esqueleto en animales. Además, la deficiencia de biotina que conduce a la reducción de la biotinilación de histonas en específicos loci del genoma podría posiblemente incrementar la inestabilidad genómica y resultar en anomalías cromosómicas y malformaciones fetales (13).
Mientras que a las mujeres embarazadas se les aconseja consumir ácido fólico suplementario antes de y durante el embarazo para prevenir defectos de tubo neural (véase Folato), sería también prudente asegurar la ingesta adecuada de biotina durante el embarazo. La IA actual para las mujeres embarazadas es de 30 μg/dia de biotina, y toxicidad alguna no ha sido reportada a este nivel de ingesta (véase Seguridad).
La enfermedad de los ganglios basales sensible a la biotina, también llamada síndrome-2 de disfunción del metabolismo de la tiamina es causada por mutaciones en el gen que codifica para el transportador de tiamina tipo 2 (THTR-2). Las características clínicas aparecen alrededor de los tres a cuatro años de edad e incluyen encefalopatía subaguda (confusión, somnolencia y alteración del nivel de conciencia), ataxia, y convulsiones. Un estudio retrospectivo de 18 individuos afectados provenientes de la misma familia o de la misma tribu en Arabia Saudita fue recientemente conducido. Los datos mostraron que la monoterapia con biotina (5-10 mg/kg/día) eficientemente suprimió las manifestaciones clínicas de la enfermedad, aunque un tercio de los pacientes sufrieron de crisis agudas recurrentes. A menudo asociadas con malos resultados, las crisis agudas no fueron observadas después de que la suplementación con tiamina iniciara (300-400 mg/día) y durante un periodo de seguimiento de cinco años. Un diagnóstico temprano y el tratamiento inmediato con biotina y tiamina llevaron a resultados positivos (25). El mecanismo para el efecto beneficial de la suplementación con biotina aún no ha sido dilucidado.
La esclerosis múltiple (EM) es una enfermedad autoinmune caracterizada por daños progresivos a la vaina de mielina que rodea las fibras nerviosas (axones) y perdida neuronal en el cerebro y medula espinal de los individuos afectados. La progresión de las discapacidades neurológicas en los pacientes con EM es a menudo evaluado por la Escala Expandida del Estado de Discapacidad (EDSS) con puntuaciones de entre 1 a 10, partiendo con señales mínimas de la disfunción motora (puntuación de 1) hasta muerte por EM (puntuación de 10). La deficiencia de ATP debido a la disfunción mitocondrial y el estrés oxidativo incrementado pueden ser parcialmente responsables por la degeneración progresiva de las neuronas en las EM (26). Dado su papel en el metabolismo intermediario y en la síntesis de ácidos grasos (requerido para la formación de mielina) (véase Función), se ha postulado que la biotina podría ejercer efectos beneficiosos que limitarían o revertirían alteraciones funcionales asociadas con la EM (26).
Un estudio piloto no aleatorio, no controlado en 23 pacientes con EM progresiva encontró que altas dosis de biotina (100-600 mg/día) se asociaban con mejoras clínicas sostenidas en 5 (de 5) pacientes con perdida visual progresiva y en 16 (de 18) pacientes con parálisis parcial de las extremidades después de un periodo medio de seguimiento de tres meses tras el inicio del tratamiento (27). Además los resultados preliminares del ensayo multicéntrico, aleatorio, controlado con placebo en 154 sujetos con EM progresiva indicó que 13 de 103 pacientes que recibieron aleatoriamente biotina oral diaria (300 mg) por 48 semanas lograron un criterio de valoración funcional compuesto que incluyo una disminución en las puntuaciones de la EDSS. En comparación, ninguno de los 51 pacientes asignados aleatoriamente al grupo de placebo mostró mejoramientos clínicos significativos (28). Dos ensayos en proceso están evaluando el efecto de la suplementación con altas dosis de biotina en el tratamiento de la EM (véase ensayos NCT02220933 y NCT02220244 en www.clinicaltrials.gov).
Se ha demostrado que la deficiencia de biotina manifiesta afecta la utilización de glucosa en ratones (29) y causa hipoglicemia fatal en pollos. La deficiencia de biotina manifiesta probablemente también causa anormalidades en la regulación de glucosa en humanos (véase Función). Un estudio temprano en humanos reportó concentraciones más bajas de biotina del suero en 43 pacientes con diabetes mellitus tipo 2 en comparación con 64 sujetos de control no diabéticos, como también una relación inversa entre las concentraciones de glucosa en ayunas y biotina sanguíneas (30). En un estudio de intervención aleatorio, controlado con placebo en 28 pacientes con diabetes tipo 2, la suplementación diaria con 9 miligramos (mg) de biotina por un mes resultó en una disminución media del 45% en las concentraciones de glucosa sanguínea en ayunas (30). A pesar de todo, otro estudio pequeño en 10 pacientes con diabetes tipo 2 y 7 controles no diabéticos no encontró efecto alguno de la suplementación con biotina (15 mg/día) por 28 días en las concentraciones de glucosa sanguínea en ayunas en ambos grupos (31). Un estudio doble ciego, controlado con placebo más reciente por el mismo grupo de investigación mostró que el mismo régimen de biotina disminuyó las concentraciones de triglicéridos del plasma en tanto los pacientes diabéticos como los no diabéticos con hipertrigliceridemia (32). En este estudio, la administración de biotina no afectó las concentraciones de glucosa sanguínea en ambos grupos de pacientes. Adicionalmente, unos pocos estudios han demostrado que la co-suplementación con biotina y picolinato de cromo puede ser una terapia adjunta beneficiosa para pacientes con diabetes tipo 2 (33-36). Sin embargo, se ha demostrado que la administración de picolinato de cromo por si sola mejora el control glicémico en sujetos diabéticos (véase el artículo en Cromo) (37).
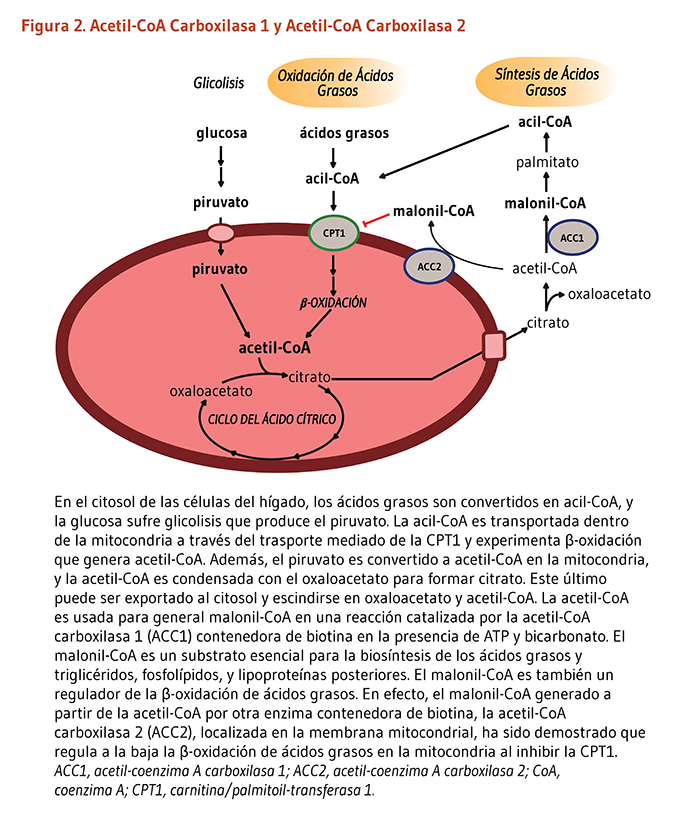
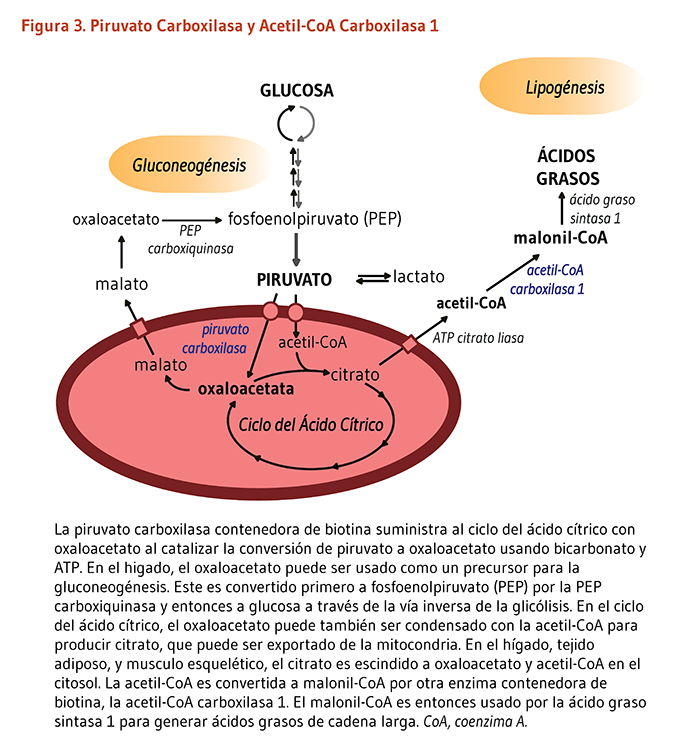
Como un cofactor de carboxilasas requerido para la síntesis de ácidos grasos, la biotina puede incrementar la utilización de glucosa para la síntesis grasa. Se ha encontrado que la biotina estimula la glucoquinasa, una enzima hepática que incrementa la síntesis de glicógeno, la forma almacenada de la glucosa. La biotina también parece desencadenar la secreción de insulina en el páncreas de ratas y mejorar la homeostasis de la glucosa (38). Sin embargo, se esperaría la actividad reducida de la ACC1 y la ACC2 para reducir la síntesis de ácidos grasos e incrementar la oxidación de ácidos grasos, respectivamente. No es de sorprenderse que actualmente no está claro si las dosis farmacológicas de biotina podrían beneficiar el manejo de la hiperglicemia en pacientes con intolerancia a la glucosa. Por otra parte, queda por ser demostrado si la biotina suplementaria disminuye el riesgo de complicaciones cardiovasculares en pacientes diabéticos al reducir los triglicéridos y el colesterol LDL del suero (32-34).
El descubrimiento de que los suplementos de biotina eran efectivos en el tratamiento de anormalidades de las pezuñas en animales ungulados, sugirió que la biotina podría también ser beneficiosa en el fortalecimiento de uñas quebradizas en humanos (39-41). Tres ensayos no controlados que examinaron los efectos de la suplementación con biotina (2.5 mg/día por varios meses) en mujeres con uñas quebradizas han sido publicados (42-44). En dos de los ensayos, se reportó evidencia subjetiva de mejora clínica en 67%-91% de las participantes disponibles para seguimiento al final del período de tratamiento (42, 43). Un ensayo que utilizó microscopía electrónica de barrido para evaluar la fragilidad de las uñas reportó menos resquebrajamiento de las uñas y un aumento del grosor del 25% de la placa ungueal en pacientes suplementados con biotina por 6 a 15 meses (44). Se encontró también que la suplementación con biotina (5 mg/día) era efectiva en controlar el cabello rebelde y resquebrajamiento de uñas en dos niños pequeños con síndrome del cabello impeinable hereditario (45). Aunque evidencia preliminar sugiere que la suplementación con biotina puede ayudar a fortalecer las uñas frágiles, ensayos controlados con placebo de mayor tamaño son necesarios para evaluar la eficacia de la suplementación con altas dosis de biotina para el tratamiento de uñas quebradizas.
Se encontró que la administración de biotina revierte la alopecia en niños tratados con el anticonvulsivo, ácido valproico (véase Interacción con drogas/fármacos). Sin embargo, aunque la pérdida de cabello es un síntoma de la deficiencia severa de biotina (véase Deficiencia), no existen estudios científicos publicados que apoyen la aseveración de que los suplementos de altas dosis de biotina son efectivos en la prevención o tratamiento de la pérdida del cabello en hombres y mujeres (46).
La biotina se encuentra en muchos alimentos, ya sea como la forma libre que es directamente tomado por los enterocitos o como biotina unida a las proteínas dietarías. La yema de huevo, hígado, y las levaduras son fuentes ricas de biotina. Estimados de las ingestas diarias promedio de biotina provenientes de estudios pequeños oscilaron entre 40 a 60 microgramos (μg) por día en adultos (1). Sin embargo, cuestionarios nutricionales nacionales estadounidenses no han aun sido capaces de estimar la ingesta de biotina debido a la escasez y la falta de fiabilidad de los datos con respecto al contenido de biotina de los alimentos. Tablas de composición de alimentos para la biotina están incompletas de manera que la ingesta diaria no puede ser estimada de forma fiable en los seres humanos. Un estudio por Staggs et al. (47) empleó un método de cromatografía líquida de alta resolución en lugar de bioensayos (48) y reportó un contenido de biotina relativamente diferente para algunos de los alimentos seleccionados. La Tabla 2 lista algunas fuentes alimenticias de biotina, junto con su contenido en μg.
| Alimento | Porción | Biotina (μg) |
|---|---|---|
| Levadura | 1 paquete (7 gramos) | 1.4-14 |
| Pan, trigo entero | 1 rebanada | 0.02-6 |
| Huevo, cocido | 1 grande | 13-25 |
| Queso, cheddar | 1 onza | 0.4-2 |
| Hígado, cocido | 3 onzas* | 27-35 |
| Cerdo, cocido | 3 onzas* | 2-4 |
| Salmón, cooked | 3 ounces* | 4-5 |
| Aguacate | 1 entero | 2-6 |
| Frambuesas | 1 taza | 0.2-2 |
| Coliflor, cruda | 1 taza | 0.2-4 |
| *Una porción de tres onzas de carnes es del tamaño de una baraja de cartas. | ||
La mayoría de las bacterias que normalmente colonizan el intestino delgado y el intestino grueso (colon) sintetizan biotina (49). Permanece sin conocerse si la biotina es liberada y absorbida por los humanos en cantidades significativas. La asimilación de biotina libre en las células intestinales a través del transportador multivitamínico dependiente del sodio humano (hSMVT) ha sido identificada en células en cultivo derivadas del revestimiento del intestino delgado y colon (50), sugiriendo que los humanos pueden ser capaces de absorber biotina producida por bacterias entéricas — un fenómeno documentado en porcinos.
No se sabe que la biotina sea toxica. En las personas sin desordenes del metabolismo de biotina, dosis de hasta 5 mg/día por dos años no fueron asociados con efectos adversos (52). La suplementación oral con biotina ha sido bien tolerada en dosis de hasta 200 mg/día (casi 7,000 veces la IA) en personas con desordenes hereditarios del metabolismo de la biotina (1). Se encontró también que la suplementación diaria con una formulación altamente concentrada de biotina (100-600 mg) fue bien tolerada en individuos con esclerosis múltiple progresiva (27, 28). Sin embargo, hay un reporte de caso de derrame pleuropericárdico eosinofílico que pone en peligro la vida en una mujer de edad avanzada que tomó una combinación de 10 mg/día de biotina y 300 mg/día de ácido pantoténico (vitamina B5) por dos meses (53). Debido a que reportes de eventos adversos fueron escasos cuando las Ingestas Dietéticas de Referencia (IDR) para la biotina fueron establecidas en 1998, el Instituto de Medicina no estableció un nivel máximo de ingesta tolerable (NM) para la biotina (1).
Grandes dosis de ácido pantoténico (vitamina B5) tienen el potencial de competir con la biotina por la asimilación intestinal y celular por el transportador multivitamínico dependiente del sodio humano (hSMVT) (54, 55). La biotina también comparte el hSMVT con el ácido α-lipoico (56). Se ha encontrado que las dosis farmacológicas (muy altas) de ácido α-lipoico disminuyen la actividad de carboxilasas dependientes de la biotina en ratas, pero tal efecto no ha sido demostrado en humanos (57).
Individuos en terapia de anticonvulsivos (anti-convulsiones) a largo plazo según se informa, han reducido las concentraciones sanguíneas de biotina así como también incrementaron la excreción urinaria de ácidos orgánicos (p. ej. ácido 3-hidroxiisovalérico) que indican un descenso en la actividad carboxilasa (véase Marcadores del estatus de la biotina) (5). Los mecanismos potenciales de la depleción de la biotina por los anticonvulsivos, primidona (Mysoline), fenitoína (Dilantin), y carbamazepina (Carbatrol, Tegretol), incluyen la inhibición de la absorción intestinal y la reabsorción renal de la biotina, como también un catabolismo incrementado de la biotina (51). El uso del anticonvulsivo ácido valproico en niños ha resultado en la pérdida de cabello revertida por la suplementación con biotina (58-61). El tratamiento a largo plazo con drogas sulfonamidas antibacterianas (sulfa) u otros antibióticos puede disminuir la síntesis bacteriana de biotina. Sin embargo, dado que la medida en la que la síntesis bacteriana contribuye a la ingesta de biotina en los humanos no es conocida, los efectos de las drogas antimicrobianas en el estatus de la biotina nutricional permanecen siendo inciertas (51).
Poco se conoce con respecto a la cantidad de biotina dietaría requerida para promover la salud optima o prevenir enfermedades crónicas. El Instituto Linus Pauling apoya la recomendación hecha por el Instituto de Medicina, la cual es de 30 microgramos (μg) de biotina por día para los adultos. Una dieta variada debería proveer biotina suficiente para la mayoría de las personas. Sin embargo, siguiendo la recomendación del Instituto Linus Pauling de tomar un suplemento multivitamínico-mineral diariamente proveerá generalmente de una ingesta de al menos 30 μg/día de biotina.
Actualmente, no existe indicación de que los adultos mayores tengan un requerimiento de biotina aumentado. Si la ingesta dietaría de biotina no es suficiente, un suplemento multivitamínico-mineral diariamente va generalmente a proveer de una ingesta de al menos 30 μg de biotina por día.
Originalmente escrito en 2000 por:
Jane Higdon, Ph.D.
Instituto Linus Pauling
Universidad Estatal de Oregon
Actualizado en Junio de 2004 por:
Jane Higdon, Ph.D.
Instituto Linus Pauling
Universidad Estatal de Oregon
Actualizado en Agosto de 2008 por:
Victoria J. Drake, Ph.D.
Instituto Linus Pauling
Universidad Estatal de Oregon
Actualizado en Julio de 2015 por:
Barbara Delage, Ph.D.
Instituto Linus Pauling
Universidad Estatal de Oregon
Actualizado en Julio de 2015 por:
Barbara Delage, Ph.D.
Instituto Linus Pauling
Universidad Estatal de Oregon
Revisado en Septiembre de 2015 por:
Donald Mock, M.D., Ph.D.
Profesor
Departamentos de Bioquímica y Biología Molecular y Pediatría
Universidad de Arkansas para las Ciencias Médicas
Traducido al Español en 2016 por:
Silvia Vazquez Lima
Instituto Linus Pauling
Universidad Estatal de Oregon
Originalmente traducido al español en 2012 por Guillermo Sandoval y editado por Andrew Quest (Ph.D.) y Lisette Leyton (Ph.D.), todos provenientes de la Universidad de Chile. Estos esfuerzos fueron patrocinados por el projecto Anillo #ACT1111, CONICYT-Chile, programa PIA.
Última actualización 10/21/15 Derechos de autoría 2000-2024 Instituto Linus Pauling
1. Food and Nutrition Board, Institute of Medicine. Biotin. Dietary Reference Intakes: Thiamin, Riboflavin, Niacin, Vitamin B6, Vitamin B12, Pantothenic Acid, Biotin, and Choline. Washington, D.C.: National Academy Press; 1998:374-389. (National Academy Press)
2. Mock DM. Biotin. Handbook of vitamins. 4th ed. Boca Raton, FL: CRC Press; 2007:361-383.
3. Zempleni J, Teixeira DC, Kuroishi T, Cordonier EL, Baier S. Biotin requirements for DNA damage prevention. Mutat Res. 2012;733(1-2):58-60. (PubMed)
4. Saggerson D. Malonyl-CoA, a key signaling molecule in mammalian cells. Annu Rev Nutr. 2008;28:253-272. (PubMed)
5. Zempleni J, Wijeratne SSK, Kuroishi T. Biotin. In: Erdman JWJ, Macdonald IA, Zeisel SH, eds. Present Knowledge in Nutrition. 10th ed.: John Wiley & Sons, Inc.; 2012:359-374.
6. Zempleni J, Li Y, Xue J, Cordonier EL. The role of holocarboxylase synthetase in genome stability is mediated partly by epigenomic synergies between methylation and biotinylation events. Epigenetics. 2011;6(7):892-894. (PubMed)
7. Zempleni J, Gralla M, Camporeale G, Hassan YI. Sodium-dependent multivitamin transporter gene is regulated at the chromatin level by histone biotinylation in human Jurkat lymphoblastoma cells. J Nutr. 2009;139(1):163-166. (PubMed)
8. Mock DM. Biotin. In: Ross AC, Caballero B, Cousins RJ, Tucker KL, Ziegler TR, eds. Modern Nutrition in Health and Disease. 11th ed.: Lippincott Williams & Wilkins; 2014:390-398.
9. Baumgartner ER, Suormala T. Inherited defects of biotin metabolism. Biofactors. 1999;10(2-3):287-290. (PubMed)
10. Elrefai S, Wolf B. Disorders of biotin metabolism. In: Rosenberg RN, Pascual JM, eds. Rosenberg's Molecular and Genetic basis of Neurological and Psychiatric Disease. 5th ed. United States of America: Elsevier; 2015:531-539.
11. Sealey WM, Teague AM, Stratton SL, Mock DM. Smoking accelerates biotin catabolism in women. Am J Clin Nutr. 2004;80(4):932-935. (PubMed)
12. Perry CA, West AA, Gayle A, et al. Pregnancy and lactation alter biomarkers of biotin metabolism in women consuming a controlled diet. J Nutr. 2014;144(12):1977-1984. (PubMed)
13. Mock DM. Marginal biotin deficiency is common in normal human pregnancy and is highly teratogenic in mice. J Nutr. 2009;139(1):154-157. (PubMed)
14. Pabuccuoglu A, Aydogdu S, Bas M. Serum biotinidase activity in children with chronic liver disease and its clinical significance. J Pediatr Gastroenterol Nutr. 2002;34(1):59-62. (PubMed)
15. Zempleni J, Hassan YI, Wijeratne SS. Biotin and biotinidase deficiency. Expert Rev Endocrinol Metab. 2008;3(6):715-724. (PubMed)
16. Wolf B. Biotinidase deficiency: "if you have to have an inherited metabolic disease, this is the one to have." Genet Med. 2012;14(6):565-575. (PubMed)
17. Mardach R, Zempleni J, Wolf B, et al. Biotin dependency due to a defect in biotin transport. J Clin Invest. 2002;109(12):1617-1623. (PubMed)
18. Schulpis KH, Nyalala JO, Papakonstantinou ED, et al. Biotin recycling impairment in phenylketonuric children with seborrheic dermatitis. Int J Dermatol. 1998;37(12):918-921. (PubMed)
19. Eng WK, Giraud D, Schlegel VL, Wang D, Lee BH, Zempleni J. Identification and assessment of markers of biotin status in healthy adults. Br J Nutr. 2013;110(2):321-329. (PubMed)
20. Mock DM. Adequate intake of biotin in pregnancy: why bother? J Nutr. 2014;144(12):1885-1886. (PubMed)
21. Mock DM, Stadler DD. Conflicting indicators of biotin status from a cross-sectional study of normal pregnancy. J Am Coll Nutr. 1997;16(3):252-257. (PubMed)
22. Mock DM, Stadler DD, Stratton SL, Mock NI. Biotin status assessed longitudinally in pregnant women. J Nutr. 1997;127(5):710-716. (PubMed)
23. Mock DM, Quirk JG, Mock NI. Marginal biotin deficiency during normal pregnancy. Am J Clin Nutr. 2002;75(2):295-299. (PubMed)
24. Takechi R, Taniguchi A, Ebara S, Fukui T, Watanabe T. Biotin deficiency affects the proliferation of human embryonic palatal mesenchymal cells in culture. J Nutr. 2008;138(4):680-684. (PubMed)
25. Alfadhel M, Almuntashri M, Jadah RH, et al. Biotin-responsive basal ganglia disease should be renamed biotin-thiamine-responsive basal ganglia disease: a retrospective review of the clinical, radiological and molecular findings of 18 new cases. Orphanet J Rare Dis. 2013;8:83. (PubMed)
26. Sedel F, Bernard D, Mock DM, Tourbah A. Targeting demyelination and virtual hypoxia with high-dose biotin as a treatment for progressive multiple sclerosis. Neuropharmacology. 2015. (PubMed)
27. Sedel F, Papeix C, Bellanger A, et al. High doses of biotin in chronic progressive multiple sclerosis: a pilot study. Mult Scler Relat Disord. 2015;4(2):159-169. (PubMed)
28. Tourbah A LFC, Edan G, Clanet M, Papeix C, Vukusic S, et al. Effect of MD1003 (high doses of biotin) in progressive multiple sclerosis: results of a pivotal phase III randomized double blind placebo controlled study. Paper presented at: American Association of Neurological Surgeons (AANS) Annual Scientific Meeting 2015; Washington, D.C. Available at: http://www.neurology.org/content/84/14_Supplement/PL2.002. Accessed 9/17/15.
29. Larrieta E, Vega-Monroy ML, Vital P, et al. Effects of biotin deficiency on pancreatic islet morphology, insulin sensitivity and glucose homeostasis. J Nutr Biochem. 2012;23(4):392-399. (PubMed)
30. Maebashi M, Makino Y, Furukawa Y, Ohinata K, Kimura S, Sato T. Therapeutic evaluation of the effect of biotin on hyperglycemia in pateints with non-insulin dependent diabetes mellitus. J Clin Biochem Nutr. 1993;14:211-218.
31. Baez-Saldana A, Zendejas-Ruiz I, Revilla-Monsalve C, et al. Effects of biotin on pyruvate carboxylase, acetyl-CoA carboxylase, propionyl-CoA carboxylase, and markers for glucose and lipid homeostasis in type 2 diabetic patients and nondiabetic subjects. Am J Clin Nutr. 2004;79(2):238-243. (PubMed)
32. Revilla-Monsalve C, Zendejas-Ruiz I, Islas-Andrade S, et al. Biotin supplementation reduces plasma triacylglycerol and VLDL in type 2 diabetic patients and in nondiabetic subjects with hypertriglyceridemia. Biomed Pharmacother. 2006;60(4):182-185. (PubMed)
33. Geohas J, Daly A, Juturu V, Finch M, Komorowski JR. Chromium picolinate and biotin combination reduces atherogenic index of plasma in patients with type 2 diabetes mellitus: a placebo-controlled, double-blinded, randomized clinical trial. Am J Med Sci. 2007;333(3):145-153. (PubMed)
34. Albarracin C, Fuqua B, Geohas J, Juturu V, Finch MR, Komorowski JR. Combination of chromium and biotin improves coronary risk factors in hypercholesterolemic type 2 diabetes mellitus: a placebo-controlled, double-blind randomized clinical trial. J Cardiometab Syndr. 2007;2(2):91-97. (PubMed)
35. Singer GM, Geohas J. The effect of chromium picolinate and biotin supplementation on glycemic control in poorly controlled patients with type 2 diabetes mellitus: a placebo-controlled, double-blinded, randomized trial. Diabetes Technol Ther. 2006;8(6):636-643. (PubMed)
36. Albarracin CA, Fuqua BC, Evans JL, Goldfine ID. Chromium picolinate and biotin combination improves glucose metabolism in treated, uncontrolled overweight to obese patients with type 2 diabetes. Diabetes Metab Res Rev. 2008;24(1):41-51. (PubMed)
37. Suksomboon N, Poolsup N, Yuwanakorn A. Systematic review and meta-analysis of the efficacy and safety of chromium supplementation in diabetes. J Clin Pharm Ther. 2014;39(3):292-306. (PubMed)
38. Lazo de la Vega-Monroy ML, Larrieta E, German MS, Baez-Saldana A, Fernandez-Mejia C. Effects of biotin supplementation in the diet on insulin secretion, islet gene expression, glucose homeostasis and beta-cell proportion. J Nutr Biochem. 2013;24(1):169-177. (PubMed)
39. Randhawa SS, Dua K, Randhawa CS, Randhawa SS, Munshi SK. Effect of biotin supplementation on hoof health and ceramide composition in dairy cattle. Vet Res Commun. 2008;32(8):599-608. (PubMed)
40. Reilly JD, Cottrell DF, Martin RJ, Cuddeford DJ. Effect of supplementary dietary biotin on hoof growth and hoof growth rate in ponies: a controlled trial. Equine Vet J Suppl. 1998(26):51-57. (PubMed)
41. Zenker W, Josseck H, Geyer H. Histological and physical assessment of poor hoof horn quality in Lipizzaner horses and a therapeutic trial with biotin and a placebo. Equine Vet J. 1995;27(3):183-191. (PubMed)
42. Romero-Navarro G, Cabrera-Valladares G, German MS, et al. Biotin regulation of pancreatic glucokinase and insulin in primary cultured rat islets and in biotin-deficient rats. Endocrinology. 1999;140(10):4595-4600. (PubMed)
43. Floersheim GL. [Treatment of brittle fingernails with biotin]. Z Hautkr. 1989;64(1):41-48. (PubMed)
44. Hochman LG, Scher RK, Meyerson MS. Brittle nails: response to daily biotin supplementation. Cutis. 1993;51(4):303-305. (PubMed)
45. Boccaletti V, Zendri E, Giordano G, Gnetti L, De Panfilis G. Familial Uncombable Hair Syndrome: Ultrastructural Hair Study and Response to Biotin. Pediatr Dermatol. 2007;24(3):E14-16. (PubMed)
46. Famenini S, Goh C. Evidence for supplemental treatments in androgenetic alopecia. J Drugs Dermatol. 2014;13(7):809-812. (PubMed)
47. Staggs CG, Sealey WM, McCabe BJ, Teague AM, Mock DM. Determination of the biotin content of select foods using accurate and sensitive HPLC/avidin binding. J Food Compost Anal. 2004;17(6):767-776. (PubMed)
48. Briggs DR, Wahlqvist ML. Food facts: the complete no-fads-plain-facts guide to healthy eating. Victoria, Australia: Penguin Books; 1988.
49. Magnusdottir S, Ravcheev D, de Crecy-Lagard V, Thiele I. Systematic genome assessment of B-vitamin biosynthesis suggests co-operation among gut microbes. Front Genet. 2015;6:148. (PubMed)
50. Said HM. Cell and molecular aspects of human intestinal biotin absorption. J Nutr. 2009;139(1):158-162. (PubMed)
51. Natural-Medicines. Biotin/Drug interactions. http://www.naturaldatabase.com/. 2014 ed.; 2014
52. Koutsikos D, Agroyannis B, Tzanatos-Exarchou H. Biotin for diabetic peripheral neuropathy. Biomed Pharmacother. 1990;44(10):511-514. (PubMed)
53. Debourdeau PM, Djezzar S, Estival JL, Zammit CM, Richard RC, Castot AC. Life-threatening eosinophilic pleuropericardial effusion related to vitamins B5 and H. Ann Pharmacother. 2001;35(4):424-426. (PubMed)
54. Chirapu SR, Rotter CJ, Miller EL, Varma MV, Dow RL, Finn MG. High specificity in response of the sodium-dependent multivitamin transporter to derivatives of pantothenic acid. Curr Top Med Chem. 2013;13(7):837-842. (PubMed)
55. Said HM, Ortiz A, McCloud E, Dyer D, Moyer MP, Rubin S. Biotin uptake by human colonic epithelial NCM460 cells: a carrier-mediated process shared with pantothenic acid. Am J Physiol. 1998;275(5 Pt 1):C1365-1371. (PubMed)
56. Prasad PD, Wang H, Kekuda R, et al. Cloning and functional expression of a cDNA encoding a mammalian sodium-dependent vitamin transporter mediating the uptake of pantothenate, biotin, and lipoate. J Biol Chem. 1998;273(13):7501-7506. (PubMed)
57. Zempleni J, Trusty TA, Mock DM. Lipoic acid reduces the activities of biotin-dependent carboxylases in rat liver. J Nutr. 1997;127(9):1776-1781. (PubMed)
58. Castro-Gago M, Gomez-Lado C, Eiris-Punal J, Diaz-Mayo I, Castineiras-Ramos DE. Serum biotinidase activity in children treated with valproic acid and carbamazepine. J Child Neurol. 2010;25(1):32-35. (PubMed)
59. Castro-Gago M, Perez-Gay L, Gomez-Lado C, Castineiras-Ramos DE, Otero-Martinez S, Rodriguez-Segade S. The influence of valproic acid and carbamazepine treatment on serum biotin and zinc levels and on biotinidase activity. J Child Neurol. 2011;26(12):1522-1524. (PubMed)
60. Schulpis KH, Karikas GA, Tjamouranis J, Regoutas S, Tsakiris S. Low serum biotinidase activity in children with valproic acid monotherapy. Epilepsia. 2001;42(10):1359-1362. (PubMed)
61. Yilmaz Y, Tasdemir HA, Paksu MS. The influence of valproic acid treatment on hair and serum zinc levels and serum biotinidase activity. Eur J Paediatr Neurol. 2009;13(5):439-443. (PubMed)