Contenido
La tiamina es una vitamina hidrosoluble del complejo B, tambien conocida como vitamina B1 o aneurina (1). Aislada y caracterizada en la década de 1930, la tiamina fue uno de los primeros compuestos orgánicos en ser reconocido como una vitamina (2). La tiamina se encuentra en el cuerpo humano como tiamina libre y como varias formas fosforilada: tiamina monofosfato (TMP), tiamina trifosfato (TTP), y tiamina pirofosfato (TPP), conocida también como tiamina difosfato.
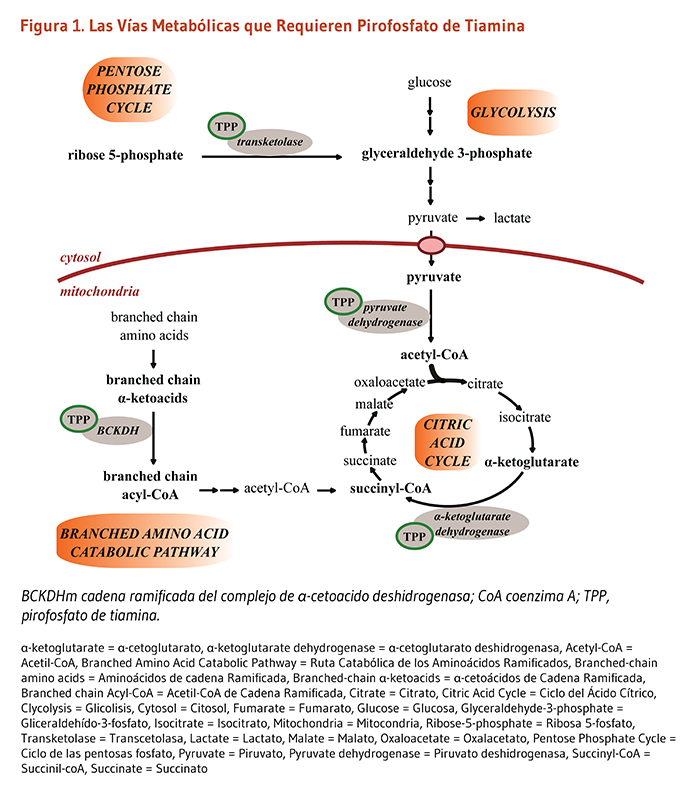
La síntesis de TPP de tiamina libre requiere magnesio, trifosfato de adenosina (ATP) y la enzima tiamina pyrophosphokinase. TPP se requiere como una coenzima para cuatro complexos enzimáticos de varios componentes asociados con el metabolismo de carbohidratos y cadenas ramificadas de aminoácidos.
Piruvato deshidrogenasa, α-cetoglutarato deshidrogenasa, y deshidrogenasa de α-cetoácidos de cadena ramificada, cada una comprende un complejo enzimático diferente encontrados al interior de organelos celulares llamados mitocondrias. Ellos catalizan la descarboxilación de piruvato, a-cetoglutarato, y aminoácidos de cadena ramificada para formar acetil-coenzima A, succinil-coenzima A, y derivados de aminoácidos de cadena ramificada, respectivamente. Todos estos productos juegan un papel crítico en la producción de energía de los alimentos a través de su conexión con el ciclo del ácido cítrico (Kreb) (2). Aminoacidos de cadena ramificada (BCAA) incluyen leucina, isoleucina, y valina, son eventualmente degradados en acetil-CoA y sucinil-CoA como combustible para el ciclo de ácido cítrico. El catabolismo de las tres BCAAs también contribuye a las producción de colesterol y dona nitrógeno para la síntesis de los neurotransmisores, glutamato y acido γ-aminobutírico (GABA) (3). Además de la coenzima de la tiamina (TTP), cada complejo deshidrogenasa necesita de una coenzima que contenga niacina (NAD), una enzima que contenga riboflavina (FAD), y ácido lipoico.
La transcetolasa cataliza reacciones fundamentales en otra vía metabólica que ocurre en el citosol conocida como la vía de las pentosas fosfato. Uno de los intermediarios más importantes de esta vía es la ribosa-5-fosfato, un azúcar fosforilado de 5 carbonos, necesario para la síntesis de ribonucleótidos tales como, ATP y guanosina trifosfato (GTP). Nucleicos son los bloques de construcción de acidos nucleicos, ADN y ARN. La via del fosfato de pentosa también suministra diversas vías anabólicas, incluyendo ácidos grasos, con la coenzima que contiene niacina (1, 4). Debido a que la transcetolasa disminuye con rapidez ante una deficiencia de tiamina, y a diferencia de la mayoría de enzimas dependientes de tiamina, está presente en las células rojas, se ha utilizado la medición de su actividad en eritrocitos para evaluar el estado nutricional de la tiamina (2).
El beriberi, la enfermedad causada por una deficiencia severa de tiamina, fue descrita en la literatura china ya en el 2600 A.C. La deficiencia de tiamina afecta el cardiovascular, muscular, gastrointestinal, y el sistema nervioso central y periférico (2). El beriberi dividido entre seco, húmedo cerebral, o gastrointestinal dependiendo de los sistemas afectados por la deficiencia severa de tiamina (1, 5).
La característica principal del beriberi seco (paralítico o nervioso) es la neuropatía periférica. Al inicio del transcurso de la neuropatía, podría tener lugar el "síndrome pies ardientes." Otros síntomas incluyen reflejos anormales (exagerados) así como también sensación disminuida y debilidad en brazos y piernas. También se han descrito dolores musculares, sensibilidad y dificultad al levantarse de una posición agachada (6).
Además de los síntomas neurológicos, el beriberi húmedo (cardiaco) se caracteriza por manifestaciones cardiovasculares de la deficiencia de tiamina, que incluyen ritmo cardiaco acelerado, agrandamiento del corazón, hinchazón severa (edema), dificultad para respirar, y en última instancia insuficiencia cardiaca congestiva. La literatura Japonesa describe la forma aguda fulminante del beriberi húmedo como "shoshin" (7).
El beriberi cerebral podría derivar en encefalopatía de Wernicke y psicosis de Korsakoff, especialmente en personas que abusan del alcohol. El diagnóstico de la encefalopatía de Wernicke se basa en una triada de señales, que incluye movimientos anormales del ojo, alteraciones de la postura y la marcha, la ataxia y deterioros cognitivos. Si no se trata el daño neurológico irreversible puede causar manifestaciones clínicas conocidas como la psicosis de Korsakoff. Este síndrome también conocido como demencia de Korsakoff, amnesia de Korsakoff, o síndrome amnésico confabulatoria implica un confuso estado apático y un trastorno profundo de la memoria, con amnesia severa y perdida de la memoria reciente y activa.
La deficiencia de tiamina que afecta al sistema nervioso central se define como la enfermedad de Wernicke cuando no se presenta el estado amnésico, y síndrome de Wernicke-Korsakoff (SWK) cuando se presentan los síntomas amnésicos junto a los trastornos del movimiento del ojo y la marcha. Las manifestaciones neurológicas más raras pueden incluir convulsiones (8). La mayoría de los que sufren de SWK son alcohólicos, aunque este síndrome se ha observado en otros trastornos de malnutrición grave, incluyendo cáncer al estómago y SIDA. Generalmente la administración de tiamina intravenosa a pacientes con SWK resulta en un rápido mejoramiento de los síntomas oculares, pero las mejoras en la coordinación motora y la memoria podrían ser menores, dependiendo de cuánto tiempo han estado presentes los síntomas. Evidencia reciente de activación aumentada de células inmunes y producción incrementada de radicales libres en las áreas del cerebro que son dañadas selectivamente, sugiere que el stress oxidativo juega un papel importante en la patología neurológica de la deficiencia de tiamina (9).
TPP es crítico para las reacciones metabólicas que utilizan glucosa en la glicolisis y el ciclo ácido cítrico (Figura 1). Una disminución en la actividad de enzimas dependientes de tiamina limita la conversión de piruvato a acetil-CoA y la utilización del ciclo acido critico, lo que lleva a la acumulación de piruvato y lactato. Acidosis láctico, una condición resultante de la acumulación de lactato, se asocia con nauseas, vomito, y dolor abdominal severo en un síndrome descrito como beriberi gastrointestinal (5).
La deficiencia de tiamina podría derivar de una ingesta de tiamina insuficiente, necesidad aumentada de tiamina, pérdida excesiva de tiamina desde el cuerpo, consumos de factores anti-tiamina en los alimentos o una combinación de estos factores.
El consumo insuficiente de tiamina es la causa principal de la deficiencia de tiamina en países subdesarrollados (2). La deficiencia de tiamina es común en poblaciones de bajos ingresos cuya dieta es alta en carbohidratos y baja en tiamina (por ejemplo, arroz blanqueado y pulido). Los infantes amamantados por madres con deficiencia de tiamina son propensos a desarrollar beriberi infantil. El alcoholismo, que se asocia con baja ingesta de tiamina, entre otros nutrientes, es la causa principal de la deficiencia de tiamina en países industrializados. Algunos de los condiciones no alcohólicas asociadas con WKS incluye anorexia, la cirugía bariatrica (cirugía para adelgazar) neoplasias gastrointestinales, y síndromes de mala absorción (10-13). Casos de encefalopia de Wernicke también se han relacionado a la falta de nutrición parental de suplementos vitamínicos (14, 15).
Las condiciones que derivan en un requerimiento aumentado de tiamina incluyen esfuerzo físico intenso, fiebre, embarazo, amamantamiento y crecimiento durante la adolescencia. Tales condiciones colocan a los individuos con ingesta marginal de tiamina en riesgo de desarrollar una deficiencia de tiamina sintomática. Pacientes con Malaria en el Sur de Asia, se descubrió que pacientes con malaria sufrían con más frecuencia de deficiencia severa de tiamina que individuos no infectados (16, 17). La infección con malaria conduce a un gran aumento en la demanda metabólica por glucosa. Debido a que la tiamina es requerida por las enzimas involucradas en el metabolismo de la glucosa, el stress inducido por una infección con malaria podría exacerbar una deficiencia de tiamina en individuos predispuestos. También se encontró en personas infectadas con VIH, aún si no han desarrollado SIDA, que se encontraban en un riesgo mayor de sufrir una deficiencia de tiamina (18). Además, el abuso crónico del alcohol perjudica la absorción intestinal y la utilización de la tiamina (1); por lo tanto, los alcohólicos tienen un requerimiento de tiamina aumentado. La deficiencia de tiamina se observada también como una complicación del síndrome de realimentación. La introducción de carbohidratos en individuos severamente hambreados conduce a un aumento de demanda por tiamina en glucolisis y el ciclo ácido cítrico que precipita la deficiencia de tiamina (19).
La pérdida excesiva de tiamina podría precipitar una deficiencia de tiamina. Mediante el aumento del flujo urinario, los diuréticos podrían evitar la reabsorción de tiamina en los riñones y aumentar su excreción en la orina (20, 21). El riesgo de la deficiencia de tiamina puede aumentar en pacientes tratados con diuréticos con una ingesta marginal de tiamina (22) y en individuos que reciben terapias de diuréticos a largo plazo (23). Los individuos con falla renal que necesitan de hemodiálisis pierden tiamina a un ritmo aumentado y están en riesgo de una deficiencia de tiamina (24). Los alcohólicos que mantienen una ingesta de fluidos altos y un ritmo de flujo urinario altos podrían también experimentar una pérdida incrementada de tiamina, exacerbando los efectos de una baja ingesta de tiamina (25).
La presencia de factores anti-tiamínicos (FAT) en los alimentos contribuye también al riesgo de una deficiencia de tiamina. Ciertas plantas contienen FAT, los que reaccionan con la tiamina formando un producto oxidado inactivo. Beber grandes cantidades de té y café (incluso descafeinado), así como mascar hojas de té y nueces de betel, se han asociado con disminución de tiamina en seres humanos debido a la presencia de FAT (26, 27). FAT incluye micotoxinas (índole) y tiaminases que degradan la tiamina de los alimentos. Las personas que habitualmente comen ciertos pescados de agua dulce crudos, mariscos y helechos crudos están en un riesgo más alto de sufrir una deficiencia de tiamina debido a que estos alimentos contienen tiaminasa, la que normalmente se inactiva por el calor al cocinarse (1). En Nigeria se ha asociado a un grave síndrome neurológico (ataxia estacional) con la deficiencia de tiamina provocada por una tiaminasa en los gusanos de seda Africanos, una comida rica en proteínas tradicional para algunos Nigerianos (28).
La IDR de tiamina, revisada en 1998por la Junta Directiva de Alimentación y Nutrición del Instituto de Medicinase basó en la prevención de su deficiencia en individuos generalmente sanos (29).
| Etapa de la Vida | Edad | Machos (mg/día) | Hembras (mg/día) |
|---|---|---|---|
| Infantes | 0-6 meses | 0.2 (IA) | 0.2 (IA) |
| Infantes | 7-12 meses | 0.3 (IA) | 0.3 (IA) |
| Niños | 1-3 años | 0.5 | 0.5 |
| Niños | 4-8 años | 0.6 | 0.6 |
| Niños | 9-13 años | 0.9 | 0.9 |
| Adolescentes | 14-18 años | 1.2 | 1.0 |
| Adultos | 19 años y más | 1.2 | 1.1 |
| Embarazo | Todas las edades | - | 1.4 |
| Período de lactancia | Todas las edades | - | 1.4 |
Un estudio transversal de 2,900 hombres y mujeres Australianos, de 49 años de edad o mayores, encontró que aquellos en el quintil más alto de ingesta de tiamina eran un 40% menos propensos a tener cataratas nucleares que aquellos en el quintil más bajo (30). Además, un estudio reciente en 480 mujeres Estadounidenses encontró que ingesta recomendada más altas de tiamina se asociaban inversamente con cambios en la opacificación de las lentes (cristalinos) en un periodo de cinco años (31). Sin embargo, las asociaciones de este estudio transversal aún deben ser aclaradas por estudios de causalidad.
Concentración plasmáticas bajas y el aclaramiento renal de tiamina alta se han observado en pacientes diabéticos en comparación con individuos saludables (32) lo que sugiere que individuaos con diabetes mellitus tipo 1 o tipo 2 tienen un mayor riesgo de deficiencia de tiamina. Dos transportadores de tiamina, transportador-1 (THTR-1) y THTR-2 están implicados en la absorción de tiamina por los enterocitos en el intestino delgado y de la re-absorción en los túbulos próximos de los riñones. Un estudio reciente sugiere que la hiperglicemia en pacientes diabéticos podría afectar la re-absorción de tiamina por la disminución de la expresión de transportadores de tiamina en los riñones (33). Por lo contrario, la deficiencia de tiamina parece dañar la función endocrinal normal del páncreas y exacerbar la hiperglicemia. Los primeros estudios mostraron que la síntesis y la secreción de la insulina fueron alteradas en las células endocrinas pancreáticas de ratas con deficiencia de tiamina (34, 35). En los seres humanos, la deficiencia de tiamina causada por mutaciones recesivas en el gen que codifica para THTR-1 conduce a diabetes mellitus en el síndrome de anemia megaloblastica sensible a tiamina.
En un estudio piloto aleatorizado, de doble ciego, los suplementos de dosis alta de tiamina (300 mg/día) fueron repartidos por seis semanas a individuos hyperglicemicos (ya intolerantes a la glucosa o con diagnostico reciente de diabetes tipo 2). La complementación de tiamina impidió cualquier aumento adicional de la glucosa en ayunas y niveles de insulina en comparación con el tratamiento con placebo, pero no redujo la hiperglicemia (36). Sin embargo, un estudio sugerio que la complementación de tiamina puede mejorar los niveles de glucosa en diabetes tipo 2 en las primeras etapas de la enfermedad (es decir, pre-diabéticos o principios de diabetes) (37).
Hiperglicemia crónica en individuos con diabetes mellitus contribuye a la patogénesis enfermedades micros vasculares. Daños vasculares relacionados con la diabetes pueden afectar el corazón (cardiomiopatía), riñones (nefropatía), retina (retinopatía) y el sistema nervioso periférico (neuropatía). En individuos con diabetes, la hiperglicemia altera la función de la medula ósea derivada de las células progenitoras endoteliales (CPE) que son críticas para el crecimiento de los vasos sanguíneos (38). Curiosamente, una ingesta diaria alta de tiamina en la dieta se correlaciono con mayor circulación de CPE y con una mejor salud del endotelio vascular en 88 individuos con diabetes tipo 2 (39). Inversamente asociado se ha encontrado entre las concentraciones plasmáticas de tiamina en pacientes con diabetes y la presencia de la molecula-1 de adhesión vascular soluble (sVCAM-1), un marcado de disfunción vascular (32, 40). Marcadores anteriores de nefropatía diabetes incluye la presencia de suero de albumina en la orina, conocida como micro-albuminuria. La administración de tiamina o benfotiamina (un derivado de tiamina) previno el desarrollo de complicaciones renales en ratas diabéticas químicamente inducidas (41). Un estudio aleatorizado, de doble ciego conducido a cabo en 40 pacientes tipo 2 con micro-albuminuria encontró que los complementos con altas dosis de tiamina (300 mg/día) disminuyen la excreción de albumina en orina en comparación con placebo durante un periodo de tres meses (40). Dado que el tratamiento de tiamina ha mostrado comprometedores resultados en células cultivadas y en modelos animales (42-44), los efectos de tiamina y derivados de las complicaciones vasculares deben ser examinados en pacientes con diabetes.
Algunas personas mayores están a un riesgo mayor de desarrollar deficiencia sub-clínica de tiamina secundaria a una dieta deficiente, reducción de la absorción gastrointestinal, y varias condiciones médicas (45, 46). Debido a que la deficiencia de tiamina puede derivar en una forma de demencia (síndrome de Wernicke-Korsakoff), se ha investigado su relación con la enfermedad de Alzheimer y a otras formas de demencia. La EA está caracterizado por la disminución de funciones cognitivas en las personas de edad avanzada, acompañado por características patológicas que incluyen deposiciones de placa β-amiloidea y ovillos formados por la proteína Tau fosforada (47). Utilizando la tomografía por emisión de positrones (TEP), se observó un metabolismo de glucosa reducido en los pacientes con la EA (48). Un estudio grande, multe-céntrico PET usando un radio marcador con analogía de glucosa, 18 F-Fluoro-desoxiglucosa (FDG), correlacionado con la reducción en el consumo FDG (un marcador sustituto para el metabolismo de la glucosa) con el grado de deterior cognitivo en pacientes con la EA. Este estudio que incluye 822 individuos mayores de 55 años de edad que eran cognitivamente normales n=299) se muestra un deterior cognitivo leve (n=405) o tenía la EA leve (=188), demostró que la utilización de glucosa cerebral podría predecir el progresión del deterioro cognitivo leve a EA (49). Curiosamente, un estudio longitudinal de nueve años asocio la presencia de diabetes mellitus en personas de edad avanzada (mayores de 55 años) con un aumento en el riesgo de desarrollo EA (50).
Una reducción en los procesos de tiamina dependiente en el cerebro puede alterar el metabolismo de glucosa en pacientes con EA (51), Un estudio de caso y control en 38 mujeres ancianas encontró que los niveles sanguíneos de tiamina (TPF), y (TMF) eran más bajos en aquellos con demencia tipo Alzheimer (DTA) comparado aquellos en el grupo control (52). Por otra parte, varios investigadores han encontrado evidencia de actividad disminuida de las enzimas dependientes de TPP, a-cetoglutarato deshidrogenasa y transcetolasa, en los cerebros de pacientes que murieron de EA (53). El hallazgo de niveles cerebrales de TPF disminuidos en la presencia de niveles normales de tiamina libre y TMF sugiere modificaciones en la síntesis TPP en lugar de escasas biodisponibilidad de tiamina. Sin embargo no está claro si las actividades de las enzimas que metabolizan TPP (incluyendo tiamina pyrophophokinase) son alteradas en pacientes con EA (54, 55). Administración crónica de tiamina derivad de benfotiamina alivio alteraciones cognitivas y disminuyo el número de placas β-amiloidea en un modelo de ratón de ED sin aumentar los nivels de TMP y TPP en el cerebro. Esto sugiere que los efectos beneficiosos de la benfotiamina en el cerebro fueron probablemente mediados por la estimulación de las vías independientes de TPP (56).
La deficiencia de tiamina ha sido relacionada con el aumento de producción de β-amiloidea en células neurales cultivadas y para la formación de placas en modelos de animales (57, 58). Estas características patológicas de la EA pueden ser reversibles por la complementación de tiamina sugiriendo que la tiamina puede tener un efecto protector en AE. Por otra parte, otros desordenes incluyen las disfunción mitocondrial, y el estrés oxidativo crónico se han relacionada con la deficiencia de tiamina y la patogénesis y la progresión de EA (9, 59). Actualmente, sólo hay evidencia escasa e inconsistente de que los suplementos con tiamina sean beneficiosos en la EA. Un estudio de doble ciego controlado con placebo de 15 pacientes (10 completaron el estudio) no informó de ningún efecto benéfico de 3 gramos de tiamina al día sobre el deterioro cognitivo en un periodo de 12 meses (60). Un reporte preliminar de otro estudio informó de un leve beneficio de 3 a 8 gramos de tiamina por día en DTA, sin embargo no hay información adicional disponible sobre dicho estudio (61). Se reportó un leve efecto benéfico en pacientes con EA luego de 12 semanas de tratamiento con 100 mg/día de un derivado de la tiamina (disulfuro tetrahidrofurfuril tiamina), sin embargo, este estudio no fue controlado con placebo (62). Una revisión sistemática de ensayos aleatorizados, de doble ciego y controlados con placebo de tiamina en pacientes con DTA, no encontró evidencia de que la tiamina fuera un tratamiento útil para los síntomas de la enfermedad de Alzheimer (63).
La deficiencia severa de tiamina (beriberi húmedo) puede derivar en función cardiaca deteriorada y, en última instancia, en insuficiencia cardiaca congestiva (ICC). Aunque las manifestaciones cardiacas del beriberi se observan muy rara vez en países industrializados, la ICC debida a otras causas es común, especialmente entre los ancianos. Los diuréticos utilizados en el tratamiento de la ICC, en particular la furosemida (Lasix), incrementan la excreción de tiamina, conduciendo potencialmente a una deficiencia marginal de tiamina (64). Una serie de estudios han examinado el estado nutricional de la tiamina en pacientes con ICC y la mayoría descubrió una incidencia bastante baja de deficiencia de tiamina, medida a través de ensayos de actividad transcetolasa. Al igual que en la población general, se descubrió que los paciente con ICC más viejos están en un riesgo más alto de sufrir una deficiencia de tiamina que los más jóvenes (65). La fracción de eyección del ventrículo izquierdo (FEVI) es una medida importante de la función cardiaca en ICC, la que puede ser evaluada por medio de un ecocardiograma. Un estudio en 25 pacientes descubrió que el uso de furosemida, en dosis de 80 mg/día o más altas, se asociaba con un 98% de prevalencia de la deficiencia de tiamina (23). En un estudio aleatorizado y de doble ciego, de 30 pacientes con ICC, de los cuales todos habían estado tomando furosemida (80 mg/día) por al menos tres meses, la terapia con tiamina intravenosa (IV) (200 mg/día) por siete días dio como resultado una mejora en la FEVI comparado con la terapia de placebo IV (66). Cuando cada uno de los 30 pacientes con ICC en ese estudio recibió subsecuentemente seis semanas de terapia con tiamina oral (200 mg/día), el promedio de la FEVI mejoró en 22%. Este hallazgo podría ser relevante debido a que se han asociado las mejoras en la FEVI con una mejor supervivencia en pacientes con ICC (67). Sin embargo, las conclusiones de los estudios publicados hasta la fecha son limitadas, debido al pequeño tamaño de los grupos de muestra de estos estudios, a la falta de aleatorización en algunos de ellos, y a la necesidad de ensayos más precisos del estado nutricional de la tiamina. En la actualidad, la necesidad de la suplementación con tiamina en la mantención de la función cardiaca en pacientes con ICC.
Se ha visto deficiencia de tiamina en algunos pacientes con cancer con tumores de crecimiento rápido. La investigación en células de cultivo y en modelos animales señala que las células cancerígenas que se dividen rápidamente tienen un requerimiento de tiamina elevado (68). Todas las células que se dividen rápidamente necesitan ácidos nucleicos a un ritmo aumentado, y algunas células cancerígenas parecen depender fuertemente en la enzima dependiente de TPP, transcetolasa, para proveer la ribosa-5-fosfato necesaria para la síntesis de ácidos nucleicos. Un reciente estudio encontró que los niveles de THTR-1 transcetolasa, y TPP transportadores mitocondriales se aumentos en muestras de tejido humano con cáncer de mama a comparación de tejido normal, sugiriendo, una adaptación en la homeostasis de la tiamina en apoyo del metabolismo del cáncer (69). La suplementación con tiamina es común en pacientes con cáncer para prevenir una deficiencia de tiamina, pero Boros et al. advierten que demasiada tiamina podría de hecho estimular el crecimiento de algunos tumores malignos (70), sugiriendo que la suplementación con tiamina se reserve para aquellos pacientes con cáncer que sean efectivamente deficientes de tiamina. En la actualidad no existe evidencia disponible de estudios en humanos que apoye o refute esta teoría. Sin embargo, sería prudente que las personas con cáncer que estén considerando la suplementación con tiamina lo discutieran con el médico a cargo de su terapia contra el cáncer.
La suplementación de tiamina está incluida en el manejo clínico de las enfermedades dietéticas que afectan el metabolismo de carbohidratos y aminoácidos de cadena ramificada (BCAAs).
Deficiencia del complejo piruvato deshidrogenasa de tiamina sensible
Las mutaciones en PDHC previenen la oxidación eficiente de carbohidratos en individuos afectados. Deficiencia de PDHC es caracterizada comúnmente por acidosis láctica, la degeneración neurológica y muscular, y muerte en la infancia. Los pacientes que responden al tratamiento de la tiamina (de pocos mg/día a dosis superiores a 1,000 mg/día) presentan deficiencia de PDHC debido a la disminución de la afinidad de PDHC de TPP (71, 72). Aunque la complementación de vitamina puede reducir la acumulación de lactato y mejorar las características clínicas en pacientes que respondan a la tiamina, esto no constituye una cura (73).
Errores innatos de BCAA metabolismo conducen a la tiamina sensible ketoaciduria de cadena ramificada, también conocida como enfermedad de orina olor a jarabe de Arce. Las alteraciones en la BCAA vía catabólica resultado de la disfunción por la acumulación de BCAAs y sus derivados, ketoacidos de cadena ramificada. El enfoque terapéutico incluye una dienta con una contenido reducido de BCAA y tiamina (10-1,000 mg/día) se complementa a los pacientes con mutaciones en la subunidad E2 del complejo BCKDH (74). En individuos sensibles a la tiamina, la complementación ha demostrado ser eficaz para corregir el fenotipo sin recurrir a la BCAA dieta restringida.
Mutaciones en THTR-1 que deterioran la absorción de la tiamina intestinal y causan deficiencia de tiamina se ha encontrado en pacientes con anemia megaloblastica sensibles a la tiamina. Este síndrome es caracterizado por anemia megaloblastica, diabetes mellitus, y la sordera. Una revisión de 30 casos reporto neurológicos adicionales, visual, y deterioro cardiaco (75). Dosis orales de tiamina (hasta 300 mg/día) mantiene la salud y corrige la hiperglicemia en niños pre-púberes. Sin embargo, después de la pubertad, a un deterioro en la función del páncreas resulta en requisito de la insulina junto con tiamina para controlar la hiperglicemia. Un estudio también reporto que el tratamiento de una niña de cuatro meses de edad, con 100 mg/dia de tiamina no evito la pérdida de audición a los 20 meses de edad (76).
Enfermedad de los ganglios basales de biotina sensible, también nombrada síndrome-2 de disfunción de tiamina, es causada por mutaciones en el código genético para THTR-2. Las características clínicas aparecen alrededor de tres y cuatro años de edad e incluye encefalopatía subaguda (confusión, somnolencia, alteración del nivel de conciencia) ataxia y convulsiones. Un estudio retrospectivo de 18 individuos afectados de la misma familia o de la misma tribu en Arabia Saudita fue conducido reciente. Los datos mostrados que la monoterapia de biotina (5-10 mg/kg/día) abolió efectivamente las manifestaciones clínicas de la enfermedad, aunque un tercio de las pacientes sufrieron de crisis agudas recurrentes. A menudo se asocia con malos resultados, crisis agudas no fueron observados después de que la complementación de tiamina comenzó 300-400 mg/día) y durante un periodo de cinco años. El tratamiento precoz y tratamiento inmediato con biotina y tiamina conducen a resultados positivos (77).
Los seres humanos obtienen tiamina a partir de fuentes dietéticas y de la microflora del colon, aunque la contribución de este último no es claro con respecto de la necesidad de tiamina del cuerpo (78).
Una dieta variada debería aportar a la mayoría de las personas la tiamina suficiente para prevenir su deficiencia. En los EE.UU. la ingesta recomendada promedio de tiamina para hombres adultos jóvenes es cercana a los 2 mg/día, y 1.2 mg/día para mujeres adultas jóvenes. Una encuesta en personas sobre los 60 años de edad se encontró con una ingesta recomendada promedio de tiamina de 1.4 mg/día para hombres y 1.1 mg/día para mujeres (29). Sin embargo, tanto la institucionalización como la pobreza aumentan la probabilidad de una ingesta de tiamina insuficiente en los adultos mayores (79). Los cereales de grano entero, las legumbres (por ejemplo, porotos y lentejas), los frutos secos, el cerdo magro, y la levadura son fuentes ricas en tiamina (1). Debido a que la mayoría de la tiamina se pierde durante la producción de la harina blanca y del arroz blanqueado y pulido, el arroz blanco y los alimentos hechos a base harina blanca (por ejemplo, pan y tallarines) se fortifican con tiamina en mucho países occidentales. La siguiente tabla muestra una serie de alimentos ricos en tiamina junto a su contenido en miligramos (mg). Para mayor información sobre el contenido de nutrientes de los alimentos, consulte la base de datos de composición de los alimentos del USDA (80).
| Alimento | Porción | Tiamina (mg) |
|---|---|---|
| Lentejas (cocidas, hervidas) | ½ taza | 0.17 |
| Arvejas (cocidas, hervidas y escurridas) | ½ taza | 0.21 |
| Arroz integral grano largo (cocido) | 1 taza | 0.19 |
| Arroz blanco grano largo, enriquecido (cocido) | 1 taza | 0.26 |
| Arroz blanco grano largo, no enriquecido (cocido) | 1 taza | 0.04 |
| Pan de trigo entero | 1 rebanada | 0.10 |
| Pan blanco, enriquecido | 1 rebanada | 0.23 |
| Cereal de desayuno fortificado | 1 taza | 0.31 |
| Cereal de desayuno de germen de trigo (tostados claro) | 1 taza | 1.88 |
| Cerdo, magro (lomo, filete, cocido, rostisado) | 3 onzas* | 0.81 |
| Pacanas | 1 onza | 0.19 |
| Espinaca (cocida, hervidas, escurridas) | ½ taza | 0.09 |
| Naranja | 1 fruta | 0.11 |
| Melón calameño (cantalupo) | ½ fruta | 0.11 |
| Leche | 1 taza | 0.10 |
| Huevo (cocido) | 1 grande | 0.03 |
| *Una porción de tres onzas de carnes es del tamaño de una baraja de cartas | ||
La tiamina se encuentra disponible en suplementos nutricionales, y, para la fortificación, como clorhidrato de tiamina y nitrato de tiamina (81).
La Junta de Nutrición y Alimentos no estableció un nivel máximo de ingesta de ingesta tolerable (NM) para la tiamina debido a que no existen efectos tóxicos bien establecidos producto del excesivo consumo de tiamina a través de los alimentos o a través de la suplementación oral a largo plazo (hasta 200 mg/día). Se ha visto un número pequeño de reacciones anafilácticas con riesgo vital con grandes dosis intravenosas de tiamina (29).
Se han reportado niveles sanguíneos de tiamina reducidos en individuos con trastornos convulsivos (epilepsia) tomando el medicamento anticonvulsivo, fenitoina, por periodos largos de tiempo (82). El 5-Fluorouracil, un medicamento utilizado en la terapia contra el cáncer, inhibe la fosforilación de la tiamina a TPP (83). Los diuréticos, especialmente la furosemida (Lasix), podría incrementar el riesgo de una deficiencia de tiamina en personas con ingestas marginales de tiamina debido a una excreción urinaria de tiamina aumentada (21). Más aún, se asocia al abuso crónico del alcohol con deficiencia de tiamina debido a una baja ingesta recomendada, absorción y utilización deterioradas, y excreción incrementada de esta vitamina (1). La alimentación crónica de alcohol a ratas mostro una disminución en la absorción active de tiamina relacionada con la inhibición de los transportadores de membranas de tiamina THTR-1 en el epitelio intestinal (84). El consume de alcohol en ratas también disminuyo los nivels de THTR-1 y THTH-2 en las células epiteliales renales, limitando de este modo la reabsorción por los riñones (85).
El Instituto Linus Pauling apoya la recomendación de la Junta de Nutrición y Alimentos de 1.2 mg de tiamina al día para hombres y 1.1 mg/día para mujeres. Una dieta variada debería aportar tiamina suficiente a la mayoría de las personas. Siguiendo la recomendación del Instituto Linus Pauling de tomar diariamente un suplemento multivitamínico/mineral que contenga el 100% del Valor Diario (VD), se asegurará una ingesta de al menos 1.5 mg de tiamina al día.
Actualmente no existe evidencia de que el requerimiento de tiamina sea mayor en adultos mayores, pero algunos estudios han encontrado que la ingesta recomendada insuficiente y la insuficiencia de tiamina son más comunes en poblaciones ancianas (79). Por lo tanto, sería prudente para los adultos mayores tomar un suplemento multivitamínico/mineral, el que aportará, generalmente, al menos 1.5 mg/día de tiamina.
Escrito en 2000 por:
Jane Higdon, Ph.D.
Instituto Linus Pauling
Universidad Estatal de Oregon
Actualizado en Septiembre de 2002 por:
Jane Higdon, Ph.D.
Instituto Linus Pauling
Universidad Estatal de Oregon
Actualizado en Junio de 2007 por:
Victoria J. Drake, Ph.D.
Instituto Linus Pauling
Universidad Estatal de Oregon
Actualizado en Junio de 2013 por:
Barbara Delage, Ph.D.
Instituto Linus Pauling
Universidad Estatal de Oregon
Revisado en Junio de 2013 por:
Christopher Bates, D.Phil.
Científico Senior Honor
Formerly Head of Micronutrient Status Research
MRC Human Nutrition Research
Elsie Widdowson Laboratorio
Cambridge, UK
Traducido al Español en 2013 por:
Guillermo Sandoval, Facultad de Odontologia, Universidad de Chile;
Revisado y editado en Diciembre 2012 por:
Andrew F.G. Quest, Ph.D. y Lisette Leyton, Ph.D.,
Profesores Titulares del Instituto de Ciencias Biomédicas,
Facultad de Medicina, Universidad de Chile,
en el marco del proyecto Anillo #ACT1111, grupo NEMESIS.
La traducción de el MIC del Inglés al Español fue asegurado, en parte, por una subvención de Bayer Consumer Care AG, Basel, Switzerland.
Derechos de autoría 2000-2024 Instituto Linus Pauling
1. Tanphaichitr V. Thiamin. In: Shils M, Olson JA, Shike M, Ross AC, eds. Modern Nutrition in Health and Disease. 9th ed. Baltimore: Williams & Wilkins; 1999:381-389.
2. Rindi G. Thiamin. In: Ziegler EE, Filer LJ, eds. Present Knowledge in Nutrition. 7th ed. Washington D.C.: ILSI Press; 1996:160-166.
3. Hutson SM, Sweatt AJ, Lanoue KF. Branched-chain [corrected] amino acid metabolism: implications for establishing safe intakes. J Nutr. 2005;135(6 Suppl):1557S-1564S. (PubMed)
4. Brody T. Nutritional Biochemistry. 2nd ed. San Diego: Academic Press; 1999.
5. Donnino M. Gastrointestinal beriberi: a previously unrecognized syndrome. Ann Intern Med. 2004;141(11):898-899. (PubMed)
6. McDowell L. Thiamin. In: Vitamins in Animal and Human Nutrition. 2nd ed. Ames: Iowa State University Press; 2000:265-310. Available at: http://www.ucv.ve/fileadmin/user_upload/facultad_agronomia/Producion_
Animal/Vitamins_in_Animal_and_Human_Nutrition.pdf
7. Yamasaki H, Tada H, Kawano S, Aonuma K. Reversible pulmonary hypertension, lactic acidosis, and rapidly evolving multiple organ failure as manifestations of shoshin beriberi. Circ J. 2010;74(9):1983-1985. (PubMed)
8. Doss A, Mahad D, Romanowski CA. Wernicke encephalopathy: unusual findings in nonalcoholic patients. J Comput Assist Tomogr. 2003;27(2):235-240. (PubMed)
9. Hazell AS, Faim S, Wertheimer G, Silva VR, Marques CS. The impact of oxidative stress in thiamine deficiency: a multifactorial targeting issue. Neurochem Int. 2013;62(5):796-802. (PubMed)
10. Saad L, Silva LF, Banzato CE, Dantas CR, Garcia C, Jr. Anorexia nervosa and Wernicke-Korsakoff syndrome: a case report. J Med Case Rep. 2010;4:217. (PubMed)
11. Becker DA, Balcer LJ, Galetta SL. The Neurological Complications of Nutritional Deficiency following Bariatric Surgery. J Obes. 2012;2012:608534. (PubMed)
12. Jung ES, Kwon O, Lee SH, et al. Wernicke's encephalopathy in advanced gastric cancer. Cancer Res Treat. 2010;42(2):77-81. (PubMed)
13. Greenspon J, Perrone EE, Alaish SM. Shoshin beriberi mimicking central line sepsis in a child with short bowel syndrome. World journal of pediatrics : World J Pediatr. 2010;6(4):366-368. (PubMed)
14. Sequeira Lopes da Silva JT, Almaraz Velarde R, Olgado Ferrero F, et al. Wernicke's encephalopathy induced by total parental nutrition. Nutr Hosp. 2010;25(6):1034-1036. (PubMed)
15. Francini-Pesenti F, Brocadello F, Manara R, Santelli L, Laroni A, Caregaro L. Wernicke's syndrome during parenteral feeding: not an unusual complication. Nutrition. 2009;25(2):142-146. (PubMed)
16. Krishna S, Taylor AM, Supanaranond W, et al. Thiamine deficiency and malaria in adults from southeast Asia. Lancet. 1999;353(9152):546-549. (PubMed)
17. Mayxay M, Taylor AM, Khanthavong M, et al. Thiamin deficiency and uncomplicated falciparum malaria in Laos. Trop Med Int Health. 2007;12(3):363-369. (PubMed)
18. Muri RM, Von Overbeck J, Furrer J, Ballmer PE. Thiamin deficiency in HIV-positive patients: evaluation by erythrocyte transketolase activity and thiamin pyrophosphate effect. Clin Nutr. 1999;18(6):375-378. (PubMed)
19. Stanga Z, Brunner A, Leuenberger M, et al. Nutrition in clinical practice-the refeeding syndrome: illustrative cases and guidelines for prevention and treatment. Eur J Clin Nutr. 2008;62(6):687-694. (PubMed)
20. Suter PM, Haller J, Hany A, Vetter W. Diuretic use: a risk for subclinical thiamine deficiency in elderly patients. J Nutr Health Aging. 2000;4(2):69-71. (PubMed)
21. Rieck J, Halkin H, Almog S, et al. Urinary loss of thiamine is increased by low doses of furosemide in healthy volunteers. J Lab Clin Med. 1999;134(3):238-243. (PubMed)
22. Sica DA. Loop diuretic therapy, thiamine balance, and heart failure. Congestive heart failure 2007;13(4):244-247. (PubMed)
23. Zenuk C, Healey J, Donnelly J, Vaillancourt R, Almalki Y, Smith S. Thiamine deficiency in congestive heart failure patients receiving long term furosemide therapy. Can J Clin Pharmacol. 2003;10(4):184-8. (PubMed)
24. Hung SC, Hung SH, Tarng DC, Yang WC, Chen TW, Huang TP. Thiamine deficiency and unexplained encephalopathy in hemodialysis and peritoneal dialysis patients. Am J Kidney Dis. 2001;38(5):941-947. (PubMed)
25. Wilcox CS. Do diuretics cause thiamine deficiency? J Lab Clin Med. 1999;134(3):192-193.
26. Vimokesant SL, Hilker DM, Nakornchai S, Rungruangsak K, Dhanamitta S. Effects of betel nut and fermented fish on the thiamin status of northeastern Thais. Am J Clin Nutr. 1975;28(12):1458-1463. (PubMed)
27. Ventura A, Mafe MC, Bourguet M, Tornero C. Wernicke's encephalopathy secondary to hyperthyroidism and ingestion of thiaminase-rich products. Neurologia. 2013;28(4):257-259. (PubMed)
28. Nishimune T, Watanabe Y, Okazaki H, Akai H. Thiamin is decomposed due to Anaphe spp. entomophagy in seasonal ataxia patients in Nigeria. J Nutr. 2000;130(6):1625-1628. (PubMed)
29. Food and Nutrition Board, Institute of Medicine. Thiamin. Dietary Reference Intakes: Thiamin, Riboflavin, Niacin, Vitamin B6, Vitamin B12, Pantothenic Acid, Biotin, and Choline. Washington D.C.: National Academy Press; 1998:58-86. (National Academy Press)
30. Cumming RG, Mitchell P, Smith W. Diet and cataract: the Blue Mountains Eye Study. Ophthalmology. 2000;107(3):450-456. (PubMed)
31. Jacques PF, Taylor A, Moeller S, et al. Long-term nutrient intake and 5-year change in nuclear lens opacities. Arch Ophthalmol. 2005;123(4):517-526. (PubMed)
32. Thornalley PJ, Babaei-Jadidi R, Al Ali H, et al. High prevalence of low plasma thiamine concentration in diabetes linked to a marker of vascular disease. Diabetologia. 2007;50(10):2164-2170. (PubMed)
33. Larkin JR, Zhang F, Godfrey L, et al. Glucose-induced down regulation of thiamine transporters in the kidney proximal tubular epithelium produces thiamine insufficiency in diabetes. PLoS One. 2012;7:e53175. (PubMed)
34. Rathanaswami P, Sundaresan R. Effects of thiamine deficiency on the biosynthesis of insulin in rats. Biochem Int. 1991;24(6):1057-1062. (PubMed)
35. Rathanaswami P, Pourany A, Sundaresan R. Effects of thiamine deficiency on the secretion of insulin and the metabolism of glucose in isolated rat pancreatic islets. Biochem Int. 1991;25(3):577-583. (PubMed)
36. Alaei Shahmiri F, Soares MJ, Zhao Y, Sherriff J. High-dose thiamine supplementation improves glucose tolerance in hyperglycemic individuals: a randomized, double-blind cross-over trial. Eur J Clin Nutr. 2013. May 29 [Epub ahead of print] (PubMed)
37. Gonzalez-Ortiz M, Martinez-Abundis E, Robles-Cervantes JA, Ramirez-Ramirez V, Ramos-Zavala MG. Effect of thiamine administration on metabolic profile, cytokines and inflammatory markers in drug-naive patients with type 2 diabetes. Eur J Clin Nutr. 2011;50(2):145-149. (PubMed)
38. Tepper OM, Galiano RD, Capla JM, et al. Human endothelial progenitor cells from type II diabetics exhibit impaired proliferation, adhesion, and incorporation into vascular structures. Circulation. 2002;106(22):2781-2786. (PubMed)
39. Wong CY, Qiuwaxi J, Chen H, et al. Daily intake of thiamine correlates with the circulating level of endothelial progenitor cells and the endothelial function in patients with type II diabetes. Mol Nutr Food Res. 2008;52(12):1421-1427. (PubMed)
40. Rabbani N, Alam SS, Riaz S, et al. High-dose thiamine therapy for patients with type 2 diabetes and microalbuminuria: a randomised, double-blind placebo-controlled pilot study. Diabetologia. 2009;52(2):208-212. (PubMed)
41. Babaei-Jadidi R, Karachalias N, Ahmed N, Battah S, Thornalley PJ. Prevention of incipient diabetic nephropathy by high-dose thiamine and benfotiamine. Diabetes. 2003;52(8):2110-2120. (PubMed)
42. Hammes HP, Du X, Edelstein D, et al. Benfotiamine blocks three major pathways of hyperglycemic damage and prevents experimental diabetic retinopathy. Nature Med. 2003;9(3):294-299. (PubMed)
43. Varkonyi T, Kempler P. Diabetic neuropathy: new strategies for treatment. Diabetes Obes Metab. 2008;10(2):99-108. (PubMed)
44. Kohda Y, Shirakawa H, Yamane K, et al. Prevention of incipient diabetic cardiomyopathy by high-dose thiamine. J Toxicol Sci. 2008;33(4):459-472. (PubMed)
45. Lee DC, Chu J, Satz W, Silbergleit R. Low plasma thiamine levels in elder patients admitted through the emergency department. Acad Emerg Med. 2000;7(10):1156-1159. (PubMed)
46. Ito Y, Yamanaka K, Susaki H, Igata A. A cross-investigation between thiamin deficiency and the physical condition of elderly people who require nursing care. J Nutr Sci Vitaminol. 2012;58(3):210-216. (PubMed)
47. Prvulovic D, Hampel H. Amyloid beta(A-beta) and phospho-tau (p-tau) as diagnostic biomarkers in Alzheimer's disease. Clin Chem Lab Med. 2011;49:367-374. (PubMed)
48. Kish SJ. Brain energy metabolizing enzymes in Alzheimer's disease: alpha-ketoglutarate dehydrogenase complex and cytochrome oxidase. Ann N Y Acad Sci. 1997;826:218-228. (PubMed)
49. Langbaum JB, Chen K, Lee W, et al. Categorical and correlational analyses of baseline fluorodeoxyglucose positron emission tomography images from the Alzheimer's Disease Neuroimaging Initiative (ADNI). NeuroImage. 2009;45(4):1107-1116. (PubMed)
50. Arvanitakis Z, Wilson RS, Bienias JL, Evans DA, Bennett DA. Diabetes mellitus and risk of Alzheimer disease and decline in cognitive function. Arch Neurol. 2004;61(5):661-666. (PubMed)
51. Gibson GE, Hirsch JA, Cirio RT, Jordan BD, Fonzetti P, Elder J. Abnormal thiamine-dependent processes in Alzheimer's Disease. Lessons from diabetes. Mol Cell Neurosci. 2013;55:17-25. (PubMed)
52. Glaso M, Nordbo G, Diep L, Bohmer T. Reduced concentrations of several vitamins in normal weight patients with late-onset dementia of the Alzheimer type without vascular disease. J Nutr Health Aging. 2004;8(5):407-413. (PubMed)
53. Bender DA. Optimum nutrition: thiamin, biotin and pantothenate. Proc Nutr Soc. 1999;58(2):427-433. (PubMed)
54. Mastrogiacoma F, Bettendorff L, Grisar T, Kish SJ. Brain thiamine, its phosphate esters, and its metabolizing enzymes in Alzheimer's disease. Ann Neurol. 1996;39(5):585-591. (PubMed)
55. Heroux M, Raghavendra Rao VL, Lavoie J, Richardson JS, Butterworth RF. Alterations of thiamine phosphorylation and of thiamine-dependent enzymes in Alzheimer's disease. Metab Brain Dis. 1996;11(1):81-88. (PubMed)
56. Pan X, Gong N, Zhao J, et al. Powerful beneficial effects of benfotiamine on cognitive impairment and beta-amyloid deposition in amyloid precursor protein/presenilin-1 transgenic mice. Brain. 2010;133(Pt 5):1342-1351. (PubMed)
57. Karuppagounder SS, Xu H, Shi Q, et al. Thiamine deficiency induces oxidative stress and exacerbates the plaque pathology in Alzheimer's mouse model. Neurobiol Aging. 2009;30(10):1587-1600. (PubMed)
58. Zhang Q, Yang G, Li W, et al. Thiamine deficiency increases beta-secretase activity and accumulation of beta-amyloid peptides. Neurobiol Aging. 2011;32(1):42-53. (PubMed)
59. Dumont M, Beal MF. Neuroprotective strategies involving ROS in Alzheimer disease. Free Rad Res Med. 2011;51(5):1014-1026. (PubMed)
60. Nolan KA, Black RS, Sheu KF, Langberg J, Blass JP. A trial of thiamine in Alzheimer's disease. Arch Neurology. 1991;48(1):81-83. (PubMed)
61. Meador K, Loring D, Nichols M, et al. Preliminary findings of high-dose thiamine in dementia of Alzheimer's type. J Geriatr Psychiatry Neurol. 1993;6(4):222-229. (PubMed)
62. Mimori Y, Katsuoka H, Nakamura S. Thiamine therapy in Alzheimer's disease. Metab Brain Dis. 1996;11(1):89-94. (PubMed)
63. Rodriguez-Martin JL, Qizilbash N, Lopez-Arrieta JM. Thiamine for Alzheimer's disease (Cochrane Review). Cochrane Database Syst Rev. 2001;2:CD001498. (PubMed)
64. Hanninen SA, Darling PB, Sole MJ, Barr A, Keith ME. The prevalence of thiamin deficiency in hospitalized patients with congestive heart failure. J Am Coll Cardiol. 2006;47(2):354-361. (PubMed)
65. Wilkinson TJ, Hanger HC, George PM, Sainsbury R. Is thiamine deficiency in elderly people related to age or co-morbidity? Age Ageing. 2000;29(2):111-116. (PubMed)
66. Shimon I, Almog S, Vered Z, et al. Improved left ventricular function after thiamine supplementation in patients with congestive heart failure receiving long-term furosemide therapy. Am J Med. 1995;98(5):485-490. (PubMed)
67. Leslie D, Gheorghiade M. Is there a role for thiamine supplementation in the management of heart failure? Am Heart J. 1996;131(6):1248-1250.
68. Comin-Anduix B, Boren J, Martinez S, et al. The effect of thiamine supplementation on tumour proliferation. A metabolic control analysis study. Eur J Biochem. 2001;268(15):4177-4182. (PubMed)
69. Zastre JA, Hanberry BS, Sweet RL, et al. Up-regulation of vitamin B1 homeostasis genes in breast cancer. J Nutr Biochem. 2013. May 1 [Epub ahead of print] (PubMed)
70. Boros LG, Brandes JL, Lee WN, et al. Thiamine supplementation to cancer patients: a double edged sword. Anticancer Res. 1998;18(1B):595-602. (PubMed)
71. Naito E, Ito M, Yokota I, Saijo T, Ogawa Y, Kuroda Y. Diagnosis and molecular analysis of three male patients with thiamine-responsive pyruvate dehydrogenase complex deficiency. J Neurological Sci. 2002;201(1-2):33-37. (PubMed)
72. Patel KP, O'Brien TW, Subramony SH, Shuster J, Stacpoole PW. The spectrum of pyruvate dehydrogenase complex deficiency: clinical, biochemical and genetic features in 371 patients. Mol Genet Metab. 2012;106(3):385-394. (PubMed)
73. Lee EH, Ahn MS, Hwang JS, Ryu KH, Kim SJ, Kim SH. A Korean female patient with thiamine-responsive pyruvate dehydrogenase complex deficiency due to a novel point mutation (Y161C)in the PDHA1 gene. J Korean Med Sci. 2006;21(5):800-804. (PubMed)
74. Chuang DT, Chuang JL, Wynn RM. Lessons from genetic disorders of branched-chain amino acid metabolism. J Nutr. 2006;136(1 Suppl):243S-249S. (PubMed)
75. Shaw-Smith C, Flanagan SE, Patch AM, et al. Recessive SLC19A2 mutations are a cause of neonatal diabetes mellitus in thiamine-responsive megaloblastic anaemia. Pediatr Diabetes. 2012;13(4):314-321. (PubMed)
76. Akin L, Kurtoglu S, Kendirci M, Akin MA, Karakukcu M. Does early treatment prevent deafness in thiamine-responsive megaloblastic anaemia syndrome? J Clin Res Pediatr Endocrinol. 2011;3(1):36-39. (PubMed)
77. Alfadhel M, Almuntashri M, Jadah RH, et al. Biotin-responsive basal ganglia disease should be renamed biotin-thiamine-responsive basal ganglia disease: a retrospective review of the clinical, radiological and molecular findings of 18 new cases. Orphanet J Rare Dis. 2013;8:83. (PubMed)
78. LeBlanc JG, Milani C, de Giori GS, Sesma F, van Sinderen D, Ventura M. Bacteria as vitamin suppliers to their host: a gut microbiota perspective. Curr Opin Biotechnol. 2013;24(2):160-168. (PubMed)
79. Russell RM, Suter PM. Vitamin requirements of elderly people: an update. Am J Clin Nutr. 1993;58(1):4-14. (PubMed)
80. US Department of Agriculture, Agricultural Research Service. USDA National Nutrient Database for Standard Reference, Release 25. 2012. Available at: http://ndb.nal.usda.gov//. Accessed 6/21/13.
81. Thiamin (vitamin B1). In: Hendler S, Rorvik D, eds. PDR for Nutritional Supplements. 2nd ed. Montvale: Physicians' Desk Reference Inc.; 2008:609-615.
82. Flodin N. Pharmacology of micronutrients. New York: Alan R. Liss, Inc.; 1988.
83. Schumann K. Interactions between drugs and vitamins at advanced age. Int J Vitam Nutr Res. 1999;69(3):173-178. (PubMed)
84. Subramanya SB, Subramanian VS, Said HM. Chronic alcohol consumption and intestinal thiamin absorption: effects on physiological and molecular parameters of the uptake process. Am J Physiol Gastrointest Liver Physiol. 2010;299(1):G23-G31. (PubMed)
85. Subramanian VS, Subramanya SB, Tsukamoto H, Said HM. Effect of chronic alcohol feeding on physiological and molecular parameters of renal thiamin transport. Am J Physiol Renal Physiol. 2010;299(1):F28-F34. (PubMed)