Contenido
La vitamina B6 es una vitamina hidrosoluble que se aisló por primera vez en la década de 1930. El termino vitamina B6 se refiere a seis formas comunes conocidas como piridoxal, piridoxina (piridoxol), piridoxamina y sus formas fosforiladas. El derivado éster fosfato, piridoxal 5’-fosfato (PLP), es la forma co-enzimática bioactiva que participa en más de un 4% de todas las reacciones enzimáticas (Figura 1) (1-3).
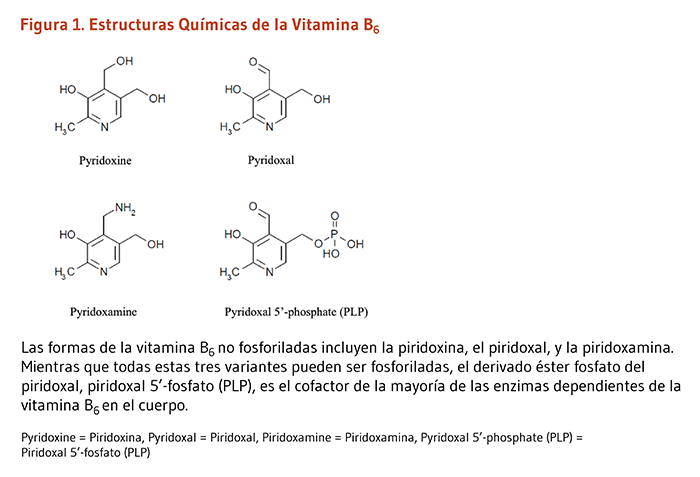
La vitamina B6 debe ser obtenida de la dieta, debido a que los humanos no pueden sintetizarla. La PLP juega un papel vital en la función de aproximadamente 100 enzimas que catalizan reacciones químicas esenciales en el cuerpo humano (4). Las enzimas dependientes de PLP han sido clasificadas en cinco clases estructurales conocidas como plegamiento tipo I-V (5):
• Plegamiento Tipo I- familia aspartato aminotransferasa
• Plegamiento Tipo II- familia triptófano sintasa
• Plegamiento Tipo III- familia alanina racemasa
• Plegamiento Tipo IV- familia D-aminoácido aminotransferasa
• Plegamiento tipo V- familia glicógeno fosforilasa
Las muchas reacciones biológicas catalizadas por las enzimas dependientes de PLP están involucradas en procesos bilógicos esenciales, tales como la biosíntesis de la hemoglobina y amino ácidos, así como también el metabolismo de los ácidos grasos. Cabe destacar que la PLP también funciona como una coenzima para la glucógeno fosforilasa, una enzima que cataliza la liberación de la glucosa del glicógeno almacenado. Mucha de la PLP en el cuerpo humano se encuentra en el músculo unida a la glucógeno fosforilasa. La PLP es también una coenzima en las reacciones que generan glucosa a partir de aminoácidos, un proceso conocido como gluconeogénesis (6).
En el cerebro, la enzima L-aminoácido aromático descarboxilasa cataliza la síntesis de dos neurotransmisor principales: la serotonina, a partir del aminoácido triptófano y la dopamina a partir de la L-3,4 dihidroxifenilalanina (L-Dopa). Otros neurotransmisores, incluyendo la glicina, D-serina, glutamato, histamina, y el ácido γ-aminobutírico (GABA), también son sintetizados en reacciones catalizadas por enzimas dependientes de PLP (7).
Las funciones de la PLP como coenzima del ácido 5-aminolevulínico sintasa el cual está involucrado en la síntesis del grupo hemo, un componente de la hemoglobina que contiene hierro. La hemoglobina se encuentra en los eritrocitos y es fundamental en su capacidad para transportar oxígeno a lo largo del cuerpo. Tanto el piridoxal como la PLP son capaces de unirse a la molécula de hemoglobina e intervenir en su capacidad para captar y liberar el oxígeno. Sin embargo, se desconoce su impacto sobre la entrega normal del oxígeno a los tejidos (6, 8). La deficiencia de vitamina B6 podría perjudicar la síntesis de la hemoglobina y conducir a una anemia microcítica (3).
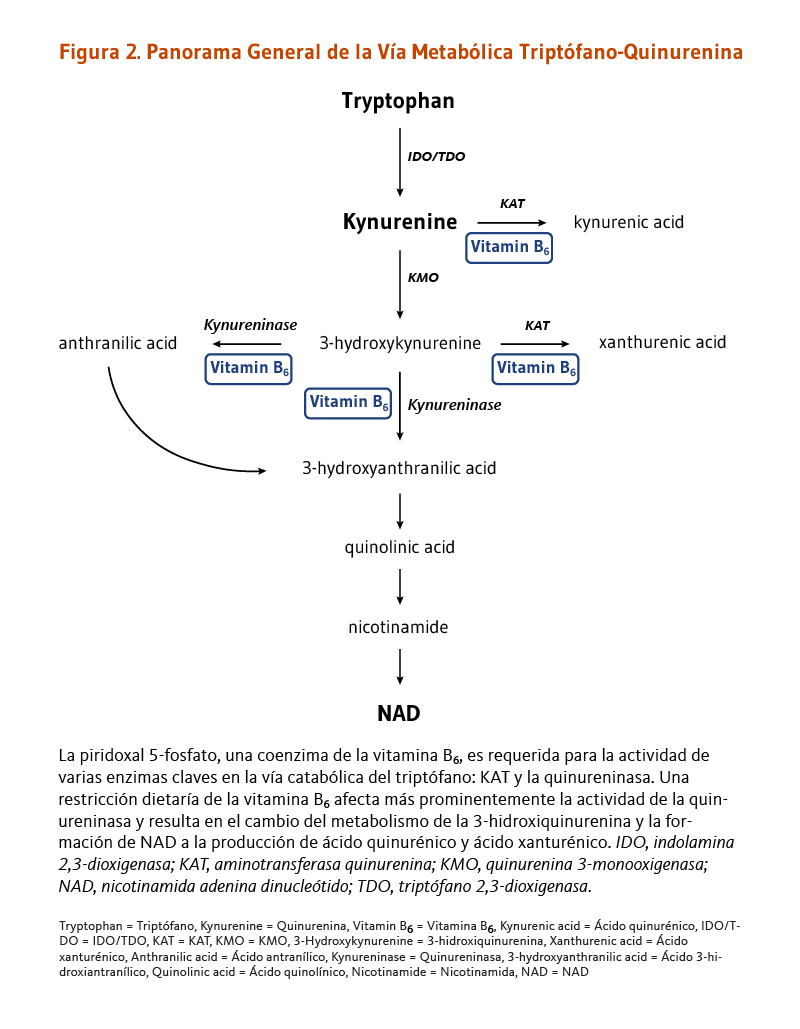
La deficiencia en otra vitamina B, la niacina, es fácilmente evitada por ingestas dietarías adecuadas. El requerimiento dietario de la niacina y la coenzima de la niacina, nicotinamida adenina dinucleótido (NAD) puede ser también satisfecha, aunque en un grado bastante limitado, debido al catabolismo del amino acido esencial triptófano en la vía triptófano-quinurenina (Figura 2). Reacciones clave en esta vía son la PLP dependiente; en particular, la PLP es el cofactor para la enzima quinureninasa, la cual cataliza la conversión de 3-hidroxiquinurenina a ácido 3-hidroxiantranílico. Una reducción en la disponibilidad de la PLP parece afectar principalmente la actividad de la quinureninasa, limitando la producción de NAD y llevando a altas concentraciones de quinurenina, 3-hidroxiquinurenina y ácido xanturénico en la sangre y orina (Figura 2) (9). De este modo, mientras que la restricción de la vitamina B6 dietaría afecta la síntesis de la NAD a partir del triptófano, niveles adecuados de la PLP ayudan a mantener la formación de la NAD a partir del triptófano (10). El efecto de la insuficiencia de la vitamina B6 en la activación inmune e inflamación podría estar parcialmente relacionada al papel de la PLP en el metabolismo del triptófano-quinurenina (véase Prevención de Enfermedades).
Las hormonas esteroidales, como el estrógeno y la testosterona, ejercen sus efectos en el cuerpo al unirse a receptores de hormonas esteroidales en el núcleo de células diana. Los receptores nucleares se unen a secuencias reguladoras específicas en el ADN alterando la transcripción de genes diana. Estudios experimentales han descubierto un mecanismo por el cual la PLP podría afectar la actividad de los receptores esteroidales y disminuir sus efectos en la expresión de genes. Se encontró que la PLP pudo interactuar con la RIP140/NRIP1 un represor de los receptores nucleares conocido por su papel en la biología reproductiva (11). A pesar de todo, investigación adicional es necesaria para confirmar que esta interacción puede mejorar la actividad represiva de RIP140/NRIP1 en la expresión de genes mediada por receptores esteroidales. Si la actividad de los receptores esteroidales para el estrógeno, progesterona, testosterona, u otras hormonas esteroidales puede ser inhibida por la PLP, es posible que el estatus de la vitamina B6 influencie el riesgo de desarrollar enfermedades impulsadas por las hormonas esteroides, como el cáncer de próstata o seno (6).
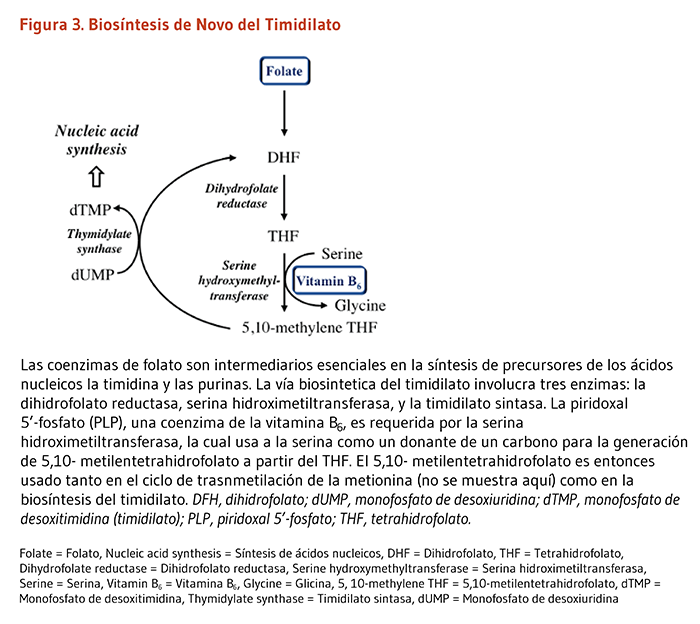
La síntesis de ácidos nucleicos a partir de precursores de timidina y purinas depende de coenzimas de folato. La ruta biosintética de novo del timidilato (dTMP) involucra tres enzimas: la dihidrofolato reductasa (DHFR), la serina hidroximetiltransferasa (SHMT) y la timidilato sintasa (TS) (Figura 3). La PLP sirve como coenzima para la SHMT, la cual cataliza las conversiones simultaneas de serina a glicina y de tetrahidrofolato (THF) a 5,10-metileno THF. Esta última molécula es el donante de un carbono para la generación del dTMP a partir del dUMP por la TS.
Una severa deficiencia de vitamina B6 es poco común. Se piensa que alcohólicos se encuentran en un mayor riesgo de una deficiencia debido a ingestas dietarías bajas y a una alteración del metabolismo de la vitamina. A principios de 1950 se observaron convulsiones en infantes como resultado de una deficiencia severa de vitamina B6 provocada por un error en la fabricación de la fórmula infantil (7). También han sido reportados patrones de electroencefalogramas (EEG) alterados en adultos con una deficiencia de vitamina B6. Otros síntomas neurológicos observados en la deficiencia severa de vitamina B6 incluyen irritabilidad, depresión y confusión; síntomas adicionales incluyen inflamación de la lengua, dolor o úlceras en la boca y úlceras en la piel de las comisuras de la boca (12).
Debido a que la vitamina B6 está involucrada en muchos aspectos del metabolismo, especialmente en vías metabólicas del amino ácido, la ingesta de proteína de un individuo es probable que influya en el requerimiento de vitamina B6 (13). A diferencia de las recomendaciones previas, la Junta de Nutrición y Alimentos (JNA) del Instituto de Medicina no expresó la IDR de la vitamina B6 más reciente en términos de la ingesta de proteínas, aunque la relación se consideró en el establecimiento de la IDR (14). La IDR actual fue revisada por la Junta de Nutrición y Alimentos (JNA) en 1998 y se muestra en la Tabla 1.
| Etapa de la Vida | Edad | Machos (mg/día) | Hembras (mg/día) |
|---|---|---|---|
| Infantes | 0-6 meses | 0.1 (IA) | 0.1 (IA) |
| Infantes | 7-12 meses | 0.3 (IA) | 0.3 (IA) |
| Niños | 1-3 años | 0.5 | 0.5 |
| Niños | 4-8 años | 0.6 | 0.6 |
| Niños | 9-13 años | 1.0 | 1.0 |
| Adolescentes | 14-18 años | 1.3 | 1.2 |
| Adultos | 19-50 años | 1.3 | 1.3 |
| Adultos | 51 años y más | 1.7 | 1.5 |
| Embarazo | Todas las edades | - | 1.9 |
| Período de lactancia | Todas las edades | - | 2.0 |
Varias reacciones enzimáticas en la vía triptófano-quinurenina dependen de la coenzima de la vitamina B6, piridoxal-5'-fosfato (PLP) (véase Figura 2 arriba) (véase Metabolismo del triptófano). Esta vía es conocida por estar activada durante las respuestas inmunes pro-inflamatorias y juega un papel crítico en la tolerancia inmune del feto durante el embarazo (15). Intermediarios claves en la vía triptófano-quinurenina están involucrados en la regulación de las respuestas inmunes. Se ha encontrados que varios derivados del triptófano inducen la muerte (apoptosis) o bloquean la proliferación de ciertos tipos de células inmunitarias, como los linfocitos (en particular los linfocitos T colaboradores 1). Estos también pueden inhibir la producción de citoquinas pro-inflamatorias (revisado en 15). Existe evidencia que sugiere que una ingesta adecuada de vitamina B6 es importante para una función óptima del sistema inmunitario, especialmente en individuos mayores (16, 17). A pesar de todo, la inflamación crónica que desencadena la degradación del triptófano y subyace en muchas enfermedades (ej. enfermedades cardiovasculares y canceres) podría precipitar la perdida de la PLP e incrementar los requerimientos de la vitamina B6. Investigación adicional es necesaria para evaluar si las ingestas elevadas de vitamina B6 más que la actual IDR podría prevenir y/o invertir las deficiencias del sistema inmunológico (véase también Vitamina B6 y la inflamación).
El uso de suplementos multivitamínicos (incluyendo la vitamina B6) ha sido asociado con un riesgo 24% menor de padecer una enfermedad coronaria cardíaca (ECC) incidental en un estudio prospectivo exhaustivo en 80,082 mujeres de la cohorte del Estudio de Salud de Enfermeras estadounidense (18). Usando cuestionarios de frecuencia de alimentos, los autores observaron que las mujeres en el quintil más alto de la ingesta de vitamina B6 proveniente tanto de alimentos como suplementos (mediana, 4.6 mg/día) tuvieron un riesgo 34% menor de ECC en comparación con aquellas en el quintil más bajo (mediana, 1.1 mg/día). La ECC se caracteriza por la estenosis (estrechamiento) anormal de las arterias coronarias (generalmente debido a la aterosclerosis), la cual puede resultar en un infarto al miocardio (ataque al corazón) potencialmente fatal. Más recientemente, un estudio prospectivo que dio seguimiento a una cohorte japonesa de más de 40,000 individuos de edad media por 11.5 años reporto un riesgo 48% menor de un infarto al miocardio en aquellos en el quintil más alto (promedio, 1.6 mg/día) en comparación con aquellos en el quintil más bajo (promedio 1.3 mg/día) de las ingestas de vitamina B6 en usuarios no suplementados (19).
Estudios basados en la observación tempranos han también demostrado una asociación entre niveles subóptimos de piridoxal-5'-fosfato (PLP) en el plasma, niveles elevados de homocisteína en la sangre, y un riesgo incrementado de enfermedades cardiovasculares (20-22). Investigación más reciente ha confirmado que un estatus bajo de PLP en el plasma es un factor de riesgo para ECC. En un estudio de caso y control, el cual incluyo 184 participantes con ECC y 516 controles sanos, niveles bajos de PLP en el plasma (<30 nanomoles/litro) fueron asociados con casi el doble del riesgo de padecer ECC cuando se comparó con altos niveles de PLP (≥30 nanomoles/litro) (23). En un estudio caso-control anidado basado en la cohorte del Estudio de Salud de Enfermeras e incluyendo 144 casos de infarto al miocardio (de las cuales 21 fueron fatales), las mujeres con niveles de PLP en la sangre en el cuartil más alto (≥70 nanomoles/litro) tuvieron un 79% menos riesgo de padecer un infarto al miocardio en comparación con aquellas en el cuartil más bajo (<27.9 nanomoles/litro) (24).
Incluso niveles moderadamente elevados de homocisteína en la sangre han sido asociados con un incremento en el riesgo de enfermedades cardiovasculares (ECV), incluyendo insuficiencia cardiaca, ECC, infarto al miocardio, y accidentes cerebrovasculares (25). Durante la digestión de proteínas, los aminoácidos, incluyendo la metionina, son liberados. La metionina es un aminoácido esencial y precursor de la S-adenosilmetionina (SAM), el donante de metilo universal para la mayoría de las reacciones de metilación, incluyendo la metilación del ADN, ARN, proteínas y fosfolípidos (Figura 4). La homocisteína es un intermediario en el metabolismo de la metionina. Los individuos sanos utilizan dos vías diferentes para regenerar la metionina de la homocisteína en el ciclo de la remetilacion de la metionina (Figura 5). Una vía se basa en la metionina sintasa dependiente de la vitamina B12 y el donante de metilo, el 5-metil tetrahidrofolato (un derivado del folato), para convertir la homocisteína de regreso a metionina. La otra reacción es catalizada por la betaína homocisteína metiltransferasa, la cual utiliza la betaína como fuente de grupos metilo para la formación de la metionina a partir de la homocisteína. Por otra parte, dos enzimas dependientes de la PLP son requeridas para convertir la homocisteína al amino acido cisteína en la vía de transulfuración de la homocisteína: la cistationina β sintasa y la cistationina γ liasa (Figura 5). Así, la cantidad de homocisteína en la sangre podría ser influenciada por el estatus nutricional de por lo menos tres vitaminas B, es decir el folato, la vitamina B12 y la vitamina B6.
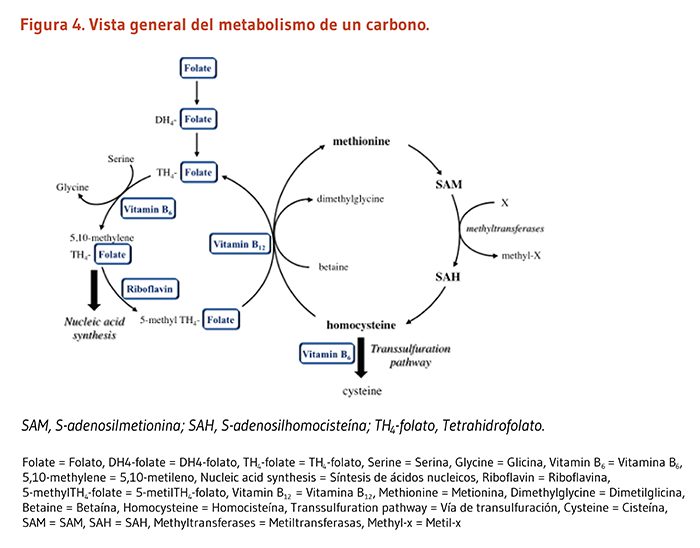

Deficiencias en una o en todas estas vitaminas B podrían afectar tanto los procesos de remetilación como de transulfuración y resultar en niveles anormalmente elevados de homocisteína. Un estudio temprano encontró que la suplementación con vitamina B6 pudo disminuir los niveles de homocisteína después de que una dosis oral de metionina fue administrada (es decir una prueba de carga de metionina (26), pero la suplementación con vitamina B6 podría no ser efectiva en la disminución de los niveles de homocisteína en ayunas. En un reciente estudio conducido en nueve voluntarios jóvenes saludables, se encontró que el aumento de la homocisteína durante el periodo postprandrial (después de una comida) era mayor con una deficiencia de vitamina B6 marginal (nivel promedio de PLP en el plasma de 19 nanomoles/litro) en comparación con la suficiencia de vitamina B6 (nivel promedio de PLP en el plasma de 49 nanomoles/litro) (27). Los autores reportaron una mayor tasa de la síntesis de cistationina con la restricción de la vitamina B6, sugiriendo que el catabolismo de la homocisteína en la transulfuración podría ser mantenido o mejorado en respuesta a una reducción marginal en la disponibilidad de PLP. A pesar de todo, la proporción del flujo entre el ciclo de la metionina y la vía de transulfuración pareció favorecer el despeje de la homocisteína más bien por la remetilación que por la transulfuración en seis de nueve participantes (27).
Numerosos ensayos controlados aleatorios, muchos basados en sujetos con hiperhomocisteinemia y disfunción vascular existentes han demostrado que la suplementación con ácido fólico, sola o combinada con la vitamina B6 y la vitamina B12, pudo efectivamente reducir las concentraciones de homocisteína en el plasma en ayunas. En 19 estudios de intervención recientemente incluidos en un meta-análisis, las reducciones en el nivel de homocisteína en la sangre después de una suplementación con vitamina B oscilo entre un 7.6% y un 51.7% en comparación con los niveles al inicio del estudio (28). En contraste, estudios que suplementaron a individuos con solo vitamina B6 han usualmente fallado en mostrar un efecto en los niveles de homocisteína en la sangre en ayunas (29, 30). De las tres vitaminas B suplementarias, el ácido fólico parece ser el determinante principal en la regulación de los niveles de homocisteína en ayunas cuando no hay una deficiencia de vitamina B12 o vitamina B6 (31). A pesar de todo, el efecto de la disminución de la homocisteína en la reducción del riesgo de ECV es debatido. Un reciente meta-análisis de nueve ensayos controlados aleatorios reporto una reducción del 10% en casos de accidentes cerebrovasculares con vitaminas B suplementarias, con mayores beneficios para sujetos de alto riesgo (ej. Aquellos con enfermedad renal) (32). Sin embargo, la mayoría de las revisiones sistemáticas y meta-análisis de estudios de intervención de la vitamina B hasta la fecha han indicado una falta de causalidad entre la disminución de los niveles de homocisteína en ayunas y la prevención de eventos cardiovasculares (28, 33-35). Por otra parte, ensayos de suplementación con vitamina B en sujetos de alto riesgo no han resultado en cabios significativos en el grosor íntima-media carotídeo (CIMT) y la dilatación mediada por flujo (DMF) de la arteria braquial, dos marcadores de la salud vascular usada para evaluar la progresión aterosclerótica (36). Finalmente, en el Ensayo de Intervención de la Vitamina B de Noruega Occidental (WENBIT), un ensayo controlado aleatorio, doble ciego con placebo en 87 sujetos con sospecha de ECC, la suplementación con vitamina B6 (40 mg/día de piridoxina) por un promedio de 10 meses no tuvo efecto en la progresión de la estenosis coronaria, evaluada por la angiografía cuantitativa (37).
Se ha sugerido que la terapia antiplaquetaria usada en la prevención primaria de ECV podría interferir con el efecto de la disminución de la homocisteína por las vitaminas B en el riesgo de ECV (38). En este contexto, un análisis post-hoc de un subgrupo del ensayo multicéntrico, aleatorio, doble ciego, controlado con placebo VITATOPS (39) propuso que el pequeño beneficio de la reducción de la homocisteína por las vitaminas B podría ser cancelada en pacientes tratados con fármacos antiplaquetarios (40). A pesar de todo, el beneficio de la suplementación con vitamina B en la prevención primaria (es decir, en usuarios no antiplaquetarios) falta por ser establecida.
Un creciente cuerpo de evidencia actualmente sugiere que un estatus bajo de vitamina B6 pudiese incrementar el riesgo de enfermedades cardiovasculares a través de mecanismos independientes de la disminución de homocisteína (41-43). Marcadores de la activación inmune e inflamación han sido asociados con la hiperhomocisteinemia (niveles de homocisteina >15 micromoles/litro) en individuos con enfermedades coronarias cardíacas (ECC) (44). De hecho, la inflamación está involucrada en las primeras etapas de la aterosclerosis en las cuales los lípidos se depositan en las plaquetas (conocidos como ateromas) dentro de las paredes arteriales y aumentan el riesgo de ECC (45). En un estudio de caso y control que incluyo 267 pacientes con ECC y 475 controles saludables, las concentraciones de PLP en el plasma fueron inversamente correlacionadas con los niveles de dos marcadores de la inflamación sistémica, la proteína C reactiva (PCR) y el fibrinógeno (46). A pesar de todo, el estudio sugirió que niveles subóptimos de PLP (<36.3 nanomoles/litro) podrían contribuir a un riesgo incrementado de ECC independientemente de la inflamación ya que el riesgo se mantuvo sin cambios después del ajuste de los marcadores de la inflamación (razón de momios (RM) sin ajustar: 1.71 vs. RM multivariada ajustada: 1.73). Además, el análisis de los marcadores de inflamación en 2,686 participantes del US National Health and Nutrition Examination Survey (NHANES) del 2003-2004 indico que las concentraciones de la PCR del suero fueron inversamente relacionadas a las ingestas totales de la vitamina B6 (tanto de alimentos como suplementos). Específicamente, el riesgo de tener niveles de PCR en el suero de más de 10 mg/L (correspondientes a una alta actividad inflamatoria) fue 57% mayor en individuos con ingestas de vitamina B6 menores de 2 mg/día en comparación con aquellos con ingestas iguales a o mayores de 5 mg/día (41). Además, la prevalencia de un estatus inadecuado de vitamina B6 (niveles de PLP en el plasma <20 nanomoles/litro) con ingestas menores de 5 mg/día fue sistemáticamente mayor en individuos con concentraciones altas de PCR en el suero frente a las bajas (>10 mg/L vs. ≤3 mg/L), sugiriendo que la inflamación podría perjudicar el metabolismo de la vitamina B6. Estas observaciones fueron confirmadas en el estudio de otra cohorte (Framingham Offspring Study) en el cual el estatus de la vitamina B6 fue ligado a un puntaje inflamatorio general basado en los niveles de 13 marcadores de inflamación (incluyendo PCR, fibrinógeno, factor de necrosis tumoral α, e Interleucina-6) (42). Específicamente, los niveles de la PLP en el plasma fueron 24% menor en individuos en el tercil más alto frente a aquellos en el tercil más bajo del puntaje inflamatorio. Por otra parte, la correlación inversa entre los niveles de PLP y los puntajes inflamatorios permanecieron significativos independientemente de la ingesta de vitamina B6, cuestionando nuevamente la naturaleza de esta relación. Curiosamente, un reciente análisis de datos recolectados del estudio WENBIT demostró que la inflamación sistémica estuvo asociada con un incremento en la degradación de piridoxal (PL) a ácido 4-piridóxico (AP), apoyando el uso de la proporción PA:(PL+PLP) como un marcador de ambos el estatus de la vitamina B6 y la inflamación sistémica (47). Finalmente, mientras que la inflamación podría contribuir a disminuir el estatus de la vitamina B6, evidencia actual falla en apoyar un papel para la vitamina B6 en el control de la inflamación en pacientes con enfermedades cardiovasculares (48, 49).
Algunos estudios basados en la observación han sido ligados al deterioro cognitivo y la enfermedad de Alzheimer en las personas de edad avanzada con estatus inadecuados de folato, vitamina B12 y vitamina B6 (50). A pesar de todo, la relación entre las vitaminas B y la salud cognitiva en el envejecimiento es complicada por tanto la prevalencia de la hiperhomocisteinemia como por las señales de inflamación sistémica en personas de edad avanzada (51). Por un lado, debido a que la inflamación puede perjudicar el metabolismo de la vitamina B6, niveles bajos de la PLP en el suero pueden bien ser causados por los procesos relacionados al envejecimiento en lugar de ser causados por la malnutrición. Por el otro lado, la homocisteína elevada del suero puede posiblemente ser un factor de riesgo para el declive cognitivo en personas de edad avanzada, aunque el tema aún está bajo debate. Específicamente, el meta-análisis de 19 ensayos aleatorios controlados con placebo de la suplementación de vitamina B fallo en reportar alguna diferencia en varios parámetros de la función cognitiva entre los grupos de tratamiento y placebo, a pesar de que el tratamiento efectivamente disminuyo los niveles de homocisteína (52). En un estudio aleatorio, doble ciego, controlado con placebo reciente de 2,695 sobrevivientes de accidentes cerebrovasculares con o sin alteraciones cognitivas, una suplementación diaria con 2 mg de ácido fólico, 0.5 mg de vitamina B12 y 25 mg de vitamina B6 por 3.4 años resulto en reducciones significativas en los niveles medios de homocisteína (por un 28% y 43% en pacientes con alteraciones cognitivas y sin ellas respectivamente) en comparación con el placebo. A pesar de todo, la intervención de la vitamina B no tuvo efecto en tanto la incidencia de deterioros cognitivos recién diagnosticados como en parámetros del rendimiento cognitivo cuando se compara con el placebo (53). En contraste, otro ensayo controlado con placebo reciente encontró que un régimen diario de vitamina B que llevo a una disminución significativa de la homocisteína en individuos de edad avanzada de alto riesgo pudo limitar la atrofia progresiva de la materia gris de regiones del cerebro asociadas con el proceso del Alzheimer (54). A pesar de todo, los autores atribuyeron los cambios en los niveles de homocisteína principalmente a la vitamina B12. Debido a los descubrimientos mixtos, en la actualidad no está claro si la suplementación con vitaminas B podría atenuar el deterioro cognitivo en las personas mayores. Evidencia es necesaria para determinar si las deficiencias de vitamina B marginales, las cuales son relativamente comunes en las personas mayores, podrían incluso contribuir a deterioros de la función cognitiva asociados con la edad, o si ambas resultan de procesos asociados con el envejecimiento y/o enfermedad.
La depresión tardía o en personas de edad avanzada es un trastorno común que a veces ocurre después de enfermedades agudas, como fractura de cadera o accidentes cerebrovasculares (55, 56). La coexistencia de síntomas de depresión y un estatus bajo de la vitamina B6 (niveles de PLP en el plasma ≤20 nanomoles/litro) ha sido reportada en algunos estudios de corte transversal (57, 58). En un estudio prospectivo de 3,503 personas viviendo libremente de 65 años y mayores del Chicago Health and Aging Project, ingestas totales de vitamina B6 (pero ingestas no dietarías únicamente) fueron inversamente correlacionadas con la incidencia de síntomas depresivos durante un periodo medio de seguimiento de 7.2 años (59). En un ensayo aleatorio, doble ciego, controlado con placebo en 563 individuos que sufrieron de un accidente cerebrovascular reciente, una suplementación diaria de 2 mg de ácido fólico, 0.5 mg de vitamina B12, y 25 mg de vitamina B6, redujo a la mitad el riesgo de desarrollar un episodio depresivo mayor durante un periodo de seguimiento medio de 7.1 años (60). Esta reducción del riesgo fue asociada con un nivel 25% inferior de la homocisteína plasmática en pacientes suplementados en comparación a los controles. Evidencia adicional es requerida para evaluar si las vitaminas B podrían ser incluidas en el tratamiento habitual de personas mayores en alto riesgo de depresión.
La inflamación crónica que subyace a la mayoría de canceres podría aumentar la degradación de la vitamina B6 (véase La vitamina B6 y la inflamación). Además, el requerimiento de PLP en el ciclo de la metionina, el catabolismo de la homocisteína, y la síntesis de timidilato que disminuyen el estatus de la vitamina B6 puede contribuir al comienzo y/o progresión de tumores. La revisión sistemática de nueve estudios prospectivos encontró tanto asociaciones inversas como positivas entre las ingestas de vitamina B6 y el riesgo de cáncer colorrectal (CCR) (61). Evidencia inconsistente con respecto a la relación entre las ingestas de vitamina B6 y el cáncer de seno fue también reportada recientemente en un meta-análisis (62). A pesar de todo, un estudio prospectivo que dio seguimiento a aproximadamente 500,000 adultos mayores por nueve años observo que el riesgo de cáncer esofágico y gástrico fue menor en participantes en el quintil más alto que aquellos en el quintil más bajo de las ingestas totales de vitamina B6 (valores medios, 2.7 mg/día vs. 1.4 mg/día) (63). Adicionalmente, un meta-análisis de cuatro estudios de caso y control anidados reporto una reducción del 48% en el riesgo de CCR en el cuartil más elevado frente al cuartil más bajo del nivel de PLP de la sangre (61). Otro meta-análisis de cinco estudios de caso y control anidados encontró que los niveles más altos frente a los más bajos de PLP en el suero estuvieron asociados con un riesgo 29% menor de cáncer de seno en mujeres posmenopáusicas, pero no premenopáusicas (62).
Muy pocos ensayos aleatorios controlados con placebo que investigan la naturaleza de la asociación entre vitaminas B y el riesgo de cáncer se han enfocado en la vitamina B6. Dos estudios tempranos conducidos en sujetos con una enfermedad coronaria cardiaca fallaron en observar algún beneficio de la vitamina B6 suplementaria (40 mg/día) en el riesgo y mortalidad del CCR (revisado en 64). Un estudio aleatorio, doble ciego, controlado con placebo conducido en 1,470 mujeres con un alto riesgo cardiovascular mostro que la suplementación diaria con 2.5 mg de ácido fólico, 1 mg de vitamina B12, y 50 mg de vitamina B6 por un periodo de tratamiento promedio de 7.3 años no tuvo efecto en el riesgo de desarrollar adenoma colorrectal cuando se comparó con el placebo (65).
Un estudio prospectivo de gran magnitud examino la relación entre la ingesta de vitamina B6 y la ocurrencia de cálculos renales sintomáticos en mujeres. A un grupo de más de 85,000 mujeres sin un historial previo de cálculos renales se les dio seguimiento por sobre 14 años, y aquellas que consumieron 40 mg o más de vitamina B6 diariamente tuvieron solo dos tercios del riesgo de desarrollar cálculos renales en comparación con aquellas que consumieron 3 mg o menos (66). Sin embargo, en un grupo de ms de 45,000 hombres con un seguimiento de 14 años, no se encontró alguna asociación entre la ingesta de vitamina B6 y la ocurrencia de cálculos renales (67). Datos experimentales limitados han sugerido que la suplementación con altas dosis de piridoxamina puede ayudar a disminuir la formación de cálculos renales de oxalato de calcio y reducir los niveles de oxalato urinario, un determinante importante de la formación de cálculos renales de oxalato de calcio (68, 69). Actualmente, la relación entre la ingesta de vitamina B6 y el riesgo de desarrollar cálculos renales requiere de estudios adicionales antes de que alguna recomendación puede ser hecha.
Los suplementos de vitamina B6 en dosis farmacológicas (es decir, en dosis mucho más grandes que las necesarias para prevenir una deficiencia) han sido utilizados en un intento de tratar una amplia variedad de condiciones, algunas de las cuales se comentan a continuación.
Algunos trastornos metabólicos congénitos raros, incluyendo la epilepsia dependiente de piridoxina (EDP) y la deficiencia de fosfato de piridoxamina oxidasa (PNPO), son la causa de la aparición temprana de encefalopatías epilépticas las cuales se encontró son sensibles a dosis farmacológicas de vitamina B6. En individuos afectados por EDP y la deficiencia de PNPO, la biodisponibilidad de la PLP es limitada, y el tratamiento con piridoxina y/o PLP han sido usados para aliviar o abolir las convulsiones epilépticas que caracterizan estas condiciones (70, 71). La terapia con piridoxina, en conjunto con la restricción de proteína dietaría, es también usada en el manejo de la homocistinuria sensible a la vitamina B6 causada por la deficiencia de la enzima dependiente de la PLP, la cistationina β sintasa (72).
Las náuseas y vómitos en el embarazo (NVE), frecuentemente referidos como malestar matutino, pueden afectar hasta un 85% de las mujeres durante el inicio del embarazo y usualmente dura entre 12 a 16 semanas (73). La vitamina B6 ha sido usada desde 1940 para tratar las náuseas durante el embarazo. Originalmente la vitamina B6 se incluyó en el medicamento Bendectina, el cual era recetado para el tratamiento del malestar matutino y que posteriormente fue retirado del mercado debido a preocupaciones no probadas que incrementaban el riesgo de defectos de nacimiento. La vitamina B6 por si sola es considerada segura durante el embarazo y ha sido usada en mujeres embarazadas sin ninguna evidencia de daño fetal (74). Los resultados de dos ensayos doble ciegos, controlados con placebo que incluyeron 401 mujeres embarazadas que usaron 25 mg de piridoxina cada ocho horas por tres días (75) o 10 mg de piridoxina cada ocho horas por cinco días (76), sugiriendo que la vitamina B6 puede ser beneficiosa en la reducción de náuseas. Una revisión sistemática reciente de ensayos controlados aleatorios en síntomas del malestar matutino durante el inicio del embarazo encontró que la vitamina B6 suplementaria fue algo eficaz (77). Cabe señalar que las NVE usualmente se resuelven sin ningún tratamiento, por lo que es difícil llevar a cabo ensayos bien controlados. Más recientemente los síntomas del malestar matutino fueron evaluados usando puntuaciones de la Cuantificación Única de Emesis en el Embarazo (PUQE) en un estudio aleatorio, doble ciego, controlado con placebo conducido en 256 mujeres embarazadas (7-14 semanas de gestación) que padecían de NVE (78). La suplementación con piridoxina y el fármaco doxilamina mejoró significativamente los síntomas de NVE, como se evaluó con puntuaciones más bajas de la PUQE en comparación con el placebo. Por otra parte, más de las mujeres suplementadas con piridoxina-doxilamina (48.9%) que aquellas con el tratamiento de placebo (32.8%) pidieron la continuación de su tratamiento al final de la prueba de 15 días. Los Colegios Americanos y Canadienses de Obstetricia y Ginecología han recomendado el uso de la vitamina B6 (hidrocloruro de piridoxina, 10 mg) y el succinato de doxilamina (10 mg) como terapia de primera line para las NVE (73).
El síndrome premenstrual SPM hace referencia a un grupo de síntomas incluyendo, aunque no limitado a la fatiga, irritabilidad, mal humor/depresión, la retención de líquidos, y la sensibilidad mamaria, que comienzan poco después de la ovulación (mitad del ciclo) y que disminuyen con el inicio de la menstruación (el periodo menstrual). Una revisión sistemática y meta-análisis de nueve ensayos aleatorios, controlados con placebo sugirieron que la vitamina B6 suplementaria, de hasta 100 mg/día, puede ser de valor para tratar el SPM, incluyendo síntomas del estado de ánimo, sin embargo, sólo se pueden extraer conclusiones limitadas debido a que la mayoría de los estudios eran de baja calidad (79). Otra revisión reciente de 13 estudios controlados aleatorios también enfatizo la necesidad por evidencia concluyente antes de poder hacer recomendaciones (80).
La importancia de las enzimas dependientes de la PLP en la síntesis de varios neurotransmisores (vea Funcionamiento del sistema nervioso) ha llevado a investigadores a considerar si la deficiencia de vitamina B6 puede contribuir al comienzo de los síntomas depresivos (véase Prevención de Enfermedades). Existe evidencia limitada que sugiere que la vitamina B6 suplementaria puede tener una eficacia terapéutica en el manejo de la depresión. En un ensayo aleatorio controlado con placebo conducido en 225 pacientes de edad avanzada hospitalizados por una enfermedad aguda, una intervención de seis meses con suplementos minerales/multivitamínicos mejoro el estatus de la vitamina B y disminuyo el número y severidad de los síntomas depresivos al compararse con el placebo (81). Además, mientras la ingesta del suplemento efectivamente redujo los niveles de homocisteína en el plasma en comparación con el placebo, el efecto de la suplementación en los síntomas depresivos al final de la prueba fue mayor en sujetos tratados en el cuartil más bajo de los niveles de homocisteína frente a aquellos en el cuartil más alto (≤10 micromoles/litro vs. ≥16.1 micromoles/litro) (82). A pesar de todo, la etiología de la depresión tardía no es aun clara y evidencia actualmente carece de sugerir si las vitaminas B suplementarias (incluyendo la vitamina B6) podrían aliviar los síntomas depresivos.
El síndrome del túnel carpiano causa entumecimiento, dolor y debilidad de la mano y los dedos debido a la compresión del nervio mediano en la muñeca. Esto podría derivar de una lesión de la muñeca por estrés repetitivo o de la hinchazón de tejido blando, lo que algunas veces ocurre con el embarazo o el hipotiroidismo. Estudios tempranos por el mismo investigador sugirieron que la suplementación con 100 a 200 mg/día de vitamina B6 por varios meses podría mejorar los síntomas del síndrome del túnel carpiano en individuos con un estatus bajo de vitamina B6 (83, 84). Además, un estudio transversal en 137 hombres que no tomaban suplementos vitamínicos encontró que la disminución de los niveles de PLP en la sangre se asociaba con un incremento del dolor, hormigueo y despertar nocturno, todos síntomas del síndrome del túnel carpiano (85). Sin embargo, estudios que utilizan mediciones electrofisiológicas de la conducción del nervio mediano han fallado ampliamente en encontrar una asociación entre la deficiencia de vitamina B6 y el síndrome del túnel carpiano (86). Mientras que algunos estudios han notado algún alivio sintomático con la suplementación de la vitamina B6, ensayos doble ciegos controlados con placebo no han encontrado que la vitamina B6 sea generalmente eficaz en el tratamiento del síndrome del túnel carpiano (86). Sin embargo, a pesar de su eficacia equívoca, la suplementación con vitamina B6 es a veces usada en la terapia complementaria en un intento de evitar la cirugía de la mano. Los pacientes que toman altas dosis de vitamina B6 deben ser aconsejados por un médico y monitoreados en caso de síntomas relacionados con la toxicidad de la vitamina B6 (véase Toxicidad) (87).
El análisis de los datos recolectados en el US NHANES 2003-2004 ha indicado que las ingestas de vitamina B6 de los alimentos solo promedian alrededor de 1.9 mg/día (88). Sin embargo, a pesar de los valores muy por encima de la actual IDR, las ingestas totales de vitamina B6 (combinando los alimentos y suplementos) por debajo de los 2 mg/día parecieron estar asociados con proporciones relativamente altas de un estatus bajo de vitamina B6 en todos los grupos de edad (véase Suplementos). Muchos alimentos vegetales contienen una forma única de vitamina B6 denominada glucósido de piridoxina; esta forma de vitamina B6 parece ser sólo la mitad de biodisponible que la vitamina B6 de otras fuentes alimenticias o suplementos (7). Se ha encontrado que la vitamina B6 en una dieta variada es biodisponible en aproximadamente un 75% (14). En la mayoría de los casos, incluir en la dieta alimentos ricos en vitamina B6 debería ser suficiente como para satisfacer la IDR actual. Sin embargo, aquellos que siguen una dieta vegetariana estricta podrían necesitar incrementar su ingesta de vitamina B6 consumiendo alimentos fortificados con vitamina B6 o tomando un suplemento. Algunos alimentos que son relativamente ricos en vitamina B6 y su contenido de vitamina B6 en miligramos (mg) se muestran en la Tabla 2. Para más información sobre el contenido de nutrientes de alimentos específicos, revise la base de datos de composición de los alimentos del USDA.
La vitamina B6 está disponible como clorhidrato de piridoxina en suplementos multivitamínicos, de vitaminas del complejo B y en suplementos de vitamina B6 (89). En el NHANES 2003-2004, se reportó un estatus bajo de la vitamina B6 (nivel de PLP en el plasma <20 nanomoles/litro) en un 24% de los usuarios no suplementados y en un 11% en los usuarios suplementados. Además, las ingestas totales de vitamina B6 (proveniente de alimentos y suplementos) menores de 2 mg/día fueron asociadas con altas proporciones de niveles bajos de PLP en el plasma: 16% en hombres de entre 13 a 54 años, 24% en mujeres que menstruaban, y 26% en individuos de 65 años y mayores. Finalmente, se encontró que la prevalencia de niveles bajos de PLP era mayor en individuos que consumían menos de 2 mg/día de vitamina B6 en comparación con ingestas más altas. Por ejemplo, solo el 14% de los hombre y mujeres de 65 y mayores tuvieron valores bajos de PLP con ingestas totales de vitamina B6 de entre 2-2.9 mg/día en comparación con el 26% en aquellos que consumieron menos de 2 mg/día de vitamina B6 (88).
Debido a que sólo se han documentado efectos adversos provenientes de suplementos de vitamina B6 y nunca de fuentes alimenticias, sólo se discute sobre la seguridad respecto a la forma suplementaria de la vitamina B6 (piridoxina). Aunque la vitamina B6 es una vitamina hidrosoluble y se secreta en la orina, la suplementación a largo plazo con dosis muy altas de piridoxina podría resultar en dolorosos síntomas neurológicos conocidos como neuropatía sensorial. Los síntomas incluyen dolor y entumecimiento de las extremidades y, en casos severos, dificultad para caminar. Típicamente, la neuropatía sensorial se desarrolla con dosis de piridoxina excesivas de 1,000 mg por día. Sin embargo, ha habido algunos reportes de casos de personas que desarrollaron neuropatías sensoriales con dosis de menos de 500 mg al día por un periodo de uno o más meses. A pesar de todo, ninguno de los estudios en los que se realizó un examen neurológico objetivo, reportó evidencia de daño a los nervios sensoriales con ingestas por debajo de los 200 mg de piridoxina diariamente (90). Para prevenir la neuropatía sensorial en virtualmente todos los individuos, la Junta de Nutrición y Alimentos del Instituto de Medicina estableció el nivel máximo de ingesta tolerable (NM) de piridoxina en 100 mg/día para adultos (Tabla 3) (14). Debido a que generalmente los estudios controlados con placebo han fallado en demostrar los beneficios terapéuticos de las dosis elevadas de piridoxina, existe poco fundamento para exceder el NM de 100 mg/día.
Ciertos medicamentos interfieren con el metabolismo de la vitamina B6, por lo que algunas personas podrían ser vulnerables a una deficiencia de vitamina B6 si no toman vitamina B6 suplementaria. En el análisis del NHANES 2003-2004, significativamente más usuarias actuales y usuarias pasadas de anticonceptivos orales (AO) de entre mujeres que menstruaban tuvieron niveles bajos de PLP en el plasma en comparación con aquellas que nunca usaron anticonceptivos orales, sugiriendo que el contenido de estrógeno puede interferir con el metabolismo de la vitamina B6 (véase Efectos secundarios de los anticonceptivos orales) (88). Medicamentos antituberculosos (ej. isoniazida y cicloserina), la penicilamina quelante de metales, y fármacos antiparkinsonianos como L-Dopa pueden formar complejos con la vitamina B6 y limitar su biodisponibilidad, de esta manera creando una deficiencia funcional. La biodisponibilidad de la PLP puede ser también reducida por las metilxantinas como la teofilina usada para tratar ciertas condiciones respiratorias (7). El uso a largo plazo de fármacos antinflamatorios no esteroideos (AINE: ej. celecoxib y naproxeno) puede también perjudicar el metabolismo de la vitamina B6 (91). Inversamente, se ha descubierto que altas dosis de vitamina B6 disminuyen la eficiencia de dos anticonvulsivos, el fenobarbital y la fenitoína, y de la L-Dopa (9, 90).
Debido a que la vitamina B6 es requerida para el metabolismo del amino ácido triptófano, la prueba de carga de triptófano (un análisis de los metabolitos de triptófano después de una dosis oral de triptófano) ha sido usada como una evaluación funcional del estatus de la vitamina B6. Pruebas de carga de triptófano anormales en mujeres que tomaron altas dosis de anticonceptivos orales (AO) en 1960 y 1970 sugirieron que estas mujeres estaban deficientes de vitamina B6, lo cual condujo a la prescripción de altas dosis de vitamina B6 (100-150 mg/día) en mujeres que toman AO. Sin embargo, la mayoría de los otros índices del estatus de la vitamina B6 fueron normales en mujeres con altas dosis de anticonceptivos orales, y el contenido de estrógeno de los anticonceptivos orales pareció ser más probable responsable de la anormalidad en el metabolismo del triptófano (88). A pesar de todo, más recientemente, el uso de formulaciones de dosis más bajas también se ha asociado con la insuficiencia de vitamina B6 (88, 92). Aunque aún se desconoce si los AO en realidad perjudican el metabolismo de la vitamina B6 o meramente afectan la distribución tisular de la PLP, el uso de AO puede colocar a las mujeres en un riesgo mayor de una deficiencia de vitamina B6 cuando descontinúen los AO y queden embarazadas (93). También es necesario determinar si los usuarios de AO están en un riesgo mayor padecer enfermedades cardiovasculares a pesar de poseer niveles normales de homocisteína. Finalmente, aunque altas dosis de vitamina B6 (piridoxina) no han demostrado algún beneficio en la prevención del riesgo de efectos secundarios de los AO (94), el uso de suplementos de vitamina B6 puede estar justificado en usuarias actuales y pasadas de anticonceptivos orales.
El Instituto Linus Pauling apoya la IDR para la vitamina B6. El Instituto Linus Pauling recomienda que todos los adultos mayores tomen un suplemento multivitamínico/mineral diariamente, el cual usualmente contiene por lo menos 2 mg de vitamina B6. Esta cantidad está ligeramente por encima de la IDR pero 50 veces aún menor que el nivel máximo de ingesta tolerable (NM) establecido por la Junta de Alimentos y Nutrición (véase Seguridad).
Estudios metabólicos tempranos han indicado que el requerimiento para la vitamina B6 en adultos mayores es de aproximadamente 2 mg al día (95). A pesar de todo, el análisis de la encuesta de población de EE.UU. (NHANES) 2003-2004 mostro que un estatus adecuado de vitamina B6 y niveles bajos de homocisteína fueron asociados con ingestas totales de vitamina B6 iguales a o por encima de los 3 mg/día en personas de 65 años y mayores (88). El Instituto Linus Pauling recomienda que adultos mayores tomen un suplemento multivitamínico/mineral, el cual provee de al menos 2.0 mg de vitamina B6 diariamente.
Escrito en 2000 por:
Jane Higdon, Ph.D.
Instituto Linus Pauling
Universidad Estatal de Oregon
Actualizado en Febrero de 2002 por:
Jane Higdon, Ph.D.
Instituto Linus Pauling
Universidad Estatal de Oregon
Actualizado en Noviembre de 2007 por:
Victoria J. Drake, Ph.D.
Instituto Linus Pauling
Universidad Estatal de Oregon
Actualizado en Mayo de 2014 por:
Barbara Delage, Ph.D.
Instituto Linus Pauling
Universidad Estatal de Oregon
Revisado en Junio de 2014 por:
Jesse F. Gregory, Ph.D.
Profesor, Ciencia de los Alimentos y Nutrición Humana
Universidad de Florida
Traducido al Español en 2015 por:
Silvia Vazquez Lima
Instituto Linus Pauling
Universidad Estatal de Oregon
La actualización del artículo del 2014 fue suscrito en parte, por un donación de Bayer Consumer Care AG, Basel, Suiza.
Originalmente traducido al español en 2012 por Guillermo Sandoval y editado por Andrew Quest (Ph.D.) y Lisette Leyton (Ph.D.), todos provenientes de la Universidad de Chile. Estos esfuerzos fueron patrocinados por el projecto Anillo #ACT1111, CONICYT-Chile, programa PIA.
Derechos de autoría 2000-2024 Instituto Linus Pauling
1. Dakshinamurti S, Dakshinamurti K. Vitamin B6. In: Zempleni J, Rucker RB, McCormick DB, Suttie JW, eds. Handbook of Vitamins. 4th ed. New York: CRC Press (Taylor & Fracis Group); 2007:315-359.
2. Galluzzi L, Vacchelli E, Michels J, et al. Effects of vitamin B6 metabolism on oncogenesis, tumor progression and therapeutic responses. Oncogene. 2013;32(42):4995-5004. (PubMed)
3. McCormick DB. Vitamin B6. In: Bowman BA, Russell RM, eds. Present Knowledge in Nutrition. Vol. I. Washington, D.C.: International Life Sciences Institute; 2006:269-277.
4. Da Silva VR, Russell KA, Gregory JF 3rd. Vitamin B6. In: Erdman JW Jr., Macdonald IA, Zeisel SH. Present Knowldege in Nutrition. 10th ed: Wiley-Blackwell; 2012:307-320.
5. Eliot AC, Kirsch JF. Pyridoxal phosphate enzymes: mechanistic, structural, and evolutionary considerations. Annu Rev Biochem. 2004;73:383-415. (PubMed)
6. Leklem JE. Vitamin B-6. In: Shils M, Olson JA, Shike M, Ross AC, eds. Modern Nutrition in Health and Disease. 9th ed. Baltimore: Williams & Wilkins; 1999:413-422.
7. Clayton PT. B6-responsive disorders: a model of vitamin dependency. J Inherit Metab Dis. 2006;29(2-3):317-326. (PubMed)
8. Schnackerz KD, Benesch RE, Kwong S, Benesch R, Helmreich EJ. Specific receptor sites for pyridoxal 5'-phosphate and pyridoxal 5'-deoxymethylenephosphonate at the α and β NH2-terminal regions of hemoglobin. J Biol Chem. 1983;258(2):872-875. (PubMed)
9. Rios-Avila L, Nijhout HF, Reed MC, Sitren HS, Gregory JF, 3rd. A mathematical model of tryptophan metabolism via the kynurenine pathway provides insights into the effects of vitamin B-6 deficiency, tryptophan loading, and induction of tryptophan 2,3-dioxygenase on tryptophan metabolites. J Nutr. 2013;143(9):1509-1519. (PubMed)
10. Oxenkrug G. Insulin resistance and dysregulation of tryptophan-kynurenine and kynurenine-nicotinamide adenine dinucleotide metabolic pathways. Mol Neurobiol. 2013;48(2):294-301. (PubMed)
11. Huq MD, Tsai NP, Lin YP, Higgins L, Wei LN. Vitamin B6 conjugation to nuclear corepressor RIP140 and its role in gene regulation. Nat Chem Biol. 2007;3(3):161-165. (PubMed)
12. Leklem JE. Vitamin B6. In: Machlin L, ed. Handbook of Vitamins. New York: Marcel Decker Inc; 1991:341-378.
13. Hansen CM, Shultz TD, Kwak HK, Memon HS, Leklem JE. Assessment of vitamin B-6 status in young women consuming a controlled diet containing four levels of vitamin B-6 provides an estimated average requirement and recommended dietary allowance. J Nutr. 2001;131(6):1777-1786. (PubMed)
14. Food and Nutrition Board, Institute of Medicine. Vitamin B6. Dietary Reference Intakes: Thiamin, Riboflavin, Niacin, Vitamin B6, Vitamin B12, Pantothenic Acid, Biotin, and Choline. Washington D.C.: National Academies Press; 1998:150-195. (National Academies Press)
15. Paul L, Ueland PM, Selhub J. Mechanistic perspective on the relationship between pyridoxal 5'-phosphate and inflammation. Nutr Rev. 2013;71(4):239-244. (PubMed)
16. Meydani SN, Ribaya-Mercado JD, Russell RM, Sahyoun N, Morrow FD, Gershoff SN. Vitamin B-6 deficiency impairs interleukin 2 production and lymphocyte proliferation in elderly adults. Am J Clin Nutr. 1991;53(5):1275-1280. (PubMed)
17. Talbott MC, Miller LT, Kerkvliet NI. Pyridoxine supplementation: effect on lymphocyte responses in elderly persons. Am J Clin Nutr. 1987;46(4):659-664. (PubMed)
18. Rimm EB, Willett WC, Hu FB, et al. Folate and vitamin B6 from diet and supplements in relation to risk of coronary heart disease among women. JAMA. 1998;279(5):359-364. (PubMed)
19. Ishihara J, Iso H, Inoue M, et al. Intake of folate, vitamin B6 and vitamin B12 and the risk of CHD: the Japan Public Health Center-Based Prospective Study Cohort I. J Am Coll Nutr. 2008;27(1):127-136. (PubMed)
20. Folsom AR, Nieto FJ, McGovern PG, et al. Prospective study of coronary heart disease incidence in relation to fasting total homocysteine, related genetic polymorphisms, and B vitamins: the Atherosclerosis Risk in Communities (ARIC) study. Circulation. 1998;98(3):204-210. (PubMed)
21. Robinson K, Arheart K, Refsum H, et al. Low circulating folate and vitamin B6 concentrations: risk factors for stroke, peripheral vascular disease, and coronary artery disease. European COMAC Group.Circulation. 1998;97(5):437-443. (PubMed)
22. Robinson K, Mayer EL, Miller DP, et al. Hyperhomocysteinemia and low pyridoxal phosphate. Common and independent reversible risk factors for coronary artery disease. Circulation. 1995;92(10):2825-2830. (PubMed)
23. Lin PT, Cheng CH, Liaw YP, Lee BJ, Lee TW, Huang YC. Low pyridoxal 5'-phosphate is associated with increased risk of coronary artery disease. Nutrition. 2006;22(11-12):1146-1151. (PubMed)
24. Page JH, Ma J, Chiuve SE, et al. Plasma vitamin B(6) and risk of myocardial infarction in women. Circulation. 2009;120(8):649-655. (PubMed)
25. Gerhard GT, Duell PB. Homocysteine and atherosclerosis. Curr Opin Lipidol. 1999;10(5):417-428. (PubMed)
26. Ubbink JB, Vermaak WJ, van der Merwe A, Becker PJ, Delport R, Potgieter HC. Vitamin requirements for the treatment of hyperhomocysteinemia in humans. J Nutr. 1994;124(10):1927-1933. (PubMed)
27. Lamers Y, Coats B, Ralat M, Quinlivan EP, Stacpoole PW, Gregory JF, 3rd. Moderate vitamin B-6 restriction does not alter postprandial methionine cycle rates of remethylation, transmethylation, and total transsulfuration but increases the fractional synthesis rate of cystathionine in healthy young men and women. J Nutr. 2011;141(5):835-842. (PubMed)
28. Huang T, Chen Y, Yang B, Yang J, Wahlqvist ML, Li D. Meta-analysis of B vitamin supplementation on plasma homocysteine, cardiovascular and all-cause mortality. Clin Nutr. 2012;31(4):448-454. (PubMed)
29. Bosy-Westphal A, Holzapfel A, Czech N, Muller MJ. Plasma folate but not vitamin B(12) or homocysteine concentrations are reduced after short-term vitamin B(6) supplementation. Ann Nutr Metab. 2001;45(6):255-258. (PubMed)
30. Lee BJ, Huang MC, Chung LJ, et al. Folic acid and vitamin B12 are more effective than vitamin B6 in lowering fasting plasma homocysteine concentration in patients with coronary artery disease. Eur J Clin Nutr. 2004;58(3):481-487. (PubMed)
31. Bostom AG, Carpenter MA, Kusek JW, et al. Homocysteine-lowering and cardiovascular disease outcomes in kidney transplant recipients: primary results from the Folic Acid for Vascular Outcome Reduction in Transplantation trial. Circulation. 2011;123(16):1763-1770. (PubMed)
32. Qin X, Huo Y, Xie D, Hou F, Xu X, Wang X. Homocysteine-lowering therapy with folic acid is effective in cardiovascular disease prevention in patients with kidney disease: a meta-analysis of randomized controlled trials. Clin Nutr. 2013;32(5):722-727. (PubMed)
33. Clarke R, Halsey J, Bennett D, Lewington S. Homocysteine and vascular disease: review of published results of the homocysteine-lowering trials. J Inherit Metab Dis. 2011;34(1):83-91. (PubMed)
34. Marti-Carvajal AJ, Sola I, Lathyris D, Karakitsiou DE, Simancas-Racines D. Homocysteine-lowering interventions for preventing cardiovascular events. Cochrane Database Syst Rev. 2013;1:CD006612. (PubMed)
35. Zhang C, Chi FL, Xie TH, Zhou YH. Effect of B-vitamin supplementation on stroke: a meta-analysis of randomized controlled trials. PLoS One. 2013;8(11):e81577. (PubMed)
36. Potter K, Hankey GJ, Green DJ, Eikelboom J, Jamrozik K, Arnolda LF. The effect of long-term homocysteine-lowering on carotid intima-media thickness and flow-mediated vasodilation in stroke patients: a randomized controlled trial and meta-analysis. BMC Cardiovasc Disord. 2008;8:24. (PubMed)
37. Loland KH, Bleie O, Blix AJ, et al. Effect of homocysteine-lowering B vitamin treatment on angiographic progression of coronary artery disease: a Western Norway B Vitamin Intervention Trial (WENBIT) substudy. Am J Cardiol. 2010;105(11):1577-1584. (PubMed)
38. Wang X, Qin X, Demirtas H, et al. Efficacy of folic acid supplementation in stroke prevention: a meta-analysis. Lancet. 2007;369(9576):1876-1882. (PubMed)
39. Vitatops Trial Study Group. B vitamins in patients with recent transient ischaemic attack or stroke in the VITAmins TO Prevent Stroke (VITATOPS) trial: a randomised, double-blind, parallel, placebo-controlled trial. Lancet Neurol. 2010;9(9):855-865. (PubMed)
40. Hankey GJ, Eikelboom JW, Yi Q, et al. Antiplatelet therapy and the effects of B vitamins in patients with previous stroke or transient ischaemic attack: a post-hoc subanalysis of VITATOPS, a randomised, placebo-controlled trial. Lancet Neurol. 2012;11(6):512-520. (PubMed)
41. Morris MS, Sakakeeny L, Jacques PF, Picciano MF, Selhub J. Vitamin B-6 intake is inversely related to, and the requirement is affected by, inflammation status. J Nutr. 2010;140(1):103-110. (PubMed)
42. Sakakeeny L, Roubenoff R, Obin M, et al. Plasma pyridoxal-5-phosphate is inversely associated with systemic markers of inflammation in a population of US adults. J Nutr. 2012;142(7):1280-1285. (PubMed)
43. Shen J, Lai CQ, Mattei J, Ordovas JM, Tucker KL. Association of vitamin B-6 status with inflammation, oxidative stress, and chronic inflammatory conditions: the Boston Puerto Rican Health Study. Am J Clin Nutr. 2010;91(2):337-342. (PubMed)
44. Schroecksnadel K, Grammer TB, Boehm BO, Marz W, Fuchs D. Total homocysteine in patients with angiographic coronary artery disease correlates with inflammation markers. Thromb Haemost. 2010;103(5):926-935. (PubMed)
45. Hartman J, Frishman WH. Inflammation and atherosclerosis: a review of the role of interleukin-6 in the development of atherosclerosis and the potential for targeted drug therapy. Cardiol Rev. 2014;22(3):147-151. (PubMed)
46. Friso S, Girelli D, Martinelli N, et al. Low plasma vitamin B-6 concentrations and modulation of coronary artery disease risk. Am J Clin Nutr. 2004;79(6):992-998. (PubMed)
47. Ulvik A, Midttun O, Pedersen ER, Eussen SJ, Nygard O, Ueland PM. Evidence for increased catabolism of vitamin B-6 during systemic inflammation. Am J Clin Nutr. 2014;100(1):250-255. (PubMed)
48. Bleie O, Semb AG, Grundt H, et al. Homocysteine-lowering therapy does not affect inflammatory markers of atherosclerosis in patients with stable coronary artery disease. J Intern Med. 2007;262(2):244-253. (PubMed)
49. Potter K, Lenzo N, Eikelboom JW, Arnolda LF, Beer C, Hankey GJ. Effect of long-term homocysteine reduction with B vitamins on arterial wall inflammation assessed by fluorodeoxyglucose positron emission tomography: a randomised double-blind, placebo-controlled trial. Cerebrovasc Dis. 2009;27(3):259-265. (PubMed)
50. Selhub J, Bagley LC, Miller J, Rosenberg IH. B vitamins, homocysteine, and neurocognitive function in the elderly. Am J Clin Nutr. 2000;71(2):614S-620S. (PubMed)
51. Pawelec G, Goldeck D, Derhovanessian E. Inflammation, ageing and chronic disease. Curr Opin Immunol. 2014;29C:23-28. (PubMed)
52. Ford AH, Almeida OP. Effect of homocysteine lowering treatment on cognitive function: a systematic review and meta-analysis of randomized controlled trials. J Alzheimers Dis. 2012;29(1):133-149. (PubMed)
53. Hankey GJ, Ford AH, Yi Q, et al. Effect of B vitamins and lowering homocysteine on cognitive impairment in patients with previous stroke or transient ischemic attack: a prespecified secondary analysis of a randomized, placebo-controlled trial and meta-analysis. Stroke. 2013;44(8):2232-2239. (PubMed)
54. Douaud G, Refsum H, de Jager CA, et al. Preventing Alzheimer's disease-related gray matter atrophy by B-vitamin treatment. Proc Natl Acad Sci U S A. 2013;110(23):9523-9528. (PubMed)
55. Hackett ML, Yapa C, Parag V, Anderson CS. Frequency of depression after stroke: a systematic review of observational studies. Stroke. 2005;36(6):1330-1340. (PubMed)
56. Lenze EJ, Munin MC, Skidmore ER, et al. Onset of depression in elderly persons after hip fracture: implications for prevention and early intervention of late-life depression. J Am Geriatr Soc. 2007;55(1):81-86. (PubMed)
57. Merete C, Falcon LM, Tucker KL. Vitamin B6 is associated with depressive symptomatology in Massachusetts elders. J Am Coll Nutr. 2008;27(3):421-427. (PubMed)
58. Pan WH, Chang YP, Yeh WT, et al. Co-occurrence of anemia, marginal vitamin B6, and folate status and depressive symptoms in older adults. J Geriatr Psychiatry Neurol. 2012;25(3):170-178. (PubMed)
59. Skarupski KA, Tangney C, Li H, Ouyang B, Evans DA, Morris MC. Longitudinal association of vitamin B-6, folate, and vitamin B-12 with depressive symptoms among older adults over time. Am J Clin Nutr. 2010;92(2):330-335. (PubMed)
60. Almeida OP, Marsh K, Alfonso H, Flicker L, Davis TM, Hankey GJ. B-vitamins reduce the long-term risk of depression after stroke: The VITATOPS-DEP trial. Ann Neurol. 2010;68(4):503-510. (PubMed)
61. Larsson SC, Orsini N, Wolk A. Vitamin B6 and risk of colorectal cancer: a meta-analysis of prospective studies. JAMA. 2010;303(11):1077-1083. (PubMed)
62. Wu W, Kang S, Zhang D. Association of vitamin B6, vitamin B12 and methionine with risk of breast cancer: a dose-response meta-analysis. Br J Cancer. 2013;109(7):1926-1944. (PubMed)
63. Xiao Q, Freedman ND, Ren J, Hollenbeck AR, Abnet CC, Park Y. Intakes of folate, methionine, vitamin B6, and vitamin B12 with risk of esophageal and gastric cancer in a large cohort study. Br J Cancer. 2014;110(5):1328-1333. (PubMed)
64. Zhang XH, Ma J, Smith-Warner SA, Lee JE, Giovannucci E. Vitamin B6 and colorectal cancer: current evidence and future directions. World J Gastroenterol. 2013;19(7):1005-1010. (PubMed)
65. Song Y, Manson JE, Lee IM, et al. Effect of combined folic acid, vitamin B(6), and vitamin B(12) on colorectal adenoma. J Natl Cancer Inst. 2012;104(20):1562-1575. (PubMed)
66. Curhan GC, Willett WC, Speizer FE, Stampfer MJ. Intake of vitamins B6 and C and the risk of kidney stones in women. J Am Soc Nephrol. 1999;10(4):840-845. (PubMed)
67. Taylor EN, Stampfer MJ, Curhan GC. Dietary factors and the risk of incident kidney stones in men: new insights after 14 years of follow-up. J Am Soc Nephrol. 2004;15(12):3225-3232. (PubMed)
68. Chetyrkin SV, Kim D, Belmont JM, Scheinman JI, Hudson BG, Voziyan PA. Pyridoxamine lowers kidney crystals in experimental hyperoxaluria: a potential therapy for primary hyperoxaluria. Kidney Int. 2005;67(1):53-60. (PubMed)
69. Scheinman JI, Voziyan PA, Belmont JM, Chetyrkin SV, Kim D, Hudson BG. Pyridoxamine lowers oxalate excretion and kidney crystals in experimental hyperoxaluria: a potential therapy for primary hyperoxaluria. Urol Res. 2005;33(5):368-371. (PubMed)
70. Pearl PL, Gospe SM, Jr. Pyridoxine or pyridoxal-5'-phosphate for neonatal epilepsy: The distinction just got murkier. Neurology. 2014;82(16):1392-1394. (PubMed)
71. Stockler S, Plecko B, Gospe SM, Jr., et al. Pyridoxine dependent epilepsy and antiquitin deficiency: clinical and molecular characteristics and recommendations for diagnosis, treatment and follow-up. Mol Genet Metab. 2011;104(1-2):48-60. (PubMed)
72. Picker JD, Levy HL. Homocystinuria caused by cystathionine β-synthase deficiency. In: Pagon RA, Adam MP, Ardinger HH, et al., eds. GeneReviews®. Seattle, Washington: University of Washington, Seattle 1993-2014. (PubMed)
73. Maltepe C, Koren G. The management of nausea and vomiting of pregnancy and hyperemesis gravidarum--a 2013 update. J Popul Ther Clin Pharmacol. 2013;20(2):e184-192. (PubMed)
74. Magee LA, Mazzotta P, Koren G. Evidence-based view of safety and effectiveness of pharmacologic therapy for nausea and vomiting of pregnancy (NVP). Am J Obstet Gynecol. 2002;186(5 Suppl Understanding):S256-261. (PubMed)
75. Sahakian V, Rouse D, Sipes S, Rose N, Niebyl J. Vitamin B6 is effective therapy for nausea and vomiting of pregnancy: a randomized, double-blind placebo-controlled study. Obstet Gynecol. 1991;78(1):33-36. (PubMed)
76. Vutyavanich T, Wongtra-ngan S, Ruangsri R. Pyridoxine for nausea and vomiting of pregnancy: a randomized, double-blind, placebo-controlled trial. Am J Obstet Gynecol. 1995;173(3 Pt 1):881-884. (PubMed)
77. Matthews A, Haas DM, O'Mathuna DP, Dowswell T, Doyle M. Interventions for nausea and vomiting in early pregnancy. Cochrane Database Syst Rev. 2014;3:CD007575. (PubMed)
78. Koren G, Clark S, Hankins GD, et al. Effectiveness of delayed-release doxylamine and pyridoxine for nausea and vomiting of pregnancy: a randomized placebo controlled trial. Am J Obstet Gynecol. 2010;203(6):571 e571-577. (PubMed)
79. Wyatt KM, Dimmock PW, Jones PW, Shaughn O'Brien PM. Efficacy of vitamin B-6 in the treatment of premenstrual syndrome: systematic review. BMJ. 1999;318(7195):1375-1381. (PubMed)
80. Whelan AM, Jurgens TM, Naylor H. Herbs, vitamins and minerals in the treatment of premenstrual syndrome: a systematic review. Can J Clin Pharmacol. 2009;16(3):e407-429. (PubMed)
81. Gariballa S, Forster S. Effects of dietary supplements on depressive symptoms in older patients: a randomised double-blind placebo-controlled trial. Clin Nutr. 2007;26(5):545-551. (PubMed)
82. Gariballa S. Testing homocysteine-induced neurotransmitter deficiency, and depression of mood hypothesis in clinical practice. Age Ageing. 2011;40(6):702-705. (PubMed)
83. Ellis J, Folkers K, Watanabe T, et al. Clinical results of a cross-over treatment with pyridoxine and placebo of the carpal tunnel syndrome. Am J Clin Nutr. 1979;32(10):2040-2046. (PubMed)
84. Ellis JM, Kishi T, Azuma J, Folkers K. Vitamin B6 deficiency in patients with a clinical syndrome including the carpal tunnel defect. Biochemical and clinical response to therapy with pyridoxine. Res Commun Chem Pathol Pharmacol. 1976;13(4):743-757. (PubMed)
85. Keniston RC, Nathan PA, Leklem JE, Lockwood RS. Vitamin B6, vitamin C, and carpal tunnel syndrome. A cross-sectional study of 441 adults. J Occup Environ Med. 1997;39(10):949-959. (PubMed)
86. Aufiero E, Stitik TP, Foye PM, Chen B. Pyridoxine hydrochloride treatment of carpal tunnel syndrome: a review. Nutr Rev. 2004;62(3):96-104. (PubMed)
87. Ryan-Harshman M, Aldoori W. Carpal tunnel syndrome and vitamin B6. Can Fam Physician. 2007;53(7):1161-1162. (PubMed)
88. Morris MS, Picciano MF, Jacques PF, Selhub J. Plasma pyridoxal 5'-phosphate in the US population: the National Health and Nutrition Examination Survey, 2003-2004. Am J Clin Nutr. 2008;87(5):1446-1454. (PubMed)
89. Hendler SS, Rorvik DR, eds. PDR for Nutritional Supplements. Montvale: Medical Economics Company, Inc; 2001.
90. Bender DA. Non-nutritional uses of vitamin B6. Br J Nutr. 1999;81(1):7-20 (PubMed)
91. Chang HY, Tang FY, Chen DY, et al. Clinical use of cyclooxygenase inhibitors impairs vitamin B-6 metabolism. Am J Clin Nutr. 2013;98(6):1440-1449. (PubMed)
92. Lussana F, Zighetti ML, Bucciarelli P, Cugno M, Cattaneo M. Blood levels of homocysteine, folate, vitamin B6 and B12 in women using oral contraceptives compared to non-users. Thromb Res. 2003;112(1-2):37-41. (PubMed)
93. Wilson SM, Bivins BN, Russell KA, Bailey LB. Oral contraceptive use: impact on folate, vitamin B(6), and vitamin B(1)(2) status. Nutr Rev. 2011;69(10):572-583. (PubMed)
94. Villegas-Salas E, Ponce de Leon R, Juarez-Perez MA, Grubb GS. Effect of vitamin B6 on the side effects of a low-dose combined oral contraceptive. Contraception. 1997;55(4):245-248. (PubMed)
95. Ribaya-Mercado JD, Russell RM, Sahyoun N, Morrow FD, Gershoff SN. Vitamin B-6 requirements of elderly men and women. J Nutr. 1991;121(7):1062-1074. (PubMed)