コレカルシフェロールとエルゴカルシフェロールは生物学的に不活性なビタミンD前駆体で、肝臓や腎臓で生物活性のある形態に変換されねばならない(図1)。実際、食事から摂取したりUVBにあたって表皮で合成されたりした後では、どちらの形態のビタミンDも血液中に入ってビタミンD結合タンパク質によって(および程度は低いがアルブミンによっても)肝臓まで輸送される。肝実質細胞(肝細胞)では、ビタミンDは25-ヒドロキシビタミンD(カルシジオール;カルシフェジオール)にヒドロキシル化(=水酸化)される。日光を浴びることや食事からビタミンDを摂取することで、25-ヒドロキシビタミンDの血清濃度が上がる。25-ヒドロキシビタミンDは血液中のビタミンDの主要な形態であり、25-ヒドロキシビタミンD2と25-ヒドロキシビタミンD3の血清濃度の合計は、ビタミンDの栄養状態の指標として使用される(3)。腎臓の25-ヒドロキシビタミンD-1α-ヒドロキシラーゼ酵素(CYP27B1としても知られる)は最終的に、25-ヒドロキシビタミンDを1α,25-ジヒドロキシビタミンD(カルシトリオール)に変換する第二のヒドロキシル化の触媒作用をする。腎臓での1α,25-ジヒドロキシビタミンDの生成は、血清中のリン、カルシウム、副甲状腺ホルモン(PTH)、線維芽細胞増殖因子-23(FGF-23)、および1α,25-ジヒドロキシビタミンDそのものなどのいくつかの要因によって調整されている。腎臓は1α-ヒドロキシラーゼ(=水酸化酵素)が活動する主要な部位であるが、皮膚、副甲状腺、乳房、結腸、前立腺、および免疫細胞や骨細胞などの様々な組織でも1α,25-ジヒドロキシビタミンDの腎臓外での生成が行われる(2)。体内でのビタミンDのほとんどの生理的効果は、1α,25-ジヒドロキシビタミンDの活性に関連している(4)。ビタミンDの様々な形態を図1に示す。
血清カルシウム濃度を狭い範囲に維持することは、神経系の正常な機能や骨の成長および骨密度の維持に極めて重要である。体がカルシウムを効率的に利用するために、ビタミンDは不可欠である(1)。副甲状腺が血清カルシウム濃度を感知し、それが正常値より少ないと副甲状腺ホルモン(PTH)を分泌する(図3参照)。PTHの上昇が腎臓での25-ヒドロキシビタミンD3-1α-ヒドロキシラーゼ酵素の活性を刺激し、その結果1α,25-ジヒドロキシビタミンDの生成が増える。ビタミンDの活性型である1α,25-ジヒドロキシビタミンDは血液中に放出され、標的組織に運ばれる。標的細胞の中で1α,25-ジヒドロキシビタミンDはVDRと結合してそれを活性化し、血清カルシウム濃度を正常化する遺伝子の発現を変化させる。この遺伝子は(1)食事性カルシウムの腸における吸収を増やし、(2)腎臓でろ過されたカルシウムの再吸収を増やし、(3)正常な血清カルシウム濃度を維持するのに必要な食事性のカルシウムが不足している場合には骨からカルシウムを移動させる(7)。
カルシウムとリンの恒常性の調整は密接に関連しており、カルシウム調整ホルモンであるPTHと1α,25-ジヒドロキシビタミンDは、血清リン濃度も調整可能である。特に、1α,25-ジヒドロキシビタミンDは小腸でのナトリウム・リン酸共輸送体の発現を刺激することで、腸でのリンの吸収を増やす。PTHは腎臓でのリンの再吸収を減らして尿へのリンの排出を増やすが、1α,25-ジヒドロキシビタミンDが直接的に腎臓でのリンの輸送を調整することができるのかどうかは不明である。リン利尿ホルモンであり、骨芽細胞(骨を造る細胞)で分泌される線維芽細胞増殖因子-23(FGF-23)は、25-ヒドロキシビタミンD-1α-ヒドロキシラーゼ酵素を抑制することで、1α,25-ジヒドロキシビタミンDの生成を制限する(図3)((8)の文献でレビュー)。
急速に分裂している細胞は増殖していると言う。分化の結果、細胞が特定の機能に特化する。一般的に、細胞分化は増殖の低下につながる。細胞増殖は成長や傷の治癒には不可欠であるが、特定の突然変異を持つ細胞の制御不能な増殖は、がんになる可能性がある。活性のあるビタミンD形態である1α,25-ジヒドロキシビタミンDは増殖を抑制し、VDRと結合することで細胞分化を刺激する(1)。
VDRを介して作用する1α,25-ジヒドロキシビタミンDは、免疫系の強力な調整役である。VDRは、樹状細胞やマクロファージといった制御性T細胞や抗原提示細胞などの免疫系のほとんどの細胞で発現する(9)。特定の状況では、単球、マクロファージ、およびT細胞は25-ヒドロキシビタミンD3-1α-ヒドロキシラーゼ酵素を発現させて1α,25-ジヒドロキシビタミンDを生成し、局所的に免疫反応の調整作用をする(10,11)。1α,25-ジヒドロキシビタミンDが免疫系の機能に様々な効果をもたらし、これが生来の免疫を強化したり自己免疫の発生を抑制しているのかもしれないという少なからぬ科学的エビデンスがある(12)。逆に、ビタミンDの欠乏は免疫系の整合性を損なって、不適切な免疫反応を起こすことになるのかもしれない(「自己免疫疾患」の項参照)。
VDRは膵臓のインスリン分泌細胞によって発現し、動物研究の結果では、1α,25-ジヒドロキシビタミンDはインスリン需要が増えた状況でのインスリンの分泌に関与することが示唆されている(13,14)。横断研究および前向き研究で、ビタミンDの栄養状態が不充分だと、インスリンの分泌および2型糖尿病(非インスリン依存性糖尿病)の耐糖能に悪影響を及ぼすかもしれないことが示唆されている((15)の文献でレビュー)。
幼児や子供では、重篤なビタミンD欠乏症は骨の石灰化不全を起こす。骨芽細胞によるリン酸カルシウム結晶の生成を起こす石灰化のプロセスは、骨の硬さや強さを決定する。ビタミンD欠乏症は、急速に成長する骨に深刻に影響する。骨の成長板は大きくなり続けるが、適切な石灰化ができないと、体重を支える四肢(腕と脚)が曲がる。幼児では、頭蓋骨の泉門(柔らかい部分)の閉鎖が遅れることになるかもしれず、また横隔膜に引っ張られて胸郭が変形する可能性がある。重篤なケースでは、血清カルシウム濃度が低い(低カルシウム血症)ことで痙攣が起きる可能性がある。ビタミンD欠乏症に関しては食品の強化で満足のいく結果になっているが、世界中では栄養不足のくる病はいまだに報告されている(19,20)。
成人の骨はもはや成長はしないが、常に代謝回転、つまり「再形成」の状態にある。重篤なビタミンD欠乏症の成人では、コラーゲン性骨基質は保持されているものの骨塩の喪失が進行して骨が柔らかくなったり(骨軟化症)、骨の痛みがあったり、骨粗しょう症のリスクが上がったりする(21)。
ビタミンD欠乏症は、子供や成人に筋力低下や筋肉痛を引き起こす。デンマークに住むアラブ人およびデンマーク人のイスラム教徒女性の研究で、筋肉痛や筋力低下はビタミンD欠乏症の顕著な症状であった(22)。持続する非特異性の筋骨格痛を診てもらうためににミネソタ州の診療所を訪れた150人の連続症例の横断研究では、93%が血清中の25-ヒドロキシビタミンD濃度が20ng/mL以下で平均で12.1ng/mLであり、これはビタミンD不足を呈している(23)。筋力がなくなると転倒や骨折のリスクが大幅に高くなり、年配者では特にそうである(24)。加えて、長期にわたるビタミンDの不足は年配者の骨粗しょう症の要因であるかもしれない(「骨粗しょう症」の項参照)。
ビタミンDの不足がくる病や骨軟化症以上の重篤な健康問題を起こすことを広く知らしめるため、ビタミンDの栄養状態を正確に評価する必要性が強調される。現在では、血清25-ヒドロキシビタミンDの全体濃度(1ng/mLが2.5nmol/Lに相当)の測定が、ビタミンDの状態を示す最善の指標であると合意されている。しかしながら、現在のカットオフ値(=しきい値)がビタミンD不足や欠乏症の状態を定義するのに最適であることを確実にする質の高いエビデンスがいまだに必要である(40)。さらに、大部分が標準化されていない研究データを用いての指針が開発できるように、商業的および研究室で開発される25-ヒドロキシビタミンDアッセイ(=測定法)の標準化への努力がやっと最近になってなされている(49)。ビタミンDの充足濃度を示す試験室での基準値はもともと、健康な者のコホートにおける血清中の25-ヒドロキシビタミンD濃度に基づいている。しかし、二次性副甲状腺機能亢進症や骨量減少を防ぐための健康に基づくカットオフ値は、それよりかなり高くなくてはいけないことが追加的な研究で示唆されている。実際、血清の25-ヒドロキシビタミンD濃度が8~10ng/mL(20~25-nmol/L)未満だと、くる病や骨軟化症を伴う重篤な欠乏症を示すと考えられているが、いくつかの研究でPTH濃度(50,51)やカルシウム吸収(52)は、血清の25-ヒドロキシビタミンD濃度が32ng/mL(80nmol/L)未満では最適化されなかったことが観察された。
今のところ、より最近の研究でもPTHの抑制と最適なカルシウム吸収に関する血清の25-ヒドロキシビタミンD濃度のしきい値を見つけることはできなかった。一方で312,962の臨床試料の横断的分析では、血清中のPTHおよび25-ヒドロキシビタミンD濃度の測定値のペアが逆相関を示すよく理論に合うグラフにおいて、25-ヒドロキシビタミンD濃度が70ng/mL(175nmol/L)超でもPTH抑制のしきい値のエビデンスはわからなかった(53)。これは、40ng/mL(100nmol/L)以上の25-ヒドロキシビタミンD濃度に対するPTHの最大抑制値を推測した米国全国健康栄養調査(NHANES2003-2006)の解析と矛盾する(54)。さらに、どちらの研究も血清25-ヒドロキシビタミンD濃度が優に20ng/mL(50nmol/L)を超える者に軽度の副甲状腺機能亢進症(血清PTHが65pg/mL超)のエビデンスを見つけており、血清PTHをビタミンD欠乏症の感度の良い指標として使用することに疑問を呈している(53,54)。一方で、ビタミンD不足(血清中の25-ヒドロキシビタミンD濃度が20ng/mL未満)の閉経後の女性に400~4,800 IUのビタミンD3を毎日補給した無作為化プラセボ対照試験では、20~66ng/mLという正常な25-ヒドロキシビタミンD濃度の範囲にわたって、カルシウムの吸収にわずかな変化(6%)しか見られなかった(55)。
米国医学研究所(IOM)によって提唱されている現在のカットオフ値は以下のようである:血清25-ヒドロキシビタミンD濃度が12ng/mL(30nmol/L)未満で欠乏症、12~19ng/mL(30~49nmol/L)で不足、20~50ng/mL(50~125nmol/L)で充足である(56)。米国医学研究所で設定した食事摂取基準(EAR, RDA)は、骨の健康と最適なカルシウム吸収を維持するのに適切である血液中の25-ヒドロキシビタミンD濃度を達成することを意図している(57)。
米国医学研究所の食品栄養委員会(FNB)は、骨の健康に必要なビタミンDの量に基づく推奨量(RDA)を2010年に設定した。RDAは1997年に設定された目安量(AI)よりも増やされたが、一般の人々の副甲状腺機能亢進症を最小限にして骨の健康を最善にする最適な推奨摂取量や血清25-ヒドロキシビタミンD濃度についてはいまだに議論のあるところである(40)。年齢層別および性別ごとのビタミンDのRDAを表1に示す。
15,099人(うち77%が白人)が参加した第三回米国全国健康栄養調査(NHANES III)の9年間に及ぶ追跡分析で、ビタミンD標準化プログラム(VDSP)によって開発された方法論により標準化された血清25-ヒドロキシビタミンD濃度と死亡率との関係が調べられた。その分析からは、血清25-ヒドロキシビタミンD濃度が16ng/mL未満に減少すると総死亡率が上昇することが示唆された(60)。対照的に、ベースライン(=調査開始時)血清25-ヒドロキシビタミンD濃度が16~40ng/mLの範囲だと、総死亡率リスクにはほとんど変化がなかった(60)。標準化された25-ヒドロキシビタミンD濃度と死亡率の関係を考慮した平均で10.5年間の8つの前向きコホート研究のメタ解析でも、似たような結果が得られた。25-ヒドロキシビタミンD濃度が30~39.99ng/mLの場合の死亡リスクに比べて、濃度が12~15.99ng/mLだと死亡リスクが19%高く、12ng/mL未満だと56%高かったことがわかった(61)。800,000人超が参加した73の前向きコホート研究のメタ解析で、血清25-ヒドロキシビタミンD濃度が最低位の三分位群は最高位の三分位群に比べて、総死亡率(+35%)、心血管疾患による死亡率(+35%)、およびがんによる死亡率(+14%)のすべてでリスクが高いことがわかった(62)。しかしデンマークの95,766人の成人による3つの大規模コホートのデータを、交絡因子因果および逆因果によるバイアスを限定するメンデルランダム化解析(63)で分析すると、遺伝的な血漿25-ヒドロキシビタミンD低濃度は総死亡率とがん関連の死亡率には有意な相関があったが、心血管疾患関連の死亡率とは相関がないことがわかった(64)。なお、無作為化対照試験の2つのメタ解析で、ビタミンDとカルシウムを補給した年配者の総死亡率がやや低下したものの、ビタミンD単独ではそうではなかったことが示唆された(62,65)。ビタミンD単独またはカルシウムとの組み合わせでの補給が食事が充分に足りている者の早期死亡を防ぐことに役立つのかどうかを、さらなるプラセボ対照試験で調べる必要がある。
骨粗しょう症
ビタミンDの栄養状態、骨粗鬆症、および骨折リスク
骨粗しょう症の原因には多くの因子があるが、年配の成人にはビタミンDの不足が重要な病因学的要素となりうる。骨粗しょう症は、60~70歳の女性の3分の1に、80歳以上の女性の3分の2に影響している(66)。骨粗しょう症を患う2,600人超の閉経後の女性による多国間(北緯64度から南緯38度までの18ヶ国)調査で、31%の被験者の25-ヒドロキシビタミンD濃度が20ng/mL(50nmol/L)よりも低かったことが明らかになった(67)。さらに、111人の大腿骨頚部骨折患者と73人の対照群(中央値が83歳)を含む症例対照研究で、患者の血清中の25-ヒドロキシビタミンD濃度およびビタミンK1濃度がともに低いと、大腿骨頚部骨折のリスクが対照群よりも高まるという関連があることがわかった(68)。日光にあたったり食事から摂取したりしてビタミンDを充分にしておかないと、腸でのカルシウムの吸収が大きく減りうる。これが副甲状腺によるPTH分泌を増やし、PTHが高いままだと骨からのカルシウムの再吸収を増やすことになり、結果的に骨粗しょう症による骨折のリスクを上昇させることになるかもしれない(69)。
ビタミンD補給と骨密度
骨密度(BMD)が進行的に減って骨減少症(骨粗しょう症の前兆)や骨粗しょう症になるのは、年配者、特に老齢者によく見られる。4,000人超(平均年齢59歳)が参加した23の無作為化対照試験をメタ解析した結果、腰椎、大腿骨頚部、転子、前腕、および全身といった調査対象の5箇所の骨格部位のどこにおいても、ビタミンDの補給がBMDに及ぼす効果のエビデンスはほとんど見られなかった。BMDのかなりの上昇が報告されたのは、大腿骨頚部のみであった(70)。しかしながら、それはこの年齢層の者のカルシウム摂取が適切で、それによって正常な骨の新陳代謝が行われているため、骨量の増加にビタミンD補給の効果がないことを示唆しているのかもしれない(71)。逆に年配の個人では、ビタミンD補給は適切な血清25-ヒドロキシビタミンD濃度を達成したり維持したりして、二次的な副甲状腺機能亢進症や骨密度減少を防ぐのに不可欠である(72)。
ビタミンD補給と骨折リスク
米国で18年にわたって72,000人超の閉経後の女性を追跡した前向きコホート研究で、少なくとも600 IU/日のビタミンDを食事やサプリメントから摂取していた者は、140 IU/日未満のビタミンDしか摂取しなかった女性よりも、骨粗しょう症での大腿骨頚部骨折リスクが37%低かったことがわかった(73)。しかしながら、36,282人の閉経後の女性によるWomen's Health Initiative trial(=女性の健康イニシアティブ研究)では、1,000mgのカルシウムとともに400 IUのビタミンD3を毎日補給しても、大腿骨頚部骨折リスクはプラセボに比べて大きく減ることがなく(74)、骨折リスクの減少が見られるのに必要なビタミンD摂取のしきい値があるかもしれないことが示唆される。この試験データの遺伝子解析結果では、骨折リスクに対するビタミンDとカルシウム補給の有益な効果は、低骨密度になる遺伝子リスクが最も少ない女性に限られているかもしれないことが示唆された(75)。それでも、アドヒアランス(=服薬遵守)が悪いことや結果を交絡させかねない追加のビタミンDやカルシウムのサプリメント摂取が認められていたことなどから、この研究には疑問が呈されてきた。さらに、閉経後の女性の集団における主要な交絡要因であるにもかかわらず、この集団の骨格の健康状態に対するビタミンDやカルシウムの効果の研究において、ホルモン補充療法の適用が考慮されていなかった(57,76)。
カルシウムまたはビタミンDの無作為化評価研究(RECORD)という別の研究では、ビタミンD3単独(800 IU/日)またはカルシウム(1,000mg/日)との組み合わせでの経口補給は、軽度の骨粗しょう症性骨折の外傷をすでにしたことのある年配の成人の骨粗しょう症性骨折の発生を予防することはできなかったことが報告された(77)。後者の研究でも、アドヒアランスが悪いことおよび/またはビタミンD補給によって血清25-ヒドロキシビタミンD濃度が骨折を防ぐであろうほどには上昇しなかったことなどを含むいくつかの制限が、効果がなかったことの原因であるかもしれない(78)。治療へのアドヒアランスが高かったにも関わらず、3年間のビタミンD評価試験(ViDA)では、ビタミンD3補給(初期に200,000 IU/月で、その後100,000 IU/月)をしてもプラセボ補給をしても、閉経後の女性の非椎体骨折の発生率は同じようなものだった(79)。
それでも、米国予防医学専門委員会が52,915人の年配者(そのうち69%は閉経後の女性)を含む11の無作為化プラセボ対照試験をメタ解析し、最大7年間ビタミンD(300~1,000 IU/日)およびカルシウム(500~1,200mg/日)を補給したら、新しく骨折するリスクが12%減ったことを発見した(80)。65歳以上の31,022人(91%が女性)に対するビタミンD補給の効果に関する11の無作為化二重盲検プラセボ対照試験の別のメタ解析では、ビタミンD摂取が最大(792~2,000 IU/日)の者は大腿骨頚部骨折のリスクが30%、その他の脊髄以外の骨折のリスクが14%低かったことが示された(81)。なお、ビタミンDとカルシウムの組み合わせが年配の男性や閉経後の女性の骨折を予防する効果を調べた試験の第三のメタ解析でも、大腿骨頚部骨折を含む新たな骨折のリスクは、補給した者のほうが対照群に比べてかなり下がったとの結論になった(82)。興味深いことにこれらの3つのメタ解析では、ビタミンDとカルシウムの補給によって骨折が予防されるのは、施設に入っている年配者に限られた。実際、地域社会で生活をしている年配者の骨折リスクは大きく下がることはなかった(80~82)。
ビタミンD補給と姿勢バランス、筋力、および転倒リスク
840人の転倒経験者と1,330人の非転倒経験者を調べた7つの観察研究のメタ解析で、転倒経験者は非経験者に比べて血清25-ヒドロキシビタミンD濃度がかなり低いことがわかった(83)。さらに、3つの観察研究からの4つのコホートのメタ解析で、ビタミンDの栄養状態と転倒リスクの間に控えめながらも有意な逆相関があることが報告された(83)。いくつかの無作為化対照試験で年配の被験者の筋力、姿勢バランス、または転倒リスクに対するビタミンD補給の影響が調べられた。これらの試験のメタ解析で、筋力および運動性についてそれぞれ1種類の検査を基にしたビタミンD補給効果の限定的なエビデンスが見られた。しかしながら、ビタミンDの栄養状態が最適ではない(平均血清25-ヒドロキシビタミンD濃度が20ng/mL未満)160人の閉経後の女性(50~65歳)による最近の無作為化二重盲検プラセボ対照試験で、1,000 IU/日のビタミンD3補給により、ビタミンDの栄養状態だけでなく上肢および下肢の筋力および姿勢バランスのパラメータが大きく改善した(84,85)。転倒および転倒の繰り返しのリスクは、ビタミンD3補給をした群よりも対照群の方が2~3倍高いことがわかった(85)。対照的に、200人の年配者(そのうち58%はベースライン血清25-ヒドロキシビタミンD濃度が20ng/mL未満)による12ヶ月の別の無作為化対照研究では、2,000 IU/日(10μgのカルシジオール補給も有りもしくは無し)の補給をした者には、800 IU/日の補給をした者と比べて下肢の機能または転倒の可能性に関して何の利点も示されなかった(86)。最近発表されたViDA試験の事後解析で、平均で3.4年間ビタミンD補給(100,000 IU/月、すなわち約3,350 IU/日)またはプラセボを摂取するように無作為化されても、5,108人の地域在住参加者(50~84歳)の転倒の可能性や報告数に何の違いもなかったことがわかった(79)。ViDAの参加者のほとんどは血清25-ヒドロキシビタミンD濃度が20ng/mL以上で、少なくともこれがビタミンDが転倒におよぼす影響がなかったことの説明になっているかもしれない(87)。
全体的に、800~1,000 IU/日のビタミンD3補給が年配者の転倒や骨折率を減らすのに役立つのではないかということが、現在のエビデンスから示唆される。ビタミンD補給が骨の健康を維持するのに有効であるためには、食事からの適切なカルシウム摂取(1,000~1,200mg/日)をすべきである(「カルシウム」の項目の別記事を参照)(88)。
がん
生態学的研究で、北緯とビタミンD欠乏症とがんの発生率との関連が最初に示唆された(89)。1980年代からのいくつかの前向きコホート研究で、ビタミンD摂取またはビタミンDの栄養状態と様々な種類のがんとの関連が調べられてきた。137,567人を対象とした16の前向き研究の2013年のシステマティックレビュー(=系統的総括)とメタ解析で、血液中の25-ヒドロキシビタミンD濃度が20ng/mL(50nmol/L)増加するごとにがん全体の発生率が11%減少し、がんの死亡率も17%低下することが報告された。しかし、8つの研究の性別によるサブグループ(=下位群)の解析で、女性では血液中のビタミンD濃度とがんの死亡率には逆相関があったものの、男性ではそれがなかった(90)。さらに、ビタミンD受容体(VDR)をコード化する遺伝子のいくつかの変異が個人のビタミンDの状態に影響し、それによって部位ごとのがんのなりやすさに変化があったり(91)、がんからの回復に影響したりしている(92)かもしれないことが、増大するエビデンスによって示唆されている。なお、乳がん、肺がん、皮膚がん(メラノーマ)、結腸がん、および骨がんを含む多くの悪性腫瘍がVDRを発現させることがわかっており(93)、これらがビタミンDの作用によって影響されやすいかもしれないことが示唆される。多数の実験的研究で、1α,25-ジヒドロキシビタミンDやその類似体などの生物学的に活性のある形態のビタミンDは、多種のがん状態の細胞の分裂抑制および/または細胞分化や細胞死(アポトーシス)の誘発によって、VDRと結合する際に細胞の運命を制御しうることが実証された(94)。
結腸直腸がん
結腸がんの死亡率の地理的分布は、かつてのくる病の地理的分布と似ている(95)。このことは、日光にあたることが減りビタミンDの栄養状態が悪化することが結腸がんのリスク上昇に関係するのではないかという状況的な証拠を提示している。観察研究からのエビデンスは概ねこの仮設を支持している。4つの前向きコホート研究、4つの横断研究、および7つの症例対照研究の最近のメタ解析で、血液中のビタミンD濃度と悪性に変わる可能性のある良性腫瘍である結腸直腸腺腫の発生率に逆相関があることがわかった(96)。この解析で、血清25-ヒドロキシビタミンD濃度が最高位の四分位群は最低位の四分位群に比べて32%のリスク減少があることがわかった(96)。さらに、ビタミンD摂取が多いことと血清中の25-ヒドロキシビタミンD濃度が高いことが結腸直腸がんのリスク減少に関連があることを示唆する前向きコホート研究のメタ解析からの強力なエビデンスがある(97~99)。4つの前向きコホート研究、17のコホート内症例対照研究、および3つの症例対照研究の最新のメタ解析で、血清25-ヒドロキシビタミンD濃度が最高位の四分位群は、最低位の四分位群に比べて結腸直腸がんのリスクが38%低いことがわかった(100)。 5つのコホート内症例内対照研究に基づく初期の用量反応解析では、33ng/mL以上の血清25-ヒドロキシビタミンD濃度だと、(12ng/mL以下と比較して)結腸直腸がんリスクが50%低下するという関連があると推測された(101)。
しかしながら、女性の健康イニシアティブ研究に参加した36,282人の閉経後の女性による7年間の無作為化二重盲検プラセボ対照試験では、ビタミンD3(400 IU/日)にカルシウム(1,000mg/日)を組み合わせて補給しても、結腸直腸がんの発生率は低下しなかった(102)。カルシウム補給(1,200mg/日)が有りまたは無しでビタミンD3補給(1,000 IU/日)をした別の無作為化対照試験では、参加者の結腸直腸腺腫をまず除去した後の3~5年間に腺腫が再発するリスクに、プラセボと比べて何の低下も見られなかった(103)。これらのビタミンDの一日用量では、がんの発生に対する効果を検出するには低すぎるのかどうかはよくわかっていない(101,104)。結腸直腸がんの予防にビタミンD補給が役立つのかどうかを評価するさらなる無作為化臨床試験が必要である。また、ビタミンDの代謝や機能に関わる遺伝子配列の遺伝的変異(多型)が、ビタミンDの状態と結腸直腸腺腫またはがんのリスクの関係に影響する可能性があるのかはっきりしな(105~107)。
積み上がっていくエビデンスからは、適切なビタミンDの状態が結腸直腸がんの患者の生存によいという関連があるのではないかと示唆される。5つの前向き研究のメタ解析で、血清25-ヒドロキシビタミンD濃度が高いがん患者の結腸直腸部位のがん死亡リスクが35%低いことがわかった。用量反応解析では、25-ヒドロキシビタミンD濃度が8ng/mL増えるごとに、結腸直腸がんの死亡率が10%下がるという関連が推定された(108)。
乳がん
緯度が高くなって日光にあたることが減ると乳がんの死亡率が増えることが生態学的エビデンスから示唆されるが、ビタミンDの栄養状態と乳がんリスクの関連を裏付ける最新の観察研究データはほとんどない(86)。第一回米国国民健康栄養調査(NHANES I)に参加した女性による初期の前向き研究では、適切な日光浴と食事からのビタミンD摂取をした白人女性は、20年後に乳がんのリスクがかなり減ったことがわかった(110)。しかしながら、この研究と9つのより直近の前向き研究をともにメタ解析したところ、ビタミンD摂取の程度の高低による乳がんの発生リスクには何の有意な違いもなかった(111)。さらに、血液中のビタミンD濃度と乳がんリスクの間に関連があるのかもはっきりしない。14の観察研究(9,110人の症例群と16,244人の対照群)のメタ解析で、血清25-ヒドロキシビタミンD濃度が最高位の四分位群を最低位の四分位群と比べると、全体で16%のリスク低下があったと報告された。この逆相関は閉経後の女性で統計的に有意であったが、閉経前の女性ではそうではなかった(112)。しかし、同じような群を含む14の前向き研究(そのうち2つの研究では異なる)の別のメタ解析では、全体的に何の関連も見られなかった(111)。初期の乳がん患者に対する研究の1つのメタ解析では、ビタミンDの状態が不適切であることと、再発および死亡のリスク上昇に関連があることがわかった(113)。無作為化対照試験からのエビデンスは現在、ビタミンD補給が乳がん発生を減らす可能性について結論付けるにはあまりに限定的すぎる((114)の文献でレビュー)。
しかしながら、3つのメタ解析で血液中のビタミンD濃度と乳がん関連死の間の逆相関がわかった(111,115,116)。1つの後ろ向きコホート研究と5つの前向きコホート研究のメタ解析で、血清ビタミンD濃度が高い者は低い者よりも死亡率が33%低いという関連があり、用量反応解析では血清ビタミンD濃度が8ng/mL上昇するごとに12%低下していたことがわかった(115)。
なお、現在のエビデンスではVDRのコード化における特定の遺伝子変異が乳がんリスクに影響しているかもしれないとは示されていない(117,118)。
その他のがん
ビタミンDの状態とその他のがんとを関連づけるエビデンスは、現在のところ限られている。前立腺がんの発生が日照と逆相関があるように思われるが、前向きコホート研究では血清25-ヒドロキシビタミンD濃度とそれによる前立腺がんの発症リスクとの有意な関係は一般的に示されていない(119,120)。実際、血液中のビタミンD濃度が高いと前立腺がんのリスクが高いと示唆する研究もある。たとえばスカンジナビアの男性(622人の症例と1,451人の対照群)によるコホート内症例対照研究では、血清25-ヒドロキシビタミンD濃度と前立腺がんリスクとの間にU字形の関係があったことがわかった。その研究では、血清25-ヒドロキシビタミンD濃度が7.6ng/mL以下か32ng/mL以上だと、前立腺がんリスクが高いという関連があった(121)。17のコホート内症例対照研究、3つの前向きコホート研究、および1つの後ろ向きコホート研究のメタ解析では、血液中の25-ヒドロキシビタミンD濃度が高い者は、低い者に比べて前立腺がんのリスクが17%高かったことがわかった(122)。血中ビタミンD濃度が高い男性の前立腺がんの症例が少し多く発見されることは、交絡因子の可能性によって説明できるかもしれないことが、最近の発表で強調されている(123)。
なお、観察研究の最近のメタ解析で、ビタミンDの状態と肺がんリスク(124,125)および膀胱がんリスク(126,127)の逆相関がわかった。しかし、現在までに発表されたしばしば異種な内容の研究では、血清25-ヒドロキシビタミンD濃度は、非ホジキンリンパ腫(128)、卵巣がん(129)、胃がん(130)、または皮膚がん(131)などの他のがんと関連づけられなかった。
自己免疫疾患
インスリン依存性糖尿病(1型糖尿病)、多発性硬化症(MS)、関節リウマチ(RA)、および全身性エリテマトーデス(SLE)は自己免疫疾患の例である。自己免疫疾患は、体が外来の病原体ではなく自分自身の組織に対して免疫反応を起こして発生する。1型糖尿病では、インスリン産生をする膵臓のβ細胞が不適切な免疫反応の標的になる。MSでは、中枢神経系のミエリン産生細胞が標的であり、RAでは関節のコラーゲン産生細胞が標的である(132)。SLEは複数の組織を損傷する可能性のある広範な自己抗体があることが特徴である(133)。自己免疫反応は、T細胞と呼ばれる免疫細胞によって媒介されている。生物学的に活性のあるビタミンDの形態である1α,25-ジヒドロキシビタミンDは、自己免疫反応が消えるようにT細胞の反応を調整することがわかっている。自己免疫疾患(特にMS(134))の罹患率は緯度が高くなるに連れて増えることが生態学的研究からわかっており、UVBに当たらないで皮膚でのビタミンD合成が減ると、これらの疾病の病理に影響があるかもしれないことを示唆している。いくつかの前向きコホート研究の結果も、異なる年齢層(胎児、幼児、および青少年期を含む)における適切なビタミンDの状態が、自己免疫疾患リスクを減少させるかもしれないことを示唆している。
1型糖尿病
新たに1型糖尿病と診断される患者は、同じ年齢層や性別の糖尿病でない被験者に比べて、血液中のビタミンD濃度が低いことが報告されている(135,136)。複数の膵島関連自己抗体(インスリンを分泌する膵臓の細胞に対する抗体)を持つ前糖尿病性の子供は、自己抗体を持たない子供に比べてビタミンDの不足や欠乏症が蔓延していることも観察されている。しかし前糖尿病性の子供のコホートを追跡した前向き研究では、不足、欠乏、または充足で定義されるビタミンDの状態は、5または10年間の追跡後に1型糖尿病に進行する率とは関連がなかったことがわかった(137)。1966年にフィンランドに生まれた子供を30年間追跡した初期の前向きコホート研究では、生後1年間ビタミンD補給をされた子供は、補給を受けなかった子供に比べて1型糖尿病を発症するリスクが88%低かったことがわかった。しかも、生後1年間にくる病(重篤なビタミンD欠乏症)の疑いのあった子供は、1型糖尿病の発症率が有意に高かった(138)。したがって、ビタミンD補給は1型糖尿病の発症から体を保護するようであり、乳幼児期に最適以下のビタミンDの状態だと、その後の人生で免疫反応に長期的影響があるかもしれない。
妊娠中の母親のビタミンD不足が子供の1型糖尿病リスクに影響するかもしれないと示唆する限定的なデータもある。最近の症例対照研究で、母親の妊娠後期での血清25-ヒドロキシビタミンD濃度が21.6ng/mL(54nmol/L)未満だと、濃度が35.6ng/mL(89nmol/L)超の母親から生まれた子供に比べて、子供の1型糖尿病の発症リスクが2倍よりも高かった(139)。その他の症例対照研究でも、妊娠中のビタミンD補給で子供の糖尿病関連の自己抗体の発生リスクが低いという関連がわかった(140,141)。しかしながら、糖尿病のリスクが遺伝的に高い子供の母親に対する大規模な研究では、子供の生後1年間の膵島関連自己抗体および/または糖尿病の発生と母親の妊娠中のビタミンD摂取との間に関連はなかったと報告された(142)。別の症例対照研究では、妊娠初期の血清25-ヒドロキシビタミンDと子供の1型糖尿病の発症との間に関係が見られなかった(143)。妊娠中の母親のビタミンDの状態が子供の1型糖尿病リスクに影響するのかどうかを確定する大規模前向き研究が必要である。
また、ビタミンD代謝に関係する遺伝子の多型と1型糖尿病との関係が現在研究されている。たとえば、CYP27B1(25-ヒドロキシビタミンD3-1α-ヒドロキシラーゼをコード化する)やVDRの遺伝子における特定の多型がビタミンDの作用に機能的に関係があり、それにより1型糖尿病のなりやすさに影響しているのかもしれないということが提唱されている。1型糖尿病の8,517人の子供および青少年と7,320人の対照群に対する研究では、コレステロールの合成とビタミンDのヒドロキシル化に関わる遺伝子の多型が、血液中のビタミンD濃度と糖尿病の状態に関連していた(26)。
多発性硬化症
日光にあたることが少ないことやビタミンDの欠乏症は、多発性硬化症(MS)の発症に関連しているようである。ビタミンDの状態が悪いと、様々な免疫反応の調整に重要な特定の免疫細胞の働きを損ない、MSの自己免疫を引き起こすことに寄与してしまうかもしれない(144)。Multiple Sclerosis Genetics Consortium(=多発性硬化症遺伝学コンソーシアム)のデータのメンデルランダム化解析において、ビタミンDの低栄養状態の遺伝的決定因子は最近、成人発症性のMSになりやすくなることと関連付けられた(145)。これはビタミンDが充分であることがMSのリスク低下に関連していることを示唆しているいくつかの観察研究の結果と呼応していた。オーストラリアで行われた紫外線の量とMSの症例の後ろ向き研究で、子供のMSの発生は、妊娠初期の母親が紫外線に当たることと逆相関があったことがわかった(146)。1,660人のMS患者と3,050人の対照群を含む最近の症例対照研究でも、日光にあたることはビタミンD摂取の代替マーカーとして使用された。屋外での活動がたまにしかなく幼児期や青少年期に日焼け止めを使用していると、後にMSを発症するリスクが高くなるという関連があることを著者らは発見した(147)。横断研究では、子供の時に日光に当たってタラの肝油(ビタミンDが豊富)を摂取することが、再発性MSを患う退役軍人の後の症状の発現に関連していた(148)。さらに、MSと診断された257人の症例を含む米国軍人の症例対照研究では、血清25-ヒドロキシビタミンD濃度が最高五分位(39.6ng/mL超)の白人被験者は、最低五分位(25.3ng/mL未満)の者に比べてMSの発症リスクが62%低かったことがわかった(149)。また、187,000人超の米国人女性の2つの大規模コホートを少なくとも10年間追跡したところ、ビタミンDのサプリメント(400 IU/日以上)を使用していると、MSの発症リスクが41%低いという関連があった(150)。別の前向き非対照研究では、156人の再発寛解型MS患者に第一線の免疫調節療法に加えてビタミンD補給(100,000 IU/月を6~42ヶ月、平均で31ヶ月)をする前と後で、症状の再発生をビタミンDの状態との関係でモニターしたら(151)、血清25-ヒドロキシビタミンD濃度が4ng/mL上がるごとに再発生が14.9%減るという関連があった(151)。新たに臨床分離症候群(CIS)と診断されインターフェロン(IFN)-βで治療を受けている患者に対して行われた多機関の研究で、ビタミンDの状態がMSの活動性や進行の予兆となっていた。CISの診断から最初の1年間の血清25-ヒドロキシビタミンD濃度が高い(20ng/mLすなわち50nmol/L以上)と、その後4年間の追跡でMSと診断されるまでの時間が長くなり、新規の病変の数が減り、病変の変化も脳の体積の変化も少ないことが予見された(152)。しかしながらある後ろ向き研究では、再発寛解型MS患者のビタミンDの状態は、身体障害の悪化が特徴的である二次性進行型MSへの転換までの時間に関しての予測値にはならないと示唆された(153)。
MS患者の再発率や身体障害に関連した症状について、単独またはIFN-βによる治療と組み合わせてビタミンD補給をしても、臨床試験では何の利点も実証されなかった(154,155)。別の臨床試験でも、ビタミンD3補給は免疫調節作用を示さなかった(156~159)。53人のIFN-β治療を受けている再発寛解型MS患者に対する最近の無作為化プラセボ対照試験で、ビタミンD3補給(7,000 IU/日を4週間、その後14,000 IU/日を第48週まで)は48週間の研究期間にわたって、ある種の制御性T細胞とB細胞の比率にほとんど影響しなかった。ビタミンD3は抗炎症のCD4+T細胞の割合の維持にのみ役立つようであったが、これはプラセボを与えられた患者では減少していたものの、ガラス容器内で1,25-ジヒドロキシビタミンDで刺激してもこの細胞の反応性が良くなることはなかった(157)。別の試験では、再発寛解型MS患者にビタミンD3(10,400 IU/日を3ヶ月間)補給をすると、炎症促進性のIL-17産生CD4+T細胞の割合が減ったことがわかり、これはMSの発症に中心的な役割を果たしていると考えられている(160)。
関節リウマチ
エビデンスが主に動物研究によるものであるとはいえ、ビタミンDの欠乏は関節リウマチ(RA)の病因および/または進行にも関係があるかもしれない。ビタミンD受容体(VDR)がない遺伝子組み換えのマウスは、炎症の程度がひどく自己免疫になりやすくなるという関連がある(161)。自然に炎症性の関節炎を起こす遺伝子導入マウスにVDRが欠乏していると、より侵襲性の慢性関節炎を起こす(162)。また、VDR遺伝子が特定の多型だと、ある集団でRAになりやくなるという関連があるが、これらの遺伝子的変異がどのようにビタミンDの機能に作用するのかは充分にわかっていない(163~165)。しかしながら、RAを含む多くの慢性疾患の根本的な炎症プロセスの調整におけるビタミンDの役割が、現在のデータで示されている。中度から重度の炎症のある個人を対象にしたいくつかの横断研究では、血液中の25-ヒドロキシビタミンD濃度と炎症マーカーとの間には、何の関係もないか逆相関があることが報告された。それでもなお、重度炎症のある被験者の炎症を制限し疾病(RAを含む)のリスクを減らすことがビタミンD補給によってできるかどうかを示す介入試験が不足してい(166)。
今のところ、RAの発症にビタミンD欠乏症の有病率が関連しているかどうかは不明のままである。30,000人近い米国の閉経後の女性を対象にした大規模コホート研究では、ビタミンD摂取が最多レベル(467.7 IU/日以上)の被験者は最少レベル(221.4 IU/日未満)の者に比べて、11年間の追跡調査後にRAの発症リスクが33%低かった(167)。しかし、200,000人近くの米国人女性の2つの大規模コホートを数十年間にわたって追跡したより最近の解析では、青少年期や成人期におけるビタミンDの食事からの摂取の報告(食品摂取頻度調査票を使用した)とその後のRAの発症との関連は見られなかった(168,169)。さらに、RA患者の血液中のビタミンDと疾患活動性との関係を探ったいくつかの研究で、関連の有無どちらの結果も報告されている((170)の文献でレビュー)。しかし、観察研究の最近の2つのメタ解析で、疾患活動性指標28(DAS28)を使用して評価されたRA患者の疾患活動性とビタミンDの栄養状態の間に逆相関があることがわかった(171,172)。なお、関節炎の患者の疾患活動性に対するビタミンD補給の効果を探る研究は不足している。22人のRA患者による小規模な無作為化二重盲検プラセボ対照試験では、カルシウム(1,500mg/日)と高用量ビタミンD2(エルゴカルシフェロール;平均4,500 IU/日超)を1年間補給された被験者は、プラセボと比べても疾患活動性や炎症の程度に改善が見られなかった(173)。初期のRAである41人の女性を対象にした3ヶ月間の別の無作為化対照試験では、T-ヘルパーリンパ球の数え上げ、サイトカイン産生、または疾患活動性を含む臨床的パラメータに関して、ビタミンD3補給(300,000 IUの急速投与を1回)は標準的療法(メソトレキサートおよびグルココルチコイド)に対して何の追加的利点もなかったことがわかった(174)。また、ビタミンD補給は2つの小規模な無作為化対照試験に登録したRA患者の再発率を減らすことができなかった(175,176)。サンプル数が少ないことも含めてこれらの研究にはいくつかの限界があり、追加的な研究がなされるべきである。
全身性エリテマトーデス
非白人(ヒスパニック、アフリカ系、およびアジア系)により多く見られより重症である(177)全身性エリテマトーデス(SLE)は、臨床的に様々な症状を示す自己免疫疾患である。この病気は、皮膚(皮膚発疹や光過敏性)、腎臓(腎炎)および関節(関節炎)を含むたいていの組織や臓器に影響する可能性がある。動物モデルでは、SLEの予防にビタミンDが役立つというエビデンスがある(178)。興味深いことに、11の症例対照研究の最近のメタ解析で、特定のVDRの多型がアジア人のSLEに特に関連しているとわかった(179)。しかし、そのような遺伝子変異の機能的関連性はわかっていない(180)。200,000人近い米国人女性に対する2つの大規模前向きコホート研究の解析では、青少年期や成人期におけるビタミンDの食事からの摂取(食品摂取頻度調査票を使用した)と、その後のSLEの発症との関連は見られなかった(168,169)。
今のところ、ビタミンDの状態がSLEの被験者では最適以下なことが一般的で、これは日光に当たることが少ないことによって一部説明可能で、それが疾病の症状を悪化させる傾向がある(181,182)。血清中の25-ヒドロキシビタミンD濃度は、378人のSLE患者のコホートで疾患活動性の測定値と逆相関があった(183)。20人のSLEの被験者に高用量ビタミンD3補給(100,000 IU/週を1ヶ月間、その後100,000 IU/月を6ヶ月間)でビタミンD不足を治してもらったら、免疫の不均衡の徴候やSLEで典型的に検出される自己抗体の濃度が下がったという関連があり、これは疾病の治療におけるビタミンDの効果を示唆している(184)。皮膚エリテマトーデス(皮膚病だけのループス(=狼瘡)の一種)でビタミンD欠乏症でもある52人の患者に対する別の前向き研究で、ビタミンD3(初めは1,400 IU/日で、後に800 IU/日)とカルシウムを1年間補給した群は、何もしなかった群に比べて疾病の重症度が下がったことが報告された(185)。267人のSLE患者に対する無作為化プラセボ対照試験でも、ビタミンD3補給(200 IU/日を1年間)をしたら、炎症サイトカインの濃度を下げることができた(186)。別の無作為化プラセボ対照試験では、ビタミンD3補給(50,000 IU/週を6ヶ月間)によってSLE疾患活動性指標(SLEDAI)、欧州コンセンサスループス活動性測定(ECLAM)のスコア、および若年発症型SLEの若者のいくつかの疲労測定値が改善した(187)。しかしながら最近の2つの別な研究では、ビタミンD3補給(約800~7,000 IU/日に相当する1週または1月あたりの急速投与量で6~24ヶ月補給)でSLE患者のビタミンDの状態が改善したものの、疾患活動性に関して何の利点も示されなかった(188,189)。SLE患者へのビタミンDの経口投与は耐容性がよいものの、その効能には疑問が残るままであり、さらなる臨床試験での調査がなされるべきである。
要旨
したがって、自己免疫疾患の予防や治療にビタミンD補給が有効であると結論づけられないものの、ビタミンD不足を解消し充分な濃度を維持することが疾患のリスクを下げることに役立つ可能性があることを、ヒトでの疫学的研究のエビデンスは示している(190)。
心血管疾患
高血圧
高血圧は心血管疾患(CVD)のリスク要因としてよく知られている(191)。観察研究および臨床研究の結果は、血圧を下げるのにビタミンDが役立つことを示唆しており、これは一部には1α,25-ジヒドロキシビタミンDがレニンの合成を抑制するということで説明できるかもしれない(「機能」の項参照)。したがって、ビタミンD欠乏症とそれによるレニン・アンジオテンシン系の上方制御が高血圧やCVDリスクに寄与するのかもしれない。PTH濃度が高いと、高血圧やCVDのリスクを高めるのではないかとも示唆されてきた(6)。3,002人(ベースライン時に平均59歳)に対する最近の前向きコホート研究で、9年間の追跡期間に41%の参加者が高血圧を患ったが、この発症は血清25-ヒドロキシビタミンD濃度が20ng/mL未満の者には多くなく、PTH濃度が高いことにわずかに関連があった(192)。それにもかかわらず、全部で48,633人が参加し5,000人近くが高血圧を発症した7つの前向き研究のメタ解析で、血清25-ヒドロキシビタミンD濃度が上部三分位の者は、下部三分位の者より30%高血圧リスクが低かったことがわかった。用量反応解析では、血清25-ヒドロキシビタミンD濃度が10ng/mL上がるごとに、高血圧リスクが12%下がるという関連が推定された(193)。4つの前向き研究と14の横断研究のメタ解析でも、血液中の25-ヒドロキシビタミンD濃度と高血圧の逆相関が報告された(194)。
血管内皮障害
血管内皮障害は心血管疾患(CDV)のリスク上昇に寄与し、慢性腎疾患(CKD)の患者に一般的に見られる(195)。CKDの患者では、上腕動脈の血流依存性血管拡張反応(FMD)という血管の健康状態を示す代理マーカーの値が低いことが、異常な血管内皮機能と関連している。軽度から中度のCKDの被験者に対する最近の研究で、血清25-ヒドロキシビタミンD濃度はFMDの値と正の相関があり、これはビタミンDの状態が最適より悪いことが血管内皮障害と関連があることを示唆している(196)。ある予備的な介入研究では、ビタミンDが不足(平均で17.2ng/mL)している26人の中度のCKD患者に300,000 IUのビタミンD3を2回補給(1週目と8週目)し、全体で16週間追跡した。ビタミンD補給によって血清25-ヒドロキシビタミンD濃度がほぼ倍になり、PTH濃度は68.5%減った。ビタミンDの状態の改善は、FMDの数値の上昇と血管内皮障害のマーカーの低下とともに起こった(197)。CVDリスクが高い患者に対する12の小規模無作為化対照試験の最近のメタ解析で、ビタミンD補給(1日用量で2,500~5,000 IU、1週用量で50,000 IU、1月用量で60,000 IU、1回の急速投与量で100,000~200,000 IU)を8週間から6ヶ月したところ、FMDが有意に上昇したことがわかった(198)。
観察研究と臨床試験での心血管イベント(=事象)
今日までビタミンDとCVDの転帰(=結果)との関係を調べた多くの疫学的研究は、まちまちの結果を生んできた((199)の文献でレビュー)。最近のメンデルランダム化研究では、冠動脈性心疾患、虚血性心疾患、または心筋梗塞のリスクと遺伝的低血清25-ヒドロキシビタミンD濃度との間には何の関連も見られなかった(200,201)。このことは、観察研究で報告された関連が交絡因子や因果関係の逆転によるものである可能性を示唆している。5,292人の年配者によるRECORD試験(「骨粗しょう症」の項参照)では、800 IU/日のビタミンD3補給(カルシウム有りまたは無し)によって、カルシウム単独またはプラセボを摂取した場合に比べて最初の心不全リスクが減ったものの、心筋梗塞および脳卒中のリスクには何の効果もなかった(202)。心血管イベントに対するビタミンD補給の効果に関するデータは、13,033人の参加者(60歳以上)による21の無作為化対照研究(RECORD試験も含む)から集められ、メタ解析に組み込まれた(202)。1~6.2年間の追跡期間にわたって、心不全、心筋梗塞、および脳卒中といった主要な心血管イベントに関してビタミンD補給(ビタミンD類似体を含む)の効果は見られなかった(202)。しかしながら、これらの結果を解釈する際には注意をした方がよい。それというのもこれらの試験はもともと骨の健康に対するビタミンDの効果を評価するように考えられたものであって、心血管に関する結果は主要エンドポイント(=評価項目)ではないからである。CVDリスクに対するビタミンD補給の効果を探るいくつかの無作為化対照試験が現在進行中であり(203)、それらには米国のビタミンDとオメガ3試験(VITAL)(204)やオーストラリアのD健康試験(D-Health trial)(205)という2つの大規模試験も含まれる。ニュージーランドの無作為化対照試験であるビタミンD評価試験(ViDA)の結果が最近発表された。追跡期間中の全CVDイベント数や最初のCVDイベントまでの時間は、中央値で3.3年にわたってビタミンD3補給(最初の月の用量が200,000 IUでその後100,000 IUの1月用量)をした者とプラセボを摂取した者とでは違いはなかった(206)。
2型糖尿病
メタボリック症候群の人々は、2型糖尿病(非インスリン依存性糖尿病)や心血管疾患(CVD)のリスクが高い。メタボリック症候群とは、脂質異常症、高血圧、インスリン抵抗性、および肥満を含むいくつかの代謝障害をいう。最近の研究で、1,801人のメタボリック症候群の患者における2型糖尿病の罹患率は、血清25-ヒドロキシビタミンD濃度が低い(30ng/mL未満)ことと関連していることがわかった。8年間の追跡期間で、血清25-ヒドロキシビタミンD濃度が30ng/mL(75nmol/L)超の者は、10ng/mL(25nmol/L)未満の者に比べて全死因による死亡リスクが72%低く、CVDによる死亡のリスクも64%低いことが報告された(207)。
健康な者には、ビタミンDが充分であることはインスリン感受性や膵臓β細胞の適切な機能と正の相関がある。逆に、ビタミンD欠乏症はグルコース恒常性に影響し、耐糖能異常やインスリン抵抗性を引き起こすかもしれない(208)。前糖尿病状態(2型糖尿病の発症リスクが高い状態)にある4,057人を含む12,719人の成人に対する横断研究で、前糖尿病の罹患率は血清25-ヒドロキシビタミンD濃度が低いこと(32.4ng/mL以下)と関連があった。血清25-ヒドロキシビタミンD濃度が最低レベル(17.7ng/mL以下)の被験者は、現在喫煙中で肥満で高血圧であることが多かった(209)。リスクの高い個人のビタミンD不足は、はっきりとした糖尿病への進行を加速させるかもしれない。2,378人の中年男性および女性を8~10年間追跡した前向き研究で、前糖尿病から2型糖尿病への進行リスクは、血液中のビタミンD濃度が最も高い(28.4ng/mL超)四分位群では、最も低い(18.5ng/mL未満)四分位群より女性で62%、男性で60%低かった。用量反応解析では、2型糖尿病への進行リスクは、血清25-ヒドロキシビタミンD濃度が4ng/mL(10nmol/L)上がるごとに、平均で23%低くなった(210)。210,000人超の参加者を中央値で10年間追跡した18の前向きコホート研究の最近のレビューとメタ解析で、ビタミンD濃度(血液中の濃度または食事からの摂取による)が上位3分の1の者は、2型糖尿病リスクやメタボリック症候群リスクが下位の3分の1に比べてそれぞれ19%と14%低かった(211)。28,258人の年配者(平均年齢67.7歳)に対する9つの前向き研究の別のメタ解析で、中央値で7.3年間の追跡期間にわたって、ベースライン血中ビタミンD濃度が低い者は高い者より2型糖尿病になるリスクが17%高いという関連があったことがわかった(212)。現在、ビタミンD補給は耐糖能障害や顕性2型糖尿病の者のインスリン感受性を向上させるかもしれないということが、限定的なエビデンスで示唆されている(213~216)。適切なビタミンD濃度を維持することが健康またはリスクの高い個人の代謝に関する結果の悪化を防ぐのかどうかを調べるように良く計画された臨床試験が必要である。
神経変性疾患
認知障害およびアルツハイマー病
アルツハイマー病(AD)は最も一般的な認知症の形態で、脳内に神経外のβアミロイド斑や神経内のTタンパク質凝集物(神経原線維変化として知られる)が存在することが特徴である。動物研究で現在調べられているメカニズムのモデルは、大脳皮質や海馬の領域でのビタミンD欠乏またはビタミンD代謝の異常および/またはビタミンDとVDRの経路の分断が、神経細胞の変性や認知機能の喪失に関わっているかもしれないことを示唆している(217)。中枢神経系のカルシウムチャネルの調整、神経細胞保護、および免疫調整におけるビタミンDの役割を裏付ける実験的エビデンスでも、低ビタミンD状態が加齢に伴う認知機能障害の前兆となったり寄与をしたりすることが暗示されている(218)。
食事性のビタミンD摂取と血清25-ヒドロキシビタミンD濃度との関連で、年配者の認知機能低下と脳の変性疾患が多くの観察研究で調べられてきた。閉経後の女性の骨粗しょう症と大腿骨頚部骨折に関するフランスでの大規模コホート研究では、ファイファーの簡易携帯型知的状態質問票(SPMSQ)というテストで評価された全体的な認知能力の損傷は、5,596人の年配の女性(平均年齢80.5歳)で食事からのビタミンD摂取が少ない(1,400 IU/週未満)ことと関連があった(219)。498人のサブグループの女性を7年間追跡した研究では、ベースライン時に食事性ビタミンD摂取が最高五分位の者は、最低五分位の者に比べて(その他の認知症ではなく)アルツハイマー病のリスクが77%低かったことが示された(220)。全部ではないがいくつかの観察研究で、血清25-ヒドロキシビタミンD濃度が低いことと年配者の軽度認知障害に関連があることがわかった(219,221,222)。65歳以上の1,604人の男性(223)と6,257人の女性(224)に対する2つの前向き研究の横断的および縦断的解析で、女性はビタミンD欠乏症(血液中の25-ヒドロキシビタミンD濃度が10ng/mL未満)だと30ng/mL以上の場合よりもベースライン時で認知障害の可能性が60%高く、4年間の追跡期間の間では認知障害のリスクが58%上昇したが、男性ではそうではなかったことが報告された。2,273人(平均年齢70.4歳)を対象とした多民族のコホート内症例対照研究であるSingapore Kidney Eye Study(=シンガポール腎臓眼研究)では、簡略型認知機能テスト(AMT)で評価された逆行性エピソード記憶、意味記憶、および時間の見当識に影響する認知障害と、血清25-ヒドロキシビタミンD濃度が逆相関していた(225)。
しかし観察研究の系統的総括やメタ解析は、認知能力やADとビタミンDの状態との関連についてまちまちな結果となっている(226-230)。さらに、1,182人の男性を18年間追跡した成人男性ウプサラ縦断研究(ULSAM)の最近のデータ解析では、ビタミンD合成の遺伝的決定因子、ビタミンD摂取、および血漿25-ヒドロキシビタミンD濃度と、認知機能障害、AD,血管性認知症、または全原因による認知症のリスクとの間の相関は見られなかった(231)。対照的に別のメンデルランダム化研究では、国際アルツハイマー病ゲノムプロジェクト(International Genomics of Alzheimer's Project)のデータ(17,008人のAD患者と37,154人の健常者)で、ビタミンDの状態が悪いことの遺伝的決定因子とADリスクの上昇が関連付けられた(232)。
そうは言っても、年配の成人の70~90%にビタミンDの不足/欠乏が蔓延しており、血清25-ヒドロキシビタミンD濃度が低い状態を治すことが、認知プロセス、特に実行機能の向上に役立つかもしれない(233)。外来診療所での小規模非無作為化対照研究において、800 IU/日(または100,000 IU/月)のビタミンD補給をした20人の患者と24人の対照群被験者で、ベースライン時と16ヶ月後に認知機能全体の評価が行われた。補給されなかった群に比べて、外来患者へのビタミンD補給によってビタミンD濃度が低い状態は改善され(血清25-ヒドロキシビタミンD濃度の平均はベースライン時で16.8ng/mL、16ヶ月後では30ng/mL)、認知テストの成績が大きく改善するという関連があった(234)。鼻からのインスリン投与を受けている32人の軽度から中度のAD患者による小規模無作為化プラセボ対照臨床試験では、高用量(最大で36,000 IU/日)のビタミンD2を8週間補給しても、低用量(1,000 IU/日)の場合に比べて大きく認知能力が改善することはなかった(235)。年配者におけるビタミンDの再充足と認知能力への長期的な有益性の因果関係を調べるさらなる試験が必要である。また、認知障害の被験者のビタミンD欠乏を治すことが抗認知症治療の影響を強めることができるかどうかを評価することは非常に重要である(236)。
パーキンソン病
パーキンソン病(PD)は、患者の間でビタミンD不足が広く見られるという関連があり、体を動かすことに問題がある者については特にそうである(237)。平均年齢65歳の296人の外来患者による症例対照研究では、血清25-ヒドロキシビタミンD濃度が20ng/mL以下の者はPD被験者の23%にあたり、AD患者や健康な者ではそれぞれ16%と10%だった(238)。ベースライン時にPDでなかった50~79歳の男女3,173人による前向きコホート研究では、血清25-ヒドロキシビタミンD濃度が最高四分位(女性では20ng/mL以上、男性では22.8ng/mL以上)にある者は、最低四分位(女性で10ng/mL以下、男性で11.2ng/mL以下)にある者に比べてPDのリスクが67%低かった(239)。観察研究からメタ解析用にプールされたデータはすべて、健康な対照群にくらべてPD患者にはビタミンDの状態の不適切さが報告されやすいことを示していた(240~242)。
ある無作為化二重盲検プラセボ対照試験では、標準的なPD治療を受けている112人のPD患者(平均年齢72歳)が1,200 IU/日のビタミンDまたはプラセボ補給を12ヶ月受けた。ビタミンD補給によって、補給を受けた被験者の血清25-ヒドロキシビタミンD濃度が倍近くになった(平均22.5ng/mLから41.7ng/mLへ)だけでなく、PDの進行も限定的になった。これは、補給を受けた群の大部分の患者で、症状の悪化(ホーン・ヤールの重症度分類[Hoehn and Yahr stage]やパーキンソン病統一スケールのパートII[United Parkinson Disease Rating Scale part II]で評価)がプラセボ群に比べてまったくなかったことによって示されている(243)。この疾患の病因にビタミンD不足が関わっているかは不明だが、ビタミンDを充足させてやることで、PDの予防および/または治療以上の健康への利点があるかもしれない。たとえば、ビタミンD欠乏はPDや多発性硬化症を含む神経障害のある者の骨粗しょう症や骨折のリスクを悪化させるかもしれない(244~246)。興味深いことに、324人のPDの年配者に対する前向き研究で、日光に当たることはビタミンDの状態の改善、第二中手骨の骨密度の増加、および大腿骨頚部骨折の発生率の低下と関連があることがわかった(247)。
妊娠への悪影響
母親のビタミンDの状態と妊娠の転帰に関する31の観察研究の系統的総括とメタ解析で、ビタミンD不足は妊娠中の女性の妊娠糖尿病、妊娠高血圧腎症 、および細菌性膣炎と関連しているかもしれないことが示された。妊娠中に母親の血清ビタミンD濃度が低いと不当軽量児や低出生体重児のリスクが上昇することとも関連しているが、帝王切開とは関連がない(248)。しかし、妊娠中にビタミンD補給をすることが上記のような妊娠への悪影響の発生を減らす可能性があるのかについて結論を出すには、介入試験の数が現在ではあまりにも限られすぎている(249)。
妊娠糖尿病
膵臓のβ細胞機能障害による異常な高血糖症は、2型糖尿病でない妊婦における妊娠糖尿病(GDM)の徴候の特徴である。この症状は、妊娠高血圧腎症、帝王切開分娩のリスク上昇、およびメタボリック症候群や2型糖尿病の生涯を通じてのリスク上昇を含む深刻な母体への悪影響と関連している。GDMは、生まれた子供の胎児性巨大児(過剰出生体重)、新生児低血糖症、新生児呼吸窮迫症候群、および生涯を通じての肥満、耐糖能異常、2型糖尿病、および心血管疾患のリスク上昇を含むリスクの上昇に寄与しているかもしれない((250)の文献でレビュー)。
655人の妊婦に対する最近の前向き研究で、GDMを発症した54人の女性はそれ以外の者に比べて、妊娠第一期に平均血清25-ヒドロキシビタミンD濃度がかなり低かった(23ng/mL対25.4ng/mL)ことがわかった。ビタミンDの状態とGDMのリスク(体重過多/肥満および2型糖尿病やGDMの前病歴を含む)の交絡因子に対する複数の補正を行った後、妊娠初期に血清25-ヒドロキシビタミンD濃度が7.5ng/mL減少するごとに、GDM発症リスクが48%高くなるという関連があることがこの研究でわかった(251)。118人のGDMの妊婦と219人の同等な対照群の被験者によるコホート内症例対照研究で、妊娠第二期に血清25-ヒドロキシビタミンD濃度が低い(29.4ng/mL未満)ことはGDMの発症と関連があった(252)。中等~上質の観察研究を含む5つのメタ解析(248, 253~256)でも、異なる血清25-ヒドロキシビタミンD濃度測定方法が使用されていたり、異なる妊娠期に濃度測定されていたり、GDMの評価の基準が異なるなどの研究の偏りのエビデンスはあったものの、妊娠中の母体の血清ビタミンD濃度はGDMの発症リスクと逆相関していたと報告された((257)の文献でレビュー)。
さらに、妊娠中のグルコース(=ブドウ糖)調整におけるビタミンDの役割のエビデンスが、GDMと診断された54人の妊婦に対する小規模無作為化二重盲検プラセボ対照試験で報告された。6週間に2回(第1日目と第21日目)50,000 IUのビタミンD3を補給したら、プラセボに比べて空腹時血糖値および血清インスリン濃度が有意に低くなり、インスリン抵抗性が減り、インスリン感受性が改善した(258)。これは、ビタミンD欠乏が妊娠中の耐糖能に悪影響を及ぼし、GMDの発症に寄与するかもしれないことを示唆している。今のところ、耐糖能異常やGDMの予防におけるビタミンD補給の潜在的有益性は評価されていない。GDMのリスクのある妊婦(妊娠前BMIが29kg/m2以上)の代謝の状態に対して、ビタミンD補給とライフスタイルのへ介入(健康な食事や運動)の効果を評価する多機関の無作為化対照試験(DALI)がヨーロッパで進行中である(259)。健康な食事と運動が標準治療に比べて妊娠性の体重増加を抑えるのに役立つことが予備的な結果では示唆されているが、これらの生活様式変化は肥満の妊婦のGDMリスクを低くすることはなさそうである(260)。DALI研究でのビタミンD補給の効果に関する結果はまだ発表されていない。
生まれた子供の健康
妊娠中に腸でのカルシウム吸収や骨格からのカルシウム代謝が増えることによって、胎児の骨格へのカルシウムの付加が可能になる。しかし、母親のビタミンDの状態と胎児の骨成長の測定値の関係を調べた観察研究は、一貫した結果になっていない(261,262)。さらに、母親のビタミンD骨粗しょう症研究(MAVIDOS)からの最近のデータでは、妊娠17週未満から出産までの間毎日ビタミンD3(1,000 IU)またはプラセボを無作為化されて補給した母親から生まれた新生児の全身の骨塩量(BMC)には、差がなかったことが示唆された(263)。また、母親が妊娠中にビタミンD強化によって余分にビタミンDを摂取していてもいなくても、10~18歳のデンマークの子供の骨折リスクは同じようなものであった(264)。妊娠中のビタミンD補給は、出産時に新生児のビタミンD欠乏症リスクを効果的に防ぐ(265)ものの、新生児のビタミンD状態がその後の幼児期に骨折リスクに影響するというエビデンスはほとんどない(266)。
いくつかの観察研究で、妊娠中の母親のビタミンDが充分であることと子供の呼吸器症状やアレルギーの発生との関係を支持するやや弱いエビデンスが示された(267)。無作為化対照試験では、妊娠第三期(妊娠第27週から出産まで)の108人の妊婦にビタミンD3を800 IU/日または200,000 IUの急速投与で補給しても、3歳時点でその子供の喘鳴、アレルギー性鼻炎、食物アレルギーの診断、下気道感染症、または湿疹のリスクはプラセボ(N=50)に比べて減らなかったことがわかった(268)。より最近の二重盲検無作為化対照試験で、295人のデンマーク人妊婦に妊娠第22~26週から出産まで2,800 IU/日(70μg/日)のビタミンD3補給をしたら、400 IU/日(10μg/日)のビタミンD3補給(これはデンマークの現在の推奨量である)をした場合(N=286)に比べて、子供が3歳になるまでの間に肺の症状で問題になるエピソードのリスクが17%減ったことがわかった(269)。しかしながら持続性喘鳴、喘息、アレルギーの感作、気道感染症、または湿疹のリスクに関して、治療群と対照群とでは何の差も報告されなかった(269)。喘息、アレルギー性鼻炎、または湿疹の病歴(または配偶者にその病歴)のある777人の米国人妊婦に対するビタミンD出生前喘息低減試験(Vitamin D Antenatal Asthma Reduction Trial)という同様の無作為化二重盲検対照試験で、2,400 IU/日(60μg/日)または400 IU/日(10μg/日)の補給をしても、その子供が3歳時点で喘息や再発性喘鳴を発症するリスクには何の差もなかった(270)。個々の研究で有意性がなかったにも関わらず、これら3つの研究の統合解析では、妊娠中に高用量のビタミンD補給をした母親の子供は低用量の補給をした母親の子供よりも、再発性喘鳴のリスクが19%低いことがわかった(271)。378の母子ペアのコホートでは、妊娠第34週で測定された血清25-ヒドロキシビタミンD濃度が高いと、子供が2歳までに食物アレルギーになるリスクが上昇するという関連があり、妊娠中のビタミンD補給の安全性に関して注意深い評価が必要となっている(272)。
ビタミンDが不十分なことが自己免疫に関連する(「自己免疫疾患」の項参照)ため、妊娠中に母親のビタミンDの状態が良くないことがその子供の自己免疫性糖尿病(インスリン依存性1型糖尿病)のリスク上昇に寄与しているかもしれない。しかし1型糖尿病リスクが遺伝的に高い3,723人の子供を平均で4.3年間追跡した研究の結果、妊娠第三期の母親のビタミンD摂取(食物および/または補給による摂取を食品摂取頻度質問票で評価)は、進行したβ細胞自己免疫や臨床的糖尿病とは関連がなかった(142)。あるコホート内症例対照研究では、1型糖尿病の子供の母親343人と対照群の母親343人の妊娠第三期における血清25-ヒドロキシビタミンDの平均濃度には何の差もなかった(143)。追跡研究では、母親のビタミンDの状態よりもむしろ特定のVDR多型が、子供が1型糖尿病を発症しやすくなることに関連しているかもしれないことが示唆された(273)。別のコホート内症例対照研究(1型糖尿病の子供の母親119人と129人の対照群の母親)では、25-ヒドロキシビタミンD濃度ではなく妊娠第三期のビタミンD結合タンパク質濃度と子供の1型糖尿病リスクとの間に逆相関があることがわかった(274)。現在のところ、妊娠中の母親のビタミンDの状態と子供の自己免疫疾患との間の因果関係は確定していない。
急性呼吸器感染症
200超のウィルスが上気道(URT)によくある感染、つまり風邪を引き起こし、鼻づまりや鼻水、咳、喉の痛み、およびくしゃみといった症状が現れる(275)。第三回米国国民健康栄養調査(NHANES III)への18,883人の参加者(12歳以上)による横断的データの解析で、血清25-ヒドロキシビタミンD濃度と最近の(自己申告による)URT感染(URTI)との間に逆相関が報告された。血液中のビタミンD濃度が30ng/mL以上の場合に比べて、10~29ng/mLの者では24%、10ng/mL未満の者だと36%URTIのリスクが高かった(276)。サブグループの解析で、喘息や慢性閉塞性肺疾患(COPD)の被験者が低い血清25-ヒドロキシビタミンD濃度だと、肺疾患のない者に比べてずっとURTIにかかりやすいと関連付けられた。
322人の健康な成人(18歳以上)に対して行われた無作為化二重盲検プラセボ対照試験では、月々のビタミンD3の服用(初めの2ヶ月は200,000 IUで、その後16ヶ月は100,000 IU)によって、プラセボに比べて介入群では平均の血清25-ヒドロキシビタミンD濃度が大きく上昇(29ng/mLから48ng/mLに変化)したが、URTIの発生が減ることはなかった(277)。また、結腸直腸腺腫の病歴のある2,259人の被験者(45~75歳)によるより大規模な多機関4群臨床試験では、ベースライン時に血清25-ヒドロキシビタミンD濃度が最低レベルの参加者でも、毎日1,000 IUのビタミンD3補給をしても冬またはその他の季節のURTIの症例の数や期間が減ることはなかった(278)。さらに、644人(60~84歳)による無作為化プラセボ対照試験の事後解析では、最長1年間1ヶ月に30,000または60,000 IUのビタミンD3を補給しても、細菌性気道感染に対する抗生物質の処方の割合は大きくは減らなかった。しかし月に60,000 IUの用量では、70歳以上の参加者への抗生物質使用のリスクが47%減ったことが層別解析でわかった(279)。また、妊婦にビタミンD3補給(2,000 IU/日)を出産までの3ヶ月とその後に子供への補給(800 IU/日)を生後6ヶ月まで行ったところ、介入期間後に6~18ヶ月齢の子供の急性呼吸器感染症の数がプラセボに比べて大幅に減った(280)。興味深いことにこれらのデータと追加的な21の試験のデータの統合解析では、試験の不均一性が大きいにもかかわらず、急速投与(毎週、毎月、または3ヶ月ごと)、毎日投与、または急速投与と毎日投与の組み合わせでビタミンD3を摂取すると、URTIの発症が全体で12%減少したことが示唆された(281)。サブグループの解析では、ベースライン血清25-ヒドロキシビタミンD濃度が10ng/mL未満の被験者ではビタミンD3補給によってURTIリスクが42%減ったが、濃度が10ng/mL以上の者には何の予防効果もなかったことがわかった。また急速投与を除いたサブグループの解析で、ベースラインのビタミンDの状態に関わらず毎日および毎週のビタミンD3投与計画がURTIに対して予防的であるようで、急速大量投与(30,000 IU以上)は毎日または毎週の投与に比べて効果がないことがわかった。またURTIに対するビタミンD3補給の効果は、年齢、BMI、喘息やCOPDの持病があること、およびインフルエンザワクチンの状態によっては変化しないようであった(281)。
ニュージーランドでの大規模臨床試験であるビタミンD状態評価研究(ViDA)の結果で、急性呼吸器感染症リスクの低下にビタミンDの急速大量投与は無効であることが確認された(282)。5,110人の年配者(ベースライン時で50~84歳)を対象としたこの二重盲検プラセボ対照試験で、中間値で3.3年間ビタミンD3を初めに200,000 IU/月、その後100,000 IU/月補給しても、急性呼吸器感染症の発症(自己申告による)に関して何の効果(HR, 1.01; 95% CI, 0.94-1.07)もなかった。ビタミンDの状態によるデータの層別化でも、血中ビタミンD濃度が20ng/mL(50nmol/L)以下の参加者には効果無し(HR, 1.08; 95% CI, 0.95-1.23)という同様の結果が見られた(282)。
最近終了したビタミンDとオメガ-3試験(VITAL試験)で、感染症の予防は試験の二次的な結果であるものの、年配者の気道感染症リスクに関する毎日のビタミンD服用(2,000 IU/日)効果に対する追加的なエビデンスが提供されるかもしれない(204,283,284)。
就学前の子供による試験では、2,000 IU/日のビタミンDを少なくとも4ヶ月間補給しても、400 IU/日を少なくとも4ヶ月間補給した場合と比べて、冬季間のURTIの発生率(285)または重症度(286)は低下しなかった。2,000 IU/日の補給で400 IU/日の場合より血清25-ヒドロキシビタミンDの平均濃度は有意に上昇した(48.7ng/mLに対して36.8ng/mL)が、これらの幼児のURTI予防には400 IUの用量で充分であったかもしれない(285)。ベトナムの農村における1,300人の健康な子供と青少年(対照群も介入群もベースライン25-ヒドロキシビタミンD濃度は26ng/mL)を対象にしたプラセボ対照試験で、8ヶ月間ビタミンDを14,000 IU/週補給したところ、インフルエンザでないウィルス性の呼吸器感染症が24%という有意な減少を示したが、インフルエンザAまたはBの発症は減少しなかった(287)。
新型コロナウィルス感染症、COVID-19
新型コロナウィルス感染症のCOVID-19は、重症急性呼吸器症候群コロナウィルス-2(SARS-CoV-2)に感染することによって引き起こされる。このウィルスは2019年後半に中国の武漢において発生し、急速に世界中に広まって全世界的なパンデミックを引き起こしている。咳、発熱、倦怠感、および呼吸困難といったインフルエンザに似た症状だけでなく、その他の多様な症状がCOVID-19の特徴である(CDCやWHOのウェブサイトを参照のこと)。この疾患の影響は広範囲に及び、最も重篤な場合には肺炎や呼吸困難、および死亡といった結果になる。しかしSARS-CoV-2に感染しても無症状のままで、他者をウィルス感染させてしまう可能性のある者もいる(288)。さらに、SARS-CoV-2に感染した者は症状が現れる前にこの疾病を拡散してしまう(発症前感染)可能性があり(289)、手洗い、マスク着用、ソーシャルディスタンスの確保、および検査や接触者追跡といった公衆衛生対策がこのパンデミックを抑えていくために重要である。
いくつかの観察研究でビタミンDの栄養状態とCOVID-19発生との相関が調べられ、全部(290-292)ではないがその大部分で、ビタミンDの欠乏または不足がSARS-CoV-2の感染リスク上昇と関連しているとわかった。2020年春の3ヶ月間にSARS-CoV-2検査を受けた191,000人超の米国在住者を調べた後ろ向きコホート研究で、ウィルス検査以前の12ヶ月以内のある一時点で測定された血清25-ヒドロキシビタミンD濃度が低めであることが、SARS-CoV-2検査での陽性結果と強く相関していた(293)。この研究では、血清25-ヒドロキシビタミンD濃度が1ng/mL上がるごとにSARS-CoV-2の陽性リスクが1.6%下がるという関連があり、血清濃度が55ng/mL以上でリスクが最も低くなっていた(293)。イスラエルにおける782人のSARS-CoV-2陽性者を含む7,807人の集団ベース後ろ向き研究で、血漿25-ヒドロキシビタミンD濃度が30ng/mL未満だと、それ以上のビタミンD濃度の場合に比べてSARS-CoV-2感染のリスクが50%高いという関連があった(294)。この研究ではビタミンDの状態評価がウィルス検査の前に行われたが、その時間枠に関する詳細情報は不足している。ビタミンDの栄養状態測定値とCOVID診断検査の時間的な関係は英国バイオバンク(UK Biobank)の大規模データ分析でも懸念であり、この分析ではSARS-CoV-2感染とビタミンDの状態には関連がないとなっている。この研究においては、COVID-19診断検査の10~14年前に行われたビタミンDの状態評価が使用された(291)。小規模後ろ向きコホート研究(295)と5つの症例対照研究(296-300)では、ビタミンDの状態とSARS-CoV-2感染との逆相関が報告されており、これは現在までのほとんどの研究結果と一致している。361,934人が参加した10の観察研究の2021年のメタ解析では、ビタミンD不足または欠乏とCOVID-19リスクの上昇との関連(OR, 1.43; 95% CI: 1.00-2.05)が報告されたが、それぞれの研究ごとの異種性が高い(301)。また英国バイオバンクのデータの解析では、ビタミンDのサプリメントを定期的に服用していると、服用していない者に比べてSARS-CoV-2感染リスクが34%低いという関連が見られた(292)。
さらに、入院の必要性や集中治療室への入室(302)」、肺炎のステージ(男性のみで女性はない;(303))、非侵襲的換気の必要性(304)、侵襲的機械的換気の必要性(305)、またはこれらやその他の指標の組み合わせ(297)によって測定されたCOVID-19の重篤リスクの上昇とビタミンD欠乏症との関連がわかり、ビタミンDの栄養状態が悪いこととCOVID-19の重篤度の関連が観察研究の大部分で示唆された。別の研究では、血漿25-ヒドロキシビタミンD濃度が30ng/mL未満と定義されるビタミンD不足とCOVID関連の入院可能性の上昇との相関がわかったが、50歳超の者のサブ解析(OR, 2.71; 95% CI 1.55-4.78; p<0.001)以外ではこの相関は統計的に有意になっていない(p=0.061)(294)。今日までの大部分のエビデンスと対照的に、ある症例対照研究ではビタミンD欠乏症はCOVID-19の重篤度と関連がないとわかった(298)。また、いくつかの研究でビタミンDの状態とCOVID-19の死亡率の関係が調べられ、そのうちの3つでビタミンD欠乏症が死亡リスクの上昇と関連しているとわかった(303, 305, 306)。残りの2つでは何の関連も見つからなかった(304, 307)が、そのうちの1つはCOVID-19診断検査の10年以上も前のビタミンDの測定値を使用していた(307)。
高齢、肥満、および2型糖尿病や心血管疾患の持病など、COVID-19重篤化リスク要因はいくつか知られている(308)ため、観察研究では潜在的交絡因子をコントロールすることが重要である。2つの準実験的研究では、SARS-CoV-2感染の前または間にビタミンD3を大量補給(50,000 IU/月、または80,000~100,000 IUを2~3ヶ月ごと)することによって、脆弱な年配のCOVID-19患者の重症度低下や生存率向上に関連があったと報告されている(309, 310)。COVID-19予防や治療にビタミンD補給をする無作為化対照試験がいくつか進行中であり、これらの結果でこの関連の因果関係に関する情報が得られるであろう。とはいえ現在のデータは、ビタミンDの状態を補給で改善することによってCOVID-19リスク要因を変えられることを示している。
疾病治療
アトピー性皮膚炎
アトピー性皮膚炎やアトピー性湿疹は先進国で特に広がっており、10~20%の子供および1~3%の成人が罹っている。アトピー性皮膚炎は、罹患すると皮膚が乾いて痒みのあることが特徴的な慢性炎症性皮膚疾患である。局所的な皮膚の炎症や免疫機能不全は、罹患者の表皮バリアを損なって皮膚感染やアトピー性反応を起こしやすくする可能性がある。この疾患はしばしば、食物アレルギー、喘息、およびアレルギー性鼻炎などのその他のアトピー性疾患を伴う(311)。
この疾病の病因は充分によくわかっていないが、ビタミンD欠乏がこの疾病の発症および/または重篤度に寄与しているかもしれないことが示唆されている(312)。英国バイオバンクの資料、(313)、SUNLIGHTコンソーシアム(35)、GABRIEL asthmaコンソーシアム(314)、EAGLE eczemaコンソーシアム(315)などのヨーロッパ系白人の大規模データを用いて、遺伝的に血清25-ヒドロキシビタミンD濃度が低いこととアトピー性皮膚炎、喘息、または血清イムノグロブリン(Ig)-E濃度が高いこととの間に何の関連もないことが最近のメンデルランダム化研究でわかった(316)。
もしかしたら局所的な炎症反応を調整し皮膚の抗菌作用を刺激することで、ビタミンDはこの疾病の治療に有効な付加的手段になるかもしれないのではないかと、いくつかの無作為化対照研究で調べられた。さらに、アトピー性皮膚炎の特定のケースに見られる光療法の有効性にも、ビタミンDの作用が部分的に介在しているかもしれない(311)。アトピー性皮膚炎でビタミンD濃度が低い45人の患者(被験者の70%が血清25-ヒドロキシビタミンD濃度が20ng/mL未満)による小規模無作為化二重盲検プラセボ対照試験で、600 IUのビタミンEと一緒もしくは単体で1,600 IUのビタミンD3を60日間毎日経口投与したら、SCORAD(SCORing Atopic Dermatitis=アトピー性皮膚炎のスコア)によって評価された湿疹の広がりやひどさが有意に低減した(317)。別の小規模無作為化試験でも、ビタミンD3(1,600 IU/日を60日間)はアトピー性皮膚炎の53人の患者のビタミンDの栄養状態を改善し、疾病の重篤度を下げた(318)。より最近では、湿疹面積と重症度指数(EASI)および包括的重症度評価(IGA)のスコア変化で示されたモンゴル人の子供の冬季性アトピー性皮膚炎の重症度が、ビタミンD3(1,000 IU/日を1ヶ月)によって改善した(319)。4つの小規模試験(上記のものを含む)のメタ解析で、ビタミンD補給は罹患者の測定可能な臨床的改善につながる可能性があると結論づけられた(320)。これらの予備的結果を支持し最も適切で効果的な補給計画を決定するための大規模試験が必要である。注記したいのは、ビタミンD類似体による乾癬の局所的治療が米国食品医薬品局(FDA)によって承認され、これはその他の皮膚病の治療でも有効であるかもしれないことだ(321)。
炎症性腸疾患
いくつかの原因不明の環境および遺伝的要因は、潰瘍性大腸炎(UC)およびクローン病(CD)を引き起こす腸内細菌叢に対する不適切な免疫反応が起こることに寄与すると考えられている。特定のVDR多型が、UCやCDを発症しやすくなることに関連しているかもしれない(322)。一方で、72,719人の女性の大規模コホートでは、ビタミンD摂取が多く血液中の濃度が高いと考えられると、UCやCDの発生が減るという関連がわかった(323)。6つの観察研究のメタ解析で、ビタミンDの状態とCDの重症度の逆相関がわかった(324)。3つの研究で、おそらく腸の炎症を抑えることでビタミンD3がCDの患者に有益となるかどうかを調べた。多機関による1つの二重盲検プラセボ対照研究で、1年間の治療後に寛解状態にあるCD患者の再発率は、毎日1,200 IUのビタミンD3と1,200mgのカルシウムを補給した者の方が、カルシウムのみを補給した者に比べて有意に低かった(13%対29%)(325)。もう一つの予備的研究では、18人のCD患者に1,000から5,000 IUまで用量を増やしながら24週間毎日ビタミンD3を投与して、血液中の25-ヒドロキシビタミンD濃度が40ng/mL超になるようにした。患者の半分は40ng/mLには至らなかったが、平均25-ヒドロキシビタミンD濃度は(ベースラインの平均16ng/mLから)45ng/mLまで上がり、ビタミンDの状態が全体的に改善したことで、クローン病活動指数(CDAI)のスコアで評価されるこの疾病の重篤度が有意に下がるという関連があった(326)。寛解中の27人の患者に対する3ヶ月の無作為化二重盲検プラセボ対照試験で、ビタミンD3を毎日補給(2,000 IU)したらビタミンDの状態はよくなったが、腸管透過性(腸管壁浸漏)または炎症や疾患活動度の測定値には何の有意な効果もなかった(327)。それでもその研究で、血清25-ヒドロキシビタミンD濃度が30 ng/mL以上になることが腸の炎症を減らして患者の生活の質を上げることに役立つかもしれないことが示唆された。炎症性腸疾患におけるビタミンDの治療的有効性を確定するさらなる研究が必要である。
心血管疾患
Intermountain Heart Collaborative study(=インターマウンテン心臓共同研究)における41,504の電子医療記録の前向き解析で、患者の3分の1しか適切な血清25-ヒドロキシビタミンD濃度(30ng/mL超)になっていなかったことがわかった。ビタミンD不足(血清25-ヒドロキシビタミンD濃度が30ng/mL以下)は、高血圧、冠動脈疾患、心不全、および脳卒中などの多くの心血管的病状の発生や蔓延に関連していた(328)。最適以下のビタミンD状態は、高血圧の発生や心血管的な有害事象の強力な決定因子である動脈壁硬化や血管内皮障害に関連付けられてきた(329)。
高血圧
いくつかの介入試験で、血圧に対するビタミンD補給の効果が評価されてきた。オランダに住み軽度の高血圧だが治療を受けていない18名の男女による初期の対照臨床試験で、冬に6週間毎週3回紫外線B波に当たると、血清25-ヒドロキシビタミンD濃度が162%上昇し、PTH濃度が15%下がり、24時間自由行動下の収縮期(=最高)および拡張期(=最低)血圧値が平均で6mmHg下がったことがわかった(330)。健康または心臓代謝の既存症状(高血圧を含む)のある1,879人の参加者による16の無作為化対照試験の最近のメタ解析で、ビタミンD補給(800~8,571 IU/日を5週間から1年間)をしても最高および最低血圧値が大きく下がることはなかった。しかし、6つの試験のサブグループ解析で、既存症状のある者の最低血圧値が有意に1.31mmHg下がったことがわかった。ビタミンD不足/欠乏の場合には血圧の改善が期待できても、参加者の最適以下のビタミンD濃度は心臓代謝の症状のある者にのみ観察されるのではないことに、著者らは留意している(331)。対照的に、Styrian vitamin D hypertension trial(=スティリアのビタミンD高血圧試験)(332)およびDAYLIGHT(=高血圧リスクの高い者へのビタミンD療法試験)(333)という最近の2つの介入試験で、(前)高血圧症の被験者にビタミンD3補給(400~4,000 IU/日を2~6ヶ月)しても、ベースラインのビタミンDの状態(IOMの現在のカットオフ値で不足または適切)に関わらず血圧低下のエビデンスは示されなかった。
皮膚の色が濃い、温帯気候の緯度に住んでいる、および加齢などの皮膚でのビタミンD合成を減らす条件は高血圧の罹患率の上昇と関連があり(334)、このことはビタミンDが特定の集団の血圧を下げるかもしれないことを示唆している。上記のメタ解析で、ある4群二重盲検プラセボ対照試験が283人のアフリカ系アメリカ人に対して行われ、彼らは無作為に分けられて日に1,000 IU、2,000 IU、または4,000 IUのビタミンD3補給を3ヶ月間受けた。ベースライン値に比べて最高血圧は1,000 IU/日、2,000 IU/日、および4,000 IU/日の群でそれぞれ0.66mmHg、3.4mmHg、および4mmHg下がったのに対して、プラセボ群では1.7mmHg上がった。25-ヒドロキシビタミンD濃度が1ng/mL上がるごとに、最高血圧値が有意に0.2mmHg下がることが発見された。しかし、ビタミンD3とプラセボとでは3ヶ月の血圧変化に何の統計的な差もなかった(335)。150人の年配者(平均年齢77歳)を対象にした別の無作為化プラセボ対照試験では、3ヶ月ごとに100,000 IUのビタミンD3補給を1年間しても、プラセボに比べて血圧は大きく下がらなかった(336)。
ビタミンD補給が高血圧の予防や管理に役立つのかどうかを決定するさらなる研究が必要である。
うっ血性心不全
うっ血性心不全(心機能不全)は、脈拍が上がりその後に左心室肥大になることが特徴である。心不全は、心エコー検査(=心臓超音波検査)で評価される左室駆出率(LVEF)の減少を伴う。心不全の患者には現在、アンジオテンシン変換酵素(ACE)阻害薬(「血圧調整」の項参照)が第一選択治療薬として使用される。冠動脈造影を受けた健康な患者に対する横断研究で、血清25-ヒドロキシビタミンD濃度が30ng/mL未満だと、冠血流量率が悪いという関連があった(337)。ビタミンD濃度が最適以下だと、心不全の患者の予後がよくないこととも関連があった(338)。過去数年間のいくつかの介入研究で、心不全の者へのビタミンD補給の効果が調べられた。12週間の無作為化二重盲検プラセボ対照研究では、慢性うっ血性心不全の子供に毎日1,200 IUのビタミンD3を補給したら、ビタミンDの状態が大幅に良くなり、心筋の働きも改善(LVEFが高くなる)し、PTHや炎症性サイトカインの濃度も低くなった(339)。心不全を患う64人の年配の患者による別の無作為化二重盲検プラセボ対照試験では、800mg/日のカルシウムと50,000 IU/週のビタミンD3を摂取した参加者は、カルシウムだけ補給した者と比べても、体力成績(有酸素能力や骨格筋強度の評価の代替指標として使用される)が大幅に良いということはなかった(340)。心不全の573人の被験者に対する7つの小規模無作為化プラセボ対照試験の最近のメタ解析で、ビタミンD補給(1,000 IU/日~50,000 IU/週)を6週間~9ヶ月したら血清中のPTH、腫瘍壊死因子-α(TNF-α)、およびC-反応性タンパク質(CRP)の濃度が下がった。しかしビタミンDで治療をした患者とプラセボを摂取した患者とでは、LVEF、血中インターロイキン-10(IL-10)濃度およびレニン濃度に有意な差はなかった(341)。また、末期心不全でビタミンD濃度が不適切(ベースライン血清25-ヒドロキシビタミンD濃度が8.6~19.7ng/mL)な患者に対するEVITA(=総死亡率に対するビタミンDの効果)試験で、4,000 IU/日のビタミンD補給を3年間しても、プラセボに比べて死亡リスクは下がらなかった(342)。
摂取源
日光
日光に含まれる紫外線B波(UVB;波長290~315ナノメートル)は、皮膚の表皮でのビタミンD3の生成を刺激する(343)。日光にあたることで、大部分の人のビタミンD必要量全部がまかなえる。屋外で週に2~3回短時間すごす子供や若い成人は一般的に、ビタミンD欠乏症を防ぐのに必要なすべてのビタミンDを合成することになる。ある研究で、模擬太陽光に最小紅斑量(肌が若干赤くなるのに必要な量)だけ全身を当てた後の血清ビタミンD濃度は、ビタミンDを約10,000~25,000 IU摂取した時と同じであった(344)。肌の色が濃い者は肌の色が明るい者に比べて、日光に当たってもビタミンD合成が顕著に少ない(34)。さらに、年配者は日光に当ってもビタミンDを合成する能力が下がっている上に、皮膚がんや肌の損傷を防ぐために頻繁に日焼け止めを使ったり肌を覆ったりする。SPF値が10の日焼け止めを塗ると、ビタミンD合成が90%も減る(30)。北緯および南緯40度くらい(マサチューセッツ州ボストンは北緯42度)では、11月から3月初旬までビタミンD合成に必要なUVB量が不十分である。さらに10度北または南(たとえばカナダのエドモントン)では、「ビタミンD不足の冬」は10月中旬から3月中旬まで延びる。緯度が25度(フロリダ州マイアミ)では年間を通して、緯度42度(ボストン)では春、夏、および秋に、12時ころに手、腕、および顔に日光を毎日15分まで浴びると、肌の色が明るい者はビタミンDが1,000 IU生成されるかもしれない(345)。
食品の摂取源
ビタミンDは天然にはいくつかの食品にしか入っておらず、それには油ののった魚(サバ、サケ、イワシ)、肝油、およびビタミンDを餌に混ぜて育てられた鶏の卵、および日光または紫外線にさらされたきのこなどがある。米国では牛乳と粉ミルクがビタミンD強化されており、1リットル弱に400 IU(10μg)入っている。しかし、チーズやヨーグルトなどのその他の乳製品は、常にビタミンD強化されているとは限らない。シリアル、パン、およびフルーツジュースもビタミンD強化されている可能性がある。強化食品のビタミンD含有量の変異が大きいので、ビタミンDの食事からの平均摂取量を正確に推定するのは難しい(346)。下の表2にビタミンDが豊富ないくつかの食品のビタミンD含有量(ビタミンD2とビタミンD3の合計)を国際単位(IU)とマイクログラム(μg)で示す。特定の食品の栄養素含有量についての詳細は、USDA(=米国農務省)のFoodData Centralを検索のこと。25-ヒドロキシビタミンD代謝物も低濃度で特定の食物に含まれ、それらには肉、乳製品、および卵などがある(347,348)。
表2 ビタミンD摂取源の食品
|
食品 |
分量 |
ビタミンD(IU) |
ビタミンD(μg) |
|
缶詰のカラフトマス(ピンクサーモン) |
85g |
465 |
11.6 |
|
詰のサバ(骨なし) |
85g |
248 |
6.2 |
|
缶詰のイワシ |
85g |
164 |
4.1 |
|
低脂肪(1%)ビタミンD強化牛乳 |
1カップ強 |
108 |
2.7 |
|
ビタミンD強化オレンジジュース |
1カップ強 |
100 |
2.5 |
|
強化シリアル |
1食分(通常1カップ強)
|
40~50 |
1.0~1.3 |
|
卵黄 |
大1 |
37 |
0.9 |
サプリメント
処方箋なしで入手可能な大部分のビタミンDサプリメントは、コレカルシフェロール(ビタミンD3)を含んでいる。マルチビタミンのサプリメントは一般的に、400 IU~1,000 IU(10μg~25μg)のビタミンD2またはD3を含む。ビタミンD単一成分サプリメントは400~50,000 IUのビタミンD3を含むかもしれないが、400 IUが最も一般的な用量である(66)。多くのカルシウムサプリメントもビタミンDを含んでいることがある。ビタミンD2(エルゴカルシフェロール)の急速投与量では血清25-ヒドロキシビタミンD濃度を上げるのにビタミンD3ほど常に有効ではないかもしれないことが無作為化対照試験のメタ解析で示唆されたが、毎日補給の効能にはビタミンD2とビタミンD3の差は見られなかった(349)。ただしある25週間の無作為化二重盲検プラセボ対照試験では、夏の終わりに毎日1,000 IUのビタミンD3補給を開始すると、夏の時点の25-ヒドロキシビタミンD濃度を秋や冬も維持する効能がビタミンD2よりも高かったことがわかった(350)。
コレカルシフェロールのヒドロキシ化された形態である25-ヒドロキシビタミンD3(カルシジオール;カルシフェジオール)をサプリメントとして使用することに関心が高まっている。このビタミンD代謝物は皮膚で生成されたり食事で摂取されたりしたコレカルシフェロールからヒトや動物の肝臓で合成され、いくつかの食物(肉、牛乳、卵など)にも低濃度で含まれている(347,348)。一般的にカルシフェジオールの方が、同量のコレカルシフェロールを補給するよりも血中25-ヒドロキシビタミンD濃度の上昇に2~5倍効能があることが、臨床研究でわかっている(351~359)。したがってカルシフェジオール補給はコレカルシフェロールよりも低用量でビタミンDの状態を急速かつ一貫して改善するための手段である可能性があり、コレカルシフェロールの腸での吸収が減るような症状の者には有益であるかもしれない(359)。しかしながら25-ヒドロキシビタミンD3の形態は、現在米国では店頭で購入可能なサプリメントではない。
安全性
毒性
ビタミンDの毒性(ビタミンD過剰症)で、日光にあたることによって発生したものは観察されていない。これは、過剰な日光浴が7-デヒドロコレステロールやコレカルシフェロールから生物学的に不活性ないくつかの光反応生成物を発生させるからである(3)。ビタミンDの毒性で異常に高い血清カルシウム濃度(高カルシウム血症)になることがあり、これは長期間治療しないでいると骨量減少、腎臓結石、および心臓や腎臓といった臓器の石灰化に至る可能性がある。高カルシウム血症は、日に50,000 IU超のビタミンDを摂取した後に見られる(360)。全体的に、10,000 IU/日未満の摂取量なら、ビタミンDによる毒性は健康な者ではとても少ないことが研究で示唆されている(361~363)。しかし、米国医学研究所の食品栄養委員会は許容上限摂取量(UL)をすべての成人に対して4,000 IU/日(100μg/日)に設定した(表3参照)。原発性副甲状腺機能亢進症、サルコイドーシス、結核、およびリンパ腫などの特定の病状は、ビタミンDに反応して高カルシウム血症のリスクを高めることがある(361)。これらの病状の者はビタミンDのいかなる増加にも反応して高カルシウム血症になるかもしれず、ビタミンD摂取の増加に関して有識の医療従事者に相談すべきである。
表3 ビタミンDの許容上限摂取量(UL)
|
年齢 |
μg/日 |
IU/日 |
|
乳児 0-6ヶ月 |
25 |
1,000 |
|
乳児 6-12ヶ月 |
37.5 |
1,500 |
|
幼児 1-3歳 |
62.5 |
2,500 |
|
子供 4-8歳 |
75 |
3,000 |
|
子供 9-13歳 |
100 |
4,000 |
|
青少年 14-18歳 |
100 |
4,000 |
|
成人 19歳以上 |
100 |
4,000 |
薬物相互作用
以下の薬物は腸でのビタミンDの吸収を減らす可能性があるので、ビタミンDと同時に摂取すべきでない:コレスチラミン(クエストラン)、コレスチポール(コレスチッド)、オルリスタット(ゼニカル)、および鉱物油(364,365)。以下の薬物はビタミンDの代謝を上げて血清25-ヒドロキシビタミンD濃度を減らすかもしれない:フェニトイン(ジランチン)、フォスフェニトイン(セレビクス)、フェノバルビタール(ルミナール)、カルバマゼピン(テグレトール)、およびリファンピン(リマクタン)(6)。胃酸の分泌を抑えるH2ブロッカーであるシメチジンは、肝臓でのビタミンDのヒドロキシル化を阻害する(366)。呑酸、胃食道逆流疾患(GERD)、または胃潰瘍をプロトンポンプ阻害薬(オメプラゾール、ランソプラゾール)で治療することは、カルシウムの吸収に支障をきたして骨折リスクを高めるかもしれないので、患者にはカルシウムとビタミンDのサプリメントの摂取が勧められる(367)。経口抗真菌薬のケトコナゾールは25-ヒドロキシビタミンD3-1α-ヒドロキシラーゼ酵素を抑制し、健康な男性の血清1α,25-ジヒドロキシビタミンD濃度を減らすことがわかっている(368)。米国内分泌学会は、糖質コルチコイドやHIVの治療薬を服用している患者のビタミンD状態を監視することも勧めている。これらの薬物は25-ヒドロキシビタミンDの異化を増進させるからである(40)。細胞増殖抑制剤の中には、化学療法中のがん患者の25-ヒドロキシビタミンDおよび1α,25-ジヒドロキシビタミンDの分解を増進するものがある(6)。ビタミンDを有害なレベルまで服用して高カルシウム血症になると、ジゴキシン(ラノキシン)を服用している患者の不整脈を促進するかもしれない(366)。高カルシウム血症はまた、心房細動におけるベラパミル(カラン)およびジルチアゼム(カルディゼム)の効果を低減させる可能性がある(366)。
ライナス・ポーリング研究所の推奨
ライナス・ポーリング研究所は、概して健康な成人が毎日2,000 IU(50μg)のビタミンD補給をすることを推奨する。大部分のマルチビタミン剤は400 IU(10μg)のビタミンDを含んでおり、ビタミンD単一成分のサプリメントも追加的に利用できる。日光浴、食事、肌の色、および肥満度指数(BMI)が、体のビタミンD濃度に変動的かつ実質的に影響する。個人差を調整し適切なビタミンDの状態を確保するために、ライナス・ポーリング研究所は血清25-ヒドロキシビタミンD濃度として少なくとも30ng/mL(75nmol/L)を目標にすることを推奨する。血清25-ヒドロキシビタミンビタミンD濃度が30ng/mL~60ng/mLだと、がんや自己免疫疾患などの健康への悪影響のリスクが低いという関連が観察研究で示唆されている。
米国小児科学会は現在、すべての幼児、子供、および青少年が毎日400 IUのビタミンD補給を受けることを提唱している(19)。米国内分泌学会の推奨(40)と同様に、乳児は400~1,000 IU(10~25μg)のビタミンDを、子どもや青少年では600~1,000 IU(15~25μg)のビタミンDを毎日摂取することをライナス・ポーリング研究所は推奨する。母乳、粉ミルク、および子供や青少年の食事の平均的ビタミンD含有量であれば、これらの推奨値を達成するのにビタミンD補給が必要かもしれない。
年配者(50歳超)
年配者には毎日2,000 IU(50μg)のビタミンD補給が特に重要で、これは加齢によって日光に当たっても皮膚でビタミンDを合成する能力が下がるという関連があるからである。
Authors and Reviewers
Originally written in 2000 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in March 2003 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in March 2004 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in January 2008 by:
Victoria J. Drake, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in July 2014 by:
Barbara Delage, Ph.D.
Linus Pauling Institute
Oregon State University
The 2014 update of this article was supported by a grant from Bayer Consumer Care AG, Basel, Switzerland.
Updated in July 2017 by:
Barbara Delage, Ph.D.
Linus Pauling Institute
Oregon State University
Reviewed in October 2017 by:
Adrian F. Gombart, Ph.D.
Principal Investigator, Linus Pauling Institute
Associate Professor, Department of Biochemistry and Biophysics
Oregon State University
The 2017 update of this article was supported by a grant from Pfizer Inc.
Last updated 2/11/21 Copyright 2000-2024 Linus Pauling Institute
References
1. Holick MF. Vitamin D: importance in the prevention of cancers, type 1 diabetes, heart disease, and osteoporosis. Am J Clin Nutr. 2004;79(3):362-371. (PubMed)
2. Bikle DD. Vitamin D metabolism, mechanism of action, and clinical applications. Chem Biol. 2014;21(3):319-329. (PubMed)
3. Volmer DA, Mendes LR, Stokes CS. Analysis of vitamin D metabolic markers by mass spectrometry: Current techniques, limitations of the "gold standard" method, and anticipated future directions. Mass Spectrom Rev. 2015;34(1):2-23. (PubMed)
4. Holick MF. Vitamin D: A millenium perspective. J Cell Biochem. 2003;88(2):296-307. (PubMed)
5. Sutton AL, MacDonald PN. Vitamin D: more than a "bone-a-fide" hormone. Mol Endocrinol. 2003;17(5):777-791. (PubMed)
6. Grober U, Spitz J, Reichrath J, Kisters K, Holick MF. Vitamin D: Update 2013: From rickets prophylaxis to general preventive healthcare. Dermatoendocrinol. 2013;5(3):331-347. (PubMed)
7. Lieben L, Carmeliet G. The delicate balance between vitamin D, calcium and bone homeostasis: lessons learned from intestinal- and osteocyte-specific VDR null mice. J Steroid Biochem Mol Biol. 2013;136:102-106. (PubMed)
8. Fukumoto S. Phosphate metabolism and vitamin D. Bonekey Rep. 2014;3:497. (PubMed)
9. Lin R, White JH. The pleiotropic actions of vitamin D. Bioessays. 2004;26(1):21-28. (PubMed)
10. Edfeldt K, Liu PT, Chun R, et al. T-cell cytokines differentially control human monocyte antimicrobial responses by regulating vitamin D metabolism. Proc Natl Acad Sci U S A. 2010;107(52):22593-22598. (PubMed)
11. Smolders J, Thewissen M, Damoiseaux J. Control of T cell activation by vitamin D. Nat Immunol. 2011;12(1):3; author reply 3-4. (PubMed)
12. Aranow C. Vitamin D and the immune system. J Investig Med. 2011;59(6):881-886. (PubMed)
13. Zeitz U, Weber K, Soegiarto DW, Wolf E, Balling R, Erben RG. Impaired insulin secretory capacity in mice lacking a functional vitamin D receptor. Faseb J. 2003;17(3):509-511. (PubMed)
14. Bourlon PM, Billaudel B, Faure-Dussert A. Influence of vitamin D3 deficiency and 1,25 dihydroxyvitamin D3 on de novo insulin biosynthesis in the islets of the rat endocrine pancreas. J Endocrinol. 1999;160(1):87-95. (PubMed)
15. Heer M, Egert S. Nutrients other than carbohydrates: their effects on glucose homeostasis in humans. Diabetes Metab Res Rev. 2015;31(1):14-35. (PubMed)
16. Sheng H-W. Sodium, chloride, and potassium. In: Stipanuk M, ed. Biochemical and Physiological Aspects of Human Nutrition. Philadelphia: W.B. Saunders Company; 2000:686-710.
17. Sigmund CD. Regulation of renin expression and blood pressure by vitamin D(3). J Clin Invest. 2002;110(2):155-156. (PubMed)
18. Li YC, Kong J, Wei M, Chen ZF, Liu SQ, Cao LP. 1,25-Dihydroxyvitamin D(3) is a negative endocrine regulator of the renin-angiotensin system. J Clin Invest. 2002;110(2):229-238. (PubMed)
19. Wagner CL, Greer FR, American Academy of Pediatrics Section on B, American Academy of Pediatrics Committee on N. Prevention of rickets and vitamin D deficiency in infants, children, and adolescents. Pediatrics. 2008;122(5):1142-1152. (PubMed)
20. Goldacre M, Hall N, Yeates DG. Hospitalisation for children with rickets in England: a historical perspective. Lancet. 2014;383(9917):597-598. (PubMed)
21. Jones AN, Hansen KE. Recognizing the musculoskeletal manifestations of vitamin D deficiency. J Musculoskelet Med. 2009;26(10):389-396. (PubMed)
22. Bringhurst FR, Demay MB, Kronenberg HM. Mineral Metabolism. In: Larson PR, Kronenberg HM, Melmed S, Polonsky KS, eds. Williams Textbook of Endocrinology. 10th ed. Philadelphia: Saunders Book Company; 2003:1317-1320.
23. Plotnikoff GA, Quigley JM. Prevalence of severe hypovitaminosis D in patients with persistent, nonspecific musculoskeletal pain. Mayo Clin Proc. 2003;78(12):1463-1470. (PubMed)
24. Deandrea S, Lucenteforte E, Bravi F, Foschi R, La Vecchia C, Negri E. Risk factors for falls in community-dwelling older people: a systematic review and meta-analysis. Epidemiology. 2010;21(5):658-668. (PubMed)
25. Al-Khalidi B, Kimball SM, Rotondi MA, Ardern CI. Standardized serum 25-hydroxyvitamin D concentrations are inversely associated with cardiometabolic disease in US adults: a cross-sectional analysis of NHANES, 2001-2010. Nutr J. 2017;16(1):16. (PubMed)
26. Cooper JD, Smyth DJ, Walker NM, et al. Inherited variation in vitamin D genes is associated with predisposition to autoimmune disease type 1 diabetes. Diabetes. 2011;60(5):1624-1631. (PubMed)
27. Webb AR, Kline L, Holick MF. Influence of season and latitude on the cutaneous synthesis of vitamin D3: exposure to winter sunlight in Boston and Edmonton will not promote vitamin D3 synthesis in human skin. J Clin Endocrinol Metab. 1988;67(2):373-378. (PubMed)
28. Nichols EK, Khatib IM, Aburto NJ, et al. Vitamin D status and determinants of deficiency among non-pregnant Jordanian women of reproductive age. Eur J Clin Nutr. 2012;66(6):751-756. (PubMed)
29. Bassil D, Rahme M, Hoteit M, Fuleihan Gel H. Hypovitaminosis D in the Middle East and North Africa: prevalence, risk factors and impact on outcomes. Dermatoendocrinol. 2013;5(2):274-298. (PubMed)
30. Balk SJ, Council on Environmental H, Section on D. Ultraviolet radiation: a hazard to children and adolescents. Pediatrics. 2011;127(3):e791-817. (PubMed)
31. Dawodu A, Tsang RC. Maternal vitamin D status: effect on milk vitamin D content and vitamin D status of breastfeeding infants. Adv Nutr. 2012;3(3):353-361. (PubMed)
32. Thiele DK, Senti JL, Anderson CM. Maternal vitamin D supplementation to meet the needs of the breastfed infant: a systematic review. J Hum Lact. 2013;29(2):163-170. (PubMed)
33. Wharton B, Bishop N. Rickets. Lancet. 2003;362(9393):1389-1400. (PubMed)
34. Chen TC, Chimeh F, Lu Z, et al. Factors that influence the cutaneous synthesis and dietary sources of vitamin D. Arch Biochem Biophys. 2007;460(2):213-217. (PubMed)
35. Wang TJ, Zhang F, Richards JB, et al. Common genetic determinants of vitamin D insufficiency: a genome-wide association study. Lancet. 2010;376(9736):180-188. (PubMed)
36. Ahn J, Yu K, Stolzenberg-Solomon R, et al. Genome-wide association study of circulating vitamin D levels. Hum Mol Genet. 2010;19(13):2739-2745. (PubMed)
37. Wang W, Ingles SA, Torres-Mejia G, et al. Genetic variants and non-genetic factors predict circulating vitamin D levels in Hispanic and non-Hispanic White women: the Breast Cancer Health Disparities Study. Int J Mol Epidemiol Genet. 2014;5(1):31-46. (PubMed)
38. Elkum N, Alkayal F, Noronha F, et al. Vitamin D insufficiency in Arabs and South Asians positively associates with polymorphisms in GC and CYP2R1 genes. PLoS One. 2014;9(11):e113102. (PubMed)
39. Zhang Y, Yang S, Liu Y, Ren L. Relationship between polymorphisms in vitamin D metabolism-related genes and the risk of rickets in Han Chinese children. BMC Med Genet. 2013;14:101. (PubMed)
40. Holick MF, Binkley NC, Bischoff-Ferrari HA, et al. Evaluation, treatment, and prevention of vitamin D deficiency: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab. 2011;96(7):1911-1930. (PubMed)
41. Harris SS, Soteriades E, Coolidge JA, Mudgal S, Dawson-Hughes B. Vitamin D insufficiency and hyperparathyroidism in a low income, multiracial, elderly population. J Clin Endocrinol Metab. 2000;85(11):4125-4130. (PubMed)
42. Allain TJ, Dhesi J. Hypovitaminosis D in older adults. Gerontology. 2003;49(5):273-278. (PubMed)
43. Doorenbos CR, van den Born J, Navis G, de Borst MH. Possible renoprotection by vitamin D in chronic renal disease: beyond mineral metabolism. Nat Rev Nephrol. 2009;5(12):691-700. (PubMed)
44. Pappa HM, Bern E, Kamin D, Grand RJ. Vitamin D status in gastrointestinal and liver disease. Curr Opin Gastroenterol. 2008;24(2):176-183. (PubMed)
45. Jahnsen J, Falch JA, Mowinckel P, Aadland E. Vitamin D status, parathyroid hormone and bone mineral density in patients with inflammatory bowel disease. Scand J Gastroenterol. 2002;37(2):192-199. (PubMed)
46. Arunabh S, Pollack S, Yeh J, Aloia JF. Body fat content and 25-hydroxyvitamin D levels in healthy women. J Clin Endocrinol Metab. 2003;88(1):157-161. (PubMed)
47. Gallagher JC, Yalamanchili V, Smith LM. The effect of vitamin D supplementation on serum 25(OH)D in thin and obese women. J Steroid Biochem Mol Biol. 2013;136:195-200. (PubMed)
48. Deng X, Song Y, Manson JE, et al. Magnesium, vitamin D status and mortality: results from US National Health and Nutrition Examination Survey (NHANES) 2001 to 2006 and NHANES III. BMC Med. 2013;11:187. (PubMed)
49. Sempos CT, Durazo-Arvizu RA, Binkley N, Jones J, Merkel JM, Carter GD. Developing vitamin D dietary guidelines and the lack of 25-hydroxyvitamin D assay standardization: The ever-present past. J Steroid Biochem Mol Biol. 2016;164:115-119. (PubMed)
50. Chapuy MC, Preziosi P, Maamer M, et al. Prevalence of vitamin D insufficiency in an adult normal population. Osteoporos Int. 1997;7(5):439-443. (PubMed)
51. Thomas MK, Lloyd-Jones DM, Thadhani RI, et al. Hypovitaminosis D in medical inpatients. N Engl J Med. 1998;338(12):777-783. (PubMed)
52. Heaney RP, Dowell MS, Hale CA, Bendich A. Calcium absorption varies within the reference range for serum 25-hydroxyvitamin D. J Am Coll Nutr. 2003;22(2):142-146. (PubMed)
53. Valcour A, Blocki F, Hawkins DM, Rao SD. Effects of age and serum 25-OH-vitamin D on serum parathyroid hormone levels. J Clin Endocrinol Metab. 2012;97(11):3989-3995. (PubMed)
54. Ginde AA, Wolfe P, Camargo CA, Jr., Schwartz RS. Defining vitamin D status by secondary hyperparathyroidism in the US population. J Endocrinol Invest. 2012;35(1):42-48. (PubMed)
55. Gallagher JC, Yalamanchili V, Smith LM. The effect of vitamin D on calcium absorption in older women. J Clin Endocrinol Metab. 2012;97(10):3550-3556. (PubMed)
56. Looker AC, Johnson CL, Lacher DA, Pfeiffer CM, Schleicher RL, Sempos CT. Vitamin D status: United States, 2001-2006. NCHS Data Brief. 2011(59):1-8. (PubMed)
57. Food and Nutrition Board, Institute of Medicine. Dietary Reference Intakes for Calcium and Vitamin D. Washington, D.C.: The National Academies Press; 2011. (The National Academies Press)
58. Mithal A, Wahl DA, Bonjour JP, et al. Global vitamin D status and determinants of hypovitaminosis D. Osteoporos Int. 2009;20(11):1807-1820. (PubMed)
59. Powe CE, Evans MK, Wenger J, et al. Vitamin D-binding protein and vitamin D status of black Americans and white Americans. N Engl J Med. 2013;369(21):1991-2000. (PubMed)
60. Durazo-Arvizu RA, Dawson-Hughes B, Kramer H, et al. The reverse J-shaped association between serum total 25-hydroxyvitamin D concentration and all-cause mortality: the impact of assay standardization. Am J Epidemiol. 2017;185(8):720-726. (PubMed)
61. Gaksch M, Jorde R, Grimnes G, et al. Vitamin D and mortality: Individual participant data meta-analysis of standardized 25-hydroxyvitamin D in 26916 individuals from a European consortium. PLoS One. 2017;12(2):e0170791. (PubMed)
62. Chowdhury R, Kunutsor S, Vitezova A, et al. Vitamin D and risk of cause specific death: systematic review and meta-analysis of observational cohort and randomised intervention studies. BMJ. 2014;348:g1903. (PubMed)
63. Gupta V, Walia GK, Sachdeva MP. 'Mendelian randomization': an approach for exploring causal relations in epidemiology. Public Health. 2017;145:113-119. (PubMed)
64. Afzal S, Brondum-Jacobsen P, Bojesen SE, Nordestgaard BG. Genetically low vitamin D concentrations and increased mortality: Mendelian randomisation analysis in three large cohorts. BMJ. 2014;349:g6330. (PubMed)
65. Bjelakovic G, Gluud LL, Nikolova D, et al. Vitamin D supplementation for prevention of mortality in adults. Cochrane Database Syst Rev. 2014(1):Cd007470. (PubMed)
66. Wacker M, Holick MF. Vitamin D - effects on skeletal and extraskeletal health and the need for supplementation. Nutrients. 2013;5(1):111-148. (PubMed)
67. Lips P, Hosking D, Lippuner K, et al. The prevalence of vitamin D inadequacy amongst women with osteoporosis: an international epidemiological investigation. J Intern Med. 2006;260(3):245-254. (PubMed)
68. Torbergsen AC, Watne LO, Wyller TB, et al. Vitamin K1 and 25(OH)D are independently and synergistically associated with a risk for hip fracture in an elderly population: A case control study. Clin Nutr. 2015;34(1):101-106. (PubMed)
69. Lips P, van Schoor NM. The effect of vitamin D on bone and osteoporosis. Best Pract Res Clin Endocrinol Metab. 2011;25(4):585-591. (PubMed)
70. Reid IR, Bolland MJ, Grey A. Effects of vitamin D supplements on bone mineral density: a systematic review and meta-analysis. Lancet. 2014;383(9912):146-155. (PubMed)
71. Rosen CJ. Vitamin D supplementation: bones of contention. Lancet. 2014;383(9912):108-110. (PubMed)
72. Mocanu V, Vieth R. Three-year follow-up of serum 25-hydroxyvitamin D, parathyroid hormone, and bone mineral density in nursing home residents who had received 12 months of daily bread fortification with 125 mug of vitamin D3. Nutr J. 2013;12:137. (PubMed)
73. Feskanich D, Willett WC, Colditz GA. Calcium, vitamin D, milk consumption, and hip fractures: a prospective study among postmenopausal women. Am J Clin Nutr. 2003;77(2):504-511. (PubMed)
74. Jackson RD, LaCroix AZ, Gass M, et al. Calcium plus vitamin D supplementation and the risk of fractures. N Engl J Med. 2006;354(7):669-683. (PubMed)
75. Wang Y, Wactawski-Wende J, Sucheston-Campbell LE, et al. The influence of genetic susceptibility and calcium plus vitamin D supplementation on fracture risk. Am J Clin Nutr. 2017;105(4):970-979. (PubMed)
76. Gurney EP, Nachtigall MJ, Nachtigall LE, Naftolin F. The Women's Health Initiative trial and related studies: 10 years later: a clinician's view. J Steroid Biochem Mol Biol. 2014;142:4-11. (PubMed)
77. Grant AM, Avenell A, Campbell MK, et al. Oral vitamin D3 and calcium for secondary prevention of low-trauma fractures in elderly people (Randomised Evaluation of Calcium Or vitamin D, RECORD): a randomised placebo-controlled trial. Lancet. 2005;365(9471):1621-1628. (PubMed)
78. Bischoff-Ferrari HA, Giovannucci E, Willett WC, Dietrich T, Dawson-Hughes B. Estimation of optimal serum concentrations of 25-hydroxyvitamin D for multiple health outcomes. Am J Clin Nutr. 2006;84(1):18-28. (PubMed)
79. Khaw KT, Stewart AW, Waayer D, et al. Effect of monthly high-dose vitamin D supplementation on falls and non-vertebral fractures: secondary and post-hoc outcomes from the randomised, double-blind, placebo-controlled ViDA trial. Lancet Diabetes Endocrinol. 2017;5(6):438-447. (PubMed)
80. Chung M, Lee J, Terasawa T, Lau J, Trikalinos TA. Vitamin D with or without calcium supplementation for prevention of cancer and fractures: an updated meta-analysis for the US Preventive Services Task Force. Ann Intern Med. 2011;155(12):827-838. (PubMed)
81. Bischoff-Ferrari HA, Willett WC, Orav EJ, et al. A pooled analysis of vitamin D dose requirements for fracture prevention. N Engl J Med. 2012;367(1):40-49. (PubMed)
82. Avenell A, Mak JC, O'Connell D. Vitamin D and vitamin D analogues for preventing fractures in post-menopausal women and older men. Cochrane Database Syst Rev. 2014;4:CD000227. (PubMed)
83. Annweiler C, Beauchet O. Questioning vitamin D status of elderly fallers and nonfallers: a meta-analysis to address a 'forgotten step'. J Intern Med. 2015;277(1):16-44. (PubMed)
84. Cangussu LM, Nahas-Neto J, Orsatti CL, Bueloni-Dias FN, Nahas EA. Effect of vitamin D supplementation alone on muscle function in postmenopausal women: a randomized, double-blind, placebo-controlled clinical trial. Osteoporos Int. 2015;26(10):2413-2421. (PubMed)
85. Cangussu LM, Nahas-Neto J, Orsatti CL, et al. Effect of isolated vitamin D supplementation on the rate of falls and postural balance in postmenopausal women fallers: a randomized, double-blind, placebo-controlled trial. Menopause. 2016;23(3):267-274. (PubMed)
86. Bischoff-Ferrari HA, Dawson-Hughes B, Orav EJ, et al. Monthly high-dose vitamin D treatment for the prevention of functional decline: a randomized clinical trial. JAMA Intern Med. 2016;176(2):175-183. (PubMed)
87. Murad MH, Elamin KB, Abu Elnour NO, et al. Clinical review: The effect of vitamin D on falls: a systematic review and meta-analysis. J Clin Endocrinol Metab. 2011;96(10):2997-3006. (PubMed)
88. Boonen S, Lips P, Bouillon R, Bischoff-Ferrari HA, Vanderschueren D, Haentjens P. Need for additional calcium to reduce the risk of hip fracture with vitamin d supplementation: evidence from a comparative metaanalysis of randomized controlled trials. J Clin Endocrinol Metab. 2007;92(4):1415-1423. (PubMed)
89. Grant WB. Update on evidence that support a role of solar ultraviolet-B irradiance in reducing cancer risk. Anticancer Agents Med Chem. 2013;13(1):140-146. (PubMed)
90. Yin L, Ordonez-Mena JM, Chen T, Schottker B, Arndt V, Brenner H. Circulating 25-hydroxyvitamin D serum concentration and total cancer incidence and mortality: a systematic review and meta-analysis. Prev Med. 2013;57(6):753-764. (PubMed)
91. Gandini S, Gnagnarella P, Serrano D, Pasquali E, Raimondi S. Vitamin D receptor polymorphisms and cancer. Adv Exp Med Biol. 2014;810:69-105. (PubMed)
92. Vaughan-Shaw PG, O'Sullivan F, Farrington SM, et al. The impact of vitamin D pathway genetic variation and circulating 25-hydroxyvitamin D on cancer outcome: systematic review and meta-analysis. Br J Cancer. 2017;116(8):1092-1110. (PubMed)
93. Gombart AF, Luong QT, Koeffler HP. Vitamin D compounds: activity against microbes and cancer. Anticancer Res. 2006;26(4A):2531-2542. (PubMed)
94. Thorne J, Campbell MJ. The vitamin D receptor in cancer. Proc Nutr Soc. 2008;67(2):115-127. (PubMed)
95. Garland CF, Garland FC, Gorham ED. Calcium and vitamin D. Their potential roles in colon and breast cancer prevention. Ann N Y Acad Sci. 1999;889:107-119. (PubMed)
96. Choi YJ, Kim YH, Cho CH, Kim SH, Lee JE. Circulating levels of vitamin D and colorectal adenoma: A case-control study and a meta-analysis. World J Gastroenterol. 2015;21(29):8868-8877. (PubMed)
97. Gandini S, Boniol M, Haukka J, et al. Meta-analysis of observational studies of serum 25-hydroxyvitamin D levels and colorectal, breast and prostate cancer and colorectal adenoma. Int J Cancer. 2011;128(6):1414-1424. (PubMed)
98. Ma Y, Zhang P, Wang F, Yang J, Liu Z, Qin H. Association between vitamin D and risk of colorectal cancer: a systematic review of prospective studies. J Clin Oncol. 2011;29(28):3775-3782. (PubMed)
99. Touvier M, Chan DS, Lau R, et al. Meta-analyses of vitamin D intake, 25-hydroxyvitamin D status, vitamin D receptor polymorphisms, and colorectal cancer risk. Cancer Epidemiol Biomarkers Prev. 2011;20(5):1003-1016. (PubMed)
100. Ekmekcioglu C, Haluza D, Kundi M. 25-Hydroxyvitamin D status and risk for colorectal cancer and type 2 diabetes mellitus: a systematic review and meta-analysis of epidemiological studies. Int J Environ Res Public Health. 2017;14(2). (PubMed)
101. Gorham ED, Garland CF, Garland FC, et al. Optimal vitamin D status for colorectal cancer prevention: a quantitative meta analysis. Am J Prev Med. 2007;32(3):210-216. (PubMed)
102. Cauley JA, Chlebowski RT, Wactawski-Wende J, et al. Calcium plus vitamin D supplementation and health outcomes five years after active intervention ended: the Women's Health Initiative. J Womens Health (Larchmt). 2013;22(11):915-929. (PubMed)
103. Baron JA, Barry EL, Mott LA, et al. A trial of calcium and vitamin D for the prevention of colorectal adenomas. N Engl J Med. 2015;373(16):1519-1530. (PubMed)
104. Holick MF. Calcium plus vitamin D and the risk of colorectal cancer. N Engl J Med. 2006;354(21):2287-2288; author reply 2287-2288. (PubMed)
105. Barry EL, Peacock JL, Rees JR, et al. Vitamin D receptor genotype, vitamin D3 supplementation, and risk of colorectal adenomas: a randomized clinical trial. JAMA Oncol. 2017;3(5):628-635. (PubMed)
106. Hiraki LT, Joshi AD, Ng K, et al. Joint effects of colorectal cancer susceptibility loci, circulating 25-hydroxyvitamin D and risk of colorectal cancer. PLoS One. 2014;9(3):e92212. (PubMed)
107. Vidigal VM, Silva TD, de Oliveira J, Pimenta CAM, Felipe AV, Forones NM. Genetic polymorphisms of vitamin D receptor (VDR), CYP27B1 and CYP24A1 genes and the risk of colorectal cancer. Int J Biol Markers. 2017;32(2):e224-e230. (PubMed)
108. Maalmi H, Ordonez-Mena JM, Schottker B, Brenner H. Serum 25-hydroxyvitamin D levels and survival in colorectal and breast cancer patients: Systematic review and meta-analysis of prospective cohort studies. 2014;50(8):1510-1521. (PubMed)
109. Mohr SB, Garland CF, Gorham ED, Grant WB, Garland FC. Relationship between low ultraviolet B irradiance and higher breast cancer risk in 107 countries. Breast J. 2008;14(3):255-260. (PubMed)
110. John EM, Schwartz GG, Dreon DM, Koo J. Vitamin D and breast cancer risk: the NHANES I Epidemiologic follow-up study, 1971-1975 to 1992. National Health and Nutrition Examination Survey. Cancer Epidemiol Biomarkers Prev. 1999;8(5):399-406. (PubMed)
111. Kim Y, Je Y. Vitamin D intake, blood 25(OH)D levels, and breast cancer risk or mortality: a meta-analysis. Br J Cancer. 2014;110(11):2772-2784. (PubMed)
112. Wang D, Velez de-la-Paz OI, Zhai JX, Liu DW. Serum 25-hydroxyvitamin D and breast cancer risk: a meta-analysis of prospective studies. Tumour Biol. 2013;34(6):3509-3517. (PubMed)
113. Rose AA, Elser C, Ennis M, Goodwin PJ. Blood levels of vitamin D and early stage breast cancer prognosis: a systematic review and meta-analysis. Breast Cancer Res Treat. 2013;141(3):331-339. (PubMed)
114. Sperati F, Vici P, Maugeri-Sacca M, et al. Vitamin D supplementation and breast cancer prevention: a systematic review and meta-analysis of randomized clinical trials. PLoS One. 2013;8(7):e69269. (PubMed)
115. Hu K, Callen DF, Li J, Zheng H. Circulating vitamin D and overall survival in breast cancer patients: a dose-response meta-analysis of cohort studies. Integr Cancer Ther. 2017:1534735417712007. (PubMed)
116. Mohr SB, Gorham ED, Kim J, Hofflich H, Garland CF. Meta-analysis of vitamin D sufficiency for improving survival of patients with breast cancer. Anticancer Res. 2014;34(3):1163-1166. (PubMed)
117. Lu D, Jing L, Zhang S. Vitamin D receptor polymorphism and breast cancer risk: a meta-analysis. Medicine (Baltimore). 2016;95(18):e3535. (PubMed)
118. Mun MJ, Kim TH, Hwang JY, Jang WC. Vitamin D receptor gene polymorphisms and the risk for female reproductive cancers: A meta-analysis. Maturitas. 2015;81(2):256-265. (PubMed)
119. Gilbert R, Martin RM, Beynon R, et al. Associations of circulating and dietary vitamin D with prostate cancer risk: a systematic review and dose-response meta-analysis. Cancer Causes Control. 2011;22(3):319-340. (PubMed)
120. van der Rhee H, Coebergh JW, de Vries E. Is prevention of cancer by sun exposure more than just the effect of vitamin D? A systematic review of epidemiological studies. Eur J Cancer. 2013;49(6):1422-1436. (PubMed)
121. Tuohimaa P, Tenkanen L, Ahonen M, et al. Both high and low levels of blood vitamin D are associated with a higher prostate cancer risk: a longitudinal, nested case-control study in the Nordic countries. Int J Cancer. 2004;108(1):104-108. (PubMed)
122. Xu Y, Shao X, Yao Y, et al. Positive association between circulating 25-hydroxyvitamin D levels and prostate cancer risk: new findings from an updated meta-analysis. J Cancer Res Clin Oncol. 2014;140(9):1465-1477. (PubMed)
123. Grant WB, Karras SN, Bischoff-Ferrari HA, et al. Do studies reporting 'U'-shaped serum 25-hydroxyvitamin D-health outcome relationships reflect adverse effects? Dermatoendocrinol. 2016;8(1):e1187349. (PubMed)
124. Wu X, Cheng J, Yang K. Vitamin D-related gene polymorphisms, plasma 25-hydroxy-vitamin D, cigarette smoke and non-small cell lung cancer (NSCLC) Risk. Int J Mol Sci. 2016;17(10). (PubMed)
125. Zhang L, Wang S, Che X, Li X. Vitamin D and lung cancer risk: a comprehensive review and meta-analysis. Cell Physiol Biochem. 2015;36(1):299-305. (PubMed)
126. Liao Y, Huang JL, Qiu MX, Ma ZW. Impact of serum vitamin D level on risk of bladder cancer: a systemic review and meta-analysis. Tumour Biol. 2015;36(3):1567-1572. (PubMed)
127. Zhang H, Zhang H, Wen X, Zhang Y, Wei X, Liu T. Vitamin D deficiency and increased risk of bladder carcinoma: a meta-analysis. Cell Physiol Biochem. 2015;37(5):1686-1692. (PubMed)
128. Lu D, Chen J, Jin J. Vitamin D status and risk of non-Hodgkin lymphoma: a meta-analysis. Cancer Causes Control. 2014;25(11):1553-1563. (PubMed)
129. Prescott J, Bertrand KA, Poole EM, Rosner BA, Tworoger SS. Surrogates of long-term vitamin d exposure and ovarian cancer risk in two prospective cohort studies. Cancers (Basel). 2013;5(4):1577-1600. (PubMed)
130. Khayatzadeh S, Feizi A, Saneei P, Esmaillzadeh A. Vitamin D intake, serum Vitamin D levels, and risk of gastric cancer: A systematic review and meta-analysis. J Res Med Sci. 2015;20(8):790-796. (PubMed)
131. Gandini S, Raimondi S, Gnagnarella P, Dore JF, Maisonneuve P, Testori A. Vitamin D and skin cancer: a meta-analysis. Eur J Cancer. 2009;45(4):634-641. (PubMed)
132. Deluca HF, Cantorna MT. Vitamin D: its role and uses in immunology. Faseb J. 2001;15(14):2579-2585. (PubMed)
133. Agmon-Levin N, Mosca M, Petri M, Shoenfeld Y. Systemic lupus erythematosus one disease or many? Autoimmun Rev. 2012;11(8):593-595. (PubMed)
134. Goodin DS. The epidemiology of multiple sclerosis: insights to disease pathogenesis. Handb Clin Neurol. 2014;122:231-266. (PubMed)
135. Littorin B, Blom P, Scholin A, et al. Lower levels of plasma 25-hydroxyvitamin D among young adults at diagnosis of autoimmune type 1 diabetes compared with control subjects: results from the nationwide Diabetes Incidence Study in Sweden (DISS). Diabetologia. 2006;49(12):2847-2852. (PubMed)
136. Pozzilli P, Manfrini S, Crino A, et al. Low levels of 25-hydroxyvitamin D3 and 1,25-dihydroxyvitamin D3 in patients with newly diagnosed type 1 diabetes. Horm Metab Res. 2005;37(11):680-683. (PubMed)
137. Raab J, Giannopoulou EZ, Schneider S, et al. Prevalence of vitamin D deficiency in pre-type 1 diabetes and its association with disease progression. Diabetologia. 2014;57(5):902-908. (PubMed)
138. Hypponen E, Laara E, Reunanen A, Jarvelin MR, Virtanen SM. Intake of vitamin D and risk of type 1 diabetes: a birth-cohort study. Lancet. 2001;358(9292):1500-1503. (PubMed)
139. Sorensen IM, Joner G, Jenum PA, Eskild A, Torjesen PA, Stene LC. Maternal serum levels of 25-hydroxy-vitamin D during pregnancy and risk of type 1 diabetes in the offspring. Diabetes. 2012;61(1):175-178. (PubMed)
140. Brekke HK, Ludvigsson J. Vitamin D supplementation and diabetes-related autoimmunity in the ABIS study. Pediatr Diabetes. 2007;8(1):11-14. (PubMed)
141. Fronczak CM, Baron AE, Chase HP, et al. In utero dietary exposures and risk of islet autoimmunity in children. Diabetes Care. 2003;26(12):3237-3242. (PubMed)
142. Marjamaki L, Niinisto S, Kenward MG, et al. Maternal intake of vitamin D during pregnancy and risk of advanced beta cell autoimmunity and type 1 diabetes in offspring. Diabetologia. 2010;53(8):1599-1607. (PubMed)
143. Miettinen ME, Reinert L, Kinnunen L, et al. Serum 25-hydroxyvitamin D level during early pregnancy and type 1 diabetes risk in the offspring. Diabetologia. 2012;55(5):1291-1294. (PubMed)
144. Smolders J, Thewissen M, Peelen E, et al. Vitamin D status is positively correlated with regulatory T cell function in patients with multiple sclerosis. PLoS One. 2009;4(8):e6635. (PubMed)
145. Mokry LE, Ross S, Ahmad OS, et al. Vitamin D and risk of multiple sclerosis: a Mendelian randomization study. PLoS Med. 2015;12(8):e1001866. (PubMed)
146. Staples J, Ponsonby AL, Lim L. Low maternal exposure to ultraviolet radiation in pregnancy, month of birth, and risk of multiple sclerosis in offspring: longitudinal analysis. BMJ. 2010;340:c1640. (PubMed)
147. Bjornevik K, Riise T, Casetta I, et al. Sun exposure and multiple sclerosis risk in Norway and Italy: The EnvIMS study. Mult Scler. 2014; 20(8):1042-1049. (PubMed)
148. McDowell TY, Amr S, Culpepper WJ, et al. Sun exposure, vitamin D and age at disease onset in relapsing multiple sclerosis. Neuroepidemiology. 2011;36(1):39-45. (PubMed)
149. Munger KL, Levin LI, Hollis BW, Howard NS, Ascherio A. Serum 25-hydroxyvitamin D levels and risk of multiple sclerosis. JAMA. 2006;296(23):2832-2838. (PubMed)
150. Munger KL, Zhang SM, O'Reilly E, et al. Vitamin D intake and incidence of multiple sclerosis. Neurology. 2004;62(1):60-65. (PubMed)
151. Pierrot-Deseilligny C, Rivaud-Pechoux S, Clerson P, de Paz R, Souberbielle JC. Relationship between 25-OH-D serum level and relapse rate in multiple sclerosis patients before and after vitamin D supplementation. Ther Adv Neurol Disord. 2012;5(4):187-198. (PubMed)
152. Ascherio A, Munger KL, White R, et al. Vitamin d as an early predictor of multiple sclerosis activity and progression. JAMA Neurol. 2014;71(3):306-314. (PubMed)
153. Muris AH, Smolders J, Rolf L, et al. Vitamin D status does not affect disability progression of patients with multiple sclerosis over three year follow-up. PLoS One. 2016;11(6):e0156122. (PubMed)
154. Kampman MT, Steffensen LH, Mellgren SI, Jorgensen L. Effect of vitamin D3 supplementation on relapses, disease progression, and measures of function in persons with multiple sclerosis: exploratory outcomes from a double-blind randomised controlled trial. Mult Scler. 2012;18(8):1144-1151. (PubMed)
155. Soilu-Hanninen M, Aivo J, Lindstrom BM, et al. A randomised, double blind, placebo controlled trial with vitamin D3 as an add on treatment to interferon beta-1b in patients with multiple sclerosis. J Neurol Neurosurg Psychiatry. 2012;83(5):565-571. (PubMed)
156. Mrad MF, El Ayoubi NK, Esmerian MO, Kazan JM, Khoury SJ. Effect of vitamin D replacement on immunological biomarkers in patients with multiple sclerosis. Clin Immunol. 2017;181:9-15. (PubMed)
157. Muris AH, Smolders J, Rolf L, Thewissen M, Hupperts R, Damoiseaux J. Immune regulatory effects of high dose vitamin D3 supplementation in a randomized controlled trial in relapsing remitting multiple sclerosis patients receiving IFNbeta; the SOLARIUM study. J Neuroimmunol. 2016;300:47-56. (PubMed)
158. O'Connell K, Sulaimani J, Basdeo SA, et al. Effects of vitamin D3 in clinically isolated syndrome and healthy control participants: A double-blind randomised controlled trial. Mult Scler J Exp Transl Clin. 2017;3(3):2055217317727296. (PubMed)
159. Rosjo E, Steffensen LH, Jorgensen L, et al. Vitamin D supplementation and systemic inflammation in relapsing-remitting multiple sclerosis. J Neurol. 2015;262(12):2713-2721. (PubMed)
160. Sotirchos ES, Bhargava P, Eckstein C, et al. Safety and immunologic effects of high- vs low-dose cholecalciferol in multiple sclerosis. Neurology. 2016;86(4):382-390. (PubMed)
161. Bruce D, Whitcomb JP, August A, McDowell MA, Cantorna MT. Elevated non-specific immunity and normal Listeria clearance in young and old vitamin D receptor knockout mice. Int Immunol. 2009;21(2):113-122. (PubMed)
162. Zwerina K, Baum W, Axmann R, et al. Vitamin D receptor regulates TNF-mediated arthritis. Ann Rheum Dis. 2011;70(6):1122-1129. (PubMed)
163. Hitchon CA, Sun Y, Robinson DB, et al. Vitamin D receptor polymorphism rs2228570 (Fok1) is associated with rheumatoid arthritis in North American natives. J Rheumatol. 2012;39(9):1792-1797. (PubMed)
164. Lee YH, Bae SC, Choi SJ, Ji JD, Song GG. Associations between vitamin D receptor polymorphisms and susceptibility to rheumatoid arthritis and systemic lupus erythematosus: a meta-analysis. Mol Biol Rep. 2011;38(6):3643-3651. (PubMed)
165. Mosaad YM, Hammad EM, Fawzy Z, et al. Vitamin D receptor gene polymorphism as possible risk factor in rheumatoid arthritis and rheumatoid related osteoporosis. Hum Immunol. 2014;75(5):452-461. (PubMed)
166. Zanetti M, Harris SS, Dawson-Hughes B. Ability of vitamin D to reduce inflammation in adults without acute illness. Nutr Rev. 2014;72(2):95-98. (PubMed)
167. Merlino LA, Curtis J, Mikuls TR, Cerhan JR, Criswell LA, Saag KG. Vitamin D intake is inversely associated with rheumatoid arthritis: results from the Iowa Women's Health Study. Arthritis Rheum. 2004;50(1):72-77. (PubMed)
168. Costenbader KH, Feskanich D, Holmes M, Karlson EW, Benito-Garcia E. Vitamin D intake and risks of systemic lupus erythematosus and rheumatoid arthritis in women. Ann Rheum Dis. 2008;67(4):530-535. (PubMed)
169. Hiraki LT, Munger KL, Costenbader KH, Karlson EW. Dietary intake of vitamin D during adolescence and risk of adult-onset systemic lupus erythematosus and rheumatoid arthritis. Arthritis Care Res (Hoboken). 2012;64(12):1829-1836. (PubMed)
170. Sen D, Ranganathan P. Vitamin D in rheumatoid arthritis: panacea or placebo? Discov Med. 2012;14(78):311-319. (PubMed)
171. Lee YH, Bae SC. Vitamin D level in rheumatoid arthritis and its correlation with the disease activity: a meta-analysis. Clin Exp Rheumatol. 2016;34(5):827-833. (PubMed)
172. Lin J, Liu J, Davies ML, Chen W. Serum vitamin D level and rheumatoid arthritis disease activity: review and meta-analysis. PLoS One. 2016;11(1):e0146351. (PubMed)
173. Hansen KE, Bartels CM, Gangnon RE, Jones AN, Gogineni J. An evaluation of high-dose vitamin D for rheumatoid arthritis. J Clin Rheumatol. 2014;20(2):112-114. (PubMed)
174. Buondonno I, Rovera G, Sassi F, et al. Vitamin D and immunomodulation in early rheumatoid arthritis: A randomized double-blind placebo-controlled study. PLoS One. 2017;12(6):e0178463. (PubMed)
175. Dehghan A, Rahimpour S, Soleymani-Salehabadi H, Owlia MB. Role of vitamin D in flare ups of rheumatoid arthritis. Z Rheumatol. 2014;73(5):461-464. (PubMed)
176. Yang J, Liu L, Zhang Q, Li M, Wang J. Effect of vitamin D on the recurrence rate of rheumatoid arthritis. Exp Ther Med. 2015;10(5):1812-1816. (PubMed)
177. Gonzalez LA, Toloza SM, McGwin G, Jr., Alarcon GS. Ethnicity in systemic lupus erythematosus (SLE): its influence on susceptibility and outcomes. Lupus. 2013;22(12):1214-1224. (PubMed)
178. Hsieh CC, Lin BF. Dietary factors regulate cytokines in murine models of systemic lupus erythematosus. Autoimmun Rev. 2011;11(1):22-27. (PubMed)
179. Mao S, Huang S. Association between vitamin D receptor gene BsmI, FokI, ApaI and TaqI polymorphisms and the risk of systemic lupus erythematosus: a meta-analysis. Rheumatol Int. 2014;34(3):381-388. (PubMed)
180. Monticielo OA, Teixeira Tde M, Chies JA, Brenol JC, Xavier RM. Vitamin D and polymorphisms of VDR gene in patients with systemic lupus erythematosus. Clin Rheumatol. 2012;31(10):1411-1421. (PubMed)
181. Ruiz-Irastorza G, Egurbide MV, Olivares N, Martinez-Berriotxoa A, Aguirre C. Vitamin D deficiency in systemic lupus erythematosus: prevalence, predictors and clinical consequences. Rheumatology (Oxford). 2008;47(6):920-923. (PubMed)
182. Toloza SM, Cole DE, Gladman DD, Ibanez D, Urowitz MB. Vitamin D insufficiency in a large female SLE cohort. Lupus. 2010;19(1):13-19. (PubMed)
183. Amital H, Szekanecz Z, Szucs G, et al. Serum concentrations of 25-OH vitamin D in patients with systemic lupus erythematosus (SLE) are inversely related to disease activity: is it time to routinely supplement patients with SLE with vitamin D? Ann Rheum Dis. 2010;69(6):1155-1157. (PubMed)
184. Terrier B, Derian N, Schoindre Y, et al. Restoration of regulatory and effector T cell balance and B cell homeostasis in systemic lupus erythematosus patients through vitamin D supplementation. Arthritis Res Ther. 2012;14(5):R221. (PubMed)
185. Cutillas-Marco E, Marquina-Vila A, Grant W, Vilata-Corell J, Morales-Suarez-Varela M. Vitamin D and cutaneous lupus erythematosus: effect of vitamin D replacement on disease severity. Lupus. 2014;23(7):615-623. (PubMed)
186. Abou-Raya A, Abou-Raya S, Helmii M. The effect of vitamin D supplementation on inflammatory and hemostatic markers and disease activity in patients with systemic lupus erythematosus: a randomized placebo-controlled trial. J Rheumatol. 2013;40(3):265-272. (PubMed)
187. Lima GL, Paupitz J, Aikawa NE, Takayama L, Bonfa E, Pereira RM. Vitamin D supplementation in adolescents and young adults With juvenile systemic lupus erythematosus for improvement in disease activity and fatigue scores: a randomized, double-blind, placebo-controlled trial. Arthritis Care Res (Hoboken). 2016;68(1):91-98. (PubMed)
188. Andreoli L, Dall'Ara F, Piantoni S, et al. A 24-month prospective study on the efficacy and safety of two different monthly regimens of vitamin D supplementation in pre-menopausal women with systemic lupus erythematosus. Lupus. 2015;24(4-5):499-506. (PubMed)
189. Karimzadeh H, Shirzadi M, Karimifar M. The effect of Vitamin D supplementation in disease activity of systemic lupus erythematosus patients with Vitamin D deficiency: A randomized clinical trial. J Res Med Sci. 2017;22:4. (PubMed)
190. Antico A, Tampoia M, Tozzoli R, Bizzaro N. Can supplementation with vitamin D reduce the risk or modify the course of autoimmune diseases? A systematic review of the literature. Autoimmun Rev. 2012;12(2):127-136. (PubMed)
191. Wang TJ, Pencina MJ, Booth SL, et al. Vitamin D deficiency and risk of cardiovascular disease. Circulation. 2008;117(4):503-511. (PubMed)
192. van Ballegooijen AJ, Kestenbaum B, Sachs MC, et al. Association of 25-Hydroxyvitamin D and parathyroid hormone with incident hypertension: MESA (Multi-Ethnic Study of Atherosclerosis). J Am Coll Cardiol. 2014;63(12):1214-1222. (PubMed)
193. Kunutsor SK, Apekey TA, Steur M. Vitamin D and risk of future hypertension: meta-analysis of 283,537 participants. Eur J Epidemiol. 2013;28(3):205-221. (PubMed)
194. Burgaz A, Orsini N, Larsson SC, Wolk A. Blood 25-hydroxyvitamin D concentration and hypertension: a meta-analysis. J Hypertens. 2011;29(4):636-645. (PubMed)
195. Moody WE, Edwards NC, Madhani M, et al. Endothelial dysfunction and cardiovascular disease in early-stage chronic kidney disease: cause or association? Atherosclerosis. 2012;223(1):86-94. (PubMed)
196. Chitalia N, Recio-Mayoral A, Kaski JC, Banerjee D. Vitamin D deficiency and endothelial dysfunction in non-dialysis chronic kidney disease patients. Atherosclerosis. 2012;220(1):265-268. (PubMed)
197. Chitalia N, Ismail T, Tooth L, et al. Impact of vitamin d supplementation on arterial vasomotion, stiffness and endothelial biomarkers in chronic kidney disease patients. PLoS One. 2014;9(3):e91363. (PubMed)
198. Mazidi M, Karimi E, Rezaie P, Vatanparast H. The impact of vitamin D supplement intake on vascular endothelial function; a systematic review and meta-analysis of randomized controlled trials. Food Nutr Res. 2017;61(1):1273574. (PubMed)
199. Messa P, Curreri M, Regalia A, Alfieri CM. Vitamin D and the cardiovascular system: an overview of the recent literature. Am J Cardiovasc Drugs. 2014;14(1):1-14. (PubMed)
200. Brondum-Jacobsen P, Benn M, Afzal S, Nordestgaard BG. No evidence that genetically reduced 25-hydroxyvitamin D is associated with increased risk of ischaemic heart disease or myocardial infarction: a Mendelian randomization study. Int J Epidemiol. 2015;44(2):651-661. (PubMed)
201. Manousaki D, Mokry LE, Ross S, Goltzman D, Richards JB. Mendelian randomization studies do not support a role for vitamin D in coronary artery disease. Circ Cardiovasc Genet. 2016;9(4):349-356. (PubMed)
202. Ford JA, MacLennan GS, Avenell A, Bolland M, Grey A, Witham M. Cardiovascular disease and vitamin D supplementation: trial analysis, systematic review, and meta-analysis. Am J Clin Nutr. 2014;100(3):746-755. (PubMed)
203. Chin K, Appel LJ, Michos ED. Vitamin D, calcium, and cardiovascular disease: a"D"vantageous or "D"etrimental? An era of uncertainty. Curr Atheroscler Rep. 2017;19(1):5. (PubMed)
204. Pradhan AD, Manson JE. Update on the Vitamin D and OmegA-3 trial (VITAL). J Steroid Biochem Mol Biol. 2016;155(Pt B):252-256. (PubMed)
205. Neale RE, Armstrong BK, Baxter C, et al. The D-Health Trial: A randomized trial of vitamin D for prevention of mortality and cancer. Contemp Clin Trials. 2016;48:83-90. (PubMed)
206. Scragg R, Stewart AW, Waayer D, et al. Effect of monthly high-dose vitamin D supplementation on cardiovascular disease in the vitamin D assessment study: a randomized clinical trial. JAMA Cardiol. 2017;2(6):608-616. (PubMed)
207. Thomas GN, o Hartaigh B, Bosch JA, et al. Vitamin D levels predict all-cause and cardiovascular disease mortality in subjects with the metabolic syndrome: the Ludwigshafen Risk and Cardiovascular Health (LURIC) Study. Diabetes Care. 2012;35(5):1158-1164. (PubMed)
208. Chiu KC, Chu A, Go VL, Saad MF. Hypovitaminosis D is associated with insulin resistance and beta cell dysfunction. Am J Clin Nutr. 2004;79(5):820-825. (PubMed)
209. Shankar A, Sabanayagam C, Kalidindi S. Serum 25-hydroxyvitamin D levels and prediabetes among subjects free of diabetes. Diabetes Care. 2011;34(5):1114-1119. (PubMed)
210. Deleskog A, Hilding A, Brismar K, Hamsten A, Efendic S, Ostenson CG. Low serum 25-hydroxyvitamin D level predicts progression to type 2 diabetes in individuals with prediabetes but not with normal glucose tolerance. Diabetologia. 2012;55(6):1668-1678. (PubMed)
211. Khan H, Kunutsor S, Franco OH, Chowdhury R. Vitamin D, type 2 diabetes and other metabolic outcomes: a systematic review and meta-analysis of prospective studies. Proc Nutr Soc. 2013;72(1):89-97. (PubMed)
212. Lucato P, Solmi M, Maggi S, et al. Low vitamin D levels increase the risk of type 2 diabetes in older adults: A systematic review and meta-analysis. Maturitas. 2017;100:8-15. (PubMed)
213. George PS, Pearson ER, Witham MD. Effect of vitamin D supplementation on glycaemic control and insulin resistance: a systematic review and meta-analysis. Diabet Med. 2012;29(8):e142-150. (PubMed)
214. Gulseth HL, Wium C, Angel K, Eriksen EF, Birkeland KI. Effects of vitamin D supplementation on insulin sensitivity and insulin secretion in subjects with type 2 diabetes and vitamin D deficiency: a randomized controlled trial. Diabetes Care. 2017;40(7):872-878. (PubMed)
215. Lee CJ, Iyer G, Liu Y, et al. The effect of vitamin D supplementation on glucose metabolism in type 2 diabetes mellitus: A systematic review and meta-analysis of intervention studies. J Diabetes Complications. 2017;31(7):1115-1126. (PubMed)
216. Talaei A, Mohamadi M, Adgi Z. The effect of vitamin D on insulin resistance in patients with type 2 diabetes. Diabetol Metab Syndr. 2013;5(1):8. (PubMed)
217. Gezen-Ak D, Yilmazer S, Dursun E. Why vitamin d in Alzheimer's disease? The hypothesis. J Alzheimers Dis. 2014;40(2):257-269. (PubMed)
218. Landel V, Annweiler C, Millet P, Morello M, Feron F. Vitamin D, cognition and Alzheimer's disease: the therapeutic benefit is in the D-tails. J Alzheimers Dis. 2016;53(2):419-444. (PubMed)
219. Annweiler C, Schott AM, Rolland Y, Blain H, Herrmann FR, Beauchet O. Dietary intake of vitamin D and cognition in older women: a large population-based study. Neurology. 2010;75(20):1810-1816. (PubMed)
220. Annweiler C, Rolland Y, Schott AM, et al. Higher vitamin D dietary intake is associated with lower risk of Alzheimer's disease: a 7-year follow-up. J Gerontol A Biol Sci Med Sci. 2012;67(11):1205-1211. (PubMed)
221. Annweiler C, Fantino B, Schott AM, Krolak-Salmon P, Allali G, Beauchet O. Vitamin D insufficiency and mild cognitive impairment: cross-sectional association. Eur J Neurol. 2012;19(7):1023-1029. (PubMed)
222. Hooshmand B, Lokk J, Solomon A, et al. Vitamin D in relation to cognitive impairment, cerebrospinal fluid biomarkers, and brain volumes. J Gerontol A Biol Sci Med Sci. 2014;69(9):1132-1138. (PubMed)
223. Slinin Y, Paudel ML, Taylor BC, et al. 25-Hydroxyvitamin D levels and cognitive performance and decline in elderly men. Neurology. 2010;74(1):33-41. (PubMed)
224. Slinin Y, Paudel M, Taylor BC, et al. Association between serum 25(OH) vitamin D and the risk of cognitive decline in older women. J Gerontol A Biol Sci Med Sci. 2012;67(10):1092-1098. (PubMed)
225. Annweiler C, Milea D, Whitson HE, et al. Vitamin D insufficiency and cognitive impairment in Asians: a multi-ethnic population-based study and meta-analysis. J Intern Med. 2016;280(3):300-311. (PubMed)
226. Annweiler C, Llewellyn DJ, Beauchet O. Low serum vitamin D concentrations in Alzheimer's disease: a systematic review and meta-analysis. J Alzheimers Dis. 2013;33(3):659-674. (PubMed)
227. Balion C, Griffith LE, Strifler L, et al. Vitamin D, cognition, and dementia: a systematic review and meta-analysis. Neurology. 2012;79(13):1397-1405. (PubMed)
228. Lopes da Silva S, Vellas B, Elemans S, et al. Plasma nutrient status of patients with Alzheimer's disease: Systematic review and meta-analysis. Alzheimers Dement. 2014;10(4):485-502. (PubMed)
229. Shen L, Ji HF. Vitamin D deficiency is associated with increased risk of Alzheimer's disease and dementia: evidence from meta-analysis. Nutr J. 2015;14:76. (PubMed)
230. Sommer I, Griebler U, Kien C, et al. Vitamin D deficiency as a risk factor for dementia: a systematic review and meta-analysis. BMC Geriatr. 2017;17(1):16. (PubMed)
231. Olsson E, Byberg L, Karlstrom B, et al. Vitamin D is not associated with incident dementia or cognitive impairment: an 18-y follow-up study in community-living old men. Am J Clin Nutr. 2017;105(4):936-943. (PubMed)
232. Mokry LE, Ross S, Morris JA, Manousaki D, Forgetta V, Richards JB. Genetically decreased vitamin D and risk of Alzheimer disease. Neurology. 2016;87(24):2567-2574. (PubMed)
233. Annweiler C, Montero-Odasso M, Llewellyn DJ, Richard-Devantoy S, Duque G, Beauchet O. Meta-analysis of memory and executive dysfunctions in relation to vitamin D. J Alzheimers Dis. 2013;37(1):147-171. (PubMed)
234. Annweiler C, Fantino B, Gautier J, Beaudenon M, Thiery S, Beauchet O. Cognitive effects of vitamin D supplementation in older outpatients visiting a memory clinic: a pre-post study. J Am Geriatr Soc. 2012;60(4):793-795. (PubMed)
235. Stein MS, Scherer SC, Ladd KS, Harrison LC. A randomized controlled trial of high-dose vitamin D2 followed by intranasal insulin in Alzheimer's disease. J Alzheimers Dis. 2011;26(3):477-484. (PubMed)
236. Annweiler C, Karras SN, Anagnostis P, Beauchet O. Vitamin D supplements: a novel therapeutic approach for Alzheimer patients. Front Pharmacol. 2014;5:6. (PubMed)
237. Sato Y, Kikuyama M, Oizumi K. High prevalence of vitamin D deficiency and reduced bone mass in Parkinson's disease. Neurology. 1997;49(5):1273-1278. (PubMed)
238. Evatt ML, Delong MR, Khazai N, Rosen A, Triche S, Tangpricha V. Prevalence of vitamin D insufficiency in patients with Parkinson disease and Alzheimer disease. Arch Neurol. 2008;65(10):1348-1352. (PubMed)
239. Knekt P, Kilkkinen A, Rissanen H, Marniemi J, Saaksjarvi K, Heliovaara M. Serum vitamin D and the risk of Parkinson disease. Arch Neurol. 2010;67(7):808-811. (PubMed)
240. Lv Z, Qi H, Wang L, et al. Vitamin D status and Parkinson's disease: a systematic review and meta-analysis. Neurol Sci. 2014;35(11):1723-1730. (PubMed)
241. Shen L, Ji HF. Associations between vitamin D status, supplementation, outdoor work and risk of Parkinson's disease: a meta-analysis assessment. Nutrients. 2015;7(6):4817-4827. (PubMed)
242. Zhao Y, Sun Y, Ji HF, Shen L. Vitamin D levels in Alzheimer's and Parkinson's diseases: a meta-analysis. Nutrition. 2013;29(6):828-832. (PubMed)
243. Suzuki M, Yoshioka M, Hashimoto M, et al. Randomized, double-blind, placebo-controlled trial of vitamin D supplementation in Parkinson disease. Am J Clin Nutr. 2013;97(5):1004-1013. (PubMed)
244. Dobson R, Yarnall A, Noyce AJ, Giovannoni G. Bone health in chronic neurological diseases: a focus on multiple sclerosis and parkinsonian syndromes. Pract Neurol. 2013;13(2):70-79. (PubMed)
245. Torsney KM, Noyce AJ, Doherty KM, Bestwick JP, Dobson R, Lees AJ. Bone health in Parkinson's disease: a systematic review and meta-analysis. J Neurol Neurosurg Psychiatry. 2014;85(10):1159-66. (PubMed)
246. van den Bos F, Speelman AD, Samson M, Munneke M, Bloem BR, Verhaar HJ. Parkinson's disease and osteoporosis. Age Ageing. 2013;42(2):156-162. (PubMed)
247. Sato Y, Iwamoto J, Honda Y. Amelioration of osteoporosis and hypovitaminosis D by sunlight exposure in Parkinson's disease. Parkinsonism Relat Disord. 2011;17(1):22-26. (PubMed)
248. Aghajafari F, Nagulesapillai T, Ronksley PE, Tough SC, O'Beirne M, Rabi DM. Association between maternal serum 25-hydroxyvitamin D level and pregnancy and neonatal outcomes: systematic review and meta-analysis of observational studies. BMJ. 2013;346:f1169. (PubMed)
249. Perez-Lopez FR, Pasupuleti V, Mezones-Holguin E, et al. Effect of vitamin D supplementation during pregnancy on maternal and neonatal outcomes: a systematic review and meta-analysis of randomized controlled trials. Fertil Steril. 2015;103(5):1278-1288.e1274. (PubMed)
250. Alzaim M, Wood RJ. Vitamin D and gestational diabetes mellitus. Nutr Rev. 2013;71(3):158-167. (PubMed)
251. Lacroix M, Battista MC, Doyon M, et al. Lower vitamin D levels at first trimester are associated with higher risk of developing gestational diabetes mellitus. Acta Diabetol. 2014;51(4):609-616. (PubMed)
252. Parlea L, Bromberg IL, Feig DS, Vieth R, Merman E, Lipscombe LL. Association between serum 25-hydroxyvitamin D in early pregnancy and risk of gestational diabetes mellitus. Diabet Med. 2012;29(7):e25-32. (PubMed)
253. Lu M, Xu Y, Lv L, Zhang M. Association between vitamin D status and the risk of gestational diabetes mellitus: a meta-analysis. Arch Gynecol Obstet. 2016;293(5):959-966. (PubMed)
254. Poel YH, Hummel P, Lips P, Stam F, van der Ploeg T, Simsek S. Vitamin D and gestational diabetes: a systematic review and meta-analysis. Eur J Intern Med. 2012;23(5):465-469. (PubMed)
255. Wei SQ, Qi HP, Luo ZC, Fraser WD. Maternal vitamin D status and adverse pregnancy outcomes: a systematic review and meta-analysis. J Matern Fetal Neonatal Med. 2013;26(9):889-899. (PubMed)
256. Zhang MX, Pan GT, Guo JF, Li BY, Qin LQ, Zhang ZL. Vitamin D deficiency increases the risk of gestational diabetes mellitus: a meta-analysis of observational studies. Nutrients. 2015;7(10):8366-8375. (PubMed)
257. Triunfo S, Lanzone A, Lindqvist PG. Low maternal circulating levels of vitamin D as potential determinant in the development of gestational diabetes mellitus. J Endocrinol Invest. 2017;40(10):1049-1059. (PubMed)
258. Asemi Z, Hashemi T, Karamali M, Samimi M, Esmaillzadeh A. Effects of vitamin D supplementation on glucose metabolism, lipid concentrations, inflammation, and oxidative stress in gestational diabetes: a double-blind randomized controlled clinical trial. Am J Clin Nutr. 2013;98(6):1425-1432. (PubMed)
259. Jelsma JG, van Poppel MN, Galjaard S, et al. DALI: Vitamin D and lifestyle intervention for gestational diabetes mellitus (GDM) prevention: an European multicentre, randomised trial - study protocol. BMC Pregnancy Childbirth. 2013;13:142. (PubMed)
260. Simmons D, Devlieger R, van Assche A, et al. Effect of Physical Activity and/or Healthy Eating on GDM Risk: The DALI Lifestyle Study. J Clin Endocrinol Metab. 2017;102(3):903-913. (PubMed)
261. Galthen-Sorensen M, Andersen LB, Sperling L, Christesen HT. Maternal 25-hydroxyvitamin D level and fetal bone growth assessed by ultrasound: a systematic review. Ultrasound Obstet Gynecol. 2014;44(6):633-640. (PubMed)
262. Shor DB, Barzel J, Tauber E, Amital H. The effects of maternal vitamin D on neonatal growth parameters. Eur J Pediatr. 2015;174(9):1169-1174. (PubMed)
263. Cooper C, Harvey NC, Bishop NJ, et al. Maternal gestational vitamin D supplementation and offspring bone health (MAVIDOS): a multicentre, double-blind, randomised placebo-controlled trial. Lancet Diabetes Endocrinol. 2016;4(5):393-402. (PubMed)
264. Handel MN, Frederiksen P, Osmond C, Cooper C, Abrahamsen B, Heitmann BL. Prenatal exposure to vitamin D from fortified margarine and risk of fractures in late childhood: period and cohort results from 222 000 subjects in the D-tect observational study. Br J Nutr. 2017;117(6):872-881. (PubMed)
265. Rodda CP, Benson JE, Vincent AJ, Whitehead CL, Polykov A, Vollenhoven B. Maternal vitamin D supplementation during pregnancy prevents vitamin D deficiency in the newborn: an open-label randomized controlled trial. Clin Endocrinol (Oxf). 2015;83(3):363-368. (PubMed)
266. Handel MN, Frederiksen P, Cohen A, Cooper C, Heitmann BL, Abrahamsen B. Neonatal vitamin D status from archived dried blood spots and future risk of fractures in childhood: results from the D-tect study, a population-based case-cohort study. Am J Clin Nutr. 2017;106(1):155-161. (PubMed)
267. Bountouvi E, Douros K, Papadopoulou A. Can getting enough vitamin D during pregnancy reduce the risk of getting asthma in childhood? Front Pediatr. 2017;5:87. (PubMed)
268. Goldring ST, Griffiths CJ, Martineau AR, et al. Prenatal vitamin D supplementation and child respiratory health: a randomised controlled trial. PLoS One. 2013;8(6):e66627. (PubMed)
269. Chawes BL, Bonnelykke K, Stokholm J, et al. Effect of vitamin D3 supplementation during pregnancy on rsk of persistent wheeze in the offspring: a randomized clinical trial. JAMA. 2016;315(4):353-361. (PubMed)
270. Litonjua AA, Carey VJ, Laranjo N, et al. Effect of prenatal supplementation with vitamin D on asthma or eecurrent wheezing in offspring by age 3 years: the VDAART randomized clinical trial. JAMA. 2016;315(4):362-370. (PubMed)
271. Vahdaninia M, Mackenzie H, Helps S, Dean T. Prenatal intake of vitamins and allergic outcomes in the offspring: a systematic review and meta-analysis. J Allergy Clin Immunol Pract. 2017;5(3):771-778.e775. (PubMed)
272. Weisse K, Winkler S, Hirche F, et al. Maternal and newborn vitamin D status and its impact on food allergy development in the German LINA cohort study. Allergy. 2013;68(2):220-228. (PubMed)
273. Miettinen ME, Smart MC, Kinnunen L, et al. Maternal VDR variants rather than 25-hydroxyvitamin D concentration during early pregnancy are associated with type 1 diabetes in the offspring. Diabetologia. 2015;58(10):2278-2283. (PubMed)
274. Sorensen IM, Joner G, Jenum PA, et al. Vitamin D-binding protein and 25-hydroxyvitamin D during pregnancy in mothers whose children later developed type 1 diabetes. Diabetes Metab Res Rev. 2016;32(8):883-890. (PubMed)
275. Makela MJ, Puhakka T, Ruuskanen O, et al. Viruses and bacteria in the etiology of the common cold. J Clin Microbiol. 1998;36(2):539-542. (PubMed)
276. Ginde AA, Mansbach JM, Camargo CA, Jr. Association between serum 25-hydroxyvitamin D level and upper respiratory tract infection in the Third National Health and Nutrition Examination Survey. Arch Intern Med. 2009;169(4):384-390. (PubMed)
277. Murdoch DR, Slow S, Chambers ST, et al. Effect of vitamin D3 supplementation on upper respiratory tract infections in healthy adults: the VIDARIS randomized controlled trial. JAMA. 2012;308(13):1333-1339. (PubMed)
278. Rees JR, Hendricks K, Barry EL, et al. Vitamin D3 supplementation and upper respiratory tract infections in a randomized, controlled trial. Clin Infect Dis. 2013;57(10):1384-1392. (PubMed)
279. Tran B, Armstrong BK, Ebeling PR, et al. Effect of vitamin D supplementation on antibiotic use: a randomized controlled trial. Am J Clin Nutr. 2014;99(1):156-161. (PubMed)
280. Grant CC, Kaur S, Waymouth E, et al. Reduced primary care respiratory infection visits following pregnancy and infancy vitamin D supplementation: a randomised controlled trial. Acta Paediatr. 2015;104(4):396-404. (PubMed)
281. Martineau AR, Jolliffe DA, Hooper RL, et al. Vitamin D supplementation to prevent acute respiratory tract infections: systematic review and meta-analysis of individual participant data. BMJ. 2017;356:i6583. (PubMed)
282. Scragg R, Waayer D, Stewart AW, et al. The Vitamin D Assessment (ViDA) study: design of a randomized controlled trial of vitamin D supplementation for the prevention of cardiovascular disease, acute respiratory infection, falls and non-vertebral fractures. J Steroid Biochem Mol Biol. 2016;164:318-325. (PubMed)
283. Manson JE, Bassuk SS, Buring JE, Group VR. Principal results of the VITamin D and OmegA-3 TriaL (VITAL) and updated meta-analyses of relevant vitamin D trials. J Steroid Biochem Mol Biol. 2020;198:105522. (PubMed)
284. Gold DR, Litonjua AA, Carey VJ, et al. Lung VITAL: Rationale, design, and baseline characteristics of an ancillary study evaluating the effects of vitamin D and/or marine omega-3 fatty acid supplements on acute exacerbations of chronic respiratory disease, asthma control, pneumonia and lung function in adults. Contemp Clin Trials. 2016;47:185-195. (PubMed)
285. Aglipay M, Birken CS, Parkin PC, et al. Effect of high-dose vs standard-dose wintertime vitamin D supplementation on viral upper respiratory tract infections in young healthy children. JAMA. 2017;318(3):245-254. (PubMed)
286. Hueniken K, Aglipay M, Birken CS, et al. Effect of high-dose vitamin D supplementation on upper respiratory tract infection symptom severity in healthy children. Pediatr Infect Dis J. 2019;38(6):564-568. (PubMed)
287. Loeb M, Dang AD, Thiem VD, et al. Effect of Vitamin D supplementation to reduce respiratory infections in children and adolescents in Vietnam: A randomized controlled trial. Influenza Other Respir Viruses. 2019;13(2):176-183. (PubMed)
288. Kronbichler A, Kresse D, Yoon S, Lee KH, Effenberger M, Shin JI. Asymptomatic patients as a source of COVID-19 infections: A systematic review and meta-analysis. Int J Infect Dis. 2020;98:180-186. (PubMed)
289. Wiersinga WJ, Rhodes A, Cheng AC, Peacock SJ, Prescott HC. Pathophysiology, transmission, diagnosis, and treatment of coronavirus disease 2019 (COVID-19): a review. JAMA. 2020;324(8):782-793. (PubMed)
290. Ferrari D, Locatelli M. No significant association between vitamin D and COVID-19. A retrospective study from a northern Italian hospital. Int J Vitam Nutr Res. 2020:1-4. (PubMed)
291. Hastie CE, Mackay DF, Ho F, et al. Vitamin D concentrations and COVID-19 infection in UK Biobank. Diabetes Metab Syndr. 2020;14(4):561-565. (PubMed)
292. Ma H, Zhou T, Heianza Y, Qi L. Habitual use of vitamin D supplements and risk of coronavirus disease 2019 (COVID-19) infection: a prospective study in UK Biobank. Am J Clin Nutr. 2021;113(5):1275-1281. (PubMed)
293. Kaufman HW, Niles JK, Kroll MH, Bi C, Holick MF. SARS-CoV-2 positivity rates associated with circulating 25-hydroxyvitamin D levels. PLoS One. 2020;15(9):e0239252. (PubMed)
294. Merzon E, Tworowski D, Gorohovski A, et al. Low plasma 25(OH) vitamin D level is associated with increased risk of COVID-19 infection: an Israeli population-based study. FEBS J. 2020;287(17):3693-3702. (PubMed)
295. Meltzer DO, Best TJ, Zhang H, Vokes T, Arora V, Solway J. Association of vitamin D status and other clinical characteristics with COVID-19 test results. JAMA Netw Open. 2020;3(9):e2019722. (PubMed)
296. D'Avolio A, Avataneo V, Manca A, et al. 25-Hydroxyvitamin D concentrations are lower in patients with positive PCR for SARS-CoV-2. Nutrients. 2020;12(5):1359. (PubMed)
297. Ye K, Tang F, Liao X, et al. Does serum vitamin D level affect COVID-19 infection and its severity?-a case-control study. J Am Coll Nutr. 2020:1-8. (PubMed)
298. Hernandez JL, Nan D, Fernandez-Ayala M, et al. Vitamin D status in hospitalized patients with SARS-CoV-2 infection. J Clin Endocrinol Metab. 2020;106(3):e1343-e1353. (PubMed)
299. Im JH, Je YS, Baek J, Chung MH, Kwon HY, Lee JS. Nutritional status of patients with COVID-19. Int J Infect Dis. 2020;100:390-393. (PubMed)
300. Abdollahi A, Kamali Sarvestani H, Rafat Z, et al. The association between the level of serum 25(OH) vitamin D, obesity, and underlying diseases with the risk of developing COVID-19 infection: A case-control study of hospitalized patients in Tehran, Iran. J Med Virol. 2020;93(4):2359-2364. (PubMed)
301. Liu N, Sun J, Wang X, Zhang T, Zhao M, Li H. Low vitamin D status is associated with coronavirus disease 2019 outcomes: a systematic review and meta-analysis. Int J Infect Dis. 2021;104:58-64. (PubMed)
302. Panagiotou G, Tee SA, Ihsan Y, et al. Low serum 25-hydroxyvitamin D (25[OH]D) levels in patients hospitalized with COVID-19 are associated with greater disease severity. Clin Endocrinol (Oxf). 2020;93(4):508-511. (PubMed)
303. De Smet D, De Smet K, Herroelen P, Gryspeerdt S, Martens GA. Serum 25(OH)D level on hospital admission associated with COVID-19 stage and mortality. Am J Clin Pathol. 2020;155(3):381-388. (PubMed)
304. Baktash V, Hosack T, Patel N, et al. Vitamin D status and outcomes for hospitalised older patients with COVID-19. Postgrad Med J. 2020. [Epub ahead of print] (PubMed)
305. Radujkovic A, Hippchen T, Tiwari-Heckler S, Dreher S, Boxberger M, Merle U. Vitamin D deficiency and outcome of COVID-19 patients. Nutrients. 2020;12(9): 2757. (PubMed)
306. Carpagnano GE, Di Lecce V, Quaranta VN, et al. Vitamin D deficiency as a predictor of poor prognosis in patients with acute respiratory failure due to COVID-19. J Endocrinol Invest. 2020;(4):765-771. (PubMed)
307. Hastie CE, Pell JP, Sattar N. Vitamin D and COVID-19 infection and mortality in UK Biobank. Eur J Nutr. 2020;60(1):545-548. (PubMed)
308. Centers for Disease Control and Prevention. Assessing Risk Factors for Severe COVID-19 Illness. Available at: https://www.cdc.gov/coronavirus/2019-ncov/covid-data/investigations-discovery/assessing-risk-factors.html. Accessed 1/22/21.
309. Annweiler G, Corvaisier M, Gautier J, et al. Vitamin D supplementation associated to better survival in hospitalized frail elderly COVID-19 patients: the GERIA-COVID quasi-experimental study. Nutrients. 2020;12(11):3377. (PubMed)
310. Annweiler C, Hanotte B, Grandin de l'Eprevier C, Sabatier JM, Lafaie L, Celarier T. Vitamin D and survival in COVID-19 patients: A quasi-experimental study. J Steroid Biochem Mol Biol. 2020;204:105771. (PubMed)
311. Mesquita Kde C, Igreja AC, Costa IM. Atopic dermatitis and vitamin D: facts and controversies. An Bras Dermatol. 2013;88(6):945-953. (PubMed)
312. Lee SA, Hong S, Kim HJ, Lee SH, Yum HY. Correlation between serum vitamin D level and the severity of atopic dermatitis associated with food sensitization. Allergy Asthma Immunol Res. 2013;5(4):207-210. (PubMed)
313. Sudlow C, Gallacher J, Allen N, et al. UK biobank: an open access resource for identifying the causes of a wide range of complex diseases of middle and old age. PLoS Med. 2015;12(3):e1001779. (PubMed)
314. Moffatt MF, Gut IG, Demenais F, et al. A large-scale, consortium-based genomewide association study of asthma. N Engl J Med. 2010;363(13):1211-1221. (PubMed)
315. Paternoster L, Zhurov AI, Toma AM, et al. Genome-wide association study of three-dimensional facial morphology identifies a variant in PAX3 associated with nasion position. Am J Hum Genet. 2012;90(3):478-485. (PubMed)
316. Manousaki D, Paternoster L, Standl M, et al. Vitamin D levels and susceptibility to asthma, elevated immunoglobulin E levels, and atopic dermatitis: A Mendelian randomization study. PLoS Med. 2017;14(5):e1002294. (PubMed)
317. Javanbakht MH, Keshavarz SA, Djalali M, et al. Randomized controlled trial using vitamins E and D supplementation in atopic dermatitis. J Dermatolog Treat. 2011;22(3):144-150. (PubMed)
318. Amestejani M, Salehi BS, Vasigh M, et al. Vitamin D supplementation in the treatment of atopic dermatitis: a clinical trial study. J Drugs Dermatol. 2012;11(3):327-330. (PubMed)
319. Camargo CA, Jr., Ganmaa D, Sidbury R, Erdenedelger K, Radnaakhand N, Khandsuren B. Randomized trial of vitamin D supplementation for winter-related atopic dermatitis in children. J Allergy Clin Immunol. 2014;134(4):831-835.e831. (PubMed)
320. Kim G, Bae JH. Vitamin D and atopic dermatitis: A systematic review and meta-analysis. Nutrition. 2016;32(9):913-920. (PubMed)
321. Wat H, Dytoc M. Off-label uses of topical vitamin d in dermatology: a systematic review. J Cutan Med Surg. 2014;18(2):91-108. (PubMed)
322. Xue LN, Xu KQ, Zhang W, Wang Q, Wu J, Wang XY. Associations between vitamin D receptor polymorphisms and susceptibility to ulcerative colitis and Crohn's disease: a meta-analysis. Inflamm Bowel Dis. 2013;19(1):54-60. (PubMed)
323. Ananthakrishnan AN, Khalili H, Higuchi LM, et al. Higher predicted vitamin D status is associated with reduced risk of Crohn's disease. Gastroenterology. 2012;142(3):482-489. (PubMed)
324. Sadeghian M, Saneei P, Siassi F, Esmaillzadeh A. Vitamin D status in relation to Crohn's disease: meta-analysis of observational studies. Nutrition. 2016;32(5):505-514. (PubMed)
325. Jorgensen SP, Agnholt J, Glerup H, et al. Clinical trial: vitamin D3 treatment in Crohn's disease - a randomized double-blind placebo-controlled study. Aliment Pharmacol Ther. 2010;32(3):377-383. (PubMed)
326. Yang L, Weaver V, Smith JP, Bingaman S, Hartman TJ, Cantorna MT. Therapeutic effect of vitamin d supplementation in a pilot study of Crohn's patients. Clin Transl Gastroenterol. 2013;4:e33. (PubMed)
327. Raftery T, Martineau AR, Greiller CL, et al. Effects of vitamin D supplementation on intestinal permeability, cathelicidin and disease markers in Crohn's disease: Results from a randomised double-blind placebo-controlled study. United European Gastroenterol J. 2015;3(3):294-302. (PubMed)
328. Anderson JL, May HT, Horne BD, et al. Relation of vitamin D deficiency to cardiovascular risk factors, disease status, and incident events in a general healthcare population. Am J Cardiol. 2010;106(7):963-968. (PubMed)
329. Al Mheid I, Patel R, Murrow J, et al. Vitamin D status is associated with arterial stiffness and vascular dysfunction in healthy humans. J Am Coll Cardiol. 2011;58(2):186-192. (PubMed)
330. Krause R, Buhring M, Hopfenmuller W, Holick MF, Sharma AM. Ultraviolet B and blood pressure. Lancet. 1998;352(9129):709-710. (PubMed)
331. Kunutsor SK, Burgess S, Munroe PB, Khan H. Vitamin D and high blood pressure: causal association or epiphenomenon? Eur J Epidemiol. 2014;29(1):1-14. (PubMed)
332. Pilz S, Gaksch M, Kienreich K, et al. Effects of vitamin D on blood pressure and cardiovascular risk factors: a randomized controlled trial. Hypertension. 2015;65(6):1195-1201. (PubMed)
333. Arora P, Song Y, Dusek J, et al. Vitamin D therapy in individuals with prehypertension or hypertension: the DAYLIGHT trial. Circulation. 2015;131(3):254-262. (PubMed)
334. Rostand SG. Ultraviolet light may contribute to geographic and racial blood pressure differences. Hypertension. 1997;30(2 Pt 1):150-156. (PubMed)
335. Forman JP, Scott JB, Ng K, et al. Effect of vitamin D supplementation on blood pressure in blacks. Hypertension. 2013;61(4):779-785. (PubMed)
336. Witham MD, Price RJ, Struthers AD, et al. Cholecalciferol treatment to reduce blood pressure in older patients with isolated systolic hypertension: the VitDISH randomized controlled trial. JAMA Intern Med. 2013;173(18):1672-1679. (PubMed)
337. Oz F, Cizgici AY, Oflaz H, et al. Impact of vitamin D insufficiency on the epicardial coronary flow velocity and endothelial function. Coron Artery Dis. 2013;24(5):392-397. (PubMed)
338. Liu LC, Voors AA, van Veldhuisen DJ, et al. Vitamin D status and outcomes in heart failure patients. Eur J Heart Fail. 2011;13(6):619-625. (PubMed)
339. Shedeed SA. Vitamin D supplementation in infants with chronic congestive heart failure. Pediatr Cardiol. 2012;33(5):713-719. (PubMed)
340. Boxer RS, Kenny AM, Schmotzer BJ, Vest M, Fiutem JJ, Pina IL. A randomized controlled trial of high dose vitamin D3 in patients with heart failure. JACC Heart Fail. 2013;1(1):84-90. (PubMed)
341. Jiang WL, Gu HB, Zhang YF, Xia QQ, Qi J, Chen JC. Vitamin D supplementation in the treatment of chronic heart failure: a meta-analysis of randomized controlled trials. Clin Cardiol. 2016;39(1):56-61. (PubMed)
342. Zittermann A, Ernst JB, Prokop S, et al. Effect of vitamin D on all-cause mortality in heart failure (EVITA): a 3-year randomized clinical trial with 4000 IU vitamin D daily. Eur Heart J. 2017;38(29):2279-2286. (PubMed)
343. Norman AW, Henry HH. Vitamin D. In: Bowman BA, Russell RM, eds. Present Knowledge in Nutrition. 9th ed. Washington, D.C.: ILSI Press; 2006:198-210.
344. Holick MF. Vitamin D: the underappreciated D-lightful hormone that is important for skeletal and cellular health. Curr Opin Endocrinol Diabetes. 2002;9:87-98.
345. Terushkin V, Bender A, Psaty EL, Engelsen O, Wang SQ, Halpern AC. Estimated equivalency of vitamin D production from natural sun exposure versus oral vitamin D supplementation across seasons at two US latitudes. J Am Acad Dermatol. 2010;62(6):929 e921-929. (PubMed)
346. Food and Nutrition Board, Institute of Medicine. Vitamin D. Dietary Reference Intakes for Calcium, Phosphorus, Magnesium, Vitamin D, and Fluoride. Washington, D.C.: National Academies Press; 1999:250-287. (National Academy Press)
347. Ovesen L, Brot C, Jakobsen J. Food contents and biological activity of 25-hydroxyvitamin D: a vitamin D metabolite to be reckoned with? Ann Nutr Metab. 2003;47(3-4):107-113. (PubMed)
348. Jakobsen J, Christensen T. Natural vitamin D in food: to what degree does 25-hydroxyvitaminn D contribute to the vitamin D activity in food? JMBR Plus. 2020: doi: 10.1002/jbm1004.10453.
349. Tripkovic L, Lambert H, Hart K, et al. Comparison of vitamin D2 and vitamin D3 supplementation in raising serum 25-hydroxyvitamin D status: a systematic review and meta-analysis. Am J Clin Nutr. 2012;95(6):1357-1364. (PubMed)
350. Logan VF, Gray AR, Peddie MC, Harper MJ, Houghton LA. Long-term vitamin D3 supplementation is more effective than vitamin D2 in maintaining serum 25-hydroxyvitamin D status over the winter months. Br J Nutr. 2013;109(6):1082-1088. (PubMed)
351. Barger-Lux MJ, Heaney RP, Dowell S, Chen TC, Holick MF. Vitamin D and its major metabolites: serum levels after graded oral dosing in healthy men. Osteoporos Int. 1998;8(3):222-230. (PubMed)
352. Cashman KD, Seamans KM, Lucey AJ, et al. Relative effectiveness of oral 25-hydroxyvitamin D3 and vitamin D3 in raising wintertime serum 25-hydroxyvitamin D in older adults. Am J Clin Nutr. 2012;95(6):1350-1356. (PubMed)
353. Bischoff-Ferrari HA, Dawson-Hughes B, Stocklin E, et al. Oral supplementation with 25(OH)D3 versus vitamin D3: effects on 25(OH)D levels, lower extremity function, blood pressure, and markers of innate immunity. J Bone Miner Res. 2012;27(1):160-169. (PubMed)
354. Jetter A, Egli A, Dawson-Hughes B, et al. Pharmacokinetics of oral vitamin D(3) and calcifediol. Bone. 2014;59:14-19. (PubMed)
355. Navarro-Valverde C, Sosa-Henriquez M, Alhambra-Exposito MR, Quesada-Gomez JM. Vitamin D3 and calcidiol are not equipotent. J Steroid Biochem Mol Biol. 2016;164:205-208. (PubMed)
356. Shieh A, Ma C, Chun RF, et al. Effects of cholecalciferol vs calcifediol on total and free 25-hydroxyvitamin D and parathyroid hormone. J Clin Endocrinol Metab. 2017;102(4):1133-1140. (PubMed)
357. Vaes AMM, Tieland M, de Regt MF, Wittwer J, van Loon LJC, de Groot L. Dose-response effects of supplementation with calcifediol on serum 25-hydroxyvitamin D status and its metabolites: A randomized controlled trial in older adults. Clin Nutr. 2018;37(3):808-814. (PubMed)
358. Graeff-Armas LA, Bendik I, Kunz I, Schoop R, Hull S, Beck M. Supplemental 25-hydroxycholecalciferol is more effective than cholecalciferol in raising serum 25-hydroxyvitamin D concentrations in older adults. J Nutr. 2020;150(1):73-81. (PubMed)
359. Quesada-Gomez JM, Bouillon R. Is calcifediol better than cholecalciferol for vitamin D supplementation? Osteoporos Int. 2018;29(8):1697-1711. (PubMed)
360. Holick MF. Vitamin D deficiency. N Engl J Med. 2007;357(3):266-281. (PubMed)
361. Vieth R. Vitamin D supplementation, 25-hydroxyvitamin D concentrations, and safety. Am J Clin Nutr. 1999;69(5):842-856. (PubMed)
362. Heaney RP, Davies KM, Chen TC, Holick MF, Barger-Lux MJ. Human serum 25-hydroxycholecalciferol response to extended oral dosing with cholecalciferol. Am J Clin Nutr. 2003;77(1):204-210. (PubMed)
363. Vieth R, Chan PC, MacFarlane GD. Efficacy and safety of vitamin D3 intake exceeding the lowest observed adverse effect level. Am J Clin Nutr. 2001;73(2):288-294. (PubMed)
364. Knodel LC, Talbert RL. Adverse effects of hypolipidaemic drugs. Med Toxicol. 1987;2(1):10-32. (PubMed)
365. McDuffie JR, Calis KA, Booth SL, Uwaifo GI, Yanovski JA. Effects of orlistat on fat-soluble vitamins in obese adolescents. Pharmacotherapy. 2002;22(7):814-822. (PubMed)
366. Natural Medicines. Vitamin D. Professional handout/Drug interactions. Available at: https://naturalmedicines.therapeuticresearch.com. Accessed 6/11/17.
367. Panday K, Gona A, Humphrey MB. Medication-induced osteoporosis: screening and treatment strategies. Ther Adv Musculoskelet Dis. 2014;6(5):185-202. (PubMed)
368. Glass AR, Eil C. Ketoconazole-induced reduction in serum 1,25-dihydroxyvitamin D. J Clin Endocrinol Metab. 1986;63(3):766-769. (PubMed)
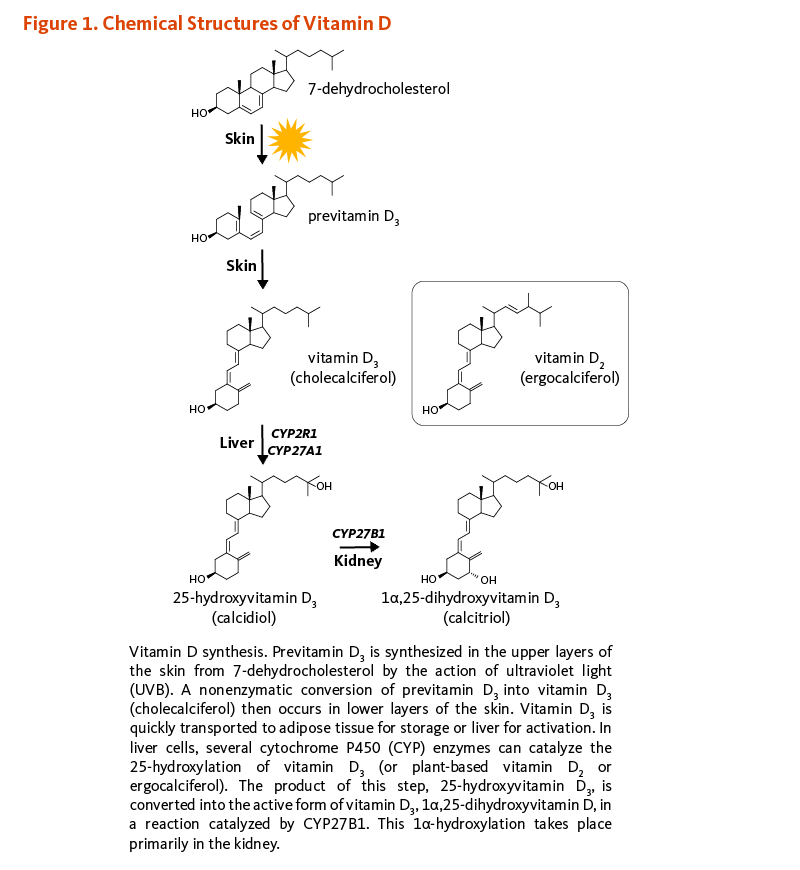
![Figure 2. Conversion to the Active Form of Vitamin D and VDR-mediated Gene Regulation. Mechanism of action. 25-hydroxyvitamin D (25(OH)D) is the main form of vitamin D in the circulation. Most 25(OH)D and 1α,25-dihydroxyvitamin D (1,25(OH)2D) molecules are transported bound to the vitamin D-binding protein and they enter cells via the megalin/tubulin complex. In kidney cells, 1α-hydroxylase (CYP27B1) catalyzes the conversion of 25(OH)D into 1,25(OH)2D. Parathyroid hormone (PTH), estradiol, and low phosphorus concentration ([P]) stimulate this reaction, whereas 1,25(OH)2D, fibroblast growth factor-23 (FGF-23), and high calcium concentration ([Ca]) inhibit it. 1,25(OH)2D enters the circulation and is transported to extra-renal target tissues where it can regulate gene expression. In the nucleus of target cells, 1,25(OH)2D binds to the vitamin D receptor (VDR), which heterodimerizes with the retinoid X receptor (RXR). VDR-RXR binds to vitamin D response elements (VDRE) in the promoter of vitamin D target genes. 25(OH)D, 25-hydroxyvitamin D; 1,25(OH)2D, 1α,25-dihydroxyvitamin D; [Ca], calcium concentration; CYP2R1, 1α-hydroxylase; DBP, vitamin D-binding protein; FGF-23, fibroblast growth factor-23; PTH, parathyroid hormone; [P], phosphorus concentration; RNA Pol II, RNA polymerase II; RXR, retinoid X receptor; VDR, vitamin D nuclear receptor; VDRE, vitamin D response element.](/sites/lpi.oregonstate.edu/files/vitamin-d-figure-2-800px.png)
![Figure 3. Regulation of Calcium and Phosphorus Homeostasis. Calcium and phosphorus homeostasis. A slight drop in blood calcium concentration ([Ca2+]) results in the secretion of parathyroid hormone (PTH) by the parathyroid glands. PTH simulates the activity of CYP27B1 (25-hydroxyvitamin D-1α-hydroxylase enzyme) that catalyzes the hydroxylation of 25-hydroxyvitamin D into 1α,25-dihydroxyvitamin D. This active form of vitamin D (i) increases the reabsorption of calcium filtered by the kidneys and stimulates phosphorus excretion, (ii) increases the intestinal absorption of both calcium and phosphorus, and (iii) mobilizes calcium (and phosphorus) from bone when dietary calcium intake is insufficient. PTH also stimulates bone resorption that releases calcium and phosphorus. 1α,25-dihydroxyvitamin D inhibits its own production, as well as PTH synthesis, via negative feedback loops. FGF-23 is secreted by bone-forming cells (osteoblasts) in response to an increase in phosphorus intake. FGF-23 inhibits the synthesis of 1α,25-dihydroxyvitamin D and promotes phosphorus excretion in the urine. [Ca2+], calcium concentration; FGF-23, fibroblast growth factor-23; PTH, parathyroid hormone.](/sites/lpi.oregonstate.edu/files/vitamin-d-figure-3-800px.png)





