English
概要
-
ω-3脂肪酸のα-リノレン酸(ALA),及びω-6脂肪酸のリノール酸(LA)は,人の体内で合成できないため,必須脂肪酸とみなされる。(詳細はこちら)
-
長鎖ω-6脂肪酸であるアラキドン酸(AA)は,LAから合成可能である。長鎖ω-3脂肪酸のエイコサペンタエン酸(EPA)とドコサヘキサエン酸(DHA)は,ALAから合成できるが,EPAとDHAの合成は,条件によっては不十分な可能性がある。(詳細はこちら)
-
典型的な洋食は,ω-3脂肪酸よりω-6脂肪酸のほうがかなり多い傾向がある。(詳細はこちら)
-
DHAは視覚及び神経系の発達にとって重要と考えられるが,DHAやAAが多く含まれる乳児用調製乳の授乳が,早産児または正常産児における視力発達や神経系発達に効果があるかどうか,なお不明である。(詳細はこちら)
-
多くの科学研究からは,ω-3脂肪酸を食事から多く摂取することが,心血管系疾患リスクの低減と相関があることが示唆されている。そこで,米国心臓病協会は,全ての成人は,魚,特に油脂の多い魚を少なくとも週2回食べるよう推奨している。(詳細はこちら)
-
無作為対照試験の結果から,ω-3脂肪酸の摂取量を多くすると,心筋梗塞(心臓マヒ)や冠動脈心疾患(CHD)の人々の心臓突然死を減少させることが示唆されている。(詳細はこちら)
-
DHAが低い状態は,アルツハイマー病などの認知症に対するリスク因子であるが,DHA補給がそのような認知障害の予防や治療に有用であるかどうか今のところ不明である。(詳細はこちら)
-
EPAやDHAの摂取量を増やすことが,2型糖尿病,特に血清中トリグリセライドが高い人々に有効である可能性がある。(詳細はこちら)
-
無作為対照試験から,リウマチ性関節炎患者において,魚油の補給が,関節圧痛を緩和し抗炎症性薬の必要量を減少させることが認められている。(詳細はこちら)
-
限られた予備試験から,ω-3脂肪酸補給が,うつ病,双極性障害(躁鬱病)及び統合失調症(精神分裂症)の治療に有効であることが示唆されているが,治療効果確認のため,より多くの管理された臨床試験が必要とされている。(詳細はこちら)
緒言
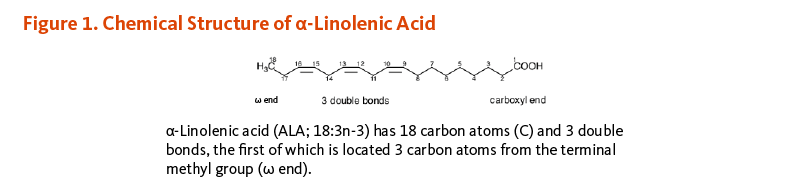
ω-3及びω-6脂肪酸は,多価不飽和脂肪酸(PUFA)であり,cis-二重結合を2つ以上含む (1)。全てのω-3脂肪酸において,最初の二重結合は,脂肪酸のメチル基末端から数えて3番目と4番目の炭素原子の間(n-3)に位置する。同様に,全てのω-6脂肪酸における最初の二重結合は,脂肪酸のメチル基末端から6番目と7番目の炭素原子の間(n-6)に位置する。脂肪酸の科学的略号は,それらの化学構造に関しいくつかの命名法がある。α-リノレン酸(ALA)の略記の一つは,18:3n-3である。最初の部分(18:3)はALAが二重結合を3個持つ炭素数18の脂肪酸であることを意味し,二番目の部分(n-3)が最初の二重結合がn-3位に位置することを示し,これがω-3脂肪酸として定義される (Figure 1) 。
人などの哺乳動物は,炭水化物やタンパク質の炭素から飽和脂肪酸と一価不飽和脂肪酸を合成できるが,脂肪酸のn-6位やn-3位にcis-二重結合を付加するために必要な酵素を持たない (1)。そのため,ω-6脂肪酸及びω-3脂肪酸は必須栄養成分である。元となるω-6脂肪酸群はリノール酸(LA;18:2n-6)であり,ω-6脂肪酸の起源はALAである(Figure 1)。人は,ジホモ-γ-リノレン酸(DGLA;20:3n-6)やアラキドン酸(AA: 20:4n-6)などの長鎖(炭素数20以上)のω-6脂肪酸をLAから合成でき,ALAからエイコサペンタエン酸(EPA; 20:5n-3)やドコサヘキサエン酸(DHA; 22:6n-3)などの長鎖ω-3脂肪酸を合成できる(下記「代謝及び生体利用能」参照)。以前は人の食事中のω-6脂肪酸とω-3脂肪酸の比率は1:1と推定されていたが (2),現在の典型的な洋食における比率は,LAの多い植物油が増加し魚の摂取が減少しているため,ほぼ10:1である (3)。多くの科学研究からは,食事からのω-3脂肪酸の相対的比率を増加させると,多くの健康利益が得られることが示唆されている。
代謝及び生体利用能
小腸に吸収される前に,脂肪酸は,膵臓の酵素によって摂取した脂肪(トリグリセリド,リン脂質及びコレステロール)から加水分解される必要がある (4)。胆汁酸塩も,脂肪酸や他の脂肪消化産物を混合ミセルとするために小腸中に存在しなければならない。混合ミセルからの脂肪吸収は,小腸通過中に起こり,正常な状態で85~95%の吸収効率である。人は,一連の不飽和化反応(二重結合の付加)及び炭素鎖延長(炭素原子の付加)反応により,それぞれ必須脂肪酸のLAとALAから長鎖のω-6及びω-3脂肪酸を合成可能である(Figure 2)(5)。LA及びALAは,AAやEPAなどの長鎖多価不飽和脂肪酸の合成において,同一の延伸酵素と脱飽和酵素を競合して使用する。ALAは,δ-6 脱飽和酵素に親和性がある基質であるが,LAの摂取がALAより多くなると,AA(20:4n-6)の総生成量がEPA(20:5n-3)より多くなる (6)。ALAからDHAへの変換能は,男性より女性のほうが高い。健常な若い男性におけるALA代謝の研究からは,摂取したALAの約8%がEPAに変換され,0~4%がDHAに変換される (7)。健常な若い女性において,摂取したALAの約21%がEPAに変換され,9%がDHAへ変換される (8)。男性に比べ若い女性の変換効率が良いことは,エストロゲンの影響によると考えられる (6,9)。ALAは,人が合成できないことから,必須ω-3脂肪酸とみなされるが,人によるEPAや特にDHAの変換が比較的効率が悪いということは,EPAとDHAもまた,ある種の状況下では必須となる可能性を示唆している (10,11)。

生物学的活性
細胞膜の構造及び機能
ω-6 PUFA及びω-3 PUFAは,細胞膜の重要な構成成分である。リン脂質に取り込まれると,それらは,細胞膜の流動性,弾力性,浸透性及び膜結合酵素の活性などの細胞膜特性に影響を及ぼす (12)。DHAは,選択的に網膜細胞膜とシナプス後神経細胞膜に取り込まれ,視覚機能及び神経系機能に重要な役割を果たすことが示唆されている。
視覚
DHAは,網膜の細胞膜に極めて高濃度認められる。網膜は,ω-3脂肪酸摂取量が低いときでも,DHAを保存し循環させる (13)。動物実験から,DHAが,網膜の正常な発達と機能に必要であることが示唆されている。さらに,これらの研究からは,DHAの不足が網膜機能に永続性の異常を起こす網膜発達時期に,決定的期間があることが示唆されている。最近の研究から,網膜に当たる光を脳で視覚イメージに変換する視覚伝達系に重要な役割を持つ視覚色素ロドプシン(光受容タンパク質)の再生に,DHAが重要な役割を持つことが示されている (14)。
神経系
脳灰白質のリン脂質は高い割合でDHAやAAを含有し,それらが中枢神経系の機能に重要であることが示唆されている (15)。動物実験において,脳内DHA枯渇が学習機能を欠損させることが認められているため,脳のDHA含有量は特に重要である。DHAが脳機能にどのように影響を与えるかはわかっていないが,神経細胞膜のDHA含量変化が,神経伝達物質の利用能だけでなく,イオンチャンネルや膜関連受容体の機能を変化させる可能性がある (16)。
エイコサノイド(イコサノイド)合成
炭素数20のPUFA由来エイコサノイド類は,免疫反応や炎症反応に決定的役割を果たす潜在的な化学伝達物質である。炎症反応中に,細胞膜中のDGLA,AA及びEPAが,シクロオキシゲナーゼやリポキシゲナーゼと呼ばれる酵素によって代謝され,それぞれ,プロスタグランジン類やロイコトリエン類を生成する(Figure 2)。典型的な洋食を摂取する人々において,細胞膜中のAA量は,EPA量よりかなり多く,EPAよりAAに由来するエイコサノイドの生成が多く起きる。しかしながら,ω-3脂肪酸の摂取量を増やすことは細胞膜のEPA量を増加させ,その結果,EPAに由来するエイコサノイドの割合を高めることになる。AA由来エイコサノイドに対する生理反応は,EPA由来エイコサノイドとの反応とは異なる。一般に,EPA由来エイコサノイドは,炎症,血管収縮及び血液凝固の誘発能が,AA由来エイコサノイドより低い (3,17)。
遺伝子発現の制御
培養細胞と動物試験の結果から,ω-6及びω-3脂肪酸は,脂肪酸代謝や炎症に関与する遺伝子を含む多くの遺伝子発現を調節することが示唆されている (17,18)。そのメカニズムはさらに解明する必要があるが,ω-6脂肪酸及びω-3脂肪酸は,ペルオキソーム増殖因子活性化レセプター(PPARs)及び肝臓Xレセプター(LXRs)など,特異的な転写因子と相互作用することによって,遺伝子発現を制御するのかもしれない (19)。これらの制御経路には,複数のメカニズムが関与している (20)。多くの場合,PUFAは,遺伝子発現をコントロールする疎水性ホルモン類(例えば,ステロイドホルモン類)のように働く。この場合,PUFAはPPARsのような受容体に直接結合する。これらの受容体は,遺伝子のプロモーターと結合し,遺伝子の転写を増減させる機能を持つ。他には,PUFAは,細胞核内の転写因子の数量を制御する (20)。これらの因子に関して,PUFAの制御メカニズムはあまりわかっていない。2つの例はNFκBとSREBP-1である。NFκBは,炎症に関係する複数の遺伝子発現制御に関与する転写因子である。例えば,ω-3 PUFAは,炎症誘発性のエイコサノイドやサイトカインの産生を阻害するNFκBの核内含量を低減させる。SREBP-1は,新規の脂質生成とPUFA合成の両方の脂肪酸合成を制御する主要な転写因子である (21)。食事からのPUFAはSREBP-1活性を抑制し,脂肪酸合成やPUFA合成に関与する酵素の発現を低下させる (22,23)。このように,食事からのPUFAは,全ての脂肪酸合成のフィードバック阻害剤として機能する。
欠乏症
必須脂肪酸の欠乏症
必須脂肪酸欠乏症の臨床症状は,乾燥した鱗状発疹,乳幼児の発育遅延,感染症に対する感受性増加及び傷の治癒が遅いなどがある (24)。ω-3,ω-6及びω-9脂肪酸は同一の脱飽和酵素を競合する。脱飽和酵素は,ω-3 >ω-6 >ω-9の順で脂肪酸類に選択性を示す。このため,ω-9脂肪酸であるエイコサトリエン酸(20:3n-9,ミード酸,5,8,11-エイコサトリエン酸)は,ω-3脂肪酸とω-6脂肪酸の食事摂取量が極めて少ない場合にのみ増加する。したがって,ミード酸は必須脂肪酸欠乏症のマーカーの一つとなる (25)。血漿中のエイコサトリエン酸:アラキドン酸(トリエン:テトラエン)の比が0.2以上の場合,一般的に必須脂肪酸欠乏症の症状とみなされる (24,26)。脂肪を含まないグルコースとアミノ酸混合物を完全非経口栄養法で投与された患者において,必須脂肪酸欠乏症の生化学的徴候が7~10日ほどの短期間で発生した (27)。これらの場合,持続性のグルコース点滴が,高いインスリン循環レベルを起こし,脂肪組織に蓄積された必須脂肪酸の遊離を阻害していた。グルコースフリーのアミノ酸溶液を用いた場合,最大14日までの非経口栄養は,必須脂肪酸欠乏症の生化学的徴候を起こさなかった。必須脂肪酸の欠乏は,慢性の脂肪吸収不良患者 (28)及び嚢胞性線維症患者 (29)でも起こることが認められている。近年では,必須脂肪酸欠乏がタンパク質-エネルギー栄養失調の病理学で一役担うかもしれないといわれている (25)。
ω-3脂肪酸欠乏症
ω-3脂肪酸の欠乏症例は少なくとも一例報告されている。極微量のALAを含む脂質エマルジョンを静脈注射された少女が,視覚障害と感覚神経障害を発症した。これらの症状は,より多いALAを含むエマルジョンを投与したときに解消した (30)。ω-3脂肪酸摂取量が不足すると,血漿中のDHA濃度が低下するが,カットオフ値は決まっていない。ω-3脂肪酸の欠乏単独では,血漿中のトリエン:テトラエン比の増加は起こさない (1)。しかしながら,げっ歯類の試験において,n-3 PUFA欠乏が学習と記憶機能に関して重要な障害を示した (31,32)。これらの研究が,認知機能発達と認知機能低下に及ぼすω-3 PUFAの影響を評価するための人における臨床試験についての必要性を提起した(www.clinicaltrials.gov)。
疾病の予防
視覚発達と神経発達
妊娠の最終三半期は,脳及び網膜におけるDHA蓄積に重要な期間であるため,早産児は,視覚発達と神経発達において,DHA欠乏による悪影響を特に受けやすいと考えられる (33)。母乳はALAやEPAの他にDHAを含むが,最近まで,ALAが通常の乳児用調製乳中に存在する唯一のω-3脂肪酸であった。早産児はALA からDHAを合成できるが,概して,更なる食事からの摂取なしに,血漿中及び細胞内のDHA濃度の低下を防止するための十分な量を合成できない。そこで,早産児用調製乳が,調製乳授乳児の血漿中及び細胞中のDHAレベルを母乳授乳児のレベルまで引き上げるために,十分な量のDHAで補われることが提案された (34)。DHAを強化された調製乳は,早産や正常産児において,血漿中及び赤血球中のDHA濃度を上昇させるが,DHA添加の有無による調製乳で授乳された乳児において,視力及び神経の発達の尺度を検定した無作為対照試験の結果は,様々である (35-38)。いくつかの対照試験では,DHAを添加された調製乳を授乳された健常な早産乳児が,DHAを添加しない調製乳を授乳された乳児より,2~4月齢において,微妙ではあるが有意な視力の改善が認められた (39)が,大部分の無作為対照試験では,DHAの添加有無による調製乳を授乳された健常な早産児間で視力に差が認められなかった (36)。同様に,12ヵ月と24ヵ月齢での乳児発育の一般的尺度を評価した2つの無作為対照試験で,DHA添加の有無により調製乳授乳早産児で差は認められなかった (40,41)。一方,最近の2例の無作為対照試験で,18ヵ月齢乳児の発育が評価され,早産児におけるDHA補給の有効性が報告されたが,このうち一方の試験では有意な効果が認められたのは男児のみであった (42,43)。DHAを強化された乳児用調製乳は,通常乳児用にも市販されているが,正常産児におけるこれら調製乳の視力や発育についての結果は,やはり様々である (37,44-47,38,48)。DHAは,視力発達と神経発達にとって重要と考えられるが,DHAを強化された乳児用調製乳が,早産または通常産の乳児において視力発達や神経発達の効果があるかどうか依然不明である (49)。
妊娠期及び授乳期
乳児のDHA必要量は大きな研究課題であるが,母親が胎児と母乳授乳児とって唯一のω-脂肪酸供給源であると言う事実にも拘わらず,母胎のω-3脂肪酸必要量の調査は比較的少ない (50)。妊娠時の無作為対照試験の結果からは,ω-3脂肪酸補給は,妊娠糖尿病,妊娠が誘発する高血圧や子癇前症の発生率を減少させないことが示唆されている (51-53) が,妊娠期間のわずかな延長が特にω-3脂肪酸摂取量が少ない女性で起こる可能性がある。健常なデンマーク女性において,EPA+DHA 2.7 g/日を魚油として補給したとき,平均で4日まで妊娠期間が長くなった (52)。さらにその後,米国の低収入層において,妊娠最終三半期の間にDHA強化卵からのわずか0.13 g/日の摂取により,平均6日まで妊娠期間が延長された (53)。低リスク妊娠女性における6例の無作為対照試験のメタアナリシスから,妊娠時のω-3 PUFA補給が,1.6日までの妊娠期延長をもたらすことが認められた (54)。ヨーロッパの高リスク妊娠女性において,妊娠最後3半期でのEPA+DHA 2.7 g/日の魚油で補給したとき,早産リスクが33%から21%へ減少した (55)。しかしながら,高リスク妊娠女性における無作為対照試験のメタアナリシスでは,長鎖PUFAによる補給が,妊娠期間や早産の発生率に影響はないが,初期の早産(妊娠34週間以下)の発生率を低減することが認められた (56)。世界周産期学会,早期栄養アカデミー(Early Nutrition Academy)及び子供健康基金(Child Health Foundation)は,妊娠時及び授乳期の女性が,一日少なくとも平均200 mgのDHAを摂取すること(週1~2回の魚料理)を推奨した (57)。
妊娠期または授乳期の長鎖PUFA補給が産児の神経系発達に及ぼす影響は,活発に研究されている分野である。ノルウェーにおいて,妊娠時及び授乳の最初の3ヵ月にタラ肝油(EPA+DHAを2 g/日)を補給された母親から生まれた子供が,母親がタラ肝油を補給されなかった子供と比較して,4歳時における感情処理テスト(mental processing test)で高スコアを記録した (58)。しかしながら,子供が4歳のとき試験を実施できたのは,参加者の14%だけであった。二重盲検無作為対照試験において,妊娠時(出産までの20週間)に魚油(DHA 2.2 gとEPA 1.1 g)を補給された母親から生まれた子供が,オリーブ油を補給された母親の子供と比較して,2.5歳において,目と手の共同作業で高いスコアを示した (59)。DHAを含むシリアルバー(DHA 300 mg/バー,平均5バー/週)またはプラセボシリアルバーを29人の妊娠女性(妊娠24週から出産まで)に摂取してもらった小規模試験において,母胎のDHA補給が生後9ヵ月の乳児の問題解決スキルと相関を示した (60)。2つの乳児群で,認知記憶作業に有意差はなかった。授乳期間中だけにω-3脂肪酸を母親に与えた子供における認知機能を評価した無作為対照試験の結果は,様々であった (38)。いくつかの結果は有望ではあるが,妊娠期または授乳期における長鎖PUFA補給が,子供における長期の知覚発達に有効かどうか判断するために,さらに多くの研究が必要である。現在のところ,妊娠時及び授乳期に適度の魚を摂取(例えば,週1~2食)することによって,長鎖ω-3脂肪酸を摂取することと関係する潜在的利益は,共存する汚染物質の曝露リスクを上回っているが,高レベルのメチル水銀を含む魚は避ける必要がある (61)。魚の汚染に関する情報と出産年齢の女性による魚の摂取のためのガイドラインについては,下記「魚の汚染」を参照のこと。
心血管系疾患
ω-6脂肪酸:リノール酸
LAは,食事中に最も多く含まれるPUFAである。PUFA摂取量と冠動脈心疾患(CHD)との間の相関関係を調査した前向きコホート研究の結果は,いくぶん不一致が見られる (62)。すべてではないがいくつかの前向きコホート研究からは,PUFAとLAの高摂取が,CHDリスク (63-65) や心血管に関連する死亡率 (66) の有意な低減と相関がみられている。食事からの脂肪摂取量がCHDリスクに及ぼす影響を試験した最大の前向きコホート研究は,78,000人女性を20年間追跡したNurses’ Health Studyである。このコホートにおいて,総PUFA摂取量(エネルギーの7.4%)とLA摂取量が最も高い群が,総PUFA(エネルギーの5%)とLAの摂取量が最も低い群よりCHDリスクが25%低かった (64)。飽和脂肪酸(SFA)摂取量はCHDリスクと相関がなかったが,PUFA:SFA摂取量の比は,CHDリスクと逆相関が認められた。管理された飼養試験において,飼料中のSFAをPUFAに置き換えることで,血清中の総コレステロール濃度とLDLコレステロール濃度がかなり低下した (67)。実際,LAは,食事中のSFAと置換したとき,血清中の総コレステロールとLDLコレステロールの濃度を最も下げる能力のある脂肪酸である (68)。いくつかの食事介入試験によって,CHDによる疾病率(病気)と死亡率に関して,SFAの多い食事(エネルギーの18~19%)とSFAが低く(エネルギーの8~9%)PUFAが高い(エネルギーの14~21%)食事について比較された (62)。PUFA増加のほとんどはLAにより供給されたが,これらの試験ではALA摂取量も増加させた (67)。いくつかの男性での食事介入試験では,食事中のSFAをPUFAに置き換えることで,CHDによる疾病発症率や死亡率を減少させることが認められた (69-72)。一方で,女性における2例の同様な食事介入試験では,CHDによる疾病率や死亡率の有意な低減はみられなかった (73,75)。米国心臓病協会は,最近の科学助言において,ω-6 PUFAsから得られる総カロリーの5~10%が,CHDリスク低減と相関があると結論している (75)。
ω-3脂肪酸;α-リノレン酸(ALA)
いくつかの前向きコホート研究で,食事からのALA摂取量とCHDリスクとの間の相関が試験された。米国男性45,000人以上を14年間追跡したコホート研究において,食事ALA摂取量の1 g/日の増加が,CHDリスクの16%低減と相関がみられた (76)。また,ほとんど水産食品を食べない人において,食事中ALA摂取量の1 g/日増加が,CHDリスクの47%減少と相関していた。米国人女性76,000人以上を10年間追跡したコホート研究において,ALA摂取量が最大(1.4 g/日程度)の人は,最小摂取量(0.7 g/日程度)の女性より,致命的なCHDリスクが45%低かった (77)。興味深いことに,油と酢のサラダドレッシングが,この集団において大きな食事ALAの摂取源であった。油と酢のサラダドレッシングを週5~6回摂取する女性は,野菜摂取量で補正した後でも,あまりドレッシングを摂取しない人より致命的なCHDリスクが54%低かった。米国人男性6,000人以上の小規模コホート研究において,ALAの最大摂取者が,次の10年間で,最小摂取群よりCHDによる死亡リスクが40%低かった (78)。逆に,ヨーロッパにおける2例の研究では,食事からのALA摂取量とCHDリスクとの間に相関は認められなかった (79,80)。付け加えると,Nurses’ Health Study(76,763人の女性を18年間追跡)において,食事からのALA摂取量は,致命的なCHDや死に至らない心筋梗塞と相関がみられなかったが,心臓突然死とは逆相関が認められた(下記参照)(81)。水産食品からの長鎖ω-3脂肪酸の高い摂取量を支持する科学的証拠は必ずしも一致していないが,多くの前向き研究からは,比較的高いALA摂取量(2~3 g/日)が,特に魚摂取量が低い集団において,CHDリスクの有意な低減と相関することが認められている (82)。LAと異なり,高いALA摂取による心臓保護効果は,血清中の脂質プロファイル変化と関連するとは考えられていない。14例の無作為対照試験のメタアナリシスから,ALA補給が,総コレステロール,LDLコレステロール,トリグリセライドのレベルの影響がなかったと結論された (83)。一方,いくつかの管理された臨床試験からは,ALA摂取量の増加が,心筋梗塞(MI)や脳卒中などの心血管系症例のリスクに強く関係している炎症マーカーである,C-反応性タンパク質(CRP)の血清中濃度を減少させることが認められている (84-86)。
長鎖ω-3脂肪酸:エイコサペンタエン酸及びドコサヘキサエン酸
長鎖ω-3脂肪酸(EPAとDHA)が,1) 突然心臓死を起こす可能性がある不整脈を予防する,2) 心筋梗塞(MI)や脳卒中を起こす可能性がある血栓症(凝血塊)リスクを低下させる,3) 血清中のトリグリセライドレベルを低下させる,4) 動脈硬化性プラークの成長を遅らせる,5) 血管内皮機能を改善する,6) 血圧を少し下げる,及び7) 炎症を低減させる,ことによって,心血管系疾患リスクを低下できるという科学的証拠が蓄積されつつある (87)。無作為対照試験の最近の系統的レビューから,魚や魚油サプリメントからのEPAやDHA摂取が,全ての死亡原因,心臓死,突然死を低減させることと相関があることが認められた (88)。しかしながら,別の無作為対照試験と前向きコホート研究の系統的レビューとメタアナリシスからは,長鎖ω-3脂肪酸は,死亡率全体や心血管系症例のリスクを有意に低減しないと結論された (89)。
冠動脈心疾患(Coronary Heart Disease):いくつかの前向きコホート研究からは,少なくとも週一回魚を食べる男性が,魚を食べない人よりCHDによる死亡率が低いことが認められている (90-92)。そのような研究の一例で,1,822人男性を30年間追跡され,CHDによる死亡率が,少なくとも一日あたり平均35 g(1オンス)の魚を摂取する男性において,魚を食べない人より38%低く,一方でMIによる死亡率は67%低いことが認められた (93)。魚の摂取による心臓予防効果は,典型的な洋食を摂取する人に限定されるものではないかもしれない。18,000人以上の男性を10年間追跡した中国の研究において,魚介類を毎週200 g(7オンス)以上摂取する人は,週50 g(2オンス)以下の摂取の人より,致命的なMIリスクが59%低いことが認められた (94)。女性における高いω-3脂肪酸と魚の摂取の影響に関して利用できる情報はあまりない。84,000人以上の女性を16年間追跡したNurses’ Health Studyにおいて,少なくとも週一回魚を食べる女性は,魚を月一回以下しか食べない女性より,CHDによる死亡率が29~34%低かった (95)。2,445人のフィンランド女性による前向き研究において,魚摂取量の最大五分位の人(41 g/日以上;平均70 g/日)は,最小五分位の人(8 g/日以下;平均4.2 g/日)と比較し41%低いCHDリスクであった (96)。
41,748人の日本人男女を対象とした大規模な前向き研究において,魚の高い摂取量がCHDリスクの更なる低減との関係が認められた。この研究において,魚を週8回摂取する人が,一回しか摂取しない人と比べて,非致死的な冠動脈症例リスクが57%低く,MIリスクが56%低かった (97)。一方,8,879人の日本人男女のやや小規模な前向き研究では,1日2回の魚摂取が,週1~2回の魚摂取と比較したとき,総死亡率やCHD死亡率のリスクを低減しなかったことが報告された (98)。
心臓突然死(Sudden Cardiac Death):心臓突然死(SCD)は,致命的な心室性不整脈の結果であり,通常CHDを病む人で起こる。培養細胞を用いた研究から,長鎖ω-3脂肪酸が,イオンチャンネル透過性を調整することにより心筋細胞(ミオサイト)の興奮性を低下させることが示唆されている (99)。疫学研究の結果からは,定期的な魚の摂取が,心臓突然死リスクと逆相関することが示唆されている。20,000人以上の男性を11年間追跡した大規模前向きコホート研究において,最低週一回魚を食べる人が,月一回以下で魚を食べる人より心臓突然死のリスクが52%低かった (100)。EPAとDHAの血漿中レベルも心臓突然死リスクと逆相関が認められ,ω-3脂肪酸が,心臓突然死における魚摂取の有益効果に少なくとも一部分関与しているという考えを裏づけしていた (101)。さらにその後,45,000人以上の男性を14年間追跡した前向き研究で,少なくとも平均250 mg/日のEPA+DHA(毎週1~2の油の多い魚料理に相当)を食事から摂取する人において,250 mg/日以下の摂取量の人より突然心臓死リスクが約40~50%低いことが認められた (76)。食事からのEPA+DHA摂取量は,非致死性のMIや総CHD症例とは関係せず,長鎖ω-3脂肪酸の抗不整脈作用が,通常の食事からの摂取レベルで重要であることを示唆している。さらに,いくつかの観察研究や臨床試験からは,食事に魚や魚油を加えることが心臓突然死リスクを下げることが認められた (102)。比較的短鎖のω-3脂肪酸であるALA摂取がSCDリスクに影響するかどうかを調査した研究は少ない。76,763人女性を対象としたNurses' Health Studyにおいて,比較的高いALAの食事摂取が,SCDリスクの38~40%低減と相関がみられた (81)。45,722人男性を追跡したHealth Professionals Follow-up Studyでは,食事からのALA摂取量と心臓突然死との間に相関はみられなかった (76)。ω-3脂肪酸補給が,心室性不整脈リスクを低減するかどうかも明らかではない。最近の3例の臨床試験 (103-105)のメタアナリシスでは,植込み型の心臓除細動器をつけた患者において,心室性不整脈の予防効果がないと結論されたが,これらの患者はすでに心疾患を発症していた (106)。ω-3脂肪酸の状態が,心室性不整脈のリスクに影響するかどうか判定するためには,さらに多くの疫学研究や臨床試験が必要である (107)。
脳卒中(Stroke):虚血性脳卒中は,脳領域への血流が不十分な結果であり,脳に通じる動脈が,血栓によって塞がれたときに起こる。出血性脳卒中は,血管が破裂し脳に出血したときに起こる。米国において,脳卒中の70~80%は虚血性である (108)。魚やω-3脂肪酸の摂取量と脳卒中の総発症率との間の相関を試験した前向き研究では,魚の摂取量が多いと有益であることが認められたもの (109,110),効果がみられなかったもの (111-113) がある。さらにその後,2つの大規模前向き研究から,魚摂取量とω-3脂肪酸摂取量が多いことが,虚血性脳卒中リスクを有意に低下させることと相関し,出血性脳卒中には相関がなかったことが認められた。79,000人以上の女性を14年間追跡した研究において,少なくとも週2回魚を食べる女性は,月1回以下しか食べない人より,血栓性(虚血性)脳卒中のリスクが52%低かった (114)。同様に,43,000人以上の男性を12年間追跡した研究において,最低月に一回魚を食べる人では,月1回以下の人より虚血性脳卒中リスクが43%低かった (115)。長鎖ω-3脂肪酸の摂取が脳卒中発生率に及ぼす効果は,CHDほど十分には研究されていないが,利用できる証拠のメタアナリシスでは,多い魚摂取量が虚血性脳卒中のリスクを減少させ,出血性脳卒中リスクは低下させないことが示唆されている (116)。最近の研究結果は,高用量のEPA補給が,二次的な脳卒中予防,すなわち病歴のある人の脳卒中再発を予防するのに有効であることを示唆している (117)。
血清中トリグリセライド:17例の前向き研究のメタアナリシスから,高グリセライド血症(血清中トリグリセライドが> 200 mg/dl)が,心血管系疾患の独立したリスク因子であることが認められている (118)。人における数多くの管理された臨床試験からは,EPAとDHAの摂取量増加が血清中のトリグリセライド濃度を有意に低下させることが確認された (119)。EPAとDHAによるトリグリセライド低下作用は用量とともに高まる (120) が,臨床的に有意義な血中トリグリセライド濃度減少は,EPA+DHAの2 g/日用量で確認されている (3)。ω-3脂肪酸と心血管系疾患に関しての推奨の中で(下記「推奨摂取量」参照),米国心臓病協会は,EPA+DHA補給は,高トリグリセライド血症患者において有用かもしれないと述べている (87)。
要約:ω-3及びω-6 PUFAと心血管系疾患予防
疫学研究と無作為対照試験の結果は,食事からのSFAをω-6及びω-3 PUFAに置き換えると,LDLコレステロールを低下させ,心血管系疾患リスクを減少させることを示唆している。さらに,疫学研究の結果は,食事からのω-3脂肪酸摂取量増加が,LDLコレステロール低下以外のメカニズムによる心血管系疾患リスクの有意な低減と相関があることを提示している。特に,水産食品からのEPAとDHA摂取量増加は,心臓突然死の有意な低減と相関が認められ,長鎖のω-3脂肪酸が,週に油が多い魚を2食程度の量に相当する摂取レベルで抗不整脈作用を持つことを示唆している。この魚の量は,EPA+DHAのおよそ400~500 mg/日を供給することになる (121)。そこで,米国医薬品機構が,EPA+DHAについての食事摂取基準(DRI)を設定すべきと提案する研究者もいる (122)。
アルツハイマー病と認知症
アルツハイマー病は,高齢者における最も一般的な認知症原因である。アルツハイマー病は,脳内のアミロイドプラーク形成及び神経細胞の退化により特徴付けられる。記憶喪失や意識障害などの疾病症状は,時間とともに悪化する (123)。いくつかの疫学研究から,認知機能障害 (124),認知症 (125) 及びアルツハイマー病 (125,126) のリスク低下と,魚の高摂取との相関が認められている。脳内の主要なω-3脂肪酸であるDHAは,アルツハイマー病に対し予防効果があると思われる (127)。観察研究から,低いDHA状態は,アルツハイマー病 (128-130) だけでなく他の認知症 (129) のリスク増加と相関があると認められている。Framingham Heart Studyのコホートにおいて,血漿中のホスファチジルコリンDHA含有量の最大四分位である男女が,最小四分位の人と比べ,全認知症発症リスクを47%低下させ,アルツハイマー病発症リスクを39%減少させた (131)。最大四分位の人は,魚を週平均3食摂取していた(DHAの0.18 g/日)(131)。このように,低いDHA状態は,アルツハイマー病などの認知症の,そして老化と関連した認知障害のリスク因子である可能性がある。
疾病の治療
冠動脈心疾患
食事介入試験
総死亡率と致命的なMIは,男性のMI生存者に油脂の多い魚を週200~400 g(7~14オンス),すなわち長鎖ω-3脂肪酸(EPA+DHA)の追加推定量として500~800 mg/日,増やすことを助言することにより,29%減少した (132)。別の食事介入試験では,初めてのMIで生存した患者について,通常の治療をされるか,またはω-3脂肪酸(特にALA)が多く,典型的な洋食よりω-6脂肪酸が低い地中海食を用いる場合に任意に割り当てられた。ほぼ4年後,地中海食の群は,通常療養の群より,心臓死と非致死性MIのリスクが38%低かった (133)。高い血漿中のALAレベルは,良好な転帰に相関がみられたが,地中海食の効用は,一価不飽和脂肪酸と野菜・果実の摂取量も増えたため,ALA摂取量へ完全に関連付けすることはできない。平均46ヵ月間で,地中海食または低脂肪食を摂ったMI生存者について,その後の介入研究で生存率が比較された。総死亡率と心血管系関連の死亡率は,2つの介入群間で差がみられなかった (134)。
食事への補給試験
現在までで最も大規模なω-3脂肪酸を補給する無作為対照試験において,3.5年間EPA+DHAを850 mg/日供給されたCHD患者が,補給されない患者と比較し,心臓突然死リスクは45%低かった。サプリメント使用者は,非使用者より全ての死亡症例でも20%のリスク低下であった (135)。興味深いことに,総死亡率における有意な減少を確認するためにかかった期間は,服用3ヵ月だけであり,心臓突然死の有意な減少確認は4ヵ月で確認できた (136)。もう一つの補給試験において,急性MIで入院した患者に,任意に魚油を含むカプセル(EPA+DHAを1.8 g/日),マスタード油(ALA 2.9 g/日)または対照群が投与された (137)。1年後,非致死性MIを含む総心臓系症例は,対照群と比較し,魚油投与群とマスタード油投与群で有意に少なかった。対照的に,比較的魚の摂取量が多いノルウェー地方において,急性のMI患者において,コーン油と比較して,EPA+DHAの3.5 g/日による補給からはいかなる効果も認められなかった (138)。食事からまたはサプリメントからのω-3脂肪酸についての11例の無作為対照試験の結果を集めたメタアナリシスから,ω-3脂肪酸摂取量の増加は,CHD患者における心臓突然死による総死亡率及びMIによる死亡率を有意に減少させることが示された (139)。
2例の無作為対照試験により,冠状動脈造影法により測定する冠動脈アテローム硬化の進行に関する魚油補給の効果を調査された。冠動脈疾患患者59人の研究では,オリーブ油と比較して,EPA+DHAを6 g/日に相当する魚油を補給された2年後の有効性は認められなかったが (140),223患者による大規模試験では,EPA+DHAを3ヵ月間3.3 g/日補給,及び追加で21ヵ月間1.65 g/日補給にすることより,冠動脈硬化の進行において,対照群より少し減少が認められた (141)。多くの無作為対照試験により,経皮的冠動脈形成術(PTCA)後の冠動脈再狭窄に及ぼす魚油補給の効果が調査された。12例の無作為対照試験の結果を結合させたメタアナリシスにより,魚油の補給が,冠動脈再狭窄を14%減少させたが,この減少は統計的有意性には至らなかった (142)。冠動脈再狭窄試験における魚油の補給は,2.6~6.0 g/日の範囲であった。
要約
CHDと診断された患者における無作為対照試験結果からは,食事からとサプリメントによるω-3脂肪酸について有益な効果が示唆されている。これらの試験結果に基づき,米国心臓病協会は,CHD診断患者は,約1 g/日のEPA+DHAを摂取することを推奨している(下記「推奨摂取量」参照)(143)。
糖尿病
心血管系疾患は,糖尿病(DM)患者の主な死亡原因である。高トリグリセライド血症(血清中のトリグリセライド >200 mg/dl)は,タイプ2糖尿病患者において共通する脂質代謝異常であり,多くの無作為対照試験から,糖尿病者において,魚油の補給が血清中のトリグリセライドレベルを有意に低下させることが認められている(上記「血中トリグリセライド」参照)(144)。初期の管理されていない試験からは,魚油の補給が血中グルコース(血糖)制御に悪性の影響を及ぼすとの懸念が提起されたが (145,146),無作為の管理された試験では,魚油補給が長期の血糖値制御に悪性の影響を及ぼすことは概して認められていない (147)。800人以上の糖尿病患者がかかわる18例の無作為対照試験結果の系統的レビューから,魚油の補給が,血清中トリグリセライドを有意に低下させ,特に高トリグリセライド血症患者で低下が有意であった (144)。2型糖尿病やメタボリックシンドロームの人における18例の無作為対照試験のメタアナリシスでは,魚油補給が,対照群との比較で31 mg/dlまで血清中トリグリセライドを減少させることが認められたが,血清中コレステロール濃度,空腹時グルコース濃度またはヘモグロビンA1c濃度には影響がみられなかった (147)。より最近の2型糖尿病での無作為対照試験のメタアナリシスでは,ω-3脂肪酸補給が,血清中トリグリセライド濃度を25%まで低下させることが認められた (148)。一方で,魚油補給は,LDLコレステロールレベルをわずかに増加させていた (144,148,149)。魚油補給が,糖尿病における心血管系疾患転帰に及ぼす影響を調査した管理された試験はほとんどないが,2型糖尿病と診断され研究開始時点で心血管系疾患やがんを患っていなかった5,103女性を追跡した前向き研究において,16年の追跡期間を通して,魚の高い摂取量が,CHDリスクの有意な減少と相関がみられた (150)。従って,EPAとDHA摂取量の増加は,糖尿病の人,特に血清中トリグリセライドが高い人には有効であるかもしれない (151)。さらに,3 mg/日以下の日常的なEPA+DHA摂取は,糖尿病における長期の血糖コントロールに悪性の影響を及ぼすという証拠はほとんどない (144,152)。米国糖尿病協会は,糖尿病患者は,週に2~3回,3オンスの魚料理を摂取することによって,ω-3脂肪酸摂取量を増やすことを推奨している (153)。
炎症性疾患
リウマチ性関節炎
リウマチ性関節炎患者における無作為対照試験の3例のメタアナリシスにおいて,魚油補給が,身体検査における関節の痛みを有意に減少させたことが認められた (147,154,155)。これらのメタアナリシスで最も新しいものでは,痛みの程度の改善や朝硬直の期間とω-3 PUFA補給との間にも相関が示された (155)。概して,臨床的な有効性は, EPA+DHAの2.7 g/日の最小用量で認められ,少なくとも12週間の服用までは効果が現われなかった (155)。これらのメタアナリスの2例は,魚油補給が炎症の指標である赤血球沈降速度(ESR)に及ぼす影響も評価された (147,154)。魚油補給は,ESRに有意な影響は認めなかった。長鎖ω-3脂肪酸補給が,リウマチ性関節炎患者における非ステロイド系抗炎症薬(NSAID)やコルチコステロイドの使用に及ぼす影響を試験した7例の研究のうち6例により,抗炎症薬の必要量を減らすことが確認された (147)。
炎症性腸疾患
長鎖ω-3脂肪酸補給についての臨床試験から,炎症性腸疾患患者においては,有益な効果がリウマチ性関節炎患者より少ないことが一致している。クローン病患者における魚油補給についての2例の無作為対照試験では有効性は報告されていないが (156,157),一例の試験から,EPA+DHAを2.7 g/日補給されたクローン病患者が,有意に高い比率で,対照群より12ヵ月間寛解(症状が好転すること)が持続した (158)。クローン病の子供38人(5~16歳)における無作為対照試験において,標準的な5-アミノサリチル酸治療に加えてω-3 PUFA(EPA 1.2 g/日とDHA 0.6 g/日)を補給したとき,1年間の再発率が有意に減少した (159)。潰瘍性大腸炎患者でEPA+DHA補給(3~12ヵ月間 4.2~5.4 g/日)した無作為対照試験で,体重増加,コルチコステロイド服用の減少,疾病程度の改善及び組織学的症状の改善など,少なくとも一つの転帰尺度に有意な改善が報告された (160-162)。対照的に,寛解した潰瘍性大腸炎患者へのEPA+DHAの5.1 g/日補給は,2年間の再発率に有意な変化を示さなかった (163)。長鎖ω-3脂肪酸の補給が潰瘍性大腸炎にどのような治療効果を示すかは,さらに研究が必要である (164)。
喘息
AA(20:4n-6)由来の炎症誘発性エイコサノイド(ロイコトリエン)は,喘息の病理に重要な役割を持つと考えられている (17)。ω-3脂肪酸摂取量を増やすと,AA由来ロイコトリエン(炎症に関与する不飽和脂質メディエーター)生成を減少させることが認められたため,喘息におけるω-3脂肪酸補給の効果について,多くの臨床試験が行われた。ω-3脂肪酸補給が喘息患者における炎症性メディエーターの産生を低減するといういくつかの証拠があるが (165,166),管理された試験において,ω-3脂肪酸補給が臨床的に重度の喘息を低減させるという証拠は不一致がみられる (167)。長鎖ω-3脂肪酸補給の喘息である成人や子供についての無作為対照試験の系統的レビューからは,肺機能検査,喘息症状,医薬品使用または気管支過敏症など,臨床試験結果に一貫した影響を認めなかった (168-171)。
イムノグロブリンA腎症(IgA腎症)
イムノグロブリンA(IgA)腎症は,腎糸球体へのIgA沈着により起こる腎臓障害である。IgA腎症の原因は不明であるが,進行性の腎不全が最終的に患者の15~40%で発症する (171)。腎糸球体のIgA沈着は炎症性メディエーターの産生増加により起こるため,ω-3脂肪酸補給は,炎症反応を調節し腎機能を保護できる可能性がある。複数機関による無作為対照試験において,IgA腎症患者に魚油(DHA 1.8 g/日+DHA 1.2 g/日)を2年間補給することにより,有意な腎機能の減退を遅らせることが報告された (172)。2年の処置期間で,33%の対照群において,血清中クレアチニンの50%増加(すなわち,腎機能低下の証拠)がみられ,魚油投与群では機能低下は6%だけであった。これらの結果は,平均6年の追跡で持続したが (173),比較的高い用量の魚油では改善が認められなかった (174)。さらに小規模の2年間試験で,低用量のω-3脂肪酸(EPA 0.85 g/日+DHA 0.57 g/日)が,高リスクのIgA腎症患者における腎疾患の進行を遅らせた (175)。対照的に,いくつかの研究では,IgA腎症患者におけるω-3 PUFA補給の有意な効果は認められなかった (176-179)。興味深いことに,6ヵ月間の魚油補給(EPA+DHA 3 g/日)は,IgA腎症患者において,炎症性メディエーターの尿中排泄を減少させなかった (180)。魚油補給についての無作為対照試験の2例のメタアナリシスから,IgA腎症患者全体において,統計的有意な有効性を見出せなかった (181,182)。利用できる無作為対照試験の一致しない結果から,魚油補給が,成人や子供において,IgA腎症の進行を防止できるかどうか明らかではない (147)。
大うつ病と双極性障害(躁うつ病)
異なる国々の生態学的研究データからは,水産食品の摂取と大うつ病 (183) と双極性障害 (184) の国内発生率との間に逆相関があることが示唆されている。いくつかの小規模研究では,うつ病を病んでいる人の血漿 (185-187) 及び脂肪組織(脂肪)(188) 中のω-3脂肪酸濃度が,対照群より低いことが認められた。ω-3脂肪酸摂取量がうつ病の発症にどのように影響するかは不明であるが,神経伝達系の調節やエイコサノイド産生が,可能性のあるメカニズムとして提案されている (189)。うつ病における長鎖ω-3脂肪酸による補給についての無作為対照試験の結果は,様々である。うつ病治療を受けている人の治療に魚油サプリメント(8g/日)を加えた場合,同じ量のオリーブ油を12週間加えたときと比較し,有意な効果はなかった (190)。大うつ病と診断された患者において,4ヵ月の魚油補給(DHA 2.2 g/日+EPA 0.6 g/日)は,標準的治療以上のいかなる効果も得られなかった (191)。軽度から中度のうつ病者において,低用量(DHA 0.85 g/日+EPA 0.63 g/日)を,12週間摂取したとき効果はみられなかった (192)。2 g/日のDHAを6週間補給した場合,大うつ病治療において,対照群より有意に良好な効果はみられなかった (193)。一方,大うつ病と診断された中国人患者における小規模の管理された試験において,EPA+DHAを6.6 g/日で8週間補給したとき,ハミルトンうつ病評価尺度のスコアが対照群より改善された (194)。もう一つの小規模無作為対照試験において,境界型人格障害と診断された女性30人が試験され,8週間EPAエチルを1 g/日で任意に処置された女性20人が,プラセボ処置された任意の10人よりうつ症状が少し改善された (195)。さらに,最近の予備試験結果から,ω-3脂肪酸補給が,大うつ病の子供の治療に有用であることが示唆された (196)。
単極性うつ病と双極性障害は,両方とも大うつ病を発生するが,異なる精神状態と考えられる。双極性障害患者に高用量のEPA(6.2 g/日)とDHA(3.4 g/日)による効果を調査した無作為対照試験において,EPA+DHAを補給された人は,オリーブ油の対照より,4ヵ月の観察期間において症状回復期間が有意に長いことが認められた (197)。EPA+DHAを補給された患者もまた,プラセボよりうつ状態が軽減された。しかしながら,4週間EPAエチルを6 g/日服用した患者が,いかなる双極性障害からの回復も経験しなかった報告もある (198)。EPAの低用量は,双極性障害を治療する際に,より有効である場合がある。小規模の研究において,EPAを1.5g/日または2g/日,6ヵ月服用した患者には,双極性障害を伴ううつ病に若干の回復があることが明らかになった (199)。双極性の人における12週間の二重盲検プラセボ対照試験により,EPAエチルを1 g/日または2 g/日のいずれかを摂った人は,うつ症状の有意な改善を経験したが,プラセボ群と比較し,どちらの試験群も躁状態の計測に差はなかった (200)。さらに,いくつかの最近の無作為対照試験のメタアナリシスでは,ω-3 PUFA補給が,単極性うつ病や双極性うつ病の治療に有効であると結論されている (201, 202)。しかしながら,別の系統的レビューやメタアナリシスでは,うつ病にω-3 PUFA補給を用いることについての示唆はほとんどないと結論された (203)。大うつ病及び双極性障害に関する長鎖ω-3脂肪酸補給の効果を検証するために,大規模な長期無作為対照試験が必要である。
統合失調症(精神分裂病)
限られた数の統合失調症患者の赤血球細胞 (204, 205) 及び脳 (206) 中のω-3脂肪酸レベル減少についての知見は,管理されていない補給研究の結果 (207) とともに,統合失調症のための通常の抗精神薬の補助として,長鎖ω-3脂肪酸サプリメント使用についての関心を生み出した。45人の統合失調症患者による予備的試験から,後遺症の軽減において,標準的な抗精神治療にEPA 2 g/日を加えることが,DHA 2 g/日の補完やプラセボより優っていたことが認められた (208)。再発を起こした統合失調症患者にEPA補給を単独で治療に用いた場合,EPAを2 g/日補給された患者の14人中の8人が,12週間の試験期間の終わりまで抗精神薬投与を必要とし,プラセボ群では12人中12人が必要とした (208)。統合失調症患者に標準的な抗精神薬治療の補助としてEPAエチルを用いた無作為対照試験の結果は,いくらか統一性を欠いていた。ある試験では,標準の抗精神薬治療に12週間EPAエチルを3 g/日追加したとき,症状が改善され,運動異常(ジスキネジア)のスコアが減少し (209),類似の12週間試験では,EPAエチル2 g/日で運動異常のある患者に効果はみられなかった (210)。別の試験では,16週間EPAエチルを3 g/日補給した場合に,症状,情緒または認知機能などの改善にプラセボ群と変化がなかった (211)。EPAエチルを1,2,4 g/日で他の治療薬に添加して比較したプラセボ対照試験において,EPAエチルの補給は,抗精神薬クロザピン投与されている統合失調症患者の症状を改善したが,他の薬物投与群では改善はみられなかった (212)。数少ない証拠から,EPA補給が,統合失調症患者における抗精神薬治療の補助に有用であることが示唆されているが,臨床的に関連する状態変化を扱う大規模な長期試験が必要である (213)。
アルツハイマー病と認知症
いくつかの疫学研究が,DHA状態の減少をアルツハイマー病や他の認知症と関連付けている(上記)。動物実験での結果は有望ではあるが (214),DHA補給が,人におけるアルツハイマー病治療に有用かどうかはわかっていない。最近の,軽度から中程度のアルツハイマー病患者295人による二重盲検プラセボ対照試験では,18ヵ月間,2 g/日のDHA補給が対照と比べ認知機能の有効性は認められなかった (215)。
摂取源
食品からの摂取源
ω-6脂肪酸
リノール酸(LA):
LAの摂取源は,大豆,ベニバナなどの植物油,コーン油,ナッツ類,種実類並びにいくつかの野菜である。米国の食事調査では,平均的な成人のLA摂取量は,男性で12~17 g/日,女性で9~11 g/日である (1)。LAが多く含まれるいくつかの食品を下表に示した。
表1 リノール酸(18:2n-6)の食品摂取源の例 (216)
|
食品 |
一食 |
リノール酸(g) |
|
ベニバナ油 |
スプーン1杯 |
10.1
|
|
ヒマワリ種子(油焙煎) |
1オンス |
9.7
|
|
松の実 |
1オンス |
9.4
|
|
ヒマワリ油 |
スプーン1杯 |
8.9
|
|
コーン油 |
スプーン1杯 |
7.3
|
|
大豆油 |
スプーン1杯 |
6.9
|
|
ペカン(油焙煎) |
1オンス |
6.4
|
|
ブラジルナッツ |
1オンス |
5.8
|
|
ゴマ油 |
スプーン1杯 |
5.6
|
アラキドン酸(AA):
動物は,植物と違いLAをAAに変換する。従って,AAは,肉,家禽類及び卵に少量存在する。
ω-3脂肪酸
α-リノレン酸(ALA):
亜麻仁,クルミ及びそれらの油は,最も多いALA摂取源である。キャノーラ油(菜種油)も優れたALA摂取源である。米国の食事調査から,成人の平均摂取量は男性1.2~1.6 g/日,女性で0.9~1.1 g/日である (1)。ALAを多く含むいくつか食品を下表に示した。
表2 α-リノレン酸(18:n-3)の食品摂取源の例 (216)
|
食品 |
一食 |
α-リノレン酸(g) |
|
亜麻仁油 |
スプーン1杯 |
7.3
|
|
クルミ(英国) |
1オンス |
2.6
|
|
亜麻仁種子(粉末) |
スプーン1杯 |
1.6
|
|
クルミ油 |
スプーン1杯 |
1.4
|
|
キャノーラ油 |
スプーン1杯 |
1.3
|
|
大豆油 |
スプーン1杯 |
0.9
|
|
マスタードオイル |
スプーン1杯 |
0.8
|
|
豆腐(包装) |
カップ1/2 |
0.7
|
|
Tofu, firm |
1オンス |
0.6
|
エイコサペンタエン酸(EPA)とドコサヘキサエン酸(DHA):
油の多い魚が主要なEPAとDHA摂取源である。米国の食事調査から,平均的な成人のEPA摂取量は0.04~0.07 g/日,DHAの成人平均摂取量は0.05~0.09 g/日の範囲である (1)。ω-3脂肪酸が豊富な卵類も米国では入手できる。EPA及びDHAが多く含むいくつかの食品を下表に示した。
表3 EPA(20:5n-3)及びDHA(22:6n-3)の食品源の例 (3)
|
食品 |
一食 |
EPA(g) |
DHA(g) |
EPA+DHAを1g供給する量 |
|
ニシン(太平洋) |
3オンス* |
1.06
|
0.75
|
1.5オンス
|
|
サケ(タイヘイヨウサケ) |
3オンス |
0.86
|
0.62
|
2オンス
|
|
イワシ(太平洋) |
3オンス |
0.45
|
0.74
|
2.5オンス
|
|
サケ(大西洋) |
3オンス |
0.28
|
0.95
|
2.5オンス
|
|
カキ(太平洋) |
3オンス |
0.75
|
0.43
|
2.5オンス
|
|
サケ(ベニザケ) |
3オンス |
0.45
|
0.60
|
3オンス
|
|
ニジマス |
3オンス |
0.40
|
0.44
|
3.5オンス
|
|
ビンチョウマグロ(缶詰) |
3オンス |
0.20
|
0.54
|
4オンス
|
|
アメリカイチョウガニ |
3オンス |
0.24
|
0.10
|
9オンス
|
|
ライトツナ(缶詰) |
3オンス |
0.04
|
0.19
|
12オンス
|
|
*魚の3オンスは,大体トランプ一式の大きさ |
EPAとDHAの生合成
人は,一連の脱飽和反応と炭素鎖延伸反応により,LAからAAを,ALAからEPAとDHAを合成することができる(「代謝及び生体利用能」参照)。
サプリメント
ω-6脂肪酸
ルリジサ種子油,月見草油,カシス種子油は,γ-リノレン酸(GLA)が多く含まれ,しばしばGLAサプリメントまたは必須脂肪酸サプリメントとして販売される (217)。
ω-3脂肪酸
亜麻仁油(flax seed oil; flax oilまたはlinseed oilともいわれる)は,ALAサプリメントとして市販されている。多くの魚油が,ω-3脂肪酸サプリメントとして市場に出ている。EPAとDHAのエチルエステル(EPAエチル,DHAエチル)は,長鎖ω-3脂肪酸が濃縮されたものである。EPAやDHAの含有量が,魚油やエチルエステル製剤中で変動することが予想されるため,特定サプリメントのEPA含量やDHA含量を測定した表示を読む必要がある。藻類やカビ類に由来するDHAサプリメントも販売されている。全てのω-3脂肪酸サプリメントは,食事とともに摂取するとより効果的に吸収される。一日用量を2~3回に小分けすると,胃腸内の副作用リスクが軽減される(下記「安全性」参照)。タラ肝油はEPAとDHAの豊富な摂取源であるが,いくつかのタラ肝油製剤は,既成ビタミンA(レチノール)を過剰に含有している (217)。
乳児用調製乳
2001年に,FDAは,米国内の乳児用調製乳へのDHAとAA添加の許可を開始した (218)。現在,製造者は,乳児用調製乳のラベルにDHA及びAAの添加量を表示することは要求されていない。しかしながら,大部分の乳児用調製乳の製造者はこの表示をしている。米国において製剤に添加する量は,DHAが8~17 mg/100 カロリー(5 液量オンス),AAが16~34 mg/100 カロリーの範囲である。例えば,DHA強化粉ミルクを毎日20 液量オンス飲む乳児は,DHAを32~68 mg/日,AAを64~136 mg/日摂取することになる。
安全性
有害作用(副作用)
γ-リノレン酸(18:3n-6)
γ-リノレン酸サプリメントは,一般に許容されており,重大な副作用は,12ヵ月間で最大2.8 g/日までの用量で認められていない (219)。ルリジサ種子油,月見草油及びカシス種子油の高用量は,胃腸の不調,軟便及び下痢を引き起こす可能性がある (217)。月見草オイルサプリメントが,診断未確定の側頭葉てんかんの人に発作活性を誘発する症例報告があるため (220),発作病歴や発作障害のある人は,月見草オイルなどのγ-リノレン酸が多い油を避けることが,一般に推奨されている (217)。
α-リノレン酸(18:3n-3)
亜麻仁油は一般的に容認されているが,高用量では軟便や下痢を起こす可能性がある (221)。アレルギー反応及びアナフィラキシー反応が,亜麻仁や亜麻仁油摂取により報告されている (222)。
エイコサペンタエン酸(20:5n-3)及びドコサヘキサエン酸(22:6n-3)
魚油やその他のEPAやDHAサプリメントを服用した人において,重大な有害反応は報告されていない。魚油やEPAとDHAサプリメントの最も一般的な有害作用は,生臭い後味である。げっぷや胸焼けも報告されている。さらに,高用量では吐き気や軟便を引き起こす可能性がある。
多量出血の可能性:ω-脂肪酸,特にEPAとDHAの高摂取が出血時間を長くする可能性はよく研究されており,ω-3脂肪酸の心臓予防効果に関係しているかもしれない。過剰に長い出血時間や出血性脳卒中の発生率増加が,EPA+DHAの摂取量が極めて高い(6.5 g/日)グリーンランドエスキモーの人で認められているが,EPA及びDHAの高摂取が,これらの観察結果に関与する唯一の因子であるかどうかは不明である (1)。米国FDAは,最大3 g/日までの長鎖ω-3脂肪酸(EPAとDHA)摂取量が,食事中の含有で一般に安全とみなされる(GRAS)と規定し,利用できる証拠からは,3 g/日以下の摂取量では,臨床的に有意な出血を起こすことはないと考えられる (3)。医薬品協会は,ω-3脂肪酸の耐容上限摂取量(UL)を設定していないが,EPAやDHAサプリメントの使用による注意は,特に過剰出血リスクの高い人に向けられている(「薬物と栄養成分相互作用」参照)(1)。
免疫抑制の可能性:ω-3脂肪酸摂取量が多いことから起こる炎症反応の抑制は,炎症性疾患や自己免疫性疾患の人には有効であるが,ω-3脂肪酸の抗炎症効果のある用量は,病原菌を破壊する免疫系の作用を低下させる可能性がある (223)。生体外(ex vivo)免疫細胞機能をベースラインとω-3脂肪酸(主にEPAとDHA)の抗炎症作用量補給した人とで比較した研究において,EPA 0.9 g/日とDHA 0.6 g/日ほどの低用量で免疫抑制作用が確認された (1)。これらの結果がin vivoでの免疫反応の損傷へ適用できるかどうか不明ではあるが,免疫系を損なっている人でω-3脂肪酸補給をしようとする場合,注意が必要である。
乳児用調製乳
DHA強化乳児用調製乳についての初期研究で,EPAやDHAの多い魚油がDHA供給源として用いられた。しかしながら,魚油を添加した調製乳を飲んだ早産児数名が,血漿中のAA濃度を減少させ,発育遅延と相関がみられた (224)。この作用は,高濃度のEPAが正常な発育に必須のAA合成を阻害する作用があることに起因していた。その結果,EPAは排除され,AAがDHA強化乳へ添加された。現在米国で利用できる乳児用調製乳は,魚油というよりはむしろ藻類やカビに由来するAAとDHAだけが含まれている。無作為対照試験からは,最大1年まで,AAやDHAを強化された調製乳を授乳された乳児において,発育に関する有害な影響は認められていない (36,37)。
妊娠期と授乳期
ルリジサ種子油,月見草油,カシス種子油及び亜麻仁油などω-3及びω-6脂肪酸サプリメントの安全性は,妊娠期や授乳期の女性については確認されていない (217)。妊娠時及び授乳時における魚油補給についての研究からは,いかなる重大な有害影響は報告されていない(「魚及びサプリメントの汚染物質」参照)。
魚中の汚染物質
魚種の中には,メチル水銀,PCBsまたは他の環境汚染物質を有意なレベルで含有するものがある (61)。一般に,メカジキのような比較的大きな捕食性の魚は,これらの汚染物質をかなり高レベル含有する傾向がある。調理前に皮膚,脂肪及び内臓を除去し,調理中に魚から脂肪を排出させると,PCBsのような多くの脂溶性汚染物質による曝露が低減される (225)。しかしながら,メチル水銀は魚の筋肉に認められるため,これらの調理措置ではメチル水銀曝露を低減できない。有機水銀化合物は毒性があり,過剰曝露は,脳や腎臓の障害を起こす可能性がある。発育中の胎児,乳児及び幼児は特に脳における水銀の毒性作用を受けやすい。メチル水銀による曝露を少なくするために,米国の保健社会福祉省(DHHS)及び環境保護庁(EPA)は,妊娠可能な女性,妊婦及び母乳授乳女性について,次の合同推奨を行った (170)。
1) 高レベルでメチル水銀を含むサメ,メカジキ,大きなサバまたはアマダイ(ゴールデンバス,ゴールデンスナッパーとも呼ばれる)を食べないこと。
2) 水銀の少ない多種の魚を週12オンス(平均2食)以下で食べること。
-
水銀が少なくて最もよく食べられている5種の魚は,マグロ缶詰,エビ,サケ,ナマズ及びタラ(ポロック)である。
-
シロ(ビンチョウ)マグロ缶詰及びマグロステーキの摂取は,週6オンス(平均1食)までに制限する。
3) 地方の湖,河川及び近海で友人や家族が捕獲した魚の安全性に関して地方当局に確認すること。
幼児に魚を食べさせる場合,DHHSとEPAは上記ガイドラインに従うが,平均で3オンスのような,より少量を食事に出すことを推奨している。
魚中のメチル水銀に関するFDA/EPA消費者委員会の追加情報は,オンライン冊子で参照できる。市販魚介類中の水銀レベルについての追加情報は,FDAから入手可能である。
サプリメント中の汚染物質
魚油由来のω-3脂肪酸がメチル水銀,PCBs及びダイオキシン類を含む可能性に関する懸念は生ずるが,米国のいくつかの試験所の分析では,市販されているω-3脂肪酸サプリメントにメチル水銀,PCBs及びダイオキシン類は含まれないことが確認されている (226-228)。ω-3脂肪酸サプリメント中にメチル水銀が存在しないことは,水銀が魚の脂肪よりは筋肉に蓄積されやすいという事実によって説明できる (3)。一般に,魚体の油は,魚の肝油よりPCBsなどの脂溶性汚染物質レベルは低い。さらに,より高度に精製,脱臭された魚油もまた,PCBsレベルが低い (229)。潜在的に肝毒性があり発がん物質であるピロリジジンアルカロイド類は,ルリジサ植物の各部位で認められる。ルリジサ油サプリメントを摂取する人は,ピロリジジンアルカロイドを含まないことが証明された製品を使用すべきである (217)。
薬剤との相互作用
月見草油やルリジサ種子油などのγ-リノレン酸サプリメントは,クロルプロマジンのようなフェノチアジン系薬物治療を受けている人に発作リスクを高める可能性がある (220)。高用量のカシス種子油,ルリジサ種子油,月見草油,亜麻仁油及び魚油は,血小板凝集を阻害するため,これらのサプリメントは,抗凝血剤治療を受けている人には注意して使用すべきである。特に,アスピリン,クロピドグレル(Plavix),ダルテパリン(Fragmin),ジピリダモール(Persantine),エノキサパリン(Lovenox),ヘパリン,チクロピジン(Ticlid)及びワルファリン(Coumadin)などの血液凝固防止剤と併せて,長鎖ω-3脂肪酸(EPAとDHA)サプリメントや魚油を摂取する人は,標準的なプロトロンビン時間アッセイ(INR)を用いて,その血液凝固状態を監視する必要がある。一つの小規模研究では,3 g/日または6 g/日の魚油は,4週間の間ワルファリン投与患者10人においてINR値に影響を与えないことが確認されている (230)。一方,魚油用量を1 g/日から2 g/日へ2倍にしたとき,ワルファリン用量の減少が必要であった人の症例報告もある (231)。
栄養成分との相互作用
ビタミンE
体外において,PUFAはSFAより容易に酸敗(酸化)する。ビタミンEなどの脂溶性酸化防止剤は,PUFAの酸化防止に重要な役割を持つ。体内では,動物実験と人による限られた試験結果から,脂質過酸化を防止するために必要なビタミンE量がPUFA摂取により増加することが示唆されている (232)。広く用いられているビタミンEの推奨摂取量の一つは,食事からのPUFAのgあたり,α-トコフェロール0.6 mgである。この推奨量は,小規模な男性による研究と米国食事におけるα-トコフェロールとLAの比率に基づいており,より包括的な研究で検証されてはいない。EPAとDHAは体外では容易に酸化されるが,EPAとDHAが,体内で酸化的損傷を受けやすいかどうか今のところ不明である (233)。高いビタミンE摂取量が,EPAとDHAの摂取量を増やしととき,酸化的損傷のバイオマーカーを減少させることは認められていないが (234,235),PUFA摂取量,特にω-3 PUFA摂取量の増加は,ビタミンE摂取量の増加を伴わせるべきと考えている専門家もいる (1)。
推奨摂取量
米国医薬品協会(US Institute of Medicine)
2002年に,米国医薬品協会の食品栄養委員会は,ω-6及びω-3脂肪酸についての適正摂取量(AI)を設定した。それを下表に示す (1)。
表4 ω-6脂肪酸の適正摂取量(AI) (1)
|
人生期 |
年齢 |
摂取源 |
男性(g/日) |
女性(g/日) |
|
乳児 |
0-6ヵ月 |
ω-6 PUFA* |
4.4 |
4.4 |
|
乳児 |
7-12ヵ月 |
ω-6 PUFA* |
4.6 |
4.6 |
|
幼児 |
1-3歳 |
LA** |
7 |
7 |
|
子供 |
4-8歳 |
LA |
10 |
10 |
|
子供 |
9-13歳 |
LA |
12 |
10 |
|
青少年 |
14-18歳 |
LA |
16 |
11 |
|
成人 |
19-50歳 |
LA |
17 |
12 |
|
成人 |
51歳以上 |
LA |
14 |
11 |
|
妊婦 |
全年齢群 |
LA |
- |
13 |
|
授乳女性 |
全年齢群 |
LA |
- |
13 |
*母乳中に存在する様々なω-6多価不飽和脂肪酸(PUFA)が,乳児に対するAIに寄与している。
** LA;リノール酸 |
表5 ω-3脂肪酸の適正摂取量(AI) (1)
|
人生期 |
年齢 |
摂取源 |
男性(g/日) |
女性(g/日) |
|
乳児 |
0-6ヵ月 |
ALA, EPA, DHA* |
0.5
|
0.5
|
|
乳児 |
7-12ヵ月 |
ALA, EPA, DHA |
0.5
|
0.5
|
|
幼児 |
1-3歳 |
ALA |
0.7
|
0.7
|
|
子供 |
4-8歳 |
ALA |
0.9
|
0.9
|
|
子供 |
9-13歳 |
ALA |
1.2
|
1.0
|
|
青少年 |
14-18歳 |
ALA |
1.6
|
1.1
|
|
成人 |
19歳以上 |
ALA |
1.6
|
1.1
|
|
妊婦 |
全年齢群 |
ALA |
-
|
1.4
|
|
授乳女性 |
全年齢群 |
ALA |
-
|
1.3
|
|
*母乳中に存在する全てのω-3多価不飽和脂肪酸が,乳児に対するAIに寄与している。ALA;α-リノレン酸,EPA;エイコサペンタエン酸,DHA;ドコサヘキサエン酸 |
国際的な推奨
欧州委員会は,ω-6脂肪酸摂取量をエネルギーの4~8%,ω-3脂肪酸摂取量をALA 2g/日,長鎖ω-3脂肪酸(EPAとDHA)摂取量200 mg/日を推奨している (236)。世界保健機構(WHO)は,ω-6脂肪酸をエネルギーの5~8%,ω-3脂肪酸摂取量をエネルギーの1~2%と推奨している (147)。一方,日本脂質栄養学会は,ω-3脂肪酸を,EPA+DHAとして約1 g/日を含み平均2.6 g/日摂取する日本人では,LA摂取量をエネルギーの3~4%まで減らすよう推奨している (237)。
米国心臓病協会の推奨
米国心臓病協会は,CHD履歴のない人は,ALAの多い油や食品を摂取することに加えて,少なくとも週2回は魚(できれば油の多い)を食べることを推奨している (143)。妊婦や子供は,一般に高レベルのメチル水銀を含む魚を避けるべきである(「魚中の汚染物質」参照)。CHDと診断された人は,好ましくは油の多い魚からEPA+DHAを約1 g/日摂取し,医者と相談してEPA+DHAサプリメントも検討することが推奨されている。血清中トリグリセライドを下げる必要のある患者は,医者の管理下でEPA+DHAサプリメントを2~4 g/日摂取してもよい。
Authors and Reviewers
Written in December 2005 by:
Jane Higdon, Ph.D.
Linus Pauling Institute
Oregon State University
Updated in April 2009 by:
Victoria J. Drake, Ph.D.
Linus Pauling Institute
Oregon State University
Reviewed in April 2009 by:
Donald B. Jump, Ph.D.
Professor of Nutrition and
Exercise Sciences Principal Investigator,
Linus Pauling Institute
Oregon State University
Copyright 2003-2024 Linus Pauling Institute
References
1. Food and Nutrition Board, Institute of Medicine. Dietary Reference Intakes for Energy, Carbohydrate, Fiber, Fat, Fatty Acids, Cholesterol, Protein, and Amino Acids. Washington, D.C.: National Academies Press; 2002. (National Academies Press)
2. Simopoulos AP, Leaf A, Salem N, Jr. Workshop statement on the essentiality of and recommended dietary intakes for omega-6 and omega-3 fatty acids. Prostaglandins Leukot Essent Fatty Acids. 2000;63(3):119-121. (PubMed)
3. Kris-Etherton PM, Harris WS, Appel LJ. Fish consumption, fish oil, omega-3 fatty acids, and cardiovascular disease. Circulation. 2002;106(21):2747-2757. (PubMed)
4. Lichtenstein AH, Jones PJ. Lipids: absorption and transport. In: Bowman BA, Russel RM,eds. Present Knowledge in Nutrition. 8th ed. Washington, D.C.: ILSI Press; 2001:93-103.
5. Nakamura MT, Nara TY. Structure, function, and dietary regulation of delta6, delta5, and delta9 desaturases. Annu Rev Nutr. 2004;24:345-376. (PubMed)
6. Burdge G. Alpha-linolenic acid metabolism in men and women: nutritional and biological implications. Curr Opin Clin Nutr Metab Care. 2004;7(2):137-144. (PubMed)
7. Burdge GC, Jones AE, Wootton SA. Eicosapentaenoic and docosapentaenoic acids are the principal products of alpha-linolenic acid metabolism in young men*. Br J Nutr. 2002;88(4):355-364. (PubMed)
8. Burdge GC, Wootton SA. Conversion of alpha-linolenic acid to eicosapentaenoic, docosapentaenoic and docosahexaenoic acids in young women. Br J Nutr. 2002;88(4):411-420. (PubMed)
9. Giltay EJ, Gooren LJ, Toorians AW, Katan MB, Zock PL. Docosahexaenoic acid concentrations are higher in women than in men because of estrogenic effects. Am J Clin Nutr. 2004;80(5):1167-1174. (PubMed)
10. Muskiet FA, Fokkema MR, Schaafsma A, Boersma ER, Crawford MA. Is docosahexaenoic acid (DHA) essential? Lessons from DHA status regulation, our ancient diet, epidemiology and randomized controlled trials. J Nutr. 2004;134(1):183-186. (PubMed)
11. Cunnane SC. Problems with essential fatty acids: time for a new paradigm? Prog Lipid Res. 2003;42(6):544-568. (PubMed)
12. Stillwell W, Wassall SR. Docosahexaenoic acid: membrane properties of a unique fatty acid. Chem Phys Lipids. 2003;126(1):1-27. (PubMed)
13. Jeffrey BG, Weisingerb HS, Neuringer M, Mitcheli DC. The role of docosahexaenoic acid in retinal function. Lipids. 2001;36(9):859-871. (PubMed)
14. SanGiovanni JP, Chew EY. The role of omega-3 long-chain polyunsaturated fatty acids in health and disease of the retina. Prog Retin Eye Res. 2005;24(1):87-138. (PubMed)
15. Innis SM. Perinatal biochemistry and physiology of long-chain polyunsaturated fatty acids. J Pediatr. 2003;143(4 Suppl):S1-8. (PubMed)
16. Chalon S, Vancassel S, Zimmer L, Guilloteau D, Durand G. Polyunsaturated fatty acids and cerebral function: focus on monoaminergic neurotransmission. Lipids. 2001;36(9):937-944. (PubMed)
17. Calder PC. Dietary modification of inflammation with lipids. Proc Nutr Soc. 2002;61(3):345-358. (PubMed)
18. Price PT, Nelson CM, Clarke SD. Omega-3 polyunsaturated fatty acid regulation of gene expression. Curr Opin Lipidol. 2000;11(1):3-7. (PubMed)
19. Sampath H, Ntambi JM. Polyunsaturated fatty acid regulation of gene expression. Nutr Rev. 2004;62(9):333-339. (PubMed)
20. Jump DB. Fatty acid regulation of gene transcription. Crit Rev Clin Lab Sci. 2004;41(1):41-78. (PubMed)
21. Jump DB, Botolin D, Wang Y, Xu J, Demeure O, Christian B. Docosahexaenoic acid (DHA) and hepatic gene transcription. Chem Phys Lipids. 2008;153(1):3-13. (PubMed)
22. Jump DB. N-3 polyunsaturated fatty acid regulation of hepatic gene transcription. Curr Opin Lipidol. 2008;19(3):242-247. (PubMed)
23. Jump DB, Botolin D, Wang Y, Xu J, Christian B, Demeure O. Fatty acid regulation of hepatic gene transcription. J Nutr. 2005;135(11):2503-2506. (PubMed)
24. Jeppesen PB, Hoy CE, Mortensen PB. Essential fatty acid deficiency in patients receiving home parenteral nutrition. Am J Clin Nutr. 1998;68(1):126-133. (PubMed)
25. Smit EN, Muskiet FA, Boersma ER. The possible role of essential fatty acids in the pathophysiology of malnutrition: a review. Prostaglandins Leukot Essent Fatty Acids. 2004;71(4):241-250. (PubMed)
26. Mascioli EA, Lopes SM, Champagne C, Driscoll DF. Essential fatty acid deficiency and home total parenteral nutrition patients. Nutrition. 1996;12(4):245-249. (PubMed)
27. Stegink LD, Freeman JB, Wispe J, Connor WE. Absence of the biochemical symptoms of essential fatty acid deficiency in surgical patients undergoing protein sparing therapy. Am J Clin Nutr. 1977;30(3):388-393. (PubMed)
28. Jeppesen PB, Hoy CE, Mortensen PB. Deficiencies of essential fatty acids, vitamin A and E and changes in plasma lipoproteins in patients with reduced fat absorption or intestinal failure. Eur J Clin Nutr. 2000;54(8):632-642. (PubMed)
29. Lepage G, Levy E, Ronco N, Smith L, Galeano N, Roy CC. Direct transesterification of plasma fatty acids for the diagnosis of essential fatty acid deficiency in cystic fibrosis. J Lipid Res. 1989;30(10):1483-1490. (PubMed)
30. Holman RT, Johnson SB, Hatch TF. A case of human linolenic acid deficiency involving neurological abnormalities. Am J Clin Nutr. 1982;35(3):617-623. (PubMed)
31. Fedorova I, Hussein N, Baumann MH, Di Martino C, Salem N, Jr. An n-3 fatty acid deficiency impairs rat spatial learning in the Barnes maze. Behav Neurosci. 2009;123(1):196-205. (PubMed)
32. Fedorova I, Salem N, Jr. Omega-3 fatty acids and rodent behavior. Prostaglandins Leukot Essent Fatty Acids. 2006;75(4-5):271-289. (PubMed)
33. Uauy R, Hoffman DR, Peirano P, Birch DG, Birch EE. Essential fatty acids in visual and brain development. Lipids. 2001;36(9):885-895. (PubMed)
34. Larque E, Demmelmair H, Koletzko B. Perinatal supply and metabolism of long-chain polyunsaturated fatty acids: importance for the early development of the nervous system. Ann N Y Acad Sci. 2002;967:299-310. (PubMed)
35. Uauy R, Hoffman DR, Mena P, Llanos A, Birch EE. Term infant studies of DHA and ARA supplementation on neurodevelopment: results of randomized controlled trials. J Pediatr. 2003;143(4 Suppl):S17-25. (PubMed)
36. Simmer K, Patole S. Longchain polyunsaturated fatty acid supplementation in preterm infants. Cochrane Database Syst Rev. 2004;(1):CD000375. (PubMed)
37. Simmer K. Longchain polyunsaturated fatty acid supplementation in infants born at term. Cochrane Database Syst Rev. 2001;(4):CD000376. (PubMed)
38. Eilander A, Hundscheid DC, Osendarp SJ, Transler C, Zock PL. Effects of n-3 long chain polyunsaturated fatty acid supplementation on visual and cognitive development throughout childhood: a review of human studies. Prostaglandins Leukot Essent Fatty Acids. 2007;76(4):189-203. (PubMed)
39. SanGiovanni JP, Parra-Cabrera S, Colditz GA, Berkey CS, Dwyer JT. Meta-analysis of dietary essential fatty acids and long-chain polyunsaturated fatty acids as they relate to visual resolution acuity in healthy preterm infants. Pediatrics. 2000;105(6):1292-1298. (PubMed)
40. O'Connor DL, Hall R, Adamkin D, et al. Growth and development in preterm infants fed long-chain polyunsaturated fatty acids: a prospective, randomized controlled trial. Pediatrics. 2001;108(2):359-371. (PubMed)
41. Fewtrell MS, Morley R, Abbott RA, et al. Double-blind, randomized trial of long-chain polyunsaturated fatty acid supplementation in formula fed to preterm infants. Pediatrics. 2002;110(1 Pt 1):73-82. (PubMed)
42. Fewtrell MS, Abbott RA, Kennedy K, et al. Randomized, double-blind trial of long-chain polyunsaturated fatty acid supplementation with fish oil and borage oil in preterm infants. J Pediatr. 2004;144(4):471-479. (PubMed)
43. Clandinin MT, Van Aerde JE, Merkel KL, et al. Growth and development of preterm infants fed infant formulas containing docosahexaenoic acid and arachidonic acid. J Pediatr. 2005;146(4):461-468. (PubMed)
44. Birch EE, Castaneda YS, Wheaton DH, Birch DG, Uauy RD, Hoffman DR. Visual maturation of term infants fed long-chain polyunsaturated fatty acid-supplemented or control formula for 12 mo. Am J Clin Nutr. 2005;81(4):871-879. (PubMed)
45. Auestad N, Scott DT, Janowsky JS, et al. Visual, cognitive, and language assessments at 39 months: a follow-up study of children fed formulas containing long-chain polyunsaturated fatty acids to 1 year of age. Pediatrics. 2003;112(3 Pt 1):e177-183. (PubMed)
46. Gibson RA, Chen W, Makrides M. Randomized trials with polyunsaturated fatty acid interventions in preterm and term infants: functional and clinical outcomes. Lipids. 2001;36(9):873-883. (PubMed)
47. Birch EE, Garfield S, Castaneda Y, Hughbanks-Wheaton D, Uauy R, Hoffman D. Visual acuity and cognitive outcomes at 4 years of age in a double-blind, randomized trial of long-chain polyunsaturated fatty acid-supplemented infant formula. Early Hum Dev. 2007;83(5):279-284. (PubMed)
48. McCann JC, Ames BN. Is docosahexaenoic acid, an n-3 long-chain polyunsaturated fatty acid, required for development of normal brain function? An overview of evidence from cognitive and behavioral tests in humans and animals. Am J Clin Nutr. 2005;82(2):281-295. (PubMed)
49. Koo WW. Efficacy and safety of docosahexaenoic acid and arachidonic acid addition to infant formulas: can one buy better vision and intelligence? J Am Coll Nutr. 2003;22(2):101-107. (PubMed)
50. Makrides M, Gibson RA. Long-chain polyunsaturated fatty acid requirements during pregnancy and lactation. Am J Clin Nutr. 2000;71(1 Suppl):307S-311S. (PubMed)
51. Onwude JL, Lilford RJ, Hjartardottir H, Staines A, Tuffnell D. A randomised double blind placebo controlled trial of fish oil in high risk pregnancy. Br J Obstet Gynaecol. 1995;102(2):95-100. (PubMed)
52. Olsen SF, Sorensen JD, Secher NJ, et al. Randomised controlled trial of effect of fish-oil supplementation on pregnancy duration. Lancet. 1992;339(8800):1003-1007. (PubMed)
53. Smuts CM, Huang M, Mundy D, Plasse T, Major S, Carlson SE. A randomized trial of docosahexaenoic acid supplementation during the third trimester of pregnancy. Obstet Gynecol. 2003;101(3):469-479. (PubMed)
54. Szajewska H, Horvath A, Koletzko B. Effect of n-3 long-chain polyunsaturated fatty acid supplementation of women with low-risk pregnancies on pregnancy outcomes and growth measures at birth: a meta-analysis of randomized controlled trials. Am J Clin Nutr. 2006;83(6):1337-1344. (PubMed)
55. Olsen SF, Secher NJ, Tabor A, Weber T, Walker JJ, Gluud C. Randomised clinical trials of fish oil supplementation in high risk pregnancies. Fish Oil Trials In Pregnancy (FOTIP) Team. Bjog. 2000;107(3):382-395. (PubMed)
56. Horvath A, Koletzko B, Szajewska H. Effect of supplementation of women in high-risk pregnancies with long-chain polyunsaturated fatty acids on pregnancy outcomes and growth measures at birth: a meta-analysis of randomized controlled trials. Br J Nutr. 2007;98(2):253-259. (PubMed)
57. Koletzko B, Lien E, Agostoni C, et al. The roles of long-chain polyunsaturated fatty acids in pregnancy, lactation and infancy: review of current knowledge and consensus recommendations. J Perinat Med. 2008;36(1):5-14. (PubMed)
58. Helland IB, Smith L, Saarem K, Saugstad OD, Drevon CA. Maternal supplementation with very-long-chain n-3 fatty acids during pregnancy and lactation augments children's IQ at 4 years of age. Pediatrics. 2003;111(1):e39-44. (PubMed)
59. Dunstan JA, Simmer K, Dixon G, Prescott SL. Cognitive assessment of children at age 2(1/2) years after maternal fish oil supplementation in pregnancy: a randomised controlled trial. Arch Dis Child Fetal Neonatal Ed. 2008;93(1):F45-50. (PubMed)
60. Judge MP, Harel O, Lammi-Keefe CJ. Maternal consumption of a docosahexaenoic acid-containing functional food during pregnancy: benefit for infant performance on problem-solving but not on recognition memory tasks at age 9 mo. Am J Clin Nutr. 2007;85(6):1572-1577. (PubMed)
61. Mozaffarian D, Rimm EB. Fish intake, contaminants, and human health: evaluating the risks and the benefits. JAMA. 2006;296(15):1885-1899. (PubMed)
62. Kris-Etherton PM, Hecker KD, Binkoski AE. Polyunsaturated fatty acids and cardiovascular health. Nutr Rev. 2004;62(11):414-426. (PubMed)
63. Shekelle RB, Shryock AM, Paul O, et al. Diet, serum cholesterol, and death from coronary heart disease. The Western Electric study. N Engl J Med. 1981;304(2):65-70. (PubMed)
64. Oh K, Hu FB, Manson JE, Stampfer MJ, Willett WC. Dietary fat intake and risk of coronary heart disease in women: 20 years of follow-up of the nurses' health study. Am J Epidemiol. 2005;161(7):672-679. (PubMed)
65. Ascherio A, Rimm EB, Giovannucci EL, Spiegelman D, Stampfer M, Willett WC. Dietary fat and risk of coronary heart disease in men: cohort follow up study in the United States. BMJ. 1996;313(7049):84-90. (PubMed)
66. Laaksonen DE, Nyyssonen K, Niskanen L, Rissanen TH, Salonen JT. Prediction of cardiovascular mortality in middle-aged men by dietary and serum linoleic and polyunsaturated fatty acids. Arch Intern Med. 2005;165(2):193-199. (PubMed)
67. Sacks FM, Katan M. Randomized clinical trials on the effects of dietary fat and carbohydrate on plasma lipoproteins and cardiovascular disease. Am J Med. 2002;113 Suppl 9B:13S-24S. (PubMed)
68. Mensink RP, Katan MB. Effect of dietary fatty acids on serum lipids and lipoproteins. A meta-analysis of 27 trials. Arterioscler Thromb. 1992;12(8):911-919. (PubMed)
69. Controlled trial of soya-bean oil in myocardial infarction. Lancet. 1968;2(7570):693-699. (PubMed)
70. Dayton S, Pearce ML, Goldman H, et al. Controlled trial of a diet high in unsaturated fat for prevention of atherosclerotic complications. Lancet. 1968;2(7577):1060-1062. (PubMed)
71. Leren P. The Oslo diet-heart study. Eleven-year report. Circulation. 1970;42(5):935-942. (PubMed)
72. Turpeinen O, Karvonen MJ, Pekkarinen M, Miettinen M, Elosuo R, Paavilainen E. Dietary prevention of coronary heart disease: the Finnish Mental Hospital Study. Int J Epidemiol. 1979;8(2):99-118. (PubMed)
73. Frantz ID, Jr., Dawson EA, Ashman PL, et al. Test of effect of lipid lowering by diet on cardiovascular risk. The Minnesota Coronary Survey. Arteriosclerosis. 1989;9(1):129-135. (PubMed)
74. Miettinen M, Turpeinen O, Karvonen MJ, Pekkarinen M, Paavilainen E, Elosuo R. Dietary prevention of coronary heart disease in women: the Finnish mental hospital study. Int J Epidemiol. 1983;12(1):17-25. (PubMed)
75. Harris WS, Mozaffarian D, Rimm E, et al. Omega-6 fatty acids and risk for cardiovascular disease: a science advisory from the American Heart Association Nutrition Subcommittee of the Council on Nutrition, Physical Activity, and Metabolism; Council on Cardiovascular Nursing; and Council on Epidemiology and Prevention. Circulation. 2009;119(6):902-907. (PubMed)
76. Mozaffarian D, Ascherio A, Hu FB, et al. Interplay between different polyunsaturated fatty acids and risk of coronary heart disease in men. Circulation. 2005;111(2):157-164. (PubMed)
77. Hu FB, Stampfer MJ, Manson JE, et al. Dietary intake of alpha-linolenic acid and risk of fatal ischemic heart disease among women. Am J Clin Nutr. 1999;69(5):890-897. (PubMed)
78. Dolecek TA. Epidemiological evidence of relationships between dietary polyunsaturated fatty acids and mortality in the multiple risk factor intervention trial. Proc Soc Exp Biol Med. 1992;200(2):177-182. (PubMed)
79. Pietinen P, Ascherio A, Korhonen P, et al. Intake of fatty acids and risk of coronary heart disease in a cohort of Finnish men. The Alpha-Tocopherol, Beta-Carotene Cancer Prevention Study. Am J Epidemiol. 1997;145(10):876-887. (PubMed)
80. Oomen CM, Ocke MC, Feskens EJ, Kok FJ, Kromhout D. alpha-Linolenic acid intake is not beneficially associated with 10-y risk of coronary artery disease incidence: the Zutphen Elderly Study. Am J Clin Nutr. 2001;74(4):457-463. (PubMed)
81. Albert CM, Oh K, Whang W, et al. Dietary alpha-linolenic acid intake and risk of sudden cardiac death and coronary heart disease. Circulation. 2005;112(21):3232-3238. (PubMed)
82. Mozaffarian D. Does alpha-linolenic acid intake reduce the risk of coronary heart disease? A review of the evidence. Altern Ther Health Med. 2005;11(3):24-30; quiz 31, 79. (PubMed)
83. Wendland E, Farmer A, Glasziou P, Neil A. Effect of alpha linolenic acid on cardiovascular risk markers: a systematic review. Heart. 2006;92(2):166-169. (PubMed)
84. Bemelmans WJ, Lefrandt JD, Feskens EJ, et al. Increased alpha-linolenic acid intake lowers C-reactive protein, but has no effect on markers of atherosclerosis. Eur J Clin Nutr. 2004;58(7):1083-1089. (PubMed)
85. Rallidis LS, Paschos G, Liakos GK, Velissaridou AH, Anastasiadis G, Zampelas A. Dietary alpha-linolenic acid decreases C-reactive protein, serum amyloid A and interleukin-6 in dyslipidaemic patients. Atherosclerosis. 2003;167(2):237-242. (PubMed)
86. Zhao G, Etherton TD, Martin KR, West SG, Gillies PJ, Kris-Etherton PM. Dietary alpha-linolenic acid reduces inflammatory and lipid cardiovascular risk factors in hypercholesterolemic men and women. J Nutr. 2004;134(11):2991-2997. (PubMed)
87. Kris-Etherton PM, Harris WS, Appel LJ. Omega-3 fatty acids and cardiovascular disease: new recommendations from the American Heart Association. Arterioscler Thromb Vasc Biol. 2003;23(2):151-152. (PubMed)
88. Wang C, Harris WS, Chung M, et al. n-3 Fatty acids from fish or fish-oil supplements, but not alpha-linolenic acid, benefit cardiovascular disease outcomes in primary- and secondary-prevention studies: a systematic review. Am J Clin Nutr. 2006;84(1):5-17. (PubMed)
89. Hooper L, Thompson RL, Harrison RA, et al. Risks and benefits of omega 3 fats for mortality, cardiovascular disease, and cancer: systematic review. BMJ. 2006;332(7544):752-760. (PubMed)
90. Kromhout D, Bosschieter EB, de Lezenne Coulander C. The inverse relation between fish consumption and 20-year mortality from coronary heart disease. N Engl J Med. 1985;312(19):1205-1209. (PubMed)
91. Kromhout D, Feskens EJ, Bowles CH. The protective effect of a small amount of fish on coronary heart disease mortality in an elderly population. Int J Epidemiol. 1995;24(2):340-345. (PubMed)
92. Dolecek TA, Granditis G. Dietary polyunsaturated fatty acids and mortality in the Multiple Risk Factor Intervention Trial (MRFIT). World Rev Nutr Diet. 1991;66:205-216. (PubMed)
93. Daviglus ML, Stamler J, Orencia AJ, et al. Fish consumption and the 30-year risk of fatal myocardial infarction. N Engl J Med. 1997;336(15):1046-1053. (PubMed)
94. Yuan JM, Ross RK, Gao YT, Yu MC. Fish and shellfish consumption in relation to death from myocardial infarction among men in Shanghai, China. Am J Epidemiol. 2001;154(9):809-816. (PubMed)
95. Hu FB, Bronner L, Willett WC, et al. Fish and omega-3 fatty acid intake and risk of coronary heart disease in women. JAMA. 2002;287(14):1815-1821. (PubMed)
96. Jarvinen R, Knekt P, Rissanen H, Reunanen A. Intake of fish and long-chain n-3 fatty acids and the risk of coronary heart mortality in men and women. Br J Nutr. 2006;95(4):824-829. (PubMed)
97. Iso H, Kobayashi M, Ishihara J, et al. Intake of fish and n3 fatty acids and risk of coronary heart disease among Japanese: the Japan Public Health Center-Based (JPHC) Study Cohort I. Circulation. 2006;113(2):195-202. (PubMed)
98. Nakamura Y, Ueshima H, Okamura T, et al. Association between fish consumption and all-cause and cause-specific mortality in Japan: NIPPON DATA80, 1980-99. Am J Med. 2005;118(3):239-245. (PubMed)
99. Leaf A, Xiao YF, Kang JX, Billman GE. Prevention of sudden cardiac death by n-3 polyunsaturated fatty acids. Pharmacol Ther. 2003;98(3):355-377. (PubMed)
100. Albert CM, Hennekens CH, O'Donnell CJ, et al. Fish consumption and risk of sudden cardiac death. JAMA. 1998;279(1):23-28. (PubMed)
101. Albert CM, Campos H, Stampfer MJ, et al. Blood levels of long-chain n-3 fatty acids and the risk of sudden death. N Engl J Med. 2002;346(15):1113-1118. (PubMed)
102. Mozaffarian D. Fish and n-3 fatty acids for the prevention of fatal coronary heart disease and sudden cardiac death. Am J Clin Nutr. 2008;87(6):1991S-1996S. (PubMed)
103. Leaf A, Albert CM, Josephson M, et al. Prevention of fatal arrhythmias in high-risk subjects by fish oil n-3 fatty acid intake. Circulation. 2005;112(18):2762-2768. (PubMed)
104. Raitt MH, Connor WE, Morris C, et al. Fish oil supplementation and risk of ventricular tachycardia and ventricular fibrillation in patients with implantable defibrillators: a randomized controlled trial. JAMA. 2005;293(23):2884-2891. (PubMed)
105. Brouwer IA, Zock PL, Camm AJ, et al. Effect of fish oil on ventricular tachyarrhythmia and death in patients with implantable cardioverter defibrillators: the Study on Omega-3 Fatty Acids and Ventricular Arrhythmia (SOFA) randomized trial. JAMA. 2006;295(22):2613-2619. (PubMed)
106. Jenkins DJ, Josse AR, Beyene J, et al. Fish-oil supplementation in patients with implantable cardioverter defibrillators: a meta-analysis. Cmaj. 2008;178(2):157-164. (PubMed)
107. London B, Albert C, Anderson ME, et al. Omega-3 fatty acids and cardiac arrhythmias: prior studies and recommendations for future research: a report from the National Heart, Lung, and Blood Institute and Office Of Dietary Supplements Omega-3 Fatty Acids and their Role in Cardiac Arrhythmogenesis Workshop. Circulation. 2007;116(10):e320-335. (PubMed)
108. American Stroke Association. What is a stroke? http://www.strokeassociation.org/presenter.jhtml?identifier=2528. Accessed 11/25/02.
109. Keli SO, Feskens EJ, Kromhout D. Fish consumption and risk of stroke. The Zutphen Study. Stroke. 1994;25(2):328-332. (PubMed)
110. Gillum RF, Mussolino ME, Madans JH. The relationship between fish consumption and stroke incidence. The NHANES I Epidemiologic Follow-up Study (National Health and Nutrition Examination Survey). Arch Intern Med. 1996;156(5):537-542. (PubMed)
111. Morris MC, Manson JE, Rosner B, Buring JE, Willett WC, Hennekens CH. Fish consumption and cardiovascular disease in the physicians' health study: a prospective study. Am J Epidemiol. 1995;142(2):166-175. (PubMed)
112. Orencia AJ, Daviglus ML, Dyer AR, Shekelle RB, Stamler J. Fish consumption and stroke in men. 30-year findings of the Chicago Western Electric Study. Stroke. 1996;27(2):204-209. (PubMed)
113. Myint PK, Welch AA, Bingham SA, et al. Habitual fish consumption and risk of incident stroke: the European Prospective Investigation into Cancer (EPIC)-Norfolk prospective population study. Public Health Nutr. 2006;9(7):882-888. (PubMed)
114. Iso H, Rexrode KM, Stampfer MJ, et al. Intake of fish and omega-3 fatty acids and risk of stroke in women. JAMA. 2001;285(3):304-312. (PubMed)
115. He K, Rimm EB, Merchant A, et al. Fish consumption and risk of stroke in men. JAMA. 2002;288(24):3130-3136. (PubMed)
116. He K, Song Y, Daviglus ML, et al. Fish consumption and incidence of stroke: a meta-analysis of cohort studies. Stroke. 2004;35(7):1538-1542. (PubMed)
117. Tanaka K, Ishikawa Y, Yokoyama M, et al. Reduction in the recurrence of stroke by eicosapentaenoic acid for hypercholesterolemic patients: subanalysis of the JELIS trial. Stroke. 2008;39(7):2052-2058. (PubMed)
118. Austin MA, Hokanson JE, Edwards KL. Hypertriglyceridemia as a cardiovascular risk factor. Am J Cardiol. 1998;81(4A):7B-12B. (PubMed)
119. Harris WS. n-3 fatty acids and serum lipoproteins: human studies. Am J Clin Nutr. 1997;65(5 Suppl):1645S-1654S. (PubMed)
120. Balk EM, Lichtenstein AH, Chung M, Kupelnick B, Chew P, Lau J. Effects of omega-3 fatty acids on serum markers of cardiovascular disease risk: a systematic review. Atherosclerosis. 2006;189(1):19-30. (PubMed)
121. Harris WS, Kris-Etherton PM, Harris KA. Intakes of long-chain omega-3 fatty acid associated with reduced risk for death from coronary heart disease in healthy adults. Curr Atheroscler Rep. 2008;10(6):503-509. (PubMed)
122. Harris WS, Mozaffarian D, Lefevre M, et al. Towards establishing dietary reference intakes for eicosapentaenoic and docosahexaenoic acids. J Nutr. 2009;139(4):804S-819S. (PubMed)
123. Maccioni RB, Munoz JP, Barbeito L. The molecular bases of Alzheimer's disease and other neurodegenerative disorders. Arch Med Res. 2001;32(5):367-381. (PubMed)
124. Kalmijn S, van Boxtel MP, Ocke M, Verschuren WM, Kromhout D, Launer LJ. Dietary intake of fatty acids and fish in relation to cognitive performance at middle age. Neurology. 2004;62(2):275-280. (PubMed)
125. Kalmijn S, Launer LJ, Ott A, Witteman JC, Hofman A, Breteler MM. Dietary fat intake and the risk of incident dementia in the Rotterdam Study. Ann Neurol. 1997;42(5):776-782. (PubMed)
126. Morris MC, Evans DA, Bienias JL, et al. Consumption of fish and n-3 fatty acids and risk of incident Alzheimer disease. Arch Neurol. 2003;60(7):940-946. (PubMed)
127. van Marum RJ. Current and future therapy in Alzheimer's disease. Fundam Clin Pharmacol. 2008;22(3):265-274. (PubMed)
128. Kyle DJ, Schaefer E, Patton G, Beiser A. Low serum docosahexaenoic acid is a significant risk factor for Alzheimer's dementia. Lipids. 1999;34 Suppl:S245. (PubMed)
129. Conquer JA, Tierney MC, Zecevic J, Bettger WJ, Fisher RH. Fatty acid analysis of blood plasma of patients with Alzheimer's disease, other types of dementia, and cognitive impairment. Lipids. 2000;35(12):1305-1312. (PubMed)
130. Tully AM, Roche HM, Doyle R, et al. Low serum cholesteryl ester-docosahexaenoic acid levels in Alzheimer's disease: a case-control study. Br J Nutr. 2003;89(4):483-489. (PubMed)
131. Schaefer EJ, Bongard V, Beiser AS, et al. Plasma phosphatidylcholine docosahexaenoic acid content and risk of dementia and Alzheimer disease: the Framingham Heart Study. Arch Neurol. 2006;63(11):1545-1550. (PubMed)
132. Burr ML, Fehily AM, Gilbert JF, et al. Effects of changes in fat, fish, and fibre intakes on death and myocardial reinfarction: diet and reinfarction trial (DART). Lancet. 1989;2(8666):757-761. (PubMed)
133. de Lorgeril M, Salen P, Martin JL, Monjaud I, Delaye J, Mamelle N. Mediterranean diet, traditional risk factors, and the rate of cardiovascular complications after myocardial infarction: final report of the Lyon Diet Heart Study. Circulation. 1999;99(6):779-785. (PubMed)
134. Tuttle KR, Shuler LA, Packard DP, et al. Comparison of low-fat versus Mediterranean-style dietary intervention after first myocardial infarction (from The Heart Institute of Spokane Diet Intervention and Evaluation Trial). Am J Cardiol. 2008;101(11):1523-1530. (PubMed)
135. Dietary supplementation with n-3 polyunsaturated fatty acids and vitamin E after myocardial infarction: results of the GISSI-Prevenzione trial. Gruppo Italiano per lo Studio della Sopravvivenza nell'Infarto miocardico. Lancet. 1999;354(9177):447-455. (PubMed)
136. Marchioli R, Barzi F, Bomba E, et al. Early protection against sudden death by n-3 polyunsaturated fatty acids after myocardial infarction: time-course analysis of the results of the Gruppo Italiano per lo Studio della Sopravvivenza nell'Infarto Miocardico (GISSI)-Prevenzione. Circulation. 2002;105(16):1897-1903. (PubMed)
137. Singh RB, Niaz MA, Sharma JP, Kumar R, Rastogi V, Moshiri M. Randomized, double-blind, placebo-controlled trial of fish oil and mustard oil in patients with suspected acute myocardial infarction: the Indian experiment of infarct survival--4. Cardiovasc Drugs Ther. 1997;11(3):485-491. (PubMed)
138. Nilsen DW, Albrektsen G, Landmark K, Moen S, Aarsland T, Woie L. Effects of a high-dose concentrate of n-3 fatty acids or corn oil introduced early after an acute myocardial infarction on serum triacylglycerol and HDL cholesterol. Am J Clin Nutr. 2001;74(1):50-56. (PubMed)
139. Bucher HC, Hengstler P, Schindler C, Meier G. N-3 polyunsaturated fatty acids in coronary heart disease: a meta-analysis of randomized controlled trials. Am J Med. 2002;112(4):298-304. (PubMed)
140. Sacks FM, Stone PH, Gibson CM, Silverman DI, Rosner B, Pasternak RC. Controlled trial of fish oil for regression of human coronary atherosclerosis. HARP Research Group. J Am Coll Cardiol. 1995;25(7):1492-1498. (PubMed)
141. von Schacky C, Angerer P, Kothny W, Theisen K, Mudra H. The effect of dietary omega-3 fatty acids on coronary atherosclerosis. A randomized, double-blind, placebo-controlled trial. Ann Intern Med. 1999;130(7):554-562. (PubMed)
142. Balk E, Chung M, Lichtenstein A, et al. Effects of omega-3 fatty acids on cardiovascular risk factors and intermediate markers of cardiovascular disease. Evid Rep Technol Assess (Summ). 2004;(93):1-6. (PubMed)
143. Lichtenstein AH, Appel LJ, Brands M, et al. Diet and lifestyle recommendations revision 2006: a scientific statement from the American Heart Association Nutrition Committee. Circulation. 2006;114(1):82-96. (PubMed)
144. Montori VM, Farmer A, Wollan PC, Dinneen SF. Fish oil supplementation in type 2 diabetes: a quantitative systematic review. Diabetes Care. 2000;23(9):1407-1415. (PubMed)
145. Glauber H, Wallace P, Griver K, Brechtel G. Adverse metabolic effect of omega-3 fatty acids in non-insulin-dependent diabetes mellitus. Ann Intern Med. 1988;108(5):663-668. (PubMed)
146. Friday KE, Childs MT, Tsunehara CH, Fujimoto WY, Bierman EL, Ensinck JW. Elevated plasma glucose and lowered triglyceride levels from omega-3 fatty acid supplementation in type II diabetes. Diabetes Care. 1989;12(4):276-281. (PubMed)
147. MacLean CH, Mojica WA, Morton SC, et al. Effects of omega-3 fatty acids on lipids and glycemic control in type II diabetes and the metabolic syndrome and on inflammatory bowel disease, rheumatoid arthritis, renal disease, systemic lupus erythematosus, and osteoporosis. Evid Rep Technol Assess (Summ). 2004;(89):1-4. (PubMed)
148. Hartweg J, Farmer AJ, Perera R, Holman RR, Neil HA. Meta-analysis of the effects of n-3 polyunsaturated fatty acids on lipoproteins and other emerging lipid cardiovascular risk markers in patients with type 2 diabetes. Diabetologia. 2007;50(8):1593-1602. (PubMed)
149. Farmer A, Montori V, Dinneen S, Clar C. Fish oil in people with type 2 diabetes mellitus. Cochrane Database Syst Rev. 2001;(3):CD003205. (PubMed)
150. Hu FB, Cho E, Rexrode KM, Albert CM, Manson JE. Fish and long-chain omega-3 fatty acid intake and risk of coronary heart disease and total mortality in diabetic women. Circulation. 2003;107(14):1852-1857. (PubMed)
151. Nettleton JA, Katz R. n-3 long-chain polyunsaturated fatty acids in type 2 diabetes: a review. J Am Diet Assoc. 2005;105(3):428-440. (PubMed)
152. Friedberg CE, Janssen MJ, Heine RJ, Grobbee DE. Fish oil and glycemic control in diabetes. A meta-analysis. Diabetes Care. 1998;21(4):494-500. (PubMed)
153. Franz MJ, Bantle JP, Beebe CA, et al. Evidence-based nutrition principles and recommendations for the treatment and prevention of diabetes and related complications. Diabetes Care. 2003;26 Suppl 1:S51-61. (PubMed)
154. Fortin PR, Lew RA, Liang MH, et al. Validation of a meta-analysis: the effects of fish oil in rheumatoid arthritis. J Clin Epidemiol. 1995;48(11):1379-1390. (PubMed)
155. Goldberg RJ, Katz J. A meta-analysis of the analgesic effects of omega-3 polyunsaturated fatty acid supplementation for inflammatory joint pain. Pain. 2007;129(1-2):210-223. (PubMed)
156. Lorenz R, Weber PC, Szimnau P, Heldwein W, Strasser T, Loeschke K. Supplementation with n-3 fatty acids from fish oil in chronic inflammatory bowel disease--a randomized, placebo-controlled, double-blind cross-over trial. J Intern Med Suppl. 1989;225(731):225-232. (PubMed)
157. Lorenz-Meyer H, Bauer P, Nicolay C, et al. Omega-3 fatty acids and low carbohydrate diet for maintenance of remission in Crohn's disease. A randomized controlled multicenter trial. Study Group Members (German Crohn's Disease Study Group). Scand J Gastroenterol. 1996;31(8):778-785. (PubMed)
158. Belluzzi A, Brignola C, Campieri M, Pera A, Boschi S, Miglioli M. Effect of an enteric-coated fish-oil preparation on relapses in Crohn's disease. N Engl J Med. 1996;334(24):1557-1560. (PubMed)
159. Romano C, Cucchiara S, Barabino A, Annese V, Sferlazzas C. Usefulness of omega-3 fatty acid supplementation in addition to mesalazine in maintaining remission in pediatric Crohn's disease: a double-blind, randomized, placebo-controlled study. World J Gastroenterol. 2005;11(45):7118-7121. (PubMed)
160. Aslan A, Triadafilopoulos G. Fish oil fatty acid supplementation in active ulcerative colitis: a double-blind, placebo-controlled, crossover study. Am J Gastroenterol. 1992;87(4):432-437. (PubMed)
161. Hawthorne AB, Daneshmend TK, Hawkey CJ, et al. Treatment of ulcerative colitis with fish oil supplementation: a prospective 12 month randomised controlled trial. Gut. 1992;33(7):922-928. (PubMed)
162. Stenson WF, Cort D, Rodgers J, et al. Dietary supplementation with fish oil in ulcerative colitis. Ann Intern Med. 1992;116(8):609-614. (PubMed)
163. Loeschke K, Ueberschaer B, Pietsch A, et al. n-3 fatty acids only delay early relapse of ulcerative colitis in remission. Dig Dis Sci. 1996;41(10):2087-2094. (PubMed)
164. De Ley M, de Vos R, Hommes DW, Stokkers P. Fish oil for induction of remission in ulcerative colitis. Cochrane Database Syst Rev. 2007;(4):CD005986. (PubMed)
165. Hodge L, Salome CM, Hughes JM, et al. Effect of dietary intake of omega-3 and omega-6 fatty acids on severity of asthma in children. Eur Respir J. 1998;11(2):361-365. (PubMed)
166. Okamoto M, Mitsunobu F, Ashida K, et al. Effects of dietary supplementation with n-3 fatty acids compared with n-6 fatty acids on bronchial asthma. Intern Med. 2000;39(2):107-111. (PubMed)
167. Wong KW. Clinical efficacy of n-3 fatty acid supplementation in patients with asthma. J Am Diet Assoc. 2005;105(1):98-105. (PubMed)
168. Schachter HM, Reisman J, Tran K, et al. Health effects of omega-3 fatty acids on asthma. Evid Rep Technol Assess (Summ). 2004;(91):1-7. (PubMed)
169. Woods RK, Thien FC, Abramson MJ. Dietary marine fatty acids (fish oil) for asthma in adults and children. Cochrane Database Syst Rev. 2002;(3):CD001283. (PubMed)
170. Reisman J, Schachter HM, Dales RE, et al. Treating asthma with omega-3 fatty acids: where is the evidence? A systematic review. BMC Complement Altern Med. 2006;6:26. (PubMed)
171. Donadio JV, Grande JP. IgA nephropathy. N Engl J Med. 2002;347(10):738-748. (PubMed)
172. Donadio JV, Jr., Bergstralh EJ, Offord KP, Spencer DC, Holley KE. A controlled trial of fish oil in IgA nephropathy. Mayo Nephrology Collaborative Group. N Engl J Med. 1994;331(18):1194-1199. (PubMed)
173. Donadio JV, Jr., Grande JP, Bergstralh EJ, Dart RA, Larson TS, Spencer DC. The long-term outcome of patients with IgA nephropathy treated with fish oil in a controlled trial. Mayo Nephrology Collaborative Group. J Am Soc Nephrol. 1999;10(8):1772-1777. (PubMed)
174. Donadio JV, Jr., Larson TS, Bergstralh EJ, Grande JP. A randomized trial of high-dose compared with low-dose omega-3 fatty acids in severe IgA nephropathy. J Am Soc Nephrol. 2001;12(4):791-799. (PubMed)
175. Alexopoulos E, Stangou M, Pantzaki A, Kirmizis D, Memmos D. Treatment of severe IgA nephropathy with omega-3 fatty acids: the effect of a "very low dose" regimen. Ren Fail. 2004;26(4):453-459. (PubMed)
176. Bennett WM, Walker RG, Kincaid-Smith P. Treatment of IgA nephropathy with eicosapentanoic acid (EPA): a two-year prospective trial. Clin Nephrol. 1989;31(3):128-131. (PubMed)
177. Cheng IK, Chan PC, Chan MK. The effect of fish-oil dietary supplement on the progression of mesangial IgA glomerulonephritis. Nephrol Dial Transplant. 1990;5(4):241-246. (PubMed)
178. Pettersson EE, Rekola S, Berglund L, et al. Treatment of IgA nephropathy with omega-3-polyunsaturated fatty acids: a prospective, double-blind, randomized study. Clin Nephrol. 1994;41(4):183-190. (PubMed)
179. Hogg RJ, Lee J, Nardelli N, et al. Clinical trial to evaluate omega-3 fatty acids and alternate day prednisone in patients with IgA nephropathy: report from the Southwest Pediatric Nephrology Study Group. Clin J Am Soc Nephrol. 2006;1(3):467-474. (PubMed)
180. Branten AJ, Klasen IS, Wetzels JF. Short-term effects of fish oil treatment on urinary excretion of high- and low-molecular weight proteins in patients with IgA nephropathy. Clin Nephrol. 2002;58(4):267-274. (PubMed)
181. Dillon JJ. Fish oil therapy for IgA nephropathy: efficacy and interstudy variability. J Am Soc Nephrol. 1997;8(11):1739-1744. (PubMed)
182. Strippoli GF, Manno C, Schena FP. An "evidence-based" survey of therapeutic options for IgA nephropathy: assessment and criticism. Am J Kidney Dis. 2003;41(6):1129-1139. (PubMed)
183. Hibbeln JR. Fish consumption and major depression. Lancet. 1998;351(9110):1213. (PubMed)
184. Noaghiul S, Hibbeln JR. Cross-national comparisons of seafood consumption and rates of bipolar disorders. Am J Psychiatry. 2003;160(12):2222-2227. (PubMed)
185. Maes M, Christophe A, Delanghe J, Altamura C, Neels H, Meltzer HY. Lowered omega3 polyunsaturated fatty acids in serum phospholipids and cholesteryl esters of depressed patients. Psychiatry Res. 1999;85(3):275-291. (PubMed)
186. Peet M, Murphy B, Shay J, Horrobin D. Depletion of omega-3 fatty acid levels in red blood cell membranes of depressive patients. Biol Psychiatry. 1998;43(5):315-319. (PubMed)
187. Tiemeier H, van Tuijl HR, Hofman A, Kiliaan AJ, Breteler MM. Plasma fatty acid composition and depression are associated in the elderly: the Rotterdam Study. Am J Clin Nutr. 2003;78(1):40-46. (PubMed)
188. Mamalakis G, Tornaritis M, Kafatos A. Depression and adipose essential polyunsaturated fatty acids. Prostaglandins Leukot Essent Fatty Acids. 2002;67(5):311-318. (PubMed)
189. Locke CA, Stoll AL. Omega-3 fatty acids in major depression. World Rev Nutr Diet. 2001;89:173-185. (PubMed)
190. Silvers KM, Woolley CC, Hamilton FC, Watts PM, Watson RA. Randomised double-blind placebo-controlled trial of fish oil in the treatment of depression. Prostaglandins Leukot Essent Fatty Acids. 2005;72(3):211-218. (PubMed)
191. Grenyer BF, Crowe T, Meyer B, et al. Fish oil supplementation in the treatment of major depression: a randomised double-blind placebo-controlled trial. Prog Neuropsychopharmacol Biol Psychiatry. 2007;31(7):1393-1396. (PubMed)
192. Rogers PJ, Appleton KM, Kessler D, et al. No effect of n-3 long-chain polyunsaturated fatty acid (EPA and DHA) supplementation on depressed mood and cognitive function: a randomised controlled trial. Br J Nutr. 2008;99(2):421-431. (PubMed)
193. Marangell LB, Martinez JM, Zboyan HA, Kertz B, Kim HF, Puryear LJ. A double-blind, placebo-controlled study of the omega-3 fatty acid docosahexaenoic acid in the treatment of major depression. Am J Psychiatry. 2003;160(5):996-998. (PubMed)
194. Su KP, Huang SY, Chiu CC, Shen WW. Omega-3 fatty acids in major depressive disorder. A preliminary double-blind, placebo-controlled trial. Eur Neuropsychopharmacol. 2003;13(4):267-271. (PubMed)
195. Zanarini MC, Frankenburg FR. omega-3 Fatty acid treatment of women with borderline personality disorder: a double-blind, placebo-controlled pilot study. Am J Psychiatry. 2003;160(1):167-169. (PubMed)
196. Nemets H, Nemets B, Apter A, Bracha Z, Belmaker RH. Omega-3 treatment of childhood depression: a controlled, double-blind pilot study. Am J Psychiatry. 2006;163(6):1098-1100. (PubMed)
197. Stoll AL, Severus WE, Freeman MP, et al. Omega 3 fatty acids in bipolar disorder: a preliminary double-blind, placebo-controlled trial. Arch Gen Psychiatry. 1999;56(5):407-412. (PubMed)
198. Keck PE, Jr., Mintz J, McElroy SL, et al. Double-blind, randomized, placebo-controlled trials of ethyl-eicosapentanoate in the treatment of bipolar depression and rapid cycling bipolar disorder. Biol Psychiatry. 2006;60(9):1020-1022. (PubMed)
199. Osher Y, Bersudsky Y, Belmaker RH. Omega-3 eicosapentaenoic acid in bipolar depression: report of a small open-label study. J Clin Psychiatry. 2005;66(6):726-729. (PubMed)
200. Frangou S, Lewis M, McCrone P. Efficacy of ethyl-eicosapentaenoic acid in bipolar depression: randomised double-blind placebo-controlled study. Br J Psychiatry. 2006;188:46-50. (PubMed)
201. Lin PY, Su KP. A meta-analytic review of double-blind, placebo-controlled trials of antidepressant efficacy of omega-3 fatty acids. J Clin Psychiatry. 2007;68(7):1056-1061. (PubMed)
202. Freeman MP, Hibbeln JR, Wisner KL, et al. Omega-3 fatty acids: evidence basis for treatment and future research in psychiatry. J Clin Psychiatry. 2006;67(12):1954-1967. (PubMed)
203. Appleton KM, Hayward RC, Gunnell D, et al. Effects of n-3 long-chain polyunsaturated fatty acids on depressed mood: systematic review of published trials. Am J Clin Nutr. 2006;84(6):1308-1316. (PubMed)
204. Assies J, Lieverse R, Vreken P, Wanders RJ, Dingemans PM, Linszen DH. Significantly reduced docosahexaenoic and docosapentaenoic acid concentrations in erythrocyte membranes from schizophrenic patients compared with a carefully matched control group. Biol Psychiatry. 2001;49(6):510-522. (PubMed)
205. Kemperman RF, Veurink M, van der Wal T, et al. Low essential fatty acid and B-vitamin status in a subgroup of patients with schizophrenia and its response to dietary supplementation. Prostaglandins Leukot Essent Fatty Acids. 2006;74(2):75-85. (PubMed)
206. Horrobin DF, Manku MS, Hillman H, Iain A, Glen M. Fatty acid levels in the brains of schizophrenics and normal controls. Biol Psychiatry. 1991;30(8):795-805. (PubMed)
207. Laugharne JD, Mellor JE, Peet M. Fatty acids and schizophrenia. Lipids. 1996;31 Suppl:S163-165. (PubMed)
208. Peet M, Brind J, Ramchand CN, Shah S, Vankar GK. Two double-blind placebo-controlled pilot studies of eicosapentaenoic acid in the treatment of schizophrenia. Schizophr Res. 2001;49(3):243-251. (PubMed)
209. Emsley R, Myburgh C, Oosthuizen P, van Rensburg SJ. Randomized, placebo-controlled study of ethyl-eicosapentaenoic acid as supplemental treatment in schizophrenia. Am J Psychiatry. 2002;159(9):1596-1598. (PubMed)
210. Emsley R, Niehaus DJ, Koen L, et al. The effects of eicosapentaenoic acid in tardive dyskinesia: a randomized, placebo-controlled trial. Schizophr Res. 2006;84(1):112-120. (PubMed)
211. Fenton WS, Dickerson F, Boronow J, Hibbeln JR, Knable M. A placebo-controlled trial of omega-3 fatty acid (ethyl eicosapentaenoic acid) supplementation for residual symptoms and cognitive impairment in schizophrenia. Am J Psychiatry. 2001;158(12):2071-2074. (PubMed)
212. Peet M, Horrobin DF. A dose-ranging exploratory study of the effects of ethyl-eicosapentaenoate in patients with persistent schizophrenic symptoms. J Psychiatr Res. 2002;36(1):7-18. (PubMed)
213. Joy CB, Mumby-Croft R, Joy LA. Polyunsaturated fatty acid supplementation for schizophrenia. Cochrane Database Syst Rev. 2003;(2):CD001257. (PubMed)
214. Hooijmans CR, Kiliaan AJ. Fatty acids, lipid metabolism and Alzheimer pathology. Eur J Pharmacol. 2008;585(1):176-196. (PubMed)
215. National Institutes of Health. DHA (Docosahexaenoic Acid), an Omega 3 Fatty Acid, in Slowing the Progression of Alzheimer's Disease. ClinicalTrials.gov (Web page). Available at:http://clinicaltrials.gov/ct2/show/NCT00440050?term=DHA+Alzheimer&rank=1. Accessed 12/8/08.
216. US Department of Agriculture, Agricultural Research Service. USDA National Nutrient Database for Standard Reference, Release 21. 2008. http://www.nal.usda.gov/fnic/foodcomp/search/. Accessed 11/7/08.
217. Hendler SS, Rorvik DR (eds). PDR for Nutritional Supplements. Montvale: Medical Economics Company, Inc; 2001.
218. US Food and Drug Administration Center for Food Safety and Applied Nutrition. Agency Response Letter: GRAS Notice No. GRN 000080. 2001. http://www.cfsan.fda.gov/~rdb/opa-g080.html. Accessed 11/7/08.
219. Zurier RB, Rossetti RG, Jacobson EW, et al. gamma-Linolenic acid treatment of rheumatoid arthritis. A randomized, placebo-controlled trial. Arthritis Rheum. 1996;39(11):1808-1817. (PubMed)
220. Vaddadi KS. The use of gamma-linolenic acid and linoleic acid to differentiate between temporal lobe epilepsy and schizophrenia. Prostaglandins Med. 1981;6(4):375-379. (PubMed)
221. Nordstrom DC, Honkanen VE, Nasu Y, Antila E, Friman C, Konttinen YT. Alpha-linolenic acid in the treatment of rheumatoid arthritis. A double-blind, placebo-controlled and randomized study: flaxseed vs. safflower seed. Rheumatol Int. 1995;14(6):231-234. (PubMed)
222. Alonso L, Marcos ML, Blanco JG, et al. Anaphylaxis caused by linseed (flaxseed) intake. J Allergy Clin Immunol. 1996;98(2):469-470. (PubMed)
223. Harbige LS. Fatty acids, the immune response, and autoimmunity: a question of n-6 essentiality and the balance between n-6 and n-3. Lipids. 2003;38(4):323-341. (PubMed)
224. Carlson SE, Cooke RJ, Werkman SH, Tolley EA. First year growth of preterm infants fed standard compared to marine oil n-3 supplemented formula. Lipids. 1992;27(11):901-907. (PubMed)
225. Environmental Protection Agency. Fish Advisories. http://www.epa.gov/waterscience/fish/. Accessed 4/28/03.
226. Fish or pills? Consumer Reports. 2003;68(7):30-32.
227. ConsumerLab. Product Review: Omega-3 Fatty Acids (EPA and DHA) from Fish/Marine Oils. http://www.consumerlab.com/results/omega3.asp. Accessed 4/14/01.
228. Melanson SF, Lewandrowski EL, Flood JG, Lewandrowski KB. Measurement of organochlorines in commercial over-the-counter fish oil preparations: implications for dietary and therapeutic recommendations for omega-3 fatty acids and a review of the literature. Arch Pathol Lab Med. 2005;129(1):74-77. (PubMed)
229. Hilbert G, Lillemark L, Balchen S, Hojskov CS. Reduction of organochlorine contaminants from fish oil during refining. Chemosphere. 1998;37(7):1241-1252. (PubMed)
230. Bender NK, Kraynak MA, Chiquette E, Linn WD, Clark GM, Bussey HI. Effects of marine fish oils on the anticoagulation status of patients receiving chronic warfarin therapy. J Thromb Thrombolysis. 1998;5(3):257-261. (PubMed)
231. Buckley MS, Goff AD, Knapp WE. Fish oil interaction with warfarin. Ann Pharmacother. 2004;38(1):50-52. (PubMed)
232. Valk EE, Hornstra G. Relationship between vitamin E requirement and polyunsaturated fatty acid intake in man: a review. Int J Vitam Nutr Res. 2000;70(2):31-42. (PubMed)
233. Higdon JV, Liu J, Du SH, Morrow JD, Ames BN, Wander RC. Supplementation of postmenopausal women with fish oil rich in eicosapentaenoic acid and docosahexaenoic acid is not associated with greater in vivo lipid peroxidation compared with oils rich in oleate and linoleate as assessed by plasma malondialdehyde and F(2)-isoprostanes. Am J Clin Nutr. 2000;72(3):714-722. (PubMed)
234. Wander RC, Du SH, Ketchum SO, Rowe KE. alpha-Tocopherol influences in vivo indices of lipid peroxidation in postmenopausal women given fish oil. J Nutr. 1996;126(3):643-652. (PubMed)
235. Wander RC, Du SH. Oxidation of plasma proteins is not increased after supplementation with eicosapentaenoic and docosahexaenoic acids. Am J Clin Nutr. 2000;72(3):731-737. (PubMed)
236. European Commission Directorate General for Health and Consumer Protection. Eurodiet: Nutrition and Diet for Healthy Lifestyles in Europe. 2001. Available at:http://eurodiet.med.uoc.gr/. Accessed 11/7/08.
237. Hamazaki T, Okuyama H. The Japan Society for Lipid Nutrition recommends to reduce the intake of linoleic acid. A review and critique of the scientific evidence. World Rev Nutr Diet. 2003;92:109-132. (PubMed)
238. Park WJ, Kothapalli KS, Lawrence P, Tyburczy C, Brenna JT. An alternate pathway to long chain polyunsaturates: The FADS2 gene product u8-desaturates 20:2n-6 and 20:3n-3. J Lipid Res. 2009;50(6):1195-202. (PubMed)
239. Serhan CN, Yacoubian S, Yang R. Anti-inflammatory and proresolving lipid mediators. Annu Rev Pathol. 2008;3:279-312. (PubMed)
240. Calder PC. Polyunsaturated fatty acids and inflammation. Prostaglandins Leukot Essent Fatty Acids. 2006;75(3):197-202. (PubMed)






